Область техники, к которой относится изобретение
Настоящее изобретение относится к выделению и выработке антител, модифицирующих раковые заболевания (АМРЗ), а также к применению указанных АМРЗ отдельно или в комбинации с одним или несколькими химиотерапевтическими агентами в способах лечения или диагностики. Настоящее изобретение также относится к исследованиям связывания, в которых используют АМРЗ по настоящему изобретению.
Предпосылки создания изобретения
Моноклональные антитела в качестве противораковых средств. Каждый человек с раковым заболеванием уникален, причем его рак отличается от рака других людей, подобно отличию самих больных. Несмотря на это современная терапия лечит всех пациентов с одинаковым типом рака, находящихся на одной и той же стадии заболевания, одним и тем же способом. На первой линии терапии результат лечения по меньшей мере 30% таких пациентов оказывается неудачным, поэтому проводят дополнительные циклы лечения и повышают вероятность неудачи лечения, метастазов и неизбежно смерти. Лучшим подходом к лечению может быть подбор терапии для конкретного индивидуума. Единственной современной терапией, которая учитывает индивидуальность пациента, является хирургия. Химиотерапия и радиотерапия не могут быть подобраны для конкретного пациента, а хирургия в большинстве случаев не соответствует выбранному курсу лечения.
После начала применения моноклональных антител вероятность разработки способов индивидуальной терапии становится более реалистичной, поскольку каждое антитело может быть направлено на единственный эпитоп. Кроме того, можно выработать сочетание антител, направленных на комбинацию эпитопов, которые уникальным образом распознают опухоль индивидуума.
Установив, что отличие раковых клеток от здоровых заключается в том, что раковые клетки содержат антигены, специфичные для трансформированных клеток, в научном сообществе сформировалось устойчивое представление о том, что моноклональные антитела можно специфически нацеливать на трансформированные клетки благодаря их специфическому связыванию с таким раковым антигеном, и что моноклональные антитела могут выступать в качестве «магической пули» для уничтожения раковых клеток. Однако в настоящее время общеизвестно, что нет единого моноклонального антитела, которое может применяться во всех случаях заболевания раком, и что моноклональные антитела могут быть использованы в качестве представителей класса антител для целевой противораковой терапии. Установлено, что моноклональные антитела, выделенные по настоящему изобретению, модифицируют процесс ракового заболевания полезным для пациента образом, например, уменьшая опухолевую нагрузку, и могут по-разному упоминаться в настоящем изобретении, или в качестве антител, модифицирующих раковые заболевания (АМРЗ), или в качестве «противораковых антител».
В настоящее время пациент, больной раком, обычно располагает несколькими вариантами лечения. Преобладающий подход к противораковой терапии приводит к улучшению общей выживаемости и показателя смертности. Однако для конкретного индивидуума такая улучшенная статистика необязательно совпадает с улучшением конкретно его состояния.
Таким образом, если бы была предложена методология, позволяющая специалисту лечить каждое опухолевое заболевание конкретного пациента независимо от других способа лечения других пациентов в той же группе, появился бы уникальный подход направленной терапии применительно к одному конкретному человеку. Такой курс терапии в идеале мог бы повысить показатель выживания и привести к лучшим результатам, тем самым удовлетворяя существующую потребность.
Ранее эффективность применения поликлональных антител для лечения раковых заболеваний человека была малоэффективна. Формы лимфомы и лейкоза лечили плазмой человека, но была всего лишь умеренная пролонгированная ремиссия или ответ. Кроме того, отсутствовала воспроизводимость, и лечебный эффект не превышал такового от применения химиотерапии. Плотные опухоли, например рак груди, меланома и почечно-клеточный рак, также лечили кровью людей, сывороткой шимпанзе, плазмой человека и сывороткой лошади с соответствующими непредсказуемыми и неэффективными результатами.
Было много клинических исследований по применению моноклональных антител для лечения плотных опухолей. В 1980-х годах было по меньшей мере четыре клинических исследования рака груди человека, в которых из 47 пациентов, которых лечили антителами против специфических антигенов или основанными на тканевой избирательности, был только один респондер. Успешные результаты были получены только в 1998 году, когда были проведены успешные клинические исследования с применением гуманизированного анти-Her2/neu антитела (продукта Herceptin®) в комбинации с цисплатином. В этом исследовании оценивали ответ 37 пациентов, из которых примерно четверть показала частичный ответ и еще одна четверть обладала незначительным или стабильным прогрессированием заболевания. Среднее время до начала прогрессирования среди респондеров составляло 8,4 месяца при средней длительности ответа 5,3 месяца.
Продукт Herceptin® одобрен в 1998 году для первой линии применения в комбинации с продуктом Taxol®. Результаты клинического исследования показали повышение среднего времени до начала прогрессирования заболевания для тех, кто получил лечение антителом плюс продуктом Taxol® (6,9 месяцев), по сравнению с группой, которая получала только продукт Taxol® (3,0 месяца). Также было небольшое увеличение средней выживаемости: 22 против 18 месяцев для лечения продуктом Herceptin® плюс продуктом Taxol® против лечения только продуктом Taxol®. Кроме того, было увеличение числа и полных (8% против 2%), и частичных респондеров (34% против 15%) в группе лечения комбинацией антитела плюс продукт Taxol® по сравнению с лечением только продуктом Taxol®. Однако лечение продуктом Herceptin® и продуктом Taxol® приводило к повышенной частоте кардиотоксичности по сравнению с лечением только продуктом Taxol® (13% против 1% соответственно). Кроме того, лечение продуктом Herceptin® было эффективно только для пациентов с избыточной экспрессией (по данным иммуногистохимического анализа (ИГХ)) рецептора эпидермального фактора роста человека 2 (human epidermal growth factor receptor 2-Her2/neu), рецептора, для которого в настоящее время не установлена функция или биологически значимый лиганд; примерно 25% пациентов имели метастатический рак груди. Таким образом, для пациентов с раком груди все еще существует насущная потребность в разработке эффективного способа лечения. Даже те пациенты, на которых продукт Herceptin® может оказать целебное воздействие, все же нуждаются в химиотерапии и, следовательно, у них возможны по меньшей мере в некоторой степени побочные эффекты от терапии такого рода.
В клинических исследованиях колоректального рака применялись антитела против и гликопротеиновых, и гликолипидных мишеней. Антитело, например, 17-1А, которое имеет некоторую специфичность в отношении аденокарциномы, прошло II фазу клинических исследований с участием более 60 пациентов, среди которых только один пациент показал частичный ответ. В других исследованиях среди 52 пациентов в протоколах с дополнительным применением циклофосфамида, применение 17-1А привело только к 1 полному ответу и 2 минорным ответам. К настоящему времени III фаза клинических исследований не показала повышенной эффективности 17-1А в качестве адьювантной терапии для III стадии рака ободочной кишки. Применение гуманизированного мышиного моноклонального антитела, первоначально одобренного для визуализации, также не приводило регрессии опухоли.
Только недавно получены некоторые положительные результаты применения моноклональных антител в клинических исследованиях колоректального рака. В 2004 году продукт ERBITUX® одобрен для второй линии лечения пациентов с EGFR-экспрессирующим метастатическим колоректальным раком, которые не поддаются химиотерапии на основе иринотекана. Результаты и II фазы клинического исследования с участием двух групп пациентов, и исследования с участием одной группы пациентов, показали, что при использовании продукта ERBITUX® в комбинации с иринотеканом степень ответа составляла 23 и 15 процентов соответственно, при среднем времени до прогрессирования заболевания 4,1 и 6,5 месяцев соответственно. Результаты той же II фазы клинического исследования с участием двух групп пациентов и другого исследования с участием одной группы пациентов показали, что лечение с применением только одного продукта ERBITUX® приводило к степени ответа 11 и 9 процентов, соответственно, при среднем времени до прогрессирования заболевания 1,5 и 4,2 месяцев соответственно.
В результате, в Швейцарии и в Соединенных Штатах лечение с применением продукта ERBITUX® в комбинации с иринотеканом, и в Соединенных Штатах лечение с применением одного продукта ERBITUX®, одобрено в качестве второй линии лечения пациентов с колоректальным раком, у которых первая линия терапии иринотеканом оказалась неудачной. Поэтому, подобно продукту Herceptin®, в Швейцарии одобрено только лечение с применением комбинации моноклонального антитела и химиотерапии. Кроме того, лечение и в Швейцарии, и в США одобрено только для пациентов в качестве второй линии терапии. К тому же в 2004 году продукт AVASTIN® одобрен для использования в комбинации с химиотерапией с применением внутривенного введения 5-фторурацила в качестве первой линии лечения метастатического колоректального рака. Результаты III фазы клинических исследований показали повышение средней выживаемости у пациентов, получавших лечение продуктом AVASTIN® в сочетании с 5-фторурацилом, по сравнению с пациентами, получавшими лечение только одним 5-фторурацилом (20 месяцев против 16 месяцев соответственно). Однако, подобно продуктам Herceptin® и ERBITUX®, лечение одобрено только в качестве комбинации моноклонального антитела и химиотерапии.
Остаются также неудовлетворительными результаты лечения рака легких, мозга, яичников, поджелудочной железы, простаты и желудка. Наиболее обещающие результаты недавно получены для немелкоклеточного рака легкого во II фазе клинического исследования, в котором в лечение было вовлечено моноклональное антитело (SGN-15, dox-BR96, анти-Sialyl-LeX), конъюгированное с лекарственным средством, убивающим клетки, доксорубицином, в комбинации с химиотерапевтическим агентом продуктом TAXOTERE®. Продукт TAXOTERE® является единственным, одобренным FDA (Food and Drug Administration - Управление по контролю за продуктами и лекарствами США) химиотерапевтическим средством второй линии лечения рака легкого. Начальные данные показывают повышенную общую выживаемость по сравнению с применением только одного продукта TAXOTERE®. Из 62 пациентов, которые участвовали в исследовании, две трети получали SGN-15 в комбинации с продуктом TAXOTERE®, а оставшаяся одна треть получала только продукт TAXOTERE®. Для пациентов, получавших SGN-15 в комбинации с продуктом TAXOTERE®, средняя общая выживаемость составляла 7,3 месяцев по сравнению с 5,9 месяцами для пациентов, получавших только продукт TAXOTERE®. Общая выживаемость до 1 года и 18 месяцев составляла 29 и 18 процентов, соответственно, для пациентов, получавших SNG-15 плюс продукт TAXOTERE®, по сравнению с 24 и 8 процентами, соответственно, для пациентов, получавших только TAXOTERE®. Планируется проведение дальнейших клинических исследований.
На предклинической стадии некоторый успех достигнут при использовании моноклональных антител в отношении меланомы. До клинических исследований дошло очень незначительное количество таких антител, и на сегодняшний день ни одно из них не одобрено и не показало благоприятных результатов в III фазе клинических исследований.
Открытие новых лекарственных средств тормозится отсутствием идентификации релевантных мишеней среди продуктов 30000 известных генов, которые могут способствовать патогенезу заболевания. В онкологическом исследовании потенциальные мишени для лекарств часто выбираются просто на основании их сверхэкспрессии в опухолевых клетках. Идентифицируемые таким образом мишени затем используются в скрининге по взаимодействию с множеством соединений. При потенциальной терапии антителами соединения-кандидаты обычно получают посредством традиционных методов выработки моноклональных антител в соответствии с фундаментальными принципами, заложенными Kohler и Milstein (Nature, 256, 1975, сс.495-497). Клетки селезенки берут от мышей, иммунизированных антигеном (например, целыми клетками, клеточными фракциями, очищенным антигеном), и сливают их с бессмертными гибридомными партнерами. Получающиеся гибридомы подвергают скринингу и отбору по секреции антител, которые наиболее активно связываются с мишенью. Многие терапевтические и диагностические антитела, направленные против раковых клеток, включая продукт Herceptin® и ритуксимаб, получены с использованием этих методов и отобраны на основе их аффинитета. Недостатки этой стратегии двояки. Во-первых, выбор подходящих мишеней для связывания терапевтических или диагностических антител ограничивается недостатком знаний о специфических канцерогенных процессах в окружающих тканях и в результате упрощенческими подходами, например, селекцией на основе сверхэкспрессиии, посредством которых эти мишени идентифицируют.Во-вторых, допущение, что молекула лекарственного средства, которая связывается с рецептором с наибольшим сродством, обычно обладает наибольшим шансом инициирования или ингибирования сигнала, не всегда оказывается верным.
Несмотря на некоторый прогресс в лечении рака молочной железы и рака ободочной кишки идентификация и разработка эффективных способов лечения на основе антител либо в качестве единственных агентов, либо для сочетанного лечения были недостаточно эффективны для всех типов рака.
Предшествующие патенты
Патент US 5750102 описывает способ, в котором клетки опухоли пациента трансфецируют генами главного комплекса гистосовместимости (ГКГ), которые могут быть клонированы из клеток или тканей пациента. Такие трансфецированные клетки затем применяют для вакцинации пациента.
Патент US 4861581 описывает способ, включающий стадии получения моноклональных антител, специфичных к внутреннему клеточному компоненту неопластических или нормальных клеток млекопитающего, но не к внешним компонентам, нанесения метки на моноклональное антитело, контакта меченого антитела с тканью млекопитающего, которого лечили, чтобы убить неопластические клетки, и определения эффективности терапии путем измерения связывания меченого антитела с внутренним клеточным компонентом перерождающихся неопластических клеток. При приготовлении антител, направленных на внутриклеточные антигены человека, в указанном патенте было установлено, что злокачественные клетки представляют соответствующий источник таких антигенов.
Патент US 5171665 описывает новое антитело и способ его получения. В частности, патент описывает получение моноклонального антитела, которое обладает способностью к сильному связыванию с белковым антигеном, связанным с опухолями человека, например, толстой кишки или легкого, связываясь при этом с нормальными клетками в гораздо меньшей степени.
Патент US 5484596 описывает способ терапии рака, включающий хирургическое удаление опухолевой ткани у человека, больного раком, обработку опухолевой ткани с целью получения опухолевых клеток, облучение опухолевых клеток, сохраняющее их жизнеспособность, но ликвидирующее опухолеродность, и использование этих клеток для приготовления вакцины для пациента, которая способна к ингибированию рецидива первичной опухоли наряду с одновременным ингибированием метастазов. Патент описывает создание моноклональных антител, которые реагируют с поверхностными антигенами опухолевых клеток. В колонке 4, строке 45 и последующих показано, что в патенте используют автохтонные раковые клетки для разработки активной специфической иммунотерапии при неоплазии человека на основе моноклональных антител.
Патент US 5693763 описывает гликопротеиновый антиген, характерный для карциномы человека, вне зависимости от происхождения эпителиальной ткани.
Патент US 5783186 посвящен анти-Her2 антителам, которые индуцируют апоптоз в экспрессирующих Her2 клетках, гибридомным клеточным линиям, вырабатывающим антитела, способам лечения рака с применением антител и фармацевтическим композициям, включающим указанные антитела.
Патент US 5849876 описывает новые линии гибридомных клеток для выработки моноклональных антител к муциновым антигенам, выделенным и очищенным из опухолевой и неопухолевой ткани.
Патент US 5869268 раскрывает способ образования лимфоцитов человека, продуцирующих антитела, специфичные к искомому антигену, способ получения моноклональных антител, а также моноклональные антитела, получаемые этим способом. В частности, патент раскрывает выработку анти-HD моноклональных антител человека, пригодных для диагностики и лечения раковых заболеваний.
Патент US 5869045 относится к антителам, фрагментам антител, конъюгатам антител и одноцепочечным иммунотоксинам, реагирующим с клетками карциномы человека. Механизм, с помощью которого эти антитела функционируют, является двояким, поскольку, во-первых, молекулы реагируют с мембранными антигенами, присутствующими на поверхности карциномы человека, и, во-вторых, после связывания антитела могут проникать внутрь клеток карциномы, что делает их особенно полезными для образования конъюгатов антитело-лекарство и антитело-токсин. В своей немодифицированной форме антитела при определенных концентрациях также проявляют цитотоксические свойства.
Патент US 5780033 раскрывает применение аутоантител для терапии и профилактики опухолевых заболеваний. Однако эти антитела являются антинуклеарными аутоантителами от старого млекопитающего. В этом случае аутоантитела согласно описанию являются одним типом природных антител, обнаруживаемых в иммунной системе. Поскольку антитела происходят от «старого млекопитающего», не требуется, чтобы аутоантитела обязательно происходили от пациента, получавшего лечение. Кроме того, патент описывает природные и моноклональные антинуклеарные антитела от старого млекопитающего и гибридомную клеточную линию, вырабатывающую моноклональные антинуклеарные антитела.
Краткое описание изобретения
Эта заявка использует методологию получения специфических для пациента противораковых антител, показанную в патенте US 6180357 для выделения клеточных линий гибридом, которые кодируют моноклональные антитела, модифицирующие раковые заболевания. Эти антитела можно получить конкретно для одной опухоли, что дает возможность проведения индивидуальной терапии рака. В контексте настоящей заявки противораковые антитела, обладающие либо приводящими к гибели клетки (цитотоксическими), либо подавляющими рост клеток (цитостатическими) свойствами, в дальнейшем будут рассматриваться в качестве цитотоксических. Эти антитела можно применять при определении стадии и диагностики рака, а также для лечения метастазов опухоли. Эти антитела можно применять для предупреждения рака путем профилактического лечения. В отличие от антител, получаемых в соответствии с традиционными принципами поиска лекарственных средств, антитела, получаемые этим способом, можно нацеливать на молекулы и пути, участие которых в росте и/или выживании злокачественной ткани ранее не было обнаружено. Кроме того, связывающее сродство этих антител соответствует условиям инициации цитотоксических событий, которые могут не поддаваться более сильным аффинным взаимодействиям. Также в рамках настоящего изобретения предусматривается соединение стандартных химиотерапевтических средств, например радионуклеотидов, с АМРЗ по настоящему изобретению, тем самым фокусируя применение химиотерапевтических средств. АМРЗ также можно соединять с токсинами, цитотоксическими компонентами или гематогенными клетками, получая, таким образом, конъюгаты антител. АМРЗ можно применять отдельно или в комбинации АМРЗ с одним или несколькими химиотерапевтическими агентами.
Возможность применения индивидуального лечения рака может привнести изменение в результате лечения человека. Вероятный клинический сценарий заключается в том, что во время описания заболевания получают образец опухоли и закладывают его в банк. На основании этого образца опухоль можно типировать по панели имеющихся антител, модифицирующих раковые заболевания. У пациента может быть условно определена стадия, но можно использовать имеющиеся в наличии антитела для последующего определения стадии заболевания. Пациента можно непосредственно лечить имеющимися в наличии антителами, а также можно получить панель специфических к опухоли антител либо с помощью способов, приведенных в настоящем описании, либо посредством использования библиотек фагового дисплея в сочетании со способами скрининга, описанными в настоящем изобретении. Все произведенные антитела могут быть добавлены к библиотеке противораковых антител, поскольку существует вероятность того, что другие опухоли могут нести некоторые из тех же эпитопов, которые характерны для опухоли, подвергающейся лечению. Произведенные в соответствие с этим способом антитела могут быть применимы для лечения раковых заболеваний у какого-либо числа пациентов, которые имеют раковые опухоли, которые связываются с указанными антителами.
Кроме противораковых антител в качестве части многомодального режима лечения пациент может получать рекомендованное в настоящее время лечение. Поскольку антитела, получаемые с помощью настоящей методологии, относительно нетоксичны для нераковых клеток, возможно применение высоких доз антител при их использовании либо отдельно, либо в сочетании с традиционной терапией. Высокий терапевтический индекс также позволяет проведение повторного лечения по краткосрочной шкале, которая уменьшает вероятность появления устойчивых к лечению клеток.
Если пациент не поддается первоначальному курсу терапии, или развиваются метастазы, процесс выработки антител, специфических к опухоли, можно повторить в качестве повторного лечения. Кроме того, противораковые антитела можно соединять с красными кровяными тельцами, получаемыми от пациента, и снова вводить их инфузией для лечения метастазов. Лечение метастазирующего рака обычно малоэффективно, и появление метастазов обычно свидетельствует о плохом прогнозе, приводящем к смерти. Однако метастатические раковые опухоли обычно хорошо васкуляризованы и доставка противораковых антител красными кровяными тельцами может привести к концентрированию антител в месте опухоли. Даже до развития метастазов выживаемость большинства раковых клеток зависит от кровоснабжения хозяина, и противораковые антитела, соединенные с красными кровяными тельцами, могут также оказаться эффективными против самих опухолей. В другом варианте антитела можно соединять с другими гематогенными клетками, например лимфоцитами, макрофагами, моноцитами, естественными клетками-киллерами и т.д. Существует пять классов антител, и каждый класс связан с функцией, которая определяется их тяжелой цепью. Обычно считают, что уничтожение раковых клеток голыми антителами опосредовано либо через антителозависимую клеточную цитотоксичность, либо через комплементзависимую цитотоксичность. Например, мышиные антитела IgM и IgG2a могут активировать человеческий комплемент путем связывания компонента С-1 системы комплемента, то есть классическим путем активации комплемента, которая может привести к лизису опухоли. Что касается антител человека, наиболее эффективными комплемент-активирующими антителами обычно являются IgM и IgG1. Мышиные антитела изотипа IgG2a и IgG3 эффективны в рекрутинге цитотоксических клеток, имеющих рецептор Fc, который приводит к лизису клеток моноцитами, макрофагами, гранулоцитами и определенными лимфоцитами. Антитела человека изотипов IgG1 и IgG3 опосредуют антителозависимую клеточную цитотоксичность (АЗКЦ).
Цитотоксичность, опосредуемая через Fc-область, требует присутствия клеток-эффекторов и их соответствующих рецепторов, или белков, например NK-клеток, комплемента и Т-клеток, соответственно. При отсутствии этих эффекторных механизмов Fc-область антитела инертна. Fc-область антитела может определять свойства, которые воздействуют на фармакокинентику антитела in vivo, но в условиях in vitro Fc-область неэффективна.
В анализах цитотоксичности по настоящему изобретению, в которых исследуют антитела, нет никаких эффекторных механизмов, и они выполняются in vitro. В этих анализах не используются клетки-эффекторы (NK, макрофаги или Т-клетки) или комплемент. Поскольку эти анализы полностью зависят от добавляемых компонентов, каждый компонент может быть описан. Анализы, применяемые в настоящем изобретении, включают только клетки-мишени, среды и сыворотки. Клетки-мишени не обладают функциональными свойствами эффекторов, поскольку они являются раковыми клетками или фибробластами. Без экзогенных клеток, которые имеют функциональные свойства эффекторов, нет клеточных элементов с такой функцией. Среда не содержит ни комплемента, ни каких-либо клеток. Согласно описанию фирм-поставщиков сыворотка, используемая для поддержки роста клеток-мишеней, не обладает активностью комплемента. Кроме того, отсутствие комплементарной активности в используемых сыворотках подтверждено в лабораториях авторов настоящего патента. Таким образом, согласно настоящему изобретению установлено, что действия антител полностью определяются связыванием антигена, которое опосредуется через Fab. Действительно, клетки-мишени очевидны и взаимодействуют только с Fab, поскольку они не имеют рецепторов для Fc. Хотя гибридома секретирует целый иммуноглобулин, который исследовался с клетками-мишенями, только части иммуноглобулина, взаимодействующие с клетками, представляют Fab, которые действуют в качестве антигенсвязывающих фрагментов.
Что касается описанных в настоящем изобретении антител и антигенсвязывающих фрагментов, в поданной заявке показана их клеточная цитотоксичность, подтвержденная данными, представленными в таблице (фиг.1). Как подчеркивалось выше, и согласно объективному доказательству, представленному в настоящем описании, этот эффект полностью определяется связыванием Fab с опухолевыми клетками.
Существует важное доказательство антитело-опосредованной цитотоксичности, которая определяется прямым связыванием антитела с антигеном-мишенью и не зависит от эффекторных механизмов, связанных с Fc. Лучшим доказательством этого являются эксперименты in vitro, в которых не используют дополнительные клетки или комплемент (чтобы официально исключить эти механизмы). Эти типы экспериментов проводят с целым иммуноглобулином или с антигенсвязывающими фрагментами, например, F(ab)'2-фрагментами. В экспериментах таких типов используют антитела или антигенсвязывающие фрагменты, которые могут прямо индуцировать апоптоз клеток-мишеней, например, анти-Неr2 и анти-EGFR антитела, которые оба одобрены FDA США для маркетинга в терапии рака.
Другие возможные механизмы уничтожения раковых клеток, опосредованные антителами, могут осуществляться через использование так называемых каталитических антител, которые функционально катализируют гидролиз различных химических соединений в клеточной мембране и мембранно-связанных гликопротеинах и гликолипидах.
Существует еще три дополнительных механизма уничтожения раковых клеток, опосредованных антителами. Первый заключается в применении антител в качестве вакцины, чтобы побудить организм к иммунному ответу против предполагаемого антигена, который находится на раковой клетке. Второй заключается в применении антител к ростовым рецепторам-мишеням и нарушении их функционирования или в снижении регулирования этих рецепторов так, чтобы их функция существенно утрачивалась. Третий заключается в непосредственном эффекте таких антител на лигирование частей клеточной поверхности, которое может привести к прямой гибели клетки, например лигирование рецепторов смерти, например TRAIL R1 или TRAIL R2, или молекул интегрина, например альфа V бета 3 и других.
Клиническая ценность противоракового лекарственного препарата определяется целебным эффектом лекарства при допустимом профиле риска для пациента. В терапии рака выживаемость обычно является главной установкой после целебного эффекта, однако существует большое количество других хорошо известных целебных эффектов дополнительно к пролонгированию жизни. К таким другим целебным эффектам, когда лечение не наносит ущерб выживаемости, относят временное облегчение симптомов, защиту от побочных эффектов и удлинение времени до начала прогрессирования заболевания. Эти критерии обычно являются общепринятыми, и регулирующие органы, например, Управление по пищевым продуктам и лекарствам США (FDA), утверждают лекарственные средства на основе указанных лечебных эффектов (Hirschfeld и др., Critical Reviews in Oncology/Hematolgy, 42, 2002, сс. 137-143). Хорошо известно, что дополнительно к этим критериям существуют другие конечные точки, которые могут предсказывать эти типы лечебных эффектов. В частности, в ускоренной процедуре одобрения, предоставляемой FDA США, используются заменители, которые дают возможность прогнозировать лечебный для пациента эффект. Так к концу 2003 года по этой процедуре было одобрено шестнадцать лекарственных средств, и из них четыре дошли до полного одобрения, т.е. доведенные до конца исследования показали их непосредственный лечебный эффект для пациента, который прогнозировался на основе суррогатных конечных точек. Одной важной конечной точкой для определения эффектов лекарственного препарата на плотные опухоли является определение опухолевой нагрузки при оценке ответа на лечение (Therasse и др., Journal of the National Cancer Institute, 92(3), 2000, сс.205-216). Клинические критерии (критерии RECIST) для такой оценки опубликованы рабочей группой по критериям оценки ответа плотных опухолей (Response Evaluation Criteria in Solid Tumors Working Group), группой международных экспертов в области рака. Лекарства с достоверным эффектом на опухолевую нагрузку, показанным на основе объективных ответов в соответствии с критериями RECIST, по сравнению с соответствующей контрольной группой, в конечном счете, оказывают непосредственный лечебный эффект на пациента. В предклинических исследованиях опухолевая нагрузка обычно наиболее часто оценивается и документируется. Когда по результатам доклинических исследований предсказывается клиническая картина, лекарственные препараты, которые вызывают длительную выживаемость в предклинических моделях, имеют самую большую прогнозируемую клиническую ценность. Аналогично положительным ответам на клиническое лечение, лекарственные препараты, которые уменьшают опухолевую нагрузку в предклиническом исследовании, могут также иметь значительное непосредственное воздействие на заболевание. Хотя удлинение выживаемости представляет наибольшую клиническую выгоду от лекарственного лечения рака, существуют другие полезные для клиники целебные эффекты, и очевидно, что уменьшение опухолевой нагрузки, которая может коррелировать с задержкой прогрессирования заболевания, удлинением выживаемости или обоими указанными результатами, может также приводить к прямому общему полезному результату и иметь клиническое значение (Eckhardt и др.. Developmental Therapeutics: Successes and Failures of Clinical Trial Designs of Targeted Compounds, ASCO Educational Book, 39-oe ежегодное собрание, 2003, сс.209-219).
Настоящее изобретение описывает разработку и применение продукта AR81A410.7, идентифицированного по его действию в цитотоксических анализах и в экспериментальной модели на животной модели рака человека. Это изобретение описывает реагенты, которые специфически связываются с эпитопом или эпитопами, присутствующими на молекуле-мишени, а также обладают in vitro цитотоксическими свойствами, подобно голому антителу, против злокачественных опухолевых клеток, но не обладают таковыми против нормальных клеток, и которые также непосредственно опосредуют, подобно голому антителу, ингибирование опухолевого роста. Дополнительное усовершенствование заключается в применении противораковых антител, например, для нацеливания на опухоли, экспрессирующие близкие антигенные маркеры, для подавления опухолевого роста и достижения других положительных конечных точек лечения рака.
В целом, настоящее изобретение предусматривает применение антигена AR81A410.7 в качестве мишени для терапевтического агента, который при введении может понизить опухолевую нагрузку раковой опухоли, экспрессирующей этот антиген у млекопитающего. Настоящее изобретение также предусматривает применение АМРЗ (AR81A410.7), его производных, антигенсвязывающих фрагментов, а также лигандов, индуцирующих цитотоксичность, для нацеливания антигена с тем, чтобы понизить нагрузку раковой опухоли, экспрессирующей этот антиген, у млекопитающего. Кроме того, настоящее изобретение предусматривает использование обнаружения антигена AR81A410.7 в раковых клетках, которое может быть пригодно для диагностики, прогнозирования терапии и прогнозирования млекопитающих, несущих опухоли, которые экспрессируют этот антиген.
Таким образом, цель настоящего изобретения заключается в использовании способа для получения антител, модифицирующих раковое заболевание (АМРЗ), формирующихся против раковых клеток, полученных от конкретного пациента, или одной или нескольких раковых клеточных линий, причем АМРЗ цитотоксичны в отношении раковых клеток и при этом относительно нетоксичны в отношении нераковых клеток, чтобы выделить гибридомные клеточные линии и кодируемые ими соответствующие выделенные моноклональные антитела и их антигенсвязывающие фрагменты.
В другом объекте настоящего изобретения предусматриваются антитела, модифицирующие раковое заболевание, их лиганды и антигенсвязывающие фрагменты.
В другом объекте настоящего изобретения предусматривается получение антител, модифицирующих раковое заболевание, цитотоксичность которых опосредуется через антителозависимую клеточную токсичность.
Еще один дополнительный объект настоящего изобретения заключается в получении антител, модифицирующих раковое заболевание, цитотоксичность которых опосредуется через комплемент-зависимую клеточную токсичность.
Кроме того, объектом настоящего изобретения является получение антител, модифицирующих раковое заболевание, цитотоксичность которых является результатом их способности катализировать гидролиз клеточных химических связей.
Еще одним объектом настоящего изобретения является получение антител, модифицирующих раковое заболевание, которые можно использовать в анализах связывания для диагностики, прогнозирования и мониторинга ракового заболевания.
Другие цели и преимущества настоящего изобретения будут видны из последующего описания, в котором изложены, в виде иллюстраций и примеров, определенные варианты осуществления настоящего изобретения.
Краткое описание фигур
Фиг.1 сравнивает в процентах цитотоксичность и уровни связывания гибридомных супернатантов против клеточных линий А549, NCI-H23, NCI-Н460, MDA-MB-231 и Hs888.Lu.
Фиг.2 представляет связывание AR81A410.7 с раковыми и нормальными клеточными линиями. Данные представлены в виде таблицы, чтобы показать среднюю интенсивность флуоресценции, как кратное увеличение над изотипным контролем.
Фиг.3 включает характерные FACS гистограммы AR81A410.7 и анти-EGFR антител, направленных в отношении некоторых раковых и нераковых клеточных линий.
Фиг.4 демонстрирует воздействие AR81A410.7 на опухолевый рост в профилактической модели рака поджелудочной железы ВхРС-3. Вертикальные пунктирные линии показывают период, в течение которого вводится антитело. Информационные точки представляют среднее значение +/- СО (стандартная ошибка среднего значения).
Фиг.5 демонстрирует воздействие AR81A410.7 на массу тела в профилактической модели рака поджелудочной железы ВхРС-3. Информационные точки представляют среднее значение +/- СО.
Подробное описание изобретения
Обычно следующие слова или фразы имеют указанное определение, когда используются в резюме, описании, примерах и формуле изобретения.
Понятие «антитело» используется в широком смысле и специфически охватывает, например, индивидуальные моноклональные антитела (включая агонистические, антагонистические и нейтрализующие антитела), композиции антител с полиэпитопной специфичностью, одноцепочечные антитела, двойные антитела, тройные антитела, иммуноконъюгаты и фрагменты антител (см. ниже).
Понятие «моноклональное антитело» в контексте настоящего изобретения относится к антителу, полученному из популяции в существенной степени гомогенных антител, т.е. индивидуальных антител, составляющих популяцию, являются идентичными за исключением возможных естественно встречающихся мутаций, которые могут присутствовать в минорных количествах. Моноклональные антитела высоко специфичны и направлены против единственного антигенного участка. Кроме того, в противоположность препаратам поликлональных антител, которые включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против единственной детерминанты на антигене. Дополнительно к их специфичности, моноклональные антитела полезны тем, что их можно синтезировать без примесей других антител. Понятие «моноклональное» указывает на характер антитела, которое получают из популяции антител, которая в существенной степени гомогенна, и не следует считать, что антитела получают каким-то особым способом. Например, моноклональные антитела, применяемые по настоящему изобретению, можно получить на основе гибридомной (мышиной или человеческой) технологии, впервые описанной Kohler и др.. Nature, 256, 1975, сс.495, или их можно получить посредством методов рекомбинантных ДНК (см., например, патент US 4816567). «Моноклональные антитела» можно также выделить из библиотек фаговых антител, используя методы, например, описанные Clackson и др., в Nature, 352, 1991, сс. 624-628 и Marks и др., в J. Mol. Biol., 222, 1991, сс.581-597.
«Фрагменты антител» включают часть интактного антитела, предпочтительно включающую его антигенсвязывающую или вариабельную область. Примеры фрагментов антител включают части, имеющие меньшую длину, чем целые антитела, фрагменты Fab, Fab', F(ab')2 и Fv, двойные антитела, линейные антитела, одноцепочечные молекулы антител, одноцепочечные антитела, однодоменные молекулы антител, слитые белки, рекомбинантные белки и полиспецифические антитела, образованные из фрагментов антител.
«Интактное» антитело представляет антитело, включающее антигенсвязывающий вариабельный участок, а также константный домен легкой цепи (CL) и константные домены тяжелой цепи CH1, CH2 и CH3. Константные домены могут быть константными доменами с нативной последовательностью (например, константные домены с нативной последовательностью человека) или с измененной аминокислотной последовательностью. Предпочтительно, интактное антитело имеет одну или несколько эффекторных функций.
В зависимости от аминокислотной последовательности константного домена тяжелых цепей интактные антитела могут причисляться к различным «классам». Существует пять основных классов интактных антител: IgA, IgD, IgE, IgG и IgM, и некоторые из них дополнительно могут подразделяться на «подклассы» (изотипы), например IgG1, IgG2, IgG3, IgG4, IgA и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам антител, называются α, δ, ε, γ и µ, соответственно. Субъединичные структуры и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны.
«Эффекторные функции» антител относятся к биологическим активностям, свойственным Fc-области (Fc-области с нативной последовательностью или Fc-области с измененной аминокислотной последовательностью) антитела. Примеры эффекторных функций антител включают связывание Clq, комплемент-зависимую цитотоксичность, связывание Fc-рецептора, антитело-зависимую клеточно-опосредованную цитотоксичность (АЗКЦ), фагоцитоз, пониженную регуляцию рецепторов клеточной поверхности (например, В-клеточного рецептора, BCR) и т.д.
Понятие «антителозависимая клеточно-опосредованная цитотоксичность (АЗКЦ)» относится к опосредуемой клетками реакции, при которой неспецифические цитотоксические клетки, которые экспрессируют Fc-рецепторы (FcR) (например, природные клетки-киллеры (NK-natural killer), нейтрофилы и макрофаги) распознают связанное антитело на клетке-мишени и затем вызывают лизис клетки-мишени. Основные клетки для опосредования АЗКЦ, NK-клетки, экспрессируют только FcγRIII, а моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR в гемопоэтических клетках представлена в обобщенном виде в табл.3 на с.464 Ravetch и Kinet в Annu. Rev. ImmunoL, 9, 1991, сс. 457-492. Для оценки АЗКЦ-активности интересующей молекулы можно провести АЗКЦ-анализ in vitro, например, описанный в патентах US 5500362 или 5821337. Подходящие эффекторные клетки для таких анализов включают мононуклеарные клетки периферической крови (МКПК) и естественные клетки-киллеры (NK). В другом варианте или дополнительно АЗКЦ-активность интересующей молекулы можно оценить in vivo, например, в экспериментальной модели на животных, например, описанной Clynes и др. в PNAS (США), 95, 1998, сс.652-656.
«Эффекторные клетки» являются лейкоцитами, которые экспрессируют один или несколько FcR и осуществляют эффекторные функции. Предпочтительно клетки экспрессируют по меньшей мере FcγRIII и осуществляют АЗКЦ-эффекторную функцию. Примеры лейкоцитов человека, которые опосредуют АЗКЦ, включают мононуклеарные клетки периферической крови (МКПК), природные клетки-киллеры (NK), моноциты, цитотоксические Т-клетки и нейтрофилы, притом что предпочтительными являются МКПК и NK. Эффекторные клетки можно выделить из их естественного источника, например из крови или МКПК, в соответствии с приведенным здесь описанием.
Понятия «Fc-рецептор» или «FcR» используют для обозначения рецептора, который связывается с Fc-областью антитела. Предпочтительный FcR представляет естественную последовательность FcR человека. Кроме того, предпочтительный FcR связывается с IgG-антителом (гамма-рецептор) и включает рецепторы подклассов FcγRI, FcγRII и FeγRIII, включая аллельные варианты и альтернативно сплайсированные формы данных рецепторов. FcγRII-рецепторы включают FcγRIIA («активирующий рецептор») и FcγRIIB («ингибирующий рецептор»), которые имеют одинаковые аминокислотные последовательности, различающиеся в основном по цитоплазматическим доменам. Активирующий FcγRIIA-рецептор в своем цитоплазматическом домене содержит иммунорецепторный активаторный мотив, основанный на тирозине (ITAM - immunoreceptor tyrosine-based activation motif). Ингибирующий FcγRIIB-рецептор в своем цитоплазматическом домене содержит иммунорецепторный ингибиторный мотив, основанный на тирозине (ITIM-immunoreceptor tyrosine-based inhibition motif). (См. обзор М. Daëron, Annu. Rev. Immunol., 15, 1997, сс.203-234). Обзор по FcR представлен Ravetch и Kiner в Annu. Rev. Immunol., 9, 1991, сс.457-492, Capel и др., Immunomethods, 4, 1994, сс.25-34 и de Haas и др., J. Lab. Clin. Med., 126, 1995, сс.330-341. Понятием «FcR» объединены в настоящем описании и другие FcR, включая таковые, которые будут идентифицированы в будущем. Это понятие также включает неонатальный рецептор, FcRn, который ответственен за передачу материнских IgG плоду (Guyer и др., J. Immunol., 117, 1976, с.587, Kim и др., Eur. J. Immunol., 24, 1994, с.249).
«Комплемент-зависимая цитотоксичность (complement dependent cytotoxicity-CDC» относится к способности молекулы лизировать мишень в присутствии комплемента. Путь активации комплемента начинается со связывания первого компонента комплементарной системы (Clq) с молекулой (например, антителом), образующей комплекс с родственным антигеном. Для оценки активации комплемента можно провести CDC-анализ, например, по описанию Gazzano-Santoro и др. в J. Immunol. Methods, 202, 1996, с.163.
Понятие «вариабельный» относится к тому факту, что определенные участки вариабельных доменов в значительной степени различаются по последовательности среди антител и используются при связывании и специфичности каждого конкретного антитела в отношении его конкретного антигена. Однако вариабельность распределена неравномерно в вариабельных доменах антител. Она концентрируется в трех сегментах, называемых гипервариабельными участками, как в вариабельных доменах легкой цепи, так и тяжелой цепи. Наиболее высококонсервативные участки вариабельных доменов называются каркасными областями (FR). Каждый из вариабельных доменов естественной тяжелой и легкой цепей включает четыре FR, в основном имеющих β-складчатую конфигурацию, соединенных с тремя гипервариабельными участками, которые образуют петли, соединяющиеся и в некоторых случаях образующие часть β-складчатой структуры. Гипервариабельные участки в каждой цепи поддерживаются вместе в тесной пространственной близости с помощью FR и с гипервариабельными участками другой цепи, участвуя в образовании антигенсвязывающего сайта антител (см. Kabat и др. в кн.: «Sequences of Proteins of Immunological Interest», Министерство здравоохранения, Национальный институт здравоохранения, Бетезда, штат Мэриленд, 1991, 5-е изд.). Константные домены непосредственно не участвуют в связывании антитела с антигеном, но проявляют различные эффекторные функции, например участие антитела в антитело-зависимой клеточной цитотоксичности (АЗКЦ).
Термин «гипервариабельный участок» в контексте настоящего описания относится к аминокислотным остаткам антитела, которые ответственны за связывание антигена. Гипервариабельный участок обычно включает аминокислотные остатки из «определяющей комплементарность области (complementarity determining region - CDR» (например, остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) в вариабельном домене легкой цепи и 31-35 (H1), 50-65 (Н2) и 95-102 (Н3) в вариабельном домене тяжелой цепи, Kabat и др. в кн.: «Sequences of Proteins of Immunological Interest», Министерство здравоохранения, Национальный институт здравоохранения, Бетезда, штат Мэриленд, 1991, 5-е изд., и/или те остатки из «гипервариабельной петли» (например, остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в вариабельном домене легкой цепи и 26-32 (H1), 53-55 (Н2) и 96-101 (Н3) в вариабельном домене тяжелой цепи, Chothia и Lesk, J. Mol. Biol., 196, 1987, cc.901-917). Остатками «каркасной области (framework region - FR)» являются остатки вариабельного домена, отличные от остатков гипервариабельного участка, согласно описанию в настоящем изобретении. В результате расщепления антител папаином получается два одинаковых антигенсвязывающих фрагмента, называемых «Fab»-фрагментами, каждый с одним антигенсвязывающим сайтом, и остаточный «Fс»-фрагмент, название которого отражает его способность к легкой кристаллизации. Обработка пепсином дает F(ab')2-фрагмент, который имеет два антигенсвязывающих сайта и по-прежнему способен перекрестно связываться с антигеном.
«Fv» представляет минимальный фрагмент антитела, который содержит полный антиген-распознающий и антигенсвязывающий сайт. Данный участок состоит из димера вариабельного домена одной тяжелой цепи и одной легкой цепи в близкой нековалентной связи. Он находится в такой конфигурации, при которой три гипервариабельных участка каждого вариабельного домена взаимодействуют с образованием антигенсвязывающего сайта на поверхности димера VH-VL. Совместно шесть гипервариабельных участков придают антителу антигенсвязывающую специфичность. Однако даже один вариабельный домен (или половина Fv, включающая только три гипервариабельных участка, специфичных для антигена) обладает способностью распознавать и связывать антиген, хотя с меньшим сродством, чем связывающий целиком сайт. Fab-фрагмент также содержит константный домен легкой цепи и первый константный домен (СНГ) тяжелой цепи. Fab'-фрагменты отличаются от Fab'-фрагментов добавлением нескольких остатков на карбоксильном конце домена CHI тяжелой цепи, включая один или несколько цистеинов из шарнирной области антитела. В данном случае Fab'-SH является обозначением Fab', в котором цистеиновый остаток (остатки) константных доменов имеет по меньшей мере одну свободную тиоловую группу. F(ab')2-фрагменты антител первоначально были получены в виде пары Fab'-фрагментов, которые имеют между ними шарнирные цистеины. Известны также другие химические связи фрагментов антител.
«Легкие цепи» антител позвоночных могут обозначать один из двух четко различаемых типов, названных каппа (κ) и лямбда (λ), на основе аминокислотных последовательностей их константных доменов.
«Одноцепочечные Fv (single-chain Fv-scFv» фрагменты антитела включают домены VH и VL антитела, в которых данные домены находятся в одной полипептидной цепи. Предпочтительно полипептид Fv дополнительно включает полипептидный линкер между доменами VH и VL, который способствует scFv формировать желаемую структуру для связывания антигена. Обзор по scFv см. в работе Plückthun в кн.: «The Pharmacology of Monoclonal Antibodies», под ред. Rosenburg и Moore, Springer-Verlag, Нью-Йорк, 1994, т.113, cc.269-315.
Понятие «двойные антитела» относится к небольшим фрагментам антител с двумя антигенсвязывающими участками, эти фрагменты включают вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) в одной полипептидной цепи (VH-VL). При использовании линкера, который является слишком коротким для спаривания двух доменов в одной цепи, домены вынуждены спариваться с комплементарными доменами другой цепи и создавать два антигенсвязывающих участка. Более полно двойные антитела описаны, например, в ЕР 404097, WO 93/11161, Hollinger и др., Proc. Natl. Acad. Sci. USA, 90, 1993, сс.6444-6448.
Понятие «тройные антитела» или «трехвалентные тримеры» относится к комбинации трех одноцепочечных антител. Тройные антитела конструируют с аминокислотным концом VL или VH домена, т.е. без линкерной последовательности. Тройное антитело имеет три Fv головы с полипептидами, организованными в циклическую, голова к хвосту, форму. Возможна плоская конформация тройного антитела с тремя связывающими участками, локализованными в одной плоскости под углом 120 градусов друг к другу. Тройные антитела могут обладать моноспецифичностью, двойной специфичностью или тройной специфичностью.
«Выделенным» называют антитело, которое идентифицировано, отделено и/или извлечено из компонента его естественной среды. Загрязняющие компоненты его естественной среды являются соединениями, которые будут мешать диагностическим или терапевтическим применениям антитела, и могут включать ферменты, гормоны и другие белковые или небелковые растворимые вещества. Выделенное антитело включает антитело in situ внутри рекомбинантных клеток, если не будет присутствовать по меньшей мере один компонент естественного окружения антитела. Однако обычно выделенное антитело получают с использованием по меньшей мере одной стадии очистки.
Антителом, «которое связывает» интересующий антиген, называют антитело, которое способно связывать этот антиген с достаточной степенью сродства, чтобы антитело было пригодно в качестве терапевтического или диагностического агента для направленного воздействия на клетку, экспрессирующую антиген. Если антитело связывает антигенную часть, оно обычно предпочтительно будет связывать эту антигенную часть в противоположность другим рецепторам, и не включает побочное связывание, например, неспецифическую Fc-связь, или связывание с посттрансляционными модификациями, общими с другими антигенами, и может быть таковым, которое незначительно перекрестно реагирует с другими белками. Способы для выявления антитела, которое связывает интересующий антиген, хорошо известны в данной области, и включают, но ими не ограничиваются, например, FACS, клеточный твердофазный иммуноферментный анализ ТИФА и вестерн-блоттинг.
В контексте настоящего изобретения понятия «клетка», «клеточная линия» и «культура клеток» используются взаимозаменяемо, и все эти обозначения относятся к потомству. Следует также учитывать, что все потомство может быть не строго идентичным по содержанию ДНК, вследствие намеренных или случайных мутаций. К нему также относится мутантное потомство, которое имеет ту же функцию или биологическую активность, которая показана в изначально трансформированной клетке. Из контекста следует, в каких случаях применяются определенные обозначения.
Понятия «лечение» или «терапия» относятся и к терапевтическому лечению, и к профилактическим или превентивным мероприятиям, в которых необходимо предупредить или замедлить (сократить) данное патологическое состояние или нарушение. Нуждающиеся в лечении включают индивидуумов уже с имеющимся нарушением, а также индивидуумов, которые подвержены нарушению, или тех, у которых нарушение следует предупредить. Следовательно, у млекопитающего, для которого показано лечение по настоящему изобретению, может быть уже поставлен диагноз нарушения, или млекопитающее может быть предрасположено или восприимчиво к нарушению.
Понятие «рак» или «раковый» относится к физиологическому состоянию у млекопитающего или описывает его, которое обычно характеризуется неконтролируемым клеточным ростом или смертью. Примеры рака включают, но ими не ограничиваются, карциному, лимфому, бластому, саркому, лейкемию или лимфонеоплазию. Более конкретные примеры таких раковых заболеваний включают плоскоклеточный рак (например, эпителиальный плоскоклеточный рак), рак легкого, включая мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого и плоскоклеточный рак легкого, рак брюшины, гепатоцеллюлярный рак, рак желудка, включая рак желудочно-кишечного тракта, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, печеночно-клеточную аденому, рак молочной железы, рак ободочной кишки, рак прямой кишки, рак прямой и ободочной кишки, карциному эндометрия или рак тела матки, или карциному слюнных желез, рак почки или почечный рак, рак простаты, рак вульвы, рак щитовидной железы, печеночную карциному, анальную карциному, карциному полового члена, а также рак головы и шеи.
«Химиотерапевтический агент» означает химическое соединение, пригодное для лечения рака. Примеры химиотерапевтических агентов включают алкилирующие агенты, например тиотепу и циклофосфамид (CYTOXAN™), алкилсульфонаты, например бусульфан, импросульфан и пипосульфан, азиридины, например бензодопу, карбоквон, метуредопу и уредопу, этиленимины и метилмеламины, включая алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилолмеламин, производные азотистого иприта, например хлорамбуцил, хлорнафазин, хлорфосфамид, эстрамустин, ифосфамид, мехлоретамин, мехлоретамина оксид гидрохлорид, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урацил-иприт, нитрозомочевины, например кармустин, хлорозотоцин, фотемустин, ломустин, нимустин, ранимустин, антибиотики, например аклациномицины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, калихеамицин, карабицин, карномицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин, эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, микофенольную кислоту, ногаламицин, оливомицины, пепломицин, порфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин, антиметаболиты, например метотрексат и 5-фторурацил (5-ФУ), аналоги фолиевой кислоты, например деноптерин, метотрексат, птероптерин, триметрексат, аналоги пуринов, например флударабин, 6-меркаптопурин, тиамиприн, тиогуанин, аналоги пиримидинов, например анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин, 5-ФУ, андрогены, например калустерон, дромостанолон пропионат, эпитиостанол, мепитиостан, тестолактон, антагонисты надпочечников, например аминоглютетимид, митотан, трилостан, аналоги фолиевой кислоты, например фролиновую кислоту, ацеглатон, альдофосфамида гликозид, аминолевулиновую кислоту, амсакрин, бестрабуцил, бисантрен, эдатрексат, дефофамин, демеколцин, диазихинон, элформитин, эллиптиния ацетат, этоглуцид, галлия нитрат, гидроксимочевину, лентинан, лонидамин, митогуазон, митоксантрон, мопидамол, нитракрин, пентостатин, фенамет, пирарубицин, подофиллиновая кислота, 2-этилгидразид, прокарбазин, продукт PSK®, разоксан, сизофиран, спирогерманий, тенуазоновую кислоту, триазихинон, 2,2',2''-трихлортриэтиламин, уретан, виндезин, дакарбазин, манномустин, митобронитол, митолактол, пипоброман, гацитозин, арабинозид («Ara-С»), циклофосфамид, тиотепу, таксаны, например паклитаксел (продукт TAXOL®, Bristol-Myers Squibb Oncology, Принстон, Нью-Джерси) и доцетаксел (продукт TAXOTERE®, фирма Rh-Poulenc Rorer, Antony, Франция), хлорамбуцил, гемцитабин, 6-тиогуанин, меркаптопурин, метотрексат, аналоги платины, например цисплатин и карбоплатин, винбластин, платину, этопозид (VP-16), ифосфамид, митомицин С, митоксантрон, винкристин, винорелбин, навелбин, новантрон, тенипозид, дауномицин, аминоптерин, кселоду, ибандронат, СРТ11, ингибитор топоизомеразы RFS 2000, дифторметилорнитин (DMFO), ретиноевую кислоту, эсперамицины, капецитабин и фармацевтически приемлемые соли, кислоты и производные любого, из вышеуказанных. Также в это определение включаются антигормональные агенты, которые регулируют или ингибируют действие гормонов на опухоли, например антиэстрогены, включая, например, тамоксифен, ралоксифен, ингибирующие ароматазу 4(5)-имидазолы, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен (фарестон), а также антиандрогены, например флутамид, нилутамид, бикалутамид, леупролид и гозерелин и фармацевтически приемлемые соли, кислоты или производные любого из вышеуказанных соединений.
Понятие «млекопитающее» для целей лечения относится к какому-либо животному, относящемуся к млекопитающим, включая людей, мышей, SCID или голых мышей, или линии мышей, домашних и сельскохозяйственных животных и животных зоопарков, спортивных или домашних животных, например овец, собак, лошадей, кошек, коров и т.д. Предпочтительно в контексте настоящего изобретения млекопитающее является человеком.
Понятие «олигонуклеотиды» означает короткие, одно- или двухцепочечные полидезоксинуклеотиды, которые химически синтезируют известными способами (например, фосфотриэфирным, фосфитным или фосфорамидитным способами, используя синтез на твердой фазе, например, описанный в ЕР 266032, опубликованном 4 мая 1988 года, или посредством дезоксинуклеозид-Н-фосфоната, согласно описанию Froehler и др. в Nucl. Acids Res., 14, 1986, сс.5399-5407). Затем проводится их очистка на полиакриламидных гелях.
Согласно настоящему изобретению, «гуманизированные» и/или «химерные» формы иммуноглобулинов, не являющихся иммуноглобулинами человека (например, иммуноглобулины мыши), относятся к антителам, которые содержат специфические химерные иммуноглобулины, цепи иммуноглобулинов или их фрагменты (например, Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие последовательности антител), которые вызывают снижение ответов человеческого антимышиного антитела (ЧАМА), человеческого антихимерного антитела (ЧАХА) или человеческого античеловеческого антитела (ЧАЧА) по сравнению с оригинальным антителом и содержат необходимые участки (например, CDR, антигенсвязывающие области, вариабельные домены и т.д.), полученные из указанного нечеловеческого иммуноглобулина, необходимые для получения желаемого действия, и в то же время сохраняющие связывающие характеристики, которые сравнимы с указанным нечеловеческим иммуноглобулином. В основном гуманизированные антитела являются человеческими иммуноглобулинами (реципиентное антитело), в которых участки, определяющие комплементарность (CDR), реципиентного антитела замещены остатками из CDR, отличных от человеческих видов (донорное антитело), например мыши, крысы, кролика, обладающих желаемой специфичностью, аффинностью и активностью. В некоторых случаях остатки Fv каркасной области (FR) человеческого иммуноглобулина замещаются соответствующими остатками, отличными от человеческих, FR остатками. Кроме того, гуманизированные антитела могут включать остатки, которые не обнаружены ни в реципиентном антителе, ни в импортированных CDR или FR последовательностях. Данные модификации проводят для дополнительного совершенствования функциональной активности антитела. В основном гуманизированное антитело включает, главным образом, все из по меньшей мере одного и обычно двух вариабельных доменов, в которых все или в основном все из CDR участков гипервариабельных петлей соответствуют таковым нечеловеческого иммуноглобулина и все или в основном все FR остатки являются таковыми от общей типичной последовательности человеческого иммуноглобулина. Гуманизированное антитело также оптимально включает по меньшей мере участок константной области (Fc) иммуноглобулина, обычно от человеческого иммуноглобулина.
«Деиммунизированные» антитела означают иммуноглобулины, которые неиммуногенны или слабоиммуногенны для данного вида. Деиммунизацию можно достигнуть через структурные изменения антитела. Можно применять любые методы деиммунизации, известные квалифицированным в данной области специалистам. Один из приемлемых способов деиммунизирования антител описан, например, в WO 00/34317.
Антитело, которое индуцирует «апоптоз», является антителом, которое индуцирует запрограммированную смерть клетки каким-либо способом, что определяют, но этими методами не ограничиваются, по связыванию с аннексином V, по каспазной активности, по фрагментации ДНК, по клеточному сморщиванию, по расширению эндоплазматической сети, по фрагментации клеток и/или по образованию мембранных везикул (называемых апоптическими телами).
В контексте настоящего изобретения понятие «цитотоксичность, индуцируемая антителом» означает цитотоксический эффект, происходящий от супернатанта гибридомы или антитела, производимого гибридомой, депонированной в коллекции IDAC под номером 051206-01, эффект, который не обязательно зависит от уровня связывания.
В настоящем изобретении клеточные линии гибридом, а также выделенные моноклональные антитела, которые ими производятся, в другом варианте рассматриваются под их принятым обозначением, AR81A410.7, или депозитарным обозначением, IDAC 051206-01.
В контексте настоящего изобретения «антитело-лиганд» включает часть, которая проявляет специфичность связывания в отношении по меньшей мере одного эпитопа антигена-мишени, и которая может представлять молекулу интактного антитела, фрагменты антитела и какую-либо молекулу, имеющую по меньшей мере антигенсвязывающий участок или его часть (т.е. вариабельную часть молекулы антитела), например Fv-молекулу, Fab-молекулу, Fab'-молекулу, F(ab').sub.2-молекулу, биспецифическое антитело, слитый белок или какую-либо генно-инженерную молекулу, которая специфически распознает и связывается по меньшей мере с одним эпитопом антигена, связанного выделенным моноклональным антителом, вырабатываемым линией клеток гибридомы, обозначаемой IDAC 051206-01 (антиген IDAC 051206-01).
В контексте настоящего изобретения понятие «антитела, модифицирующие раковое заболевания (АМРЗ)» относится к моноклональным антителам, которые модифицируют процесс ракового заболевания, таким образом, который оказывает благоприятное воздействие на пациента, например, путем снижения опухолевой нагрузки или продлением выживаемости индивидуумов с опухолевым заболеванием, и к их антителам-лигандам.
В самом широком смысле следует понимать, что «родственный АМРЗ связывающий агент» включает, но ею не ограничивается, какую-либо форму антител человека или другого вида, фрагментов антител, лигандов антител или им подобных соединений, которые конкурентно связываются по меньшей мере с одним эпитопом-мишенью АМРЗ.
Следует понимать, что «конкурентно связывающийся агент» включает какую-либо форму антител человека или другого вида, фрагментов антител, лигандов антител или им подобных, которые с высокой аффинностью связываются по меньшей мере с одним эпитопом-мишенью АМРЗ.
Опухоли, подлежащие лечению, включают первичные опухоли и метастазирующие опухоли, а также не поддающиеся лечению опухоли. Не поддающиеся лечению опухоли включают опухоли, которые не отвечают на лечение или являются устойчивыми к лечению только химиотерапевтическими агентами, только антителами, только лучевой терапией или их комбинацией. Не поддающиеся лечению опухоли также охватывают опухоли, которые, по-видимому, ингибируются лечением такими агентами, но рецидивируют в течение пяти лет, иногда в течение десяти лет или более, после прекращения лечения.
Опухоли, которые поддаются лечению, включают неваскуляризированные, умеренно васкуляризированные, а также васкуляризированные опухоли. Примеры плотных опухолей, которые, соответственно, поддаются лечению, включают карциному молочной железы, карциному легкого, карциному ободочной и прямой кишки, карциному поджелудочной железы, глиому и лимфому. Некоторые примеры таких опухолей включают эпидермоидные опухоли, сквамозные опухоли, например опухоли головы и шеи, колоректальные опухоли, опухоли простаты, опухоли молочной железы, опухоли легкого, опухоли яичников и опухоли печени. Другие примеры включают саркому Капоши, неоплазмы ЦНС, нейробластомы, капиллярные гемангиобластомы, менингиомы и церебральные метастазы, меланому, карциномы и саркомы желудочно-кишечного тракта и почки, рабдомиосаркому, глиобластому, предпочтительно мультиформную глиобластому и лейомиосаркому.
В контексте настоящего изобретения «антигенсвязывающий участок» означает часть молекулы, которая распознает антиген-мишень.
В контексте настоящего изобретения понятие «конкурентно ингибирует» означает наличие способности распознавать и связывать определенный участок, на который ориентировано моноклональное антитело, вырабатываемое линией клеток гибридомы, обозначаемой IDAC 051206-01 (антитело IDAC 051206-01), способности, выявляемой традиционными анализами взаимной конкуренции антител (L. Belanger, С.Sylvestre и D. Dufour, Clinica Chimica Acta, 48, 1973, с.15).
В контексте настоящего изобретения «антиген-мишень» представляет антиген IDAC 051206-01 или его части.
В контексте настоящего изобретения «иммуноконъюгат» означает какую-либо молекулу или АМРЗ, например антитело, связанное химически или биологически с цитотоксинами, радиоактивными агентами, цитокинами, интерферонами, участком-мишенью или репортерным участком, ферментами, токсинами, противоопухолевыми лекарственными препаратами или терапевтическими агентами. Антитело или АМРЗ может быть связано с цитотоксинами, радиоактивными агентами, цитокинами, интерферонами, участком-мишенью или репортерным участком, ферментом, токсином, противоопухолевым лекарственным препаратом или терапевтическим агентом в любом местоположении вдоль молекулы при условии способности к связыванию своей мишени. Примеры иммуноконъюгатов включают химические конъюгаты антитела и токсина и слитые белки антитело-токсин.
Радиоактивные агенты, пригодные для использования в качестве противоопухолевых агентов, хорошо известны специалистам в данной области.
Например, можно использовать 131I или 211At. Эти изотопы присоединяют к антителу, используя традиционные технологии (например, Pedley и др., Br. J. Cancer, 68, 1993, сс.69-73). В другом варианте противоопухолевый агент, который присоединяют к антителу, представляет фермент, который активирует пролекарство. Вводят пролекарство, которое сохраняется в своей неактивной форме, пока не достигнет участка опухоли, где оно преобразуется в свою цитотоксическую форму при введении комплекса антитела. На практике пациенту вводят конъюгат антитело-фермент и дают ему возможность локализоваться в области ткани, которая подлежит лечению. Затем пациенту вводят пролекарство с тем, чтобы его конверсия в цитотоксическую форму происходила в области ткани, которая подлежит лечению. В другом варианте, противоопухолевый агент, сопряженный с антителом, представляет цитокин, например интерлейкин-2 (ИЛ-2), интерлейкин-4 (ИЛ-4) или фактор некроза опухоли альфа (ФНО-α). Антитело нацеливает цитокин на опухоль, для того чтобы цитокин повредил или уничтожил опухоль, не затрагивая при этом другие ткани. Цитокин сливают с антителом на уровне ДНК, используя традиционные генно-инженерные технологии. Также можно использовать интерфероны.
В контексте настоящего изобретения понятие «гибридный белок» означает какой-либо гибридный белок, в котором антигенсвязывающий участок присоединен к биологически активной молекуле, например токсину, ферменту, флуоресцентным белкам, люминесцентному маркеру, полипептидной метке, цитокину, интерферону, участку-мишени или репортерному участку или белковому лекарственному препарату.
Кроме того, настоящее изобретение рассматривает АМРЗ по настоящему изобретению, с которым связаны части-мишени или репортерные части. Части-мишени представляют первых представителей связывающихся пар. Противоопухолевые агенты, например, конъюгируют со вторыми представителями таких пар и в связи с этим направляются на участок, с которым связан антигенсвязывающий белок. Общим примером такой связывающей пары являются авидин и биотин. В предпочтительном варианте осуществления настоящего изобретения, биотин конъюгирует с антигеном-мишенью АМРЗ по настоящему изобретению и в связи с этим представляет мишень для противоопухолевого агента, или другой частью, которая конъюгирована с авидином или стрептавидином. В другом варианте биотин или другая такая часть молекулы связан с антигеном-мишенью АМРЗ по настоящему изобретению и используется в качестве репортера, например, в диагностической системе, где обнаруживаемый агент, продуцирующий сигнал, конъюгирован с авидином или стрептавидином.
Обнаруживаемые агенты, вырабатывающие сигнал, пригодны in vivo и in vitro для диагностических целей. Агент, вырабатывающий сигнал, производит измеримый сигнал, который обнаруживается наружными средствами, обычно измерением электромагнитного излучения. В основном агент, вырабатывающий сигнал, представляет фермент или хромофор, или излучает свет путем флуоресценции, фосфоресценции или хемилюминесценции. К хромофорам относятся красители, которые поглощают свет в ультрафиолетовой или видимой области и могут представлять субстраты или продукты деградации катализируемых ферментами реакций.
Кроме того, в рамках настоящего изобретения находится применение данного АМРЗ in vivo и in vitro в исследовательских или диагностических способах, которые хорошо известны в данной области. С целью осуществления диагностических методов, рассматриваемых в настоящем описании, настоящее изобретение дополнительно предусматривает включение наборов, которые содержат АМРЗ по настоящему изобретению. Такие наборы могут быть полезны для идентификации индивидуумов с риском развития определенного типа рака, путем выявления сверхэкспрессии мишени-антигена АМРЗ на клетках таких индивидуумов.
Диагностический набор реактивов
Предполагается использование АМРЗ по настоящему изобретению в форме диагностического набора реактивов с целью определения наличия опухоли. Обычно опухоль определяют у пациента на основании присутствия одного или нескольких опухолеспецифических антигенов, например белков и/или полинуклеотидов, которые кодируют такие белки, в биологическом образце, например крови, сыворотке, моче и/или биоптатах опухоли, образцы которых получают от пациента.
Белки функционируют в качестве маркеров, которые указывают на наличие или отсутствие конкретной опухоли, например опухоли ободочной кишки, молочной железы, легкого или предстательной железы. Также предполагается, что антиген полезен для определения других злокачественных опухолей. Включение в диагностические наборы реактивов связывающих агентов, включающих АМРЗ по настоящему изобретению, или родственных АМРЗ связывающих агентов, позволяет определять уровень антигена, который связывается с агентом в биологическом образце. Для определения уровня иРНК, кодирующей белок опухоли, который также указывает на наличие или отсутствие рака, можно использовать полинуклеотидные праймеры и зонды. Чтобы анализ связывания являлся диагностическим, накапливают данные, которые коррелируют со статистически значимыми уровнями антигена относительно присутствующего в нормальной ткани, с тем чтобы подтвердить, что связывание является диагностическим для наличия раковой опухоли. Предполагается, что для диагностического анализа по настоящему изобретению пригодно множество форматов, которые известны специалистам с обычной квалификацией в данной области, для использования связывающего агента с целью определения полипептидных маркеров в образце. Например, тех, которые указаны Harlow и Lane в кн. «Antibodies: A Laboratory Manual», Cold Spring Harbor Laboratory, 1988, гл. 9-14. Кроме того, рассматриваются какие-либо и все комбинации, перемещения или модификации вышеуказанных форматов диагностического анализа.
Наличие или отсутствие рака у пациента обычно устанавливают путем (а) контакта биологического образца, полученного от пациента, со связывающим агентом, (б) определения в образце уровня полипептида, который связывается со связывающим агентом и (г) сравнения уровня полипептида с предварительно установленным пороговым значением.
В иллюстративных вариантах осуществления настоящего изобретения предусматривается анализ, включающий использование связывающего агента на основе АМРЗ, иммобилизованного на твердом носителе, с целью связывания и удаления полипептида с остатка образца. Связанный полипептид затем можно выявить, используя детекционный реагент, который содержит репортерную группу и специфически связывается с комплексом связывающий агент/полипептид. Иллюстративные детекционные реагенты могут включать связывающий агент на основе АМРЗ, который специфически связывается с полипептидом или антителом или другим агентом, который специфически связывается со связывающим агентом, например антииммуноглобулином, белком G, белком А или лектином. В другом варианте осуществления изобретения предусматривается использование конкурентного анализа, в котором полипептид помечен репортерной группой и может связываться с иммобилизованным связывающим агентом после инкубации связывающего агента с образцом. Признаком реактивности образца с иммобилизованным связывающим агентом служит объем, в котором компоненты образца ингибируют связывание меченого полипептида со связывающим агентом. Пептиды, пригодные для использования в таких анализах, включают опухолеспецифические белки полной длины и/или их части, с которыми связывающий агент обладает связывающим сродством.
Диагностический набор может предусматривать твердый носитель, который может быть в форме какого-либо материала, к которому можно прикрепить белок, известного специалисту в данной области. Примеры пригодных носителей могут включать лунку в планшете для микротитрований или нитроцеллюлозную или другую пригодную мембрану. В другом варианте носителем могут быть бусины или диски, например, стеклянные, из стекловолокна, латекса или пластического материала, например полистерола или поливинилхлорида. Носителем может также быть магнитная частица или волоконно-оптический датчик, например, описанные в патенте US 5359681.
Предполагается, что связывающий агент можно иммобилизовать на твердом носителе, используя различные методы, известные квалифицированным в данной области специалистам, которые достаточно полно описаны в патентной и научной литературе. Понятие «иммобилизация» относится к нековалентной ассоциации, например адсорбции, а также к ковалентному закреплению, которое в контексте настоящего изобретения может представлять прямое соединение между агентом и функциональными группами на носителе или может представлять связь посредством сшивающего агента. В предпочтительном, хотя и не ограничивающем, варианте осуществления настоящего изобретения предпочтительна иммобилизация путем адсорбции на лунке в микротитровальном планшете или на мембране. Адсорбцию можно осуществить путем контакта связывающего агента в соответствующем буфере с твердым носителем в течение приемлемого времени. Время контакта может различаться в зависимости от температуры и обычно находится в пределах примерно от 1 ч и примерно до 1 суток.
Ковалентное закрепление связывающего агента на твердом носителе обычно достигается посредством в первую очередь реакции носителя с бифункциональным реагентом, который может взаимодействовать и с носителем, и с функциональной группой, например гидроксилом или аминогруппой, на связывающем агенте. Например, связывающий агент может ковалентно закрепляться на носителях, имеющих соответствующее полимерное покрытие, используя бензохинон, или путем конденсации альдегидной группы на носителе с амином или активным водородом на связывающем партнере.
Кроме того, предполагается, что диагностический набор реактивов может принимать форму сэндвич-анализа с использованием пары антител. Этот анализ можно осуществить, прежде всего, путем контакта антитела, например, описанного в настоящем изобретении АМРЗ, которое иммобилизовано на твердом носителе, обычно на лунке микротитровального планшета, с образцом, чтобы полипептиды в образце могли связаться с иммобилизованным антителом. Затем несвязанный образец отделяют от иммобилизованных комплексов полипептид - антитело и добавляют детекторный реагент (предпочтительно второе антитело, способное к связыванию с другим участком на полипептиде), содержащий репортерную группу. Затем определяют количество детекторного реагента, которое остается связанным с твердым носителем, используя метод, подходящий для специфической репортерной группы.
В конкретном варианте осуществления изобретения предполагается, что после иммобилизации антитела на подложке, согласно описанному выше, оставшиеся связывающие белок участки на носителе блокируют, посредством использования какого-либо пригодного известного специалистам в данной области блокирующего агента, например бычьего сывороточного альбумина или Tween 20™ (фирма Sigma Chemical Co., Сант-Луис, Миссури). Иммобилизованное антитело затем инкубируют с образцом, давая возможность полипептиду связаться с антителом. Перед инкубацией образец можно развести пригодным растворителем, например фосфатно-солевым буфером (ФСБ). В целом, соответствующее время контакта (т.е. время инкубации) подбирают на основе периода времени, достаточного для выявления присутствия полипептида в образце, полученном от индивидуума со специфически выбранной опухолью. Предпочтительно время контакта должно быть достаточным для достижения уровня связывания, которое составляет по меньшей мере 95 процентов от связывания, достигаемого при равновесии между связанным и несвязанным полипептидом. Специалист в данной области представляет, что время, необходимое для достижения равновесия, можно легко определить на основании оценки уровня связывания, которое происходит за период времени.
Кроме того, предусматривается, что несвязанный образец можно затем удалить путем промывания твердого носителя соответствующим буфером. Затем к твердому носителю добавляют второе антитело, которое содержит репортерную группу. Затем проводят инкубацию детекторного реагента с иммобилизованным комплексом антитело - полипептид в течение времени, достаточного для выявления связанного пептида. Впоследствии несвязанный детекторный реагент удаляют, а связанный детекторный реагент выявляют, используя репортерную группу. Пригодный для детекции репортерной группы метод обязательно специфичен для типа выбранной репортерной группы (обычно радиоактивной, или флуоресцентной группы, или фермента). Ферментные репортерные группы можно обычно выявить путем добавления субстрата (обычно в течение специфического периода времени) с последующим спектроскопическим или иным анализом продуктов реакции.
Чтобы использовать диагностический набор реактивов по настоящему изобретению, для определения наличия или отсутствия рака, например рака простаты, выявленный сигнал от репортерной группы, которая остается связанной с твердым носителем, обычно сравнивают с сигналом, который соответствует ранее установленному пороговому значению. Например, иллюстративным пороговым значением для выявления рака может быть среднее значение сигнала, получаемого при инкубации иммобилизованного антитела с образцами, полученными от пациентов без рака. В общем, образец, гененерирующий сигнал, который примерно на три стандартных отклонения выше предварительно установленного порогового значения, считается положительным на рак. В другом варианте осуществления изобретения пороговое значение можно установить, используя рабочую характеристическую кривую (Receiver Operator Curve), в соответствии с методом Sackett и др. В кн.: «Clinical Epidemiology. A Basic Science for Clinical Medicine», изд-во Little Brown and Co., 1985, cc.106-107. В таком варианте осуществления изобретения пороговое значение можно установить на основании графика пар действительно положительных оценок (т.е. чувствительность) и ошибочных положительных оценок (т.е. 100% специфичность), которые соответствуют каждому возможному пороговому значению для результата диагностического исследования. Пороговое значение на графике, которое является ближайшим к верхнему левому углу (т.е. значению, которое огораживает самую большую область) является самым точным пороговым значением, и образец, генерирующий сигнал, который превышает пороговое значение, установленное этим способом, может считаться положительным. В другом варианте, пороговое значение может быть смещено влево по графику, чтобы минимизировать ошибочную положительную оценку. В общем, образец, генерирующий сигнал, который превышает пороговое значение, установленное этим способом, считается положительным на рак.
Предполагается, что диагностический анализ на основе набора можно проводить либо в проточном режиме, либо в режиме полос, в которых связывающий агент иммобилизован на мембране, например нитроцеллюлозе. В проточном тестировании полипептиды в образце присоединяются к иммобилизованному связывающему агенту, когда образец проходит через мембрану. Затем, когда раствор, содержащий второй связывающий агент, проходит через мембрану, к комплексу связывающий агент - полипептид присоединяется второй меченый связывающий агент. Затем, согласно описанию, представленному выше, можно провести выявление связанного второго связывающего агента. В режиме полос при исследовании один конец мембраны, с которой связан связывающий агент, погружают в раствор, содержащий образец. Образец перемещается по мембране через область, содержащую второй связывающий агент, к области иммобилизованного связывающего агента. Концентрация второго связывающего агента в области иммобилизованного антитела указывает на наличие рака. Порождение рисунка, например, линии, на связывающем участке, которую можно определить визуально, указывает на то, что тест является положительным. Отсутствие такого рисунка указывает на отрицательный результат. В общем, количество связывающего агента, иммобилизованного на мембране, подбирают, чтобы получить визуально видимую картину, когда биологический образец содержит уровень полипептида, который является достаточным для порождения положительного сигнала в сэндвич-анализе с двумя антителами, в рассмотренном выше формате. Предпочтительными связывающими агентами для использования в настоящем диагностическом анализе являются описанные в настоящем изобретении антитела, их антигенсвязывающие фрагменты и какие-либо родственные АМРЗ-связывающие агенты, описанные в настоящем изобретении. Количество антитела, иммобилизованного на мембране, представляет какое-либо количество, эффективное для осуществления диагностического анализа, и может находиться в диапазоне примерно от 25 нг до примерно 1 мкг. Обычно такие тесты можно проводить с очень маленьким количеством биологического образца.
Дополнительно АМРЗ по настоящему изобретению, благодаря их способности идентифицировать свой антиген-мишень, можно использовать в исследовательской лаборатории.
Чтобы описываемое здесь изобретение стало более понятным, приводятся следующие описания.
Настоящее изобретение предусматривает антитело АМРЗ (т.е. IDAC 051206-01 АМРЗ), которое специфически распознает и связывает антиген IDAC 051206-01.
АМРЗ выделенного моноклонального антитела, вырабатываемого гибридомой, депонированной в коллекции IDAC под номером 051206-01, может быть представлено в какой-либо форме, пока она имеет антигенсвязывающий участок, который конкурентно ингибирует иммуноспецифическое связывание выделенного моноклонального антитела, вырабатываемого гибридомой IDAC 051206-01, с его антигеном-мишенью. Таким образом, в рамки настоящего изобретения входят какие-либо рекомбинантные белки (например, слитые белки, в которых антитело соединено со вторым белком, например, лимфокином или фактором роста, ингибирующим опухоль), имеющие такую же специфичность связывания, как антитело IDAC 051206-01.
В одном из вариантов осуществления изобретения АМРЗ представляет антитело IDAC 051206-01.
В других вариантах осуществления настоящего изобретения АМРЗ представляет антигенсвязывающий фрагмент, который может быть Fv-молекулой (например, одноцепочечной Fv-молекулой), Fab-молекулой, Fab'-молекулой, F(ab')2-молекулой, слитым белком, биспецифическим антителом, гетероантителом или какой-либо рекомбинантной молекулой, имеющей антигенсвязывающий участок антитела IDAC 051206-01. АМРЗ по настоящему изобретению ориентировано на эпитоп, на который ориентировано моноклональное антитело IDAC 051206-01.
АМРЗ по настоящему изобретению можно модифицировать, т.е. посредством модификаций аминокислот в молекуле, для получения молекул-производных. Возможна также химическая модификация. Возможны также модификации путем прямой мутации, методами аффинного созревания, фагового дисплея и перетасовки цепей.
Аффинность и специфичность можно изменить или улучшить путем мутирования CDR и/или фенилаланин-триптофановых (FW) остатков и скрининга антигенсвязывающих участков с желаемыми характеристиками (например, Yang и др., J. Mol. Biol., 254, 1995, сс. 392-403). Один способ заключается в рандомизации отдельных остатков или комбинациях остатков так, чтобы в популяции в других отношениях идентичных антигенсвязывающих участков подмножества от двух до двадцати аминокислот находились в определенных положениях. В другом варианте осуществления настоящего изобретения мутации можно индуцировать на протяжении диапазона остатков посредством методов допускающей ошибки ПЦР (например, Hawkins и др., J. Mol. Biol., 226, 1992, сс. 889-896). В другом примере фаг-дисплейные векторы, содержащие гены вариабельных регионов тяжелой и легкой цепей можно размножить в штаммах-мутаторах Е.coli (например. Low и др., J. Mol. Biol., 250, 1996, сс.359-368). Эти методы мутагенеза могут служить в качестве примера среди многих методов, известных квалифицированным в данной области специалистам.
Другой способ повышения аффинности антител по настоящему изобретению состоит в проведении перетасовки цепей, где тяжелую или легкую цепи случайно спаривают с другими тяжелыми или легкими цепями, чтобы получить антитело с более высокой аффинностью. Различные CDR антител также можно тасовать с соответствующими CDR других антител.
Производные молекулы должны сохранять функциональные свойства полипептида, а именно молекула, имеющая такие замены, по-прежнему будет позволять связывание полипептида с антигеном IDAC 051206-03 или его частями.
Эти аминокислотные замены включают, но необязательно ими ограничиваются, аминокислотные замены, известные в данной области в качестве «консервативных».
Например, твердо установившийся принцип химии белков заключается в том, что определенные аминокислотные замены, называемые «консервативными аминокислотными заменами», часто можно осуществлять в белке, не изменяя ни конформации, ни функции белка.
Такие замены включают замещение какой-либо аминокислоты из аминокислот изолейцина (I), валина (V) и лейцина (L) на какую-либо другую из этих гидрофобных аминокислот; аспарагиновую кислоту на (D) на глутаминовую кислоту (Е) и наоборот, глутамин (Q) на аспарагин (N) и наоборот и серии (S) на треонин (Т) и наоборот. Другие замены также могут считаться консервативными в зависимости от окружения конкретной аминокислоты и ее роли в трехмерной структуре белка. Например, глицин (G) и аланин (А) часто взаимозаменяемы, подобно аланину и валину (V). Метионин (М), который относительно гидрофобен, часто может взаимозаменяться с лейцином и изолейцином и иногда валином. Лизин (К) и аргинин (R) часто взаимозаменяемы в тех положениях, в которых существенная особенность аминокислотных остатков заключается в их заряде, а отличия в рК этих двух аминокислотных остатков являются незначительными. Кроме того, «консервативными» могут считаться и другие изменения в конкретном окружении.
Пример 1
Получение гибридомы - линия клеток гибридомы AR81A410.7
Линия клеток гибридомы AR81A410.7 депонирована в соответствии с Будапештским договором о международном признании депонирования микроорганизмов для целей патентной процедуры в Международном ведомстве по депонированию Канады (IDAC - International Depository Authority of Canada), Бюро микробиологии. Канадское агентство здравоохранения, 1015 Arlington Street, Winnipeg, Манитоба, Канада, R3E 3R2, 5 декабря, 2006 г., под номером 051206-03. В соответствии со статьей 37 свода федеральных постановлений США (CFR 1.808) депозиторы гарантируют, что все ограничения, налагаемые на доступность общественности депонированных материалов, будут безвозвратно устранены при предоставлении патента. Депозит будет возвращен, если депозитарий не сможет выдавать жизнеспособные образцы.
Для получения гибридомы, которая вырабатывает противораковое антитело AR81A410.7, готовят суспензию однородных клеток замороженной опухолевой ткани аденокарциномы легкого (фирма Genomics Collaborative, Кембридж, Массачусетс) в ФСБ. С помощью осторожного перемешивания подготавливают для применения адъювант IMMUNEASY™ (фирма Qiagen, Венло, Нидерланды). Мышей линии BALB/c в возрасте 5-7 недель иммунизируют путем подкожной инъекции 2 миллионов клеток в 50 микролитрах антигена-адьюванта. Через 2 и 5 недель после первоначальной иммунизации свежеприготовленный антиген-адьювант вводят внутрибрюшинно в качестве бустерной иммунизации иммунизированных мышей, 2 миллиона клеток в 50 микролитрах. Через трое суток после последней иммунизации селезенку используют для слияния. Гибридомы готовят путем слияния изолированных спленоцитов с NSO-1 миеломными партнерами. Проводят исследование супернатантов от слияний из субклонов гибридом.
Чтобы определить, являются ли антитела, секретируемые гибридомными клетками, изотипом IgG или изотипом IgM, используют твердофазный ИФА. К планшетам ИФА добавляют 100 микролитров/лунку козьего антимышиного IgG+IgM (H+L) в концентрации 2,4 мкг/мл в покрывающем буфере (0,1 М карбонатно-бикарбонатный буфер, рН 9,2-9,6) и выдерживают при 4°С в течение ночи. Планшеты трижды промывают промывочным буфером (ФСБ+0,05% Твина). К планшету добавляют 100 мкл/лунку блокирующего буфера (5% молоко в промывочном буфере) и выдерживают в течение 1 ч при комнатной температуре и затем трижды промывают промывочным буфером. Добавляют 100 мкл/лунку супернатанта гибридомы и планшет инкубируют в течение 1 ч при комнатной температуре. Затем планшеты трижды промывают промывочным буфером и добавляют 1/100000 раствора либо козьего антимышиного IgG, либо конъюгата IgM с пероксидазой хрена (разведенного в ФСБ, содержащем 1% молока), 100 мкл/лунку. После инкубации планшета в течение 1 ч при комнатной температуре планшет трижды промывают промывочным буфером. Добавляют по 100 мкл/лунку раствора ТМВ и инкубируют в течение 1-3 мин при комнатной температуре. Цветную реакцию останавливают путем добавления 50 мкл/лунку 2М H2SO4 и планшет считывают при 450 нм с помощью планшетного ридера Perkin-Elmer HTS7000. Фиг.1 показывает, что гибридома AR81A410.7 секретировала первичные антитела изотипа IgG.
Чтобы определить подкласс антитела, секретируемого клетками гибридомы, проводят изотипирование, используя набор для изотипирования мышиных моноклональных антител Mouse Monoclonal Antibody Isotyping Kit (фирма HyCult Biotechnology, Frontstraat, Нидерланды). 500 микролитров буферного раствора добавляют к тест-полоске, содержащей подкласс крысиных антимышиных специфических антител. К пробирке добавляют 500 микролитров супернатанта гибридомы и погружают при осторожном встряхивании. Захваченные мышиные иммуноглобулины выявляют непосредственно с помощью второго крысиного моноклонального антитела, которое связывается с коллоидными частицами. Комбинация этих двух белков создает визуальный сигнал, используемый для анализа изотипа. Противораковое антитело AR81A410.7 является IgG2a, изотипом каппа.
После одного цикла серийных разведений, супернатанты гибридомы исследуют в клеточном ИФА на антитела, которые связываются с клетками-мишенями. Исследуют три линии клеток рака легкого человека, 1 линию клеток рака молочной железы человека и 1 линию нераковых клеток легкого человека: А549, NCI-H23, NCI-H460, MDA-MB-231 и Hs888.Lu, соответственно. Все линии клеток получены из Американской коллекции типовых культур (АТСС, Манассас, Вирджиния). Клетки в планшетах перед использованием фиксируют. Планшеты трижды промывают ФСБ, содержащим MgCl2 и CaCl2, при комнатной температуре. К каждой лунке добавляют по 100 микролитров 2% параформальдегида, разведенного в ФСБ, выдерживают 10 мин при комнатной температуре и затем сливают. Планшеты снова три раза промывают ФСБ, содержащим MgCl2 и CaCl2, при комнатной температуре. Блокируют, путем добавления 100 мкл/лунку 5% молока в промывочном буфере (ФСБ+0,05% твина), в течение 1 ч при комнатной температуре. Планшеты трижды промывают промывочным буфером и добавляют супернатант гибридомы, 100 мкл/лунку, 1 ч при комнатной температуре. Планшеты 3 раза промывают промывочным буфером и добавляют по 100 мкл/лунку раствора 1/25000 козьего антимышиного IgG антитела, конъюгированного с пероксидазой хрена (разведенной в ФСБ, содержащем 1% молока). После инкубации планшета в течение 1 ч при комнатной температуре планшеты три раза промывают промывочным буфером и добавляют по 100 мкл/лунку раствора субстрата ТМВ и инкубируют в течение 1-3 мин при комнатной температуре. Реакцию останавливают путем добавления 50 мкл/лунку 2М H2SO4 и планшет считывают при 450 нм с помощью Perkin-Elmer HTS7000 планшетного ридера. Результаты, сведенные в таблицу на фиг.1, показывают кратное число превышения над фоном по сравнению с собственным изотипом IgG в качестве контроля, который по предварительным данным не связывается с исследуемыми линиями клеток. Антитела от гибридомы AR81A410.7 показывают сильное связывание с линией клеток рака груди MDA-МВ-231 и слабое связывание с линиями клеток рака легких NCI-H23 и NCI-H460 и нормальной линией клеток легких Hs888.Lu.
Вместе с исследованием связывания антител исследуют цитотоксический эффект супернатантов гибридомы (антитело-индуцируемую цитотоксичность) на клеточных линиях: А549, NCI-H23, NCI-H460, MDA-MB-231 и Hs888.Lu. Кальцеин AM получают от фирмы Molecular Probes (Юджин, штат Орегон) и анализ проводят в соответствии с описанием, представленным ниже. Перед анализом клетки высевают в планшеты при заранее определенной соответствующей плотности. Спустя 2 суток по 100 мкл супернатанта из микротитровальных планшет с культурами гибридомы переносят в планшеты с культурами клеток и инкубируют в течение 5 суток в атмосфере 5% СО2. Из лунок, которые служат в качестве положительных контролей, полностью удаляют жидкость и добавляют в них по 100 мкл азида натрия (NaN3 0,01%, фирма Sigma, Оквилл, Онтарио) или циклогексимида (СНХ, 0,5 микромолярный, фирма Sigma, Оквилл, Онтарио), растворенных в культуральной среде. Спустя 5 суток после обработки планшеты опорожняют, опрокидывая и подсушивая, промокая фильтровальной бумагой. В каждую лунку вносят при комнатной температуре ДФСБ (фосфатно-солевой буфер в модификации Дульбекко), содержащий MgCl2 и CaCl2, распределяя его из многоканальной гибкой бутылки, 3 раза промывают водопроводной водой, опорожняют переворачиванием и затем подсушивают, промокая фильтровальной бумагой. К каждой лунке добавляют по 50 микролитров флуоресцентного красителя кальцеина, разведенного в ДФСБ, содержащем MgCl2 и CaCl2 и инкубируют в течение 30 мин в термостате при 37°С в атмосфере 5% СО2. Планшеты считывают с помощью флуоресцентного планшетного ридера Perkin-Elmer HTS7000 и данные анализируют в Microsoft Excel. Результаты сведены в таблицу на фиг.1. Супернатант гибридомы AR81A410.7 вызывает специфическую цитотоксичность, 43%, на клетках рака легкого NCI-H23. С положительными контролями азидином натрия и циклогексимидом цитотоксичность составляет 86% и 391% соответственно. AR81A410.7 также приводит к специфической цитотоксичности 12% клеток рака легкого NCI-H460, которая составляет 17% и 52% цитотоксичности, полученной для положительных контролей азида натрия и циклогексимида соответственно.
Результаты, представленные на фиг.1, показывают, что цитотоксические эффекты AR81A410.7 не имеют прямой корреляции с уровнями связывания на типах раковых клеток. Хотя отмечались близкие уровни связывания с клетками рака груди MDA-MB-231, цитотоксичность выявлялась только в случае клеток рака легкого NCI-H23 и NCI-H460. Результаты, представленные на фиг.1 показывают, что AR81A410.7 не вызывает цитотоксического действия в отношении линии нормальных клеток легкого человека Hs888.Lu. Согласно ожиданиям, известные неспецифические цитотоксические агенты циклогексимид и NaN3 производят обычное цитотоксическое действие.
Пример 2
Связывание in vitro
Моноклональное антитело AR81A410.7 получают путем культивирования гибридомы в колбах CL-1000 (фирма BD Biosciences, Оквилл, Онтарио), сбора и повторного пересева дважды/неделю. Затем проводят стандартные процедуры очистки антитела с использованием Protein G Sepharose 4 Fast Flow (фирма Amersham Biosciences, Бэ-д'Юрфе, Квебек, Канада). В рамках настоящего изобретения предусматривается применение деиммунизированных, гуманизированных, химерных или мышиных моноклональных антител.
Связывание AR81A410.7 с линиями клеток рака легкого (А549, NCI-H23, NCI-H322M, NCI-H460 и NCI-H520), ободочной кишки (Lovo), молочной железы (MDA-MB-231), поджелудочной железы (ВхРС-3), простаты (РС-3) и яичников (OVCAR-3), а также с линиями нераковых клеток кожи (CCD-27sk) и легкого (Hs888.Lu), анализируют путем проточной цитометрии (FACS). Все клеточные линии, за исключением линии клеток рака легкого NCI-H322M, получены из Американской коллекции типовых культур (АТСС, Манассас, Вирджиния). Линия NCI-H322M получена из NCI-Frederick Cancer DCTD Tumor/Cell Line Repository (Фредерик, Мэриленд).
Чтобы подготовить клетки для FACS анализа, сначала монослой клеток промывают буфером ДФСБ (без Ca++ и Mg++). Затем клетки смывают с планшета для клеточных культур, используя буфер для диссоциации клеток (фирма Invitrogen, Берлингтон, Онтарио, Канада), при температуре 37°С. Клетки собирают путем центрифугирования, затем ресуспендируют в буфере ДФСБ, содержащем MgCl2, CaCl2 и 2% фетальной сыворотки теленка (красящая среда) при температуре 4°С и определяют их количество, разводят до соответствующей плотности клеток, осаждают и ресуспендируют в красящей среде при 4°С в присутствии исследуемого антитела (AR81A410.7) или контрольных антител (изотипного контроля, анти-EGFR). Изотипный контроль и исследуемое антитело анализируют при концентрации 20 мкг/мл, а анти-EGFR при концентрации 5 мкг/мл на льду в течение 30 мин. Перед добавлением вторичного антитела, конъюгированного с красителем Alexa Fluor 546, клетки один раз промывают красящей средой. Затем добавляют вторичное антитело, конъюгированное с красителем Alexa Fluor 546, в течение 30 мин при температуре 4°С. Затем клетки еще раз промывают и ресуспендируют в фиксирующей среде (красящая среда, содержащая 1,5% параформальдегида). Проточный цитометрический анализ клеток проводят путем проточных образцов на FACSarray™, используя FACSarray™ System Software (фирма BD Biosciences, Оквилл, Онтарио, Канада). Прямое (FSC) и боковое светорассеивание (SSC) клеток устанавливают путем настройки усилений по напряжению и амплитуде на детекторах FSC и SSC. Детекторы для канала флуоресценции (Alexa-546) доводят по потоку неокрашенных клеток, чтобы клетки имели равномерный пик со средней интенсивностью флуоресценции, приблизительно 1-5 единиц. Для анализа каждого образца получают приблизительно 10000 стробируемых событий (окрашенных фиксированных клеток) и результаты представляют на фиг.2.
Фиг.2 представляет кратное увеличение средней интенсивности флуоресценции по сравнению с изотипным контролем. Характерные гистограммы антител AR81A410.7 собраны на фиг.3. AR81A410.7 показывает обнаружимое связывание с линиями клеток рака легкого NCI-H23 (в 3,5 раза), молочной железы MDA-MB-231 (в 1,6 раза), поджелудочной железы ВхРС-3 (в 2,6 раза), яичников OVCAR-3 (в 2,5 раза), простаты РС-3 (в 2,5 раза), линиями нераковых клеток кожи CCD-27sk (в 1,9 раза) и линиями нераковых клеток легкого Hs888.Lu. Эти данные также демонстрируют, что антитело AR81A410.7 связывается с несколькими различными линиями клеток рака с разными уровнями экспрессии антигенов.
Пример 3
Эксперименты in vivo с опухолевыми клетками ВхРС-3
Примеры 1 и 2 показывают, что антитело AR81A410.7 обладает противораковыми свойствами в отношении линий клеток рака человека и показывает обнаруживаемое перекрестное связывание с несколькими различными видами рака. В отношении фиг.4 и 5 самкам мышей SCID в возрасте 8-9 недель подкожно имплантируют в заднюю часть шеи 5 миллионов клеток опухоли поджелудочной железы человека (ВхРС-3) в 100 мкл раствора ФСБ. Мышей рандомизируют на 2 группы, по 6 мышей в каждой группе лечения. В первый день после имплантации в каждой группе мышам внутрибрюшинно вводят по 20 мг/кг исследуемого антитела AR81A410.7 или контрольного буферного раствора в объеме 300 микролитров после разведения исходной концентрации растворителем, содержащим 2,7 мМ KCl, 1 мМ КН2РО4, 137 мМ NaCl и 20 мМ Na2HPO4. Затем образцы антитела и контроля вводят тем же способом один раз в неделю на протяжении исследования. Рост опухоли измеряют примерно каждые семь суток с помощью кронциркуля. Исследование завершают после 8 доз антитела. Массу тела животных регистрируют один раз в неделю на протяжении исследования. В конце исследования всех животных умерщвляют в соответствии с рекомендациями ССАС.
В профилактической модели рака поджелудочной железы человека ВхРС-3 in vivo введение антитела AR81A410.7 снижает рост опухоли. Лечение с ARIUS антителом AR81A410.7 редуцирует рост опухоли ВхРС-3 на 71,5% по сравнению с группой, получавшей буферный раствор, при определении на 56 сутки, шестые сутки после введения последней дозы антитела (фиг.4). Результаты нельзя считать достоверными (р=0,14, критерий Стьюдента) из-за малого числа мышей в каждой группе, но размер опухоли в группе лечения антителом меньше по сравнению с контрольной группой, в которой применяли растворитель. На 41 сутки, когда еще все мыши были живы, рост опухоли подавлялся на 75% (р=0,104, критерий Стьюдента).
На протяжении исследования не выявляют никаких клинических признаков токсичности. Масса тела, измеряемая с недельным интервалом, косвенно характеризует способность и неспособность прибавления в весе. Не было существенного различия в массе тела в обеих группах с начала до конца исследования (контроль, р=1,000, критерий Стьюдента; AR81A410.7 р=0,2094, критерий Стьюдента). Однако наблюдают существенное различие между группами к концу исследования (р=0,0396, критерий Стьюдента) на 62 сутки (фиг.5).
Вкратце, AR81A410.7 хорошо переносится и снижает опухолевую нагрузку в указанной модели с ксенотрансплантатом опухоли поджелудочной железы человека.
Пример 4
Выделение конкурентных связующих
Получая антитело, специалист в данной области может создать конкурентно ингибирующее АМРЗ, например конкурирующее антитело, которое распознает тот же эпитоп (Belanger L и др., Clinica Chimica Acta, 48, 1973, сс. 15-18). Один способ основан на иммунизации иммуногеном, который экспрессирует антиген, распознаваемый антителом. Примеры могут включать, но ими не ограничиваются, ткани, выделенные белки или клеточные линии. Получающуюся гибридому можно отобрать, используя конкурентный анализ, на основании которого можно идентифицировать антитела, ингибирующие связывание исследуемого антитела, например, твердофазный анализ ИФА, FACS-анализ и вестерн-блоттинг. Другой способ может основываться на использовании фаговых дисплейных библиотек антител и пэннинге антител, которые распознают по меньшей мере один эпитоп указанного антигена (J.L. Rubinstein и др., Anal Biochem, 2003, 314, сс.294-300). В любом случае антитела отбирают на основании их способности замещать связывание первоначального меченного антитела по меньшей мере с одним эпитопом его антигена-мишени. Следовательно, такие антитела должны обладать свойством распознавания по меньшей мере одного эпитопа антигена, что и первоначальное антитело.
Пример 5
Клонирование вариабельных областей моноклонального антитела AR81A410.7
Можно установить последовательности вариабельных областей тяжелой (VH) и легкой (VL) цепей моноклонального антитела, вырабатываемого линией клеток гибридомы AR81A410.7. Из данной гибридомы можно экстрагировать РНК, кодирующую тяжелую и легкую цепи иммуноглобулина, используя стандартные методы, включающие клеточную солюбилизацию гуанидин изотиоцианатом (Chirgwin и др., Biochem., 18, 1979, сс.5294-5299). Молекулы иРНК можно использовать для получения кДНК, для последующего выделения генов VH и VL посредством известного в данной области метода ПЦР («Molecular Cloning», под ред. Sambrook и др., Cold Spring Harbor laboratories Press, Нью-Йорк, 1989, гл.14). Последовательность N-концевых аминокислот тяжелой и легкой цепей можно независимо установить автоматизированным секвенированием по Эдману. Другие участки CDR и фланкирующих FR также можно определить путем аминокислотного секвенирования фрагментов VH и VL. Затем можно разработать синтетические праймеры для изоляции генов VH и VL из моноклонального антитела AR81A410.7 и изолированный ген можно лигировать в соответствующий вектор для секвенирования. Для получения химерного и гуманизированного IgG вариабельные домены легкой и тяжелой цепей можно субклонировать в соответствующий вектор для экспрессии.
В другом варианте осуществления изобретения AR81A410.7 или его деиммунизированный, химерный или гуманизированный вариант получают посредством экспрессии нуклеиновой аминокислоты, кодирующей антитело, в трансгенном животном так, чтобы антитело можно было экспрессировать и выделить. Например, антитело можно экспрессировать тканеспецифично, что облегчает выделение и очистку. В одном из таких вариантов осуществления настоящего изобретения, антитело по изобретению экспрессируют в молочной железе для секреции во время лактации. Трансгенные животные включают, но ими не ограничиваются, мышей, коз и кроликов.
i) Моноклональное антитело
ДНК, кодирующую моноклональное антитело (согласно описанию в примере 1), легко выделить и секвенировать с использованием обычных методов (например, с использованием олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими тяжелую и легкую цепи моноклональных антител). Предпочтительным источником такой ДНК служит клетка гибридомы. После выделения ДНК можно поместить в векторы экспрессии, которые затем трансфектируют в клетки-хозяева, например клетки Е.coli, клетки обезьяны COS, клетки яичника китайского хомяка (СНО) или миеломные клетки, которые иным способом не продуцируют белок иммуноглобулин, чтобы добиться синтеза моноклональных антител в рекомбинантных клетках-хозяевах. Кроме того, ДНК можно модифицировать, например, заменой кодирующей последовательности константных доменов человеческой тяжелой и легкой цепей вместо гомологичных мышиных последовательностей. Химерные или гибридные антитела также можно получить in vitro, используя методы, известные в химии синтетических белков, включая методы с использованием сшивающих агентов. Например, иммунотоксины можно получить, используя реакцию дисульфидного обмена или посредством образования тиоэфирной связи. Примеры пригодных реагентов для этой цели включают иминотиолат и метил-4-меркаптобутиримидат.
(ii) Гуманизированные антитела
Гуманизированное антитело имеет один или несколько аминокислотных остатков, введенных в него из источника, которым не является человек. Такие аминокислотные остатки, отличные от аминокислотных остатков человека, часто относят к «заимствованным» остаткам, которые обычно взяты из «заимствованного» вариабельного домена. Гуманизирование можно проводить, следуя способу Winter и др., путем замены последовательностей CDR грызунов на соответствующие последовательности антитела человека (Jones и др., Nature, 321, 1986, сс.522-525, Riechmann и др., Nature, 332, 1988, сс. 323-327, Verhoeyen и др., Science, 239, 1988, сс.1534-1536, в обзоре Clark, Immunol. Today, 21, 2000, сс.397-402).
Гуманизированные антитела можно получить в процессе анализа родительских последовательностей и различных концептуальных гуманизированных продуктов с использованием трехмерных моделей родительских и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов являются доступными и известными специалистам в данной области. Имеются компьютерные программы, которые показывают и воспроизводят возможные трехмерные конформационные структуры выбранных последовательностей-кандидатов иммуноглобулинов. Проверка данных воспроизведений позволяет проанализировать возможную роль остатков в функционировании последовательностей-кандидатов иммуноглобулинов, т.е. проанализировать остатки, которые оказывают влияние на способность иммуноглобулина-кандидата связываться с его антигеном. Таким образом, можно выбрать и объединить остатки FR из консенсусной и важной последовательности так, чтобы достичь желаемого свойства антитела, например повышенной аффинности в отношении антигена-мишени (антигенов-мишеней). В основном на связывание с антигеном непосредственно и в наиболее значительной степени влияют остатки CDR.
(iii) Фрагменты антител
Для получения фрагментов антител разработаны различные способы. Данные фрагменты можно получить с помощью рекомбинантных клеток-хозяев (обзоры Hudson, Curr. Opin. Immunol., 11, 1999, сс.548-557, Little и др., Immunol. Today, 21, 2000, сс.364-370). Например, Fab'-SH-фрагменты можно непосредственно выделить из E.coli и химически соединить с получением F(ab')2-фрагментов (Carter и др., Biotechnology, 10, 1992, сс.163-167). В другом варианте осуществления изобретения, F(ab')2 получают, используя для сборки молекулы F(ab')2 лейциновый зиппер GCN4. В соответствии с другими подходами фрагменты Fv, Fab или F(ab')2 можно непосредственно выделить из культуры рекомбинантных клеток-хозяев.
Пример 6
Композиция, включающая антитело по настоящему изобретению
Антитело по настоящему изобретению можно применять в виде композиции для предупреждения/лечения рака. Композиция для предупреждения/лечения рака, которая включает антитело по настоящему изобретению, обладает низкой токсичностью и может вводиться либо в форме жидких препаратов, либо в форме фармацевтических композиций соответствующих препаратов человеку или млекопитающим (например, крысам, кроликам, овцам, свиньям, крупному рогатому скоту, животным из семейства кошачьих, животным из семейства псовых, обезьяноподобным и т.д.) перорально или парентерально (например, внутрь сосудов, внутрибрюшинно, подкожно и т.д.). Антитело по настоящему изобретению можно вводить отдельно или в виде соответствующей композиции. Композиция, предназначенная для введения, может содержать антитело по настоящему изобретению или его соль, фармацевтически приемлемый носитель, растворитель или эксципиент. Такую композицию предусматривают в форме фармацевтических препаратов, пригодных для перорального или парентерального введения.
Примеры композиции для парентерального введения включают препараты, пригодные для инъекций, суппозитории и т.д. Препараты, пригодные для инъекций, могут включать дозированные формы, например, для внутривенного, подкожного, внутрикожного и внутримышечного введения, для капельных вливаний, внутрисуставных инъекций и т.д. Эти препараты, пригодные для инъекций, можно получить общеизвестными способами. Например, препараты, пригодные для инъекций, можно получить посредством растворения, суспендирования или эмульгирования антитела по настоящему изобретению или его соли в стерильной водной среде или маслянистой среде, традиционно используемых для инъекций. В качестве водной среды для инъекций могут служить, например, физиологический раствор, изотонический раствор, содержащий глюкозу и другие вспомогательные вещества, и т.д., которые могут использовать в комбинации с соответствующими растворителями, например спиртом (например, этанолом), полиспиртом (например, пропиленгликолем, полиэтиленгликолем), неионогенным поверхностно-активным веществом (например, полисорбатом 80, НСО-50 (продуктом соединения полиоксиэтилена (50 молей) и гидрогенизированного касторового масла)) и т.д. В качестве масляной среды применяют, например, кунжутное масло, соевое масло и т.д., которые можно использовать в комбинации с растворителями, например бензилбензоатом, бензиловым спиртом и т.д. Приготовленный таким образом инъекционный препарат обычно фасуют в соответствующие ампулы. Суппозитории, используемые для ректального введения, можно приготовить путем смешивания антитела по настоящему изобретению или его соли с традиционной основой для суппозиториев. Композиция для перорального введения включает твердые или жидкие препараты, в особенности таблетки (включая драже и таблетки с пленочным покрытием), пилюли, гранулы, порошки, капсулы (включая мягкие капсулы), сироп, эмульсии, суспензии и т.д. Такая композиция готовится общеизвестными способами и может содержать связующее вещество, разбавитель или эксципиент, традиционно используемые в области фармацевтических препаратов. Примерами связующего вещества или эксципиента для таблеток являются лактоза, крахмал, сахароза, стеарат магния и т.д.
Преимущественно вышеописанные композиции для перорального или парентерального применения готовят в виде фармацевтических препаратов в унифицированных дозах, в соответствии с дозами активных ингредиентов. Такие дозированные препараты включают, например, таблетки, пилюли, капсулы, инъекционные растворы (ампулы), суппозитории и т.д. Количество содержащегося вышеуказанного соединения обычно составляет 5-500 мг на унифицированную дозированную форму. Предпочтительно, когда вышеуказанное антитело содержится в количестве примерно от 5 мг до примерно 100 мг, особенно в форме инъекционного раствора, и от 10 мг до 250 мг для других форм.
Доза указанного выше профилактического/терапевтического агента или регулятора, включающего антитело по настоящему изобретению, может изменяться в зависимости от субъекта, которому предназначено введение, заболевания, подлежащего лечению, состояний, способа введения и т.д. Например, при использовании в целях лечения/профилактики, например, рака молочной железы у взрослого субъекта, полезно вводить антитело по настоящему изобретению внутривенно в дозе примерно от 0,01 до примерно 20 мг/кг массы тела, предпочтительно примерно от 0,1 до примерно 10 мг/кг массы тела, и более предпочтительно примерно от 0,1 до примерно 5 мг/кг массы тела, примерно 1-5 раз/сутки, предпочтительно примерно 1-3 раза/сутки. В случае других парентеральных и пероральных способов введения, агент можно вводить в дозе, соответствующей приведенной выше дозе. Когда состояние особенно тяжелое, дозу можно увеличивать в соответствии с состоянием.
Антитело по настоящему изобретению можно вводить само по себе или в форме соответствующей композиции. Композиция, используемая для введения, может содержать с вышеуказанным антителом или его солями фармацевтически приемлемый носитель, разбавитель или эксципиент. Такая композиция предусматривается в форме фармацевтических препаратов, пригодных для перорального и парентерального введения (например, интраваскулярной инъекции, подкожной инъекции и т.д.). Каждая вышеописанная композиция может дополнительно содержать другие действующие вещества. Кроме того, антитело по настоящему изобретению может применяться в комбинации с другими лекарственными препаратами, например алкилирующими агентами (циклофосфамидом, ифосфамидом и т.д.), антиметаболитами (например, метотрексатом, 5-фторурацилом и т.д.), противоопухолевыми антибиотиками (например, митомицином, адриамицином и т.д.), противоопухолевыми агентами растительного происхождения (например, винкристином, виндезином, таксолом и т.д.), цисплатином, карбоплатином, этопозидом, иринотеканом и т.д. Антитело по настоящему изобретению и описанные выше лекарственные препараты пациенту можно вводить одновременно или в разное время.
Описанный в настоящем изобретении способ лечения, особенно рака, можно также проводить с введением других антител или химиотерапевтических агентов. Можно также вводить, например, антитело против EGFR, например продукт ERBITUX® (цетуксимаб), особенно при лечении рака ободочной кишки. Также показано, что продукт ERBITUX® эффективен для лечения псориаза. Другие антитела, используемые для комбинации, включают продукт Herceptin® (трастузумаб), особенно при лечении рака молочной железы, продукт AVASTIN®, особенного при лечении рака ободочной кишки, и SGN-15, особенно при лечении немелкоклеточного рака легкого. Антитело по настоящему изобретению с другими антителами/химиотерапевтическими агентами можно вводить совместно или раздельно, посредством одинаковых или различных способов введения.
Используемые режимы терапии с применением химиотерапевтического агента/другого антитела, включают какой-либо режим, который считается оптимально соответствующим для лечения состояния пациента. Различные злокачественные заболевания могут требовать применения специфических противоопухолевых антител и специфических химиотерапевтических агентов, которые устанавливаются для каждого конкретного пациента. В предпочтительном варианте осуществления настоящего изобретения химиотерапию проводят одновременно или, более предпочтительно, после лечения антителами. Однако следует подчеркнуть, что настоящее изобретение не ограничивается каким-либо особым методом или способом введения.
Наличие веских доказательств показывает, что AR81A410.7 опосредует противораковые эффекты через лигирование эпитопа, присутствующего на линиях клеток рака. Кроме того, можно показать, что антитело AR81A410.7 может использоваться для детекции клеток, которые экспрессируют эпитоп, который с ним специфически связывается; с использованием, например, методов FACS, клеточного твердофазного ИФА или ИГХ.
Все патенты и публикации, упоминаемые в настоящем изобретении, отражают уровень работы специалистов в области, к которой относится настоящее изобретение. Все патенты и публикации включены в настоящее изобретение в виде ссылок, отражающих их сущность.
Следует учитывать, что хотя определенная часть настоящего изобретения приводится в качестве его иллюстрации, она не ограничивается определенной формой или порядком представленных в настоящем изобретении частей. Специалистам очевидно, что различные изменения могут быть произведены без отклонения от области охвата настоящего изобретения и что настоящее изобретение не ограничивается примерами, изложенными в описании.
Специалистам очевидно, что настоящее изобретение хорошо адаптировано к осуществлению и достижению целей и получению упомянутых преимуществ, а также тому, что этому свойственно. Любые олигонуклеотиды, пептиды, полипептиды, биологически близкие соединения, способы, процедуры и технологии, указанные в настоящем описании, являются показательными для предпочтительных вариантов осуществления настоящего изобретения, предназначены для иллюстрации, но не для ограничения объема изобретения. Специалисты могут вносить в них изменения и находить другие возможности применения, которые соответствуют сущности настоящего изобретения и определены рамками настоящей формулы изобретения. Хотя изобретение описано на примере специфических вариантов осуществления изобретения, следует понимать, что заявленное изобретение не должно полностью ограничиваться такими специфическими вариантами осуществления. На самом деле, в объем следующей формулы изобретения входят различные модификации описанных способов осуществления изобретения, которые очевидны специалистам в данной области.
| название | год | авторы | номер документа |
|---|---|---|---|
| МУЛЬТИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА, ПРЕДНАЗНАЧЕННЫЕ ДЛЯ ПРИМЕНЕНИЯ ПРИ ЛЕЧЕНИИ НЕОПЛАЗМЫ МОЧЕВЫХ ПУТЕЙ | 2017 |
|
RU2766358C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ АНТИТЕЛ ДЛЯ ЛЕЧЕБНЫХ ЦЕЛЕЙ С ИСПОЛЬЗОВАНИЕМ СОЕДИНЕНИЙ, ПОТЕНЦИИРУЮЩИХ NK-КЛЕТКИ | 2004 |
|
RU2396981C2 |
| АНТИТЕЛА ПРОТИВ КЛАУДИНА 18.2 ДЛЯ ДИАГНОСТИКИ РАКА | 2013 |
|
RU2661772C2 |
| Антитело, связывающееся с карбоангидразой, и его применение | 2017 |
|
RU2727682C1 |
| ЛЕЧЕНИЕ РАКА ПРИ ПОМОЩИ НАПРАВЛЕННЫХ НА МИШЕНЬ АНТИТЕЛ IN VIVO | 2011 |
|
RU2642305C2 |
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО К PD-L1 | 2017 |
|
RU2665790C1 |
| МОНОКЛОНАЛЬНЫЕ АНТЕТЕЛА К CD44, ПРЕДНАЗНАЧЕННЫЕ ДЛЯ ПРИМЕНЕНИЯ ПРИ ЛЕЧЕНИИ ПЛОСКОКЛЕТОЧНОЙ КАРЦИНОМЫ ГОЛОВЫ И ШЕИ | 2011 |
|
RU2599447C2 |
| ИНДУЦИРУЮЩИЙ ЦИТОТОКСИЧНОСТЬ ТЕРАПЕВТИЧЕСКИЙ АГЕНТ | 2011 |
|
RU2774414C2 |
| КОМБИНАЦИЯ, СОДЕРЖАЩАЯ ПЕРЕНАПРАВЛЯЮЩИЕ Т-КЛЕТКИ МНОГОФУНКЦИОНАЛЬНЫЕ АНТИТЕЛА И МОДУЛЯТОРЫ КОНТРОЛЬНЫХ ТОЧЕК, И ЕЕ ПРИМЕНЕНИЯ | 2017 |
|
RU2773655C2 |
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ АНТИ-СЕАСАМ 1 И АНТИ-PD АНТИТЕЛА ДЛЯ ТЕРАПИИ РАКА | 2014 |
|
RU2697522C1 |

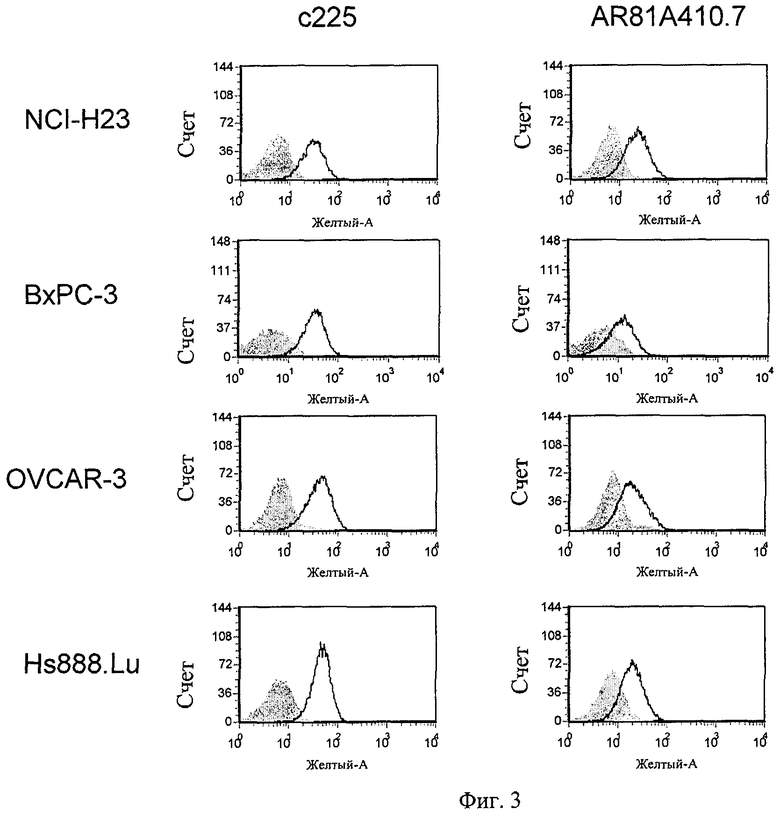
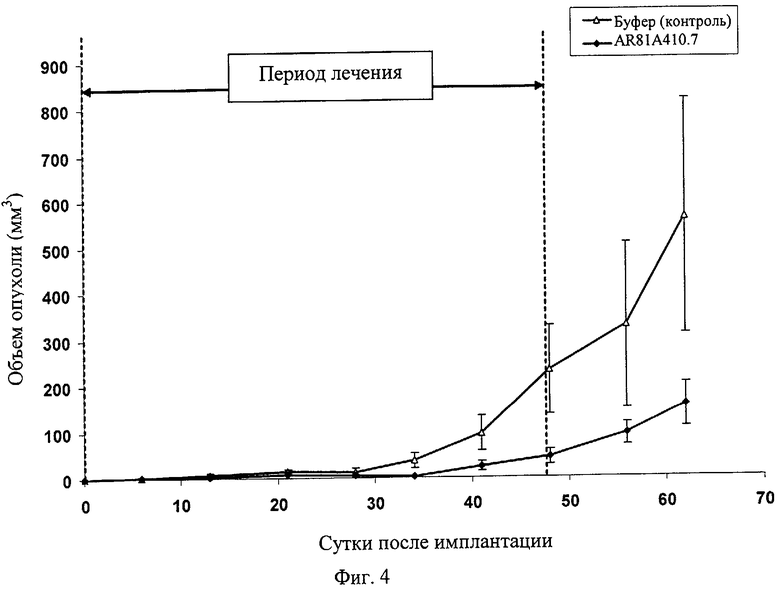
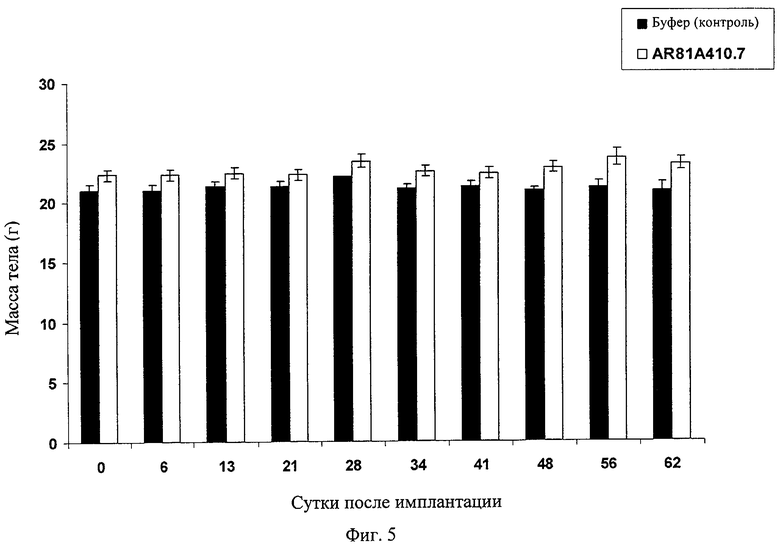
Настоящее изобретение относится к иммунологии и биотехнологии. Предложено выделенное моноклональное антитело, индуцирующее цитотоксичность в отношении раковых клеток, продуцируемое гибридомой, депонированной в коллекции IDAC под номером 051206-01, или его антигенсвязывающий фрагмент. Описаны: химерный и гуманизированный варианты, получаемые из указанного антитела. Раскрыта гибридома, продуцирующая моноклональное антитело и депонированная в коллекции IDAC под номером 051206-01, а также композиция на основе указанного антитела для лечения раковой опухоли человека. Использование изобретения обеспечивает варианты моноклональных антител, способных индуцировать цитотоксичность in vitro в отсутствии эффекторных клеток в отношении клеток аденокарциномы легкого, что может найти применение в терапии опухолей. 5 н.п. ф-лы, 5 ил., 6 пр.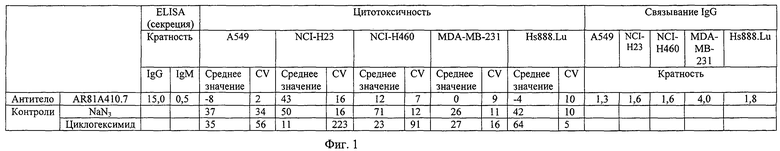
1. Выделенное моноклональное антитело, индуцирующее цитотоксичность в отношении раковых клеток, причем указанное моноклональное антитело продуцируется гибридомой, депонированной в коллекции IDAC под номером 051206-01, или антигенсвязывающий фрагмент, получаемый из указанного антитела, где указанное моноклональное антитело способно индуцировать цитотоксичность in vitro в отсутствии эффекторных клеток в отношении клеток аденокарциномы легкого.
2. Гуманизированный вариант выделенного моноклонального антитела, индуцирующего цитотоксичность в отношении раковых клеток, причем указанное моноклональное антитело продуцируется гибридомой, депонированной в коллекции IDAC под номером 051206-01, или антигенсвязывающий фрагмент, получаемый из указанного гуманизированного антитела, где указанное моноклональное антитело способно индуцировать цитотоксичность in vitro в отсутствии эффекторных клеток в отношении клеток аденокарциномы легкого.
3. Химерный вариант выделенного моноклонального антитела, индуцирующего цитотоксичность в отношении раковых клеток, причем указанное моноклональное антитело продуцируется гибридомой, депонированной в коллекции IDAC под номером 051206-01, или антигенсвязывающий фрагмент, получаемый из указанного антитела, где указанное моноклональное антитело способно индуцировать цитотоксичность in vitro в отсутствии эффекторных клеток в отношении клеток аденокарциномы легкого.
4. Выделенная линия гибридомных клеток, депонированная в коллекции IDAC под номером 051206-01, продуцирующая моноклональное антитело, индуцирующее цитотоксичность в отношении раковых клеток.
5. Композиция, эффективная для лечения раковой опухоли человека, содержащая в комбинации:
антитело или его антигенсвязывающий фрагмент по одному из пп.1-3, и необходимое количество фармакологически приемлемого носителя, причем указанная композиция эффективна для лечения указанной раковой опухоли у человека.
| HELLSTROM et al., "Antitumor effects of L6, an IgG2a antibody that reacts with most human carcinomas", Proc | |||
| Natl | |||
| Acad | |||
| Sci, USA, 1986, vol.83, с.7059-7063 | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| ВИБРОБУНКЕР | 0 |
|
SU234122A1 |
| Способ освобождения шкур от волоса | 1927 |
|
SU6945A1 |
Авторы
Даты
2012-11-27—Публикация
2008-01-23—Подача