Область техники, к которой относится изобретение
Настоящее изобретение относится к иммунотерапии рака, в частности к комбинациям анти-CEACAM1 и анти-PD/PD-лиганд антител и их применению в лечении рака.
Уровень техники изобретения
Трансмембранный белок карциномоэмбриональной антигензависимой молекулы клеточной адгезии 1 (CEACAM1, также известный как билиарный гликопротеин (BGP), CD66a и C-CAM1) является членом семейства карциномоэмбриональных антигенов (CEA), которое также принадлежит к суперсемейству иммуноглобулинов. CEACAM1 человека в базе данных SwissProt был присвоен регистрационный номер P13688. CEACAM1 взаимодействует сам с собой и с другими известными белками CEACAM, включая белки CD66e (CEACAM6) и CD66e (CEACAM5, CEA). Он экспрессируется в широком спектре клеток, начиная от эпителиальных клеток и заканчивая клетками гемопоэтического происхождения (например, иммунные клетки).
Белку CEACAM1 приписывается много различных функций. Было показано, что белок CEACAM1 сверхэкспрессируется в некоторых видах карцином толстой кишки, предстательной железы, а также в других типах рака, таких как меланома. Дополнительные данные подтверждают ключевую роль CEACAM1 в ангиогенезе и метастазировании. CEACAM1 также играет роль в модуляции врожденного и адаптивного иммунного ответа. Например, было показано, что CEACAM1 является ингибирующим рецептором для активированных T-лимфоцитов, содержащихся в эпителии кишечника человека (международная заявка WO99/52552 и Morales et al. J. Immunol. 1999, 163, 1363-1370). В дополнительных сообщениях указывается, что взаимодействие CEACAM1 или с T-клеточным рецептором, соединенным с моноклональными антителами (mAbs), или с Opa-белками Neisseria gonorrhea ингибирует активацию и пролиферацию T-лимфоцитов. Некоторые моноклональные антитела против белка CEACAM1 уже известны, например, 26H7, 5F4, TEC-11, 12-140-4, 4/3/17, COL-4, F36-54, 34B1, YG-C28F2, D14HD11, b18.7.7, D11-AD11, HEA81, B 1.1, CLB-gran-10, F34-187, T84.1, B6.2, B1.13, YG-C94G7, 12-140-5, TET-2 и scFv-DIATHIS1 (Watt et al, Blood, 2001, Vol. 98, страницы 1469-1479). В международной заявке WO2010/12557 описаны мышиное моноклональное антитело к CEACAM1 человека. В международной заявке WO2013/054331 описано гибридное моноклональное антитело к CEACAM1 CM10 человека.
Белок 1 программируемой клеточной смерти (PD-1) представляет собой трансмембранный белок типа I, принадлежащий к семейству иммунорецепторов CD28/CTLA-4, которые проводят сигналы, регулирующие иммунные ответы. PD-1 человека в базе данных SwissProt был присвоен регистрационный номер Q15116. Члены семейства CD28/CTLA-4 или активируют (CD28 и ICOS) или подавляют активацию T-лимфоцитов (CTLA-4 и PD-1). PD-1 экспрессируется на активированных T-лимфоцитах, B-лимфоцитах, миелоидных клетках и в субпопуляции тимоцитов. Некоторые моноклональные антитела против белка PD-1 уже известны, например, MK-3475 (гуманизированное IgG4 mAb), AMP514, BMS-936558 (полностью человеческое IgG4 mAb) и пидилизумаб, также известный как CT-011 (гуманизированное IgG1 mAb) (Topalian et al., Curr. Opin. Immunol., 2012, Vol. 24(2), страницы 207-212).
Лиганд 1 программируемой клеточной смерти (PD-L1), также известный как кластер дифференцировки 274 (CD274) или гомолог B7 (B7-H1) представляет собой белок, который у человека кодируется геном CD274. PD-L1 представляет собой трансмембранный белок типа I массой 40 кДа, который, как предполагают, играет основную роль в подавлении иммунной системы во время определенных событий, таких как беременность, аллотрансплантация тканей и другие патологические состояния, такие как гепатит. В норме иммунная система реагирует на чужеродные антигены, где происходит их накопление в лимфатических узлах или селезенке, которое запускает пролиферацию антигенспецифичных CD8+ T-лимфоцитов. Образование комплекса PD-1/PD-L1 лиганд передает ингибирующий сигнал, который уменьшает пролиферацию этих CD8+ T-лимфоцитов в лимфатических узлах, и в дополнение к этому PD-1 также может регулировать накопление специфичных к чужеродному антигену T-лимфоцитов в лимфатических узлах через апоптоз, который затем опосредуется пониженной регуляцией гена Bcl-2 (Chemnitz JM et al., 2004, Journal of Immunology, 173(2): 945-54). Взаимодействие PD-L1 со своим рецептором PD-1, обнаруженным на активированных T-лимфоцитах, B-лимфоцитах и миелоидных клетках, обеспечивает проведение сигнала, который ингибирует TCR-опосредованную активацию IL-2 и пролиферацию T-лимфоцитов. Лиганд 2 белка 1 программируемой клеточной смерти (также известный как PD-L2, B7-DC) представляет собой белок, который у человека кодируется геном PDCD1LG2. PDCD1LG2 также обозначается как CD273 (кластер дифференцировки 273).
PD-1 и его лиганды PD-L1 и PD-L2 обеспечивают ингибирующий сигнал, который регулирует баланс между активацией T-лимфоцитов, толерантностью и иммунопатологией. Иммунные ответы на чужеродные и собственные антигены требуют специфичных и сбалансированных ответов для очистки от патогенов и опухолей и еще для поддержания толерантности. PD-L1 и PD-L2 человека в базе данных SwissProt были присвоены регистрационные номера Q9NZQ7 и Q9BQ51, соответственно. Индукция и поддержание T-клеточной толерантности требуют наличия PD-1 и его лиганда PD-L1 на негемопоэтических клетках, которые могут ограничивать ответы эффекторных T-лимфоцитов и защищать ткани от иммуноопосредованного повреждения тканей. PD-1:PD-L1 путь также используется микроорганизмами и опухолями для ослабления противомикробного и опухолевого иммунитета и облегчения развития хронической инфекции и выживания опухоли. Некоторые моноклональные антитела против белка PD-L1 уже известны, например, MEDI-4736, BMS-936559, MSB0010718C и MPDL3280A (Lu et al, J. Oncol. Pharm. Pract., 2014). Другие моноклональные антитела против белка PD-L2 также известны, например, те, которые раскрыты в публикациях заявок PCT Nos. WO2010/027827, WO2010/036959 и WO2011/066342. WO2014/059251 относится к композициям и способам усиления иммунного ответа и/или уменьшения Т-клеточной толерантности у субъектов путем введения ингибиторов двух или нескольких из CEACAM1, PD-1 и/или латентно ассоциированного пептида (LAP).
Иммунотерапия рака представляет собой использование иммунной системы для лечения рака. Существует три основные группы иммунотерапии: клеточная терапия, терапия антителами и терапия цитокинами. Все они основаны на том явлении, что раковые клетки часто имеют на своей поверхности различные молекулы, которые могут быть обнаружены иммунной системой. Эти молекулы известны как раковые антигены. Иммунотерапия используется для того, чтобы стимулировать иммунную систему атаковать опухолевые клетки, используя эти раковые антигены в качестве мишеней.
Терапия антителами является в настоящее время наиболее успешной формой иммунотерапии, имеющей много разрешенных к применению препаратов для лечения широкого спектра раковых заболеваний. Антитела представляют собой белки, продуцируемые иммунной системой, которые связываются с антигеном-мишенью на поверхности клетки. При нормальном физиологическом процессе они используются иммунной системой для борьбы с патогенами. Каждое антитело является специфичным по отношению к одному или нескольким высокогомологичным белкам, и те из них, которые связываются раковыми антигенами, используются в лечении рака. После связывания с раковым антигеном антитела могут индуцировать антителозависимую клеточно-опосредованную цитотоксичность, активировать систему комплемента, предотвращать взаимодействие рецептора со своим лигандом или доставлять полезную химиотерапевтическую или радиационную нагрузку, все из вышеперечисленного может приводить к гибели клеток. В настоящее время существуют антитела, разрешенные к применению в терапии рака Управлением по контролю пищевых продуктов и лекарственных средств США (FDA): Ритуксимаб (1997), Трастузумаб (1998), Гемтузумаб озогамицин (2000), Алемтузумаб (2001), Ибритутомаб тиуксетан (2002), Тозитумомаб (2003), Цетуксимаб (2004), Бевацизумаб (2004), Панитумумаб (2006), Офатумумаб (2009), Ипилимумаб (2011) и Брентуксимаб ведотин (2011).
При этом некоторые антитела, изначально разрешенные для применения в противораковой монотерапии, в дальнейшем были разрешены для применения в комбинации с другими видами противораковой терапии, таким как химиотерапия. Например, FDA выдала разрешение на применение Ритуксимаба (Rituxan, Genentech, Inc.) в комбинации с флударабином и циклофосфамидом для лечения как ранее нелеченых, так и ранее леченых пациентов с хроническим лимфоцитарным лейкозом (ХЛЛ). Недавно FDA выдала разрешение на применение Бевацизумаба (Avastin, Genentech, Inc.) в комбинации с паклитакселом и цисплатином или топотеканом для лечения персистирующего, рецидивирующего или метастатического рака шейки матки.
Остается неудовлетворенная потребность в улучшении комбинированной терапии на основе антител, с использованием различных антител, направленно воздействующих на различные или параллельные механизмы прогрессирования рака.
Сущность изобретения
Настоящее изобретение относится к улучшенным комбинированным терапиям на основе антител, с использованием множества антител, направленно воздействующих на различные или параллельные механизмы прогрессирования рака. Настоящее изобретение основано на неожиданном открытии, что комбинации анти-CEACAM1 антител и антител, направлено нарушающих связывание PD-1 с его природными лигандами PD-L1 и PD-L2, значительно и синергетически повышают цитотоксичность лимфоцитов, таких как опухоль-инфильтрирующие лимфоциты (ОИЛ) и лимфокинактивированные клетки-киллеры (ЛАК), в отношении различных типов рака. В настоящем изобретении впервые показано, что поэтапная предварительная инкубация лимфоцитов с этими двумя типами антител, в отличие от одновременной инкубации, максимизирует лимфоцит-опосредованную цитотоксичность. Это неожиданное открытие может быть эффективно использовано для улучшения клинического исхода, когда различные антитела отдельно вводятся пациентам, страдающим раком, для достижения максимальной эффективности. Другим неожиданным открытием явилось то, что блокирование CEACAM1 анти-CEACAM1 антителами повышает экспрессию PD-L1 раковыми клетками. Кроме того, впервые было обнаружено, что комбинации анти-CEACAM1 антител и антител, направлено нарушающих связывание PD-1 с его природными лигандами PD-L1 и PD-L2, синергетически ослабляют прогрессирование сформировавшихся опухолей в иммунокомпетентной мышиной модели.
Таким образом, в одном аспекте настоящее изобретение относится к фармацевтической композиции, содержащей моноклональное антитело к карциномоэмбриональной антигензависимой молекуле клеточной адгезии 1 человека (CEACAM1) или его антигенсвязывающий фрагмент, и к фармацевтической композиции, содержащей моноклональное антитело, по меньшей мере, к одной из следующих молекул: белок 1 программируемой клеточной смерти человека (PD-1), PD-L1 и PD-L2, или его антигенсвязывающий фрагмент, для применения в лечении рака путем раздельного введения.
В другом аспекте настоящее изобретение также относится к фармацевтической композиции, содержащей моноклональное антитело к карциномоэмбриональной антигензависимой молекуле клеточной адгезии 1 человека (CEACAM1) или его антигенсвязывающий фрагмент, и к фармацевтической композиции, содержащей моноклональное антитело, способное ингибировать или блокировать взаимодействие между белком 1 программируемой клеточной смерти человека (PD-1) и его лигандами, или его антигенсвязывающий фрагмент, для применения в лечении рака путем раздельного введения.
В другом аспекте настоящее изобретение также относится к моноклональному антителу к карциномоэмбриональной антигензависимой молекуле клеточной адгезии 1 человека (CEACAM1) или его антигенсвязывающему фрагменту и к моноклональному антителу, способному ингибировать или блокировать взаимодействие между белком 1 программируемой клеточной смерти человека (PD-1) и его лигандами, или его антигенсвязывающему фрагменту, для применения в лечении рака путем раздельного введения.
В еще одном аспекте настоящее изобретение также относится к способу лечения страдающего раком пациента, включающему введение этому пациенту фармацевтической композиции, содержащей моноклональное антитело к CEACAM1 человека или его антигенсвязывающий фрагмент, и фармацевтической композиции, содержащей моноклональное антитело, по меньшей мере, к одной из следующих молекул: PD-1, PD-L1 и PD-L2 человека, или его антигенсвязывающий фрагмент, осуществляя тем самым лечение рака.
В другом аспекте настоящее изобретение относится к набору реагентов, включающему фармацевтическую композицию, содержащую моноклональное антитело к CEACAM1 человека или его антигенсвязывающий фрагмент, и фармацевтическую композицию, содержащую моноклональное антитело, по меньшей мере, к одной из следующих молекул: PD-1, PD-L1 и PD-L2 человека, или его антигенсвязывающий фрагмент.
В другом аспекте настоящее изобретение относится к вышеописанному набору реагентов для применения в лечении рака.
В некоторых вариантах осуществления изобретения моноклональное антитело к CEACAM1 человека или его антигенсвязывающий фрагмент способно связываться с аффинностью, по меньшей мере, примерно 10-8М с белком CEACAM1 человека. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых вариантах осуществления изобретения моноклональное антитело к CEACAM1 человека или его антигенсвязывающий фрагмент способно связываться с аффинностью, по меньшей мере, примерно 5×10-7М с, по меньшей мере, одним из следующих белков: белок CEACAM3 человека и белок CEACAM5 человека. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения.
В некоторых вариантах осуществления изобретения моноклональное антитело к CEACAM1 человека выбрано из группы, состоящей из CM-24, 26H7, 5F4, TEC-11, 12-140-4, 4/3/17, COL-4, F36-54, 34B1, YG-C28F2, D14HD11, b18.7.7, D11-AD11, HEA81, B1.1, CLB-gran-10, F34-187, T84.1, B6.2, B1.13, YG-C94G7, 12-140-5, scFv DIATHIS1, TET-2, их антигенсвязывающих фрагментов и любой их комбинации. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В конкретном варианте осуществления изобретения моноклональное антитело к CEACAM1 человека представляет собой CM-24 или его антигенсвязывающий фрагмент или любую их комбинацию. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения.
В некоторых вариантах осуществления изобретения моноклональное антитело или его фрагмент, который распознает CEACAM1, содержит, по меньшей мере, одну CDR тяжелой цепи, содержащую последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 2 и SEQ ID NO: 3, и, по меньшей мере, одну CDR легкой цепи, содержащую последовательность, выбранную из группы, состоящей из SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых вариантах осуществления изобретения моноклональное антитело или его фрагмент, который распознает CEACAM1, содержит, по меньшей мере, две CDRs тяжелой цепи, содержащие последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 2 и SEQ ID NO: 3, и, по меньшей мере, одну CDR легкой цепи, содержащую последовательность, выбранную из группы, состоящей из SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения.
В некоторых вариантах осуществления изобретения моноклональное антитело или его фрагмент, который распознает CEACAM1, содержит, по меньшей мере, одну последовательность CDR тяжелой цепи, имеющую, по меньшей мере, пять последовательных аминокислот, полученных из последовательности, выбранной из группы, состоящей SEQ ID NO: 19, SEQ ID NO: 20 и SEQ ID NO: 21, и, по меньшей мере, одну последовательность CDR легкой цепи, имеющую, по меньшей мере, пять аминокислот, полученных из последовательности, выбранной из группы, состоящей SEQ ID NO: 22, SEQ ID NO: 23 и SEQ ID NO: 24. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения.
В некоторых вариантах осуществления изобретения сайт связывания моноклонального антитела или его фрагмента, который распознает CEACAM1, состоит из шести CDRs, имеющих последовательности SEQ ID NOs: 1, 2, 3, 4, 5 и 6. В некоторых вариантах осуществления изобретения сайт связывания моноклонального антитела или его фрагмента, который распознает CEACAM1, состоит из шести CDRs, имеющих последовательности SEQ ID NOs: 7, 8, 9, 10, 11 и 12. В некоторых вариантах осуществления изобретения сайт связывания моноклонального антитела или его фрагмента, который распознает CEACAM1, состоит из шести CDRs, имеющих последовательности SEQ ID NOs: 13, 14, 15, 16, 17 и 18. В некоторых вариантах осуществления изобретения сайт связывания моноклонального антитела или его фрагмента, который распознает CEACAM1, состоит из шести CDRs, имеющих последовательности SEQ ID NOs: 19, 20, 21, 22, 23 и 24.
В некоторых вариантах осуществления изобретения моноклональное антитело или его антигенсвязывающий фрагмент, который распознает CEACAM1 человека, содержит CDR1 тяжелой цепи, содержащую последовательность, представленную в SEQ ID NO: 1, CDR2 тяжелой цепи, содержащую последовательность, представленную в SEQ ID NO: 2, CDR3 тяжелой цепи, содержащую последовательность, представленную в SEQ ID NO: 3, CDR1 легкой цепи, содержащую последовательность, представленную в SEQ ID NO: 4, CDR2 легкой цепи, содержащую последовательность, представленную в SEQ ID NO: 5, и CDR3 легкой цепи, содержащую последовательность, представленную в SEQ ID NO: 6, и их аналоги и производные.
В некоторых вариантах осуществления изобретения моноклональное антитело или его антигенсвязывающий фрагмент, который распознает CEACAM1 человека, содержит CDR1 тяжелой цепи, имеющую последовательность, представленную в SEQ ID NO: 7, CDR2 тяжелой цепи, имеющую последовательность, представленную в SEQ ID NO: 8, и CDR3 тяжелой цепи, имеющую последовательность, представленную в SEQ ID NO: 9. В некоторых вариантах осуществления изобретения моноклональное антитело или его антигенсвязывающий фрагмент, который распознает CEACAM1 человека, содержит CDR1 тяжелой цепи, имеющую последовательность, представленную в SEQ ID NO: 13, CDR2 тяжелой цепи, имеющую последовательность, представленную в SEQ ID NO: 14, и CDR3 тяжелой цепи, имеющую последовательность, представленную в SEQ ID NO: 15.
В некоторых вариантах осуществления изобретения моноклональное антитело или его антигенсвязывающий фрагмент, который распознает CEACAM1 человека, содержит CDR1 легкой цепи, имеющую последовательность, представленную в SEQ ID NO: 10, CDR2 легкой цепи, имеющую последовательность, представленную в SEQ ID NO: 11, и CDR3 легкой цепи, имеющую последовательность, представленную в SEQ ID NO: 12. В некоторых вариантах осуществления изобретения моноклональное антитело или его антигенсвязывающий фрагмент, который распознает CEACAM1 человека, содержит CDR1 легкой цепи, имеющую последовательность, представленную в SEQ ID NO: 16, CDR2 легкой цепи, имеющую последовательность, представленную в SEQ ID NO: 17, и CDR3 легкой цепи, имеющую последовательность, представленную в SEQ ID NO: 18.
В некоторых вариантах осуществления изобретения моноклональное антитело или его антигенсвязывающий фрагмент, который распознает CEACAM1 человека, содержит последовательности CDR, представленные в SEQ ID NOs: 13, 14, 15, 16, 17 и 18. В некоторых вариантах осуществления изобретения моноклональное антитело или его антигенсвязывающий фрагмент, который распознает CEACAM1 человека, содержит последовательности CDR, представленные в SEQ ID NOs: 7, 8, 9, 10, 11 и 12.
В некоторых вариантах осуществления изобретения моноклональное антитело или его антигенсвязывающий фрагмент, который распознает CEACAM1 человека, содержит последовательность вариабельного домена тяжелой цепи, имеющую последовательность, представленную в SEQ ID NO: 25, или ее аналог или производное, имеющие, по меньшей мере, 97% идентичности по последовательности с указанной последовательностью тяжелой цепи. В некоторых вариантах осуществления изобретения моноклональное антитело или его антигенсвязывающий фрагмент, который распознает CEACAM1 человека, содержит последовательность вариабельного домена легкой цепи, имеющую последовательность, представленную в SEQ ID NO: 26, или ее аналог или производное, имеющие, по меньшей мере, 97% идентичности по последовательности с указанной последовательностью легкой цепи. В некоторых вариантах осуществления изобретения моноклональное антитело или его антигенсвязывающий фрагмент, который распознает CEACAM1 человека, содержит вариабельный домен тяжелой цепи, имеющий последовательность, представленную в SEQ ID NO: 25, и вариабельный домен легкой цепи, имеющий последовательность, представленную в SEQ ID NO: 26, или их аналог или производное, имеющие, по меньшей мере, 97% идентичности по последовательности с последовательностью антитела или фрагмента.
В некоторых вариантах осуществления изобретения моноклональное антитело или его антигенсвязывающий фрагмент, который распознает CEACAM1 человека, содержит:
i. каркасную последовательность, выбранную из группы, состоящей из мышиного IgG2a, мышиного IgG2b, мышиного IgG3, IgG1 человека, IgG2 человека, IgG3 человека; и
ii. шесть CDRs, имеющих последовательности, представленные в SEQ ID NOs: 13, 14, 1, 16, 17 и 18; или шесть CDRs, имеющих последовательности, представленные в SEQ ID NOs: 7, 8, 9, 10, 11 и 12; и их аналоги и производные, имеющие, по меньшей мере, 97% идентичности по последовательности с указанными последовательностями CDR, где это моноклональное антитело или фрагмент связывается с аффинностью, по меньшей мере, 5×10-7М с, по меньшей мере, двумя подтипами CEACAM.
В некоторых вариантах осуществления изобретения моноклональное антитело или его антигенсвязывающий фрагмент, который распознает CEACAM1 человека, содержит полученные от человека константные области, выбранные из группы, состоящей из IgG1 человека, IgG2 человека, IgG3 человека. В некоторых вариантах осуществления изобретения человеческое или гуманизированное моноклональное антитело или его антигенсвязывающий фрагмент, который распознает CEACAM1 человека, содержит константную область подкласса подтипа IgG1 человека.
В некоторых вариантах осуществления изобретения человеческое или гуманизированное моноклональное антитело или его антигенсвязывающий фрагмент, который распознает CEACAM1 человека, содержит шесть CDRs, имеющих последовательности, представленные в SEQ ID NOs: 13, 14, 1, 16, 17 и 18; или шесть CDRs, имеющих последовательности, представленные в SEQ ID NOs: 7, 8, 9, 10, 11 и 12; и их аналоги и производные, имеющие, по меньшей мере, 97% идентичности по последовательности с указанными последовательностями CDR, где это моноклональное антитело связывается с аффинностью, по меньшей мере, 10-8М с CEACAM1.
В некоторых вариантах осуществления изобретения человеческое или гуманизированное моноклональное антитело или его антигенсвязывающий фрагмент, который распознает CEACAM1 человека, содержит последовательность тяжелой цепи, представленную в SEQ ID NO: 27. В некоторых вариантах осуществления изобретения человеческое или гуманизированное моноклональное антитело или его антигенсвязывающий фрагмент, который распознает CEACAM1 человека, содержит последовательность легкой цепи, представленную в SEQ ID NO: 28. В некоторых вариантах осуществления изобретения человеческое или гуманизированное моноклональное антитело или его антигенсвязывающий фрагмент, который распознает CEACAM1 человека, содержит последовательность тяжелой цепи, представленную в SEQ ID NO: 27, и последовательность легкой цепи, представленную в SEQ ID NO: 28.
В некоторых вариантах осуществления изобретения моноклональное антитело или его антигенсвязывающий фрагмент, который распознает CEACAM1 человека, содержит, по меньшей мере, антигенсвязывающую часть, которая способна связываться с тем же эпитопом на молекуле CEACAM1, с которым связывается моноклональное антитело, имеющее шесть последовательностей CDR, представленных в SEQ ID NOs: 7, 8, 9, 10, 11 и 12; или шесть последовательностей CDR, представленных в SEQ ID NOs: 13, 14, 15, 16, 17 и 18. В некоторых вариантах осуществления изобретения моноклональное антитело или его антигенсвязывающий фрагмент взаимодействует с эпитопом в пределах остатков 17-29 и 68-79 CEACAM1 человека, что соответствует последовательностям VLLLVHNLPQQLF (SEQ ID NO: 32) и YPNASLLIQNVT (SEQ ID NO: 33), соответственно.
В некоторых вариантах осуществления изобретения моноклональное антитело или его антигенсвязывающий фрагмент взаимодействует с эпитопом, содержащем, по меньшей мере, четыре аминокислоты последовательности VLLLVHNLPQQLF (SEQ ID NO: 29). В некоторых вариантах осуществления изобретения моноклональное антитело или его антигенсвязывающий фрагмент взаимодействует с эпитопом, содержащем аминокислотные остатки в последовательностях VLLLVHNLPQQLF (SEQ ID NO: 29) и YPNASLLIQNVT (SEQ ID NO: 30). В некоторых вариантах осуществления изобретения моноклональное антитело или его антигенсвязывающий фрагмент взаимодействует с эпитопом в пределах последовательностей VLLLVHNLPQQLF (SEQ ID NO: 29) и PNASLLI (SEQ ID NO: 31).
В некоторых вариантах осуществления изобретения антигенсвязывающий фрагмент сохраняет, по меньшей мере, 10%, по меньшей мере, 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере, 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере, 80% или, по меньшей мере, 90% соответствующей аффинности полноразмерного антитела к указанному эпитопу или антигену. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых вариантах осуществления изобретения антигенсвязывающий фрагмент сохраняет, по меньшей мере, 50% соответствующей аффинности полноразмерного антитела к указанному эпитопу или антигену. В некоторых вариантах осуществления изобретения антигенсвязывающий фрагмент сохраняет, по меньшей мере, 90% соответствующей аффинности полноразмерного антитела к указанному эпитопу или антигену.
В некоторых вариантах осуществления изобретения моноклональное антитело к PD-1 человека выбрано из группы, состоящей из MK-3475, AMP514, BMS-936558, CT-011, их антигенсвязывающих фрагментов и любой их комбинации. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых вариантах осуществления изобретения моноклональное антитело к PD-L1 человека выбрано из группы, состоящей из MEDI-4736, BMS-936559, MSB0010718C, MPDL3280A, их антигенсвязывающих фрагментов и любой их комбинации. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых вариантах осуществления изобретения анти-PD-L1 антитело представляет собой AMP-224.
В некоторых вариантах осуществления изобретения моноклональное антитело к CEACAM1 человека представляет собой человеческое или гуманизированное моноклональное антитело. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых вариантах осуществления изобретения моноклональное антитело к PD-1 человека представляет собой человеческое или гуманизированное моноклональное антитело. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых вариантах осуществления изобретения моноклональное антитело к PD-L1 человека представляет собой человеческое или гуманизированное моноклональное антитело. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых вариантах осуществления изобретения моноклональное антитело к PD-L2 человека представляет собой человеческое или гуманизированное моноклональное антитело. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых вариантах осуществления изобретения человеческое антитело представляет собой выделенное человеческое антитело, т.е. полученное от человека-донора. В некоторых вариантах осуществления изобретения человеческое антитело представляет собой человеческое антитело, выделенное из гибридомной клеточной линии. В некоторых вариантах осуществления изобретения термин «человеческое антитело» относится к рекомбинантному человеческому антителу, т.е. полученному при помощи технологии рекомбинантных ДНК.
В некоторых вариантах осуществления изобретения фармацевтические композиции, описанные выше, дополнительно содержат лимфоцит или множество лимфоцитов.
В некоторых вариантах осуществления изобретения лимфоцит экспрессирует CEACAM1, PD-1 или оба этих белка. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых таких вариантах осуществления изобретения лимфоцит экспрессирует CEACAM1 и PD-1.
В некоторых вариантах осуществления изобретения лимфоцит выбран из группы, состоящей из опухоль-инфильтрирующего лимфоцита (ОИЛ), лимфокинактивированной клетки-киллера (ЛАК), цитокин-индуцированной клетки-киллера (ЦИК), T-лимфоцита, B-лимфоцита, NK-клетки и любой их комбинации. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых таких вариантах осуществления изобретения лимфоцит выбран из группы, состоящей из опухоль-инфильтрирующего лимфоцита (ОИЛ) и лимфокинактивированной клетки-киллера (ЛАК). В некоторых таких вариантах осуществления изобретения лимфоцит представляет собой опухоль-инфильтрирующий лимфоцит (ОИЛ) или множество ОИЛ. В некоторых таких вариантах осуществления изобретения лимфоцит представляет собой лимфокинактивированную клетку-киллер (ЛАК) или множество ЛАК клеток.
В некоторых вариантах осуществления изобретения лимфоцит является активированным. В некоторых вариантах осуществления изобретения лимфоцит является цитотоксичным для раковой клетки.
В некоторых вариантах осуществления изобретения раковая клетка экспрессирует CEACAM1, PD-L1, PD-L2 или любую их комбинацию. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых вариантах осуществления изобретения раковая клетка экспрессирует CEACAM1, PD-L1 или оба этих белка. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых вариантах осуществления изобретения раковая клетка экспрессирует CEACAM1, PD-L2 или оба этих белка. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых таких вариантах осуществления изобретения раковая клетка экспрессирует CEACAM1 и PD-L1 и PD-L2.
В некоторых вариантах осуществления изобретения рак выбран из группы, состоящей из меланомы, лимфомы, рака легких, рака щитовидной железы, рака молочной железы, рака толстой кишки, рака предстательной железы, рака печени, рака мочевого пузыря, рака почки, рака шейки матки, рака поджелудочной железы, лейкоза, миелоидного рака, рака яичников, рака матки, саркомы, рака желчного пузыря и рака клеток эндометрия. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых вариантах осуществления изобретения рак выбран из группы, состоящей из меланомы и лимфомы. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых вариантах осуществления изобретения рак представляет собой меланому. В некоторых вариантах осуществления изобретения рак представляет собой лимфому.
В некоторых вариантах осуществления изобретения моноклональное антитело, по меньшей мере, к одной из следующих молекул: PD-1, PD-L1 и PD-L2 человека, способно ингибировать или блокировать взаимодействие между PD-1 человека и его лигандами. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения.
В некоторых вариантах осуществления изобретения способ включает введение указанному пациенту фармацевтической композиции, содержащей моноклональное антитело к CEACAM1 человека или его антигенсвязывающий фрагмент, и фармацевтической композиции, содержащей моноклональное антитело к PD-1 человека или его антигенсвязывающий фрагмент. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения.
В некоторых вариантах осуществления изобретения способ включает введение указанному пациенту фармацевтической композиции, содержащей моноклональное антитело к CEACAM1 человека или его антигенсвязывающий фрагмент, и фармацевтической композиции, содержащей моноклональное антитело к PD-L1 человека или его антигенсвязывающий фрагмент. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения.
В некоторых вариантах осуществления изобретения способ включает введение указанному пациенту фармацевтической композиции, содержащей моноклональное антитело к CEACAM1 человека или его антигенсвязывающий фрагмент, и фармацевтической композиции, содержащей моноклональное антитело к PD-L2 человека или его антигенсвязывающий фрагмент. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения.
В некоторых вариантах осуществления способа настоящего изобретения введение двух или нескольких фармацевтических композиций осуществляется одновременно. В некоторых вариантах осуществления способа настоящего изобретения введение двух или нескольких фармацевтических композиций осуществляется последовательно. В некоторых вариантах осуществления способа настоящего изобретения моноклональное антитело к PD-1 человека или его антигенсвязывающий фрагмент вводится до введения моноклонального антитела к CEACAM1 человека или его антигенсвязывающего фрагмента. В некоторых вариантах осуществления способа настоящего изобретения моноклональное антитело к PD-1 человека или его антигенсвязывающий фрагмент вводится одновременно с моноклональным антителом к CEACAM1 человека или его антигенсвязывающим фрагментом. В некоторых вариантах осуществления способа настоящего изобретения моноклональное антитело к PD-1 человека или его антигенсвязывающий фрагмент вводится после введения моноклонального антитела к CEACAM1 человека или его антигенсвязывающего фрагмента. В некоторых вариантах осуществления способа настоящего изобретения введение двух или нескольких фармацевтических композиций осуществляется одновременно. В некоторых вариантах осуществления способа настоящего изобретения введение двух или нескольких фармацевтических композиций осуществляется последовательно. В некоторых вариантах осуществления способа настоящего изобретения моноклональное антитело к PD-L1 человека или его антигенсвязывающий фрагмент вводится до введения моноклонального антитела к CEACAM1 человека или его антигенсвязывающего фрагмента. В некоторых вариантах осуществления способа настоящего изобретения моноклональное антитело к PD-L1 человека или его антигенсвязывающий фрагмент вводится одновременно с моноклональным антителом к CEACAM1 человека или его антигенсвязывающим фрагментом. В некоторых вариантах осуществления способа настоящего изобретения моноклональное антитело к PD-L1 человека или его антигенсвязывающий фрагмент вводится после введения моноклонального антитела к CEACAM1 человека или его антигенсвязывающего фрагмента. В некоторых вариантах осуществления способа настоящего изобретения моноклональное антитело к PD-L2 человека или его антигенсвязывающий фрагмент вводится до введения моноклонального антитела к CEACAM1 человека или его антигенсвязывающего фрагмента. В некоторых вариантах осуществления способа настоящего изобретения моноклональное антитело к PD-L2 человека или его антигенсвязывающий фрагмент вводится одновременно с моноклональным антителом к CEACAM1 человека или его антигенсвязывающим фрагментом. В некоторых вариантах осуществления способа настоящего изобретения моноклональное антитело к PD-L2 человека или его антигенсвязывающий фрагмент вводится после введения моноклонального антитела к CEACAM1 человека или его антигенсвязывающего фрагмента.
В некоторых вариантах осуществления изобретения описанный выше способ дополнительно включает этап введения указанному пациенту фармацевтической композиции, содержащей лимфоцит. В некоторых вариантах осуществления способа настоящего изобретения введение фармацевтической композиции, содержащей лимфоцит, осуществляется одновременно с, по меньшей мере, одной из фармацевтических композиций, содержащих антитела. В некоторых вариантах осуществления способа настоящего изобретения введение двух или нескольких фармацевтических композиций осуществляется последовательно.
В некоторых вариантах осуществления изобретения лимфоцит предварительно инкубируют с моноклональным антителом к CEACAM1 человека или его антигенсвязывающим фрагментом, или с моноклональным антителом к PD-1 человека или его антигенсвязывающим фрагментом перед введением. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых таких вариантах осуществления изобретения лимфоцит предварительно инкубируют с моноклональным антителом к CEACAM1 человека или его антигенсвязывающим фрагментом, и с моноклональным антителом к PD-1 человека или его антигенсвязывающим фрагментом перед введением. В некоторых других таких вариантах осуществления изобретения перед введением лимфоцит предварительно инкубируют с моноклональным антителом к PD-1 человека или его антигенсвязывающим фрагментом, и затем инкубируют с моноклональным антителом к CEACAM1 человека или его антигенсвязывающим фрагментом.
В некоторых вариантах осуществления изобретения, по меньшей мере, два различных антитела, выбранных из группы, состоящей из анти-CEACAM1, анти-PD-1, анти-PD-L1 и анти-PD-L2, входят в состав, по меньшей мере, двух различных фармацевтических композиций. В некоторых вариантах осуществления изобретения, по меньшей мере, одно антитело, выбранное из группы, состоящей из анти-CEACAM1, анти-PD-1, анти-PD-L1 и анти-PD-L2, и, по меньшей мере, один лимфоцит входят в состав одной и той же фармацевтической композиции.
В некоторых вариантах осуществления изобретения набор реагентов включает фармацевтическую композицию, содержащую моноклональное антитело к CEACAM1 человека или его антигенсвязывающий фрагмент, и фармацевтическую композицию, содержащую моноклональное антитело к PD-1 человека или его антигенсвязывающий фрагмент. В некоторых вариантах осуществления изобретения набор реагентов включает фармацевтическую композицию, содержащую моноклональное антитело к CEACAM1 человека или его антигенсвязывающий фрагмент, и фармацевтическую композицию, содержащую моноклональное антитело к PD-L1 человека или его антигенсвязывающий фрагмент. В некоторых вариантах осуществления изобретения набор реагентов включает фармацевтическую композицию, содержащую моноклональное антитело к CEACAM1 человека или его антигенсвязывающий фрагмент, и фармацевтическую композицию, содержащую моноклональное антитело к PD-L2 человека или его антигенсвязывающий фрагмент.
В некоторых вариантах осуществления изобретения каждая фармацевтическая композиция, содержащая антитело или его антигенсвязывающий фрагмент, находится в наборе реагентов в отдельном контейнере.
В некоторых вариантах осуществления изобретения набор реагентов дополнительно включает фармацевтическую композицию, содержащую лимфоцит. В некоторых таких вариантах осуществления изобретения набор реагентов включает фармацевтическую композицию, содержащую лимфоцит и моноклональное антитело к CEACAM1 человека или его антигенсвязывающий фрагмент, или моноклональное антитело к PD-1 человека или его антигенсвязывающий фрагмент. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых таких вариантах осуществления изобретения набор реагентов включает фармацевтическую композицию, содержащую лимфоцит и моноклональное антитело к CEACAM1 человека или его антигенсвязывающий фрагмент. В некоторых таких вариантах осуществления изобретения набор реагентов включает фармацевтическую композицию, содержащую лимфоцит и моноклональное антитело к PD-1 человека или его антигенсвязывающий фрагмент. В некоторых вариантах осуществления изобретения набор реагентов дополнительно включает инструкции по применению данного набора реагентов.
Краткое описание чертежей
Фигура 1A-B. Клетки меланомы человека экспрессируют CEACAM1 и PD-L1 при активации ИФН-γ. Клетки линии MALME 3M инкубировали с ИФН-γ в течение 24 часов и анализировали при помощи сортировки флуоресцентно-активированных клеток (FACS) с PE-конъюгированным анти-PD-L1 антителом (пустая гистограмма) или соответствующим изотипическим контрольным антителом (закрашенные гистограммы) (A), или с PE-конъюгированным моноклональным антителом к CEACAM1 человека (пустая гистограмма) или соответствующим изотипическим контрольным антителом (закрашенные гистограммы) (B).
Фигура 2A-B. ОИЛ клетки человека экспрессируют CEACAM1 и PD-1. ОИЛ клетки окрашивали моноклональным антителом к PD-1 человека и анализировали при помощи FACS. Представлена экспрессия PD-1 (пустая гистограмма) по сравнению с соответствующим изотипическим контролем (закрашенная гистограмма) (A) или с PE-конъюгированным моноклональным антителом к CEACAM1 человека (пустая гистограмма) или соответствующим изотипическим контрольным антителом (закрашенные гистограммы) (B).
Фигура 3. Синергическое действие анти-CEACAM1 и анти-PD-1 антител на цитотоксичность ОИЛ клеток человека против клеток меланомы человека. Клетки меланомы человека выращивали в присутствии ИФН-γ, чтобы индуцировать экспрессию PD-1. ОИЛ клетки инкубировали с различными концентрациями моноклонального антитела к CEACAM1 человека (черная пунктирная линия, круглый маркер), моноклонального антитела к PD-1 человека (сплошная серая линия, прямоугольный маркер) или комбинации обоих антител (сплошная черная линия, треугольный маркер). Обработанные ИФН-γ клетки меланомы добавляли для инкубации в течение ночи. Результаты представлены в виде среднего значения % цитотоксичности ±СО, которое определяли при помощи классического анализа высвобождения ЛДГ в лунках в трех повторностях на каждую обработку. * P<0,05 парный критерий Стьюдента для сравнения с только моноклональным антителом к CEACAM1 человека.
Фигура 4A-B. Синергическое действие анти-CEACAM1 и анти-PD-1 антител на уровень гранзима B и цитотоксичность ОИЛ клеток человека против клеток меланомы человека, когда анти-PD-1 антитела добавляли перед добавлением анти-CEACAM1 антител. Клетки меланомы человека выращивали в присутствии ИФН-γ, чтобы индуцировать экспрессию PD-L1. ОИЛ клетки человека инкубировали только со средой (черный цвет), неспецифичным IgG антителом (белый цвет), различными концентрациями моноклонального антитела к CEACAM1 человека (вертикальные линии), моноклональным антителом к PD-1 человека (горизонтальные линии) или комбинацией обоих антител (точки).
Сначала добавляли моноклональное антитело к PD-1 человека в течение 30 минут при температуре 37°C с последующим добавлением моноклонального антитела к CEACAM1 человека. Обработанные ИФН-γ клетки MALME 3M добавляли для инкубации в течение ночи. (A) Результаты представлены в виде среднего значения % цитотоксичности ±СО, которое определяли при помощи классического анализа высвобождения ЛДГ в лунках в трех повторностях на каждую обработку. * P≤0,05 парный критерий Стьюдента для сравнения с только анти-PD-1. (B) Результаты представляют собой уровень гранзима B ±СО, который определяли при помощи коммерческого набора реагентов для ИФА гранзима B в лунках в трех повторностях на каждую обработку.
Фигура 5A-B. Синергическое действие анти-CEACAM1 и анти-PD-L1 антител на уровень гранзима B и цитотоксичность ОИЛ клеток человека против клеток меланомы человека, когда анти-PD-L1 антитела добавляли перед добавлением анти-CEACAM1 антител. Клетки меланомы человека выращивали в присутствии ИФН-γ, чтобы индуцировать экспрессию PD-L1. ОИЛ клетки человека инкубировали только со средой (черный цвет), неспецифичным IgG антителом (белый цвет), различными концентрациями моноклонального антитела к PD-L1 человека (горизонтальные линии), моноклональным антителом к CEACAM1 человека (вертикальные линии) или комбинацией обоих антител (точки). Сначала добавляли анти-PD-L1 антитело в течение 30 минут при температуре 37°C с последующим добавлением моноклонального антитела к CEACAM1 человека. Обработанные ИФН-γ клетки MALME 3M добавляли для инкубации в течение ночи. (A) Результаты представлены в виде среднего значения % цитотоксичности ±СО, которое определяли при помощи классического анализа высвобождения ЛДГ в лунках в трех повторностях на каждую обработку. (B) Результаты представляют собой уровень гранзима B ±СО, который определяли при помощи коммерческого набора реагентов для ИФА гранзима B в лунках в трех повторностях на каждую обработку. * P≤0,05 парный критерий Стьюдента для сравнения с только анти-PD-L1.
Фигура 6. Синергическое действие анти-CEACAM1 и анти-PD-1 антител на цитотоксичность ЛАК клеток человека против клеток меланомы человека, когда анти-PD-1 антитела добавляли перед добавлением анти-CEACAM1 антител. Клетки меланомы человека выращивали в присутствии ИФН-γ, чтобы индуцировать экспрессию PD-L1. ЛАК клетки человека, получаемые путем активации полученных от здорового донора МКПК IL-2, инкубировали только со средой (черный цвет), неспецифичным IgG антителом (белый цвет), различными концентрациями моноклонального антитела к CEACAM1 человека (вертикальные линии), моноклональным антителом к PD-1 человека (горизонтальные линии) или комбинацией обоих антител (точки). Сначала добавляли моноклональное антитело к PD-1 человека в течение 30 минут при температуре 37°C с последующим добавлением моноклонального антитела к CEACAM1 человека. Обработанные ИФН-γ клетки SKMEL28 добавляли для инкубации в течение 24 часов. Результаты представлены в виде среднего значения % цитотоксичности ±СО, которое определяли при помощи классического анализа высвобождения ЛДГ в лунках в трех повторностях на каждую обработку. * P≤0,05 парный критерий Стьюдента для сравнения с только анти-PD-1. Показатель аддитивности рассчитывали как описано выше.
Фигура 7A-B. Обработка анти-CEACAM1 антителами повышает экспрессию PD-L1 на раковых клетках-мишенях. NK-клетки (NK92MI) инкубировали в присутствии или без моноклонального антитела к CEACAM1 человека (CM-24) (10 мкг/мл) с последующим добавлением клеток меланомы человека (SKEL28). Клетки инкубировали в течение 24, 48 и 72 часов и измеряли уровень PD-L1 в каждый момент времени при помощи FACS-анализа. A. Среднее соотношение анти-PD-L1 по сравнению с соответствующим изотипическим контролем для указанных обработок в различные моменты времени. B. Репрезентативный FACS-анализ уровней экспрессии PD-L1 после 48 часов.
Фигура 8. Синергическое действие анти-CEACAM1 и анти-PD-1 антител на прогрессирование опухоли у иммунокомпетентных мышей. Мышиные лимфомные клетки подкожно имплантировали в брюшную полость мышей линии BALB/C (День 1). В дни 10, 15 и 20 мышам внутривенно вводили или ФСБ (пунктирная черная линия, пустые кружки), антитело к мышиному CEACAM1 (сплошная серая линия, серые прямоугольники), антитело к мышиному PD-1 (сплошная серая линия, серые треугольники) или комбинацию обоих антител (сплошная черная линия, черные кружки). Эксперимент прекращали в День 22.
Фигура 9A-D. Индивидуальные кривые прогрессирования опухоли. Индивидуальные кривые прогрессирования опухоли для мышей, получавших ФСБ (A), антитело к мышиному CEACAM1 (B), антитело к мышиному PD-1 (C), или комбинацию обоих антител (D).
Подробное описание изобретения
Настоящее изобретение основано на неожиданном открытии, что комбинации анти-CEACAM1 антител и антител, направлено нарушающих связывание PD-1 с его природными лигандами PD-L1 и PD-L2, значительно повышают цитотоксичность лимфоцитов, таких как опухоль-инфильтрирующие лимфоциты (ОИЛ) и лимфокинактивированные клетки-киллеры (ЛАК), в отношении различных типов рака. Также неожиданно было обнаружено, что поэтапная предварительная инкубация лимфоцитов с этими двумя антителами, в отличие от одновременной инкубации, максимизирует цитотоксичность лимфоцитов. Также было обнаружено, что экспрессия CEACAM1 и PD-лигандов на раковых клетках является взаимосвязанной, так как связывание анти-CEACAM1 антител с раковыми клетками повышает экспрессию PD-L1. Кроме того, было обнаружено, что такая комбинация антител значительно ослабляет прогрессирование развившихся опухолей в иммунокомпетентной мышиной модели, предположительно используя естественное окружение мышиных лимфоцитов.
Не ограничиваясь какой-либо теорией или механизмом, на основе данных настоящего изобретения предполагается, что лимфоциты, экспрессирующие CEACAM1 и PD-1 могут в значительной степени подавляться путем взаимодействия со своими соответствующими лигандами и/или PD-L1 и/или PD-L2, которые представляются, например, раковыми клетками. С другой стороны, когда эти подавляющие взаимодействия блокируются, эти лимфоциты могут становиться цитотоксичными по отношению к этим раковым клеткам при активации, что приводит к уничтожению злокачественных клеток.
Таким образом, настоящее изобретение относится к фармацевтической композиции, направленной на блокирование двух основных иммуносупрессивных гомотипических взаимодействий CEACAM1лимфоцит/CEACAM1раковая клетка и PD-1лимфоцит/PD-лигандраковая клетка, и повышение уровня противораковых цитотоксических клеток в организме пациента с диагностированным раком. Не ограничиваясь какой-либо теорией или механизмом, предполагается, что композиции настоящего изобретения образуют «двухходовую» комбинацию, при которой у ракового пациента повышается уровень противораковых цитотоксических лимфоцитов, и при этом их цитотоксичность поддерживается за счет защитного взаимодействия с анти-CEACAM1 антителами и/или анти-PD-1/PD-L1/PD-L2 антителами, связанными с молекулами CEACAM1 и/или PD-1, представляемыми самими лимфоцитами, с молекулами CEACAM1/PD-L1/PD-L2, представляемыми раковыми клеткам, или с тем и другим типом молекул.
Таким образом, в одном аспекте настоящее изобретение относится к фармацевтической композиции, содержащей моноклональное антитело к карциномоэмбриональной антигензависимой молекуле клеточной адгезии 1 человека (CEACAM1) или его антигенсвязывающий фрагмент, и к фармацевтической композиции, содержащей моноклональное антитело, по меньшей мере, к одной из следующих молекул: белок 1 программируемой клеточной смерти человека (PD-1), PD-L1 и PD-L2, или его антигенсвязывающий фрагмент, для применения в лечении рака путем раздельного введения.
В другом аспекте настоящее изобретение также относится к фармацевтической композиции, содержащей моноклональное антитело к карциномоэмбриональной антигензависимой молекуле клеточной адгезии 1 человека (CEACAM1) или его антигенсвязывающий фрагмент, и к фармацевтической композиции, содержащей моноклональное антитело, способное ингибировать или блокировать взаимодействие между белком 1 программируемой клеточной смерти человека (PD-1) и его лигандами, или его антигенсвязывающий фрагмент, для применения в лечении рака путем раздельного введения.
В другом аспекте настоящее изобретение также относится к моноклональному антителу к карциномоэмбриональной антигензависимой молекуле клеточной адгезии 1 человека (CEACAM1) или его антигенсвязывающему фрагменту и к моноклональному антителу, способному ингибировать или блокировать взаимодействие между белком 1 программируемой клеточной смерти человека (PD-1) и его лигандами, или его антигенсвязывающему фрагменту, для применения в лечении рака путем раздельного введения.
В еще одном аспекте настоящее изобретение также относится к способу лечения страдающего раком пациента, включающему введение этому пациенту фармацевтической композиции, содержащей моноклональное антитело к CEACAM1 человека или его антигенсвязывающий фрагмент, и фармацевтической композиции, содержащей моноклональное антитело, по меньшей мере, к одной из следующих молекул: PD-1, PD-L1 и PD-L2 человека, или его антигенсвязывающий фрагмент, осуществляя тем самым лечение рака.
Кроме того, в другом аспекте настоящее изобретение относится к набору реагентов, включающему фармацевтическую композицию, содержащую моноклональное антитело к CEACAM1 человека или его антигенсвязывающий фрагмент, и фармацевтическую композицию, содержащую моноклональное антитело, по меньшей мере, к одной из следующих молекул: PD-1, PD-L1 и PD-L2 человека, или его антигенсвязывающий фрагмент.
В другом аспекте настоящее изобретение относится к вышеописанному набору реагентов для применения в лечении рака.
Используемый здесь термин «раздельное введение» относится к различным терапевтическим агентам, таким как антитела, содержащимся в отдельных фармацевтических композициях. В некоторых вариантах осуществления изобретения различные терапевтические агенты различных фармацевтических композиций вводятся страдающим раком пациентам одновременно или один за другим. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. Например, фраза «моноклональное антитело к CEACAM1 человека и моноклональное антитело к PD-1 человека для применения в лечении рака путем раздельного введения» означает, что анти-CEACAM1 антитело содержится в композиции, которая отличается от композиции, содержащей анти-PD-1 антитело.
Термин «CEACAM1» используется для обозначения белкового продукта гена CEACAM1, например, NP_001020083.1, NP_001703.2. В настоящее время у человека было обнаружено 11 различных вариантов сплайсинга CEACAM1. Отдельные изоформы CEACAM1 различаются количеством внеклеточных иммуноглобулинподобных доменов (например, CEACAM1 с четырьмя внеклеточными иммуноглобулинподобными доменами известен как CEACAM1-4), мембранным якорем и/или длиной своих цитоплазматических концевых доменов (например, CEACAM1-4 с длинным цитоплазматическим концевым доменом известен как CEACAM1-4L, а CEACAM1-4 с коротким цитоплазматическим концевым доменом известен как CEACAM1-4S). N-концевой домен CEACAM1 начинается непосредственно после сигнального пептида, и его структура рассматривается как IgV-тип. Например, в CEACAM1, аннотированном как P13688, N-концевой домен IgV-типа состоит из 108 аминокислот, от аминокислоты 35 до 142. Этот домен был идентифицирован как отвечающий за гомофильную связывающую активность (Watt et al., 2001, Blood. 98, 1469-79). Все варианты, в том числе эти варианты сплайсинга, включены в термин «CEACAM1».
Используемый здесь термин «фармацевтическая композиция» относится к композиции, содержащей, по меньшей мере, один биологически активный ингредиент. Антитела, их антигенсвязывающие фрагменты и лимфоциты являются неограничивающими примерами биологически активных ингредиентов.
Термин «антитело» используется в самом широком смысле и включает моноклональные антитела (включая полноразмерные или интактные моноклональные антитела), поликлональные антитела, поливалентные антитела, мультиспецифичные антитела (например, биспецифичные антитела), иммуномодулирующие агенты и фрагменты антител, имеющие размер, достаточный для того чтобы сохранять и проявлять необходимую биологическую активность полноразмерного антитела.
Термины «иммуномодулирующий агент» или «иммуномодулирующий белок» или «фрагмент антитела» используются взаимозаменяемо и включают синтетические или генно-инженерные белки, которые действуют как антитела путем связывания со специфичным антигеном с образованием комплекса. Например, фрагменты антител включают выделенные фрагменты, состоящие из вариабельных областей, такие как Fv-фрагменты, состоящие из вариабельных областей тяжелой и легкой цепей, и рекомбинантные одноцепочечные полипептидные молекулы, в которых вариабельные области тяжелой и легкой цепей соединены пептидным линкером («scFv белки»). Фрагменты могут быть сконструированы различными способами с получением поливалентных и/или мультиспецифичных связывающихся форм. Антитело или антитела в соответствии с настоящим изобретением включают интактные антитела, такие как поликлональные антитела или моноклональные антитела (mAbs), а также их протеолитические фрагменты, такие как фрагменты Fc, Fab или F(ab')2. Также в объем настоящего изобретения включены гибридные антитела; человеческие и гуманизированные антитела; рекомбинантные и сконструированные антитела и их фрагменты.
«Моноклональное антитело к CEACAM1 человека», «антитело, которое распознает CEACAM1», «антитело против CEACAM1» или «антитело к CEACAM1» представляет собой антитело, которое связывается с белком CEACAM1 с достаточной аффинностью и специфичностью. Как правило, моноклональное антитело к CEACAM1 человека способно связываться с CEACAM1 с минимальной аффинностью примерно 10-8 или 10-9М. Некоторые из моноклональных анти-CEACAM1 антител способны связываться с CEACAM3, 5 и/или 8 с минимальной аффинностью примерно 5×10-7М. В некоторых вариантах осуществления изобретения моноклональное антитело к CEACAM1 человека способно предотвращать, мешать или разрушать взаимодействие между CEACAM1, представляемым лимфоцитами, и CEACAM1, представляемым раковыми клетками.
Используемый здесь термин «нейтрализующее антитело» относится к молекуле, имеющей антигенсвязывающей сайт со специфичным рецептором или лигандом-мишенью, способной уменьшать или ингибировать (блокировать) активность или передачу сигнала через рецептор, что определяется в анализе in vivo или in vitro в соответствии со спецификацией.
Используемый здесь термин «моноклональное антитело» относится к антителу, полученному из популяции в значительной степени однородных антител, т.е. отдельные антитела, составляющие популяцию, являются идентичными за исключением возможных встречающихся в природе мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела являются высокоспецифичными, направленными против одного антигена. Кроме того, в отличие от препаратов поликлональных антител, которые, как правило, включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. Определение «моноклональное» не следует рассматривать как требующее получение антитела каким-либо конкретным способом. Моноклональные Abs могут быть получены способами, известными специалистам в данной области техники. Например, моноклональные антитела для применения в соответствии с настоящим изобретением могут быть получены при помощи гибридомной технологии, впервые описанной в Kohler et al., Nature 1975, 256, 495, или они могут быть получены при помощи технологий рекомбинантных ДНК (см., например, Патент США No.4816567). Моноклональные антитела также могут быть выделены из фаговых библиотек антител, например, при помощи методов, описанных в Clackson et al., Nature 1991, 352, 624-628 или Marks et al., J. Mol. Biol., 1991, 222: 581-597.
Используемый здесь термин «множество» относится к двум или более указанным объектам.
mAb могут быть иммуноглобулинами любого класса, включая IgG, IgM, IgE, IgA. Продуцирующая mAb гибридома может культивироваться in vitro или in vivo. Высокие титры mAbs могут быть получены продуцированием в условиях in vivo, когда клетки из отдельных гибридом вводят внутрибрюшинно первоначально примированным мышам линии BALB/c для получения асцитической жидкости, содержащей высокие концентрации соответствующих mAbs. Моноклональные Abs изотипа IgM или IgG могут быть очищены из таких асцитических жидкостей или из культуральных супернатантов при помощи способов колоночной хроматографии, хорошо известных специалистам в данной области техники.
Термин «антигенная детерминанта» или «эпитоп» в соответствии с настоящим изобретением относится к области молекулы антигена, которая специфично взаимодействует с конкретным антителом. «Антиген» представляет собой молекулу или часть молекулы, которая способна индуцировать образование антител, и которая связывается антителом. Антиген может иметь один или более одного эпитопа. В соответствии с настоящим изобретение антиген представляет собой белок CEACAM1 или его фрагмент.
Антитела или иммуноглобулины содержат две тяжелые цепи, соединенные друг с другом дисульфидными связями, и две легкие цепи, каждая легкая цепь соединена с соответствующей тяжелой цепью дисульфидными связями в Y-образной конфигурации. Протеолитическое расщепление антитела приводит к образованию Fv (вариабельный фрагмент) и Fc (кристаллический фрагмент) доменов. Антигенсвязывающие домены Fab включают области с изменяющейся полипептидной последовательностью. Термин F(ab')2 относится к двум Fab'-областям, соединенных друг с другом дисульфидными связями. Центральная ось антитела называется Fc-фрагмент. Каждая тяжелая цепь имеет на одном конце вариабельный домен (VH), за которым следует ряд константных доменов (CH). Каждая легкая цепь имеет вариабельный домен (VL) на одном конце и константный домен (CL) на другом своем конце, вариабельный домен легкой цепи совмещается в пространстве с вариабельным доменом тяжелой цепи, а константный домен легкой цепи совмещается в пространстве с первым константным доменом тяжелой цепи (CH1). Вариабельные домены каждой пары легкой и тяжелой цепей образуют антигенсвязывающий сайт. Домены легкой и тяжелой цепей имеют одинаковую общую структуру, и каждый домен содержит четыре каркасные области, последовательности которых являются относительно консервативными, соединенные тремя гипервариабельными доменами, известными как определяющие комплементарность области (CDR1-3). Эти домены способствуют специфичности и аффинности антигенсвязывающего сайта. Изотип тяжелой цепи (гамма, альфа, дельта, эпсилон или мю) определяет класс иммуноглобулина (IgG, IgA, IgD, IgE или IgM, соответственно). Легкая цепь бывает одного из двух изотипов (каппа, κ или лямбда, λ), обнаруженных во всех классах антител.
Используемые здесь термины «моноклональное антитело к CEACAM1 человека», «моноклональное антитело к PD-1 человека», «анти-PD-L1 антитело» и «анти-PD-L2 антитело» относятся к полноразмерным молекулам иммуноглобулина, например, IgMs, IgDs, IgEs, IgAs или IgGs, антигенсвязывающим доменам таких молекул иммуноглобулина, например, Fab-фрагментам, Fab'-фрагментам, F(ab)2-фрагментам, гибридным F(ab)2 или гибридным Fab' фрагментам, гибридным Fab-фрагментам или выделенным VH или CDR-областям, и известным изоформам и модификациям иммуноглобулинов, например, одноцепочечным антителам или одноцепочечным Fv-фрагментам (scAB/scFv) или биспецифичным конструкциям антител, способным связываться со своими указанными мишенями. Используемые здесь термины «анти-человеческий CEACAM1 антитело», «анти-человеческий PD-1 антитело», «моноклональное антитело к PD-L1 человека» и «моноклональное антитело к PD-L2 человека» относятся к антителам, способным связываться со своими указанными мишенями, когда эти мишени человеческого происхождения.
Термины «антигенсвязывающий фрагмент антитела» и «антигенсвязывающий фрагмент» используются здесь взаимозаменяемо и относятся к одному или нескольким фрагментам антитела, которые сохраняют способность специфично связываться с раскрытым антигеном. Например, антигенсвязывающий фрагмент может включать без ограничений Fab-фрагмент, F(ab')2-фрагмент, scFV-фрагмент, dAb-фрагмент, CDR-содержащий фрагмент или выделенную CDR. Таким образом, антигенсвязывающий фрагмент моноклонального антитела к CEACAM1 человека может представлять собой, например, Fab-фрагмент моноклонального антитела к CEACAM1 человека или любую молекулу, которая имитирует последовательности и структуру такого Fab-фрагмента, без непосредственного получения из моноклонального антитела к CEACAM1 человека, например путем химического или ферментативного расщепления.
«Фрагменты антитела» включают только часть интактного антитела, как правило, включающую антигенсвязывающий сайт интактного антитела и таким образом сохраняющую способность связываться с антигеном. Примеры фрагментов антитела, охватываемых настоящим определением, включают : (i) Fab-фрагмент, имеющий VL, CL, VH и CH1 домены; (ii) Fab'-фрагмент, который представляет собой Fab-фрагмент, имеющий один или несколько остатков цистеина на C-конце CH1 домена; (iii) Fd-фрагмент, имеющий VH и CH1 домены; (iv) Fd'-фрагмент, имеющий VH и CH1 домены и один или несколько остатков цистеина на C-конце CH1 домена; (v) Fv-фрагмент, имеющий VL и VH домены одного плеча антитела; (vi) dAb-фрагмент (Ward et al., Nature 1989, 341, 544-546), который состоит из VH домена; (vii) выделенные CDR области; (viii) F(ab')2-фрагменты, двухвалентный фрагмент, включающий два Fab'-фрагмента, соединенных дисульфидным мостиком в шарнирной области; (ix) молекулы одноцепочечных антител (например, одноцепочечный Fv; scFv) (Bird et al., Science 1988, 242, 423-426; и Huston et al, PNAS (USA) 1988, 85, 5879-5883). (x) «диатела» с двумя антигенсвязывающими сайтами, содержащие вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL) в составе одной полипептидной цепи (см., например, Европейский патент EP404097; Международную патентную заявку WO93/11161; и Hollinger et al, Proc. Natl. Acad. Sci. USA, 1993, 90, 6444-6448); (xi) «линейные антитела», содержащие пару тандемных Fd-сегментов (VH-CH1-VH-CH1), которые вместе с комплементарными полипептидами легких цепей образуют пару антигенсвязывающих областей (Zapata et al. Protein Eng., 1995, 8, 1057-1062; и Патент США No.5641870).
Термин «одноцепочечный вариабельный фрагмент (scFv)» означает слияние вариабельных областей тяжелой и легкой цепей иммуноглобулина, соединенных друг с другом коротким (как правило, сериновым, глициновым) линкером. Одноцепочечные антитела могут представлять собой одноцепочечные составные полипептиды, обладающие антигенсвязывающими свойствами и содержащие аминокислотные последовательности, гомологичные или аналогичные вариабельным областям легкой и тяжелой цепей иммуноглобулина (соединенные VH-VL или одноцепочечный Fv (scFv)). Как VH, так и VL могут копировать последовательности существующего в природе моноклонального антитела, или одна или обе цепи могут содержать конструкцию типа CDR-FR, описанную в Патенте США No.5091513, полное содержание которого включено в настоящее изобретение путем ссылки. Отдельные полипептиды, аналогичные вариабельным областям легкой и тяжелой цепей, удерживаются вместе при помощи полипептидного линкера. Способы получения таких одноцепочечных антител, в частности, где известны ДНК, кодирующие полипептидные структуры VH и VL цепей, могут быть осуществлены в соответствии со способами, описанными, например, в Патентах США Nos. 4946778, 5091513 и 5096815, полное содержание каждого из которых включено в настоящее изобретение путем ссылки.
Одноцепочечные антитела могут представлять собой одноцепочечные составные полипептиды, обладающие антигенсвязывающими свойствами и содержащие аминокислотные последовательности, гомологичные или аналогичные вариабельным областям легкой и тяжелой цепей иммуноглобулина, т.е. соединенные VH-VL или одноцепочечный Fv (scFv).
Предполагается, что используемый здесь термин «молекула, имеющая антигенсвязывающую часть антитела» включает не только интактные молекулы иммуноглобулинов любого изотипа и продуцируемые любой животной клеточной линией или микроорганизмом, но также их антигенсвязывающую реактивную часть, включая без ограничений Fab-фрагмент, Fab'-фрагмент, F(ab')2-фрагмент, вариабельную часть их тяжелой и/или легкой цепей, Fab-миниантитела (см. Международные патентные заявки WO93/15210, WO96/13583, WO96/37621, полное содержание которых включено в настоящее изобретение путем ссылки), димерные биспецифичные миниантитела (см. Muller et al., 1998) и гибридные или одноцепочечные антитела, включающие такую реактивную часть, а также любой другой тип молекулы или клетку, в которую такая реактивная часть антитела была физически встроена, например гибридный T-клеточный рецептор или T-клетка, имеющая такой рецептор, или молекулы, сконструированные для доставки терапевтических веществ при помощи части молекулы, содержащей такую реактивную часть. Такие молекулы могут быть получены любым известным способом, включая без ограничений ферментативное расщепление, пептидный синтез или рекомбинантные технологии.
Используемый здесь термин «антиген» относится к молекуле или части молекулы, которая способна индуцировать образование антител, и/или которая связывается антителом. Антиген может иметь один или более одного эпитопа. Например, каждый из белков CEACAM1, PD-1, PD-L1 и/или PD-L2 в настоящем изобретении рассматривается как антиген. В предпочтительных вариантах осуществления изобретения антигены представляют собой человеческие антигены.
Используемый здесь термин «антитело, способное ингибировать или блокировать взаимодействие между PD-1 и его лигандами» относится к антителу или его антигенсвязывающему фрагменту, которое затрудняет, ингибирует, уменьшает, устраняет или предотвращает взаимодействие между молекулой PD-1, например, представляемой лимфоцитом, и молекулой PD-L1 и/или PD-L2, например, представляемой раковой клеткой, в некоторых случаях путем химического и/или физического взаимодействия с PD-1 и/или PD-L1 и/или PD-L2.
Используемый здесь термин «лечение рака» относится к введению терапевтически эффективных количеств агентов, таких как антитела и/или лимфоциты, пациенту с диагностированным раком для подавления дальнейшего роста злокачественных клеток у этого пациента, для подавления распространения злокачественных клеток в организме пациента, и/или для индуцирования гибели злокачественных клеток у этого пациента. Таким образом, в некоторых вариантах осуществления изобретения лечение рака означает ослабление прогрессирования опухоли, подавление распространения злокачественных клеток в организме пациента, индуцирование гибели злокачественных клеток у пациента и любую их комбинацию. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых вариантах осуществления изобретения лечение рака означает ослабление прогрессирования опухоли, индуцирование гибели злокачественных клеток у пациента или оба этих эффекта.
Термин «терапевтически эффективное количество» относится к количеству лекарственного средства, эффективному для лечения заболевания или патологии у млекопитающего. В случае рака терапевтически эффективное количество лекарственного средства может уменьшать количество раковых клеток; уменьшать размер опухоли; подавлять (т.е. замедлять до некоторой степени и предпочтительно останавливать) инфильтрацию раковых клеток в периферические органы; подавлять (т.е. замедлять до некоторой степени и предпочтительно останавливать) метастазирование опухоли; подавлять до некоторой степени рост опухоли; и/или облегчать до некоторой степени один или несколько симптомов, связанных с этой патологией. В зависимости от того, в какой степени лекарственное средство может предотвращать рост и/или уничтожать существующие раковые клетки, оно может быть цитостатическим и/или цитотоксическим. Для терапии рака эффективность in vivo может быть измерена, например, путем оценки продолжительности выживания, времени до прогрессирования заболевания (ВПЗ), частоты случаев положительного клинического ответа (ЧСПКО), продолжительности ответа и/или качества жизни.
Термины «рак» и «раковый» относятся или описывают физиологическое состояние у млекопитающего, которое, как правило, характеризуется неконтролируемым ростом клеток. Примеры рака включают без ограничений карциному, лимфому, бластому, саркому и лейкоз. Более конкретные примеры таких видов рака включают меланому, рак легких, рак щитовидной железы, рак молочной железы, рак толстой кишки, рак предстательной железы, рак печени, рак мочевого пузыря, рак почки, рак шейки матки, рак поджелудочной железы, лейкоз, лимфому, миелоидный рак, рак яичников, рак матки, саркому, рак желчного пузыря или рак клеток эндометрия.
Термин «противоопухолевая композиция» относится к композиции, применяемой для лечения рака, содержащей, по меньшей мере, один активный терапевтический агент, способны подавлять или предотвращать рост или функционирование опухоли, и/или вызывающий разрушение опухолевых клеток. Терапевтические агенты, подходящие для использования в противоопухолевой композиции для лечения рака включают без ограничений химиотерапевтические агенты, радиоактивные изотопы, токсины, цитокины, такие как интерфероны, и антагонистические агенты, направленные на цитокины, рецепторы цитокинов или антигены, связанные с опухолевыми клетками.
Используемый здесь термин «набор реагентов» относится к комбинации реагентов и других материалов. Предполагается, что набор реагентов может включать такие реагенты, как антитела, смеси антител, буферы, разбавители и другие водные растворы, и/или один или несколько флаконов для хранения или других контейнеров. Не предполагается, что термин «набор реагентов» ограничивается конкретной комбинацией реагентов и/или других материалов.
Настоящее изобретение также относится к фармацевтическим композициям, направленным на блокирование двух основных иммуносупрессивных взаимодействий: CEACAM1лимфоцит/CEACAM1раковая клетка и PD-1лимфоцит/PD-лигандраковая клетка. Таким образом, в некоторых вариантах осуществления изобретения фармацевтические композиции содержат моноклональное антитело к CEACAM1 человека или его антигенсвязывающий фрагмент и моноклональное антитело к PD-1 человека или его антигенсвязывающий фрагмент. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых вариантах осуществления изобретения фармацевтические композиции содержат моноклональное антитело к CEACAM1 человека или его антигенсвязывающий фрагмент и моноклональное антитело к PD-L1 человека или его антигенсвязывающий фрагмент. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых вариантах осуществления изобретения фармацевтические композиции содержат моноклональное антитело к CEACAM1 человека или его антигенсвязывающий фрагмент и моноклональное антитело к PD-L2 человека или его антигенсвязывающий фрагмент. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых вариантах осуществления изобретения фармацевтические композиции содержат моноклональное антитело к CEACAM1 человека или его антигенсвязывающий фрагмент, моноклональное антитело к PD-1 человека или его антигенсвязывающий фрагмент и моноклональное антитело к PD-L1 человека или его антигенсвязывающий фрагмент. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых вариантах осуществления изобретения фармацевтические композиции содержат моноклональное антитело к CEACAM1 человека или его антигенсвязывающий фрагмент, моноклональное антитело к PD-1 человека или его антигенсвязывающий фрагмент и моноклональное антитело к PD-L2 человека или его антигенсвязывающий фрагмент. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения.
В одном аспекте настоящее изобретение относится к фармацевтической композиции, содержащей моноклональное антитело к CEACAM1 человека или его антигенсвязывающий фрагмент и моноклональное антитело, выбранное из группы, состоящей из антитела к PD-1 человека или его антигенсвязывающего фрагмента, антитела к PD-L1 человека или его антигенсвязывающего фрагмента и антитела к PD-L2 человека или его антигенсвязывающего фрагмента. В некоторых вариантах осуществления фармацевтическая композиция содержит моноклональное антитело к CEACAM1 человека или его антигенсвязывающий фрагмент и моноклональное антитело к PD-1 человека или его антигенсвязывающий фрагмент. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых вариантах осуществления фармацевтическая композиция содержит моноклональное антитело к CEACAM1 человека или его антигенсвязывающий фрагмент и моноклональное антитело к PD-L1 человека или его антигенсвязывающий фрагмент. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых вариантах осуществления фармацевтическая композиция содержит моноклональное антитело к CEACAM1 человека или его антигенсвязывающий фрагмент и моноклональное антитело к PD-L2 человека или его антигенсвязывающий фрагмент. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых вариантах осуществления фармацевтическая композиция содержит моноклональное антитело к CEACAM1 человека или его антигенсвязывающий фрагмент, моноклональное антитело к PD-1 человека или его антигенсвязывающий фрагмент и моноклональное антитело к PD-L1 человека или его антигенсвязывающий фрагмент. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых вариантах осуществления фармацевтическая композиция содержит моноклональное антитело к CEACAM1 человека или его антигенсвязывающий фрагмент, моноклональное антитело к PD-1 человека или его антигенсвязывающий фрагмент и моноклональное антитело к PD-L2 человека или его антигенсвязывающий фрагмент. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения.
Фраза «фармацевтические композиции содержат антитело A и антитело B» относится, по меньшей мере, к двум отдельным фармацевтическим композициям, каждая из которых содержит, по меньшей мере, одно антитело, которое отличается от антитела, содержащегося в другой фармацевтической композиции. Фраза «фармацевтическая композиция содержит» относится к одной фармацевтической композиции, содержащей, по меньшей мере, два различных антитела.
Многие моноклональные антитела против белка CEACAM1 уже известны, все они рассматриваются как подходящие для использования в композициях и способах настоящего изобретения. Тем не менее, в некоторых вариантах осуществления изобретения моноклональное антитело к CEACAM1 человека выбрано из группы, состоящей из CM-24, 26H7, 5F4, TEC-11, 12-140-4, 4/3/17, COL-4, F36-54, 34B1, YG-C28F2, D14HD11, b18.7.7, D11-AD11, HEA81, B1.1, CLB-gran-10, F34-187, T84.1, B6.2, B1.13, YG-C94G7, 12-140-5, scFv DIATHIS1 и TET-2, их антигенсвязывающих фрагментов и любой их комбинации. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения.
В конкретном варианте осуществления изобретения моноклональное антитело к CEACAM1 человека представляет собой CM-24, его антигенсвязывающие фрагменты и любую их комбинацию. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения.
CDR-сегменты CM-24 идентифицировали методами, использующими два разных алгоритма:
1. IMGT алгоритм (Lefranc et al, 1999, Nucleic Acids Research, 27, 209-212);
2. KABAT алгоритм (Wu T.T. and Kabat E.A., 1970, J. Exp. Med. 132, 211-250).
В Таблице 1 приведены последовательности CDR, определенные при помощи этих двух методов, а также минимальная консенсусная последовательность и комбинированная последовательность для последовательностей, идентифицированных при помощи обоих методов.
Последовательности CDR
В некоторых вариантах осуществления изобретения монклональное антитело ли его фрагмент, который распознает CEACAM1, содержит, по меньшей мере, одну CDR тяжелой цепи, содержащую последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 2 и SEQ ID NO: 3, и, по меньшей мере, одну CDR легкой цепи, содержащую последовательность, выбранную из группы, состоящей из SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения.
В некоторых вариантах осуществления изобретения моноклональное антитело или его фрагмент, который распознает CEACAM1, содержит, по меньшей мере, две CDRs тяжелой цепи, содержащие последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 2 и SEQ ID NO: 3, и, по меньшей мере, одну CDR легкой цепи, содержащую последовательность, выбранную из группы, состоящей из SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения.
В некоторых вариантах осуществления изобретения моноклональное антитело или его фрагмент, который распознает CEACAM1, содержит, по меньшей мере, одну последовательность CDR тяжелой цепи, имеющую, по меньшей мере, пять последовательных аминокислот, полученных из последовательности, выбранной из группы, состоящей SEQ ID NO: 19, SEQ ID NO: 20 и SEQ ID NO: 21, и, по меньшей мере, одну последовательность CDR легкой цепи, имеющую, по меньшей мере, пять аминокислот, полученных из последовательности, выбранной из группы, состоящей SEQ ID NO: 22, SEQ ID NO: 23 и SEQ ID NO: 24. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения.
В некоторых вариантах осуществления изобретения сайт связывания моноклонального антитела или его фрагмента, который распознает CEACAM1, состоит из шести CDRs, имеющих последовательности SEQ ID NOs: 1, 2, 3, 4, 5 и 6. В некоторых вариантах осуществления изобретения сайт связывания моноклонального антитела или его фрагмента, который распознает CEACAM1, состоит из шести CDRs, имеющих последовательности SEQ ID NOs: 7, 8, 9, 10, 11 и 12. В некоторых вариантах осуществления изобретения сайт связывания моноклонального антитела или его фрагмента, который распознает CEACAM1, состоит из шести CDRs, имеющих последовательности SEQ ID NOs: 13, 14, 15, 16, 17 и 18. В некоторых вариантах осуществления изобретения сайт связывания моноклонального антитела или его фрагмента, который распознает CEACAM1, состоит из шести CDRs, имеющих последовательности SEQ ID NOs: 19, 20, 21, 22, 23 и 24.
В некоторых вариантах осуществления изобретения моноклональное антитело или его антигенсвязывающий фрагмент, который распознает CEACAM1 человека, содержит CDR1 тяжелой цепи, содержащую последовательность, представленную в SEQ ID NO: 1, CDR2 тяжелой цепи, содержащую последовательность, представленную в SEQ ID NO: 2, CDR3 тяжелой цепи, содержащую последовательность, представленную в SEQ ID NO: 3, CDR1 легкой цепи, содержащую последовательность, представленную в SEQ ID NO: 4, CDR2 легкой цепи, содержащую последовательность, представленную в SEQ ID NO: 5, и CDR3 легкой цепи, содержащую последовательность, представленную в SEQ ID NO: 6, и их аналоги и производные.
В некоторых вариантах осуществления изобретения моноклональное антитело или его антигенсвязывающий фрагмент, который распознает CEACAM1 человека, содержит CDR1 тяжелой цепи, имеющую последовательность, представленную в SEQ ID NO: 7, CDR2 тяжелой цепи, имеющую последовательность, представленную в SEQ ID NO: 8, и CDR3 тяжелой цепи, имеющую последовательность, представленную в SEQ ID NO: 9. В некоторых вариантах осуществления изобретения моноклональное антитело или его антигенсвязывающий фрагмент, который распознает CEACAM1 человека, содержит CDR1 тяжелой цепи, имеющую последовательность, представленную в SEQ ID NO: 13, CDR2 тяжелой цепи, имеющую последовательность, представленную в SEQ ID NO: 14, и CDR3 тяжелой цепи, имеющую последовательность, представленную в SEQ ID NO: 15.
В некоторых вариантах осуществления изобретения моноклональное антитело или его антигенсвязывающий фрагмент, который распознает CEACAM1 человека, содержит CDR1 легкой цепи, имеющую последовательность, представленную в SEQ ID NO: 10, CDR2 легкой цепи, имеющую последовательность, представленную в SEQ ID NO: 11, и CDR3 легкой цепи, имеющую последовательность, представленную в SEQ ID NO: 12. В некоторых вариантах осуществления изобретения моноклональное антитело или его антигенсвязывающий фрагмент, который распознает CEACAM1 человека, содержит CDR1 легкой цепи, имеющую последовательность, представленную в SEQ ID NO: 16, CDR2 легкой цепи, имеющую последовательность, представленную в SEQ ID NO: 17, и CDR3 легкой цепи, имеющую последовательность, представленную в SEQ ID NO: 18.
В некоторых вариантах осуществления изобретения моноклональное антитело или его антигенсвязывающий фрагмент, который распознает CEACAM1 человека, содержит последовательности CDR, представленные в SEQ ID NOs: 13, 14, 15, 16, 17 и 18. В некоторых вариантах осуществления изобретения моноклональное антитело или его антигенсвязывающий фрагмент, который распознает CEACAM1 человека, содержит последовательности CDR, представленные в SEQ ID NOs: 7, 8, 9, 10, 11 и 12.
В некоторых вариантах осуществления изобретения моноклональное антитело или его антигенсвязывающий фрагмент, который распознает CEACAM1 человека, содержит последовательность вариабельного домена тяжелой цепи, имеющую последовательность, представленную в SEQ ID NO: 25, или ее аналог или производное, имеющие, по меньшей мере, 97% идентичности по последовательности с указанной последовательностью тяжелой цепи. В некоторых вариантах осуществления изобретения моноклональное антитело или его антигенсвязывающий фрагмент, который распознает CEACAM1 человека, содержит последовательность вариабельного домена легкой цепи, имеющую последовательность, представленную в SEQ ID NO: 26, или ее аналог или производное, имеющие, по меньшей мере, 97% идентичности по последовательности с указанной последовательностью легкой цепи. В некоторых вариантах осуществления изобретения моноклональное антитело или его антигенсвязывающий фрагмент, который распознает CEACAM1 человека, содержит вариабельный домен тяжелой цепи, имеющий последовательность, представленную в SEQ ID NO: 25, и вариабельный домен легкой цепи, имеющий последовательность, представленную в SEQ ID NO: 26, или их аналог или производное, имеющие, по меньшей мере, 97% идентичности по последовательности с последовательностью антитела или фрагмента.
В некоторых вариантах осуществления изобретения моноклональное антитело или его антигенсвязывающий фрагмент, который распознает CEACAM1 человека, содержит:
i. каркасную последовательность, выбранную из группы, состоящей из мышиного IgG2a, мышиного IgG2b, мышиного IgG3, IgG1 человека, IgG2 человека, IgG3 человека; и
ii. шесть CDRs, имеющих последовательности, представленные в SEQ ID NOs: 13, 14, 1, 16, 17 и 18; или шесть CDRs, имеющих последовательности, представленные в SEQ ID NOs: 7, 8, 9, 10, 11 и 12; и их аналоги и производные, имеющие, по меньшей мере, 97% идентичности по последовательности с указанными последовательностями CDR, где это моноклональное антитело или фрагмент связывается с аффинностью, по меньшей мере, 5×10-7М с, по меньшей мере, двумя подтипами CEACAM.
В некоторых вариантах осуществления изобретения моноклональное антитело или его антигенсвязывающий фрагмент, который распознает CEACAM1 человека, содержит полученные от человека константные области, выбранные из группы, состоящей из IgG1 человека, IgG2 человека, IgG3 человека. В некоторых вариантах осуществления изобретения человеческое или гуманизированное моноклональное антитело или его антигенсвязывающий фрагмент, который распознает CEACAM1 человека, содержит константную область подкласса подтипа IgG1 человека.
В некоторых вариантах осуществления изобретения человеческое или гуманизированное моноклональное антитело или его антигенсвязывающий фрагмент, который распознает CEACAM1 человека, содержит шесть CDRs, имеющих последовательности, представленные в SEQ ID NOs: 13, 14, 1, 16, 17 и 18; или шесть CDRs, имеющих последовательности, представленные в SEQ ID NOs: 7, 8, 9, 10, 11 и 12; и их аналоги и производные, имеющие, по меньшей мере, 97% идентичности по последовательности с указанными последовательностями CDR, где это моноклональное антитело связывается с аффинностью, по меньшей мере, 10-8М с CEACAM1.
В некоторых вариантах осуществления изобретения человеческое или гуманизированное моноклональное антитело или его антигенсвязывающий фрагмент, который распознает CEACAM1 человека, содержит последовательность тяжелой цепи, представленную в SEQ ID NO: 27. В некоторых вариантах осуществления изобретения человеческое или гуманизированное моноклональное антитело или его антигенсвязывающий фрагмент, который распознает CEACAM1 человека, содержит последовательность легкой цепи, представленную в SEQ ID NO: 28. В некоторых вариантах осуществления изобретения человеческое или гуманизированное моноклональное антитело или его антигенсвязывающий фрагмент, который распознает CEACAM1 человека, содержит последовательность тяжелой цепи, представленную в SEQ ID NO: 27, и последовательность легкой цепи, представленную в SEQ ID NO: 28.
В некоторых вариантах осуществления изобретения моноклональное антитело или его антигенсвязывающий фрагмент, который распознает CEACAM1 человека, содержит, по меньшей мере, антигенсвязывающую часть, которая способна связываться с тем же эпитопом на молекуле CEACAM1, с которым связывается моноклональное антитело, имеющее шесть последовательностей CDR, представленных в SEQ ID NOs: 7, 8, 9, 10, 11 и 12; или шесть последовательностей CDR, представленных в SEQ ID NOs: 13, 14, 15, 16, 17 и 18. В некоторых вариантах осуществления изобретения моноклональное антитело или его антигенсвязывающий фрагмент взаимодействует с эпитопом в пределах остатков 17-29 и 68-79 CEACAM1 человека, что соответствует последовательностям VLLLVHNLPQQLF (SEQ ID NO: 32) и YPNASLLIQNVT (SEQ ID NO: 33), соответственно.
В некоторых вариантах осуществления изобретения моноклональное антитело или его антигенсвязывающий фрагмент взаимодействует с эпитопом, содержащим, по меньшей мере, четыре аминокислоты последовательности VLLLVHNLPQQLF (SEQ ID NO: 29). В некоторых вариантах осуществления изобретения моноклональное антитело или его антигенсвязывающий фрагмент взаимодействует с эпитопом, содержащим аминокислотные остатки в последовательностях VLLLVHNLPQQLF (SEQ ID NO: 29) и YPNASLLIQNVT (SEQ ID NO: 30). В некоторых вариантах осуществления изобретения моноклональное антитело или его антигенсвязывающий фрагмент взаимодействует с эпитопом в пределах последовательностей VLLLVHNLPQQLF (SEQ ID NO: 29) и PNASLLI (SEQ ID NO: 31).
В некоторых вариантах осуществления изобретения моноклональное антитело к CEACAM1 человека или его антигенсвязывающий фрагмент способно связываться с аффинностью, по меньшей мере, примерно 10-8М с белком CEACAM1 человека. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых вариантах осуществления изобретения моноклональное антитело к CEACAM1 человека или его антигенсвязывающий фрагмент способно связываться с аффинностью, по меньшей мере, примерно 5×10-7М, по меньшей мере, с одним из следующих белков: белок CEACAM3 человека и белок CEACAM5 человека. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения.
Несколько моноклональных антител против белка PD-1 уже известно, все они рассматриваются как подходящие для использования в композициях и способах настоящего изобретения. Тем не менее, в некоторых вариантах осуществления изобретения моноклональное антитело к PD-1 человека выбрано из группы, состоящей из MK-3475, AMP514, BMS-936558, CT-011, их антигенсвязывающих фрагментов и любой их комбинации. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения.
Несколько моноклональных антител против белка PD-L1 уже известно, все они рассматриваются как подходящие для использования в композициях и способах настоящего изобретения. Тем не менее, в некоторых вариантах осуществления изобретения моноклональное антитело к PD-L1 человека выбрано из группы, состоящей из MEDI-4736, BMS-936559, MSB0010718C, MPDL3280A, их антигенсвязывающих фрагментов и любой их комбинации. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. Неограничивающим примером антитела в соответствии с настоящим изобретением является AMP-224, также известное как B7-DCIg, которое представляет собой слитый белок растворимого рецептора PD-L1 и Fc-домена антитела, описанный в публикациях заявок PCT Nos. WO2010/027827 и WO2011/066342.
Несколько моноклональных антител против белка PD-L2 уже известно, например, антитела, раскрытые в публикации заявки PCT No.WO2010/036959, все они рассматриваются как подходящие для использования в композициях и способах настоящего изобретения.
Когда процесс получения специфичных антител включает их выработку иммунной системой отличной от человеческой (например, такой как у мышей), белковые последовательности получаемых антител частично отличаются от гомологичных антител, встречающихся в природе в организме человека, и поэтому они являются потенциально иммуногенными при введении их в организм пациентов-людей.
Таким образом, чтобы избежать иммуногенности при введении пациенту-человеку, в некоторых вариантах осуществления изобретения моноклональное антитело к CEACAM1 человека представляет собой человеческое или гуманизированное моноклональное антитело. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых вариантах осуществления изобретения моноклональное антитело к PD-1 человека представляет собой человеческое или гуманизированное моноклональное антитело. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых вариантах осуществления изобретения моноклональное антитело к PD-L1 человека представляет собой человеческое или гуманизированное моноклональное антитело. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых вариантах осуществления изобретения моноклональное антитело к PD-L2 человека представляет собой человеческое или гуманизированное моноклональное антитело. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения.
Предполагается, что используемый здесь термин «человеческое антитело» включает антитела, имеющие вариабельные и константные области, полученные из последовательностей эмбриональных иммуноглобулинов человека. Человеческие антитела могут включать аминокислотные остатки, не кодируемые последовательностями эмбриональных иммуноглобулинов человека (например, мутации, введенные случайным или сайт-специфичным мутагенезом in vitro, или возникшие в результате соматической мутации in vivo), например в CDRs. Однако, не предполагается, что используемый здесь термин «человеческое антитело» включает антитела, в которых последовательности CDR, полученные из эмбриональных линий других видов млекопитающих, например мыши, были встроены в каркасные последовательности человека. В некоторых вариантах осуществления изобретения термин «человеческое антитело» относится к выделенному человеческому антителу, т.е. полученному от человека-донора. В некоторых вариантах осуществления изобретения термин «человеческое антитело» относится к человеческому антителу, выделенному из гибридомной клеточной линии. В некоторых вариантах осуществления изобретения термин «человеческое антитело» относится к рекомбинантному человеческому антителу, т.е. полученному при помощи технологии рекомбинантных ДНК.
«Человеческое антитело» представляет собой антитело, которое обладает аминокислотной последовательностью, которая соответствует последовательности антитела, продуцируемого организмом человека и/или полученного при помощи любого из методов получения человеческих антител, как описано здесь. Это определение человеческого антитела специально исключает гуманизированное антитело, содержащее не человеческие антигенсвязывающие остатки. Человеческие антитела могут быть получены при помощи различных методов, известных из уровня техники. В одном варианте осуществления изобретения человеческое антитело выбрано из фаговой библиотеки, где эта фаговая библиотека экспрессирует человеческие антитела (Vaughan et al. Nature Biotechnology 1996 14, 309-314; Sheets et al. PNAS (USA), 1998, 95, 6157-6162); Hoogenboom and Winter, J. Mol. Biol, 1991, 227, 381; Marks et al, J. Mol. Biol, 1991, 222, 581). Человеческие антитела также могут быть получены путем введения локусов иммуноглобулинов человека в трансгенных животных, например, мышей, у которых эндогенные гены иммуноглобулинов были частично или полностью инактивированы. После заражения наблюдается образование человеческих антител, которые очень похожи на те, которые образуются у людей, во всех отношениях, включая перестройку генов, сборку и спектр антител. Такой подход описан, например, в Патентах США Nos. 5545807; 5545806; 5569825; 5625126; 5633425; 5661016, и в следующих научных публикациях: Marks et al, Bio/Technology 10: 779-783 (1992); Lonberg et al, Nature 368: 856-859 (1994); Morrison, Nature 368: 812-13 (1994); Fishwild et al., Nature Biotechnology 14: 845-51 (1996); Neuberger, Nature Biotechnology 14: 826 (1996); Lonberg and Huszar, Intern. Rev. Immunol. 73: 65-93 (1995). В альтернативном варианте, человеческое антитело может быть получено путем иммортализации B-лимфоцитов человека, продуцирующих антитело, направленное против антигена-мишени (такие B-лимфоциты могут быть получены от индивидуума, или могут быть иммунизированы in vitro). См., например, Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p. 77 (1985); Boerner et al, J. Immunol, 147 (l):86-95 (1991); и Патент США No.5750373.
Предполагается, что используемый здесь термин «рекомбинантное человеческое антитело» включает все человеческие антитела, которые получены, экспрессированы, созданы или выделены при помощи рекомбинантных технологий, например, антитела, экспрессированные с использованием рекомбинантного экспрессионного вектора, трансфецированного в клетку-хозяин, антитела, выделенные из рекомбинантной, комбинаторной библиотеки человеческих антител, антитела, полученные от животного (например, мыши), которое является трансгенным по генам иммуноглобулинов человека (см., например, Taylor, L. D., et al. (1992) Nucl. Acids Res. 20: 6287-6295) или антитела, полученные, экспрессированные, созданные или выделенные при помощи других способов, которые включают сплайсинг последовательностей генов иммуноглобулинов человека с образованием других последовательностей ДНК. Такие рекомбинантные человеческие антитела имеют вариабельную и константную области, полученные из последовательностей эмбриональных иммуноглобулинов человека. Однако, в некоторых вариантах осуществления изобретения такие рекомбинантные человеческие антитела подвергаются мутагенезу in vitro (или, в случае использования животного, трансгенного по последовательностям Ig человека, соматическому мутагенезу in vivo), и, таким образом, аминокислотные последовательности VH и VL областей рекомбинантных антител представляют собой последовательности, которые, несмотря на то, что они получены из или родственны последовательностям VH и VL из эмбриональной линии человека, могут не встречаться в природе в спектре эмбриональных человеческих антител in vivo.
Предполагается, что используемый здесь термин «гуманизированное антитело» включает антитела, CDRs (определяющие комплементарность области) которых получены из иммуноглобулинов видов, не являющихся человеком, а остальная часть молекулы антитела в основном получена из человеческого иммуноглобулина.
«Гуманизированные» формы нечеловеческих (например, мышиных) антител представляют собой гибридные антитела, которые содержат минимальную последовательность, полученную из нечеловеческого иммуноглобулина. В большинстве случаев гуманизированные антитела представляют собой иммуноглобулины человека (антитело-реципиент), в котором остатки из гипервариабельной области реципиента заменены остатками из гипервариабельной области вида, не являющегося человеком, (антиело-донор), такого как мышь, крыса, кролик или не являющийся человеком примат, обладающие необходимой специфичностью, аффинностью и антигенсвязывающей емкостью. В некоторых случаях остатки каркасной области (КО) из иммуноглобулина человека заменены соответствующими нечеловеческими остатками. Кроме того, гуманизированные антитела могут содержать остатки, которые не обнаружены в антителе-реципиенте или в антителе-доноре. Эти модификации делаются для того, чтобы дополнительно улучшить характеристики антитела. Как правило, гуманизированное антитело содержит практически весь, по меньшей мере, один и, как правило, два вариабельных домена, в которых все или практически все гипервариабельные петли соответствуют этим гипервариабельным петлям нечеловеческого иммуноглобулина, и все или практически все КО представляют собой КО последовательности иммуноглобулина человека. В некоторых случаях гуманизированное антитело также содержит, по меньшей мере, часть константной области иммуноглобулина (Fc), как правило, часть иммуноглобулина человека. Более подробную информацию см. в Jones et al., Nature 1986, 321, 522-525; Riechmann et al., Nature 1988, 332, 323- 329; и Presta, Curr. Op. Struct. Biol., 1992 2, 593-596.
Предполагается, что используемый здесь термин «рекомбинантное человеческое антитело» включает все человеческие антитела, которые получены, экспрессированы, созданы или выделены при помощи рекомбинантных технологий, например, антитела, экспрессированные с использованием рекомбинантного экспрессионного вектора, трансфецированного в клетку-хозяин, антитела, выделенные из рекомбинантной, комбинаторной библиотеки человеческих антител, антитела, полученные от животного (например, мыши), которое является трансгенным по генам иммуноглобулинов человека (см., например, Taylor, L. D., et al. (1992) Nucl. Acids Res. 20: 6287-6295) или антитела, полученные, экспрессированные, созданные или выделенные при помощи других способов, которые включают сплайсинг последовательностей генов иммуноглобулинов человека с образованием других последовательностей ДНК. Такие рекомбинантные человеческие антитела имеют вариабельную и константную области, полученные из последовательностей эмбриональных иммуноглобулинов человека. Однако в некоторых вариантах осуществления изобретения такие рекомбинантные человеческие антитела подвергаются мутагенезу in vitro (или, в случае использования животного, трансгенного по последовательностям Ig человека, соматическому мутагенезу in vivo), и, таким образом, аминокислотные последовательности VH и VL областей рекомбинантных антител представляют собой последовательности, которые, несмотря на то, что они получены из или родственны последовательностям VH и VL из эмбриональной линии человека, могут не встречаться в природе в спектре эмбриональных человеческих антител in vivo.
Не ограничиваясь каким-либо механизмом или теорией, предполагается, что существенный противораковый цитотоксический эффект, демонстрируемый комбинацией антител настоящего изобретения, как in vitro, так и in vivo, может быть усилен экзогенными лимфоцитами. Таким образом, в некоторых вариантах осуществления изобретения описанные выше фармацевтические композиции дополнительно содержат лимфоцит или множество лимфоцитов.
Используемый здесь термин «лимфоцит» относится к любой одной из следующих клеток: натуральная клетка-киллер (NK-клетка) (как правило, участвующая в клеточно-опосредованном цитотоксическом врожденном иммунитете), T-лимфоцит (как правило, участвующий в клеточно-опосредованном цитотоксическом адаптивном иммунитете), B-лимфоцит (как правило, участвующий в гуморальном, обусловленном антителами адаптивном иммунитете), их множеству и любой их комбинации. Мононуклеарные клетки периферической крови (МКПК), опухоль-инфильтрирующие лимфоциты (ОИЛ) и лимфокинактивированные клетки-киллеры (ЛАК) (как правило, участвующий в уничтожении опухолевых клеток) также считаются лимфоцитами. Неограничивающие примеры лимфоцитов включают цитотоксические лимфоциты (ЦТЛ, CD8+ или CD4+), NK-клетки (CD2+) и T-хелперы (CD4+).
Термины «лимфокинактивированные клетки-киллеры (ЛАК)», «лимфокинактивированные клетки-киллеры» и «ЛАК клетки» используются взаимозаменяемо и относятся к лимфоцитам, которые были стимулированы или активированы, чтобы уничтожать опухолевые клетки, т.е. которые стали более цитотоксичными по отношению к опухолевым клеткам. Так как ЛАК клетки могут быть получены из гомогенных или гетерогенных популяций клеток, вышеуказанные термины также относятся к гомогенным или гетерогенным популяциям клеток, стимулированным или активированным, чтобы стать более цитотоксичными по отношению к опухолевым клеткам. В конкретных вариантах осуществления изобретения ЛАК клетки получают из МКПК путем воздействия на них IL-2.
Ранее было установлено, что известные активирующие лимфоциты агенты, такие как IL-2, интерферон-γ (ИФН-γ) и/или анти-CD3 моноклональные антитела, способны трансформировать лимфоциты, такие как МКПК, таким образом, чтобы они становились более цитотоксичными, в результате чего образуется популяция клеток, именуемая «активированные цитотоксические лимфоциты», «активированные лимфоциты» или «цитотоксические лимфоциты», как in vitro, так и in vivo. Настоящее изобретение и другие источники содержат исчерпывающую информацию для среднего специалиста в данной области техники о том, как активировать МКПК, чтобы получать различные популяции активированных цитотоксических лимфоцитов без нежелательных побочных эффектов. Например, Stephen E. Ettinghausen с коллегами установил, что системное введение рекомбинантного IL-2 стимулирует пролиферацию лимфоидных клеток в тканях in vivo (Stephen E. Ettinghausen et al., The Journal of Immunology, 1985, Vol.135, No.2, pp. 1488-1497), и что рекомбинантный IL-2 стимулирует in vivo пролиферацию адоптивно перенесенных ЛАК клеток (Stephen E. Ettinghausen et al., The Journal of Immunology, 1985, Vol.135, No.5, pp. 3623-3635). Joseph H. Phillips с коллегами установил, что непрерывное введение 100000 Ед. IL-2/кг/q8 является достаточным для того, чтобы инициировать процесс превращения МКПК в ЛАК клетки у пациентов с запущенной карциномой толстой кишки, злокачественной меланомой или почечно-клеточным раком (J. Clin. Oncol., 1987, Vol.5, pp. 1933-1941). Цитокин-индуцированные клетки-киллеры (ЦИК) представляют собой активированные in vitro CD8 T-лимфоциты человека, которые приобрели неспецифичную противоопухолевую цитотоксичность, и таким образом представляют собой популяцию клеток с двойным фенотипом T-лимфоцитов и NK-клеток. Благодаря своему внутриопухолевому хомингу и отсутствию реакции трансплантат против хозяина (РТПХ), ЦИК клетки широко применяются для лечения онкологических пациентов, или в аутологичных или аллогенных контекстах. В статье M. Introna et al. (Immunology Letters, 2013, Vol.155, pp. 27-30) приводится обобщенная информация об основных биологических свойствах ЦИК клеток, а также о наиболее значимых результатах их клинического применения.
В некоторых вариантах осуществления изобретения лимфоцит экспрессирует CEACAM1, PD-1 или оба этих белка. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых таких вариантах осуществления изобретения лимфоцит экспрессирует CEACAM1 и PD-1.
В некоторых вариантах осуществления изобретения лимфоцит выбран из группы, состоящей из опухоль-инфильтрирующего лимфоцита (ОИЛ), лимфокинактивированной клетки-киллера (ЛАК), цитокин-индуцированной клетки-киллера (ЦИК), T-лимфоцита, B-лимфоцита, NK-клетки и любой их комбинации. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых таких вариантах осуществления изобретения лимфоцит выбран из группы, состоящей из опухоль-инфильтрирующего лимфоцита (ОИЛ) и лимфокинактивированной клетки-киллера (ЛАК). В некоторых таких вариантах осуществления изобретения лимфоцит представляет собой опухоль-инфильтрирующий лимфоцит (ОИЛ) или множество ОИЛ. В некоторых таких вариантах осуществления изобретения лимфоцит представляет собой лимфокинактивированную клетку-киллер (ЛАК) или множество ЛАК клеток.
Не ограничиваясь каким-либо механизмом или теорией, предполагается, что желаемый противораковый цитотоксический эффект, демонстрируемый лимфоцитами настоящего изобретения in vitro, может быть максимизирован в результате использования активированных лимфоцитов. Таким образом, в некоторых вариантах осуществления изобретения лимфоцит является активированным.
Используемый здесь термин «активированный» относится к любому лимфоциту, обладающему цитотоксической активностью, например, против линии раковых клеток, такой как линия клеток меланомы человека (MALME 3M или SKMEL28), или имеющему повышенный уровень продуцирования гранзима B.
В некоторых вариантах осуществления изобретения лимфоцит является цитотоксичным в отношении раковой клетки.
Используемый здесь термин «цитотоксичный» относится к агенту (такому как лимфоцит), который является вредоносным для структуры и/или функции клетки (такой как раковая клетка). Например, при воздействии на дисфункциональные соматические клетки цитотоксические T-лимфоциты (ЦТЛ) цитотоксины перфорин, гранзимы и гранулизин. Благодаря действию перфорина, гранзимы проникают в цитоплазму клетки-мишени, и их функция сериновой протеазы запускает каспазный каскад, который представляет собой ряд цистеиновых протеаз, что в конечном итоге приводит к апоптозу (программируемой клеточной смерти).
Было показано, что композиции и способы настоящего изобретения являются эффективными в отношении нескольких типов рака, не связанных по своему происхождению. В некоторых вариантах осуществления изобретения раковая клетка экспрессирует CEACAM1, PD-L1, PD-L2 или любую их комбинацию. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых вариантах осуществления изобретения раковая клетка экспрессирует CEACAM1, PD-L1 или оба этих белка. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых вариантах осуществления изобретения раковая клетка экспрессирует CEACAM1, PD-L2 или оба этих белка. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых таких вариантах осуществления изобретения раковая клетка экспрессирует CEACAM1 и PD-L1 и PD-L2.
В некоторых вариантах осуществления изобретения рак выбран из группы, состоящей из меланомы, лимфомы, рака легких, рака щитовидной железы, рака молочной железы, рака толстой кишки, рака предстательной железы, рака печени, рака мочевого пузыря, рака почки, рака шейки матки, рака поджелудочной железы, лейкоза, миелоидного рака, рака яичников, рака матки, саркомы, рака желчного пузыря и рака клеток эндометрия. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых вариантах осуществления изобретения рак выбран из группы, состоящей из меланомы и лимфомы. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых вариантах осуществления изобретения рак представляет собой меланому. В некоторых вариантах осуществления изобретения рак представляет собой лимфому.
В некоторых вариантах осуществления изобретения моноклональное антитело, по меньшей мере, к одной из следующих молекул: PD-1, PD-L1 и PD-L2 человека, способно ингибировать или блокировать взаимодействие между PD-1 человека и его лигандами. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения.
Как описано выше, настоящее изобретение относится к способу, в котором используются фармацевтические композиции, направленные на одновременное блокирование двух основных иммуносупрессивных взаимодействий: CEACAM1лимфоцит/CEACAM1раковая клетка и PD-1лимфоцит/PD-лигандраковая клетка. Таким образом, в некоторых вариантах осуществления изобретения данный способ включает введение указанному пациенту фармацевтической композиции, содержащей моноклональное антитело к CEACAM1 человека или его антигенсвязывающий фрагмент, и фармацевтической композиции, содержащей моноклональное антитело к PD-1 человека или его антигенсвязывающий фрагмент.
В некоторых вариантах осуществления изобретения способ включает введение указанному пациенту фармацевтической композиции, содержащей моноклональное антитело к CEACAM1 человека или его антигенсвязывающий фрагмент, и фармацевтической композиции, содержащей моноклональное антитело к PD-L1 человека или его антигенсвязывающий фрагмент.
В некоторых вариантах осуществления изобретения способ включает введение указанному пациенту фармацевтической композиции, содержащей моноклональное антитело к CEACAM1 человека или его антигенсвязывающий фрагмент, и фармацевтической композиции, содержащей моноклональное антитело к PD-L2 человека или его антигенсвязывающий фрагмент.
В некоторых вариантах осуществления способа моноклональное антитело к PD-1 человека или его антигенсвязывающий фрагмент вводится до введения моноклонального антитела к CEACAM1 человека или его антигенсвязывающего фрагмента. В некоторых вариантах осуществления способа моноклональное антитело к PD-1 человека или его антигенсвязывающий фрагмент вводится одновременно с моноклональным антителом к CEACAM1 человека или его антигенсвязывающим фрагментом. В некоторых вариантах осуществления способа моноклональное антитело к PD-1 человека или его антигенсвязывающий фрагмент вводится после введения моноклонального антитела к CEACAM1 человека или его антигенсвязывающего фрагмента. В некоторых вариантах осуществления способа введение двух или нескольких фармацевтических композиций осуществляется одновременно. В некоторых вариантах осуществления способа введение двух или нескольких фармацевтических композиций осуществляется последовательно. В некоторых вариантах осуществления способа моноклональное антитело к PD-L1 человека или его антигенсвязывающий фрагмент вводится до введения моноклонального антитела к CEACAM1 человека или его антигенсвязывающего фрагмента. В некоторых вариантах осуществления способа моноклональное антитело к PD-L1 человека или его антигенсвязывающий фрагмент вводится одновременно с моноклональным антителом к CEACAM1 человека или его антигенсвязывающим фрагментом. В некоторых вариантах осуществления способа моноклональное антитело к PD-L1 человека или его антигенсвязывающий фрагмент вводится после введения моноклонального антитела к CEACAM1 человека или его антигенсвязывающего фрагмента. В некоторых вариантах осуществления способа моноклональное антитело к PD-L2 человека или его антигенсвязывающий фрагмент вводится до введения моноклонального антитела к CEACAM1 человека или его антигенсвязывающего фрагмента. В некоторых вариантах осуществления способа моноклональное антитело к PD-L2 человека или его антигенсвязывающий фрагмент вводится одновременно с моноклональным антителом к CEACAM1 человека или его антигенсвязывающим фрагментом. В некоторых вариантах осуществления способа моноклональное антитело к PD-L2 человека или его антигенсвязывающий фрагмент вводится после введения моноклонального антитела к CEACAM1 человека или его антигенсвязывающего фрагмента.
В некоторых вариантах осуществления изобретения описанный выше способ дополнительно включает этап введения указанному пациенту фармацевтической композиции, содержащей лимфоцит. В некоторых вариантах осуществления способа настоящего изобретения введение фармацевтической композиции, содержащей лимфоцит, осуществляется одновременно с, по меньшей мере, одной из фармацевтических композиций, содержащих антитела. В некоторых вариантах осуществления способа настоящего изобретения введение двух или нескольких фармацевтических композиций осуществляется последовательно.
Неожиданно было обнаружено, что связывание анти-CEACAM1 антител и анти-PD-1 антител со своими соответствующими мишенями на лимфоцитах каким-то образом взаимосвязано. Таким образом, в некоторых вариантах осуществления изобретения лимфоцит предварительно инкубируют с моноклональным антителом к CEACAM1 человека или его антигенсвязывающим фрагментом, или с моноклональным антителом к PD-1 человека или его антигенсвязывающим фрагментом перед введением. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых таких вариантах осуществления изобретения лимфоцит предварительно инкубируют с моноклональным антителом к CEACAM1 человека или его антигенсвязывающим фрагментом, и с моноклональным антителом к PD-1 человека или его антигенсвязывающим фрагментом перед введением. В некоторых других таких вариантах осуществления изобретения перед введением лимфоцит предварительно инкубируют с моноклональным антителом к PD-1 человека или его антигенсвязывающим фрагментом, и затем инкубируют с моноклональным антителом к CEACAM1 человека или его антигенсвязывающим фрагментом.
Используемый здесь термин «предварительно инкубируют с» относится к лимфоциту, моноклональному антителу к CEACAM1 человека или его антигенсвязывающему фрагменту и/или моноклональному антителу к PD-1 человека или его антигенсвязывающему фрагменту, находящимся в одних и тех же фармацевтических композициях, в таких условиях, которые обеспечивают специфичное связывание одного или обоих антител или их антигенсвязывающих фрагментов со своими мишенями, представляемыми лимфоцитом.
Система лейкоцитарных антигенов человека (HLA) представляет собой локус генов, кодирующие белки на поверхности клеток, которые ответственны за регулирование иммунной системы человека. Гены HLA представляют собой человеческие варианты генов главного комплекса гистосовместимости (ГКГС), которые обнаружены у большинства позвоночных. Как правило, HLAs используются для определения совместимости пациента, страдающего заболеванием, со здоровым донором для трансплантации органов или клеток. Лучший результат трансплантации имеет место тогда, когда HLAs пациента и HLAs донора имеют близкое соответствие, предпочтительно являются идентичными. Используемый здесь термин «аутологичный лимфоцит» относится к лимфоциту, выделенному или полученному от онкологического пациента, при необходимости размноженному или инкубированному с анти-CEACAM1 антителами или их антигенсвязывающими фрагментами и/или с анти-PD-1 антителами или их антигенсвязывающими фрагментами, и введенному этому онкологическому пациенту. Используемый здесь термин «аутологичный лимфоцит» также относится к лимфоциту, выделенному или полученному от совместимого по лейкоцитарным антигенам человека (HLA) донора.
В некоторых вариантах осуществления изобретения, по меньшей мере, два различных антитела, выбранных из группы, состоящей из анти-CEACAM1, анти-PD-1, анти-PD-L1 и анти-PD-L2, входят в состав, по меньшей мере, двух различных фармацевтических композиций. В некоторых вариантах осуществления изобретения, по меньшей мере, одно антитело, выбранное из группы, состоящей из анти-CEACAM1, анти-PD-1, анти-PD-L1 и анти-PD-L2, и, по меньшей мере, один лимфоцит входят в состав одной и той же фармацевтической композиции.
В некоторых вариантах осуществления изобретения набор реагентов включает фармацевтическую композицию, содержащую моноклональное антитело к CEACAM1 человека или его антигенсвязывающий фрагмент, и фармацевтическую композицию, содержащую моноклональное антитело к PD-1 человека или его антигенсвязывающий фрагмент. В некоторых вариантах осуществления изобретения набор реагентов включает фармацевтическую композицию, содержащую моноклональное антитело к CEACAM1 человека или его антигенсвязывающий фрагмент, и фармацевтическую композицию, содержащую моноклональное антитело к PD-L1 человека или его антигенсвязывающий фрагмент. В некоторых вариантах осуществления изобретения набор реагентов включает фармацевтическую композицию, содержащую моноклональное антитело к CEACAM1 человека или его антигенсвязывающий фрагмент, и фармацевтическую композицию, содержащую моноклональное антитело к PD-L2 человека или его антигенсвязывающий фрагмент.
В некоторых вариантах осуществления изобретения каждая фармацевтическая композиция, содержащая антитело или его антигенсвязывающий фрагмент, находится в наборе реагентов в отдельном контейнере.
В некоторых вариантах осуществления изобретения набор реагентов дополнительно включает фармацевтическую композицию, содержащую лимфоцит. В некоторых таких вариантах осуществления изобретения набор реагентов включает фармацевтическую композицию, содержащую лимфоцит и моноклональное антитело к CEACAM1 человека или его антигенсвязывающий фрагмент, или моноклональное антитело к PD-1 человека или его антигенсвязывающий фрагмент. Каждая возможность представляет собой отдельный вариант осуществления настоящего изобретения. В некоторых таких вариантах осуществления изобретения набор реагентов включает фармацевтическую композицию, содержащую лимфоцит и моноклональное антитело к CEACAM1 человека или его антигенсвязывающий фрагмент. В некоторых таких вариантах осуществления изобретения набор реагентов включает фармацевтическую композицию, содержащую лимфоцит и моноклональное антитело к PD-1 человека или его антигенсвязывающий фрагмент. В некоторых вариантах осуществления изобретения набор реагентов дополнительно включает инструкции по применению данного набора реагентов.
Следующие примеры предназначены для иллюстрации того, как получать и применять химические соединения и способы настоящего изобретения, и они ни в коем случае не должны рассматриваться как ограничивающие. Хотя настоящее изобретение далее будет описано в связи с конкретными вариантами его осуществления, понятно, что многие модификации и варианты будут очевидны для специалистов в данной области техники. Таким образом, предполагается, что настоящее изобретение включает все такие модификации и варианты, которые находятся в пределах сущности и широкого объема прилагаемой формулы изобретения.
Примеры
Пример 1 - Клетки меланомы человека экспрессируют CEACAM1 и PD-L1 при активации ИФН-γ.
Клетки меланомы человека (MALME 3M) инкубировали с ИФН-γ (2000 едениц/мл) в течение 24 часов с последующим FACS-анализом с PE-конъюгированным анти-PD-L1 антителом (клон 29E.2A3) или с PE-конъюгированным моноклональным антителом к CEACAM1 человека (CM-24 получено cCAM Biotherapeutics). Аналогичный анализ проводили с изотипическим контролем.
На Фигуре 1 показано, что используемые в экспериментах клетки меланомы человека экспрессируют как CEACAM1, так и PD-L1.
Пример 2 - ОИЛ клетки человека экспрессируют PD-1 и CEACAM1.
ОИЛ клетки человека (опухоль-инфильтрирующие лимфоциты, полученные от пациентов #14 в институте «Элла», партия 14, TIL14) окрашивали моноклональным антителом к PD-1 человека (клон E12.2H7) или PE-конъюгированным моноклональным антителом к CEACAM1 человека (CM-24) и анализировали при помощи FACS. Представлена экспрессия PD-1 (A) и CEACAM1 (B) по сравнению с соответствующим изотипическим контролем.
На Фигуре 2 показано, что используемые в экспериментах ОИЛ клетки экспрессируют как PD-1, так и CEACAM1.
Пример 3 - Синергическое действие анти-CEACAM1 и анти-PD-1 антител на цитотоксичность ОИЛ клеток человека против клеток меланомы человека.
Клетки меланомы человека (MALME 3M) выращивали в присутствии ИФН-γ, чтобы индуцировать экспрессию PD-L1. ОИЛ клетки человека (TIL14) инкубировали с моноклональным антителом к CEACAM1 человека (CM-24) (0,01 мкг/мл, 0,05 мкг/мл, 0,1 мкг/мл, 0,5 мкг/мл), моноклональным антителом к PD-1 человека (клон E12.2H7) или комбинацией обоих антител (0,005, 0,025, 0,05 и 0,25 мкг/мл каждого антитела) в течение 30 минут при температуре 37°C.
Обработанные ИФН-γ клетки меланомы человека добавляли для инкубации в течение ночи перед оценкой цитотоксичности. Результаты представлены в виде среднего значения % цитотоксичности ±СО, которое определяли при помощи классического анализа высвобождения ЛДГ в лунках в трех повторностях на каждую обработку. * P<0,05 парный критерий Стьюдента для сравнения с только CM-24. Показатель аддитивности (CI), который составил ≤0,2, вычисляли по следующему уравнению:
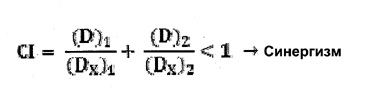
На Фигуре 3 показано, что как анти-CEACAM1 антитела, так и анти-PD-1 антитела оказались способны связываться со своими соответствующими мишенями на лимфоцитах человека, таких как ОИЛ клетки, и что это связывание значительно увеличивает токсичность ОИЛ клеток человека против раковых клеток человека, по сравнению с каждой монотерапией в отдельности. Таким образом, данные, представленные на Фигуре 3, свидетельствуют о том, что защита лимфоцитов от иммуносупрессивных сигналов от раковых клеток-мишеней приводит к существенной цитотоксичности в отношении этих раковых клеток.
Пример 4 - Синергическое действие анти-CEACAM1 и анти-PD-1 антител на уровень гранзима B и цитотоксичность ОИЛ клеток человека против клеток меланомы человека, когда анти-PD-1 антитела добавляли перед добавлением анти-CEACAM1 антител.
Клетки меланомы человека (MALME 3M) выращивали в присутствии ИФН-γ, чтобы индуцировать экспрессию PD-L1. ОИЛ клетки человека (TIL14) инкубировали только со средой (черный цвет), неспецифичным IgG антителом (0,8 мкг/мл, белый цвет), различными концентрациями (0,05 мкг/мл, 0,1 мкг/мл, 0,2 мкг/мл, 0,4 мкг/мл, 0,8 мкг/мл) моноклонального антитела к CEACAM1 человека (CM-24), моноклональным антителом к PD-1 человека (клон E12.2H7) или комбинацией обоих антител (0,05 мкг/мл каждое, 0,1 мкг/мл каждое, 0,2 мкг/мл каждое, 0,4 мкг/мл каждое, 0,8 мкг/мл каждое).
Сначала добавляли моноклональное антитело к PD-1 человека в течение 30 минут при температуре 37°C с последующим добавлением моноклонального антитела к CEACAM1 человека. Обработанные ИФН-γ клетки меланомы человека добавляли для инкубации в течение ночи перед оценкой цитотоксичности (Фигура 4A). Вычисленный показатель аддитивности (CI) составил 0,15. Результаты представлены в виде среднего значения % цитотоксичности ±СО, которое определяли при помощи классического анализа высвобождения ЛДГ в лунках в трех повторностях на каждую обработку. * P<0,05 парный критерий Стьюдента для сравнения с только анти-PD-1. В том же анализе уровень цитотоксичного белка гранзим B, который секретируется при активации цитотоксических клеток, определяли при помощи коммерческого набора реагентов для ИФА гранзима B (Фигура 4B). Результаты представляют собой среднее значение уровня гранзима B в лунках в трех повторностях на каждую обработку.
На Фигуре 4 показано, что анти-CEACAM1 антитела и анти-PD-1 антитела способны связываться со своими соответствующими мишенями на лимфоцитах человека, таких как ОИЛ клетки, и что это связывание увеличивает секрецию гранзима B и токсичность ОИЛ клеток человека против раковых клеток человека. На Фигуре 4 также показано, что связывание этих антител с ОИЛ клетками человека каким-то образом взаимосвязано, что служит основой для дальнейшего изучения механизма их связывания. Аналогично данным, приведенным на Фигуре 3, Фигура 4 также указывает на то, что защита лимфоцитов от иммуносупрессивных сигналов от раковых клеток-мишеней приводит к существенной цитотоксичности в отношении этих раковых клеток и свидетельствует о том, что выбор определенного времени может быть ключевым фактором в комбинированной терапии.
Пример 5 - Синергическое действие анти-CEACAM1 и анти-PD-L1 антител на уровень гранзима B и цитотоксичность ОИЛ клеток человека против клеток меланомы человека, когда анти-PD-L1 антитела добавляли перед добавлением анти-CEACAM1 антител.
Клетки меланомы человека (MALME 3M) выращивали в присутствии ИФН-γ, чтобы индуцировать экспрессию PD-L1. ОИЛ клетки человека (TIL14) инкубировали только со средой (черный цвет), неспецифичным IgG антителом (0,8 мгк/мл, белый цвет), различными концентрациями (0,05 мкг/мл, 0,1 мкг/мл, 0,2 мкг/мл, 0,4 мкг/мл, 0,8 мкг/мл) моноклонального антитела к CEACAM1 человека (CM-24), моноклональным антителом к PD-L1 человека (клон 29E.2A3) или комбинацией обоих антител (0,05 мкг/мл каждое, 0,1 мкг/мл каждое, 0,2 мкг/мл каждое, 0,4 мкг/мл каждое, 0,8 мкг/мл каждое). Сначала добавляли анти-PD-L1 антитело в течение 30 минут при температуре 37°C с последующим добавлением моноклонального антитела к CEACAM1 человека.
Обработанные ИФН-γ клетки меланомы человека добавляли для инкубации в течение ночи перед оценкой цитотоксичности (Фигура 5A). Вычисленный показатель аддитивности (CI) составил 0,67. Результаты представлены в виде среднего значения % цитотоксичности ±СО, которое определяли при помощи классического анализа высвобождения ЛДГ в лунках в трех повторностях на каждую обработку. * P≤0,05 парный критерий Стьюдента для сравнения с только анти-PD-L1. В том же анализе уровень цитотоксичного белка гранзим B, который секретируется при активации цитотоксических клеток, определяли при помощи коммерческого набора реагентов для ИФА гранзима B (Фигура 5B). Результаты представляют собой среднее значение уровня гранзима B в лунках в трех повторностях на каждую обработку.
На Фигуре 5 показано, что анти-CEACAM1 антитела и анти-PD-1 антитела способны связываться со своими соответствующими мишенями на лимфоцитах человека (таких как ОИЛ клетки) и на раковых клетках человека (таких как клетки меланомы), и что это связывание увеличивает секрецию гранзима B и токсичность ОИЛ клеток человека против раковых клеток человека. На Фигуре 5 также показано, что блокирование PD-1/PD-L1 и CEACAM1/CEACAM1 взаимодействий может приводить к синергическому действию. Таким образом, данные, приведенные на Фигуре 5, свидетельствуют о том, что защита лимфоцитов от PD-1лимфоцит/PD-лигандраковая клетка иммуносупрессивного сигнала приводит к существенной цитотоксичности в отношении этих раковых клеток, независимо от того какой антиген является мишенью PD-1, PD-L1 или PD-L2.
Пример 6 - Синергическое действие анти-CEACAM1 и анти-PD-1 антител на цитотоксичность ЛАК клеток человека против клеток меланомы человека, когда анти-PD-1 антитела добавляли перед добавлением анти-CEACAM1 антител.
Клетки меланомы человека (SKMEL28, CEACAM1 положительные, PD-L1 положительные) выращивали в присутствии ИФН-γ, чтобы индуцировать экспрессию PD-L1. ЛАК клетки (лимфокинактивированные клетки-киллеры) человека, получаемые путем активации в течении 7 суток при помощи IL-2 (500 единиц/мл) полученных от здорового донора МКПК, инкубировали только со средой (черный цвет), неспецифичным IgG антителом (0,8 мкг/мл, белый цвет), различными концентрациями (0,05 мкг/мл, 0,1 мкг/мл, 0,2 мкг/мл, 0,4 мкг/мл, 0,8 мкг/мл) моноклонального антитела к CEACAM1 человека (CM-24), моноклональным антителом к PD-1 человека (клон E12.2H7) или комбинацией обоих антител (0,05 мкг/мл каждое, 0,1 мкг/мл каждое, 0,2 мкг/мл каждое, 0,4 мкг/мл каждое, 0,8 мкг/мл каждое). Сначала добавляли моноклональное антитело к PD-1 человека в течение 30 минут при температуре 37°C с последующим добавлением моноклонального антитела к CEACAM1 человека.
Обработанные ИФН-γ клетки меланомы человека добавляли для инкубации в течение 24 часов перед оценкой цитотоксичности (Фигура 6). Вычисленный показатель аддитивности (CI) составил <0,2 Результаты представлены в виде среднего значения % цитотоксичности ±СО, которое определяли при помощи классического анализа высвобождения ЛДГ в лунках в трех повторностях на каждую обработку. * P≤0,05 парный критерий Стьюдента для сравнения с только анти-PD-1.
На Фигуре 6 показано, что анти-CEACAM1 антитела и анти-PD-1 антитела способны связываться со своими соответствующими мишенями на активированных лимфоцитах человека, таких как ЛАК клетки, и что это связывание увеличивает токсичность ЛАК клеток человека против раковых клеток человека. На Фигуре 6 также показано, что связывание этих антител с ЛАК клетками каким-то образом взаимосвязано, что служит основой для дальнейшего изучения механизма их связывания, и что этот механизм присутствует в различных активированных лимфоцитах.
Пример 7 - Обработка анти-CEACAM1 антителами повышает экспрессию PD-L1 на раковых клетках-мишенях.
NK-клетки человека (NK92MI) инкубировали в присутствии или без моноклонального антитела к CEACAM1 человека (10 мкг/мл, CM-24) с последующим добавлением клеток меланомы человека (SKEL28). Клетки инкубировали в течение 24, 48 и 72 часов и измеряли уровень PD-L1 в каждый момент времени при помощи FACS-анализа. На Фигуре 7A показано среднее соотношение уровней анти-PD-L1 по сравнению с соответствующим изотипическим контролем для указанных обработок в различные моменты времени. B. Репрезентативный FACS-анализ уровней экспрессии PD-L1 после 48 часов.
На Фигуре 7 показано, что экспрессия CEACAM1 и PD-L1 на раковых клетках действительно взаимосвязана. Добавление анти-CEACAM1 антител приводит к повышенной экспресси PD-L1 на выживших раковых клетках, предоставляя, таким образом, дополнительное обоснование комбинированного лечения обоими агентами. Поэтому может оказаться эффективным лечение рака при помощи первого введения анти-CEACAM1 антител, а затем последующего введения анти-PD-L1 и/или анти-PD-L2 антител, так как количество белков PD-L1 на раковых клетках остается относительно высоким, что делает эти клетки более чувствительными к лечению PD-1/PD-L1 антителами, предполагая, что комбинированная терапия может улучшить клинические результаты.
Данные, представленные в Примерах 4-6, иллюстрируют неожиданное открытие, согласно которому введение различных антител в разное время, а не одновременно, максимизирует цитотоксическое действие лимфоцитов на раковые клетки. Не ограничиваясь какой-либо теорией или механизмом, эти результаты могут быть связаны с другим неожиданным открытием настоящего изобретения, в соответствии с которым обработка анти-CEACAM1 антителами увеличивает экспрессию PD-L1 на раковых клетках-мишенях. Гипотетически, это должно поддерживать необходимость наличия множества антител для получения улучшенной эффективности цитотоксических лимфоцитов. Можно предположить, что первое введение анти-PD-L1 антител блокирует молекулы PD-1 на лимфоцитах, а последующее введение анти-CEACAM1 антител блокирует молекулы CEACAM1 на лимфоцитах и/или раковых клетках-мишенях и повышает экспрессию лигандов PD-1 на раковых клетках-мишенях. Однако так как молекулы PD-1 на лимфоцитах уже блокированы, повышенный уровень экспрессии лигандов PD-1 на раковых клетках-мишенях не препятствует реализации лимфоцитами своего полного цитотоксического потенциала.
Пример 8 - Синергическое действие анти-CEACAM1 и анти-PD-1 антител на прогрессирование опухоли у иммунокомпетентных мышей.
Мышиные лимфомные клетки (5*106, A20) аллотрансплантировали в брюшную полость мышей линии BALB/C путем подкожной инъекции в день 1. В день 10 опухоли достигали среднего объема 45 мм3, и мышей случайным образом распределяли по четырем отдельным группам (по 11-12 мышей на группу), и внутривенно вводили или ФСБ (Фигура 8, пунктирная черная линия, пустые кружки) или CC-1 (антитело к мышиному CEACAM1 6 мг/кг, Фигура 8, сплошная серая линия, серые прямоугольники) или PRM-1 (антитело к мышиному PD-1, 6 мг/кг, Фигура 8, сплошная серая линия, серые треугольники) или комбинацию CC-1 и PRM-1 (6 мг/кг каждого, Фигура 8, сплошная черная линия, черные кружки). Лечение повторяли в дни 15 и 20. Эксперимент прекращали в день 22. Далее проводили оценку влияния только моноклонального антитела к CEACAM1 человека, только моноклонального антитела к PD-1 человека и комбинации обоих антител на подавление роста опухоли.
Для этого эксперимента были отобраны иммунокомпетентные мыши линии Balb/C, чтобы можно было провести оценку биологической активности антитела к мышиному CEACAM1 и антитела к мышиному PD-1 у мышей с интактной иммунной системой, а также оценить полную реакцию иммунной системы на мышиные раковые клетки. В целом, эта модель имитирует терапию у человека, при которой онкологические пациенты будут получать комбинации анти-человеческий CEACAM1 антитела и анти-человеческий PD-1/PD-L1/PD-L2 антител. Не ограничиваясь какой-либо теорией или механизмом, предполагается, что комбинация анти-CEACAM1 и анти-PD-1/PD-L1/PD-L2 антител будет не давать раковым клеткам избежать действия активации и цитотоксичности иммунной системы пациента, создавая тем самым значительный противораковый ответ.
На Фигуре 8 показано, что анти-CEACAM1 и анти-PD-1/PD-L1/PD-L2 антитела способны связываться со своими соответствующими мишенями на опухолевых клетках и/или иммунных клетках in vivo, и что это комбинированное связывание значительно ослабляет прогрессирование опухоли по сравнению с каждой монотерапией. Этот результат является очень важным, так как он свидетельствует об эффективности и возможности применения комбинации анти-CEACAM1 и анти-PD-1/PD-L1/PD-L2 антител даже в случае сформировавшихся опухолей значительных объемов, что имитирует клинические условия, в которых пациенты с сформировавшимися опухолями проходят лечение.
На Фигуре 9 приведены кривые прогрессирования опухоли для каждой отдельной мыши, сгруппированные в зависимости от получаемой ими соответствующей терапии (контроль, анти-CEACAM1 антитела, анти-PD-1 антитела или комбинация анти-CEACAM1 и анти-PD-1 антител).
Пример 9 - Лечение ксенотрансплантатной модели рака комбинацией анти-CEACAM1 антитела и анти-PD-1 или анти-PD-L1 антитела.
Опухоли ксенотрансплантировали мышам линии SCID NOD путем подкожной инъекции линии раковых клеток (например, линии клеток меланомы, такой как SKMEL5). Действие только анти-CEACAM1 антитела (например, CM-24), действие только моноклонального антитела к PD-1 человека или только моноклонального антитела к PD-L1 человека, и действие комбинации обоих антител с или без ОИЛ клеток оценивали по эрадикации опухоли, подавлению роста опухоли и/или уровню смертности мышей.
Например, мышей линии SCID NOD случайным образом распределяли по группам, указанным в Таблице 2.
Группы мышей SCID NOD
Заражение опухолью - Каждой мыши вводили раковые клетки (например, клетки меланомы) в ФСБ путем подкожной инъекции в правый бок мыши. Лечение - Лечение начинали в день инокуляции опухоли. Измерение роста опухоли - Измерения проводились дважды в неделю при помощи штангенциркуля лицом, не принимающим участия в проведении эксперимента. Измерения начинали со дня заражения опухолью. Измерения прекращали на ~60-80 день со дня заражения опухолью. В день завершения анализа всех мышей умерщвляли после полного обескровливания тела и отделения сыворотки крови. Опухоли передавали на фиксацию в отдельной пробирке для каждой мыши.
Пример 10 - Сравнение монотерапии анти-PD-1/анти-PD-L1/анти-PD-L2/анти-CEACAM1 и комбинированной терапии анти-CEACAM1 и анти-PD-1/анти-PD-L1/анти-PD-L2 у людей с нелеченым, неоперабельным или метастатическим раком.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> CCAM БИОТЕРАПЬЮТИКС ЛТД
<120> КОМПОЗИЦИИ, СОДЕРЖАЩИЕ АНТИ-CEACAM1 И АНТИ-PD АНТИТЕЛА ДЛЯ ТЕРАПИИ РАКА
<130> CCAM 006 PCT
<160> 31
<170> Патентная версия 3.5
<210> 1
<211> 5
<212> Белок
<213> Mus musculus
<220>
<221> Отличительные особенности
<222> (1)..(1)
<223> X отсутствует или Thr
<220>
<221> Отличительные особенности
<222> (5)..(5)
<223> X отсутствует или Ile
<400> 1
Xaa Asn Asn Leu Xaa
1 5
<210> 2
<211> 8
<212> Белок
<213> Mus musculus
<400> 2
Ile Asn Pro Gly Ser Gly Asp Thr
1 5
<210> 3
<211> 11
<212> Белок
<213> Mus musculus
<400> 3
Gly Asp Tyr Tyr Gly Gly Phe Ala Val Asp Tyr
1 5 10
<210> 4
<211> 6
<212> Белок
<213> Mus musculus
<400> 4
Gln Asp Ile Gly Asn Tyr
1 5
<210> 5
<211> 4
<212> Белок
<213> Mus musculus
<400> 5
Tyr Thr Ser Arg
1
<210> 6
<211> 7
<212> Белок
<213> Mus musculus
<400> 6
Gln Gln Gly Lys Ser Leu Pro
1 5
<210> 7
<211> 5
<212> Белок
<213> Mus musculus
<400> 7
Asn Asn Leu Ile Glu
1 5
<210> 8
<211> 17
<212> Белок
<213> Mus musculus
<400> 8
Val Ile Asn Pro Gly Ser Gly Asp Thr Asn Tyr Asn Glu Lys Phe Lys
1 5 10 15
Gly
<210> 9
<211> 11
<212> Белок
<213> Mus musculus
<400> 9
Gly Asp Tyr Tyr Gly Gly Phe Ala Val Asp Tyr
1 5 10
<210> 10
<211> 11
<212> Белок
<213> Mus musculus
<400> 10
Arg Thr Ser Gln Asp Ile Gly Asn Tyr Leu Asn
1 5 10
<210> 11
<211> 7
<212> Белок
<213> Mus musculus
<400> 11
Tyr Thr Ser Arg Leu His Ser
1 5
<210> 12
<211> 7
<212> Белок
<213> Mus musculus
<400> 12
Gln Gln Gly Lys Ser Leu Pro
1 5
<210> 13
<211> 8
<212> Белок
<213> Mus musculus
<400> 13
Gly Tyr Ala Phe Thr Asn Asn Leu
1 5
<210> 14
<211> 8
<212> Белок
<213> Mus musculus
<400> 14
Ile Asn Pro Gly Ser Gly Asp Thr
1 5
<210> 15
<211> 13
<212> Белок
<213> Mus musculus
<400> 15
Ala Arg Gly Asp Tyr Tyr Gly Gly Phe Ala Val Asp Tyr
1 5 10
<210> 16
<211> 6
<212> Белок
<213> Mus musculus
<400> 16
Gln Asp Ile Gly Asn Tyr
1 5
<210> 17
<211> 4
<212> Белок
<213> Mus musculus
<400> 17
Tyr Thr Ser Arg
1
<210> 18
<211> 9
<212> Белок
<213> Mus musculus
<400> 18
Gln Gln Gly Lys Ser Leu Pro Arg Thr
1 5
<210> 19
<211> 10
<212> Белок
<213> Mus musculus
<400> 19
Gly Tyr Ala Phe Thr Asn Asn Leu Ile Glu
1 5 10
<210> 20
<211> 17
<212> Белок
<213> Mus musculus
<400> 20
Val Ile Asn Pro Gly Ser Gly Asp Thr Asn Tyr Asn Glu Lys Phe Lys
1 5 10 15
Gly
<210> 21
<211> 13
<212> Белок
<213> Mus musculus
<400> 21
Ala Arg Gly Asp Tyr Tyr Gly Gly Phe Ala Val Asp Tyr
1 5 10
<210> 22
<211> 11
<212> Белок
<213> Mus musculus
<400> 22
Arg Thr Ser Gln Asp Ile Gly Asn Tyr Leu Asn
1 5 10
<210> 23
<211> 7
<212> Белок
<213> Mus musculus
<400> 23
Tyr Thr Ser Arg Leu His Ser
1 5
<210> 24
<211> 9
<212> Белок
<213> Mus musculus
<400> 24
Gln Gln Gly Lys Ser Leu Pro Arg Thr
1 5
<210> 25
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> Рекомбинантный полипептид
<400> 25
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Thr
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn Asn
20 25 30
Leu Ile Glu Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Gly Ser Gly Asp Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Asn Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Asp Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Gly Asp Tyr Tyr Gly Gly Phe Ala Val Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 26
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Рекомбинантный полипептид
<400> 26
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Thr Ser Gln Asp Ile Gly Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Lys Ser Leu Pro Arg
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 27
<211> 450
<212> Белок
<213> Искусственная последовательность
<220>
<223> Рекомбинантный полипептид
<400> 27
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Thr
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn Asn
20 25 30
Leu Ile Glu Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Gly Ser Gly Asp Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Asn Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Asp Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Gly Asp Tyr Tyr Gly Gly Phe Ala Val Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ser Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 28
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> Рекомбинантный полипептид
<400> 28
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Thr Ser Gln Asp Ile Gly Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Lys Ser Leu Pro Arg
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 29
<211> 13
<212> Белок
<213> Homo sapiens
<400> 29
Val Leu Leu Leu Val His Asn Leu Pro Gln Gln Leu Phe
1 5 10
<210> 30
<211> 12
<212> Белок
<213> Homo sapiens
<400> 30
Tyr Pro Asn Ala Ser Leu Leu Ile Gln Asn Val Thr
1 5 10
<210> 31
<211> 7
<212> Белок
<213> Homo sapiens
<400> 31
Pro Asn Ala Ser Leu Leu Ile
1 5
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИ-ГАЛЕКТИН-9 АНТИТЕЛО И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2840501C1 |
| Способы лечения рака с помощью анти-PD-1-антител и анти-CTLA4-антител | 2019 |
|
RU2825835C2 |
| АНТИ-PD-L1 АНТИТЕЛО И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2783685C2 |
| АНТИТЕЛА АНТИ-TNFRSF25 | 2017 |
|
RU2746314C2 |
| АНТИ-αvβ8 АНТИТЕЛА И КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2812478C2 |
| АНТИ-PD-1 АНТИТЕЛА | 2017 |
|
RU2752832C2 |
| НОВЫЕ АНТИ-PD-1 АНТИТЕЛА | 2016 |
|
RU2729830C2 |
| НОВЫЕ АНТИ-PD-L1 АНТИТЕЛА | 2017 |
|
RU2776121C2 |
| НОВЫЕ АНТИ-PD-L1 АНТИТЕЛА | 2017 |
|
RU2744959C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ЧЕЛОВЕКА К БЕЛКУ ПРОГРАММИРУЕМОЙ СМЕРТИ 1 (PD-1) И СПОСОБЫ ЛЕЧЕНИЯ РАКА С ИСПОЛЬЗОВАНИЕМ АНТИ-PD-1-АНТИТЕЛ САМОСТОЯТЕЛЬНО ИЛИ В КОМБИНАЦИИ С ДРУГИМИ ИММУНОТЕРАПЕВТИЧЕСКИМИ СРЕДСТВАМИ | 2016 |
|
RU2732924C2 |
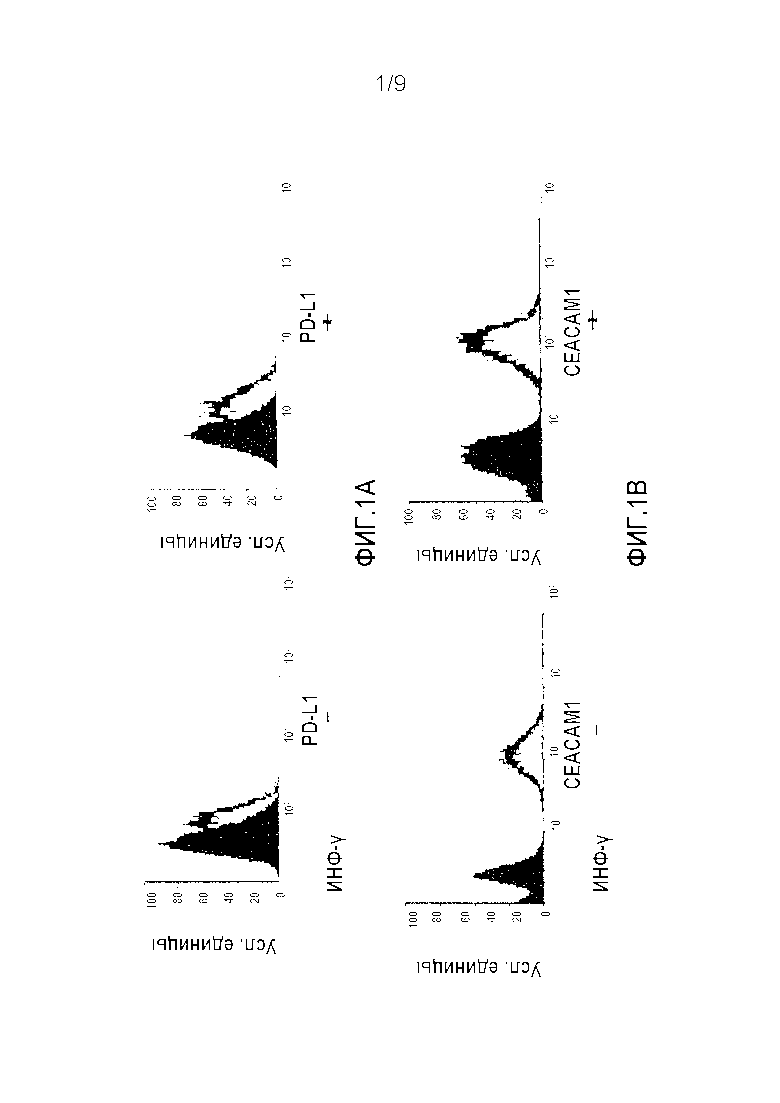
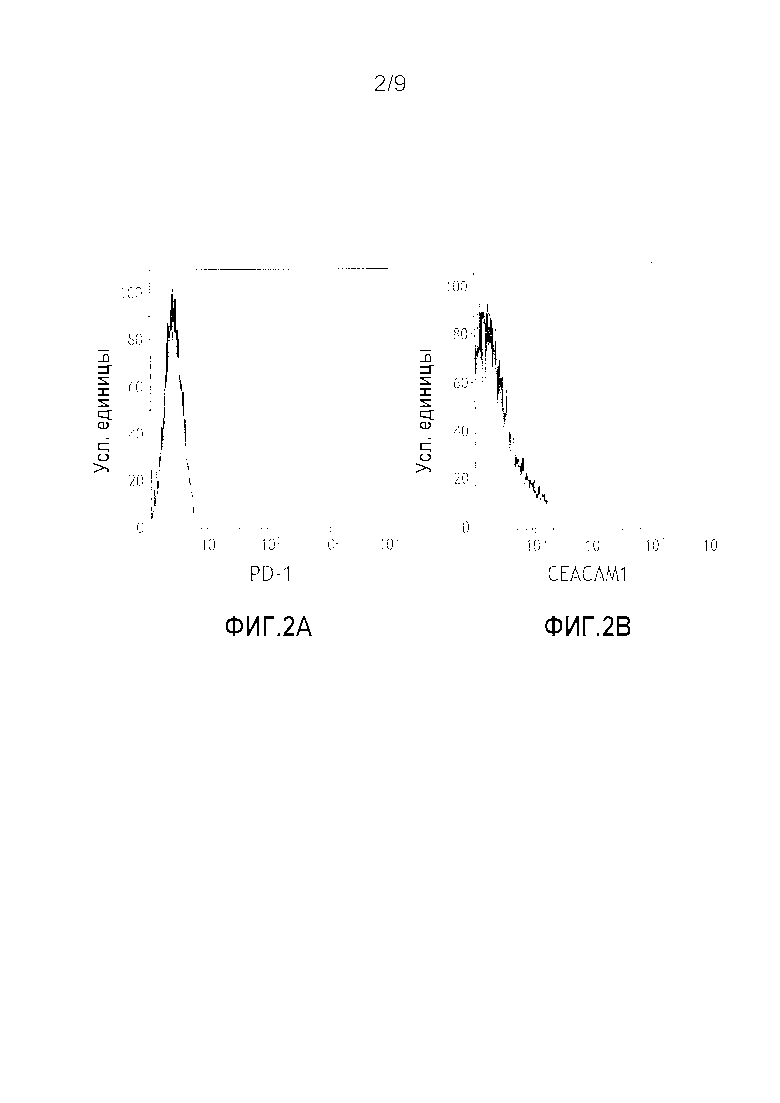
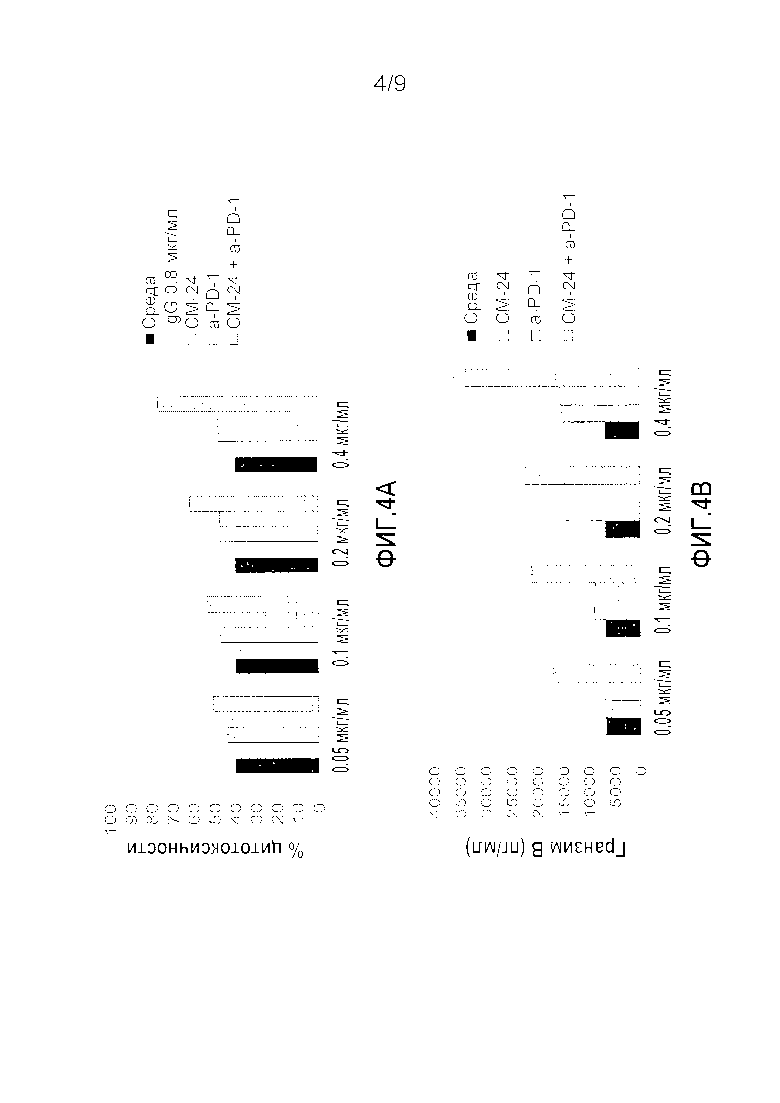
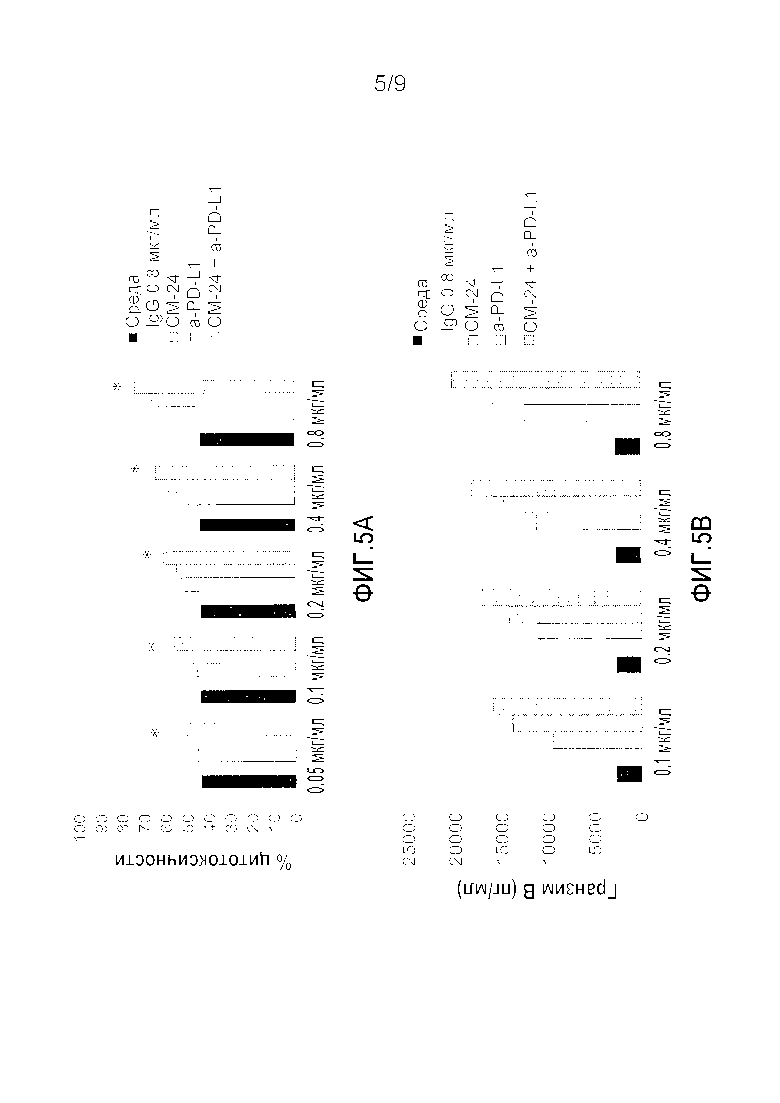
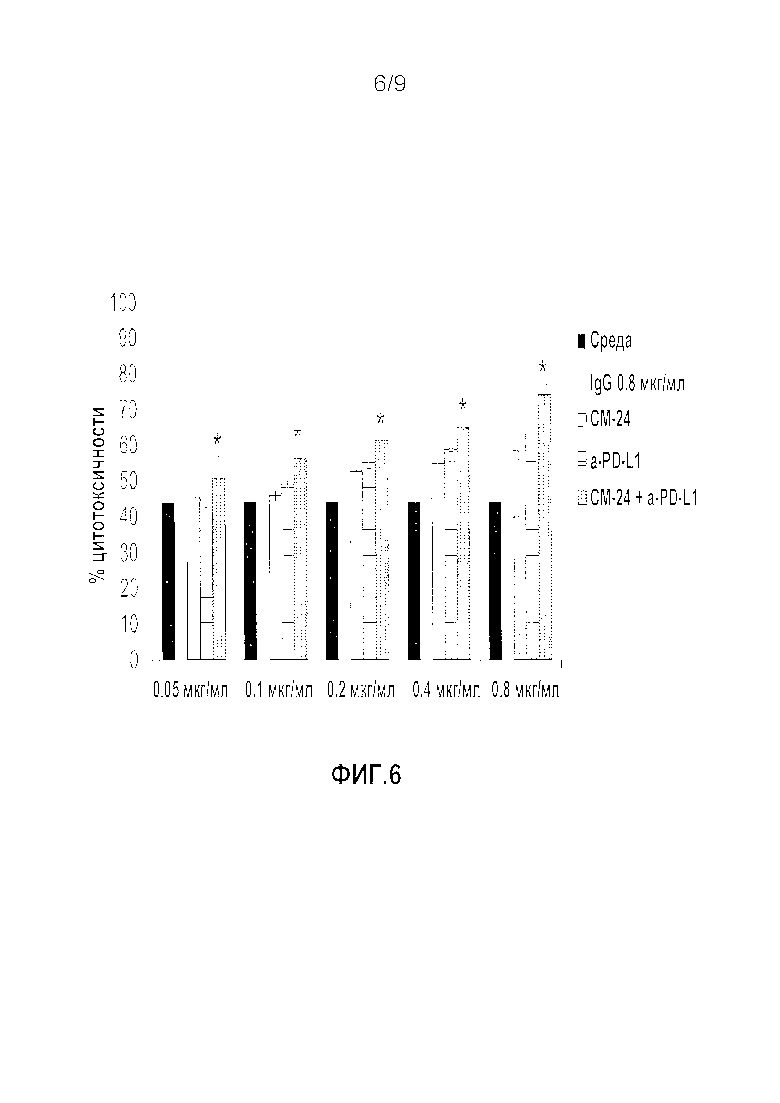
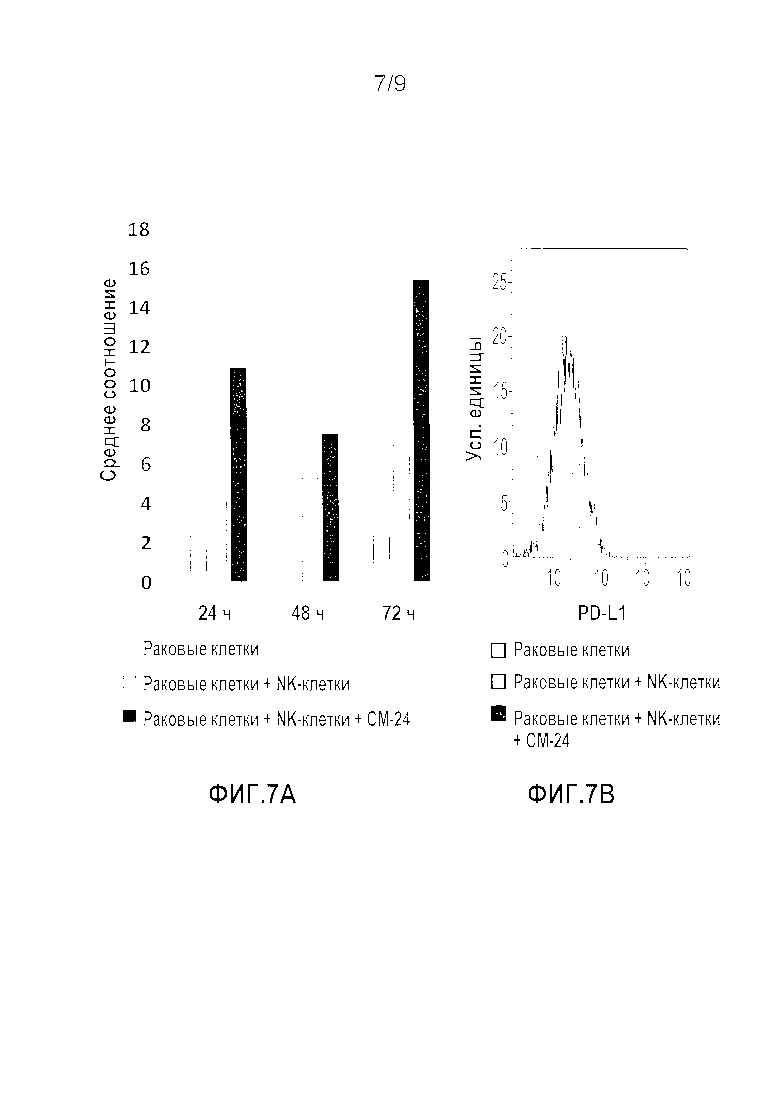
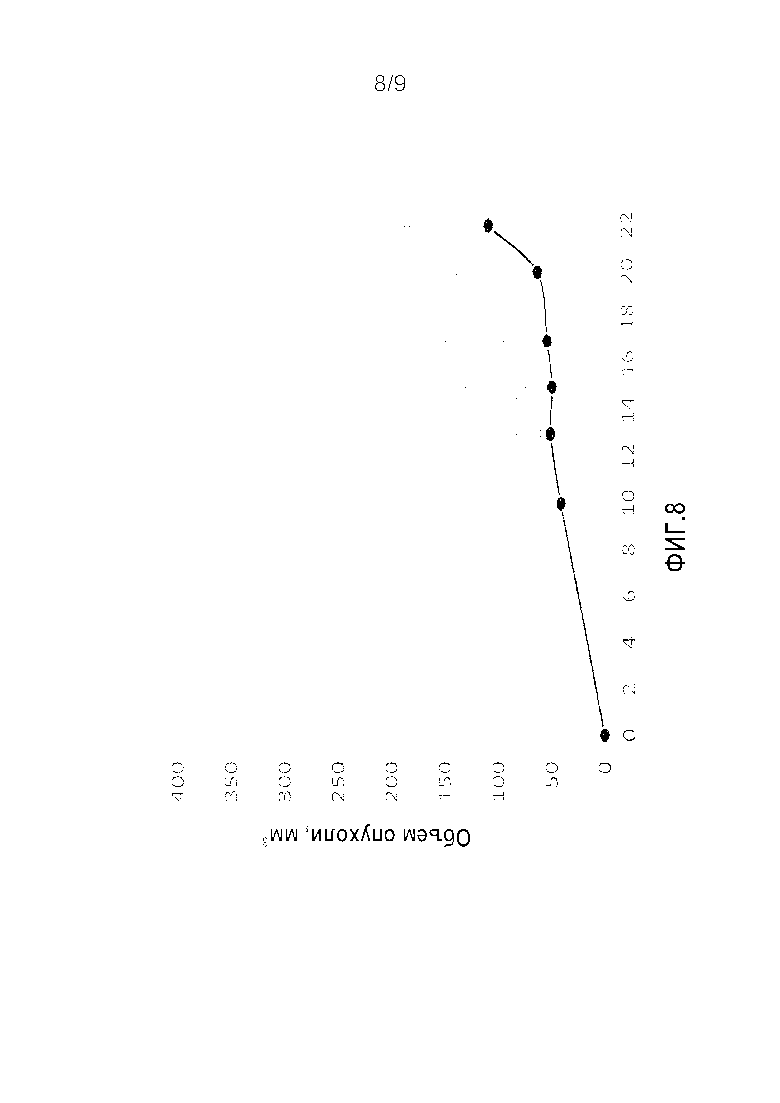
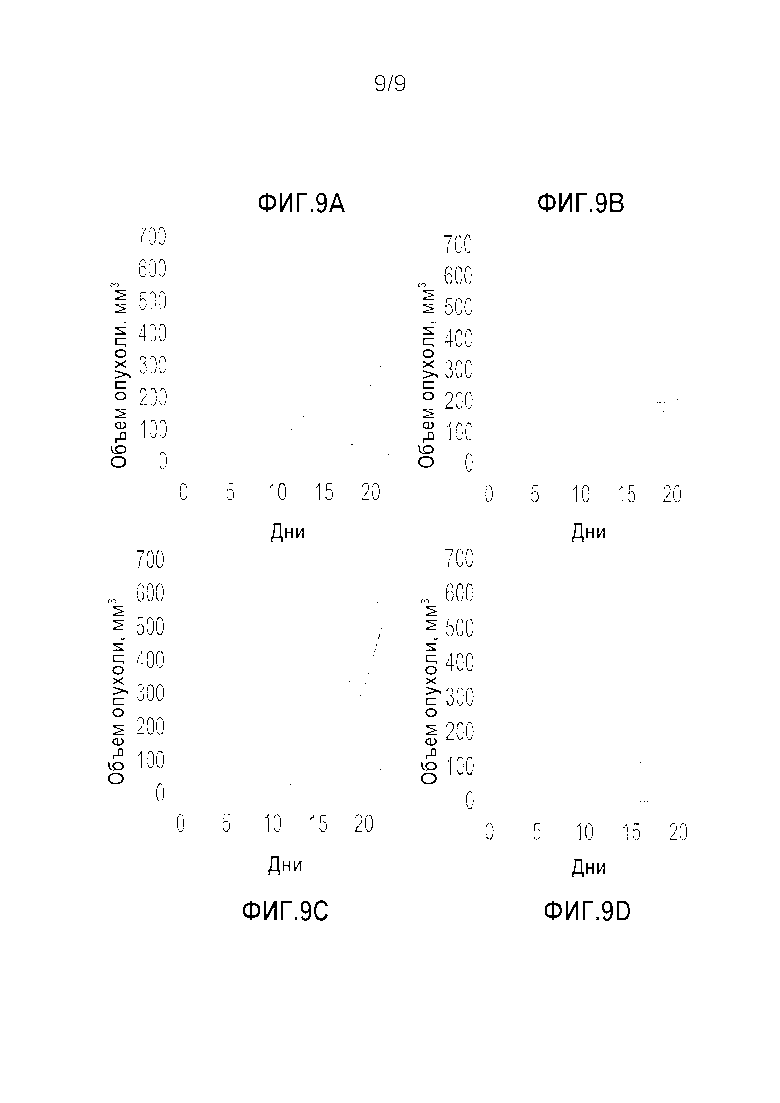
Группа изобретений относится к лечению злокачественного новообразования. Комбинация для раздельного введения содержит фармацевтическую композицию, содержащую моноклональное анти-CEACAM1 антитело человека или его антигенсвязывающий фрагмент; и фармацевтическую композицию, содержащую моноклональное антитело против одного из PD-1 человека, PD-L1 человека и PD-L2 человека, или его антигенсвязывающий фрагмент; где указанное моноклональное антитело способно ингибировать или блокировать взаимодействие PD-1 с по меньшей мере одним из его лигандов. Также раскрыты способ лечения страдающего раком пациента и набор реагентов с инструкцией по применению. Группа изобретений обеспечивает синергетическое повышение цитотоксичности лимфоцитов. 3 н. и 46 з.п. ф-лы, 9 ил., 2 табл., 10 пр.
1. Комбинация, содержащая
фармацевтическую композицию, содержащую моноклональное анти-CEACAM1 антитело человека или его антигенсвязывающий фрагмент; и
фармацевтическую композицию, содержащую моноклональное антитело против одного из PD-1 человека, PD-L1 человека и PD-L2 человека, или его антигенсвязывающий фрагмент; где указанное моноклональное антитело способно ингибировать или блокировать взаимодействие PD-1 с по меньшей мере одним из его лигандов;
для лечения злокачественного новообразования при раздельном введении.
2. Комбинация по п.1, содержащая моноклональное анти-CEACAM1 антитело человека и моноклональное анти-PD-1 антитело человека.
3. Комбинация по п.1, содержащая моноклональное анти-CEACAM1 антитело человека и моноклональное анти-PD-L1 антитело человека.
4. Комбинация по п.1, содержащая моноклональное анти-CEACAM1 антитело человека и моноклональное анти-PD-L2 антитело человека.
5. Комбинация по п.1, в которой указанное моноклональное анти-CEACAM1 антитело человека или его антигенсвязывающий фрагмент способно связываться с белком CEACAM1 человека с аффинностью, равной по меньшей мере примерно 10-8М.
6. Комбинация по п.5, в которой указанное моноклональное анти-CEACAM1 антитело человека или его антигенсвязывающий фрагмент способно связываться по меньшей мере с белком CEACAM3 человека или с белком CEACAM5 человека с аффинностью, равной по меньшей мере примерно 5×10-7М.
7. Комбинация по п.1, в которой указанное моноклональное анти-CEACAM1 антитело человека выбрано из группы, состоящей из: CM-24, 26H7, 5F4, TEC-11, 12-140-4, 4/3/17, COL-4, F36-54, 34B1, YG-C28F2, D14HD11, b18.7.7, D11-AD11, HEA81, B1.1, CLB-gran-10, F34-187, T84.1, B6.2, B1.13, YG-C94G7, 12-140-5, scFv DIATHIS1, TET-2, их антигенсвязывающих фрагментов и любой их комбинации.
8. Комбинация по п.1, в которой указанное моноклональное анти-CEACAM1 антитело человека или его антигенсвязывающий фрагмент содержит
CDR1 тяжелой цепи, содержащую последовательность SEQ ID NO:1,
CDR2 тяжелой цепи, содержащую последовательность SEQ ID NO:2,
CDR3 тяжелой цепи, содержащую последовательность SEQ ID NO:3,
CDR1 легкой цепи, содержащую последовательность SEQ ID NO:4,
CDR2 легкой цепи, содержащую последовательность SEQ ID NO:5, и
CDR3 легкой цепи, содержащую последовательность SEQ ID NO:6.
9. Комбинация по п.1, в которой указанное моноклональное анти-PD-1 антитело человека выбрано из группы, состоящей из: MK-3475, AMP514, BMS-936558, CT-011, их антигенсвязывающих фрагментов и любой их комбинации.
10. Комбинация по п.1, в которой указанное моноклональное анти-PD-L1 антитело человека выбрано из группы, состоящей из: MEDI-4736, BMS-936559, MSB0010718C, MPDL3280A, их антигенсвязывающих фрагментов и любой их комбинации.
11. Комбинация по п.1, в которой указанные моноклональные антитела представляют собой гуманизированные моноклональные антитела или моноклональные антитела человека.
12. Комбинация по любому из пп.1-11, дополнительно содержащая лимфоцит человека.
13. Комбинация по п.12, в которой указанный лимфоцит экспрессирует CEACAM1, PD-1 или оба этих белка.
14. Комбинация по п.13, в которой указанный лимфоцит экспрессирует CEACAM1 и PD-1.
15. Комбинация по п.12, в которой указанный лимфоцит выбран из группы, состоящей из опухоль-инфильтрирующего лимфоцита (ОИЛ), лимфокин-активированной клетки-киллера (ЛАК), цитокин-индуцированной клетки-киллера (ЦИК), T-лимфоцита, B-лимфоцита, NK-клетки и любой их комбинации.
16. Комбинация по п.15, в которой указанный лимфоцит выбран из группы, состоящей из: ОИЛ-клетки и ЛАК-клетки.
17. Комбинация по п.12, в которой указанный лимфоцит является активированным.
18. Комбинация по п.12, в которой указанный лимфоцит является цитотоксичным для раковой клетки.
19. Комбинация по п.18, в которой указанная раковая клетка экспрессирует CEACAM1, PD-L1, PD-L2 или любую их комбинацию.
20. Комбинация по п.19, в которой указанная раковая клетка экспрессирует CEACAM1 и PD-L1.
21. Комбинация по п.19, в которой указанная раковая клетка экспрессирует CEACAM1 и PD-L2.
22. Комбинация по п.1, в которой указанный рак выбран из группы, состоящей из: меланомы, лимфомы, рака легких, рака щитовидной железы, рака молочной железы, рака толстой кишки, рака предстательной железы, рака печени, рака мочевого пузыря, рака почки, рака шейки матки, рака поджелудочной железы, лейкоза, миелоидного рака, рака яичников, рака матки, саркомы, рака желчного пузыря и рака клеток эндометрия.
23. Комбинация по п.22, в которой указанный рак выбран из группы, состоящей из меланомы и лимфомы.
24. Комбинация по п.1, в которой моноклональное антитело против по меньшей мере одной из следующих молекул: PD-1, PD-L1 и PD-L2 человека, способно ингибировать или блокировать взаимодействие между PD-1 человека и его лигандами.
25. Способ лечения страдающего раком пациента, включающий стадии введения указанному пациенту:
(i) фармацевтической композиции, содержащей моноклональное анти-CEACAM1 антитело человека или его антигенсвязывающий фрагмент; и
(ii) фармацевтической композиции, содержащей моноклональное антитело против по меньшей мере одного из PD-1 человека, PD-L1 человека и PD-L2 человека или его антигенсвязывающий фрагмент; где указанное моноклональное антитело способно ингибировать или блокировать взаимодействие PD-1 и по меньшей мере одного его лиганда;
осуществляя тем самым лечение рака.
26. Способ по п.25, включающий введение указанному пациенту:
(i) фармацевтической композиции, содержащей моноклональное анти-CEACAM1 антитело человека или его антигенсвязывающий фрагмент; и
(ii) фармацевтической композиции, содержащей моноклональное анти-PD-1 антитело человека или его антигенсвязывающий фрагмент.
27. Способ по п.25, включающий введение указанному пациенту:
(i) фармацевтической композиции, содержащей моноклональное анти-CEACAM1 антитело человека или его антигенсвязывающий фрагмент; и
(ii) фармацевтической композиции, содержащей моноклональное анти-PD-L1 антитело человека или его антигенсвязывающий фрагмент.
28. Способ по п.27, в котором указанное моноклональное анти-PD-L1 антитело человека вводится указанному пациенту перед введением указанного моноклонального анти-CEACAM1 антитела человека.
29. Способ по п.27, в котором указанное моноклональное анти-PD-L1 антитело человека вводится указанному пациенту одновременно с указанным моноклональным анти-CEACAM1 антителом человека.
30. Способ по п.27, в котором указанное моноклональное анти-PD-L1 антитело человека вводится указанному пациенту после введения указанного моноклонального анти-CEACAM1 антитела человека.
31. Способ по п.25, включающий введение указанному пациенту:
(i) фармацевтической композиции, содержащей моноклональное анти-CEACAM1 антитело человека или его антигенсвязывающий фрагмент; и
(ii) фармацевтической композиции, содержащей моноклональное анти-PD-L2 антитело человека или его антигенсвязывающий фрагмент.
32. Способ по п.31, в котором указанное моноклональное анти-PD-L2 антитело человека вводится указанному пациенту перед введением указанного моноклонального анти-CEACAM1 антитела человека.
33. Способ по п.31, в котором указанное моноклональное анти-PD-L2 антитело человека вводится указанному пациенту одновременно с указанным моноклональным анти-CEACAM1 антителом человека.
34. Способ по п.31, в котором указанное моноклональное анти-PD-L2 антитело человека вводится указанному пациенту после введения указанного моноклонального анти-CEACAM1 антитела человека.
35. Способ по любому из пп.25-34, дополнительно включающий введение указанному пациенту фармацевтической композиции, содержащей лимфоцит.
36. Способ по п.35, в котором указанный лимфоцит предварительно инкубируют с моноклональным анти-CEACAM1 антителом человека или с моноклональным анти-PD-1 антителом человека перед введением.
37. Способ по п.36, в котором указанный лимфоцит предварительно инкубируют с моноклональным анти-CEACAM1 антителом человека и с моноклональным анти-PD-1 антителом человека перед введением.
38. Способ по п.37, в котором перед указанным введением указанный лимфоцит предварительно инкубируют с моноклональным анти-PD-1 антителом человека, а затем инкубируют с моноклональным анти-CEACAM1 антителом человека.
39. Способ по п.35, в котором указанный лимфоцит экспрессирует CEACAM1, PD-1 или оба этих белка.
40. Способ по п.39, в котором указанный лимфоцит экспрессирует CEACAM1 и PD-1.
41. Способ по п.35, в котором указанный лимфоцит выбран из группы, состоящей из ОИЛ-клетки, ЛАК-клетки, ЦИК-клетки, T-лимфоцита, B-лимфоцита, NK-клетки и любой их комбинации.
42. Способ по п.35, в котором указанный лимфоцит представляет собой аутологичный лимфоцит.
43. Способ по п.35, в котором указанный лимфоцит является активированным.
44. Способ по п.25, в котором указанный рак экспрессирует CEACAM1, PD-L1, PD-L2 или любую их комбинацию.
45. Способ по п.44, в котором указанный рак экспрессирует CEACAM1 и PD-L1.
46. Способ по п.44, в котором указанный рак экспрессирует CEACAM1 и PD-L2.
47. Способ по п.25, в котором указанный рак выбран из группы, состоящей из меланомы, лимфомы, рака легких, рака щитовидной железы, рака молочной железы, рака толстой кишки, рака предстательной железы, рака печени, рака мочевого пузыря, рака почки, рака шейки матки, рака поджелудочной железы, лейкоза, миелоидного рака, рака яичников, рака матки, саркомы, рака желчного пузыря и рака клеток эндометрия.
48. Способ по п.47, в котором указанный рак выбран из группы, состоящей из меланомы и лимфомы.
49. Набор реагентов, включающий:
(i) фармацевтическую композицию, содержащую моноклональное анти-CEACAM1 антитело человека или его антигенсвязывающий фрагмент;
(ii) фармацевтическую композицию, содержащую моноклональное антитело против по меньшей мере одного из PD-1 человека, PD-L1 человека и PD-L2 человека, или его антигенсвязывающий фрагмент; и
(iii) инструкцию по применению набора.
| КОМПЛЕКСЫ НА ОСНОВЕ РНК И КАТИОННЫХ ПЕПТИДОВ ДЛЯ ТРАНСФЕКЦИИ И ИММУНОСТИМУЛЯЦИИ | 2008 |
|
RU2493256C2 |
| US 20120064100 A1, 15.03.2012. | |||
Авторы
Даты
2019-08-15—Публикация
2014-11-25—Подача