Настоящее изобретение относится к лечению неоплазмы мочевых путей, в частности, к иммунотерапии рака мочевого пузыря.
Неоплазмы, поражающие мочевые пути, относятся к наиболее быстро увеличивающимся случаям неоплазм во всем мире, прежде всего из-за быстрого старения популяций в большинстве стран. Рак мочевого пузыря является наиболее часто встречающимся среди неоплазм мочевых путей. Только в Соединенных Штатах каждый год новые случаи заболевания раком мочевого пузыря диагностируются у более чем 70000 человек, из них 80% относятся к неинвазивному раку мочевого пузыря. Например, по данным Американского онкологического общества в 2016 г. выявлено 76960 случаев рака мочевого пузыря, что в 16390 случаях привело к смерти (http://www.cancer.org/acs/groups/content/@research/documents/document/acspc-047079.pdf). Во всем мире рак мочевого пузыря занимает 9 место среди основных видов рака, ежегодно выявляют 430000 новых его случаев (World Cancer Report 2014. World Health Organization. 2014, глава 1.1. ISBN 9283204298) и с ним ежегодно связано примерно 165000 случаев смерти. Кроме того, существует вероятность рецидива рака мочевого пузыря, и поэтому пациенты с раком мочевого пузыря должны находиться под наблюдением в течение длительного периода времени. 5-летняя общая выживаемость при раке мочевого пузыря составляет 77%, и этот показатель не претерпел существенного изменения в течение последних 10 лет, т.е. периода, в течение которого никаких новых лекарственных средств против рака мочевого пузыря не было одобрено FDA. Если учитывать зависимость от стадии, то 5-летная относительная выживаемость пациентов с опухолями, ограниченными внутренним слоем мочевого пузыря, или с болезнью, локализованной на мочевом пузыре, составляет 96% и 69% соответственно. Показатели снижаются до 34% для пациентов с болезнью, распространившейся локально за пределы мочевого пузыря и до 6% для пациентов с отдаленными метастазами. Хотя в большинстве впервые диагностированных случаев рака мочевого пузыря не происходит инвазии в мышечный слой, пациенты с высоко злокачественными опухолями все же имеют существенный риск связанной с раком смерти. Рецидив опухоли важен также даже для пациентов с болезнью низкой степени злокачественности и требует продолжительного периода наблюдения.
Большинство видов рака (раков) мочевого пузыря начинается в переходных эпителиальных клетках, которые образуют внутреннюю выстилку мочевого пузыря (уротелий, известный также как уроэпителий). По мере роста этих опухолей они могут внедряться в окружающую соединительную ткань и мышцу. При запущенной болезни опухоли распространяются за пределы мочевого пузыря в близлежащие лимфатические узлы или органы тазовой области или метастазируют в более отдаленные органы, такие как легкие, печень или кость. Уротелий, который представляет собой «переходный эпителий», выстилает значительную часть мочевых путей, включая почечные лоханки, мочеточники, мочевой пузырь и части мочеиспускательного канала. Наиболее распространенным типом рака мочевого пузыря, в частности, и рака мочевых путей, в целом, является рак, поражающий уротелий (уроэпителий), который называют «переходно-клеточной карциномой» (ТСС, которую называют также «карциномой из уротелиальных клеток»). Примерно 90% случаев рака мочевого пузыря классифицируют как ТСС, а оставшиеся 10% представляют собой в основном плоскоклеточный рак или аденокарциному (Fair W.R., Fuks Z.Y., Scher H.I. Cancer: Principles & Practice of Oncology, под ред. DeVita V.T., Hellman S. Rosenberg S.A., 4-ое изд., изд-во J.В. Lippincott Co., Philadelphia, PA. 1993, cc. 1052-1072.). В момент первоначального диагноза 75% опухолей являются «поверхностными», т.е. они (еще) не проникли в мышечный слой, и их, как правило, классифицируют согласно «TNM Classification of Malignant Tumours» как pTa, pT1 или pTIS. Из них 50-80% могут иметь один или несколько рецидивов, а 15-25% могут развиваться в инвазивные опухоли (Messing Е.М. Urothelial tumors of the bladder. В: Wein A.J., и др. Campbell-Walsh Urology. Philadelphia, Pa.: Saunders Elsevier; 2007, c. 1445.).
Лечение неоплазмы мочевых путей, в частности, рака мочевого пузыря, зависит от глубины инвазии неоплазмы в стенку мочевых путей.
Стандартное лечение пациентов с инвазирующим в мышечный слой раком мочевого пузыря включает химиотерапию на основе цисплатина с последующим хирургическим удалением мочевого пузыря или лучевую терапию и сопутствующую химиотерапию. Рекуррентный рак мочевого пузыря лечат с использованием режимов комбинированной химиотерапии, включающих гемцитабин плюс цисплатин (GC) или метотрексат, винбластин, доксорубицин и цисплатин (MVAC).
Стандартное лечение пациентов с неинвазирующим в мышечный слой раком мочевого пузыря включает хирургическое удаление опухоли с последующей одной дозой химиотерапии, как правило, митомицина С, которую вводят внутрипузырно (внутрипузырная химиотерапия). Иссечение рака может приводить к излечению некоторых пациентов с ранней стадией болезни. Однако это непригодно для всех пациентов, или рак может не поддаваться обнаружению на достаточно ранней стадии. В альтернативном или дополнительном варианте иногда осуществляют применяемую местно химиотерапию. Поверхностные опухоли (примерно 75% ТСС) можно «сбривать» с использованием устройства в виде электроножа, присоединенного к цистоскопу, который в таком случае называют резектоскопом. Процедура называется трансуретальная резекция (TUR) и служит, прежде всего, для определения стадии патологического процесса. В случае неинвазирующего в мышечный слой рака мочевого пузыря трансуретальная резекция может сама по себе являться лечением, но во многих случаях, таких как инвазирующий в мышечный слой рак, этой процедуры недостаточно для окончательного лечения («European Association of Urology (EAU)-Guidelines-Online Guidelines». Uroweb.org. Retrieved 2015-05-07).
После восстановления после хирургического вмешательства за пациентами с пониженным риском развития заболевания можно осуществлять наблюдение или их можно подвергать внутрипузырной химиотерапии. Однако рак мочевого пузыря может быть агрессивным также и на ранних стадиях, например, в случае карциномы in situ (CIS). CIS представляет собой наиболее агрессивную стадию неинвазирующего в мышечный слой рака мочевого пузыря и, как установлено, часто является устойчивой к принятому в настоящее время лечению. Пациенты, страдающие заболеванием от умеренной до высокой степени злокачественности, часто получают внутрипузырную иммунотерапию с использованием ослабленной живой бактерии, такой как бацилла Кальметта-Герена (БЦЖ).
БСЖ представляет собой первое одобренное FDA иммунотерапевтическое средство и способствует снижению риска рецидива рака мочевого пузыря путем стимуляции иммунного ответа, мишенью которого являются бактерии, а также любые раковые клетки мочевого пузыря. Таким образом, иммунотерапия в форме инсталляции (закапывания) бацилл Кальметта-Герена (БЦЖ) выступает в качестве альтернативного лечения ТСС и предупреждения рецидива поверхностных опухолей ( , Recent knowledge on BCG's mechanism of action in the treatment of superficial bladder cancer. Braz J Urol 26, 2000, c. 488; Burger и др., The application of adjuvant autologous intravesical macrophage cell therapy vs. BCG in non-muscle invasive bladder cancer: a multicenter randomized trial. J Transl Med 8, 2010, c. 54). В случае поверхностных форм рака мочевого пузыря, таких как ТСС, БЦЖ даже становится наиболее широко применяемым агентом для местной, например, внутрипузырной, терапии и в настоящее время рассматривается в качестве наиболее эффективного агента при указанном поверхностном раке мочевого пузыря. Установлено, что терапия с использованием БЦЖ замедляет, хотя необязательно предотвращает, развитие опухоли до более запущенной стадии, снижает потребность в последующей цистэктомии и повышает общую выживаемость. В настоящее время БЦЖ является единственным агентом, одобренным FDA в качестве первичной терапии карциномы in situ мочевого пузыря. Болезнь - специфическая 15-летняя выживаемость, составляющая 63% при использовании БЦЖ, по благоприятному действию на пациентов сравнима с цистэктомией, проведенной на ранней стадии указанного заболевания. Для того чтобы вакцина на основе БЦЖ обладала эффективностью, хозяин должен быть иммунокомпетентным, опухоль, которую он несет, должна быть небольшой, должен иметь место непосредственный контакт с опухолью, а доза должна быть такой, чтобы индуцировать противоопухолевый ответ. Четко установлено, что лечение БЦЖ может ликвидировать этот рак у 70% пациентов с карциномой in situ, которые удовлетворяли указанным критериям. Для предупреждения рецидива рака необходима длительная поддерживающая терапия после фазы индукции.
, Recent knowledge on BCG's mechanism of action in the treatment of superficial bladder cancer. Braz J Urol 26, 2000, c. 488; Burger и др., The application of adjuvant autologous intravesical macrophage cell therapy vs. BCG in non-muscle invasive bladder cancer: a multicenter randomized trial. J Transl Med 8, 2010, c. 54). В случае поверхностных форм рака мочевого пузыря, таких как ТСС, БЦЖ даже становится наиболее широко применяемым агентом для местной, например, внутрипузырной, терапии и в настоящее время рассматривается в качестве наиболее эффективного агента при указанном поверхностном раке мочевого пузыря. Установлено, что терапия с использованием БЦЖ замедляет, хотя необязательно предотвращает, развитие опухоли до более запущенной стадии, снижает потребность в последующей цистэктомии и повышает общую выживаемость. В настоящее время БЦЖ является единственным агентом, одобренным FDA в качестве первичной терапии карциномы in situ мочевого пузыря. Болезнь - специфическая 15-летняя выживаемость, составляющая 63% при использовании БЦЖ, по благоприятному действию на пациентов сравнима с цистэктомией, проведенной на ранней стадии указанного заболевания. Для того чтобы вакцина на основе БЦЖ обладала эффективностью, хозяин должен быть иммунокомпетентным, опухоль, которую он несет, должна быть небольшой, должен иметь место непосредственный контакт с опухолью, а доза должна быть такой, чтобы индуцировать противоопухолевый ответ. Четко установлено, что лечение БЦЖ может ликвидировать этот рак у 70% пациентов с карциномой in situ, которые удовлетворяли указанным критериям. Для предупреждения рецидива рака необходима длительная поддерживающая терапия после фазы индукции.
Как правило, БЦЖ вводят еженедельно в течение 6 недель. Можно применять второй 6-недельный курс, если повторная цистоскопия выявила персистентность или рецидив опухоли. Современные данные свидетельствуют о том, что поддерживающая терапия с еженедельной обработкой в течение 3 недель каждые 6 месяцев на протяжении 1-3 лет может обеспечивать более длительный результат. Периодические биопсии мочевого пузыря, как правило, необходимы для оценки ответа. В то время как эффективность БЦЖ, как правило, рассматривается в качестве соответствующей, ее применение дискутируется в случае пациентов с низким или промежуточным риском, при этом лимитирующим фактором является токсичность (Babjuk М. и др., EAU. Guidelines on Non-Muscle-Invasive Urothelial Carcinoma of the Bladder. Eur Urol 54(2), 2008, c. 303; Denzinger S. и др., Versus deferred cystectomy for initial high-risk pT1G3 urothelial carcinoma of the bladder: do risk factors define feasibility of bladdersparing approach? Eur Urol 53(1), 2008, c. 146; Witjes, Management of BCG failures in superficial bladder cancer: a review. Eur Urol 49(5), 2006, c. 790).
Нежелательные явления, обусловленные БЦЖ, связаны с ее механизмом действия. БЦЖ стимулирует иммунную реакцию и происходит локальный и системный воспалительный ответ. Наиболее часто встречающиеся связанные с иммунотерапией нежелательные явления включают констелляцию напоминающих грипп и цистит симптомов. Системная токсичность, а именно проявляющаяся в виде лихорадки, встречается у вплоть до 20% пациентов. Описано, что из-за нежелательных явлений значительная часть пациентов прекратила лечение с использованием БЦЖ и многие урологи ограничили ее применение (Herr. Is maintenance Bacillus 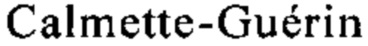 really necessary? Eur Urol 54(5), 2008, cc. 971-973). БЦЖ действует через сложные и разнообразные механизмы путем стимуляции опосредуемого Т-клетками локального иммунного ответа посредством различных цитокинов (Zlotta A.R. и др., What are the immunologically active components of bacille
really necessary? Eur Urol 54(5), 2008, cc. 971-973). БЦЖ действует через сложные и разнообразные механизмы путем стимуляции опосредуемого Т-клетками локального иммунного ответа посредством различных цитокинов (Zlotta A.R. и др., What are the immunologically active components of bacille 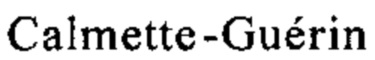 in therapy of superficial bladder cancer? Int J Cancer 87(6), 2000, c. 844; Luo Y. и др., Role of Th1-stimulating cytokines in bacillus
in therapy of superficial bladder cancer? Int J Cancer 87(6), 2000, c. 844; Luo Y. и др., Role of Th1-stimulating cytokines in bacillus 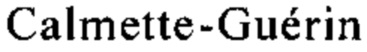 (BCG)-induced macrophage cytotoxicity against mouse bladder cancer MBT-2 cells. Clin Exp Immunol 146(1), 2006, c. 181). В результате этого запускается связанное с гранулоцитами противоопухолевое действие и цитотоксичность макрофагов (Ayari С.и др., Bladder tumour infiltrating mature dendritic cells and macrophages as predictors of response to bacillus
(BCG)-induced macrophage cytotoxicity against mouse bladder cancer MBT-2 cells. Clin Exp Immunol 146(1), 2006, c. 181). В результате этого запускается связанное с гранулоцитами противоопухолевое действие и цитотоксичность макрофагов (Ayari С.и др., Bladder tumour infiltrating mature dendritic cells and macrophages as predictors of response to bacillus  immunotherapy. Eur Urol 55(6), 2009, c. 1386; de Reijke. Editorial comment on: Bladder tumour infiltrating mature dendritic cells and macrophages as predictors of response to bacillus
immunotherapy. Eur Urol 55(6), 2009, c. 1386; de Reijke. Editorial comment on: Bladder tumour infiltrating mature dendritic cells and macrophages as predictors of response to bacillus  immunotherapy. Eur Urol 55(6), 2009, c. 1395; Takayama H. и др., Increased infiltration of tumor associated macrophages is associated with poor prognosis of bladder carcinoma in situ after intravesical bacillus Calmette-Guerin instillation. J Urol 181(4), 2009, c. 1894; Brandau. Tumour-associated macrophages: predicting bacillus Calmette-Guerin immunotherapy outcomes. J Urol 181(4), 2009, c. 1532; Siracusano S. и др., The role of granulocytes following intravesical BCG prophylaxis. Eur Urol 51(6), 2007, c. 1589; Brandau S. и др., The role of granulocytes following intravesical BCG prophylaxis. Eur Urol 51, 2007, cc. 1589-1599).
immunotherapy. Eur Urol 55(6), 2009, c. 1395; Takayama H. и др., Increased infiltration of tumor associated macrophages is associated with poor prognosis of bladder carcinoma in situ after intravesical bacillus Calmette-Guerin instillation. J Urol 181(4), 2009, c. 1894; Brandau. Tumour-associated macrophages: predicting bacillus Calmette-Guerin immunotherapy outcomes. J Urol 181(4), 2009, c. 1532; Siracusano S. и др., The role of granulocytes following intravesical BCG prophylaxis. Eur Urol 51(6), 2007, c. 1589; Brandau S. и др., The role of granulocytes following intravesical BCG prophylaxis. Eur Urol 51, 2007, cc. 1589-1599).
В целом, растворы БЦЖ являются не имеющими четких характеристик продуктами, которые содержат ослабленную форму бактерии Mycobacterium tuberculosis и поэтому имеют плохой профиль безопасности. Кроме того, иммунотерапия на основе БЦЖ обладает эффективностью только вплоть до 30% случаев указанной неинвазивной стадии опухоли. Пациентов с рецидивами опухоли после лечения БЦЖ сложнее лечить. Для таких пациентов многие врачи рекомендуют цистэктомию. Эта рекомендация основана на официальных руководствах Европейской ассоциации урологов и Американской ассоциации урологов. Однако многие пациенты отказываются от указанной изменяющей жизнь операции и предпочитают попытаться найти новые консервативные варианты лечения, прежде чем прибегнуть к указанному последнему радикальному средству.
Без лечения поверхностные раки могут постепенно начать инфильтрацию в мышечную стенку мочевого пузыря или другие участки мочевых путей. Как следствие, после инфильтрации рака требуется, например, более радикальная хирургия мочевых путей. В этом случае удаляют, например, часть или весь мочевой пузырь путем цистэктомии и отклоняют поток мочи в выделенную петлю кишечника. Для лечения инвазивных форм заболевания, являющихся результатом, например, плохо пролеченных неинвазивных форм, может требоваться применение тяжелой (для пациента) комбинации излучения и химиотерапии. Указанная химиотерапия ассоциирована с серьезными побочными действиями, и ее по возможности следует избегать. Кроме того, может возникать микрометастатическое заболевание, влияющее на продолжительность жизни, источником которого является рак мочевого пузыря. Таким образом, с учетом возникающей впоследствии дополнительной проблемы, необходимы новые варианты лечения, которые включают ранее лечение поверхностного рака мочевого пузыря. Указанный новый вариант лечения на ранней стадии предпочтительно должен позволять избегать применения хирургии и химиотерапии. Таким образом, существует назревшая потребность в разработке действующего вещества, пригодного для лечения неоплазм мочевых путей, таких как неопластическое заболевание мочевого пузыря, прежде всего неинвазивные формы уротелиального рака мочевого пузыря, лечение которых в настоящее время ограничено главным образом применением БЦЖ и хирургии.
Таким образом, существует неудовлетворенная потребность в иммунотерапиях при раке мочевого пузыря, отличных от лечения с помощью БЦЖ. В этом контексте перспективным подходом является применение ингибиторов иммунных контрольных точек (чекпойнтов) для лечения рака мочевого пузыря. Основанные на блокаде ингибирующих молекул или альтернативно этому, активации стимуляторных молекул, указанные пути лечения предназначены для инициации или повышения ранее существующих противораковых иммунных ответов. Например, лиганд PD-1 PD-L1 экспрессируется в 12% опухолевых клеток мочевого пузыря, в 27% инфильтрующих опухоль иммунных клеток и вплоть до 50% злокачественных уротелиальных клеток при карциноме in situ. Кроме того, 95% лимфоцитов, которые вторгаются в опухоли мочевого пузыря, экспрессируют рецептор PD-1. Уротелиальная экспрессия PD-L1 также является прогностическим фактором смертности после цистэктомии у пациентов с ограниченным органом заболеванием. Таким образом, путь PDL1/PD-1 идентифицирован в качестве привлекательной терапевтической мишени для лечения рака мочевого пузыря, аналогичные данные, получены для других эпителиальных опухолей, таких как почечно-клеточный рак, рак легкого и меланома. На осуществляемой в настоящее время фазе II испытания проводят тестирование MPDL3280A в качестве лечения первой линии запущенного рака мочевого пузыря у пациентов, которые не являются кандидатами для лечения с использованием содержащих цисплатин режимов, или в качестве лечения второй линии (NCT02108652). Также активно изучается блокада CTLA-4 в качестве другой иммунотерапевтической стратегии при уротелиальных раках. CTLA-4 играет важную роль в опосредуемой опухолевыми клетками иммуносупрессии, и блокада этой молекулы с помощью моноклонального антитела к CTLA-4 ипилимумаба усиливает функцию Т-лимфоцитов, что приводит к выраженным ответам опухоли при меланоме, почечно-клеточной карциноме и немелкоклеточном раке легкого. Лечение пациентов с локализованным раком мочевого пузыря перед цистэктомией с помощью ипилимумаба продемонстрировало целесообразность и безопасность такого подхода (Carthon B.C., Wolchok J.D., Yuan J., Kamat A., Ng Tang D.S., Sun J. и др.: Preoperative CTLA-4 blockade: tolerability and immune monitoring in the setting of a presurgical clinical trial. Clin Cancer Res, 16(10), 2010, cc. 2861-2771). Основываясь на указанных результатах, продолжается фаза II испытания комбинации гемцитабина, цисплатина и ипилимумаба в качестве лечения первой линии метастатической уротелиальной карциномы (NCT01524991). Кроме того, на основе результатов доклинического испытания, в которых установлена возможность повышения противоопухолевой активности в сочетании с иммунотерапиями (например, антитела к PD-1, антитела к CTLA-4 и вакцины), начаты продолжающиеся в настоящее время клинические испытания по исследованию безопасности и эффективности комбинаций, включающих антитело к PD-L1, антитело к CTLA-4 и агонист ОХ-40, в отношении запущенных солидных опухолей, включая рак мочевого пузыря (NCT02205333).
Однако, несмотря на важную клиническую значимость, с ингибитором контрольных точек, который «запускает» иммунные ответы, связан уникальный спектр серьезных побочных действий, которые обозначают как нежелательные явления, ассоциированные с вовлечением иммунной системы (irAEs) или иногда нежелательные явления, представляющие особый интерес (Naidoo J., Page D.B., Li B.T., Connell L.C., Schindler K., Lacouture M.E., Postow M.A., Wolchok J.D.: Toxicities of the anti-PD-1 and anti-PD-L1 immune checkpoint antibodies. Ann Oncol. 26(12), 2015, c. 2375; Champiat S., Lambotte O., Barreau E., Belkhir R., Berdelou A., Carbonnel F., Cauquil C., Chanson P., Collins M., Durrbach A., Ederhy S., Feuillet S., Francois H., Lazarovici J., Le Pavec J., De Martin E., Mateus C., Michot J.M., Samuel D., Soria J.C., Robert C., Eggermont A., Marabelle A.: Management of immune checkpoint blockade dysimmune toxicities: a collaborative position paper. Ann Oncol. 28 декабря 2015 г., pii: mdv623. [Epub ahead of print (предварительная публикация до выхода в печать]).
Другим подходом является применения моноспецифических антител против ассоциированных с опухолью антигенов в таргетной терапии. Одним из примеров является препарат ALT-801 (фирма Altor Bioscience Corporation), представляющий собой бифункциональный слитый белок, который содержит интерлейкин-2 (IL-2), связанный с растворимым одноцепочечным доменом Т-клеточного рецептора, который распознает пептидный эпитоп (ак 264-272) человеческого антигена р53, экспонированный на раковых клетках в контексте HLA-A*0201 (p53+/HLA-A*0201). При этом IL-2 таргетирует раковые клетки и активность иммунной системы повышается. На двух фазах I/II испытаний изучается ALT-801 в комбинации с гемцитабином на пациентах с неинвазирующим в мышечный слой раком мочевого пузыря, которые не давали ответ на терапию с применением БЦЖ (NCT01625260), и в комбинации с гемцитабином и цисплатином на пациентах с инвазирующим в мышечный слой раком мочевого пузыря (NCT01326871). Однако предполагается, что указанная таргетная иммунотерапия ограничена пациентами со специфическим типом HLA.
В другом подходе таргетной терапии применяют антитело против ассоциированного с опухолью антигена ЕрСАМ, связанное с экозотоксином А Pseudomonas exotoxin A («Oportuzumab monatox (опортузумаб монатокс)», известный также как VB4-845) (Kowalski и др., A phase II study of oportuzumab monatox: an immunotoxin therapy for patients with noninvasive urothelial carcinoma in situ previously treated with bacillus  J Urol 188, 2012, c. 1712). Для достижения эффективного лечения пациента требуется несколько высоких доз по 100 мг лекарственного средства на основе антитела. Указанные высокие дозы антитела, как правило, несут риск иммунологических побочных действий, и они действительно провоцировали побочные действия у 93,5% пациентов, при этом по меньшей мере 65% были непосредственно ассоциированы с высокими дозами опортузумаба монатокса. Поэтому исследования опортузумаба монатокса не продолжены.
J Urol 188, 2012, c. 1712). Для достижения эффективного лечения пациента требуется несколько высоких доз по 100 мг лекарственного средства на основе антитела. Указанные высокие дозы антитела, как правило, несут риск иммунологических побочных действий, и они действительно провоцировали побочные действия у 93,5% пациентов, при этом по меньшей мере 65% были непосредственно ассоциированы с высокими дозами опортузумаба монатокса. Поэтому исследования опортузумаба монатокса не продолжены.
В свете вышеизложенного существует необходимость в улучшенной иммунотерапии, предназначенной для лечения неоплазмы мочевых путей. Таким образом, задача, положенная в основу настоящего изобретения, заключалась в преодолении недостатков современных иммунотерапии рака мочевого пузыря, которые изложены выше, и в разработке нового соединения, предназначенного для применения при лечении неоплазмы мочевых путей, которое улучшает выживаемость пациентов, страдающих неоплазмой мочевых путей, прежде всего раком мочевого пузыря, и которое имеет более низкий риск побочных действий.
Указанная задача решается с помощью объекта изобретения, изложенного ниже и в прилагаемой формуле изобретения.
Хотя настоящее изобретение подробно описано ниже, следует понимать, что настоящее изобретение не ограничено конкретными методологиями, протоколами и реагентами, указанными в настоящем описании, которые могут варьироваться. Должно быть очевидно также, что применяемая в настоящем описании терминология не ограничивает объем настоящего изобретения, который ограничен только прилагаемой формулой изобретения. Если не указано иное, то все технические и научные понятия, применяемые в контексте настоящего описания, имеют значения, хорошо известные обычному специалисту в данной области.
Ниже описаны элементы настоящего изобретения. Эти элементы перечислены в конкретных вариантах осуществления изобретения, однако, как должно быть очевидно, их можно объединять любым образом и в любом количестве с получением дополнительных вариантов осуществления изобретения. Различные описанные примеры и предпочтительные варианты осуществления изобретения не должны рассматриваться как свидетельствующие о том, что настоящее изобретение ограничено только описанными вариантами осуществления изобретения. Следует понимать, что настоящее описание дано в качестве основы, и оно включает варианты осуществления изобретения, в которых объединены варианты осуществления изобретения, приведенные в недвусмысленном виде, с любым количеством описанных и/или предпочтительных элементов. Кроме того, подразумевается, что любые перестановки и комбинации всех указанных в настоящем описании элементов подпадают под объем настоящего описания, если из контекста не следует иное.
В контексте настоящего описания и в прилагаемой формуле изобретения, если из контекста не следует иное, понятие «содержать» и его вариации, такие как «содержит» и «содержащий» следует рассматривать как включающее указанный член, целое число или стадию, но это не исключает любые другие не указанные член, целое число или стадию. Понятие «состоит из» является конкретным вариантом понятия «содержит», исключая любой другой не указанный член, целое число или стадию. В контексте настоящего изобретения понятие «содержит» включает понятие «состоит из». Так, под понятие «содержащий» подпадает понятие «включающий», а также «состоящий», например, композиция «содержащая» X, может состоять только из X или может включать что-то дополнительно, например, X+Y.
Упоминание понятия в единственном числе и аналогичная ссылка, применяемая в контексте настоящего изобретения (особенно в контексте формулы изобретения) подразумевает его упоминание, как в единственном числе, так и во множественном числе, если из контекста не следует иное или если это не противоречит контексту. Перечисление диапазонов значений в контексте настоящего описания предназначено только в качестве сокращенного метода индивидуального упоминания каждой индивидуальной величины, находящейся в указанном диапазоне. Если не указано иное, то каждая индивидуальная величина включена в настоящее описание, так, если бы она индивидуально упомянута в нем. Ничто из изложенного в спецификации не может толковаться как указывающее на какой-либо незаявленный элемент, имеющий важное значение для воплощения на практике изобретения.
Понятие «практически» не исключает «полностью», например, композиция, которая «практически свободна» от Y может быть полностью свободна от Y. При необходимости понятие «практически» может быть опущено в определении рассматриваемого понятия в настоящем изобретении.
Понятие «примерно» касательно численной величины х означает х ± 10%.
Мультиспецифическое антитело, предназначенное для лечения неоплазм мочевых путей
Первым объектом настоящего изобретения является выделенное мультиспецифическое антитело или его антигенсвязывающий фрагмент, которое/который содержит
(I) специфичность в отношении поверхностного антигена Т-клетки и
(II) специфичность в отношении ассоциированного с раком и/или опухолью антигена,
предназначенное для применения при лечении неоплазмы мочевых путей.
При наличии обеих специфичностей, т.е. специфичности в отношении поверхностного антигена Т-клетки и специфичности в отношении ассоциированного с раком и/или опухолью антигена, мультиспецифические антитела или их антигенсвязывающие фрагменты, предлагаемые в настоящем изобретении, обладают способностью переориентировать Т-клетки к раковым клеткам. Так, «специфичность в отношении поверхностного антигена Т-клетки» означает, в частности, что антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящего изобретению, содержит паратоп, который распознает эпитоп поверхностного антигена Т-клетки. Другими словами, фраза «специфичность в отношении поверхностного антигена Т-клетки» означает, в частности, что антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящего изобретению, содержит сайт связывания для поверхностного антигена Т-клетки. Соответственно «специфичность в отношении ассоциированного с раком и/или опухолью антигена» означает, в частности, что антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящего изобретению, содержит паратоп, который распознает эпитоп ассоциированного с раком и/или опухолью антигена. Другими словами, фраза «специфичность в отношении ассоциированного с раком и/или опухолью антигена» означает, в частности, что антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящего изобретению, содержит сайт связывания ассоциированного с раком и/или опухолью антигена.
Важно отметить, что в отличие от канонических («обычных») антител, которые обладают только одной специфичностью, мультиспецифические антитела обладают способностью связываться по меньшей мере с двумя различными эпитопами, а именно, с одним эпитопом на раковой/опухолевой клетке и одним эпитопом на Т-клетке, тем самым «переориентируя» Т-клетку к раковой/опухолей клетке, что приводит к опосредуемому Т-клеточной цитолизу клетки. Таким образом, мультиспецифические антитела, предлагаемые в настоящем изобретении, обладают способностью переориентировать Т-клетки, т.е. антитело, как правило, обладает способностью реактивировать опухоль специфические Т-клетки, находящиеся в состоянии анергии, и/или направлять Т-клетки к требуемому антигену (что определяется специфичностью антитела в отношении ассоциированного с раком и/или опухолью антигена).
Кроме того, мультиспецифическое антитело или его антигенсвязывающий фрагмент предпочтительно обладает способностью индуцировать опухоль реактивные комплементсвязывающие антитела и тем самым индуцировать гуморальный иммунный ответ. Таким образом, усиливается опосредуемая Т-клетками цитотоксичность и дополнительный иммунитет, что приводит к терапевтическому действию, специфическому в отношении клеток, которые несут являющийся мишенью ассоциированный с раком и/или опухолью антиген. Таким образом, предложены сильные средства для применения с целью эффективного лечения неоплазм мочевых путей.
Указанное антитело или его антигенсвязывающий фрагмент, предлагаемое/предлагаемый в настоящем изобретении, является достаточно сильным, чтобы дозировать его в очень небольших количествах по сравнению с общепринятыми моноспецифическими антителами. Как продемонстрировано в примерах, фактически очень небольшие количества антител, предлагаемых в настоящем изобретении, являются достаточными для достижения терапевтических действий у пациентов с раком мочевого пузыря, т.е. во «враждебной» среде, полностью отличной, например, от крови. Это оказалось неожиданным, поскольку, как правило, считается, что мультиспецифические, например, биспецифические антитела или их антигенсвязывающие фрагменты, в большей степени подвержены снижению функциональности, например, из-за вредных условий, обусловленных рН или электролитами, по сравнению с каноническими моноспецифическими антителами. Причиной этого может быть то, что в отличие от канонических моноспецифических антител мультиспецифические антитела имеют предпочтительно только один единственный паратоп касательно каждой специфичности (т.е. строго один паратоп для каждой специфичности). Например, касательно двухвалентных антител (т.е. антител, которые имеют два паратопа) каноническое моноспецифическое антитело имеет два паратопа с одной и той же специфичностью, что приводит к избыточности, в то время как биспецифическое двухвалентное антитело имеет только один паратоп для каждой специфичности. Таким образом, когда функциональность одного паратопа утрачивается (например, из-за вредных условий, обусловленных рН или электролитами, таких как среда, представляющая собой мочу), моноспецифическое антитело все еще имеет другой паратоп, в то время как биспецифическое антитело полностью утрачивает функциональность (такую как способность переориентировать Т-клетки к раковым клетками). Кроме того, с учетом существенно более низких доз мультиспецифических антител или их антигенсвязывающих фрагментов по сравнению с общепринятыми дозами моноспецифических антител и их антигенсвязывающих фрагментов, также является неожиданным, что эффекты разведения в моче не оказывали существенного воздействия на терапевтические концентрации в мочевых путях.
С другой стороны, низкие дозы существенно снижают риск побочных действий. Таким образом, мультиспецифическое антитело или его антигенсвязывающий фрагмент, предлагаемое/предлагаемый в настоящем изобретении, вносит вклад в уменьшение высвобождения провоспалительных цитокинов. Следует отметить, что высвобождение провоспалительных цитокинов часто происходит в окружающей среде раков и/или опухолей. Таким образом, хроническое воспаление, которое часто обнаруживается в окружающей среде раков и/или опухолей, можно уменьшать при введении заявляемого антитела, предлагаемого в настоящем изобретении. В частности, лечение с использованием мультиспецифического антитела или его антигенсвязывающего фрагмента, предлагаемого в настоящем изобретении, приводит к снижению количества лейкоцитов, поддающегося обнаружению в моче, как это продемонстрировано в примерах. Это приводит к тому, что признаки воспаления, которые в противном случае являются типичными для неоплазмы мочевых путей, в частности, для рака мочевого пузыря, уменьшаются или искореняются, что в свою очередь демонстрирует целительное действие антитела, предлагаемого в настоящем изобретении.
Кроме того, терапевтическая эффективность антитела, предлагаемого в настоящем изобретении, сохраняется в течение по меньшей мере нескольких месяцев, и в случае нежелательного рецидива последующий цикл лечения с помощью предлагаемого мультиспецифического антитела или его антигенсвязывающего фрагмента может реверсировать указанный рецидив без необходимости в хирургическом вмешательстве или даже химиотерапии, что является общепринятым в случае рецидивов после лечения БЦЖ.
В контексте настоящего описания под понятие «антитело» подпадают различные формы антител, предпочтительно моноклональные антитела, включая (но, не ограничиваясь только ими) полные антитела, фрагменты антител, человеческие антитела, химерные антитела, гуманизированные антитела и генетически сконструированные антитела (вариантные или мутантные антитела), если они сохраняют характерные свойства, предлагаемые в изобретении. Предпочтительными являются человеческие или гуманизированные моноклональные антитела и рекомбинантные антитела, прежде всего рекомбинантные антитела. Таким образом, антитело или его антигенсвязывающий фрагмент, предлагаемое/предлагаемый в настоящем изобретении, предпочтительно представляет собой моноклональное антитело или его антигенсвязывающий фрагмент.Кроме того, предпочтительно также, если антитело представляет собой многоцепочечное антитело, т.е. антитело, которое содержит более одной цепи, что отличает его от одноцепочечного антитела.
В контексте настоящего описания подразумевается, что понятие «человеческое антитело» включает антитела, которые имеют вариабельные и константные области, имеющие происхождение из последовательностей человеческого иммуноглобулина. Человеческие антитела хорошо известны в данной области (van Dijk М.А. и van de Winkel J.G., Curr. Opin. Chem. Biol. 5, 2001, cc. 368-374). Человеческие антитела можно получать также в трансгенных животных (например, мышах), которые после иммунизации могут продуцировать полный спектр человеческих антител или выбранные антитела в отсутствии производства эндогенных иммуноглобулинов. Перенос массива генов иммуноглобулинов зародышей линии человека в указанных мышей с мутантной зародышевой линией должно приводить к производству человеческих антител после контрольного заражения антигеном (см., например, Jakobovits А. и др., Proc. Natl. Acad. Sci. USA 90, 1993, cc. 2551-2555; Jakobovits А. и др., Nature 362, 1993, cc. 255-258; Bruggemann M. и др., Year Immunol. 7, 1993, c. 3340). Человеческие антитела можно получать также с использованием фаговых дисплейных библиотек (Hoogenboom Н.R. и Winter G., J. Mol. Biol. 227, 1992, cc. 381-388; Marks J.D. и др., J. Mol. Biol. 222, 1991, cc. 581-597). Кроме того, для получения человеческих моноклональных антител можно применять методики, описанные у Cole с соавторами и Boerner с соавторами (Cole и др., Monoclonal Antibodies and Cancer Therapy, изд-во Alan R. Liss, 1985, c. 77; и Boerner P. и др., J. Immunol. 147, 1991, cc. 86-95). В контексте настоящего описания понятие «человеческое антитело» включает также антитела, которые модифицированы, например, в вариабельной области, для создания свойств, требуемых согласно изобретению.
В контексте настоящего описания подразумевается, что понятие «рекомбинантное антитело» включает все антитела, которые не встречаются в природе, в частности, антитела, полученные, экспрессированные, созданные или выделенные методами рекомбинации, например, антитела, выделенные из клетки-хозяина, такой, например, как СНО-клетка, или из клетки животного (например, мыши), или антитела, экспрессированные с использованием рекомбинантного экспрессионного вектора, которым трансфектировали клетку-хозяина. Указанные рекомбинантные антитела имеют вариабельные и константные области в преобразованной форме по сравнению с встречающимися в естественных условиях антителами.
В контексте настоящего описания понятия «антигенсвязывающий фрагмент», «фрагмент» и «фрагмент антитела» применяют взаимозаменяемо для обозначения любого фрагменты антитела, предлагаемого в изобретении, который сохраняет специфическую связывающую активность антитела, предназначенного для применения согласно изобретению, в частности специфичность в отношении поверхностного антигена Т-клетки и специфичность в отношении ассоциированного с раком и/или опухолью антигена. Примеры фрагментов антител включают (но, не ограничиваясь только ими) одноцепочечное антитело, Fab, Fab', F(ab')2, Fv или scFv. Фрагменты антител, предлагаемые в изобретении, можно получать из антител с помощью методов, которые включают расщепление ферментами, такими как пепсин или папаин, и/или путем расщепления дисульфидных связей с помощью химического восстановления. Альтернативно этому, фрагменты антител можно получать путем клонирования и экспрессии части последовательностей тяжелых и/или легких цепей. «Фрагменты» включают (но, не ограничиваясь только ими) Fab-, Fab'-, F(ab')2- и Fv-фрагменты. Под объем изобретения подпадают также одноцепочечные Fv-фрагменты (scFv), полученные из тяжелой и легкой цепей антитела, предлагаемого в изобретении. Например, изобретение включает scFv, содержащий CDR из антитела, предлагаемого в изобретении. Они включают также мономеры и димеры тяжелых и легких цепей, антитела с единичным доменом тяжелой цепи, антитела с единичным доменом легкой цепи, а также одноцепочечные антитела, например, одноцепочечный Fv, в котором вариабельные домены тяжелой и легкой цепей соединены с помощью пептидного линкера. Фрагменты антител, предлагаемые в изобретении, могут участвовать в одновалентных или многовалентных взаимодействиях и содержаться в различных описанных выше структурах. Например, молекулы scFv можно синтезировать с получением трехвалентного «триабоди» или четырехвалентного «тетрабоди». Молекулы scFv могут включать домен Fc-области, что приводит к получению двухвалентных миниантител (минибоди). Кроме того, последовательности, предлагаемые в изобретении, могут являться компонентом мультиспецифических молекул, в которых мишенями последовательностей, предлагаемых в изобретении, являются эпитопы, предлагаемые в изобретении, а другие области молекулы связываются с другими мишенями. Примеры молекул включают (но, не ограничиваясь только ими) биспецифические Fab2, триспецифические Fab3, биспецифические scFv и диабоди (димерные антитела) (Holliger и Hudson, Nature Biotechnology 9, 2005, сс. 1126-1136). Хотя в описании изобретения, включая формулу изобретения, в некоторых местах может недвусмысленно упоминаться антигенсвязывающий(ие) фрагмент(ы), фрагмент(ы) антитела, вариант(ы) и/или производное(ые) антител, следует понимать, что понятие «антитело» или «антитело, предлагаемое в изобретении» включает все категории антител, а именно антигенсвязывающий(ие) фрагмент(ы), фрагмент(ы) антитела, вариант(ы) и/или производное(ые) антител.
В контексте настоящего описания понятие «мультиспецифичность» относится к способности связываться по меньшей мере с двумя различными эпитопами, например, на различных антигенах, например, на поверхностном антигене Т-клетки и раковом/опухолевом антигене. Так, понятия типа «биспецифический», «триспецифический», «тетраспецифический» и т.д. относится к количеству различных эпитопов, с которыми антитело может связываться. Например, канонические моноспецифические антитела IgG-типа имеют два идентичных эпитопсвязывающих сайта (паратопы) и поэтому могут связываться только с идентичными эпитопами (но не с различными эпитопами). В противоположность этому, мультиспецифическое антитело имеет по меньшей мере два различных типа паратопов и поэтому может связываться по меньшей мере с двумя различными эпитопами. В контексте настоящего описания понятие «паратоп» относится к эпитопсвязывающему сайту антитела. Кроме того, индивидуальная «специфичность» может относиться к одному, двум, трем или большему количеству идентичных паратопов в одном антителе (фактическое количество паратопов в индивидуальной молекуле антитела обозначают как «валентность»). Например, индивидуальное нативное антитело IgG-типа является моноспецифическим и двухвалентным, поскольку оно имеет два идентичных паратопа. Таким образом, мультиспецифическое антитело содержит по меньшей мере два (различных) паратопа. Так, понятие «мультиспецифические антитела» относится к антителам, которые имеют более одного паратопа и обладают способностью связываться с двумя или большим количеством различных эпитопов. Понятие «мультиспецифические антитела» включает, в частности, биспецифические антитела, указанные выше, но, как правило, включает также белок, например, антитело, каркасы, которые связываются, в частности, с тремя или большим количеством различных эпитопов, например, антитела с тремя или большим количеством паратопов.
В частности, мультиспецифическое антитело или его антигенсвязывающий фрагмент может содержать два или большее количество паратопов, при этом некоторые паратопы могут быть идентичными, но в результате все паратопы антитела принадлежат по меньшей мере к двум различным типам паратопов, и поэтому антитело имеет по меньшей мере две специфичности. Например, мультиспецифическое антитело или его антигенсвязывающий фрагмент, предлагаемое/предлагаемый в настоящем изобретении, может содержать четыре паратопа, из которых каждые два паратопа являются идентичными (т.е. имеют одинаковую специфичность), и таким образом, антитело или его фрагмент является биспецифическим и четырехвалентным (два идентичных паратопа для каждой из двух специфичностей). Таким образом, понятие «одна специфичность» относится, в частности, одному или нескольким паратопам, характеризующимся одинаковой специфичностью (это, как правило, означает, что указанный(ые) один или несколько паратопов являются идентичными), и таким образом, «две специфичности» могут быть реализованы двумя, тремя, четырьмя, пятью, шестью или большим количеством паратопов, если они относятся только к двум специфичностям. Наиболее предпочтительно мультиспецифическое антитело содержит один единственный паратоп для каждой (по меньшей мере двух) специфичности, т.е. мультиспецифическое антитело содержит в целом по меньшей мере два паратопа. Например, биспецифическое антитело содержит один единственный паратоп для каждой из двух специфичностей, т.е. антитело содержит в целом два паратопа. Предпочтительно также антитело содержит два (идентичных) паратопа для каждой из двух специфичностей, т.е. антитело содержит в целом четыре паратопа. Предпочтительно антитело содержит три (идентичных) паратопа для каждой из двух специфичностей, т.е. антитело содержит в целом шесть паратопов.
В контексте настоящего описания понятие «антиген» относится к субстанции любой структуры, которая служит мишенью для рецепторов адаптивного иммунного ответа, в частности, мишенью для антител, Т-клеточных рецепторов и/или В-клеточных рецепторов. Понятие «эпитоп», известное также как «антигенная детерминанта», является частью (или фрагментом) антигена, который распознается иммунной системой, в частности, антителами, Т-клеточными рецепторами и/или В-клеточными рецепторами. Так, один антиген имеет по меньшей мере один эпитоп, т.е. индивидуальный антиген имеет один или несколько эпитопов. Антиген может представлять собой (I) пептид, полипептид или белок, (II) полисахарид, (III) липид, (IV) липопротеин или липопептид, (V) гликолипид, (VI) нуклеиновую кислоту или (VII) низкомолекулярное лекарственное средство или токсин. Таким образом, антиген может представлять собой пептид, белок, полисахарид, липид, их комбинацию, включая липопротеины и гликолипиды, нуклеиновую кислоту (например, ДНК, siPHK, shPHK, антисмысловые олигонуклеотиды, ДНК-ловушку, плазмиду) или низкомолекулярное лекарственное средство (например, циклоспорин А, паклитаксел, доксорубицин, метотрексат, 5-аминлевулиновая кислота), или любую их комбинацию. Предпочтительно антиген выбирают из (I) пептида, полипептида или белка, (II) полисахарида, (III) липида, (IV) липопротеина или липопептида и (V) гликолипида; более предпочтительно антиген представляет собой пептид, полипептид или белок.
В контексте настоящего описания понятие «ассоциированный с раком и/или опухолью антиген (его эпитоп)» относится к ассоциированному с раком антигену, ракспецифическому антигену, ассоциированному с опухолью антигену и/или опухольспецифическому антигену (его эпитопу). Указанные эпитопы/антигены, как правило, являются специфическими для определенного типа рака/опухоли или ассоциированы с ними. Сведения о приемлемых раковых/опухолевых эпитопах и антигенах можно почерпнуть, например, из баз данных раковых/опухолевых эпитопов, например, из базы данных, описанной у van der Bruggen P., Stroobant V., Vigneron N., Van den Eynde В., Peptide database: T cell-defined tumor antigens. Cancer Immun 2013; URL: http://www.cancerimmunity.org/peptide/, в которой человеческие опухолевые антигены классифицированы в виде четырех основных групп на основе их схемы экспрессии, или базы данных «Tantigen» (TANTIGEN, версия 1.0, 1 декабря 2009 г., которая разработана Bioinformatics Core at Cancer Vaccine Center, Dana-Farber Cancer Institute; URL: http://cvc.dfci.harvard.edu/tadb/). Конкретные примеры связанных с раком, в частности, связанных с опухолью или тканеспецифических антигенов, которые можно применять в контексте настоящего изобретения, включают (но, не ограничиваясь только ими) следующие антигены: Epha2, Epha4, PCDGF, НААН, мезотелин; ЕРСАМ; NY-ESO-1, гликопротеин MUC1 и NIUC10 муцинов р5 (прежде всего мутантные версии), EGFR; раковый антиген 125 (СА 125), эпителиальный гликопротеин 40 (EGP40) (Kievit и др., Int. J. Cancer 71, 1997, сс. 237-245), антиген плоскоклеточной карциномы (SCC) (Lozza и др., Anticancer Res. 17, 1997, сс. 525-529), катепсин Е (Mota и др., Am. J Pathol. 150, 1997, сс. 1223-1229), CDC27 (включая мутантную форму белка), антигены триозофосфатизомеразы, 707-АР, микобактериальный антиген А60 (Macs и др., J. Cancer Res. Clin. Oncol. 122, 1996, cc. 296-300), AFP, альфа(v)бета(3)-интегрин, ART-4, ASC, BAGE, β-катенин/m, BCL-2, bcr-abl, bcr-abl p190, bcr-abl p210, BRCA-1, BRCA-2, CA 19-9 (Tolliver и  , South Med. J. 90, 1997, cc. 89-90; Tsuruta и др., Urol. Int. 58, 1997, cc. 20-24), CA125, CALLA, CAMEL, угольная ангидраза, CAP-1, CASP-8, CDC27/m, CDK-4/m, CD1, CD2, CD4, CD6, CD7, CD8, CD11, CD13, CD14, CD19, CD20, CD21, CD22, CD23, CD24, CD30, CD33, CD37, CD38, CD40, CD41, CD44v3, CD44v6, CD47, CD52, CEA (Huang и др., Exper Rev. Vaccines 1, 2002, cc. 49-63), c-erb-2, CT9, CT10, Cyp-B, Dek-cain, DAM-6 (MAGE-B2), DAM-10 (MAGE-B1), EphA2 (Zantek и др., Cell Growth Differ. 10, 1999, cc. 629-638; Carles-Kinch и др., Cancer Res. 62, 2002, cc. 2840-2847), EphA4 (Cheng и др., Cytokine Growth Factor Rev. 13, 2002, cc. 75-85), ассоциированный с опухолью антиген Томсена-Фриденрейха (Dahlenborg и др., Int. J Cancer 70, 1997, cc. 63-71), ELF2M, ETV6-AML1, G250, GAGE-1, GAGE-2, GAGE-3, GAGE-4, GAGE-5, GAGE-6, GAGE-7B, GAGE-8, GD1a, GD1b, GD2, GD3, GnT-V, GM1, GM2, GM3, gp100 (Zajac и др., Int. J Cancer 71, 1997, cc. 491-496), GT1b, GT3, GQ1, HAGE, HER2/neu, HLA, HLA-DR, HLA-A*0201-R170I, HPV-E7, HSP-27, HSP-70, HSP70-2M, HSP-72, HSP-90, HST-2, hTERT, hTRT, iCE, ингибиторы апоптоза, такие как сурвивин, антиген аденокарциномы KH-1 (Deshpande и Danishefsky, Nature 387, 1997, cc. 164-166), KIAA0205, K-ras, LAGE, LAGE-1, LDLR/FUT, антиген Y Льюиса, MAGE-1, MAGE-2, MAGE-3, MAGE-6, MAGE-A1, MAGE-A2, MAGE-А3, MAGE-A4, MAGE-A6, MAGE-A10, MAGE-A12, MAGE-B5, MAGE-B6, MAGE-C2, MAGE-C3, MAGE D, MART-1, MART-1/Melan-A (Kawakami и Rosenberg, Int. Rev. Immunol. 14, 1997, cc. 173-192), MC1R, MCSP, MDM-2, MHCII, mTOR, миозин/m, MUC1, MUC2, MUM-1, MUM-2, MUM-3, нео-полиА-полимераза, NA88-A, NFX2, NY-ESO-1, NY-ESO-1a (CAG-3), PAGE-4, PAP, протеиназа 3 (Molldrem и др., Blood 88, 1996, cc. 2450-2457; Molldrem и др., Blood 90, 1997, cc. 2529-2534), P15, p53, p97, p190, PD-L1, Pgp, PIK3CA, Pm1/RARα, PRAME, протеогликан, PSA, PSM, PSMA, RAGE, RAS, RCAS1, RU1, RU2, SAGE, SART-1, SART-2, SART-3, SP17, SPAS-1, SSX2, SSX4 TEL/AML1, TPI/m, тирозиназа, TARP, теломераза, TRP-1 (gp75), TRP-2, TRP-2/INT2, VEGF, WT-1, антиген Wue, мишени на клеточной поверхности GC182, GT468 или GT512 и альтернативно транслируемые белки NY-ESO-ORF2 и CAMEL, полученные из генов NY-ESO-1 и LAGE-1. Другим конкретным примером связанного с раком, в частности, связанного с опухолью или тканеспецифического антигена, который можно применять в контексте настоящего изобретения, является CD133.
, South Med. J. 90, 1997, cc. 89-90; Tsuruta и др., Urol. Int. 58, 1997, cc. 20-24), CA125, CALLA, CAMEL, угольная ангидраза, CAP-1, CASP-8, CDC27/m, CDK-4/m, CD1, CD2, CD4, CD6, CD7, CD8, CD11, CD13, CD14, CD19, CD20, CD21, CD22, CD23, CD24, CD30, CD33, CD37, CD38, CD40, CD41, CD44v3, CD44v6, CD47, CD52, CEA (Huang и др., Exper Rev. Vaccines 1, 2002, cc. 49-63), c-erb-2, CT9, CT10, Cyp-B, Dek-cain, DAM-6 (MAGE-B2), DAM-10 (MAGE-B1), EphA2 (Zantek и др., Cell Growth Differ. 10, 1999, cc. 629-638; Carles-Kinch и др., Cancer Res. 62, 2002, cc. 2840-2847), EphA4 (Cheng и др., Cytokine Growth Factor Rev. 13, 2002, cc. 75-85), ассоциированный с опухолью антиген Томсена-Фриденрейха (Dahlenborg и др., Int. J Cancer 70, 1997, cc. 63-71), ELF2M, ETV6-AML1, G250, GAGE-1, GAGE-2, GAGE-3, GAGE-4, GAGE-5, GAGE-6, GAGE-7B, GAGE-8, GD1a, GD1b, GD2, GD3, GnT-V, GM1, GM2, GM3, gp100 (Zajac и др., Int. J Cancer 71, 1997, cc. 491-496), GT1b, GT3, GQ1, HAGE, HER2/neu, HLA, HLA-DR, HLA-A*0201-R170I, HPV-E7, HSP-27, HSP-70, HSP70-2M, HSP-72, HSP-90, HST-2, hTERT, hTRT, iCE, ингибиторы апоптоза, такие как сурвивин, антиген аденокарциномы KH-1 (Deshpande и Danishefsky, Nature 387, 1997, cc. 164-166), KIAA0205, K-ras, LAGE, LAGE-1, LDLR/FUT, антиген Y Льюиса, MAGE-1, MAGE-2, MAGE-3, MAGE-6, MAGE-A1, MAGE-A2, MAGE-А3, MAGE-A4, MAGE-A6, MAGE-A10, MAGE-A12, MAGE-B5, MAGE-B6, MAGE-C2, MAGE-C3, MAGE D, MART-1, MART-1/Melan-A (Kawakami и Rosenberg, Int. Rev. Immunol. 14, 1997, cc. 173-192), MC1R, MCSP, MDM-2, MHCII, mTOR, миозин/m, MUC1, MUC2, MUM-1, MUM-2, MUM-3, нео-полиА-полимераза, NA88-A, NFX2, NY-ESO-1, NY-ESO-1a (CAG-3), PAGE-4, PAP, протеиназа 3 (Molldrem и др., Blood 88, 1996, cc. 2450-2457; Molldrem и др., Blood 90, 1997, cc. 2529-2534), P15, p53, p97, p190, PD-L1, Pgp, PIK3CA, Pm1/RARα, PRAME, протеогликан, PSA, PSM, PSMA, RAGE, RAS, RCAS1, RU1, RU2, SAGE, SART-1, SART-2, SART-3, SP17, SPAS-1, SSX2, SSX4 TEL/AML1, TPI/m, тирозиназа, TARP, теломераза, TRP-1 (gp75), TRP-2, TRP-2/INT2, VEGF, WT-1, антиген Wue, мишени на клеточной поверхности GC182, GT468 или GT512 и альтернативно транслируемые белки NY-ESO-ORF2 и CAMEL, полученные из генов NY-ESO-1 и LAGE-1. Другим конкретным примером связанного с раком, в частности, связанного с опухолью или тканеспецифического антигена, который можно применять в контексте настоящего изобретения, является CD133.
Антигены, описанные у Jones и др., Anticancer Res. 17, 1997, сс. 685-687, являются наиболее предпочтительными в контексте раков мочевого пузыря, таких как ТСС. Многочисленные другие раковые антигены хорошо известны в данной области. В частности, уротелиальные клетки могут содержать несколько (поверхностных) структур, которые сверхэкспрессируются в неоплазме и могут служить в качестве специфических раковых и/или опухолевых антигенов. Таким образом, указанные антигены, связанные с неоплазмой уротелиальных клеток, являются предпочтительными.
В контексте настоящего описания понятие «поверхностный антиген Т-клетки (его эпитоп)» относится к ассоциированному с поверхностью Т-клетки антигену (его эпитопу) или специфическому для поверхности Т-клетки антигену (который обозначают также как «маркеры поверхности Т-клетки»). Они представляют собой, в частности, молекулы «CD» (кластер дифференцировки), специфические для Т-клеток. Молекулы CD являются маркерами клеточной поверхности, которые можно применять для идентификации и характеризации лейкоцитов. Номенклатура CD была разработана и продолжается посредством изучения HLDA (дифференцировочные антигены лейкоцитов человека), начиная с 1982 г. Сведения о том, присутствует или нет определенная молекула CD на Т-клетках (и следовательно представляет ли она собой поверхностный антиген Т-клетки в контексте настоящего изобретения) можно почерпнуть, например, из различных источников, известных специалисту в данной области, например, http://www.ebioscience.com/resources/human-cd-chart.htm, BD Bioscience's "Human and Mouse CD Marker Handbook" (можно получать из https://www.bdbiosciences.com/documents/cd_marker_handbook.pdf) или из www.hcdm.org. Таким образом, примеры антигенов поверхности Т-клетки включают, например, те (человеческие) CD-маркеры, которые указаны как присутствующие (позитивные) на Т-клетках в BD Bioscience's «Human and Mouse CD Marker Handbook» (можно получать из https://www.bdbiosciences.com/documents/cd_marker_handbook.pdf) или других источников «CD marker charts».
Антитело или его антигенсвязывающий фрагмент, предлагаемое/предлагаемый в настоящем изобретении, применяют при лечении неоплазмы мочевых путей.
В контексте настоящего описания понятие «неоплазма» относится к аномальному росту ткани. Указанный аномальный рост (неоплазия), как правило, но не всегда, приводит к формированию массы. Если формируется масса, то ее называют «опухолью». В частности, опухоль представляет собой солидную опухоль или заполненное жидкостью кистозное повреждение, которое может быть (или может не быть) образовано в результате аномального роста неопластических клеток и характеризуется увеличенным размером. В контексте настоящего изобретения неоплазмы могут образовывать или не могут не образовывать опухоль. В частности, лейкоз и большинство форм карциномы in situ (CIS) не формируют опухоль. Опухоль также не является синонимом рака. В то время как рак по определению является злокачественным заболеванием, опухоль может быть доброкачественной, предраковой или злокачественной.
В целом, неоплазмы подразделяют на четыре основные группы: доброкачественные неоплазмы, неоплазмы in situ, злокачественные неоплазмы и неоплазмы неясного или неизвестного поведения. Злокачественные неоплазмы обозначают также как «раки». В частности, неоплазма может быть доброкачественной, потенциально злокачественной (предрак) или злокачественной (рак). Доброкачественные опухоли включают миому матки и меланоцитарный невус (родинки кожи). Они являются ограниченными и локализованными и не трансформируются в рак. Потенциально злокачественные неоплазмы включают карциномы in situ. Они являются локализованными, не являются инвазивными и разрушительными, но со временем могут трансформироваться в рак. Злокачественные неоплазмы обычно называют раком. Они внедряются в окружающую ткань и разрушают ее, могут образовывать метастазы и без лечения или в случае невосприимчивости к лечению приводят к смерти. Понятие «вторичная неоплазма» относится к любому классу злокачественной опухоли, которая представляет собой либо метастатическое разрастание первичной опухоли, либо предположительно неродственную опухоль, частота встречаемости которой повысилась после некоторых определенных противораковых обработок, таких как химиотерапия или лучевая терапия. Редко они могут представлять собой метастатическую неоплазму с неизвестной областью первичного рака, и поэтому ее относят к классу рака с неизвестным первичным происхождением.
В контексте настоящего изобретения неоплазма предпочтительно является потенциально злокачественной (предрак), такой как карцинома in situ, или злокачественной (рак).
В контексте настоящего описания подразумевается, что понятие «мочевые пути» (известное также как «мочевая система») включает почки, мочеточники, мочевой пузырь и мочеиспускательный канал. Понятие «мочевые пути», как правило, относится к структурам, в которых образуется моча, и которые проводят мочу к месту экскреции.
Предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, вводят системно или местно в мочевые пути, предпочтительно путем инсталляции.
Антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, можно вводить различными путями, например, системно или местно. Пути системного введения включают, как правило, например, чрескожный, оральный и парентеральные пути, которые включают подкожное, внутривенное, внутримышечное, внутриартериальное, внутрикожное и внутрибрюшинное и/или интраназальное введение. Пути местного применения, как правило, включают, например, местные пути введения, но также введение непосредственно в область поражения, например, внутриопухолевое введение. В контексте настоящего изобретения «местное применение» является предпочтительным и относится, в частности, к местному введению непосредственно в мочевые пути, такому как внутрипузырное введение.
Предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, вводят с помощью парентерального пути введения. Более предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, вводят посредством внутривенного, внутриопухолевого, внутрикожного, внутримышечного, интраназального или внутринодального пути. Например, антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, вводят внутривенно. Предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, не вводят подкожно.
Предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, вводят путем инсталляции, например, местно в мочевые пути путем инсталляции, такой как внутрипузырная инстилляция. Инсталляцию можно облегчать с помощью средств, известных специалисту в данной области, например, путем катетеризации для достижения внутренней поверхности мочеиспускательного канала или мочевого пузыря.
Наиболее предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, вводят внутрипузырно.
Внутрипузырное введение означает, в частности, непосредственное введение в мочевой пузырь, предпочтительно с использованием катетера, такого как катетер для мочеиспускательного канала. Можно применять устройство с желе лидокаина (2%) Urojet или не применять его. Внутрипузырное введение предпочтительно осуществляют путем инсталляции. Предпочтительно мочевой пузырь опорожняют непосредственно перед внутрипузырной обработкой, в результате антитело или его антигенсвязывающий фрагмент вводят в пустой мочевой пузырь. После внутрипузырного введения пациента предпочтительно инструктируют о том, что следует пытаться удерживать введенную субстанцию в течение по меньшей мере 1 ч, более предпочтительно по меньшей мере 2 ч. Другими словами, пациента предпочтительно инструктируют о том, что следует не опорожнять мочевой пузырь в течение по меньшей мере 1 ч, более предпочтительно по меньшей мере 2 ч после обработки.
Областью-мишенью для внутрипузырного введения может быть внутренняя часть мочевого пузыря, включая, например, доставку в пустое пространство мочевого пузыря или в уротелий. Как правило, понятие «внутрипузырная обработка» в контексте настоящего описания относится к введению в пустое пространство мочевого пузыря. В этом случае закапанная жидкость диспергируется в моче, если они присутствует, или непосредственно покрывает внутренние стенки мочевого пузыря. Антитело или его антигенсвязывающий фрагмент, указанное/указанный в настоящем описании, как правило, функционирует в окружении, содержащем мочу, по меньшей мере в течение промежутка времени, необходимого для оказания фармакологического действия на требуемую область, находящуюся внутри мочевого пузыря.
При создании изобретения неожиданно было установлено, что антитело или его антигенсвязывающий фрагмент, указанное/указанный в настоящем описании, функционируют даже в неблагоприятной среде, содержащей мочу, и в результате может связываться со специфическими антигенами в предпочтительной ткани-мишени, например, в уротелий, после внутрипузырного введения. Кроме того, предполагается, что некоторые антигены, ассоциированные с раком и/или опухолью мочевых путей, такие как ЕрСАМ, локализуются, например, на или вблизи базальной мембраны уротелия. В физиологических условиях, как правило, сверхэкспрессия этих антигенов не имеет места и плотно прилегающие клетки уротелия затрудняют доступ к ним. Однако при состояниях, связанных с неоплазмами, в частности при злокачественных или in situ неоплазмах, например, в случае ТСС, пораженные клетки, как правило, становятся более проницаемыми, что делает базальную мембрану более доступной. Тем самым потенциал и эффективность антитела или его антигенсвязывающего фрагмента, указанного в настоящем описании, предпочтительно повышаются.
Кроме того, после внутрипузырного введения антитела или его антигенсвязывающего фрагмента, указанного в настоящем описании, действие является предпочтительно только местным, и поэтому системные эффекты предотвращаются. В частности, предотвращаются побочные действия, которые являются более вероятными после системного введения. В частности, значительно снижается системное высвобождение провоспалительных цитокинов, таких как IL-6, IL-8, IFN-γ и TNF-α, что предотвращает нежелательные побочные действия, типа лихорадки, тошноты, головной боли и симптомов нежелательного генерализованного иммунного ответа, такого как покраснение, зуд и даже анафилактический шок. Кроме того, предпочтительно предотвращаются также нежелательные реакции типа НАМА (человеческое антимышиное антитело) или ADA (антитело против лекарственного средства). Кроме того, известно, что антитело или его антигенсвязывающий фрагмент, указанное/указанный в настоящем описании, например, катумаксомаб, является иммуногенным при внутрибрюшинном введении (Heiss и др., The trifunctional antibody catumaxomab for the treatment of malignant ascites due to epithelial cancer: results of a prospective randomized phase II/III trial. Int. J Cancer 127, 2010, cc. 2209-2221; Ott и др., Humoral response to catumaxomab correlates with clinical outcome: results of the pivotal phase II/III study in patients with malignant ascites. Int. J Cancer 130, 2012, cc. 2195-2203). Однако внутрипузырное введение антигенсвязывающего фрагмента, указанного в настоящем описании, например, катумаксомаба, как правило, не является иммуногенным, наиболее вероятно из-за того, что лекарственное средство не оказывает системного действия.
Из-за предотвращения побочных действий, которые являются наиболее вероятными после системного введения, даже более высокие количества антитела или его антигенсвязывающего фрагмента, указанного в настоящем описании, при необходимости можно вводить внутрипузырно. С другой стороны, внутрипузырное введение может позволять снижать требуемую дозу благодаря присутствию активного агента непосредственно в требуемом месте действия. Таким образом, от низкого до очень низкого количества антитела или его антигенсвязывающего фрагмента, указанного в настоящем описании, достаточно для гарантии терапевтической эффективности - несмотря на возможное высокое разведение в мочевом пузыре мочой.
Кроме того, антитело или его антигенсвязывающий фрагмент, указанное/указанный в настоящем описании, предпочтительно не требуется включать в комплекс для того, чтобы иметь возможность вводить его внутрипузырно. Другими словами, антитело или его антигенсвязывающий фрагмент, указанное/указанный в настоящем описании, предпочтительно является стабильным во вредном содержащем мочу окружении, в частности после местного применения, например, внутрипузырного введения.
Предпочтительно неоплазма, которую можно лечить антигенсвязывающим фрагментом, указанным в настоящем описании, представляет собой неоплазму in situ или злокачественную неоплазму, более предпочтительно неоплазма представляет собой злокачественную неоплазму.
В контексте настоящего изобретения понятие «злокачественная неоплазма» (которую обозначают также как злокачественное заболевание) относится, в целом, к раку. В противоположность доброкачественной неоплазме злокачественная неоплазма, как правило, не характеризуется самоограничением своего роста, как правило, она обладает способностью внедряться в прилегающие ткани и может обладать способностью распространяться в удаленные ткани.
Неоплазму in situ обозначают также как «карцинома in situ» (CIS). Неоплазмы in situ являются потенциально злокачественными. В противоположность злокачественной неоплазме неоплазмы in situ являются локализованными, не внедряются и не разрушают (прилегающие ткани), но в конце концов могут трансформироваться в рак. Как правило, карцинома in situ представляет собой группу аномальных клеток, которые предпочтительно растут в характерном для них месте, т.е. «in situ». Таким образом, злокачественность характеризуется одним или несколькими из следующих признаков: анаплазия, инвазионная способность и метастазирование.
Касательно мочевых путей, то предпочтительной является уротелиальная CIS. Уротелиальная CIS представляет собой высоко злокачественную неоплазму и является показателем рецидива и прогрессирования, что требует специфического лечения. В частности, уротелиальная CIS представляет собой плоскую неинвазирующую высоко злокачественную уротелиальную неоплазму. Высоко злокачественная и серьезная дисплазия, а также некоторые формы умеренной дисплазии подпадают под понятие «карцинома in situ». Хотя неинвазивные папиллярные уротелиальные неоплазмы технически тоже находятся in situ, их не называют карциномами in situ. Важно отметить, что при CIS, как правило, оправдано применение внутрипузырной химиотерапии или цистэктомии.
Согласно Классификации злокачественных опухолей («Classification of Malignant Tumors», TNM) CIS, как правило, классифицируется как TisN0M0 (стадия 0). TNM представляет собой систему определений стадий рака, в которой применяют коды для описания стадии рака индивидуума, когда он начинается с солидной опухоли. «Т» обозначает размер исходной (первичной) опухоли и наличие инвазий в прилегающую ткань, «N» обозначает затронутые прилегающие (региональные) лимфатические узлы, а «М» означает отдаленные метастазы (распространение рака из одной части тела в другую). Другие стадии обозначают T1, Т2, Т3, Т4 в зависимости от размера и/или расширения первичной опухоли.
Например, при раке мочевого пузыря система определения стадий рака TNM включает следующие стадии для первичных опухолей («Т»-стадии): ТХ - первичную опухоль не удалось оценить, Т0 - отсутствует проявление первичной опухоли, Та - неинвазивная папиллярная карцинома, Tis - карцинома in situ ('плоская опухоль'), Т1 - инвазия опухоли в субэпителиальную соединительную ткань, Т2а - инвазия опухоли в поверхностный мышечный слой (внутренняя половина), T2b - глубокая инвазия опухоли в мышечный слой (наружная половина), Т3 - инвазия опухоли в перивезикулярную ткань: Т3а - микроскопическая и T3b - макроскопическая (экстра везикулярная масса), Т4а - инвазия опухоли в предстательную железу, матку или влагалище и T4b - инвазия опухоли в стенку таза или стенку брюшины; далее следуют стадии для лимфатических узлов («N»-стадии): NX - региональные лимфатические узлы не удалось оценить, N0 - отсутствуют метастазы в региональные лимфатические узлы, N1 - метастазы в одном лимфатическом узле, имеющие максимальный размер 2 см или менее, N2 - метастазы в одном лимфатическом узле, имеющие максимальный размер более 2 см, но не более 5 см, или в нескольких лимфатических углах, имеющие максимальный размер не более 5 см, и N3 - метастазы в лимфатическом узле, имеющие максимальный размер более 5 см; далее следуют стадии для отдаленных метастазов («М»-стадии): MX - отдаленные метастазы не удалось оценить, М0 - отсутствуют отдаленные метастазы и M1 - наличие отдаленных метастазов (Longe, Jacqueline L., Gale Encyclopedia Of Cancer: A Guide To Cancer And Its Treatments. Detroit: Thomson Gale. 2005, c. 137). Указанные стадии можно объединять в следующие нумерические стадии рака мочевого пузыря: стадия 0а: Та, N0, М0; стадия 0is: Tis, N0, М0; стадия I: Т1, N0, М0; стадия II: Т2а или T2b, N0, М0; стадия III: Т3а, T3b или Т4а, N0, М0; и стадия IV: любой из следующих кодов: T4b, N0, М0; любой Т, N1-N3, М0 или любой Т, любой N, M1.
Предпочтительно антитело или его антигенсвязывающий фрагмент применяют для лечения неоплазмы уротелия.
Уротелий представляет собой «переходный эпителий» и выстилает многие мочевые пути, включая почечную лоханку, мочеточники, мочевой пузырь и части мочеиспускательного канала. Уротелиальная ткань является высокоспецифической для мочевых путей и обладает высокой эластичностью и трансэпителиальным электрическим сопротивлением. Уротелий, как правило, состоит примерно из 3-5 слоев клеток с толстым слоем защитных гликопротеиновых бляшек в (апикальной) поверхности полости.
Как правило, считается, что уротелий является чувствительным к неоплазмам, прежде всего к карциноме. «Карцинома» обозначает тип рака, развивающегося из эпителиальных клеток, таких как уротелиальные клетки. В целом, карцинома, как правило, представляет собой рак, который начинается с ткани, которая выстилает внутреннюю или внешнюю поверхности тела, и который обычно возникает из клеток, образующихся из эндодермального или эктодермального зародышевого слоя (листка) в процессе эмбриогенеза.
Наиболее предпочтительной неоплазмой уротелия является переходноклеточная карцинома (ТСС; которую обозначают также как карцинома уротелиальных клеток, UCC). Таким образом, антитело или его антигенсвязывающий фрагмент предпочтительно применяют для лечения карциномы уротелиальных клеток (переходноклеточной карциномы). «Переходный» относится к гистологическому подтипу раковых клеток при рассмотрении под микроскопом. ТСС, как правило, встречается в мочевой системе: в почке, в мочевом пузыре и вспомогательных органах. ТСС является наиболее широко распространенным типом рака мочевого пузыря и рака мочеточника, мочеиспускательного канала и мочевого протока. ТСС является вторым по частоте встречаемости типом рака почки. ТСС образуется из уротелия, тканевой выстилки внутренней поверхности мочевых путей и может распространяться из системы почечных канальцев в мочевой пузырь («ползучая» (прогрессирующая) опухоль). ТСС часто являются многоочаговыми, при этом у 30-40% пациентов диагностируется более одной опухоли. Схема роста ТСС может быть папиллярной, сидячей (плоской) или свойственной карциноме in situ. Наиболее принятой системой градации для ТСС (папиллома, G1, G2 или G3) является система, принятая ВОЗ в 1973 г, несмотря на ее замену системой градации ВОЗ в 2004 г. (папиллярная неоплазма с низким потенциалом злокачественности [PNLMP], папиллярная карцинома с низкой злокачественностью или высоко злокачественная папиллярная карцинома).
Предпочтительно антитело или его антигенсвязывающий фрагмент применяют для лечения неоплазмы мочевых путей, выбранной из группы, которая состоит из (I) карциномы in situ, предпочтительно карциномы in situ мочеиспускательного канала, карциномы in situ мочевого пузыря, карциномы in situ мочеточника и/или карциномы in situ почечных лоханок; (II) не инвазирующего в мышечный слой уротелиального рака, предпочтительно локализованного в почечной лоханке, мочеточнике, мочеиспускательном канале, треугольнике мочевого пузыря, куполе мочевого пузыря, боковой стенке мочевого пузыря, передней стенке мочевого пузыря, задней стенке мочевого пузыря, шейке мочевого пузыря, устье мочеточника и/или в мочевом протоке; и (III) инвазирующего в мышечный слой уротелиального рака, предпочтительно локализованного в почечной лоханке, мочеточнике, мочеиспускательном канале, треугольнике мочевого пузыря, куполе мочевого пузыря, боковой стенке мочевого пузыря, передней стенке мочевого пузыря, задней стенке мочевого пузыря, шейке мочевого пузыря, устье мочеточника и/или в мочевом протоке.
Предпочтительно также антитело или его антигенсвязывающий фрагмент применять для лечения лимфомы и/или саркомы, локализованной в мочевых путях.
В частности, предпочтительно антитело или его антигенсвязывающий фрагмент применять для лечения переходноклеточной карциномы, плоскоклеточной карциномы, аденокарциномы, саркомы, мелкоклеточной карциномы и вторичного отложения рака в другой области мочевых путей. ТСС является наиболее предпочтительной.
Предпочтительно неоплазма мочевых путей представляет собой неоплазму нижних мочевых путей. Нижние мочевые пути включают, в частности, мочевой пузырь со всеми его структурными и функциональными подобластями и мочеиспускательный канал - но не включают почки и мочеточники, которые образуют верхние мочевые пути. Нижние мочевые пути наиболее доступны для внутрипузырного введения.
Таким образом, предпочтительно антитело или его антигенсвязывающий фрагмент применяют для лечения неоплазмы нижних мочевых путей, выбранной из группы, состоящей из (I) карциномы in situ мочеиспускательного канала и/или карциномы in situ мочевого пузыря; (II) не инвазирующего в мышечный слой уротелиального рака, локализованного в мочеиспускательном канале, треугольнике мочевого пузыря, куполе мочевого пузыря, боковой стенке мочевого пузыря, передней стенке мочевого пузыря, задней стенке мочевого пузыря, шейке мочевого пузыря, устье мочеточника и/или в мочевом протоке; и (III) инвазирующего в мышечный слой уротелиального рака, локализованного в мочеиспускательном канале, треугольнике мочевого пузыря, куполе мочевого пузыря, боковой стенке мочевого пузыря, передней стенке мочевого пузыря, задней стенке мочевого пузыря, шейке мочевого пузыря, устье мочеточника и/или в мочевом протоке.
Наиболее предпочтительно антитело или его антигенсвязывающий фрагмент применяют для лечения неоплазмы мочевого пузыря, предпочтительно карциномы in situ мочевого пузыря или злокачественной неоплазмы мочевого пузыря. В частности, антитело или его антигенсвязывающий фрагмент применяют для лечения рака мочевого пузыря. В контексте понятия «рак» рак мочевого пузыря включает все нумерические стадии, описанные выше, и, таким образом, предпочтительную стадию рака мочевого пузыря можно выбирать из группы, состоящей из (I) стадии 0а: Та, N0, М0 (рак представляет собой неинвазивную папиллярную карциному (Та) и растет в сторону центральной области полости мочевого пузыря, но не прорастает в соединительную ткань или мышцу стенку мочевого пузыря; она не распространяется в прилежащие лимфатические узлы (N0) или отдаленные области (М0)); (II) стадии 0is: Tis, N0, М0 (рак представляет собой плоскую неинвазивную карциному (Tis), которую обозначают также как плоская карцинома in situ (CIS), и она прорастает только в слой внутренней выстилки мочевого пузыря; она не растет в полую часть мочевого пузыря, не внедряется в соединительную ткань или мышцу стенку мочевого пузыря; она не распространяется в прилежащие лимфатические узлы (N0) или отдаленные области (М0)); (III) стадии I: Т1, N0, М0 (рак прорастает в слой соединительной ткани под выстилающим слоем мочевого пузыря, но не достигает мышечного слоя в стенке мочевого пузыря (Т1); рак не распространяется в прилежащие лимфатические узлы (N0) или отдаленные области (М0)); (IV) стадии II: Т2а или T2b, N0, М0 (рак прорастает в толстый мышечный слой стенки мочевого пузыря, но не полностью проходит через мышцу, не достигая слоя жировой ткани, окружающей мочевой пузырь (Т2); рак не распространяется в прилежащие лимфатические узлы (N0) или отдаленные области (М0)); (V) стадии III: Т3а, T3b или Т4а, N0, М0 (рак прорастает в слой жировой ткани, окружающей мочевой пузырь (Т3а или T3b); он может распространяться в предстательную железу, матку или влагалище, но не прорастает в стенку таза или брюшины (Т4а); рак не распространяется в прилежащие лимфатические узлы (N0) или отдаленные области (М0)); и (VI) стадии IV: она характеризуется любым из следующих кодов: T4b, N0, М0 (рак прорастает через стенку мочевого пузыря в стенку таза или брюшины (T4b); рак не распространяется в прилежащие лимфатические узлы (N0) или отдаленные области (М0)); любой из Т, N1-N3, М0 (рак распространяется в прилежащие лимфатические узлы (N1-N3), но не в отдаленные области (М0)), или любой из Т, любой N, M1 (рак распространяется в отдаленные лимфатические узлы или в такие области, как кости, печень или легкие (M1)). Более предпочтительно антитело или его антигенсвязывающий фрагмент применяют для лечения любой из следующий стадий: стадия 0а, стадия 0is, стадия I или стадия II, в частности, для лечения рака мочевого пузыря любой из следующий стадий: стадия 0а, стадия 0is, стадия I или стадия II. Наиболее предпочтительно антитело или его антигенсвязывающий фрагмент применяют для лечения стадии 0а, прежде всего для лечения стадии 0а рака мочевого пузыря. Наиболее предпочтительно антитело или его антигенсвязывающий фрагмент применяют для лечения стадии 0is, прежде всего для лечения стадии 0is рака мочевого пузыря. Наиболее предпочтительно антитело или его антигенсвязывающий фрагмент применяют для лечения стадии I, прежде всего для лечения стадии I рака мочевого пузыря. Наиболее предпочтительно антитело или его антигенсвязывающий фрагмент применяют для лечения стадии II, прежде всего для лечения стадии II рака мочевого пузыря.
Предпочтительные примеры рака мочевого пузыря включают карциному in situ мочевого пузыря, неинвазивную, инвазивную и метастатическую переходноклеточную карциному и непереходноклеточную карциному мочевого пузыря. Таким образом, неоплазму мочевого пузыря выбирают из переходноклеточной карциномы, плоскоклеточной карциномы, аденокарциномы, саркомы, мелкоклеточной карциномы и вторичного отложения рака в другой области организма, предпочтительно неоплазма мочевого пузыря представляет собой переходноклеточную карциному. CIS мочевого пузыря имеет тенденцию к более злокачественному развитию с более высоким метастатическим потенциалом по сравнению с некоторым имеющими существенно меньшую степень злокачественности опухолями, которые начинают внедряться через стенку мочевого пузыря.
Пригодным маркером для определения агрессивности переходноклеточных опухолей является lamina propria (собственная пластинка). Собственная пластинка представляет собой слой соединительной ткани и клеток в стенке мочевого пузыря между слоем переходных клеток (уротелий) и мышечными волокнами. Имеется тенденция к тому, что по мере размножения аномальных клеток в их генетическом механизме происходит больше мутаций. В норме может происходить репарация этих мутаций, но эта способность ограничена в указанных клетках. В конце концов, генетические изменения и дополнительный рост клеток приводят к нарушению свойств клеток, и они проникают в низлежащую собственную пластинку. Это является началом инвазии опухоли из переходных клеток. Таким образом, различие между «поверхностной» (неинвазивной) ТСС и «инвазивной (в мышечный слой)» ТСС является важным отличительным признаком. По существу все опухоли, не инвазирующие в мышечный слой, рассматриваются как поверхностные (неинвазивные). Однако, если мышечный слой нарушен («пробит»), то диагностируется инвазирующая в мышечной слой ТСС. Это различие имеет решающее значение, поскольку позволяет прогнозировать развитие этих опухолей в естественных условиях. Поверхностная ТСС имеет тенденцию к нескольким рецидивам, однако рецидивы почти всегда представляют собой поверхностные опухоли, хорошо реагирующие на местную резекцию. Только 15% поверхностных опухолей могут трансформироваться или возвращаться в виде высоко злокачественных инвазивных повреждений. С другой стороны, связанные с рекуррентной CIS повреждения или высоко злокачественные/инвазивные опухоли существенно сложнее контролировать, и они с большей степенью вероятности приводят к распространению метастазов.
Помимо ТСС в мочевом пузыре могут развиваться некоторые другие виды опухолей, и они также являются предпочтительными в контексте настоящего изобретения. Они включают плоскоклеточную карциному (SCC). Длительное раздражение мочевого пузыря инфицирующими агентами или чужеродными телами может приводить к изменению переходного эпителия на другой тип клеток, известный как сквамозные или «плоские» клетки.
Кроме того, теоретически любые из многочисленных других типов клеток в мочевом пузыре могут развиваться в раки: мышечные клетки (рабдомиосаркома), железистые клетки (аденокарцинома), нервные клетки (опухоли из нервных клеток) и даже клетки иммунного типа (лимфомы). Опухоли, возникающие в соседних органах, могут также внедряться в мочевой пузырь и выглядеть как «опухоль мочевого пузыря» (например, цервикальная карцинома или раки ободочной кишки). Таким образом, любой из указанных выше раков мочевого пузыря можно лечить с помощью антитела или его антигенсвязывающего фрагмента, указанного в настоящем описании.
Предпочтительно антитело или его антигенсвязывающий фрагмент применяют для лечения неоплазмы мочевого пузыря, выбранной из группы, состоящей из (I) карциномы in situ мочевого пузыря; (II) не инвазирующего в мышечный слой уротелиального рака, локализованного в треугольнике мочевого пузыря, куполе мочевого пузыря, боковой стенке мочевого пузыря, передней стенке мочевого пузыря, задней стенке мочевого пузыря, шейке мочевого пузыря, устье мочеточника и/или в мочевом протоке; и (III) инвазирующего в мышечный слой уротелиального рака, локализованного в треугольнике мочевого пузыря, куполе мочевого пузыря, боковой стенке мочевого пузыря, передней стенке мочевого пузыря, задней стенке мочевого пузыря, шейке мочевого пузыря, устье мочеточника и/или в мочевом протоке.
Таким образом, антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно изобретению, может предпочтительно служить для лечения карциномы in situ мочевого пузыря, в частности уротелиальной карциномы in situ. Кроме того, они предпочтительно могут служить для лечения злокачественных неоплазм мочевого пузыря, в частности, не инвазирующего в мышечный слой уротелиального рака, локализованного в треугольнике мочевого пузыря, куполе мочевого пузыря, боковой стенке мочевого пузыря, передней стенки мочевого пузыря, задней стенке мочевого пузыря, устье мочеточника, мочевом протоке и/или шейки мочевого пузыря, включая внутреннее устье мочеиспускательного канала. Кроме того, они могут служить для лечения любых злокачественных неоплазм мочевого пузыря, в частности, инвазирующего в мышечный слой уротелиального рака, локализованного в треугольнике мочевого пузыря, куполе мочевого пузыря, боковой стенке мочевого пузыря, передней стенки мочевого пузыря, задней стенке мочевого пузыря, устье мочеточника, мочевом протоке и/или шейки мочевого пузыря, включая внутреннее устье мочеиспускательного канала.
Наиболее предпочтительными в контексте настоящего изобретения являются карцинома in situ мочевого пузыря и не инвазирующий в мышечный слой уротелиальный рак, локализованный в треугольнике мочевого пузыря, куполе мочевого пузыря, боковой стенке мочевого пузыря, передней стенки мочевого пузыря, задней стенке мочевого пузыря, устье мочеточника, мочевом протоке или шейки мочевого пузыря, включая внутреннее устье мочеиспускательного канала.
Предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, представляет собой моноклональное антитело.
В контексте настоящего описания под моноклональным антителом (МАт или МоАт) подразумевается антитело, образованное идентичными иммунными клетками, которые все представляют собой клоны одной родительской клетки, что отличает их от поликлональных антител, образованных несколькими различными иммунными клетками. В целом, возможно создание моноклонального антитела, которое специфически связывается со специфической субстанцией.
Предпочтительно поверхностный антиген Т-клетки выбирают из группы, состоящей из CD2, CD3, CD4, CD5, CD6, CD8, CD28, CD40L и CD44. Это означает, что антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, содержит паратоп, который предпочтительно распознает (обладает способностью связываться с) эпитоп поверхностного антигена Т-клетки, выбранного из группы, которая состоит из CD3, CD2, CD4, CD5, CD6, CD8, CD28, CD40L и/или CD44. Указанная специфичность предпочтительно облегчает рекрутмент Т-клеток. В данном контексте CD является сокращенным обозначением «кластера дифференцировки» (кластер номенклатуры или классификации детерминант), описанного выше. В целом, он известен в качестве протокола идентификации и изучения молекул клеточной поверхности, которые представляют собой мишени для иммунофенотипирования клеток. В понятиях физиологии молекулы CD действуют в качестве многочисленных путей, часто действующих через рецепторы или лиганды (молекула, которая активирует рецептор), важные для клетки. Как правило, инициируется каскад передачи сигналов, изменяющий поведение клетки (см. раздел, посвященный передаче сигналов в клетке). Некоторые белки CD не играют роли в передаче сигналов в клетке, но обладают другими функциями, такими как клеточная адгезия. В настоящее время человеческие CD обозначены номерами вплоть до 364. Настоящее изобретение относится к ассоциированным с Т-клетками молекулам CD.
Более предпочтительно поверхностный антиген Т-клетки представляет собой CD2 или CD3, наиболее предпочтительно поверхностный антиген Т-клетки представляет собой CD3. Это означает, что антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, содержит паратоп, который более предпочтительно распознает эпитоп CD2 или CD3, наиболее предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, содержит паратоп, который распознает эпитоп CD3.
В контексте настоящего изобретения предпочтительно также, что ассоциированный с раком и/или опухолью антиген выбирают из группы, которая состоит из ЕрСАМ, HER2/neu, СЕА, MAGE, протеогликана, VEGF, EGFR, mTOR, PIK3CA, RAS, альфа(v)бета(3)-интегрина, HLA, HLA-DR, ASC, угольной ангидразы, CD1, CD2, CD4, CD6, CD7, CD8, CD11, CD13, CD14, CD19, CD20, CD21, CD22, CD23, CD24, CD30, CD33, CD37, CD38, CD40, CD41, CD47, CD52, c-erb-2, CALLA, MHCII, CD44v3, CD44v6, p97, GM1, GM2, GM3, GD1a, GD1b, GD2, GD3, GT1b, GT3, GQ1, NY-ESO-1, NFX2, SSX2, SSX4, Trp2, gp100, тирозиназы, MUC-1, теломеразы, сурвивина, p53, PD-L1, CA125, антигена Wue, антигена Y Льюиса, HSP-27, HSP-70, HSP-72, HSP-90, Pgp, MCSP, EphA2 и мишеней клеточной поверхности GC182, GT468 или GT512. Это означает, что антитело или его антигенсвязывающий фрагмент,
предназначенное/предназначенный для применения согласно настоящему изобретению, содержит паратоп, который распознает (обладает способностью связываться с) эпитоп ассоциированного с раком и/или опухолью антигена, выбранного из группы, которая состоит из ЕрСАМ, HER2/neu, СЕА, MAGE, протеогликана, VEGF, EGFR, mTOR, PIK3CA, RAS, альфа(v)бета(3)-интегрина, HLA, HLA-DR, ASC, угольной ангидразы, CD1, CD2, CD4, CD6, CD7, CD8, CD11, CD13, CD14, CD19, CD20, CD21, CD22, CD23, CD24, CD30, CD33, CD37, CD38, CD40, CD41, CD47, CD52, c-erb-2, CALLA, MHCII, CD44v3, CD44v6, p97, GM1, GM2, GM3, GD1a, GD1b, GD2, GD3, GT1b, GT3, GQ1, NY-ESO-1, NFX2, SSX2, SSX4, Trp2, gp100, тирозиназы, MUC-1, теломеразы, сурвивина, p53, PD-L1, CA125, антигена Wue, антигена Y Льюиса, HSP-27, HSP-70, HSP-72, HSP-90, Pgp, MCSP, EphA2 и мишеней клеточной поверхности GC182, GT468 или GT512.
В контексте настоящего изобретения предпочтительно ассоциированный с раком и/или опухолью антиген выбирают из группы, которая состоит из ЕрСАМ, HER2/neu, СЕА, MAGE, протеогликана, VEGF, EGFR, mTOR, PIK3CA, RAS, альфа(v)бета(3)-интегрина, HLA, HLA-DR, ASC, угольной ангидразы, CD1, CD2, CD4, CD6, CD7, CD8, CD11, CD13, CD14, CD19, CD20, CD21, CD22, CD23, CD24, CD30, CD33, CD37, CD38, CD40, CD41, CD47, CD52, CD133, c-erb-2, CALLA, MHCII, CD44v3, CD44v6, p97, GM1, GM2, GM3, GD1a, GD1b, GD2, GD3, GT1b, GT3, GQ1, NY-ESO-1, NFX2, SSX2, SSX4, Trp2, gp100, тирозиназы, MUC-1, теломеразы, сурвивина, p53, PD-L1, CA125, антигена Wue, антигена Y Льюиса, HSP-27, HSP-70, HSP-72, HSP-90, Pgp, MCSP, EphA2 и мишеней клеточной поверхности GC182, GT468 или GT512. Это означает, что антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, содержит паратоп, который распознает (обладает способностью связываться с) эпитоп ассоциированного с раком и/или опухолью антигена, выбранного из группы, которая состоит из ЕрСАМ, HER2/neu, СЕА, MAGE, протеогликана, VEGF, EGFR, mTOR, PIK3CA, RAS, альфа(v)бета(3)-интегрина, HLA, HLA-DR, ASC, угольной ангидразы, CD1, CD2, CD4, CD6, CD7, CD8, CD11, CD13, CD14, CD19, CD20, CD21, CD22, CD23, CD24, CD30, CD33, CD37, CD38, CD40, CD41, CD47, CD52, CD133, c-erb-2, CALLA, МНСИ, CD44v3, CD44v6, р97, GM1, GM2, GM3, GD1a, GD1b, GD2, GD3, GT1b, GT3, GQ1, NY-ESO-1, NFX2, SSX2, SSX4, Trp2, gp100, тирозиназы, MUC-1, теломеразы, сурвивина, p53, PD-L1, CA125, антигена Wue, антигена Y Льюиса, HSP-27, HSP-70, HSP-72, HSP-90, Pgp, MCSP, EphA2 и мишеней клеточной поверхности GC182, GT468 или GT512.
Особенно предпочтительно ассоциированный с раком и/или опухолью антиген выбирают из группы, которая состоит из ЕрСАМ, HER2/neu, СЕА, MAGE, VEGF, EGFR, mTOR, PD-L1, PIK3CA, RAS, GD2, CD19, CD20 и CD33, наиболее предпочтительно ассоциированный с раком и/или опухолью антиген выбирают из группы, которая состоит из ЕрСАМ, HER2/neu, СЕА, GD2, CD19, CD20 и CD33, еще более предпочтительно ассоциированный с раком и/или опухолью антиген выбирают из группы, которая состоит из ЕрСАМ, HER2/neu, GD2 и CD20, и наиболее предпочтительно ассоциированный с раком и/или опухолью антиген представляет собой ЕрСАМ. Это означает, что антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, содержит паратоп, который предпочтительно распознает эпитоп ЕрСАМ, HER2/neu, СЕА, MAGE, VEGF, EGFR, mTOR, PD-L1, PIK3CA, RAS, GD2, CD19, CD20 или CD33; более предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, содержит паратоп, который распознает эпитоп ЕрСАМ, HER2/neu, СЕА, GD2, CD19, CD20 или CD33; еще более предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, содержит паратоп, который распознает эпитоп ЕрСАМ, HER2/neu, GD2 или CD20; и наиболее предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, содержит паратоп, который распознает эпитоп ЕрСАМ. ЕрСАМ главным образом экспрессируется при высоко злокачественной и запущенной стадии уротелиальной карциномы мочевого пузыря (Brunner и др., ЕрСАМ is predominantly expressed in high grade and advanced stage urothelial carcinoma of bladder. J Clin Pathol 61(3), 2008, c. 307). Таким образом, предпочтительно ассоциированный с раком и/или опухолью антиген (или его эпитоп соответственно), распознаваемый антителом или его антигенсвязывающим фрагментом, предназначенным для применения согласно настоящему изобретению, представляет собой ЕрСАМ.
Предпочтительно ассоциированный с раком и/или опухолью антиген (или его эпитоп соответственно), распознаваемый антителом или его антигенсвязывающим фрагментом, предназначенным для применения согласно настоящему изобретению, представляет собой Her2/neu. Предпочтительно ассоциированный с раком и/или опухолью антиген (или его эпитоп соответственно), распознаваемый антителом или его антигенсвязывающим фрагментом, предназначенным для применения согласно настоящему изобретению, представляет собой GD2. Предпочтительно ассоциированный с раком и/или опухолью антиген (или его эпитоп соответственно), распознаваемый антителом или его антигенсвязывающим фрагментом, предназначенным для применения согласно настоящему изобретению, представляет собой GD3. Предпочтительно ассоциированный с раком и/или опухолью антиген (или его эпитоп соответственно), распознаваемый антителом или его антигенсвязывающим фрагментом, предназначенным для применения согласно настоящему изобретению, представляет собой CD20. Предпочтительно ассоциированный с раком и/или опухолью антиген (или его эпитоп соответственно), распознаваемый антителом или его антигенсвязывающим фрагментом, предназначенным для применения согласно настоящему изобретению, представляет собой CD19. Предпочтительно ассоциированный с раком и/или опухолью антиген (или его эпитоп соответственно), распознаваемый антителом или его антигенсвязывающим фрагментом, предназначенным для применения согласно настоящему изобретению, представляет собой CD30. Альтернативно этому, ассоциированный с раком и/или опухолью антиген (или его эпитоп соответственно), распознаваемый антителом или его антигенсвязывающим фрагментом, предназначенным для применения согласно настоящему изобретению, представляет собой СЕА, MAGE, VEGF, EGFR, mTOR, PD-L1, PIK3CA или RAS.
Предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, связывается (I) с помощью его первой специфичности, например, с помощью его первого паратопа, с эпитопом поверхностного антигена Т-клетки, выбранного из группы, которая состоит из CD2, CD3, CD4, CD5, CD6, CD8, CD28, CD40L и CD44, предпочтительно CD2 или CD3, более предпочтительно CD3; и (II) с помощью его второй специфичности, например, с помощью его второго паратопа, с ассоциированным с раком и/или опухолью антигеном, выбранным из группы, которая состоит из опухолевых антигенов ЕрСАМ, HER2/neu, СЕА, MAGE, VEGF, EGFR, mTOR, PD-L1, PIK3CA, RAS, GD2, CD19, CD20 и CD33.
Более предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, связывается (I) с помощью его первой специфичности, например, с помощью его первого паратопа, с эпитопом поверхностного антигена Т-клетки, выбранного из группы, которая состоит из CD2, CD3, CD4, CD5, CD6, CD8, CD28, CD40L и CD44, предпочтительно CD2 или CD3, более предпочтительно CD3; и (II) с помощью его второй специфичности, например, с помощью его второго паратопа, с ассоциированным с раком и/или опухолью антигеном, выбранным из группы, которая состоит из опухолевых антигенов ЕрСАМ, HER2/neu, СЕА, MAGE, VEGF, EGFR, mTOR, PD-L1, PIK3CA, RAS, GD2, CD19 и CD20.
Антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, предпочтительно связывается с помощью его первой специфичности, например, с помощью первого паратопа, с эпитопом поверхностного антигена Т-клетки, предпочтительно CD3, и с помощью его второй специфичности, например, с помощью его второго паратопа, с ассоциированным с раком и/или опухолью антигеном, предпочтительно выбранным из группы, которая состоит из опухолевых антигенов ЕрСАМ, HER2/neu, СЕА, MAGE, VEGF, EGFR, mTOR, PD-L1, PIK3CA, RAS, GD2, CD19 и CD20, или с ганглиозидами GM1, GM2, GM3, GD1a, GD1b, GD3, GT1b, GT3 или GQ1.
Предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, содержит первую специфичность против CD3 и вторую специфичность против ассоциированного с раком и/или опухолью антигена, выбранного из группы, которая состоит из ЕрСАМ, HER2/neu, СЕА, GD2, CD19, CD20 и CD33.
Таким образом, антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, может содержать одну специфичность, предпочтительно один паратоп, против CD3 и одну специфичность, предпочтительно один паратоп, против ЕрСАМ (анти-CD3 × анти-ЕрСАМ). Предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, может содержать одну специфичность, предпочтительно один паратоп, против CD3 и одну специфичность, предпочтительно один паратоп, против Her2/neu (анти-CD3 × анти-Her2/neu). Предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, может содержать одну специфичность, предпочтительно один паратоп, против CD3 и одну специфичность, предпочтительно один паратоп, против GD2 (анти-CD3 × анти-GD2). Предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, может содержать одну специфичность, предпочтительно один паратоп, против CD3 и одну специфичность, предпочтительно один паратоп, против GD3 (анти-CD3 × анти-GD3). Предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, может содержать одну специфичность, предпочтительно один паратоп, против CD3 и одну специфичность, предпочтительно один паратоп, против CD20 (анти-CD3 × анти-CD20). Предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, может содержать одну специфичность, предпочтительно один паратоп, против CD3 и одну специфичность, предпочтительно один паратоп, против CD19 (анти-CD3 × анти-CD19). Предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, может содержать одну специфичность, предпочтительно один паратоп, против CD3 и одну специфичность, предпочтительно один паратоп, против СЕА (анти-CD3 × анти-СЕА). Предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, может содержать одну специфичность, предпочтительно один паратоп, против CD3 и одну специфичность, предпочтительно один паратоп, против MAGE (анти-CD3 × анти-MAGE). Предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, может содержать одну специфичность, предпочтительно один паратоп, против CD3 и одну специфичность, предпочтительно один паратоп, против VEGF (анти-CD3 × анти-VEGF). Предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, может содержать одну специфичность, предпочтительно один паратоп, против CD3 и одну специфичность, предпочтительно один паратоп, против EGFR (анти-CD3 × анти-EGFR). Предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, может содержать одну специфичность, предпочтительно один паратоп, против CD3 и одну специфичность, предпочтительно один паратоп, против mTOR (анти-CD3 × анти-mTOR). Предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, может содержать одну специфичность, предпочтительно один паратоп, против CD3 и одну специфичность, предпочтительно один паратоп, против PD-L1 (анти-CD3 × анти-PD-L1). Предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, может содержать одну специфичность, предпочтительно один паратоп, против CD3 и одну специфичность, предпочтительно один паратоп, против PIK3CA (анти-CD3 × анти-PIK3CA). Предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, может содержать одну специфичность, предпочтительно один паратоп, против CD3 и одну специфичность, предпочтительно один паратоп, против RAS (анти-CD3 × анти-RAS).
Альтернативно этому, антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, может содержать одну специфичность, предпочтительно один паратоп, против CD3 и одну специфичность, предпочтительно один паратоп, против CD30 (анти-CD3 × анти-CD30). Предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, может содержать одну специфичность, предпочтительно один паратоп, против CD3 и одну специфичность, предпочтительно один паратоп, против CD33 (анти-CD3 × анти-CD33). Предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, может содержать одну специфичность, предпочтительно один паратоп, против CD3 и одну специфичность, предпочтительно один паратоп, против эпитопа белка Е арбовируса (анти-CD3× анти-белок Е арбовируса).
Предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, содержит две специфичности, выбранные из анти-ЕрСАМ × анти-CD3, анти-CD20 × анти-CD3, анти-HER2/neu × анти-CD3, анти-GD2 × анти-CD3 и анти-CD19 × анти-CD3.
Предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, представляет собой биспецифическое антитело или его биспецифический антигенсвязывающий фрагмент.
В контексте настоящего изобретения биспецифические антитела (BiAb (БиАт) содержат (строго) две специфичности. Они являются наиболее предпочтительным типом мультиспецифических антител и их антигенсвязывающих фрагментов. В контексте настоящего изобретения биспецифическое антитело может представлять собой биспецифическое антитело любого формата, например, описанное у Spiess С., Zhai Q. и Carter P.J., Molecular Immunology 67, 2-15, сс. 95-106. Например, БиАт могут представлять собой полные антитела, такие как полные IgG-подобные молекулы, или их фрагменты, которые не представляют собой полные антитела, но сохраняют свойства антител. Они могут представлять собой форматы малых рекомбинантных антител, например, в виде тандемных одноцепочечных молекул вариабельных фрагментов (taFv), димерных антител (диабоди) (Db), одноцепочечных димерных антител (scDb), биспецифических активаторов (проводников) Т-клеток (BiTe) и различных других их производных (см., например, у Byrne Н. и др., Trends Biotech, 31 (11), 2013, сс. 621-632, где на фиг. 2 продемонстрированы различные форматы биспецифических антител). Несколько форматов БиАт обладают способностью перенаправлять эффекторные клетки к клеткам-мишеням, которые играют ключевую роль в развитии заболеваний. Например, несколько форматов БиАт могут переориентировать эффекторные клетки к опухолевым клеткам, и были созданы различные конструкции БиАт для переориентирования клеток иммунной системы, например, путем связывания с Fc-рецепторами на поверхности эффекторных клеток и их запуска или путем связывания с комплексами Т-клеточного рецептора (TCR).
Предпочтительно мультиспецифическое, в частности, биспецифическое, антитело или его антигенсвязывающий фрагмент является по меньшей мере двухвалентным, т.е. имеет по меньшей мере два паратопа. Более предпочтительно мультиспецифическое, в частности, биспецифическое, антитело или его антигенсвязывающий фрагмент является двухвалентным, трехвалентным, четырехвалентным или шестивалентным. Еще более предпочтительно мультиспецифическое, в частности, биспецифическое, антитело или его антигенсвязывающий фрагмент является двухвалентным или четырехвалентным. Наиболее предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, представляет собой биспецифическое двухвалентное антитело, т.е. антитело, которое имеет два паратопа: один, распознающий антиген на поверхности Т-клетки, и другой, распознающий ассоциированный с раком и/или опухолью антиген.
Предпочтительно также, если антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, представляет собой бифункциональное или трехфункциональное антитело или его антигенсвязывающий фрагмент, т.е. обладает способностью взаимодействовать с двумя или тремя, предпочтительно различными сайтами связывания одновременно. Более предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, представляет собой трехфункциональное антитело или его трехфункциональный антигенсвязывающий фрагмент, в частности, биспецифическое трехфункциональное антитело или его биспецифический трехфункциональный антигенсвязывающий фрагмент.
В контексте настоящего изобретения «бифункциональное» антитело или его антигенсвязывающий фрагмент относится к соединению, которое так же, как правило, является биспецифическим. Как правило, указанное соединение не имеет дополнительных сайтов связывания помимо двух «специфичностей» (паратопов), даже неспецифических сайтов связывания. В противоположность этому, под «трехфункциональными» антителами (trAb) в контексте настоящего описания подразумевается специфический класс биспецифических антител, которые вызывают рекрутинг и активацию Т-клеток и, в частности, вспомогательных иммунных клеток, таких как макрофаги, дендритные клетки, естественные клетки-киллеры (NK) и другие экпрессирующие Fc-рецептор клетки, одновременно в раке-/опухоли-мишени, например, посредством их сайта связывания Fc-рецептора. Таким образом, трехфункциональные биспецифические антитела имеют два антигенсвязывающих сайта (т.е. два паратопа). Как правило, эти два антигенсвязывающих сайта (паратопы) обеспечивают связывание антител с раковыми/опухолевыми клетками (поверхностными антигенами раковых/опухолевых клеток) и с Т-клетками (поверхностные антигены Т-клетки). Одновременно, например, через их Fc-фрагмент, в частности их сайт связывания Fcγ-рецептора, происходит рекрутинг позитивных вспомогательных клеток, например, моноцитов/макрофагов, естественных клеток-киллеров, дендритных клеток или других экспрессирующих Fcγ-рецептор клеток. Одновременная активация этих эффекторных клеток различных классов приводит к эффективному цитолизу опухолевых клеток с помощью различных механизмов, таких как фагоцитоз и обусловленная перфорином цитотоксичность. Как правило, непосредственное (чистое) действие трехфункционального антитела представляет собой связывание Т-клеток и, в частности, позитивных по Fcγ-рецептору вспомогательных клеток, с опухолевыми клетками, что приводит к деструкции опухолевых клеток.
Трехфункциональные антитела вызывают устранение опухолевых клеток, в частности, посредством (I) антитело-обусловленной клеточнозависимой цитотоксичности, (II) опосредуемого Т-клетками цитолиза клеток и (III) индукции противоопухолевого иммунитета. В противоположность этому, лишь первый механизм действия фактически имеет место в случае канонических (моноклональных и моноспецифических) антител. Кроме того, в отличие от канонических антител биспецифические и, в частности, трехфункциональные, антитела обладают более высоким цитотоксическим потенциальном, и они даже связываются с антигенами, уровень экспрессии которых относительно низкий. Таким образом, биспецифические и, в частности, трехфункциональные, антитела в эквивалентной дозе являются более эффективными (более, чем в 1000 раз) в отношении элиминации опухолевых клеток по сравнению с каноническими антителами.
Антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, могут представлять собой антитело любого формата. В частности, мультиспецифические антитела предпочтительно представляют собой «полные» антитела, такие как полные IgG- или IgG-подобные молекулы, в то время как антигенсвязывающие фрагменты в контексте настоящего изобретения предпочтительно представляют собой форматы малых рекомбинантных антител, такие как биспецифические активаторы Т-клеток (BiTe), тандемные одноцепочечные молекулы вариабельных фрагментов (taFv), димерные антитела (диабоди) (Db), одноцепочечные димерные антитела (scDb) и различные другие их производные (см., например, у Byrne Н. и др., Trends Biotech, 31 (11), 2013, сс. 621-632, где на фиг. 2 продемонстрированы различные форматы биспецифических антител); Weidle U.H. и др., Cancer Genomics and Proteomics 10, 2013, сс. 1-18, где, в частности, на фиг. 1 продемонстрированы различные форматы биспецифических антител; и Chan А.С. и Carter P.J. Nat Rev Immu 10, 2010, сс. 301-316, где на фиг. 3 продемонстрированы различные форматы биспецифических антител). Примеры форматов биспецифических антител включают (но, не ограничиваясь только ими) квадрому, химически сшитый Fab (антигенсвязывающий фрагмент) и BiTE® (биспецифический активатор Т-клеток). В одном из вариантов осуществления настоящего изобретения применяемое антитело предпочтительно представляет собой BiTE® (биспецифический активатор Т-клеток).
Таким образом, антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, можно выбирать из группы, содержащей Triomab (триомат); грибную гибридому (квадрома); мультиспецифические соединения на антикалиновой платформе (фирма Pieris); димерные антитела; одноцепочечные димерные антитела; тандемные одноцепочечные Fv-фрагменты; TandAb (тандАт), триспецифические Ат (фирма Affimed) (105-110 кДа); Dart (переориентирующие антитела с двойной аффинностью; фирма Macrogenics); биспецифические Xmab (ХМАт) (фирма Xencor); биспецифические активаторы Т-клеток (BiTe; фирма Amgen; 55 кДа); Triplebody (триплетные антитела); Tribody (трибоди), т.е. слитый белок Fab-scFv (фирма CreativeBiolabs), многофункциональные рекомбинантные производные антител (110 кДа); антитела на платформе Duobody (фирма Genmab); антитела на платформе Dock and lock (ключ и замок); антитела на платформе Knob into hole (KIH) (выступ-во-впадину); гуманизированное биспецифическое антитело IgG-типа (REGN1979) (фирма Regeneron); биспецифические антитела МАт2 (фирма F-Star); DVD-Ig, т.е. иммуноглобулин с двойным вариабельным доменом (фирма Abbvie); каппа-лямбда тела; TBTI, т.е. четырехвалентный биспецифический тандемный Ig; и CrossMab-антитела.
Антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, можно выбирать из биспецифических IgG-подобных антител (BsIgG), содержащих CrossMab; DAF (два-в-одном); DAF (четыре-в-одном); DutaMab; DT-IgG; созданных с помощью технологии «Knobs-in-holes» общие LC (легкие цепи); созданных с помощью сборки по типу «Knobs-in-holes» антител; антител, созданных с использованием модификации зарядов пары цепей; антител, созданных на основе замены Fab-плеча; SEEDbody; Triomab; LUZ-Y; Fcab; κλ-тело и ортогонального Fab. Эти форматы биспецифических антител представлены и описаны, например, у Spiess С., Zhai Q. и Carter P.J., Molecular Immunology 67, 2015, сс. 95-106, в частности, на фиг. 1 и в соответствующем описании, например, на сс. 95-101.
Предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, можно выбирать из антител с присоединенным IgG с дополнительным антигенсвязывающим фрагментом, содержащим DVD-IgG; IgG(H)-scFv; scFv-(H)IgG; IgG(L)-scFv; scFV-(L)IgG; IgG(L,H)-Fv; IgG(H)-V; V(H)-IgG; IgG(L)-V; V(L)-IgG; KIH IgG-scFab; 2scFv-IgG; IgG-2scFv; scFv4-Ig; scFv4-Ig; Zybody; и DVI-IgG (четыре-в-одном). Эти форматы биспецифических антител представлены и описаны, например, у Spiess С., Zhai Q. и Carter P.J., Molecular Immunology 67, 2015, сс. 95-106, в частности, на фиг. 1 и в соответствующем описании, например, на сс. 95-101.
Предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, можно выбирать из фрагментов биспецифических антител, содержащих Nanobody (нанотело); нанотело-HAS; BiTE; димерное антитело; DART; TandAb; sc-диабоди; sc-диабоди-CH3; диабоди-CH3; тройное антитело; миниантитело; минитело; минитело TriB; scFv-CH3 KIH; Fab-scFv; scFv-CH-CL-scFv; F(ab')2; F(ab')2-scFv2; scFv-KIH; Fab-scFv-Fc; четырехвалентный НС-Ат; sc-диабоди-Рс; диабоди-Fc; тандемный scFv-Fc и Intrabody (интрабоди, внутриклеточное антитело). Эти форматы биспецифических антител представлены и описаны, например, у Spiess С., Zhai Q. и Carter P.J., Molecular Immunology 67, 2015, cc. 95-106, в частности, на фиг. 1 и в соответствующем описании, например, на сс. 95-101.
Предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, не содержит сайт связывания с Fc-рецептором, в частности, антитело или его антигенсвязывающий фрагмент не содержит Fc-фрагмент, такой как Fc-область.
Предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, можно выбирать из биспецифических слитых белков, содержащих структуру типа «Dock and Lock» (ключ и замок); ImmTAC; HAS-body (HAS-боди); sc-диабоди-HAS и тандем scFv-токсин. Эти форматы биспецифических антител представлены и описаны, например, у Spiess С., Zhai Q. и Carter P.J., Molecular Immunology 67, 2015, сс. 95-106, в частности, на фиг. 1 и в соответствующем описании, например, на сс. 95-101.
В частности, антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, можно выбирать из конъюгатов биспецифических антител, содержащих IgG-IgG; Cov-X-боди и scFv1-PEG-scFv2. Эти форматы биспецифических антител представлены и описаны, например, у Spiess С., Zhai Q. и Carter P.J., Molecular Immunology 67, 2015, сс. 95-106, в частности, на фиг. 1 и в соответствующем описании, например, на сс. 95-101.
Предпочтительно также антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, выбирают из группы, состоящей из биспецифического активатора Т-клеток (BiTE™) и биспецифического трехфункционального антитела.
Предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, содержит сайт связывания с F-рецептором. Более предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, содержит Fc-фрагмент, в частности, Fc-область.
В контексте настоящего описания понятие «Fc-фрагмент» относится к последовательности из области тяжелой цепи иммуноглобулина, которая начинается с шарнирной области, расположенной в обратном направлении относительно сайта расщепления папаином, и заканчивается на С-конце тяжелой цепи иммуноглобулина. Предпочтительно «Fc-фрагмент» содержит сайт связывания Fc-рецептора. Однако предпочтительно также для Fc-фрагмента может быть характерно функциональное различие относительно связывания с Fc-рецептором, например, он может связываться с белком системы комплемента. Таким образом, «Fc-фрагмент» может представлять собой полную Fc-область или ее часть (например, домен). Предпочтительно «Fc-фрагмент» обладает полной функциональностью полной Fc-области, например, включая связывание с Fc-рецептором и необязательно связывание с белком системы комплемента. Таким образом, антитело, предлагаемое для применения согласно настоящему изобретению, предпочтительно содержит полную Fc-область, где полная Fc-область содержит по меньшей мере шарнирный домен, СН2-домен и СН3-домен. Fc-фрагмент может содержать также одну или несколько аминокислотных инсерций, делеций или замен относительно встречающейся в естественных условиях Fc-области. Например, по меньшей мере один шарнирный домен, СН2-домен или СН3-домен (или их часть) может быть удален в результате делеций. Например, Fc-фрагмент может содержать или состоять из: (I) шарнирного домена (или его части), слитого с СН2-доменом (или его частью), (II) шарнирного домена (или его части), слитого с СН3-доменом (или его частью), (III) СН2-домена (или его части), слитого с СН3-доменом (или его частью), (IV) шарнирного домена (или его части), (V) СН2-домена (или его части), или (VI) СН3-домена или его части.
В качестве мультиспецифических антител или их антигенсвязывающих фрагментов наиболее предпочтительными являются трехфункциональные биспецифические антитела, поскольку их можно применять согласно настоящему изобретению, и они обладают тремя функциями, в частности, способностью связываться с Т-клетками (переориентировать их) и связываться с опухолевыми клетками (таргетировать их) с помощью двух описанных выше специфичностей, и - в качестве третьей функции - трехфункциональные антитела обладают высокой способностью связываться, например, с моноцитами, макрофагами, дендритными клетками, «естественными клетками-киллерами» (NK-клетки), и/или активированными нейтрофилами, в частности посредством их Fc-рецептора. Предпочтительно их Fc-участок связывается с позитивными по Fc-рецептору клетками, которые предпочтительно экспрессируют по меньшей мере один тип Fcγ-рецептора, предпочтительно Fcγ-рецептор типа I, IIa и/или III. Однако бифункциональные и биспецифические антигенсвязывающие агенты, у которых отсутствует указанная третья функция, такие как биспецифические активаторы Т-клеток, также являются предпочтительными из-за их способности переориентировать Т-клетки, также и в окружающей среде, присутствующей в мочевом пузыре.
Например, «третья функциональность» у биспецифического трехфункционального антитела, предназначенного для применения согласно настоящему изобретению, представляет собой сайт связывания для Fc-рецептора, и, таким образом, в частности, биспецифическое трехфункциональное антитело, предназначенное для применения согласно настоящему изобретению, предпочтительно содержит сайт связывания для Fc-рецептора. Более предпочтительно биспецифическое трехфункциональное антитело, предназначенное для применения согласно настоящему изобретению, содержит Fc-фрагмент, такой как Fc-область (фрагмент кристаллизуемой области, который обозначают также как «Fc-участок»). Указанное предпочтительное трехфункциональное биспецифическое антитело, предназначенное для применения согласно настоящему изобретению, вызывает рекрутинг, в частности, благодаря его сайту связывания для Fc-рецептора, иммунных клеток, которые экспрессируют на своей клеточной поверхности Fc-рецепторы, в частности, Fcγ-рецептор типа I, IIa и/или III. Таким образом, трехфункциональные биспецифические антитела образуют агрегаты прежде всего с тремя различными типами клеток, т.е. с двумя типами иммунных клеток (Т-клетки и экспрессирующие Fc-рецептор иммунные клетки) и раковыми/опухолевыми клетками-мишенями. Тем самым различные механизмы действия иммунной системы мобилизуются для «атаки» на рекрутированные раковые/опухолевые клетки-мишени.
Сайт связывания для Fc-рецептора, например, Fc-область, позволяет (трехфункциональному) антителу осуществлять дополнительный рекрутинг клеток, экспрессирующих Fc-рецептор, таких как позитивные по Fcγ-рецептору вспомогательные клетки, например, макрофаги, дендритные клетки, естественные клетки-киллеры (NK) и другие экспрессирующие Fc-рецептор клетки. Поскольку трехфункциональные антитела являются биспецифическими (или мультиспецифическими) антителами, они предпочтительно могут осуществлять рекрутинг и активировать (I) Т-клетки и (II) экспрессирующие Fc-рецептор клетки, такие как вспомогательные иммунные клетки, например, моноциты/макрофаги, естественные клетки-киллеры, дендритные клетки или другие экспрессирующие Fc-рецептор клетки, одновременно с (III) раковыми /опухолевыми клетками-мишенями. Одновременная активация указанных различных классов эффекторных клеток приводит к эффективному цитолизу опухолевых клеток посредством различных механизмов, таких, например, как фагоцитоз и обусловленная перфорином цитотоксичность. Как правило, непосредственное (чистое) действие предпочтительного трехфункционального антитела, которое содержит Fcγ-рецептор, представляет собой связывание Т-клеток и позитивных по Fcγ-рецептору вспомогательных клеток, с опухолевыми клетками, что приводит к деструкции опухолевых клеток. Трехфункциональные антитела вызывают устранение опухолевых клеток, в частности, посредством (I) антитело-обусловленной клеточнозависимой цитотоксичности, (II) опосредуемого Т-клетками цитолиза клеток и (III) индукции противоопухолевого иммунитета.
Предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, имеет IgG-подобный формат (формат на основе IgG, который обозначают также как «IgG-тип»), при этом антитело, имеющее формат IgG-типа, как правило, содержит две тяжелых цепи и две легких цепи. В целом, иммуноглобулин G (IgG) является известным типом антитела. В контексте настоящего описания под IgG подразумевают белковый комплекс, состоящий из четырех пептидных цепей - двух идентичных тяжелых цепей и двух идентичных легких цепей, организованных в Y-форму, типичную для мономеров антитела. Каждый IgG, как правило, содержит два антигенсвязывающих сайта, которые могут быть различными или идентичными. С учетом того, что у людей на их долю приходится примерно 75% сывороточных антител, IgG является наиболее общим типом антител, присутствующих в кровотоке. Физиологические молекулы IgG создаются и высвобождаются плазматическими В-клетками.
Примеры антитела, имеющего IgG-подобный формат, включают квадрому и различные форматы IgG-scFv (см. Byrne Н. и др., Trends Biotech, 31 (11), 2013, сс. 621-632; фиг. 2А-Д), при этом квадрома является предпочтительной, ее предпочтительно получают путем слияния двух различных гибридом. В пределах IgG-класса основой антител предпочтительно может быть подкласс IgG1, IgG2, IgG3 или IgG4, при этом предпочтительным является антитело на основе IgG1 (которое обозначают также как антитело «IgG1-типа»). Основой мультиспецифических антител или их антигенсвязывающих фрагментов, таких как биспецифические антитела, предназначенные для применения согласно настоящему изобретению, в альтернативном варианте может являться любой класс (например, IgA, IgG, IgM и т.д.) и подкласс иммуноглобулинов (например, IgA1, IgA2, IgG1, IgG2, IgG3, IgG4 и т.д.).
В целом, мультиспецифические антитела, такие как биспецифические антитела, или их антигенсвязывающие фрагменты, предназначенные для применения согласно настоящему изобретению, получают тремя основными методами: (I) химическая конъюгация, которая включает химическое перекрестное сшивание; (II) слияние двух различных линий клеток гибридом; или (III) генетические подходы, включая технологию рекомбинантной ДНК. Слияние двух различных гибридом позволяет получать гибридную гибридому (или «квадрому»), секретирующую гетерогенную популяцию антител, включающую биспецифические молекулы.
Альтернативные подходы включают химическую конъюгацию двух различных МАт и/или более мелких фрагментов антител. Установлено, что стратегии окислительной реассоциации для связывания двух различных антител или фрагментов антител являются неэффективными из-за присутствия побочных реакций в процессе повторного окисления множества нативных дисульфидных связей. Современные методы химической конъюгации фокусируются на применении гомо- или гетеробифункциональных перекрестносшивающих реагентов. Технология рекомбинантной РНК позволила получить широчайшее разнообразие биспецифических антител (БсАт) посредством искусственной манипуляции с генами, и представляет собой обладающий наибольшим разнообразием подход для создания БсАт (за последние двадцать лет созданы 45 форматов; см. Byrne Н. и др., Trends Biotech, 31 (11), 2013, сс. 621-632).
В частности, с использованием указанной технологии рекомбинантной ДНК в настоящее время создано широкое разнообразие дополнительных мультиспецифических антител. В частности, с помощью технологии рекомбинантной ДНК удалось получить мультиспецифические антитела, в частности, с тремя или большим количеством паратопов. В контексте настоящего изобретения антитело может, в частности, иметь также более двух специфичностей, и, как следствие, более двух паратопов, поскольку по меньшей мере два паратопа требуется согласно настоящему изобретению, например, один для клетки-мишени, а другой для Т-клетки. Таким образом, антитело, предназначенное для применения согласно настоящему изобретению, может иметь дополнительные паратопы, в частности, связанные с дополнительными специфичностями, в дополнение к двум паратопам.
Предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, представляет собой антитело IgG-типа, которое содержит сайт связывания для Fc-рецептора, в частности, Fc-область. Более предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, представляет собой трехфункциональное биспецифическое антитело, которое гетерологично взаимодействует в интактным крысиным/мышиным антителом, содержащим сайт связывания для Fc-рецептора, в частности, Fc-область. При этом, предпочтительным является антитело с комбинацией подклассов мышиного IgG2a и крысиного IgG2b. Наиболее предпочтительным является гетерологичное интактное крысиное/мышиное антитело, содержащее сайт связывания для Fc-рецептора, в частности, Fc-область, с тяжелой цепью, состоящей из мышиного IgG2a-подкласса и крысиного IgG2b-подкласса, в каждом случае с соответствующими им легкими цепями.
В целом, трехфункциональное биспецифическое антитело, предназначенное для применения согласно изобретению, характеризуется предпочтительно одной из следующих комбинаций изотипов в его Fc-области: крысиный-IgG2b/мышиный-IgG2a, крысиный-IgG2b/мышиный-IgG2b, крысиный-IgG2b/человеческий-IgG1 или мышиный-[VH-СН1,VL-CL]-человеческий-IgG1/крысиный-[VH-СН1,VL-CL]-человеческий-IgG1-[шарнир]-человеческий IgG3*-[CH2-CH3], где * = европеоидные аллотипы G3m(b+g) = отсутствие связывания с белком А.
Предпочтительно также антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, содержит по меньшей мере два различных одноцепочечных вариабельных фрагмента (scFv). В контексте настоящего описания под одноцепочечным вариабельным фрагментом (scFv) подразумевается слитый белок вариабельных областей тяжелой (VH) и легкой (VL) цепей иммуноглобулинов, которые соединены коротким линкерным пептидом. Указанный пептид, как правило, содержит по меньшей мере 5, предпочтительно по меньшей мере 10, более предпочтительно примерно 25 аминокислот. Линкер, как правило, является богатым глицином для гибкости, а также серином или треонином для растворимости и может быть связан либо на N-конце VH с С-концом VL, либо наоборот. ScFv может сохранять специфичность исходного иммуноглобулина несмотря на удаление константных областей и интродукцию линкера. Как правило, scFv можно создавать непосредственно из субклонированных тяжелых и легких цепей, полученных из гибридомы. ScFv, как правило, используют, например, в проточной цитометрии, иммуногистохимии и в качестве антигенсвязывающих доменов искусственных Т-клеточных рецепторов. В контексте настоящего изобретения их предпочтительно применяют в качестве антигенсвязывающих доменов искусственных Т-клеточных рецепторов.
Предпочтительные форматы биспецифических IgG-подобных антител содержат, например, гибридную гибридому (квадрому), конструкцию типа «выступы-во-впадины» с общей легкой цепью, различные форматы IgG-scFv, различные форматы scFv-IgG, IgG «два-в-одном», IgG с двойным V-доменом, IgG-V и V-IgG, которые представлены на фиг. 3в у Chan А.С. и Carter P.J. Nat Rev Immu 10, 2010, сс. 301-316 и описаны в указанной статье. Другие предпочтительные форматы биспецифических IgG-подобных антител включают, например, DAF, CrossMab, IgG-dsscFv, DVD, IgG-dsFV, IgG-scFab, scFab-dsscFv и Fv2-Fc, которые представлены на фиг. 1А у Weidle U.H. и др., Cancer Genomics and Proteomics 10, 2013, сс. 1-18 и описаны в указанной статье. Другие предпочтительные форматы биспецифических IgG-подобных антител включают DAF («два-в-одном»); DAF («четыре-в-одном»); DutaMab; DT-IgG; антитела, полученные сборкой по типу «knobs-into holes»; антитела, созданные с использованием модификации зарядов пары цепей; антитела, созданные на основе замены Fab-плеча; SEEDbody; Triomab; LUZ-Y; Fcab; κλ-тело; ортогональный Fab; DVD-IgG; IgG(H)-scFv; scFv-(H)IgG; IgG(L)-scFv; scFV-(L)IgG; IgG(L,H)-Fv; IgG(H)-V; V(H)-IgG; IgG(L)-V; V(L)-IgG; KIH IgG-scFab; 2scFv-IgG; IgG-2scFv; scFv4-Ig; scFv4-Ig; Zybody; и DVI-IgG («четыре-в-одном»), как продемонстрировано, например, у Spiess С., Zhai Q. и Carter P.J., Molecular Immunology 67, 2015, сс. 95-106, в частности на фиг. 1 и соответствующем описании, например, на сс. 95-101.
Предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, выбирают из группы, состоящей из катумаксомаба (анти-CD3 × анти-ЕрСАМ), FBTAOS/лимфомуна (анти-CD3 × анти-CD20), эртумаксомаба (анти-CD3 × анти-HER2/neu), эктомуна (анти-CD3 × анти-GD2), блинатумомаба и срлитомаба, предпочтительно антитело представляет собой катумаксомаб.
Наиболее предпочтительным примером трехфункциональных биспецифических антител является катумаксомаб (Removab®) (анти-ЕрСАМ × анти-CD3). Другие предпочтительные примеры трехфункциональных биспецифических антител включают (I) FBTA05 (который называют также «лимфомун»), трехфункциональное антитело анти-CD3 × анти-CD20, (II) эртумаксомаб, трехфункциональное антитело анти-CD3 × анти-HER2 и (III) TRBs02/TRBs07, два трехфункциональных антитела, специфических в отношении человеческой меланомы (Ruf и др., Int J Cancer, 108, 204, сс. 725-732).
Альтернативно этому, антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно изобретению, выбирают из группы, состоящей из биспецифического активатора Т-клеток анти-CD19 × анти-CD3 и биспецифического активатора Т-клеток анти-ЕрСАМ × анти-CD3.
Протоколы обработки и дозы
Из-за различий в механизмах действия разработанные протоколы обработки для мультиспецифических, в частности биспецифических антител, таких как биспецифические трехфункциональные антитела, как правило, существенно отличаются от протоколов для канонических (моноклональных и моноспецифических) антител. Например, катумаксомаб вводили согласно режиму, включающему четыре внутрибрюшинных инфузии в дни 0, 3, 7 и 10 в дозах 10, 20, 50 и 150 мкг соответственно (см. Heiss и др., Int J Cancer, 127, 2010, сс. 2209-2221 и «Assessment Report for Removab», European Medicines Agency, Doc.Ref.: EMEA/CHMP/100434/2009). FBTA05/лимфомун вводили, например, путем i.v.-инфузии в возрастающих дозах, начиная с 10 мкг в день 1, повышая, например, удваивая, дозы в последующие дни, при этом дозы в конце лечения составляли вплоть до 2000 мкг (Buhmann и др., Bone Marrow Transplant, 43, 2009, сс. 383-397, таблица 2). Эртумаксомаб вводили путем i.v.-инфузии в возрастающих дозах, начиная с 10 мкг в день 1, с последующим введением 20, 50, 100, 150 или 200 мкг соответственно в каждый из дней 7±1 и 13±1 (Kiewe и др., Clin Cancer Res, 12, 2006, сс. 3085-3091). Таким образом, для мультиспецифических, в частности биспецифических антител, таких как биспецифические трехфункциональные антитела, в клинических испытаниях протокол обработки, как правило, предусматривал схему на основе возрастающих доз. Следует отметить, что назальная доза мультиспецифических, в частности биспецифических антител, таких как биспецифические трехфункциональные антитела, является имеющим решающее значение параметром, поскольку эти антитела активируют Т-клетки, запускают высвобождение провоспалительных цитокинов и осуществляют повышающую регуляцию костимуляторных факторов, например, CD28.
Предпочтительно антитело или его антигенсвязывающий фрагмент, предлагаемое/предлагаемый для применения согласно настоящему изобретению, применяют в виде одного или нескольких циклов лечения. В контексте настоящего описания цикл лечения обозначает курс, включающий одну или несколько обработку(ок), которую(ые) можно повторять на регулярной основе с периодами без обработки между ними. Например, антитело или его антигенсвязывающий фрагмент, предлагаемое/предлагаемый для применения согласно настоящему изобретению, можно применять в виде одного цикла лечения (например, одной единичной дозы или повторяющихся доз) и затем можно оценивать происходят ли рецидивы рака или опухоли. В частности, в случае рецидивов рака/опухоли можно осуществлять дополнительный цикл лечения. Однако дополнительный цикл лечения можно осуществлять также в профилактических целях. В частности, интервал между двумя обработками (например, двумя дозами) в одном цикле лечения предпочтительно не должен превышать 1 месяц (31 день), более предпочтительно он не должен превышать 3 недели, при этом интервал между окончанием одного цикла лечения и началом следующего цикла лечения предпочтительно составляет по меньшей мере 1 месяц, предпочтительно по меньшей мере 2 месяца, более предпочтительно по меньшей мере 3 месяца, еще более предпочтительно по меньшей мере 4 месяца и наиболее предпочтительно по меньшей мере 6 месяцев.
Предпочтительно один цикл лечения включает (I) одну единичную дозу (II) одну начальную дозу и одну или несколько последующих доз. Протокол лечения согласно настоящему изобретению, как правило, включает несколько однократных обработок, из которых состоит цикл лечения. Пациента можно подвергать одному единственному или нескольким циклам лечения. Каждый цикл лечения, как правило, включает введение от 2 до 28, предпочтительно от 2 до 20, более предпочтительно от 3 до 10 и еще более предпочтительно от 5 до 8, например, 6 или 7, индивидуальных доз.
Предпочтительно один цикл лечения включает одну начальную дозу и одну или несколько последующих доз и при этом (I) одна начальная доза и одна или несколько последующих доз являются одинаковыми, или (II) одна или несколько последующая(их) доза(з) является(ются) более высокой(ими), чем начальная доза. Другими словами, предпочтительно, чтобы в цикле лечения (начинающегося начальной дозой и оканчивающегося конечной дозой) доза при каждой индивидуальной обработке (за исключением начальной дозы) не была ниже предшествующей применяемой дозы, т.е. каждая последующая доза была равна или превышала предшествующую дозу. Указанное применение возрастающих доз, которое в контексте настоящего описания обозначают как эскалация дозирования, предпочтительно включает также дозы, равные предшествующим. Например, только начальная доза может быть более низкой, а все последующие дозы могут быть такими же (и превышать начальную дозу) или начальная доза может быть ниже, а вторая доза может быть выше начальной дозы, но ниже, чем последующие дозы, при этом все последующие дозы предпочтительно являются одинаковыми (и выше, чем начальная доза и вторая доза). Таким образом, предпочтительно, чтобы одна или несколько последующих доз представляли собой возрастающие дозы, т.е. дозы, превышающие предшествующую дозу. Конечная доза цикла лечения, как правило, соответствует самому высокому количеству антитела, которое можно вводить в одном цикле лечения; т.е. представляет собой максимальную дозу. В частности, в конце любого цикла лечения можно предусматривать одно, два, три, четыре, пять или большее количество введений доз, соответствующих максимальной дозе. В целом, основной принцип эскалации доз состоит в том, чтобы избегать введения пациенту субтерапевтических доз с сохранением безопасности и поддержанием быстрого накопления.
Таким образом, предпочтительно, чтобы в одном и том же цикле лечения ни одна из единичных доз не была ниже предшествующей. Если последующая доза представляет собой вторую дозу, то предшествующая доза представляет собой начальную дозу («первая доза» или «исходная доза»). Если последующая доза представляет собой третью дозу, то предшествующая доза представляет собой вторую дозу. Таким образом, понятие «предшествующая доза» в контексте настоящего описания относится к дозе, непосредственно предшествующей дозе, вводимой пациенту в настоящее время, если у пациента диагностирован по меньшей мере один тип рака.
Как правило, один цикл лечения включает по меньшей мере начальную (первую) дозу и вторую дозу. В предпочтительном варианте осуществления изобретения один цикл лечения может включать начальную (первую) дозу, вторую дозу, третью дозу, четвертую дозу, пятую дозу и предпочтительно дополнительно шестую дозу. В одном цикле лечения последующую дозу можно предпочтительно вводить через 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или 21 день после предшествующей дозы, предпочтительно последующую дозу вводят через 2-15 дней после предшествующей дозы, более предпочтительно последующую дозу вводят через 5-10 дней после предшествующей дозы, еще более предпочтительно последующую дозу вводят через 6-8 дней после предшествующей дозы и наиболее предпочтительно последующую дозу вводят примерно через 7 дней после предшествующей дозы. Другими словами, наиболее предпочтительно, если антитело или его антигенсвязывающий фрагмент вводят еженедельно, предпочтительно в виде одной дозы в неделю, например, посредством внутрипузырного пути. Введение последующих доз указанного антитела или его антигенсвязывающего фрагмента продемонстрировало снижение (избыточного) высвобождения провоспалительных цитокинов. Скачкообразно повышающиеся уровни провоспалительных цитокинов, как правило, снижаются в процессе лечения до уровня ниже предела обнаружения. Одновременно усиливаются цитотоксические иммунные ответы против неоплазм в мочевых путях.
Предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, применяют в виде одной единичной дозы, составляющей от 0,1 до 5000 мкг, предпочтительно от 1 до 1000 мкг или от 5 до 500 мкг, более предпочтительно от 10 до 300 мкг, наиболее предпочтительно от 20 до 100 мкг. Другими словами, каждая доза антитела или его антигенсвязывающего фрагмента, предназначенного для применения согласно настоящему изобретению, составляет от 0,1 до 5000 мкг, предпочтительно от 1 до 1000 мкг или от 5 до 500 мкг, более предпочтительно от 10 до 300 мкг, наиболее предпочтительно от 20 до 100 мкг. В контексте настоящего изобретения «одна (единичная) доза» (или «каждая доза» представляет собой индивидуальную дозу, которую вводят одному пациенту в один момент введения.
Общая доза (в виде суммы всех единичных доз в цикле лечения) антитела или его антигенсвязывающего фрагмента, предназначенного для применения согласно настоящему изобретению, в цикле лечения предпочтительно составляет от 100 до 1500 мкг, более предпочтительно от 200 до 1000 мкг и еще более предпочтительно от 300 до 800 мкг.
Предпочтительно начальная доза антитела или его антигенсвязывающего фрагмента составляет от 0,5 до 500 мкг, предпочтительно от 1 до 200 мкг, более предпочтительно от 5 до 100 мкг, наиболее предпочтительно от 10 до 70 мкг. Начальная доза представляет собой первую и предпочтительно самую низкую дозу в одном цикле лечения.
Предпочтительно также, чтобы единичная доза мультиспецифического антитела или его антигенсвязывающего фрагмента, подлежащего введению, составляла от 0,5 до 1000 мкг, более предпочтительно от 1 до 500 мкг, еще более предпочтительно от 5 до 200 мкг и наиболее предпочтительно от 10 до 150 мкг.
Предпочтительно уровень первой из последующих доз превышает количество, вводимое в качестве начальной дозы, предпочтительно в 1,1-10,0 раз, более предпочтительно в 1,2-5,0 раз и еще более предпочтительно в 1,5-3,0 раза, и необязательно вторая последующая доза и каждая из вводимых далее доз превышает количество, вводимое в качестве начальной дозы в 1,1-10,0 раз, предпочтительно в 1,5-5,0 раз.
При этом, третья, четвертая и пятая последующая доза могут быть такими же, как вторая последующая доза. Предпочтительно вторая последующая доза выше, чем первая последующая доза. Необязательно третья последующая доза и каждая из последующих доз может представлять собой повторную дозу первой или второй последующей дозы, т.е. доза может оставаться постоянной. Альтернативно этому, третья и каждая другая последующая доза выше, чем вторая последующая доза в одном и том же цикле лечения.
Соответственно мультиспецифическое антитело или его антигенсвязывающий фрагмент, указанное/указанный в настоящем описании, применяют также для приготовления фармацевтической композиции, предназначенной для лечения индивидуума, у которого диагностирован рак, при этом указанную фармацевтическую композицию предпочтительно вводят внутрипузырно и предпочтительно указанную фармацевтическую композицию вводят в таком объеме, который соответствует начальной дозе мультиспецифического антитела или его антигенсвязывающего фрагмента (в виде раствора), составляющей от 10 до 200 мкг, предпочтительно от 15 до 100 мкг, например, 20 мкг или 50 мкг, и/или максимальной дозе от 50 до 200 мкг, например, 100 мкг.
Максимальную дозу (в цикле лечения) предпочтительно выбирают из диапазона от 25 до 1000 мкг, предпочтительно от 50 до 500 мкг, более предпочтительно от 75 до 150 мкг, например, она составляет 100 мкг.
Предпочтительно в одном цикле лечения каждую последующую дозу вводят через 1-31 день после предшествующей дозы, предпочтительно через 1-21 день после предшествующей дозы, более предпочтительно через 5-10 дней после предшествующей дозы и еще более предпочтительно через 7 дней после предшествующей дозы. Указанная доза предпочтительно представляет собой «последующую дозу». Каждую единичную дозу предпочтительно вводят внутрипузырно, например, каждые 7 дней (еженедельно). Прежде всего, пожилым пациентам, у которых наиболее часто встречаются и превалируют неопластические заболевания мочевого пузыря, предпочтительно введение осуществляют с меньшей частотой, например еженедельно или реже.
Антитело или его антигенсвязывающий фрагмент, указанное/указанный в настоящем описании, как правило, применяют для лечения неоплазмы мочевых путей, при этом указанное лечение предпочтительно включает один единственный или повторные циклы лечения. Каждый цикл лечения можно повторять один, два, три раза или еще большее количество раз. Как правило, цикл лечения включает, например, от 6 до 10 доз, которые следует вводить каждые 1-30 дней, например, каждые 1-10 дней, предпочтительно каждый 7-ой день, в течение периода времени, составляющего от 30 до 60 дней. Несколько циклов лечения, как правило, прерываются периодами без лечения, составляющими от 1 до 12 месяцев, предпочтительно по меньшей мере 2 месяца, более предпочтительно по меньшей мере 3 месяца, еще более предпочтительно по меньшей мере 4 месяца и наиболее предпочтительно по меньшей мере 6 месяцев. Затем лечение можно повторять, используя другой цикл лечения, который может быть практически идентичен предыдущему циклу лечения (идентичное дозирование и протокол введения). Альтернативно этому, дозирование при осуществлении второго, третьего и любого дополнительного цикла лечения можно также изменять по сравнению с предыдущим циклом лечения (в зависимости от воздействий, обнаруженных в процессе предыдущего цикла). Как правило, доза каждого индивидуального введения второго и третьего цикла лечения является либо такой же, либо несколько (например, вплоть до 3,0 раз) превышает начальную дозу. В конце протокола лечения, например, четвертого, пятого или шестого цикла лечения, дозу каждого индивидуального введения можно вновь снижать, например, до уровня, соответствующего первому циклу, или даже до более низкого уровня.
В предпочтительном варианте осуществления изобретения (единичную) дозу антитела или его антигенсвязывающего фрагмента вводят один раз в неделю, например, в течение 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 недель. Альтернативно этому, (единичную) дозу антитела или его антигенсвязывающего фрагмента, вводят, например, по меньшей мере два раза в неделю, например, ежедневно. Ежедневное введение предпочтительно осуществляют в течение 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 последовательных дней. Для уменьшения влияния на качество жизни пациента и для увеличения удобства введение предпочтительно осуществляют реже, чем каждый день, например, лишь каждый второй, третий, четвертый, пятый или шестой день. Наиболее предпочтительно частота введения составляет максимум раз в неделю, более предпочтительно лишь каждую вторую или третью неделю. В некоторых вариантах осуществления настоящего изобретения введение можно осуществлять лишь один раз в месяц. Однако в контексте настоящего изобретения предпочтительным является введение один раз в неделю, поскольку в указанном временном интервале, с одной стороны, сбалансировано удобство применения и, с другой стороны, непрерывный медицинский надзор лечащим врачом.
Комбинированная терапия
Антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, можно вводить в виде индивидуальной (автономной) терапии или в сочетании с одним или несколькими другими компонентами (в контексте настоящего описания обозначены также как «агенты комбинации»).
Предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, вводить в виде индивидуальной терапии, например, после хирургического удаления опухоли. Так, понятие «индивидуальная терапия» означает, в частности, что антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, представляет собой единственный агент, который применяют для лечения неоплазмы мочевых путей, указанной в настоящем описании. Предпочтительно никаких других агентов или лекарственных средств не требуется (в сочетании с антителом или его антигенсвязывающим фрагментом, предназначенным для применения согласно настоящему изобретению) для лечения неоплазмы мочевых путей, указанной в настоящем описании.
Антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, является особенно предпочтительным в качестве индивидуальной терапии при всех стадиях рака. Антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, является особенно предпочтительным в качестве индивидуальной терапии на ранних стадиях рака, в частности, на стадии 0а или на стадии 0is рака мочевого пузыря.
Например, антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, можно не применять в комбинации с активированными лимфоцитами периферической крови (PBL). Кроме того, антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, можно, например, не применять в сочетании с IL-2.
Предпочтительно также антитело или его антигенсвязывающий фрагмент, указанное/указанный в настоящем описании, применять в комбинации, в частности, в комбинации с противораковым лекарственным средством или в комбинации с аутологичными иммунными эффекторными клетками. Указанную комбинированную терапию можно применять на всех стадиях рака. Однако комбинированная терапия, указанная в настоящем описании, является особенно предпочтительной на более поздних стадиях рака, в частности, на стадии I или стадии II рака мочевого пузыря.
Понятие «комбинированная терапия» или «применение в сочетании (комбинации)» в контексте настоящего описания относится, в частности, к введению, гарантирующему, что компоненты (лекарственные средства) комбинированной терапии по меньшей мере в определенный момент времени одновременно проявляют их действия в организме (человека). Другими словами, если введение первого компонента настолько предшествует введению второго компонента, что в момент введения второго компонента первый компонент уже не присутствует и/или является не эффективным в организме (человека) (например, в результате процессов расщепления), то такую ситуация, как правило, не рассматривают как «комбинированную терапию» или как «введение в комбинации» в контексте настоящего изобретения. Специалист в данной области, как правило, учитывает время полужизни компонентов при рассмотрении комбинированной терапии.
Предпочтительно антитело или его антигенсвязывающий фрагмент, указанное/указанный в настоящем описании, применяют в сочетании с адаптивным переносом клеток. В целом, клетки, подлежащие переносу, можно получать из организма пациента и затем изменять перед обратным внесением или их можно получать из другого индивидуума. Наиболее часто клетки получают из иммунной системы с целью придания улучшенной иммунной функциональности и характеристик при возвращении клеток обратно в организм пациент. Перенос аутологичных клеток или клеток из организма пациента минимизирует реакцию трансплантат-против-хозяина (GVHD). Таким образом, предпочтительно антитело или его антигенсвязывающий фрагмент, указанное/указанный в настоящем описании, вводить в комбинации с аутологичными иммунными эффекторными клетками, предпочтительно РВМС (мононуклеарные клетки периферической крови). В частности, если антитело или его антигенсвязывающий фрагмент, указанное/указанный в настоящем описании, применяют местно, например, внутрипузырно, то его предпочтительно применять в сочетании с аутологичными иммунными эффекторными клетками, предпочтительно РВМС (мононуклеарные клетки периферической крови). При этом увеличивается популяция локально доступных иммунных эффекторных клеток. Аутологичные РВМС можно получать из периферической крови пациента с помощью стандартных методов типа центрифугирования в плотности фиколла. РВМС можно применять в диапазоне 104-108 клеток.
Предпочтительно также антитело или его антигенсвязывающий фрагмент, указанное/указанный в настоящем описании, вводить в комбинации с противораковым лекарственным средством. Противораковое лекарственное средство может представлять собой любую малую или крупную молекулу или соединение, которая/которое обладает терапевтической активностью при лечении рака, в частности рака мочевых путей. Указанные противораковые лекарственные средства, в частности противораковые лекарственные средства для лечения раков мочевых путей, хорошо известны специалисту в данной области. Кроме того, комбинации различных противораковых лекарственных средств можно также применять в сочетании с антителом или его антигенсвязывающим фрагментом, указанным в настоящем описании.
Предпочтительно противораковое лекарственное средство, которое можно применять в сочетании с антителом или его антигенсвязывающим фрагментом, указанным в настоящем описании, представляет собой цитотоксический агент, противораковое антитело или БЦЖ (бацилла Кальметта-Герена). Более предпочтительно противораковое лекарственное средство, которое можно применять в сочетании с антителом или его антигенсвязывающим фрагментом, указанным в настоящем описании, представляет собой цитотоксический агент или противораковое антитело. Еще более предпочтительно противораковое лекарственное средство, которое можно применять в сочетании с антителом или его антигенсвязывающим фрагментом, указанным в настоящем описании, представляет собой цитотоксический агент.
Цитотоксические агенты препятствуют или ингибируют клеточную функцию, предупреждая тем самым быстрый рост и деление раковых клеток и других клеток в организме. Предпочтительные цитотоксические агенты включают алкилирующие агенты, антиметаболиты, агенты, воздействующие на микротрубочки, ингибиторы топоизомеразы и цитотоксические антибиотики. Предпочтительно цитотоксический агент выбирают из группы, состоящей из цисплатина, митомицина (в частности, митомицина С), валрубицина, доцетаксела, тиотепы и гемцитабина.
Противораковое антитело предпочтительно представляет собой моноклональное моноспецифическое противораковое антитело, которое предпочтительно выбирают из группы, состоящей из трастузумаба, алемтузумаба, атезолизумаба, авелумаба, бевацизумаба, брентуксимаба ведотина, цетуксимаба, гемтузумаба озогамицина, ибритумомаба, тиуксетана, ипилимумаба, нимотузумаба, офатумумаба, панитумумаба, пембролизумаба, ритуксимаба и тозитумомаба. Предпочтительно также противораковое антитело представляет собой моноклональное моноспецифическое противораковое антитело, которое выбирают из группы, состоящей из трастузумаба, алемтузумаба, атезолизумаба, авелумаба, бевацизумаба, брентуксимаба ведотина, цетуксимаба, гемтузумаба озогамицина, ибритумомаба, тиуксетана, ипилимумаб, нимотузумаба, ниволумаба, офатумумаба, панитумумаба, пембролизумаба, ритуксимаба и тозитумомаба.
Предпочтительно антитело или его антигенсвязывающий фрагмент, предлагаемое/предлагаемый для применения согласно настоящему изобретению, вводят в комбинации с противораковым лекарственным средством, в частности, с противораковым антителом, указанным в настоящем описании, но не в комбинации с (аутологичными) иммунными эффекторными клетками, такими, например, как (актированные) лимфоциты периферической крови. Это означает, что предпочтительно в комбинированной терапии, указанной в настоящем описании, антитело или его антигенсвязывающий фрагмент,
предлагаемое/предлагаемый для применения согласно настоящему изобретению, и противораковое лекарственное средство представляют собой единственные агенты, которые применяют для лечения неоплазмы мочевых путей, указанной в настоящем описании.
Альтернативно этому, предпочтительно также антитело или его антигенсвязывающий фрагмент, предлагаемое/предлагаемый для применения согласно настоящему изобретению, вводят в комбинации с адаптивным переносом клеток, указанным в настоящем описании, но не в комбинации с противораковым лекарственным средством, указанным в настоящем описании. Это означает, что предпочтительно в комбинированной терапии, указанной в настоящем описании, антитело или его антигенсвязывающий фрагмент, предлагаемое/предлагаемый для применения согласно настоящему изобретению, и (аутологичные) иммунные эффекторные клетки представляют собой единственные агенты, которые применяют для лечения неоплазмы мочевых путей, указанной в настоящем описании.
Кроме того, предпочтительно также антитело или его антигенсвязывающий фрагмент, предлагаемое/предлагаемый для применения согласно настоящему изобретению, вводят в комбинации с (I) противораковым лекарственным средством, указанным в настоящем описании, в частности, с противораковым антителом, указанным в настоящем описании, и (II) адаптивным переносом клеток, указанным в настоящем описании, в частности, (аутологичных) иммунных эффекторных клеток, указанных в настоящем описании.
Предпочтительно антитело или его антигенсвязывающий фрагмент, указанное/указанный в настоящем описании, и (другой) входящий в комбинацию агент, такой как противораковое лекарственное средство или (аутологичные) иммунные эффекторные клетки, вводят последовательно. Например, антитело или его антигенсвязывающий фрагмент, указанное/указанный в настоящем описании, предпочтительно вводят перед (другим) входящим в комбинацию агентом, таким как противораковое лекарственное средство или (аутологичные) иммунные эффекторные клетки. Предпочтительно также антитело или его антигенсвязывающий фрагмент, указанное/указанный в настоящем описании, вводят после (другого) входящего в комбинацию агента, такого как противораковое лекарственное средство или (аутологичные) иммунные эффекторные клетки.
При последовательном применении промежуток времени между введением первого компонента и введением второго компонента предпочтительно составляет не более 1 недели, более предпочтительно составляет не более 3 дней, еще более предпочтительно составляет не более 2 дней и наиболее предпочтительно составляет не более 24 ч между введением первого компонента и введением второго компонента. Особенно предпочтительно оба компонента вводят в один и тот же день так, чтобы промежуток времени между введением первого компонента (и введением второго компонента) составлял предпочтительно не более 6 ч, более предпочтительно не более 3 ч, еще более предпочтительно не более 2 ч и наиболее предпочтительно не более 1 ч.
Альтернативно этому, антитело или его антигенсвязывающий фрагмент, указанное/указанный в настоящем описании, можно вводить также параллельно с (другим) входящем в комбинацию агентом, таким как противораковое лекарственное средство или (аутологичные) иммунные эффекторные клетки, т.е. примерно в одно и то же время. «Примерно в одно и то же время» в контексте настоящего описания означает, в частности, одновременное введение или вариант, когда непосредственно после введения (другого) входящего в комбинацию агента, такого как противораковое лекарственное средство или (аутологичные) иммунные эффекторные клетки, вводят антитело или его антигенсвязывающий фрагмент, указанный в настоящем описании, или непосредственно после введения антитела или его антигенсвязывающего фрагмента, указанного в настоящем описании, вводят (другой) входящий в комбинацию агент, такой как противораковое лекарственное средство или (аутологичные) иммунные эффекторные клетки. Специалисту в данной области должно быть очевидно, что «непосредственно после» включает время, необходимое для подготовки ко второму введению - в частности, время, необходимое для обработки и дезинфекции области для второго введения, а также для соответствующей подготовки «устройства для введения» (например, шприца, насоса и т.д.). Одновременное введение включает также ситуацию, когда периоды введения антитела или его антигенсвязывающего фрагмента, указанного в настоящее описании, и (другого) входящего в комбинацию агента, такого как противораковое лекарственное средство или (аутологичные) иммунные эффекторные клетки, перекрываются, или ситуацию, когда, например, один компонент вводят в течение более длительного периода времени, такого как 30 мин, 1 ч, 2 ч или еще более длительного периода времени, например, путем инфузии, а другой компонент вводят в некоторый момент времени в течение указанного длительного периода. Введение антитела или его антигенсвязывающего фрагмента, указанного в настоящем описании, и (другого) входящего в комбинацию агента, такого как противораковое лекарственное средство или (аутологичные) иммунные эффекторные клетки, примерно в одно и то же время является особенно предпочтительным, если используют различные пути введения и/или различные области введения.
Предпочтительно антитело или его антигенсвязывающий фрагмент, указанное/указанный в настоящем описании, и (другой) входящий в комбинацию агент, такой как противораковое лекарственное средство или (аутологичные) иммунные эффекторные клетки, (I) входят в одну композицию или (II) их вводят отдельно.
Если они входят в одну композицию, то можно использовать описанную ниже фармацевтическую композицию.
Введение по отдельности является особенно предпочтительным, если предполагается использовать различные пути введения. Например, (другой) входящий в комбинацию агент, такой как противораковое лекарственное средство или (аутологичные) иммунные эффекторные клетки, можно вводить системно, например, i.v. или р.о., а антитело или его антигенсвязывающий агент, указанное/указанный в настоящем описании, можно вводить внутрипузырно.
Фармацевтическая композиция, предназначенная для применения при лечении неоплазмы мочевых путей
Следующим объектом настоящего изобретения является фармацевтическая композиция, содержащая антитело или его антигенсвязывающий фрагмент, указанное/указанный в настоящем описании, которая предназначена для применения при лечении неоплазмы мочевых путей, указанной в настоящем описании.
Более конкретно, настоящее изобретение относится к фармацевтической композиции, предназначенной для лечения неоплазмы мочевых путей, указанной в настоящем описании, например, путем внутрипузырного введения. Фармацевтическая композиция содержит мультиспецифическое антитело или его антигенсвязывающий фрагмент, указанное/указанный выше. Предпочтительно соответствующее дозирование (режим дозирования) применяют для введения антитела или его антигенсвязывающего фрагмента, указанного в настоящем описании, такого как режим дозирования, схема и путь обработки, описанные выше для антитела или его антигенсвязывающего фрагмента.
Таким образом, следующим объектом настоящего изобретения является фармацевтическая композиция, предназначенная для применения при лечении неоплазмы мочевых путей, где указанная фармацевтическая композиция содержит антитело или его антигенсвязывающий фрагмент, указанное/указанный в настоящем описании, в частности биспецифическое, например, биспецифическое трехфункциональное антитело. Предпочтительные варианты фармацевтической композиции включают указанные в настоящем описании предпочтительные варианты антитела, предназначенного для применения согласно настоящему изобретению. Предпочтительные применения фармацевтической композиции включают предпочтительные применения антитела или его антигенсвязывающего фрагмента, указанного в настоящем описании.
Предпочтительно фармацевтическая композиция содержит антитело или его антигенсвязывающий фрагмент, указанное/указанный в настоящем описании, в «терапевтически эффективном количестве», которое является достаточным для оказания благоприятного воздействия на индивидуума. Фактическое вводимое количество и уровень, и период времени обработки должны зависеть от природы и серьезности неоплазмы мочевых путей.
Фармацевтическая композиция может содержать также комбинацию по меньшей мере двух различных антител или их антигенсвязывающих фрагментов, указанных в настоящем описании. Таким образом, целью могут являться различные мишени, ассоциированные с одной и той же неоплазмой, что предпочтительно повышает эффективность. Таким образом, с успехом может быть снижена доза индивидуального лекарственного средства.
Предпочтительно фармацевтическая композиция содержит также фармацевтически приемлемый носитель и/или наполнитель или любой эксципиент, буфер, стабилизатор или другие материалы, хорошо известные специалистам в данной области.
В качестве дополнительного ингредиента фармацевтическая композиция может, в частности, содержать (совместимый) фармацевтически приемлемый носитель и/или наполнитель. В контексте настоящего изобретения фармацевтически приемлемый носитель, как правило, включает жидкую или нежидкую основу фармацевтической композиции. Понятие «совместимый» в контексте настоящего описания означает, что указанные составляющие фармацевтической композиции можно смешивать с антителом или его антигенсвязывающим фрагментом, указанным выше, так, что не происходит никакого взаимодействия, которое могло бы существенно снижать фармацевтическую эффективность фармацевтической композиции в обычных условиях применения. Фармацевтически приемлемые носители и наполнители должны, естественно, иметь достаточно высокую степень чистоты и достаточно низкую токсичность, что делает их приемлемыми для введения субъекту, подлежащему лечению.
Предпочтительно фармацевтическая композиция находится в форме лиофилизированного порошка или в форме жидкой композиции, предпочтительно водного раствора. Таким образом, фармацевтическую композицию, предлагаемую в настоящем изобретении, можно получать в виде высушенного лиофизированного порошка или более предпочтительно в виде раствора (растворенного в наполнителе). Если производитель получает ее в виде лиофилизированного порошка, то обычно ее растворяют в соответствующем растворе (водный раствор, такой как вода для инъекций или физиологический раствор, необязательно забуренный, такой как ЗФР) непосредственно перед применением. Флаконы жидкого лекарственного средства могут быть одноразовые или могут быть предназначены для многократного применения.
В другом предпочтительном варианте осуществления изобретения антитело и/или фармацевтическая композиция, предназначенная для применения согласно настоящему изобретению, не является лиофилизированным/лиофилизированной. Так, предпочтительно антитело или его антигенсвязывающий фрагмент, предназначенное/предназначенный для применения согласно настоящему изобретению, не является лиофилизированным, но его приготавливают в растворе, предпочтительно в водном растворе, более предпочтительно в водном забуференном растворе.
Таким образом, наиболее предпочтительно фармацевтическая композиция находится в жидкой форме. Так, фармацевтически приемлемый носитель должен, как правило, содержать один или несколько (совместимых) фармацевтически приемлемых жидких носителей. Примеры (совместимых) фармацевтически приемлемых жидких носителей включают свободную от пирогенов воду, изотонические физиологические или забуференные (водные) растворы, например, цитратные забуференные растворы; полиолы, такие, например, как полипропиленгликоль, глицерин, сорбит, манит и полиэтиленгликоль; альгиновую кислоту, дополнительные неорганические или органические полимеры, такие как PLGA, предпочтительно для обеспечения существенного высвобождения активного агента, предлагаемого в настоящем изобретении. Предпочтительно в жидкой фармацевтической композиции носитель представляет собой свободную от пирогенов воду; изотонические физиологические или забуференные (водные) растворы, например, забуференные фосфатные, цитратные и т.д. растворы. Предпочтительно для инъекции или инстилляции фармацевтической композиции можно применять предпочтительно буфер, более предпочтительно водный буфер, такой как цитратный буфер.
Таким образом, предпочтительно фармацевтическая композиция содержит буфер, предпочтительно органический кислотный буфер (т.е. буфер на основе органической кислоты), такой как цитратный буфер, сукцинатный буфер и тартратный буфер, более предпочтительно фармацевтическая композиция содержит цитратный буфер. Так, буфер на основе органической кислоты предпочтительно выбирают из группы, состоящей из цитратного буфера, сукцинатного буфера, тартратного буфера и фосфат-цитратного буфера, более предпочтительно выбирают из группы, состоящей из цитратного буфера, сукцинатного буфера и тартратного буфера. Наиболее предпочтительный буфер представляет собой цитратный буфер. Как правило, буфер может содержать (также) натриевую соль, предпочтительно по меньшей мере 30 мМ натриевую соль, кальциевую соль, предпочтительно по меньшей 0,05 мМ кальциевую соль, и/или необязательно, калиевую соль, предпочтительно по меньшей мере 1 мМ калиевую соль. Натриевая, кальциевая и/или калиевая соль могут присутствовать в форме галогенидов, например, хлоридов, йодидов или бромидов, в форме их гидроксидов, карбонатов, кислых карбонатов или сульфатов и т.д.. Примеры натриевых солей включают (но, не ограничиваясь только ими), например, NaCl, NaI, NaBr, Na2CO3, NaHCO3, Na2SO4, примеры необязательных калиевых солей включают, например, KСl, KI, KBr, K2CO3, KHCO3, K2SO4, и примеры кальциевых солей включают, например, CaCl2, CaI2, CaBr2, CaCO3, CaSO4, Са(ОН)2. Кроме того, в буфер могут входить органические анионы вышеперечисленных катионов.
Фармацевтическая композиция может содержать также физиологический раствор (0,9% NaCl), лактированный раствор Рингера или ЗФР (забуференный фосфатом физиологический раствор). Например, фармацевтическая композиция может находиться в виде маточного раствора антитела или его антигенсвязывающего фрагмента в соответствующем буфере, таком как буфер на основе органической кислоты, описанный выше, предпочтительно цитратном буфере, и лишь непосредственно перед применением указанный маточный раствор может быть разведен физиологическим раствором (0,9% NaCl), лактированным раствором Рингера или ЗФР до достижения требуемой подлежащей введению концентрации антитела.
Кроме того, можно использовать один или несколько совместимых твердых или жидких наполнителей или разбавителей, или капсулирующих соединений для фармацевтической композиции, которые пригодны для введения субъекту, подлежащему лечению. Другие примеры соединений, которые могут содержаться в фармацевтической композиции, включают сахара, такие, например, как лактоза, глюкоза и сахароза; крахмалы, такие, например, как кукурузный крахмал или картофельный крахмал; целлюлозу и ее производные, такие, например, как натриевая соль карбоксиметилцеллюлозы, этилцеллюлоза, ацетат целлюлозы; порошкообразный трагакант; солод; желатин; твердый жир; твердые обеспечивающие скольжение вещества, такие, например, как стеариновая кислота, стеарат магния; сульфат кальция; растительные масла, такие, например, как арахисовое масло, масло из семян хлопчатника, кунжутное масло, оливковое масло, кукурузное масло и масло купуасу (теобромы); полиолы, такие, например, как полипропиленгликоль, глицерин, сорбит, маннит и полиэтиленгликоль; альгиновую кислоту. Кроме того, при необходимости можно включать консерванты, стабилизаторы, антиоксиданты и/или другие добавки. Таким образом, фармацевтическая композиция может включать также стабилизаторы, такие как Tween® 80 или Tween® 20. Необязательно эксципиенты, обеспечивающие способность к непрерывному высвобождению антитела или его антигенсвязывающего фрагмента, указанного в настоящем описании, могут входить в фармацевтическую композицию.
Фармацевтическая композиция может содержать также дополнительное противораковое лекарственное средство, указанное выше.
Предпочтительно значение рН фармацевтической композиции составляет от 6,5 до 8,2, предпочтительно от 7,0 до 7,8, более предпочтительно от 7,2 до 7,6, наиболее предпочтительно от 7,4. Указанное значение рН адаптировано как к окружению мочевых путей, так и обеспечивает стабильность, необходимую для активного агента, предлагаемого в настоящем изобретении. Таким образом, фармацевтическая композиция, имеющая указанное рН, пригодна, например, для местного введения в мочевые пути, не вызывая при этом раздражения и без влияния на стабильность антитела или его антигенсвязывающего фрагмента, указанного в настоящем описании.
В предпочтительном варианте осуществления изобретения фармацевтическая композиция не содержит других компонентов кроме (I) антитела или его антигенсвязывающего фрагмента, указанного в настоящем описании; (II) буфера, указанного в настоящем описании; и необязательно (III) воды для инъекций, физиологического раствора и/или ЗФР.
Субъекты, подлежащие лечению
Субъект, подлежащий лечению, предпочтительно представляет собой человека или животное кроме человека, в частности, млекопитающее или человека. Для людей может быть наиболее ценным предлагаемый в изобретении протокол введения антитела или его антигенсвязывающего фрагмента, указанного выше. Предпочтительно субъекты представляют собой пациентов, имеющих неоплазму мочевого пузыря. Например, молодых (возрастом менее 15 лет) или престарелых (возрастом более 60 лет) пациентов можно лечить согласно настоящему изобретению. Особенно предпочтительными являются престарелые пациенты, которые представляет группу популяции с наиболее частой встречаемостью и превалированием неоплазмы мочевых путей. Для престарелых пациентов наиболее целесообразно вводить лекарственное средство с помощью пути, назначенного лечащим врачом, который гарантирует удобство применения. В то же время введение предпочтительно должно быть безболезненным.
В целом, на пациентов с неопластическим заболеванием мочевых путей вне зависимости от возраста, которые предпочтительно не подвергаются иммуносупрессорному лечению, может оказывать особенно благоприятное воздействие применение мультиспецифического антитела или его антигенсвязывающего фрагмента, предлагаемого в изобретении.
Набор, содержащий мультиспецифическое антитело
Следующим объектом настоящего изобретения является набор, содержащий антитело или его антигенсвязывающий фрагмент, указанное/указанный в настоящем описании, или фармацевтическую композицию, указанную в настоящем описании, и листовку-вкладыш в упаковку или этикетку с указаниями по лечению неоплазмы мочевых путей, предпочтительно путем местного введения в мочевые пути.
Набор может содержаться в одном или нескольких контейнерах, предпочтительно в одном контейнере.
Указанный набор предпочтительно применяют для предупреждения и/или лечения неоплазмы мочевых путей, указанной в настоящем описании.
Кроме того, набор может содержать также (I) мочевой катетер, (II) шприц для мочевого катетера, (III) дополнительное противораковое лекарственное средство и/или (IV) раствор для восстановления лиофилизированного порошка фармацевтической композиции или раствор для разведения маточного раствора фармацевтической композиции.
Способ лечения субъекта, страдающего неоплазмой мочевых путей
Следующим объектом настоящего изобретения является способ лечения субъекта, страдающего неоплазмой мочевых путей, путем введения мультиспецифического антитела или его антигенсвязывающего фрагмента, где мультиспецифическое антитело содержит
(I) специфичность в отношении поверхностного антигена Т-клетки и
(II) специфичность в отношении ассоциированного с опухолью антигена клеточной поверхности.
Предпочтительно антитело или его антигенсвязывающий фрагмент представляет собой описанные выше антитело или его антигенсвязывающий фрагмент. Более предпочтительно вводят фармацевтическую композицию, указанную выше. Так, при осуществлении указанного способа лечения мультиспецифическое антитело или его антигенсвязывающий фрагмент, как правило, применяют в виде фармацевтической композиции. Фармацевтическую композицию или антитело предпочтительно вводят местно в мочевые пути, например, внутрипузырно.
Кроме того, предлагаемый в настоящем изобретении способ лечения предпочтительно относится также к комбинированной терапии, предусматривающей введение антитела или его антигенсвязывающего фрагмента, указанного в настоящем описании, в сочетании с другим противораковым средством, указанным в настоящем описании. Противораковое средство можно вводить любым приемлемым путем, например, системно или внутрипузырно, предпочтительно, осуществляя введение отдельно от введения антитела, указанного в настоящем описании.
Предпочтительно антитело или его антигенсвязывающий фрагмент, указанное/указанный в настоящем описании, предпочтительно применяют в дозовом режиме, согласно протоколу лечения и посредством пути введения, которые указаны выше, например, путем местного введения в мочевые пути, например, посредством внутрипузырного введения. Таким образом, в способе лечения, указанном в настоящем описании, антитело или его антигенсвязывающий фрагмент, указанное/указанный в настоящем описании, предпочтительно применяют согласно описанному выше.
Краткое описание чертежей
Ниже представлено краткое описание прилагаемых чертежей. Чертежи предназначены для более подробной иллюстрации настоящего изобретения. Однако они никоим образом не направлены на ограничение сущности изобретения.
На чертежах показано:
на фиг. 1 - полученные в примере 1: (А) данные о связывании катумаксомаба с экспрессирующими CD3 клетками Jurkat в 100% моче. 5×105 клеток-мишеней инкубировали при 2-8°С в течение 60 мин с использованием катумаксомаба в указанных концентрациях и (Б) данные о связывании катумаксомаба с позитивными по ЕрСАМ клетками НСТ-8 в 100% моче. 5×105 клеток-мишеней инкубировали при 2-8°С в течение 60 мин с использованием катумаксомаба в указанных концентрациях;
на фиг. 2 - полученные в примере 2 данные о биологической активности катумаксомаба в среде, содержащей 10% мочи, с использованием анализа аллогенной цитотоксичности. 1×105 мононуклеарных клеток периферической крови (РВМС) смешивали с 1×104 опухолевых клеток ЕрСАМ+-НСТ-8 в присутствии в указанных количествах антител. Рассчитывали цитолиз опухолевых клеток и выражали в [%];
на фиг. 3А-Е - полученные в примере 3 результаты эндоскопической визуализации мочевого пузыря пациента 1 примерно за 2 недели до внутрипузырного введения катумаксомаба. Стрелкой на панели Е обозначена растущая папиллярная структура, типичная для поверхностного рака мочевого пузыря;
на фиг. 4А-Е - полученные в примере 3 результаты эндоскопической визуализации мочевого пузыря пациента 1 через 2 недели после последней обработки катумаксомабом. Слизистая оболочка вновь оказалась полностью здоровой в области, проанализированной до лечения.
Примеры
Ниже представлены конкретные примеры, иллюстрирующие различные варианты осуществления и объекты изобретения. Однако объем настоящего изобретения не ограничен конкретными вариантами осуществления изобретения, указанными в настоящем описании. Приведенные препараты и примеры даны для облечения специалисту в данной области понимания и воплощения на практике настоящего изобретения. Однако настоящее изобретение не ограничено объемом приведенных в качестве примера вариантов осуществления изобретения, которые даны только для иллюстрации индивидуальных объектов изобретения, и способы, которые являются функционально эквивалентными, подпадают под объем изобретения. Фактически различные модификации помимо указанных в настоящем описании, могут стать очевидными специалистам в данной области из указанного выше описания, прилагаемых чертежей и представленных ниже примеров. Все такие модификации подпадают по объем прилагаемой формулы изобретения.
Пример 1: Связывающая активность катумаксомаба в содержащей мочу среде
Целью настоящего исследования была оценка связывающей активности катумаксомаба в содержащей мочу среде. Для оценки связывающей активности катумаксомаба применяли линии клеток, экспрессирующие антигены-мишени, соответствующие специфичностям катумаксомаба. Поскольку биспецифическая связывающая активность катумаксомаба характеризуется связыванием CD3+-T-клетками и с опухолевыми ЕрСАМ+-клетками (Chelius и др., Structural and functional characterization of the trifunctional antibody catumaxomab. mAbs 2(3), 2010, cc. 1-12), связывающую активность катумаксомаба оценивали с помощью FACS-анализа (проточная цитометрия) с использованием линий клеток, экспрессирующих релевантные антигены-мишени, а именно, CD3+-клеток Jurkat и ЕрСАМ+-клеток НСТ-8. Для оценки связывающей активности катумаксомаба в содержащей мочу среде, связывание катумаксомаба в нейтральном забуференном фосфатом физиологическом растворе ЗФР (применяемый в качестве контроля буфер (контрольный буфер)) сравнивали со связыванием в образцах мочи двух человек (100% моча).
5×105 клеток-мишеней (CD3+-клеток Jurkat или ЕрСАМ+-клеток НСТ-8) инкубировали при 2-8°С в течение 60 мин, используя катумаксомаб в концентрациях 0,0, 0,01, 0,02, 0,04, 0,08, 0,15, 0,30, 0,60, 1,20, 2,40, 4,80, 9,60 и 19,20 мкг/мл. Клетки-мишени ресуспендировали в ЗФР-буфере или образцах мочи (100% моча). Затем клетки промывали дважды, и клетки, связавшиеся с катумаксомабом, выявляли с помощью флуоресцентно меченных (ФИТЦ) вторичных идентифицирующих антител, таких как крысиный антимышиный IgG (Jurkat) или мышиный антикрысиный IgG (НСТ-8) (фирма Dianova). Позитивно окрашенные клетки оценивали с использованием цитометра FACS-Calibur (фирма Becton Dickinson).
Результаты представлены на фиг. 1. На фиг. 1 продемонстрировано наличие связывания катумаксомаба с экспрессирующими CD3 клетками Jurkat (фиг. 1А) и ЕрСАМ-позитивными клетками НСТ-8 (фиг. 1Б) в контрольном буфере и в 100% моче. В частности, не обнаружено различия в связывании в образце 2 мочи по сравнению с контрольным буфером. Связывание катумаксомаба в образце 1 мочи также не отличалось от связывания в контрольном буфере при более высоких концентрациях антитела. Небольшое снижение связывания в образце 1 мочи по сравнению с контрольным буфером обнаружено при более низких концентрациях антитела, но не при более высоких концентрациях. Таким образом, результаты свидетельствуют о том, что катумаксомаб обладает способностью связываться с его антигенами-мишенями ЕрСАМ и CD3 без снижения активности даже в среде, представляющей собой 100% мочу.
Пример 2: Биологическая активность катумаксомаба в содержащей мочу среде
Затем исследовали биологическую активность катумаксомаба в содержащей мочу среде. Биспецифическое антитело катумаксомаб индуцирует эффективную деструкцию опухолевых ЕрСАМ+-клеток путем переориентирования и активации Т-клеток и иммунных FcγR+-клеток (Lindhofer Н., Hess J, Ruf P., Trifunctional Triomab® antibodies for cancer therapy. B: Bispecific Antibodies, под ред. Kontermann R.E., изд-во Springer Heidelberg Dordrecht London New York, 2011, с. 289). Таким образом, биологическую активность катумаксомаба идеально оценивать in vitro с использованием анализов аллогенной цитотоксичности, в которых осуществляют анализ цитолиза опухолевых клеток-мишеней (Chelius и др., Structural and functional characterization of the trifunctional antibody catumaxomab. mAbs 2(3), 2010, cc. 1-12).
Так, опосредуемый катумаксомабом цитолиз опухолевых ЕрСАМ+-клеток НСТ-8 оценивали с использованием анализа аллогенной цитотоксичности. При этом «цитолитическая активность» катумаксомаба в контрольном ЗФР-буфере сравнивали с его активностью в образцах, содержащих 10% мочи. Тестировали три различных образца мочи. Мононуклеарные клетки периферической крови (РВМС) (1×105 клеток) здорового донора выделяли с помощью центрифугирования в градиенте плотности фиколла и затем смешивали с 1×104 опухолевых ЕрСАМ+-клеток НСТ-8 в присутствии антитела в указанных количествах в 96-луночных плоскодонных планшетах. 10 об. % мочи добавляли в «образец 1 мочи», «образец 2 мочи» и «образец 3 мочи». После совместного культивирования в течение 4 дней при 37°С и 5% СО2 растворимые РВМС промывали дважды ЗФР без Са2+ и Mg2+. Прикрепленные опухолевые клетки затем окрашивали гидроксидом тетразолия (ХТТ, набор для оценки пролиферации клеток II, фирма Roche) и пролиферацию измеряли до тех пор, пока ОП650 нм-490 нм в контрольных образцах опухолевых клеток не достигало 2,5-3,0. Цитолиз опухолевых клеток (%) рассчитывали с помощью формулы:
(ОПопухолевые клетки + РВМС - ОПопухолевые клетки + РВМС + антитело) / (ОПопухолевые клетки + РВМС - ОПсреда)×100%.
Измерение для каждого образца осуществляли с дублированием и рассчитывали средние значения.
Результаты представлены на фиг. 2. На фиг. 2 продемонстрировано, что биологическая активность катумаксомаба в образцах мочи не ослаблялась по сравнению с контрольным буфером. Во всех случаях 100% цитолиз опухолевых клеток обнаружен даже при низких концентрациях катумаксомаба, таких как 4 нг/мл. Следует отметить, что только по техническим причинам, связанным с аналитическими анализами, применяли концентрации, не превышающие 10%: более высокие концентрации мочи приводили к нарушению указанного анализа из-за влияния самой мочи на рост опухолей и цитолиз опухолевых клеток. Однако, можно ожидать, что более высокие концентрации мочи могут приводить к получению других результатов касательно цитотоксических свойств катумаксомаба, что дополнительно подтверждается положительными результатами in vivo, которые представлены ниже в примерах.
Пример 3: Применение для необременительного (сострадательного) лечения 70-летней пациентки с раком мочевого пузыря
70-летнюю пациентку («пациентка 1») с уротелиальной карциномой, впервые диагностированной в 2004 г., и наличием подтвержденных с помощью цитологического анализа мочи ЕрСАМ-позитивных опухолевых клеток лечили с использованием 6 доз антитела катумаксомаба, которое вводили внутрипузырно в соответствии со схемой лечения, обобщенной ниже в таблице 1. Каждую дозу антитела вводили в пустой мочевой пузырь с помощью катетера в 40 мл раствора ЗФР (рН 7,4) и выдерживали в течение по меньшей мере 2 ч до опорожнения, давая антителу связываться.
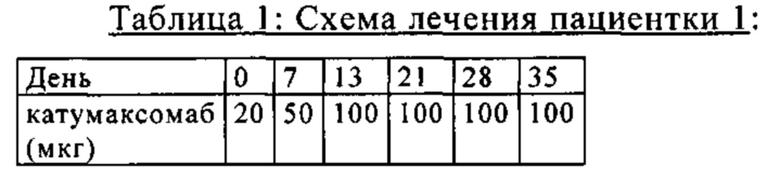
Таким образом, пациентка 1 получала 6-недельные инсталляции возрастающими дозами катумаксомаба, достигающими вплоть до 100 мкг. Общее количество примененного антитела составляло 470 мкг.
Уровни цитокинов в образцах плазмы анализировали с помощью системы Luminex 200 (фирма Luminex, шт. Техас, США) в сочетании с предварительно смешанным 8-плексным набором флуорокинов Х-Мар (фирма R&D Systems, шт. Миннесота, США), содержащим цитокины IL-2, IL-4, IL-6, IL-8, IL-10, IL-17, IFN-γ и TNF-α. Образцы собирали в моменты времени, указанные в таблицах 2А и 2Б, хранили при -20°С и оценивали в виде партии. Образцы, собранные в дни обработок, получали перед инсталляцией антитела. Предел обнаружения цитокинов составлял 3,2 пг/мл. Системные концентрации катумаксомаба измеряли с помощью известного метода ELISA (Ruf и др., Pharmacokinetics, immunogenicity and bioactivity of the therapeutic antibody catumaxomab intraperitonealy administered to cancer patients. Br J Clin Pharmacol. 69(6), 2010, cc. 617-625). Количественный предел обнаружения метода ELISA составлял 125 пг/мл. НАМА (человеческие антимышиные антитела) количественно определяли с помощью набора для ELISA фирма Medac (фирма Medac, Гамбург, Германия) согласно инструкциям производителя. В отрицательных контролях (neg.) уровни составляли менее 40 нг/мл.
Результаты представлены ниже в таблицах 2А и 2Б.

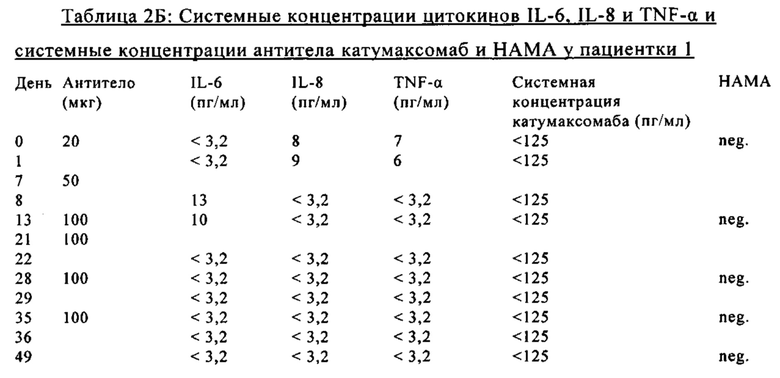
Согласно собственным ощущениям пациентки и результатам физикального обследования лечащим врачом лечение антителом очень хорошо переносилось без видимых признаков каких-либо негативных побочных действий. Прежде всего отсутствовали данные о лихорадке или гриппоподобных симптомах. Таким образом, не обнаружено существенного высвобождения системных цитокинов (таблица 2А и 2Б). Только после второй инстилляции с использованием 50 мкг катумаксомаба в середине курса лечения были выявлены небольшие уровни IL-6 в плазме, составляющие 13 и 10 пг/мл. В процессе дальнейшего лечения уровни IL-6 возвратились к уровням ниже предела обнаружения (3,2 пг/мл). Низкие количества IL-8 и TNF-α были установлены уже до начала лечения - но никакой связанной с лечением индукции этих цитокинов не выявлено. Наоборот, в процессе лечения уровни цитокинов IL-8 и TNF-α снижались до уровня ниже предела обнаружения. Этот результат позволяет предположить, что хроническое воспаление, которое часто обнаруживается в окружении опухолей, могло снижаться в процессе терапии.
Как продемонстрировано в таблице 2Б, концентрации катумаксомаба находились ниже предела количественного обнаружения, составляющего 125 пг/мл и, таким образом, не удалось обнаружить системного присутствия (т.е. в крови пациентки) антитела катумаксомаба. Это свидетельствует о том, что местное введение антитела (т.е. внутрипузырная обработка) в мочевой пузырь не приводило к системному высвобождению лекарственного средства. В соответствии с указанным результатом не происходила индукция человеческих антимышиных антител (НАМА). Через 14 дней после окончания терапии антителом, включающей обработку лекарственным средством в течение 6 недель, пациентка все еще оставалась негативной по НАМА (таблица 2Б).
Образцы мочи пациентки анализировали в отношении опухолевых ЕрСАМ+-клеток до и после лечения. Опухолевые ЕрСАМ+-клетки выявляли с помощью разработанного и описанного иммуногистохимического протокола ( и др., Immunomonitoring Results of a Phase II/III Study of Malignant Ascites Patients Treated with the Trifunctional Antibody Catumaxomab (Anti-EpCAM x anti-CD3). Cancer Res. 72(1), 2012, cc. 24-32), который модифицировали для анализа образцов мочи. В целом, метод состоял в следующем: клетки в 30 мл мочи центрифугировали с использованием цитоцентрифуг Cytospin. Срезы подвергали двойному окрашиванию в отношении ЕрСАМ и цитокератина. Окрашивание ЕрСАМ осуществляли с использованием ЕрСАМ-специфического антитела НО-3 (Ruf и др., Characterisation of the new EpCAM-specific antibody HO-3: implications for trifunctional antibody immunotherapy of cancer. Br J Cancer 97 (3), 2007, cc. 315-321), непосредственного меченного красителем Alexa Fluor 594 Texas Red. Для окрашивания цитокератина использовали антитела к цитокератину 8, 18, 19 А45 В-В3 (фирма Micromet) в сочетании с соответствующим меченным Alexa Fluor 488 вторичным идентифицирующим антителом в виде антимышиного IgG1 (фирма Molecular Probes). Все результаты, полученные с помощью цитоцентрифуг, анализировали с использованием компьютерной системы анализа изображений (MDS, фирма Applied Imaging), подсчитывающей дважды окрашенные клетки. Для количественной оценки CD45+-лейкоцитов дополнительные полученные с помощью цитоцентрифуг препараты окрашивали антителом к CD45 антитело (фирма Caltag Laboratories, Гамбург, Германия) и соответствующим им вторичным антителом в виде антимышиного IgG1, меченного Alexa Fluor 488 (фирма Molecular Probes).
и др., Immunomonitoring Results of a Phase II/III Study of Malignant Ascites Patients Treated with the Trifunctional Antibody Catumaxomab (Anti-EpCAM x anti-CD3). Cancer Res. 72(1), 2012, cc. 24-32), который модифицировали для анализа образцов мочи. В целом, метод состоял в следующем: клетки в 30 мл мочи центрифугировали с использованием цитоцентрифуг Cytospin. Срезы подвергали двойному окрашиванию в отношении ЕрСАМ и цитокератина. Окрашивание ЕрСАМ осуществляли с использованием ЕрСАМ-специфического антитела НО-3 (Ruf и др., Characterisation of the new EpCAM-specific antibody HO-3: implications for trifunctional antibody immunotherapy of cancer. Br J Cancer 97 (3), 2007, cc. 315-321), непосредственного меченного красителем Alexa Fluor 594 Texas Red. Для окрашивания цитокератина использовали антитела к цитокератину 8, 18, 19 А45 В-В3 (фирма Micromet) в сочетании с соответствующим меченным Alexa Fluor 488 вторичным идентифицирующим антителом в виде антимышиного IgG1 (фирма Molecular Probes). Все результаты, полученные с помощью цитоцентрифуг, анализировали с использованием компьютерной системы анализа изображений (MDS, фирма Applied Imaging), подсчитывающей дважды окрашенные клетки. Для количественной оценки CD45+-лейкоцитов дополнительные полученные с помощью цитоцентрифуг препараты окрашивали антителом к CD45 антитело (фирма Caltag Laboratories, Гамбург, Германия) и соответствующим им вторичным антителом в виде антимышиного IgG1, меченного Alexa Fluor 488 (фирма Molecular Probes).
Результаты представлены ниже в таблице 3.

Непосредственно перед началом лечения (день 0) 23 опухолевые клетки удалось обнаружить в 30 мл мочи, в то время как через 1 день после окончания лечения (день 36) никаких опухолевых клеток больше не было обнаружено (таблица 3). Наиболее важным является то, что образцы, полученные в дальнейшем в дни 148, 211, 339 и 701, все еще оставались негативными по опухолевым клеткам. Для подтверждения указанного факта осуществляли цитологический анализ образца мочи, полученного в день 703 (17 февраля 2017 г.), в другой лаборатории, который также не показал наличие опухолевых клеток.
Указанный результат демонстрирует эффективность лечения. Опухолевые клетки часто присутствуют в моче, прежде всего у пациентов с запущенным раком мочевого пузыря, и цитологический анализ мочи представляет собой рекомендованный метод последующего медицинского ухода при неинвазирующих в мышечный слой уротелиальных карцином мочевого пузыря (Babjuk и др., EAU guidelines on non-muscle-invasive urothelial carcinoma of the bladder, the 2011 Update. Eur Urol 59, 2011, cc. 997-1008). Помимо опухолевых ЕрСАМ+-клеток анализировали также лейкоциты до и после лечения в дни, указанные в таблице 3. До начала лечения (день 0) удалось обнаружить 496 CD45+-лейкоцитов, в то время как через 1 день после завершения лечения (день 36) обнаружено только 6 лейкоцитов. Этот результат позволяет предположить, что (I) иммунные эффекторные клетки присутствовали внутри пузыря в начале лечения, которые могли быть переориентированы к области опухоли с помощью трехфункционального антитела, и (II) снижение количества лейкоцитов через 1 день после окончания лечения может свидетельствовать о том, что лейкоциты все еще были иммобилизованы в области опухоли.
Примерно за 2 недели до первого внутрипузырного введения катумаксомаба ситуацию в мочевом пузыре оценивали с помощью эндоскопической визуализации связанных с опухолью повреждений. Результаты представлены на фиг. 3А-Е. Стрелкой на фиг. 3Е обозначена растущая папиллярная структура, типичная для поверхностного рака мочевого пузыря.
Через 2 недели после последнего внутрипузырного введения катумаксомаба ситуацию в мочевом пузыре пациентки 1 вновь оценивали с помощью эндоскопической визуализации. Результаты представлены на фиг. 4А-Е. Как продемонстрировано на фиг. 4, по данным эндоскопической визуализации мочевого пузыря пациентки 1 через 2 недели после последнего введения катумаксомаба слизистая оболочка вновь оказалась полностью здоровой в той же области, которую анализировали ранее (ср. фиг. 3). Это свидетельствует о том, что неопластические состояния были излечены с помощью мультиспецифического антитела.
Пример 4: Применение для необременительного (сострадательного) лечения 72-летнего пациента с раком мочевого пузыря
72-летнего пациента («пациент 2») с раком мочевого пузыря после резекции лечили с использованием 6 доз антитела катумаксомаба, которое вводили внутрипузырно в соответствии со схемой лечения, обобщенной ниже в таблице 4. Каждую дозу антитела вводили в пустой мочевой пузырь с помощью катетера в 40 мл раствора ЗФР (рН 7,4) и выдерживали в течение по меньшей мере 2 ч до опорожнения, давая антителу связываться.

Примерно через 6 месяцев у пациента обнаружен рецидив (обнаружение атипических клеток с помощью теста Urovysion, фирма Abbott) и поэтому его подвергли второму циклу лечения, включающему введение еженедельно доз катумаксомаба в течение 7 недель, как указано в таблице 5. Каждую дозу антитела вводили в пустой мочевой пузырь с помощью катетера в 40 мл раствора ЗФР (рН 7,4) и выдерживали в течение по меньшей мере 2 ч до опорожнения, давая антителу связываться.

Уровни цитокинов в образцах плазмы анализировали с помощью системы Luminex 200 (фирма Luminex, шт. Техас, США) в сочетании с предварительно смешанным 8-плексным набором флуорокинов Х-Мар (фирма R&D Systems, шт. Миннесота, США), содержащим цитокины IL-2, IL-4, IL-6, IL-8, IL-10, IL-17, IFN-γ и TNF-α. Образцы собирали в указанные моменты времени, хранили при -20°С и оценивали в виде партии. Образцы, собранные в дни обработок, получали перед инстилляцией антитела. Предел обнаружения цитокинов составлял 3,2 пг/мл (catu обозначает катумаксомаб). Системные концентрации катумаксомаба измеряли с помощью известного метода ELISA (Ruf и др., Pharmacokinetics, immunogenicity and bioactivity of the therapeutic antibody catumaxomab intraperitoneally administered to cancer patients. Br J Clin Pharmacol. 69(6), 2010, cc. 617-625). Количественный предел обнаружения метода ELISA составлял 125 пг/мл. НАМА (человеческие антимышиные антитела) количественно определяли с помощью набора для ELISA фирма Medac (фирма Medac, Гамбург, Германия) согласно инструкциям производителя. В отрицательных контролях уровни составляли менее 40 нг/мл.
Результаты представлены в таблицах 6А и 6Б (первый цикл лечения) и в таблицах 7А и 7Б (второй цикл лечения).


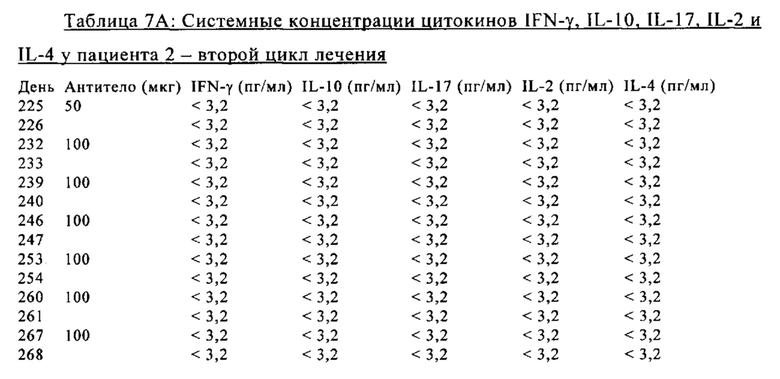
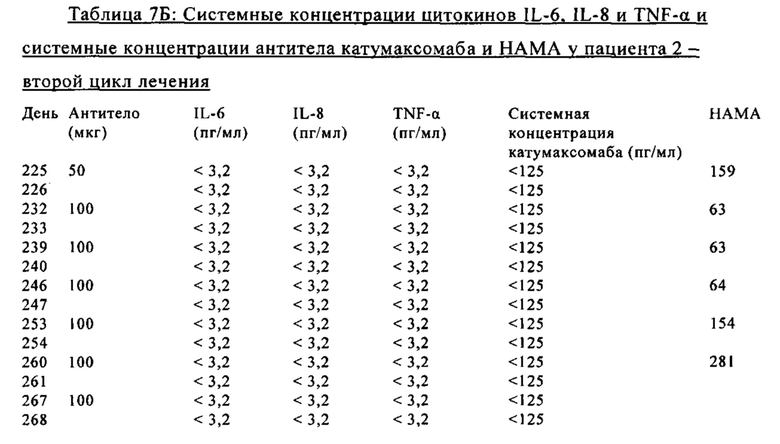
Согласно собственным ощущениям пациентки и физикальным обследованиям лечащего врача лечение антителом очень хорошо переносилось без видимых признаков каких-либо негативных побочных действий. Прежде всего, отсутствовали данные о лихорадке или гриппоподобных симптомах. Таким образом, не обнаружено существенного системного высвобождения цитокинов в обоих циклах лечения (таблицы 6А/6Б и 7А/7Б). Только после третьей инстилляции с использованием 100 мкг катумаксомаба в первом цикле лечения в середине курса лечения были выявлены небольшие уровни IL-6 в плазме, составляющие 16 и 13 пг/мл (таблица 6Б). В процессе дальнейшего лечения уровни IL-6 возвращались к уровням ниже предела обнаружения, составляющего 3,2 пг/мл. Низкие количества IL-8 и TNF-α были установлены уже до начала лечения, но не было выявлено никакой связанной с лечением индукции этих цитокинов. Наоборот, в процессе лечения уровни указанных цитокинов снижались до уровня ниже предела обнаружения. Этот результат позволяет предположить, что хроническое воспаление, которое часто обнаруживается в окружении опухолей, могло снижаться в процессе терапии. Важно отметить, что уровни IL-8 и TNF-α и всех других оцениваемых цитокинов оставались на уровне ниже предела обнаружения в течение всего второго цикла лечения (таблицы 7А/7Б).
Кроме того, очень низкие системные концентрации антитела катумаксомаба в пг/мл-диапазоне были обнаружены в крови пациента только после второй и после пятой обработки в первом цикле лечения. Все остальные измеренные концентрации находились ниже предела количественного обнаружения, составляющего 125 пг/мл (таблицы 6А/6Б и 7А/7Б). Это свидетельствует о том, что местная обработка антителом мочевого пузыря не приводила к существенному системному высвобождению лекарственного средства. В соответствии с указанным результатом не происходила индукция человеческих антимышиных антител (НАМА). Пациент имел пограничный уровень НАМА 40 нг/мл (уровни ниже 40 нг/мл считаются отрицательными) уже до начала лечения. В процессе лечения уровни НАМА сначала несколько возрастали, но затем вновь снижались почти до начальных значений (первый цикл лечения, таблица 6Б). Важно отметить, что даже во время второго цикла лечения уровни НАМА лишь незначительно возрастали, достигая 281 нг/мл. Этот процесс не представлял собой типичную индуцированную катумаксомабом НАМА-реакцию. В проведенных ранее исследованиях, в которых осуществляли внутрибрюшинное введение катумаксомаба, концентрации НАМА достигали вплоть до 104-105 нг/мл (Ruf и др., Pharmacokinetics, immunogenicity and bioactivity of the therapeutic antibody catumaxomab intraperitoneally administered to cancer patients. Br J Clin Pharmacol. 69(6), 2010, cc. 617-625). Таким образом, катумаксомаб, прежде всего при его внутрипузырном введении, вызывал лишь слабую иммуногенность, описанную в примере.
Образцы мочи пациента анализировали в отношении опухолевых ЕрСАМ+-клеток до и после лечения. Опухолевые ЕрСАМ+-клетки выявляли с помощью разработанного и описанного иммуногистохимического протокола ( и др., Immunomonitoring Results of a Phase II/III Study of Malignant Ascites Patients Treated with the Trifunctional Antibody Catumaxomab (Anti-EpCAM x anti-CD3). Cancer Res. 72(1), 2012, cc. 24-32), который модифицировали для анализа образцов мочи. В целом, метод состоял в следующем: клетки в 30 мл мочи центрифугировали с использованием цитоцентрифуг Cytospin. Срезы подвергали двойному окрашиванию для выявления ЕрСАМ и цитокератина. Окрашивание ЕрСАМ осуществляли с использованием ЕрСАМ-специфического антитела НО-3 (Ruf и др., Characterisation of the new EpCAM-specific antibody HO-3: implications for trifunctional antibody immunotherapy of cancer. Br J Cancer 97 (3), 2007, cc. 315-321), непосредственного меченного красителем Alexa Fluor 594 Texas Red. Для окрашивания цитокератина использовали антитела к цитокератину 8, 18, 19 А45 В-В3 (фирма Micromet) в сочетании с соответствующим меченным Alexa Fluor 488 вторичным идентифицирующим антителом в виде антимышиного IgG1 (фирма Molecular Probes). Все результаты, полученные с помощью цитоцентрифуг, анализировали с использованием компьютерной системы анализа изображений (MDS, фирма Applied Imaging), подсчитывая дважды окрашенные клетки.
и др., Immunomonitoring Results of a Phase II/III Study of Malignant Ascites Patients Treated with the Trifunctional Antibody Catumaxomab (Anti-EpCAM x anti-CD3). Cancer Res. 72(1), 2012, cc. 24-32), который модифицировали для анализа образцов мочи. В целом, метод состоял в следующем: клетки в 30 мл мочи центрифугировали с использованием цитоцентрифуг Cytospin. Срезы подвергали двойному окрашиванию для выявления ЕрСАМ и цитокератина. Окрашивание ЕрСАМ осуществляли с использованием ЕрСАМ-специфического антитела НО-3 (Ruf и др., Characterisation of the new EpCAM-specific antibody HO-3: implications for trifunctional antibody immunotherapy of cancer. Br J Cancer 97 (3), 2007, cc. 315-321), непосредственного меченного красителем Alexa Fluor 594 Texas Red. Для окрашивания цитокератина использовали антитела к цитокератину 8, 18, 19 А45 В-В3 (фирма Micromet) в сочетании с соответствующим меченным Alexa Fluor 488 вторичным идентифицирующим антителом в виде антимышиного IgG1 (фирма Molecular Probes). Все результаты, полученные с помощью цитоцентрифуг, анализировали с использованием компьютерной системы анализа изображений (MDS, фирма Applied Imaging), подсчитывая дважды окрашенные клетки.
Результаты, полученные в процессе второго цикла лечения, представлены ниже в таблице 8. Результаты, полученные в последующие дни 319 (21 января 2016 г.) и 463 (15 июня 2016 г.) представлены ниже в таблице 9.


Эти результаты демонстрируют клиническую эффективность катумаксомаба. Цитологический анализ мочи пациента до начала лечения был позитивным. Некоторые уротелиальные клетки представляли собой клетки с увеличенными ядрами, имеющие повышенное содержание хроматина, и с измененным в сторону ядер соотношением ядра-плазма. На исходном уровне обнаружены единичные лимфоциты и нейтрофильные гранулоциты.
Через 10 дней после начала лечения катумаксомабом при цитологическом анализе мочи были выявлены различные клетки, не имеющие аномального фенотипа, включая несколько лимфоцитов и очень небольшое количество нейтрофильных гранулоцитов. Не обнаружено никаких атипичных клеток.
Однако примерно через 6 месяцев у пациента произошел рецидив, о чем свидетельствовал позитивный результат UroVysion FISH-теста. Поэтому пациента подвергли второму циклу лечения катумаксомабом. Количество опухолевых ЕрСАМ+-клеток постепенно снижалось в течение второго цикла лечения с 111 до 4 ЕрСАМ-позитивных опухолевых клеток, что продемонстрировано в таблице 8. Эти результаты свидетельствуют об опосредуемом катумаксомабом противоопухолевом ответе in vivo. Важно отметить, что в образцах, полученных в день 261 и 268, присутствовали только клетки с нарушенной морфологией и клеточный дебрис.
Наиболее важным является то, что в полученных в последующем в дни 319 и 463 образцах не обнаружено ЕрСАМ-позитивных опухолевых клеток.
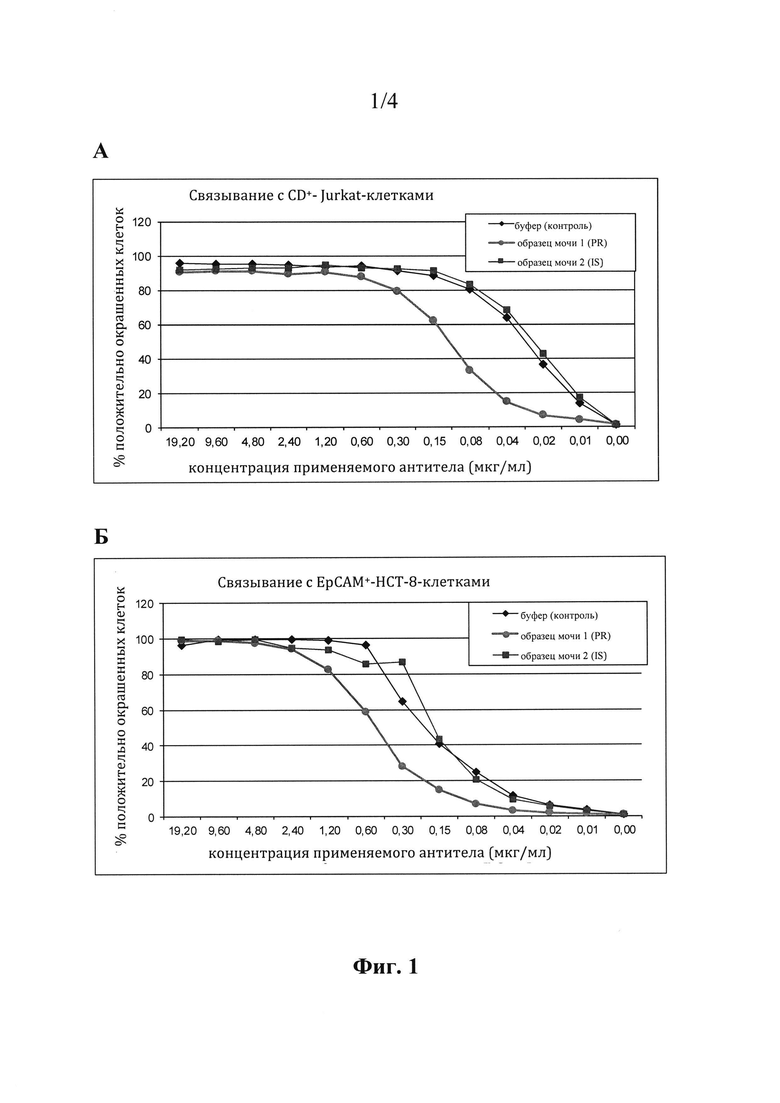
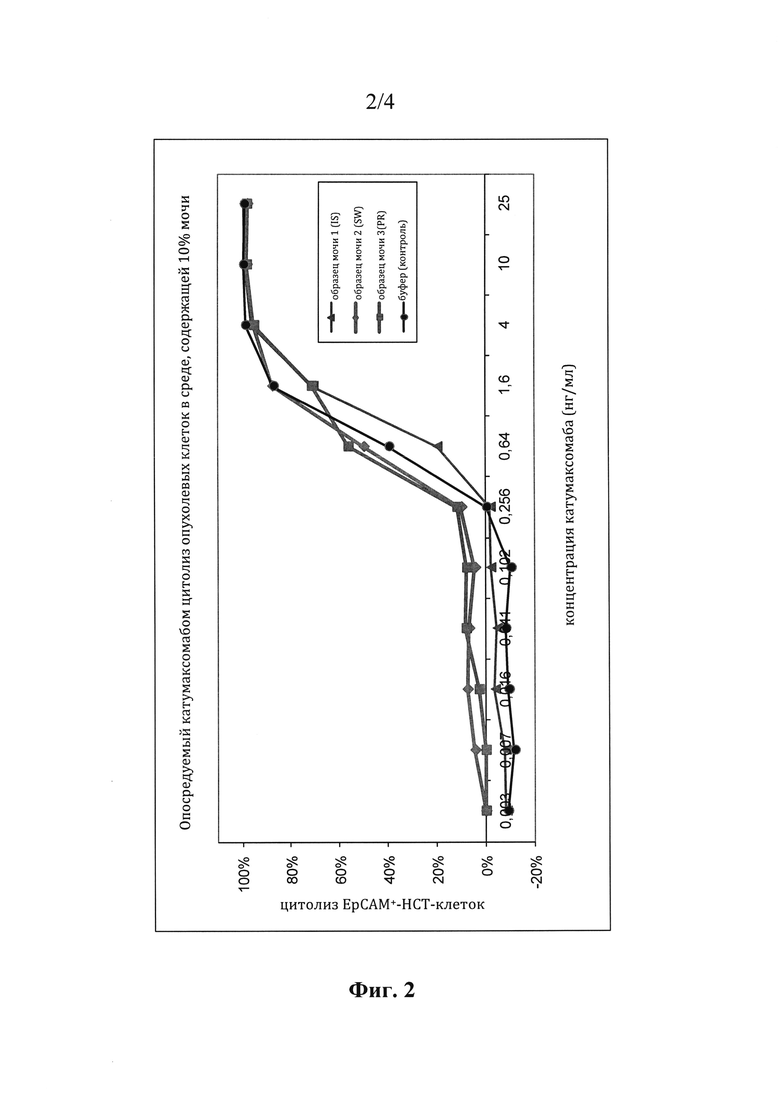
Изобретение относится к области биотехнологии, в частности к применению мультиспецифического антитела или его антигенсвязывающего фрагмента, характеризующегося (I) специфичностью в отношении CD3 и (II) специфичностью в отношении ракового и/или опухолевого антигена, который ассоциирован с неоплазмой уротелиальных клеток, а также к применению содержащей его композиции и набору для лечения неоплазмы мочевого пузыря. Изобретение эффективно для лечения неоплазмы мочевых путей, улучшает выживаемость пациентов, страдающих неоплазмой мочевых путей и имеет более низкий риск побочных действий. 4 н. и 121 з.п. ф-лы, 4 ил., 9 табл., 4 пр.
1. Применение мультиспецифического антитела или его антигенсвязывающего фрагмента, характеризующегося
(I) специфичностью в отношении CD3 и
(II) специфичностью в отношении ракового и/или опухолевого антигена, который ассоциирован с неоплазмой уротелиальных клеток,
для лечения неоплазмы мочевого пузыря, где антитело или его антигенсвязывающий фрагмент вводят внутрипузырно.
2. Применение по п. 1, где неоплазма уротелиальных клеток представляет собой карциному уротелиальных клеток.
3. Применение по п. 1 или 2, где неоплазма мочевого пузыря представляет собой карциному in situ мочевого пузыря или злокачественную неоплазму мочевого пузыря.
4. Применение по п. 1, где неоплазму мочевого пузыря выбирают из группы, состоящей из (I) карциномы in situ мочевого пузыря; (II) не инвазирующего в мышечный слой уротелиального рака, локализованного в треугольнике мочевого пузыря, куполе мочевого пузыря, боковой стенке мочевого пузыря, передней стенке мочевого пузыря, задней стенке мочевого пузыря, шейке мочевого пузыря, устье мочеточника и/или в мочевом протоке; и (III) инвазирующего в мышечный слой уротелиального рака, локализованного в треугольнике мочевого пузыря, куполе мочевого пузыря, боковой стенке мочевого пузыря, передней стенке мочевого пузыря, задней стенке мочевого пузыря, шейке мочевого пузыря, устье мочеточника и/или в мочевом протоке.
5. Применение по п. 1, где неоплазму мочевого пузыря выбирают из переходно-клеточной карциномы, плоскоклеточной карциномы, аденокарциномы, саркомы, мелкоклеточной карциномы и вторичного отложения рака в другой области организма, предпочтительно неоплазма мочевого пузыря представляет собой переходно-клеточную карциному.
6. Применение по любому из пп. 1-5, где антитело представляет собой моноклональное антитело или его антигенсвязывающий фрагмент.
7. Применение по п. 1, где ассоциированный с раком и/или опухолью антиген выбирают из группы, состоящей из ЕрСАМ, HER2/neu, СЕА, GD2 и PD-L1.
8. Применение по п. 1, где ассоциированный с раком и/или опухолью антиген представляет собой ЕрСАМ.
9. Применение по п. 7, где антитело или его антигенсвязывающий фрагмент содержит первую специфичность в отношении CD3 и вторую специфичность в отношении ассоциированного с раком и/или опухолью антигена, выбранного из группы, которая состоит из ЕрСАМ, HER2/neu, СЕА и GD2.
10. Применение по п. 9, где антитело или его антигенсвязывающий фрагмент содержит две специфичности, выбранные из анти-ЕрСАМ × анти-СD3, анти-HER2/neu × анти-СD3 и анти-GD2 × анти-СD3.
11. Применение по любому из пп. 1-10, где антитело или его антигенсвязывающий фрагмент представляет собой биспецифическое антитело или его биспецифический антигенсвязывающий фрагмент.
12. Применение по любому из пп. 1-11, где антитело или его антигенсвязывающий фрагмент представляет собой трехфункциональное антитело или его трехфункциональный антигенсвязывающий фрагмент.
13. Применение по любому из пп. 1-12, где антитело или его антигенсвязывающий фрагмент не содержит сайт связывания Fc-рецептора, в частности, антитело или его антигенсвязывающий фрагмент не содержит Fc-фрагмент.
14. Применение по любому из пп. 1-12, где антитело или его антигенсвязывающий фрагмент содержит сайт связывания Fc-рецептора.
15. Применение по п. 14, где антитело или его антигенсвязывающий фрагмент содержит Fc-фрагмент.
16. Применение по любому из пп. 1-12 и 14, 15, где антитело имеет IgG-подобный формат.
17. Применение по любому из пп. 1-11, где антитело или его антигенсвязывающий фрагмент выбирают из группы, которая состоит из катумаксомаба, эртумаксомаба, эктомаба и солитомаба, предпочтительно антитело представляет собой катумаксомаб.
18. Применение по любому из пп. 1-17, где антитело или его антигенсвязывающий фрагмент применяют в одном или нескольких циклах лечения.
19. Применение по п. 18, где один цикл лечения включает (I) одну единичную дозу или (II) одну начальную дозу и одну или несколько последующих доз.
20. Применение по п. 19, где один цикл лечения включает одну начальную дозу и одну или несколько последующих доз и где одна начальная доза и одна или несколько последующих доз являются одинаковыми или где одна или несколько последующих доз является(ются) более высокой(ими), чем начальная доза.
21. Применение по любому из пп. 1-20, где антитело или его антигенсвязывающий фрагмент вводят в дозе, составляющей от 0,1 до 5000 мкг, предпочтительно от 1 до 1000 мкг или от 5 до 500 мкг, более предпочтительно от 10 до 300 мкг, наиболее предпочтительно от 20 до 100 мкг.
22. Применение по любому из пп. 19-21, где начальная доза антитела или его антигенсвязывающего фрагмента составляет от 0,5 до 500 мкг, предпочтительно от 1 до 200 мкг, более предпочтительно от 5 до 100 мкг, наиболее предпочтительно от 10 до 70 мкг.
23. Применение по любому из пп. 19-22, где первая из последующих доз превышает по вводимому количеству начальную дозу, предпочтительно в 1,1-10,0 раз, более предпочтительно в 1,2-5,0 раз, и необязательно вторая и каждая последующая доза превышает по вводимому количеству начальную дозу, предпочтительно в 1,1-10,0 раз, предпочтительно в 1,5-5,0 раз.
24. Применение по любому из пп. 19-23, где в одном цикле лечения каждую последующую дозу вводят через 1-31 день после предшествующей дозы, предпочтительно через 1-21 день после предшествующей дозы, более предпочтительно через 5-10 дней после предшествующей дозы и еще более предпочтительно через 7 дней после предшествующей дозы.
25. Применение по любому из пп. 1-24, где антитело или его антигенсвязывающий фрагмент применяют в виде индивидуальной терапии.
26. Применение по любому из пп. 1-24, где антитело или его антигенсвязывающий фрагмент применяют в комбинации с аутологичными иммунными эффекторными клетками, предпочтительно в комбинации с мононуклеарными клетками периферической крови (РВМС).
27. Применение по любому из пп. 1-24 и 26, где антитело или его антигенсвязывающий фрагмент применяют в комбинации с противораковым лекарственным средством.
28. Применение по п. 27, где указанное противораковое лекарственное средство представляет собой цитотоксический агент или противораковое антитело.
29. Применение по п. 28, где цитотоксический агент выбирают из группы, состоящей из митомицина, валрубицина, доцетаксела, тиотепы, цисплатина и гемцитабина.
30. Применение по п. 28 или 29, где противораковое антитело представляет собой моноклональное моноспецифическое противораковое антитело, предпочтительно выбранное из группы, состоящей из трастузумаба, алемтузумаба, атезолизумаба, авелумаба, бевацизумаба, брентуксимаба ведотина, цетуксимаба, гемтузумаба озогамицина, ибритумомаба, тиуксетана, ипилимумаба, нимотузумаба, ниволумаба, офатумумаба, панитумумаба, пембролизумаба, ритуксимаба и тозитумомаба.
31. Применение по любому из пп. 27-30, где антитело или его антигенсвязывающий фрагмент применяют в комбинации с противораковым лекарственным средством, но не в комбинации с иммунными эффекторными клетками.
32. Применение по любому из пп. 27-31, где антитело или его антигенсвязывающий фрагмент вводят до введения противоракового лекарственного средства или после введения противоракового лекарственного средства.
33. Применение по любому из пп. 27-32, где антитело или его антигенсвязывающий фрагмент и противораковое лекарственное средство (I) входят в одну композицию или (II) их вводят по отдельности.
34. Применение фармацевтической композиции, содержащей мультиспецифическое антитело или его антигенсвязывающий фрагмент, характеризующиеся
(I) специфичностью в отношении CD3 и
(II) специфичностью в отношении ракового и/или опухолевого антигена, который ассоциирован с неоплазмой уротелиальных клеток для лечения неоплазмы мочевого пузыря, при котором антитело или его антигенсвязывающий фрагмент вводят внутрипузырно.
35. Применение по п. 34, где неоплазма уротелиальных клеток представляет собой карциному из уротелиальных клеток.
36. Применение по п. 34 или 35, где неоплазма мочевого пузыря представляет собой карциному in situ мочевого пузыря или злокачественную неоплазму мочевого пузыря.
37. Применение по п. 34, где неоплазму мочевого пузыря выбирают из группы, состоящей из (I) карциномы in situ мочевого пузыря; (II) не инвазирующего в мышечный слой уротелиального рака, локализованного в треугольнике мочевого пузыря, куполе мочевого пузыря, боковой стенке мочевого пузыря, передней стенке мочевого пузыря, задней стенке мочевого пузыря, шейке мочевого пузыря, устье мочеточника и/или в мочевом протоке; и (III) инвазирующего в мышечный слой уротелиального рака, локализованного в треугольнике мочевого пузыря, куполе мочевого пузыря, боковой стенке мочевого пузыря, передней стенке мочевого пузыря, задней стенке мочевого пузыря, шейке мочевого пузыря, устье мочеточника и/или в мочевом протоке.
38. Применение по п. 34, где неоплазму мочевого пузыря выбирают из переходно-клеточной карциномы, плоскоклеточной карциномы, аденокарциномы, саркомы, мелкоклеточной карциномы и вторичного отложения рака в другой области организма, предпочтительно неоплазма мочевого пузыря представляет собой переходно-клеточную карциному.
39. Применение по любому из пп. 34-38, где антитело представляет собой моноклональное антитело или его антигенсвязывающий фрагмент.
40. Применение по п. 34, где ассоциированный с раком и/или опухолью антиген выбирают из группы, состоящей из ЕрСАМ, HER2/neu, СЕА, GD2 и PD-L1.
41. Применение п. 34, где ассоциированный с раком и/или опухолью антиген представляет собой ЕрСАМ.
42. Применение по п. 40, где антитело или его антигенсвязывающий фрагмент содержит первую специфичность в отношении CD3 и вторую специфичность в отношении ассоциированного с раком и/или опухолью антигена, выбранного из группы, которая состоит из ЕрСАМ, HER2/neu, СЕА и GD2.
43. Применение по п. 42, где антитело или его антигенсвязывающий фрагмент содержит две специфичности, выбранные из анти-ЕрСАМ × анти-СD3, анти-HER2/neu × анти-СD3 и анти-GD2 × анти-СD3.
44. Применение по любому из пп. 34-43, где антитело или его антигенсвязывающий фрагмент представляет собой биспецифическое антитело или его биспецифический антигенсвязывающий фрагмент.
45. Применение по любому из пп. 34-44, где антитело или его антигенсвязывающий фрагмент представляет собой трехфункциональное антитело или его трехфункциональный антигенсвязывающий фрагмент.
46. Применение по любому из пп. 34-45, где антитело или его антигенсвязывающий фрагмент не содержит сайт связывания Fc-рецептора, в частности антитело или его антигенсвязывающий фрагмент не содержит Fc-фрагмент.
47. Применение по любому из пп. 34-45, где антитело или его антигенсвязывающий фрагмент содержит сайт связывания Fc-рецептора.
48. Применение по п. 47, где антитело или его антигенсвязывающий фрагмент содержит Fc-фрагмент.
49. Применение по любому из пп. 34-45 и 47, 48, где антитело имеет IgG-подобный формат.
50. Применение по любому из пп. 34-44, где антитело или его антигенсвязывающий фрагмент выбирают из группы, которая состоит из катумаксомаба, лимфомуна, эртумаксомаба, эктомаба и солитомаба, предпочтительно антитело представляет собой катумаксомаб.
51. Применение по п. 34, где фармацевтическая композиция содержит фармацевтически приемлемый носитель или наполнитель.
52. Применение по п. 51, где фармацевтическая композиция содержит буфер, предпочтительно буфер на основе органической кислоты, такой как цитратный буфер, сукцинатный буфер и тартратный буфер.
53. Применение по любому из пп. 34 и 51, 52, где фармацевтическая композиция дополнительно содержит противораковое лекарственное средство.
54. Применение по п. 53, где указанное противораковое лекарственное средство представляет собой цитотоксический агент или противораковое антитело.
55. Применение по п. 54, где цитотоксический агент выбирают из группы, состоящей из митомицина, валрубицина, доцетаксела, тиотепы, цисплатина и гемцитабина.
56. Применение по п. 54 или 55, где противораковое антитело представляет собой моноклональное моноспецифическое противораковое антитело, предпочтительно выбранное из группы, состоящей из трастузумаба, алемтузумаба, атезолизумаба, авелумаба, бевацизумаба, брентуксимаба ведотина, цетуксимаба, гемтузумаба озогамицина, ибритумомаба, тиуксетана, ипилимумаба, нимотузумаба, ниволумаба, офатумумаба, панитумумаба, пембролизумаба, ритуксимаба и тозитумомаба.
57. Применение по любому из пп. 34-56, где фармацевтическая композиция находится в форме лиофилизированного порошка или в форме жидкой композиции, предпочтительно водного раствора.
58. Применение по любому из пп. 34-57, где значение рН фармацевтической композиции составляет от 6,5 до 8,2, предпочтительно от 7,0 до 7,8, более предпочтительно от 7,2 до 7,6, наиболее предпочтительно оно составляет 7,4.
59. Применение набора, содержащего
мультиспецифическое антитело или его антигенсвязывающий фрагмент, характеризующиеся
(I) специфичностью в отношении CD3 и
(II) специфичностью в отношении ракового и/или опухолевого антигена, который ассоциирован с неоплазмой уротелиальных клеток;
или фармацевтическую композицию, содержащую мультиспецифическое антитело или его антигенсвязывающий фрагмент, характеризующиеся
(I) специфичностью в отношении CD3 и
(II) специфичностью в отношении ракового и/или опухолевого антигена, который ассоциирован с неоплазмой уротелиальных клеток;
листовку-вкладыш в упаковке или этикетку,
для предупреждения или лечения неоплазмы мочевого пузыря путем внутрипузырного введения.
60. Применение по п. 59, где неоплазма уротелиальных клеток представляет собой карциному из уротелиальных клеток.
61. Применение по п. 59 или 60, где неоплазма мочевого пузыря представляет собой карциному in situ мочевого пузыря или злокачественную неоплазму мочевого пузыря.
62. Применение по п. 59, где неоплазму мочевого пузыря выбирают из группы, состоящей из (I) карциномы in situ мочевого пузыря; (II) не инвазирующего в мышечный слой уротелиального рака, локализованного в треугольнике мочевого пузыря, куполе мочевого пузыря, боковой стенке мочевого пузыря, передней стенке мочевого пузыря, задней стенке мочевого пузыря, шейке мочевого пузыря, устье мочеточника и/или в мочевом протоке; и (III) инвазирующего в мышечный слой уротелиального рака, локализованного в треугольнике мочевого пузыря, куполе мочевого пузыря, боковой стенке мочевого пузыря, передней стенке мочевого пузыря, задней стенке мочевого пузыря, шейке мочевого пузыря, устье мочеточника и/или в мочевом протоке.
63. Применение по п. 59, где неоплазму мочевого пузыря выбирают из переходно-клеточной карциномы, плоскоклеточной карциномы, аденокарциномы, саркомы, мелкоклеточной карциномы и вторичного отложения рака в другой области организма, предпочтительно неоплазма мочевого пузыря представляет собой переходно-клеточную карциному.
64. Применение по любому из пп. 59-63, где антитело представляет собой моноклональное антитело или его антигенсвязывающий фрагмент.
65. Применение по п. 59, где ассоциированный с раком и/или опухолью антиген выбирают из группы, состоящей из ЕрСАМ, HER2/neu, СЕА, GD2 и PD-L1.
66. Применение п. 59, где ассоциированный с раком и/или опухолью антиген представляет собой ЕрСАМ.
67. Применение по п. 65, где антитело или его антигенсвязывающий фрагмент содержит первую специфичность в отношении CD3 и вторую специфичность в отношении ассоциированного с раком и/или опухолью антигена, выбранного из группы, которая состоит из ЕрСАМ, HER2/neu, СЕА и GD2.
68. Применение по п. 67, где антитело или его антигенсвязывающий фрагмент содержит две специфичности, выбранные из анти-ЕрСАМ × xанти-СD3, анти-HER2/neu × анти-СD3 и анти-GD2 × анти-СD3.
69. Применение по любому из пп. 59-68, где антитело или его антигенсвязывающий фрагмент представляет собой биспецифическое антитело или его биспецифический антигенсвязывающий фрагмент.
70. Применение по любому из пп. 59-69, где антитело или его антигенсвязывающий фрагмент представляет собой трехфункциональное антитело или его трехфункциональный антигенсвязывающий фрагмент.
71. Применение по любому из пп. 59-70, где антитело или его антигенсвязывающий фрагмент не содержит сайт связывания Fc-рецептора, в частности, антитело или его антигенсвязывающий фрагмент не содержит Fc-фрагмент.
72. Применение по любому из пп. 59-70, где антитело или его антигенсвязывающий фрагмент содержит сайт связывания Fc-рецептора.
73. Применение по п. 72, где антитело или его антигенсвязывающий фрагмент содержит Fc-фрагмент.
74. Применение по любому из пп. 59-70 и 72, 73, где антитело имеет IgG-подобный формат.
75. Применение по любому из пп. 59-69, где антитело или его антигенсвязывающий фрагмент выбирают из группы, которая состоит из катумаксомаба, эртумаксомаба, эктомаба и солитомаба, предпочтительно антитело представляет собой катумаксомаб.
76. Применение по п. 59, где набор содержит фармацевтическую композицию с фармацевтически приемлемым носителем или наполнителем.
77. Применение по п. 76, где фармацевтическая композиция содержит буфер, предпочтительно буфер на основе органической кислоты, такой как цитратный буфер, сукцинатный буфер и тартратный буфер.
78. Применение по любому из пп. 59-77, где фармацевтическая композиция дополнительно содержит противораковое лекарственное средство.
79. Применение по п. 78, где указанное противораковое лекарственное средство представляет собой цитотоксический агент или противораковое антитело.
80. Применение по п. 79, где цитотоксический агент выбирают из группы, состоящей из митомицина, валрубицина, доцетаксела, тиотепы, цисплатина и гемцитабина.
81. Применение по п. 79 или 80, где противораковое антитело представляет собой моноклональное моноспецифическое противораковое антитело, предпочтительно выбранное из группы, состоящей из трастузумаба, алемтузумаба, атезолизумаба, авелумаба, бевацизумаба, брентуксимаба ведотина, цетуксимаба, гемтузумаба озогамицина, ибритумомаба, тиуксетана, ипилимумаба, нимотузумаба, ниволумаба, офатумумаба, панитумумаба, пембролизумаба, ритуксимаба и тозитумомаба.
82. Применение по любому из пп. 59-81, где фармацевтическая композиция находится в форме лиофилизированного порошка или в форме жидкой композиции, предпочтительно водного раствора.
83. Применение по любому из пп. 59-82, где значение рН фармацевтической композиции составляет от 6,5 до 8,2, предпочтительно от 7,0 до 7,8, более предпочтительно от 7,2 до 7,6, наиболее предпочтительно оно составляет 7,4.
84. Способ предупреждения или лечения субъекта, страдающего неоплазмой мочевого пузыря, путем введения мультиспецифического антитела или его антигенсвязывающего фрагмента, характеризующегося
(I) специфичностью в отношении CD3 и
(II) специфичностью в отношении ракового и/или опухолевого антигена, который ассоциирован с неоплазмой уротелиальных клеток,
при котором антитело или его антигенсвязывающий фрагмент вводят внутрипузырно.
85. Способ по п. 84, в котором неоплазма уротелиальных клеток представляет собой карциному из уротелиальных клеток.
86. Способ по п. 84 или 85, в котором неоплазма мочевого пузыря представляет собой карциному in situ мочевого пузыря или злокачественную неоплазму мочевого пузыря.
87. Способ по п. 84, в котором неоплазму мочевого пузыря выбирают из группы, состоящей из (I) карциномы in situ мочевого пузыря; (II) не инвазирующего в мышечный слой уротелиального рака, локализованного в треугольнике мочевого пузыря, куполе мочевого пузыря, боковой стенке мочевого пузыря, передней стенке мочевого пузыря, задней стенке мочевого пузыря, шейке мочевого пузыря, устье мочеточника и/или в мочевом протоке; и (III) инвазирующего в мышечный слой уротелиального рака, локализованного в треугольнике мочевого пузыря, куполе мочевого пузыря, боковой стенке мочевого пузыря, передней стенке мочевого пузыря, задней стенке мочевого пузыря, шейке мочевого пузыря, устье мочеточника и/или в мочевом протоке.
88. Способ по п. 84, в котором неоплазму мочевого пузыря выбирают из переходноклеточной карциномы, плоскоклеточной карциномы, аденокарциномы, саркомы, мелкоклеточной карциномы и вторичного отложения рака в другой области организма, предпочтительно неоплазма мочевого пузыря представляет собой переходно-клеточную карциному.
89. Способ по любому из пп. 84-88, в котором антитело представляет собой моноклональное антитело или его антигенсвязывающий фрагмент.
90. Способ по п. 84, в котором ассоциированный с раком и/или опухолью антиген выбирают из группы, состоящей из ЕрСАМ, HER2/neu, СЕА и PD-L1.
91. Способ по п. 84, в котором ассоциированный с раком и/или опухолью антиген представляет собой ЕрСАМ.
92. Способ по п. 90, где антитело или его антигенсвязывающий фрагмент содержит первую специфичность в отношении CD3 и вторую специфичность в отношении ассоциированного с раком и/или опухолью антигена, выбранного из группы, которая состоит из ЕрСАМ, HER2/neu, СЕА и GD2.
93. Способ по п. 92, где антитело или его антигенсвязывающий фрагмент содержит две специфичности, выбранные из анти-ЕрСАМ × анти-СD3, анти-HER2/neu × анти-СD3 и анти-GD2 × анти-СD3.
94. Способ по любому из пп. 84-93, где антитело или его антигенсвязывающий фрагмент представляет собой биспецифическое антитело или его биспецифический антигенсвязывающий фрагмент.
95. Способ по любому из пп. 84-93, где антитело или его антигенсвязывающий фрагмент представляет собой трехфункциональное антитело или его трехфункциональный антигенсвязывающий фрагмент.
96. Способ по любому из пп. 84-95, где антитело или его антигенсвязывающий фрагмент не содержит сайт связывания Fc-рецептора, в частности антитело или его антигенсвязывающий фрагмент не содержит Fc-фрагмент.
97. Способ по любому из пп. 84-95, в котором антитело или его антигенсвязывающий фрагмент содержит сайт связывания Fc-рецептора.
98. Способ по п. 97, в котором антитело или его антигенсвязывающий фрагмент содержит Fc-фрагмент.
99. Способ по любому из пп. 84-95 и 97, 98, в котором антитело имеет IgG-подобный формат.
100. Способ по любому из пп. 84-94, в котором антитело или его антигенсвязывающий фрагмент выбирают из группы, которая состоит из катумаксомаба, лимфомуна, эртумаксомаба, эктомаба и солитомаба, предпочтительно антитело представляет собой катумаксомаб.
101. Способ по п. 84, в котором мультиспецифическое антитело или его антигенсвязывающий фрагмент вводят в составе фармацевтической композиции.
102. Способ по п. 101, в котором фармацевтическая композиция содержит фармацевтически приемлемый носитель или наполнитель.
103. Способ по п. 102, в котором фармацевтическая композиция содержит буфер, предпочтительно буфер на основе органической кислоты, такой как цитратный буфер, сукцинатный буфер и тартратный буфер.
104. Способ по п. 101, в котором фармацевтическая композиция дополнительно содержит противораковое лекарственное средство.
105. Способ по п. 104, в котором указанное противораковое лекарственное средство представляет собой цитотоксический агент или противораковое антитело.
106. Способ по п. 105, в котором цитотоксический агент выбирают из группы, состоящей из митомицина, валрубицина, доцетаксела, тиотепы, цисплатина и гемцитабина.
107. Способ по п. 105 или 106, в котором противораковое антитело представляет собой моноклональное моноспецифическое противораковое антитело, предпочтительно выбранное из группы, состоящей из трастузумаба, алемтузумаба, атезолизумаба, авелумаба, бевацизумаба, брентуксимаба ведотина, цетуксимаба, гемтузумаба озогамицина, ибритумомаба, тиуксетана, ипилимумаба, нимотузумаба, ниволумаба, офатумумаба, панитумумаба, пембролизумаба, ритуксимаба и тозитумомаба.
108. Способ по любому из пп. 101-107, в котором фармацевтическая композиция находится в форме лиофилизированного порошка или в форме жидкой композиции, предпочтительно водного раствора.
109. Способ по любому из пп. 101-108, в котором значение рН фармацевтической композиции составляет от 6,5 до 8,2, предпочтительно от 7,0 до 7,8, более предпочтительно от 7,2 до 7,6, наиболее предпочтительно оно составляет 7,4.
110. Способ по любому из пп. 84-109, в котором антитело или его антигенсвязывающий фрагмент применяют в одном или нескольких циклах лечения.
111. Способ по п. 110, в котором один цикл лечения включает (I) одну единичную дозу или (II) одну начальную дозу и одну или несколько последующих доз.
112. Способ по п. 111, в котором один цикл лечения включает одну начальную дозу и одну или несколько последующих доз и где одна начальная доза и одна или несколько последующих доз являются одинаковыми или где одна или несколько последующих доз является(ются) более высокой(ими), чем начальная доза.
113. Способ по любому из пп. 84-112, в котором антитело или его антигенсвязывающий фрагмент вводят в дозе, составляющей от 0,1 до 5000 мкг, предпочтительно от 1 до 1000 мкг или от 5 до 500 мкг, более предпочтительно от 10 до 300 мкг, наиболее предпочтительно от 20 до 100 мкг.
114. Способ по любому из пп. 111-113, в котором начальная доза антитела или его антигенсвязывающего фрагмента составляет от 0,5 до 500 мкг, предпочтительно от 1 до 200 мкг, более предпочтительно от 5 до 100 мкг, наиболее предпочтительно от 10 до 70 мкг.
115. Способ по любому из пп. 111-114, в котором первая из последующих доз превышает по вводимому количеству начальную дозу, предпочтительно в 1,1-10,0 раз, более предпочтительно в 1,2-5,0 раз, и необязательно вторая и каждая последующая доза превышает по вводимому количеству начальную дозу, предпочтительно в 1,1-10,0 раз, предпочтительно в 1,5-5,0 раз.
116. Способ по любому из пп. 111-115, в котором в одном цикле лечения каждую последующую дозу вводят через 1-31 день после предшествующей дозы, предпочтительно через 1-21 день после предшествующей дозы, более предпочтительно через 5-10 дней после предшествующей дозы и еще более предпочтительно через 7 дней после предшествующей дозы.
117. Способ по любому из пп. 84-116, в котором антитело или его антигенсвязывающий фрагмент применяют в виде индивидуальной терапии.
118. Способ по любому из пп. 84-116, в котором антитело или его антигенсвязывающий фрагмент применяют в комбинации с аутологичными иммунными эффекторными клетками, предпочтительно в комбинации с мононуклеарными клетками периферической крови (РВМС).
119. Способ по любому из пп. 111-116 и 118, в котором антитело или его антигенсвязывающий фрагмент применяют в комбинации с противораковым лекарственным средством.
120. Способ по п. 119, в котором указанное противораковое лекарственное средство представляет собой цитотоксический агент или противораковое антитело.
121. Способ по п. 120, в котором цитотоксический агент выбирают из группы, состоящей из митомицина, валрубицина, доцетаксела, тиотепы, цисплатина и гемцитабина.
122. Способ по п. 120 или 121, в котором противораковое антитело представляет собой моноклональное моноспецифическое противораковое антитело, предпочтительно выбранное из группы, состоящей из трастузумаба, алемтузумаба, атезолизумаба, авелумаба, бевацизумаба, брентуксимаба ведотина, цетуксимаба, гемтузумаба озогамицина, ибритумомаба, тиуксетана, ипилимумаба, нимотузумаба, ниволумаба, офатумумаба, панитумумаба, пембролизумаба, ритуксимаба и тозитумомаба.
123. Способ по любому из пп. 119-122, в котором антитело или его антигенсвязывающий фрагмент применяют в комбинации с противораковым лекарственным средством, но не в комбинации с иммунными эффекторными клетками.
124. Способ по любому из пп. 119-123, в котором антитело или его антигенсвязывающий фрагмент вводят до введения противоракового лекарственного средства или после введения противоракового лекарственного средства.
125. Способ по любому из пп. 119-124, в котором антитело или его антигенсвязывающий фрагмент и противораковое лекарственное средство (I) входят в одну композицию или (II) их вводят по отдельности.
| RM LUITEN et al., Generation of chimeric bispecific G250/anti-CD3 monoclonal antibody, a tool to combat renal cell carcinoma, British Journal of Cancer, 1996, Vol.74, pp.735-744 | |||
| ROLF LINKE et al., Catumaxomab Clinical development and future directions, mAbs, 2010, Vol.2, N.2, pp.129-136 | |||
| MARK KOWALSKI et al., A Phase II Study of Oportuzumab |
Авторы
Даты
2022-03-15—Публикация
2017-03-30—Подача