Область техники, к которой относится изобретение
Настоящее изобретение относится, вообще, к способам и композициям для повышения эффективности антител для лечебных целей. Конкретнее, изобретение относится к применению антител для лечебных целей в сочетании с соединением, которое блокирует ингибирующий рецептор или стимулирует активирующий рецептор естественных клеток-киллеров (NK-клеток), причем посредством этого создается возможность потенциирования цитотоксичности естественных клеток-киллеров у млекопитающих, для того, чтобы повысить эффективность лечения людей, в частности через усиление ADCC механизма.
Уровень техники
Различные лечебные стратегии для человеческого организма основаны на применении антител для лечебных целей (therapeutic antibodies). К ним относятся, например, применение антител для лечебных целей, разработанных для устранения клеток-мишеней, в частности пораженных клеток, таких как клетки, зараженные вирусом, опухолевые клетки или другие патогенные клетки. Такие антитела типично представляют собой моноклональные антитела, виды IgG, типично, Fc-участки человеческого IgGI или IgG3. Такие антитела могут быть нативными или рекомбинантными антителами и часто являются "гуманизированными" мышиными антителами [т.е., содержащими функциональные области различного вида, типично, Fc-участок человеческого происхождения или происходящий от примата, не являющегося человеком, и вариабельная область антител или гипервариабельная область антигенсвязывающих участков антител, определяющих их комплементарность (CDR, complementary determining region), мышиного происхождения]. С другой стороны, моноклональные антитела могут быть полностью человеческими, полученными с помощью иммунизации трансгенной мыши, имеющей локус человеческого Ig, или полученными из библиотеки кДНК из клеток человека.
Конкретным примером таких антител для лечебных целей является ритуксимаб (rituximab, Mabthera®, Rituxan®), который представляет собой химерные моноклональные антитела против CD20, полученные из человеческих γ1 и к константных областей (поэтому с Fc-участком человеческого IgGI), соединенных с мышиными вариабельными областями, придающими специфичность к CD20, В последние несколько лет ритуксимаб существенно изменил лечебную стратегию против В-лимфопролиферативных злокачественных состояний, в частности неходжкинских лимфом (NHL). Другими примерами гуманизированных IgGI антител являются алемтузумаб (alemtuzumab, кампат, Campath-1H®), который применяют при лечении В-клеточных злокачественных состояний, и трастузумаб (trastuzumab, Herceptin®), который применяют при лечении рака молочной железы. В технике раскрываются другие примеры антител, разрабатываемых для лечебных целей.
Механизм действия антител для лечебных целей пока является предметом для обсуждения. Инъекция антител ведет к исчезновению клеток, содержащих антиген, специфически узнаваемый антителом. Такое исчезновение может быть опосредовано, по меньшей мере, тремя механизмами: опосредованной антителами клеточной цитотоксичности (ADCC, antibody-dependent cellular cytotoxicity), комплемент-зависимьм лизисом клеток и прямым противоопухолевым ингибированием роста опухоли через сигналы, подаваемые антигенами, направляемые антителами.
Хотя указанные антитела представляют новый и эффективный подход к лечению людей, в частности к лечению опухолей, они не всегда проявляют устойчивую эффективность. Например, хотя показано, что ритуксимаб, один или в сочетании с химиотерапией, является эффективным при лечении NHL как низкой, средней, так и высокой степени, от 30% до 50% пациентов с NHL низкой степени не имеют клинической реакции на ритуксимаб. Предполагается, что уровень экспрессии CD20 на клетках лимфомы, наличие высокой опухолевой массы в момент лечения или низких концентраций ритуксимаба в сыворотке могут объяснить недостаточную эффективность ритуксимаба для некоторых пациентов. Тем не менее, фактические причины неудачи лечения остаются большей частью неизвестными.
Кроме того, применение антител для лечебных целей может ограничиваться побочным действием, вызываемым их введением. Например, у пациентов могут проявиться такие побочные действия как лихорадка, головная боль, тошнота, гипотензия, стерторозное (шумное) дыхание, сыпь, инфекции и ряд других побочных действий, потенциально ограничивающих возможное количество или частоту, с которой можно вводить антитела.
Таким образом, может быть весьма интересным повышение эффективности антител для лечебных целей или возможность достижения лечебной эффективности с использованием уменьшенных доз антител, которые с меньшей вероятностью вызывают побочное действие. Настоящее изобретение направлено на указанные и другие потребности.
Сущность изобретения
Настоящее изобретение раскрывает новые подходы к повышению эффективности антител для лечебных целей. Не ограничиваясь изложенной далее теорией, полагают, что неожиданные результаты, достигаемые с применением способов настоящего изобретения, имеют место вследствие способности антител для лечебных целей, когда их инъецируют, усиливать механизм ADCC in vivo. Безусловно, настоящее изобретение относится к новым композициям и способам, которые преодолевают трудности, связанные с эффективностью антител для лечебных целей. Настоящее изобретение показывает, что NK-клетки индивидуума (natural killer cells, естественные клетки-киллеры, которые проявляют цитотоксичность по отношению к клеткам собственного организма) могут иметь плохое лечебное опосредованное mAb (monoclonal antibody, моноклональными антителами) ADCC из-за недостаточной активации NK-клеток, например, путем ингибирования ингибирующих рецепторов NK-клеток. Предпочтительно усиление механизма ADCC достигается введением соединений, блокирующих ингибирующие рецепторы или стимулирующих активирующие рецепторы на естественных клетках-киллерах, причем посредством этого промотируется потенциирование цитотоксичности естественных клеток-киллеров в организме млекопитающих. Предпочтительно соединение представляет собой антитело или его фрагмент.
Указанные антитела или другие соединения могут взаимодействовать, например, с ингибирующими рецепторами NK-клеток - молекулами ингибирующего рецептора киллера (KIR, killer inhibitory receptor, или NKG2A/C) или с активирующими рецепторами NK-клеток, например NCR, такими как NKp30, NKp44 или NKp46, причем посредством этого нейтрализуется ингибирование клеток и повышается активность их ADCC.
Конкретнее, изобретение относится к лечению субъекта, при котором соединение, предпочтительно антитела или его фрагменты, блокирующее ингибирующий рецептор или стимулирующие активирующий рецептор NK-клетки, вводят субъекту совместно с антителами для лечебных целей. В данном описании демонстрируется, что эффективность антител для лечебных целей можно существенно усилить совместным введением, например, совместной инъекцией, такого соединения, предпочтительно антител или их фрагментов, которое преодолевает ингибирование NK-клеток, например, блокированием ингибирующего рецептора или стимулированием активирующего рецептора NK-клетки.
Изобретение также относится к фармацевтическим композициям, содержащим антитела для лечебных целей и соединение, предпочтительно антитела или их фрагменты, блокирующее ингибирующий рецептор или стимулирующее активирующий рецептор NK-клетки. Изобретение также относится к наборам, содержащим антитела для лечебных целей и соединение, предпочтительно антитела или их фрагменты, блокирующее ингибирующий рецептор или стимулирующее активирующий рецептор NK-клетки.
Изобретение также относится к применению соединения, предпочтительно антител или их фрагментов, блокирующего ингибирующий рецептор или стимулирующего активирующий рецептор NK-клетки, для повышения эффективности лечения антителами для лечебных целей или для усиления ADCC у субъекта, которого лечат антителами для лечебных целей.
Изобретение также относится к применению соединения, предпочтительно антител или их фрагментов, блокирующего ингибирующий рецептор или стимулирующего активирующий рецептор NK-клетки, и антител для лечебных целей для получения лекарственного средства для лечения заболевания. Конкретнее, для лечения заболевания требуется устранение клеток-мишеней, предпочтительно зараженных клеток, таких как клетки, зараженные вирусом, опухолевые клетки или другие патогенные клетки. Предпочтительно заболевание представляет собой рак, инфекции или иммунопатологию. Предпочтительнее заболевание выбирают из группы, состоящей из рака, аутоиммунного заболевания, воспалительного заболевания и вирусного заболевания. К заболеванию также относится отторжение трансплантата, в частности отторжение аллотрансплантата, и болезнь "трансплантат против хозяина" (GVHD, graft versus host disease).
Настоящее изобретение также относится к способу снижения дозировки антител для лечебных целей, например антител, которые связываются Fcy-рецептором, предпочтительно CD 16 (FcyRIIIa). Например, совместное введение антител для лечебных целей и соединения, блокирующего ингибирующий рецептор или стимулирующего активирующий рецептор NK-клетки, позволяет применять более низкую дозу антител для лечебных целей. Такие антитела можно использовать в дозе, составляющей 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% дозы, рекомендованной в отсутствие соединения, или в более низкой дозе.
Кроме того, изобретение относится к способу определения терапевтически эффективной пониженной дозы антител для лечебных целей, например антител, связываемых CD 16, включающему
i) совместную инкубацию антител для лечебных целей в первой концентрации с клетками-мишенями и NK-клетками и в отсутствие соединения, блокирующего ингибирующие рецепторы или стимулирующего активирующие рецепторы NK-клеток;
ii) совместную инкубацию антител для лечебных целей во второй, меньшей концентрации с клетками-мишенями, с NK-клетками и в присутствии соединения, блокирующего ингибирующие рецепторы или стимулирующего активирующие рецепторы NK-клеток;
iii) определение, является ли исчезновение клеток-мишеней, наблюдаемое на стадии (ii), настолько же значительным как на стадии (i).
Если наблюдают, что стадия (ii) так же эффективна, как стадия (i), тогда относительные концентрации соединения и антител для лечебных целей можно изменять и наблюдать за исчезновением клеток-мишеней для того, чтобы идентифицировать различные условия, которые могут подходить для применения к данному пациенту, например максимизацию исчезновения клеток-мишеней, пониженную дозу антител для лечебных целей или пониженную дозу соединения, в зависимости от конкретных потребностей пациента.
В частном аспекте настоящее изобретение относится к способу лечения заболевания у человека, нуждающегося в этом, включающему
a) введение указанному субъекту соединения, блокирующего ингибирующий рецептор или стимулирующего активирующий рецептор NK-клетки; и
b) введение указанному субъекту антител для лечебных целей, которые могут связываться CD 16.
В одном воплощении антитела для лечебных целей и соединение вводят субъекту одновременно. В другом воплощении соединение вводят субъекту в пределах одной недели, в пределах 4 дней, в пределах 3 дней или того же дня (например, в пределах примерно 24 часов) после введения антител для лечебных целей. В другом воплощении заболеванием является рак, инфекции или иммунопатология.
В одном воплощении способ также включает дополнительную стадию, на которой оценивают активность или число NK-клеток до или после введения соединения. В другом воплощении дополнительная стадия включает
i) получение NK-клеток от субъекта до введения;
ii) инкубацию NK-клеток в присутствии одной или нескольких клеток-мишеней, узнаваемых антителами для лечебных целей, в присутствии или в отсутствие соединения;
iii) оценку воздействия соединения на способность NK-клеток устранять клетки-мишени; где выявление того, что соединение усиливает способность NK-клеток устранять клетки-мишени, указывает на то, что соединение подходит для применения в способе, и что способ подходит для применения к субъекту.
В другом аспекте настоящее изобретение относится к фармацевтической композиции, содержащей антитела для лечебных целей, например, которые могут связываться CD 16, соединение, блокирующее ингибирующие рецепторы или стимулирующее активирующие рецепторы NK-клеток, и фармацевтически приемлемый носитель. В другом аспекте настоящее изобретение относится к набору, содержащему антитела для лечебных целей, например, которые могут связываться CD 16, и одно или несколько соединений, блокирующих ингибирующие рецепторы или стимулирующих активирующие рецепторы NK-клеток.
Для любого из вышеуказанных способов, композиций или наборов в одном воплощении антитела для лечебных целей содержат Fc-участок человеческого IgG1 или IgG3. В другом воплощении соединение представляет собой антитело или его фрагмент. В еще одном воплощении антитела для лечебных целей представляют собой моноклональные антитела или их фрагменты. В другом воплощении антитела для лечебных целей не являются конъюгированными с радиоактивной или токсичной группой. В другом воплощении соединение ингибирует ингибирующий рецептор NK-клетки. В другом воплощении соединение стимулирует активирующий рецептор NK-клетки. В другом воплощении соединение представляет собой человеческое, гуманизированное или химерное антитело или его фрагмент. В одном воплощении антитела для лечебных целей или соединения могут представлять собой фрагменты или производные антител, такие как, среди прочего, Fab фрагмент, Fab'2 фрагмент, CDR и ScFv.
В одном воплощении антитела для лечебных целей представляют собой человеческие, гуманизированные или химерные антитела или их фрагменты. В другом воплощении антитела для лечебных целей представляют собой ритуксимаб или кампат (Campath). В другом воплощении антитела представляют собой ритуксимаб, и указанные антитела вводят в дозировке менее чем 375 мг/м2 в неделю. В другом воплощении антитела представляют собой кампат, и антитела вводят в дозировке менее чем 90 мг в неделю.
В одном воплощении соединение связывается, по меньшей мере, с одним из человеческих рецепторов NKG2, KIR2DL или KIR3DL и ингибирует соответствующее, опосредованное NKG2, KIR2DL или KIR3DL, ингибирование цитотоксичности NK-клеток. В другом воплощении соединение блокирует ингибирующий рецептор NK-клетки, выбранный из группы, состоящей из KIR2DL1, KIR2DL2/3, KIR2DL4, KIR2DL5A, KIR2DL5B, KIR3DL1, KIR3DL2, KIR3DL3, LILRB1, NKG2A, NKG2C, NKG2E и LILRB5. В другом воплощении соединение связывается с общей детерминантой человеческих рецепторов KIR2DL и ингибирует опосредованное KIR2DL ингибирование цитотоксичности NK-клеток. В другом воплощении соединение связывается с общей детерминантой человеческих рецепторов KIR2DL1, KIR2DL2 и KIR2DL3 и ингибирует опосредованное KIR2DL1, KIR2DL2 и KIR2DL3 ингибирование цитотоксичности NK-клеток. В другом воплощении соединение ингибирует связывание аллельного варианта молекулы HLA-C, содержащей остаток Lys в позиции 80, с человеческим рецептором KIR2DL1, и связывание аллельного варианта молекулы HLA-C, содержащей остаток Asn в позиции 80, с человеческими рецепторами KIR2DL2 и KIR2DL3. В другом воплощении соединение связывается с тем же эпитопом, что и моноклональные антитела DF200, продуцируемые гибридомой DF200. В другом воплощении соединение конкурирует с моноклональными антителами DF200, продуцируемыми гибридомой DF200, за связывание с рецептором KIR на поверхности человеческой NK-клетки. В другом воплощении соединение представляет собой моноклональное антитело DF200, продуцируемое гибридомой DF200, или его фрагмент.
В одном воплощении соединение связывается с рецептором, выбранным из группы, состоящей из NKp30, NKp44, NKp46 и NKG2D. В другом воплощении соединение происходит от, или конкурирует с моноклональными антителами, выбранными из группы, состоящей из AZ20, А76, Z25, Z231 и ВАВ281.
В другом аспекте настоящее изобретение относится к способу отбора соединения для введения в сочетании с антителами для лечебных целей, причем указанный способ включает
i) обеспечение тестируемого соединения, ингибирующего ингибирующие рецепторы или стимулирующего активирующие рецепторы NK-клеток;
ii) инкубацию антител для лечебных целей с клетками-мишенями, специфически узнаваемыми антителами для лечебных целей, в присутствии NK-клеток и в присутствии или в отсутствие испытываемого соединения; и
iii) оценку действия соединения на способность NK-клеток устранять клетки-мишени; где обнаружение того, что соединение усиливает способность NK-клеток устранять клетки-мишени, указывает на то, что соединение подходит для применения в способе.
В одном воплощении соединение усиливает способность антител для лечебных целей разрушать клетки-мишени на 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% или более. В другом воплощении соединение выбирают из группы, состоящей из антитела, фрагмента антитела, моноклонального антитела, фрагмента моноклонального антитела, гуманизированного антитела, химерного антитела и человеческого антитела. В другом воплощении клетки-мишени представляют собой раковые клетки, клетки, зараженные вирусом, или клетки, поддерживающие аутоиммунное расстройство. В другом воплощении антителами для лечебных целей являются ритуксимаб или кампат.
В другом аспекте настоящее изобретение относится к способу повышения эффективности лечения, включающему введение субъекту антител для лечебных целей, которые могут связываться CD 16, причем указанный способ включает введение указанному субъекту до, одновременно или после введения указанных антител для лечебных целей, терапевтически эффективного количества соединения, блокирующего ингибирующий рецептор или стимулирующего активирующий рецептор NK-клетки. В одном воплощении соединение повышает эффективность лечения, усиливая ADCC у указанного субъекта.
Краткое описание фигур
Фигура 1. Моноклональные антитела DF200 связываются с общей детерминантой различных человеческих рецепторов KIR2DL.
Фигура 2. Восстановление лизиса mAb (моноклональными антителами) против KIR2DL на мишени C1R Cw4 при соотношении эффектор/мишень 4/1. Моноклональные антитела DF200 ингибируют опосредованное KIR2DL ингибирование цитотоксичности KIR2DL1-положительных NK-клеток (восстановленный лизис) на Суу4-положительных клетках-мишенях.
Фигура 3. Опосредованное ритуксаном усиление ADCC KIR2DL1-положительного NK-клона на Сw4-положительной клеточной линии EBV путем блокирования взаимодействия KIR/HLA. Цитолиз NK-клона, содержащего KIR2DL1, тестировали против Сw4-положительной трансформированной EBV (СD20-положительной) клеточной линии-мишени при разных соотношениях эффектор/мишень (от 1 до 4) в присутствии 5 мкг/мл антител против CD20 (ритуксан) и 10 мкг/мл антител ЕВ6 (против KIR2DL1); одного ритуксана; одних ЕВ6 или без каких-либо антител. ADCC существенно усиливается в присутствии антител против KIR2DL1 (ЕВ6).
Фигура 4. Опосредованное кампатом усиление ADCC KIR2DL1-положительного NK-клона на Сw4-положительной клеточной линии EBV путем блокирования взаимодействия KIR/HLA. Цитолиз NK-клона, содержащего KIR2DL1, тестировали против Сw4-положительной трансформированной EBV (CD20-пoлoжитeльнoй) клеточной линии-мишени в присутствии кампата и 100 мкг/мл антител ЕВ6 (против KIR2DL1); одного кампата; одних ЕВ6 или без каких-либо антител. ADCC существенно усиливается в присутствии антител против KIR2DL1 (ЕВ6).
Подробное описание изобретения
Настоящее изобретение относится к способу повышения эффективности антител для лечебных целей. Конкретнее, изобретение раскрывает, что применение соединения, предпочтительно антител или их фрагментов, потенциирующего NK-клетки, предпочтительно путем блокирования ингибирующего рецептора или активирования активирующего рецептора NK-клетки, может существенно повысить эффективность антител для лечебных целей путем совместного введения антител, направленных против NK-клеточного рецептора, например ингибирующего рецептора.
Следовательно, изобретение относится к способу лечения заболевания у субъекта, нуждающегося в таком лечении, включающему
a) введение указанному субъекту соединения, предпочтительно антител или их фрагментов, блокирующего ингибирующий рецептор или стимулирующего активирующий рецептор NK-клетки; и
b) введение указанному субъекту антител для лечебных целей.
Указанные антитела для лечебного применения могут связываться CD 16 NK-клеток, предпочтительно через Fc-участок.
Предпочтительно указанные антитела для лечебных целей содержат Fc-участок человеческого IgG1 или IgG3, в частности моноклональные антитела или их фрагменты, также предпочтительно гуманизированные, человеческие или химерные антитела или их фрагменты, например ритуксимаб.
Подразумевается, что соединения, предпочтительно антитела или их фрагменты, блокирующие ингибирующий рецептор NK-клетки, можно вводить субъекту до, одновременно или после введения антител для лечебного применения. Способ введения различных антител зависит от их биологической доступности и фармакокинетики. Предпочтительно антитела для лечебных целей вводят в пределах недели относительно введения соединений, предпочтительно антител или их фрагментов, блокирующих ингибирующий рецептор NK-клетки, предпочтительнее в пределах периода в 5 или 2 дня. Предпочтительно антитела для лечебных целей вводят до или одновременно с соединениями, предпочтительно антителами или их фрагментами, блокирующими ингибирующий рецептор NK-клетки.
В другом аспекте изобретение относится к способу усиления ADCC у субъекта, получающего лечение антителами для лечебных целей, причем указанный способ включает введение указанному субъекту до, одновременно или после введения указанных антител для лечебных целей достаточное для усиления ADCC количество соединения, предпочтительно антител или их фрагментов, блокирующего ингибирующий рецептор NK-клетки. Указанные антитела для лечебных целей могут связываться CD 16 NK-клеток, предпочтительно через Fc-участок. Предпочтительно указанные антитела для лечебных целей содержат Fc-участок человеческого IgG1 или IgG3, в частности моноклональные антитела или их фрагменты, также предпочтительно гуманизированные, человеческие или химерные антитела или их фрагменты, например ритуксимаб.
В другом аспекте изобретение относится к способу повышения эффективности лечения субъекта антителами для лечебных целей, причем указанный способ включает введение указанному субъекту до, одновременно или после введения указанных антител для лечебных целей достаточного для повышения эффективности указанных антител для лечебных целей количества соединения, предпочтительно антител или их фрагментов, блокирующего ингибирующий рецептор NK-клетки. Указанные антитела для лечебных целей могут связываться CD 16NK-клеток, предпочтительно через Fc-участок. Предпочтительно указанные антитела для лечебных целей содержат Fc-участок человеческого IgG1 или IgG3, в частности моноклональные антитела или их фрагменты, также предпочтительно гуманизированные, человеческие или химерные антитела или их фрагменты, например, ритуксимаб.
Определения
Используемые в данном описании следующие далее термины имеют приписываемые им значения, если не указано иное.
Используемый в данном описании термин "NK"-клетки относится к субпопуляции лимфоцитов, которая вовлекается в нестандартный иммунитет. NK-Клетки можно идентифицировать на основании некоторых характеристик и биологических свойств, таких как экспрессия специфических поверхностных антигенов, в том числе CD 16, CD56 и/или CD57, отсутствие альфа/бета- или гамма/дельта-TCR комплекса на поверхности клетки, способность связываться с и убивать клетки, которые не в состоянии экспрессировать "собственные" антигены MHC/HLA, путем активации специфических цитолитических ферментов, способность убивать опухолевые клетки или другие пораженные клетки, экспрессирующие лиганд для активирующих рецепторов NK, и способность высвобождать белковые молекулы, называемые цитокинами, которые стимулируют или ингибируют иммунную реакцию. Любую из указанных характеристик и активностей можно использовать для идентификации NK-клеток с использованием способов, хорошо известных в технике.
Термин "антитело", используемый в данном описании, относится к поликлональным и моноклональным антителам. В зависимости от типа константной области в тяжелых цепях антитела относят к одному из пяти основных классов: IgA, IgD, IgE, IgG и IgM. Некоторые их них также подразделяют на подклассы или изотипы, такие как IgG1, IgG2, IgG3, IgG4 и т.д. Пример структурной единицы иммуноглобулинов (антител) включает тетрамер. Каждый тетрамер состоит из двух идентичных пар полипептидных цепей, причем каждая пара имеет одну "легкую" (L, light, примерно 25 кД) и одну "тяжелую" (Н, heavy, примерно 50-70 кД) цепь. N-конец каждой цепи определяет вариабельную область в примерно 100-110 или более аминокислот, которая в первую очередь ответственна за распознавание антигенов. Термины "вариабильная область легкой цепи" (VL) и "вариабильная область тяжелой цепи" (VH) относятся к таким легким и тяжелым цепям соответственно. Константные области тяжелых цепей, соответствующие различным классам иммуноглобулинов, называют "альфа", "дельта", "эпсилон", "гамма" и "мю", соответственно. Структуры субъединиц и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны. IgG и/или IgM являются предпочтительными классами антител, используемых в данном изобретении, причем IgG являются особенно предпочтительными, поскольку они являются наиболее обычными антителами в физиологической ситуации, поскольку их легче всего получать в лаборатории, и поскольку IgG специфически распознаются Fc-гамма рецепторами. Предпочтительно антитела данного изобретения являются моноклональными антителами.
Особенно предпочтительными являются гуманизированные, химерные, человеческие или иные подходящие для человека антитела.
В контексте данного изобретения термин "антитело или антитела для лечебных целей" (therapeutic antibody) предназначен, конкретнее, для любых антител, которые функционируют как устраняющие у пациента клетки-мишени. В частности, антитела для лечебных целей специфически связываются с антигенами, присутствующими на поверхности клеток-мишеней, например опухолевыми специфическими антигенами, присутствующими преимущественно или исключительно на опухолевых клетках. Предпочтительно антитела для лечебных целей включают человеческие Fc-участки или способны взаимодействовать с человеческими Fc-рецепторами. Антитела для лечебных целей могут метить клетки любыми способами, например ADCC или иначе, и могут быть "голыми", т.е. без конъюгированных частиц, или могут быть конъюгированы с такими соединениями, как радиоактивные метки или токсины.
Термин "специфически связываются с" означает, что антитела могут связываться предпочтительно в конкурентно-связывающем анализе с партнером по связыванию, например активирующим рецептором NK, таким как NKp30, NKp44 или NKp46, или человеческим Fc-гамма рецептором, при оценке с использованием или рекомбинантных форм белков, их эпитопов, или нативных белков, присутствующих на поверхности изолированных NK или соответствующих клеток-мишеней. Конкурентно-связывающие анализы и другие способы также описываются ниже и хорошо известны в технике.
Антитело, "подходящее для человека" (human-suitable), является любым антителом, дериватизированным антителом или фрагментом антитела, которые можно безопасно применять для людей в случае, например, способов лечения, описанных в данном описании. Антитела, подходящие для человека, включают все типы гуманизированных, химерных или полностью человеческих антител или антитела, в которых, по меньшей мере, часть антитела происходит от человека или модифицирована иначе с тем, чтобы достигать иммунной реакции, которая вызывается, когда используют нативные, не являющиеся человеческими, антитела.
Термин "иммуногенный фрагмент" в данном описании обозначает любой полипептидный или пептидный фрагмент, способный выявлять иммунную реакцию, такую как
i) выработка антител, связывающих указанный фрагмент и/или связывающих любую форму молекулы, содержащей указанный фрагмент, включая мембранно-связанный рецептор и происходящие от него мутанты,
ii) стимуляция Т-клеточной реакции, вовлекающей Т-клетки во взаимодействие с бимолекулярным комплексом, содержащим любую молекулу МНС и пептид, образованный от указанного фрагмента,
iii) связывание трансфецированных носителей, таких как бактериофаги или бактерии, экспрессирующие гены, кодирующие иммуноглобулины млекопитающих.
С другой стороны, термин "иммуногенный фрагмент" также относится к любой конструкции, способной выявлять иммунную реакцию, описанную выше, такой как пептидный фрагмент, конъюгированный с белком-носителем ковалентной связью, химерная рекомбинантная полипептидная конструкция, содержащая указанный пептидный фрагмент в своей аминокислотной последовательности, и специфически включает клетки, трансфецированные кДНК, последовательность которой содержит участок, кодирующий указанный фрагмент.
Для целей настоящего изобретения определение антитела как "гуманизированное" относится к антителу, в котором константная область и каркасный участок вариабельной области одного или нескольких человеческих иммуноглобулинов слиты с участком связывания, например CDR, иммуноглобулина животного. Такие гуманизированные антитела создают для того, чтобы сохранить специфичность связывания антител, не являющихся человеческими, от которых происходят участки связывания, но избежать иммунной реакции против антител, не являющихся человеческими.
"Химерное антитело" представляет собой молекулу антитела, в которой
a) константная область или ее часть изменена, заменена или обменена таким образом, что сайт связывания антигена (вариабельная область) связывается с константной областью молекулы другого или измененного класса, эффекторной функции или вида, и или полностью другой молекулой, которая придает новые свойства химерному антителу, например ферментом, токсином, гормоном, фактором роста, лекарственньм средством и т.д.; или
b) вариабельная область или ее часть изменена, заменена или обменена с вариабельной областью с отличной или измененной антиген-специфичностью. В предпочтительных воплощениях настоящего изобретения химерные антитела, тем не менее, сохраняют Fc-участок иммуноглобулина, предпочтительно человеческий Fc-участок, за счет чего возможны взаимодействия с человеческими Fc-рецепторами на поверхности клеток-мишеней.
В контексте данного изобретения термины "потенциированные", "активные" или "активированные" NK-клетки обозначают биологически активные NK-клетки, конкретнее NK-клетки, способные лизировать клетки-мишени. Например, "активные" NK-клетки способны убивать клетки, которые экспрессируют лиганд для активирующих рецепторов NK и не в состоянии экспрессировать "собственные" антигены MHC/HLA (KIR-несовместимые клетки). Примерами подходящих клеток-мишеней для применения в перенацеленных киллинг-анализах (redirected killing assays) являются клетки Р815 и К562, но можно использовать любые клетки из ряда типов клеток, которые хорошо известны в технике (см., например, Sivori et al. (1997), J. Exp. Med., 186:1129-1136; Vitale et al. (1998), J. Exp. Med., 187:2065-2072; Pessino et al. (1998), J. Exp. Med., 188:953-960; Neri et al. (2001), Clin. Diag. Lab. Immun., 8:1131-1135). "Потенциированные", "активные" или "активированные" клетки также можно идентифицировать по любому свойству или активности, известным в технике как связанные с NK-активностью, таким как продуцирование цитокинов (например, IFN-γ и TNF-α) или повышение уровней свободного внутриклеточного кальция. Для целей настоящего изобретения термины "потенциированные", "активные" или "активированные" NK-клетки относятся определенно к NK-клеткам in vivo, которые не подавляются стимуляцией ингибирующего рецептора или в которых такое подавление преодолено, например, через стимуляцию активирующего рецептора.
Используемый в данном описании термин "NK-активирующий рецептор" относится к любой молекуле на поверхности NK-клеток, которая, когда стимулирована, вызывает поддающееся измерению усиление какого-либо свойства или активности, известных в технике как связанные с NK-активностью, таких как продуцирование цитокинов (например, IFN-γ и TNF-α), повышение уровней свободного внутриклеточного кальция, способность связываться с клетками-мишенями в перенацеленном киллинг-анализе, описанном, например, в другом месте в данном описании, или способность стимулировать пролиферацию NK-клеток. Термин "KIR-активирующий рецептор" включает, но не ограничивается перечисленным, NKp30, NKp44, NKp46, NKG2D, IL-12R, IL-15R, IL-18R и IL-21R. Термин "NK-активирующий рецептор", используемый в данном описании, исключает рецептор IL-2 (IL-2R). Способы определения, является ли NK-клетка активной или профилирующей или не является, описываются подробнее ниже и хорошо известны специалистам в данной области техники.
Используемый в данном описании термин "ингибирующий" или "подавляющий NK-рецептор" относится к любой молекуле на поверхности NK-клеток, которая, когда стимулирована, вызывает поддающееся измерению ослабление какого-либо свойства или активности, известных в технике как связанные с NK-активностью, таких как продуцирование цитокинов (например, IFN-γ и TNF-α), повышение уровней свободного внутриклеточного кальция или способность связываться с клетками-мишенями в перенацеленном киллинг-анализе, описанном, например, в другом месте в данном описании. Примерами таких рецепторов являются KIR2DL1, KIR2DL2/3, KIR2DL4, KIR2DL5A, KIR2DL5B, KIR3DL1, KIR3DL2, KIR3DL3, LILRB1, NKG2A, NKG2C, NKG2E и LILRB5. Способы определения, является ли NK-клетка активной или не является, описываются подробнее ниже и хорошо известны специалистам в данной области техники.
В настоящем изобретении термин "блокирование ингибирующего рецептора или стимуляция активирующего рецептора NK-клетки" относится к способности некоторых соединений, предпочтительно антител, их фрагментов или производных, предпочтительно непосредственно взаимодействовать с, по меньшей мере, одним ингибирующим или активирующим рецептором NK-клетки, например KIR, NKG2A/C, NKp30, NKp44, NKp46 и другими, перечисленными в данном описании, и/или нейтрализовать подавляющие сигналы рецептора (в случае ингибирующих рецепторов) или стимулировать сигналы рецептора (в случае активирующих рецепторов). В случае ингибирующих рецепторов предпочтительно соединение, предпочтительно антитела или их фрагменты, способно блокировать взаимодействие между HLA и рецептором.
Когда соединение представляет собой антитела, они могут быть поликлональными или предпочтительно моноклональными. Они могут продуцироваться гибридомами или рекомбинантными клетками, созданными для экспрессии нужных вариабельных и константных областей. Антитела могут представлять собой одноцепочечные антитела или другие производные антител, сохраняющие антиген-специфичность и нижний шарнирный участок или его фрагмент, такие как Fab-фрагмент, Fab'2-фрагмент, CDR и ScFv. Они могут представлять собой полифункциональные антитела, рекомбинантные антитела, гуманизированные антитела или их варианты.
В контексте данного изобретения термин "общая детерминанта" обозначает детерминанту или эпитоп, являющиеся частью нескольких членов группы родственных рецепторов, например группы человеческих рецепторов KIR2DL. Детерминанта или эпитоп могут представлять пептидный фрагмент или конформационный эпитоп, являющийся частью членов указанной группы. В конкретном воплощении общая детерминанта содержит эпитоп, распознаваемый моноклональными антителами DF200, NKVSF1 или EB6.
В контексте данного изобретения термин "антитело, которое связывается с общей детерминантой", обозначает антитело, которое связывается с указанной детерминантой со специфичностью и/или аффинностью, например, которое, по существу, не связывается с высокой аффинностью или специфичностью с другими неродственными мотивами или детерминантной или структурами на поверхности человеческих NK-клеток. В более частном случае связывание моноклональных антител согласно данному изобретению с указанной детерминантой можно различить по связыванию указанных антител с другими эпитопом или детерминантой.
Соединения, предпочтительно антитела, способные связываться с ингибирующими NK-рецепторами и предотвращать их стимуляцию, являются, таким образом, "нейтрализующими" или "ингибирующими" соединениями, предпочтительно антителами, в том смысле, что они блокируют, по меньшей мере, частично ингибирующий сигнальный каскад, опосредуемый ингибирующими рецепторами NK-клеток, т.е. рецепторами KIR или NKG2A/C, так что такие соединения, предпочтительно антитела, можно использовать для различных субъектов с высокой эффективностью.
Термин "рекомбинантные", когда используется в отношении, например, клетки или нуклеиновой кислоты, белка или вектора, указывает, что клетка, нуклеиновая кислота, белок или вектор модифицированы введением гетерологичной нуклеиновой кислоты или белка, или изменением нативных нуклеиновой кислоты или белка, или что клетка происходит от клетки, модифицированной таким образом. Так, например, рекомбинантные клетки экспрессируют гены, которые не обнаруживаются в нативной (не рекомбинантной) форме клетки, или экспрессируют нативные гены, которые в ином случае экспрессируются аномально, экспрессируются недостаточно или вовсе не экспрессируются.
В контексте настоящего изобретения субъектом или пациентом является любое млекопитающее, предпочтительнее человек.
Антитела для лечебных целей
Настоящее изобретение относится к применению соединений, потенциирующих NK-клетки, в сочетании с антителами для лечебных целей. В настоящем изобретении можно использовать любую крупную разновидность антител для лечебных целей. По существу, можно использовать любые антитела для лечебных целей, являются ли они "голыми" или конъюгированы с радиоактивными метками, токсинами или другими группами, являются ли они полноразмерными или фрагментами, или являются ли они истинными антителами или модифицированными производными антител. Предпочтительно используют способы усиления эффективности лечения, в которых играет роль активность NK-клеток - без исключения - эффективности вводимых антител для лечебных целей, а также предпочтительно антитела или фрагменты будут включать естественно, или будут модифицированы для включения, человеческий Fc-участок или другую область, которая дает возможность распознавания антител человеческими Fc-рецепторами, например Fc-гамма рецепторами.
Соединения настоящего изобретения можно применять для усиления способности антител для лечебных целей устранять клетки-мишени, экспрессирующие антиген, который специфически распознается антителами для лечебных целей. Соответственно любое заболевание или состояние, которое вызывается или обостряется, по меньшей мере, частично клетками, которые могут быть мишенями для антител для лечебных целей, можно лечить с использованием способов, описанных в данном описании. Конкретными примерами клеток-мишеней являются опухолевые клетки, клетки, инфицированные вирусом, аллогенные клетки, патологические иммунокомпетентные клетки (например, В-лимфоциты, Т-лимфоциты, антиген-представляющие клетки и т.д.), вовлеченные в аллергические реакции, аутоиммунные болезни, аллогенные реакции и т.п., или даже здоровые клетки (например, эндотелиальные клетки в антиангиогенной лечебной стратегии). Наиболее предпочтительными клетками-мишенями в контексте данного изобретения являются опухолевые клетки и клетки, инфицированные вирусом. Антитела для лечебных целей могут, например, опосредовать цитотоксическое действие или лизис клеток, в частности опосредованную антителами клеточную цитотоксичность (ADCC).
Для ADCC требуются лейкоцитарные рецепторы для Fc-участка IgG (FcγR), функцией которых является связь чувствительных к IgG антигенов с цитотоксичными клетками, содержащими FcγR, и запуск механизма клеточной активации. Поэтому антитела для лечебных целей способны образовывать иммунный комплекс. Например, иммунный комплекс может представлять собой опухоль-мишень, покрытую антителами для лечебных целей. Конкретнее, антитела могут связываться CD 16 предпочтительно через их Fc-участки. Определение того, связываются ли антитела для лечебных целей с Fcγ-рецептором, таким как CD 16, можно осуществить любым подходящим способом, например, определяя связывание с полученным рекомбинантным полипептидом CD 16 или его фрагментом, необязательно иммобилизованными на носителе, или, например, определяя связывание антител для лечебных целей с клетками, о которых известно, или ожидается, что они экспрессируют CD 16.
Антитела для лечебных целей могут быть поликлональными или предпочтительно моноклональными. Они могут продуцироваться гибридомами или рекомбинантными клетками, созданными для экспрессии нужных вариабельных и константных областей. Антитела могут представлять собой одноцепочечные антитела или другие производные антител, сохраняющие антиген-специфичность и нижний шарнирный участок или его фрагмент. Они могут быть полифункциональными антителами, рекомбинантными антителами, гуманизированными антителами, их фрагментами или вариантами. Указанный фрагмент или его производное выбирают предпочтительно из числа Fab-фрагмента, Fab'2-фрагмента, CDR и ScFv. Предпочтительно фрагмент представляет собой антиген-связывающий фрагмент. Антитела для лечебных целей, содержащие фрагмент антитела, также могут включать биспецифические антитела, и другое; один из примеров подходящих биспецифических антител содержит антигенсвязывающий участок, специфический для CD 16, и антигенсвязывающий участок, специфический для опухолевого антигена. Другие форматы антител, содержащих фрагменты, включают рекомбинантные производные биспецифических антител, объединяющие участки связывания двух различных антител в единой полипептидной цепи, также называемые BiTE™ [Kufer P. et al., TRENDS, в Biotechnology, 2004; 22(5):238-234; и Baeuerle et al., Current Opinion in Molecular Therapeutics, 2003; 5(4): 413-419, работы включены в данное описание в качестве ссылок].
Антитела для лечебных целей, как правило, специфичны для поверхностных антигенов, например мембранных антигенов. Наиболее предпочтительными антителами для лечебных целей являются антитела, специфичные для опухолевых антигенов (например, молекул, специфически экспрессируемых опухолевыми клетками), таких как CD20, CD52, ErbB2 (или HER2/Neu), CD33, CD22, CD25, MUC-1, CEA, KDR, αVβ3 и т.д., в частности антигенов лимфом (например, CD20). Антитела для лечебных целей содержат предпочтительно Fc-участок человеческого IgG1 или IgG3 или примата, не являющегося человеком, предпочтительнее человеческого IgG1.
В одном воплощении антитела будут включать модификации в своем Fc-участке, усиливающие взаимодействие антител с NK-клетками во время ADCC. Такие модифицированные антитела для лечебных целей ("измененные антитела"), как правило, содержат модификации предпочтительно в Fc-участке, изменяющие аффинность связывания антител с одним или несколькими FcγR. Способы модификации антител с модифицированным связыванием с одним или несколькими FcγR известны в технике, см, например, публикации РСТ № WO 2004/016750 (заявка на Международный патент PCT/US2003/025399), WO 99/158572, WO 99/151642, WO 98/123289, WO 89/107142, WO 88/107089 и патенты США №5843597 и 5642821, включенные в данное описание в качестве ссылок.
Антитела для лечебных целей применения, идентифицированные в данном описании, такие как D2E7 [Cambridge Antibody Technology Group, pie (Cambridge, UK)/BASF (Ludwigshafen, Germany)], применяемые для лечения ревматоидного артрита, или инфликсимаб (infliximab, Centocor, Inc., Malvem, PA; используемый для лечения болезни Крона и ревматоидного артрита), или антитела, раскрытые в заявке на Международный патент PCT/US2003/025399 (включенной в данное описание в качестве ссылки), можно модифицировать, как указано в приведенных выше и ниже заявках и использовать для лечения заболеваний, для которых типично используют такие антитела. В некоторых воплощениях изобретение относится к измененным антителам с измененной аффинностью - или более высокой или более низкой аффинностью - в отношении активирующего FcγR, например FcγRIII. Некоторые предпочтительные воплощения относятся к измененным антителам с более высокой аффинностью в отношении FcγR. Предпочтительно такие модификации также имеют измененную Fc-опосредованную эффекторную функцию.
Модификации, влияющие на Fc-опосредованную эффекторную функцию, хорошо известны в технике (см., например, US 6194351, включенный в данное описание в качестве ссылки). К аминокислотам, которые можно модифицировать, относятся пролин 329, пролин 331, лизин 322 и другие. Пролин 329 и/или 331 и лизин 322 можно предпочтительно заменить аланином, однако также рассматривают любую другую аминокислоту. См. Международную публикацию № WO 00/142072 и US 61945351, включенные в данное описание в качестве ссылок.
Таким образом, модификация Fc-участка может заключаться в одном или нескольких изменениях аминокислот, находящихся в Fc-участке антитела. Такие изменения могут привести к получению антитела с измененной антитело-опосредованной эффекторной функцией, с измененным связыванием с другими Fc-рецепторами (например, активирующими Fc-рецепторами), с измененной активностью ADCC, с измененной активностью Clq связывания, с измененной комплемент-зависимой цитотоксической активностью или любым их сочетанием.
В одном воплощении антитела специфически распознаются Fc-гамма рецептором, таким как FCGR3A [также называемым CD 16, FcγRIIIa, FCGR3, Fc-рецептором III иммуноглобулина G; IGFR3, рецептором для Fc-фрагмента IgG, низко аффинным IIIa (Low Affinity IIIa); см., например, OMIM 146740], FCGR2A (также называемым CD32, CDw32, рецептором для Fc-фрагмента IgG, низко аффинным IIа; FGG2, Fc-рецептором II иммуноглобулина G; см., например, OMIM 146740); FCGR2B (также называемым CD32, рецептором для Fc-фрагмента IgG, низко аффинным IIb; РС-гамма-КПВ FCGR2B; см., например, OMIM 604590); FCG1RA [также называемым CD64; рецептором для Fc-фрагмента IgG, высоко аффинным la (High Affinity Ia); IGFR1; см., например, OMIM 146740]; FCGR1 фрагмент IgG (также называемым высоко аффинный 1с, Fc-рецептор IC иммуноглобулина G, см., например, OMIM 601503); или FCGR1 В (также называемым CD64, рецептором для Fc-фрагмента IgG, высоко аффинным Ib; Fc-рецептором IB иммуноглобулина G; IGFRB; см., например, OMIM 601502).
Типичными примерами антител для лечебных целей данного изобретения являются ритуксимаб, алемтузумаб и трастузумаб. Такие антитела можно использовать согласно клиническим протоколам, разрешенным к применению для людей. Другими конкретными примерами антител для лечебных целей являются, например, эпратузумаб, базиликсимаб, даклизумаб, цетуксимаб, лабетузумаб, севирумаб, тувуримаб, палвизумаб, инфликсимаб, омализумаб, эфализумаб, кленоликсимаб и т.д. Необязательно, когда соединение, стимулирующее активирующий рецептор NK-клетки, представляет собой цитокин, антитела для лечебного применения являются иными, чем ритуксимаб или герцептин, или, необязательно, иными, чем антитела против CD20 или против HER2/neu. Другие примеры предпочтительных антител для лечебных целей согласно изобретению включают анти-ферритиновые антитела (публикация патента США № 2002/0106324), антитела против р140 и против sc5 (WO 02/50122) и антитела против KIR (киллер-ингибирующий рецептор) (рецепторы KIR описываются в Camngton and Norman, The KIR Gene Cluster, May 3, 2003, доступно на http://www.ncbi.nlm.nih.gov/books), все перечисленные работы включены в данное описание в качестве ссылок. Другие примеры антител для лечебных целей перечислены в таблице, приведенной ниже, любые из которых (и другие) можно применять в способах настоящего изобретения. Следует иметь в виду, что, несмотря на то, перечислены ли антитела в приведенной далее таблице или нет, или описаны в другом месте настоящего описания, любые антитела, которые могут устранять клетки-мишени, предпочтительно за счет ADCC, могут быть благоприятными в способах настоящего изобретения, и что приведенная далее таблица 1 не является исчерпывающей ни в отношении перечисленных в ней антител, ни в отношении мишеней или показаний для перечисленных антител.
Антитела для лечебных целей
кого CD19, CD3
Соединения, регулирующие активность NK-клеток
Активность NK-клеток регулируется сложным механизмом, в котором участвуют как стимулирующие, так и подавляющие сигналы. Соответственно эффективного опосредованного NK-клетками лечения можно достичь стимуляцией указанных клеток или нейтрализацией подавляющих сигналов. Следует иметь в виду, что можно использовать любое соединение, которое обладает действием блокирования, ингибирования или иной отрицательной регуляции ингибирующего рецептора NK-клетки, или активирующим, стимулирующим или иным действием, промотирующим активность или экспрессию активирующего рецептора NK-клетки. К таким соединениям относятся такие соединения как цитокины, а также небольшие молекулы, полипептиды и антитела, которые могут связываться с рецепторами NK-клеток и непосредственно ингибировать или стимулировать их. Также следует иметь в виду, что механизм, по которому рецепторы блокируются или стимулируются, не является критическим фактором для преимуществ изобретения. Например, соединения могут усиливать экспрессию активирующего рецептора или подавлять экспрессию ингибирующего рецептора, соединения могут предотвращать взаимодействие между лигандом и ингибирующим рецептором или усиливать взаимодействие между лигандом и активирующим рецептором, или соединения могут непосредственно связываться с рецепторами и ингибировать их (в случае ингибирующих рецепторов) или активировать их (в случае активирующих рецепторов). Критическим параметром является действие, которое соединения оказывают на способность антител для лечебного применения устранять их клетки-мишени in vivo.
Любой ингибирующий рецептор на поверхности NK-клетки может быть мишенью для соединений настоящего изобретения. NK-Клетки отрицательно регулируются специфическими ингибирующими рецепторами класса I главного комплекса гистосовместимости (МНС) (Кarrе et al., 1986; Ohien et al., 1989; работы включены в данное описание в качестве ссылок). Такие специфические рецепторы связываются с полиморфными детерминантами молекул класса I главного комплекса гистосовместимости (МНС) или HLA и ингибируют лизис естественных киллерных (NK) клеток. У людей семейство рецепторов, называемых киллерными Ig-подобными рецепторами (KIR), распознает группы аллелей класса I HLA.
Существует несколько групп KIR-рецепторов, в том числе KIR2DL, KIR2DS, KIR3DL и KIR3DS. KIR-рецепторы, содержащие два домена Ig (KIR2D), идентифицируют аллотипы HLA-C: KIR2DL2 (называемый прежде р58.1) или близкородственный генный продукт KIR2DL3, распознает эпитоп, общий для аллотипов HLA-C группы 2 (Cw1, 3, 7 и 8), в то время как KIR2DL1 (р58.2) распознает эпитоп, общий для аллотипов HLA-C реципрокной группы 1 (Cw2, 4, 5 и 6). Распознавание KIR2DL1 диктуется наличием остатка Lys в позиции 80 аллелей HLA-C. Распознавание KIR2DL2 и KIR2DL3 диктуется наличием остатка Asn в позиции 80. Более того, значительное большинство аллелей HLA-С имеет остаток Asn или Lys в позиции 80. Один KIR с тремя доменами Ig KIR3DL1 (р70) распознает эпитоп, общий для аллелей HLA-Bw4. Наконец, гомодимер молекул с тремя доменами Ig KIR3DL2 (р140) распознает HLA-A3 и -Al 1.
Хотя KIR и другие ингибирующие рецепторы класса I (Moretta et al., 1997; Valiante et al., 1997; Lanier, 1998; все работы включены в данное описание в качестве ссылок) могут совместно экспрессироваться NK-клетками, в любом данном отдельном NK-репертуаре существуют клетки, которые экспрессируют один KIR, и, таким образом, соответствующие NK-клетки блокируются только клетками, экспрессирующими специфическую группу аллелей класса I. Соответственно, как описано ниже, когда ингибирующие рецепторы локализуются, способы настоящего изобретения часто будут включать введение соединений, которые локализуют несколько ингибирующих рецепторов, обеспечивая посредством этого всеобъемлющее действие, которого достигает максимальный диапазон NK-клеток.
В некоторых воплощениях соединение, предпочтительно антитела или их фрагменты, блокирует ингибирующий рецептор NK-клетки, нейтрализуя ингибирующий сигнал, по меньшей мере, одного ингибирующего рецептора, выбранного из группы, состоящей из KIR2DL2, KIR2DL3, KIR2DL1, KIR3DL1, KIR3DL2, NKG2A и NKG2C. Предпочтительнее соединение, предпочтительно антитела или их фрагменты, блокирующее ингибирующий рецептор NK-клетки, представляет собой соединение, предпочтительно антитела или их фрагменты, нейтрализующее ингибирующий сигнал KIR2DL2, KIR2DL3 и/или KIR2DL1.
Изобретение также относится к применению сочетания нескольких соединений, предпочтительно антител или их фрагментов, блокирующих различные ингибирующие рецепторы NK-клеток. Предпочтительно соединения, предпочтительно антитела или их фрагменты, блокирующие ингибирующие рецепторы NK-клеток, специфичны в отношении ингибирующего рецептора, выбранного из числа KIR2DL1, KIR2DL2, KIR2DL3, KIR3DL1, KIR3DL2, NKG2A и NKG2C, и способны ингибировать опосредованное родственными KIR- или NKG2A/C ингибирование цитотоксичности NK-клеток. Например, соединения, блокирующие ингибирующие рецепторы NK-клеток, могут содержать антитела, обладающие специфичностью к KIR2DL1, и другие антитела, обладающие специфичностью к KIR2DL2 и/или KIR2DL3. Предпочтительнее сочетание соединений, блокирующих ингибирующие рецепторы NK-клеток, способно ингибировать опосредованное KIR2DL1, KIR2DL2 и KIR2DL3 ингибирование цитотоксичности NK-клеток. В других воплощениях будет вводиться смесь одного или нескольких соединений, локализующих один или несколько ингибирующих рецепторов, а также одно или несколько соединений, локализующих один или несколько активирующих рецепторов.
Например, показано, что моноклональные антитела, специфичные для KIR2DL1, блокируют аллели KIR2DL1 Cw4 (или подобные) (Moretta et al., 1993; работа включена в данное описание в качестве ссылки). Как другой пример, также сообщается, что моноклональные антитела против KIR2DL2/3 блокируют аллели KIR2DL2/3 HLACw3 (или подобные) (Moretta et al., 1993). Показано, что антитела против NKG2A блокируют ингибирующее взаимодействие между NKG2A и HLA-E.
Необязательно, антитела можно выбрать из группы, состоящей из GL183 (KIR2DL2, L3, доступны от Immunotech, France and Becton Dickinson, USA); EB6 (KIR2DL1, доступны от Immunotech, France and Becton Dickinson, USA); AZ138 (KIR3DL1, доступны от Moretta et al., Univ. Genova, Italy); Q66 (KIR3DL2, доступны от Immunotech, France); Z270 (NKG2A, доступны от Immunotech, France); P25 (NKG2A/C, доступны от Moretta et al., Univ. Genova, Italy) и DX9, Z27 (KIR3DL1, доступны от Immunotech, France and Becton Dickinson, USA).
В предпочтительном аспекте в изобретении используют моноклональные антитела, а также их фрагменты и производные, где указанные антитела, фрагменты или производные перекрестно взаимодействуют с несколькими KIR- или NKG2A/C-рецепторами на поверхности NK-клеток и нейтрализуют их ингибирующие сигналы.
В одном воплощении в изобретении используют моноклональные антитела, связывающие общую детерминанту человеческих KIRlDL-peuenTopoa и ингибирующие соответствующий ингибирующий каскад реакций. Предпочтительно в изобретении используют моноклональные антитела, связывающие KIR2DL1- и KIR2DL2/3-рецепторы на поверхности человеческих NK-клеток и ингибирующие опосредованное KIR2DL1 и KIR2DL2/3 ингибирование цитотоксичности NK-клеток. Антитела специфически ингибируют связывание молекул HLA-c с KIR2DL1- и KIR2DL2/3-рецепторами. Предпочтительнее антитела способствуют активности NK-клеток in vivo. Поскольку KIR2DL1 и KIR2DL2 (или KIR2DL3) достаточно для схватывания большинства аллотипов HLA-C, соответственно группы 1 аллотипов HLA-C и группы 2 аллотипов HLA-C, такие антитела можно использовать для повышения эффективности антител для лечебных целей для большинства людей, типично, для примерно 90% людей или более. В таком воплощении согласно изобретению можно использовать любые из антител, описанных в заявке на патент, РСТ, № PCT7FR04/01702, зарегистрированной 1 июля 2004, имеющей название "Композиции и способы регуляции активности NK-клеток", включенной в данное описание в качестве ссылки.
Особой целью данного изобретения являются антитела, блокирующие ингибирующий рецептор NK-клетки, представляющие собой моноклональные антитела, связывающие общую детерминанту человеческих KIR2DL-penenTOpoB и ингибирующие опосредованное KIR2DL ингибирование цитотоксичности NK-клеток. Антитела специфичнее связываются с тем же эпитопом, что и моноклональные антитела DF200 или NKVSF1, продуцируемые гибридомами DF200 и NKVSF1, соответственно и/или конкурирующие с моноклональными антителами DF200 или NKVSF1, продуцируемыми гибридомами DF200 и NKVSF1, соответственно за связывание с KIR-рецептором на поверхности человеческой NK-клетки. Примеры антител, функциональные анализы и анализы для определения того, конкурируют ли антитела за связывание с указанными антителами, для обсуждения, описываются в заявке на патент PCT/FR04/01702.
В конкретном воплощении моноклональные антитела представляют собой моноклональные антитела DF200, продуцируемыми гибридомой DF200. В другом воплощении моноклональные антитела представляют собой ЕВ6, или антитела связываются с тем же эпитопом, что и моноклональные антитела ЕВ6, или конкурируют за связывание с моноклональными антителами ЕВ6. В других воплощениях антитела представляют собой фрагменты или производные антител DF200 или ЕВ6. Гибридома, продуцирующая DF200, депонирована в коллекции культур CNCM, идентификационный № "DF200", регистрационный № CNCM 1-3224, зарегистрирована 10 июня 2004, Collection Nationale de Cultures de Microorganismes, Institut Pasteur, 25, Rue du Docteur Roux, F-75724 Paris Cedex 15, France. Антитела NKVSF1 доступны от Serotec (Cergy Sainte-Christophe, France), № по каталогу - MCA2243.
В другом воплощении настоящего изобретения соединение, используемое для усиления эффективности антител для лечебных целей, стимулирует активирующий рецептор NK-клетки. Можно использовать любой активирующий рецептор, например NKp30 (см., например, РСТ WO 01/36630, включенную в данное описание в качестве ссылки), NKp44 (см., например, Vitale et al. (1988), J. Exp. Med., 187:2065-2072, работа включена в данное описание в качестве ссылки), NKp46 (см., например, Sivori et al. (1997), J. Exp. Med., 186:1129-1136; Pessino et al. (1988), J. Exp. Med., 188: 953-960; работы включены в данное описание в качестве ссылок), NKG2D (см., например, OMIM 602893), IL-12R, IL-15R, IL-18R, IL-21R, или активирующий KIR-рецептор, например, рецептор KIR2DS4 (Carrington and Norman, The KIR Gene Cluster, May 3, 2003, доступно на http://www.ncbi.nlm.nih.gov/books), или любой другой рецептор, присутствующий на основной части NK-клеток, и активация которого приводит к активации или пролиферации клетки, даже предпочтительно, если клетка предварительно ингибирована ингибирующим рецептором, таким как ингибирующий KIR-рецептор. Соединение может представлять собой любые молекулы, в том числе полипептиды, небольшие молекулы и антитела. Примерами соединений являются любые лиганды, в том числе природные, рекомбинантные или синтетические лиганды, которые взаимодействуют с активирующими рецепторами. Например, соединение, стимулирующее активирующий рецептор NK-клетки, может представлять собой цитокин, такой как IL-12, взаимодействующий с рецептором IL-12 (IL-12R), IL-15, взаимодействующий с рецептором IL-15 (IL-15R), IL-18, взаимодействующий с рецептором IL-18 (IL-18R), IL-21, взаимодействующий с рецептором IL-21 (IL-21R). Такие соединения известны для, например, IL-12 (Research Diagnostics, NJ, DI-212), IL-15 (Research Diagnostics, NJ, RDI-215), IL-21 (Asano et al., FEBS Letter, 2002; 528: 70-76). Предпочтительно соединение, стимулирующее активирующий рецептор NK-клетки, представляет собой соединение, иное чем IL-2. Другие примеры соединений, стимулирующих активирующий рецептор NK-клетки, включают антитела, связывающие рецептор NK-клетки, выбранный из группы, состоящей из NKp30, NKp44, NKp46, NKG2D, KIR2DS4, и другие активирующие KIR-рецепторы.
В некоторых предпочтительных воплощениях активирующий рецептор представляет собой естественный рецептор цитотоксичности (NCR, natural cytotoxicity receptor), обнаруженный на NK-клетках, предпочтительно NCR, выбранный из группы, состоящей из NKp30, NKp44 или NKp46, и соединение, стимулирующее активирующий рецептор, которое связывается с тем же эпитопом или конкурирует за связывание с любыми моноклональными антителами, выбирают из группы, состоящей из AZ20, А76, Z25, Z231 и BAB281.
Связывание любого соединения с любыми из описанных в данном описании рецепторами NK-клеток можно обнаружить с использованием ряда стандартных способов. Например, можно использовать анализы типа колориметрического ELISA, а также иммунопреципитацию и радиоиммуноанализы. Можно использовать конкурентные анализы, например, для сравнения связывания испытываемого соединения и соединения, о котором известно, что оно связывается с рецептором NK-клетки, в которых контрольное (например, ВАВ281, специфически связывающееся с NKp46) и испытываемое соединения смешивают (или предварительно адсорбируют) и применяют к образцу, содержащему эпитоп-содержащий белок, например NKp46 в случае ВАВ281. Протоколы, основанные на ELISA, радиоиммуноанализах, вестерн-блоттинге и применении BIACORE, подходят для применения в таких простых конкурентных исследованиях и хорошо известны в технике.
Ингибирование опосредованного KIR или NKG2A/C ингибирования цитотоксичности NK-клеток или стимуляцию опосредованной NKp30, NKp44, NKp46 или NKG2D активации NK-клеток можно оценить различными анализами или испытаниями, такими как на связывание, цитотоксичность, или другими молекулярными или клеточными анализами.
В определенном варианте ингибирующая активность иллюстрируется способностью указанного соединения, предпочтительно антител, восстанавливать лизис KIR- или NKG2A/C-пoлoжитeльныx NK-клонов, соответственно на положительных мишенях HLA-C или HLA-E. В другом специфическом воплощении соединение, предпочтительно антитела, определяют как связывающее молекулы HLA-C с рецепторами KIR2DL1 и KIR2DL3 (или близкородственными KIR2DL2), также предпочтительно по его способности изменять связывание молекулы HLA-C, выбранной из числа Cw1, Cw3, Cw7 и Cw8 (или молекулы HLA-c, содержащей остаток Asn в позиции 80), с KIR2DL2/3; и связывание молекулы HLA-C, выбранной из числа Cw2, Cw4, Cw5 и Cw6 (или молекулы HLA-c, содержащей остаток Lys в позиции 80), с KIR2DL1.
Ингибирующую или потенциирующую активность соединения данного изобретения, предпочтительно антител, можно оценить любым из ряда способов, например, по его воздействию на свободный внутриклеточный кальций, как описано, например, в Sivori et al. (1997), J. Exp. Med., 186:1129-1136, работе, включенной в данное описание в качестве ссылки. Активность NK-клеток также можно оценивать с использованием анализов, основанных на клеточной цитотоксичности, например измерение высвобождения хрома, так как при этом оценивается способность антител стимулировать NK-клетки для уничтожения клеток-мишеней, таких как клетки Р815, К562, или соответствующих опухолевых клеток, как раскрывается в Sivori et al. (1997), J. Exp. Med., 186:1129-1136; Vitale et al. (1998), J. Exp. Med., 187:2065-2072; Pessino et al. (1998), J. Exp. Med., 188:953-960; Neri et al. (2001), Clin. Diag. Lab. Immun., 8:1131-1135;
Pende et al. (1999), J. Exp. Med., 190:1505-1516, все работы включены в данное описание в качестве ссылок. Подходящие анализы на цитотоксичность также описываются в разделе примеров настоящего описания. В предпочтительных воплощениях антитела вызывают, по меньшей мере, 10% увеличение NK-цитотоксичности, предпочтительно, по меньшей мере, 40% или 50% увеличение NK-цитотоксичности или предпочтительнее, по меньшей мере, 70% увеличение NK-цитотоксичности.
Активность NK-клеток также можно оценивать с использованием анализа на высвобождение цитокинов, при котором NK-клетки инкубируют с антителами, стимулирующими продуцирование цитокинов NK-клетками (например, продуцирование IFN-γ и TNF-α). В примерном протоколе продуцирование IFN-γ из РМВС оценивают, окрашивая поверхность клетки и интрацитоплазму, и осуществляя через 4 дня анализ в культуре методом проточной цитометрии. Коротко, в последние 4 часа выращивания добавляют брефелдин A (Sigma) в конечной концентрации 5 мкг/мл. Затем клетки инкубируют с mAb против CD3 и против CD56 перед их пермеабилизацией (повышением проницаемости клеточной мембраны с помощью IntraPrep™; Beckman Coulter) и окрашиванием РЕ-против-IFN-y или PE-IgGI (Pharmingen). Образование GM-CSF и IFN-y из поликлональных активированных NK-клеток измеряют в супернатантах с использованием ELISA (GM-CSF: DuoSet Elisa, R&D Systems, Minneapolis, MN; IFN-y: OpEIA set, Pharmingen).
В предпочтительных воплощениях оценивают способность антител активировать человеческие NK-клетки, где способность активировать человеческие NK-клетки, по меньшей мере, так же, как и NK-клетки, не являющиеся человеческими, показывает, что соединения подходят для применения в настоящем изобретении. В частности, можно оценить способность соединения усиливать способность антител для лечебных целей управлять устранением подходящих клеток-мишеней NK-клетками in vitro или in vivo.
Соединения данного изобретения, предпочтительно антитела, могут обнаруживать частичную ингибирующую или стимулирующую активность, например частично уменьшать опосредованное KIR2DL ингибирование цитотоксичности NK-клеток, или частично активировать NK-клетку стимуляцией NCR или других рецепторов на любом уровне. Наиболее предпочтительные соединения способны ингибировать (или стимулировать в случае активирующих рецепторов), по меньшей мере, 20%, предпочтительно, по меньшей мере, 30%, 40% или 50% или более, активности NK-клетки, например, при измерении в анализе клеточной цитотоксичности по сравнению с клетками в отсутствие соединения. Также предпочтительное соединение может обеспечить повышение устранения клеток-мишеней на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500%, 1000% или более относительно уровня устранения в отсутствие соединения. С другой стороны, предпочтительные соединения данного изобретения, предпочтительно антитела, способны индуцировать лизис популяции подходящих под пару или HLA-совместимых или аутологичных клеток-мишеней, т.е. популяции клеток, которые не лизируются эффективно NK-клетками в отсутствие указанных антител. Соответственно соединения данного изобретения также можно определить как способствующие активности NK-клеток in vivo.
Изобретение также относится к воплощениям, в которых соединения, стимулирующие активирующие рецепторы или предпочтительно блокирующие ингибирующий рецептор NK-клетки, представляют собой фрагменты таких моноклональных антител, обладающие, по существу, такой же антиген-специфичностью, в том числе без ограничений, Fab-фрагменты, Fab'2-фрагменты, CDR и ScFv. Кроме того, моноклональные антитела могут быть гуманизированными, человеческими или химерными (например, биспецифическими или функционализированными антителами). Хотя антитела, стимулирующие активирующие рецепторы, также могут представлять собой фрагменты, они предпочтительно являются полноразмерными. Производные, например, с модифицированными последовательностями, или конъюгированными гетерологичными функциональными группами, или другими соединениями можно использовать в случае любых антител, описанных в данном описании.
Антитела согласно изобретению, блокирующие ингибирующий рецептор или стимулирующие активирующий рецептор NK-клетки, можно получить различными методами, известными в технике. Типично их получают иммунизацией животного, не являющегося человеком, иммуногеном, содержащим полипептид KIR, NKG2A/C, NCR (например, NKp30, NKp44, NKp46) или NKG2D, или иммуногенный фрагмент любого из указанных полипептидов, и набор клеток селезенки (для получения гибридом слиянием с соответствующими клеточными линиями). Способы получения моноклональных антител от различных видов хорошо известны в технике (см., например, Harlow et al., "Antibodies: A laboratory Manual", CSH Press, 1988; Coding, "Monoclonal Antibodies: Principles and Practice", Academic Press, 1986; включенные в данное описание в качестве ссылок). Конкретнее, указанные способы включают иммунизацию животного, не являющегося человеком, антигеном, последующее извлечение клеток селезенки, которые затем сливают с иммортализованными (бессмертными) клетками, такими как клетки миеломы. Полученные гибридомы продуцируют моноклональные антитела и могут быть отобраны предельными разведениями для выделения отдельных клонов. Антитела также можно получить отбором комбинаторных библиотек иммуноглобулинов, как раскрывается, например, в работе Ward et al. (1989); включенной в данное описание в качестве ссылки.
Предпочтительные антитела согласно изобретению, блокирующие ингибирующий рецептор или стимулирующие активирующий рецептор NK-клетки, получают иммунизацией иммуногеном, содержащим активирующий или ингибирующий рецептор NK-клетки, например полипептид KIR2DL, предпочтительнее человеческий полипептид KIR2DL. Полипептид KIR2DL может содержать полноразмерную последовательность человеческого полипептида KIR2DL или его фрагмент или производное, типично иммуногенный фрагмент, т.е. часть полипептида, содержащую эпитоп, предпочтительно Т- или В-клеточный эпитоп. Такие фрагменты типично содержат, по меньшей мере, 7 последовательных аминокислот последовательности зрелого полипептида, даже предпочтительнее, по меньшей мере, 10 таких последовательных аминокислот. Они, по существу, происходят от внеклеточного домена рецептора. В предпочтительном воплощении иммуноген содержит человеческий KIR2DL, NCR или другой полипептид дикого типа в липидной мембране типично на поверхности клетки. В конкретном воплощении иммуноген содержит интактные NK-клетки, в частности интактные человеческие NK-клетки, необязательно обработанные или лизированные.
Хотя антитела для лечебного применения могут содержать Fc-участки, модифицированные таким образом, что усиливается их способность связываться с рецепторами, такими как CD 16, в некоторых воплощениях антитела, потенциирующие NK-клетки, будут содержать Fc-участки, измененные таким образом, что уменьшается их аффинность к Fc-рецепторам, посредством чего уменьшается вероятность того, что сами NK-клетки, связанные антителами, будут связываться и лизироваться.
Антитела, блокирующие KIR2DL-penenTopbi NK-клеток, можно получить способами, включающими:
i) иммунизацию животного, не являющегося человеком, иммуногеном, содержащим полипептид KIR2DL;
ii) получение моноклональных антител от указанного животного, где указанные моноклональные антитела связывают указанный полипептид KIR2DL;
iii) отбор моноклональных антител со стадии (ii), перекрестно взаимодействующих с, по меньшей мере, двумя различными серотипами полипептидов KIR2DL; и
iv) отбор моноклональных антител со стадии (iii), ингибирующих опосредованное KIR2DL ингибирование NK-клеток.
Порядок осуществления стадий (iii) и (iv) может быть изменен. Необязательно способ также может включать дополнительные стадии получения фрагментов или производных моноклональных антител, как описано ниже.
В другом варианте способ включает:
i) отбор из библиотеки или репертуара моноклональных антител, или их фрагментов, или производных, перекрестно взаимодействующих с, по меньшей мере, двумя различными серотипами полипептидов KIR2DL; и
ii) отбор антител со стадии (i), ингибирующих опосредованное KIR2DL ингибирование NK-клеток.
Следует иметь в виду, что любой из указанных способов можно использовать для отбора любых антител или фрагментов антител, специфичных для любой группы (ингибирующих или активирующих) рецепторов NK-клеток с общими одним или несколькими эпитопами. Например, подобные способы можно использовать для получения антител, блокирующих KIR3DL и/или NKG2A/C рецепторы NK-клеток, или стимулирующих активирующий рецептор NK-клеток.
В предпочтительном воплощении животным, не являющимся человеком, используемым в указанных способах или при получении любых описанных в данном описании антител, является млекопитающее, такое как грызун (например, мышь, крыса и т.д.), корова, свинья, лошадь, кролик, коза, овца и т.д.
Также любые антитела из описанных в данном описании можно генетически модифицировать или обработать методами генной инженерии, чтобы они были подходящими для человека, например гуманизированными, химерными или человеческими антителами. Способы гуманизации антител хорошо известны в технике. Как правило, гуманизированное антитело по настоящему изобретению содержит один или несколько аминокислотных остатков, встроенных в него из первоначального антитела. Такие мышиные или не относящиеся к человеку аминокислотные остатки часто называют "внесенными" (import) остатками, которые типично берут из "внесенной" вариабельной области. Гуманизацию можно, по существу, осуществить, следуя способу Винтера (Winter) с сотрудниками (Jones et al. (1986), Nature, 321:522; Riechmann et al. (1988), Nature, 332:323; Verhoeyen et al. (1988), Science, 239: 1534). В некоторых случаях такие "гуманизированные" антитела представляют собой химерные антитела (Cabilly et al., пат. США №4816567), в которых, по существу, меньшая чем интактная человеческая, вариабельная область замещена соответствующей последовательностью из первоначального антитела. На практике гуманизированные антитела по данному изобретению типично представляют собой человеческие антитела, в которых некоторые остатки CDR и, возможно, некоторые остатки FR замещены остатками из аналогичных сайтов в первоначальном антителе.
В другом способе получения "гуманизированных" моноклональных антител в качестве мыши, используемой для иммунизации, следует использовать XenoMouse® (Abgenix, Fremont, CA). XenoMouse представляет собой мышь-хозяина, у которой собственные гены иммуноглобулинов заменены функциональными генами человеческого иммуноглобулина. Таким образом, антитела, продуцируемые такой мышью, или гибридомы, полученные из В-клеток такой мыши, уже являются гуманизированными. XenoMouse описывается в патенте США №6162963, включенном в данное описание в качестве ссылки. Аналогичный способ можно осуществить с использованием HuMAb-Mouse™ (Medarex).
Человеческие антитела также можно получить согласно различным другим методам, таким как использование для иммунизации других трансгенных животных, полученных методами генной инженерии, для экспрессии репертуара человеческих антител [Jakobovitz et al., Nature, (1993), 362:255], или отбором репертуаров антител с использованием методов фагового отображения (phage display). Такие методы известны специалистам в данной области техники и могут быть осуществлены, исходя из моноклональных антител, описанных в настоящей заявке.
Антитела настоящего изобретения также можно дериватизировать до "химерных" антител (иммуноглобулинов), в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в первоначальном антителе, в то время как остальная(ые) часть(и) цепи(ей) идентична(ы) или гомологична(ы) соответствующим последовательностям в антителах, полученных от другого вида или принадлежащих к другому классу или подклассу антител, а также фрагментов таких антител, до тех пор, пока они не будут проявлять желательную биологическую активность (Cabilly et al., см. выше; Morrison et al. (1984), Proc. Natl. Acad. Sci, 81:6851).
Также следует иметь в виду, что когда соединение, блокирующее ингибирующий рецептор NK-клетки или стимулирующее активирующий рецептор NK-клетки, представляет собой антитело, такое антитело может быть поликлональным или предпочтительно моноклональным. Антитела можно получить с помощью гибридом или методами клеточной инженерии для экспрессии нужных вариабельных и константных областей. Антитело может представлять собой одноцепочечное антитело или другое производное антитела, сохраняющее антиген-специфичность и меньший шарнирный участок или его вариант. Антитело может представлять собой полифункциональное антитело, рекомбинантное антитело, гуманизированное антитело или его фрагмент или производное. Указанные его фрагмент или производное предпочтительно выбирают из числа Fab-фрагмента, Fab'2-фрагмента, CDR и ScFv. Предпочтительно фрагмент является антигенсвязывающим фрагментом. Антитела, содержащие фрагмент антитела, также включают биспецифические антитела, но не ограничиваются указанным. Одним из примеров является биспецифическое антитело, содержащее антигенсвязывающий участок, специфический для активирующего рецептора, и антигенсвязывающий участок, специфический для опухолевого антигена (см. публикацию РСТ № WO 01/71005, включенную в данное описание в качестве ссылки).
Композиция и введение
Изобретение относится к композиции, содержащей, по меньшей мере, одно соединение, предпочтительно антитело или его фрагмент, блокирующее ингибирующий рецептор или стимулирующее активирующий рецептор NK-клетки, и антитела для лечебных целей, применению указанной композиции для повышения эффективности антител для лечебных целей, усиления ADCC у субъекта, которого лечат антителами для лечебных целей, или для лечения субъекта с заболеванием, в частности заболеванием, при котором требуется устранение клеток-мишеней, предпочтительно зараженных клеток, таких как клетки, зараженные вирусом, опухолевые клетки или другие патогенные клетки. Предпочтительно заболевание выбирают из группы, состоящей из рака, аутоиммунного заболевания, воспалительного заболевания, вирусного заболевания. К заболеванию также относится отторжение трансплантата, в частности отторжение аллотрансплантата, и болезнь "трансплантат против хозяина" (GVHD).
Конкретнее, для лечения заболевания требуется устранение клеток-мишеней предпочтительно зараженных клеток, таких как клетки, зараженные вирусом, опухолевые клетки или другие патогенные клетки. Предпочтительно заболевание представляет собой рак, инфекции или иммунное заболевание. Предпочтительнее заболевание выбирают из группы, состоящей из ракового заболевания, аутоиммунного заболевания, воспалительного заболевания, вирусного заболевания. К заболеванию также относится отторжение трансплантата, в частности отторжение аллотрансплантата, и болезнь "трансплантат против хозяина" (GVHD).
Указанные заболевания включают опухолевую прогрессию гемопоэтических клеток. Необязательно указанные заболевания выбирают из группы, состоящей из лимфобластного лейкоза, острого и хронического миелоидного лейкоза, лимфомы Ходжкина, неходжкинской лимфомы, миелодиспластического синдрома, множественной миеломы и хронического лимфоцитарного лейкоза. Указанные заболевания также включают раковые заболевания ENT, колоректальный рак, рак молочной железы, эпителиальный рак. Указанные заболевания включают заражение CMV и гепатит В. Указанные заболевания включают болезнь Крона, ревматоидный артрит, астму, псориаз, рассеянный склероз или диабет. В частности, можно лечить любое заболевание из перечисленных в таблице, приведенной выше.
Указанные антитела для лечебных целей могут связываться CD 16 предпочтительно через их Fc-участок. Предпочтительно указанные антитела для лечебных целей содержат часть человеческого IgG1 или IgG3, в частности моноклональные антитела или их фрагменты, также предпочтительно человеческие, гуманизированные или химерные антитела или их фрагменты, например ритуксимаб.
Указанное соединение, предпочтительно антитела или их фрагменты, блокирующее ингибирующий рецептор или стимулирующее активирующий рецептор NK-клетки, связывается, по меньшей мере, с одним из человеческих рецепторов KIR, NKG2A/C, NCR или NKG2D и или ингибирует опосредованное родственными KIR2DL, KIR3DL и/или NKG2A/C ингибирование цитотоксичности NK-клеток, или стимулирует опосредованную родственными NCR или NKG2D активацию цитотоксичности NK-клеток. В одном предпочтительном воплощении используют человеческий рецептор KIR2DL, например рецептор, выбранный из группы, состоящей из человеческих рецепторов KIR2DL1, KIR2DL2, KIR2DL3, или человеческий рецептор KIR3DL, например рецептор, выбранный из группы, состоящей из KIR3DL1 и KIR3DL2.
В одном предпочтительном воплощении соединение, потенциирующее NK-клетку, связывается с, по меньшей мере, одним из человеческих рецепторов KIR2DL и ингибирует опосредованное родственными KIR2DL ингибирование цитотоксичности NK-клеток. Предпочтительно человеческий рецептор KIR2DL выбирают из группы, состоящей из человеческих рецепторов KIR2DL1, KIR2DL2, KIR2DL3. В предпочтительном воплощении соединение, предпочтительно антитела или их фрагменты, связывает общую детерминанту человеческих рецепторов KIR2DL и ингибирует опосредованное KIR2DL ингибирование цитотоксичности NK-клеток. Предпочтительнее указанное соединение, предпочтительно антитела, связывает общую детерминанту человеческих рецепторов KIR2DL1, KIR2DL2, KIR2DL3 и ингибирует опосредованное KIR2DL1, KIR2DL2, KIR2DL3 ингибирование цитотоксичности NK-клеток. В частном воплощении указанное соединение, предпочтительно антитела, ингибирует связывание аллельной молекулы HLA-C, содержащей остаток Lys в позиции 80, с человеческим рецептором KIR2DL1, и связывание аллельной молекулы HLA-C, содержащей остаток Asn в позиции 80, с человеческими рецепторами KIR2DL2 и KIR2DL3. В другом частном воплощении антитела связываются с тем же эпитопом, что и моноклональные антитела DF200, продуцируемые гибридомой DF200. Необязательно антитела конкурируют с моноклональными антителами DF200, продуцируемыми гибридомой DF200, за связывание с KIR-рецептором на поверхности человеческой NK-клетки. В одном предпочтительном воплощении антитела представляют собой моноклональные антитела DF200, продуцируемые гибридомой DF200. В другом воплощении антитела конкурируют с или связываются с тем же эпитопом, что и моноклональные антитела ЕВ6.
Композиция по настоящему изобретению может содержать сочетание нескольких соединений, предпочтительно антител или их фрагментов, блокирующих различные ингибирующие рецепторы NK-клеток и/или стимулирующие один или несколько активирующих рецепторов NK-клеток. Предпочтительно соединения, предпочтительно антитела или их фрагменты, блокирующие ингибирующие рецепторы NK-клеток, специфичны для ингибирующего рецептора, выбранного из числа KIR2DL1, KIR2DL2, KIR2DL3, KIR3DL1, KIR3DL2, NKG2A и NKG2C и способны ингибировать опосредованное родственными KIR или NKG2A/C ингибирование цитотоксичности NK-клеток. Предпочтительнее сочетание "нейтрализующих" соединений способно ингибировать опосредованное KIR2DL1, KIR2DL2 или KIR2DL3 ингибирование цитотоксичности NK-клеток. За счет сочетания соединений максимальное число различных ингибирующих рецепторов будет блокироваться у максимального числа пациентов. Также можно использовать сочетания соединений, стимулирующих различные активирующие соединения (или, как в случае ингибирующих рецепторов, связываться с различными эпитопами в одном рецепторе), например соединения, которые вместе приводят к активации любой комбинации двух или большего числа рецепторов, выбранных из группы, состоящей из NKp30, NKp44, NKp46 и NKG2D. Также можно использовать сочетания, содержащие одно или несколько соединений, блокирующих ингибирующий рецептор, и одно или несколько соединений, стимулирующих активирующий рецептор. Как описано ниже, в предпочтительном воплощении можно получить от пациента образец NK-клеток до применения способов настоящего изобретения, и можно оценить реактивность NK-клеток для различных сочетаний соединений, например, в присутствии клеток-мишеней и антител для лечебных целей.
Композиции данного изобретения могут содержать любой фармацевтически приемлемый носитель или эксципиент, типично буфер, изотонические растворы, водные суспензии, необязательно с добавлением стабилизаторов, консервантов и т.д. Типичная композиция содержит физиологический раствор и необязательно защитное или стабилизирующее вещество, такое как высокомолекулярный белок (например, человеческий сывороточный альбумин).
Также предоставляются наборы, содержащие любое сочетание одного или нескольких видов антител для лечебного применения и одного или нескольких соединений, потенициирующих NK-клетки, и предпочтительно инструкции по их применению.
Согласно способам и композициям настоящего изобретения соединения, предпочтительно антитела или их фрагменты, блокирующие ингибирующий рецептор или стимулирующие активирующий рецептор NK-клетки, и антитела для лечебных целей вводят в "эффективном" или "терапевтически эффективном" количестве.
Эффективное количество антител для лечебных целей для реципиента может составлять от примерно 0,1 мг/кг до примерно 20 мг/кг. Однако эффективное количество антител зависит от формы антител (полный Ig или фрагменты), аффинности mAb и фармакокинетических параметров, которые необходимо определить для каждого определенного вида антител.
Эффективное количество соединения, предпочтительно антител или их фрагментов, блокирующего ингибирующий рецептор или стимулирующего активирующий рецептор NK-клетки, вводимое реципиенту, может составлять от примерно 0,1 мг/кг до примерно 20 мг/кг. Однако эффективное количество антител зависит от формы антител (полный Ig или фрагменты), аффинности mAb и фармакокинетических параметров, которые необходимо определить для каждого определенного вида антител.
В важном воплощении изобретения применение соединений настоящего изобретения может позволить достичь лечебной эффективности с уменьшенными дозами антител для лечебных целей применения. Применение (например, дозировка, схема введения) антител для лечебных целей может ограничиваться побочным действием, например, в случае ритуксимаба, лихорадкой, головной болью, стерторозным дыханием, падением кровяного давления и другими. Соответственно хотя многим пациентам стандартная доза антител для лечебных целей будет вводиться в сочетании с описанными в данном описании соединениями, потенциирующими NK-клетки (т.е. рекомендованной дозе в отсутствие каких-либо других соединений), посредством этого усиливается эффективность стандартной дозы у пациентов, нуждающихся даже в еще большей лечебной эффективности; у других пациентов, например, которые страдают от побочного действия, введение соединений настоящего изобретения позволит достичь лечебной эффективности при уменьшенной дозе антител для лечебных целей и посредством этого избежать побочного действия. На практике практикующий врач сможет установить идеальную дозу и схему введения антител для лечебных целей и соединения, потенциирующего NK-клетки, для данного пациента, например лечебную стратегию, которая будет наиболее подходящей с точки зрения особых потребностей и общего состояния пациента. Доступны многие ссылки для руководства при установлении подходящих дозировок как для антител для лечебных целей, так и для соединений, потенциирующих NK-клетки, например Remington: The Science and Practice of Pharmacy, by Gennaro (2003), ISBN: 0781750253; Goodman and Gilmans, The Pharmacological Basis of Therapeutics, be Hardman, Limbird & Gilman (2001), ISBN: 0071354697; Rawlins E.A., editor, "Bentley's Textbook of Pharmaceutics", London: Bailliere, Tindall and Сох (1977) и другие издания.
В одном воплощении практикующий врач может постепенно снижать количество антител для лечебных целей, которые дают в сочетании с введением какого-либо соединения, потенциирующего NK-клетки, из числа соединений настоящего изобретения, в смысле или дозировки или частоты введения и контролировать эффективность антител для лечебных целей; например, контролировать активность NK-клеток, контролировать наличие у пациента клеток-мишеней, контролировать различные клинические показания, или любым другим способом, и, с учетом результатов контроля, подбирать относительные концентрации или способы введения антител для лечебных целей и/или соединения, потенциирующего NK-клетки, для оптимизации лечебной эффективности и ограничения побочного действия.
В другом ряду воплощений NK-клетки будут получать от пациента до введения антител для лечебных целей и соединений, потенциирующих NK-клетки (и, в подходящем случае, во время лечения), и оценивать для определения наиболее подходящего соединения или набора соединений, используемых для максимальной эффективности. Например, можно установить идентичность ингибирующих и активирующих рецепторов, присутствующих на NK-клетках, и вводимые соединения, которые специфически локализуются на наиболее заметных рецепторах. С другой стороны, полученные NK-клетки можно инкубировать с антителами для лечебных целей и клетками-мишенями и можно оценить способность одного или нескольких соединений усиливать исчезновение клеток-мишеней. Затем любое одно или несколько соединений, которые являются наиболее эффективными в усилении исчезновения in vitro, можно отобрать для применения в способах настоящего изобретения.
Подходящие дозы соединений и/или антител для лечебных целей также можно, как правило, определить in vitro или на животных моделях, например in vitro инкубацией антител для лечебных целей в различных концентрациях в присутствии клеток-мишеней, NK-клеток (предпочтительно человеческих NK-клеток), необязательно других иммунных клеток и различных концентраций одного или нескольких соединений, потенциирующих NK-клетки, и оценивая степень или скорость исчезновения клеток-мишеней в различных условиях с использованием стандартных анализов (например, описанных в разделе примеров). С другой стороны, можно давать животным моделям различных заболеваний, которые можно лечить антителами (например, животной модели NHL в случае ритуксимаба), различные дозировки антител для лечебных целей вместе с различными дозировками описанных в данном описании соединений и можно оценить эффективность антител при лечении животных (например, по определению любым подходящим клиническим, клеточным или молекулярным анализом или критерием).
Композицию по настоящему изобретению можно инъецировать непосредственно субъекту типично внутривенным, интраперитонеальным, интраартериальным, внутримышечным или трансдермальным путем. Показано, что с композицией данного изобретения можно использовать некоторые моноклональные антитела, эффективные в клинических ситуациях, такие как ритуксан (ритуксимаб) или ксолаир (омализумаб), и по схожим схемам введения (т.е. композициям, и/или дозам, и/или протоколам введения).
Кроме того композиции данного изобретения также могут включать или могут использоваться в сочетании с другими активными веществами или лечебными программами, такими как химиотерапия или другие виды иммунотерапии, или одновременно, или последовательно.
В конкретном предпочтительном примере способ изобретения также включает одну или несколько инъекций двух или большего числа соединений, блокирующих ингибирующий рецептор или стимулирующих активирующий рецептор NK-клетки. Таким образом, указанные два или большее число соединений можно использовать в сочетании. Это может послужить для того, чтобы вызвать еще большее увеличение ADCC и эффективности антител для лечебных целей, и/или может послужить для того, чтобы уменьшить дозировку определенного соединения, блокирующего ингибирующий рецептор или стимулирующего активирующий рецептор NK-клетки. Например, известно, что такие соединения, как IL-1, токсичны в повышенных дозах. Следовательно, изобретение относится предпочтительно к способу лечения заболевания у субъекта, нуждающегося в таком лечении, включающему:
a) введение указанному субъекту, по меньшей мере, двух соединений, предпочтительно антител или их фрагментов, блокирующих ингибирующий рецептор или стимулирующих активирующий рецептор NK-клетки, и
b) введение указанному субъекту антител для лечебных целей.
Например, предпочтительной является схема, когда указанные два соединения представляют собой:
i) первое соединение, выбранное из группы, состоящей из антител, стимулирующих NCR- или МК020-рецептор или активирующих KIR-рецептор, и антител, блокирующих ингибирующий NCR- или NKG2D-рецептор, и
ii) второе соединение, выбранное из группы, состоящей из IL-12, IL-15, IL-18 и IL-21. Следовательно, изобретение также относится к способу лечения заболевания у субъекта, нуждающегося в таком лечении, включающему а) введение указанному субъекту соединения по настоящему изобретению, предпочтительно антител или их фрагментов, блокирующего ингибирующий рецептор или стимулирующего активирующий рецептор NK-клетки, b) введение указанному субъекту антител для лечебных целей и с) введение указанному субъекту IL-2. IL-2 доступен от Research Diagnostics, NJ, RDI-202, или Chiron Corp. (Emerville, CA).
Цитокин можно вводить согласно любой подходящей схеме введения и можно вводить до, одновременно и/или после введения соединения, блокирующего ингибирующий рецептор или стимулирующего активирующий рецептор NK-клетки, и до, одновременно и/или после введения антител для лечебного применения. В типичном примере цитокин вводят ежедневно в течение 5-10 дней, причем цитокин(ы) сначала инъецируют в тот же день, что и первую инъекцию соединения, блокирующего ингибирующий рецептор или стимулирующего активирующий рецептор NK-клетки. Указанный способ предпочтительно включает одну или две инъекции цитокин(ов) в день подкожным способом.
Дозировка цитокина будет выбираться в зависимости от состояния пациента, которого лечат. В предпочтительных примерах можно использовать относительно низкую дозу цитокина. Например, эффективная доза типично составляет менее 1 миллиона единиц цитокина(ов) на квадратный метр в сутки, когда цитокинсодержащую фармацевтическую композицию используют для ежедневной подкожной инъекции. В предпочтительном примере IL-2 инъецируют подкожно ежесуточными дозами менее 1 миллиона единиц/м2 в течение 5-10 дней. Другие подробности применения цитокинов описываются в публикации Международного патента № РСТ/ЕР/0314716 и заявке на патент США №60/435344, озаглавленной "Фармацевтические композиции, оказывающие действие на пролиферацию NK-клеток, и способ их применения", включенных в данное описание в качестве ссылок.
Также следует иметь в виду, что антитела для лечебных целей и соединения, потенциирующие NK-клетки, можно вводить совместно, например совместно инъецировать, или можно вводить одновременно, но в разных композициях, или можно вводить независимо, например соединения вводят за часы, дни, недели до или после введения соединения.
Другие аспекты и преимущества изобретения раскрываются в приведенном далее экспериментальном разделе, который следует рассматривать как пояснительный и не ограничивающий объем данной заявки.
Примеры
Пример 1. Получение антител pan KIR2DL
Очистка PBL и получение поликлоналъных или клепальных NK-клеточных линий.
Лимфоциты периферийной крови (PBL, peripheral blood tymphocytes) получают от здоровых доноров путем центрифугирования в градиенте плотности с фиколлом Hypaque и удаления прикрепляющихся к пластику клеток. Для того чтобы получить больше NK-клеток, PBLs инкубируют с mAb против CD3, против CD4 и против HLA-DR (30 мин при 4°С), а затем с козьими антимышиными магнитными гранулами (Dynal) (30 мин при 4°С), и способами иммуномагнитной селекции, известными в технике (Pende et al., 1999). CD3 минус, CD4 минус и DR минус клетки культивируют на подслое облученных питающих клеток в присутствии 100 Е/мл интерлейкина 2 (Proleukin, Chiron Corporation) и 1,5 нг/мл фитогемагглютинина A (Gibco BRL) и получают поликлональные популяции NK-клеток. NK-Клетки клонируют методом серийных разведении, и клоны NK-клеток характеризуют методом проточной цитометрии на экспрессию рецепторов клеточной поверхности.
В данном исследовании используют следующие клоны:
- CPU, CN5 и CN505, представляющие собой KIR2DL1-положительные клоны, окрашивающиеся антителами ЕВ6 или ХА-141;
- CN12 и CN502, представляющие собой KIR2DL3-положительные клоны, окрашивающиеся антителами GL-183.
Анализ методом проточной цитометрии
mAb используют для получения в лаборатории JT3A (IgG2a, против CD3), ЕВ6 и GL-183 (IgGI, против KIR2DL1 и KIR2DL3 соответственно), ХА-141 IgM против KIR2DL1 (такая же специфичность при сравнении с ЕВ6, против CD4 (НР2.6), против DR (D1.12, IgG2a). Вместо JT3A, НР2.6 и DR1.12 можно использовать коммерчески доступные mAb той же специфичности, например, от Beckman Coulter Inc., Fuller-ton, CA. ХА-141 коммерчески недоступны, но можно использовать ЕВ6 для контроля за восстановлением лизиса, как описано в Moretta et al., 1993.
Проточная цитометрия
Клетки окрашивают соответствующими антителами (30 мин при 4°С), затем РЕ или FITC конъюгированными поликлональными антимышиными антителами (Southern Biotechnology Associates Inc.). Образцы анализируют цитофлуорометрическим анализом на приборе FACSAN (Becton Dickinson, Mountain View, CA).
Цитотоксические эксперименты
Цитолитическую активность NK-клонов оценивают стандартным анализом на высвобождение 51Сг за 4 часа, в котором эффекторные NK-клетки испытывают на Cw3-или Cw4-пoлoжитeльныx клеточных линиях, известных своей чувствительностью к лизису NK-клеток. Все мишени используют в количестве 5000 клеток на лунку в титрационном микропланшете, и соотношение эффектора и мишеней указывается на фигурах (как правило, 4 эффектора на клетки-мишени). Цитолитический анализ осуществляют с супернатантом указанных моноклональных антител при разведении 1/2 или без него. Процедура, по существу, такая же, какая описана в Moretta et al., 1993.
Получение новых mAb
Получают mAb иммунизацией 5-недельных Balb С мышей с активацией поликлональных или моноклональных NK-клеточных линий, как описано в Moretta et al., 1990; работа включена в данное описание в качестве ссылки. После слияния различных клеток mAb сначала отбирают по их способности давать перекрестную реакцию с ЕВ6- и GL 183-положительными NK-клеточными линиями и клонами. Затем положительные моноклональные антитела подвергают скринингу на их способность восстанавливать лизис ЕВ6-положительными или CL183-положительными NK-клонами Cw4- или Cw3-положительных мишеней соответственно.
DF200 - новые моноклональные антитела против общей детерминанты KIR2DL человеческих NK-рецепторов
Обнаружено, что одно из моноклональных антител mAb DF200 взаимодействует с различными членами семейства KIR, в том числе KIR2DL1, KIR2DL2/3. Что касается окрашивания NK-клеток mAb DF200, то, как KIR2DL1+, так и KIR2DL2/3+ ярко окрашиваются (фигура 1).
NK-клоны, экспрессирующие тот или другой (или даже оба) из HLA класс I-специфические ингибирующие рецепторы, используют в качестве эффекторных клеток против клеток-мишеней, экспрессирующих один или несколько аллелей HLA-C. Как ожидается, KIR2DL1+NK-клоны показывают (displayed) слабую цитолитическую активность против клеток-мишеней, экспрессирующих HLA-Cw4, a KIR2DL3+ NK-клоны показывают слабую активность (или не активны) против Cw3-положительных мишеней. Однако в присутствии mAb DF200 (используемых для «маскировки» их KIR2DL-рецепторов) NK-клоны становятся неспособны распознавать их HLA-C-лиганды и показывают сильную цитолитическую активность на Cw3- или Сw4-мишенях.
Например, клеточная линия CIR (клеточная линия CW4+ EBV, ATCC № CRL 1993) не убивается KIR2DL1+ NK-клонами (CN5/CN505), но ингибирование можно эффективно вернуть на прежний уровень при использовании DF200 или обычных mAb против KIR2DL1. С другой стороны, NK-клоны, экспрессирующие фенотип KIR2DL2/3+ KIR2DL1 (CN12), эффективно убивают CIR, и на такую их активность не влияют mAb DF200 (фигура 2). Подобные результаты можно получить с KIR2DL2- или KIR2DL3-положительными NK-клонами на Cw3-положительных мишенях.
Анализ Biacore взаимодействий mAb DF200/KIR 2DL1 и mAb DF200/KIR 2DL3
Материалы и методы
Получение и очистка рекомбинантных белков.
Рекомбинантные белки KIR2DL1 и KIR2DL3 получают в Е. coli. Молекулу кДНК, кодирующую полный внеклеточный домен KIR2DL1 и KIR2DL3, амплифицируют методом ПЦР из вектора pCDM8 клон 71.11 (Biassoni et al., 1993; работа включена в данное описание в качестве ссылки) и вектора RSVS(gpt)183 клон 6 (Wagman et al., 1995; работа включена в данное описание в качестве ссылки) соответственно с использованием следующих праймеров:
- смыслового 5'-GGAATTCCAGGAGGAATTTAAAATGCATGAGGGAGTCCACAG-3';
- антисмыслового 5'-CCCAAGCTTGGGTTATGTGACAGAAACAAGCAGTGG-3'.
Их клонируют в экспрессирующий вектор pML1 в рамке с последовательностью, кодирующей сигнал биотинилирования (Saulquin et al., 2003; работа включена в данное описание в качестве ссылки).
Экспрессию белков осуществляют в бактериальном штамме BL21(DE3) (Invitrogen). Трансфицированные бактерии выращивают до OD600≈0,6 при 37°С в среде с добавлением ампициллина (100 мкг/мл) и индуцированием 1 мМ IPTG.
Белки извлекают из телец включений (inclusion bodies) в денатурирующих условиях (8 М мочевины). Рефолдинг (новое свертывание третичной структуры) рекомбинантных белков осуществляют в буфере трис 20 мМ, рН 7,8, 150 мМ NaCl, содержащем L-аргинин (400 мМ, Sigma) и β-меркаптоэтанол (1 мМ), при комнатной температуре, снижая концентрацию мочевины путем шестистадийного диализа (4, 3, 2, 1, 0,5 и 0 М мочевины соответственно). Во время стадий диализа с 0,5 и 0 М мочевины добавляют восстановленный и окисленный глутатион (5 мМ и 0,5 мМ, соответственно Sigma). Наконец, белки экстенсивно диализуют против буфера трис 10 мМ, рН 7,5, 150 мМ NaCl. Растворимые, вновь свернутые белки концентрируют и затем очищают на колонке с супердексом 200 методом замещающей хроматографии (Pharmacia; система АКТА).
Анализ Biacore.
Измерения методом поверхностного плазменного резонанса осуществляют на приборе Biacore (Biacore, оптический биосенсор). Во всех экспериментах с Biacore в качестве рабочего буфера служит буфер HBS с добавлением 0,05% поверхностно-активного вещества Р20.
Иммобилизация белков.
Рекомбинантные белки KIR 2DL1 и KIR 2DL3 иммобилизуют ковалентно на карбоксильных группах в слое декстрана на сенсорном чипе СМ5 (Biacore). Поверхность сенсорного чипа активируют EDC/NHS (гидрохлорид N-этил-N'-(3-диметиламино-пропил)карбодиимидо гидрохлорид и N-гидроксисукцинимид, Biacore). Белки инъецируют в связующем буфере (coupling buffer, 10 мМ ацетата, рН 4,5). Дезактивацию оставшихся активированных групп осуществляют с использованием 100 мМ этаноламина, рН 8 (Biacore).
Измерения аффинности.
Для кинетических измерений на иммобилизованные образцы наносят различные концентрации растворимых антител (от 10-7 до 4×10-10 М). Измерения проводят при постоянной скорости потока 20 мкл/мин. Для каждого цикла поверхность сенсорного чипа регенерируют инъекций 5 мкл 10 мМ раствора NaOH, рН 11.
Для оценки результатов анализа используют программу BIAlogue Kinetics Evaluation (BIAevaluation 3.1).
Результаты
Анализ методом BIAcore связывания mAb DF200 с иммобилизованными KIR2DL1 и KIR2DL3
KD: константа диссоциации
Растворимый аналит (40 мкл при разных концентрациях) инъецируют со скоростью потока 20 мкл/мин в буфере HBS в слои декстрана с отражательной способностью 500 или 540 единиц (RU, reflectance units) и 1000 или 700 RU для KIR2DL1 и KIR2DL3 соответственно. Данные представляют по 6 независимым экспериментам.
Пример 2. Усиление ADCC за счет использования сочетания ритуксана и mAb против KIR
Получение человеческих NK-клонов.
Мононуклеарные клетки крови, лишенные Т-клеток с помощью отрицательной СD3-иммуномагнитной селекции (Miltenyi), высевают в условиях серийных разведений, активируют фитогемагглютинином (PHA) (Biochrom KG, Берлин, Германия) и культивируют с интерлейкином (IL)-2 (Chiron B.V., Амстердам, Нидерланды) и облученными питающими клетками. Эффективность клонирования эквивалентна для всех доноров и колеблется от 1 к 5 до 1 к 10 высеянных NK-клеток. Клонированные NK-клетки подвергают скринингу на аллореактивность стандартным методом определения цитотоксичности по высвобождению 51Cr против трансформированных вирусом Эпштейна-Барр линий В-лимфобластоидных клеток известного HLA типа при соотношении эффектора к мишени, равном 10:1. Клоны, обнаруживающие ≥30% лизиса, оценивают как аллореактивные. Как правило, клоны обнаруживают или <5%, или >40% лизиса.
Усиление ADCC клона KIR2DLI-положительных NK-клеток, опосредованное ритуксаном
Цитолитическую активность NK-клона оценивают стандартным анализом высвобождения 51Сr за 4 часа, в котором эффекторные NK-клетки испытывают на Cw4-или Cw3-положительных EBV-клеточных линиях (СD20-положительных), известных по их чувствительности к лизису NK-клетками. Все мишени используют в количестве 5000 клеток на лунку в микропланшете для титрования, а соотношение эффектора (клон NK-клеток) и мишеней указывается на фигуре 3. В некоторых экспериментах к смеси эффектора и мишени добавляют химерные антитела для лечебных целей ритуксимаб (ритуксан. Idec) в количестве 5 мкг/мл. В некоторых экспериментах к смеси эффектора и мишени добавляют антитела ЕВ6 (против KIR2DLI) в количестве 10 мкг/мл.
Данный эксперимент показывает, что один ритуксан, по существу, не опосредует ADCC KIR2DLI-положительного NK-клона на Сw4-положительных мишенях. ADCC KIR2DLI-положительного NK-клона существенно усиливается в присутствии антител против KIR2DLI.
Пример 3. Усиление ADCC клона КIR2DL1-положительных NK-клеток, опосредованное кампатом.
В эксперименте, подобном описанному в примере 2, аутологичные Cw4+ PHA бластные клетки инкубируют в присутствии NK-клеток с добавлением алумтузумаба (кампат, Berlex), антител ЕВ6 (100 мкг/мл) или кампата и ЕВ6. Результаты, приведенные на фигуре 4, показывают, что присутствие ЕВ6 существенно усиливает способность NK-клеток устранять аутологичные клетки: приблизительно 4% клеток-мишеней лизируется в присутствии одного кампата, в то время как свыше 30% клеток подвергается лизису в присутствии кампата с добавление ЕВ6.
Ссылки
Biassoni R., Verdiani S., Cambiaggi A., Romeo P.H., Ferrini S., Moretta L. Human CD3-CD16+ natural killer cells express the hGATA-3 Т cell transcription factor and an unrearranged 2.3-kb TcR delta transcript. Eur. J. Immunol., 1993,23 (5):1083-1087.
Karre К., Ljunggren H.G., Piontek G., Kiessling R. Selective rejection ofH-2-deficient lymphoma variants suggests alternative immune defence strategy. Nature, 1986,319:675-678.
Larder L.L. NK cell receptors. Annu. Rev. ImmunoL, 1998,16:359-393.
Moretta A., Bottino C., Pende D., Tripodi G., Tambussi G., Viale O., Orengo A., Barbaresi M., Merii A., Ciceone E., et al. Identification of four subsets of human CD3-CD16+ natural killer (NK) cells by the expression ofclonally distributed functional surface molecules: correlation between subset assignment of NK clones and ability to mediate specific alloantigen recognition. J. Exp. Med. 1990,172:1589-1598.
Moretta A., Vitale M., Bottino C., Orengo A. M., Morelli L., Augugliaro R., Barbaresi M., Ciceone E., and Moretta L. P58 molecules as putative receptors for major histocompatibility complex (MHC) class I molecules in human natural killer (NK) cells. Anti-p58 antibodies reconstitute lysis of MHC class I-protected cells in NK clones displaying different specificities. J Exp Med. 1993,178:597-604.
Moretta A., Moretta L. HLA class I specific inhibitory receptors. Curr. Opin. ImmunoL 1997, 9:694-701.
Ohien C., Kling G., Hoglund P., Hansson M., Scangos G., Bieberich C., Jay G., Karre K. Prevention ofallogeneic bone marrow graft rejection by H-2 transgene in donor mice. Science, 1989,246:666-668.
Pende D., Parolini S., Pessino A., Sivori S., Augugliaro R., Morelli L., Marcenaro E., Accame L., Malaspina A., Biassoni R., et al. Identification and molecular characterization ofNKp30, a novel triggering receptor involved in natural cytotoxicity mediated by human natural killer cells. J, Exp. Med. 1999,190:1505-1516.
Ruggeri L.; Capanni M., Urbani E., Perruccio K., Shiomchik W. D., Tosti A., Posati S., Rogaia D., Frassoni F., Aversa F., et al. Effectiveness of donor natural killer cell alloreactivity in mismatched hematopoietic transplants. Science, 2002,295:2097-2100.
Saulquin X., Gastinel L.N., Vivier E. Crystal structure of the human natural killer cell activating receptor KJR2DS2 (CD158J). J. Exp. Med. 2003,197 (7):933-938.
Valiante N.M., Lienert K., Shilling H.G., Smits B.J., Parham P. Killer cell receptors: keeping pace with MHC class I evolution. Immunol. Rev. 1997,155:155-164.
Wagtmann N., Biassoni R., Cantoni C., Verdiani S., Malnati M.S., Vitale M., Bottino C., Moretta L., Moretta A., Long E.O. Molecular clones of the p58 NK cell receptor reveal immunoglobulin-related molecules with diversity in both the extra- and intracellular domains. Immunity, 1995,2 (5):439-449.
Ward et al. Nature, 1989, 341:544.
Все публикации и заявки на патенты, цитированные в данном описании, включены в него в качестве ссылок, как если бы каждая отдельная публикация или заявка на патент конкретно и отдельно включалась в описание в качестве ссылки.
Хотя вышеизложенное изобретение описано с некоторыми подробностями для пояснения и примерами в целях ясности понимания, для специалиста в данной области техники будет очевидно, что в свете указаний данного изобретения можно осуществлять некоторые замены и модификации без отхода от сущности или объема прилагаемой формулы изобретения.
Любое сочетание описанных выше элементов во всех их возможных вариантах охватывается изобретением, если в данном описании не указано иное, или из контекста не обнаруживается явных противоречий.
Термины с определенным и неопределенным артиклем в оригинале и подобные соотношения, используемые в контексте описания изобретения, следует рассматривать как употребляемые как для единственного, так и для множественного числа, если не указано иное, или из контекста не обнаруживается явных противоречий.
Предполагается, что перечисление интервалов величин в данном описании служит только в качестве способа сокращения обращения по отдельности к каждой величине, попадающей в указанный интервал, если в данном описании не указано иное, и каждая отдельная величина включена в описание, как если бы она цитировалась в нем отдельно. Если не указано иное, все точные величины, приведенные в данном описании, представляют соответствующие приблизительные величины (например, все точные величины, приведенные в качестве примеров в связи с определенным фактором или измерением, можно рассматривать как отражающие также соответствующее приблизительное измерение, измененное, где это подходит, наречием "примерно").
Все способы, описанные в данном описании, можно осуществить в любом подходящем порядке, если не указано иное, или из контекста не обнаруживается явных противоречий.
Применение любого и всех примеров или выражения для примеров (например, "такой, как"), приведенных в данном описании, предназначается только для лучшего пояснения изобретения и не ставит ограничения объема изобретения, если не указано иное. Нет выражений в описании изобретения, которые следует рассматривать как указывающие на то, что какой-либо элемент является незаменимым для практического осуществления изобретения, если не указано именно это.
Цитирование и включение в данное описание патентных документов сделано только для удобства и не отражает какой-либо точки зрения о пригодности, патентоспособности и/или защищенности таких патентных документов.
Описание в данной заявке любого аспекта или воплощения изобретения с использованием терминов, таких как "заключающий в себе", "имеющий", "включающий" или "содержащий", относящихся к элементу или элементам, предназначается для поддержания подобного аспекта или воплощения, которое "состоит из", "состоит, по существу, из" или "по существу, включает" такой отдельный элемент или элементы, если не указано иное, или из контекста не обнаруживается явных противоречий (например, композицию, описанную в данном изобретении, содержащую определенный элемент, следует представлять также, как композицию, описанную как состоящую из данного элемента, если не указано иное, или из контекста не обнаруживается явных противоречий).
Изобретение включает все модификации и эквиваленты предмета изобретения, перечисленные в аспектах или формуле изобретения, представленных в данном описании, в максимальной степени, допускаемой соответствующими правилами.

| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИЯ И СПОСОБ РЕГУЛИРОВАНИЯ АКТИВНОСТИ ЕСТЕСТВЕННЫХ КЛЕТОК-КИЛЛЕРОВ | 2004 |
|
RU2376315C2 |
| КОМПОЗИЦИИ И СПОСОБЫ РЕГУЛЯЦИИ КЛЕТОЧНОЙ АКТИВНОСТИ NK | 2004 |
|
RU2404993C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С РЕЦЕПТОРАМИ KIR2DL1,-2,-3 И НЕ СВЯЗЫВАЮЩИЕСЯ С РЕЦЕПТОРОМ KIR2DS4, И ИХ ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2005 |
|
RU2410396C2 |
| СЕЛЕКТИВНАЯ ЭЛИМИНАЦИЯ ЭРОЗИЙНЫХ КЛЕТОК | 2012 |
|
RU2617056C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА С ПОВЫШЕННОЙ СТАБИЛЬНОСТЬЮ | 2015 |
|
RU2684703C2 |
| СВЯЗЫВАЮЩИЕ KIR3DL2 АГЕНТЫ | 2013 |
|
RU2682449C2 |
| ЛЕЧЕНИЕ РАКОВЫХ ЗАБОЛЕВАНИЙ С ПРИМЕНЕНИЕМ АНТИ-NKG2A СРЕДСТВ | 2015 |
|
RU2721271C2 |
| СПОСОБЫ ПРИМЕНЕНИЯ АГОНИСТОВ АРО-2L-РЕЦЕПТОРОВ И АКТИВАТОРОВ NK-КЛЕТОК | 2005 |
|
RU2395294C2 |
| НЕЙТРАЛИЗАЦИЯ ИНГИБИТОРНЫХ ПУТЕЙ В ЛИМФОЦИТАХ | 2015 |
|
RU2734771C2 |
| ПРОТИВОРАКОВАЯ ТАРГЕТНАЯ ИММУНОТЕРАПИЯ С ПРИМЕНЕНИЕМ IL-12 | 2015 |
|
RU2689160C2 |
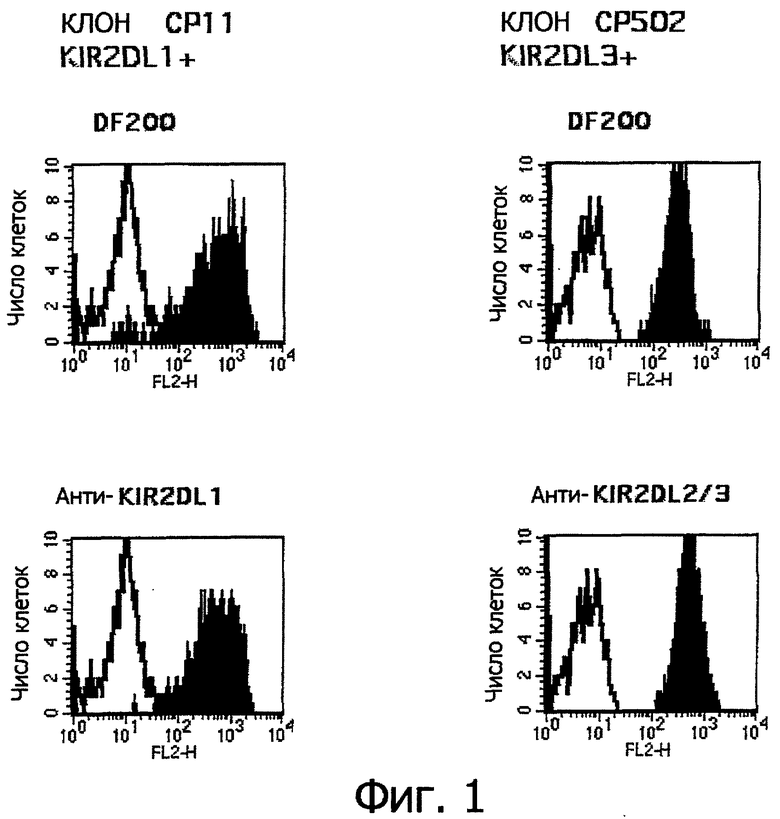



Изобретение относится к области медицины и касается способов и композиций для повышения эффективности антител для лечебных целей с использованием соединений, потенцирующих NK-клетки. Сущность изобретения включает способ лечения заболевания и фармацевтическую композицию для лечения заболевания, вызванного или обостряемого частично клетками, которые могут быть мишенями и которые могут быть устранены антителом для лечебных целей, включающие введение нуждающемуся пациенту первого антитела, блокирующего ингибирующий рецептор NK-клетки, выбранный из группы: KIR2DL1, KIR2DL2, KIR2DL3 и NKG2A и затем введения антитела для лечебных целей. Преимущество изобретения заключается в повышении эффективности лечения. 4 н. и 36 з.п. ф-лы, 1 табл., 4 ил.
1. Способ лечения заболевания, вызванного или обостряемого, по меньшей мере, частично клетками, которые могут быть мишенями и которые могут быть устранены антителом для лечебных целей, у субъекта-человека, нуждающегося в этом, включающий
a) введение указанному субъекту первого антитела, блокирующего ингибирующий рецептор NK-клетки, причем указанный ингибирующий рецептор выбран из группы, состоящей из KIR2DL1, KIR2DL2, KIR2DL3 и NKG2A; и
b) введение указанному субъекту антитела для лечебных целей, которое может связываться с CD 16 через Fc-участок указанного антитела для лечебных целей.
2. Способ по п.1, где указанное антитело для лечебных целей содержат Fc-участок человеческого IgG1 или IgG3.
3. Способ по пп.1 или 2, где указанное первое антитело представляет собой антитело или содержит его антигенсвязывающий фрагмент.
4. Способ по п.1, где указанное антитело для лечебных целей является моноклональным антителом или содержит его антигенсвязывающий фрагмент.
5. Способ по п.1, где указанное антитело для лечебных целей неконъюгировано с радиоактивной или токсичной группой.
6. Способ по п.1, где указанное первое антитело представляет собой человеческое, гуманизированное, или химерное антитело, или содержит его антигенсвязывающий фрагмент.
7. Способ по п.1, где указанное антитело для лечебных целей представляет собой человеческое, гуманизированное, или химерное антитело, или содержит его антигенсвязывающий фрагмент.
8. Способ по п.1, где указанное антитело для лечебных целей представляет собой ритуксимаб или кампат.
9. Способ по п.8, где указанное антитело представляет собой ритуксимаб, и указанное антитело вводят в дозировке менее 375 мг/м2 в неделю.
10. Способ по п.8, где указанное антитело представляет собой кампат, и указанное антитело вводят в дозировке менее 90 мг в неделю.
11. Способ по п.1, где указанное первое антитело связывается с общей детерминантой человеческих рецепторов KIR2DL1, KIR2DL2 и KIR2DL3 и ингибирует опосредованное KIR2DL1, KIR2DL2 и KIR2DL3 ингибирование цитотоксичности NK-клеток.
12. Способ по п.11, где указанное первое антитело ингибирует связывание аллельной молекулы HLA-C, содержащей остаток Lys в позиции 80, с человеческим рецептором KIR2DL1 и связывание аллельной молекулы HLA-C, содержащей остаток Asn в позиции 80, с человеческими рецепторами KIR2DL2 и KIR2DL3.
13. Способ по п.1, где указанное первое антитело связывается с тем же эпитопом, что и моноклональное антитело DF200, продуцируемое гибридомой DF200, или моноклональное антитело ЕВ6.
14. Способ по п.1, где указанное первое антитело конкурирует с моноклональным антителом DF200, продуцируемым гибридомой DF200, или моноклональным антителом ЕВ 6 за связывание с рецептором KIR на поверхности человеческой NK-клетки.
15. Способ по п.1, где указанное первое антитело представляет собой моноклональное антитело DF200, продуцируемое гибридомой DF200, или его фрагмент или производное, или моноклональное антитело ЕВ6 или его фрагмент или производное.
16. Способ по п.1, где указанное антитело для лечебных целей и указанное первое антитело вводят указанному субъекту одновременно.
17. Способ по п.1, где указанное первое антитело вводят указанному субъекту в пределах одной недели относительно введения указанного антитела для лечебных целей.
18. Способ по п.1, где указанное заболевание представляет собой рак, инфекции или иммунное заболевание.
19. Фармацевтическая композиция для лечения заболевания, вызванного или обостряемого, по меньшей мере, частично клетками, которые могут быть мишенями и которые могут быть устранены антителом для лечебных целей, содержащая
(а) антитело для лечебных целей, которое может связываться с CD 16 через Fc-участок указанного антитела для лечебных целей, (b) первое антитело, которое блокирует ингибирующий рецептор NK-клетки, причем указанный ингибирующий рецептор выбран из группы, состоящей из KIR2DL1, KIR2DL2, KIR2DL3 и NKG2A, и (с) фармацевтически приемлемый носитель.
20. Композиция по п.19, где указанное антитело для лечебных целей содержит Fc-участок человеческого IgG1 или IgG3 или Fc-участок IgG1 или IgG3 примата, не являющегося человеком.
21. Композиция по пп.19 или 20, где указанное первое антитело представляет собой антитело или содержит его антигенсвязывающий фрагмент.
22. Композиция по пп.19 или 20, где указанное первое антитело представляет собой моноклональное антитело или содержит его антигенсвязывающий фрагмент.
23. Композиция по п.19, где указанное первое антитело представляет собой человеческое, гуманизированное или химерное антитело или содержит его антигенсвязывающий фрагмент.
24. Композиция по п.19, где указанное антитело для лечебных целей представляет собой моноклональное антитело или содержит его антигенсвязывающий фрагмент.
25. Композиция по п.24, где указанное антитело для лечебных целей представляет собой человеческое, гуманизированное или химерное антитело или содержит его антигенсвязывающий фрагмент.
26. Композиция по п.24, где указанное антитело неконъюгировано с радиоактивной или токсичной группой.
27. Композиция по п.19, где указанное антитело для лечебных целей представляет собой ритуксимаб или кампат.
28. Композиция по п.19, где указанное первое антитело связывается с общей детерминантой человеческих рецепторов KIR2DL1, KIR2DL2 и KIR2DL3 и ингибирует опосредованное KIR2DL1, KIR2DL2 и KIR2DL3 ингибирование цитотоксичности NK-клеток.
29. Композиция по п.28, где указанное первое антитело ингибирует связывание аллельной молекулы HLA-C, содержащей остаток Lys в позиции 80, с человеческим рецептором KIR2DL1 и связывание аллельной молекулы HLA-C, содержащей остаток Asn в позиции 80, с человеческими рецепторами KIR2DL2 и KIR2DL3.
30. Композиция по п.19, где указанное первое антитело связывается с тем же эпитопом, что и моноклональное антитело DF200, продуцируемое гибридомой DF200, моноклональное антитело NKVSF1 или моноклональное антитело ЕВ6.
31. Композиция по п.19, где указанное первое антитело конкурирует с моноклональным антителом DF200, продуцируемым гибридомой DF200, моноклональным антителом NKVSF1, или моноклональным антителом ЕВ6 за связывание с рецептором KIR на поверхности человеческой NK-клетки.
32. Композиция по п.19, где указанное первое антитело представляет собой моноклональное антитело DF200, продуцируемое гибридомой DF200, или его фрагмент или производное, моноклональное антитело NKVSF1 или его фрагмент или производное, или моноклональное антитело ЕВ6 или его фрагмент или производное.
33. Способ отбора первого антитела для введения в сочетании с антителом для лечебных целей, включающий
i) предоставление испытываемого первого антитела, блокирующего ингибирующий рецептор NK-клетки, причем указанный ингибирующий рецептор выбран из группы, состоящей из KIR2DL1, KIR2DL2, KIR2DL3 и NKG2A;
ii) инкубацию указанного антитела для лечебных целей с клетками-мишенями, специфически распознаваемыми указанным антителом для лечебных целей, в присутствии NK-клеток и в присутствии или в отсутствии указанного испытываемого первого антитела; и
iii) оценку действия указанного первого антитела на способность указанных NK-клеток устранять указанные клетки-мишени;
где обнаружение того, что указанное первое антитело усиливает способность указанных NK-клеток устранять указанные клетки-мишени, указывает, что указанное первое антитело подходит для применения в способе по любому из пп.1-18.
34. Способ по п.33, где указанное первое антитело усиливает способность указанного антитела для лечебных целей разрушать указанные клетки-мишени на 30%.
35. Способ по п.33, где указанное первое антитело усиливает способность указанного антитела для лечебных целей разрушать указанные клетки-мишени на 50%.
36. Способ по п.33, где указанное первое антитело выбирают из группы, состоящей из антитела, фрагмента антитела, моноклонального антитела, фрагмента моноклонального антитела, гуманизированного антитела, химерного антитела и человеческого антитела.
37. Способ по п.33, где указанные клетки-мишени представляют собой раковые клетки, клетки, инфицированные вирусом, или клетки, поддерживающие аутоиммунное расстройство.
38. Способ по п.33, где указанное антитело для лечебных целей представляет собой ритуксимаб или кампат.
39. Способ повышения эффективности лечения заболевания, вызванного или обостряемого, по меньшей мере, частично клетками, которые могут быть мишенями и которые могут быть устранены антителом для лечебных целей, причем указанное лечение включает введение субъекту антитела для лечебных целей, которое может связываться с CD 16 через Fc-участок указанного антитела для лечебных целей, включающий введение указанному субъекту до, одновременно или после введения указанного антитела для лечебных целей терапевтически эффективного количества первого антитела, блокирующего ингибирующий рецептор NK-клетки, причем указанный ингибирующий рецептор выбран из группы, состоящей из KIR2DL1, KIR2DL2, KIR2DL3 и NKG2A.
40. Способ по п.39, где указанное первое антитело повышает эффективность указанного лечения за счет усиления ADCC у указанного субъекта.
| SONDEL P.M | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Cancer J | |||
| Sci | |||
| Am | |||
| Электрическое сопротивление для нагревательных приборов и нагревательный элемент для этих приборов | 1922 |
|
SU1997A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| EP 1023906 A, 02.08.2000 | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2010-08-20—Публикация
2004-07-23—Подача