ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[0001] Настоящее изобретение в целом относится к способам лечения дефицита витамина B12 и фармацевтическим композициям, применяемым для такого лечения.
УРОВЕНЬ ТЕХНИКИ
[0002] Витамин B12 важен для нормального функционирования мозга и нервной системы, а также для кроветворения (формирования крови). Витамин B12 принимает участие в метаболизме каждой клетки тела, главным образом оказывая влияние на синтез и регуляцию ДНК, а также воздействуя на синтез жирных кислот и выработку энергии. Воздействие витамина B12 до сих пор окончательно не изучено.
[0003] Цианокобаламин - наиболее стабильная и широко применяемая форма витамина B12. Цианокобаламин связан с белками плазмы и накапливается в печени. Витамин B12 выделяется в желчь и подвергается некоторой кишечно-печеночной рециркуляции. Поглощенный витамин B12 транспортируется к различным тканям посредством особых белков, транскобаламинов I и II, связывающих витамин B12. Печень - основной орган для накопления витамина B12.
[0004] Дефицит витамина B12 потенциально может вызвать серьезные и необратимые нарушения, особенно для мозга и нервной системы. Для лечения дефицита витамина B12 были разработаны таблетки для перорального применения, содержащие витамин B12. Однако многие пациенты, страдающие дефицитом витамина B12 не поддаются лечению путем перорального введения витамина B12. Существует необходимость разработки лечения для таких пациентов.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0010] Один аспект изобретения относится к способу лечения дефицита витамина B12, и включает этапы (а) приготовления фармацевтической композиции для перорального введения, содержащей (1) витамин B12 и, (2) по меньшей мере, одно вещество, выбранное из группы, состоящей из N-[8-(2-гидроксибензоил)амино]каприловой кислоты и ее фармацевтически приемлемых солей, и (б) введение фармацевтической композиции субъекту для эффективного лечения указанного дефицита витамина B12.
[0011] Другой аспект изобретения относится к фармацевтической композиции для лечения дефицита витамина B12 у субъекта, содержащей (1) витамин B12 и, (2) по меньшей мере, одно вещество, выбранное из группы, состоящей из N-[8-(2-гидроксибензоил)амино]каприловой кислоты и ее фармацевтически приемлемых солей, при этом указанный субъект не поддается существующему лечению путем перорального введения витамина B12.
[0012] Содержание патентов и публикаций, процитированных в настоящей заявке, также как и содержание документов, указанных в этих патентах и публикациях, включены в настоящую заявку посредством ссылки в разрешенных пределах.
КРАТКОЕ ОПИСАНИЕ ФИГУР
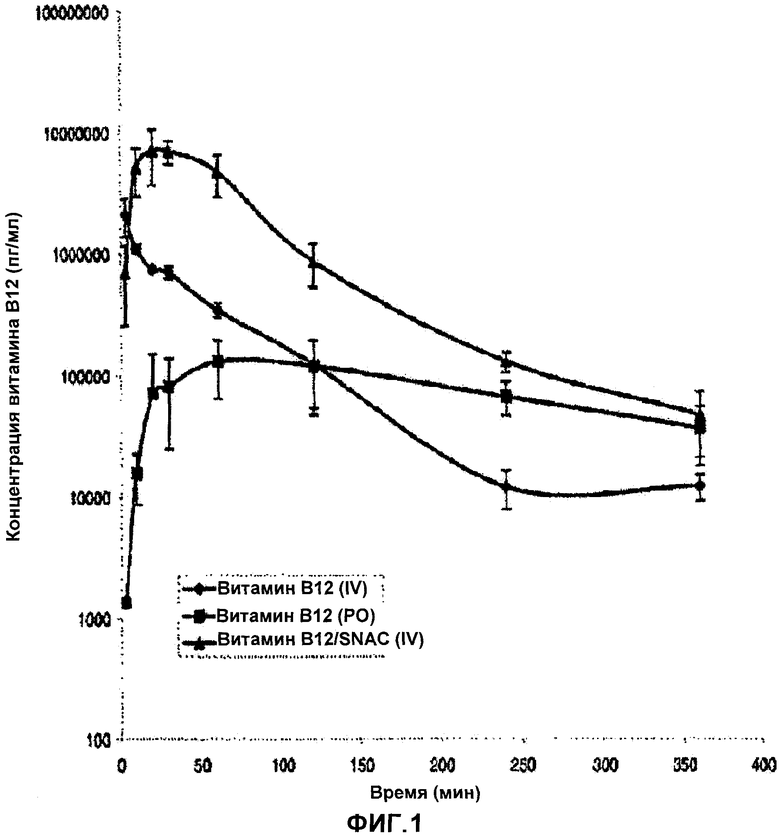
[0013] Фигура 1 представляет собой график зависимости концентрации витамина B12 в сыворотке крови от времени.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0014] Термин «SNAC», использованный в настоящей заявке, означает N-салицилоил-8-аминокаприлат натрия, 8-(N-салицилоиламино)октаноат мононатрия, мононатриевая соль N-(салицилоил)-8-аминооктановой кислоты, мононатрия N-[8-(2-феноксибензиол)амино]октаноат, Е414 мононатриевая соль или натрия 8-[(2-гидроксибензоил)амино]октаноат. Указанное соединение имеет следующую структурную формулу:
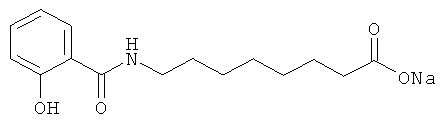
N-[8-(2-гидроксибензоил)амино]каприловая кислота характеризуется эмпирической формулой C15H21NO4.
[0015] Под термином «витамин B12» подразумевают любое вещество из группы кобальтосодержащих соединений, известных как кобаламины, включающих но не ограничивающихся указанными, цианокобаламин, гидроксокобаламин, метилкобаламин и 5-цезоксиаденозилкобаламин.
[0016] Термины «терапия» или «лечение» означают любое лечение заболевания или расстройства у млекопитающих, включая предотвращение или защиту от заболевания или расстройства, т.е. предотвращение развития клинических симптомов; ингибирование заболевания или расстройства, т.е. приостанавление или подавление развития клинических симптомов; и/или ослабление заболевания или расстройства, т.е. стимулирование регрессии клинических симптомов. Термин «млекопитающее» включает человека.
[0017] Термины «носитель, наполнитель, эмульгатор, стабилизатор, подсластитель, вкусовая добавка, разбавитель, краситель, растворитель» соответствуют определениям, представленным в «Справочнике фармацевтических эксципиентов» (4-е изд.) под редакцией Raymond С.Rowe, Paul J.Sheskey и Paul J.Welter, содержание которого включено в настоящую заявку посредством ссылки.
[0018] Термин «белок внутренний фактор» означает гликопротеин, продуцируемый париетальными клетками желудка. Он необходим для абсорбции витамина B12 далее в подвздошной кишке.
[0019] В предпочтительном варианте реализации изобретения лечение направлено на субъекты, не поддающиеся существующему лечению путем перорального введения витамина B12. Предпочтительно, чтобы для лечения применялись таблетки. В каждой такой таблетке содержится от приблизительно 0,01 мг до приблизительно 25 мг витамина B12 и от приблизительно 1 мг до приблизительно 600 мг SNAC, предпочтительно от приблизительно 0,02 мг до 25 мг витамина B12, более предпочтительно от приблизительно 0,1 мг до 20 мг витамина B12 и наиболее предпочтительно от приблизительно 0,5 мг до приблизительно 10 мг витамина B12 и от приблизительно 10 мг до 200 мг SNAC.
[0020] Предпочтительное весовое соотношение витамина B12 и SNAC в таблетке составляет от приблизительно 2:1 до приблизительно 1:700, более предпочтительно от приблизительно 1:2 до приблизительно 1:600 или от приблизительно 1:3 до приблизительно 1:20, и наиболее предпочтительно от приблизительно 1:4 до приблизительно 1:10.
[0021] В предпочтительном варианте реализации изобретения фармацевтическая композиция предложена в форме таблеток. Предпочтительно, каждая таблетка содержит от приблизительно 0,01 мг до приблизительно 25 мг витамина B12 и от приблизительно 50 мг до приблизительно 600 мг SNAC. Более предпочтительно, каждая таблетка содержит от приблизительно 0,02 мг до приблизительно 20 мг витамина B12. Более предпочтительно каждая таблетка содержит от приблизительно 0,1 мг до приблизительно 10 мг витамина B12. Наиболее предпочтительно каждая таблетка содержит приблизительно от 15 до 20 мг витамина B12 и приблизительно от 50 до 100 мг SNAC, или приблизительно от 0,1 до 1,5 мг витамина B12 и приблизительно от 25 до 150 мг SNAC.
[0022] В другом предпочтительном варианте реализации таблетка дополнительно содержит по меньшей мере один из носителя, наполнителя, эмульгатора, стабилизатора, подсластителя, вкусовой добавки, разбавителя, красителя, растворителя, или комбинации указанных веществ.
[0023] В другом предпочтительном варианте реализации изобретения таблетка возможно содержит приблизительно от 1 до 25 мг соединения Capmul PG-8, а также возможно содержит приблизительно от 0,5 до 10 мг соединения Providone. Предпочтительно, количество Capmul PG-8 составляет приблизительно от 2 до 20 мг, и количество Providone составляет от приблизительно 1 до 8 мг. Предпочтительно, количество Capmul PG-8 составляет от приблизительно 5 до 15 мг, и количество Providone составляет от приблизительно 1,5 до 5 мг. Более предпочтительно, вариантом количество Capmul PG-8 составляет от приблизительно 5 до 10 мг и количество Providone составляет от приблизительно 1,5 до 5 мг.
[0024] Не связываясь конкретной теорией, принято считать, что желудочно-кишечная абсорбция витамина B12 зависит от наличия в достаточном количестве внутреннего фактора, выделяемого париетальными клетками желудка. Среднестатистический рацион обеспечивает поступление в организм приблизительно 10 мкг/сутки витамина B12 в связанной с белком форме, которая доступна для абсорбции при нормальном усвоении пищи. Витамин B12 связывается с внутренним фактором при прохождении через желудок; в подвздошной кишке происходит разделение и витамин B12 поступает в клетки слизистой оболочки для абсорбции с помощью рецепторов. Затем витамин транспортируется посредством связывающих белков - транскобаламинов. Небольшое количество (приблизительно 1% от общего количества усвоенного) поглощается посредством простой диффузии, но этот механизм является приемлемым исключительно при очень больших дозах. Кроме того, считается, что SNAC позволяет B12 миновать обычный процесс абсорбции с помощью рецепторов.
[0025] Следующие примеры приведены в качестве конкретных иллюстраций к изобретению. Однако следует понимать, что изобретение не ограничивается только конкретными данными, сформулированными в этих примерах. Все части и проценты в примерах, а также в оставшейся части описания, выражаются в единицах веса, если не указано иное.
[0026] Кроме того, любой интервал чисел, упоминаемый в описании патента или примерах, представленных ниже, описывающих или затрагивающих различные аспекты изобретения, как, например, представление определенного набора свойств, единиц измерения, условий, физических состояний или процентного содержания, подразумевает дословное включение в явной форме в настоящую заявку посредством ссылки или иным образом любого числа, входящего в такой интервал, включая любое подмножество чисел или интервалов, относящихся к любому из указанных интервалов. Термин "приблизительно" при использовании в качестве модификатора для переменной или в сочетании с ней, предназначен для утверждения того, что числа и интервалы, раскрываемые в настоящей заявке, являются нестрогими, и могут варьироваться при практическом использовании настоящего изобретения специалистами в данной области техники, при выражении концентраций, количеств веществ, числа углеродных атомов и других характеристик, находящихся за пределами интервалов или отличающихся от отдельных значений, в том случае, если это приводит к достижению желаемого результата, а именно: эффективного лечения субъекта, страдающего дефицитом витамина B12, не поддающегося существующему лечению путем перорального введения таблеток витамина B12, а также фармацевтических композиций, применяемых для такого лечения.
Пример 1. Приготовление N-[8-(2-гидроксибензоил)амино]каприловой кислоты и SNAC
[0027] Способ приготовления N-[8-(2-гидроксибензоил)амино]каприловой кислоты и SNAC включает следующие этапы: исходным сырьем являлся салициламид, который преобразовывался с формированием Карсалама (2,4-диоксодигидро-5,6-бензо-1,3-оксазин). Второй этап включает алкилирование Карсалама. Предпоследним этапом являлся гидролиз, приводящий к расщеплению защитной этиловый группы на конце алкильной цепи, и раскрытию гетероциклического кольца с формированием свободной кислоты SNAC. На последнем этапе в результате реакции с гидроксидом натрия, вводимом в избытке на 1% относительно стехиометрического количества, образовывалась натриевая соль SNAC. После охлаждения осажденный продукт выделяли центрифугированием и сушили в вакууме перед упаковыванием. Технологический контроль схемы синтеза приведен в таблице 1.
Пример 2. Приготовление таблетированной формы витамина B12
[0028] Матрицы и штампы для таблетированных форм проверяли, чтобы удостовериться, что они чистые, и что их поверхность посыпана порошком стеарата магния. Витамин B12, SNAC, носитель, наполнитель, эмульгатор, стабилизатор, подсластитель, вкусовая добавка, разбавитель, краситель, растворитель просеивали через сито (диаметр поры сита #35 или 0,500 мм) и перемещали в герметичные контейнеры. Взвешивали 50 мг витамина B12 и тщательно перемешивали с 11 граммами носителя, наполнителя, эмульгатора, стабилизатора, подсластителя, вкусовой добавки, разбавителя, красителя и/или растворителя. Изготавливали 100 таблеток витамина B12 с содержанием в каждой таблетке 0,5 мг витамина B12 и 110 мг носителя, наполнителя, эмульгатора, стабилизатора, подсластителя, вкусовой добавки, разбавителя, красителя и/или растворителя. Указанные таблетки использовали в качестве контрольных.
Пример 3. Приготовление таблеток витамина B12 и SNAC
[0029] Взвешивали 50 мг витамина B12 и 1 грамм SNAC соответственно и тщательно перемешивали с 10 граммами носителя, наполнителя, эмульгатора, стабилизатора, подсластителя, вкусовой добавки, разбавителя, красителя и/или растворителя. Изготавливали 100 таблеток витамина B12 с содержанием в каждой таблетке 0,5 мг витамина B12, 10 мг SNAC и 100 мг носителя, наполнителя, эмульгатора, стабилизатора, подсластителя, вкусовой добавки, разбавителя, красителя и/или растворителя. Процесс повторяли для изготовления партий таблеток, содержащих 1,0 мг; 0,8 мг; 0,6 мг; 0,4 мг и 0,2 мг витамина B12 соответственно. Данные таблеточные формы имеют следующие характеристики для выпуска SNAC:
Пример 4. Приготовление таблеток для испытания на крысах
[0030] Таблетки, содержащие четыре вида различных ингредиентов, приготавливали следующим образом:
(1) взвешивали 8,8 мг витамина В12, 35 мг SNAC тщательно перемешивали и изготавливали таблетку для введения крысе;
(2) взвешивали 8,8 мг витамина B12, 35 мг SNAC и 5 мг соединения Capmul PG-8, тщательно перемешивали и изготавливали таблетку;
(3) взвешивали 8,8 мг витамина B12, 35 мг SNAC и 0,9 мг соединения Providone, тщательно перемешивали и изготавливали таблетку.
Каждый из 4-х процессов повторяли для изготовления большего количества таблеток.
Пример 5. Введение препарата крысам линии Спраг-Доули
[0031] Самцам крыс линии Спраг-Доули (325-350 грамм) вводили внутривенно витамин B12 (0,5 мг/кг) в чистом виде или перорально в виде таблеток, изготовленных в примере 4 в дозировке 50 мг/кг чистого витамина B12 или в сочетании со SNAC в количестве 200 мг/кг. Образцы крови отбирали через 0, 3, 10, 20, 30, 60, 120, 240 и 360 минут после дозирования. Образцы плазмы анализировали методом радиоиммунологического анализа. Независимые фармакокинетические количественные показатели, полученные на модели при комбинации В12-САКН, сравнивали с показателями, полученными при применении чистого B12. Результаты исследования приведены в таблице 3.
Пример 6. Приготовление таблеток для исследования на людях
[0032] Таблетки изготавливали из цианокобаламина, SNAC, коллидона 90F, Emcompress USP/EP* и стеарата магния, NF/BP/EP/JP. Каждая таблетка содержала следующие компоненты:
Пример 7. Дозирование для человека
[0033] Шестнадцать здоровых мужчин были распределены по группам в случайном порядке для получения следующих видов терапии:
(1) Терапия В: однократное пероральное введение цианокобаламина/SNAC (5 мг цианокобаламина/ 100 мг SNAC) в виде таблетки натощак (6 субъектов).
(2) Терапия С: однократное пероральное введение цианокобаламина в чистом виде (5 мг цианокобаламина, коммерчески доступный под маркой VitaLabs) в виде таблетки натощак (6 субъектов).
(3) Терапия D: однократное внутривенное введение цианокобаламина (1 мг цианокобаламина) натощак (4 субъекта). Каждый субъект получал по 1 мл внутривенной инъекции раствора цианокобаламина с концентрацией 1 мг/мл (1000 мкг/мл), в результате чего суммарная доза цианокобаламина составляла 1 мг.
Субъекты воздерживались от принятия пищи с вечера накануне дня исследований, а также не употребляли никаких жидкостей (включая воду) не менее чем за час до и через час после введения препарата. Пероральные формы таблеток цианокобаламина/SNAC вводили единичной дозой в виде таблеток, запивая 50 мл простой воды. Для анализа цианокобаламина были отобраны двадцать пять образцов крови в следующие моменты времени: в течение 30 минут перед введением препарата, а также спустя 2, 5, 10, 20, 30, 40, 50 минут и 1, 1½, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 14, 16, 20 и 24 часов после приема препарата.
Фармакокинетические количественные показатели были получены путем независимого фармакокинетического анализа на модели отдельных концентраций цианокобаламина. Для обобщения полученных результатов была использована описательная статистика.
В результате употребления 1 таблетки, содержащей 5 мг 612 и 100 мг SNAC, средняя пиковая концентрация В12 составляла 12847±6613 пг/мл, при этом такая концентрация возникала в течение 1 часа после приема препарата (среднее максимальное значение времени составляет 0,50±0,21 часа). Среднее конечное значение ППКlast от момента введения препарата до определения последней поддающейся количественному измерению концентрации (0-24) составляло 54609±16392 час·пг/мл. Величина коэффициента вариации результатов, выраженная в процентах (% CV), составляла 51,5% для среднего значения максимальной концентрации CMAX и 30,0% для ППК.
После однократного перорального введения только цианокобаламина (5 мг цианокобаламина, препарата торговой марки VitaLabs Inc®) средняя пиковая концентрация B12 составляла 1239±450 пг/мл, при этом данная концентрация возникала в период от 3 до 10 часов после приема препарата (среднее максимальное значение времени составляет 6,8±3,2 часа). Среднее конечное значение ППКlast от момента введения препарата до определения последней поддающейся количественному измерению концентрации (0-24) составляло 23165±8382 час·пг/мл. Величина коэффициента вариации результатов, выраженная в процентах (% CV), составляла 36% для среднего значения максимальной концентрации CMAX и 36% для ППК.
После однократной внутривенной инъекции раствора цианокобаламина (1 мг цианокобаламина), введенной 4-м субъектам натощак, средняя пиковая концентрация B12 составила 214738±44614 пг/мл, а среднее конечно значение ППКlast от момента введения препарата до определения последней, поддающейся количественному измерению, концентрации (0-24) составило 215391±44602 час·пг/мл. Величина коэффициента вариации результатов, выраженная в процентах (% CV), составляла 36% для среднего значения максимальной концентрации CMAX и 21% для ППК.
Средние значения показателей биологической доступности, рассчитанные для 1 таблетки, содержащей 5 мг витамина B12, 1 таблетки, содержащей 5 мг витамина В12 и 100 мг SNAC, а также 2 таблеток, содержащих 5 мг витамина B12 и 100 мг SNAC, составили 2,16±0,78, 5,09±1,53, и 5,94±3,06% соответственно. (Примечание: в условиях пробной терапии А группе испытуемых вводились 2 таблетки, содержащих 5 мг витамина В12 и 100 мг SNAC).
Среднее максимальное значение времени абсорбции 1-ой таблетки, содержащей 5 мг витамина B12, 1-ой таблетки, содержащей 5 мг витамина В12 и 100 мг SNAC, а также 2-х таблеток, содержащих 5 мг витамина В12 и 100 мг SNAC составляло 6,83±3,19, 0,50±0,21 и 0,54±0,32 часа соответственно.
При осуществлении настоящих способов лечения не наблюдалось никаких побочных эффектов. Все препараты являются безопасными и хорошо переносятся.
Неожиданно было обнаружено, что степень абсорбции витамина В12, измеренная с помощью показателей CMAX и ППК, при комплексном введении цианокобаламина и SNAC значительно повышалась. Биологическая доступность витамина B12 при применении 1 таблетки, содержащей 5 мг В12 и 100 мг SNAC, была на 240% выше по сравнению с 5 мг витамина B12, содержащимися в коммерчески доступном лекарственном средстве. Среднюю максимальную концентрацию витамина B12 при пероральном употреблении коммерческой формы препарата диагностировали намного позже по сравнению с опытом, где применяли комплекс B12/SNAC, что, по всей видимости, обусловлено различием между участками всасывания характерными для каждого из данных препаратов. Такое предположение согласуется с литературными данными, которые описывают кишечное всасывание витамина B12, происходящее в дистальном отделе желудочно-кишечного тракта при отсутствии носителя.
[0034] В вышеприведенном описании патента были приведены основы, предпочтительные варианты реализации и принципы работы данного изобретения. Изобретение, охраняемое настоящим документом, тем не менее, не должно рассматриваться в качестве ограниченного в раскрытии конкретных форм, поскольку они носят в большей мере иллюстративный, чем ограничительный характер. Вариации и изменения могут быть внесены специалистом в данной области техники, без отклонений от сущности изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПЕРОРАЛЬНАЯ ТЕРАПИЯ НЕДОСТАТОЧНОСТИ ВИТАМИНА В | 2011 |
|
RU2576511C2 |
| ТВЕРДЫЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ АГОНИСТ GLP-1, СОЛЬ N-(8-(2-ГИДРОКСИБЕНЗОИЛ)АМИНО)КАПРИЛОВОЙ КИСЛОТЫ И СМАЗЫВАЮЩЕЕ ВЕЩЕСТВО | 2019 |
|
RU2807183C2 |
| ПЕРОРАЛЬНАЯ ДОЗИРОВАННАЯ ФОРМА СОЕДИНЕНИЙ ГЛЮКАГОНОПОДОБНОГО ПЕПТИДА-1 | 2014 |
|
RU2671406C2 |
| КОМПОЗИЦИИ GLP-1 ПЕПТИДОВ И ИХ ПОЛУЧЕНИЕ | 2013 |
|
RU2641198C2 |
| ТВЕРДЫЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ АГОНИСТ GLP-1 И СОЛЬ N-(8-(2-ГИДРОКСИБЕНЗОИЛ)АМИНО)КАПРИЛОВОЙ КИСЛОТЫ | 2019 |
|
RU2804318C2 |
| ТВЕРДЫЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ АГОНИСТ GLP-1 И СОЛЬ N-(2-ГИДРОКСИБЕНЗОИЛ)АМИНО)КАПРИЛОВОЙ КИСЛОТЫ | 2011 |
|
RU2600440C2 |
| ПЕРОРАЛЬНОЕ ВВЕДЕНИЕ КАЛЬЦИТОНИНА | 2003 |
|
RU2355417C2 |
| ПРИМЕНЕНИЕ КАЛЬЦИТОНИНА ДЛЯ ЛЕЧЕНИЯ РЕВМАТОИДНОГО АРТРИТА | 2006 |
|
RU2453330C2 |
| СПОСОБЫ ИЗГОТОВЛЕНИЯ ЛЕКАРСТВЕННЫХ СОСТАВОВ АЦИКЛОВИРА | 2005 |
|
RU2406504C2 |
| Продукт для пероральной доставки | 2016 |
|
RU2732498C2 |
Группа изобретений относится к фармакологии и медицине. Способ и композиция для лечения дефицита витамина В12 у млекопитающих, не поддающихся лечению путем перорального введения витамина В12, включающие приготовление фармацевтический композиции для перорального введения, содержащей витамин В12 и по меньшей мере одно вещество, выбранное из группы, состоящей из N-[-8-(2-гидроксибензоил)амино]каприловой кислоты и ее фармацевтически приемлемых солей, а затем введение фармацевтической композиции субъекту. Группа изобретений обеспечивает повышение эффективности лечения дефицита витамина В12. 2 н. и 21 з.п. ф-лы, 1 ил., 3 табл., 7 пр.
1. Способ лечения дефицита витамина B12 у нуждающегося в этом субъекта, включающий введение:
(1) витамина В12 и (2) по меньшей мере одного вещества, выбранного из группы, состоящей из N-[8-(2-гидроксибензоил)амино]каприловой кислоты и ее фармацевтически приемлемых солей указанному субъекту.
2. Способ по п.1, отличающийся тем, что у указанного субъекта отсутствовала реакция на существующее лечение путем перорального введения витамина B12.
3. Способ по п.1, отличающийся тем, что (1) и (2) вводят в виде фармацевтической композиции.
4. Способ по п.3, отличающийся тем, что указанная фармацевтическая композиция содержит от 0,01 мг до 25 мг витамина B12 и от 1 мг до 600 мг N-[8-(2-гидроскибензоил)амино)]каприлата натрия.
5. Способ по п.3, отличающийся тем, что указанная фармацевтическая композиция содержит от 0,02 мг до 25 мг витамина B12.
6. Способ по п.3, отличающийся тем, что указанная фармацевтическая композиция содержит от 0,1 мг до 20 мг витамина B12.
7. Способ по п.3, отличающийся тем, что указанная фармацевтическая композиция содержит 0,5 мг витамина B12 и 17,5 мг N-[8-(2-гидроскибензоил)амино)]каприлата натрия.
8. Способ по п.1, отличающийся тем, что массовое соотношение витамина B12 к N-[8-(2-гидроскибензоил)амино)]каприлату натрия составляет от 2:1 до 1:700.
9. Способ по п.8, отличающийся тем, что указанное весовое соотношение составляет от 1:2 до 1:600.
10. Способ по п.8, отличающийся тем, что указанное весовое соотношение составляет от 1:3 до 1:20.
11. Способ по п.8, отличающийся тем, что указанное весовое соотношение составляет 1:4.
12. Способ по п.8, отличающийся тем, что указанное весовое соотношение составляет от 1:500 до 1:700.
13. Способ по п.3, отличающийся тем, что указанная фармацевтическая композиция дополнительно включает по меньшей мере одно вещество из группы, включающей носитель, наполнитель, эмульгатор, стабилизатор, подсластитель, вкусовую добавку, разбавитель, краситель, растворитель или комбинации указанных веществ.
14. Способ по п.3, отличающийся тем, что указанная фармацевтическая композиция представляет собой таблетку.
15. Способ по любому из пп.1-14, отличающийся тем, что при пероральном приеме указанной композиции значение Tmax для витамина В12 уменьшается.
16. Фармацевтическая композиция для лечения дефицита витамина B12 у субъекта, содержащая (1) витамин В12 и (2) по меньшей мере одно вещество, выбранное из группы, состоящей из N-[8-(2-гидроксибензоил)амино]каприловой кислоты и ее фармацевтически приемлемых солей.
17. Фармацевтическая композиция по п.16, отличающаяся тем, что указанная фармацевтическая композиция представляет собой таблетку.
18. Фармацевтическая композиция по п.17, отличающаяся тем, что указанная таблетка содержит от 0,01 мг до 25 мг витамина В12 и от приблизительно 50 мг до 600 мг N-[8-(2-гидроскибензоил)амино)]каприлата натрия.
19. Фармацевтическая композиция по п.17, отличающаяся тем, что указанная таблетка содержит от 0,02 мг до 20 мг витамина В12.
20. Фармацевтическая композиция по п.17, отличающаяся тем, что указанная таблетка содержит от 0,1 мг до 10 мг витамина В12.
21. Фармацевтическая композиция по п.17, отличающаяся тем, что указанная таблетка содержит 1-15 мг витамина В12 и 50-200 мг N-[8-(2-гидроскибензоил)амино)]каприлата натрия.
22. Фармацевтическая композиция по п.16, дополнительно включающая по меньшей мере одно вещество из группы, включающей носитель, наполнитель, эмульгатор, стабилизатор, подсластитель, вкусовую добавку, разбавитель, краситель, растворитель или комбинации указанных веществ.
23. Фармацевтическая композиция по любому из пп.16-22, отличающаяся тем, что при пероральном приеме указанной композиции значение Tmax для витамина B12 уменьшается.
| US 2006116334 A1, 01.06.2006 | |||
| US 2005186267 A1, 25.08.2005 | |||
| US 5665379 A, 09.09.1997. |
Авторы
Даты
2012-12-20—Публикация
2008-10-31—Подача