[1] Настоящая заявка испрашивает приоритет согласно предварительной патентной заявке США №60/573003 от 19 мая 2004 г., при этом описание этой заявки полностью включено в данное описание в качестве ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[2] Настоящее изобретение относится к способам изготовления лекарственных форм ацикловира, имеющим улучшенную биодоступность, что выражается в повышенной эффективности и/или требует менее частого введения.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
[3] Ацикловир, 9-[(2-гидроксиэтокси)метил]гуанин, представляет собой противовирусный препарат, который подавляет вирусы герпеса человека, включая представителей простого герпеса 1 (herpes simplex virus type 1, HSV-1) и 2 (herpes simplex virus type 2, HSV-2), ветряной оспы, вируса Эпштейна-Барра (Epstein-Barr virus, EBV) и цитомегаловирус (cytomegalovirus, CMV). Ингибирующая активность ацикловира на эти вирусы является высокоизбирательной. O'Brien и Campoli-Richards, Drugs, 37:233-309 (1989). Химический состав ацикловира описан у Shaffer, et al. (J. Med. Chem. 14:367 (1971)), патент США №4199574, и в подробном изложении патента Великобритании №1523865, каждый из которых полностью включен в данное описание в качестве ссылки.
[4] Было подтверждено, что ацикловир является потенциальным противовирусным лекарственным средством, особенно эффективным против вирусов герпеса. Shaffer, et al. Nature 272:583-585 (1978). Также было показано, что ацикловир эффективно подавляет реактивированные или вновь приобретенные вирусные заболевания, в частности, такие как простой генитальный герпес, опоясывающий лишай и ветряная оспа, также как и острые формы инфекционных заболеваний, вызванных вирусом ветряной оспы. Balfour, J. Med. Virology, 81:74-81 (1993). Заболеваемость и смертность от вирусных заболеваний была снижена с помощью пред- и послеоперационной профилактики путем длительного (>6 месяцев) курса приема ацикловира перорально. Prentice et al., Lancet 343:749-753 (1994). Одновременный прием ацикловира и AZT (азидотимидина) продлевал жизнь пациентов, больных СПИДом(AIDS) до одного года, если лечение ацикловиром начинали сразу по установлении диагноза. Stein, et al., Ann. Intern. Med. 121:100-108 (1994). В дополнение к этому, лечение ацикловиром острой формы ветряной оспы снижает жар, постоянную боль, а также распространение сыпи, и ускоряет заживление кожи.
[5] Другие направления использования ацикловира включают, но не ограничены только, кожно-слизистые, глазные и общие инфекционные заболевания, которые вызваны вирусом простого герпеса (herpes simplex virus, HSV), включая лиц, зараженных вирусом иммунодефицита человека (ВИЧ, human immunodeficiency virus, HIV). Он также является полезным при лечении энцефалита, вызванного HSV, инфекционных заболеваний у новорожденных, вызванных ВИЧ, и генитального герпеса (первичные случаи, повторное и подавляющее лечение рецидивов инфекционных заболеваний). Кроме того, ацикловир представляет собой эффективное средство лечения инфекционных заболеваний, вызванных вирусом ветряной оспы, опоясывающего герпеса (опоясывающего лишая), цитомегаловирусных инфекционных заболеваний, инфекционных заболеваний и расстройств, вызванных вирусом Эпштейна-Барра. Центр контроля заболеваний утверждает, что ацикловир можно применять перорально беременным женщинам. Это и другие направления использования можно найти в AHFS Drug Information, American Society of Health System Pharmacists, Bethesda, MD, 2005, которое полностью включено в настоящее описание в качестве ссылки.
[6] В настоящее время ацикловир продают в виде капсул, таблеток и суспензий для перорального применения. При пероральном введении ацикловира происходит его медленное и неравномерное всасывание, и биологическая доступность составляет 15-30%. Barnhart (ed.), Physicians' Desk Reference, Oradell, N.J.: Medical Economics Data (1994). Более половины дозы продаваемого в настоящее время лекарственного средства поступает в экскременты. Schaeffer et al., Nature, 272:583-585 (1978). Отсутствие реакции на лечение ацикловиром может возникнуть от недостаточной дозировки (недостаточной частоты приема или общей дневной дозы); невосприимчивости пациента; нарушения всасывания в кишечнике; или из-за устойчивых штаммов вирусов. Mindel, J. Med. Virology, 81:39-44 (1993). Потребность в быстро абсорбируемых противовирусных лекарственных средствах для перорального введения является настоятельной необходимостью при лечении вирусных заболеваний для обеих обследуемых групп больных, так как длительное внутривенное лечение имеет ограничения, а соответствие с имеющимися в настоящее время в наличии лекарственными формами ацикловира для перорального применения труднодостижимо. Katlama, J. Med. Virology S1:128-133 (1993). Изготовление такой лекарственной формы ацикловира для перорального применения, которое позволило бы использовать более низкую дозу и менее частое введение, способствовало бы такому соответствию.
[7] Ранее уже осуществлялись попытки улучшить доставку ацикловира при пероральном введении. Патент США №5629016, описание которого включено в настоящее описание в качестве ссылки, описывает водно-диспергируемые таблетки, содержащие ацикловир, которые способствуют введению больших доз (т.е. до 800 мг) ацикловира. Однако таблетки не улучшают биологическую доступность ацикловира.
[8] В патенте США №5883103 описана микроэмульсионная система для пероральной доставки ацикловира. Система включает эмульсию типа «вода-в-масле» с ацикловиром, диспергированным в каплях водной фазы. Капли имеют средний размер 20-40 нанометров и равномерно распределены в непрерывной масляной фазе.
[9] Хотя и были сделаны предшествующие попытки усовершенствовать поступление и биологическую доступность ацикловира, они имели ограниченный успех. Таким образом, существует необходимость в составах ацикловира для перорального введения, обладающих повышенной биологической доступностью.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[10] Настоящее изобретение обеспечивает состав (например, фармацевтический состав), включающий (а) по меньшей мере одно соединение агента для доставки и (б) ацикловир или его соль, эфир или пролекарство. Предпочтительно, состав включает терапевтически эффективную дозу ацикловира и соединение для доставки лекарственного средства. Состав, в соответствии с настоящим изобретением, ускоряет доставку ацикловира и повышает его биологическую доступность по сравнению с введением без соединения агента для доставки. Состав особенно хорошо подходит для перорального введения. Предпочтительно, состав обеспечивает биологическую доступность (т.е. площадь под кривой, area under curve, AUC), в, по существу, эквивалентную известным в настоящее время составам ацикловира, имеющимся в продаже под маркой Zovirax® (США FDA NDA No. 18828, 19909 или 20089) при следующих режимах введения:
(1) 200, 400, или 800 мг ацикловира каждые 4 часа 5 раз в день,
(2) 400 мг ацикловира 2 раза в день,
(3) 200 мг ацикловира 3 раза в день,
(4) 200 мг ацикловира 4 раза в день, или
(5) 200 мг ацикловира 5 раза в день.
[11] Предпочтительные соединения для доставки агента включают, но не ограничены ими, N-(8-[2-гидроксибензоил]амино)каприловую кислоту, N-(10-[2-гидроксибензоил]амино)каприловую кислоту, N-(10-[2-гидроксибензоил]амино)декановую кислоту, 4-[(4-хлоро-2-гидроксибензоил)амино]бутановую кислоту (известную также как 4-[(2-гидрокси-4-хлорбензоил)амино]бутаноат), 8-(N-2-гидрокси-5-хлорбензоил)аминокаприловую кислоту, 8-(N-2-гидрокси-4-метоксибензоил)аминокаприловую кислоту и их соли (например, фармацевтически допустимые соли), а также их сольваты и гидраты. Соль, например, может быть солью натрия, в частности моно- или динатриевой солью.
[12] В одном из вариантов настоящего изобретения состав включает ацикловир или его соль, эфир или пролекарство и по меньшей мере один агент для доставки следующей структуры или его соль (например, фармацевтически допустимую соль):
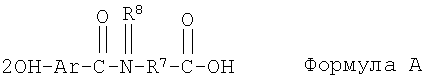
где
Ar представляет собой фенил или нафтил, причем
Ar возможно замещен одним или более -ОН, галогеном, C1-C4 алкилом, C1-C4 алкенилом, C1-C4 алкокси или C1-C4 галоалкокси;
R7 представляет собой C4-C20 алкил, C4-C20 алкенил, фенил, нафтил, (C1-С10 алкил)фенил, (С1-С10 алкенил)фенил, (С1-С10 алкил)нафтил, (C1-C10 алкенил)нафтил, фенил(С1-С10 алкил), фенил(С1-С10 алкенил), нафтил(С1-С10 алкил) или нафтил(С1-С10 алкенил);
R8 представляет собой водород, C1 до C4 алкил, С2 до C4 алкенил, C1 до C4 алкокси или C1-C4 галоалкокси, при этом
R7 возможно замещен C1 до C4 алкилом, C2 до C4 алкенилом, C1 до C4 алкокси, C1-C4 галоалкокси, -ОН, -SH, -CO2R9 или любой их комбинацией;
R9 представляет собой водород, С1 до C4 алкил или С2 до C4 алкенил; и
R7 может быть прерван кислородом, азотом, серой, или любой их комбинацией.
В соответствии с одним из вариантов соединения не имеют замещений аминогруппой в альфа-положении по отношению к кислотной группе.
[13] В другом варианте реализации настоящего изобретения состав содержит ацикловир или его соль, эфир или пролекарство и по меньшей мере один агент для доставки следующей структуры или его соль (например, фармацевтически приемлемую соль):
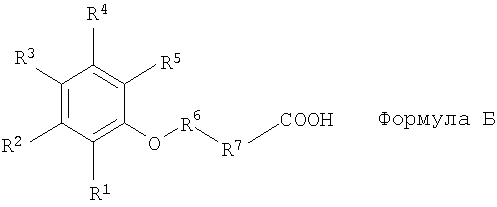
где
R1, R2, R3 и R4 представляют собой независимо друг от друга Н, -ОН, галоген, C1-C4 алкил, C2-C4 алкенил, C1-C4 алкокси, -C(O)R8, -NO2, -NR9R10 или -N+R9R10R11(R12)-;
R5 представляет собой Н, -ОН, -NO2, галоген, -CF3, -NR14R15, -N+R14R15R16(R13)-, амид, C1-C12 алкокси, C1-C12 алкил, C2-C12 алкенил, карбамат, карбонат, мочевину, или -C(O)R18, причем
R5 возможно замещен галогеном, -ОН, -SH или -СООН;
R5 возможно замещен О, N, S или -С(O)-;
R6 представляет собой C1-C12 алкилен, C2-C12 алкенилен или арилен, причем
R6 возможно замещен C1-C4 алкилом, С2-С4 алкенилом, C1-C4 алкокси, -ОН, -SH, галогеном, -NH2 или -CO2R8;
R6 возможно замещен О или N;
R7 представляет собой связь или арилен, причем
R7 возможно замещен -ОН, галогеном, -С(O)СН3, -NR10R11 или -N+R10R11R12(R13)-.
В каждом случае R8 представляет собой независимые друг от друга Н, C1-C4 алкил, С2-С4 алкенил или -NH2;
R9, R10, R11 и R12 независимые друг от друга Н или С1-С10 алкил;
R13 представляет собой галогенид, гидроксид, сульфат, тетрафторборат или фосфат;
R14, R15 и R16 представляет собой независимые друг от друга Н, С1-С10 алкил, C1-C10 алкил, замещенный -СООН, C2-C12 алкенилом, C2-C12 алкенил, замещенный -СООН или -C(O)R17;
R17 представляет собой -ОН, C1-С10 алкил или C2-C12 алкенил; и
R18 представляет собой Н, C1-C6 алкил, -ОН, -NR14R15 или N+R14R15R16(R13)-.
Возможно, когда R1, R2, R3, R4 и R5 представляют собой Н, а R7 представляет собой связь, причем R6 не является C1-C6, C9 или C10 алкилом.
Возможно, когда R1, R2, R3 и R4 представляют собой Н, причем R5 представляет собой -ОН, R7 представляет собой связь, а R6 не является C1-С3 алкилом.
Возможно, когда по меньшей мере один из R1, R2, R3 и R4 не является Н, R5 представляет собой -ОН, причем R7 представляет собой связь, при этом R6 не является C1-C4 алкилом.
Возможно, когда R1, R2 и R3 представляют собой Н, R4 представляет собой -ОСН3, причем R5 представляет собой -С(O)СН3, а R6 представляет собой связь, тогда R7 не является С3 алкилом.
Возможно, когда R1, R2, R4 и R5 представляют собой Н, R3 представляет собой -ОН, а R7 представляет собой связь, тогда R6 не является метилом.
[14] Еще в одном способе состав включает ацикловир или его соль, эфир или пролекарство и по меньшей мере один агент для доставки следующей структуры или его соль (например, фармацевтически допустимую соль):
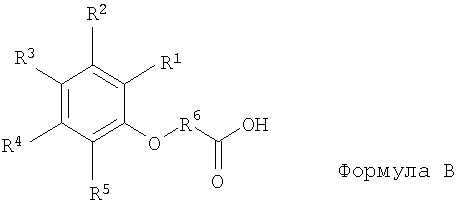
где
R1, R2, R3, R4 и R5 представляют собой независимые друг от друга Н, -CN, -ОН, -ОСН3, или галоген, при этом по меньшей мере один из R1, R2, R3, R4 и R5 представляет собой -CN; и
R6 представляет собой C1-C12 линейный или разветвленный алкилен, алкенилен, арилен, алкил(арилен) или арил(алкилен).
В соответствии с одним из способов реализации, когда R1 представляет собой -CN, R4 представляет собой Н или -CN, причем R2, R3, а R5 представляют собой Н, при этом R6 не является метиленом ((CH2)1).
[15] Обеспечена также единичная дозированная форма (например, единичная дозированная форма для пероральной доставки), содержащая состав в соответствии с настоящим изобретением. Единичная дозированная форма может быть в жидком или твердом виде, например в виде таблеток, капсул, или в измельченном виде, включая порошки, или саше (пакетики).
[16] Другой вариант реализации настоящего изобретения представляет собой способ введения ацикловира или его соли, эфира или пролекарства животному (предпочтительно млекопитающему и еще более предпочтительно человеку), которые нуждаются в соответствующем лечении, путем введения животному состава или лекарственных(ой) форм(ы) в соответствии с настоящим изобретением. Предпочтительным путем введения является пероральный.
[17] Еще один вариант реализации настоящего изобретения представляет собой способ лечения патологических состояний или расстройств, вызванных вирусом, у животного (предпочтительно у млекопитающего и еще более предпочтительно у человека), которое нуждается в соответствующем лечении, путем введения животному эффективной дозы состава или единичн(ых)ой дозированн(ых)ой форм(ы), в соответствии с настоящим изобретением. Другими словами, вводят эффективную дозу соединения для доставки, чтобы ускорить поступление ацикловира или его соли, эфира или пролекарства и эффективную дозу (например, терапевтически эффективную дозу) ацикловира.
[18] Еще один вариант настоящего изобретения представляет собой способ лечения патологических состояний и расстройств, вызванных вирусом, у животного (предпочтительно у млекопитающего, еще более предпочтительно у человека) путем введения животному терапевтически эффективного количества состава или единичн(ых)ой дозированн(ых)ой формы в соответствии с настоящим изобретением. Такие патологические состояния и расстройства включают, но не ограничены, состояния и расстройства, которые вызваны семейством вирусов герпеса, например вирусов простого герпеса 1 и 2 (HSV 1 и HSV 2), вирусом ветряной оспы (varicella zoster virus, VZV), цитомегаловирусом (cytomegalovirus, CMV), вирусом Эпштейна-Барра (Epstein-Barr virus, EBV) и другими герпетическими вирусными инфекциями (например, кошачьими герпетическими вирусными инфекциями).
[19] Другой вариант реализации настоящего изобретения представляет собой способ лечения вирусных инфекций, в частности герпетических инфекций, таких как вирусы простого герпеса 1 и 2 (HSV 1, HSV 2), вирус ветряной оспы (VZV), цитомегаловирус (CMV) и вирус Эпштейна-Барра (EBV), и других герпетических вирусных инфекционных заболеваний (например, кошачьих герпетических вирусных инфекционных заболеваний) у человека и у не относящихся к человеческому роду животных путем введения эффективного количества состава или стандартной лекарственной формы в соответствии с настоящим изобретением.
[20] Еще один вариант настоящего изобретения представляет собой способ лечения клинических состояний или симптомов, которые вызваны вирусами, перечисленными выше, включая герпетический кератит, герпетический энцефалит, герпетические лихорадки и генитальные инфекционные заболевания (вызванные простым герпесом), ветряную оспу птиц и опоясывающий лишай (вызванный вирусом ветряной оспы) и CMV-пневмонию и ретинит, в особенности у пациентов с ослабленным иммунитетом, включая пациентов с трансплантированной почкой и костным мозгом и пациентов с синдромом приобретенного иммунодефицита ВИЧ (Acquired Immune Deficiency Syndrome, AIDS), путем введения эффективной дозы состава или лекарственной формы в соответствии с настоящим изобретением. Вирус Эпштейна-Барра (Epstein-Barr virus, EVB) вызывает инфекционный мононуклеоз, и также полагают, что он является причиной возникновения рака носоглотки, иммунобластной лимфомы, лимфосаркомы Беркитта (Burkitt's lymphoma) и лейкоплакии ворсистых клеток.
[21] Еще один вариант реализации настоящего изобретения представляет собой способ лечения вирусных инфекционных заболеваний у животного (предпочтительно у млекопитающего и еще более предпочтительно у человека), которое нуждается в соответствующем лечении, путем введения животному терапевтически эффективной дозы состава или лекарственных(ой) форм(ы) в соответствии с настоящим изобретением. В целом вирусные инфекционные заболевания представляют собой заболевания, поддающиеся лечению ацикловиром или его солью, эфиром или пролекарством.
[22] Еще один вариант реализации настоящего изобретения представляет собой способ экстренного лечения опоясывающего лишая, вызванного вирусом герпеса, (также известного как опоясывающий герпес) у человека, который нуждается в соответствующем лечении, путем введения (предпочтительно перорально) эффективной дозы фармацевтического состава в соответствии с настоящим изобретением. Предпочтительно фармацевтический состав вводят перорально каждые 5 или более часов и менее чем 5 раз в день. Предпочтительно фармацевтический состав обеспечивает биологическую доступность (т.е. AUC), эквивалентную в значительной степени известным в настоящее время составам ацикловира, продаваемым под маркой Zovirax® (US FDA NDA No. 18828, 19909 или 20089), когда 200 мг ацикловира вводят каждые 4 часа 5 раз в день. Лечение можно продолжать от 7 до 10 дней.
[23] Еще один вариант настоящего изобретения представляет собой способ лечения первичных случаев и/или подавление рецидивирующего генитального герпеса у человека, который нуждается в соответствующем лечении, путем введения (предпочтительно перорально) эффективной дозы фармацевтического состава в соответствии с настоящим изобретением. Предпочтительно для лечения первичного генитального герпеса фармацевтический состав (например, 400 мг ацикловира или молярного эквивалента его соли или пролекарства) вводят каждые 5 или более часов и менее чем 5 раз ежедневно. Лечение продолжают в течение 10 дней. Предпочтительно фармацевтический состав обеспечивает биологическую доступность (т.е. AUC), эквивалентную в значительной степени известным в настоящее время лекарственным составам ацикловира, продаваемым под маркой Zovirax® (US FDA NDA №18828, 19909 или 20089), когда 800 мг ацикловира вводят каждые 4 часа 5 раз ежедневно.
[24] Предпочтительно для осуществления постоянного подавляющего лечения рецидивов генитального герпеса состав вводят раз в день или реже. Лечение продолжают до 12 месяцев, после чего следует повторная оценка. Предпочтительно состав обеспечивает биологическую доступность (т.е. AUC), в значительной степени эквивалентную существующим составам ацикловира, продаваемым под маркой Zovirax® (US FDA NDA №18828, 19909 или 20089), когда:
(1) 400 мг ацикловира вводят 2 раза в день,
(2) 200 мг ацикловира вводят 3 раза в день,
(3) 200 мг ацикловира вводят 4 раза в день, или
(4) 200 мг ацикловира вводят 5 раз в день.
Лечение продолжают в течение 12 месяцев, после чего следует повторная оценка.
[25] Еще один вариант реализации настоящего изобретения представляет собой способ лечения ветряной оспы птиц у человека, нуждающегося в соответствующем лечении, путем введения (предпочтительно перорально) эффективной дозы состава в соответствии с настоящим изобретением. Предпочтительно состав (например, 80 мг/кг/день ацикловира или мольного эквивалента его соли или пролекарства) принимают каждые 5 или более часов и менее чем 4 раза в день. Детям (от 2 лет и старше) дозу вводят перорально 4 раза в день в количестве, которое обеспечивает биологическую доступность, эквивалентную 20 мг/кг на одну дозу существующих лечебных составов ацикловира, продаваемых под маркой Zovirax® (US FDA NDA №18828, 19909 или 20089). Взрослым или детям весом более 40 кг состав вводят 4 раза в день перорально в такой дозе, чтобы обеспечить биологическую доступность, эквивалентную 800 мг известных в настоящее время составов ацикловира, продаваемых под маркой Zovirax® (US FDA NDA №18828, 19909 или 20089).
[26] Еще один вариант реализации настоящего изобретения представляет собой способ изготовления состава в соответствии с настоящим изобретением путем смешивания по меньшей мере одного соединения для доставки и ацикловира или его соли, сложного эфира или пролекарства.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
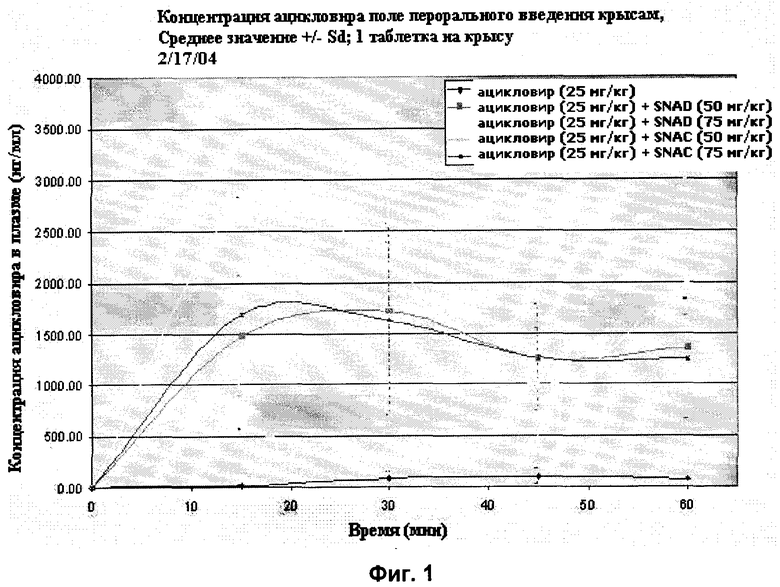
[27] Фиг.1 представляет собой график концентраций ацикловира в плазме (нг/мл ± стандартная ошибка) в зависимости от времени после перорального введения вместе и без агента доставки SNAC или SNAD с помощью методики, описанной в примере 1.
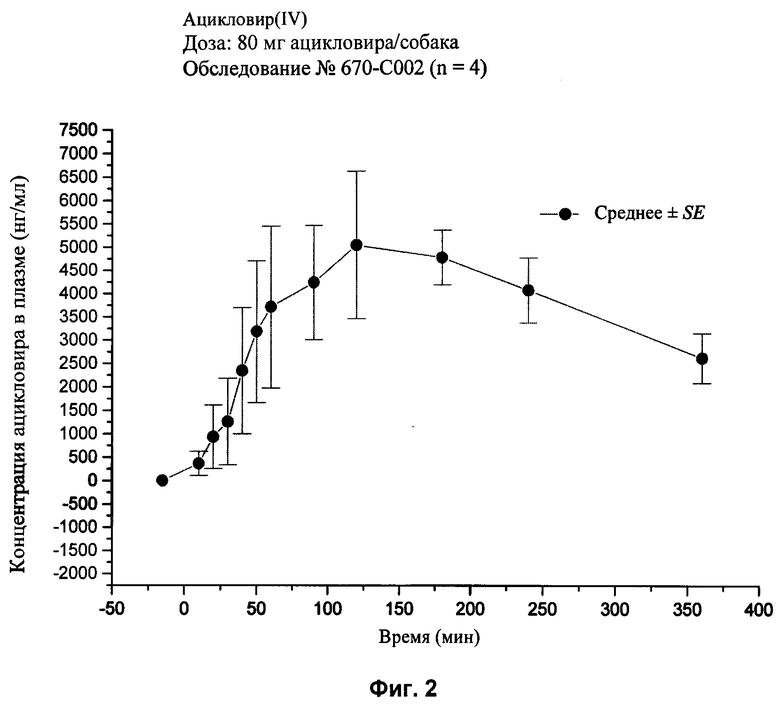
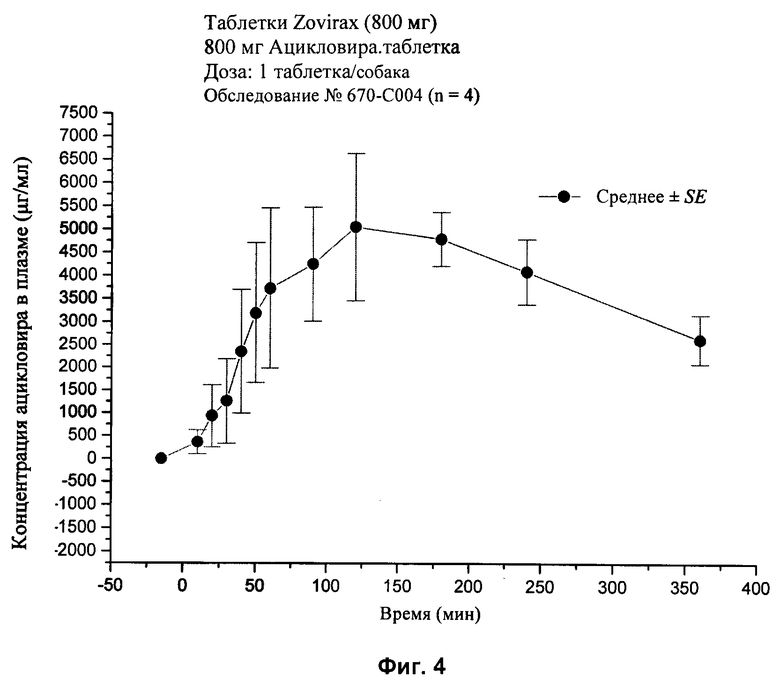
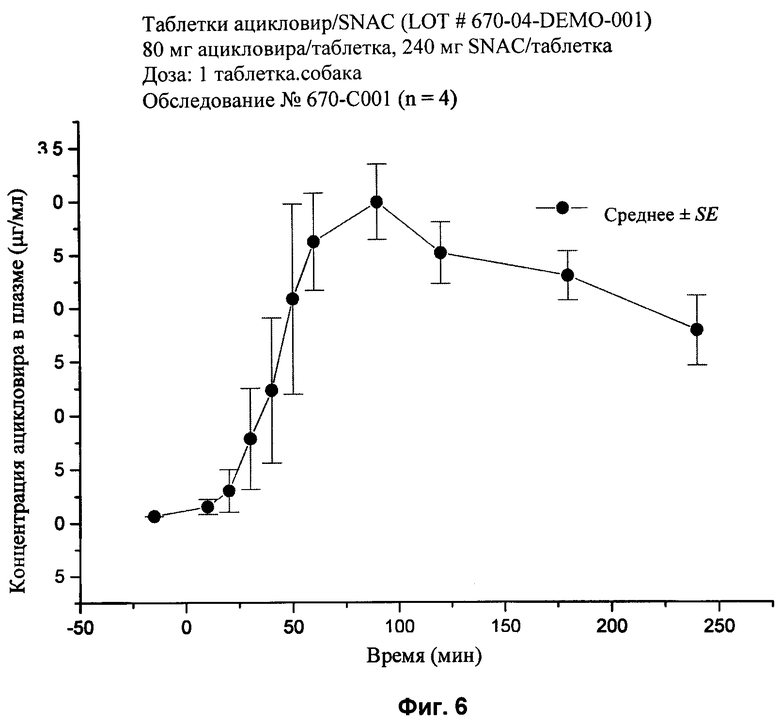
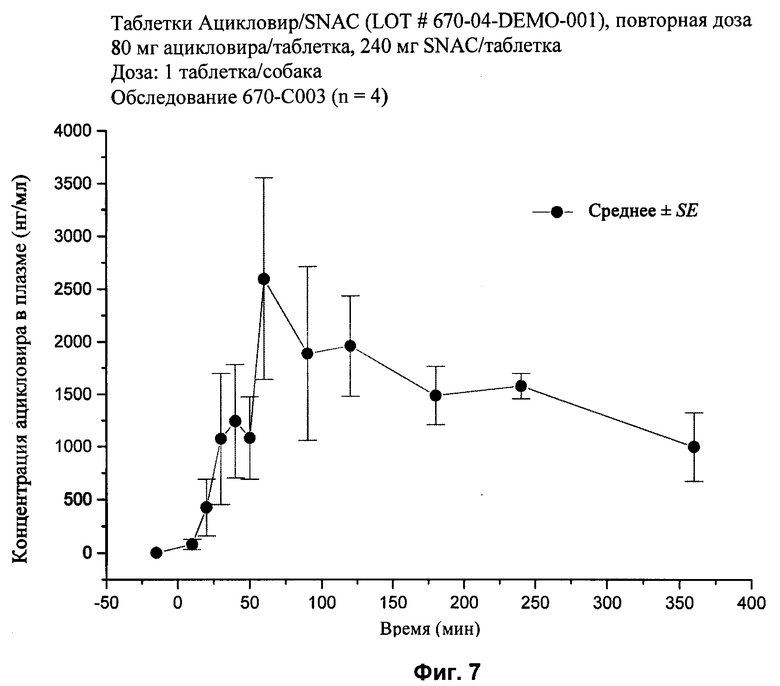
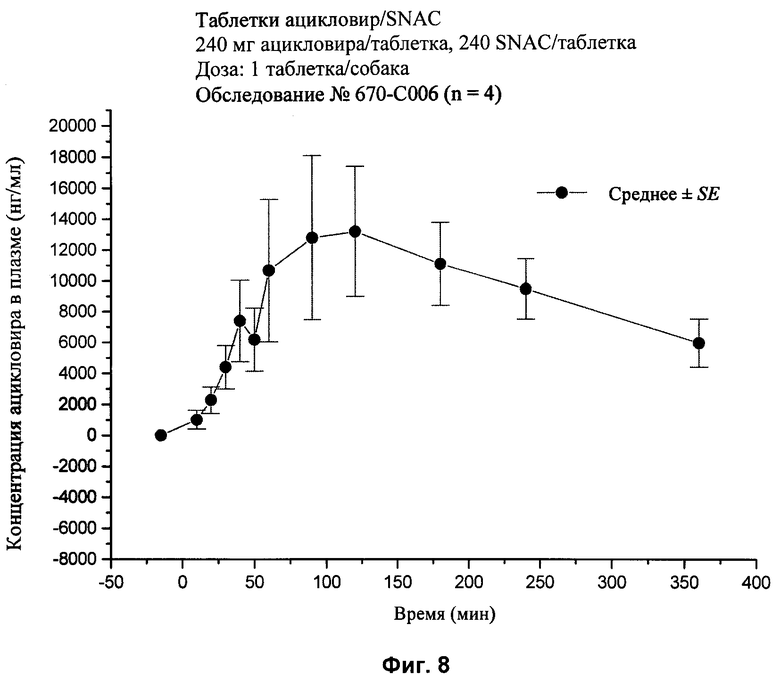
[28] На фиг.2, 4, и 6-10 представлены графики концентраций ацикловира в плазме (нг/мл ± стандартная ошибка) во времени после внутривенного или перорального введения вместе или без агента для доставки SNAC в соответствии с лекарственными составами 1, 3 и 5-9, показанными в табл.2, соответственно, с помощью методики, описанной в примере 2.
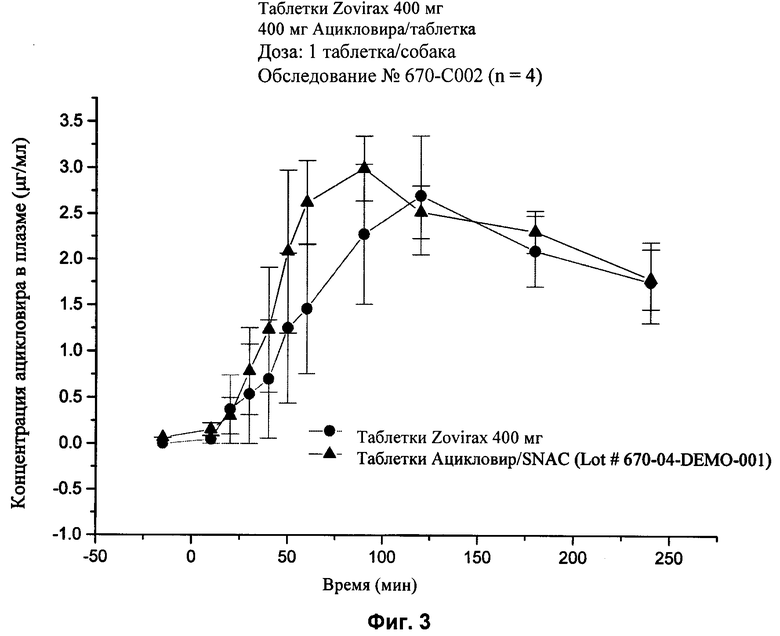
[29] На фиг.3 показаны графики концентраций ацикловира в плазме (нг/мл ± стандартная ошибка) в зависимости от времени после перорального введения (1) 400 мг ацикловира (без агента для доставки), состава 5 (показанного в табл.2) или (2) 80 мг ацикловира и 240 мг агента для доставки SNAC состава 2 (показанного в табл.2), соответственно, с помощью методики, описанной в примере 2.
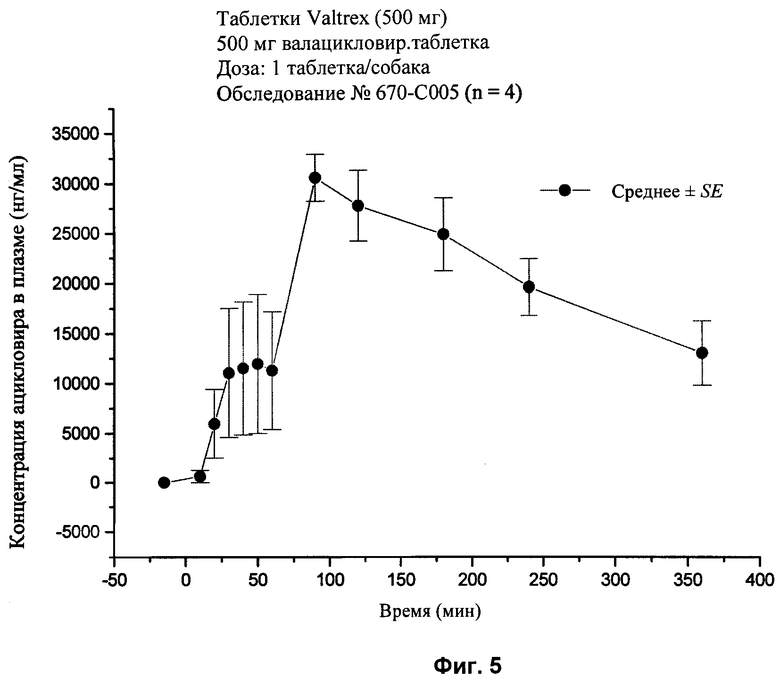
[30] На фиг.5 представлен график концентраций ацикловира в плазме (нг/мл ± стандартная ошибка) во времени после перорального введения валацикловира (без агента для доставки) состава 4, показанного в табл.2, соответственно, с помощью методики, описанной в примере 2.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
[31] Термин "гидрат", используемый в настоящем изобретении, включает, но не ограничен, (i) вещество, содержащее воду в молекулярной форме, и (ii) вещество кристаллической структуры, содержащее одну или более молекул кристаллической воды, или кристаллическое вещество, содержащее свободную воду.
[32] Термин "сольват", используемый в настоящем изобретении, включает, но не ограничен, молекулярный или ионный комплекс молекул или ионов растворителя с молекулами или ионами соединения для доставки или его соли, или его гидратом, или сольватом.
[33] Термин "агент для доставки" относится к любым соединениям для доставки, описанным в настоящем изобретении.
[34] Термин "SNAC" относится к мононатриевой соли N-(8-[2-гидроксибензоил]-амино)каприловой кислоты, если не указано другое. Если другое не указано, термин "SNAC" относится ко всем формам SNAC, включая все аморфные и полиморфные формы SNAC, в частности SNAC тригидрат, и те, которые описаны в патентах США с серийными номерами 60/619418 и 60/569476, каждый из которых включен в настоящее описание в качестве ссылки. Термин "SNAC тригидрат", используемый в настоящем изобретении, относится к кристаллической форме SNAC, в которой три молекулы воды связаны с каждой молекулой SNAC. SNAC можно изготовить с помощью способа, описанного в патенте США № 5650386 и международных публикациях № WO 00/46182 и № WO 00/59863.
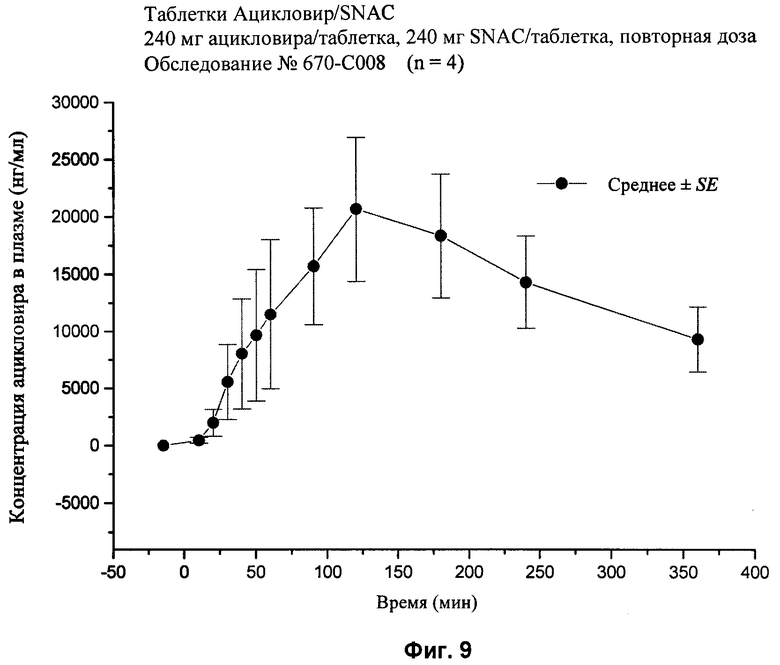
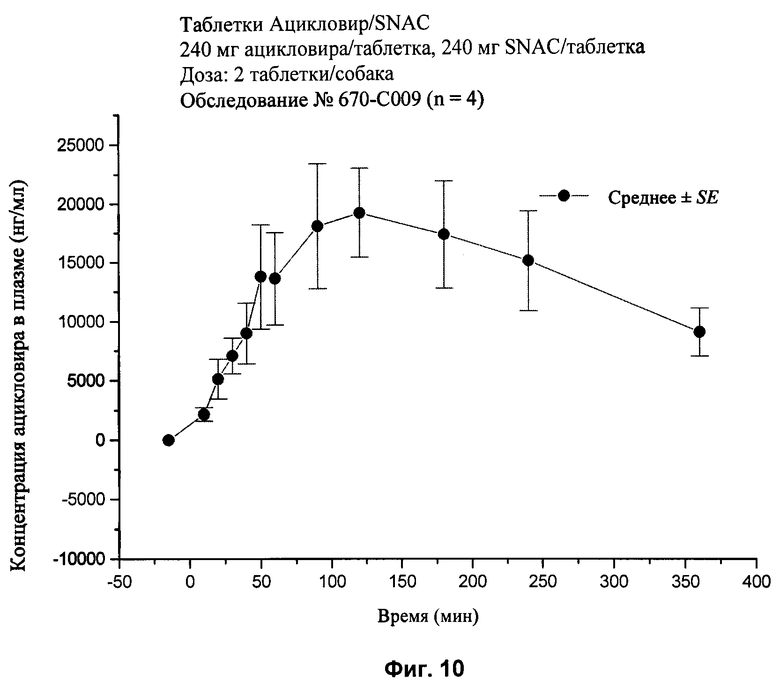
[35] Термин "SNAD" относится к мононатриевой соли N-(10-[2-гидроксибензоил]-амино)декановой кислоты, если только не указано другое. Термин "динатриевая соль SNAD" относится к динатриевой соли N-(10-[2-гидроксибензоил]-амино)декановой кислоты.
[36] Термин "эффективная доза ацикловира" представляет собой количество ацикловира, являющееся эффективным для лечения или предупреждения патологического состояния в живом организме, в который его вводят, в течение некоторого периода времени, например количество, которое обеспечивает терапевтический эффект в течение желаемого интервала между приемами лекарственного средства.
[37] "Эффективное количество агента доставки" представляет собой количество агента для доставки, которое позволяет и/или ускоряет всасывание желаемого количества ацикловира при любом способе введения (в частности, обсуждаемом в настоящей заявке, включая, но не ограничиваясь, пероральным (например, сквозь биологическую мембрану в желудочно-кишечном тракте), назальным, легочным, кожным, трансбуккальным, вагинальным и/или глазным способом).
[38] Термин "средняя величина", упоминающийся при фармакокинетической оценке (например, среднее значение пика), представляет собой среднеарифметическое значение фармакокинетического значения, если только не указано другое.
[39] Используемые в настоящем документе в формуле изобретения формы единственного числа артиклей "a," "an," и "the," включают также ссылки на множественное число, если только контекст ясно не определяет другое. Таким образом, например, упоминание о "молекуле" включает одну или более таких молекул, "реагенте" включает один или более таких различных реагентов, упоминание об "антителе" включает одно или более таких различных антител, а упоминание о "способе" включает упоминание о соответствующей последовательности операций и способах, известных специалистам в данной области, которые можно изменить или заменить на способы, описываемые в настоящем изобретении.
[40] Термин "примерно" в целом означает в пределах 10%, предпочтительно в пределах 5%, и более предпочтительно в пределах 1% от данного значения или уровня.
[41] Термин "алкил" и "алкенил", используемый в настоящем изобретении, включает прямые и разветвленные алкил- и алкенил-заместители соответственно.
[42] Фраза "фармацевтически приемлемый" относится к добавкам или составам, которые являются физиологически переносимыми и обычно не вызывают аллергических или сходных с ними реакций отторжения, в частности расстройство желудка, головокружения и ему подобных, при введении лекарства млекопитающему.
[43] Под термином "патологическое состояние или расстройство, вызванное вирусом" понимают любое патологическое состояние или расстройство у животного, которое вызвано вирусом или осложнено и усугублено вирусом. Такие состояния или расстройства включают, но не ограничены только теми, которые вызваны вирусами семейства герпеса, например вирусами простого герпеса 1 и 2 (HSV 1, HSV 2), вирусом ветряной оспы (VZV), цитомегаловирусом (CMV), вирусом Эпштейна-Барра (EBV) и другими герпетическими вирусными инфекциями (например, кошачьими герпетическими вирусными инфекциями).
[44] Используемый в настоящем изобретении термин "лечение" включает один или более из нижеследующих:
(а) остановка, замедление начала (т.е. периода, предшествующего клиническому проявлению расстройства) и/или снижение риска развития или усугубления расстройства;
(б) облегчение или смягчение по меньшей мере одного симптома расстройства у млекопитающего, включая, например, гиперкальцемию; или
(в) облегчение или смягчение интенсивности и/или продолжительности проявления расстройства, испытываемого млекопитающим, включая те из них, но не ограничиваясь только теми, которые отвечают на данное стимулирующее воздействие (например, стресс, повреждение тканей или низкая температура). Термин "лечение" также включает профилактическое предупреждение, лечение, исцеление, смягчение, облегчение, изменение, излечение, улучшение, выздоровление или влияние на состояние (например, на заболевание), симптомы состояния или предрасположенность к состоянию.
Ацикловир
[45] Термин "ацикловир" относится к 9-(2-гидроксиэтоксиметил)гуанину. Используемые соли (например, фармацевтически приемлемые соли) и сложные эфиры ацикловира описаны в патенте США №4199574, который включен в настоящее описание в качестве ссылки, и включают, но не ограничены только, ацикловир натрия и валерат ацикловира. Ацикловир также образует соли при присоединении кислот, в частности соляной, серной, фосфорной, малеиновой, фумаровой, лимонной, тартаровой, молочной и уксусной кислотами.
[46] Синтез ацикловира описан в патенте США №4199574, который включен в настоящее описание в качестве ссылки. Ацикловир серийно выпускает GlaxoSmithKline (Research Triangle Park, NC) под торговой маркой Zovirax™.
[47] Можно также использовать любое пролекарство, которое превращается организме в 9-(2-гидроксиэтоксиметил)гуанин. Термин "пролекарство", используемый в настоящем изобретении, включает фармацевтически приемлемые соли препарата. Пролекарства ацикловира включают замещенные пурины формулы:
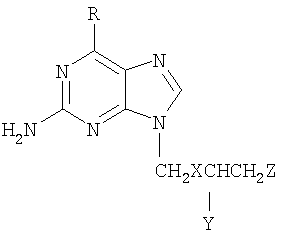
или их соли, где
R представляет собой водород, гидрокси или амино-;
X представляет собой кислород или серу;
Y представляет собой водород или гидроксиметил; и
Z представляет собой -Н, С1-16 алкил, или -OCOCH(R1)NH2, причем R1 представляет собой -СН[СН3]2.
[48] Используемые пролекарства ацикловира включают, но не ограничены только теми, которые описаны в патентах США №№4609662, 4758572 и 4957924, каждый их которых включен в настоящее описание в качестве ссылки. Неограничивающий пример такого пролекарства представляет собой 2-[(2-амино-1,6-дигидро-6-оксо-9Н-пурин-9-ил)метокси]этиловый эфир (валацикловир) и его фармацевтически приемлемые соли. Валацикловир серийно выпускает GlaxoSmithKline (Research Triangle Park, NC) под торговой маркой Valtrex™ в виде соли гидрохлорида.
[49] Терапевтически эффективные дозы ацикловира для использования при лечении патологических состояний и расстройств, описанных в настоящем документе, представляют собой дозу, достаточную для подавления или смягчения состояний, связанных с вирусной инфекцией. Как признано специалистами в данной области, эффективная доза терапевтического агента будет варьироваться в связи со многими факторами, включая активность ацикловира или его соли, сложного эфира или пролекарства, возраст и вес пациента, и опасность патологического состояния или расстройства при лечении.
[50] В соответствии с одним из вариантов реализации настоящего изобретения ацикловир (или его соль, сложный эфир, пролекарство) вводят (например, периферическим путем) в дозировке от примерно от 0.1 до примерно 250 мг на килограмм веса тела реципиента в день (мг/кг/день), от примерно от 1 до примерно 100 мг/кг/день, или от примерно от 5 до примерно 20 мг/кг/день (исходя из массы ацикловира). В соответствии с другим вариантом реализации настоящего изобретения дозировка составляет примерно 10 мг/кг/день. Желаемую дозировку можно вводить в один прием или разделить на дозы.
[51] Ацикловир и соединение для доставки можно принимать по отдельности или вместе с одним или более другими активными агентами. Например, ацикловир и соединение для доставки можно вводить отдельно или вместе с соединениями или составами, которые проявляют противовирусную активность, в частности соединения, используемые для лечения ретровирусных инфекционных заболеваний (в особенности ВИЧ инфекционных заболеваний), например 3'-азидо-3'-деокситимидин (AZT) и/или соединения или составы, которые проявляют активность в качестве ингибиторов рибонуклеотидредуктазы. Используемые ингибиторы рибонуклеотидредуктазы включают, но не ограничены только, ингибиторы тиокарбоногидразонрибонуклеотидредуктазы, в частности те, которые описаны в патенте США №5393883, который включен в настоящее описание в качестве ссылки.
Соединения для доставки
[52] Соединение для доставки может быть любым из тех, которые описаны в 6699467, 6663898, 6693208, 6693073, 6693898, 6663887, 6646162, 6642411, 6627228, 6623731, 6610329, 6558706, 6525020, 6461643, 6461545, 6440929, 6428780, 6413550, 6399798, 6395774, 6391303, 6384278, 6375983, 6358504, 6346242, 6344213, 6331318, 6313088, 6245359, 6242495, 6221367, 6180140, 6100298, 6100285, 6099856, 6090958, 6084112, 6071510, 6060513, 6051561, 6051258, 6001347, 5990166, 5989539, 5976569, 5972387, 5965121, 5962710, 5958451, 5955503, 5939381, 5935601, 5879681, 5876710, 5866536, 5863944, 5840340, 5824345, 5820881, 5811127, 5804688, 5792451, 5776888, 5773647, 5766633, 5750147, 5714167, 5709861, 5693338, 5667806, 5650386, 5643957, 5629020, 5601846, 5578323, 5541155, 5540939, 5451410, 5447728, 5443841, и 5401516; в международных публикациях под номерами WO 94/23767, WO 95/11690, WO 95/28920, WO 95/28838, WO 96/10396, WO 96/09813, WO 96/12473, WO 97/36480, WO 2004/4104018, WO 2004080401, WO 2004062587, WO 2003/057650, WO 2003/057170, WO 2003/045331, WO 2003/045306, WO 2003/026582, WO 2002/100338, WO 2002/070438, WO 2002/069937, WO 02/20466, WO 02/19969, WO 02/16309, WO 02/15959, WO 02/02509, WO 01/92206, WO 01/70219, WO 01/51454, WO 01/44199, WO 01/34114, WO 01/32596, WO 01/32130, WO 00/07979, WO 00/06534, WO 00/06184, WO 00/59863, WO 00/59480, WO 00/50386, WO 00/48589, WO 00/47188, WO 00/46182, WO 00/40203, WO 99/16427, WO 98/50341, WO 98/49135, WO 98/34632, WO 98/25589, WO 98/21951, WO 97/47288, WO 97/31938, WO 97/10197, WO 96/40076, WO 96/40070, WO 96/39835, WO 96/33699, WO 96/30036, WO 96/21464, WO 96/12475, и WO 96/12474; и в опубликованных заявках США под номерами 20040110839, 20040106825, 20040068013, 20040062773, 20040022856, 20030235612, 20030232085, 20030225300, 20030198658, 20030133953, 20030078302, 20030072740, 20030045579, 20030012817, 20030008900, 20020155993, 20020127202, 20020120009, 20020119910, 20020102286, 20020065255, 20020052422, 20020040061, 20020028250, 20020013497, 20020001591, 20010039258, и 20010003001. Каждый из выше перечисленных патентов США и каждая из опубликованных международных патентных заявок и патентных заявок США полностью включены в настоящее описание в качестве ссылки.
[53] Неограничивающие примеры соединений для доставки включают N-(8-[2-гидроксибензоил]-амино)каприловую кислоту, N-(10-[2-гидроксибензоил]-амино)декановую кислоту, 8-(2-гидрокси-4-метоксибензоиламино)октановую кислоту, 8-(2,6-дигидроксибензоиламино)октановую кислоту, 8-(2-гидрокси-5-бромобензоиламино)октановую кислоту, 8-(2-гидрокси-5-хлоробензоиламино)октановую кислоту, 8-(2-гидрокси-5-иодобензоиламино)октановую кислоту, 8-(2-гидрокси-5-метилбензоиламино)октановую кислоту, 8-(2-гидрокси-5-фторобензоиламино)октановую кислоту, 8-(2-гидрокси-5-метоксибензоиламино)октановую кислоту, 8-(3-гидроксифенокси)октановую кислоту, 8-(4-гидроксифенокси)октановую кислоту, 6-(2-цианофенокси)гексановую кислоту, 8-(2-гидроксифенокси)октилдиэтаноламин, 8-(4-гидроксифенокси)октаноат, 8-(4-гидроксифенокси)октаноат, 8-(2-гидрокси-4-метоксибензоиламино)октановую кислоту, 8-(2-гидрокси-5-метоксибензоиламино)октановую кислоту, и их соли. Предпочтительные соли включают, но не ограничены только, их мононатриевые и динатриевые соли.
[54] Соединения для доставки могут быть в форме карбоновой кислоты или их фармацевтически приемлемых солей, в частности солей натрия и их гидратов или сольватов. Соли могут быть одно- или многовалентными, в частности мононатриевые соли и динатриевые соли. Соединения для доставки могут содержать различные противоионы, выбранные, например, из-за их влияния на изменение параметров растворения носителя.
[55] Соединения для доставки можно изготовить способами, известными в данной области, в частности, теми, которые описаны в упомянутых выше публикациях (например, международных публикациях под номерами WO 98/34632, WO 00/07979, WO 01/44199, WO 01/32596, WO 02/20466, и WO 03/045306). SNAC, SNAD и их свободную кислоту и другие соли можно приготовить способами, известными в данной области, в частности, теми, которые описаны в патентах США №5650386 и 5866536.
[56] Соли соединений для доставки в соответствии с настоящим изобретением можно изготовить способами, известными в данной области. Например, соли натрия можно изготовить путем растворения соединения для доставки в этаноле и добавления водного раствора гидроксида натрия.
[57] Соединение для доставки можно очистить с помощью перекристаллизации или путем разделения на фракции на одном или более твердых хроматографических носителях, на единичном или нескольких, соединенных последовательно. Используемые системы растворителей для перекристаллизации включают, но не ограничены только, ацетонитрил, метанол и тетрагидрофуран. Фракционирование можно осуществить на подходящем хроматографическом носителе, в частности, на окиси алюминия, используя смесь метанол/н-пропанол в качестве подвижной фазы; с помощью обращенно-фазной хроматографии с использованием смеси трифторуксусной кислоты/ацетонитрила в качестве подвижной фазы; или с помощью ионообменной хроматографии с использованием воды или подходящего буфера в качестве подвижной фазы. Во время осуществления анионообменной хроматографии предпочтительно используют 0-500 мМ градиент хлорида натрия.
Системы доставки
[58] Состав, в соответствии с настоящим изобретением, включает одно или более соединений для доставки в соответствии с настоящим изобретением и ацикловир. Соединение для доставки и ацикловир обычно смешивают перед применением, получая состав для введения.
[59] Составы для введения могут быть в жидком виде. Растворяющим агентом может быть вода, 25% водный раствор пропиленгликоля или фосфатный буфер. Другие растворители включают полиэтиленгликоль. Дозированные растворы можно приготовить путем смешивания раствора соединения для доставки с раствором активного агента сразу перед введением. Поочередно раствор соединения для доставки (или ацикловир) можно смешать с ацикловиром в твердой форме (или соединением для доставки). Соединение для доставки и ацикловир можно также смешать в виде сухого порошка. Соединение для доставки и ацикловир можно также смешать во время процесса изготовления.
[60] Дозированные растворы могут содержать добавки, в частности, соли фосфатного буфера, лимонную кислоту, гликоли или другие диспергирующие вещества. Стабилизирующие добавки могут быть добавлены в раствор предпочтительно с уровнем концентрации между примерно 0.1 и 20% (мас.).
[61] Например, составы, полезные для целей настоящего изобретения, могут быть предусмотрены в качестве парентеральных составов (например, инъекций или внутривенных вливаний). В соответствии с одним из вариантов реализации настоящего изобретения состав суспензирован в водном носителе, в частности в изотоническом буферном растворе при рН примерно от 3.0 до примерно 8.0. Используемые буферы включают, но не ограничены только, буферные растворы цитрата натрия - лимонной кислоты, фосфата натрия - фосфорной кислоты, и ацетата натрия/уксусной кислоты.
[62] Можно также использовать форму длительного воздействия или "складирования" медленно поступающего препарата таким образом, что терапевтически эффективные дозы лекарства поступают в кровообращение в течение многих часов или дней следом за введением через кожу или после введения.
[63] В качестве альтернативы, составы для введения могут быть в твердой форме, в частности в виде таблеток, капсул или в измельченном виде, в частности в виде порошков или в саше (пакетиках). Твердые дозированные формы можно изготовить путем смешивания твердой формы соединения с ацикловиром в твердом виде. В качестве альтернативы твердую форму можно получить из раствора соединения и ацикловира с помощью способов, известных специалистам в этой области, в частности лиофилизацией, осаждением, кристаллизацией и дисперсией твердой фазы. В качестве альтернативы введение лекарства может быть в полутвердом виде, в форме геля, пасты, коллоида, желе, эмульсии, суспензии и им подобных.
[64] Составы для введения в соответствии с настоящим изобретением могут также включать один или более ингибиторов ферментов. Такие ингибиторы включают, но не ограничены только, такие соединения, как актинонин или эпиактинонин и их производные. Другие ингибиторы ферментов включают, но не ограничены только, апротинин (тразилол) и ингибитор Боумена-Берка (Bowman-Birk).
[65] Доза ацикловира, используемая в составе для введения, в соответствии с настоящим изобретением, представляет собой количество, эффективное для лечения установленных симптомов. Тем не менее, доза может быть меньше дозировки, используемой в лекарственной форме, так как единичная дозированная форма может включать множество сочетаний соединения для доставки/ацикловир, и такие составы могут включать разделенную эффективную дозу. Полную эффективную дозу с кумулятивным действием можно, таким образом, ввести частями, содержащими в целом эффективную дозу ацикловира. Более того, специалистами в данной области признано, что эффективная доза ацикловира будет меняться в зависимости от многих факторов, включая возраст и вес пациента, физическое состояния пациента, также как и от других факторов.
[66] Полную дозу используемого ацикловира можно определить способами, известными специалистам в данной области. Однако так как составы, в соответствии с настоящим изобретением, могут доставлять ацикловир более эффективно, чем составы, содержащие ацикловир, в предшествующих единичный дозированных формах или системах доставки, человеку можно вводить более низкие дозы ацикловира, одновременно достигая того же уровня лекарства в крови и/или терапевтического эффекта.
[67] В соответствии с одним из способов настоящего изобретения ацикловир (или его соль, сложный эфир, пролекарство) вводят (например, периферическим путем) в дозировке примерно от 0.1 до примерно 250 мг на килограмм веса тела реципиента в день (мг/кг/день), примерно от 1 до примерно 100 мг/кг/день, или примерно от 5 до примерно 20 мг/кг/день (исходя из массы ацикловира). В соответствии с другим вариантом настоящего изобретения дозировка составляет примерно 10 мг/кг/день. Желаемую дозировку можно вводить как за один раз, так и разделенной на порции.
[68] Настоящее изобретение также включает фармацевтические составы и формы дозировки, которые включают упомянутые выше дозировки ацикловира и по меньшей мере один агент для доставки.
[69] В основном, эффективную дозу агента для доставки вводят с ацикловиром, чтобы ускорить поступление препарата. В соответствии с одним из вариантов реализации настоящего изобретения мольное отношение дозы агента для доставки к ацикловиру колеблется примерно от 20:1 до примерно 1:1, примерно от 10:1 до примерно 2:1, или примерно от 5:1 до примерно 2:1. [70] Описанные в настоящем изобретении соединения для доставки ускоряют поступление ацикловира, в особенности, при введении перорально, интраназально, подъязычным способом, через двенадцатиперстную кишку, подкожно, трансбуккально, через толстую кишку, через прямую кишку, вагинально, через слизистые оболочки, легочным путем, через кожу, интрадермально, парентерально, внутрибрюшинно, внутривенно, внутримышечно и через глазную систему, также как и путем пересечения гематоэнцефалического барьера. Составы и единичные дозированные формы, в соответствии с настоящим изобретением, можно вводить любым путем, упомянутым выше.
[71] Единичные дозированные формы могут также включать один любой или комбинацию наполнителей, растворителей, агентов, вызывающих дезинтеграцию, скользящих веществ, пластификаторов, красителей, ароматизаторов, вкусовых добавок, Сахаров, заменителей сахара, солей, а также носителей, включая, но не ограничиваясь, только воду, 1,2-пропандиол, этанол, оливковое масло или любые их комбинации.
[72] Составы формулы изобретения, используемые для введения биологически или химически активных агентов любому животному включают, но не ограничиваются только, птиц, в частности кур; рыбу, рептилий, млекопитающих, в частности грызунов, коров, свиней, собак, кошек, приматов, и в особенности человека, а также насекомых.
Способы лечения
[72] Состав, в соответствии с настоящим изобретением, может лечить любое расстройство, которое лечат с помощью ацикловира или его солей (например, натрий ацикловира) или пролекарств (например, валацикловира), включая описанные в Physicians' Desk Reference (58th Ed., 2004, Medical Economics Company, Inc., Montvale, NJ).
Такие расстройства включают, но не ограничены только, те, которые описаны выше или в патентах, или других публикациях, упомянутых выше. Неограничивающими примерами таких заболеваний являются:
(1) вирус простого герпеса 1 (HSV 1),
(2) вирус простого герпеса 2 (HSV 2),
(3) вирус опоясывающего лишая (VZV),
(4) цитомегаловирус (CMV),
(5) вирус Эпштейна-Барра (EBV),
(6) другие инфекционные заболевания, вызванные вирусом герпеса (например, кошачьи герпетические вирусные инфекции),
(7) герпетический кератит,
(8) герпетический энцефалит,
(9) герпетические лихорадки и генитальные инфекционные заболевания (вызванные простым герпесом),
(10) ветряная оспа птиц,
(11) опоясывающий лишай (вызванный вирусом ветряной оспы),
(12) CMV-пневмония и ретинит, в особенности у пациентов с нарушениями иммунитета, включая пациентов с пересаженной почкой и трансплантатом костного мозга и пациентов с синдромом приобретенного иммунодефицита (ВИЧ, AIDS),
(13) инфекционный мононуклеоз, рак носоглотки, иммунобластная лимфома, лимфосаркома Беркитта и лейкоплакия ворсистых клеток, вызванные вирусом Эпштейна-Барра (Epstein-Barr virus, EVB),
(14) опоясывающий герпес, и
(15) первичные случаи и/или лечение рецидивных случаев генитального герпеса.
ПРИМЕРЫ
[74] Следующие примеры иллюстрируют настоящее изобретение без каких-либо ограничений. Все составляющие даны в массовых единицах, если только не определено другое.
Пример 1 - Пероральная доставка ацикловира в твердом виде крысам
[75] Используемая дозировка ацикловира составляла 25 мг/кг веса тела. Доза агента для доставки составила 50 или 75 мг/кг веса тела.
[76] Примерно 6.25 мг/таблетка ацикловира было смешано с 12.5 или 18.75 мг/таблетка (50 и 75 мг/кг соответственно) соединения длядоставки. Верхний пуансон, нижний пуансон и шаблон ручного пресса для изготовления таблеток Carver 4350 вместе с фасонным шаблоном для изготовления таблеток в виде капсул, которые продает Natoli Engineering Company, Inc., обрабатывали стеаратом магния (0.1%). Примерно 6.25 мг (чистого ацикловира), 18.75 мг (ацикловир + 50 мг/кг соединения для доставки) или 25 мг (ацикловир + 75 мг/кг соединения для доставки) в виде перемешанного порошка помещали в шаблон и под давлением примерно 1000 фунтов на квадратный дюйм (pound per square inch, PSI) изготавливали таблетку в форме маленького шарика. Получившиеся твердые дозированные формы составляли 2.65 мм в диаметре и примерно 8.40 мм в длину для 25 мг таблеток, 6.3 мм в длину для 18.75 мг таблеток и 2.1 мм в длину для 6.25 мг таблеток.
[77] Мужских особей крыс Sprague Dawley (весом ~250 г) выдерживали без пищи в течение ночи, а затем примерно в течение 10 секунд им вводили ингаляционный наркоз с помощью стандартного способа вдыхания CO2, в результате чего было достигнуто состояние обезболивания менее чем на одну минуту.
[78] Использовали ротовую дозировочную трубку. Дозировочную трубку вводили в рот крысы и осторожно проталкивали через глотку и пищевод примерно от 8 см до примерно15 см, в зависимости от веса крысы (обычно примерно на 11 см). Твердую дозированную форму вводили в удаленную часть пищевода и/или желудка с помощью надавливания на поршень ротовой дозировочной трубки.
[79] Образцы крови брали периодически из ретроглазничного синуса через 0, 15, 30, 45, и 60 минут. Образцы собирали на водный лед в содержащие гепарин трубки. Образцы центрифугировали и отделяли плазму. Образцы плазмы сохраняли до проведения анализов в холодильнике при -20°С. Концентрации ацикловира в плазме определяли, используя сочетание метода жидкостной хроматографии с масс-спектрометрией (анализ выполняла Quest Pharmaceutical Services, Newark, DE). Результаты анализов у животных из каждой группы усредняли для каждого момента времени. Максимум этих средних (т.е. значение пика концентрации ацикловира в плазме ± стандартное отклонение (standard deviation, SD)) указаны ниже в табл.1. Результаты также показаны на фиг.1.
[80] Агент для доставки 1 представляет собой мононатриевую соль N-(8-[2-гидроксибензоил]-амино)каприловой кислоты (SNAC).
[81] Агент для доставки 2 представляет собой мононатриевую соль N-(10-[2-гидроксибензоил]-амино)декановой кислоты (SNAD).
Пример 2 - Доставка ацикловира собакам
[82] Шесть различных дозированных форм для перорального применения (таблетки) вводили собакам: (1) единичные твердые формы для перорального применения, содержащие 80 мг ацикловира и 240 мг агента для доставки, мононатриевая соль N-(8-[2-гидроксибензоил]-амино)каприловой кислоты (SNAC), (2) твердая дозированная форма для перорального применения, содержащая 400 мг ацикловира (Zovirax™, серийно производимый GlaxoSmithKline), (3) твердая дозированная форма для перорального применения, содержащая 800 мг дозировки (Zovirax™, серийно производимая GlaxoSmithKline), (4) твердая дозированная форма для перорального применения, содержащая 500 мг дозировки валацикловира (Valtrex™, серийно производимая GlaxoSmithKline) и (6) единичная твердая дозировка для перорального применения, содержащая 240 мг ацикловира и 240 мг агента для доставки SNAC. Пероральное введение одного ацикловира и вместе с агентом для доставки сравнивали с внутривенной дозированной формой, содержащей 80 мг ацикловира (Zovirax™ для инъекций, серийно выпускаемой GlaxoSmithKline).
[83] Единичные дозировки ацикловира и агента для доставки приготовляли следующим образом. Примерно 240 мг/таблетка SNAC смешивали с 80 или 240 мг/таблетка ацикловира. Верхний пуансон, нижний пуансон и шаблон ручного пресса для изготовления таблеток Carver 4350 вместе с фасонным шаблоном для изготовления таблеток в виде капсул, которые продает Natoli Engineering Company, Inc., были обработаны стеаратом магния (0.1%). Приблизительно 320 мг (80 мг ацикловира и 240 мг SNAC), или 480 мг (240 мг ацикловира и 240 мг SNAC), смешанных в порошок помещали в шаблон и под давлением примерно 1000 фунтов на квадратный дюйм (pound per square inch, PSI) была изготовлена таблетка в форме маленького шарика.
[84] Каждой собаке вводили дозу, как описано в табл.2. Концентрации ацикловира в плазме определяли с использованием сочетания метода жидкостной хроматографии с масс-спектрометрией. Максимум пика концентрации ацикловира в плазме и область под кривой (area under the curve, AUC) отражены ниже в табл.2. Результаты экспериментов 1-9 также показаны на фиг.2-10 соответственно.
[85] Упомянутые выше патенты, заявки, способы тестирования и публикации полностью включены в настоящее описание в качестве ссылок.
[86] Предполагается, что многие варианты реализации настоящего изобретения известны специалистам в данной области в свете предыдущего подробного описания. Все такие очевидные видоизменения полностью соответствуют предполагаемой области охвата прилагаемой формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ИНГИБИТОРОВ SGLT2 | 2009 |
|
RU2530494C2 |
| ЦИКЛИЧЕСКИЕ ДЕЗОКСИРИБОНУКЛЕОТИДНЫЕ СОЕДИНЕНИЯ | 2020 |
|
RU2836016C2 |
| СОСТАВЫ И СМЕСИ ДЛЯ ДОСТАВКИ АКТИВНЫХ АГЕНТОВ | 2005 |
|
RU2403237C2 |
| СОЕДИНЕНИЯ И СОСТАВЫ ДЛЯ ДОСТАВКИ АКТИВНЫХ ВЕЩЕСТВ | 2005 |
|
RU2530889C2 |
| ПРОИЗВОДНЫЕ ЭФИРОВ ФОСФОНОВЫХ КИСЛОТ И СПОСОБЫ ИХ СИНТЕЗА | 2011 |
|
RU2581045C2 |
| ФОСФОНАТНЫЕ СОЕДИНЕНИЯ | 2000 |
|
RU2258707C2 |
| ИНГИБИТОРЫ CXCL8 ДЛЯ ПРИМЕНЕНИЯ В ЛЕЧЕНИИ COVID-19 | 2021 |
|
RU2830584C1 |
| 2-(2-АМИНО-1,6-ДИГИДРО-6-ОКСОПУРИН-9-ИЛ)-МЕТОКСИ-3-ГИДРОКСИ-1-ПРОПАНИЛ-L-ВАЛИНАТ, ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ, СПОСОБ ЕГО ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ГИДРОКСИ- И/ИЛИ АМИНОЗАЩИЩЕННЫЙ 2-(2-АМИНО-1,6-ДИГИДРО-6-ОКСОПУРИН-9-ИЛ)-МЕТОКСИ-3-ГИДРОКСИ-1-ПРОПАНИЛ-L-ВАЛИНАТ | 1995 |
|
RU2133749C1 |
| ИНГИБИТОРЫ ВИРУСА ГЕПАТИТА С | 2010 |
|
RU2544010C2 |
| НУКЛЕОЗИДНЫЕ АНАЛОГИ С КАРБОКСАМИДИН-МОДИФИЦИРОВАННЫМ МОНОЦИКЛИЧЕСКИМ ОСНОВАНИЕМ | 2001 |
|
RU2259831C2 |
Настоящее изобретение относится к химико-фармацевтической промышленности и касается способа изготовления лекарственных составов ацикловира с улучшенной биологической доступностью. Изобретение также относится к единичной дозированной форме ацикловира, способу ее введения, способу лечения вирусного заболевания и способу улучшения биологической доступности ацикловира. Изобретение обеспечивает повышенную эффективность лечения вирусных инфекционных заболеваний у пациента и сокращение числа приема лекарственного средства пациентом. 9 н. и 7 з.п. ф-лы, 2 табл., 10 ил.
1. Фармацевтический состав, включающий (а) ацикловир и (б) агент доставки формулы
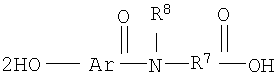
или его соль,
где Ar представляет собой фенил или нафтил; при этом
Ar возможно замещен одним или более из -ОН, галогена, С1-С4алкила, C1-С4алкенила, С1-С4алкокси или С1-С4 галоалкокси;
R7 представляет собой С4-С20 алкил, C4-C20 алкенил, фенил, нафтил, (C1-С10 алкил)фенил, (C1-С10 алкенил)фенил, (C1-С10 алкил)нафтил, (C1-С10 алкенил)нафтил, фенил(С1-С10 алкил), фенил(С1-С10 алкенил), нафтил(С1-С10 алкил), или нафтил(С1-С10 алкенил);
R8 представляет собой водород, C1 до C4 алкил, С2 до С4, алкенил, C1 до C4 алкокси, или C1-C4 галоалкокси; при этом
R7 возможно замещен C1 до С4 алкилом, С2 до С4 алкенилом, C1 до С4 алкокси, C1-C4 галоалкокси, -ОН, -SH, -CO2R9, или их любой комбинацией;
R9 представляет собой водород, C1 до C4 алкил, или С2 до C4 алкенил; причем
R7 может быть прерван кислородом, азотом, серой или любой их комбинацией.
2. Фармацевтический состав, включающий (а) ацикловир и (б) агент доставки формулы
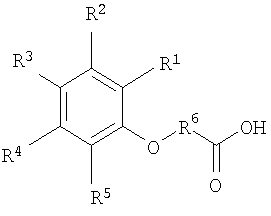
или его соль,
где R1, R2, R3, и R4 представляют собой независимо друг от друга Н, -ОН, галоген, C1-C4 алкил, С2-С4 алкенил, C1-C4 алкокси, -C(O)R8, -NO2, -NR9R10, или -N+R9R10R11(R12)-;
R5 представляет собой Н, -ОН, -NO2, галоген, -CF3, -NR14R15, -N+R14R15R16(R13)-, амид, C1-C12 алкокси, C1-C12 алкил, C2-С12 алкенил, карбамат, карбонат, мочевину, или -C(O)R18; причем
R5 возможно замещен галогеном, -ОН, -SH, или -СООН;
R5 возможно замещен О, N, S, или -С(O)-;
R6 представляет собой C1-C12 алкилен, C2-C12 алкенилен, или арилен; причем
R6 возможно замещен C1-C4 алкилом, C2-C4 алкенилом, C1-C4 алкокси, -ОН, -SH, галогеном, -NH2, или -CO2R8;
R6 возможно имеет прерывание цепи О или N;
R7 представляет собой связь или арилен; причем
R7 возможно замещенн -ОН, галогеном, -С(O)СН3, -NR10R11, или -N+R10R11R12(R13)-; при этом
каждый случай из R8 представляет собой независимо друг от друга Н, C1-C4 алкил, С2-С4 алкенил, или -NH2;
R9, R10, R11, и R12 представляют собой независимо друг от друга Н или C1-С10 алкил;
R13 представляет собой галогенид, гидроксид, сульфат, тетрафтороборат, или фосфат; и
R14, R15 и R16 представляют собой независимо друг от друга Н, C1-С10 алкил, С1-С10 алкил, замещенный -СООН, C2-C12 алкенилом, C2-C12 алкенил, замещенный -СООН, или -C(O)R17;
R17 представляет собой -ОН, C1-С10 алкил или C2-C12 алкенил; и
R18 представляет собой Н, C1-С6 алкил, -ОН, -NR14R15 или N+R14R15R16(R13)-.
3. Фармацевтический состав, включающий (а) ацикловир и (б) агент доставки формулы

или его соли,
где R1, R2, R3, R4 и R5 представляют собой независимо друг от друга Н, -CN, -ОН, -ОСН3 или галоген, причем по меньшей мере один из R1, R2, R3, R4 и
R5 представляет собой -CN; и
R6 представляет собой С1-С12 линейный или разветвленный алкилен, алкенилен, арилен, алкил(арилен) или арил(алкилен).
4. Фармацевтический состав по любому из пп.1, 2 или 3, отличающийся тем, что агент доставки выбран из группы, включающей агенты доставки SNAC или SNAD или их фармацевтически допустимые соли.
5. Фармацевтический состав по п.1, отличающийся тем, что агент доставки представляет собой N-(8-[2-гидроксибензоил]-амино)каприловую кислоту или ее фармацевтически допустимую соль.
6. Фармацевтический состав по п.1, отличающийся тем, что агент доставки представляет собой N-(10-[2-гидроксибензоил]-амино)декановую кислоту или ее фармацевтически допустимую соль.
7. Фармацевтический состав по любому из пп.1-3, 5 или 6, отличающийся тем, что фармацевтический состав обеспечивает биологическую доступность (т.е. AUC), по существу, эквивалентную составу ацикловира, продаваемого под торговой маркой Zovirax® (US FDA NDA №18828, 19909, или 20089), для введения:
(1) 200, 400, или 800 мг состава ацикловира каждые 4 ч 5 раз в день,
(2) 400 мг состава ацикловира 2 раза в день,
(3) 200 мг состава ацикловира 3 раза в день,
(4) 200 мг состава ацикловира 4 раза в день, или
(5) 200 мг состава ацикловира 5 раз в день.
8. Единичная дозированная форма, включающая:
(А) фармацевтические составы по любому из предшествующих пунктов; и
(Б) (а) наполнитель,
(б) растворитель,
(в) дезинтегратор,
(г) скользящее вещество,
(д) пластификатор,
(е) краситель,
(ж) носитель, или
(з) любую их комбинацию.
9. Единичная дозированная форма по п.8, отличающаяся тем, что единичная дозированная форма существует в виде таблетки, капсулы, гранул, порошка, пакетика, или жидкости.
10. Единичная дозированная форма по п.8, отличающаяся тем, что носитель представляет собой жидкость, выбранную из группы, включающей воду, водный раствор пропиленгликоля, фосфатный буфер, 1,2-пропандиол, этанол, и их любую комбинацию.
11. Способ введения эффективной дозы ацикловира пациенту, нуждающемуся в лечении, включающий фазу перорального введения фармацевтического состава в соответствии с любым из пп.1-8.
12. Способ лечения вирусного инфекционного заболевания у пациента, нуждающегося в таком лечении, включающий фазу введения пациенту эффективной дозы фармацевтического состава по любому из пп.1-8.
13. Способ лечения патологического состояния или расстройства, вызванных вирусом у пациента, нуждающегося в таком лечении, включающий фазу введения животному эффективной дозы фармацевтического состава по любому из пп.1-8.
14. Способ по п.13, отличающийся тем, что патологическое состояние или расстройство вызвано вирусом, выбранным из группы, включающей простой герпес 1, простой герпес 2, вирус опоясывающего лишая, цитомегаловирус и вирус Эпштейна-Барра.
15. Способ улучшения биологической доступности ацикловира у животного, нуждающегося в таком улучшении, включающий фазу введения состава по любому из пп.1, 2 или 3.
16. Способ изготовления фармацевтического состава, включающего фазу перемешивания по меньшей мере одного агента доставки по любому из пп.1-3 и ацикловира или его соли или пролекарства.
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Харкевич Д.А | |||
| Фармакология | |||
| - М.: Медицина, 1993, с.41-42 | |||
| UZ 2352 С2, 31.10.2003. | |||
Авторы
Даты
2010-12-20—Публикация
2005-05-19—Подача