Предлагаемое изобретение относится к белкам и биологически активным пептидам с иммуномодулирующей и противовирусной активностью.
Известны соединения пептидной, полипептидной и белковой природы, используемые в медицине в качестве антивирусных средств. Среди препаратов-индукторов интерферонов (ИФН) I-го типа известны как высокомолекулярные соединения [Ершов Ф.И., Киселев О.И. Интерфероны и их индукторы от молекулы до лекарства. - М.: изд. Геотар - Медиа, 2005 - стр.356], [Berg K., Bolt G., Andersen H., Owen T.C. Zink potentiates the antiviral action of human IFN-alpha tenfold. J. Interferon Cytokine Res, 2001, Jul; 21(7): 471-4], так и низкомолекулярные индукторы. Из вторых, прежде всего, следует отметить отечественный препарат циклоферон и американский препарат - имиквимод. Эти средства относятся к производным акридонов и бензимидазолов соответственно. Для имиквимода и близких производных известен тип Toll-like рецепторов, с которыми взаимодействует эта группа препаратов, вызывая индукцию синтеза ИФН-α в различных клетках [Ершов Ф.И., Киселев О.И. Интерфероны и их индукторы (от молекулы до лекарства). М.: «Изд. Геотар - Медиа», 2005. - Стр.356].
Широко известна биологическая активность низкомолекулярных пептидов. В первую очередь, это относится к пептидам животного и растительного происхождения с антибактериальной активностью [Boman H. Peptide antibiotics and their role in innate immunity. Anu. Rev. of Immunol., 1995, Vol.13, p.61-92]. Вместе с тем, описан ряд пептидов, которые обладают прямым противовирусным или противоопухолевым действием [Akiyama N., Hijikata М., Kobayashi A., Yamori Т., Tsuruo Т., Natori S. Anti-tumor effect of N-β-alanyl-5-S-glutathionyl dihydroxyphenylalanine (5-S-GAD) a novel anti-bacterial substance from an insect. Anticancer Research, 2000, Vol.20, p.357-362].
Особое место в этом ряду занимают пептиды земноводных и насекомых [Bulet P., Hetru С., Diamarcq J., Hoffmann D. Antimicrobial peptides in insects: structure and function. Devel. Comp. Immunol., 1999, Vol.23, p.329-344, Chinchar V.G., Wang J., Murti G., Carey C., Rolling-Smith L. Inactivation of frog virus 3 and channel catfish virus by esculentin-2P and ranatuerin-2P, two antimicrobial peptides isolated from frog skin. Virology, 2001, Vol.288, p.351-357].
Известны иммуномоделирующие пептиды - аллофероны (патент РФ №2172322). Основной областью применения аллоферонов является лечение вирусных инфекций. Аллофероны являются наиболее близкими аналогами предлагаемого изобретения по химической структуре и механизму действия.
Следует отметить, что авторы изобретения по патенту №2172322 рассматривают вариации только первичной структуры аллоферонов и не предают ключевого значения распределению остатков гистидина.
Кроме того, аллофероны следует отнести к достаточно «слабым» индукторам интерферона, что очевидно из сравнения их активности с циклофероном.
Вместе с тем, структура аллоферонов обращает на себя внимание регулярностью расположения остатков гистидина и повторяющимися остатками глицина. Совершенствование структуры аллоферонов возможно в направлении придания им элементов третичной структуры, например, путем введения ионов металлов.
Известен также геминпептид и его фармацевтически приемлемые соли, обладающий вирулецидным и противовирусным действием, содержащий ионы металла, в качестве которого может использоваться Zn, Cu, Fe, Mn (патент РФ 2296131). Однако данное соединение относится к другому классу пептидов и не является иммуномодулятором.
Комплексы пептидов с ионом Zn++, обладающие элементами организованной третичной структуры и активностью индукторов интерферона первого типа в литературе не описаны.
Необходимость модификации гистидинсодержащих пептидов ионом Zn++ обусловлена следующими причинами:
1. Биологически активные короткие пептиды имеют неорганизованный тип вторичной структуры, что неизбежно снижает их биологическую активность, способность к взаимодействию с другими макромолекулами, метаболическую стабильность.
2. Биологическая и фармакологическая активность пептидов в значительной степени зависит от эффективности транспорта в клетки. Придание пептидам компактной структуры повышает эффективность их транслокации через мембраны и, следовательно, фармакологическую активность [Leng Q., Mixson J. Modified branched peptides with histidine - rich tail enhance in vitro gene transfection. Nucl. Acids. Res., 2005, Vol.33, e40].
3. Образование комплексов гистидинсодержащих пептидов с ионом Zn++ приводит к принципиальному изменению свойств пептидов, делая их идентичными с доменами транскрипционных активаторов вирусов и клеток.
Задачей настоящего изобретения является разработка комплексов пептидов, организованных в трехмерную структуру. Разработанные комплексы обладают высокой способностью к связыванию с другими группами молекул и проявляют широкий спектр фармакологического действия, включая индукцию ИФН I-го типа, и действуют на различных уровнях клеточных функций, что позволит на их основе создавать новые средства для профилактики и лечения вирусных инфекций.
Новое семейство биологически активных пептидов разработано на основе известных пептидов, обогащенных остатками гистидина, аллоферонов и их гомологах с использованием в качестве прототипа Zn-фингер доменов белков с известными функциями. Аллофероны использованы в качестве матрицы пептидов длиной от 6 до 35 аминокислотных остатков. Сконструированные таким образом пептиды обладают способностью к образованию комплексов с ионом Zn++, образующих олигомеры и агрегаты, а по структурным и биологическим свойствам удовлетворяют требованиям к иммуномодуляторам.
Предлагаемые пептидные комплексы имеют трехмерную структуру и описываются следующей структурной формулой:

где X1 отсутствует либо содержит не менее 1 аминокислоты; R1 и R2 - пептидные цепи, содержащие аминокислотные остатки, способные взаимодействовать с ионами переходных металлов; причем R1 содержит до 5 аминокислотных остатков или отсутствует, R2 содержит до 3 аминокислотных остатков или отсутствует.
Способность природных пептидов, обогащенных остатками гистидина к связыванию с ионами металлов, подтверждена рядом исследований [Hua Zhao H., and Waite J.H. Proteins in Load-Bearing Junctions: The Histidine-Rich Metal-Binding Protein of Mussel Byssus, Biochemistry. 2006, 45(47): 14223-14231].
Сущность изобретения поясняется данными, приведенными на схемах и рисунках:
рис.1. Анализ консенсус-последовательностей пептидов семейства аллоферонов;
рис.2. Компьютерная модель полипептида А1;
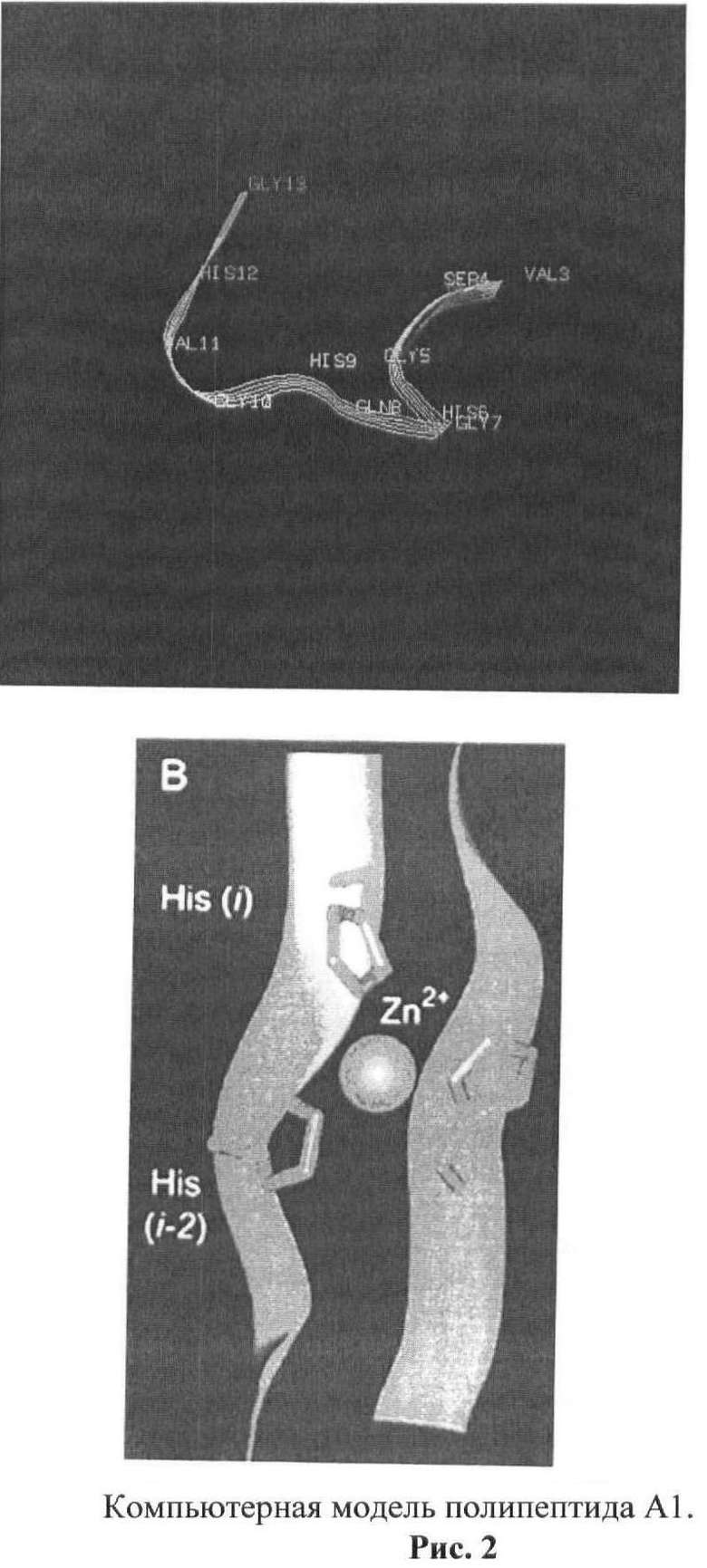
рис.3. Теоретически возможные варианты структуры комплексов А1 с ионом Zn++;
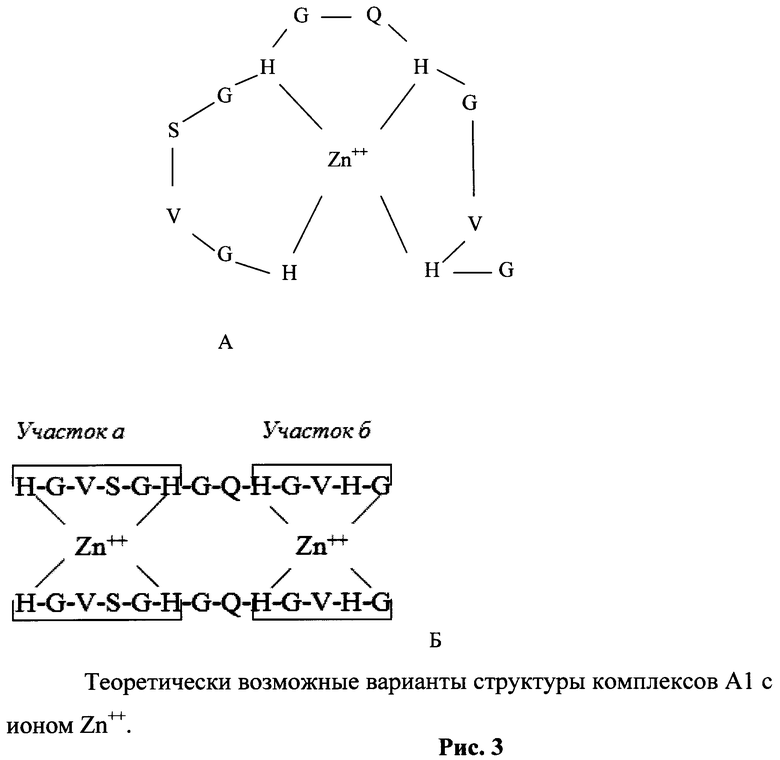
рис.4. Кинетика связывания аллоферона А1 с Zn++ методом светорассеяния;
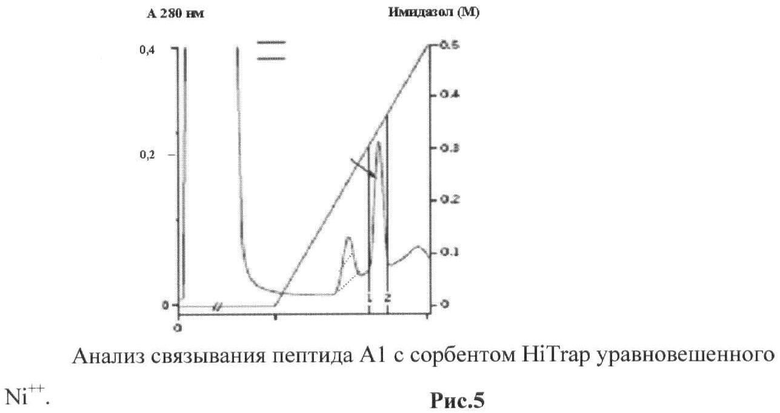
рис.5. Анализ связывания пептида Al с сорбентом HiTrap, уравновешенного Ni++;
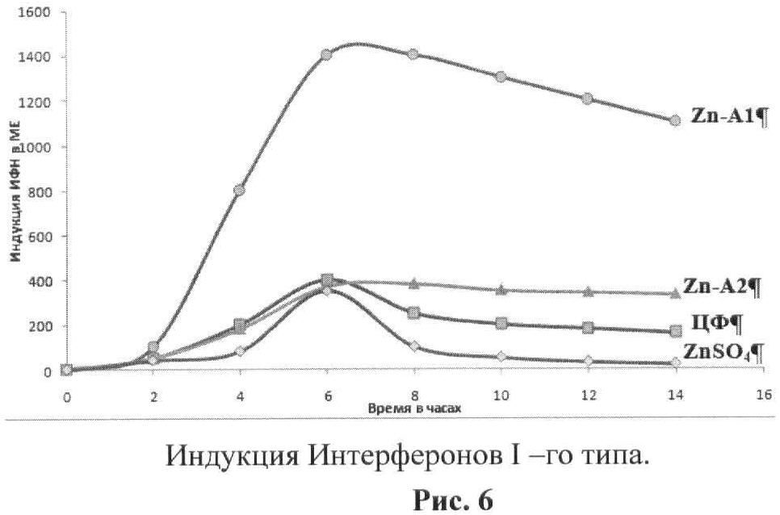
рис.6. Индукция Интерферонов I-го типа;
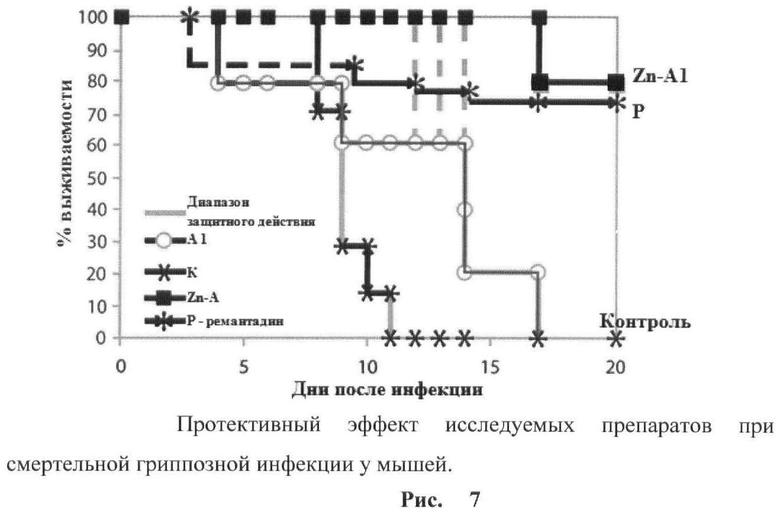
рис.7. Протективный эффект исследуемых препаратов при смертельной гриппозной инфекции у мышей.
При разработке настоящего изобретения в качестве базовой структуры был использован пептид, представленный в таблице 2 под названием Alloferon 1 (SEQ ID NO 1), Alloferon 1 был синтезирован методом твердофазного синтеза и использован для изучения биологической активности предлагаемых пептидов. Исследования, результаты которых приведены ниже в примерах, показали, что данный пептид обладает способностью к образованию комплексов с переходными металлами, является индуктором интерферона и обладает противовирусной активностью. Компьютерный анализ баз данных по структуре и свойствам белков и пептидов установил, что данное соединение относится к новому неизвестному ранее семейству биологически активных пептидов. Полипептиды, обогащенные гистидином и глицином, с введенными ионами металлов, обладают иммуномодулирующей и противовирусной активностью и, при этом, ионы цинка потенцируют их биологическую активность.
Синтез пептидов заданной последовательности проводился твердофазным методом синтеза пептидов с использованием Boc/Bzl стратегии на фенилацетамидометилполимере (РАМ). Пептиды были получены на синтезаторах пептидов Coupler-250 и Applied Biosystems 430A.
Для временной защиты α-аминогрупп использовалась трет.-бутилоксикарбонильная группа, которая удалялась трифторуксусной кислотой. Для блокирования боковых радикалов трифункциональных аминокислот использовались защитные группировки бензильного и ацильного типа: динитрофенильная для гистидина, мезитиленсульфонильная для аргинина, 2-хлорбензилоксикарбонильная для лизина, формильная для триптофана, 2,6-дихлорбензильная для тирозина, O-бензиловые эфиры для треонина и серина. Метионин вводили в конденсацию в виде сульфоксидного производного.
Удаление временных защитных групп проводили неразбавленной трифторуксусной кислотой, а нейтрализацию - по методике «in situ», добавляя N,N'-диизопропилэтиламин на стадии конденсации прямо в реакционную смесь.
Программа присоединения одного аминокислотного остатка при наращивании цепи пептидил-полимера из расчета общего содержания ациламинокислоты на полимере 0.2 ммол приведена в таблице. Предварительное активирование карбоксильной компоненты проводили в течение 30 минут, используя оксибензотриазол и диизопропилкарбодиимид. В этих условиях синтеза во всех случаях после присоединения необходимого количества аминокислотных остатков, соответствующих последовательности пептидного фрагмента, был получен удовлетворительный привес пептидил-полимера.
Удаление боковых защитных группировок и отщепление пептида от смолы производилось под действием безводного фтористого водорода в присутствии скавенджеров, в основном м-крезола. При такой обработке удалялись все боковые защитные группировки, и пептид отщеплялся от высокомолекулярной матрицы, время деблокирования колебалось от одного до полутора часов.
Для предотвращения нежелательных побочных реакций при синтезе пептидов, содержащих метионин (в частности, алкилирование серы третбутильным радикалом, а также ее частичное окисление в ходе наращивания пептидной цепи), остаток метионина гладко вводится в последовательность пептидилполимера в виде сульфоксидного производного, которое на конечных стадиях деблокирования пептида восстанавливалось до метионина. Эта реакция восстановления проходила с удовлетворительным результатом при действии йодистого аммония либо на полностью деблокированном пептиде, либо на этапе, когда пептид еще находился на смоле.
Все синтезированные пептидные препараты были очищены с помощью препаративной обращено-фазовой жидкостной хроматографии на колонке Dynamax 60 А, 22.5×250 мм (жидкостной хроматограф Gilson, Франция) и охарактеризованы данными аминокислотного анализа гидролизатов пептидов после гидролиза метансульфокислотой в присутствии триптамина (аминокислотный анализатор Alpha Plus, LKB, Швеция).
Возможность достижения цели изобретения подтверждается следующими примерами.
Пример 1. Анализ структуры и консенсус-последовательностей семейств пептидов Аллоферона.
Для анализа консенсуса последовательностей пептидов семейств аллоферонов использовали программу BioEdit v.7.09 Ibis Biosciences (США). Гомология аминокислотных последовательностей аллоферонов представлена в таблице 2.
В патенте РФ №2172322 приводится последовательность аллоферонов без представления консенсус-последовательности, что не позволяет точно оценить «коровую»-сердцевинную часть пептидов и отделить существенные модификации от несущественных.
В результате анализа семейство аллоферонов представляется возможным разделить на 3 семейства с консенсус-последовательностями:
SGHGQ-HGV, VSGHGQ-HGV, SGHGQ-HGV, что обосновывается приведенными компьютерными расчетами (рис.1) последовательностей пептидов семейства аллоферонов.
Пример 2. Компьютерное моделирование пептида А1 (анализ третичной структуры)
Для понимания структуры коротких пептидов можно использовать компьютерное моделирование, позволяющее оценить структуру пептида, в целом, и отдельных его доменов. В частности, также было необходимо оценить возможности образования комплексов данных пептидов с ионом Zn++. Для этого проводили компьютерное моделирование пептида А1, имеющего следующую структуру: His-Val-Ser-His-Gly-Gln-His-Gly-Val-His-Gly (А1). Построение простого комплекса А1 с ионом Zn++ позволяет продемонстрировать формирование пептидной петли, стабилизированной координатными связями остатков гистидина с ионом Zn++.
Компьютерное моделирование пептида А1 (рис.2) показало, что короткий пептид образует релаксированную петлю, в которой ион Zn++ может взаимодействовать с остатками гистидина, доступными для взаимодействия. При этом общая структура полипептида соответствует возможностям образования комплекса иона Zn++ как минимум с тремя остатками гистидина в положениях 1, 6 и 9.
На упрощенной модели (рис.3) Zn - A1 видно, что значительная доля остатков глицина находятся в N-концевой половине молекулы. Это соответствует вторичной структуре типа бета-слоев. С-концевая часть имеет альфа-спиральную структуру с экспонированными внутрь имидазольными кольцами гистидина, доступными для взаимодействия с ионом Zn++.
На рисунке приведен пример с Zn++. Zn++ может быть размещен практически в любом положении.
А - внутримолекулярный комплекс Zn - А1, организованный в виде петли.
Б - межмолекулярный комплекс Zn - А1, организованный в димер. Агрегация может осуществляться путем присоединения новых молекул А1 за счет межмолекулярного встраивания иона Zn++ в участках «а» и «б» или по центру линейного полипептида при взаимодействии иона Zn++ с остатками гистидина в положениях 6 и 9.
При анализе структуры А1 обращает на себя внимание высокое содержание и регулярное расположение остатков гистидина. На рисунке 2 видно, что полипептид А1 образует почти идеальную седловидную структуру. В такой конфирмации максимально доступны для взаимодействия с ионом Zn++ остатки Гис - 1, 6 и 9.
При этом важным выводом может явиться заключение о том, что комплексообразования при избытке пептида по отношению к Zn++ способно приводить к образованию межмолекулярных агрегатов (рис.2 - B). Этот структурный переход принципиально изменяет свойства пептидов, придавая им компактность структуры, необходимую для биологической активности, что продемонстрировано в ряде исследований [Rydengard V., Nordahl E. А., Schmidtchen A. Zinc potentiates the antibacterial effects of histidine-rich peptides against Enterococcus faecalis. FEBS Lett., 2006, Vol.273, p.2399-2406].
Пример 3. Аллоферон и его ближайшие аналоги являются Zn++ - связывающими пептидами.
Изучение связывания иона Zn++ с аллофероном 1 (А1) и его гомологами проводили по методу, описанному [Shi Y., Beger R.D., Berg J.M. Metal binding properties of single amino acid deletion mutants of zinc finger peptides: studies using cobalt(II) as a spectroscopic prob. Biophys.J., 1993, Vol.64, p.749-753]. Связывание иона Zn++ с пептидом А1 исследовали методом светорассеяния с использованием флюориметра ISS, Campaign, IL при 400 нм и возбуждающем свете 398 нм.
На рисунке 4 представлены графики взаимодействия иона Zn++ с пептидом А1.
Условия анализа см. Shi Y. с соавт. (1993).
А - (открытые кружки) взаимодействие А1 с Zn(NO3)2. Молярный избыток иона Zn++ по отношению к пептиду составлял 1:10. Сплошная линия - насыщение пептида ионом Zn++. При полном насыщении основная масса пептида переходила в агрегаты. К агрегатам добавлялась ЭДТА. В результате добавления ЭДТА комплекс быстро диссоциировал и пептид (аллоферон) переходил в растворимую фазу.
На рисунке 4 видно, что Zn++ (Zn(NO3)2) взаимодействует с пептидом А1, что приводит к экспоненциальному росту светорассеивания и последующей агрегации пептида в виде полидисперсных наночастиц до 50-60 нм в диаметре с последующим образованием взвеси крупных агрегатов. При добавлении хелатного агента ЭДТА агрегаты и комплексы пептида А1 растворяются.
Таким образом, пептид А1 способен взаимодействовать с ионом Zn++ с образованием на первой фазе растворимых комплексов.
Пример 4. Пептиды взаимодействуют с Zn++, проявляя высокое сродство к никелевым сорбентам.
Хроматография на колонках HiTrap показала, что А1 ведет себя, как олигогистидин и обладает достаточно высоким сродством к данному сорбенту и полностью элюруется раствором Имидазола. Элюция проведена градинентом фосфатный буфер/0,5М имидазол (рис.5).
Пример 5. Индукция интерферонов 1-го типа
Индукцию интерферонов 1-го типа исследовали по методу, опубликованному ранее [Ершов Ф.И., Киселев О.И. Интерфероны и их индукторы (от молекулы до лекарства). М.: «Изд. Геотар - Медиа», 2005 - стр.356, Chemysh с соавт., 2002]. На рисунке 6 представлены результаты тестирования препаратов на способность к индукции интерферонов 1-го типа. Как видно из полученных данных, максимальной активностью в индукции интерферонов обладал пептид Zn-А1. Несколько уступал ему пептид Zn - А2. Немодифицированный пептид А1 проявлял достаточно высокий уровень способности к индукции интерферонов, но однако существенно уступал производным в комплексе с ионом Zn++ и соответствовал активности циклоферона.
В примере 6 будет видно, что эти данные коррелируют с защитным действием препаратов при смертельной гриппозной инфекции на мышах.
Пример 6. Противовирусная активность на модели экспериментальной летальной гриппозной пневмонии у белых мышей, вызванной вирусом гриппа А.
Для тестирования противовирусной активности комплексов пептидов использовали модель летальной гриппозной инфекции на белых беспородных мышах обоего пола массой 10-12 г, полученных из питомника «Рапполово». В работе использовали штамм вируса гриппа A/Aichi/2/68 (H3N2), адаптированный к белым мышам в лабораторных условиях и проявляющий высокую патогенность, вызывая инфекцию с развитием пневмонии и смертельным исходом в течение 5-10 дней в зависимости от дозы вируса.
Пептиды и их производные вводили животным однократно за 6 и 12 ч до инфицирования в количестве 1-2 мкг/кг веса животных внутрибрюшинно. Плацебо в контрольной группе животных служил физиологический раствор или фосфатный буфер в равном объеме.
Вирус предварительно титровали на животных и определяли его концентрацию по летальности мышей. Для эксперимента вирус вводили животным интраназально под легким эфирным наркозом в дозе 0,2 и 5 LD50. В каждую группу наблюдения брали по 10 мышей. Наблюдение за животными осуществляли до 15 дней, т.е. срока, в течение которого при экспериментальном гриппе отмечается 100% смертность животных.
Ежедневно фиксировали вес и смертность животных в контрольных и опытных группах. На основании полученных показателей смертности рассчитывали процент смертности в каждой группе (отношение числа павших за 15 дней животных к общему числу зараженных животных в группе), индекс защиты. Полученные данные представлены на рис.5. Анализ полученных результатов показал, что действие исследованных препаратов А1 в отношении вируса гриппа А, патогенного для мышей, было сравнимо с эффективностью защитного эффекта референс-препарата Ремантадина (80-87% - при дозе вируса 1 LD50). Высокий защитный эффект комплексов Zn-Al свидетельствует о том, что образование комплекса Zn++ с А1 сильно потенцирует активность пептидов типа А1. Способ тестирования, использованный в данном случае, свидетельствует о том, что защитный эффект следует отнести, главным образом, за счет индукции интерферонов. Препарат проявлял максимальную активность при применении в профилактической схеме.
На рис.7 показан протективный эффект исследуемых препаратов при смертельной гриппозной инфекции у мышей. На основании вышеизложенного можно утверждать, что разработанный пептид обладает всеми заявленными свойствами.
Комплексы пептидов, обогащенные гистидином, и, в первую очередь, пептидов семейства аллоферонов с ионом Zn++, позволят создать препараты с направленным механизмом действия и осуществлять их дизайн в соответствии с пониманием свойств и строения пептидов, а также природы лекарственной мишени.


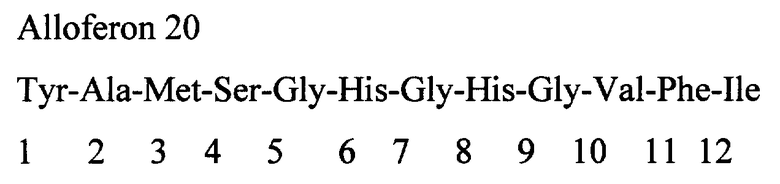

Изобретение относится к биологически активным пептидным комплексам с иммуномодулирующей и противовирусной активностью. Предлагаемые пептидные комплексы имеют трехмерную структуру, в которой X1 отсутствует либо содержит не менее 1 аминокислоты; R1 и R2 - пептидные цепи, содержащие аминокислотные остатки. His или Cys, способные взаимодействовать с ионами переходных металлов, причем R1 содержит до 5 аминокислотных остатков или отсутствует; R2 содержит до 3 аминокислотных остатков или отсутствует. Комплексы пептидов, обогащенные гистидином, и, в первую очередь, пептидов семейства аллоферонов с ионами Zn, позволят создать препараты с направленным механизмом действия и осуществлять их дизайн в соответствии с пониманием структуры лекарственной мишени. 2 з.п. ф-лы, 7 ил., 2 табл., 6 пр.

1. Пептидные комплексы, в которых пептид организован в трехмерную структуру, и характеризуемые общей структурной формулой:
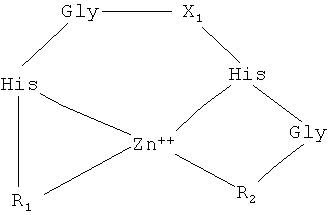
где X1 выбран из Gln, Ser, Asn, Val, Ala, Phe, Asp или отсутствует;
R1 и R2 - пептидные цепи, содержащие аминокислотные остатки His- или Cys-, способные взаимодействовать с ионами переходных металлов, при этом
R1 выбран из: His-Gly-Val-Ser-Gly-, Cys-Val-Val-Thr-Gly-, Cys-Gly-, His-Gly-Ser-Asp-Gly-, Gly-, His-Gly-Asp-Ser-Gly-, Val-Ser-Gly-, His-Gly- или отсутствует;
R2 выбран из: -Val-His-Gly, -Val-Phe-Val, -Val-His, -Val-Asp или отсутствует.
2. Пептидные комплексы по п.1, обладающие свойствами индукторов синтеза интерферона.
3. Пептидные комплексы по п.1, обладающие противовирусной активностью.
| АЛЛОФЕРОНЫ-ИММУНОМОДУЛИРУЮЩИЕ ПЕПТИДЫ | 1999 |
|
RU2172322C1 |
| Anna Janicka et al | |||
| Способ использования делительного аппарата ровничных (чесальных) машин, предназначенных для мериносовой шерсти, с целью переработки на них грубых шерстей | 1921 |
|
SU18A1 |
| Способ использования делительного аппарата ровничных (чесальных) машин, предназначенных для мериносовой шерсти, с целью переработки на них грубых шерстей | 1921 |
|
SU18A1 |
| Т.Kowalik-Jankowska et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2012-12-20—Публикация
2011-02-18—Подача