Перекрестная ссылка на родственные заявки
[0001] Настоящая заявка заявляет приоритет предварительной заявки на патент США, серийный номер 62/617080, поданной 12 января 2018 г., содержание которой в полном объеме включено здесь посредством ссылки.
Представление списка последовательностей в текстовом файле ASCII
[0002] Содержание следующего представления в текстовом файле ASCII полностью включено здесь посредством ссылки: машиночитаемая форма (CRF) списка последовательностей (название файла: 183952028240SEQLIST.txt, дата регистрации: 11 января 2019 г., размер: 29 КБ).
Область техники, к которой относится изобретение
[0003] Настоящее изобретение обеспечивает способы количественного определения содержания полипептида, который содержит константную область антитела (или ее участок) со сконструированной мутацией в образце.
Уровень техники
[0004] Белки, такие как антитела, представляют постоянно растущую группу терапевтических средств. Во время доклинических исследований терапевтические белки-кандидаты подвергаются всесторонним анализам на животных моделях для оценки их фармакокинетических (ФК), фармакодинамических (ФД) и токсикокинетических (ТК) характеристик, для оценки профилей их безопасности и для определения безопасной дозы для проведения первых исследований у человека. Во время клинических испытаний свойства терапевтических белков в отношении ФК, ФД и ТК дополнительно анализируются уже у людей. Данные исследований у людей используются для оценки безопасности и эффективности терапевтического белка, для установления схем дозирования и/или для корректировки доз в разных подгруппах пациентов. Следовательно, очень важно, чтобы способы количественного определения терапевтических белков как в образцах для доклинических исследований, так и в образцах для клинических испытаний были надежными и чувствительными.
[0005] Анализы связывания лигандов (LBA) традиционно использовали для количественного определения терапевтических белков благодаря их высокой чувствительности, низкой стоимости и высокой пропускной способности. Несмотря на эти преимущества, LBA имеют ограниченный линейный динамический диапазон, несут риск проявления перекрестной реактивности с метаболитами/аналогами и их трудно мультиплексировать. Более того, разработка новых антител для применения в LBA для новых терапевтических белков является дорогостоящей и трудоемкой.
[0006] Жидкостная хроматография-тандемная масс-спектрометрия (ЖХ-МС/МС) стала перспективной аналитической платформой для количественного определения терапевтических белков. Анализы на основе ЖХ-МС/МС, используемые для биоанализа терапевтических белков в доклинических исследованиях на животных, часто основаны на количественном определении «суррогатного пептида» (т.е. пептида, последовательность которого уникальна для терапевтического белка, и отсутствует в протеомах видов, используемых в доклинических исследованиях) в качестве опосредованного показателя терапевтического белка. Поскольку многие терапевтические белки получены из белков человека, то последовательность суррогатного пептида, вероятно, будет присутствовать в протеоме человека, что препятствует точному количественному определению терапевтического белка в образце, полученном от человека.
[0007] Следовательно, в данной области техники остается потребность в универсальных способах количественного определения терапевтических белков как в образцах для доклинических исследований (животных), так и в образцах для клинических испытаний (человека). Настоящее изобретение направлено на удовлетворение этих и других потребностей.
[0008] Все ссылки, цитированные в этой заявке, специально включены в настоящее описание посредством ссылки.
Сущность изобретения
[0009] Обеспечивается способ количественного определения содержания полипептида, содержащего участок константной области тяжелой цепи антитела, в образце, где способ включает: (а) расщепление образца, содержащего полипептид, включающий участок константной области тяжелой цепи антитела, где участок константной области тяжелой цепи антитела содержит сконструированную мутацию, и где в результате расщепления образуется пептидный фрагмент, полученный из константной области тяжелой цепи антитела, который имеет длину от 5 до 26 аминокислот и содержит сконструированную мутацию; и (b) анализ расщепленного образца масс-спектрометрией для определения количества пептидного фрагмента, посредством чего определяют количество полипептида, содержащего участок константной области тяжелой цепи антитела в образце. В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления пептидный фрагмент не содержит метионин (М) или цистеин (С). В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления пептидный фрагмент не содержит аспарагин (N), за которым следует глицин (G) или серин (S). В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления способ дополнительно включает очистку и концентрирование расщепленного образца перед масс-спектрометрическим анализом. В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления расщепленный образец очищают и концентрируют посредством твердофазной экстракции (SPE). В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления расщепленный образец очищают и концентрируют посредством SISCAPA (стабильные изотопные стандарты с захватом антипептидными антителами).
[0010] В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления образец представляет собой образец цельной крови, образец сыворотки, образец плазмы или образец ткани. В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления образец отобран у мыши, примата, отличного от человека, или человека. В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления примат, отличный от человека, представляет собой обезьяну cynomolgus или макаку-резус. В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления образец расщепляют, по меньшей мере, одним ферментом. В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления, по меньшей мере, один фермент представляет собой трипсин, химотрипсин, глутамилэндопептидазу, лизилэндопептидазу, Asp-N, Arg-C, Glu-C, цианогенбромид (CnBr) или их комбинации. В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления масс-спектрометрия, используемая для определения количества полипептида в образце, представляет собой анализ жидкостной хроматографией-тандемной масс-спектрометрией (ЖХ-МС/МС).
[0011] В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления полипептид содержит домен CH1, и где домен CH1 включает сконструированную мутацию. В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления полипептид содержит домен CH2, и где домен CH2 включает сконструированную мутацию. В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления полипептид содержит домен CH3, и где домен CH3 включает сконструированную мутацию. В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления сконструированная мутация в домене CH3 константной области тяжелой цепи антитела представляет собой T366Y, T366W, T366S, L368A, T394W, T394S, F405A, F405W, Y407T, Y407V или Y407A. В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления сконструированная мутация в домене CH3 константной области тяжелой цепи антитела представляет собой Y407V, и где домен CH3 содержит аминокислотную последовательность, представленную в SEQ ID NO: 6 (DGSFFLVS). В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления в результате расщепления образуется пептидный фрагмент, содержащий (например, состоящий из) аминокислотную последовательность TTPPVLDSDGSFFLVSK (SEQ ID NO: 7), DGSFFLVSKLTV (SEQ ID NO: 8) или GSFFLVSKLTVD (SEQ ID NO: 9). В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления образец расщеплют трипсином, и в результате расщепления образуется пептидный фрагмент, состоящий из аминокислотной последовательности TTPPVLDSDGSFFLVSK (SEQ ID NO: 7). В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления образец расщепляют Asp-N, и в результате расщепления образуется пептидный фрагмент, состоящий из аминокислотной последовательности DGSFFLVSKLTV (SEQ ID NO: 8). В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления образец расщепляют Glu-C, и в результате расщепления образуется пептидный фрагмент, состоящий из аминокислотной последовательности GSFFLVSKLTVD (SEQ ID NO: 9). В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO: 3 или SEQ ID NO: 4. В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления сконструированная мутация в домене СН3 константной области тяжелой цепи антитела представляет собой N434S. В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления образец расщепляют Glu-C и трипсином, и в результате расщепления образуется пептидный фрагмент, состоящий из аминокислотной последовательности ALHSHYTQK (SEQ ID NO: 11). В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO: 2 или SEQ ID NO: 3.
[0012] В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления полипептид, содержащий участок константной области тяжелой цепи антитела, представляет собой антитело, Fc-слитый белок или иммуноадгезин. В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления полипептид, содержащий участок константной области тяжелой цепи антитела, представляет собой антитело. В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления антитело представляет собой терапевтическое антитело. В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления антитело представляет собой химерное антитело, гуманизированное антитело или человеческое антитело. В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления антитело представляет собой моноспецифическое антитело, биспецифическое антитело, триспецифическое антитело или мультиспецифическое антитело. В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления антитело представляет собой триспецифическое антитело. В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления триспецифическое антитело содержит четыре полипептидные цепи, которые образуют три антигенсвязывающих участка, которые специфически связывают одну или более антигенов-мишеней или белков-мишеней, где первый полипептид содержит структуру, представленную формулой: VL2-L1-VL1-L2-CL; вторая полипептидная цепь содержит структуру, представленную формулой: VH1-L3-VH2-L4-CH1-шарнирная область-CH2-CH3; третья полипептидная цепь содержит структуру, представленную формулой: VH3-CH1-шарнирная область-CH2-CH3; четвертая полипептидная цепь содержит структуру, представленную формулой: VL3-CL, где VL1 представляет первый вариабельный домен легкой цепи иммуноглобулина; VL2 представляет второй вариабельный домен легкой цепи иммуноглобулина; VL3 представляет третий вариабельный домен легкой цепи иммуноглобулина; VH1 представляет первый вариабельный домен тяжелой цепи иммуноглобулина; VH2 представляет второй вариабельный домен тяжелой цепи иммуноглобулина, VH3 представляет третий вариабельный домен тяжелой цепи иммуноглобулина; CL представляет константный домен легкой цепи иммуноглобулина; СН1 представляет константный домен тяжелой цепи иммуноглобулина СН1; и L1, L2, L3 и L4 представляют аминокислотные линкеры; где первый и второй полипептиды образуют пару легкая цепь-тяжелая цепь в ориентации крест-накрест; и где вторая полипептидная цепь или третья полипептидная цепь содержит аминокислотную последовательность TTPPVLDSDGSFFLVSK (SEQ ID NO: 7), DGSFFLVSKLTV (SEQ ID NO: 8) или GSFFLVSKLTVD (SEQ ID NO: 9). В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления первый полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO: 12; второй полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO: 13; третий полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO: 14, и четвертый полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO: 15.
[0013] В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления антитело конъюгировано с лекарственным средством или меткой. В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления лекарственное средство выбрано из химиотерапевтического агента, цитотоксического агента или агента, ингибирующего рост. В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления метка представляет собой радиоизотоп, флуоресцентный краситель или фермент. В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления антитело представляет собой IgG антитело человека. В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления IgG антитело представляет собой IgG1 антитело человека или IgG4 антитело человека. В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления антитело связывается с A2AR, APRIL, ATPDазой, BAFF, BAFFR, BCMA, BlyS, BTK, BTLA, B7DC, B7H1, B7H4/VTCN1, B7H5, B7H6, B7H7, B7RP1, B7-4, C3, C5, CCL2/MCP-1, CCL3/MIP-1a, CCL4/MIP-1b, CCL5/RANTES, CCL7/MCP-3, CCL8/mcp-2, CCL11/эотаксином, CCL15/MIP-1d, CCL17/TARC, CCL19/MIP-3b, CCL20/MIP-3a, CCL21/MIP-2, CCL24/MPIF-2/эотаксином-2, CCL25/TECK, CCL26/эотаксином-3, CCR3, CCR4, CD3, CD19, CD20, CD23/FCER2, CD24, CD27, CD28, CD38, CD39, CD40, CD70, CD80/B7-1, CD86/B7-2, CD122, CD137/41BB, CD137L, CD152/CTLA4, CD154/CD40L, CD160, CD272, CD273/PDL2, CD274/PDL1, CD275/B7H2, CD276/B7H3, CD278/ICOS, CD279/PD-1, CDH1/E-кадгерином, хитиназой, CLEC9, CLEC91, CRTH2, CSF-1/M-CSF, CSF-2/GM-CSF, CSF-3/GCSF, CX3CL1/SCYD1, CXCL12/SDF1, CXCL13, CXCR3, DNGR-1, эктонуклеозидтрифосфатдифосфогидролазой 1, EGFR, ENTPD1, FCER1A, FCER1, FLAP, FOLH1, Gi24, GITR, GITRL, GM-CSF, Her2, HHLA2, HMGB1, HVEM, ICOSLG, IDO, IFNα, IgE, IGF1R, IL2Rbeta, IL1, IL1A, IL1B, IL1F10, IL2, IL4, IL4Ra, IL5, IL5R, IL6, IL7, IL7Ra, IL8, IL9, IL9R, IL10, rhIL10, IL12, IL13, IL13Ra1, IL13Ra2, IL15, IL17, IL17Rb/IL25, IL18, IL22, IL23, IL25, IL27, IL33, IL35, ITGB4/интегрином-b4, ITK, KIR, LAG3, LAMP1, лептином, LPFS2, MHC класса II, NCR3LG1, NKG2D, NTPDазой-1, OX40, OX40L, PD-1H, рецептором тромбоцитов, PROM1, S152, SISP1, SLC, SPG64, ST2/рецептором для IL33, STEAP2, киназой Syk, TACI, TDO, T14, TIGIT, TIM3, TLR, TLR2, TLR4, TLR5, TLR9, TMEF1, TNFa, TNFRSF7, Tp55, TREM1, TSLP/ IL7Ra, TSLPR, TWEAK, VEGF, VISTA, Vstm3, WUCAM или XCR/GPR5/CCXCR1. В некоторых вариантах осуществления в соответствии с (или применительно к) любым из вышеприведенных вариантов осуществления способ предназначен для применения в фармакокинетическом исследовании полипептида, содержащего константную область тяжелой цепи антитела на мыши, примате, отличном от человека, и у человека.
[0014] Каждый вариант осуществления, описанный здесь, может быть объединен с любым другим вариантом осуществления или вариантами осуществления, если явно не указано иное. В частности, любой признак или вариант осуществления, указанный как предпочтительный или преимущественный, может быть объединен с любым другим признаком или признаками или вариантом осуществления или вариантами, указанными как предпочтительный или преимущественный, если явно не указано иное. Эти и другие аспекты изобретения станут очевидными для специалиста в данной области. Эти и другие варианты осуществления изобретения дополнительно описаны посредством подробного описания, которое следует ниже.
Краткое описание фигур
[0015] На фиг. 1 показано выравнивание последовательностей Fc-областей нескольких примерных терапевтических антител. Предсказанные триптические пептиды, которые содержат, по меньшей мере, одну аминокислотную замену, подчеркнуты. Цистеины, присутствующие в триптических пептидах, обозначены жирными стрелками. SEQ ID NO: 2 и 5 включают мутацию типа «выступа» T366W. SEQ ID NO: 3 и 4 содержат мутации типа «впадины» T366S, L368A и Y407V.
[0016] На фиг. 2А-2С показаны результаты анализа ЖХ-МС/МС триптически расщепленного триспецифического конструкта (TRI-1), который содержит тяжелые цепи с аминокислотными последовательностями, представленными в SEQ ID NO: 2 и 3. SEQ ID NO: 2 содержит сконструированную мутацию типа «выступа» T366W, и SEQ ID NO: 3 содержит сконструированные мутации типа «впадины» T366S, L368A и Y407V. Предполагается, что в результате триптического расщепления SEQ ID NO: 3 образуется пептид, имеющий аминокислотную последовательность TTPPVLDSDGSFFLVSK (SEQ ID NO: 7), т. е. «сконструированный пептид TTPP». На фиг. 2А приведена хроматограмма выделенных ионов, m/z 905,40-907,60. На фиг. 2B приведена общая ионная хроматограмма. На фиг. 2C приведен МС/МС спектр сконструированного пептида TTPP.
[0017] На фиг. 3A-3D приведены хроматограммы выделенных ионов триптически расщепленной мышиной сыворотки (фиг. 3A), обезьяньей сыворотки (фиг. 3B), человеческой сыворотки (фиг. 3C) и TRI-1 в PBST (фиг. 3D). Время анализа сконструированного TTPP показано в рамке.
[0018] На фиг. 4A-4D приведены хроматограммы выделенных ионов триптически расщепленного TRI-1 в сыворотке мыши (фиг. 4A), сыворотке обезьяны (фиг. 4B), сыворотке человека (фиг. 4C) и PBST (фиг. 4D). Время анализа сконструированного TTPP показано в рамке.
[0019] На фиг. 5А-5С приведены хроматограммы выделенных ионов сконструированного TTPP из триптически расщепленного TRI-1 в PBST, m/z=905,36-905,55. Концентрации TRI-1 составляли 20 мкг/мл (фиг. 5А), 2 мкг/мл (фиг. 5В) и 0,2 мкг/мл (фиг. 5С). Площади пиков пептида TTPP составляли 44064886 (фиг. 5A), 2633166 (фиг. 5B) и 368649 (фиг. 5C).
[0020] На фиг. 6А-6С приведены хроматограммы выделенных ионов немеченого FNWYVDGVEVHNAK (SEQ ID NO: 10) (FNWY) из триптически расщепленного TRI-1 в PBST, m/z=559,90-559,98. Концентрации TRI-1 составляли 20 мкг/мл (фиг. 6А), 2 мкг/мл (фиг. 6В) и 0,2 мкг/мл (фиг. 6С). Площади пиков пептида FNWY составляли 70091279 (фиг. 6А), 1078300 (фиг. 6В) и 209110 (фиг. 6С).
[0021] На фиг. 7А-7С приведены хроматограммы выделенных ионов изотопно-меченого FNWY (FNWY (тяжелая цепь)) из триптически расщепленного SILUMAB, использованного в качестве внутреннего стандарта для расщепления TRI-1 в PBST, m/z=562,58-562,63. Концентрации TRI-1 составляли 20 мкг/мл (фиг. 7А), 2 мкг/мл (фиг. 7В) и 0,2 мкг/мл (фиг. 7С). Площади пиков пептида FNWY составляли 1369078 (фиг. 7А), 343482 (фиг. 7В) и 473743 (фиг. 7С).
[0022] На фиг. 8A-8D приведены хроматограммы выделенных ионов сконструированного TTPP из триптически расщепленного TRI-1 в сыворотке мыши, m/z=905,39-905,55. Концентрации TRI-1 составляли 0 мкг/мл (контроль) (фиг. 8А), 0,2 мкг/мл (фиг. 8В), 2 мкг/мл (фиг. 8С) и 20 мкг/мл (фиг. 8D). Площади пиков пептида TTPP не детектировались (ND) (фиг. 8A), не детектировались (ND) (фиг. 8B), составляли 2168471 (фиг. 8C) и 11833127 (фиг. 8D).
[0023] На фиг. 9A-9D приведены хроматограммы выделенных ионов немеченого FNWY из триптически расщепленного TRI-1 в сыворотке мыши, m/z=559,90-559,98. Концентрации TRI-1 составляли 0 мкг/мл (контроль) (фиг. 9А), 0,2 мкг/мл (фиг. 9В), 2 мкг/мл (фиг. 9С) и 20 мкг/мл (фиг. 9D). Площади пиков пептида FNWY не детектировались (ND) (фиг. 9А), составляли 410330 (фиг. 9В), 2500109 (фиг. 9С) и 22039621 (фиг. 9D).
[0024] На фиг. 10A-10D приведены хроматограммы выделенных ионов FNWY (тяжелая цепь) из триптически расщепленного SILUMAB, использованного в качестве внутреннего стандарта для расщепления TRI-1 в сыворотке мыши, m/z=562,58-562,63. Концентрации TRI-1 составляли 0 мкг/мл (контроль) (фиг. 10А), 0,2 мкг/мл (фиг. 10В), 2 мкг/мл (фиг. 10С) и 20 мкг/мл (фиг. 10D). Площади пиков пептида FNWY составляли 1184181 (фиг. 10А), 2310675 (фиг. 10В), 1199642 (фиг. 10С) и 967309 (фиг. 10D).
[0025] На фиг. 11A-11D приведены хроматограммы выделенных ионов сконструированного TTPP из триптически расщепленного TRI-1 в сыворотке обезьяны, m/z=905,39-905,55. Концентрации TRI-1 составляли 0 мкг/мл (контроль) (фиг. 11А), 0,2 мкг/мл (фиг. 11В), 2 мкг/мл (фиг. 11С) и 20 мкг/мл (фиг. 11D). Площади пиков пептида TTPP не детектировались (ND) (фиг. 11A), не детектировались (ND) (фиг. 11B), составляли 1013964 (фиг. 11C) и 3751017 (фиг. 11D).
[0026] На фиг. 12А-12D приведены хроматограммы выделенных ионов немеченого FNWY из триптически расщепленного TRI-1 в сыворотке обезьяны, m/z=559,92-559,95. Концентрации TRI-1 составляли 0 мкг/мл (контроль) (фиг. 12А), 0,2 мкг/мл (фиг. 12В), 2 мкг/мл (фиг. 12С) и 20 мкг/мл (фиг. 12D). Площади пиков пептида FNWY составляли 75675 (фиг. 12А), 97731 (фиг. 12В), 1298150 (фиг. 12С) и 13378187 (фиг. 12D).
[0027] На фиг.13А-13D приведены хроматограммы выделенных ионов FNWY (тяжелая цепь) из триптически расщепленного SILUMAB, использованного в качестве внутреннего стандарта для расщепления TRI-1 в сыворотке обезьяны, m/z=562,58-562,63. Концентрации TRI-1 составляли 0 мкг/мл (контроль) (фиг. 13А), 0,2 мкг/мл (фиг. 13В), 2 мкг/мл (фиг. 13С) и 20 мкг/мл (фиг. 13D). Площади пиков пептида FNWY составляли 1446203 (фиг. 13A), 1216254 (фиг. 13B), 1271728 (фиг. 13C) и 1344983 (фиг. 13D).
[0028] На фиг. 14A-14D приведены хроматограммы выделенных ионов сконструированного TTPP из триптически расщепленного TRI-1 в сыворотке человека, m/z=905,39-905,55. Концентрации TRI-1 составляли 0 мкг/мл (контроль) (фиг. 14А), 0,2 мкг/мл (фиг. 14В), 2 мкг/мл (фиг. 14С) и 20 мкг/мл (фиг. 14D). Площади пиков пептида TTPP не детектировались (ND) (фиг. 14A), не детектировались (ND) (фиг. 14B), составляли 194065 (фиг. 14C) и 1848332 (фиг. 14D).
[0029] На фиг. 15А-15D приведены сравнения соотношения площадей к концентрации антител. На фиг.15А показано сравнение соотношения площадей сконструированного TTPP:FNWY (тяжелая цепь) против концентрации антитела TRI-1 в PBST. На фиг. 15B показано сравнение соотношения площадей немеченого FNWY:FNWY (тяжелая цепь) против концентрации антитела TRI-1 в PBST. На фиг. 15C показано сравнение соотношения площадей сконструированного TTPP:FNWY (тяжелая цепь) против концентрации антитела TRI-1 в сыворотке мыши. На фиг. 15D показано сравнение соотношения площадей сконструированного TTPP:FNWY (тяжелая цепь) против концентрации антитела TRI-1 в сыворотке обезьяны.
[0030] На фиг. 16 приведены последовательности тяжелых цепей и легких цепей типичного триспецифического антитела, количественно определенного в примере 2. Последовательности суррогатных пептидов, количественно определенных в анализе ЖХ-МС/МС, подчеркнуты.
[0031] На фиг. 17 показана схема примерного триспецифического антитела, и где последовательности суррогатных пептидов, подчеркнутые на фиг. 16, находятся в триспецифическом антителе.
[0032] На фиг. 18 представлена примерная схема последовательности операций в способе количественного определения триспецифического антитела с использованием пептида TTPP.
[0033] На фиг. 19А приведена примерная хроматограмма пептида TTPP при LLOQ (нижний предел количественного определения, 2,5 мкг/мл). На фиг.19B показана примерная хроматограмма меченного стабильным изотопом пептида TTPP (стандарт [13C11-15N2]-LTTPPVLDSDGSFFLVSK (SEQ ID NO: 20), который использовали в качестве внутреннего стандарта в примере 3. На фиг.19C приведена калибровочная кривая для пептида TTPP в диапазоне концентраций от 2,5 мкг/мл до 10000 мкг/мл.
[0034] На фиг. 20А приведена калибровочная кривая для сыворотки, анализированная с использованием линейного регрессионного анализа с 1/х взвешиванием. На фиг. 20B показана вторая калибровочная кривая для сыворотки, анализированная с использованием линейного регрессионного анализа с 1/x взвешиванием. Образцы, использованные для построения кривых на фиг. 20А и 20В, получали из отдельных экспериментов, описанных в примере 3.
[0035] На фиг. 21А показано сравнение относительных уровней триспецифического антитела, детектированных измерением уровней пептида TTPP в сыворотке, полученной от мышей, которым вводили триспецифическое антитело, с использованием ЖХ-МС/МС. На фиг. 21B показано сравнение относительных уровней триспецифического антитела, детектированного с помощью ELISA, в сыворотке, полученной от мышей, которым вводили триспецифическое антитело.
[0036] На фиг. 22А приведены результаты анализа ЖХ-МС/МС чистого контрольного образца сыворотки крысы. На фиг.22В показан МС/МС спектр образца сыворотки крысы, в который добавлено триспецифическое антитело в концентрации 5 мкг/мл. На фиг. 22C приведены результаты анализа ЖХ-МС/МС чистого контрольного образца сыворотки обезьяны. На фиг. 22D показан МС/МС спектр образца сыворотки обезьяны, в который добавлено триспецифическое антитело в концентрации 5 мкг/мл. На фиг. 22E приведены результаты анализа ЖХ-МС/МС чистого контрольного образца сыворотки обезьяны. На фиг. 22F показан МС/МС спектр образца сыворотки человека, в которую добавлено триспецифическое антитело в концентрации 5 мкг/мл.
Подробное описание изобретения
Определения
[0037] Как здесь используется, термин «константная область антитела» относится к более консервативной области антитела, например, вне вариабельных областей. Термин может включать константную область легкой цепи, т. е. домен CL, шарнирную область, а также константные домены тяжелой цепи CH1, CH2, CH3 и, необязательно, CH4.
[0038] Как здесь используется, термин «сконструированная мутация» относится к мутации, созданной конструированием человеком (т. е. мутация возникла не спонтанно в результате воздействия естественных причин и/или была результатом целенаправленного манипулирования человеком).
[0039] Как здесь используется, термин «антитело» относится к интактным антителам, фрагментам антител, включающим, по меньшей мере, участок константной области тяжелой цепи (включая, без ограничения, Fab, F(ab')2, Fab'-SH (Fv, scFv или антитела из одних тяжелых цепей) при условии, что они проявляют желаемую биологическую активность; моноклональные антитела; поликлональные антитела; моноспецифические антитела; мультиспецифические антитела (например, биспецифические антитела и триспецифические антитела); и антителоподобные белки.
[0040]Термин «антитело» обычно относится к гетеротетрамерным комплексам, включающим две легкие (L) цепи и две тяжелые (H) цепи. Различное число дисульфидных связей соединяет две тяжелые цепи, и одна связь соединяет каждую легкую цепь с тяжелой цепью, в дополнение к внутрицепочечным дисульфидным мостикам. Тяжелые цепи включают вариабельную область (VH), за которой следует (от N-конца к C-концу) три или четыре константных домена. Легкие цепи включают вариабельную область (VL), за которой следует константный домен (CL). Как правило, легкие цепи млекопитающих попадают в одну из двух категорий на основе аминокислотной последовательности: каппа и лямбда.
[0041] Как здесь используется, термин «мультиспецифическое» при использовании в отношении антитела или фрагмента антитела включает антитело или фрагмент антитела, которые обладают двумя или более различными специфичностями связывания (например, биспецифические и триспецифические антитела). Например, каждая специфичность связывания может распознавать разный антиген, или каждая специфичность связывания может распознавать один и тот же антиген с разной аффинностью и/или точным эпитопом. В некоторых вариантах осуществления каждая различная специфичность связывания содержит один или более различных антигенсвязывающих доменов антитела (например, вариабельные домены), так что мультиспецифическое антитело или фрагмент антитела содержит, например, первый антигенсвязывающий домен с первой специфичностью связывания, второй антигенсвязывающий домен со второй специфичностью связывания и т. д. Различные примерные форматы мультиспецифических антител (например, форматы биспецифических и триспецифических антител) известны в данной области, и более подробно описаны в других разделах настоящего документа.
[0042] Перед подробным описанием раскрытых вариантов осуществления следует понимать, что настоящее раскрытие не ограничивается конкретными композициями или биологическими системами, которые, конечно, могут варьироваться. Также следует понимать, что терминология, используемая здесь, предназначена только для описания конкретных вариантов осуществления и не предназначена для ограничения.
[0043] Как используется в данном описании и прилагаемой формуле изобретения, формы единственного числа «а», «an» и «the» включают ссылки на множественное число, если содержание явно не диктует иное. Таким образом, например, ссылка на «молекулу» необязательно включает комбинацию двух или более таких молекул и тому подобное.
[0044] Как здесь используется, термин «примерно» относится к обычному диапазону ошибок для соответствующего значения, хорошо известного специалисту в данной области техники. Ссылка на «примерно» перед значением или параметром в данном документе включает (и описывает) варианты осуществления, которые направлены на это значение или параметр как таковые.
[0045] Понятно, что аспекты и варианты осуществления настоящего раскрытия включают «содержащий», «состоящий» и «состоящий по существу из» аспектов и вариантов осуществления.
Способы количественного определения полипептида в образце
[0046] Масс-спектрометрия (МС) является осуществимой альтернативой анализам связывания лигандов (LBA) для количественного анализа терапевтических белков в образцах, полученных, например, от животных, на которых проводятся доклинические исследования. Типичная процедура количественного определения на основе МС включает расщепление каждого образца с получением пептидных фрагментов и количественное определение содержания конкретного пептида, полученного из терапевтического белка, в качестве суррогата для самого терапевтического белка. В настоящее время «универсальные» суррогатные пептиды, полученные из константной области человеческого антитела, используются в общих способах количественного определения человеческих, гуманизированных или химерных антител на животных моделях, отличных от человека. Такие общие способы основаны на том принципе, что последовательность «универсального» суррогатного пептида является консервативной во всех Fc-областях человека, но отсутствует у видов, на которых проводятся доклинические исследования эффективности и безопасности (например, мышей, крыс, собак, обезьян и т.д.). Однако «универсальные» суррогатные пептиды невозможно использовать для точного количественного определения, например, терапевтического белка, содержащего константную область человеческого антитела, в образцах от пациентов-людей, поскольку последовательность «универсального» суррогатного пептида также присутствует в эндогенных антителах человека.
[0047] Многие терапевтические белки (например, антитела), которые содержат константную область человеческого антитела, также содержат сконструированные мутации, которые были введены в константную область, например, для модуляции эффекторной функции, изменения периода полураспада в сыворотке крови, обеспечения гетеродимеризации и т. д. Заявители настоящего изобретения установили, что пептиды, полученные из участка константной области, которая содержит сконструированную мутацию, являются уникальными как для фоновых уровней протеома, не принадлежащего человеку, так и для человека. Следовательно, способы, описанные здесь, можно использовать для количественного определения терапевтических белков как в образцах в доклинических исследованиях (т. е., полученных от видов животных), так и в образцах в клинических исследованиях (т. е., полученных от пациентов-людей).
[0048] Обеспечиваются способы количественного определения содержания полипептида в образце, где полипептид содержит участок константной области тяжелой цепи антитела, и где участок константной области тяжелой цепи антитела включает сконструированную мутацию. В некоторых вариантах осуществления способ включает стадии: (а) расщепления образца, который предположительно содержит полипептид, для получения расщепленного образца, содержащего пептидный фрагмент, который включает сконструированную мутацию; и (b) анализ расщепленного образца масс-спектрометрией для определения количества пептидного фрагмента, который содержит сконструированную мутацию, посредством чего определяют количество полипептида. Полипептиды, которые можно количественно определять с использованием способов, описанных здесь (например, слитые белки, иммуноадгезины и антитела), описаны более подробно в других разделах данного документа.
[0049] В некоторых вариантах осуществления способы, обеспеченные здесь, используются в фармакокинетических исследованиях (например, в доклинических исследованиях или в клинических испытаниях). В некоторых вариантах осуществления способы включают стадию введения полипептида, который содержит участок константной области тяжелой цепи антитела со сконструированной мутацией животному, например, во время доклинических исследований, до количественного определения. Типичные животные, отличные от человека, которым можно вводить полипептид, который содержит участок константной области тяжелой цепи антитела со сконструированной мутацией, подробно описаны ниже. В некоторых вариантах осуществления способы включают введение полипептида, который содержит участок константной области тяжелой цепи антитела со сконструированной мутацией человеку, например человеку, во время клинического испытания до количественного определения.
[0050] В некоторых вариантах осуществления образец, содержащий полипептид, который содержит участок константной области тяжелой цепи антитела со сконструированной мутацией, представляет собой биологический образец, который происходит, получен или выделен от животного. В некоторых вариантах осуществления животное, от которого происходит, получен или выделен образец, представляет собой животное, которому ввели полипептид, который содержит участок константной области тяжелой цепи антитела со сконструированной мутацией. В некоторых вариантах животное является млекопитающим. В некоторых вариантах осуществления млекопитающее представляет собой человека (например, пациента-человека), примата, отличного от человека (NHP) (например, обезьяну cynomolgus, макаку-резус, мартышку, тамарин, паукообразную обезьяну, совинолицую обезьяну, беличью обезьяну, зеленую мартышку, бабуина или других) или грызуна (например, мышь или крысу).
[0051] В некоторых вариантах осуществления анализируемый образец в соответствии со способом, представленным здесь, представляет собой любой образец, который предположительно содержит полипептид, который содержит участок константной области тяжелой цепи антитела со сконструированной мутацией. В некоторых вариантах осуществления образец представляет собой или получен из жидкости организма, включая, не ограничиваясь этим, например, кровь, плазму, сыворотку, молоко, бронхоальвеолярный лаваж, амниотическую жидкость, слюну, желчь или слезы. В некоторых вариантах осуществления образец содержит ткань или клетки. В некоторых вариантах осуществления образец содержит сыворотку и известное количество пептида (т. е. «сыворотку с добавленным пептидом»). В некоторых вариантах осуществления сыворотка с добавленным пептидом дополнительно содержит буфер. В некоторых вариантах осуществления сыворотка с добавленным аналитом служит в качестве эталона для количественного определения содержания полипептида, содержащего участок константной области тяжелой цепи антитела со сконструированной мутацией, присутствующего в образце, который происходит, получен или выделен от животного.
[0052] В некоторых вариантах осуществления способ дополнительно включает обработку образца перед расщеплением, например, для обогащения полипептида, который содержит участок константной области тяжелой цепи антитела со сконструированной мутацией в образце, или, например, истощением избыточных белков из образца (например, альбумина из образца крови, сыворотки или плазмы). В некоторых вариантах осуществления обработка образца включает проведение анализа с истощением антител. Альтернативно или дополнительно, в некоторых вариантах осуществления обработка образца включает проведение гель-электрофореза, экстракции, осаждения, центрифугирования, хроматографии (например, аффинной хроматографии с захватом, эксклюзионной хроматографии и т. д.), ультрафильтрации и/или одной или более дополнительных стадий разделения, известных специалистам в данной области.
[0053] В некоторых вариантах осуществления образец расщепляют посредством химического расщепления. Типичные химические реагенты, которые расщепляют в определенных сайтах в полипептидах, включают, не ограничиваясь этим, например, муравьиную кислоту, гидроксиламин, иодоксибензойную кислоту и NTCB (2-нитро-5-тиоцианобензойную кислоту). В некоторых вариантах осуществления образец расщепляют ферментом, например эндопептидазой. В некоторых вариантах осуществления фермент представляет собой сайт-специфическую эндопептидазу. Типичные сайт-специфические протеазы включают, не ограничиваясь этим, трипсин, химотрипсин (высокая специфичность, расщепляет С-конец до FYW, но не до Р), химотрипсин (низкая специфичность, расщепляет С-конец до FYWML, не до Р), глутамилэндопептидазу, лизилэндопептидазу, Asp-N-протеазу, Arg-C-протеазу, Lys-C-протеазу, Lys-N-протеазу, Staphylococcus aureus V8 (также известную как стафилококковую глутамилэндопептидаза или Glu-C-протеаза), цианогенбромид (CnBr), эластазу, пепсин (рН=1,3), пепсин (рН> 2), неприлизин, BNPS-скатол, каспазу 1, каспазу 2, каспазу 3, каспазу 4, каспазу 5, каспазу 6, каспазу 7, каспазу 8, каспазу 9, каспазу 10, клострипаин, энтерокиназу, фактор Ха, гранзим B, термолизин, пролинэндопептидазу, стафилококковую пептидазу I, тромбин и протеазу вируса гравировки табака. В некоторых вариантах осуществления образец расщепляют неспецифической эндопептидазой, например папаином или протеиназой К. В некоторых вариантах осуществления образец расщепляют смесью, содержащей две (или более) эндопептидазы (включая сайт-специфическую и/или не-сайт-специфическую). В некоторых вариантах осуществления две или более эндопептидазы используются одновременно для расщепления образца. В некоторых вариантах осуществления две или более эндопептидазы используются последовательно для расщепления образца. Способы расщепления полипептидов при подготовке к анализу масс-спектрометрией хорошо известны в данной области. Примерные способы описаны, например, в публикациях Gundry et al. (2009) Curr. Protoc. Mol. Biol. doi: 10.1002/0471142727.mb1025s88; Hedrick et al. (2015) Curr. Protoc. Chem. Biol., 7 (3): 201-222; Giansanti et al. (2016) Nature Protocols, 11: 993-1006; Nordhoff et al. (Int. J. Mass Spect., 226 (1): 163-180; и Zhang et al. (2014) Curr. Protoc. Mol. Biol. doi: 10.1002/0471142727.mb1021s108.
[0054] В результате расщепления образца образуется пептидный фрагмент, который содержит сконструированную мутацию. В некоторых вариантах осуществления пептидный фрагмент, полученный в результате расщепления, имеет длину от 5 до 40 аминокислот, например, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40 аминокислот в длину. В некоторых вариантах осуществления пептидный фрагмент не содержит остатков цистеина (Cys) и/или метионина (M). Альтернативно или дополнительно, в некоторых вариантах осуществления пептид не содержит остаток аспарагина (N), за которым следует остаток глицина (G) или остаток серина (S) (т. е. NG или NS). В некоторых вариантах осуществления пептидный фрагмент не содержит смежных сайтов расщепления эндопептидазой, например, двух или более сайтов расщепления сайт-специфической эндопептидазой, разделенных 6, 5, 4, 3, 2 или 1 аминокислотой. Были разработаны разнообразные инструменты компьютерного моделирования для прогнозирования популяций пептидов, которые можно получить расщеплением (например, расщеплением одним ферментом или реагентом для химического расщепления или расщеплением комбинацией ферментов и/или реагентов для химического расщепления). Такие инструменты, которые включают (без ограничения) PChopper, PeptideCutter, MAPPP, IPEP, MS-Digest и Protein Digestion Simulator, хорошо известны в данной области техники и являются общедоступными, например, в World Wide Web.
[0055] В некоторых вариантах осуществления способ дополнительно включает очистку и/или концентрирование расщепленного образца перед анализом масс-спектрометрией. В некоторых вариантах осуществления очистка и/или концентрирование расщепленного образца включает проведение аффинной хроматографии с захватом или твердофазной экстракции (SPE) и элюирование очищенного и концентрированного образца. (См., например, Gudry et al. (2009) Gudry et al. (2009) «Preparation of Proteins and Peptides for Mass Spectrometry Analysis in a Bottom-Up Proteomics Workflow», Curr. Protoc. Mol. Biol., CHAPTER: Unit10.25. doi:10.1002/0471142727.mb1025s88). В некоторых вариантах осуществления очистка и/или концентрирование расщепленного образца включает выполнение метода стабильных изотопных стандартов с захватом антипептидными антителами (SISCAPA). В некоторых вариантах осуществления образец подвергают анализу с истощением антител, расщепляют (например, используя одну или более эндопептидаз, известных в данной области) и очищают и/или концентрируют с помощью SISCAPA. Подробная информация, касающаяся SISCAPA, представлена, например, в публикации Anderson et al. (2004) «Mass spectrometric quantitation of peptides and proteins using Stable Isotope Standards and Capture by Anti-Peptide Antibodies (SISCAPA)», J. Proteome Res., 3(2): 235-244; в патентах США № 7632686 и 9166489; Whiteaker et al. (2011) «Evaluation of large scale quantitative proteomic assay development using peptide affinity-based mass spectrometry», Mol. Cell Proteomics, 10(4):M110.005645; и Rasavi et al. (2016) «Multiplexed longitudinal measurement of protein biomarkers in DBS using an automated SISCAPA workflow», Bioanalysis., 8(15):1597-1609.
[0056] В некоторых вариантах осуществления расщепленный образец анализируют жидкостной хроматографией-тандемной масс-спектрометрией (ЖХ-МС/МС). ЖХ-МС/МС представляет собой метод, в котором смесь образцов сначала разделяется с помощью жидкостной хроматографии перед ионизацией (например, посредством электрораспылительной ионизацией (ESI), химической ионизацией при атмосферном давлении (APCI) или фотоионизацией при атмосферном давлении (APPI)), и характеризуется отношением массы к заряду и относительной избыточностью с использованием двух масс-спектрометров последовательно. Подробная информация относительно ЖХ-МС/МС представлена, например, в Grebe et al. (2011) «LC-MS/MS in the Clinical Laboratory - Where to From Here?» Clin. Biochem Review. 32(1): 5-31; El-Khoury et al. «Liquid Chromatography-Tandem Mass Spectrometry in the Clinical Laboratory», J. Chrom. & Separation Tech. 4:e115. doi: 10.4172/2157-7064.1000e115; Shushan et al. (2010) «A review of clinical diagnostic applications of liquid chromatography-tandem mass spectrometry», Mass Spec. Rev., 29:930-944, 2010.
[0057] В некоторых вариантах осуществления способы, обеспеченные здесь, можно использовать для детектирования пептида в образце, где концентрация пептида в образце равна любому значению из примерно 200, 150, 100, 50, 15, 10, 5, 1, 0,5, 0,25, 0,1, 0,075, 0,05, 0,025 или 0,01 нг/мл, включая любой диапазон между этими значениями.
Сконстурированные мутации в константной области тяжелой цепи антитела
[0058] В некоторых вариантах осуществления полипептид, количественно определяемый в соответствии со способом, обеспеченным здесь, содержит домен CH1 (или его участок, например, между 10 и 50 аминокислотами), который содержит сконструированную мутацию. В некоторых вариантах осуществления домен CH1 простирается от примерно остатка 114 до примерно остатка 223 тяжелой цепи антитела в соответствии с системой нумерации по Kabat. В некоторых вариантах осуществления домен CH1 простирается от примерно остатка 118 до примерно остатка 215 тяжелой цепи антитела в соответствии с системой нумерации ЕС. См., например, веб-сайты Международной информационной системы по иммуногенетике (IMGT) на WorldWideWeb.imgt.org/IMGTScientificChart/Numbering/Hu_IGHGnber.html. Эти положения аминокислотных остатков основаны на человеческом IgG; однако не предполагается, что способы, обеспеченные здесь, ограничиваются использованием с полипептидами, содержащими домен CH1 (или его участок) человеческого IgG. Соответствующие последовательности домена CH1 из других человеческих Ig и соответствующие последовательности домена CH1 от других млекопитающих (например, макаки, обезьяны cynomolgus, мыши, крысы и т.д.) являются общедоступными.
[0059] В некоторых вариантах осуществления сконструированная мутация в домене CH1 (или его участке) включает (например, состоит из) аминокислотную замену, инсерцию или делецию, которая не влияет (или существенно влияет) на желаемую активность полипептида, содержащего константную область тяжелой цепи антитела. В некоторых вариантах осуществления замена или инсерция включает замену или инсерцию неприродной аминокислоты или конъюгированной аминокислоты. Аминокислотная замена, инсерция или делеция могут быть введены в домен CH1 (или его участок) изменением нуклеиновой кислоты, кодирующей полипептид (например, сайт-специфическим мутагенезом), или пептидным синтезом, как более подробно описано в других разделах данного документа.
[0060] В некоторых вариантах осуществления полипептид, подлежащий количественному определению в соответствии со способом, обеспеченным здесь, содержит домен CH1 человеческого IgG1 (или его участок). В некоторых вариантах осуществления сконструированная мутация в домене CH1 человеческого IgG1 (или его участке) запускает гетеродимеризацию Fc (например, для продуцирования биспецифических антител, мультиспецифических антител или антител с одним плечом). В некоторых вариантах осуществления сконструированная мутация в домене CH1 человеческого IgG1 (или его участке) представляет собой аминокислотную замену K147 или K213 (согласно системе нумерации ЕС). В некоторых вариантах осуществления сконструированная мутация в домене CH1 человеческого IgG1 включает (например, состоит из) аминокислотную замену K147D, K147E, K213D или K213E (согласно системе нумерации ЕС).
[0061] В некоторых вариантах осуществления полипептид, подлежащий количественному определению в соответствии со способом, обеспеченным здесь, содержит домен СН2 (или его участок, например, между 10 и 50 аминокислотами), который содержит сконструированную мутацию. В некоторых вариантах осуществления домен CH2 человеческого IgG простирается примерно от остатка 231 до примерно остатка 340 тяжелой цепи антитела в соответствии с системой нумерации ЕС. См., например, веб-сайты Международной информационной системы по иммуногенетике (IMGT) на WorldWideWeb.imgt.org/IMGTScientificChart/Numbering/Hu_IGHGnber.html. Эти аминокислотные положения основаны на человеческом IgG; однако не предполагается, что способы, обеспеченные здесь, ограничиваются использованием с полипептидами, содержащими домен CH2 (или его участок) человеческого IgG. Соответствующие последовательности домена CH2 из других человеческих Ig являются общедоступными, как и соответствующие последовательности домена CH2 от других млекопитающих (например, макаки, обезьяны cynomolgus, крысы, мыши и т.д.). В некоторых вариантах осуществления сконструированная мутация в домене СН2 (или его участке) включает аминокислотную замену, инсерцию или делецию, которая не влияет (или существенно не влияет) на желаемую активность полипептида, содержащего константную область тяжелой цепи антитела. В некоторых вариантах осуществления замена или инсерция включает замену или инсерцию неприродной аминокислоты или конъюгированной аминокислоты.
[0062] В некоторых вариантах осуществления полипептид, подлежащий количественному определению в соответствии со способом, обеспеченным здесь, содержит домен CH2 человеческого IgG1 (или его участок). В некоторых вариантах осуществления сконструированная мутация в домене CH2 человеческого IgG1 (или его участке) модулирует эффекторную функцию. В некоторых вариантах осуществления сконструированная мутация в домене CH2 человеческого IgG1 (или его участке) содержит аминокислотную замену в одном (или более) следующих остатках: E233, L234, L235, G236, P238, S239, F243, T250, M252, S254, T256, P257, S267, R292, Q295, N297, S298, T299, Y300, Q311, K322, A327, L328, P329, A330, P331, I332 и E333 (в соответствии с системой нумерации ЕС). В некоторых вариантах осуществления сконструированная мутация в домене CH2 человеческого IgG1 (или его участке) содержит одну (или более) из следующих аминокислотных замен: E233P, L234V, L234A, L235V, L235A,, G236A, P238D, S239D, F243L, T250Q, T250R, M252Y, S254T, T256E, P257I, S267E, R292P, Q295R, N297Q, N297D, N297A, S298G, S298N, S298C, S298A, S28T, T299A, Y300L, Q311I, K322A, A327G, L328E, L328F, L328W, P329G, P329N, A330S, A330L, A330V, P331S, P331V, I332E, I332Y, E333A и E333S (в соответствии с системой нумерации ЕС). Альтернативно или дополнительно, сконструированная мутация в домене CH2 человеческого IgG1 (или его участке) содержит (например, состоит из) ΔG236 (согласно системе нумерации ЕС).
[0063] В некоторых вариантах осуществления полипептид, подлежащий количественному определению в соответствии со способом, обеспеченным здесь, содержит домен CH2 человеческого IgG2 (или его участок). В некоторых вариантах осуществления сконструированная мутация в домене CH2 человеческого IgG2 (или его участке) модулирует эффекторную функцию. В некоторых вариантах осуществления сконструированная мутация в домене CH2 человеческого IgG2 (или его участке) содержит аминокислотную замену в одном (или более) из следующих остатков: K326 и E333 (согласно системе нумерации ЕС). В некоторых вариантах осуществления сконструированная мутация в домене CH2 человеческого IgG1 (или его участке) содержит одну (или более) из следующих аминокислотных замен: K326W и E333S (согласно системе нумерации ЕС).
[0064] В некоторых вариантах осуществления полипептид, подлежащий количественной оценке в соответствии со способом, обеспеченным здесь, содержит домен CH2 человеческого IgG3. В некоторых вариантах осуществления сконструированная мутация в домене CH2 человеческого IgG3 модулирует эффекторную функцию. В некоторых вариантах осуществления сконструированная мутация в домене CH2 человеческого IgG3 содержит аминокислотную замену в E235 (согласно системе нумерации ЕС). В некоторых вариантах осуществления аминокислотная замена включает E235Y.
[0065] В некоторых вариантах осуществления полипептид, подлежащий количественной оценке в соответствии со способом, обеспеченным здесь, содержит домен CH2 человеческого IgG4 (или его участок). В некоторых вариантах осуществления сконструированная мутация в домене CH2 человеческого IgG4 (или его участке) модулирует эффекторную функцию. В некоторых вариантах осуществления сконструированная мутация в домене CH2 человеческого IgG4 (или его участке) содержит аминокислотную замену в одном (или более) следующих остатках: S228, F234, L235, F296, G327 и P329 (согласно системе нумерации ЕС). В некоторых вариантах осуществления аминокислотная замена включает одну (или более) из следующих аминокислотных замен: S228P, F234A, F234L, L235A, F296Y, G327A, P329G и P329N.
[0066] В некоторых вариантах осуществления полипептид, подлежащий количественной оценке в соответствии со способом, обеспеченным здесь, содержит домен СН3 (или его участок, например, между 10 и 50 аминокислотами), который содержит сконструированную мутацию. В некоторых вариантах осуществления домен СН3 простирается от примерно остатка 341 до примерно остатка 447 согласно системе нумерации ЕС. См., например, веб-сайты Международной информационной системы по иммуногенетике (IMGT) на WorldWideWeb.imgt.org/IMGTScientificChart/Numbering/Hu_IGHGnber.html. Эти аминокислотные положения основаны на человеческом IgG; однако не подразумевается, что способы, обеспеченные здесь, ограничиваются использованием с полипептидами, содержащими домен СН3 человеческого IgG. Соответствующие последовательности домена СН3 из других человеческих Ig являются общедоступными, как и соответствующие последовательности домена СН3 из других Ig других млекопитающих (например, макаки, обезьяны cynomolgus, крысы, мыши и т.д.). В некоторых вариантах осуществления сконструированная мутация в домене CH3 (или его участке) представляет собой аминокислотную замену, инсерцию или делецию, которая не влияет (или существенно влияет) на желаемую активность полипептида, содержащего константную область тяжелой цепи антитела. В некоторых вариантах осуществления замена или инсерция включает замену или инсерцию неприродной аминокислоты или конъюгированной аминокислоты.
[0067] В некоторых вариантах осуществления полипептид, подлежащий количественному определению в соответствии со способом, обеспеченным здесь, содержит домен CH3 человеческого IgG4 (или его участок). В некоторых вариантах осуществления сконструированная мутация в домене CH3 человеческого IgG1 (или его участке) модулирует эффекторную функцию. В некоторых вариантах осуществления сконструированная мутация в домене CH3 человеческого IgG1 (или его участке) включает (например, состоит из) аминокислотную замену в остатках R409 (согласно системе нумерации ЕС). В некоторых вариантах осуществления сконструированная мутация в домене CH3 человеческого IgG1 (или его участке) включает (например, состоит из) аминокислотную замену R409K.
[0068] В некоторых вариантах осуществления полипептид, подлежащий количественной оценке в соответствии со способом, обеспеченным здесь, содержит домен CH3 человеческого IgG1 (или его участок). В некоторых вариантах осуществления сконструированная мутация в домене CH3 человеческого IgG1 (или его участке) модулирует эффекторную функцию и/или удлиняет период полураспада в сыворотке. В некоторых вариантах осуществления сконструированная мутация в домене CH3 человеческого IgG1 (или его участке) содержит аминокислотную замену в одном или более следующих остатков: N343, E380, E382, P396, M428, H433, N434 и Y436 (в соответствии с системой нумерации ЕС). В некоторых вариантах осуществления сконструированная мутация в домене CH3 человеческого IgG1 (или его участке) содержит одну (или более) из следующих аминокислотных замен: N343A, E380A, E382V, P396L, M428I, M428L, H433K, N434S, N434F и Y436H (согласно системе нумерации ЕС). В некоторых вариантах осуществления сконструированная мутация в домене CH3 человеческого IgG1 (или его участке) запускает гетеродимеризацию Fc (например, для продуцирования биспецифических антител, мультиспецифических антител или антител с одним плечом). В некоторых вариантах осуществления сконструированная мутация в домене CH3 человеческого IgG1 (или его участке) содержит аминокислотную замену одного (или более) из следующих остатков: Y349, S354, R355, D356, E357, K360, T366, L368, K370, K392, T394, D399, F405, Y407, K409 и K439 (в соответствии с системой нумерации ЕС). В некоторых вариантах осуществления сконструированная мутация в домене CH3 человеческого IgG1 (или его участке) содержит одну (или более) из следующих аминокислотных замен: Y349C, S354C, R355D, R355E, D356K, D356R, E357K, E357R, K360D, K360E, T366R, T366K, T366N, T366Q, T366Y, T366W, T366S, T366E, T366G, L368A, L368K, L368Q, L368D, L368E, L368G, L368H, L368I, L368N, L368R, L368S, L368T, L368V, L368W, K370W, K370D, K370E, K392D, K392E, T394W, T394S, D399A, D399G, D399I, D399L, D399M, D399N, D299S, D399T, D399F, D399H, D399K, D399R, D399Y, F405A, F405W, Y407T, Y407V, Y407A, K409R, K409A, K409H, K409D, K409E, K409G, K439D и K439E (в соответствии с системой нумерации ЕС).
[0069] В некоторых вариантах осуществления сконструированная мутация в домене СН3 человеческого IgG1 (или его участке) содержит (например, состоит из) Y407V. В некоторых вариантах осуществления полипептид, содержащий константную область тяжелой цепи антитела со сконструированной мутацией, содержит аминокислотную последовательность, представленную в SEQ ID NO: 6 (DGSFFLVS). В некоторых вариантах осуществления в результате расщепления образца, содержащего (или предположительно содержащего) полипептид, включающий константную область тяжелой цепи антитела со сконструированной мутацией Y407V, образуется пептидный фрагмент, содержащий (например, состоящий из) аминокислотную последовательность TTPPVLDSDGSFFLVSK (SEQ ID NO: 7), DGSFFLVSKLTV (SEQ ID NO: 8) или GSFFLVSKLTVD (SEQ ID NO: 9). В некоторых вариантах осуществления образец, содержащий (или предположительно содержащий) полипептид, включающий константную область тяжелой цепи антитела со сконструированной мутацией Y407V, расщепляют трипсином, и в результате расщепления образуется пептидный фрагмент, содержащий (например, состоящий из) аминокислотную последовательность TTPPVLDSDGSFFLVSK (SEQ ID NO: 7). В некоторых вариантах осуществления образец, содержащий (или предположительно содержащий) полипептид, включающий константную область тяжелой цепи антитела со сконструированной мутацией Y407V, расщепляют Asp-N, и в результате расщепления образуется пептидный фрагмент, содержащий (например, состоящий из) аминокислотную последовательность DGSFFLVSKLTV (SEQ ID NO: 8). В некоторых вариантах осуществления образец, содержащий (или предположительно содержащий) полипептид, включающий константную область тяжелой цепи антитела со сконструированной мутацией Y407V, расщепляют Glu-C, и в результате расщепления образуется пептидный фрагмент, содержащий (например, состоящий из) аминокислотную последовательность GSFFLVSKLTVD (SEQ ID NO: 9).
[0070] В некоторых вариантах осуществления сконструированная мутация в домене СН3 человеческого IgG1 содержит (например, состоит из) N434S. В некоторых вариантах осуществления образец, содержащий (или предположительно содержащий) полипептид, включающий константную область тяжелой цепи антитела со сконструированной мутацией N434S, расщепляют Glu-C и трипсином, и в результате расщепления образуется пептидный фрагмент, содержащий (например, состоящий из) аминокислотную последовательность ALHSHYTQK (SEQ ID NO: 11).
[0071] В некоторых вариантах осуществления сконструированная мутация вводится в константную область тяжелой цепи антитела (или ее участок) с помощью стандартных молекулярно-биологических методов, известных в данной области. Различные методы генной инженерии были описаны ранее. Такие способы мутагенеза включают, не ограничиваясь этим, например, ПЦР пониженной точности, перестановку петель, олигонуклеотид-направленный мутагенез, случайную вставку нуклеотидов или другие методы перед рекомбинацией. Дополнительная подробная информация, касающаяся этих способов, описана, например, в публикациях Abou-Nadler et al. (2010) Bioengineered Bugs., 1, 337-340; Firth et al. (2005) Bioinformatics., 21, 3314-3315; Cirino et al. (2003) Methods Mol. Biol., 231, 3-9; Pirakitikulr (2010) Protein Sci., 19, 2336-2346; Steffens et al. (2007) J. Biomol Tech., 18, 147-149; и другие.
Полипептиды, содержащие участок константной области тяжелой цепи антитела
[0072] Способы, обеспеченные здесь, можно осуществить с использованием любого полипептида, который содержит участок константной области тяжелой цепи антитела, где участок константной области тяжелой цепи антитела включает сконструированную мутацию. В некоторых вариантах осуществления полипептид содержит весь или участок (например, от 10 до 50 аминокислот) домена СН1, домена СН2 и/или домена СН3, при условии, что домен(ы) (или его участок(и)) включает сконструированную мутацию (например, сконструированную мутацию, описанную здесь в других разделах настоящего документа). В некоторых вариантах осуществления участок константного домена тяжелой цепи, включающий сконструированную мутацию, представляет собой или происходит от млекопитающего (например, человека, примата, отличного от человека, мыши, крысы и т.д.). В некоторых вариантах осуществления участок константной области тяжелой цепи, который содержит сконструированную мутацию, представляет собой или происходит из человеческого IgG (такого как IgG1, IgG2, IgG3 или IgG4), человеческого IgA (такого как IgA1 или IgA2) человеческого IgM, человеческого IgE или человеческого IgD. В некоторых вариантах осуществления участок константной области тяжелой цепи, который содержит сконструированную мутацию, представляет собой или происходит от мыши (например, константной области тяжелой цепи мышиного IgA, IgD, IgE, IgG1, IgG2a, IgG2b, IgG2c, IgG3 или IgM антитела).
[0073] В некоторых вариантах осуществления полипептид, содержащий участок константной области тяжелой цепи антитела со сконструированной мутацией, представляет собой антитело. В некоторых вариантах осуществления антитело представляет собой человеческое, гуманизированное или химерное антитело. В некоторых вариантах осуществления антитело содержит константную область, например, человеческого IgG1, человеческого IgG2, человеческого IgG3, человеческого IgG4, человеческого IgA1, человеческого IgA2, человеческого IgM, человеческого IgE или человеческого IgD, которая содержит, по меньшей мере, одну сконструированную мутацию.
[0074] В некоторых вариантах осуществления полипептид, содержащий участок константной области тяжелой цепи антитела со сконструированной мутацией, представляет собой слитый полипептид. В некоторых вариантах осуществления слитый полипептид представляет собой Fc-слитый полипептид, который содержит Fc-область (т. е. домены CH2 и CH3) константной области тяжелой цепи антитела. В некоторых вариантах осуществления слитый полипептид представляет собой иммуноадгезин, т. е. слитый полипептид, в котором функциональный домен связывающего белка (например, рецептор, лиганд или полипептид клеточной адгезии) слит с участком константной области тяжелой цепи антитела (как правило, шарнирной областью и Fc-областью).
Антитела
[0075] В некоторых вариантах осуществления полипептид, содержащий участок константной области тяжелой цепи антитела, который включает сконструированную мутацию, представляет собой антитело. В некоторых вариантах осуществления антитело представляет собой гетеротетрамерный комплекс, который содержит две легкие (L) цепи и две тяжелые (H) цепи. В некоторых вариантах осуществления две легкие цепи и две тяжелые цепи являются идентичными. В некоторых вариантах осуществления две легкие цепи содержат разные аминокислотные последовательности. В некоторых вариантах осуществления две тяжелые цепи содержат разные аминокислотные последовательности. В некоторых вариантах осуществления антитело представляет собой полноразмерное антитело (например, содержащее две полноразмерные легкие цепи и две полноразмерные тяжелые цепи). В некоторых вариантах осуществления антитело представляет собой фрагмент антитела, который содержит участок константного домена тяжелой цепи, который включает сконструированную мутацию, например, Fab, F(ab')2, Fab'-SH, Fv, scFv, или антитело из одних тяжелых цепей. В некоторых вариантах осуществления антитело представляет собой антитело млекопитающего (такое как антитело человека, антитело примата, отличного от человека, антитело мыши, антитело крысы и т.д.). В некоторых вариантах осуществления антитело представляет собой моноспецифическое антитело. В некоторых вариантах осуществления антитело представляет собой мультиспецифическое антитело.
Мультиспецифические антитела
[0076] Мультиспецифические антитела обладают специфичностью связывания с более чем одним антигеном (например, имеет место две, три или более трех специфичностей связывания). В некоторых вариантах осуществления антитело, количественно определяемое с использованием способа, обеспеченного здесь, представляет собой биспецифическое антитело. В некоторых вариантах осуществления биспецифическое антитело включает две разные специфичности связывания для одного и того же антигена (например, имеющие различную аффинность связывания и/или специфический эпитоп одного и того же антигена). В некоторых вариантах осуществления биспецифическое антитело обладает специфичностью связывания для двух разных антигенов. В некоторых вариантах осуществления биспецифическое антитело представляет собой полноразмерное или интактное антитело. Способы, обеспеченные здесь, предполагаются для применения с биспецифическими или мультиспецифическими форматами антител, известными в данной области. Типичные форматы биспецифических и мультиспецифических антител включают, не ограничиваясь этим, описанные ниже.
[0077] Например, технология «выступы-во-впадины» представляет собой стратегию конструирования гомодимеров тяжелых цепей антител для гетеродимеризации (например, для получения биспецифических антител, мультиспецифических антител или антител с одним плечом). Как правило, такая технология включает введение выпуклости («выступа») на поверхности раздела первого полипептида (такого как первый домен CH3 в тяжелой цепи первого антитела) и соответствующей полости («впадине») на поверхности раздела второго полипептида (такой как второй домен СН3 во второй тяжелой цепи антитела), так что выступ может располагаться во впадине так, чтобы обеспечивать образованию гетеродимера и препятствовать образованию гомодимера. Выступы конструируют заменой небольших аминокислотных боковых цепей на поверхности раздела первого полипептида (такого как первый домен СН3 в тяжелой цепи первого антитела) более крупными боковыми цепями (например, аргинином, фенилаланином, тирозином или триптофаном). Компенсаторные полости идентичного или сходного размера с выступами создаются на поверхности раздела второго полипептида (такого как второй домен СН3 во второй тяжелой цепи антитела) заменой крупных боковых цепей аминокислот более мелкими (например, аланином, серином, валином или треонином). См., например, патенты США № 5731168; 5807706; 5821333; 7642228; 7695936; 8216805 и 8679785, содержание каждого из которых в полном объеме включено здесь посредством ссылки. Примерные группы мутаций типа «выступы-во-впадины» включают, не ограничиваясь этим, приведенные в таблице 1 ниже:
Примерные группы мутаций типа «выступы-во-впадины»
L368A
Y407V
WY407T
Y407A
T394S
T366W
T366W
F405A
T366S
L368A
Y407V
T366S
L368A
Y407A
[0078] В международной заявке WO 2011/131746 описано биспецифическое антитело, содержащее асимметричные мутации в одном из положений 366, 368, 370, 399, 405 и 407 (согласно нумерации ЕС) в каждом домене CH3. Мутации индуцируют направленный обмен «Fab-плеча» или «половины молекулы» между двумя моноспецифическими IgG1-, IgG4- или IgG4-подобными антителами при инкубации в восстанавливающих условиях.
[0079] В заявке на патент США 2009/0232811 и публикации Schaefer et al. (2011) PNAS USA, 108 (27): 11187-11192 описана технология CrossMAb, т. е. формат биспецифического антитела, который включает обмен одного или более доменов тяжелой цепи и легкой цепи внутри антигенсвязывающего фрагмента (Fab) в одной половине биспецифического антитела. Правильная ассоциация легких цепей и их родственных тяжелых цепей достигается обменом доменами тяжелых цепей и легких цепей внутри антигенсвязывающего фрагмента (Fab) одной половины биспецифического антитела. Такой «обмен по типу крест-накрест» сохраняет антигенсвязывающую аффинность, но делает два плеча настолько разными, что больше не может происходить неправильное связывание легкой цепи. Типичные форматы CrossMAb включают CrossMAbFab (т. е., в котором домены CL и VL обмениваются с доменами CH1 и VH соответственно), CrossMAbVH-VL (т. е., в котором обмениваются домены VL и VH) и CrossMAbCH1-VCL (т.е., в котором обмениваются домены CH1 и CL). См. также WO 2009/080251, WO 2009/080252, WO 2009/080253 и WO 2009/080254, содержание каждой из которых в полном объеме включено здесь посредством ссылки.
[0080] В международной заявке WO 2007/147901 описана стратегия конструирования тяжелых цепей антител для гетеродимеризации (например, для получения биспецифических антител, мультиспецифических антител или антител с одним плечом), которая включает введение асимметричных мутаций в Fc-областях (т. е. K253E, D282K, K322D в первую Fc-область и D239K, E240K и K292D во вторую Fc-область) и в доменах CH/CL (т. е. K96E в CH1 и E15K в CL). Сообщается, что такие асимметричные мутации нарушают ионные взаимодействия, которые стабилизируют гомодимеризацию половин антител и способствуют гетеродимеризации Fc-областей.
[0081] В международной заявке WO 2009/089004 описаны гетеромультимерные белки (например, биспецифические, мультиспецифические или антитела с одним плечом), содержащие асимметричные пары мутаций на поверхности раздела CH3-CH3, которые делают гомодимеризацию Fc электростатически неблагоприятной, но делают электростатически выгодной гетеродимеризацию Fc. См., например, таблицы 2a и 2b в WO 2009/089004).
[0082] Несколько антителоподобных белков с codv (двойной вариабельной областью в ориентации крест-накрест) описаны в публикации steinmetz et al. (2016) mabs, 8 (5): 867-878, международных заявках wo 2012/135345, wo2016/116626 и патентах сша № 9181349, 9221917, содержание каждой из которых в полном объеме включено здесь посредством ссылки. Строение codv приводит к образованию циклической замкнутой структуры, функционирующей как независимая форма, которая сохраняет аффинность родительских антител к обоим антигенам. Антителоподобный белок codv может быть (а) двухвалентным и/или биспецифическим; (b) трехвалентныи и/или триспецифическим; (с) трехвалентным и/или биспецифическим; или (d) четырехвалентным и/или биспецифическим. В одном примерном формате полипептид содержит две полипептидные цепи, имеющие структуру, представленную формулой: VL1-L1-VL2-L2-CL, и две полипептидные цепи имеют структуру, представленную формулой: VH2-L3-VH1-L4-CH1-Fc, где VL1 представляет первый вариабельный домен легкой цепи иммуноглобулина; VL2 представляет второй вариабельный домен легкой цепи иммуноглобулина; VH1 представляет первый вариабельный домен тяжелой цепи иммуноглобулина; VH2 представляет второй вариабельный домен тяжелой цепи иммуноглобулина; CL представляет константный домен легкой цепи иммуноглобулина; CH1 представляет константный домен тяжелой цепи иммуноглобулина CH1; Fc включает шарнирную область иммуноглобулина и константные домены тяжелой цепи иммуноглобулина СН2, СН3; L1, L2, L3 и L4 представляют аминокислотные линкеры; и где полипептиды формулы I и полипептиды формулы II образуют пару легкая цепь-тяжелая цепь в ориентации крест-накрест. В еще одном примерном формате полипептид содержит две полипептидные цепи, которые образуют два антигенсвязывающих участка, где первый полипептид имеет структуру, представленную формулой: VL1-L1-VL2-L2-CL-Fc, и вторая полипептидная цепь имеет структуру представленную формулой: VH2-L3-VHI-L4-CH1-Fc, где: VLI представляет первый вариабельный домен легкой цепи иммуноглобулина; VL2 представляет второй вариабельный домен легкой цепи иммуноглобулина; VH1 представляет первый вариабельный домен тяжелой цепи иммуноглобулина; VH2 представляет второй вариабельный домен тяжелой цепи иммуноглобулина; CL представляет константный домен легкой цепи иммуноглобулина; CH1 представляет константный домен тяжелой цепи иммуноглобулина CH1; СН2 представляет константный домен тяжелой цепи иммуноглобулина СН2; СН3 представляет константный домен тяжелой цепи иммуноглобулина СН3; Fc включает шарнирную область иммуноглобулина и константные домены тяжелых цепей иммуноглобулина СН2, СН3; и L1, L2, L3 и L4 представляют аминокислотные линкеры; где первый и второй полипептиды образуют пару легкая цепь-тяжелая цепь в ориентации крест-накрест. В третьем примерном формате полипептид содержит три полипептидные цепи, которые образуют два антигенсвязывающих участка, где первая полипептидная цепь имеет структуру, представленную формулой: VL1-L1-VL2-L2-CL, вторая полипептидная цепь имеет структуру, представленную формулой VH2-L3-VHI-L4-CH1-Fc, третья полипептидная цепь содержит Fc-область антитела, где: VL1 представляет первый вариабельный домен легкой цепи иммуноглобулина; VL2 представляет второй вариабельный домен легкой цепи иммуноглобулина; VH1 представляет первый вариабельный домен тяжелой цепи иммуноглобулина; VH2 представляет второй вариабельный домен тяжелой цепи иммуноглобулина; CL представляет константный домен легкой цепи иммуноглобулина; CH1 представляет константный домен тяжелой цепи иммуноглобулина CH1; СН2 представляет константный домен тяжелой цепи иммуноглобулина СН2; СН3 представляет константный домен тяжелой цепи иммуноглобулина СН3; Fc включает шарнирную область иммуноглобулина и константные домены тяжелой цепи иммуноглобулина СН2, СН3; и L1, L2, L3 и L4 представляют аминокислотные линкеры; где первый и второй полипептиды образуют пару легкая цепь-тяжелая цепь в ориентации крест-накрест. в четвертом примерном формате полипептид содержит первую полипептидную цепь, содержащую структуру, представленную формулой: VL1-L1-VL2-L2-CL, и вторую полипептидную цепь, содержащую структуру, представленную формулой: VH2-L3-VH1-L4-CH1, где: VL1 представляет первый вариабельный домен легкой цепи иммуноглобулина; VL2 представляет второй вариабельный домен легкой цепи иммуноглобулина; VH1 представляет первый вариабельный домен тяжелой цепи иммуноглобулина; VH2 представляет второй вариабельный домен тяжелой цепи иммуноглобулина; CL представляет константный домен легкой цепи иммуноглобулина; СН1 представляет константный домен тяжелой цепи иммуноглобулина СН1; и L1, L2, L3 и L4 представляют аминокислотные линкеры; где полипептид формулы i и полипептид формулы II образуют пару легкая цепь-тяжелая цепь в ориентации крест-накрест.
[0083] Биспецифический четырехвалентный иммуноглобулин, известный как четырехвалентный биспецифический тандемный иммуноглобулин (TBTI) или иммуноглобулин с двойными вариабельными доменами (DVD-Ig), был впервые описан в публикации Wu et al. (2007) Nat. Biotechnol., 25: 1290-7. Как и обычный IgG, TBTI-DVD-Ig содержит две тяжелые цепи и две легкие цепи. Однако как тяжелая, так и легкая цепи TBTI-DVD-Ig содержат дополнительный вариабельный домен, связанный через гибкую встречающуюся в природе линкерную последовательность на N-концах VH и VL существующего моноклонального антитела. Следовательно, когда тяжелая и легкая цепи объединяются, то полученный TBTI-DVD-Ig содержит четыре сайта распознавания антигена. См. также патенты США № 9029508; 9109026; 9035027; 9046513, 8388965; 9732162; 9738728; Европейский патент № 2573121 B1, а также международную заявку WO2012/135345, содержание каждого из которых в полном объеме включено здесь посредством ссылки.
[0084] В заявке на патент США 2017/00320967 и международной заявке WO 2017/180913, содержание которых в полном объеме точно включено здесь посредством ссылки, описан связывающий белок (такой как трехвалентное и/или триспецифическое антитело), содержащий четыре полипептидные цепи, которые образуют три антигенсвязывающих участка. В некоторых вариантах осуществления связывающий белок является трехвалентным. В некоторых вариантах осуществления связывающий белок является триспецифическим. В одном примерном формате первая полипептидная цепь содержит структуру, представленную формулой: VL2-L1-VL1-L2-CL; вторая полипептидная цепь содержит структуру, представленную формулой: VH1-L3-VH2-L4-CH1-шарнирная область-CH2-CH3; третья полипептидная цепь содержит структуру, представленную формулой: VH3-CH1-шарнирная область-CH2-CH3; четвертая полипептидная цепь содержит структуру, представленную формулой: VL3-CL, где VL1 представляет первый вариабельный домен легкой цепи иммуноглобулина; VL2 представляет второй вариабельный домен легкой цепи иммуноглобулина; VL3 представляет третий вариабельный домен легкой цепи иммуноглобулина; VH1 представляет первый вариабельный домен тяжелой цепи иммуноглобулина; VH2 представляет второй вариабельный домен тяжелой цепи иммуноглобулина, VH3 представляет третий вариабельный домен тяжелой цепи иммуноглобулина; CL представляет константный домен легкой цепи иммуноглобулина; СН1 представляет константный домен тяжелой цепи иммуноглобулина СН1; и L1, L2, L3 и L4 представляют аминокислотные линкеры; где первый и второй полипептиды образуют пару легкая цепь-тяжелая цепь в ориентации крест-накрест; и где вторая полипептидная цепь или третья полипептидная цепь содержит аминокислотную последовательность TTPPVLDSDGSFFLVSK (SEQ ID NO: 7), DGSFFLVSKLTV (SEQ ID NO: 8) или GSFFLVSKLTVD (SEQ ID NO: 9).
[0085] В некоторых вариантах осуществления длина линкеров L1, L2, L3 и L4 колеблется от отсутствия аминокислот (длина=0) до длины примерно 100 аминокислот или длины менее чем 100, 50, 40, 30, 20 или 15 аминокислот или меньше. Линкеры также могут иметь длину из 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 аминокислоты. L1, L2, L3 и L4 в одном связывающем белке могут иметь одинаковую аминокислотную последовательность или могут иметь разные аминокислотные последовательности.
[0086] Примеры подходящих линкеров включают один остаток глицина (Gly); диглициновый пептид (Gly-Gly); трипептид (Gly-Gly-Gly); пептид с четырьмя остатками глицина (Gly-Gly-Gly-Gly; SEQ ID NO: 21); пептид с пятью остатками глицина (Gly-Gly-Gly-Gly-Gly; SEQ ID NO: 22); пептид с шестью остатками глицина (Gly-Gly-Gly-Gly-Gly-Gly; SEQ ID NO: 23); пептид с семью остатками глицина (Gly-Gly-Gly-Gly-Gly-Gly-Gly; SEQ ID NO: 24); пептид с восемью остатками глицина (Gly-Gly-Gly-Gly-Gly-Gly-Gly-Gly; SEQ ID NO: 25). Можно использовать другие комбинации аминокислотных остатков, такие как пептид Gly-Gly-Gly-Gly-Ser (SEQ ID NO: 26), пептид Gly-Gly-Gly-Gly-Ser-Gly-Gly-Gly-Gly-Ser (SEQ ID NO: 27) и пептид Gly-Gly-Gly-Gly-Ser-Gly-Gly-Gly-Gly-Ser-Gly-Gly-Gly-Gly-Ser (SEQ ID NO: 28). Другие подходящие линкеры включают один остаток Ser и остаток Val; дипептид Arg-Thr, Gln-Pro, Ser-Ser, Thr-Lys и Ser-Leu; Thr-Lys-Gly-Pro-Ser (SEQ ID NO: 29), Thr-Val-Ala-Ala-Pro (SEQ ID NO: 30), Gln-Pro-Lys-Ala-Ala (SEQ ID NO: 39) Gln-Arg-Ile-Glu-Gly (SEQ ID NO: 31); Ala-Ser-Thr-Lys-Gly-Pro-Ser (SEQ ID NO: 37), Arg-Thr-Val-Ala-Ala-Pro-Ser (SEQ ID NO: 32), Gly-Gln-Pro-Lys- Ala-Ala-Pro (SEQ ID NO: 33) и His-Ile-Asp-Ser-Pro-Asn-Lys (SEQ ID NO: 34). Приведенные выше примеры никоим образом не предназначены для ограничения объема изобретения, и было показано, что линкеры, содержащие произвольно выбранные аминокислоты, выбранные из группы, состоящей из валина, лейцина, изолейцина, серина, треонина, лизина, аргинина, гистидина, аспартата, глутамата, аспарагина, глутамина, глицина и пролина, являются подходящими для связывающих белков.
[0087] Индивидуальный состав и последовательность аминокислотных остатков в линкере могут варьироваться в зависимости от типа вторичного структурного элемента, необходимого для получения в линкере. Например, глицин, серин и аланин являются лучшими для линкеров, обладающих максимальной гибкостью. Некоторая комбинация глицина, пролина, треонина и серина пригодна, если необходим более жесткий и удлиненный линкер. Любой аминокислотный остаток может рассматриваться в качестве линкера в комбинации с другими аминокислотными остатками для конструирования более крупных пептидных линкеров, которые требуются в зависимости от получения желаемых свойств.
[0088] В некоторых вариантах осуществления длина L1 по меньшей мере в два раза больше длины L3. В некоторых вариантах осуществления длина L2 по меньшей мере в два раза больше длины L4. В некоторых вариантах осуществления длина L1 по меньшей мере в два раза больше длины L3, и длина L2 по меньшей мере в два раза больше длины L4. В некоторых вариантах осуществления L1 имеет длину от 3 до 12 аминокислотных остатков, L2 имеет длину от 3 до 14 аминокислотных остатков, L3 имеет длину от 1 до 8 аминокислотных остатков, и L4 имеет длину от 1 до 3 аминокислотных остатков. В некоторых вариантах осуществления L1 имеет длину от 5 до 10 аминокислотных остатков, L2 имеет длину от 5 до 8 аминокислотных остатков, L3 имеет длину от 1 до 5 аминокислотных остатков, и L4 имеет длину от 1 до 2 аминокислотных остатков. В некоторых вариантах осуществления L1 имеет длину из 7 аминокислотных остатков, L2 имеет длину из 5 аминокислотных остатков, L3 имеет длину из 1 аминокислотного остатка, и L4 имеет длину из 2 аминокислотных остатков.
[0089] В некоторых вариантах осуществления L1, L2, L3 и/или L4 содержат последовательность Asp-Lys-Thr-His-Thr (SEQ ID NO: 35). В некоторых вариантах осуществления L1 содержит последовательность Asp-Lys-Thr-His-Thr (SEQ ID NO: 35). В некоторых вариантах осуществления L3 содержит последовательность Asp-Lys-Thr-His-Thr (SEQ ID NO: 35).
[0090] В некоторых вариантах осуществления L1, L2, L3 и/или L4 содержат последовательность Gly-Gln-Pro-Lys-Ala-Ala-Pro (SEQ ID NO: 33). В некоторых вариантах осуществления L1 содержит последовательность Gly-Gln-Pro-Lys-Ala-Ala-Pro (SEQ ID NO: 33). В некоторых вариантах осуществления L1 содержит последовательность Gly-Gln-Pro-Lys-Ala-Ala-Pro (SEQ ID NO: 33), L2 включает последовательность Thr-Lys-Gly-Pro-Ser-Arg (SEQ ID NO: 36), L3 содержит последовательность Ser, и L4 содержит последовательность Arg-Thr. В некоторых вариантах осуществления L3 содержит последовательность Gly-Gln-Pro-Lys-Ala-Ala-Pro (SEQ ID NO: 33). В некоторых вариантах осуществления L1 содержит последовательность Ser, L2 содержит последовательность Arg-Thr, L3 содержит последовательность Gly-Gln-Pro-Lys-Ala-Ala-Pro (SEQ ID NO: 33) и L4 содержит последовательность Thr-Lys-Gly-Pro-Ser-Arg (SEQ ID NO: 36).
[0091] В некоторых вариантах осуществления первый полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO: 12; второй полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO: 13; третий полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO: 14, и четвертый полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO: 15 (SEQ ID NO: 12, 13, 14 и 15 соответствуют SEQ ID NO: 3, 4, 1 и 2, раскрытым в WO международной заявке 2017/074878 соответственно.) Аминокислотные последовательности дополнительных типичных триспецифических антител описаны в международной заявке WO 2017/074878, содержание которой в полном объеме включено здесь посредством ссылки.
[0092] Платформа домена, сконструированного путем обмена цепей (SEED), предназначенная для получения асимметричных и биспецифических антителоподобных молекул, основана на обмене структурно родственными последовательностями иммуноглобулина в консервативных доменах СН3. Чередующиеся последовательности из человеческих IgA и IgG в доменах SEED CH3 образуют два асимметричных, но комплементарных домена, обозначенных AG и GA. Конструкция SEED позволяет эффективно генерировать гетеродимеры AG/GA и препятствует образованию гомодимеров AG/AG и GA/GA. Смотри, например, публикацию Muda et al. (2011) Prot. Engineering, Design & Selection. 24(5): 447-454 и патент США № 8871912, содержание которых в полном объеме включено здесь посредством ссылки.
[0093] Другие форматы биспецифических и мультиспецифических антител описаны Klein et al., (2012) mAbs 4:6, 653-663; Spiess et al. (2015) «Alternative molecular formats and therapeutic applications for bispecific antibodies», Mol. Immunol., 67(2 Pt A): 95-106; Egan et al. (2017) mAbs, 9(1):68-84; Liu et al. (2017) Front Immunol., 8: 38; и Weidle et al. (2013) Cancer Genomics Proteomics, 10(1): 1-18.
Антигены-мишени
[0094] В некоторых вариантах осуществления полипептид, подлежащий количественному определению в соответствии со способом, обеспеченным здесь (т. е. полипептид, содержащий участок константной области тяжелой цепи антитела, который содержит сконструированную мутацию), специфически связывается с антигеном-мишенью. Типичные антигены-мишени включают, без ограничения, A2AR, APRIL, ATPDазу, BAFF, BAFFR, BCMA, BlyS, BTK, BTLA, B7DC, B7H1, B7H4 (также известный как VTCN1), B7H5, B7H6, B7H7, B7RP1, B7-4, C3, C5, CCL2 (также известный как MCP-1), CCL3 (также известный как MIP-1a), CCL4 (также известный как MIP-1b), CCL5 (также известный как RANTES), CCL7 (также известный как MCP-3), CCL8 (также известный как mcp-2), CCL11 (также известный как эотаксин), CCL15 (также известный как MIP-1d), CCL17 (также известный как TARC), CCL19 (также известный как MIP-3b), CCL20 (также известный как MIP-3a), CCL21 (также известный как MIP-2), CCL24 (также известный как MPIF-2/эотаксин-2), CCL25 (также известный как TECK), CCL26 (также известный как эотаксин-3), CCR3, CCR4, CD3, CD19, CD20, CD23 (также известный как FCER2, рецептор для IgE), CD24, CD27, CD28, CD38, CD39, CD40, CD70, CD80 (также известный как B7-1), CD86 (также известный как B7-2), CD122, CD137 (также известный как 41BB), CD137L, CD152 (также известный как CTLA4), CD154 (также известный как CD40L), CD160, CD272, CD273 (также известный как PDL2), CD274 (также известный как PDL1), CD275 (также известный как B7H2), CD276 (также известный как B7H3), CD278 (также известный как ICOS), CD279 (также известный как PD-1), CDH1 (также известный как E-кадгерин), хитиназу, CLEC9, CLEC91, CRTH2, CSF-1 (также известный как M-CSF), CSF-2 (также известный как GM-CSF), CSF-3 (также известный как GCSF), CX3CL1 (также известный как SCYD1), CXCL12 (также известный как SDF1), CXCL13, CXCR3, DNGR-1, эктонуклеозидтрифосфатдифосфогидролазу 1, EGFR, ENTPD1, FCER1A, FCER1, FLAP, FOLH1, Gi24, GITR, GITRL, GM-CSF, Her2, HHLA2, HMGB1, HVEM, ICOSLG, IDO, IFNα, IgE, IGF1R, IL2Rbeta, IL1, IL1A, IL1B, IL1F10, IL2, IL4, IL4Ra, IL5, IL5R, IL6, IL7, IL7Ra, IL8, IL9, IL9R, IL10, rhIL10, IL12, IL13, IL13Ra1, IL13Ra2, IL15, IL17, IL17Rb (также известный как рецептор для IL25), IL18, IL22, IL23, IL25, IL27, IL33, IL35, ITGB4 (также известный как интегрин-b4), ITK, KIR, LAG3, LAMP1, лептин, LPFS2, MHC класса II, NCR3LG1, NKG2D, NTPDазу-1, OX40, OX40L, PD-1H, рецептор тромбоцитов, PROM1, S152, SISP1, SLC, SPG64, ST2 (также известный как рецептор для IL33), STEAP2, киназу Syk, TACI, TDO, T14, TIGIT, TIM3, TLR, TLR2, TLR4, TLR5, TLR9, TMEF1, TNFa, TNFRSF7, Tp55, TREM1, TSLP (также известный как корецептор для IL7Ra), TSLPR, TWEAK, VEGF, VISTA, Vstm3, WUCAM и XCR1 (также известный как GPR5/CCXCR1). В некоторых вариантах осуществления один или более из вышеуказанных антигенов-мишеней являются антигенами-мишенями человека. В вариантах осуществления, в которых полипептид, содержащий константную область тяжелой цепи антитела, которая содержит сконструированную мутацию, представляет собой биспецифический или мультиспецифический белок, связывающий мишень, где антигены-мишени могут быть любыми двумя (или более) из примерных антигенов, приведенных выше.
Конъюгаты
[0095] В некоторых вариантах осуществления полипептид, подлежащий количественномй определению в соответствии со способом, обеспеченным здесь (т. е. полипептид, содержащий константную область тяжелой цепи антитела, которая включает сконструированную мутацию), конъюгирован с лекарственным средством, например цитотоксическим агентом, химиотерапевтическим средством, агентом, ингибирующим рост, токсином (например, ферментативно активным токсином бактериального, грибкового, растительного или животного происхождения или его фрагментом). Примеры лекарственных средств включают, без ограничения, дауномицин, доксорубицин, метотрексат, виндезин, BCNU, стрептозоцин, винкристин и 5-фторурацил. Типичные токсины включают, без ограничения, А-цепь дифтерийного токсина, несвязывающие активные фрагменты дифтерийного токсина, А-цепь экзотоксина (из Pseudomonas aeruginosa), рицин, гелданамицин, майтанзин (или другие мейтанзиноиды), ауристатины, доластатин, калихеамицин, А-цепь абрина, альфа-сарцин, белки Aleurites fordii, белки диантины, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Sapaonaria officinalis, гелонин, митогеллин, рестриктин, феномицин, эномицин, трихотецены и CC1065. Цитотоксические агенты и линкеры, которые конъюгируют агенты с антителом, известны в данной области; см., например, Parslow, A.C. et al. (2016) Biomedicines, 4:14 и Kalim M. et al. (2017) Drug Des. Devel. Ther., 11: 2265-2276.
[0096] В некоторых вариантах осуществления полипептид, подлежащий количественному определению в соответствии со способом, обеспеченным здесь (т. е. полипептид, содержащий константную область тяжелой цепи антитела, которая включает сконструированную мутацию), конъюгирован с детектируемым фрагментом, который способен продуцировать прямо или опосредовано детектируемый сигнал. В некоторых вариантах осуществления детектируемая метка представляет собой радионуклид. Различные радионуклиды доступны для производства радиоконъюгированных полипептидов для применения в клинических и исследовательских целях. Примеры включают 13C, 15N, 17O, 19F, 32P, 90Y, 99mTc, 111In, 123I, 125I, 131I, 131In, 153Sm, 186Re, 188Re, 211At, 212Bi, 212Pb и радиоактивные изотопы Lu, Mn, Fe и Gd. В некоторых вариантах осуществления детектируемая метка представляет собой флуоресцентное или хемилюминесцентное соединение, такое как флуоресцеина изотиоцианат, родамин или люциферин; или фермент, такой как щелочная фосфатаза, β-галактозидаза или пероксидаза хрена.
[0097] Полагается, что вышеизложенное письменное описание является достаточным, чтобы позволить специалисту в данной области техники осуществить изобретение на практике. Следующие примеры предлагаются только для иллюстративных целей и никоим образом не предназначены для ограничения объема настоящего изобретения. Действительно, различные модификации в дополнение к тем, которые показаны и описаны в данном документе, станут очевидными для специалистов в данной области техники из вышеприведенного описания и попадут в объем прилагаемой формулы изобретения.
Примеры
Пример 1: идентификация суррогатного пептида для применения в общем масс-спектрометрическом анализе для детектирования полипептида, содержащего константную область тяжелой цепи антитела в образце
Для идентификации суррогатного пептида для детектирования терапевтического антитела в биологическом образце посредством масс-спектрометрии использовали следующие критерии отбора:
- длина от 6 до 26 аминокислот;
- отсутствие смежных сайтов расщепления эндопептидазой;
- отсутствие метионина (М) или цистеина (С) в пептидной последовательности;
- отсутствие аспарагина, за которым следует глицин или серин (т.е. NG или NS) в пептидной последовательности;
- происходит из константной области тяжелой цепи антитела; и
- наличие, по меньшей мере, одной сконструированной мутации замещения (т.е. исключая встречающиеся в природе полиморфизмы).
[0099] Сначала выравнивали последовательности Fc трех примерных терапевтических антител. См. фиг. 1. SEQ ID NO: 1 представляет собой участок тяжелой цепи антитела против мишени А. SEQ ID NO: 1 не содержит сконструированной мутации. SEQ ID NO: 2 представляет собой участок первой цепи (т. е. «цепи 1») триспецифического конструкта (т. е. «TRI-1»). TRI-1-цепь 1 содержит тяжелую цепь антитела, которая включает мутации S354C и T366W (т. е. мутации типа «выступа») и мутации M428L/N434S (которые удлиняют период полураспада TRI-1 in vivo). SEQ ID NO: 3 представляет собой участок второй цепи (т. е. «цепи 2») TR1. TRI-1-цепь 2 содержит тяжелую цепь антитела, которая включает мутации типа «впадины» Y349C/T366S/368A/407 V и мутации M428L/N434S. SEQ ID NO: 4 представляет собой участок первой цепи (т. е. «цепи 1») второго триспецифического конструкта (т. е. «TRI-2»). TRI-2-цепь 1 содержит тяжелую цепь антитела, которая включает мутации Y349C/T366S/368A/407V (т.е. мутации типа «впадины») и мутации M428L/N434S. SEQ ID NO: 5 представляет собой участок второй цепи (т. е. «цепи 2») TR2. TRI-2-цепь 2 содержит тяжелую цепь, которая включает мутации типа «выступа» S354C/T366W и мутации M428L/ N434S. Все аминокислотные положения, указанные выше, пронумерованы в соответствии с системой нумерации ЕС.
[0100] Пептиды-кандидаты, содержащие, по меньшей мере, одну сконструированную мутацию замещения, которая, как ожидалось, является результатом триптического расщепления последовательностей, показанных на фиг. 1, подчеркнуты. Пептид TTPPVLDSDGSFFLVSK (SEQ ID NO: 7) соответствовал всем критериям, перечисленным выше.
[0101] Затем проводили поиск с помощью алгоритма BLAST с использованием TTPPVLDSDGSFFLVSK (SEQ ID NO: 7), т. е. «сконструированного пептида TTPP», в качестве последовательности запроса для баз данных белков мыши, обезьяны cynomolgus и человека, чтобы определить, обнаружена ли такая последовательность в любых нативных белках у этих видов. Единственными последовательностями, демонстрирующими 100% аминокислотную идентичность со сконструированным пептидом TTPP, были известные антитела типа «выступ-во-впадине». Другие последовательности, которые демонстрировали 94% аминокислотную идентичность со сконструированным пептидом TTPP, соответствовали Fc-областям человека, содержащим мутации замещения Y407, отличные от Y407V, и эндогенным Fc-областям человека.
[0102] Эксперименты, описанные ниже, проводили для оценки осуществимости, с которой расщепление трипсином триспецифического конструкта TRI-1 приводит к получению сконструированного пептида TTPP. Вкратце, 10 мкг TRI-1 (который содержит SEQ ID NO: 2 и 3, показанные на фиг. 1) расщепляли с использованием набора для расщепления SMART™ Digest (ThermoFisher) в соответствии с инструкциями производителя. Реакцию расщепления проводили при инкубации при 70°С со встряхиванием при 1400 об/мин в течение 75 мин. Затем расщепленный образец центрифугировали при 1000× g в течение 2 мин, и супернатант собирали для очистки и концентрирования.
[0103] Необходимое количество лунок в планшете для твердофазной экстракции (SPE) SOLAµ HRP (ThermoFisher) уравновешивали 200 мкл ацетонитрила и затем кондиционировали 200 мкл 0,1% раствора трифторуксусной кислоты (ТФК) в воде. Затем в каждую лунку добавляли еще 400 мкл 0,1% раствора ТФК в воде. Образцы супернатантов добавляли в лунки и пропускали. Затем лунки промывали 500 мкл 0,1% раствора ТФК в воде и затем промывали 500 мкл 0,1% муравьиной кислоты в воде. Расщепленные образцы элюировали 2×25 мкл 80% ацетонитрила в воде с 0,1% муравьиной кислотой. Элюат разбавляли 50 мкл 0,1% муравьиной кислоты в воде и быстро перемешивали на вортексе при 400 об/мин.
[0104] 50 мкл каждого расщепленного образца анализировали жидкостной хроматографией-тандемной масс-спектрометрией с использованием хроматографической системы Waters H-Class Acquity UPLC, соединенной с масс-спектрометром Thermo QExactive, работающим в типичных условиях пептидного картирования.
[0105] Как показано на фиг. 2A-2C, расщепление трипсином TRI-1 воспроизводимо приводило к получению сконструированного пептида TTPP, и этот пептид легко подвергался детектированию и фрагментации. Хроматограмма выделенных ионов, m/z 905,40-907,60, подгруппы естественного изотопного состава сконструированного TTPP показана на фиг. 2А. Сконструированный TTPP элюируется примерно на 19 мин. На общей ионной хроматограмме (приведенной на фиг. 2B) сконструированный TTPP был большим пиком. Кроме того, сконструированный TTPP показал хорошую фрагментацию для анализа МС/МС (фиг.2C).
Пример 2: детектирование пептида TTPP в сыворотке крови
[0106] Затем проводили серию экспериментов для определения того, можно ли детектировать сконструированный пептид TTPP в сыворотке человека, обезьяны и мыши с использованием ЖХ-МС/МС без значительного негативного влияния фона. Исследовали сыворотки мыши и обезьяны cynomolgus, поскольку эти животные обычно используются в доклинических исследованиях терапевтических антител.
[0107] Вкратце, 100 мкл обработанных на вортексе магнитных шариков, покрытых белом G (Pierce) и 100 мкл PBST добавляли в лунки 96-луночного микропланшета (Qiagen). Планшет осторожно встряхивали для получения гомогенной смеси. 96-луночный планшет помещали в магнитный штатив на 96 лунок Alpaqua 96S Super Magnet на одну минуту, затем в магнитный штатив на 96 лунок Qiagen Type A на одну минуту и затем раствор удаляли. Такой цикл промывания повторяли еще три раза с 200 мкл PBST. После завершения промывания в каждую лунку, содержащую шарики, добавляли 140 мкл PBST. Затем в лунки добавляли 30 мкл (1) мышиной сыворотки, (2) обезьяньей сыворотки, (3) человеческой сыворотки или (4) 2 мкг/мл TRI-1. 30 мкл калибраторов, QC и образцов добавляли в отдельные лунки, содержащие шарики, PBST и сыворотки. Затем 96-луночный планшет накрывали и встряхивали в течение 1 ч при 600 об/мин и промывали четыре раза. Калибраторы, QC и образцы элюировали добавлением 90 мкл 0,1% раствора ТФК в каждую лунку и осторожной обработкой планшета на вортексе для получения гомогенной смеси. Планшет помещали в магнитный штатив на 96 лунок Alpaqua 96S Super Magnet на одну минуту, затем в магнитный штатив на 96 лунок Qiagen Type A на одну минуту. Затем элюат переносили в 96-глубоколуночный планшет Protein LoBind (Eppendorf). Затем процедуру элюирования повторяли. pH элюата нейтрализовали 20 мкл 1 М трис-HCl pH 8, доводя общий объем до 200 мкл. Вкратце, 200 мкл буфера для расщепления со SMART добавляли к каждому из элюатов. Образцы инкубировали при 70°С со встряхиванием при 400 об/мин в течение 75 мин, и затем центрифугировали при 1000 × g в течение 2 мин для осаждения перевара на смоле SMART.
[0108] Лунки в планшете SOLAµ HRP SPE уравновешивали 200 мкл ацетонитрила и затем кондиционировали 200 мкл 0,1% раствора ТФК в воде. В каждую лунку добавляли еще 400 мкл 0,1% раствора ТФК в воде. Супернатант каждого образца добавляли в отдельную лунку и пропускали. Лунки промывали 500 мкл 0,1% раствора ТФК в воде и затем 500 мкл 0,1% муравьиной кислоты в воде. Расщепленные образцы элюировали 2×25 мкл 80% ацетонитрила в воде с 0,1% муравьиной кислотой. Элюат разбавляли 50 мкл 0,1% муравьиной кислоты в воде и быстро перемешивали на вортексе при 400 об/мин.
[0109] Расщепленные образцы на SMART анализировали с использованием хроматографической системы Waters H-Class UPLC и масс-спектрометра Thermo QExactive в стандартных условиях, используемых для пептидного картирования.
[0110] Хроматограммы выделенных ионов сконструированного пептида TTPP (m/z 905,472+) в чистой контрольной сыворотке приведены на фиг. 3A-3C, и хроматограмма выделенных ионов сконструированного пептида TTPP в переваре TRI-1 (2 мкг/мл в PBST) приведена на фиг. 3D. Пик на 20,65 мин в переваре TRI-1 отсутствует во всех тестированных контрольных сыворотках.
[0111] Для подтверждения того, что сконструированный пептид TTPP можно детектировать на фоне чистой контрольной сыворотки, в образцы мышиной, обезьяньей и человеческой сыворотки вносили 20 мкг/мл TRI-1 и анализировали истощением, расщеплением и масс-спектрометрией антител, как описано выше.
[0112] Хроматограммы выделенных ионов сконструированного пептида TTPP (m/z 905,472+) приведены на фиг. 4A-4C и перевара TRI-1 в PBST приведены на фиг. 4D. При добавлении TRI-1 в каждую из контрольных сывороток сконструированный пептид TTPP отчетливо виден на фоне всех сывороток.
[0113] Готовили серийные разведения TRI-1 в соответствующей контрольной сыворотке до конечных концентраций 0,2, 2 и 20 мкг/мл для определения того, увеличивался ли сигнал пропорционально количеству аналита в образце. Аликвоты сыворотки без добавления антител использовали в качестве фоновых контролей. Истощение, расщепление, очистку SPE и анализ ЖХ-МС/МС проводили, как описано выше.
[0114] Хроматограммы выделенных ионов сконструированного пептида TTPP, немеченого FNWY и FNWY (тяжелая цепь), полученного из анализа трех тестированных концентраций TRI-1 (20, 2 и 0,2 мкг/мл) в PBST, приведены на фиг. 5А-5С, 6А-6С и 7А-7С соответственно. Хроматограммы выделенных ионов сконструированного TTPP, немеченого FNWY и FNWY (тяжелая цепь), полученного из анализа четырех тестированных концентраций TRI-1 (20, 2, 0,2 и 0 мкг/мл) в мышиной сыворотке, приведены на фиг. 8А-8С, 9А-9С и 10А-10С соответственно. Хроматограммы выделенных ионов сконструированного TTPP, немеченого FNWY и FNWY (тяжелая цепь), полученного из анализа четырех тестированных концентраций TRI-1 (20, 2, 0,2 и 0 мкг/мл) в обезьяньей сыворотке, приведены на фиг. 11А-11С, 12А-12С и 13А-13С соответственно. Хроматограммы выделенных ионов сконструированного TTPP, полученные из анализа четырех тестированных концентраций TRI-1 (20, 2, 0,2 и 0 мкг/мл) в человеческой сыворотке, приведены на фиг.14A-14C.
[0115] Определяли площади пиков сконструированного пептида TTPP и пептида тяжелой цепи FNWYVDGVEVHNAK (SEQ ID NO: 10). См. таблицу 2 ниже. FNWY (тяжелая цепь) является внутренним стандартом, полученным в результате расщепления меченного стабильным изотопом универсального моноклонального антитела (SILU™ MAB).
Обобщенные результаты количественного анализа
(мкг/мл)
(легкая цепь-немеченный)
(сконструированный TTPP:FNWY(тяжелая цепь))
(FNWY: FNWY(тяжелая цепь))
[01116] Соотношения площадей сконструированного TTPP к FNWY (тяжелая цепь) на фоне PBST, мышиной сыворотки и сыворотки обезьяны также приведены в таблице 2, и график зависимости от входной концентрации TRI-1 приведен на фиг. 15A-D. Соотношение площадей сконструированного FNWY к FNWY (тяжелая цепь) для PBST показано в таблице 2, и график зависимости от входной концентрации антитела приведен на фиг. 15А, 15С и 15D.
[0117] Вышеприведенные данные показывают, что негативное влияние фона на детектирование пептида TTPP в мышиной сыворотке, обезьяньей сыворотке или человеческой сыворотке практически отсутствует, и что сигнал, генерируемый пептидом TTPP, коррелирует с количеством пептида в образце.
Аминокислотные последовательности в примерах 1 и 2
Пример 3: применение суррогатного пептида TTPP в общем масс-спектрометрическом анализе для детектирования и количественного определения типичного триспецифического антитела
Обзор
[0118] Терапевтические антитела являются привлекательными инструментами для борьбы с болезнями, и их рынок растет быстрыми темпами. Анализы связывания лигандов были стандартными методами измерения количества терапевтических антител. Однако для обеспечения их развития, необходимы новые биоаналитические стратегии. ЖХ-МС/МС представляет собой дополнительный метод, обеспечивающий специфичность и более высокую воспроизводимость, которые необходимы для исследований, проводимых согласно требованиям Надлежащей лабораторной практики (GLP). Кроме того, при использовании ЖХ-МС/МС преодолеваются некоторые ограничения, связанные с анализами связывания лигандов (LBA), такие как негативное влияние матрикса (например, компонентов в образце, которые могут мешать точному количественному определению терапевтического антитела), и необходимость в разработке реагентов, которая может быть весьма дорогостоящей и трудоемкой.
[0119] IgG представляют большую часть терапевтических белков, которые используются в настоящее время в клиниках. Для снижения иммуногенности, терапевтические антитела конструируют таким образом, чтобы они содержали константную область антитела человека, такую как константные области человеческого IgG. Разработка биоаналитического анализа на основе ЖХ-МС для количественного определения таких терапевтических антител представляла сложную задачу, поскольку трудно выбрать подходящие суррогатные пептиды, которые можно использовать для различения эндогенных человеческих IgG в образце (например, в плазме, сыворотке или образце крови) и терапевтического IgG антитела без стадии иммуноаффинной хроматографии. Для преодоления этой проблемы, константную область типичного терапевтического антитела конструировали таким образом, чтобы она содержала мутацию замещения, например, мутацию замещения, которая отсутствует в природе в константных областях антитела человека, или константных областях антитела приматов, отличных от человека, или животных, используемых в доклинических исследованиях (например, мыши). Такой оригинальный прием позволяет точно определить количество терапевтического антитела в образцах, отличных от образцов человека, и в образцах человека, без отрицательного влияния матрикса.
[0120] Ниже описан анализ на основе ЖХ-МС/МС без аффинной экстракции для быстрого и точного количественного определения трехвалентного триспецифического антитела на фоне растворимой мишени в плазме. Избегая иммуноаффинную стадии, этот способ позволяет точно определить общее количество лекарственного средства (сумма лекарственного средства, связанного с мишенью, плюс свободное лекарственное средство). Кроме того, поскольку мутация замещения находится в константной области антитела, то данный способ можно использовать для количественной оценки любого терапевтического белка, который содержит константную область антитела.
Аналитическая процедура
[0121] Суррогатные пептиды, которые были отобраны для количественного определения примерного триспецифического антитела с помощью ЖХ-МС/МС, показаны на фиг. 16 и 17 и в таблице 4 ниже. Эти суррогатные пептиды были отобраны на основе их линейного отклика. Использовали пептиды, последовательности которых не обнаружены в человеческих белках или в белках приматов, отличных от человека (т. е. SEQ ID NO: 7, 16 и 38). Для абсолютного количественного определения использовали сконструированный пептид TTPPVLDSDGSFFLVSK (SEQ ID NO: 7) (см. фиг.16 и 17 и таблицу 4 ниже). Для гарантии целостности аналита в образцах контролировали соотношения площадей под пиками TTPPVLDSDGSFFLVSK (SEQ ID NO: 7) и других пептидов, приведенных в таблице 4, которые подвергали количественному анализу на основе ЖХ-МС/МС. Соотношения оставались постоянными на всех временных точках (результаты не показаны).
Перечень суррогатных пептидов и параметры МС для их детектирования
(SEQ ID NO: 7)
Ион-продукт m/z 804,5
(SEQ ID NO 18)
Ион-продукт m/z 506,3
(SEQ ID NO: 16)
Ион-продукт m/z 1036,6
(SEQ ID NO: 17)
Ион-продукт m/z 811,0
(SEQ ID NO: 38)
Ион-продукт m/z 738,4
[0122] Вариант меченного стабильным изотопом TTPPVLDSDGSFFLVSK (SEQ ID NO: 7) использовали в качестве внутреннего стандарта (фиг.19B).
[0123] В целях применения в доклинических исследованиях была разработана быстрая и надежная рабочая процедура (см. фиг. 18). Способ основан на протоколе расщепления гранул, описанном в публикации Ouyang et al. (2012) Bioanalysis., 4(1), 17-28. Каждую стадию в протоколе расщепления оптимизировали для максимального извлечения триспецифических антител из образца и детектирования суррогатных пептидов (рабочая процедура для образца от человека-субъекта включала стадию иммуноочистки с белком А до стадии денатурации).
[0124] В способе используется только 10 мкл образца плазмы. Поскольку небольшого объема образца было достаточно, то способ количественного определения суррогатного пептида подходит для анализа образцов от животных в доклинических исследованиях, например, от грызунов. Стандартное время расщепления также было оптимизировано. Наиболее высокую интенсивность сигнала наблюдали, когда образец расщепляли в течение двух часов при 37°С. Для дальнейшего повышения чувствительности способа количественного анализа образцы подвергали твердофазной экстракции (SPE). Наилучшее восстановление получали при использовании картриджей OASIS MCX.
Валидация для плазмы крови крыс
[0125] Валидацию способа проводили на плазме крови крыс для его возможного применения в токсикологическом исследовании согласно требованиям GLP. Была выбрана модель квадратичной регрессии со средним коэффициентом регрессии 0,979 для трех независимых калибровочных кривых с тремя повторностями для анализа и 8 номинальными концентрациями (фиг. 19A). Вариабельность анализа оценивали измерением точности и прецизионности образцов контроля качества (QC) при LLOQ (нижний предел количественного определения), LOW, MID и HIGH трех независимых приготовлений. Значения точности и прецизионности в одном анализе/между анализами обобщены в таблице 5. Оценку негативного матричного эффекта проводили с использованием шести различных партий плазмы (см. таблицу 6 ниже). Стабильность антитела в плазме оценивали в плазме человека с внесением аналита, хранившейся в течение 1-3 и 6 месяцев при -80°С и при 37°С в течение 24 ч. В течение этих временных интервалов деградацию не наблюдали.
Точность и прецизионность в одном анализе и между анализами трех независимых образцов при LLOQ, LOW, MID и HIGH
(мкг/мл)
(мкг/мл)
2,5 (n=18)
7,5 (n=18)
750 (n=18)
7,500 (n=18)
Матричный эффект на шести независимых партиях плазмы крови крысы
(самец)
[0126] Проводили дополнительные эксперименты для определения того, можно ли детектировать триспецифическое антитело на уровне 5 мкг/мл с использованием суррогатного пептида TTPP (SEQ ID NO: 7) при внесении в плазму обезьяны и плазму человека. Как показано на фиг. 22A-22F, пептид TTPP детектировали в плазме крыс с добавленным аналитом (фиг. 22B), в плазме обезьян с добавленным аналитом (фиг. 22D) и плазме человека с добавленным аналитом (фиг. 22F), но не в чистой контрольной плазме крыс (фиг. 22A), чистой контрольной плазме обезьяны (фиг. 22C) или чистой контрольной плазме человека (фиг. 22E).
[0127] Как обсуждалось в других разделах в данном документе, анализы связывания лигандов (LBA), такие как ELISA, традиционно использовались для детектирования и количественного определения терапевтических белков (например, моноклональных антител) в биологических образцах. Количественное определение моноклонального антитела с помощью LBA обычно включает использование антигена-мишени в качестве агента захвата или агента детектирования. Однако LBA могут давать неточные результаты, если используются для детектирования триспецифического антитела и растворимой мишени триспецифического антитела. Для количественного определения триспецифического антитела с помощью LBA требуется разработка трех различных анализов (т. е. один анализ на каждый антиген-мишень), что приводит к получению трех наборов данных с различной концентрацией, которые невозможно контролировать в доклинических исследованиях или исследовании ФК у человека. Кроме того, было бы трудно различить количество свободного антитела и антитела, связанного с мишенью, против общего количества антитела в образце с использованием LBA. В этом примере было показано, что общий анализ ЖХ-МС, который можно использовать как в доклинической, так и в клинической фазе испытаний, способен с высокой точностью измерять содержание триспецифического антитела на фоне растворимой мишени. Было показано, что анализ является специфическим, что демонстрируется отсутствием мешающих сигналов в чистых образцах плазмы (см. фиг. 20A-20F). Также было показано, что этот анализ является воспроизводимым, как показано в таблице 5, оценкой разницы в % точности и прецизионности % между анализами и в одном анализе, соответствующих критериям приемлемости в международных нормативных документах, определенных в соответствии с указаниями FDA и EMA по валидации биоаналитического метода (т. е. точность в % более ±20% и прецизионность в % не более ±20%).
Материалы и методы для видов, используемых в доклинических исследованиях
[0128] Триспецифическое антитело обеспечивали в виде стокового раствора с номинальной концентрацией 25 мг/мл в буфере из 10 мМ гистидина, 8% сахарозы, 0,04% полисорбата 80, рН 6,0. Стандарт для калибровки и QC получали разбавлением стокового раствора в плазме крысы.
[0129] Расщепление осадков после центрифугирования крысиной плазмы, содержащей триспецифические антитела, проводили оптимизированным вариантом методики, описанной ранее в публикации Ouyang et al. (2012) Bioanalysis., 4(1), 17-28. Вкратце, 10 мкл каждого образца крысиной плазмы, содержащего триспецифическое антитело, помещали в пробирки LoBind емкостью 1,5 мл и смешивали с равным объемом буфера PBS при pH 7,4. Белки плазмы и терапевтическое антитело в каждом образце осаждали добавлением в пробирки 30 мкл метанола. После перемешивания на вортексе образцы центрифугировали в течение 6 мин при 2000 rcf (относительная центробежная сила) при 5°C. Супернатанты отбрасывали, и белковые осадки после центрифугирования ресуспендировали в 40 мкл 200 мМ аммоний-бикарбонатного буфера (ABC). 5 мкл 1 М дитиотреитола (DTT) добавляли к каждому ресуспендированному осадку и инкубировали при 56°С в течение 30 мин при осторожном перемешивании. Затем образцы охлаждали в течение 10 мин при комнатной температуре. Затем к каждому образцу добавляли 10 мкл рабочего раствора внутреннего стандарта (100 мкг/мл) и перемешивали. Затем образцы инкубировали с 10 мкл иодацетамида (IAA) (100 мМ) в 100 мМ буфере ABC в течение 30 мин при осторожном перемешивании при комнатной температуре, защищая от света. К каждому образцу добавляли 30 мкг/мл трипсина и 100 мкл буфера ABC, и затем образцы инкубировали в течение 2 ч при осторожном перемешивании при комнатной температуре.
[0130] Реакции расщепления останавливали добавлением 30 мкл 10% раствора муравьиной кислоты (FA) и центрифугировали в течение 10 мин при 16000 rcf при 5°C. Супернатанты подвергали твердофазной экстракции (SPE) с картриджами для элюирования OASIS MCX с использованием процессорного коллектора с положительным давлением. Вкратце, картриджи уравновешивали 200 мкл метанола, и затем 200 мкл 0,5% FA. 200 мкл каждого супернатанта наносили на картриджи и промывали 200 мкл 0,5% FA, 200 мкл 0,5% FA в 80% растворе МеОН и 200 мкл 0,5% FA в 20% растворе МеОН. Наконец, образцы элюировали 2-25 мкл буфера на основе гидроксида аммония 5%/метанола (40:60, об./об.). 10 мкл экстрактов разбавляли в 200 мкл воды/ муравьиной кислоты (100:0,5, об./об.). 10 мкл каждого элюированного образца использовали для анализа ЖХ-МС/МС.
[0131] Анализ ЖХ-МС/МС проводили с использованием тройного квадрупольного масс-спектрометра API 5500 SCIEX с программным обеспечением ANALYST® версии 1.6.2. Система была подключена к жидкостной хроматографической системе AGILENT 1290 INFINITY. Хроматографию проводили с использованием колонки X-Bridge Protein BEH C4; 300 Å (Waters 100×2,1 мм ID, размер частиц 3,5 мкм) при 50° и градиента растворителя A (0,1% FA) и B (0,1% FA в ацетонитриле). После уравновешивания в течение 2,5 мин растворителем А водный раствор доводили до 55% через 5 мин со скоростью потока 600 мкл/мин.
[0132] Данные МС получали в режиме положительных ионов при напряжении распыления ионов 5500 В, температуре источника 600°С и температуре десольватации 60°С. Энергию СЕ оптимизировали для каждого пептида (см. таблицу 4).
Материалы и методы для образцов человека
[0133] Аффинную очистку с использованием платформы для автоматической пробоподготовки жидких белковых образцов ASSAYMAP® BRAVO производства Agilent выполняли следующим образом: в 96-луночный планшет последовательно добавляли 90 мкл PBST и 10 мкл образца человеческой плазмы. Планшет перемешивали на вортексе в течение 5 мин и помещали в положение 4, поддерживаемое примерно при 20°С на столике ASSAYMAP® BRAVO. В 96-луночный планшет вносили 20 мкл 1М Трис-буфера, и резервуары заполняли следующими растворами, которые использовали в последовательном порядке: праймирование и уравновешивающий буфер (фосфатно-солевой буфер (PBST)), промывание картриджа 1 (1 М NaCl в PBST), промывание картриджа 2 (PBST) и буфер для элюирования и промывания шприца (1% раствор муравьиной кислоты). Затем запускали протокол аффинной очистки на платформе для автоматической пробоподготовки жидких белковых образцов ASSAYMAP® BRAVO.
[0134] Стадии денатурации, восстановления, алкилирования и расщепления выполняли следующим образом. 96-луночный планшет в положении 9 центрифугировали в течение 30 с. Последовательно добавляли 50 мкл 0,2% детергента RAPIGEST™ в 50 мМ бикарбоната аммония и 20 мкл 100 мМ DL-дитиотреитола в 100 мМ бикарбоната аммония. Затем планшет центрифугировали 30 с и инкубировали примерно при 56°С в течение 30 мин при осторожном перемешивании. Образцы охлаждали при комнатной температуре. Добавляли 20 мкл 250 мМ иодацетамида в 50 мМ бикарбоната аммония и 50 мкл ISW в 200 мМ бикарбоната аммония с 0,01% Твина 20. Планшет центрифугировали в течение 30 с и затем инкубировали в защищенных от света условиях примерно при 20°С в течение 30 мин при осторожном перемешивании. Добавляли 100 мкл свежего трипсина с концентрацией 1 мкг/мкл в 50 мМ бикарбонате аммония и образцы инкубировали при примерно 37°С в течение ночи. Затем добавляли 20 мкл 10% муравьиной кислоты в воде (для остановки расщепления).
[0135] Твердофазную экстракцию с использованием картриджа Oasis PRIME MCX µElution выполняли следующим образом: 200 мкл каждого супернатанта наносили на картридж и промывали 200 мкл 0,5% FA и 200 мкл 0,5% FA в 80% растворе MeOH. Наконец, образцы элюировали 50 мкл буфера на основе гидроксида аммония 5%/метанола (40:60, об./об.), и в элюированные образцы добавляли 150 мкл воды с 0,5% муравьиной кислоты. Картридж загружали в лоток автоматического пробоотборника при +10°С, и инъецировали 10 мкл каждого образца.
[0136] Анализ ЖХ-МС/МС проводили на образцах плазмы человека, как описано выше для доклинических образцов.
Аминокислотные последовательности в примере 3
Пример 4: подтверждение концептуальных исследований применения суррогатного пептида TTPP в общем масс-спектрометрическом анализе для детектирования и количественного определения примерного триспецифического антитела после введения мышам
Материалы и методы
[0137] Материалы, использованные в этом примере, представляли следующее: триспецифическое антитело, сыворотка (мышиную), насадки со смолой с белком G (Agilent), насадки со смолой C18 (Agilent), внутренний стандарт универсальное моноклональное антитело, меченное стабильным изотопом SILU™ MAB (Sigma), внутренний стандарт меченный сконструированный пептид тяжелой цепи (Thermo), 50 мМ бикарбоната аммония, 8 М мочевины с 550 мМ Трис-основания, рН 8, 1 М хлорида натрия в фосфатно-солевом буфере, 125 мМ дитиотреитола, 250 мМ иодацетамида, забуференный фосфатом физиологический раствор (PBS), трипсин (Promega), LysC (Promega), вода, уксусная кислота, трифторуксусная кислота (ТФК), муравьиная кислота, ацетонитрил.
Построение калибровочной кривой:
[0138] Калибровочную кривую получали серийным разведением триспецифического антитела в мышиной сыворотке. Концентрации, тестированные в этом исследовании в качестве доказательства концепции, составляли 0,012, 0,024, 0,049, 0,098, 0,195, 0,391, 0,781, 1,563, 3,125, 6,25, 12,5, 25,0, 50,0, 100,0, 200,0, 400,0 и 800 мкг/мл. В качестве нулевой точки использовали сыворотку без триспецифических антител.
Приготовление внутреннего стандарта, меченного стабильным изотопом:
[0139] В день использования 500 мкл 0,1% раствора муравьиной кислоты вносили во флакон со 100 мкг универсального моноклонального антитела, меченного стабильным изотопом SILU™ MAB (Sigma Aldrich), и оставляли при комнатной температуре в соответствии с инструкциями производителя. Концентрация антител составляла 0,2 мкг/мкл.
Приготовление внутреннего стандарта меченного сконструированного пептида тяжелой цепи:
[0140] 2,5 мл раствора из 5% ацетонитрила и 0,1% муравьиной кислоты добавляли к лиофилизированному пептиду TTPP (49 нмоль) для достижения концентрации 19,6 пмоль/мкл. В день использования концентрацию пептида TTPP разбавляли до 0,08 пмоль/мкл 40% ацетонитрилом с 0,1% муравьиной кислоты.
Высокопропускной анализ для количественного определения триспецифических антител в сыворотке с использованием платформы для автоматической пробоподготовки жидких белковых образцов (Agilent BRAVO™)
Аффинная очистка
[0141] Для каждого образца для построения калибровочной кривой или образца сыворотки, подлежащих тестированию, добавляли 10 мкл каждого образца в отдельную лунку в 96-луночном микропланшете. Затем в каждую лунку добавляли еще 10 мкл мышиной сыворотки и 30 мкл 0,2 мкг/мкл внутреннего стандарта меченного изотопом универсального моноклонального антитела. 96-луночный планшет помещали на столик платформы для автоматической пробоподготовки жидких белковых образцов (Agilent BRAVO™) и запускали протокол аффинной очистки, который включал следующие стадии:
1. Первичная промывка шприца
2. Праймирование (100 мкл PBS со скоростью 300 мкл/мин)
3. Уравновешивание (50 мкл PBS со скоростью 10 мкл/мин)
4. Загрузка образца (20 мкл со скоростью 5 мкл/мин)
5. Промывание емкости 1 (25 мкл деионизированной воды)
6. Промывание внутренней полости картриджа 1 (50 мкл 1 М NaCl в PBS при 10 мкл/мин)
7. Промывание емкости 2 (25 мкл деионизированной воды)
8. Промывание внутренней полости картриджа 2 (50 мкл PBS при 10 мкл/мин)
9. Тщательное промывание шприца (50 мкл 5% раствора уксусной кислоты)
10. Элюирование (10 мкл 5% раствора уксусной кислоты со скоростью 5 мкл/мин).
Расщепление
[0142] 96-луночный планшет, содержащий элюированные образцы, помещали на столик платформы для автоматической пробоподготовки жидких белковых образцов (Agilent BRAVO™) и выполняли протокол расщепления, который включал следующие стадии:
1. Перенос 40 мкл 8 М мочевины с 550 мМ Трис рН 8 в каждую лунку.
2. Перенос 4,3 мкл 125 мМ DTT в лунки и затем инкубирование при 40°С в течение 60 мин.
3. Перенос 4,7 мкл 250 мМ IAM в лунки и затем инкубирование при 25°C в течение 60 мин.
4. Перенос 111 мкл 50 мМ бикарбоната аммония в каждую лунку.
5. Перенос 20 мкл 0,5 мкг/мкл трипсина (1:10 фермент:субстрат) и 0,2 мкг/мкл rLysC (1:25 фермент:субстрат) в каждую лунку и инкубирование при 37°С в течение 120 мин.
6. Перенос 20 мкл 10% ТФК в каждую лунку.
7. Перенос 30 мкл 0,08 пмоль/мкл меченого сконструированного пептида тяжелой цепи (внутренний стандарт пептида) в каждую лунку.
Очистка С18
[0143] Планшет, содержащий расщепленные пробы, помещали на столик системы Agilent Bravo и запускали протокол «Очистка пептидов», состоящий из следующих стадий:
1. Первичная промывка шприца
2. Праймирование (60% ацетонитрил с 0,1% ТФК)
3. Уравновешивание (50 мкл 0,1% ТФК со скоростью 25 мкл/мин)
4. Загрузка образцов (190 мкл со скоростью 5 мкл/мин)
5. Промывание емкости (50 мкл деионизированной воды)
6. Промывание внутренней полости картриджа (50 мкл 0,1% раствора ТФК со скоростью 25 мкл/мин)
7. Тщательное промывание шприца (50 мкл 60% ацетонитрила с 0,1% раствором ТФК)
8. Элюирование (20 мкл 60% ацетонитрила с 0,1% ТФК со скоростью 5 мкл/мин)
ЖХ-МС/МС:
[0144] Каждый элюированный образец (20 мкл в 60% ацетонитриле с 0,1% ТФК) быстро разбавляли до 100 мкл раствора из 35% ацетонитрила и 0,1% муравьиной кислоты с получением 40% ацетонитрила и 0,1% муравьиной кислоты. Каждый образец переносили в отдельный флакон для ЖХ-МС и анализировали в системе ЖХ-МС/МС. Время удерживания, исходная масса, переходы и оптимизированные условия фрагментации варьируются в зависимости от пептидной последовательности и инструмента, используемого для анализа. Пептид TTPP (TTPPVLDSDGSFFLVSK (SEQ ID NO: 7)) анализировали на жидкостной хроматографической системе WATERS® ACQUITY UPLC® I-Class, связанной с системой SCIEX QTRAP® 6500 LC-MS/MS, в следующих условиях:
Колонка: Waters Acquity UPLC Peptide BEH C18 (2,1×150 мм, 1,7 мкм)
Температура колонки: 30°C
Градиент инжектирования образца: градиент начинают и сохраняют при 5% В в течение 1 мин. Увеличивают до 40% B за 17 мин. Скорость потока составляет 0,25 мл/мин. Увеличивают скорость потока до 0,4 мл/мин и 90% В для инжектирования контрольного образца.
Градиент инжектирования контрольного образца: градиент начинают и сохраняют при 90% B в течение 5 мин. Скорость потока составляет 0,4 мл/мин. Уменьшают скорость потока до 0,25 мл/мин и 5% B и сохраняют в течение 3 мин.
Подвижные фазы: А представляет собой воду с 0,1% муравьиной кислоты; B - ацетонитрил с 0,1% муравьиной кислотой
Время удерживания: 12,9 мин.
Параметры масс-спектрометрии
декластеризации
[0145] Для этого примера образцы для построения калибровочной кривой и 6 образцов сыворотки анализировали в 2 разных дня. Мышам вводили дважды в неделю внутрибрюшинно триспецифическое антитело в общей сложности в 7 дозах. Исследуемые образцы, для анализа с помощью ЖХ-МС/МС, отбирали при эвтаназии животных (примерно через 30 ч после введения последней дозы); и в опыт включали контрольное животное, которому вводили физиологический раствор (т.е. мышь 6 на фиг. 21A и 21B), и 5 мышей, которым вводили 30 мг/кг триспецифического антитела (т.е. мыши 1-5 на фиг.21А и 21В).
[0146] После анализа ЖХ-МС/МС каждую калибровочную кривую на сыворотке анализировали линейным регрессионным анализом с 1/х взвешиванием построением графика зависимости соотношения пептида TTPP и его внутреннего стандарта меченного пептида тяжелой цепи против теоретической концентрации. На фиг.20А и 20В приведены результаты этого анализа. Обе кривые на сыворотке демонстрировали хорошую линейность (с r-квадратом ≥ 0,99) и смещение (≤ 25%) для концентраций в диапазоне от 0,012 мкг/мл до 800 мкг/мл.
[0147] Как показано на фиг. 21А, в образцах сыворотки были более высокие уровни триспецифического пептида у большинства мышей, которым вводили триспецифическое антитело (# 1-5), и более низкие уровни у мышей, которым вводили физиологический раствор (# 6). Уровни пептидов, детектированные в анализе на основе ЖХ-МС/МС, совпадали между 2 анализами (фиг. 21А). Эти образцы также анализировали с использованием ELISA (n=4 повтора), и результаты анализа ELISA приведены на фиг. 21В. Относительные уровни триспецифического антитела, детектированные с помощью ЖХ-МС/МС или ELISA, показывают тенденцию к совпадению для всех образцов.
[0148] Несмотря на то, что раскрытие включает различные варианты осуществления, понятно, что вариации и модификации будут понятны для специалистов в данной области техники. Следовательно, предполагается, что прилагаемая формула изобретения охватывает все такие эквивалентные варианты, которые входят в объем раскрытия. Кроме того, заголовки разделов, используемые здесь, предназначены только для целей структурирования описания и не должны рассматриваться как ограничивающие предмет описания.
[0149] Все ссылки, цитируемые в этой заявке, точно включены здесь посредством ссылки.
--->
Список последовательностей
<110> Genzyme Corporation
MORGAN, Christopher
ZHANG, Xiaokui
<120> СПОСОБЫ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ПОЛИПЕПТИДОВ
<130> 18395-20282.40
<140> Not Yet Assigned
<141> Concurrently Herewith
<150> US 62/617,080
<151> 2018-01-12
<160> 39
<170> FastSEQ for Windows Version 4.0
<210> 1
<211> 225
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 1
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
1 5 10 15
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
20 25 30
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
35 40 45
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
50 55 60
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
65 70 75 80
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
85 90 95
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
100 105 110
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
115 120 125
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
130 135 140
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
145 150 155 160
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
165 170 175
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
180 185 190
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
195 200 205
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
210 215 220
Lys
225
<210> 2
<211> 224
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 2
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
1 5 10 15
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
20 25 30
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
35 40 45
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
50 55 60
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
65 70 75 80
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
85 90 95
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
100 105 110
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
115 120 125
Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Trp
130 135 140
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
145 150 155 160
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
165 170 175
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
180 185 190
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Leu His Glu
195 200 205
Ala Leu His Ser His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
210 215 220
<210> 3
<211> 224
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 3
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
1 5 10 15
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
20 25 30
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
35 40 45
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
50 55 60
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
65 70 75 80
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
85 90 95
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
100 105 110
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys Thr
115 120 125
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Ser
130 135 140
Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
145 150 155 160
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
165 170 175
Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp Lys
180 185 190
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Leu His Glu
195 200 205
Ala Leu His Ser His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
210 215 220
<210> 4
<211> 225
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 4
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
1 5 10 15
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
20 25 30
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
35 40 45
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
50 55 60
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
65 70 75 80
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
85 90 95
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
100 105 110
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys Thr
115 120 125
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Ser
130 135 140
Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
145 150 155 160
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
165 170 175
Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp Lys
180 185 190
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
195 200 205
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
210 215 220
Lys
225
<210> 5
<211> 224
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 5
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
1 5 10 15
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
20 25 30
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
35 40 45
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
50 55 60
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
65 70 75 80
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
85 90 95
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
100 105 110
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
115 120 125
Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Trp
130 135 140
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
145 150 155 160
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
165 170 175
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
180 185 190
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
195 200 205
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
210 215 220
<210> 6
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 6
Asp Gly Ser Phe Phe Leu Val Ser
1 5
<210> 7
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 7
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser
1 5 10 15
Lys
<210> 8
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 8
Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val
1 5 10
<210> 9
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 9
Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp
1 5 10
<210> 10
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 10
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
1 5 10
<210> 11
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 11
Ala Leu His Ser His Tyr Thr Gln Lys
1 5
<210> 12
<211> 611
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 12
Glu Val Arg Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ser Ala Ser Gly Phe Asp Phe Asp Asn Ala
20 25 30
Trp Met Thr Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Arg Ile Thr Gly Pro Gly Glu Gly Trp Ser Val Asp Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Thr Lys Asn Thr
65 70 75 80
Leu Tyr Leu Glu Met Asn Asn Val Arg Thr Glu Asp Thr Gly Tyr Tyr
85 90 95
Phe Cys Ala Arg Thr Gly Lys Tyr Tyr Asp Phe Trp Ser Gly Tyr Pro
100 105 110
Pro Gly Glu Glu Tyr Phe Gln Asp Trp Gly Gln Gly Thr Leu Val Ile
115 120 125
Val Ser Ser Asp Lys Thr His Thr Gln Val His Leu Thr Gln Ser Gly
130 135 140
Pro Glu Val Arg Lys Pro Gly Thr Ser Val Lys Val Ser Cys Lys Ala
145 150 155 160
Pro Gly Asn Thr Leu Lys Thr Tyr Asp Leu His Trp Val Arg Ser Val
165 170 175
Pro Gly Gln Gly Leu Gln Trp Met Gly Trp Ile Ser His Glu Gly Asp
180 185 190
Lys Lys Val Ile Val Glu Arg Phe Lys Ala Lys Val Thr Ile Asp Trp
195 200 205
Asp Arg Ser Thr Asn Thr Ala Tyr Leu Gln Leu Ser Gly Leu Thr Ser
210 215 220
Gly Asp Thr Ala Val Tyr Tyr Cys Ala Lys Gly Ser Lys His Arg Leu
225 230 235 240
Arg Asp Tyr Ala Leu Tyr Asp Asp Asp Gly Ala Leu Asn Trp Ala Val
245 250 255
Asp Val Asp Tyr Leu Ser Asn Leu Glu Phe Trp Gly Gln Gly Thr Ala
260 265 270
Val Thr Val Ser Ser Asp Lys Thr His Thr Ala Ser Thr Lys Gly Pro
275 280 285
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
290 295 300
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
305 310 315 320
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
325 330 335
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
340 345 350
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
355 360 365
His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser
370 375 380
Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu
385 390 395 400
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
405 410 415
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
420 425 430
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
435 440 445
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
450 455 460
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
465 470 475 480
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro
485 490 495
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
500 505 510
Val Tyr Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val
515 520 525
Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
530 535 540
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
545 550 555 560
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr
565 570 575
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
580 585 590
Leu His Glu Ala Leu His Ser His Tyr Thr Gln Lys Ser Leu Ser Leu
595 600 605
Ser Pro Gly
610
<210> 13
<211> 338
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 13
Asp Phe Val Leu Thr Gln Ser Pro His Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Glu Ser Ala Ser Ile Ser Cys Lys Ser Ser His Ser Leu Ile His Gly
20 25 30
Asp Arg Asn Asn Tyr Leu Ala Trp Tyr Val Gln Lys Pro Gly Arg Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Ala Ser Ser Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Asp Lys Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Thr Glu Asp Val Gly Thr Tyr Tyr Cys Met Gln Gly
85 90 95
Arg Glu Ser Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Asp Ile Lys
100 105 110
Asp Lys Thr His Thr Ala Ser Glu Leu Thr Gln Asp Pro Ala Val Ser
115 120 125
Val Ala Leu Lys Gln Thr Val Thr Ile Thr Cys Arg Gly Asp Ser Leu
130 135 140
Arg Ser His Tyr Ala Ser Trp Tyr Gln Lys Lys Pro Gly Gln Ala Pro
145 150 155 160
Val Leu Leu Phe Tyr Gly Lys Asn Asn Arg Pro Ser Gly Ile Pro Asp
165 170 175
Arg Phe Ser Gly Ser Ala Ser Gly Asn Arg Ala Ser Leu Thr Ile Thr
180 185 190
Gly Ala Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Arg Asp
195 200 205
Lys Ser Gly Ser Arg Leu Ser Val Phe Gly Gly Gly Thr Lys Leu Thr
210 215 220
Val Leu Asp Lys Thr His Thr Arg Thr Val Ala Ala Pro Ser Val Phe
225 230 235 240
Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val
245 250 255
Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp
260 265 270
Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr
275 280 285
Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr
290 295 300
Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val
305 310 315 320
Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly
325 330 335
Glu Cys
<210> 14
<211> 450
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 14
Gln Val Gln Leu Val Gln Ser Gly Gly Gln Met Lys Lys Pro Gly Glu
1 5 10 15
Ser Met Arg Ile Ser Cys Arg Ala Ser Gly Tyr Glu Phe Ile Asp Cys
20 25 30
Thr Leu Asn Trp Ile Arg Leu Ala Pro Gly Lys Arg Pro Glu Trp Met
35 40 45
Gly Trp Leu Lys Pro Arg Gly Gly Ala Val Asn Tyr Ala Arg Pro Leu
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Val Tyr Ser Asp Thr Ala Phe
65 70 75 80
Leu Glu Leu Arg Ser Leu Thr Val Asp Asp Thr Ala Val Tyr Phe Cys
85 90 95
Thr Arg Gly Lys Asn Cys Asp Tyr Asn Trp Asp Phe Glu His Trp Gly
100 105 110
Arg Gly Thr Pro Val Ile Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Cys Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
355 360 365
Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Leu
420 425 430
His Glu Ala Leu His Ser His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly
450
<210> 15
<211> 210
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 15
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Thr Ala Ile Ile Ser Cys Arg Thr Ser Gln Tyr Gly Ser Leu Ala
20 25 30
Trp Tyr Gln Gln Arg Pro Gly Gln Ala Pro Arg Leu Val Ile Tyr Ser
35 40 45
Gly Ser Thr Arg Ala Ala Gly Ile Pro Asp Arg Phe Ser Gly Ser Arg
50 55 60
Trp Gly Pro Asp Tyr Asn Leu Thr Ile Ser Asn Leu Glu Ser Gly Asp
65 70 75 80
Phe Gly Val Tyr Tyr Cys Gln Gln Tyr Glu Phe Phe Gly Gln Gly Thr
85 90 95
Lys Val Gln Val Asp Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe
100 105 110
Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val
115 120 125
Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp
130 135 140
Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr
145 150 155 160
Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr
165 170 175
Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val
180 185 190
Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly
195 200 205
Glu Cys
210
<210> 16
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 16
Leu Val Ile Tyr Ser Gly Ser Thr Arg
1 5
<210> 17
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 17
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys
1 5 10
<210> 18
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 18
Asp Thr Leu Met Ile Ser Arg
1 5
<210> 19
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 19
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
1 5 10 15
Lys
<210> 20
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 20
Leu Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val
1 5 10 15
Ser Lys
<210> 21
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 21
Gly Gly Gly Gly
1
<210> 22
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 22
Gly Gly Gly Gly Gly
1 5
<210> 23
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 23
Gly Gly Gly Gly Gly Gly
1 5
<210> 24
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 24
Gly Gly Gly Gly Gly Gly Gly
1 5
<210> 25
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 25
Gly Gly Gly Gly Gly Gly Gly Gly
1 5
<210> 26
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 26
Gly Gly Gly Gly Ser
1 5
<210> 27
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 27
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10
<210> 28
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 28
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 29
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 29
Thr Lys Gly Pro Ser
1 5
<210> 30
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 30
Thr Val Ala Ala Pro
1 5
<210> 31
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 31
Gln Arg Ile Glu Gly
1 5
<210> 32
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 32
Arg Thr Val Ala Ala Pro Ser
1 5
<210> 33
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 33
Gly Gln Pro Lys Ala Ala Pro
1 5
<210> 34
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 34
His Ile Asp Ser Pro Asn Lys
1 5
<210> 35
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 35
Asp Lys Thr His Thr
1 5
<210> 36
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 36
Thr Lys Gly Pro Ser Arg
1 5
<210> 37
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 37
Ala Ser Thr Lys Gly Pro Ser
1 5
<210> 38
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 38
Glu Ser Pro Trp Thr Phe Gly Gln Gly Thr Lys
1 5 10
<210> 39
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический конструкт
<400> 39
Gln Pro Lys Ala Ala
1 5
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С GPRC5D | 2020 |
|
RU2841523C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С CD3 | 2019 |
|
RU2810924C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С GPRC5D | 2019 |
|
RU2797268C2 |
| АНТИ-PD-1 АНТИТЕЛА | 2019 |
|
RU2788095C2 |
| БЕЛОК, СВЯЗЫВАЮЩИЙСЯ С NKG2D, CD16 И С ОПУХОЛЕСПЕЦИФИЧЕСКИМ АНТИГЕНОМ | 2018 |
|
RU2788531C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С CD3 | 2019 |
|
RU2832669C2 |
| ВАРИАНТЫ FC-ОБЛАСТИ С МОДИФИЦИРОВАННОЙ СПОСОБНОСТЬЮ СВЯЗЫВАТЬСЯ С FCRN И С СОХРАНЕННОЙ СПОСОБНОСТЬЮ СВЯЗЫВАТЬСЯ С БЕЛКОМ А | 2015 |
|
RU2727639C2 |
| БИСПЕЦИФИЧЕСКИЙ БЕЛОК | 2019 |
|
RU2784486C1 |
| АНТИТЕЛО ПРОТИВ КЛАУДИНА 18A2 И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2811431C2 |
| АНТИТЕЛО, СПОСОБНОЕ СВЯЗЫВАТЬСЯ С ТИМИЧЕСКИМ СТРОМАЛЬНЫМ ЛИМФОПОЭТИНОМ, И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2825304C2 |
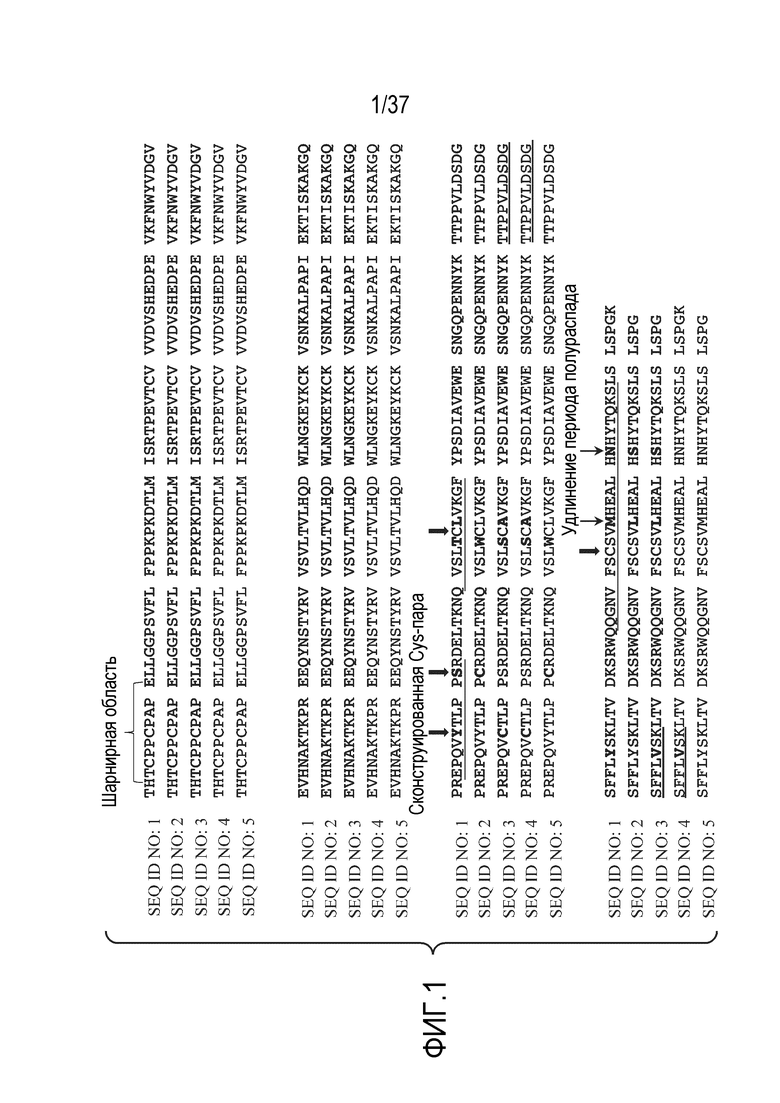
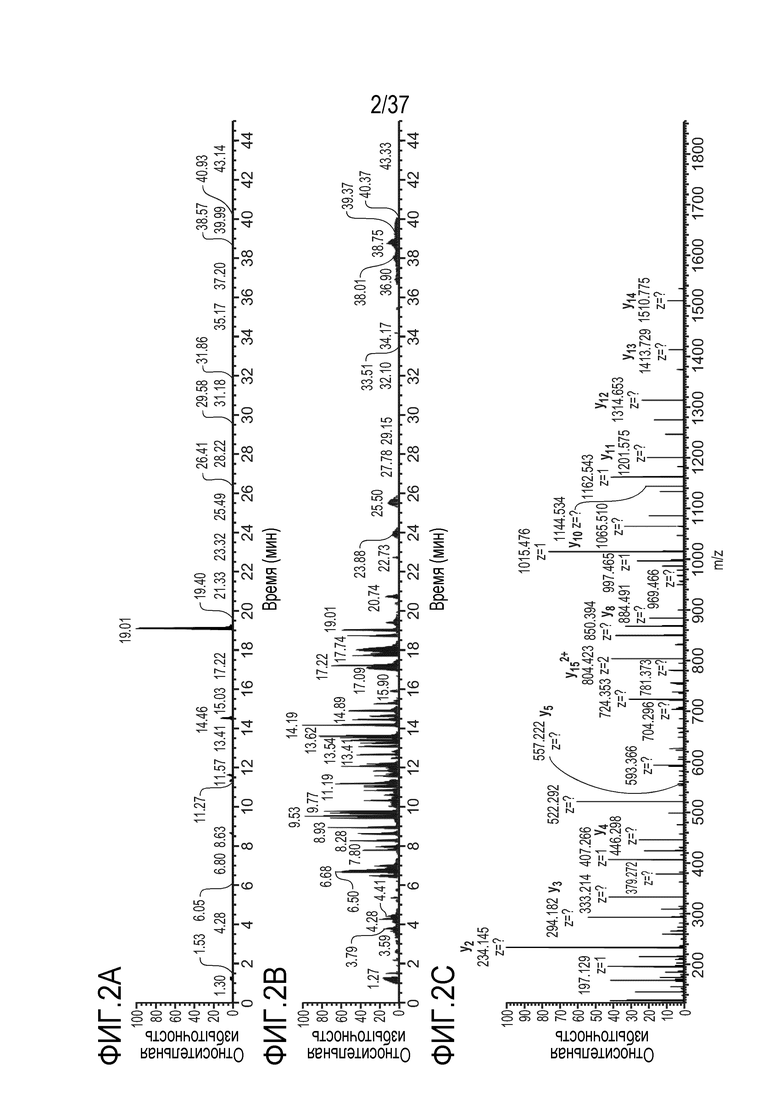
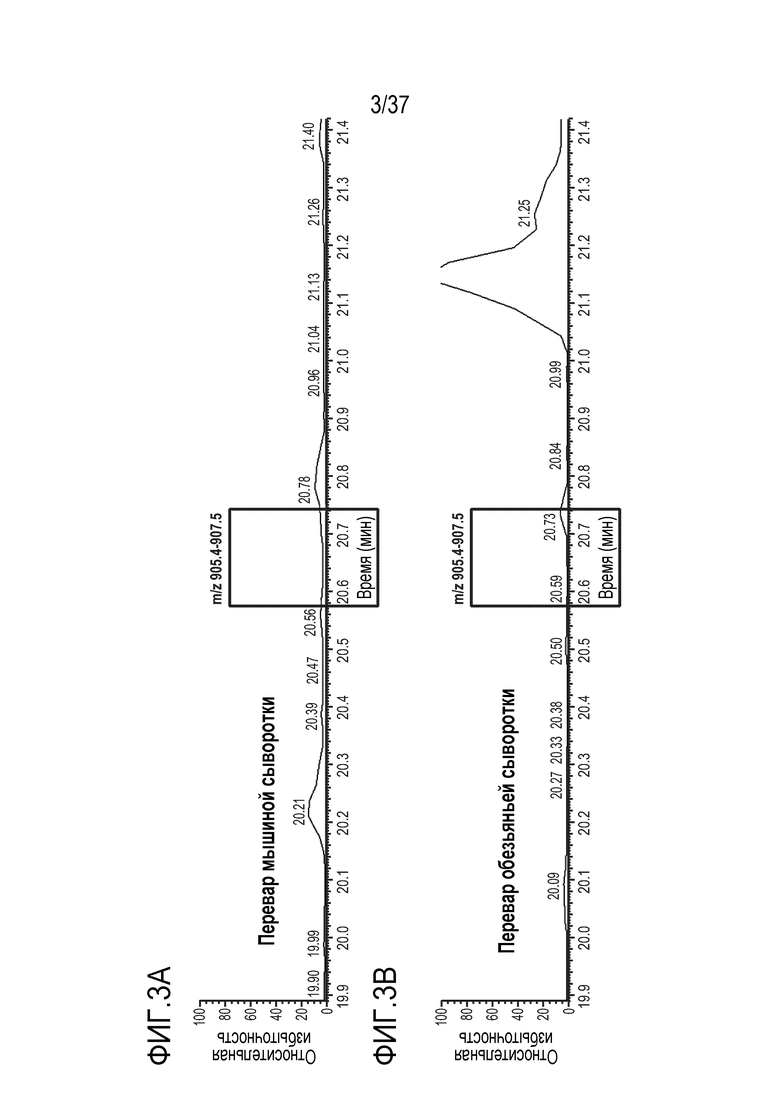
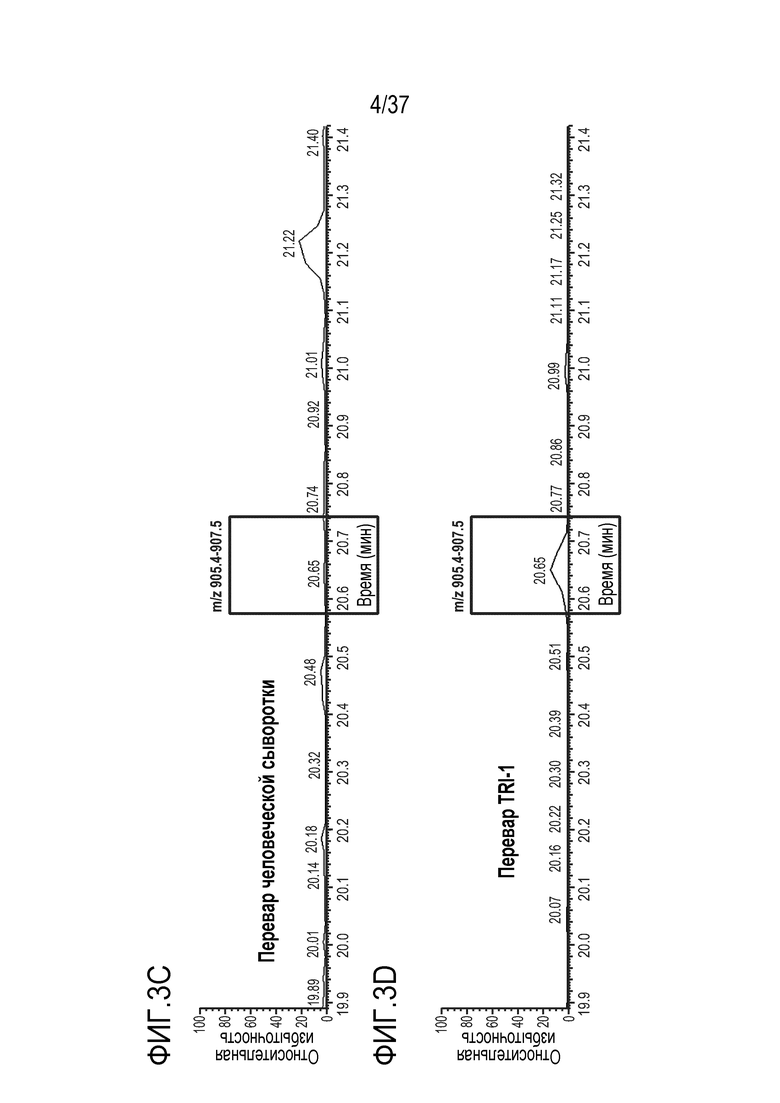
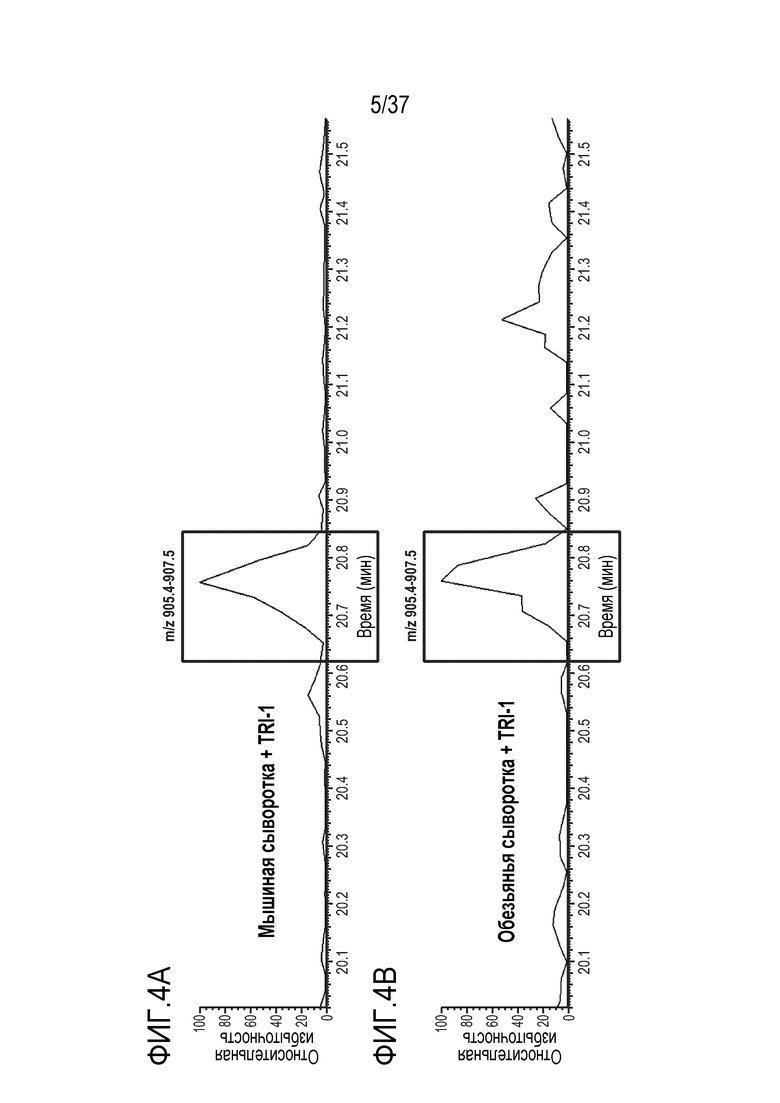
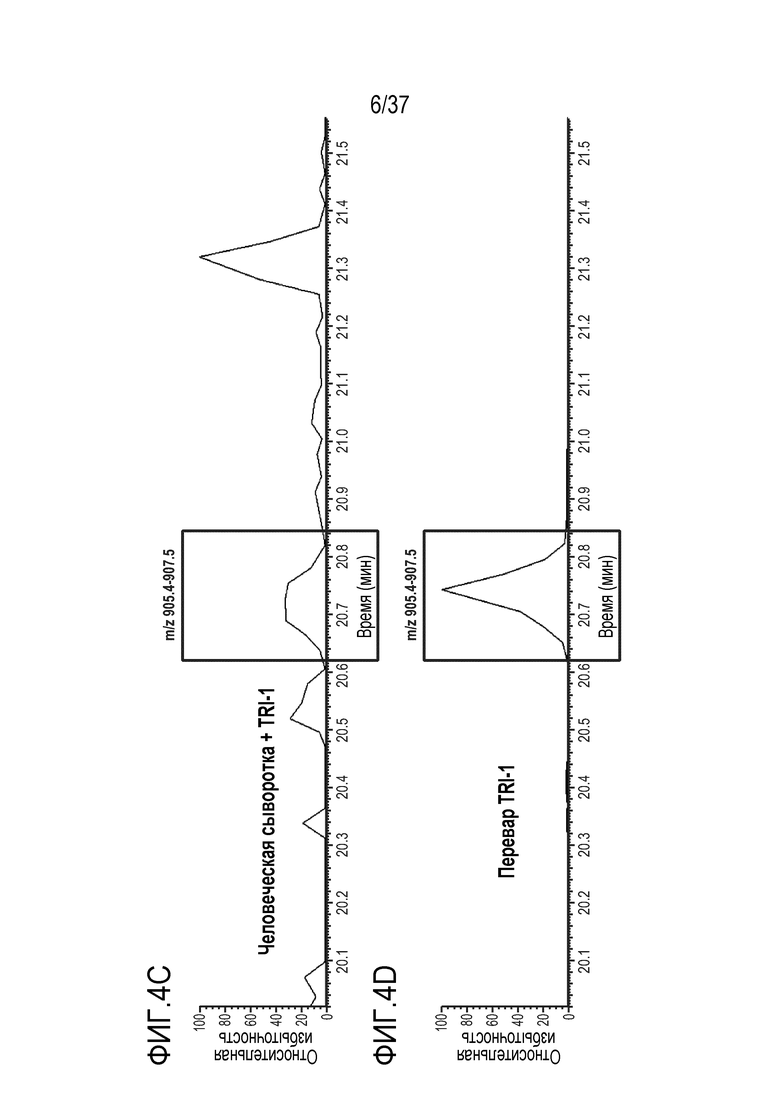
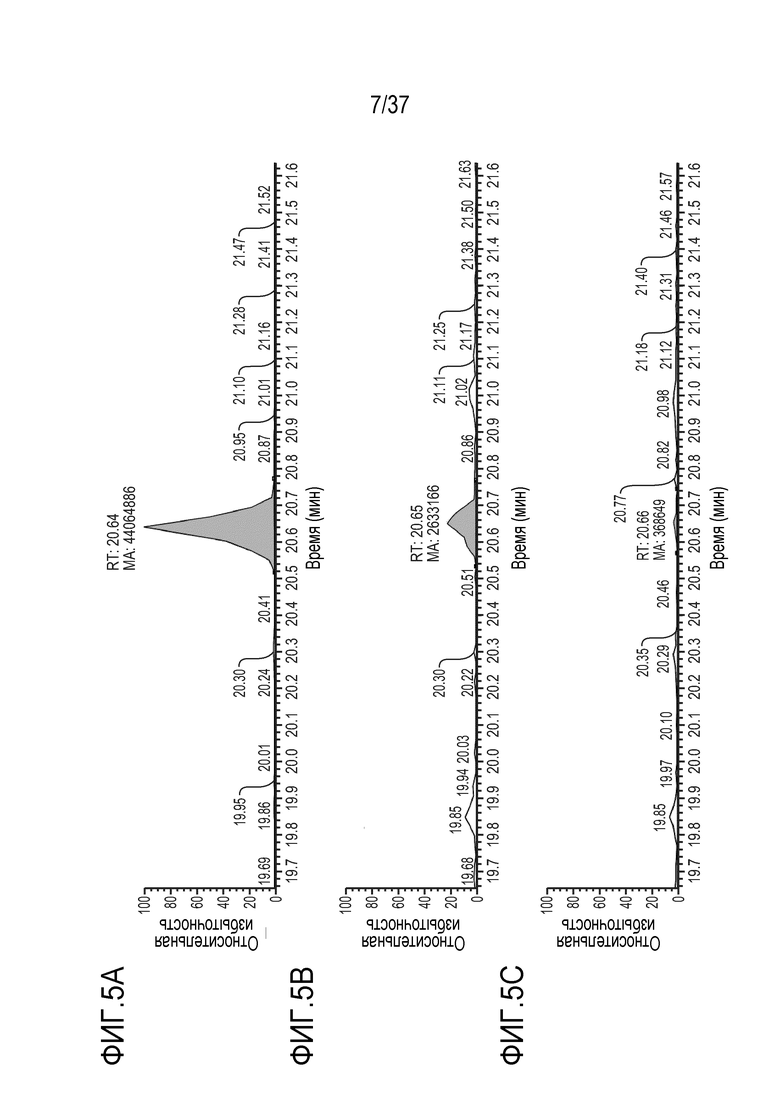
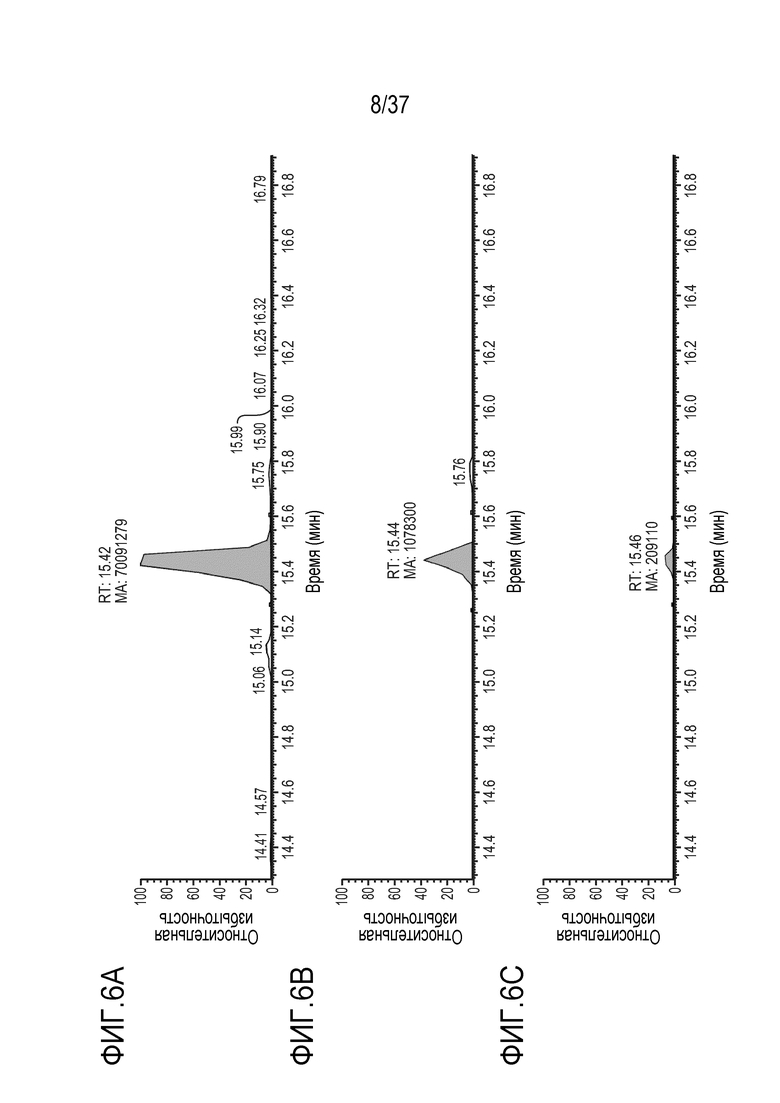
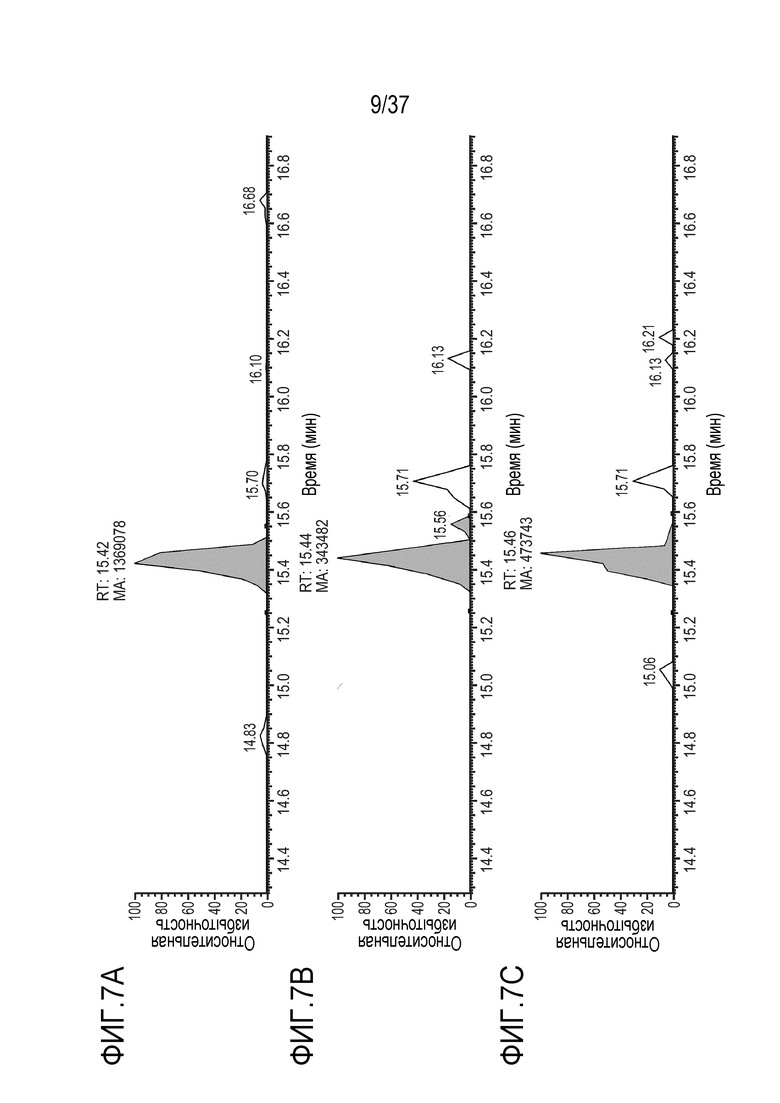

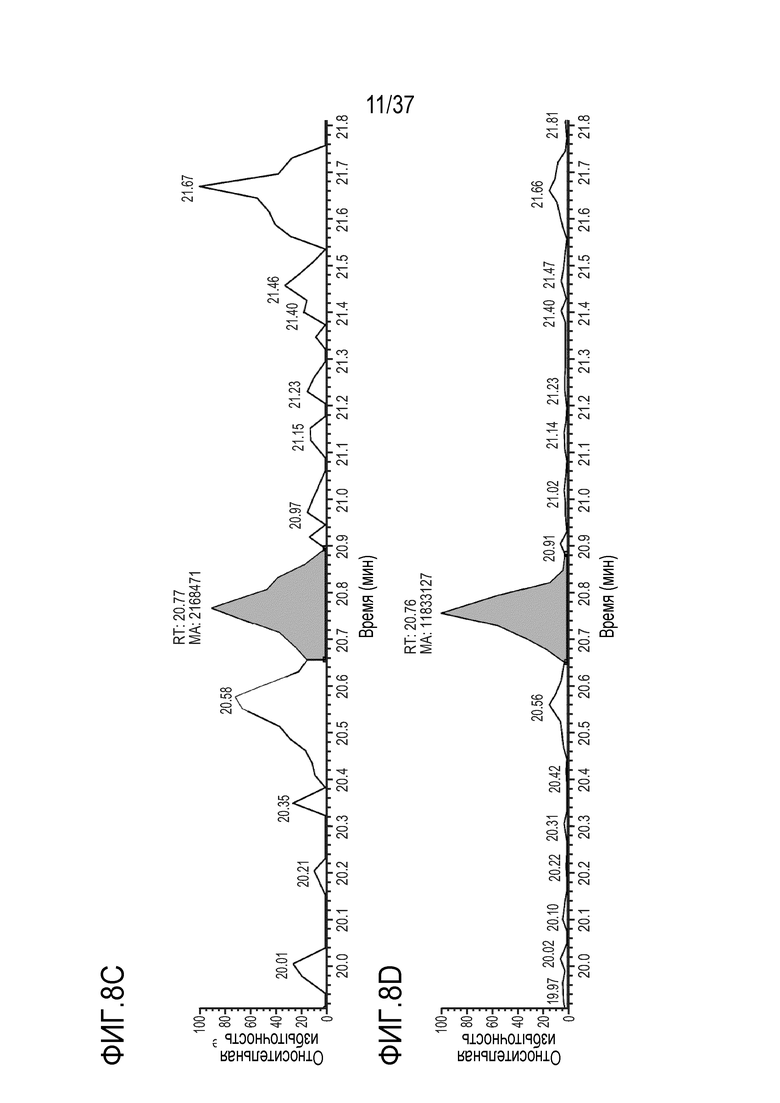
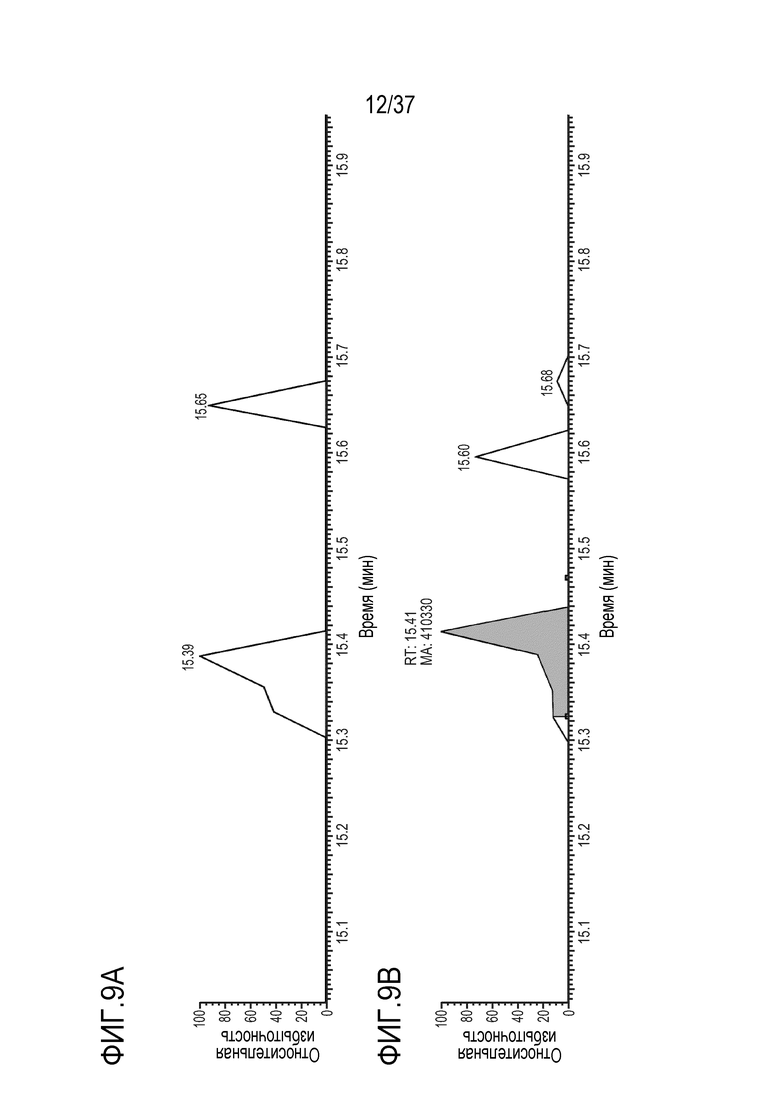
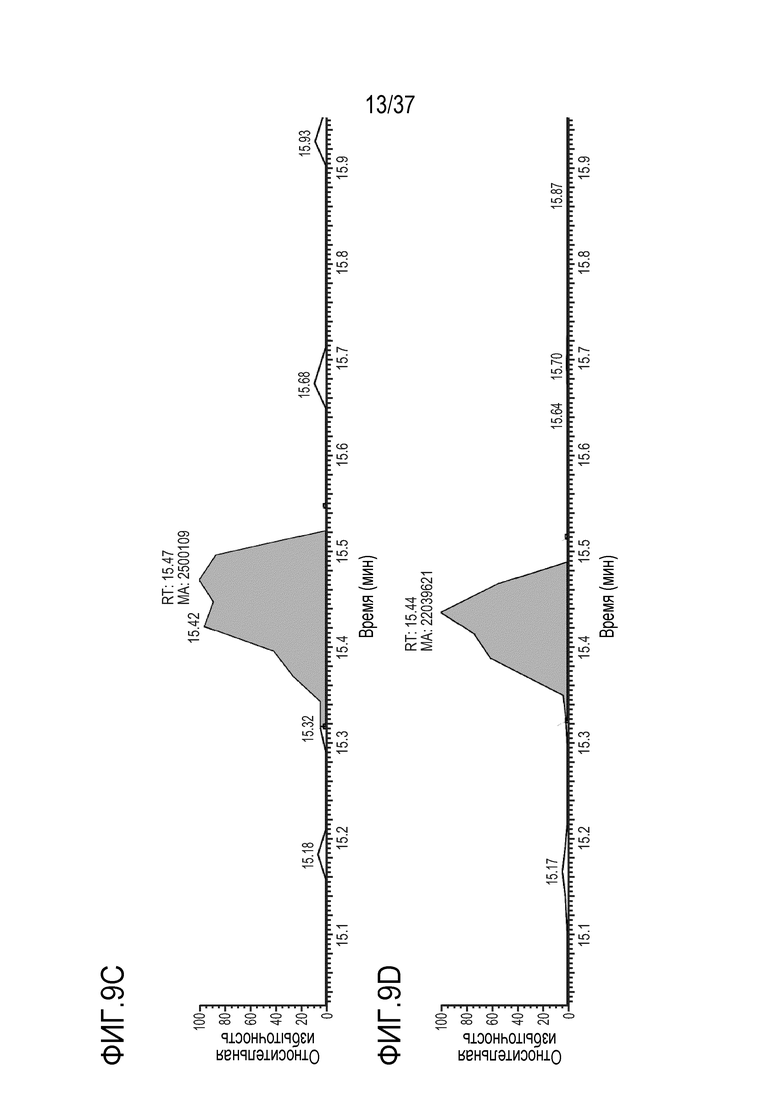
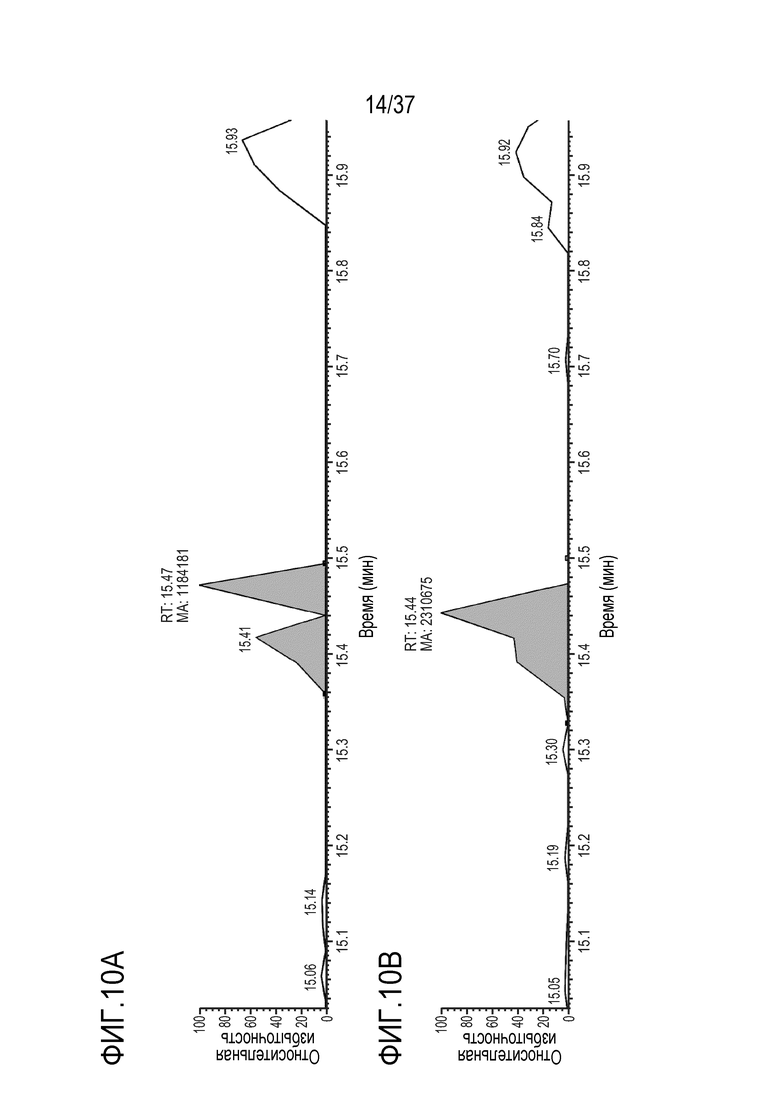
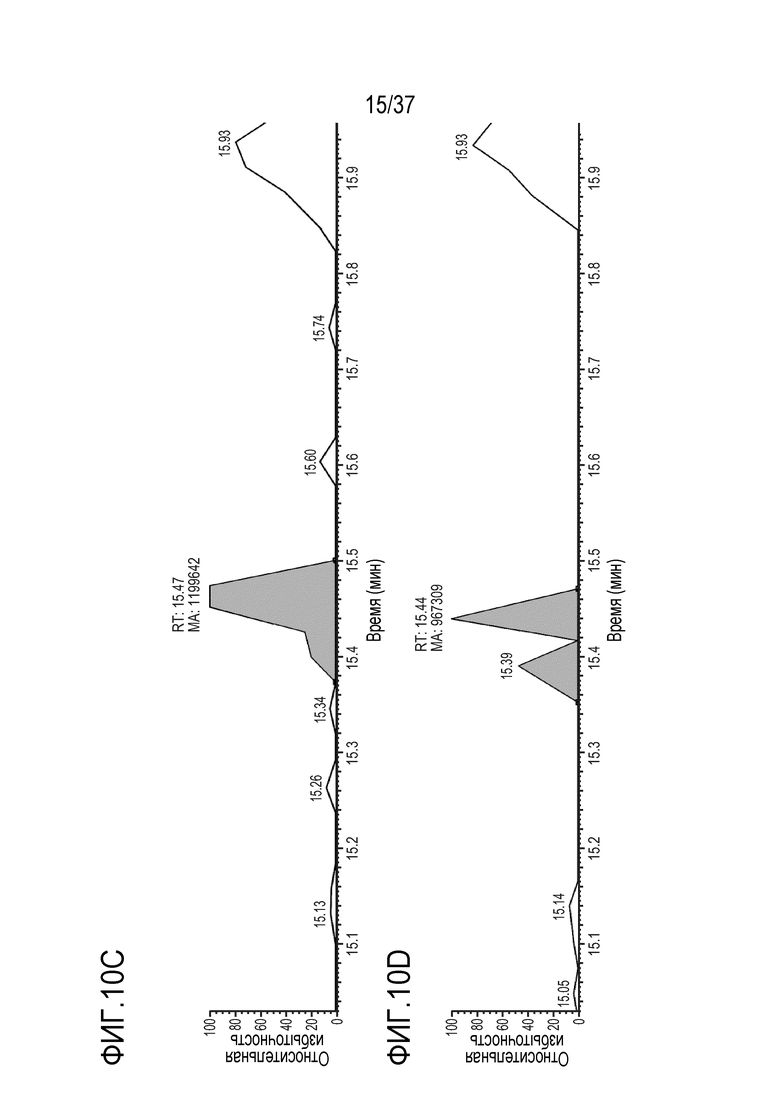
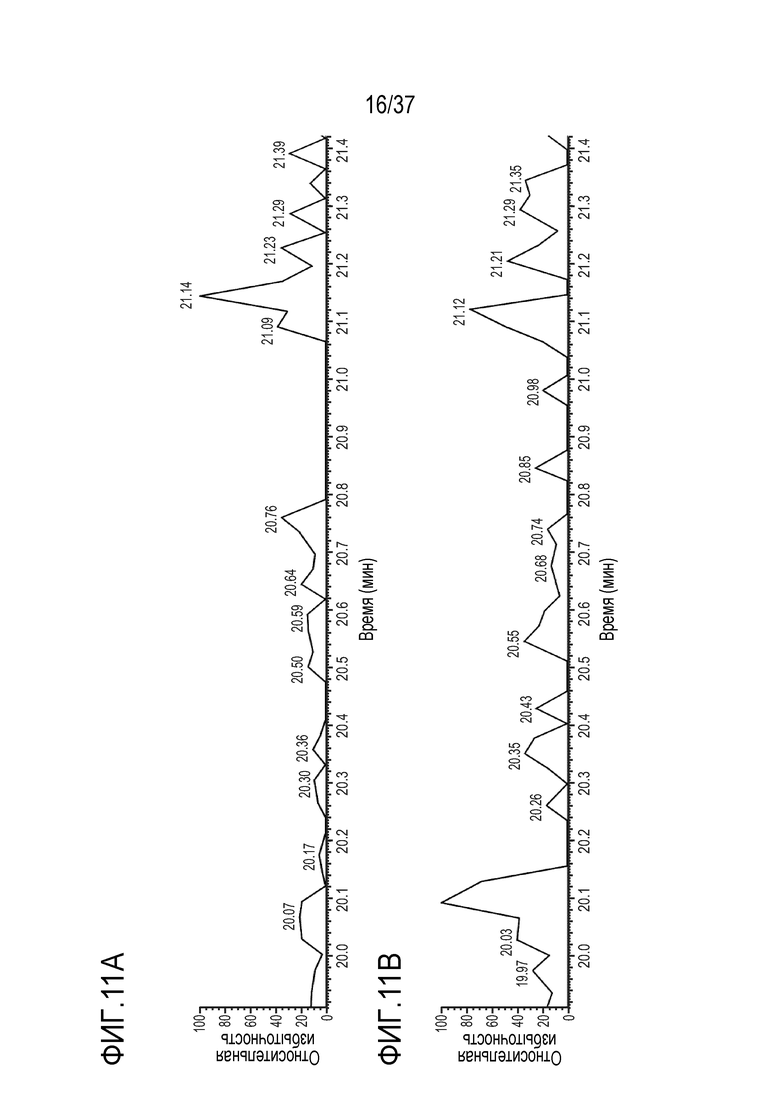
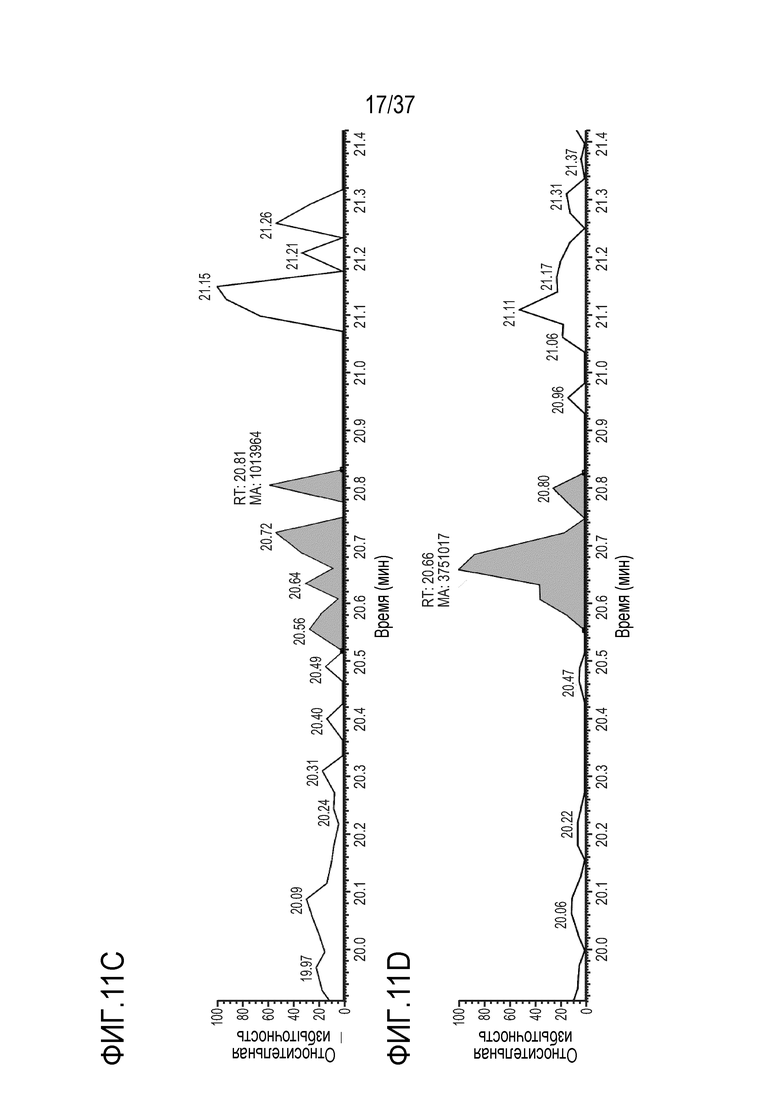
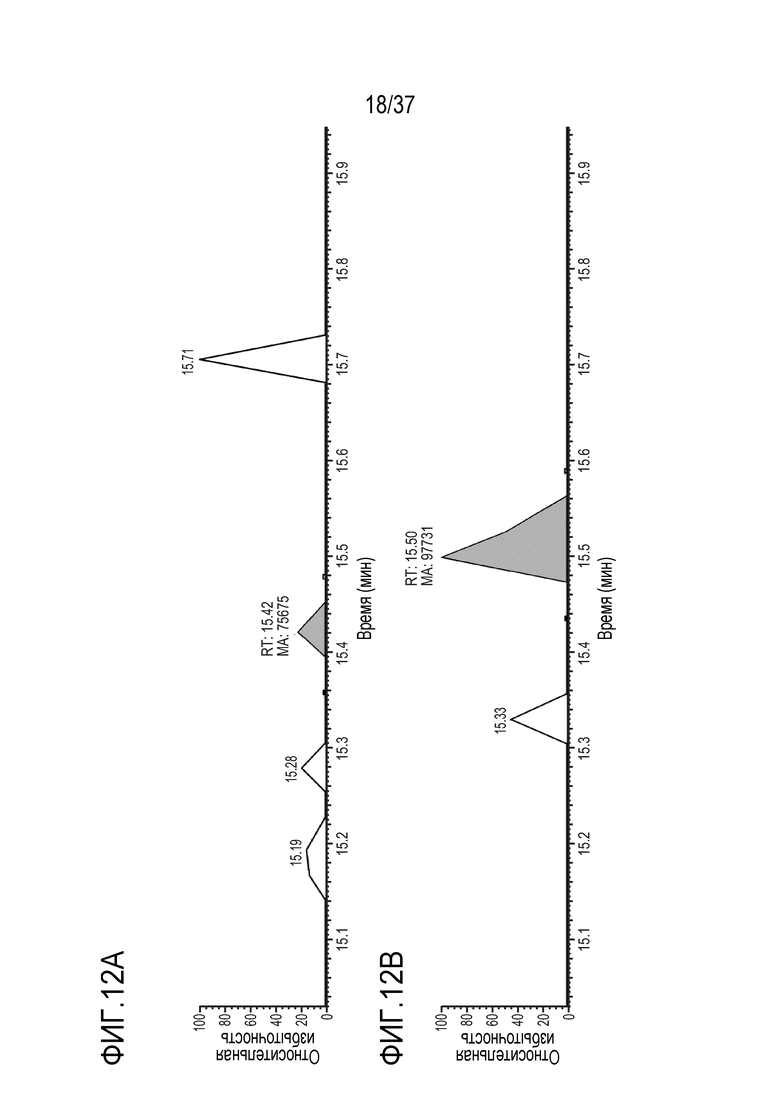
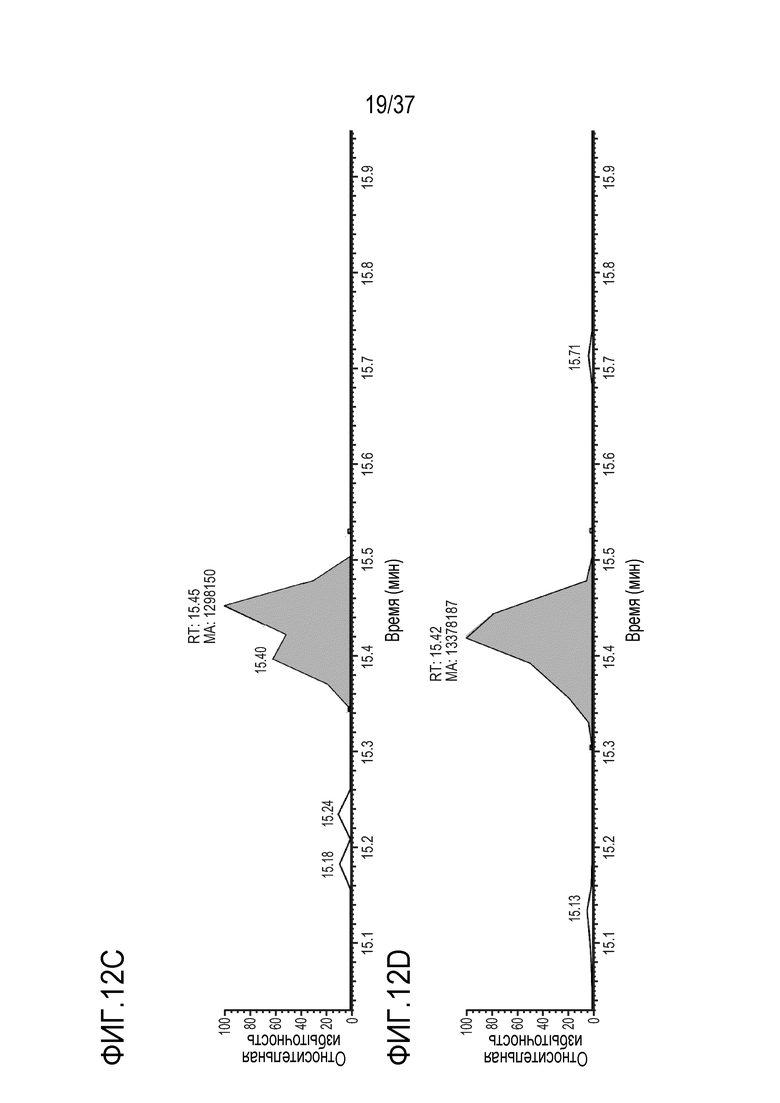
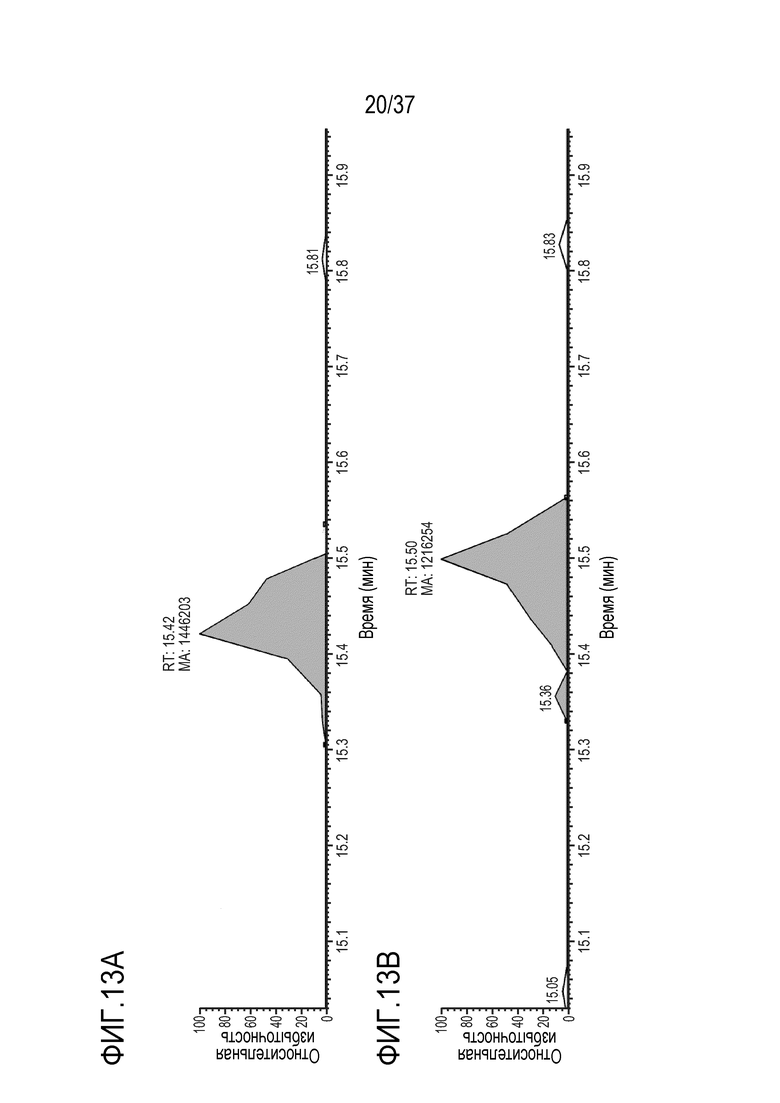

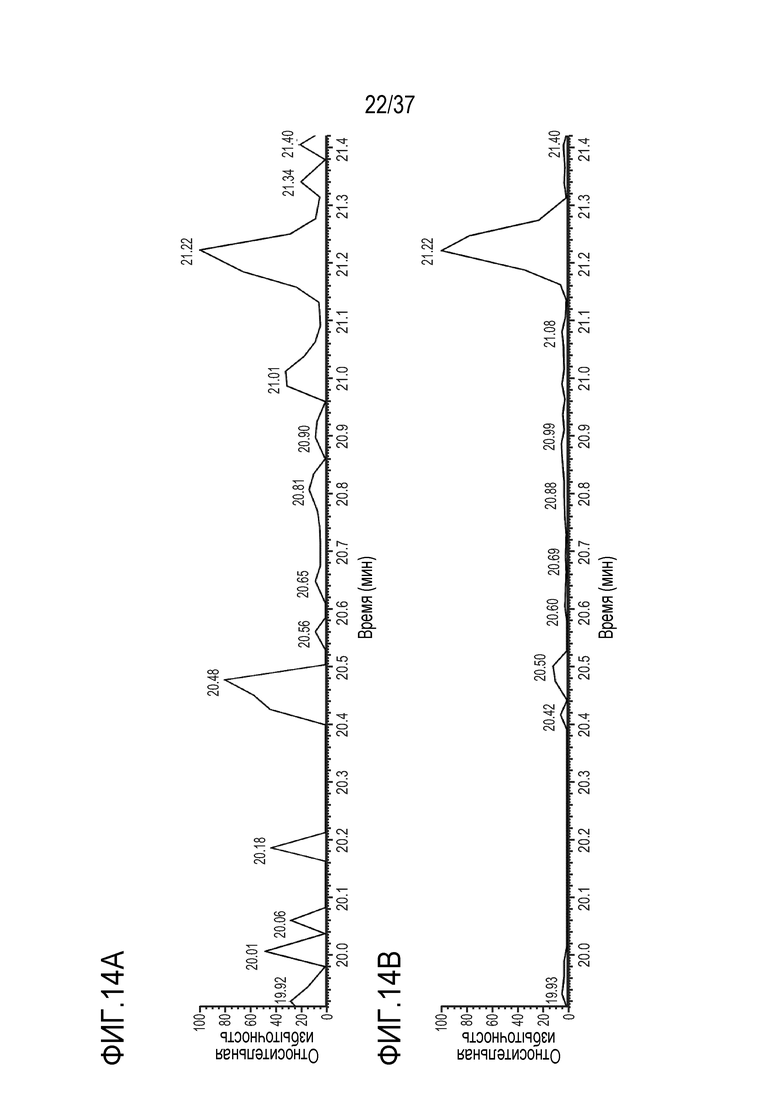
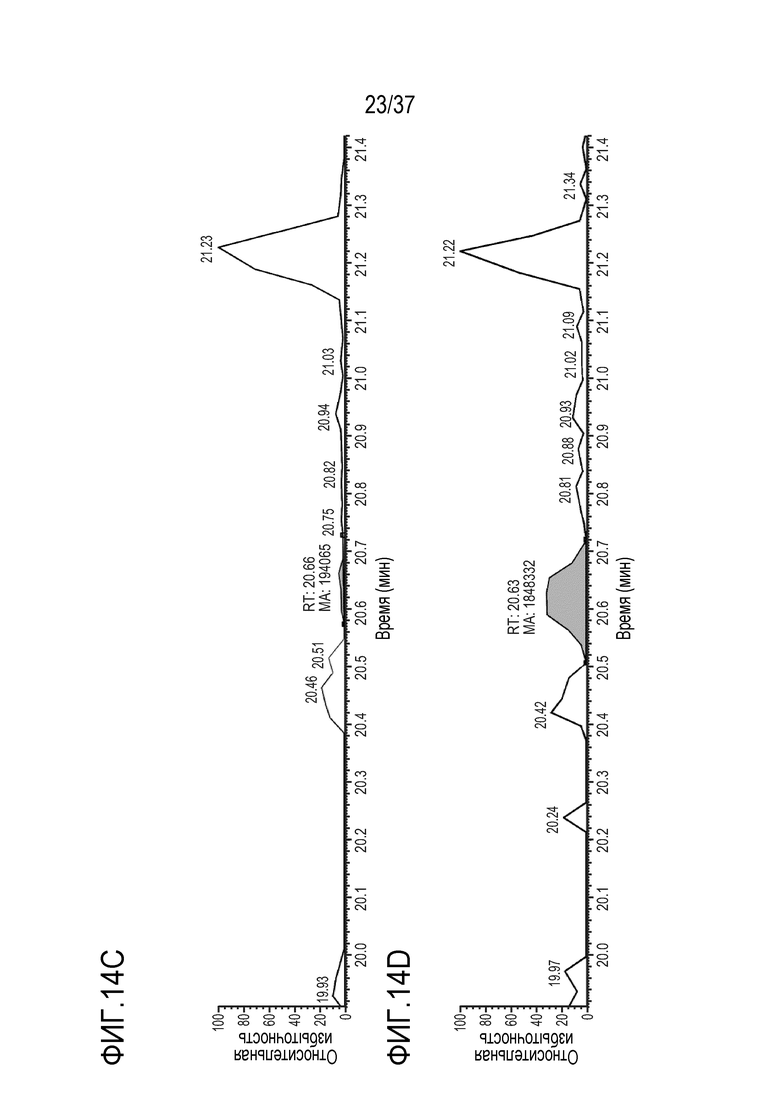
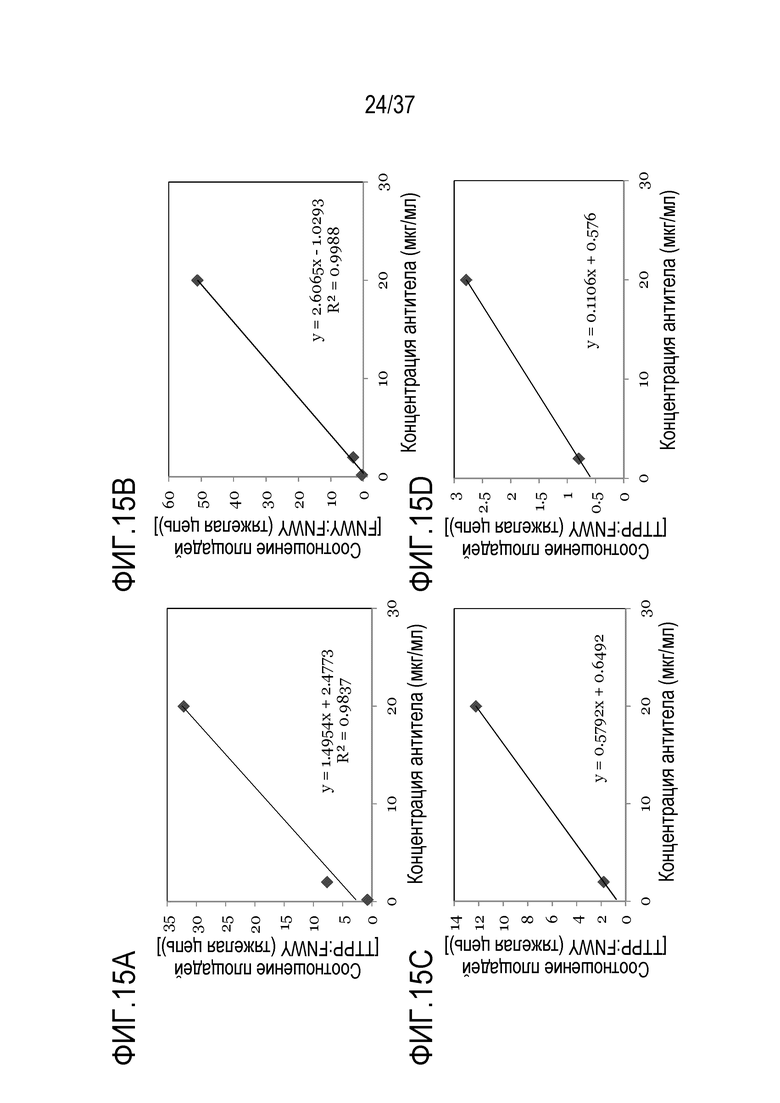

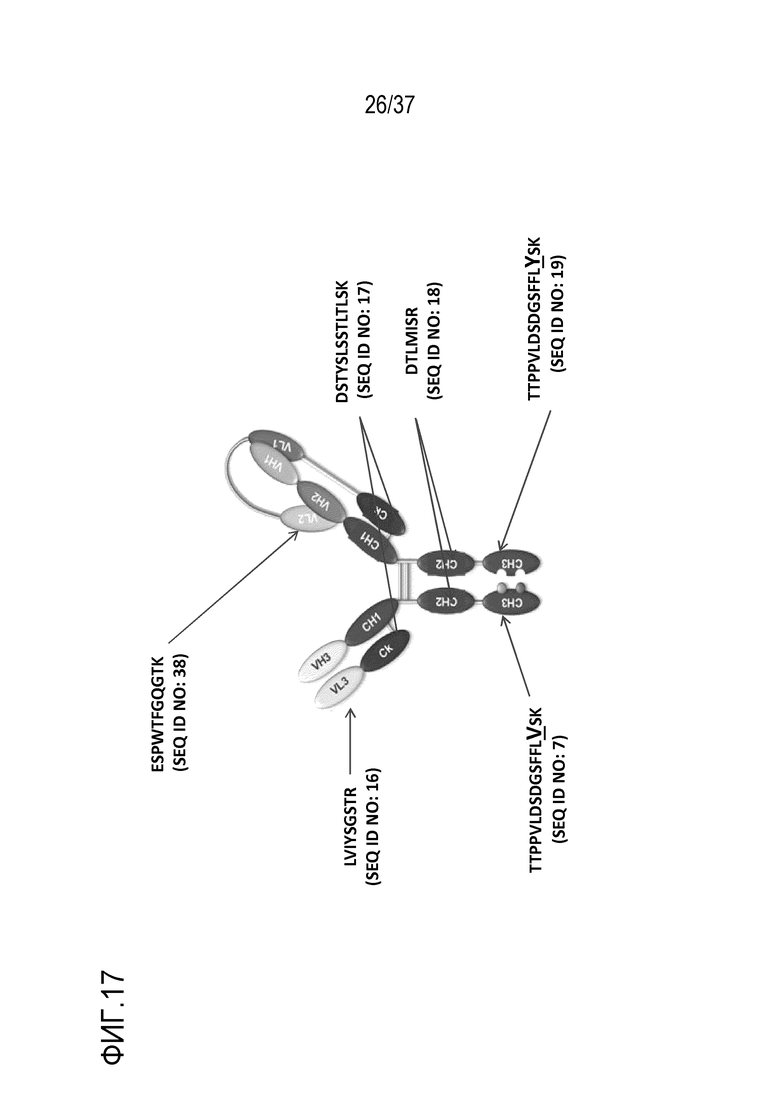
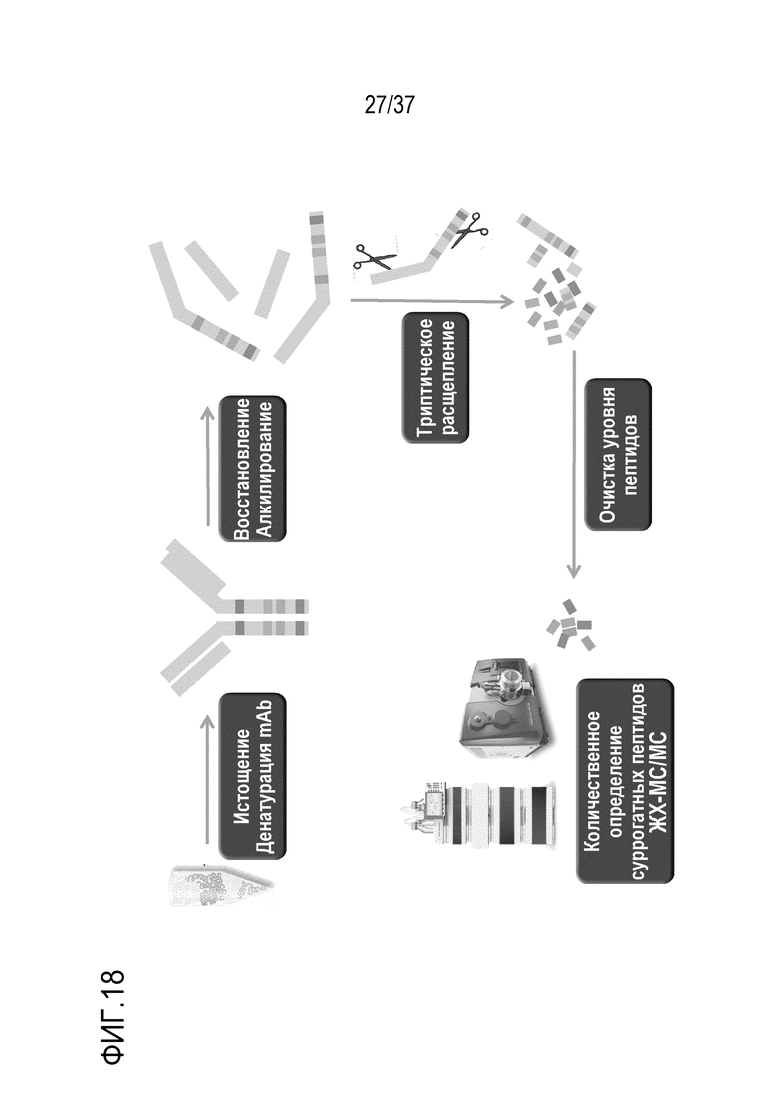
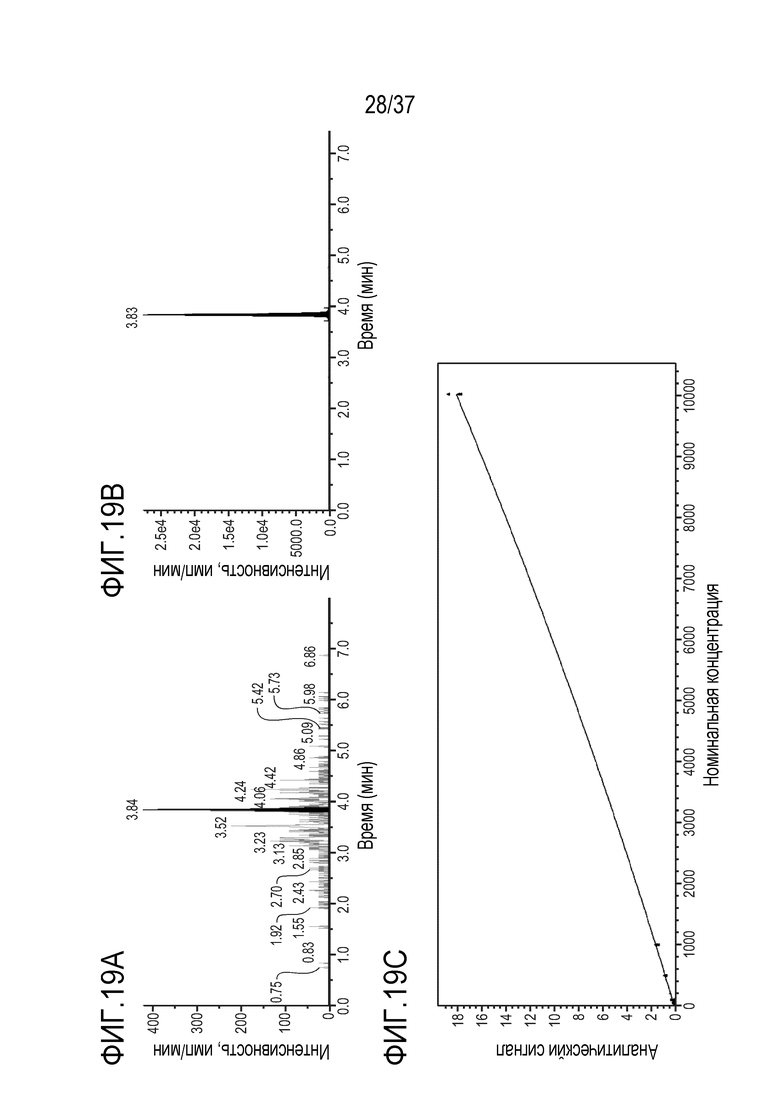
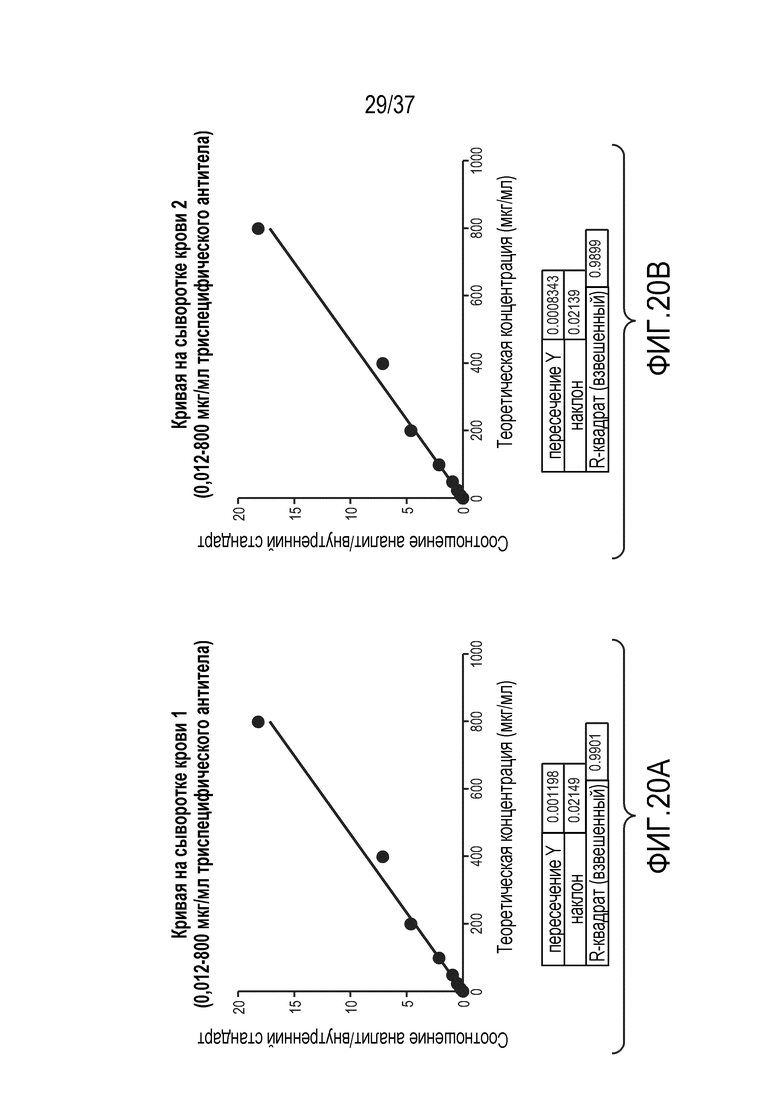
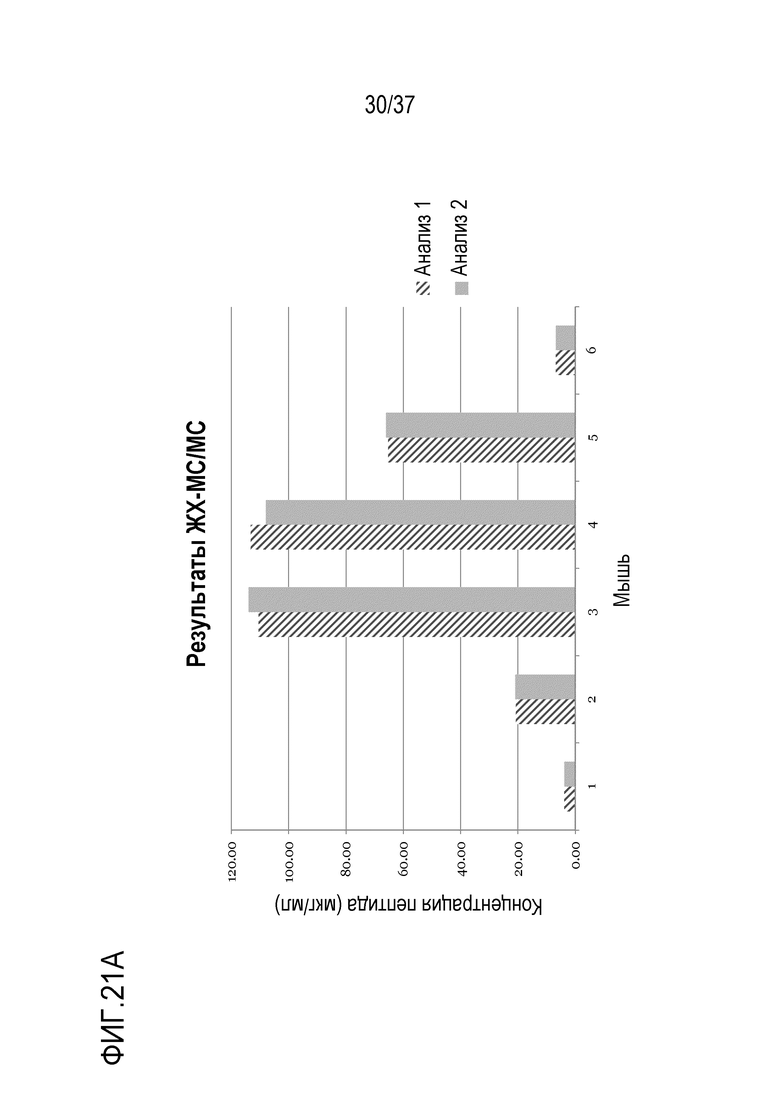
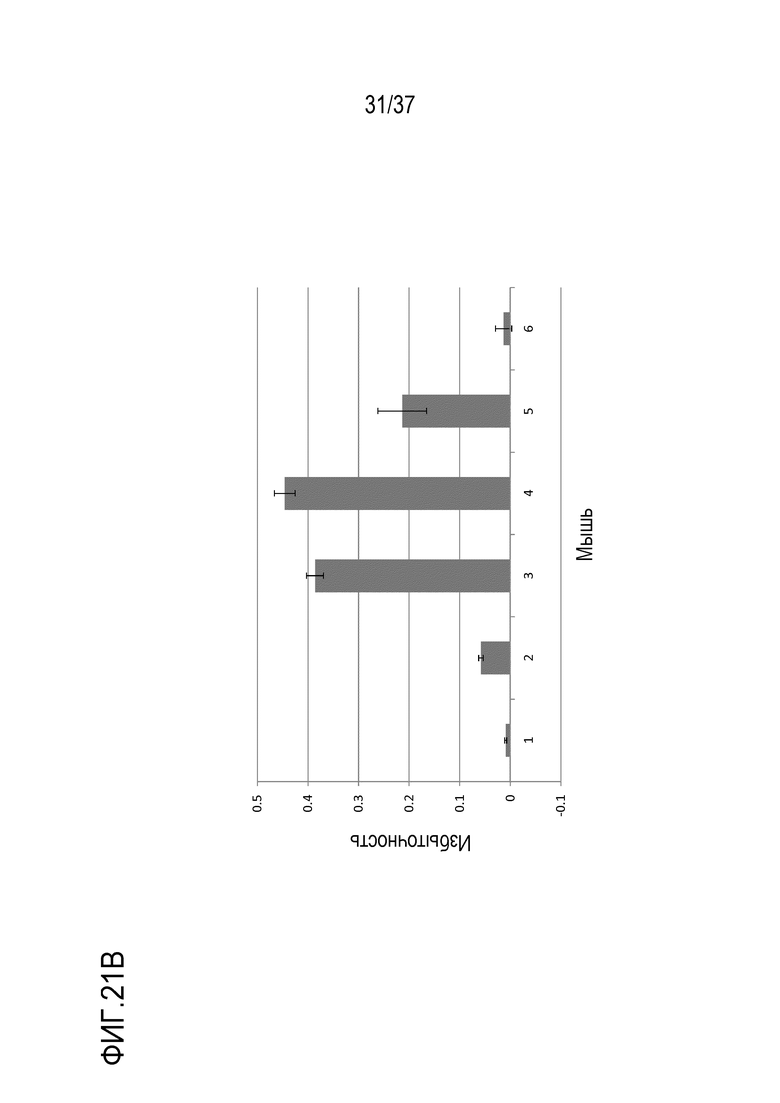
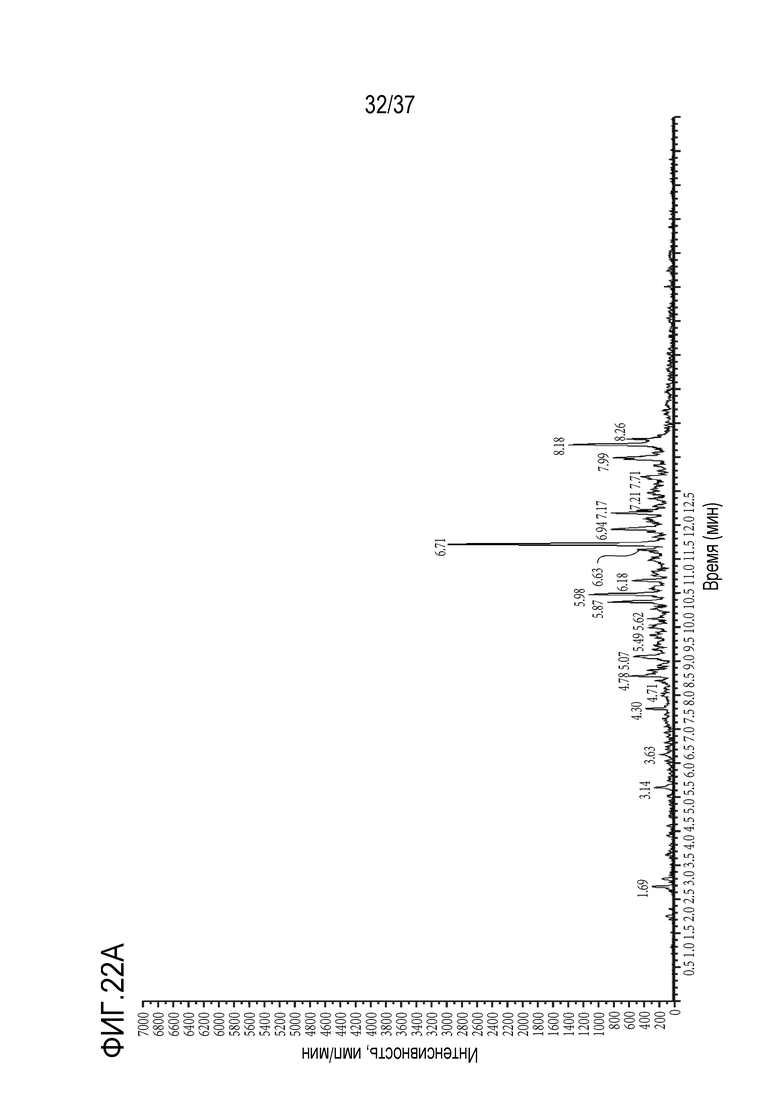


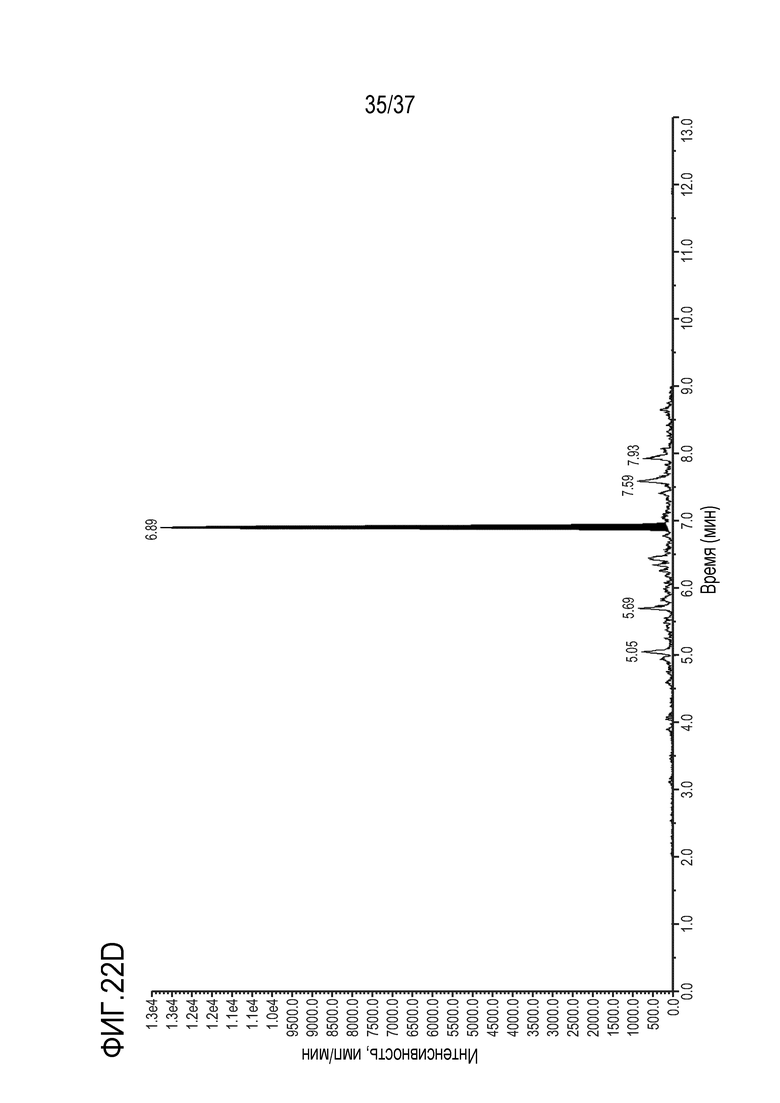

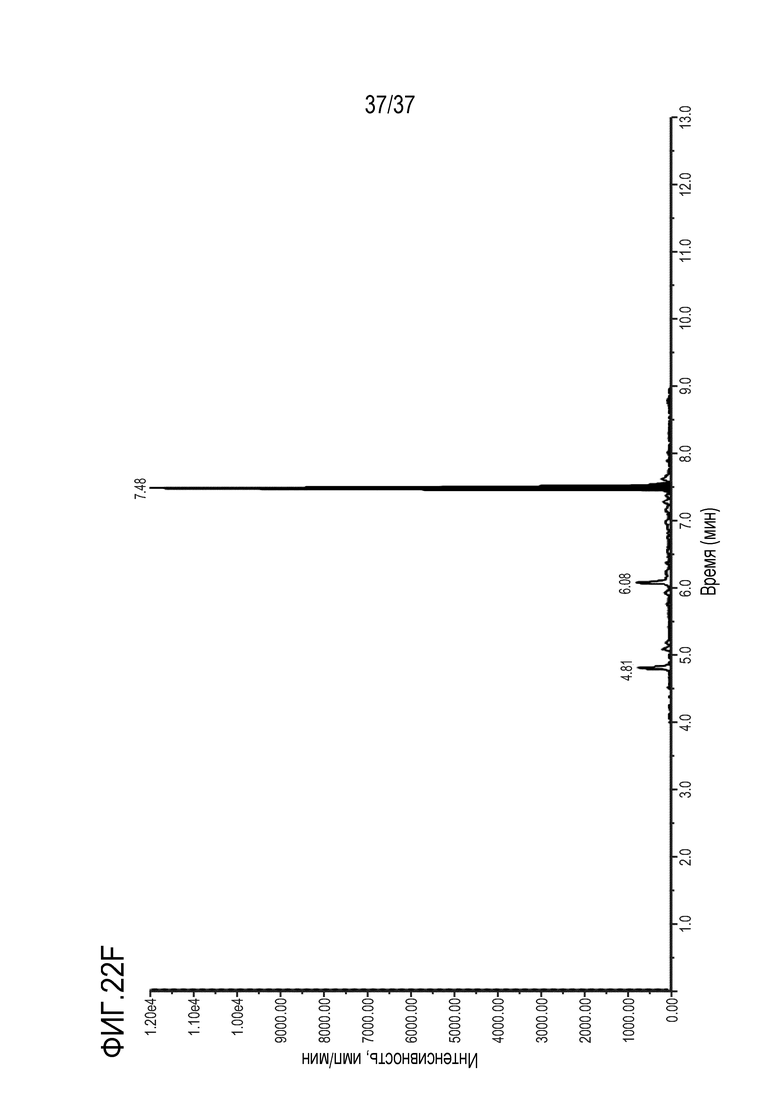
Изобретение относится к области биотехнологии и биохимии, конкретно к способу количественного определения содержания полипептида, содержащего участок константной области тяжелой цепи антитела, в образце с использованием масс-спектрометрии. Способ количественного определения содержания полипептида включает (а) расщепление образца, содержащего полипептид, включающий участок константной области тяжелой цепи антитела, содержащий сконструированную мутацию, и где в результате расщепления образуется пептидный фрагмент, полученный из константной области тяжелой цепи антитела, который имеет длину от 5 до 26 аминокислот и содержит сконструированную мутацию; и (b) анализ расщепленного образца масс-спектрометрией для определения количества пептидного фрагмента, тем самым определения количества полипептида, содержащего участок константной области тяжелой цепи антитела, в образце. Указанный способ можно использовать для количественного определения терапевтических белков как в образцах в доклинических исследованиях (т.е. полученных от видов животных), так и в образцах в клинических исследованиях (т.е. полученных от пациентов-людей). 39 з.п. ф-лы, 22 ил., 8 табл., 4 пр.
1. Способ количественного определения содержания полипептида, содержащего участок константной области тяжелой цепи антитела, в образце, включающий:
(а) расщепление образца, содержащего полипептид, включающий участок константной области тяжелой цепи антитела, где участок константной области тяжелой цепи антитела содержит сконструированную мутацию и где в результате расщепления образуется пептидный фрагмент, полученный из константной области тяжелой цепи антитела, который имеет длину от 5 до 26 аминокислот и содержит сконструированную мутацию; и
(b) анализ расщепленного образца масс-спектрометрией для определения количества пептидного фрагмента, посредством чего определяют количество полипептида, содержащего участок константной области тяжелой цепи антитела, в образце.
2. Способ по п.1, где пептидный фрагмент не содержит метионин (М) или цистеин (С).
3. Способ по п.1 или 2, где пептидный фрагмент не содержит аспарагин (N), за которым следует глицин (G) или серин (S).
4. Способ по любому из пп.1-3, дополнительно включающий очистку и концентрирование расщепленного образца перед масс-спектрометрическим анализом.
5. Способ по п.4, где расщепленный образец очищают и концентрируют посредством твердофазной экстракции (SPE).
6. Способ по п.4, где расщепленный образец очищают и концентрируют посредством SISCAPA (стабильные изотопные стандарты с захватом антипептидными антителами).
7. Способ по любому из пп.1-6, где образец представляет собой образец цельной крови, образец сыворотки, образец плазмы или образец ткани.
8. Способ по любому из пп.1-7, где образец отобран у мыши, примата, отличного от человека, или человека.
9. Способ по п.8, где примат, отличный от человека, представляет собой обезьяну cynomolgus или макаку-резус.
10. Способ по любому из пп.1-9, где образец расщепляют по меньшей мере одним ферментом.
11. Способ по п.9, где по меньшей мере один фермент представляет собой трипсин, химотрипсин, глутамилэндопептидазу, лизилэндопептидазу, Asp-N, Arg-C, Glu-C, цианогенбромид (CnBr) или их комбинации.
12. Способ по любому из пп.1-11, где масс-спектрометрия представляет собой жидкостную хроматографию-тандемную масс-спектрометрию (ЖХ-МС/МС).
13. Способ по любому из пп.1-12, где полипептид содержит домен CH1 и где домен CH1 включает сконструированную мутацию.
14. Способ по любому из пп.1-12, где полипептид содержит домен CH2 и где домен CH2 включает сконструированную мутацию.
15. Способ по любому из пп.1-12, где полипептид содержит домен СН3 и где домен СН3 включает сконструированную мутацию.
16. Способ по п.15, где сконструированная мутация в домене CH3 константной области тяжелой цепи антитела представляет собой T366Y, T366W, T366S, L368A, T394W, T394S, F405A, F405W, Y407T, Y407V или Y407A.
17. Способ по п.16, где сконструированная мутация в домене СН3 константной области тяжелой цепи антитела представляет собой Y407V и где домен СН3 содержит аминокислотную последовательность, представленную в SEQ ID NO: 6 (DGSFFLVS).
18. Способ по п.17, где в результате расщепления образуется пептидный фрагмент, содержащий аминокислотную последовательность TTPPVLDSDGSFFLVSK (SEQ ID NO: 7), DGSFFLVSKLTV (SEQ ID NO: 8) или GSFFLVSKLTVD (SEQ ID NO: 9).
19. Способ по п.18, где образец расщепляют трипсином и где в результате расщепления образуется пептидный фрагмент, состоящий из аминокислотной последовательности TTPPVLDSDGSFFLVSK (SEQ ID NO: 7).
20. Способ по п.18, где образец расщепляют Asp-N и где в результате расщепления образуется пептидный фрагмент, состоящий из аминокислотной последовательности DGSFFLVSKLTV (SEQ ID NO: 8).
21. Способ по п.18, где образец расщепляют Glu-C и в результате расщепления образуется пептидный фрагмент, состоящий из аминокислотной последовательности GSFFLVSKLTVD (SEQ ID NO: 9).
22. Способ по любому из пп.16-21, где полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO: 3 или SEQ ID NO: 4.
23. Способ по п.15, где сконструированной мутацией в домене СН3 константной области тяжелой цепи антитела является N434S.
24. Способ по п.23, где образец расщепляют Glu-C и трипсином и где в результате расщепления образуется пептидный фрагмент, состоящий из аминокислотной последовательности ALHSHYTQK (SEQ ID NO: 11).
25. Способ по п.23 или 24, где полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO: 2 или SEQ ID NO: 3.
26. Способ по любому из пп.1-5, где полипептид, содержащий участок константной области тяжелой цепи антитела, представляет собой антитело, Fc-слитый белок или иммуноадгезин.
27. Способ по п.26, где полипептид, содержащий участок константной области тяжелой цепи антитела, представляет собой антитело.
28. Способ по п.27, где антитело представляет собой терапевтическое антитело.
29. Способ по п.27 или 28, где антитело представляет собой химерное антитело, гуманизированное антитело или антитело человека.
30. Способ по любому из пп.27-29, где антитело представляет собой моноспецифическое антитело, биспецифическое антитело, триспецифическое антитело или мультиспецифическое антитело.
31. Способ по п.30, где антитело представляет собой триспецифическое антитело.
32. Способ по п.31, где триспецифическое антитело содержит четыре полипептидные цепи, которые образуют три антигенсвязывающих участка, которые специфически связывают одну или более антигенов-мишеней или белков-мишеней, где первый полипептид содержит структуру, представленную формулой: VL2-L1-VL1-L2-CL; вторая полипептидная цепь содержит структуру, представленную формулой: VH1-L3-VH2-L4-CH1-шарнирная область-CH2-CH3; третья полипептидная цепь содержит структуру, представленную формулой: VH3-CH1-шарнирная область-CH2-CH3; четвертая полипептидная цепь содержит структуру, представленную формулой: VL3-CL, где VL1 представляет первый вариабельный домен легкой цепи иммуноглобулина; VL2 представляет второй вариабельный домен легкой цепи иммуноглобулина; VL3 представляет третий вариабельный домен легкой цепи иммуноглобулина; VH1 представляет первый вариабельный домен тяжелой цепи иммуноглобулина; VH2 представляет второй вариабельный домен тяжелой цепи иммуноглобулина, VH3 представляет третий вариабельный домен тяжелой цепи иммуноглобулина; CL представляет константный домен легкой цепи иммуноглобулина; СН1 представляет константный домен тяжелой цепи иммуноглобулина СН1; и L1, L2, L3 и L4 представляют аминокислотные линкеры; где первый и второй полипептиды образуют пару легкая цепь-тяжелая цепь в ориентации крест-накрест и где вторая полипептидная цепь или третья полипептидная цепь содержит аминокислотную последовательность TTPPVLDSDGSFFLVSK (SEQ ID NO: 7), DGSFFLVSKLTV (SEQ ID NO: 8) или GSFFLVSKLTVD (SEQ ID NO: 9).
33. Способ по п.32, где первый полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO: 12; второй полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO: 13; третий полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO: 14, и четвертый полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO: 15.
34. Способ по любому из пп.27-33, где антитело конъюгировано с лекарственным средством или меткой.
35. Способ по п.34, где лекарственное средство выбрано из химиотерапевтического агента, цитотоксического агента или агента, ингибирующего рост.
36. Способ по п.35, где метка представляет собой радиоизотоп, флуоресцентный краситель или фермент.
37. Способ по любому из пп.27-36, где антитело представляет собой IgG антитело человека.
38. Способ по п.37, где IgG антитело представляет собой IgG1 антитело человека или IgG4 антитело человека.
39. Способ по любому из пп.27-32 и 34-38, где антитело связывается с A2AR, APRIL, ATPDазой, BAFF, BAFFR, BCMA, BlyS, BTK, BTLA, B7DC, B7H1, B7H4/VTCN1, B7H5, B7H6, B7H7, B7RP1, B7-4, C3, C5, CCL2/MCP-1, CCL3/MIP-1a, CCL4/MIP-1b, CCL5/RANTES, CCL7/MCP-3, CCL8/mcp-2, CCL11/эотаксином, CCL15/MIP-1d, CCL17/TARC, CCL19/MIP-3b, CCL20/MIP-3a, CCL21/MIP-2, CCL24/MPIF-2/эотаксином-2, CCL25/TECK, CCL26/эотаксином-3, CCR3, CCR4, CD3, CD19, CD20, CD23/FCER2, CD24, CD27, CD28, CD38, CD39, CD40, CD70, CD80/B7-1, CD86/B7-2, CD122, CD137/41BB, CD137L, CD152/CTLA4, CD154/CD40L, CD160, CD272, CD273/PDL2, CD274/PDL1, CD275/B7H2, CD276/B7H3, CD278/ICOS, CD279/PD-1, CDH1/E-кадгерином, хитиназой, CLEC9, CLEC91, CRTH2, CSF-1/M-CSF, CSF-2/GM-CSF, CSF-3/GCSF, CX3CL1/SCYD1, CXCL12/SDF1, CXCL13, CXCR3, DNGR-1, эктонуклеозидтрифосфатдифосфогидролазой 1, EGFR, ENTPD1, FCER1A, FCER1, FLAP, FOLH1, Gi24, GITR, GITRL, GM-CSF, Her2, HHLA2, HMGB1, HVEM, ICOSLG, IDO, IFNα, IgE, IGF1R, IL2Rbeta, IL1, IL1A, IL1B, IL1F10, IL2, IL4, IL4Ra, IL5, IL5R, IL6, IL7, IL7Ra, IL8, IL9, IL9R, IL10, rhIL10, IL12, IL13, IL13Ra1, IL13Ra2, IL15, IL17, IL17Rb/IL25, IL18, IL22, IL23, IL25, IL27, IL33, IL35, ITGB4/интегрином-b4, ITK, KIR, LAG3, LAMP1, лептином, LPFS2, MHC класса II, NCR3LG1, NKG2D, NTPDазой-1, OX40, OX40L, PD-1H, рецептором тромбоцитов, PROM1, S152, SISP1, SLC, SPG64, ST2/рецептором для IL33, STEAP2, киназой Syk, TACI, TDO, T14, TIGIT, TIM3, TLR, TLR2, TLR4, TLR5, TLR9, TMEF1, TNFa, TNFRSF7, Tp55, TREM1, TSLP/ IL7Ra, TSLPR, TWEAK, VEGF, VISTA, Vstm3, WUCAM или XCR/GPR5/CCXCR1.
40. Способ по любому из пп.1-39, где способ предназначен для применения в фармакокинетическом исследовании полипептида, содержащего константную область тяжелой цепи антитела у мыши, примата, отличного от человека, и человека.
| YIN Y | |||
| et al | |||
| "Precise quantification of mixtures of bispecific IgG produced in single host cells by liquid chromatography-Orbitrap high-resolution mass spectrometry", MAbs, 2016 Nov-Dec; V.8(8), P.1467-1476 | |||
| СРЕДСТВА И СПОСОБЫ ОПРЕДЕЛЕНИЯ КОЛИЧЕСТВА ПОЛИПЕПТИДА НЕЙРОТОКСИНА И ЕГО КАТАЛИТИЧЕСКОЙ И ПРОТЕОЛИТИЧЕСКОЙ АКТИВНОСТЕЙ | 2010 |
|
RU2545783C9 |
| SCHAEFER W | |||
| et al | |||
| "Heavy and light chain pairing of bivalent quadroma and knobs-into-holes antibodies analyzed | |||
Авторы
Даты
2022-10-27—Публикация
2019-01-11—Подача