Изобретение касается новых сульфонамидных производных формулы (I),
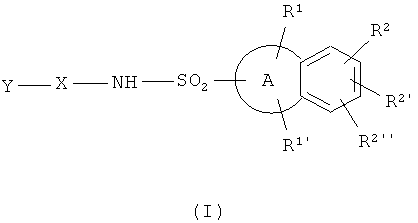
где
А представляет собой фенильное кольцо, либо гетероарильное кольцо, которое представляет собой моноциклическое ароматическое кольцо из 5 или 6 атомов, содержащее один или два гетероатома, выбранных из N, О и S, а остальные атомы кольца представляют собой С, или гетероциклическое кольцо, которое представляет собой неароматическое моноциклическое кольцо из 5 или 6 атомов, содержащее один или два гетероатома, выбранных из N и S(O)n (где n представляет собой целое число от 0 до 2), а остальные атомы кольца представляют собой С, причем один из углеродных атомов гетероциклического кольца необязательно может быть заменен карбонильной группой;
R1 и R1' независимо представляют собой водород, галогенную, нитро, циано, амино, C1-6 алкильную, гетероалкильную, С3-7 циклоалкильную, С2-6 алкенильную, С2-6 алкинильную, гидроксильную, C1-6 алкоксильную группы, -NR'R'', -(С0-6 алкилен)-NR'R'' группы, где R' и R'' независимо выбраны из группы, состоящей из водорода, C1-6 алкильной, гетероалкильной, формильной, С1-6 алкилкарбонильной, необязательно замещенной С3-7 циклоалкилкарбонильной, необязательно замещенной арилкарбонильной, необязательно замещенной гетероарилкарбонильной, необязательно замещенной гетероциклокарбонильной, C1-6 алкилсульфонильной, необязательно замещенной С3-7 циклоалкилсульфонильной, необязательно замещенной арилсульфонильной, необязательно замещенной гетероарилсульфонильной и необязательно замещенной гетероциклосульфонильной групп, или -(С0-6 алкилен)-OR', где R' представляет собой водород, C1-6 алкильную, гетероалкильную, формильную или C1-6 алкилкарбонильную группы, или R1' не присутствует, а присутствует только R1;
R2, R2' и R2'' независимо представляют собой водород, галоген, циано, нитро, амино-, моно- и ди-С1-6 алкил замещенные амино, C1-6 алкильные, С2-6 алкенильные, С2-6 алкинильные, гетероалкильные, гидрокси или C1-6 алкокси группы;
Х представляет собой фенилен, необязательно замещенный одним, двумя или тремя заместителями, независимо выбранными из группы, состоящей из галогена, циано, нитро, амино-, моно- и ди-С1-6 алкил замещенных амино, C1-6 алкильной, С2-6 алкенильной, С2-6 алкинильной, гетероалкильной, гидрокси, C1-6 алкокси, галоген-С1-6 алкильной, галоген C1-6 алкокси, гетероалкилокси, C1-6 алкилсульфонильной, C1-6 алкилсульфинильной, C1-6 алкилтио, C1-6 алкилсульфонил-С1-6 алкильной, C1-6 алкилсульфинил-С1-6 алкильной, C1-6 алкилтио-С1-6 алкильной, ацильной, формильной, C1-6 алкоксикарбонильной, гало С1-6 алкоксикарбонильной, гетероалкилоксикарбонильной и гетероалкилкарбонильной групп;
Y представляет собой необязательно замещенный гетероарил, где гетероарил представляет собой моноциклический ароматический радикал, содержащий 6 атомов в кольце, содержащий в кольце один или два гетероатома, выбранных из N(O)n (где n равно 0 или 1), О и S, а остальные атомы кольца представляют собой С, или
необязательно замещенный гетероциклил, где гетероциклил представляет собой неароматический моноциклический радикал, содержащий шесть атомов в кольце, содержащий в кольце один или два гетероатома, выбранных из N, О, или S(O)n (где n представляет собой целое число от 0 до 2), а остальные атомы кольца представляют собой С;
а также пролекарств и их фармацевтически приемлемых солей.
Кроме того, изобретение касается способа и интермедиатов для получения указанных выше соединений, фармацевтических препаратов, которые содержат такие соединения, применения этих соединений для производства фармацевтических препаратов, а также способа получения интермедиатов.
Соединения формулы (I) ингибируют химазу. Химаза представляет собой сериновую протеиназу с паттерном экспрессии, строго ограниченным субпопуляцией тучных клеток (МСТ тучные клетки). Химаза активируется только при активации и дегрануляции тучных клеток, что ограничивает активность фермента только МСТ положительными тканями. Химаза специфически расщепляет ряд патологически значимых субстратов (Raymond, W.W., S.W.Ruggles и др.; JBC 2003 278(36): 34517-34524), посредством чего данный фермент может активировать ангиотензин II, эндотелин, ТФР-b, ИЛ1, SCF (фактор стволовых клеток), коллагеназу и вызывать деградацию таких белков как тромбин, FN (фибронектин), АРО А1,2 (аполипротеин). Этот паттерн делает химазу привлекательной мишенью при аллергических, воспалительных и фиброзных заболеваниях. Действительно, ряд успешных исследований на животных с ингибиторами химазы продемонстрировали эффективность на животных с аллергией, при травмах сосудов и атеросклерозе (Doggrell SA, Wanstall JC Can J Physiol Pharmacol. Февраль 2005; 83(2): 123-30; Lindstedt KA, Kovanen PT. Curr Opin Lipidol. Октябрь 2004; 15(5):567-73; Reed CE, Kita H.J Allergy Clin Immunol. Ноябрь 2004; 114(5):997-1008; Takai S, et al,. Eur J Pharmacol, октябрь 2004 6; 501(1-3): 1-8; Takai S, et al, Trends Pharmacol Sci. октябрь 2004; 25(10):518-22; Takai S, Miyazaki M. Curr Vasc Pharmacol. Июнь 2003; l(2):217-24).
Таким образом, ингибирование химазы представляет собой полезный механизм при аллергии, астме, окклюзивных заболеваниях периферических артерий, критической ишемии конечностей (CLI), лечении пациентов с уязвимыми атеросклеротическими бляшками, нестабильной стенокардии, застойной сердечной недостаточности, гипертрофии левого желудочка, ишемической реперфузионной травме, кардиомиопатии, рестенозе, ревматоидном артрите, диабетической нефропатии, синдроме раздраженной толстой кишки, болезни Крона, заживлении ран (ожогов/язв у больных сахарным диабетом/CLI).
Настоящее изобретение предусматривает новые соединения формулы (I) в качестве ингибиторов химазы.
Если не указано иное, следующие определения приведены для иллюстрации и определения смысла и широты значения различных терминов, используемых для описания изобретения в настоящем документе.
Термин "галоген" или "гало" представляет собой фтор, хлор, бром и йод, причем предпочтительно фтор, хлор.
Термин "C1-6 алкил", отдельно или в комбинации с другими группами, представляет собой неразветвленный или разветвленный моновалентный алкильный радикал, включающий от одного до шести атомов углерода. Этот термин также можно проиллюстрировать такими радикалами, как метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил. C1-4 алкил является более предпочтительным.
Термин "галоген C1-6 алкил", отдельно или в комбинации с другими группами, представляет собой C1-6 алкил, в котором один или несколько атомов водорода заменены одинаковыми или различными галогенами, такой как -СН2Сl, -CH2CF3, трифторметил. В качестве галогенов, хлор, бром или фтор являются предпочтительными, и хлор или фтор являются более предпочтительными.
Термин "галоген C1-6 алкокси", отдельно или в комбинации с другими группами, представляет собой C1-6 алкокси группу, в которой один или несколько атомов водорода заменены одинаковыми или различными галогенами. В качестве галогенов предпочтительными являются хлор, бром или фтор, и хлор или фтор являются более предпочтительными.
Термин "ацил", отдельно или в комбинации с другими группами, представляет собой -CO-C1-6 алкил.
Термин "гетероалкил" представляет собой C1-6 алкил, замещенный одним или несколькими заместителями, независимо выбранными из группы, состоящей из нитро, гидрокси, галогенной, циано, C1-6 алкоксильной, формильной, C1-6 алкилкарбонильной, карбоксильной, C1-6 алкилтио, C1-6 алкилсульфинильной, C1-6 алкилсульфонильной, амино-, и моно-, и ди-С1-6 алкил замещенных амино групп. Этот термин можно также проиллюстрировать такими радикалами, как 2-гидроксиэтил, перфторметил.
Термин "С3-7 циклоалкил", отдельно или в комбинации с другими группами, представляет собой насыщенный моновалентный циклический углеводородный радикал, содержащий от трех до семи атомов углерода в кольце, например циклопропил, циклобутил, циклогексил.
Термин "C1-6 алкокси", отдельно или в комбинации с другими группами, представляет собой группу R'-O-, где R' представляет собой C1-6 алкил.
Термин "С2-6 алкенил", отдельно или в комбинации с другими группами, представляет собой неразветвленный или разветвленный углеводородный остаток, содержащий двойную связь, включающий от двух до шести атомов углерода, такой как, например, этенил, 2-пропенил.
Термин "С2-6-алкинил", отдельно или в комбинации с другими группами, представляет собой неразветвленный или разветвленный углеводородный остаток, содержащий тройную связь, включающий от двух до шести атомов углерода, такой как, например, этинил, 2-пропинил.
Термин "С0-6 алкилен" представляет собой связь, или неразветвленную, или разветвленную двухвалентную насыщенную алифатическую углеводородную группу, включающую от 1 до 6 атомов углерода. С0 алкилен представляет собой связь.
Термин "арил", отдельно или в комбинации с другими группами, представляет собой фенильную или нафтильную группы, предпочтительно фенильную группу.
Термин "гетероциклил", отдельно или в комбинации с другими группами, представляет собой неароматический моно- или бициклический радикал, включающий от трех до восьми атомов в кольце, где один или два атома кольца представляют собой гетероатомы, выбранные из N, О, или S(O)n (где n представляет собой целое число от 0 до 2), а остальные атомы кольца представляют собой С.
Термин "гетероарил" представляет собой моноциклический, либо бициклический радикал, включающий от 5 до 12 атомов в кольце, содержащий, по крайней мере, одно ароматическое кольцо, содержащий один, два или три гетероатома в кольце, выбранных из N, О и S, а остальные атомы кольца представляют собой С. Предпочтительно, гетероарильный радикал присоединен к соединению по ароматическому кольцу.
Термины "необязательно замещенных арил", "необязательно замещенный гетероарил", "необязательно замещенный гетероциклил" и "необязательно замещенный С3-7 циклоалкил" представляют собой, соответственно, арил, гетероарил, гетероциклил и С3-7 циклоалкил, необязательно замещенные одним или несколькими заместителями, независимо выбранными из группы, состоящей из галогена, нитро, циано, амино, C1-6 алкильной, С2-6 алкенильной, С2-6 алкинильной, гидрокси, C1-6 алкокси, гетероалкилокси, моно- и ди-С1-6 алкил замещенных амино, ацильной, формильной, гетероалкилкарбонильной, C1-6 алкоксикарбонильной, гетероалкилоксикарбонильной и гетероалкильной групп.
Предпочтительные радикалы для химических групп, определенных выше, приведены в примерах.
Соединения формулы (I) могут образовывать фармацевтически приемлемые соли присоединения (с кислотой). Примерами таких фармацевтически приемлемых солей являются соли соединений формулы (I) с физиологически совместимыми минеральными кислотами, такими как соляная кислота, серная кислота, сернистая кислота и фосфорная кислота, или с органическими кислотами, такими как метансульфоновая кислота, п-толуолсульфоновая кислота, уксусная кислота, молочная кислота, трифторуксусная кислота, лимонная кислота, фумаровая кислота, малеиновая кислота, винная кислота, янтарная кислота или салициловая кислота. Термин "фармацевтически приемлемая соль" относится к таким солям. Соединения формулы (I), в которых присутствует СООН группа, могут также образовывать соли с основаниями. Примерами таких солей являются соли щелочных, щелочноземельных металлов и соли аммония, такие как, например, Na-, K-, Са- и триметиламмонийная соли. Термин "фармацевтически приемлемая соль" также относится к таким солям. Соли присоединения кислоты, как описано выше, являются предпочтительными.
Термины "необязательный" или "необязательно" означают, что последующее описанное явление или обстоятельство может, однако, не обязательно, иметь место, и что описание включает случаи, когда явление или обстоятельство имеет место, и случаи, когда этого не происходит. Например, термин "арильная группа, необязательно замещенная алкильной группой" означает, что алкильная группа может, однако, не обязательно, присутствовать, и данное описание включает в себя ситуацию, когда арильная группа замещена алкильной группой, и ситуацию, когда арильная группа не замещена алкильной группой.
"Фармацевтически приемлемое вспомогательное вещество" представляет собой вспомогательное вещество, которое полезно при изготовлении фармацевтической композиции, которое полностью безопасно, нетоксично и не является нежелательным ни с биологической, ни с какой-либо другой точки зрения, и включает вспомогательные вещества, которые являются приемлемыми для ветеринарного применения, а также для фармацевтического применения для людей. Термин "фармацевтически приемлемое вспомогательное вещество", используемый в описании и формуле изобретения, включает как одно, так и несколько таких вспомогательных веществ.
Соединения, которые имеют одинаковую молекулярную формулу, но различаются по природе или последовательности связей их атомов, или расположению атомов в пространстве называются "изомеры". Изомеры, которые отличаются расположением атомов в пространстве, называются "стереоизомеры". Стереоизомеры, которые не являются зеркальными изображениями друг друга, называются "диастереомеры", и стереоизомеры, которые представляют собой несуперпозиционные зеркальные изображения друг друга, называются "энантиомеры". Если соединение имеет асимметрический центр, например, если атом углерода связан с четырьмя различными группами, возможно образование пары энантиомеров. Энантиомеры могут характеризоваться абсолютной конфигурацией их асимметрического центра, описываться с помощью R- и S- номенклатуры Кана, Ингольда и Прелога или характеризоваться тем, каким образом молекулы вращают плоскость поляризованного света, и обозначаться как правовращающие или левовращающие (т.е. как (+)- или (-)-изомеры соответственно). Хиральные соединения могут существовать в виде отдельных энантиомеров или в виде смесей. Смесь, содержащая энантиомеры в равных пропорциях, называется "рацемической смесью".
Соединения формулы (I) могут обладать одним или несколькими асимметрическими центрами. Если не указано иное, описание или название конкретного соединения в описании и формуле изобретения включают как оба индивидуальных энантиомера, так и их смеси, как рацемические, так и нет, а также отдельные эпимеры и их смеси. Методы для определения стереохимии и разделения стереоизомеров хорошо известны в уровне техники.
Хотя определения A, R1-R2'', Х и Y в широком смысле даны ранее, некоторые радикалы являются предпочтительными.
I) В соединении формулы (I), А предпочтительно представляет собой фенильное кольцо или гетероарильное кольцо. Гетероарильное кольцо А также предпочтительно представляет собой пятичленное кольцо.
II) В соединении формулы (I),
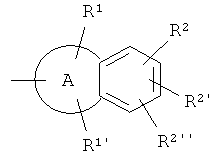
предпочтительно представляет собой,
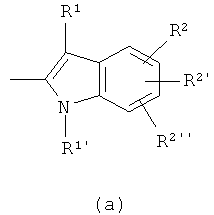 ,
,  или
или 
более предпочтительно

представляет собой
 ,
,  или
или 
в которых R1 и R1' независимо представляют собой водород или C1-6 алкил,
еще более предпочтительно

представляет собой
 ,
,  или
или 
в которых R2, R2' и R2'' независимо представляют собой водород или галоген.

особенно предпочтительно представляет собой
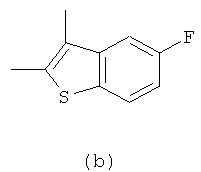
III) В соединении формулы (I), Y предпочтительно находится в пара-положении в фениленовой группе в качестве X, по отношению к -NH-SO2-группе.
IV) В соединении формулы (I), X предпочтительно представляет собой фенилен, необязательно замещенный одним, двумя или тремя заместителями, независимо выбранными из группы, состоящей из галогена, C1-6 алкильной, C1-6 алкокси, гало С1-6 алкильной, гало C1-6 алкокси, C1-6 алкилсульфонильной, C1-6 алкилсульфинильной, C1-6 алкилтио, C1-6 алкилсульфонил-С1-6 алкильной, C1-6 алкилсульфинил-С1-6 алкильной, C1-6 алкилтио- C1-6 алкильной и C1-6 алкоксикарбонильной групп; более предпочтительно Х представляет собой фенилен, замененный гало С1-6, алкильной или C1-6 алкилсульфонильной группами в орто-положении по отношению к -NH-SO2- группе, еще более предпочтительно Х представляет собой фенилен, замещенный трифторметильной или метилсульфонильной группами в орто-положении относительно -NH-SO2-группы.
V) В соединении формулы (I), Y предпочтительно представляет собой необязательно замещенный гетероарил, где гетероарил представляет собой моноциклический ароматический радикал, содержащий 6 атомов в кольце, содержащий один или два атома азота в кольце, а остальные атомы кольца представляют собой С, или необязательно замещенный гетероциклил, где гетероциклил представляет собой неароматический циклический монорадикал, содержащий 6 атомов в кольце, содержащий один или два атома азота в кольце, а остальные атомы кольца представляют собой С.
Более предпочтительно, Y представляет собой пиридил, пиримидинил или пиперидил, необязательно замещенные одним или двумя заместителями, независимо выбранными из группы, состоящей из галогена, C1-6 алкоксильной и C1-6 алкоксикарбонильной групп.
VI) Предпочтительно, соединение изобретения представляет собой соединение формулы (I), которое представляет собой (4-пиридин-4-ил-2-трифторметил-фенил)-амид 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты.
Соединения настоящего изобретения могут быть получены, например, с помощью общих методов синтеза, описанных ниже.
Общие методы синтеза
Схема 1
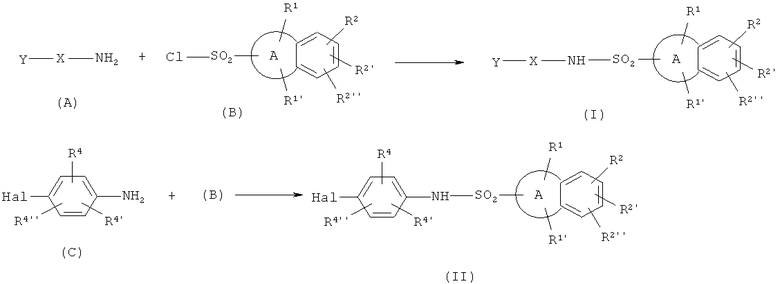
В схеме 1 A, R1-R2'', X, Y и Hal определены ранее. R4, R4' и R4'' независимо представляют собой водород, галоген, циано, нитро, амино-, моно- и ди- C1-6 алкил замещенные амино группы, C1-6 алкильную, С2-6 алкенильную, С2-6 алкинильную, гетероалкильную, гидрокси, C1-6 алкокси, гало C1-6 алкильную, гало С1-6 алкокси, гетероалкилокси, C1-6 алкилсульфонильную, C1-6 алкилсульфинильную, C1-6 алкилтио, C1-6 алкилсульфонил-С1-6 алкильную, C1-6-алкилсульфинил C1-6 алкильную, C1-6 алкилтио C1-6 алкильную, ацильную, формильную, C1-6 алкоксикарбонильную, гало C1-6 алкоксикарбонильную, гетероалкилоксикарбонильную или гетероалкилкарбонильную группы.
Соединения формул (I) и (II) преимущественно получали по реакции сульфонилхлорида (В) с амином (А) или с анилином (С) в присутствии основания. Основание предпочтительно представляет собой гидрид натрия или амин, выбранный из группы, состоящей из пиридина, пиколина, триэтиламина, диэтиламина, диизопропилэтиламина 4-N-диметиламинопиридина. Наиболее предпочтительными аминами являются пиридин и N,N-диметиламинопиридин (DMAP). Предпочтительными являются апротонные растворители, предпочтительно, выбранные из ацетонитрила, диоксана, метиленхлорида, тетрагидрофурана, толуола, диметоксиэтана, N,N-диметилацетамида, диметилсульфоксида, диметилформамида, и их комбинации. Предпочтительно, чтобы температура была в диапазоне от 0°С до 100°С.
С использованием соединения (II) в качестве интермедиата, соединения формулы (I) могут быть получены с помощью реакций образования С-С связи, таких как реакция Сузуки, в которой галогенид реагирует с соответствующим образом замещенным производным бороновой кислоты в присутствии основания и палладиевого катализатора.
Сульфонилхлориды (В) либо коммерчески доступны, либо могут быть синтезированы с использованием современных методов из нафталина, или бициклических гетероароматических соединений, или их производных. В частности, сульфонилхлоридная группа может быть введена с использованием реакции арил литиевой соли с диоксидом серы и последующего окисления/хлорирования с применением, например, сульфурилхлорида или N-хлорсукцинимида. Альтернативно, активированное положение ароматического кольца может прореагировать с хлорсульфоновой кислотой или с комплексом триоксида серы, таким как SO3·ДМФА или SO3·пиридин, с последующим хлорированием, например, с помощью тионилхлорида.
Анилины (А) либо представляют собой коммерчески доступные соединения, либо могут быть синтезированы с применением современных методов. Один из вариантов заключается в том, чтобы вводить галоидированные соединения (С) в реакции образования С-С связи, такие как реакция Сузуки, в которой галогенид реагирует с соответствующим образом замещенным производным бороновой кислоты в присутствии основания и палладиевого катализатора. Галоидированные производные анилина (С) либо коммерчески доступны, либо могут быть синтезированы с применением современных методов.
Как описано выше, соединения формулы (I) являются активными соединениями и ингибируют химазу. Следовательно, данные соединения препятствуют активации ангиотензина II, эндотелина, TGFb, IL1, SCF, коллагеназы и вызывают деградацию таких белков, как тромбин, FN, АРО А1,2. Поэтому они могут быть использованы для лечения и/или профилактики аллергических, воспалительных и/или фиброзных заболеваний, таких как аллергия, астма, окклюзивное заболевание периферических артерий, критическая ишемия конечностей (CLI), пациенты с уязвимыми атеросклеротическими бляшками, нестабильная стенокардия, застойная сердечная недостаточность, гипертрофия левого желудочка, ишемическая реперфузионная травма, удар, кардиомиопатия, рестеноз, ревматоидный артрит, диабетическая нефропатия, синдром раздраженной толстой кишки, болезнь Крона, атеротромбоз и/или ожоги/язвы у больных сахарным диабетом/CLI.
Предупреждение и/или лечение аллергических, воспалительных или фиброзных заболеваний, особенно атеротромбоза или астмы, представляют собой предпочтительное применение.
Изобретение также относится к фармацевтической композиции, включающей описанное выше соединение, а также фармацевтически приемлемое вспомогательное вещество.
Изобретение также охватывает соединения, как описано выше, для применения в качестве терапевтически активных веществ, особенно в качестве терапевтически активных веществ для лечения и/или профилактики аллергических, воспалительных и/или фиброзных заболеваний, таких как аллергия, астма, окклюзивное заболевание периферических артерий, критическая ишемия конечностей (CLI), пациенты с уязвимыми атеросклеротическими бляшками, нестабильная стенокардия, застойная сердечная недостаточность, гипертрофия левого желудочка, ишемическая реперфузионная травма, удар, кардиомиопатия, рестеноз, ревматоидный артрит, диабетическая нефропатия, синдром раздраженной толстой кишки, болезнь Крона, атеротромбоз и/или ожоги/язвы у больных сахарным диабетом/CLI.
Изобретение также относится к применению описанных выше соединений для получения лекарственных средств, предназначенных для терапевтического и/или профилактического лечения аллергических, воспалительных и/или фиброзных заболеваний, прежде всего для терапевтического и/или профилактического лечения аллергии, астмы, окклюзивного заболевания периферических артерий, критической ишемии конечностей (CLI), пациентов с уязвимыми атеросклеротическими бляшками, нестабильной стенокардией, застойной сердечной недостаточности, гипертрофии левого желудочка, ишемической реперфузионной травмы, удара, кардиомиопатии, рестеноза, ревматоидного артрита, диабетической нефропатии, синдрома раздраженной толстой кишки, болезни Крона, атеротромбоза и/или ожогов/язв у больных сахарным диабетом/CLI. Такие лекарственные средства включают соединения, как описано выше.
Изобретение также относится к способу получения и интермедиатам для получения соединений формулы (I), а также способу получения интермедиатов.
Ингибирование химазы соединениями настоящего изобретения может быть продемонстрировано с использованием пептидного субстрата, как описано в настоящем документе ниже.
Для химазы был выбран субстрат, содержащий пептид из 4 аминокислот AAPF, как стандартный субстрат для химотрипсиноподобного соединения (сукцинил-Аlа-Аlа-Рrо-Рhе-[7-амино-4-метилкумарин]; см. Lockhart BE, и др., "Recombinant human mast-cell chymase: an improved procedure for expression in Pichia pastoris and purification of the highly active enzyme." Biotechnol Appl Biochem., опубликованную в качестве немедленной публикации 26 мая 2004 года в виде рукописи ВА 20040074). Пептид был синтезирован с чистотой 95% (Bachem, Bubendorf, Switzerland). Химазу очищали из тучных клеток кожи человека, полученных из Calbiochem (Merck Biosciences, San Diego, California, USA). В тесте использовали 0,15 M NaCl, 0,05, трис-HCl, 0,05% CHAPS (3 -[(3-[холамидопропил)-диметиламмоний]-1-пропансульфонат) буфер, 0,1 мг/мл раствор гепарина (Гепарин натрий, Sigma, из слизистой оболочки кишечника свиней), 0,02 мМ раствор AAPF-субстрата, 1 нМ раствор химазы при рН 7,4. Анализ проводили в 96-ячеечных планшетах (Optiplate Packard), в объеме 0,05 мл при комнатной температуре. Активность химазы определяли по первоначальному темпу роста флуоресценции при 340/440 нм (возбуждение/излучение) свободного 7-амино-4-метилкумарина, отщепленного от субстрата. Ингибирование активности фермента ингибирующими соединениями измеряли после 30 минут преинкубации с химазой при комнатной температуре в буфере без AAPF-субстрата. Затем тест начинали добавлением указанной концентрации AAPF-субстрата.
Значения IC50 (полуингибирующая концентрация) активных соединений настоящего изобретения, предпочтительно составляют примерно от 1000 до 1 нМ, особенно предпочтительно, от 30 до 1 нМ.
Соединения формулы (I) и/или их фармацевтически приемлемые соли могут быть использованы в качестве лекарственных средств, например, в виде фармацевтических препаратов для энтерального, парентерального или местного введения. Они могут использоваться, например, перорально, например в виде таблеток, покрытых таблеток, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий, ректально, например в форме суппозиториев, парентерально, например в виде растворов для инъекций, или суспензий, или инфузионных растворов, либо местно, например в форме мазей, кремов и масел. Оральное введение является предпочтительным.
Производство фармацевтических препаратов может быть осуществлено, как известно специалистам в данной области техники, путем введения описанных соединений формулы (I) и/или их фармацевтически приемлемых солей, необязательно в сочетании с другими терапевтически ценными веществами, в галеновую форму вместе с подходящими, нетоксичными, инертными, терапевтически совместимыми твердыми или жидкими материалами-носителями и, при необходимости, с обычными фармацевтическими адъювантами.
Подходящие материалы-носители представляют собой не только неорганические материалы-носители, но также и органические материалы-носители. Так, например, в качестве материалов-носителей для таблеток, покрытых таблеток, драже и твердых желатиновых капсул могут быть использованы лактоза, кукурузный крахмал или их производные, тальк, стеариновая кислота и ее соли. Подходящие материалы-носители для мягких желатиновых капсул представляют собой, например, растительные масла, воски, жиры и полутвердые и жидкие полиолы (в случае мягких желатиновых капсул как формы введения, в зависимости от природы активного ингредиента, носители могут, однако, не потребоваться). Подходящие материалы-носители для производства сиропов и растворов представляют собой, например, воду, полиолы, сахарозу, инвертный сахар. Подходящие материалы-носители для инъекционных растворов представляют собой, например, воду, спирты, полиолы, глицерин и растительные масла. Подходящие материалы-носители для суппозиториев представляют собой, например, природные или отвердевшие масла (гидрированные), воски, жиры и полужидкие или жидкие полиолы. Подходящие материалы-носители для получения лекарственных форм для местного введения представляют собой глицериды, полусинтетические и синтетические глицериды, гидрогенизированные масла, жидкие воски, жидкие парафины, жидкие жирные спирты, стерины, полиэтиленгликоли и производные целлюлозы.
В качестве фармацевтических адъювантов можно использовать обычные стабилизаторы, консерванты, увлажняющие и эмульгирующие агенты, улучшающие консистенцию агенты, ароматизаторы, соли для изменения осмотического давления, буферные вещества, солюбилизаторы, красители, маскирующие агенты и антиоксиданты.
Дозировка соединений формулы (I) может варьироваться в широких пределах в зависимости от заболеваний, которые будут подвергаться лечению, возраста, индивидуального состояния пациента, режима введения, и, разумеется, должна быть определена индивидуально в каждом конкретном случае. Для взрослых пациентов ежедневная доза составляет от 1 до 1000 мг, особенно, приблизительно от 1 до 300 мг. В зависимости от тяжести заболевания и точного фармакокинетического профиля, соединение может быть введено в одной или нескольких дневных единичных дозированных формах, например в от 1 до 3 дневных единичных дозированных формах.
В лекарственных формах может содержаться около 1-500 мг, предпочтительно 1-100 мг, соединения формулы (I).
Примеры
Приведенные ниже примеры служат для более подробного иллюстрирования настоящего изобретения. Они, однако, никоим образом не ограничивают его.
Пример 1
(4-бром-2-трифторметил-фенил)-амид 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты
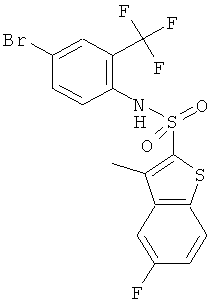
К охлаждаемому льдом раствору 4-бром-2-(трифторметил)бензамина (CAS 445-02-3, 18 г) в пиридине (25 мл) добавили 5-фтор-3-метилбензо[b]тиофен-2-сульфонилхлорид (CAS:404964-34-7, 2,0 г). Реакционную смесь перемешивали при комнатной температуре в течение 72 часов, сконцентрировали в вакууме, и остаток хроматографировали на силикагеле с использованием смеси гептан/хлороформ в качестве элюента с получением (4-бром-2-трифторметил-фенил)-амида 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты (2,35 г) в виде твердого бесцветного вещества. MS (ISN): 465,9, 468,0 (М-Н)-
Пример 2
(4-Пиридин-4-ил-2-трифторметил-фенил)-амид 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты
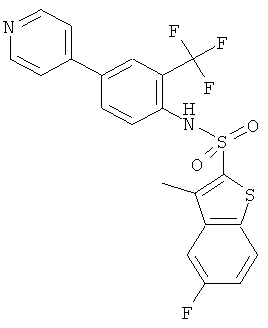
Суспензию (4-бром-2-трифторметил-фенил)-амида 5-фтор-3-метил-бензо[b] тиофен-2-сульфокислоты (0,5 г) и 4-пиридинбороновой кислоты (0,197 г) в 1,2-диметоксиэтане (6 мл), этаноле (2 мл) и 2 М водном растворе карбоната натрия (4,0 мл) дегазировали 3-4 раза для удаления кислорода, а затем к суспензии добавили тетракис(трифенилфосфин)палладий (0,065 г). Реакционную смесь перемешивали при 80°С в течение 3 часов, быстро разбавили смесью лед/вода и экстрагировали этилацетатом. Органические слои промыли, высушили и сконцентрировали. Остаток хроматографировали на силикагеле, используя смесь гептан/этилацетат в качестве элюента, с получением указанного соединения (0,35 г) в виде твердого желтоватого вещества. MS (ISP): 467,3 (М+Н)+
Пример 3
[4-(2,6-дифтор-пиридин-4-ил)-2-трифторметил-фенил]-амид 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты
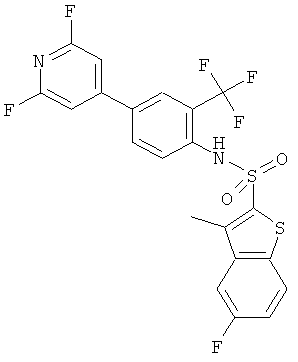
Данное соединение было получено по аналогии с Примером 2 из (4-бром-2-трифторметил-фенил)-амида 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты (0,12 г) и 2,6-дифторпиридин-4-бороновой кислоты (0,063 г) в 1,2-диметоксиэтане (1,5 мл), этиловом спирте (0,32 мл) и 2М водном растворе карбоната натрия (1,0 мл) с тетракис(трифенилфосфин)палладием (0,055 г). Указанное соединение было получено (0,055 г) в виде твердого коричневатого вещества. MS (ISP): 520,2 (M+NH4)+
Пример 4
[4-(3-фтор-пиридин-4-ил)-2-трифторметил-фенил]-амид 5-фтор-3-метил-бензо[b]тиофена-2-сульфокислоты
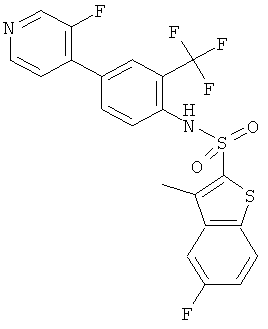
Данное соединение было получено по аналогии с Примером 2 из (4-бром-2-трифторметил-фенил)-амида 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты (0,12 г) и гидрата 3-фторпиридин-4-бороновой кислоты (0,061 г) в 1,2-диметоксиэтане (1,5 мл), этиловом спирте (0,32 мл) и 2М водном растворе карбоната натрия (1,0 мл) с тетракис(трифенилфосфин)палладием (0,050 г). Указанное соединение было получено (0,025 г) в виде желтоватой пены. MS (ISP): 485,3 (М+H)+
Пример 5
[4-(2-фтор-пиридин-4-ил)-2-трифторметил-фенил]-амид 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты
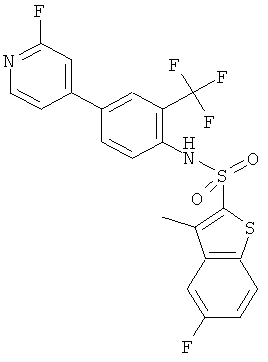
Данное соединение было получено по аналогии с Примером 2 из (4-бром-2-трифторметил-фенил)-амида 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты (0,12 г) и 2-фторпиридин-4-бороновой кислоты (0,072 г) в 1,2-диметоксиэтане (1,5 мл), этиловом спирте (0,32 мл) и 2М водном растворе карбоната натрия (1,0 мл) с тетракис(трифенилфосфин)палладием (0,065 г). Указанное соединение было получено (0,085 г) в виде бесцветной пены. MS (ISN): 483,4 (М-Н)-
Пример 6
(4-пиридин-3-ил-2-трифторметил-фенил)-амид 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты
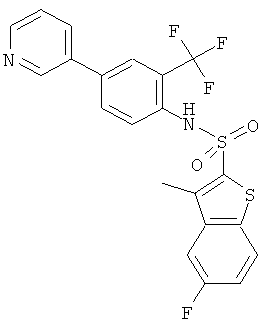
Данное соединение было получено по аналогии с Примером 2 из (4-бром-2-трифторметил-фенил)-амида 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты (0,10 г) и 3-пиридинбороновой кислоты (0,052 г) в 1,2-диметоксиэтане (1,5 мл), этиловом спирте (0,32 мл) и 2М водном растворе карбоната натрия (0,8 мл) с тетракис(трифенилфосфин)палладием (0,050 г). Указанное соединение было получено (0,086 г) в виде бесцветного твердого вещества. MS (ISP): 467,0 (М+Н)+
Пример 7
[4-(6-метокси-пиридин-3-ил)-2-трифторметил-фенил]-амид 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты
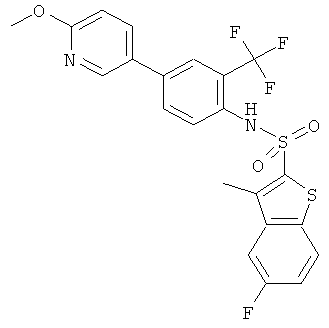
Данное соединение было получено по аналогии с Примером 2 из (4-бром-2-трифторметил-фенил)-амида 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты (0,10 г) и 2-метокси-5-пиридинбороновой кислоты (0,065 г) в 1,2-диметоксиэтане (1,5 мл), этиловом спирте (0,32 мл) и 2М водном растворе карбоната натрия (0,8 мл) с тетракис(трифенилфосфин)палладием (0,012 г). Указанное соединение было получено (0,081 г) в виде твердого бесцветного вещества. MS (ISP): 497,3 (М+Н)+
Пример 8
(4-пиримидин-5-ил-2-трифторметил-фенил)-амид 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты
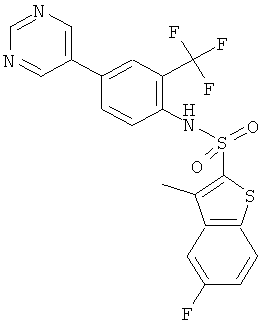
Данное соединение было получено по аналогии с Примером 2 из(4-бром-2-трифторметил-фенил)-амида 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты (0,10 г) и пиримидин-5-бороновой кислоты (0,053 г) в 1,2-диметоксиэтане (1,5 мл), этиловом спирте (0,32 мл) и 2М водном растворе карбоната натрия (0,8 мл) с тетракис(трифенилфосфин)палладием (0,012 г). Указанное соединение было получено (0,045 г) в виде твердого бесцветного вещества. MS (ISN): 466,1 (М-Н)-
Пример 9
[4-(2-метокси-пиримидин-5-ил)-2-трифторметил-фенил]-амид 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты
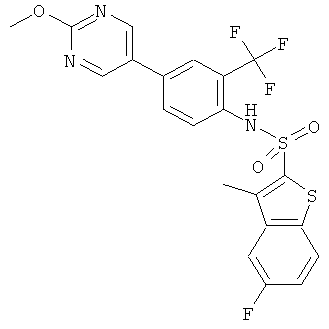
Данное соединение было получено по аналогии с Примером 2 из (4-бром-2-трифторметил-фенил)-амида 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты (0,10 г) и 2-метокси-5-пиримидинбороновой кислоты (0,066 г) в 1,2-диметоксиэтане (1,5 мл), этиловом спирте (0,32 мл) и 2М водном растворе карбоната натрия (1,0 мл) с тетракис(трифенилфосфин)палладием (0,012 г). Указанное соединение было получено (0,064 г) в виде твердого бесцветного вещества. MS (ISP): 498,4 (М+Н)+
Пример 10
[4-(5-фтор-пиридин-3-ил)-2-трифторметил-фенил]-амид 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты

Данное соединение было получено по аналогии с Примером 2 из (4-бром-2-трифторметил-фенил)-амида 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты (0,12 г) и 5-фторпиридин-3-бороновой кислоты (0,072 г) в 1,2-диметоксиэтане (1,5 мл), этиловом спирте (0,32 мл) и 2М водном растворе карбоната натрия (1,0 мл) с тетракис(трифенилфосфин)палладием (0,015 г). Указанное соединение было получено (0,065 г) в виде твердого бесцветного вещества. MS (ISP): 485,3 (М+Н)+
Пример 11
[4-(6-фтор-пиридин-3-ил)-2-трифторметил-фенил]-амид 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты
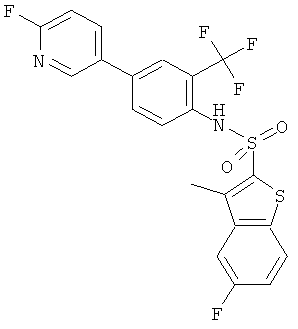
Данное соединение было получено по аналогии с Примером 2 из (4-бром-2-трифторметил-фенил)-амида 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты (0,12 г) и 2-фторпиридин-5-бороновой кислоты (0,072 г) в 1,2-диметоксиэтане (1,5 мл), этиловом спирте (0,32 мл) и 2М водном растворе карбоната натрия (1,0 мл) с тетракис(трифенилфосфин)палладием (0,015 г). Указанное соединение было получено (0,070 г) в виде твердого бесцветного вещества. MS (ISP): 485,3 (М+Н)+
Пример 12
[4-(1-окси-пиридин-4-ил)-2-трифторметил-фенил]-амид 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты
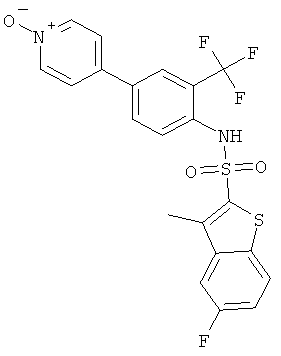
К раствору (4-пиридин-4-ил-2-трифторметил-фенил)-амида 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты (см. пример 2, 0,27 г) в хлороформе (5,0 мл) добавили 85% раствор м-хлорпероксибензойной кислоты (0,195 г). Реакционную смесь перемешивали при комнатной температуре в течение 4 часов и промыли раствором бикарбоната натрия. Органические фазы высушили над сульфатом магния и сконцентрировали. Остаток хроматографировали на колонке с силикагелем (10 г) с использованием смеси дихлорметан/метанол в качестве элюента с получением указанного соединения (0,065 г) в виде желтой пены. MS (ISP): 483,4 (M+H)+
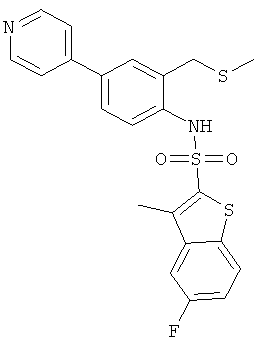
Пример 13
(2-метилсульфанилметил-4-пиридин-4-ил-фенил)-амид 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты
a) (4-бром-2-метилсульфанилметил-фенил)-амид 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты
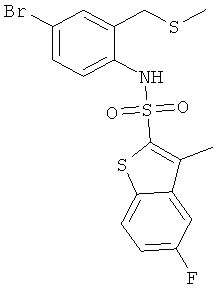
Данное соединение было получено по аналогии с Примером 1 из 4-бром-2-метилсульфанилметил-фениламина (Allen, David George; Eldred, Colin David; Judkins, Brian David; Mitchell, William Leonard, WO 9749699, 4,6 г) и 5-фтор-3-метилбензо[b]тиофен-2-сульфонилхлорида (1,06 г). Желаемое соединение было получено (1,3 г) в виде твердого коричневатого вещества. MS (ISN): 458,1, 460,0 (М-Н)-
b) (2-метилсульфанилметил-4-пиридин-4-ил-фенил)-амид 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты
Данное соединение было получено по аналогии с Примером 2 из (4-бром-2-метилсульфанилметил-фенил)-амида 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты (0,23 г) и 4-пиридинбороновой кислоты (0,092 г) в 1,2-диметоксиэтане (10 мл), этаноле (2 мл) и 2М водном растворе карбоната натрия (2 мл) с тетракис(трифенилфосфин)палладием (0,058 г). Указанное соединение было получено (0,153 г) в виде коричневой пены (0,153 г). MS (ISN): 457,2 (М-Н)-
Пример 14
(2-метансульфинилметил-4-пиридин-4-ил-фенил)-амид 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты
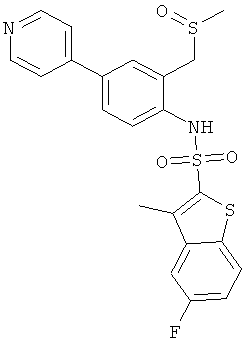
a) (4-бром-2-метансульфинилметил-фенил)-амид 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты
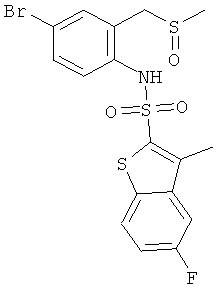
К раствору (4-бром-2-метилсульфанилметил-фенил)-амида 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты (0,46 г) (см. пример 13а) в хлороформе (25 мл) добавили 85% раствор м-хлорпероксибензойной кислоты (0,272 г). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов, сконцентрировали, и сырой остаток хроматографировали на силикагеле, с использованием смеси гептан/этилацетат в качестве элюента с получением желаемого соединения (0,31 г) в виде грязно-белого твердого вещества. MS (ISN): 473,9, 476,0 (М-Н)-
b) (4-бром-2-метансульфинилметил-фенил)-амид 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты
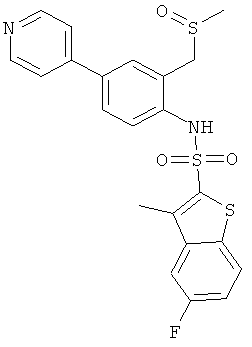
Данное соединение было получено по аналогии с Примером 2 из (4-бром-2-метансульфинилметил-фенил)-амида 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты (0,238 г) и 4-пиридинбороновой кислоты (0,092 г) в 1,2-диметоксиэтане (10 мл), этаноле (2 мл) и 2М водном растворе карбоната натрия (2 мл) с тетракис(трифенилфосфин)палладием (0,058 г). Указанное соединение было получено (0,077 г) в виде желтоватой пены. MS (ISN): 473,3 (М-Н)-
Пример 15
(2-метансульфонилметил-4-пиридин-4-ил-фенил)-амид 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты
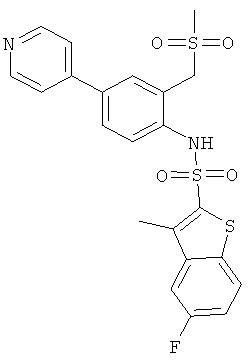
а) (4-бром-2-метансульфонилметил-фенил)-амид 5-фтор-3-метил-бензо[В]тиофен-2-сульфокислоты
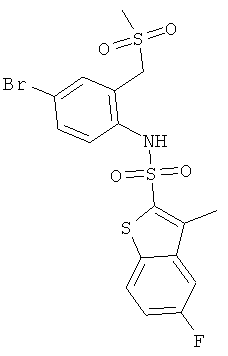
К раствору (4-бром-2-метилсульфанилметил-фенил)-амида 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты (0,46 г) (см. Пример 13а) в хлороформе (25 мл) добавили 85% раствор м-хлорпероксибензойной кислоты (0,272 г). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов, сконцентрировали, и сырой остаток хроматографировали на силикагеле с использованием смеси гептан/этилацетат в качестве элюента с получением желаемого соединения (0,138 г) в виде коричневатого твердого вещества. MS (ISN): 490,0, 492.0 (М-Н)-
b) (2-метансульфонилметил-4-пиридин-4-фенил-ил)-амид 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты
Данное соединение было получено по аналогии с Примером 2 из (4-бром-2-метансульфинилметил-фенил)-амида 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты (0,123 г) и 4-пиридинбороновой кислоты (0,0462 г) в 1,2-диметоксиэтане (5 мл), этаноле (1 мл) и 2М водном растворе карбоната натрия (2 мл) с тетракис(трифенилфосфин)палладием (0,035 г). Указанное соединение было получено (0,029 г) в виде желтоватой пены. MS (ISN): 489,1 (М-Н)-
Пример 16
(2-этил-4-пиридин-4-ил-фенил)-амид 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты
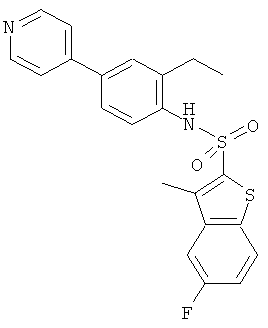
а) (4-бром-2-этил-фенил)-амид 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты
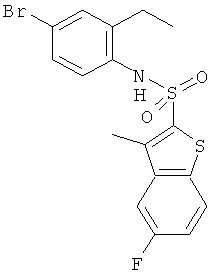
Данное соединение было получено по аналогии с Примером 1 из 4-бром-2-этиланилина (CAS: 45762-41-2, 2,0 г) и 5-фтор-3-метилбензо[b]тиофен-2-сульфонилхлорида (0,265 г) в пиридине (2,0 мл), реакцию проводили в течение 4 часов. Желаемое соединение было получено (0,20 г) в виде твердого бесцветного вещества. MS (ISP): 445,0, 447,0 (M+NH4)+
b) (2-этил-4-пиридин-4-ил-фенил)-амид 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты
Данный продукт был получен по аналогии с Примером 2 из (4-бром-2-этил-фенил)-амида 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты (0,10 г) и 4-пиридинбороновой кислоты (0,043 г) в 1,2-диметоксиэтане (1,5 мл), этиловом спирте (0,25 мл) и 2М водном растворе карбоната натрия (0,9 мл) с тетракис(трифенилфосфин)палладием (0,013 г). Указанное соединение было получено (0,025 г) в виде желтоватой пены. MS (ISP): 427,3 (М+Н)+
Пример 17
(4-бром-2-трифторметокси-фенил)-амид 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты
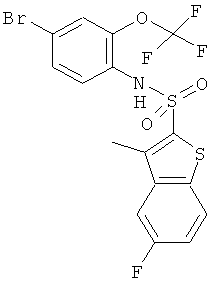
Данное соединение было получено по аналогии с Примером 1 из 4-бром-2-(трифторметокси)анилина (CAS: 175278-09-8, 2,82 г) и 5-фтор-3-метилбензо[b]тиофен-2-сульфонилхлорида (0,265 г) в пиридине (2,0 мл), реакцию проводили в течение 18 часов. Желаемое соединение было получено (0,12 г) в виде бесцветной пены. MS (ISP): 501,0, 503,0 (M+NH4)+
Пример 18
(4-пиридин-4-ил-2-трифторметокси-фенил)-амид 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты
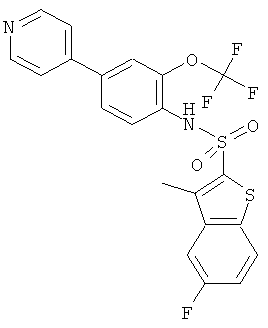
Данное соединение было получено по аналогии с примером 2 из (4-бром-2-трифторметокси-фенил)-амида 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты (0,075 г) и 4-пиридинбороновой кислоты (0,029 г) в 1,2-диметоксиэтане (1,5 мл), этиловом спирте (0,25 мл) и 2М водном растворе карбоната натрия (0,6 мл) с тетракис(трифенилфосфин)палладием (0,009 г). Указанное соединение было получено (0,055 г) в виде твердого бесцветного вещества. MS (ISP): 483,0 (М+Н)+

Пример 19
(4-пиридин-4-ил-фенил)-амид 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты
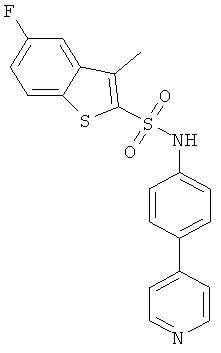
К раствору (4-пиридин-4-ил)анилина (CAS: 13296-04-3, 0,290 г) в дихлорметане (12,0 мл) добавили 5-фтор-3-метилбензо[b]тиофен-2-сульфонилхлорид (0,440 г) и DMAP (0.305 г). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч, разбавили дихлорметаном (12 мл) и хроматографировали на силикагеле с использованием смеси гептан/этилацетат в качестве элюента с получением указанного соединения (0,205 г) в виде грязно-белого твердого вещества. MS (ISN): 397,1 (М-Н)-
Пример 20
(2-метансульфонил-4-пиперидин-4-ил-фенил)-амид 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты гидрохлорид
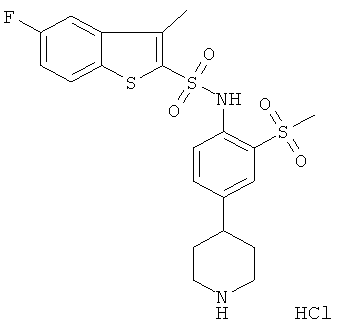
а) 4-(4-хлор-3-метансульфонил-фенил)-пиридин
1-Бром-4-хлорбензол (12,25 г) добавляли порциями к хлорсульфоновой кислоте (56 г) при 5-10°С. Полученную смесь нагревали до 130°С в течение 16 часов. После охлаждения реакционную смесь медленно добавили к хорошо перемешиваемой смеси льда с водой (500 мл), и смесь продолжали перемешивать в течение следующих 30 минут. Бесцветный осадок отделили путем фильтрации. Влажный осадок с фильтра сняли с помощью дихлорметана, смесь отделили от воды, и органические фазы высушили и выпарили до сухого состояния (14,1 г). Сухую смесь из 2 изомеров растворили в ТГФ (20 мл) и добавили к раствору сульфита натрия (15,3 г) в воде (100 мл). Реакция была экзотермическая и сопровождалась понижением рН. К смеси для поддержания температуры 20-30°С и рН приблизительно 9 добавили лед и концентрированную NaOH. Затем реакционную смесь перемешивали в течение ночи при комнатной температуре и рН 9, подкислили концентрированной HCl до рН 1 и охладили. Осадок отфильтровали, промыли холодной водой и высушивали над P2O5 при высоком вакууме в течение ночи для получения бесцветного производного сульфиновой кислоты (10,5 г). Эту кислоту растворили в ДМФА (100 мл), к раствору добавили метилйодид (13 г), а затем карбонат калия (14,0 г). Реакционную смесь перемешивали при комнатной температуре в течение ночи и сконцентрировали под высоким вакуумом. К остатку добавили воду и экстрагировали трет-бутилметиловым эфиром. Органические слои промыли, высушили и сконцентрировали. Остаток хроматографировали над силикагелем, используя смесь циклогексан/этилацетат в качестве элюента для получения метилсульфонильного производного (9,1 г), которое по-прежнему представляло собой смесь 2 изомеров. Эту смесь (9,0 г) растворили в диметоксиэтане (400 мл) и этаноле (90 мл), которые заместили 2М водным раствором карбоната натрия (200 мл). Реакционную смесь дегазировали несколько раз и добавили тетракис(трифенилфосфин)палладий (3,0 г). Смесь нагревали до 80°С в течение 16 часов и сконцентрировали до сухого состояния. Остаток растворили в смеси дихлорметан / вода, экстрагировали, высушили и сконцентрировали. Твердый остаток растворили в эфире, отфильтровали, промыли и высушили для получения требуемого соединения (5.54 г) в виде грязно-белых кристаллов. MS (EI): 267,1 (М)
b) Бензил-(2-метансульфонил-4-пиридин-4-ил-фенил)-амин
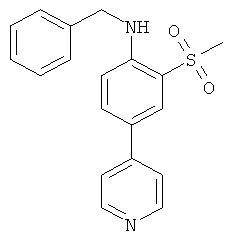
Суспензию 4-(4-хлор-3-метансульфонил-фенил)-пиридина (5,5 г) в бензиламине (23 мл) нагревали при 160°С в течение 4 часов, затем сконцентрировали под высоким вакуумом. Остаток разбавили смесью лед/вода и экстрагировали этилацетатом. Органические слои промыли, высушили и сконцентрировали, а остаток хроматографировали на силикагеле с использованием смеси гептан/этилацетат. Содержащие соединение фракции испарили, а остаток кристаллизовали из смеси метанол/эфир для получения требуемого соединения (5,75 г) в виде грязно-белого твердого вещества. MS (ISP): 339,1 (М+H)+
c) 2-Метансульфонил-4-пиридин-4-ил-фениламин
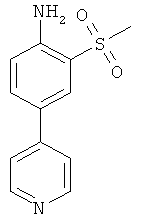
К раствору бензил-(2-метансульфонил-4-пиридин-4-ил-фенил)-амина (2,0 г) в смеси диоксан/метанол 1:1 (100 мл) добавили 2 н HCl (5 мл) и палладиевую чернь (1,0 г). Реакционную смесь гидрогенизировали при давлении 1,1 бар и комнатной температуре в течение 18 часов. Катализатор отфильтровали с помощью микрофильтра и промыли метанолом. Фильтрат испарили до сухого состояния для получения желаемого соединения (1,45 г) в виде твердого желтоватого вещества. MS (ISP): 249,1 (М+Н)+
d) 2-Метансульфонил-4-пиперидин-4-ил-фениламин; соединение с уксусной кислотой
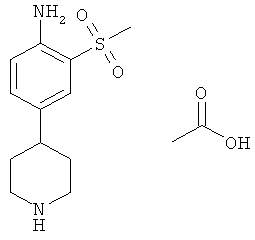
Суспензию 2-метансульфонил-4-пиридин-4-ил-фениламина (0,70 г) и окиси платины (0,70 г) в уксусной кислоте (15 мл) гидрогенизировали при давлении 1,1 бар и температуре 80°С в течение 8 часов. Реакционную смесь охладили до комнатной температуры, отфильтровали через микрофильтр, промыли уксусной кислотой и сконцентрировали до сухого состояния для получения указанного соединения (0,89 г) в виде светло-желтого аморфного порошка. MS (ISP): 255,4 (М+Н)+
e) Трет-бутиловый эфир 4-(4-амино-3-метансульфонил-фенил)-пиперидин-1-карбоновой кислоты
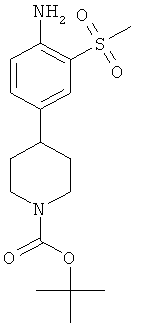
К раствору 2-метансульфонил-4-пиперидин-4-ил-фениламина в соединении с уксусной кислотой (1,5 г) в дихлорметане (30 мл) добавили ди-трет-бутилкарбонат (1,15 г) и насыщенный водный раствор карбоната натрия (10 мл). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов и экстрагировали дихлорметаном. Органические фазы высушили и сконцентрировали и остаток хроматографировали на силикагеле, используя смесь гептан/этилацетат в качестве элюента для получения желаемого соединения (0,64 г) в виде грязно-белого твердого вещества. MS (ISP): 355,1 (М+H)+
f) трет-бутиловый эфир 4-[4-(5-фтор-3-метил-бензо[b]тиофен-2-сульфониламино)-3-метансульфонил-фенил]-пиперидин-1-карбоновой кислоты
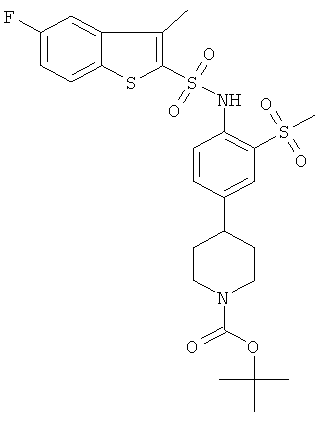
К охлаждаемой льдом суспензии гидрида натрия (60-65% в минеральном масле, 0,030 г) в абсолютном ДМСО (3 мл) добавили трет-бутиловый эфир 4-(4-амино-3-метансульфонил-фенил)-пиперидин-1-карбоновой кислоты (0,106 г). Смесь перемешивали при температуре 0-5°С в течение 30 минут, и к смеси по каплям добавили раствор 5-фтор-3-метилбензо[b]тиофен-2-сульфонилхлорида (0,237 г) в абсолютном ДМСО (1 мл). Реакционную смесь перемешивали при комнатной температуре в течение 5 часов, разбавили смесью лед/вода/1 н HCl и экстрагировали этилацетатом. Органические фазы промыли, высушили и сконцентрировали, а остаток хроматографировали на силикагеле, используя смесь гептан/этилацетат в качестве элюента для получения (0,025 г) метилбензо[b]тиофен-2-сульфонилхлорида (0,237 г). Требуемое соединение (0,025 г) было получено в виде желтоватой пены. MS (ISN): 581,3 (М-Н)-
g) гидрохлорид (2-метансульфонил-4-пиперидин-4-ил-фенил)-амида 5-фтор-3-метил-бензо[b]тиофена-2-сульфокислоты
Раствор трет-бутилового эфира 4-[4-(5-фтор-3-метил-бензо[b]тиофена-2-сульфониламино)-3-метансульфонил-фенил]-пиперидин-1-карбоновой кислоты (0,025 г) в этилацетате (1 мл) обработали смесью 2,5 н HCl/этилацетат (2 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов. К смеси добавили эфир (20 мл), осадок отфильтровали, промыли эфиром и высушили под высоким вакуумом над P2O5 для получения указанного соединения (0,020 г) в виде желтоватого порошка. MS (ISP): 483,3 (М+Н)+
Пример 21
(2-метансульфонил-4-пиперидин-4-ил-фенил)-амид 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты

Гидрохлорид (2-метансульфонил-4-пиперидин-4-ил-фенил)-амида 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты (см. Пример 20g, 6 мг) пропустили через ВЭЖХ - колонку со смесью ацетонитрил/вода/муравьиная кислота для получения указанного соединения (3 мг) в виде грязно-белой пены. MS (ISP): 483,3 (М+Н)+
Пример 22
(2-метансульфонил-4-пиридин-4-ил-фенил)-амид нафталин-2-сульфокислоты
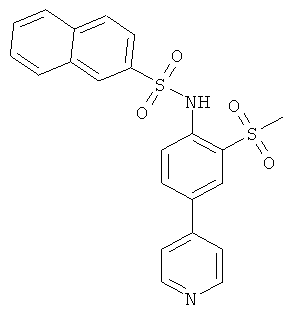
К раствору 2-метансульфонил-4-пиридин-4-ил-фениламина (см. Пример 20с, 0,046 г) в пиридине (0,5 мл) добавили нафталин-2-сульфохлорид (0,051 г). Реакционную смесь перемешивали при температуре 70°С в течение 6 часов, разбавили дихлорметаном и хроматографировали на силикагеле, используя смесь дихлорметан/метанол/аммиак, чтобы получить указанное соединение (0,025 г) в виде грязно-белого твердого вещества. MS (ISP): 439,1 (М+Н)+
Пример 23
(2-метансульфонил-4-пиридин-4-ил-фенил)-амид 5-фтор-3-метил-бензо[b]тиофен-2-сульфокислоты

Это соединение было получено по аналогии с соединением, описанным в Примере 20f, из 2-метансульфонил-4-пиридин-4-ил-фениламина (см. Пример 20с, 0,27 г) в тетрагидрофуране (10 мл) и 5-фтор-3-метилбензо[b]тиофен-2-сульфонилхлорида (0,265 г) в реакции с гидридом натрия (0,10 г), реакцию проводили при комнатной температуре в течение 18 часов с получением указанного соединения (0,025 г) в виде желтой пены. MS (ISN): 475,0 (М-Н)-
Пример 24
Трет-бутиловый эфир 4-[3-метансульфонил-4-(1-метил-1H-индол-2-сульфониламино)-фенил]-пиперидин-1-карбоновой кислоты

К раствору трет-бутилового эфира 4-(4-амино-3-метансульфонил-фенил)-пиперидин-1-карбоновой кислоты (см. Пример 20е, 0,050 г) в дихлорметане (2,0 мл) добавили 1-метил-1H-индол-2-сульфонил хлорид (0,036 г, ср. Chan, Ming Fai; Wu, Chengde; Raju, Bore Gowda; Kogan, Timothy; Kois, Adam; Verner, Erik Joel; Castillo, Rosario Silvestre; Yalamorri, Venkatachalapathi; Balaji, Vitukudi Narayanaiyengar, US 5962490) и DMAP (диметиламинопиридин) (0,021 г). Реакционную смесь перемешивали при температуре 80°С в течение 18 часов, охладили и непосредственно хроматографировали на силикагеле, используя смесь гептан/этилацетат в качестве элюента для получения указанного соединения (0,048 г) в виде желтоватой пены. MS (ISN): 546,5 (М-Н)-
Пример 25
Гидрохлорид (2-метансульфонил-4-пиперидин-4-ил-фенил)-амида 1-метил-1Н-индол-2-сульфокислоты
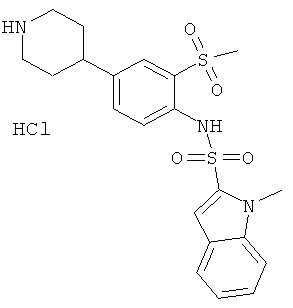
Раствор трет-бутилового эфира 4-[3-метансульфонил-4-(1-метил-1Н-индол-2-сульфониламино)-фенил]-пиперидин-1-карбоновой кислоты (0,038 г) обработали смесью 2,5 н HCl/этилацетат (2,5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов, затем к смеси добавили эфир (20 мл). Осадок собрали, промыли эфиром и высушили под высоким вакуумом над P2O5 с получением указанного соединения (0,032 г) в виде грязно-белого порошка. MS (ISN): 446,4 (М-Н)-
Пример 26
(2-метансульфонил-4-пиридин-4-ил-фенил)-амид 6-фтор-нафталин-2-сульфокислоты
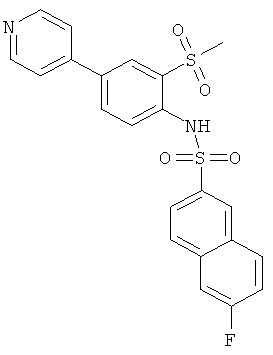
К раствору 2-метансульфонил-4-пиридин-4-ил-фениламина (см. Пример 20с, 0,27 г) и 6-фтор-нафталин-2-сульфонил хлорида (0,148 г, ср. Brown, George Robert; Stokes, Elaine Sophie Elisabeth; Waterson, David; Wood, Robin. WO 9706802) в дихлорметане (1,0 мл) добавили DMAP (0,037 г). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов и непосредственно хроматографировали на силикагеле, используя смесь гептан/этилацетат в качестве элюента с получением указанного соединения (0,098 г) в виде бесцветной пены. MS (ISP): 457,3 (M+H)+
Пример 27
Гидрохлорид (4-пиридин-4-ил-фенил)-амида 1Н-индол-2-сульфокислоты
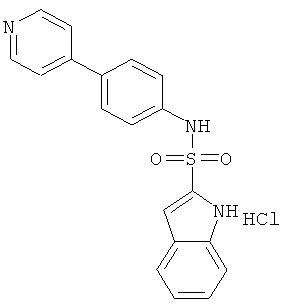
a) трет-бутиловый эфир 2-(4-пиридин-4-ил-фенилсульфамоил)-индол-1-карбоновой кислоты
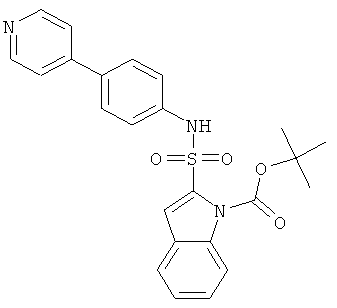
К раствору (4-пиридин-4-ил)анилина (CAS: 13296-04-3, 0,054 г) и трет-бутилового эфира 2-хлорсульфонил-индол-1-карбоновой кислоты (0,120 г, ср. Shankar, Bandarpalle В.; Gilbert, Eric; Rizvi, Razia К.; Huang, Chunli; Kozlowski, Joseph A.; McCombie, Stuart; Shih, Neng-Yang. WO 2006002133) в 1,2-дихлорэтане (5,0 мл) добавили DMAP (0,047 г). Реакционную смесь перемешивали при температуре 50°С в течение 3 часов и хроматографировали на силикагеле, используя смесь дихлорметан/этилацетат в качестве элюента для получения желаемого соединения (0,070 г) в виде бесцветного порошка. MS (ISP): 450,4 (M+H)+
b) гидрохлорид (4-пиридин-4-ил-фенил)-амида 1 Н-индол-2-сульфокислоты
К раствору трет-бутилового эфира 2-(4-пиридин-4-ил-фенилсульфамоил)-индол-1-карбоновой кислоты (0,030 г) в этилацетате (1,0 мл) добавили смесь 3,5 н HCl/этилацетат (2,0 мл). Реакционную смесь перемешивали при температуре 45°С в течение 8 часов, затем разбавили эфиром (40 мл). Осадок собрали, промыли эфиром и высушили под высоким вакуумом над P2O5 для получения указанного соединения (0,025 г) в виде бесцветного аморфного порошка. MS (ISP): 350,4 (М+H)+
Пример 28
Гидрохлорид (2-метансульфонил-4-пиперидин-4-ил-фенил)-амида 5-фтор-1-метил-1Н-индол-2-сульфокислоты
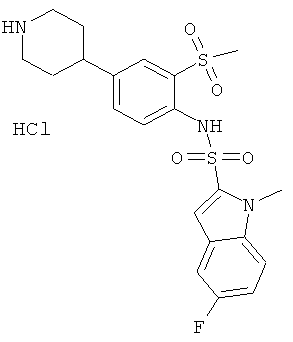
a) 5-фтор-1-метил-1Н-индол-2-сульфонил хлорид
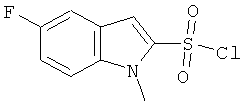
К раствору 1-метил-5-фториндола (CAS: 116176-92-2, 1,98 г) в абсолютном эфире (100 мл) при -78°С добавили по каплям трет-BuLi (1,7 н раствор в пентане, 12,4 мл). Реакционную смесь перемешивали при этой температуре в течение 60 минут, а затем над поверхностью растворителя пропускали диоксид серы до тех пор, пока не прекратилась экзотермическая реакция. Затем смесь перемешивали еще в течение 30 минут при комнатной температуре и сконцентрировали до сухого состояния. Сырой остаток суспендировали в дихлорметане (100 мл) и к смеси добавили NCS (К-хлорсукцинимид)(2,94 г). Реакционную смесь перемешивали при комнатной температуре в течение 4 часов, разбавили смесью лед/вода и экстрагировали дихлорметаном. Органические фазы промыли, высушили и сконцентрировали. Остаток хроматографировали на силикагеле, используя смесь гептан/этилацетат в качестве элюента для получения желаемого продукта (0.405 г) в виде твердого желтоватого вещества. MS (EI): 247,1 (М)
b) трет-бутиловый эфир 4-[4-(5-фтор-1-метил-1H-индол-2-сульфониламино)-3-фенил-метансульфонил]пиперидин-1-карбоновой кислоты

К раствору трет-бутилового эфира 4-(4-амино-3-метансульфонил-фенил)-пиперидин-1-карбоновой кислоты (см. Пример 24е, 0,048 г) в 1,2-дихлорэтане (3,0 мл) добавили 5-фтор-1-метил-1Н-индол-2-сульфонил хлорид (0,035 г) и DMAP (0.025 г). Реакционную смесь перемешивали при температуре 80°С в течение 72 часов, разбавили дихлорметаном (2 мл) и хроматографировали на силикагеле с использованием смеси дихлорметан/этилацетат в качестве элюента для получения указанного соединения (0.019 г) в виде грязно-белой пены. MS (ISN): 564,3 (М-Н)-
с) гидрохлорид (2-метансульфонил-4-пиперидин-4-фенил-ил)-амида 5-фтор-1-метил-1Н-индол-2-сульфокислоты
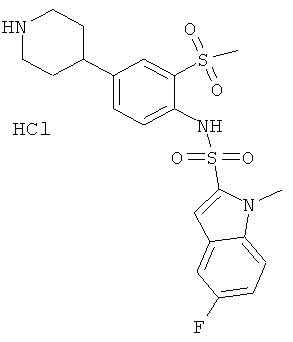
Раствор трет-бутилового эфира 4-[4-(5-фтор-1-метил-1Н-индол-2-сульфониламино)-3-фенил-метансульфонил]-пиперидин-1-карбоновой кислоты (0,019 г) обработали 2,5 н HCl/этилацетат (2,5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов, затем добавили эфир (20 мл). Осадок собрали, промыли эфиром и высушили под высоким вакуумом над Р2О5 с получением указанного соединения (0,014 г) в виде грязно-белого аморфного порошка. MS (ISN): 464,0 (М-Н)-
Пример 29
Гидрохлорид (4-пиридин-4-ил-2-трифторметил-фенил)-амида 5-фтор-3-метил-1Н-индол-2-сульфокислоты
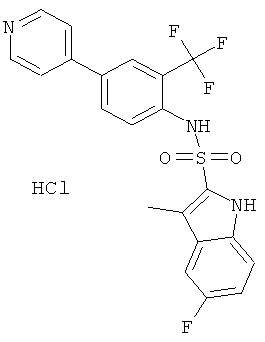
a) трет-бутиловый эфир 5-фтор-3-метил-индол-1-карбоновой кислоты
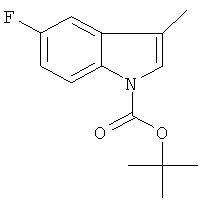
К раствору 5-фтор-3-метил-индола (CAS: 392-13-2, 2,5 г) в ТГФ (тетрагидрофуране) (25 мл) при температуре 0-5°С добавили ди-трет-бутилдикарбонат (4,02 г) и DMAP (0,205 г). Реакционную смесь перемешивали при комнатной температуре в течение 4 часов, сконцентрировали и остаток хроматографировали на силикагеле, используя смесь гептан/этилацетат в качестве элюента для получения желаемого соединения (3,15 г) в виде твердого бесцветного вещества. MS (ISP): 250,1 (М+Н)+
b) трет-бутиловый эфир 2-хлорсульфонил-5-фтор-3-метил-индол-1-карбоновой кислоты
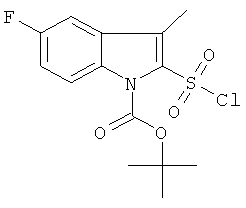
Это соединение было получено по аналогии с соединением Примера 28а из трет-бутилового эфира 5-фтор-3-метил-индол-1-карбоновой кислоты (1,0 г) в смеси диэтиловый эфир/THF 1: 2 (15 мл), 1,7 н раствора трет-BuLi (2,85 мл), SO2 (газ) и NCS (0,59 г). Указанное соединение было получено (0,80 г) в виде твердого бесцветного вещества. MS (EI): 347,2, 247,1 (М и М-Вос)
c) трет-бутиловый эфир 2-(4-бром-2-трифторметил-фенилсульфамоил)-5-фтор-3-метил-индол-1-карбоновой кислоты
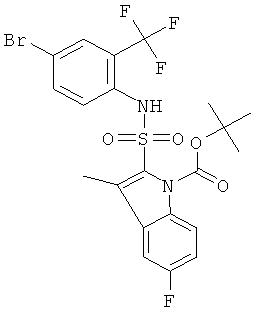
Это соединение было получено по аналогии с соединением Примера 1 из трет-бутилового эфира 2-хлорсульфонил-5-фтор-3-метил-индол-1-карбоновой кислоты (0,29 г) и 2-амино-5-бромбензотрифторида (2,0 г) в пиридине (5 мл) путем перемешивания в течение 7 дней при комнатной температуре. Указанное соединение (0,095 г) было получено в виде бесцветной пены. MS (ISN); 551,4, 549,3 (М-Н)-
d) трет-бутиловый эфир 5-фтор-3-метил-2-(4-пиридин-4-ил-2-трифторметил-фенилсульфамоил)-индол-1 -карбоновой кислоты
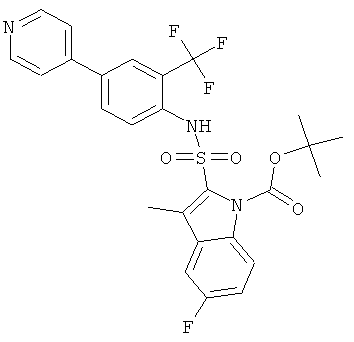
Это соединение было получено по аналогии с соединением Примера 2 из трет-бутилового эфира 2-(4-бром-2-трифторметил-фенилсульфамоил)-5-фтор-3-метил-индол-1-карбоновой кислоты (0,108 г), 4-пиридинбороновой кислоты (0,036 г) в 1,2-диметоксиэтане (5,0 мл), этаноле (0,4 мл) и 2 М водном растворе карбоната натрия (0,8 мл) с тетракис(трифенилфосфин)палладием (0,023 г). Желаемое соединение (0,058 г) было получено в виде коричневой пены. MS (ISN): 548,3 (М-Н)-
e) гидрохлорид (4-пиридин-4-ил-2-трифторметил-фенил)-амида 5-фтор-3-метил-1Н-индол-2-сульфокислоты
Это соединение было получено по аналогии с соединением Примера 27b из трет-бутилового эфира 5-фтор-3-метил-2-(4-пиридин-4-ил-2-трифторметил-фенилсульфамоил)-индол-1-карбоновой кислоты (0,052 г), 2,5 н HCl/этилацетат (10,0 мл). Указанное соединение (0,041 г) было получено в виде коричневого аморфного порошка. MS (ISN): 448.4 (М-Н)-
Пример 30
(4-пиридин-4-ил-2-трифторметил-фенил)-амид 5-фтор-1,3-диметил-1Н-индол-2-сульфокислоты
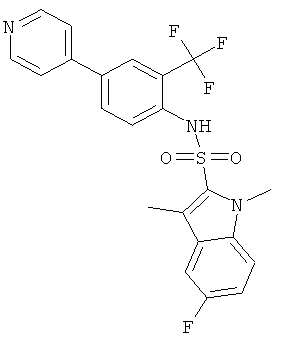
a) 5-фтор-1,3-диметил-1Н-индол
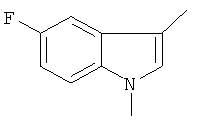
К раствору 5-фтор-3-метил-индола (CAS: 392-13-2, 2,5 г) в ДМФ (20 мл) добавили гидроксид калия (1,41 г). Суспензию перемешивали при комнатной температуре в течение 1 часа и к суспензии по каплям добавили иодметан (2,85 г) при температуре 0-5°С.Реакционную смесь перемешивали при комнатной температуре в течение 18 часов и сконцентрировали под высоким вакуумом. Остаток разбавили водой и экстрагировали этилацетатом. Органические фазы промыли, высушили и сконцентрировали. Сырой остаток хроматографировали на силикагеле с использованием смеси гептан/этилацетат в качестве элюента для получения желаемого соединения (2,15 г) в виде бесцветной жидкости. MS (EI): 163,1 (М)
b) 5-фтор-1,3-диметил-1Н-индол-2-сульфонил хлорид
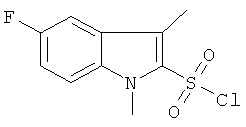
Это соединение было получено по аналогии с соединением Примера 28а из 5-фтор-1,3-диметил-1Н-индола (1,0 г) в смеси диэтиловый эфир/ТГФ 1: 2 (15 мл), 1,7 н раствора трет-BuLi (4,33 мл), SO2 (газ) и NCS (0. 90 г). Указанное соединение (0,27 г) было получено в виде твердого желтоватого вещества. MS (ISN): 241,9 (M-F)
c) (4-бром-2-трифторметил-фенил)-амид 5-фтор-1,3 -диметил-1Н-индол-2-сульфокислоты
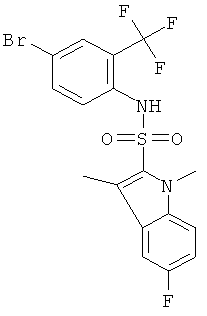
Это соединение было получено по аналогии с соединением Примера 1 из 5-фтор-1,3-диметил-1Н-индол-2-сульфонил хлорида (0,25 г) и 2-амино-5-бромбензотрифторида (2,3 г) в пиридине (5 мл), реакцию проводили в течение 18 часов при температуре 35°С. Указанное соединение (0,293 г) было получено в виде твердого желтого вещества. MS (ISN): 551,4, 549,3 (М-Н)-
d) (4-пиридин-4-ил-2-трифторметил-фенил)-амид 5-фтор-1,3-диметил-1Н-индол-2-сульфокислоты
Этот продукт был получен по аналогии с соединением Примера 2 из (4-бром-2-трифторметил-фенил)-амида 5-фтор-1,3-диметил-1Н-индол-2-сульфокислоты (0,100 г), 4-пиридинбороновой кислоты (0,040 г) в 1,2-диметоксиэтане (5,0 мл), этаноле (1,0 мл) и 2 М водном растворе карбоната натрия (1,0 мл) с тетракис(трифенилфосфин)палладием (0,025 г). Указанные соединения (0,058 г) были получены в виде коричневой пены. MS (ISN): 462,4 (М-Н)-
Пример 31
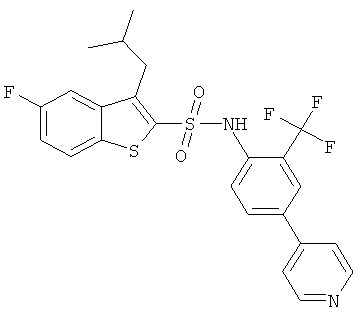
(4-пиридин-4-ил-2-трифторметил-фенил)-амид 5-фтор-3-изобутил-бензо[b]тиофен-2-сульфокислоты
a) 5-фтор-3-изобутил-бензо[b]тиофен
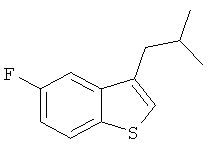
К раствору 3-бромметил-5-фторбензотиофена (2,0 г; см. Raga, Manuel; Palacin, Celia; Castello, Josep Maria; Ortiz, Jose A.; Cuberes, Maria Rosa; Moreno-Manas, Marcial, Eur. J. Med. Chem. (1986), 21(4), 329-32) в ТГФ (30 мл) добавляли в течение 5 минут изопропилмагний бромид (1,0 м, 16,6 мл). Реакционную смесь перемешивали при температуре 50°С в течение 5 часов, охладили, разбавили смесью лед/вода и раствором хлорида аммония и экстрагировали этилацетатом. Органические фазы промыли водой, высушили и сконцентрировали. Остаток хроматографировали на силикагеле с использованием смеси гептан/метиленхлорид в качестве элюента с получением указанного соединения (1,35 г) в виде желтоватого масла. MS (EI): 208,3 (М)
b) 5-фтор-3-изобутил-бензо[b]тиофен-2-сульфонил хлорид
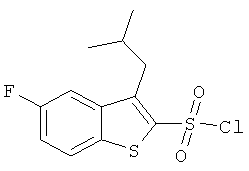
К раствору 5-фтор-3-изобутил-бензо[b]тиофена (0,55 г) в хлороформе (10 мл) добавили хлорсульфоновую кислоту (1,54 г) и полученную смесь перемешивали при комнатной температуре в течение 3 часов, разбавили смесью лед/вода и экстрагировали метиленхлоридом. Органические фазы промыли водой и водным раствором бикарбоната натрия, высушили и сконцентрировали. Остатки хроматографировали на силикагеле с использованием смеси гептан/этилацетат в качестве элюента с получением указанного соединения (0,49 г) в виде бесцветного масла. MS (EI): 306,8 (М)
c) (4-бром-2-трифторметил-фенил)-амид 5-фтор-3-изобутил-бензо[b]тиофен-2-сульфокислоты

Это соединение было получено аналогично соединению Примера 1 из 5-фтор-3-изобутил-бензо[b]тиофен-2-сульфонил хлорида (0,44 г), 2-амино-5-бромбензотрифторида (3,44 г) в пиридине (5 мл), реакцию проводили в течение 18 часов при комнатной температуре. Желаемое соединение (0,24 г) было получено в виде твердого бесцветного вещества. MS (ISN): 508,2, 510,3 (М-Н)-
d) (4-пиридин-4-ил-2-трифторметил-фенил)-амид 5-фтор-3-изобутил-бензо[b]тиофен-2-сульфокислоты
Это соединение было получено по аналогии с соединением Примера 2 из (4-бром-2-трифторметил-фенил)-амида 5-фтор-3-изобутил-бензо[b]тиофен-2-сульфокислоты (0,10 г) и 4-пиридинбороновой кислоты (0,036 г) в 1,2-диметоксиэтане (7 мл), этаноле (1 мл) и 2 М растворе карбоната натрия (2,0 мл) с тетракис(трифенилфосфин)палладием (0,027 г). Указанное соединение (0,47 г) было получено в виде твердого желтоватого вещества. MS (ISN): 507,1 (М-Н)-
Пример А
Покрытые оболочкой таблетки, содержащие следующие ингредиенты, могут быть изготовлены известными способами:
Активный ингредиент просеяли и смешали с микрокристаллической целлюлозой и смесь гранулировали с помощью раствора поливинилпирролидона в воде. Полученные гранулы смешивали с натрия крахмала гликолатом и стеаратом магния и спрессовывали с получением ядер массой 120 или 350 мг соответственно. Ядра покрывали оболочкой с помощью водного раствора/суспензии вышеупомянутой покрывающей пленки.
Пример В
Капсулы, содержащие следующие ингредиенты, могут быть изготовлены известными способами:
Эти компоненты просеяли и смешали, полученной смесью заполнили капсулы 2 размера.
Пример С
Раствор для инъекций может иметь следующую композицию:
Активное вещество растворяли в смеси полиэтилен гликоля 400 и воды для инъекций (частью воды). рН регулировали до 5,0 с помощью уксусной кислоты. Объем корректировали до 1,0 мл добавлением остаточного количества воды. Раствор фильтровали и заполняли им ампулы с приемлемым избытком и стерилизовали.
Пример D
Мягкие желатиновые капсулы, содержащие следующие ингредиенты, могут быть изготовлены известными способами:
Активный ингредиент растворили в теплом расплаве других ингредиентов и полученной смесью заполнили мягкие желатиновые капсулы соответствующих размеров. Заполненные мягкие желатиновые капсулы обрабатывали известными способами.
Пример Е
Саше, содержащие следующие ингредиенты, могут быть изготовлены известным способом:
Активные ингредиенты смешали с лактозой, микрокристаллической целлюлозой и натрий-карбоксиметилцеллюлозой и гранулировали с помощью смеси поливинилпирролидона и воды. Гранулят смешали со стеаратом магния и вкусовыми добавками и полученной смесью заполнили саше.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ИНДОЛКАРБОКСАМИДА | 2014 |
|
RU2673489C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ | 2014 |
|
RU2681849C2 |
| 2,5,6,7-ТЕТРАГИДРО-[1,4]ОКСАЗЕПИН-3-ИЛАМИНЫ ИЛИ 2,3,6,7-ТЕТРАГИДРО-[1,4]ОКСАЗЕПИН-5-ИЛАМИНЫ | 2011 |
|
RU2570796C2 |
| ЗАМЕЩЕННЫЕ ПИРАЗОЛЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ИНГИБИРОВАНИЯ АКТИВНОСТИ КАТЕПСИНА S | 2001 |
|
RU2278863C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛПИРИМИДИНА | 2005 |
|
RU2378277C2 |
| ПРОИЗВОДНЫЕ БЕНЗОДИАЗЕПИНА, ЛЕКАРСТВЕННОЕ СРЕДСТВО, СОДЕРЖАЩЕЕ ИХ, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2000 |
|
RU2257382C2 |
| ПРОИЗВОДНЫЕ ПИРИДИН-2-КАРБОКСАМИДА В КАЧЕСТВЕ АНТАГОНИСТОВ mGluR5 | 2006 |
|
RU2411237C2 |
| СПОСОБ ЛЕЧЕНИЯ АЛЛЕРГИИ С ИСПОЛЬЗОВАНИЕМ ЗАМЕЩЕННЫХ ПИРАЗОЛОВ | 2001 |
|
RU2259202C2 |
| СУЛЬФОНАМИДНЫЕ СОЕДИНЕНИЯ, ОБЛАДАЮЩИЕ АНТАГОНИСТИЧЕСКОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ TRPM8 | 2012 |
|
RU2563030C2 |
| ПРОИЗВОДНЫЕ 1-[М-КАРБОКСАМИДО(ГЕТЕРО)АРИЛ-МЕТИЛ]-ГЕТЕРОЦИКЛИЛ-КАРБОКСАМИДА | 2013 |
|
RU2644761C2 |
Изобретение относится к новым сульфонамидным производным формулы (I), где X представляет собой фенилен, необязательно замещенный одним, двумя или тремя заместителями, независимо выбранными из группы, состоящей из галогена, C1-6-алкила, C1-6-алкокси, галоген-C1-6-алкила, галоген-C1-6-алкокси, C1-6-алкилсульфонила, C1-6-алкилсульфинила, C1-6-алкилтиогруппы, C1-6-алкилсульфонил-C1-6-алкила, C1-6 -алкилсульфинил-C1-6-алкила, C1-6-алкилтио-C1-6-алкила и C1-6-алкоксикарбонила; Y представляет собой пиридил, пиримидинил или пиперидил, которые необязательно могут быть замещены одним или двумя заместителями, независимо выбранными из группы, содержащей галоген, C1-6-алкокси и C1-6-алкоксикарбонил; и его фармацевтически приемлемым солям. Сульфонамидные производные формулы (I) представляют собой ингибиторы химазы и применяются для получения фармацевтической композиции. Технический результат - сульфонамидные производные формулы (I) в качестве ингибитора химазы. 2 н. и 6 з.п. ф-лы, 36 пр.

где фрагмент  представляет собой
представляет собой 
1. Соединение формулы (I)
 ,
,
где фрагмент  представляет собой
представляет собой  ;
;
X представляет собой фенилен, необязательно замещенный одним, двумя или тремя заместителями, независимо выбранными из группы, состоящей из галогена, С1-6-алкила, С1-6-алкокси, галоген-С1-6-алкила, галоген-С1-6-алкокси, С1-6-алкилсульфонила, С1-6-алкилсульфинила, С1-6-алкилтиогруппы, С1-6-алкилсульфонил-С1-6-алкила, С1-6-алкилсульфинил- С1-6-алкила, С1-6-алкилтио-С1-6-алкила и С1-6-алкоксикарбонила;
Y представляет собой пиридил, пиримидинил или пиперидил, которые необязательно могут быть замещены одним или двумя заместителями, независимо выбранными из группы, содержащей галоген, С1-6-алкокси и С1-6-алкоксикарбонил;
и его фармацевтически приемлемые соли.
2. Соединение по п.1, в котором Y находится в пара-положении относительно -NH-SO2-группы, если X представляет собой фениленовую группу.
3. Соединение по п.1, в котором X представляет собой фенилен, замещенный галоген- С1-6-алкилом или С1-6-алкилсульфонилом в орто-положении относительно -NH-SO2-группы.
4. Соединение по п.1, в котором X представляет собой фенилен, замещенный трифторметилом или метилсульфонилом в орто-положении относительно -NH-SO2-группы.
5. Соединение по п.1, представляющее собой (4-пиридин-4-ил-2-трифторметилфенил)амид 5-фтор-3-метилбензо[b]тиофен-2-сульфокислоты.
6. Фармацевтические композиции, содержащие соединение по п.1 и фармацевтически приемлемое вспомогательное вещество, предназначенные для лечения, профилактики или лечения, и профилактики аллергических, воспалительных и/или фиброзных заболеваний, таких как аллергия, астма, окклюзивное заболевание периферических артерий, критическая ишемия конечностей (CLI), пациентов с уязвимыми атеросклеротическими бляшками, нестабильная стенокардия, застойная сердечная недостаточность, гипертрофия левого желудочка, ишемическая реперфузионная травма, удар, кардиомиопатия, рестеноз, ревматоидный артрит, диабетическая нефропатия, синдром раздраженной толстой кишки, болезнь Крона, атеротромбоз и/или ожоги/язвы у больных сахарным диабетом/СLI.
7. Соединение по п.1 для применения в качестве терапевтически активных веществ, предназначенных для лечения, профилактики или лечения, и профилактики аллергических, воспалительных и/или фиброзных заболеваний, таких как аллергия, астма, окклюзивное заболевание периферических артерий, критическая ишемия конечностей (CLI), пациентов с уязвимыми атеросклеротическими бляшками, нестабильная стенокардия, застойная сердечная недостаточность, гипертрофия левого желудочка, ишемическая реперфузионная травма, удар, кардиомиопатия, рестеноз, ревматоидный артрит, диабетическая нефропатия, синдром раздраженной толстой кишки, болезнь Крона, атеротромбоз и/или ожоги/язвы у больных сахарным диабетом/СLI.
8. Соединение по п.1 для применения в качестве терапевтически активных веществ для лечения и/или профилактики атеротромбоза или астмы.
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| BE 654017 А, 06.04.1965 | |||
| Dale S.Dhanoa et al.: "Serine Protease-Directed Small Molecule Probe Libraries", MEDICINAL CHEMISTRY RESEARCH, 1998, vol.8, №4/5, pp.187-205 | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
Авторы
Даты
2013-01-10—Публикация
2008-01-03—Подача