ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым гетероциклическим соединениям, к их применению для профилактики или лечения заболеваний, связанных с активацией белков STAT, особенно белка STAT3, и к включающим их фармацевтическим композициям.
УРОВЕНЬ ТЕХНИКИ
Белки трансдукторы сигналов и активаторы транскрипции (STAT) являются факторами транскрипции, которые передают сигналы от различных внеклеточных цитокинов и факторов роста к ядру. В настоящее время известны семь (7) подтипов белков STAT (то есть, STAT1, STAT2, STAT3, STAT4, STAT5a, STAT5b и STAT6), и в основном они состоят из приблизительно 750-850 аминокислот. Кроме того, каждый подтип белков STAT содержит несколько консервативных доменов, которые играют важную роль в осуществлении функции белков STAT. В частности, сообщалось о пяти (5) доменах от N-конца до C-конца белков STAT, включая домен coiled-coil, ДНК-связывающий домен, линкерный домен, домен SH2 и домен трансактивации (ТАD)). Кроме того, рентгеновские кристаллические структуры STAT1, STAT3, STAT4 и STAT5 были описаны с 1998 (Becker S et al., Nature, 1998, 394; Vinkemeier U et al., Science, 1998, 279; Chen X et al., Cell, 1998, 93; D. Neculai et al., J. Biol. Chem., 2005, 280). В общем, рецепторы, с которыми связываются цитокины и факторы роста, категоризированы в Класс I и Класс II. IL-2, IL-3, IL-5, IL-6, IL-12, G-CSF, GM-CSF, LIF, тромбопойетин и т.д. связываются с рецепторами Класса I, в то время как INF-α, INF-γ, IL-10 и т.д. связываются рецепторами Класса II (Schindler C et al., Annu. Rev. Biochem., 1995, 64; Novick D et al., Cell, 1994, 77; Ho AS et al., Proc. Natl. Acad. Sci., 1993, 90). Среди них рецепторы цитокина, участвующие в активации белков STAT, могут быть классифицированы в зависимости от их структурных форм внеклеточных доменов в семейство gp-130, семейство IL-2, семейство факторов роста, семейство интерферонов и семейство рецепторной тирозин киназы. Цитокины семейства Интерлейкина-6 являются репрезентативными многофункциональными цитокинами, которые опосредуют различные физиологические активности. Когда цитокин интерлейкин-6 связывается с рецептором IL-6, он вовлекает рецептор gp-130 в формирование комплекса IL-6-gp-130. В то же самое время, киназы JAK (JAK1, JAK2, JAK3 и Tyk2) в цитоплазме рекрутируются в цитоплазматическую область gp130, где фосфорилируются и активируются. Затем латентные цитоплазматические белки STAT привлекаются к рецептору, фосфорилируются киназами JAK и активируются. Тирозин-705 поблизости от домена SH2, локализованного на C-конце белков STAT, фосфорилируется, и активированный тирозин-705 каждого мономера белка STAT связывается с доменом SH2 другого мономера взаимным образом, таким образом формируя гомо- или гетеродимер. Димеры перемещаются в ядро и связываются со специфическим ДНК-связывающим промотором, промотируя транскрипцию. В рамках их транскрипционных процессов продуцируются различные белки (Myc, Cyclin D1/D2, Bcl-xL, Mcl, сюрвивин, VEGF, HIF-1, иммунные супрессоры и т.д.), связанные с пролиферацией, выживанием клеток, ангиогенезом и уклонением от иммуннологического надзора (Stark et al., Annu. Rev. Biochem., 1997, 67; Levy et al., Nat. Rev. Mol. Cell Biol., 2002, 3).
В частности, известно, что белок STAT3 играет критическую роль в остром воспалительном ответе и пути трансдукции сигнала IL-6 и EGF (Akira et al., Cell, 1994, 76; Zhong et al., Science, 1994, 264). Согласно недавнему клиническому отчету, белок STAT3 постоянно активирован у пациентов с солидными опухолями, возникающими в предстательной железе, желудке, молочной железе, легком, поджелудочной железе, почке, матке, яичнике, голове и шее и т.д., а также у пациентов с раком крови, таким как острый и хронический лейкоз, множественная миелома и т.д. Далее, сообщалось, что выживаемость в группе пациентов с активированным STAT3 существенно ниже, чем в группе пациентов с инактивированным STAT3 (Masuda et al., Cancer Res., 2002, 62; Benekli et al., Blood, 2002, 99; Yuichi et al., Int. J. Oncology, 2007, 30). Тем временем, STAT3 был идентифицирован как существенный фактор для роста и поддержания мышиных зародышевых стволовых клеток в исследовании, в котором использовали модель мыши с нокаутом по STAT3. Кроме того, исследование с тканеспецифичной STAT3-дефицитной моделью мыши, раскрывает, что STAT3 играет важную роль в росте клеток, апоптозе и подвижности клеток тканеспецифичным образом (Akira et al., Oncogene 2000, 19). Кроме того, так как апоптоз, вызываемый антисмысловым STAT3, наблюдался в различных линиях раковых клеток, STAT3 рассматривают как многообещающую новую противораковую мишень. STAT3 также рассматривают как потенциальную мишень в лечении пациентов с диабетом, иммуно-связанными заболеваниями, гепатитом C, дегенерацией желтого пятна, инфекцией папилломавируса человека, неходжкинской лимфомой, туберкулезом и т.д. Напротив, хотя STAT1 имеет пути внутриклеточного ответа цитокинов и факторов роста, идентичные таковым STAT3, STAT1 усиливает воспаление и врожденный и приобретенный иммунитет, ингибируя пролиферацию раковых клеток или вызывая проапоптотические ответы, в отличие от STAT3 (Valeria Poli et al., Review, Landes Bioscience, 2009).
Для разработки ингибиторов STAT3, можно рассмотреть следующие способы: i) ингибирование фосфорилирования белка STAT3 IL-6/gp-130/JAK киназой, ii) ингибирование димеризации активированного белка STAT3, и iii) ингибирование связывания димера STAT3 с ядерной ДНК. Малые молекулярные ингибиторы STAT3 находятся в настоящее время в процессе разработки. В частности, OPB-31121 и OPB-51602 находятся в фазе клинических исследований на пациентах с солидными опухолями или раком крови, проводимых Otsuka Pharmaceutical Co., Ltd. Далее, S3I-201 (Siddiquee et al., Proc. Natl. Acad. Sci., 2007, 104), S3I-M2001 (Siddiquee et al., Chem. Biol., 2007, 2), LLL-12 (Lin et al., Neoplasia, 2010, 12), Stattic (Schust et al., Chem. Biol. 2006, 13), STA-21 (Song et al., Proc. Natl. Acad. Sci., 2005, 102), SF-1-066 (Zhang et al., Biochem. Pharm., 2010, 79) и STX-0119 (Matsuno et al., ACS Med. Chem. Lett., 2010, 1) и т.д. были проверены в эксперименте на ингибирование роста раковых клеток и на модели животных (модель ксенотрансплантата в vivo). Кроме того, хотя пептидные соединения - миметики смежной аминокислотной последовательности pY-705 (STAT3), которая связывается с доменом SH2, или аминокислотной последовательности рецептора gp-130, которая связывается киназами JAK, были изучены (Coleman et al., J. Med. Chem., 2005, 48), разработка пептидных соединений не было успешным вследствие таких проблем как растворимость и мембранная проницаемость.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Соответственно, целью настоящего изобретения является получение новых гетероциклических производных для ингибирования активации белка STAT3.
Другой целью настоящего изобретения является применение гетероциклических производных для профилактики или лечения заболеваний, связанных с активацией белка STAT3.
В соответствии с одним аспектом, настоящее изобретение относится к соединению, выбранное из группы, состоящей из гетероциклического производного, представленного формулой (I), и его фармацевтически приемлемой соли и стереоизомера:
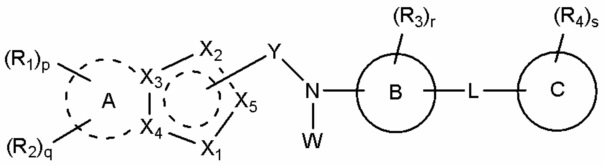 (I),
(I),
в которой
A присутствует или отсутствует, и, если он присутствует, A обозначает насыщенный или ненасыщенный C3-10 карбоцикл или 5-10-членный гетероцикл, и если A отсутствует, X3 и X4 каждый независимо в случае необходимости замещены R1 или R2;
B обозначает бензол или 5-12-членный гетероцикл;
C обозначает бензол, 5-12-членный гетероцикл или C3-6 карбоцикл;
Y обозначает -C(=O)-, связанный с X2 или X5;
X1 обозначает -O-, -S-, -S(=O)-, -S(=O)2- или -N(W1)-;
X2 обозначает атом углерода, связанный с Y, или -N=, -NH-, -C(W2)= или -CH(W2)-, не связанный с Y;
X3 и X4 каждый независимо обозначает атом углерода или азота;
X5 обозначает атом углерода, связанный с Y, или -CH=, не связанный с Y;
причем 5-членное кольцо, включающее X1-X5, является ароматическим или неароматическим;
W обозначает водород, галоген, C1-6 алкил или 5- или 6-членный гетероциклил-C1-3 алкил;
W1 обозначает водород, C1-6 алкил, C1-6 алкоксикарбонил или 5-8-членный гетероциклил-C1-4 алкил;
W2 обозначает водород, галоген, C1-6 алкил или 5-8-членный гетероциклил-C1-4 алкил;
L обозначает -(CR9R10)m-, -(CR9R10)m-O-, -NH-, -N(C1-6 алкил)-, -S(=O)2-, -C(=O)-, -C(=CH2)- или C3-7 циклоалкилен, причем m означает целое число от 0 до 3, и R9 и R10 обозначают, каждый независимо, водород, гидрокси, галоген или C1-6 алкил;
R1 обозначает нитро, амино, C1-6 алкилсульфонил, галогенC1-6 алкокси, или любую из следующих структурных формул i) - iv):
i)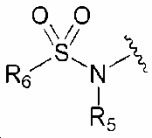 , ii)
, ii)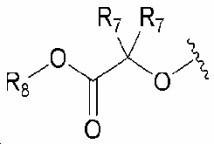 , iii)
, iii) 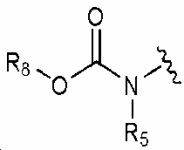 и iv)
и iv)  ;
;
R2 обозначает водород, галоген, нитро, амино, C1-6алкокси, галогенC1-6алкокси, C1-6 алкилсульфонил или 5- или 6-членный гетероциклоалкил;
R3 обозначает водород, галоген, циано, C1-6 алкил, галогенC1-6 алкил, цианоC1-6 алкил, C1-6 алкилкарбонил, C1-6 алкокси, галогенC1-6 алкокси, цианоC1-6 алкокси, C1-6 алкиламино, диC1-6 алкиламино, C1-6 алкилтио, C1-6 алкиламинокарбонил, диC1-6 алкиламинокарбонил, C2-8 алкинил, C6-10 арил, галогенC6-10 арил, 5-10-членный гетероциклил или 5-10-членный гетероциклилкарбонил, причем гетероциклильная часть может быть замещена одним-тремя заместителями, выбранными из группы, состоящей из галогена, гидрокси, циано, амино, C1-6 алкила, галогенC1-6 алкила, C1-6 алкокси и C1-6 алкоксикарбонила;
R4 обозначает водород, галоген, гидрокси, циано, нитро, амино, оксо, аминосульфонил, сульфониламидо, C1-6 алкиламино, C1-6 алкил, галогенC1-6 алкил, цианоC1-6 алкил, C1-6 алкокси, галогенC1-6 алкокси, цианоC1-6 алкокси, C3-8 циклоалкил-окси, C2-8 алкинил, C1-6 алкиламино-C1-6 алкокси, диC1-6 алкиламино-C1-6 алкокси, C1-6 алкокси-карбонил, карбамоил, карбамоил-C1-6 алкокси, C1-6 алкилтио, C1-6 алкилсульфинил, C1-6 алкилсульфонил, 5-10-членный гетероциклил, 5-10-членный гетероциклил-C1-6 алкил, 5-10-членный гетероциклил-C1-6 алкокси или 5-10-членный гетероциклил-окси, причем гетероциклильная часть может быть замещена одним или двумя заместителями, выбранными из группы, состоящей из гидрокси, оксо, C1-6 алкила, C1-6 алкилкарбонила, C1-6 алкоксикарбонила, C1-6 алкилсульфонила, диC1-3 алкилсульфонила, C1-6 алкилкарбонила, C1-6 алкиламинокарбонила, диC1-3 алкиламинокарбонила, C1-6 алкиламиносульфонила и незамещенного или C1-6 алкил-замещенного 5-10-членного гетероциклила;
R5 обозначает водород, C1-6 алкил, карбамоилC1-6 алкил, C1-6 алкиламиноC1-6 алкил, диC1-6 алкиламиноC1-6 алкил или 5-10-членный гетероциклилC1-6 алкил, или конденсирован с R6, образуя C3-4 алкилен;
R6 обозначает C1-6 алкил, галогенC1-6 алкил, C1-6 алкоксиC1-6 алкил, C1-6 алкилкарбонилC1-6 алкил, C2-7 алкенил, амино, аминоC1-6 алкил, C3-7 циклоалкил, 5-10-членный гетероциклил или 5-10-членный гетероциклил-C1-6 алкил, или конденсирован с R5, образуя C3-4 алкилен, причем аминогруппа может быть замещена одним или двумя заместителями, выбранными из гидрокси или C1-6 алкила, и гетероциклильная часть может быть замещена одним-четырьмя заместителями, выбранными из группы, состоящей из оксо, C1-6 алкила и C1-6 алкилкарбонила;
R7 и R8 обозначают, каждый независимо, водород или C1-6 алкил;
p и q означают, каждый независимо, 0 или 1;
r означает целое число от 0 до 3, и, когда r = 2 или больше, группы R3 являются одинаковыми или разными; и
s означает целое число от 0 до 3, и, когда s = 2 или больше, группы R4 являются одинаковыми или разными;
все указанные гетероциклические или гетероциклильные группы, каждая независимо, имеют насыщенное или ненасыщенное единственное кольцо или множество колец и содержат один-три гетероатома, выбранных из N, O или S; и
все указанные арильные группы, каждая независимо, имеют ароматическое единственное кольцо или множество колец.
В соответствии с другим аспектом, настоящее изобретение относится к применению соединения, выбранного из группы, состоящей из гетероциклического производного, представленного формулой (I), приведенной выше, и его фармацевтически приемлемой соли и стереоизомера, для получения лекарственного средства для профилактики или лечения заболеваний, связанных с активацией белка STAT3.
В соответствии с другим аспектом, настоящее изобретение относится к фармацевтической композиции для профилактики или лечения заболеваний, связанных с активацией белка STAT3, включающей соединение, выбранное из группы, состоящей из гетероциклического производного, представленного формулой (I), приведенной выше, и его фармацевтически приемлемой соли и стереоизомера в качестве активных ингредиентов.
В соответствии с другим аспектом, настоящее изобретение относится к способу профилактики или лечения заболеваний, связанных с активацией белка STAT3, у млекопитающего, который включает введение млекопитающему соединения, выбранного из группы, состоящей из гетероциклического производного, представленного формулой (I), приведенной выше, и его фармацевтически приемлемой соли и стереоизомера.
Гетероциклическое производное, представленное формулой (I), приведенной выше, или его фармацевтически приемлемая соль или стереоизомер имеет превосходное ингибирующее действие на активацию белка STAT3, и таким образом, оно может использоваться для профилактики или лечения заболеваний, связанных с активацией белка STAT3.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение будет подробно описано ниже.
В описании настоящего изобретения термин "галоген" относится к фтору, хлору, брому или йоду, если не указано иное.
Термин "алкил" относится к прямому или разветвленному углеводородному остатку, если не указано иное.
Термины “галогеналкил", "галогеналкокси", "галогенфенил” и т.д., соответственно, относятся к алкилу, алкокси и фенилу, замещенным по меньшей мере одним галогеном.
Термин “карбоцикл” относится к ароматическому или неароматическому углеводородному кольцу, которое может быть насыщенным или ненасыщенным, и моноциклическому или полициклическому радикалу.
Термин “карбоциклил” относится к “карбоциклическому” радикалу и используется как термин, включающий "циклоалкил" и "арил".
Термин "циклоалкил" относится к насыщенному углеводородному радикалу, который может быть моноциклическим или полициклическим.
Термин "арил" относится к ароматическому углеводородному кольцу, которое может быть моноциклическим или полициклическим.
Термины “карбоцикл", "карбоциклил", "циклоалкил" и "арил" могут относиться к, например, моно- или полициклу, имеющему 3-20 атомов углерода, и обозначаются как “C3-20 карбоцикл”, “C3-20 карбоциклил”, “C3-20 циклоалкил” и “C3-20 арил”, соответственно.
Термин "гетероцикл" относится к ароматическому или неароматическому кольцу, имеющему по меньшей мере один гетероатом, который может быть насыщенным или ненасыщенным и моноциклическим или полициклическим.
Термин “гетероциклил” относится к "гетероциклическому" радикалу, который используется как термин, включающий “гетероциклоалкил” и "гетероарил".
Термин “гетероциклоалкил” относится к насыщенному кольцевому радикалу, имеющему по меньшей мере один гетероатом, который может быть моноциклическим или полициклическим.
Термин "гетероарил" относится к ароматическому кольцевому радикалу, имеющему по меньшей мере один гетероатом, который может быть моноциклическим или полициклическим.
Термин "гетероатом" может быть выбран из N, O и S.
Термины "гетероцикл", "гетероциклил", "гетероциклоалкил” и "гетероарил" могут относиться к, например, моно- или полициклу, имеющему 3-20 гетероатомов и/или атомов углерода, и обозначаются как “3-20-членный гетероцикл”, “3-20-членный гетероциклил”, “3-20-членный гетероциклоалкил” и “3-20-членный гетероарил”.
Согласно варианту осуществления соединения формулы (I), заместители могут быть определены следующим образом (определение I):
A обозначает насыщенный или ненасыщенный C3-10 карбоцикл или 5-10-членный гетероцикл, содержащий один-три гетероатома, выбранных из N, O или S;
B обозначает бензол или 5-12-членный гетероцикл, содержащий один-три атома N;
C обозначает бензол или 5-12-членный гетероцикл, содержащий один-три гетероатома, выбранных из N, O или S;
Y обозначает -C (=O)-, связанный с X5;
X1 обозначает -O-, -S-, -S(=O)-, -S(=O)2- или -N(W1)-;
X2 обозначает -N=, -C(W2)= или -CH(W2)-, не связанный с Y;
X3 и X4 обозначают атом углерода;
X5 обозначает атом углерода, связанный с Y;
причем 5-членное кольцо, включающее X1-X5, является ароматическим или неароматическим;
W обозначает водород, галоген или C1-6 алкил;
W1 обозначает водород, C1-6 алкил, C1-6 алкоксикарбонил или 5-8-членный гетероциклоалкил-C1-4 алкил, содержащий один или два гетероатома, выбранных из N или O;
W2 обозначает водород, C1-6 алкил или 5-8-членный гетероциклоалкил-C1-4 алкил, содержащий один или два гетероатома, выбранных из N или O;
L обозначает -(CR9R10)m-, -(CR9R10)m-O-, -NH-, -N(C1-6 алкил)-, -S(=O)2-, -C(=O)-, -C(=CH2)- или C3-7 циклоалкилен, причем m означает целое число от 0 до 3, и R9 и R10 обозначают, каждый независимо, водород, гидрокси, галоген или C1-6 алкил;
R1 обозначает нитро, амино, C1-6 алкилсульфонил, галогенC1-6 алкокси или любую из следующих структурных формул i) - iv):
i) , ii)
, ii) , iii)
, iii)  и iv)
и iv)  ;
;
R2 обозначает водород, галоген, C1-6 алкокси, галогенC1-6 алкокси или C1-6 алкилсульфонил;
R3 обозначает водород, галоген, циано, C1-6 алкил, галогенC1-6 алкил, цианоC1-6 алкил, C1-6 алкилкарбонил, C1-6 алкокси, галогенC1-6 алкокси, цианоC1-6 алкокси, C1-6 алкиламино, диC1-6 алкиламино, C1-6 алкилтио, C1-6 алкиламинокарбонил, диC1-6 алкиламинокарбонил, C2-8 алкинил, C6-10 арил, 5-10-членный гетероарил, содержащий один или два гетероатома, выбранных из N или S, 5-10-членный гетероциклоалкил, содержащий один или два гетероатома, выбранных из N или O, или 5-10-членный гетероциклоалкил-карбонил, содержащий один или два гетероатома, выбранных из N или O;
R4 обозначает водород, галоген, гидрокси, циано, нитро, амино, оксо, аминосульфонил, сульфониламидо, C1-6 алкиламино, C1-6 алкил, галогенC1-6 алкил, цианоC1-6 алкил, C1-6 алкокси, галогенC1-6 алкокси, цианоC1-6 алкокси, C3-8 циклоалкил-окси, C2-8алкинил, C1-6 алкиламино-C1-6 алкокси, C1-6 алкоксикарбонил, карбамоил, карбамоил-C1-6 алкокси, C1-6 алкилтио, C1-6 алкилсульфонил, 5-10-членный гетероциклил-C1-6 алкил, содержащий один или два гетероатома, выбранных из N или O, 5-10-членный гетероциклил-C1-6 алкокси, содержащий один или два гетероатома, выбранных из N или O, или 5-10-членный гетероциклил-окси, содержащий один или два гетероатома, выбранных из N или O, причем гетероциклильная часть может быть замещена одним или двумя заместителями, выбранными из группы, состоящей из гидрокси, C1-6 алкоксикарбонила, C1-6 алкилсульфонила, C1-6 алкилкарбонила, C1-6 алкиламинокарбонила, C1-6 алкиламиносульфонила и незамещенного или C1-6 алкил-замещенного 5-10-членного гетероциклила, содержащего один или два гетероатома, выбранных из N, O или S;
R5 обозначает водород, C1-6 алкил, карбамоилC1-6 алкил, C1-6 алкиламино-C1-6 алкил или 5-10-членный гетероциклоалкил-C1-6 алкил, содержащий один-три гетероатома, выбранных из N, O или S;
R6 обозначает C1-6 алкил, галогенC1-6 алкил, C1-6 алкоксиC1-6 алкил, C1-6 алкилкарбонилC1-6 алкил, алкенил C2-7, амино, аминоC1-6 алкил, C3-7 циклоалкил, 5-10-членный гетероциклил, содержащий от одного до трех гетероатомов, выбранных из N, O или S, или 5-10-членный гетероциклилC1-6 алкил, содержащий один-три гетероатома, выбранных из N, O или S, причем аминогруппа может быть замещена одним или двумя заместителями, выбранными из гидрокси или C1-6 алкила, и гетероциклильная часть может быть замещена одним-четырьмя заместителями, выбранными из группы, состоящей из C1-6 алкила и C1-6 алкилкарбонила;
R7 и R8 обозначают, каждый независимо, водород или C1-6 алкил;
p = 1, и q = 0 или 1;
r означает целое число от 0 до 3, и, когда r = 2 или больше, группы R3 являются одинаковыми или разными; и
s означает целое число от 0 до 3, и, когда s = 2 или больше, группы R4 являются одинаковыми или разными;
все указанные гетероциклические или гетероциклильные группы, каждая независимо, имеют насыщенное или ненасыщенное единственное кольцо или множество колец;
все указанные гетероциклоалкильные группы, каждая независимо, имеют насыщенное единственное кольцо или множество колец; и
все указанные арильные или гетероарильные группы, каждая независимо, имеют ароматическое единственное кольцо или множество колец.
В определении I некоторые из заместителей могут быть определены более специфично следующим образом (определение Ia):
A обозначает насыщенный или ненасыщенный C6 карбоцикл или 6-членный гетероцикл, содержащий один-три атома N,
B обозначает бензол или 5-10-членный гетероцикл, содержащий один-три атома N,
C обозначает бензол или 5-12-членный гетероарил, содержащий один-три гетероатома, выбранных из N, O или S,
L обозначает -(CR9R10)m-, -O-, -NH-, -N(C1-6 алкил)-, -S(=O)2-, -C(=O)-, -C(=CH2)- или C3-7 циклоалкилен, причем m означает целое число от 0 до 3, и R9 и R10 обозначают, каждый независимо, водород, гидрокси, галоген или C1-6 алкил; и
R1 обозначает нитро, амино или любую из следующих структурных формул i) - iv):
i) , ii)
, ii) , iii)
, iii)  и iv)
и iv)  ;
;
в которых R5-R8 имеют те же самые значения, как определено выше в определении I;
все указанные гетероциклические группы, каждая независимо, имеют насыщенное или ненасыщенное единственное кольцо или множество колец; и
указанная гетероарильная группа имеет ароматическое единственное кольцо или множество колец.
В определении I некоторые из заместителей могут быть определены более специфично следующим образом (определение Ib):
A обозначает насыщенный или ненасыщенный C3-10 карбоцикл или 5-10-членный гетероцикл, содержащий один-три гетероатома, выбранных из N, O или S;
B обозначает бензол или 9-12-членный гетероцикл, содержащий один-три атома N;
C обозначает бензол или 5-10-членный гетероцикл, содержащий один-три гетероатома, выбранных из N, O или S;
R3 обозначает водород, галоген, циано, C1-6 алкил, галогенC1-6 алкил, цианоC1-6 алкил, C1-6 алкокси, галогенC1-6 алкокси, цианоC1-6 алкокси, C1-6 алкиламино, диC1-6 алкиламино, C1-6 алкиламинокарбонил, диC1-6 алкиламинокарбонил, C2-8 алкинил, 5-10-членный гетероциклил, содержащий от одного до трех гетероатомов, выбранных из N, O или S, или 5-10-членный гетероциклоалкил-карбонил, содержащий один или два гетероатома, выбранных из N или O, причем гетероциклильная часть может быть замещена одним-тремя заместителями, выбранными из группы, состоящей из галогена, гидрокси, циано, амино, C1-6 алкила, галогенC1-6 алкила, C1-6 алкокси и C1-6 алкоксикарбонила; и
r = 0 или 1;
все указанные гетероциклические группы и гетероциклильные группы, каждая независимо, имеют насыщенное или ненасыщенное единственное кольцо или множество колец; и
указанная гетероциклоалкильная группа имеет насыщенное единственное кольцо или множество колец.
В определении Ib некоторые из заместителей могут быть определены более специфично как следующие (i) или (ii):
(i) A обозначает насыщенный или ненасыщенный C6 карбоцикл или 6-членный гетероцикл, содержащий один-три атома N.
(ii) B обозначает  или
или 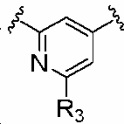 ; и R3 имеет то же самое значение, как определено в определении Ib.
; и R3 имеет то же самое значение, как определено в определении Ib.
Согласно другому варианту осуществления соединения формулы (I), заместители могут быть определены следующим образом (определение II):
A присутствует или отсутствует, и, если присутствует, A обозначает бензол или 6-членный гетероцикл, содержащий один-три атома N, и если A отсутствует, X3 и X4, каждый независимо, в случае необходимости замещены R1 или R2;
B обозначает бензол или 6-10-членный гетероцикл, содержащий один-три атома N;
C обозначает бензол, 6-10-членный гетероцикл, содержащий один-три гетероатома, выбранных из N, O или S, или C5-6 карбоцикл;
Y обозначает -C (=O)-, связанный с X2 или X5;
X1 обозначает -O-, -S-, -S(=O)-, -S(=O)2- или -N(W1)-;
X2 обозначает атом углерода, связанный с Y, или -NH-, -C(W2)= или -CH(W2)-, не связанный с Y;
X3 и X4 обозначают, каждый независимо, атом углерода или азота;
X5 обозначает атом углерода, связанный с Y, или -CH=, не связанный с Y;
причем 5-членное кольцо, включающее X1-X5, является ароматическим или неароматическим;
W обозначает водород, C1-3 алкил или 5- или 6-членный гетероциклоалкил-C1-3 алкил, содержащий один или два гетероатома, выбранных из N или O;
W1 обозначает водород, C1-3 алкил, трет-бутоксикарбонил или 5- или 6-членный гетероциклоалкил-C1-3 алкил, содержащий один или два гетероатома, выбранных из N или O;
W2 обозначает водород, галоген или C1-3 алкил;
L обозначает -(CR9R10)m-, -O-, -S(=O)2-, C3-6 циклоалкилен, -NH-, -N(C1-3 алкил)-, -C(=CH2)- или -C(=O)-, в которых m = 0 или 1, и R9 и R10 обозначают, каждый независимо, водород, галоген, гидрокси или C1-3 алкил;
R1 обозначает любую из следующих структурных формул i) - iv):
i) , ii)
, ii) , iii)
, iii)  и iv)
и iv)  ;
;
R2 обозначает водород, галоген, нитро, амино, C1-3 алкокси, галогенC1-3 алкокси, C1-3 алкилсульфонил или 5- или 6-членный гетероциклоалкил, содержащий один или два гетероатома, выбранных из N или O;
R3 обозначает водород, галоген, C1-3 алкилкарбонил, циано, цианоC1-3 алкил, C1-3 алкил, галогенC1-3 алкил, C2-3 алкинил, галогенC1-3 алкокси, цианоC1-3 алкокси, C1-6 алкокси, C1-3 алкиламино, диC1-3 алкиламино, C1-3 алкиламинокарбонил, диC1-3 алкиламинокарбонил, фенил, галогенфенил, 5- или 6-членный гетероциклил или 5- или 6-членный гетероциклил-карбонил, причем гетероциклильная часть содержит один-три гетероатома, выбранных из N, O или S, и в случае необходимости замещена одним-тремя заместителями, выбранными из группы, состоящей из галогена, гидрокси, циано, амино, C1-3 алкила, галогенC1-3 алкила, C1-3 алкокси и трет-бутоксикарбонила;
R4 обозначает водород, оксо, гидрокси, нитро, циано, галоген, аминосульфонил, амино, C1-3 алкиламино, диC1-3 алкиламино-C1-3 алкокси, C1-3 алкилтио, C1-3 алкилсульфинил, C1-3 алкилсульфонил, C1-3 алкил, цианоC1-3 алкил, C2-4 алкинил, C1-3 алкокси, цианоC1-3 алкокси, галогенC1-3 алкокси, карбамоил-C1-3 алкокси, C3-6 циклоалкил-окси, 4-10-членный гетероциклил, 4-10-членный гетероциклил-окси или 4-10-членный гетероциклил-C1-3 алкил, причем гетероциклильная часть содержит один-три гетероатома, выбранных из N, O или S, и в случае необходимости замещена одним или двумя заместителями, выбранными из группы, состоящей из гидрокси, оксо, C1-3 алкила, t-бутилкарбонила, трет-бутоксикарбонила, C1-3 алкилсульфонила, диC1-3 алкилсульфонила, диC1-3 алкиламинокарбонила, 4-6-членного гетероциклила и C1-6 алкил-замещенного 4-6-членного гетероциклила;
R5 обозначает водород, C1-3 алкил, карбамоилC1-3 алкил, диC1-3 алкиламино-C1-3 алкил, или морфолино-C1-3 алкил, или конденсирован с R6, образуя C3-4 алкилен;
R6 обозначает C1-3 алкил, галогенC1-3 алкил, C1-3 алкоксиC1-3 алкил, C2-3 алкенил, амино, аминоC1-3 алкил, C3-6 циклоалкил, 5- или 6-членный гетероциклил или 5- или 6-членный гетероциклил-C1-3 алкил, или конденсирован с R5, образуя C3-4 алкилен, причем гетероциклильная часть содержит один-три гетероатома, выбранных из N, O или S, и в случае необходимости замещена одним-четырьмя заместителями, выбранными из группы, состоящей из водорода, оксо, C1-3 алкила и ацетила, и аминогруппа незамещена или замещена одним или двумя заместителями, выбранными из гидрокси или C1-3 алкила;
R7 обозначает водород или C1-3 алкил;
R8 обозначает водород или C1-6 алкил;
p и q означают, каждый независимо, 0 или 1;
r = 0 или 1; и
s означает целое число от 0 до 3, и, когда s = 2 или больше, группы R4 являются одинаковыми или разными;
все указанные гетероциклические и гетероциклильные группы, каждая независимо, имеют насыщенное или ненасыщенное единственное или двойное кольцо.
В определении II некоторые из заместителей могут быть определены более специфично как следующие (i), (ii), (iii) или (iv):
(i) B обозначает  или
или  ; и R3 имеет то же самое значение, как определено в определении II.
; и R3 имеет то же самое значение, как определено в определении II.
(ii) m = 1; и R9 и R10 обозначают, каждый независимо, галоген, гидрокси или C1-3 алкил.
(iii) m = 0; и R3 обозначает водород, фенил, галогенфенил, насыщенный или ненасыщенный 5- или 6-членный гетероциклил или 5-6-членный гетероциклил-карбонил, причем гетероциклильная часть содержит один-три гетероатома, выбранных из N, O или S, и в случае необходимости замещена одним-тремя заместителями, выбранными из группы, состоящей из галогена, гидрокси, циано, амино, C1-3 алкила, галогенC1-3 алкила, C1-3 алкокси и трет-бутоксикарбонила.
(iv) X1 обозначает -S- или -NH-; X2 обозначает -CH=, не связанный с Y; X3 и X4 обозначают атом углерода; и R1 обозначает структурную формулу I).
Предпочтительные примеры соединения согласно настоящему изобретению приведены ниже, и их фармацевтически приемлемые соли и стереоизомеры также включены в рамки настоящего изобретения:
1) N-(3-(2-(4-фторфенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
2) 6-(метилсульфонамидо)-N-(3-(2-фенилпропан-2-ил)фенил-1H-индол-2-карбоксамид;
3) N-(3-(2-(4-фторфенил)пропан-2-ил)фенил)-5-метокси-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
4) N-(3-метокси-5-(2-(3-(трифторметокси)фенилпропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
5) N-(3-(2-(4-фторфенил)пропан-2-ил)фенил)-6-((N-метилсульфамоил)амино)-1H-индол-2-карбоксамид;
6) N-(3-(2-(4-фторфенил)пропан-2-ил)фенил)-6-(метилсульфонил)-1H-индол-2-карбоксамид;
7) N-(3-(2-(2-фторфенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
8) 6-(метилсульфонамидо)-N-(3-(2-(3-(трифторметокси)фенилпропан-2-ил)фенил)-1H-индол-2-карбоксамид;
9) N-(3-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
10) N-(3-(1-(3-метокси-5-(трифторметокси)фенил)этил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
11) N-(3-(2-(2,4-дифторфенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
12) N-(3-(2-(3-метоксифенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
13) N-(3-метокси-5-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
14) N-(3-бром-5-(2-(4-фторфенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
15) N-(3-бром-5-(2-(2,4-дифторфенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
16) N-(3-бром-5-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
17) N-(3-(дифторметокси)-5-(2-(4-фторфенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
18) N-(3-(2-(3-(2-амино-2-оксоэтокси)фенилпропан-2-ил)-5-бромфенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
19) N-(3-бром-5-(2-(4-фторфенил)пропан-2-ил)фенил)-5-метокси-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
20) N-(3-бром-5-(2-(3-(дифторметокси)фенилпропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
21) N-(3-хлор-5-(2-(4-фторфенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
22) N-(3-бром-5-(2-(3-этокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
23) N-(3-бром-5-(2-(2-фтор-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
24) N-(3-хлор-5-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
25) N-(3-(2-(4-фторфенил)пропан-2-ил)фенил)-5-(трифторметокси)-1H-индол-2-карбоксамид;
26) N-(3-(2-(4-фторфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
27) N-(3-(2-(2,4-дифторфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
28) N-(3-(2-(4-фторфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензофуран-2-карбоксамид;
29) N-(3-(2-(2,4-дифторфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензофуран-2-карбоксамид;
30) N-(3-(2-(4-фторфенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
31) N-(3-(2-(2-фторфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
32) N-(3-бром-5-(2-(4-фторфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
33) N-(3-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
34) N-(3-метокси-5-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
35) N-(3-бром-5-(2-(2,4-дифторфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
36) N-(3-бром-5-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
37) 5-(метилсульфонамидо)-N-(3-(2-(3-(трифторметокси)фенилпропан-2-ил)фенил)бензо[b]тиофен-2-карбоксамид;
38) N-(3-(2-(3-метоксифенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
39) N-(3-(дифторметокси)-5-(2-(4-фторфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
40) N-(3-хлор-5-(2-(4-фторфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
41) N-(3-(дифторметокси)-5-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
42) N-(3-хлор-5-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
43) N-(3-(2-(3-(2-амино-2-оксоэтокси)фенилпропан-2-ил)-5-бромфенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
44) N-(3-(2-(5-(2-амино-2-оксоэтокси)-2-фторфенил)пропан-2-ил)-5-бромфенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
45) N-(3-(2-(3-((1-амино-2-метил-1-оксопропан-2-ил)окси)фенил)пропан-2-ил)-5-бромфенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
46) N-(3-бром-5-(2-(3-(дифторметокси)фенилпропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
47) N-(3-бром-5-(2-(2-фтор-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
48) N-(3-бром-5-(2-(3-этокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
49) N-(3-бром-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
50) N-(3-бром-5-(2-(3-(морфолинометил)фенилпропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
51) N-(3-(2-(4-фторфенил)пропан-2-ил)фенил)-3-метил-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
52) N-(3-(2-(4-фторфенил)пропан-2-ил)фенил)-3-метил-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
53) N-(3-бром-5-(3-(4-фторфенил)пентан-3-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
54) N-(3-метокси-5-(3-(3-метокси-5-(трифторметокси)фенил)пентан-3-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
55) N-(3-метокси-5-(3-(3-метокси-5-(трифторметокси)фенил)пентан-3-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
56) N-(3-бром-5-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)тиено[2,3-b]пиридин-2-карбоксамид;
57) N-(3-хлор-5-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)тиено[2,3-b]пиридин-2-карбоксамид;
58) N-(3-хлор-5-(2-(3-этокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
59) N-(3-хлор-5-(2-(3-этокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
60) N-(3-бром-5-(2-(3-этокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)тиено[3,2-b]пиридин-2-карбоксамид;
61) N-(3-бром-5-(2-(3-этокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)тиено[2,3-c]пиридин-2-карбоксамид;
62) N-(3-хлор-5-(2-(2-фтор-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
63) N-(3-фтор-5-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
64) N-(3-хлор-5-(2-фенилпропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
65) N-(3-хлор-5-(2-(3-фторфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
66) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)-4-морфолинобензо[b]тиофен-2-карбоксамид;
67) N-(3-хлор-5-(2-(3-фтор-5-метоксифенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
68) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
69) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)тиено[2,3-b]пиридин-2-карбоксамид;
70) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)тиено[3,2-b]пиридин-2-карбоксамид;
71) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)тиено[2,3-c]пиридин-2-карбоксамид;
72) N-(3-хлор-5-(2-(3-изобутокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
73) N-(3-хлор-5-(2-(3-пропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
74) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)имидазо[1,2-a]пиридин-2-карбоксамид;
75) N-(3-(2-(3-(бут-2-ин-1-илокси)-5-(трифторметокси)фенилпропан-2-ил)-5-хлорфенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
76) N-(3-хлор-5-(2-(3-(оксетан-3-илокси)-5-(трифторметокси)фенилпропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
77) N-(3-хлор-5-(2-(3-(цианометокси)-5-(трифторметокси)фенилпропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
78) N-(3-(2-(3-(аллилокси)-5-(трифторметокси)фенилпропан-2-ил)-5-хлорфенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
79) N-(3-хлор-5-(2-(3-циклопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
80) N-(3-хлор-5-(2-(3-(1,1,2,2-тетрафторэтокси)-5-(трифторметокси)фенилпропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
81) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[d]тиазол-2-карбоксамид;
82) N-(3-фтор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
83) N-(3-хлор-5-(2-(3-(2,2-дифторэтокси)-5-(трифторметокси)фенилпропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
84) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-фтор-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
85) N-(3-фтор-5-(2-(3-(1,1,2,2-тетрафторэтокси)-5-(трифторметокси)фенилпропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
86) N-(3-фтор-5-(2-(3-(1,1,2,2-тетрафторэтокси)-5-(трифторметокси)фенилпропан-2-ил)фенил)-5-(метилсульфонамидо)тиено[2,3-c]пиридин-2-карбоксамид;
87) N-(3-бром-5-(2-(3-(1,1,2,2-тетрафторэтокси)-5-(трифторметокси)фенилпропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
88) N-(3-хлор-5-(2-(3-(2,2,2-трифторэтокси)-5-(трифторметокси)фенилпропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
89) N-(3-бром-5-(2-(3-(1,1,2,2-тетрафторэтокси)-5-(трифторметокси)фенилпропан-2-ил)фенил)-5-(метилсульфонамидо)тиено[2,3-c]пиридин-2-карбоксамид;
90) N-(3-хлор-5-(2-(3-(2-морфолиноэтокси)-5-(трифторметокси)фенилпропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
91) N-(3-(2-(3-бром-5-изопропоксифенил)пропан-2-ил)-5-хлорфенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
92) N-(3-хлор-5-(2-(3-хлор-5-изопропоксифенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
93) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-4-фтор-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
94) N-(3-хлор-5-(2-(3-(2-(диметиламино)этокси)-5-(трифторметокси)фенилпропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
95) трет-бутил-4-(3-(2-(3-хлор-5-(5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамидо)фенил)пропан-2-ил)-5-(трифторметокси)фенокси)пиперидин-1-карбоксилат;
96) N-(3-хлор-5-(2-(3-(пиперидин-4-илокси)-5-(трифторметокси)фенилпропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
97) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонил)-4,5,6,7-тетрагидротиено[3,2-c]пиридин-2-карбоксамид;
98) N-(3-бром-5-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-пирроло[3,2-c]пиридин-2-карбоксамид;
99) N-(3-бром-5-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)-1H-пирроло[2,3-c]пиридин-2-карбоксамид 2,2,2-трифторацетат;
100) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-пирроло[2,3-b]пиридин-2-карбоксамид;
101) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-пирроло[3,2-c]пиридин-2-карбоксамид;
102) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-4-(метилсульфонамидо)тиофен-2-карбоксамид;
103) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(морфолин-4-сульфонамидо)бензо[b]тиофен-2-карбоксамид;
104) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)-4,5,6,7-тетрагидротиено[3,2-c]пиридин-2-карбоксамид;
105) 6-хлор-N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
106) N-(3-хлор-5-(2-(3-метоксифенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
107) N-(3-этинил-5-(2-(4-фторфенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
108) N-(3-этинил-5-(2-(4-фторфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
109) N-(3-(2-(2,4-дифторфенил)пропан-2-ил)-5-этинилфенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
110) 3-хлор-N-(3-(2-(4-фторфенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
111) 3-хлор-N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
112) N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-7-метокси-5-(метилсульфонамидо)бензофуран-2-карбоксамид;
113) N-(3-(2-(4-фторфенил)пропан-2-ил)фенил)-7-метокси-5-(метилсульфонамидо)бензофуран-2-карбоксамид;
114) N-(3-хлор-5-(2-(3-(проп-1-ин-1-ил)-5-(трифторметокси)фенилпропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
115) N-(3-бром-5-(2-(3-((4-метилпиперазин-1-ил)метил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
116) трет-бутил-4-(3-(2-(3-бром-5-(5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамидо)фенил)пропан-2-ил)бензил)пиперазин-1-карбоксилат;
117) трет-бутил-4-(3-(2-(3-бром-5-(6-(метилсульфонамидо)-1H-индол-2-карбоксамидо)фенил)пропан-2-ил)бензил)пиперазин-1-карбоксилат;
118) N-(3-бром-5-(2-(3-(пиперазин-1-илметил)фенилпропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
119) N-(3-бром-5-(2-(3-(пиперазин-1-илметил)фенилпропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
120) N-(3-(2-(3-((1H-имидазол-1-ил)метил)фенил)пропан-2-ил)-5-бромфенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
121) N-(3-хлор-5-(2-(3-((2-гидроксиазетидин-1-ил)метил)-5-изопропоксифенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
122) N-(3-бром-5-(2-(3-изопропокси-5-(морфолинометил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
123) трет-бутил-4-(3-(2-(3-бром-5-(5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамидо)фенил)пропан-2-ил)-5-изопропоксибензил)пиперазин-1-карбоксилат;
124) N-(3-бром-5-(2-(3-изопропокси-5-(пиперазин-1-илметил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
125) N-(3-хлор-5-(2-(3-изопропокси-5-(пирролидин-1-илметил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
126) N-(3-хлор-5-(2-(3-изопропокси-5-(морфолинометил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
127) N-(3-хлор-5-(2-(3-изопропокси-5-((4-пивалоилпиперазин-1-ил)метил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
128) N-(3-хлор-5-(2-(3-изопропокси-5-((4-(метилсульфонил)пиперазин-1-ил)метил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
129) N-(3-хлор-5-(2-(3-изопропокси-5-((4-(5-изопропил-1,2,4-оксадиазол-3-ил)пиперазин-1-ил)метил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
130) N-(3-хлор-5-(2-(3-изопропокси-5-((4-(оксетан-3-ил)пиперазин-1-ил)метил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
131) N-(3-хлор-5-(2-(3-((4-(N,N-диметилсульфамоил)пиперазин-1-ил)метил)-5-изопропоксифенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
132) N-(3-хлор-5-(2-(3-((1,1-диоксидотиоморфолино)метил)-5-изопропоксифенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
133) 4-(3-(2-(3-хлор-5-(5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамидо)фенил)пропан-2-ил)-5-изопропоксибензил)-N,N-диметилпиперазин-1-карбоксамид;
134) N-(3-(2-(3-((2-окса-7-азаспиро[3,5]нонан-7-ил)метил)-5-изопропоксифенил)пропан-2-ил)-5-хлорфенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
135) N-(3-хлор-5-(2-(3-изопропокси-5-((4-(5-изопропил-1,3,4-оксадиазол-2-ил)пиперазин-1-ил)метил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
136) N-(3-фтор-5-(2-(3-изопропокси-5-((4-(5-изопропил-1,2,4-оксадиазол-3-ил)пиперазин-1-ил)метил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
137) N-(3-фтор-5-(2-(3-изопропокси-5-(морфолинометил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
138) N-(3-хлор-5-(2-(3-((1-метил-1H-пиразол-4-ил)метил)-5-(1,1,2,2-тетрафторэтокси)фенилпропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
139) N-(3-бром-5-(2-(3-((4-(N,N-диметилсульфамоил)пиперазин-1-ил)метил)-5-(1,1,2,2-тетрафторэтокси)фенилпропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
140) N-(3-фтор-5-(2-(3-(морфолинометил)-5-(1,1,2,2-тетрафторэтокси)фенилпропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
141) N-(3-бром-5-(2-(3-((4-(оксетан-3-ил)пиперазин-1-ил)метил)-5-(1,1,2,2-тетрафторэтокси)фенилпропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
142) N-(3-хлор-5-(2-(3-изопропокси-5-(1-метил-1H-пиразол-5-ил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
143) N-(3-хлор-5-(2-(3-изопропокси-5-(1-метил-1H-пиразол-4-ил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
144) N-(3-хлор-5-(2-(3-(3-гидрокси-4-метилпиперазин-1-ил)-5-изопропоксифенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
145) N-(3-хлор-5-(2-(3-изопропокси-5-морфолинофенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
146) N-(3-хлор-5-(2-(3-изопропокси-5-(пирролидин-1-ил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
147) N-(3-хлор-5-(2-(3-изопропокси-5-(4-метилпиперазин-1-ил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
148) N-(6-хлор-4-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин-2-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
149) N-(2-хлор-6-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин-4-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
150) N-(4-хлор-6-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин-2-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
151) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-2-(метилсульфонамидо)тиено[2,3-b]пиразин-6-карбоксамид;
152) N-(3-(2-(4-бромфенил)пропан-2-ил)-5-хлорфенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
153) N-(3-хлор-5-(2-(3,4-диметоксифенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
154) N-(3-хлор-5-(2-(2,4-диметоксифенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
155) N-(3-хлор-5-(2-(4-метоксифенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
156) N-(3-хлор-5-(2-(2,5-диметоксифенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
157) N-(3-хлор-5-(2-(4-(метилтио) фенилпропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
158) N-(3-хлор-5-(2-(4-хлорфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
159) N-(3-хлор-5-(2-(4-(1-метил-1H-пиразол-5-ил)фенилпропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
160) N-(3-хлор-5-(2-(4-(метилсульфинил)фенилпропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
161) N-(3-хлор-5-(2-(4-(метилсульфонил)фенилпропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
162) N-(3-хлор-5-(2-(3,4-дифторфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
163) N-(3-хлор-5-(2-(4-хлорфенил)пропан-2-ил)фенил)-6-фтор-5-(N-метилметилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
164) N-(3-хлор-5-(2-(пиперидин-1-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
165) 6-хлор-N-(3-хлор-5-(2-(пиперидин-1-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
166) N-(3-(2-(1H-пиррол-2-ил)пропан-2-ил)-5-хлорфенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
167) N-(3-(2-(1H-пиррол-3-ил)пропан-2-ил)-5-хлорфенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
168) N-(3-хлор-5-(2-(1-метил-1H-пиррол-3-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
169) N-(3-хлор-5-(2-(1-метил-1H-пиррол-2-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
170) N-(3-хлор-5-(2-(тиофен-2-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
171) N-(3-хлор-5-(2-(тиофен-3-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
172) 6-хлор-N-(3-хлор-5-(2-(4-хлорфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
173) 6-бром-N-(3-хлор-5-(2-(4-хлорфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
174) N-(3-хлор-5-(2-(5-хлортиофен-2-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
175) 6-хлор-N-(3-хлор-5-(2-(5-хлортиофен-2-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
176) N-(3-хлор-5-(2-(2-метокситиофен-3-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
177) N-(3-хлор-5-(2-(5-метокситиофен-2-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
178) N-(3-хлор-5-(2-(5-метилтиофен-2-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
179) 6-хлор-N-(3-хлор-5-(2-(5-метилтиофен-2-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
180) 6-хлор-N-(3-хлор-5-(2-(5-изопропилтиофен-2-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
181) 6-хлор-N-(3-хлор-5-(2-(4-метилтиофен-2-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
182) 6-хлор-N-(3-хлор-5-(2-(4-фторфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
183) 6-хлор-N-(3-хлор-5-(2-(4-метоксифенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
184) 5-хлор-N-(3-хлор-5-(2-(4-хлорфенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
185) 6-хлор-N-(3-хлор-5-(2-(4-хлорфенил)пропан-2-ил)фенил)-5-((2-метоксиэтил)сульфонамидо)бензо[b]тиофен-2-карбоксамид;
186) 6-хлор-N-(3-хлор-5-(2-(5-Цианотиофен-2-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
187) N-(3-хлор-5-(2-(1-этил-1H-пиррол-2-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
188) 6-хлор-N-(3-хлор-5-(2-(4-хлорфенил)пропан-2-ил)фенил)-5-((2-гидроксиэтил)сульфонамидо)бензо[b]тиофен-2-карбоксамид;
189) N-(3-хлор-5-(2-(пиримидин-2-илокси)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
190) N-(3-хлор-5-(2-(6-оксопиридазин-1(6H)-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
191) N-(3-хлор-5-(2-(пиридин-4-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
192) 2-((3-бром-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)карбамоил)бензо[b]тиофен-5-ил дигидрофосфат;
193) 2-((3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)карбамоил)бензо[b]тиофен-5-ил дигидрофосфат;
194) трет-бутил(2-((3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)карбамоил)бензо[b]тиофен-5-ил)карбамат;
195) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-((2-метоксиэтил)сульфонамидо)бензо[b]тиофен-2-карбоксамид;
196) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(((тетрагидрофуран-3-ил)метил)сульфонамидо)бензо[b]тиофен-2-карбоксамид;
197) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(((тетрагидрофуран-2-ил)метил)сульфонамидо)бензо[b]тиофен-2-карбоксамид;
198) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(((тетрагидро-2H-пиран-4-ил)метил)сульфонамидо)бензо[b]тиофен-2-карбоксамид;
199) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-((3,5-диметилизоксазол)-4-сульфонамидо)бензо[b]тиофен-2-карбоксамид;
200) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-((1-метил-1H-пиразол)-3-сульфонамидо)бензо[b]тиофен-2-карбоксамид;
201) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-((1-метил-1H-пиразол)-4-сульфонамидо)бензо[b]тиофен-2-карбоксамид;
202) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(этилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
203) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-((1-метилэтил)сульфонамидо)бензо[b]тиофен-2-карбоксамид;
204) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-((тетрагидрофуран)-3-сульфонамидо)бензо[b]тиофен-2-карбоксамид;
205) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-((1,1-диоксидотетрагидро-2H-тиопиран)-4-сульфонамидо)бензо[b]тиофен-2-карбоксамид;
206) 5-((1-ацетилпиперидин)-4-сульфонамидо)-N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)бензо[b]тиофен-2-карбоксамид;
207) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(винилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
208) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-((2-(диметиламино)этил)сульфонамидо)бензо[b]тиофен-2-карбоксамид;
209) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-((2-морфолиноэтил)сульфонамидо)бензо[b]тиофен-2-карбоксамид;
210) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-((2-(гидрокси(метил)амино)этил)сульфонамидо)бензо[b]тиофен-2-карбоксамид;
211) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(1,1-диоксидо-1,2-тиазинан-2-ил)бензо[b]тиофен-2-карбоксамид;
212) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(1,1-диоксидоизотиазолидин-2-ил)бензо[b]тиофен-2-карбоксамид;
213) N-(3-йод-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
214) 3-йод-N-(3-йод-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
215) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-фтор-5-(N-метилметилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
216) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-фтор-N-метил-5-(N-метилметилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
217) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-фтор-5-(N-(2-морфолиноэтил)метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
218) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-фтор-N-(2-морфолиноэтил)-5-(N-(2-морфолиноэтил)метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
219) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(N-(2-(диметиламино)этил)метилсульфонамидо)-6-фторбензо[b]тиофен-2-карбоксамид;
220) N-(3-хлор-5-(4-хлорфенокси)фенил)-5-(N-метилметилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
221) N-(3-хлор-5-(2-(4-хлорфенил)пропан-2-ил)фенил)-5-(N-метилметилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
222) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид 1,1-диоксид;
223) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид 1-оксид;
224) N-(3-(2-(3-Цианофенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
225) N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-нитро-1H-индол-2-карбоксамид;
226) 6-нитро-N-(2’-(трифторметил)-[1,1’-бифенил]-3-ил)-1H-индол-2-карбоксамид;
227) 5-нитро-N-(2’-(трифторметил)-[1,1’-бифенил]-3-ил)-1H-индол-2-карбоксамид;
228) 3-метил-5-нитро-N-(2’-(трифторметил)-[1,1’-бифенил]-3-ил)-1H-индол-2-карбоксамид;
229) N-(4’-фтор-2’-(трифторметил)-[1,1’-бифенил]-3-ил)-6-нитроиндолин-2-карбоксамид;
230) 6-нитро-N-(2’-(трифторметил)-[1,1’-бифенил]-3-ил)индолин-2-карбоксамид;
231) N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-нитроиндолин-2-карбоксамид;
232) 6-нитро-N-(2’-(трифторметил)-[1,1’-бифенил]-3-ил)бензо[d]тиазол-2-карбоксамид;
233) N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-5-нитро-1H-бензо[d]имидазол-2-карбоксамид;
234) 5-нитро-N-(2’-(трифторметил)-[1,1’-бифенил]-3-ил)-1H-бензо[d]имидазол-2-карбоксамид;
235) N-(4’-фтор-2’-(трифторметил)-[1,1’-бифенил]-3-ил)-5-нитро-1H-бензо[d]имидазол-2-карбоксамид;
236) N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-5-метокси-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
237) N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
238) N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-5-(метилсульфонамидо)бензофуран-2-карбоксамид;
239) N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-5-(трифторметокси)-1H-индол-2-карбоксамид;
240) N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-(метилсульфонил)-1H-индол-2-карбоксамид;
241) N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-3-метил-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
242) N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
243) N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-3-метил-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
244) N-(4’-фтор-2’-(трифторметил)-[1,1’-бифенил]-3-ил)-6-нитро-1H-индол-2-карбоксамид;
245) N-(5-ацетил-2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
246) N-(4-(2,4-дифторфенил)-1H-индазол-6-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
247) N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-1-метил-6-нитро-1H-индол-2-карбоксамид;
248) N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-1-метил-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
249) 1-метил-6-нитро-N-(2’-(трифторметил)-[1,1’-бифенил]-3-ил)-1H-индол-2-карбоксамид;
250) 1-метил-5-нитро-N-(2’-(трифторметил)-[1,1’-бифенил]-3-ил)-1H-индол-2-карбоксамид;
251) 3-метил-1-(2-морфолиноэтил)-5-нитро-N-(2’-(трифторметил)-[1,1’-бифенил]-3-ил)-1H-индол-2-карбоксамид;
252) 1-(2-морфолиноэтил)-6-нитро-N-(2’-(трифторметил)-[1,1’-бифенил]-3-ил)-1H-индол-2-карбоксамид;
253) 1-метил-6-(метилсульфонамидо)-N-(2’-(трифторметил)-[1,1’-бифенил]-3-ил)-1H-индол-2-карбоксамид;
254) 2-((2-((2’,4’-дифтор-[1,1’-бифенил]-3-ил)карбамоил)-1H-индол-6-ил)окси)-2-метилпропановая кислота;
255) этил-2-((2-((2’,4’-дифтор-[1,1’-бифенил]-3-ил)карбамоил)-1H-индол-6-ил)окси)ацетат;
256) 2-((2-((2’,4’-дифтор-[1,1’-бифенил]-3-ил)карбамоил)-1H-индол-6-ил)окси)уксусная кислота;
257) N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-((N-метилсульфамоил)амино)-1H-индол-2-карбоксамид;
258) 5-амино-N-(2’-(трифторметил)-[1,1’-бифенил]-3-ил)-1H-индол-2-карбоксамид;
259) 5-(метилсульфонамидо)-N-(2’-(трифторметил)-[1,1’-бифенил]-3-ил)-1H-индол-2-карбоксамид;
260) 6-(метилсульфонамидо)-N-(2’-(трифторметил)-[1,1’-бифенил]-3-ил)-1H-индол-2-карбоксамид;
261) N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)индолин-2-карбоксамид;
262) N-(4’-фтор-2’-(трифторметил)-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)индолин-2-карбоксамид;
263) трет-бутил-6-нитро-2-((2’-(трифторметил)-[1,1’-бифенил]-3-ил)карбамоил)-1H-индол-1-карбоксилат;
264) 6-(2,2,2-трифторэтилсульфонамидо)-N-(2’-(трифторметил)-[1,1’-бифенил]-3-ил)-1H-индол-2-карбоксамид;
265) 6-(сульфамоиламино)-N-(2’-(трифторметил)-[1,1’-бифенил]-3-ил)-1H-индол-2-карбоксамид;
266) 6-(метилсульфонамидо)-N-(2’-(трифторметил)-[1,1’-бифенил]-3-ил)-1H-индол-3-карбоксамид;
267) 6-((N,N-диметилсульфамоил)амино)-N-(2’-(трифторметил)-[1,1’-бифенил]-3-ил)-1H-индол-2-карбоксамид;
268) N-(2’-(трифторметил)-[1,1’-бифенил]-3-ил)-6-(трифторметилсульфонамидо)-1H-индол-2-карбоксамид;
269) 6-((N-метилсульфамоил)амино)-N-(2’-(трифторметил)-[1,1’-бифенил]-3-ил)-1H-индол-2-карбоксамид;
270) N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
271) 6-амино-N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-1H-индол-2-карбоксамид;
272) N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-5-(метилсульфонамидо)-1H-индол-2-карбоксамид;
273) N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-(2,2,2-трифторэтилсульфонамидо)-1H-индол-2-карбоксамид;
274) N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-(сульфамоиламино)-1H-индол-2-карбоксамид;
275) N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-3-карбоксамид;
276) N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-((N,N-диметилсульфамоил)амино)-1H-индол-2-карбоксамид;
277) N-(4’-фтор-2’-(трифторметил)-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
278) 6-(циклопропансульфонамидо)-N-(4-(2,4-дифторфенил)пиридин-2-ил)-1H-индол-2-карбоксамид;
279) N-(4-(2,4-дифторфенил)пиридин-2-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
280) N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-N-метил-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
281) N-(5’-метокси-2’-(трифторметил)-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
282) N-(5’-метокси-2’-(трифторметил)-[1,1’-бифенил]-3-ил)-6-нитро-1H-индол-2-карбоксамид;
283) 6-(метилсульфонамидо)-N-(4’-сульфамоил-2’-(трифторметил)-[1,1’-бифенил]-3-ил)-1H-индол-2-карбоксамид;
284) N-(4’-Циано-2’-(трифторметил)-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
285) 6-(метилсульфонамидо)-N-(4’-нитро-2’-(трифторметил)-[1,1’-бифенил]-3-ил)-1H-индол-2-карбоксамид;
286) метил-3’-(6-нитро-1H-индол-2-карбоксамидо)-6-(трифторметил)-[1,1’-бифенил]-3-карбоксилат;
287) метил-3’-(6-(метилсульфонамидо)-1H-индол-2-карбоксамидо)-6-(трифторметил)-[1,1’-бифенил]-3-карбоксилат;
288) метил-4-метокси-3’-(6-нитро-1H-индол-2-карбоксамидо)-6-(трифторметил)-[1,1’-бифенил]-3-карбоксилат;
289) метил-4-метокси-3’-(6-(метилсульфонамидо)-1H-индол-2-карбоксамидо)-6-(трифторметил)-[1,1’-бифенил]-3-карбоксилат;
290) 6-(метилсульфонамидо)-N-(3-(3-(трифторметил)пиридин-2-ил)фенил)-1H-индол-2-карбоксамид;
291) 6-(метилсульфонамидо)-N-(3-(4-(трифторметил)пиридин-3-ил)фенил)-1H-индол-2-карбоксамид;
292) 6-нитро-N-(3-(2-(трифторметил)пиридин-3-ил)фенил)-1H-индол-2-карбоксамид;
293) 6-(метилсульфонамидо)-N-(3-(2-(трифторметил)пиридин-3-ил)фенил)-1H-индол-2-карбоксамид;
294) N-(3-(6-хлор-4-(трифторметил)пиридин-3-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
295) N-(2’-фтор-4’-метокси-[1,1’-бифенил]-3-ил)-6-нитро-1H-индол-2-карбоксамид;
296) трет-бутил-2-((2’-фтор-4’-метокси-[1,1’-бифенил]-3-ил)карбамоил)-6-(метилсульфонамидо)-1H-индол-1-карбоксилат;
297) N-(4-(2-фтор-5-метоксифенил)пиридин-2-ил)-6-нитро-1H-индол-2-карбоксамид;
298) метил-6-хлор-3’-(6-нитро-1H-индол-2-карбоксамидо)-[1,1’-бифенил]-3-карбоксилат;
299) метил-6-хлор-3’-(6-(метилсульфонамидо)-1H-индол-2-карбоксамидо)-[1,1’-бифенил]-3-карбоксилат;
300) метил-4-хлор-3-(2-(6-(метилсульфонамидо)-1H-индол-2-карбоксамидо)пиридин-4-ил)бензоат;
301) N-(5-Циано-2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
302) N-(5-бром-2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
303) N-(5-бром-2’,4’-дифтор-[1,1’-бифенил]-3-ил)-5-метокси-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
304) N-(5-бром-2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-(метилсульфонил)-1H-индол-2-карбоксамид;
305) N-(5-бром-2’,4’-дифтор-[1,1’-бифенил]-3-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
306) N-(5-бром-2’,4’-дифтор-[1,1’-бифенил]-3-ил)-5-(метилсульфонамидо)бензофуран-2-карбоксамид;
307) N-(5-бром-2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-((N-метилсульфамоил)амино)-1H-индол-2-карбоксамид;
308) N-(5-бром-2’,4’-дифтор-[1,1’-бифенил]-3-ил)-5-(трифторметокси)-1H-индол-2-карбоксамид;
309) N-(5-бром-2’,4’-дифтор-[1,1’-бифенил]-3-ил)-3-метил-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
310) N-(5-бром-2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
311) N-(5-бром-2’,4’-дифтор-[1,1’-бифенил]-3-ил)-3-метил-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
312) 6-(метилсульфонамидо)-N-(2',4',5-трифтор-[1,1’-бифенил]-3-ил)-1H-индол-2-карбоксамид;
313) N-(2’,4’-дифтор-5-(трифторметил)-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
314) N-(2’,4’-дифтор-5-метокси-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
315) N-(5-Циано-4’-фтор-2’-(трифторметил)-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
316) N-(2’,4’-дифтор-5-метокси-[1,1’-бифенил]-3-ил)-3-метил-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
317) N-(2’,4’-дифтор-5-метокси-[1,1’-бифенил]-3-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
318) N-(2’,4’-дифтор-5-(метилкарбамоил)-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
319) N-(5-(диметилкарбамоил)-2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
320) N-(2’,4’-дифтор-5-(пиперидин-1-карбонил)-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
321) N-(2’,4’-дифтор-5-(морфолин-4-карбонил)-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
322) N-(5-хлор-2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-фтор-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
323) N-(5-хлор-2’,4’-дифтор-[1,1’-бифенил]-3-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
324) N-(5-хлор-3’-метокси-5’-(трифторметокси)-[1,1’-бифенил]-3-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
325) N-(5-хлор-3’-метокси-5’-(трифторметокси)-[1,1’-бифенил]-3-ил)-6-фтор-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
326) N-(5-хлор-3’-метокси-5’-(трифторметокси)-[1,1’-бифенил]-3-ил)-6-фтор-5-(N-метилметилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
327) N-(5-хлор-2’,4’-дифтор-[1,1’-бифенил]-3-ил)-5-((тетрагидрофуран)-3-сульфонамидо)бензо[b]тиофен-2-карбоксамид;
328) N-(5-хлор-3’-метокси-5’-(трифторметокси)-[1,1’-бифенил]-3-ил)-5-((тетрагидрофуран)-3-сульфонамидо)бензо[b]тиофен-2-карбоксамид;
329) N-(5-хлор-2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-фтор-5-(N-метилметилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
330) N-(5-хлор-2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-фтор-5-((тетрагидрофуран)-3-сульфонамидо)бензо[b]тиофен-2-карбоксамид;
331) N-(4-хлор-6-(2,4-дифторфенил)пиридин-2-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
332) N-(3-хлор-5-(тиофен-3-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
333) 6-хлор-N-(5-хлор-2’,4’-дифтор-[1,1’-бифенил]-3-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
334) N-(3-хлор-5-(1-метил-1H-пиррол-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
335) N-(5-хлор-2’,4’-дифтор-[1,1’-бифенил]-3-ил)-3-гидрокси-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
336) N-(3-хлор-5-(тиофен-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
337) N-(6-хлор-4-(2,4-дифторфенил)пиридин-2-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
338) N-(3-хлор-5-(пиразин-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
339) N-(3-хлор-5-(6-хлорпиразин-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
340) N-(3-хлор-5-(1-метил-1H-имидазол-5-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
341) N-(5-бром-2’,4’-дифтор-[1,1’-бифенил]-3-ил)-1-метил-6-(N-метилметилсульфонамидо)-1H-индол-2-карбоксамид;
342) N-(5-бром-2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-(N-метилметилсульфонамидо)-1H-индол-2-карбоксамид;
343) 1-метил-6-(N-метилметилсульфонамидо)-N-(2’-(трифторметил)-[1,1’-бифенил]-3-ил)-1H-индол-2-карбоксамид;
344) N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-(N-метилметилсульфонамидо)-1H-индол-2-карбоксамид;
345) N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-1-метил-6-(N-метилметилсульфонамидо)-1H-индол-2-карбоксамид;
346) 6-(N-метилметилсульфонамидо)-N-(2’-(трифторметил)-[1,1’-бифенил]-3-ил)-1H-индол-2-карбоксамид;
347) N-(2’,4’-дифтор-5-метокси-[1,1’-бифенил]-3-ил)-6-(N-метилметилсульфонамидо)-1H-индол-2-карбоксамид;
348) N-(2’,4’-дифтор-5-метокси-[1,1’-бифенил]-3-ил)-1-метил-6-(N-метилметилсульфонамидо)-1H-индол-2-карбоксамид;
349) N-(2’,4’-дифтор-5-(6-фторпиридин-3-ил)-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
350) трет-бутил-2-(2’,4’-дифтор-5-(6-(метилсульфонамидо)-1H-индол-2-карбоксамидо)-[1,1’-бифенил]-3-ил)-1H-пиррол-1-карбоксилат;
351) N-(2’,4’-дифтор-5-(1H-пиразол-3-ил)-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
352) N-(2’,4’-дифтор-5-(1H-пиррол-2-ил)-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
353) N-(2’,4’-дифтор-5-(1-метил-1H-пиррол-2-ил)-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
354) N-(2’,4’-дифтор-5-(тиофен-2-ил)-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
355) N-(2’,4’-дифтор-5-(тиофен-3-ил)-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
356) N-(2’,4’-дифтор-5-(пиридин-4-ил)-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
357) N-(2’,4’-дифтор-5-(пиридин-3-ил)-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
358) N-(2’,4’-дифтор-5-(6-(трифторметил)пиридин-3-ил)-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
359) N-(5-(6-Цианопиридин-3-ил)-2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
360) N-(2’,4’-дифтор-5-(пиримидин-5-ил)-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
361) N-(5-(2-аминопиримидин-5-ил)-2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
362) 6-(метилсульфонамидо)-N-(2,2’’,4,4’’-тетрафтор-[1,1':3', 1’’-терфенил]-5’-ил)-1H-индол-2-карбоксамид;
363) N-(5-(цианометил)-2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
364) N-(2’,4’-дифтор-5-(6-гидроксипиридин-3-ил)-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
365) N-(5-этинил-2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
366) N-(5-(2,2-дифторэтокси)-2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
367) N-(2’,4’-дифтор-5-изобутокси-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
368) N-(5-(цианометокси)-2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
369) N-(5-(дифторметокси)-2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
370) N-(5-(дифторметокси)-2’,4’-дифтор-[1,1’-бифенил]-3-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
371) N-(2’,4’-дифтор-5-(пиперидин-1-ил)-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
372) N-(5-(диметиламино)-2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
373) N-(2’,4’-дифтор-5-(метиламино)-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
374) N-(2’,4’-дифтор-5-морфолино-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
375) N-(5-(диметиламино)-2’,4’-дифтор-[1,1’-бифенил]-3-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
376) N-(5-(диметиламино)-2’,4’-дифтор-[1,1’-бифенил]-3-ил)-5-(метилсульфонамидо)бензофуран-2-карбоксамид;
377) N-(5’-карбамоил-4’-метокси-2’-(трифторметил)-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
378) N-(5’-карбамоил-4’-гидрокси-2’-(трифторметил)-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
379) N-(5’-карбамоил-2’-(трифторметил)-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
380) N-(5’-карбамоил-2’-хлор-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
381) N-(4-(5-карбамоил-2-хлорфенил)пиридин-2-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
382) N-(2’,4’-дифтор-5-(6-метоксипиридин-3-ил)-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
383) N-(2’,4’-дифтор-5-(6-метоксипиридин-2-ил)-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
384) N-(2’,4’-дифтор-5-(6-гидроксипиридин-2-ил)-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
385) N-(4’-амино-2’-(трифторметил)-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
386) N-(4’-(метиламино)-2’-(трифторметил)-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
387) N-(3-(дифтор(фенил)метил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
388) N-(3-(дифтор(пиридин-4-ил)метил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
389) N-(3-(дифтор(пиридин-2-ил)метил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
390) N-(3-((3-Цианофенил)дифторметил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
391) N-(3-((3-Цианофенил)дифторметил)-5-(2,2-дифторэтокси)фенил-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
392) N-(3-((3-Цианофенил)дифторметил)-5-изобутоксифенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
393) N-(3-(цианометокси)-5-((3-Цианофенил)дифторметил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
394) N-(3-((4-метоксифенил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
395) 6-(метилсульфонамидо)-N-(3-(фенилсульфонил)фенил-1H-индол-2-карбоксамид;
396) 6-(метилсульфонамидо)-N-(3-((3-(трифторметокси)фенил)сульфонил)фенил)-1H-индол-2-карбоксамид;
397) N-(3-метокси-5-((3-(трифторметокси)фенил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
398) 6-(метилсульфонамидо)-N-(3-((3-(трифторметокси)фенил)сульфонил)-5-(трифторметил)фенил-1H-индол-2-карбоксамид;
399) N-(3-Циано-5-((3-(трифторметокси)фенил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
400) N-(3-изобутокси-5-((3-(трифторметокси)фенил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
401) N-(3-(2,2-дифторэтокси)-5-((3-(трифторметокси)фенил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
402) N-(3-((3-Цианофенил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
403) 6-(метилсульфонамидо)-N-(3-(пиридин-2-илсульфонил)фенил-1H-индол-2-карбоксамид;
404) 6-(метилсульфонамидо)-N-(3-(пиридин-3-илсульфонил)фенил-1H-индол-2-карбоксамид;
405) N-(3-((3-хлорфенил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
406) N-(3-((6-Цианопиридин-2-ил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
407) N-(3-((5-метоксипиридин-3-ил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
408) N-(3-((6-метоксипиридин-2-ил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
409) N-(3-(бензо[b]тиофен-5-илсульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
410) N-(3-((2-метилбензо[d]тиазол-6-ил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
411) N-(3-((3-Циано-5-метоксифенил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
412) N-(3-((3-(цианометил)фенил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
413) 6-(метилсульфонамидо)-N-(3-((4-оксо-4H-хромен-7-ил)сульфонил)фенил)-1H-индол-2-карбоксамид;
414) N-(3-((3-бромфенил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
415) N-(3-((3-аминофенил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
416) N-(3-((3-этинилфенил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
417) N-(3-((3-Циано-5-гидроксифенил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
418) N-(3-бром-5-((7-фтор-3,4-дигидроизохинолин-2(1H)-ил)сульфонил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
419) N-(3-бром-5-((5,7-дифтор-3,4-дигидроизохинолин-2(1H)-ил)сульфонил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
420) N-(3-бром-5-((4,4-дифторпиперидин-1-ил)сульфонил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
421) 5-(метилсульфонамидо)-N-(3-(1-фенилциклопропил)фенилбензо[b]тиофен-2-карбоксамид;
422) 6-(метилсульфонамидо)-N-(3-(1-фенилциклопропил)фенил-1H-индол-2-карбоксамид;
423) 5-(метилсульфонамидо)-N-(3-(1-фенилвинил)фенилбензо[b]тиофен-2-карбоксамид;
424) N-(3-(1-(4-фторфенил)циклопропил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
425) N-(3-(1-(4-фторфенил)циклопропил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
426) N-(3-бром-5-(1-(2,4-дифторфенил)циклопропил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
427) N-(3-метокси-5-(1-(3-метокси-5-(трифторметокси)фенил)циклопропил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
428) N-(3-(дифторметокси)-5-(1-(4-фторфенил)циклопропил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
429) N-(3-(дифторметокси)-5-(1-(4-фторфенил)циклопропил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
430) N-(3-хлор-5-(1-(3-изопропокси-5-(трифторметокси)фенил)циклопропил)фенил)-6-фтор-5-(N-метилметилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
431) N-(3-хлор-5-(1-(3-изопропокси-5-(трифторметокси)фенил)циклопропил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
432) N-(3-хлор-5-(1-(4-хлорфенил)циклопропил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
433) 6-хлор-N-(3-хлор-5-(1-(4-хлорфенил)циклопропил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
434) N-(3-бензоилфенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
435) N-(3-(1-гидрокси-1-фенилэтил)фенил-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
436) 6-(N-(2-амино-2-оксоэтил)метилсульфонамидо)-N-(3-(2-(3-гидрокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-1H-индол-2-карбоксамид;
437) N-(3-(2-(3-(2-амино-2-оксоэтокси)-5-(трифторметокси)фенилпропан-2-ил)фенил)-6-(N-(2-амино-2-оксоэтил)метилсульфонамидо)-1H-индол-2-карбоксамид;
438) N-(3-хлор-5-((2,4-дифторфенил)амино)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
439) N-(3-хлор-5-((2,4-дифторфенил)амино(метил))фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
440) N-(3-хлор-5-((4-хлорфенил)амино(метил))фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
441) 6-хлор-N-(3-хлор-5-((4-хлорфенил)амино(метил))фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
442) 6-хлор-N-(3-хлор-5-((2,4-дифторфенил)амино (метил))фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
443) N-(3-хлор-5-((3-изопропокси-5-(трифторметокси)фенил)амино (метил))фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
444) N-(3-хлор-5-(2,4-дифторфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
445) N-(3-хлор-5-(4-хлорфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
446) N-(3-хлор-5-(4-фторфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
447) N-(3-хлор-5-(4-метоксифенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
448) N-(3-хлор-5-(2,5-дифторфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
449) 6-хлор-N-(3-хлор-5-(4-хлорфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
450) N-(3-хлор-5-(3-(трифторметокси)фенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
451) N-(3-хлор-5-(4-Цианофенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
452) N-(3-хлор-5-(3-изопропокси-5-(трифторметокси)фенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
453) 6-бром-N-(3-хлор-5-(4-хлорфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
454) N-(3-хлор-5-(4-(трифторметокси)фенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
455) N-(3-хлор-5-(3-(трифторметил)фенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
456) N-(3-хлор-5-(3-хлорфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
457) N-(3-хлор-5-(3-метоксифенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
458) N-(3-хлор-5-(3-хлор-5-Цианофенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
459) N-(3-хлор-5-(3-Цианофенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
460) N-(3-хлор-5-(3,4-дифторфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
461) N-(3-хлор-5-(3-хлор-4-фторфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
462) N-(3-хлор-5-(2,4-дихлорфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
463) N-(3-хлор-5-(3,5-дифторфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
464) N-(3-хлор-5-(3,5-дихлорфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
465) N-(3-хлор-5-(4-(трифторметил)фенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
466) N-(3-хлор-5-(4-хлор-3-фторфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
467) N-(3-хлор-5-(3-хлор-5-(трифторметокси)фенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
468) N-(3-хлор-5-(4-хлор-3-(трифторметокси)фенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
469) N-(3-хлор-5-(3-хлор-5-фторфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
470) N-(3-хлор-5-(4-фтор-3-(трифторметокси)фенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
471) 6-хлор-N-(3-хлор-5-(тиазол-2-илокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
472) 6-хлор-N-(3-хлор-5-(тиазол-5-илокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
473) 6-хлор-N-(3-хлор-5-((5-хлортиофен-2-ил)окси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
474) 6-хлор-N-(3-хлор-5-(3-хлор-5-метоксифенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
475) 6-хлор-N-(3-хлор-5-(3-хлор-5-гидроксифенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
476) 6-хлор-N-(3-хлор-5-(3-хлор-4-фторфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
477) 6-хлор-N-(3-хлор-5-(4-хлор-3-фторфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
478) 6-хлор-N-(3-хлор-5-(4-фторфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
479) 6-хлор-N-(3-хлор-5-(3-(трифторметокси)фенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
480) 6-хлор-N-(3-хлор-5-(4-(трифторметокси)фенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
481) 6-хлор-N-(3-хлор-5-(3,4-дифторфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
482) 6-хлор-N-(3-хлор-5-(4-(трифторметил)фенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
483) 6-хлор-N-(3-хлор-5-(3-хлор-5-фторфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
484) 6-хлор-N-(3-хлор-5-(3-фтор-5-метоксифенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
485) 5-хлор-N-(3-хлор-5-(4-хлорфенокси)фенил)-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
486) 6-хлор-N-(3-хлор-5-(циклогексилокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
487) 6-хлор-N-(3-хлор-5-((5-метилтиофен-2-ил)окси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
488) 4-бром-N-(3-хлор-5-(2-(3-изопропокси-5-метилфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
489) N-(2-хлор-6-(4-хлорфенокси)пиридин-4-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
490) 6-хлор-N-(2-хлор-6-(4-хлорфенокси)пиридин-4-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
491) N-(2-хлор-6-((6-хлорпиридин-3-ил)окси)пиридин-4-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
492) 6-хлор-N-(2-хлор-6-((6-хлорпиридин-3-ил)окси)пиридин-4-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
493) N-(2-хлор-6-((6-(трифторметил)пиридин-3-ил)окси)пиридин-4-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
494) 6-хлор-N-(2-хлор-6-((6-(трифторметил)пиридин-3-ил)окси)пиридин-4-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
495) N-(2-хлор-6-(4-(трифторметил)фенокси)пиридин-4-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
496) 6-хлор-N-(2-хлор-6-(4-(трифторметил)фенокси)пиридин-4-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
497) N-(3-хлор-5-(2-(4-хлорфенил)пропан-2-ил)фенил)-6-метокси-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид; и
498) N-(3-хлор-5-(4-хлорфенокси)фенил)-6-метокси-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид.
Приведенные выше названия соединений описаны в соответствии с способом номенклатуры, обеспечиваемым программным обеспечением ChemBioDraw Ultra (Version 13.0.0.3015) от PerkinElmer.
Настоящее изобретение относится к фармацевтически приемлемой соли гетероциклического производного, представленного формулой (I), приведенной выше. Фармацевтически приемлемая соль должна иметь низкую токсичность для человека и не должна иметь никакого негативного воздействия на биологическую активность и физико-химические свойства родительских соединений. Примеры фармацевтически приемлемой соли могут включать соль присоединения с кислотой между пригодной фармацевтически свободной кислотой и основным соединением, представленным формулой (I), соль щелочного металла (натриевая соль и т.д.) и соль щелочно-земельного металла (калиевая соль и т.д.), соль присоединения с органическим основанием между органическим основанием и карбоновой кислотой, представленной формулой (I), соль присоединения с аминокислотой и т.д.
Примерами подходящей формы солей согласно настоящему изобретению может быть соль с неорганической кислотой или органической кислотой, причем неорганическая кислота может быть соляной кислотой, серной кислотой, азотной кислотой, фосфорной кислотой, хлорной кислотой, бромноватой кислотой и т.д., и органическая кислота может быть уксусной кислотой, метансульфоновой кислотой, этансульфоновой кислотой, п-толуолсульфоновой кислотой, фумаровой кислотой, малеиновой кислотой, малоновой кислотой, фталевой кислотой, янтарной кислотой, молочной кислотой, лимонной кислотой, глюконовой кислотой, винной кислотой, салициловой кислотой, яблочной кислотой, щавелевой кислотой, бензойной кислотой, эмбоновой кислотой, аспарагиновой кислотой, глутаминовой кислотой и т.д. Органическое основание, которое может использоваться для получения соли присоединения с органическим основанием, может включать трис(гидроксиметил)метиламин, дициклогексиламин и т.д. Аминокислоты, которые могут использоваться для получения соли присоединения с аминокислотой, могут включать натуральные аминокислоты, такие как аланин и глицин.
Соли могут быть получены с использованием обычного способа. Например, соли могут быть получены растворением соединения, представленного формулой (I), в водорастворимом растворителе, таком как метанол, этанол, ацетон и 1,4-диоксан, добавлением свободной кислоты или свободного основания и последующей кристаллизацией результанта.
Дополнительно, соединения согласно настоящему изобретению могут иметь хиральный углеродный центр, и таким образом, они могут присутствовать в форме изомера R или S, рацемического соединения, индивидуального энантиомера или смеси, индивидуального диастереомера или смеси, и все эти стереоизомеры и их смесь могут входить в объем настоящего изобретения.
Дополнительно, соединения согласно настоящему изобретению могут также включать гидрат или сольват гетероциклического производного, представленного формулой (I). Гидрат или сольват могут быть получены с использованием известного способа, и они предпочтительно являются нетоксичными и водорастворимыми, и в частности, они предпочтительно представляют собой воду или гидрат или сольват, имеющий 1-5 молекул спиртового растворителя (особенно этанола и т.д.), связанных с ним.
Настоящее изобретение также относится к применению соединения, выбранного из группы, состоящей из гетероциклического производного, представленного формулой (I), приведенной выше, и его фармацевтически приемлемой соли и стереоизомера для получения лекарственного средства для профилактики или лечения заболеваний, связанных с активацией белка STAT3.
Далее, настоящее изобретение относится к способу профилактики или лечения заболеваний, связанных с активацией белка STAT3, у млекопитающего, который включает введение млекопитающему соединения, выбранного из группы, состоящей из гетероциклического производного, представленного формулой (I), приведенной выше, и его фармацевтически приемлемой соли и стереоизомера.
Далее, настоящее изобретение относится к фармацевтической композиции для профилактики или лечения заболеваний, связанных с активацией белка STAT3, включающей соединение, выбранное из группы, состоящей из гетероциклического производного, представленного формулой (I), приведенной выше, и его фармацевтически приемлемой соли и стереоизомера в качестве активных ингредиентов.
В частности, заболевания, связанные с активацией белка STAT3, выбраны из группы, состоящей из солидных опухолей, гематологического рака или рака крови, радио- или хемо-резистентного рака, метастатического рака, воспалительных заболеваний, иммунологических заболеваний, диабета, дегенерации желтого пятна, инфекции папилломавируса человека и туберкулеза.
Более конкретно, заболевания, связанные с активацией белка STAT3, выбраны из группы, состоящей из рака молочной железы, рака легкого, рака желудка, рака предстательной железы, рака матки, рака яичника, рака почки, рака поджелудочной железы, рака печени, рака толстой кишки, рака кожи, рака головы и шеи, рака щитовидной железы, остеосаркомы, острого или хронического лейкоза, множественной миеломы, B- или Т-лимфоцитарной лимфомы, неходжкинской лимфомы, аутоиммунных заболеваний, включающих ревматоидный артрит, псориаз, гепатит, воспалительное заболевание кишечника, болезнь Крона, диабет, дегенерацию желтого пятна, инфекцию папилломавируса человека и туберкулез.
В частности, гетероциклическое производное, представленное формулой (I), приведенной выше, или его фармацевтически приемлемая соль или стереоизомер имеет превосходное ингибирующее действие в отношении активации белка STAT3, и таким образом, настоящее изобретение также относится к композиции для ингибирования белка STAT3, включающего его в качестве активного ингредиента.
Фармацевтическая композиция согласно настоящему изобретению, в дополнение к гетероциклическому производному, представленному формулой (I), приведенной выше, его фармацевтически приемлемой соли или его стереоизомеру, может дополнительно включать в качестве активных ингредиентов обычные и нетоксичные фармацевтически приемлемые добавки, например, носитель, эксципиент, разбавитель, адъювант и т.д., для составления в препарат согласно обычному способу.
Фармацевтическая композиция согласно настоящему изобретению может быть составлена в различные формы препаратов для перорального введения, такие как таблетки, пилюли, порошки, капсулы, сиропы или эмульсии, или для парентерального введения, такие как внутримышечные, внутривенные или подкожные инъекции и т.д., и предпочтительно в форме препарата для перорального введения.
Примеры добавок, которые используются в фармацевтической композиции согласно настоящему изобретению, могут включать подсластители, связующие, растворители, вспомогательные вещества для придания растворимости, смачивающие вещества, эмульгаторы, изотонические средства, абсорбирующие вещества, разрыхлители, антиоксиданты, консерванты, лубриканты, наполнители, ароматизаторы и т.д. Например, они могут включать лактозу, декстрозу, сахарозу, маннит, сорбит, целлюлозу, глицин, диоксид кремния, тальк, стеариновую кислоту, стеарин, стеарат магния, алюмосиликат магния, крахмал, желатин, трагакант, альгиновую кислоту, альгинат натрия, метилцеллюлозу, натрий карбоксиметилцеллюлозу, агар-агар, воду, этанол, полиэтиленгликоль, поливинилпирролидон, хлорид натрия, хлорид кальция, апельсиновое эфирное масло, земляничное эфирное масло, аромат ванили и т.д.
Фармацевтическая композиция согласно настоящему изобретению может быть составлена в препарат для перорального введения добавлением добавок к активным ингредиентам, причем добавки могут включать целлюлозу, силикат кальция, кукурузный крахмал, лактозу, сахарозу, декстрозу, фосфат кальция, стеариновую кислоту, стеарат магния, стеарат кальция, желатин, тальк, поверхностно-активные вещества, суспендирующие средства, эмульгаторы, разбавители и т.д.
Фармацевтическая композиция согласно настоящему изобретению может быть составлена в препарат для инъекции добавлением к активным ингредиентам добавок, например, воды, физиологического раствора, раствора глюкозы, водного аналога раствора глюкозы, спирта, гликоля, простого эфира, масла, жирной кислоты, эфира жирной кислоты, глицерида, поверхностно-активных веществ, суспендирующих средств, эмульгаторов и т.д.
Соединение согласно настоящему изобретению можно вводить предпочтительно в количестве от 0,1 до 2000 мг/сутки в расчете на взрослого пациента с массой тела 70 кг. Соединение согласно настоящему изобретению можно вводить один раз в сутки или в нескольких разделенных дозах. Дозировка соединения согласно настоящему изобретению может варьировать в зависимости от состояний здоровья, возраста, массы тела, пола пациента, пути введения, серьезности заболевания и т.д., и объем настоящего изобретения не ограничен дозой, предложенной выше.
Пример
Далее, настоящее изобретение описано более подробно следующими примерами, но они приведены только в целях иллюстрации, и настоящее изобретение ими не ограничено.
Определение аббревиатур, используемых в следующих примерах, является следующим.
Промежуточное соединение 1) Синтез гидрохлорида 6-(метилсульфонамидо)-1H-индол-2-карбоновой кислоты
(a) Синтез метил-6-нитро-1H-индол-2-карбоксилата
6-нитро-1H-индол-2-карбоновую кислоту (100,0 мг, 0,49 ммоль) растворяли в MeOH (2,4 мл) и медленно добавляли SOCl2 (100,0 мкл). Реакционную смесь нагревали с обратным холодильником в течение 4 часов и концентрировали при пониженном давлении, и остаток очищали флэш-хроматографией на колонке (амин силикагель, CH2Cl2: MeOH = 30: 1), получая метил-6-нитро-1H-индол-2-карбоксилат (107,0 мг, 100 %) в форме твердого вещества желтого цвета.
1H-ЯМР (300 МГц, ДМСО-d6): δ 12,64 (ушир.с, 1H), 8,34 (с, 1H), 7,92 (м, 2H), 7,33 (с, 1H), 3,93 (с, 3H)
(b) Синтез метил-6-амино-1H-индол-2-карбоксилата
Метил-6-нитро-1H-индол-2-карбоксилат (4,3 г, 19,39 ммоль) растворяли в смеси THF/MeOH/H2O (115,0 мл, 1/1/0,5 об./об.) и добавляли Zn (12,7 г, 0,19 ммоль) и NH4Cl (3,1 г, 58,14 ммоль). Реакционную смесь обрабатывали ультразвуком при 40°C в течение 1 часа, фильтровали через Целит и концентрировали при пониженном давлении. Остаток перекристаллизовывали в смеси i-PR2O/MeOH/EtOAc (100,0 мл, 1/0,1/0,1 об./об.), получая метил-6-амино-1H-индол-2-карбоксилат (3,2 г, 86 %) в форме твердого вещества желтого цвета.
LC/MS (ESI +): 191 (M+1)
(c) Синтез метил-6-(метилсульфонамидо)-1H-индол-2-карбоксилата
Метил-6-амино-1H-индол-2-карбоксилат (250,0 мг, 1,31 ммоль) растворяли в пиридине (10,0 мл), и метансульфонил хлорид (107,0 мкл, 1,38 ммоль) медленно добавляли при 0°C. Реакционную смесь перемешивали при комнатной температуре в течение 3 часов, экстрагировали EtOAc, промывали солевым раствором, высушивали над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток перекристаллизовывали в смеси i-PR2O/MeOH (100,0 мл, 1/0,1 об./об.), получая метил-6-(метилсульфонамидо)-1H-индол-2-карбоксилат (280,0 мг, 80 %) в форме твердого вещества желтого цвета.
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,87 (ушир.с, 1H), 9,69 (ушир.с, 1H), 7,60 (д, 1H, J=9,0 Гц), 7,37 (с, 1H), 7,11 (м, 1H), 6,98 (дд, 1H, J=8,4, 1,8 Гц), 3,85 (с, 3H), 2,95 (с, 3H)
(d) Синтез гидрохлорида 6-(метилсульфонамидо)-1H-индол-2-карбоновой кислоты
Метил-6-(метилсульфонамидо)-1H-индол-2-карбоксилат (280,0 мг, 1,04 ммоль) растворяли в смеси THF/MeOH/H2O (5,6 мл, 5/3/1 об./об.) и добавляли LiOH·H2O (125,0 мг, 5,22 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 10 часов, концентрировали при пониженном давлении. Остаток разбавляли в H2O (2,0 мл), подкисляли до рН 1-2 с помощью 1н. HCl и экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток перекристаллизовывали со смесью i-PR2O/MeOH (10,0 мл, 1/0,1 об./об.), получая гидрохлорид 6-(метилсульфонамидо)-1H-индол-2-карбоновой кислоты (136,0 мг, 45 %) в форме твердого вещества грязно-белого цвета.
1H-ЯМР (300 МГц, ДМСО-d6): δ 12,60 (ушир.с, 1H), 11,48 (ушир.с, 1H), 9,43 (ушир.с, 1H), 7,36 (д, 1H, J=8,4 Гц), 7,15 (с, 1H), 6,82 (м, 1H), 6,75 (дд, 1H, J=8,4, 1,8 Гц), 2,73 (с, 3H)
Промежуточное соединение 2) Синтез гидрохлорида 6-((N-метилсульфамоил)амино)-1H-индол-2-карбоновой кислоты
(a) Синтез метил-6-((N-метилсульфамоил)амино)-1H-индол-2-карбоксилата
Метил-6-амино-1H-индол-2-карбоксилат (промежуточное соединение 1-b) (900,0 мг, 4,73 ммоль) и DMAP (2,0 г, 16,60 ммоль) растворяли в CH3CN (20,0 мл), и метилсульфамоил хлорид (644,0 мг, 4,97 ммоль) медленно добавляли при 0°C. После нагревания с обратным холодильником в течение 1 часа, реакционную смесь экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 4:1), получая метил-6-((N-метилсульфамоил)амино)-1H-индол-2-карбоксилат (902,0 мг, 64 %) в форме твердого вещества коричневого цвета.
LC/MS ESI (+): 284 (M+1)
(b) Синтез гидрохлорида 6-((N-метилсульфамоил)амино)-1H-индол-2-карбоновой кислоты
Метил-6-((N-метилсульфамоил)амино)-1H-индол-2-карбоксилат (900,0 мг, 3,18 ммоль) растворяли в смеси THF/MeOH/H2O (18,0 мл, 5/10/3 об./об.) и добавляли LiOH·H2O (380,0 мг, 15,90 ммоль). После перемешивания при комнатной температуре в течение 14 часов, реакционную смесь концентрировали при пониженном давлении. Остаток разбавляли в H2O (2,0 мл), подкисляли до рН 1-2 с помощью 1н. HCl и экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток перекристаллизовывали, используя i-PR2O, получая гидрохлорид 6-((N-метилсульфамоил)амино)-1H-индол-2-карбоновой кислоты (630,0 мг, 70 %) в форме твердого вещества коричневого цвета.
LC/MS ESI (+): 270 (M+1)
Промежуточное соединение 3) Синтез 5-(метилсульфонамидо)бензо[b]тиофен-2-карбоновой кислоты
(a) Синтез этил-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксилата
Этил-5-амино-1-бензотиофен-2-карбоксилат (300,0 мг, 1,36 ммоль) растворяли в пиридине (15,0 мл), и метансульфонил хлорид (111,0 мкл, 1,38 ммоль) медленно добавляли при 0°C. Реакционную смесь перемешивали при комнатной температуре в течение 3 часов, экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток перекристаллизовывали, используя смесь i-PR2O/MeOH (100,0 мл, 1/0,1 об./об.), получая этил-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксилат (350,0 мг, 86 %) в форме твердого вещества желтого цвета.
LC/MS ESI (+): 300 (M+1)
(b) Синтез 5-(метилсульфонамидо)бензо[b]тиофен-2-карбоновой кислоты
Этил-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксилат (189,0 мг, 0,66 ммоль) растворяли в смеси THF/H2O (6,6 мл, 2/1 об./об.) и LiOH·H2O (278,0 мг, 6,62 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 10 часов, концентрировали при пониженном давлении. Остаток разбавляли в H2O (2,0 мл) и подкисляли до рН 1-2 с помощью 1н. HCl. Осадок отфильтровывали, промывали i-PR2O и высушивали при пониженном давлении, получая 5-(метилсульфонамидо)бензо[b]тиофен-2-карбоновую кислоту (165,5 мг, 92 %) в форме твердого вещества грязно-белого цвета.
LC/MS ESI (+): 272 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 13,50 (с, 1H), 9,88 (с, 1H), 8,08 (с, 1H), 8,00 (д, 1H, J=9,0 Гц), 7,82 (д, 1H, J=1,8 Гц), 7,35 (дд, 1H, J=9,0, 1,8 Гц), 3,01 (с, 3H)
Промежуточное соединение 4) Синтез 5-(морфолин-4-сульфонамидо)бензо[b]тиофен-2-карбоновой кислоты
Процедуру синтеза Промежуточного соединения 3 повторяли за исключением использования этил-5-амино-1-бензотиофен-2-карбоксилата (100,0 мг, 0,45 ммоль), получая 5-(морфолин-4-сульфонамидо)бензо[b]тиофен-2-карбоновую кислоту (60,0 мг).
LC/MS ESI (+): 343 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 13,40 (ушир.с, 1H), 10,67 (с, 1H), 8,09 (с, 1H), 7,97 (д, 1H, J=8,8 Гц), 7,81 (д, 1H, J=1,9 Гц), 7,37 (дд, 1H, J=8,8, 2,1 Гц), 3,50-3,52 (м, 4H), 3,07-3,09 (м, 4H)
Промежуточное соединение 5) Синтез 5-((тетрагидрофуран)-3-сульфонамидо)бензо[b]тиофен-2-карбоновой кислоты
Процедуру синтеза Промежуточного соединения 3 повторяли за исключением использования этил-5-амино-1-бензотиофен-2-карбоксилата (100,0 мг, 0,45 ммоль), получая 5-((тетрагидрофуран)-3-сульфонамидо)бензо[b]тиофен-2-карбоновую кислоту (16,0 мг).
LC/MS ESI (+): 328 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,09 (с, 1H), 8,11 (с, 1H), 8,02 (д, 1H, J=8,8 Гц), 7,86 (д, 1H, J=1,6 Гц), 7,38 (дд, 1H, J=8,8, 1,6 Гц), 3,90-4,01 (м, 2H), 3,79-3,87 (м, 2H), 3,61-3,66 (м, 1H), 2,12-2,18 (м, 2H)
Промежуточное соединение 6) Синтез 3-метил-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоновой кислоты
(a) Синтез этил-3-метил-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоксилата
Этил-6-амино-3-метилбензо[b]тиофен-2-карбоксилат (300,0 мг, 1,27 ммоль) растворяли в пиридине (12,7 мл), и метансульфонил хлорид (128,0 мкл, 1,65 ммоль) медленно добавляли при 0°C. Реакционную смесь перемешивали при комнатной температуре в течение 1 часа и экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (амин силикагель, CH2Cl2 : MeOH = 20:1), получая этил-3-метил-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоксилат (394,0 мг, 99 %) в форме твердого вещества белого цвета.
LC/MS ESI (+): 314 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 9,90 (с, 1H), 7,98 (д, 1H, J=8,8 Гц), 7,72 (м, 1H), 7,42 (дд, 1H, J=8,8, 1,8 Гц), 4,33 (кв., 2H, J=7,2 Гц), 3,01 (с, 3H), 2,68 (с, 3H), 1,33 (т, 3H, J=6,9 Гц)
(b) Синтез 3-метил-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоновой кислоты
Этил-3-метил-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоксилат (390,0 мг, 1,24 ммоль) растворяли в смеси THF/H2O (24,8 мл, 2/1 об./об.) и добавляли LiOH·H2O (261,0 мг, 6,22 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 10 часов, концентрировали при пониженном давлении. Остаток разбавляли в H2O (2,0 мл), подкисляли до рН 1-2 с помощью 1н. HCl и экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении, получая 3-метил-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоновую кислоту (354,0 мг, 100 %) в форме твердого вещества белого цвета.
1H-ЯМР (300 МГц, ДМСО-d6): δ 13,38 (ушир.с, 1H), 9,87 (с, 1H), 7,96 (д, 1H, J=8,8 Гц), 7,71 (м, 1H), 7,40 (дд, 1H, J=8,8, 1,8 Гц), 3,01 (с, 3H), 2,66 (с, 3H)
Промежуточное соединение 7) Синтез 5-(метилсульфонамидо)бензофуран-2-карбоновую кислота
(a) Синтез этил-5-(метилсульфонамидо)бензофуран-2-карбоксилата
Этил-5-аминобензофуран-2-карбоксилат (300,0 мг, 1,46 ммоль) растворяли в пиридине (15,0 мл), и метансульфонил хлорид (119,0 мкл, 1,38 ммоль) медленно добавляли при 0°C. Реакционную смесь перемешивали при комнатной температуре в течение 3 часов, экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток перекристаллизовывали, используя смесь i-PR2O/MeOH (100,0 мл, 1/0,1 об./об.), получая этил-5-(метилсульфонамидо)бензофуран-2-карбоксилат (300,0 мг, 72 %) в форме твердого вещества грязно-белого цвета.
LC/MS ESI (+): 284 (M+1)
(b) Синтез 5-(метилсульфонамидо)бензофуран-2-карбоновой кислоты
Этил-5-(метилсульфонамидо)бензофуран-2-карбоксилат (180,0 мг, 0,71 ммоль) растворяли в смеси THF/H2O (6,6 мл, 2/1 об./об.) добавляли и LiOH·H2O (299,0 мг, 6,62 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 10 часов, концентрировали при пониженном давлении. Остаток разбавляли в H2O (2,0 мл) и подкисляли до рН 1-2 с помощью 1н. HCl. Осадок отфильтровывали и промывали i-PR2O. Осадок высушивали при пониженном давлении, получая 5-(метилсульфонамидо)бензофуран-2-карбоновую кислоту (170,0 мг, 94 %) в форме твердого вещества грязно-белого цвета.
LC/MS ESI (+): 256 (M+1)
Промежуточное соединение 8) Синтез 5-метокси-6-(метилсульфонамидо)-1H-индол-2-карбоновой кислоты
(a) Синтез этил-5-метокси-6-(метилсульфонамидо)-1H-индол-2-карбоксилата
Этил-6-амино-5-метокси-1H-индол-2-карбоксилат (100,0 мг, 0,43 ммоль) растворяли в пиридине (4,3 мл), и метансульфонил хлорид (39,8 мкл, 0,51 ммоль) медленно добавляли при 0°C. Реакционную смесь перемешивали при комнатной температуре в течение 1 часа, экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (амин силикагель, CH2Cl2 : MeOH = 20:1), получая этил-5-метокси-6-(метилсульфонамидо)-1H-индол-2-карбоксилат (131,0 мг, 97 %) в форме твердого вещества белого цвета.
LC/MS ESI (+): 313 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,71 (с, 1H), 8,90 (ушир.с, 1H), 7,39 (с, 1H), 7,19 (с, 1H), 7,04 (м, 1H), 4,31 (кв., 2H, J=7,2 Гц), 3,83 (с, 3H), 2,91 (с, 3H), 1,32 (т, 3H, J=7,5 Гц)
(b) Синтез 5-метокси-6-(метилсульфонамидо)-1H-индол-2-карбоновой кислоты
Этил-5-метокси-6-(метилсульфонамидо)-1H-индол-2-карбоксилат (131,0 мг, 0,42 ммоль) растворяли в смеси THF/H2O (8,4 мл, 2/1 об./об.) и добавляли LiOH·H2O (88,0 мг, 2,10 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 10 часов, подкисляли до рН 1-2 с помощью 1н. HCl, и экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении, получая 5-метокси-6-(метилсульфонамидо)-1H-индол-2-карбоновую кислоту (119,0 мг, 100 %) в форме твердого вещества белого цвета.
LC/MS ESI (+): 285 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6); δ 12,88 (ушир.с, 1H), 11,59 (с, 1H), 8,83 (с, 1H), 7,38 (с, 1H), 7,20 (с, 1H), 6,98 (с, 1H), 3,83 (с, 3H), 2,91 (с, 3H)
Промежуточное соединение 9) Синтез гидрохлорида 6-(метилсульфонамидо)-1H-пирроло[2,3-b]пиридин-2-карбоновой кислоты
(a) Синтез 6-амино-1H-пирроло[2,3-b]пиридин-2-карбоновой кислоты
В закрытой пробирке 6-хлор-1H-пирроло[2,3-b]пиридин-2-карбоновую кислоту (500,0 мг, 2,53 ммоль) растворяли в 30%-ом NH4OH (15,0 мл) и добавляли CuSO4·5H2O (318,0 мг, 1,27 ммоль). Реакционную смесь нагревали с обратным холодильником при 150°C в течение 48 часов и концентрировали при пониженном давлении, получая смесь твердого вещества белого цвета 6-хлор-1H-пирроло[2,3-b]пиридин-2-карбоновой кислоты и 6-амино-1H-пирроло[2,3-b]пиридин-2-карбоновой кислоты 1:1.
LC/MS ESI (+): 178 (M+1)
(b) Синтез метил-6-амино-1H-пирроло[2,3-b]пиридин-2-карбоксилата
Смесь (500,0 мг) 6-хлор-1H-пирроло[2,3-b]пиридин-2-карбоновой кислоты и 6-амино-1H-пирроло[2,3-b]пиридин-2-карбоновой кислоты растворяли в MeOH (20,0 мл) и добавляли SOCl2 (4,0 мл). Реакционную смесь нагревали с обратным холодильником при 80°C в течение 19 часов и концентрировали при пониженном давлении, получая смесь твердого вещества белого цвета метил-6-хлор-1H-пирроло[2,3-b]пиридин-2-карбоксилата и метил-6-амино-1H-пирроло[2,3-b]пиридин-2-карбоксилата 1:1.
LC/MS ESI (+): 192 (M+1)
(c) Синтез метил-6-(метилсульфонамидо)-1H-пирроло[2,3-b]пиридин-2-карбоксилата
Процедуру синтеза Промежуточного соединения 6-a повторяли за исключением использования смеси метил-6-хлор-1H-пирроло[2,3-b]пиридин-2-карбоксилата и метил-6-амино-1H-пирроло[2,3-b]пиридин-2-карбоксилата, получая метил-6-(метилсульфонамидо)-1H-пирроло[2,3-b]пиридин-2-карбоксилат (76,0 мг, 3 стадии выход: 8 %) в форме твердого вещества белого цвета.
LC/MS ESI (+): 270 (M+1)
(d) Синтез гидрохлорида 6-(метилсульфонамидо)-1H-пирроло[2,3-b]пиридин-2-карбоновой кислоты
Процедуру синтеза Промежуточного соединения 6-b повторяли за исключением использования метил-6-(метилсульфонамидо)-1H-пирроло[2,3-b]пиридин-2-карбоксилата (76,0 мг, 0,20 ммоль), получая гидрохлорид 6-(метилсульфонамидо)-1H-пирроло[2,3-b]пиридин-2-карбоновой кислоты (30,0 мг, 60 %).
LC/MS ESI (+): 256 (M+1)
Промежуточное соединение 10) Синтез гидрохлорида 6-(метилсульфонамидо)-1H-пирроло[3,2-c]пиридин-2-карбоновой кислоты
Процедуру синтеза Промежуточного соединения 9 повторяли за исключением использования 6-хлор-1H-пирроло[3,2-c]пиридин-2-карбоновой кислоты (300,0 мг), получая гидрохлорид 6-(метилсульфонамидо)-1H-пирроло[3,2-c]пиридин-2-карбоновой кислоты (30,0 мг).
LC/MS ESI (+): 256 (M+1)
Промежуточное соединение 11) Синтез гидрохлорида 5-(метилсульфонамидо)-1H-пирроло[2,3-c]пиридин-2-карбоновой кислоты
Процедуру синтеза Промежуточного соединения 9 повторяли за исключением использования этил-5-бром-1H-пирроло[2,3-c]пиридин-2-карбоксилата (200,0 мг, 0,74 ммоль), получая гидрохлорид 5-(метилсульфонамидо)-1H-пирроло[2,3-c]пиридин-2-карбоновой кислоты (21,6 мг).
LC/MS ESI (+): 256 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 13,48 (ушир.с, 1H), 12,17 (с, 1H), 9,98 (с, 1H), 8,58 (с, 1H), 7,29 (с, 1H), 7,06 (с, 1H), 3,19 (с, 3H)
Промежуточное соединение 12) Синтез 4-(метилсульфонамидо)тиофен-2-карбоновую кислота
(a) Синтез метил-4-(метилсульфонамидо)тиофен-2-карбоксилата
Процедуру синтеза Промежуточного соединения 1-с повторяли за исключением использования метил-4-аминотиофен-2-карбоксилата (100,0 мг, 0,64 ммоль), получая метил-4-(метилсульфонамидо)тиофен-2-карбоксилат (110,0 мг, 73 %).
LC/MS ESI (+): 236 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,63 (д, 1H, J=1,6 Гц), 7,31 (д, 1H, J=1,6 Гц), 6,61 (с, 1H), 3,90 (с, 3H), 3,03 (с, 3H)
(b) Синтез 4-(метилсульфонамидо)тиофен-2-карбоновой кислоты
Процедуру синтеза Промежуточного соединения 1-d повторяли за исключением использования метил-4-(метилсульфонамидо)тиофен-2-карбоксилата (110,0 мг, 0,47 ммоль), получая 4-(метилсульфонамидо)тиофен-2-карбоновую кислоту (95,0 мг, 91 %).
1H-ЯМР (400 МГц, MeOH-d4): δ 7,59 (д, 1H, J=1,7 Гц), 7,30 (д, 1H, J=1,7 Гц), 2,97 (с, 3H)
Промежуточное соединение 13) Синтез 6-(метилсульфонамидо)бензо[b]тиофен-2-карбоновой кислоты
(a) Синтез метил-6-нитробензо[b]тиофен-2-карбоксилата
2,4-динитробензальдегид (1,2 г, 5,96 ммоль) и Et3N (2,0 мл, 14,40 ммоль) растворяли в ДМСО (7,0 мл), и метил-2-меркаптоацетат (0,6 мл, 6,00 ммоль) медленно добавляли при комнатной температуре. После перемешивания в течение 12 часов, реакционную смесь нагревали при 110°C в течение 2 часов. Реакционную смесь экстрагировали EtOAc, промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток промывали Et2O, получая метил-6-нитробензо[b]тиофен-2-карбоксилат (1,1 г, 78 %) в форме твердого вещества желтого цвета.
1H-ЯМР (300 МГц, ДМСО-d6): δ 9,18 (с, 1H), 8,38 (с, 1H), 8,26-8,27 (м, 2H), 3,93 (с, 3H)
(b) Синтез метила-6-аминобензо[b]тиофен-2-карбоксилата
Метил-6-нитробензо[b]тиофен-2-карбоксилат (500,0 мг, 2,11 ммоль), Zn (2,1 г, 31,60 ммоль) и NH4Cl (564,0 мг, 10,60 ммоль) растворяли в смеси THF/MeOH/H2O (42,0 мл, 1/0,5/0,5 об./об.). Реакционную смесь обрабатывали ультразвуком в течение 2 часов, фильтровали через Целит и концентрировали при пониженном давлении, получая метил-6-аминобензо[b]тиофен-2-карбоксилат (437,0 мг) в форме твердого вещества белого цвета без очистки.
LC/MS ESI (+): 208 (M+1)
(c) Синтез метил-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоксилата
Сырой метил-6-аминобензо[b]тиофен-2-карбоксилат (437,0 мг) растворяли в пиридине (21,0 мл), и метансульфонил хлорид (213,0 мкл, 2,74 ммоль) медленно добавляли при комнатной температуре. После перемешивания в течение 2 часов, реакционную смесь экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (амин силикагель, н-гексан : EtOAc = 1:1), получая метил-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоксилат (272,0 мг, 2 стадии выход: 45 %) в форме твердого вещества желтого цвета.
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,18 (с, 1H), 8,14 (с, 1H), 7,97 (д, 1H, J=8,8 Гц), 7,83 (с, 1H), 7,30 (дд, 1H, J=9,2, 1,5 Гц), 3,87 (с, 3H), 3,09 (с, 3H)
(d) Синтез 6-(метилсульфонамидо)бензо[b]тиофен-2-карбоновой кислоты
Метил-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоксилат (270,0 мг, 0,95 ммоль) и LiOH·H2O (199,0 мг, 4,73 ммоль) растворяли в смеси THF/H2O (9,5 мл, 4/1 об./об.) с последующим перемешиванием при комнатной температуре в течение 24 часов. Реакционную смесь подкисляли до рН 1-2 с помощью 1н. HCl и затем экстрагировали EtOAc. Органический экстракт высушивали над безводным Na2SO4 и фильтровали, получая 6-(метилсульфонамидо)бензо[b]тиофен-2-карбоновую кислоту (257,0 мг, 100 %) в форме твердого вещества белого цвета.
1H-ЯМР (300 МГц, ДМСО-d6): δ 13,30 (ушир.с, 1H), 10,11 (с, 1H), 8,03 (с, 1H), 7,94 (д, 1H, J=8,8 Гц), 7,80 (с, 1H), 7,29 (дд, 1H, J=8,8, 2,3 Гц), 3,07 (с, 3H)
Промежуточное соединение 14) Синтез 6-фтор-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоновой кислоты
(a) Синтез метил-6-фтор-5-нитробензо[b]тиофен-2-карбоксилата
Процедуру синтеза 13-a Промежуточного соединения повторяли за исключением использования 2,4-дифтор-5-нитробензальдегида (5,0 г, 26,70 ммоль), получая смесь метил-6-фтор-5-нитробензо[b]тиофен-2-карбоксилата (1,6 г).
1H-ЯМР (300 МГц, CDCl3): δ 8,62 (д, 1H, J=7,2 Гц), 8,13 (с, 1H), 7,77 (д, 1H, J=10,4 Гц), 3,99 (с, 3H)
(b) Синтез метил-5-амино-6-фторбензо[b]тиофен-2-карбоксилата
Процедуру синтеза Промежуточного соединения 13-b повторяли за исключением использования смеси метил-6-фтор-5-нитробензо[b]тиофен-2-карбоксилата (1,6 г), получая метил 5-амино-6-фторбензо[b]тиофен-2-карбоксилат (853,0 мг, 2 стадии выход: 14 %).
LC/MS ESI (+): 226 (M+1)
1H-ЯМР (300 МГц, CDCl3): δ 7,86 (с, 1H), 7,45 (д, 1H, J=10,8 Гц), 7,21 (д, 1H, J=8,4 Гц), 3,92 (с, 3H), 3,86 (с, 2H)
(c) Синтез метил-6-фтор-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксилата
Процедуру синтеза Промежуточного соединения 13-с повторяли за исключением использования метил-5-амино-6-фторбензо[b]тиофен-2-карбоксилата (530,0 мг, 2,35 ммоль), получая метил-6-фтор-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксилат (663,0 мг, 93 %).
LC/MS ESI (+): 304 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 9,78 (с, 1H), 8,23 (с, 1H), 8,12 (д, 1H, J=10,3 Гц), 8,06 (д, 1H, J=7,7 Гц), 3,89 (с, 3H), 3,06 (с, 3H)
(d) Синтез 6-фтор-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоновой кислоты
Процедуру синтеза Промежуточного соединения 13-d повторяли за исключением использования метил-6-фтор-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксилата (134,6 мг, 0,44 ммоль), получая 6-фтор-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоновую кислоту (118,0 мг, 92 %).
LC/MS ESI (+): 290 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 13,56 (ушир.с, 1H), 9,75 (с, 1H), 8,11 (с, 1H), 8,08 (д, 1H, J=10,4 Гц), 8,02 (д, 1H, J=7,7 Гц), 3,06 (с, 3H)
Промежуточное соединение 15) Синтез 6-фтор-5-(N-метилметилсульфонамидо)бензо[b]тиофен-2-карбоновой кислоты
(a) Синтез метил-6-фтор-5-(N-метилметилсульфонамидо)бензо[b]тиофен-2-карбоксилата
Метил-6-фтор-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксилат (промежуточное соединение 14-с) (663,0 мг, 2,19 ммоль) растворяли в безводном DMF (22,0 мл), и CH3I (272,0 мкл, 4,37 ммоль) и K2CO3 (906,4 мг, 6,56 ммоль) добавляли при комнатной температуре. Реакционную смесь нагревали при 60°C в течение 14 часов и охлаждали до комнатной температуры, с последующим добавлением воды и экстракцией EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 1:1), получая метил-6-фтор-5-(N-метилметилсульфонамидо)бензо[b]тиофен-2-карбоксилат (672,8 мг, 97 %) в форме твердого вещества грязно-белого цвета.
LC/MS ESI (+): 318 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 8,22 (д, 1H, J=7,6 Гц), 8,20 (с, 1H), 8,16 (д, 1H, J=10,6 Гц), 3,89 (с, 3H), 3,26 (с, 3H), 3,12 (с, 3H)
(b) Синтез 6-фтор-5-(N-метилметилсульфонамидо)бензо[b]тиофен-2-карбоновой кислоты
Процедуру синтеза Промежуточного соединения 13-d повторяли за исключением использования метил-6-фтор-5-(N-метилметилсульфонамидо)бензо[b]тиофен-2-карбоксилата (672,8 мг, 2,12 ммоль), получая 6-фтор-5-(N-метилметилсульфонамидо)бензо[b]тиофен-2-карбоновую кислоту (596,8 мг, 93 %).
LC/MS ESI (+): 304 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 13,65 (ушир.с, 1H), 8,20 (д, 1H, J=7,5 Гц), 8,20 (д, 1H, J=10,5 Гц), 8,08 (с, 1H), 3,26 (с, 3H), 3,12 (с, 3H)
Промежуточное соединение 16) Синтез 4-фтор-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоновой кислоты
Процедуру синтеза Промежуточного соединения 13 повторяли за исключением использования 2,6-дифтор-3-нитробензальдегида (300,0 мг, 1,60 ммоль), получая 4-фтор-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоновую кислоту (14,7 мг).
LC/MS ESI (+): 290 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 13,83 (ушир.с, 1H), 9,77 (с, 1H), 8,03 (м, 1H), 7,88 (д, 1H, J=8,4 Гц), 7,48-7,50 (м, 1H), 3,04 (с, 3H)
Промежуточное соединение 17) Синтез гидрохлорида 5-(метилсульфонамидо)-4-морфолинобензо[b]тиофен-2-карбоновой кислоты
(a) Синтез метил-4-фтор-5-нитробензо[b]тиофен-2-карбоксилата
Процедуру синтеза Промежуточного соединения 13-a повторяли за исключением использования 2,6-дифтор-3-нитробензальдегида (300,0 мг, 1,60 ммоль), получая региоизомеры (84,0 мг), включая метил-4-фтор-5-нитробензо[b]тиофен-2-карбоксилат.
1H-ЯМР (300 МГц, CDCl3): δ 8,30 (с, 1H), 8,13-8,17 (м, 1H), 7,74 (д, 1H, J=8,8 Гц), 4,00 (с, 3H)
(b) Синтез метил-4-морфолино-5-нитробензо[b]тиофен-2-карбоксилата
Региоизомеры метил-4-фтор-5-нитробензо[b]тиофен-2-карбоксилата (82,0 мг, 0,32 ммоль), морфолин (55,5 мкл, 0,64 ммоль) и K2CO3 (88,7 мг, 0,64 ммоль) растворяли в ДМСО (2,6 мл). Реакционную смесь нагревали при 100°C в течение 5 часов. Реакционную смесь экстрагировали EtOAc, промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 1:1), получая метил-4-морфолино-5-нитробензо[b]тиофен-2-карбоксилат (20,5 мг, 2 стадии выход: 4 %) в форме твердого вещества желтого цвета.
LC/MS ESI (+): 323 (M+1)
1H-ЯМР (300 МГц, CDCl3): δ 8,24 (с, 1H), 7,70 (д, 1H, J=8,8 Гц), 7,60 (д, 1H, J=8,8 Гц), 3,99 (с, 3H), 3,30-3,90 (м, 4H), 3,28-3,30 (м, 4H)
(c) Синтез метил-5-амино-4-морфолинобензо[b]тиофен-2-карбоксилата
Процедуру синтеза Промежуточного соединения 13-b повторяли за исключением использования метил-4-морфолино-5-нитробензо[b]тиофен-2-карбоксилата (19,0 мг, 0,06 ммоль), получая метил-5-амино-4-морфолинобензо[b]тиофен-2-карбоксилат (22,0 мг, колич.).
LC/MS ESI (+): 293 (M+1)
1H-ЯМР (300 МГц, CDCl3): δ 8,25 (с, 1H), 7,50 (д, 1H, J=8,8 Гц), 7,00 (д, 1H, J=8,4 Гц), 4,36 (ушир.с, 2H), 3,97-4,03 (м, 2H), 3,95 (с, 3H), 3,76-3,82 (м, 2H), 3,55-3,62 (м, 2H), 2,83-2,86 (м, 2H)
(d) Синтез метил-5-(метилсульфонамидо)-4-морфолинобензо[b]тиофен-2-карбоксилата
Процедуру синтеза Промежуточного соединения 13-с повторяли за исключением использования метил-5-амино-4-морфолинобензо[b]тиофен-2-карбоксилата (20,0 мг, 0,07 ммоль), получая метил-5-(метилсульфонамидо)-4-морфолинобензо[b]тиофен-2-карбоксилат (16,8 мг, 66 %).
LC/MS ESI (+): 371 (M+1)
1H-ЯМР (300 МГц, CDCl3): δ 8,33 (с, 1H), 8,31 (с, 1H), 7,77 (с, 2H), 4,02-4,07 (м, 2H), 3,98 (с, 3H), 3,81-3,85 (м, 2H), 3,66-3,69 (м, 2H), 3,05 (с, 3H), 2,73-2,77 (м, 2H)
(e) Синтез гидрохлорида 5-(метилсульфонамидо)-4-морфолинобензо[b]тиофен-2-карбоновой кислоты
Процедуру синтеза Промежуточного соединения 13-d повторяли за исключением использования метил-5-(метилсульфонамидо)-4-морфолинобензо[b]тиофен-2-карбоксилата (15,0 мг, 0,04 ммоль), получая гидрохлорид 5-(метилсульфонамидо)-4-морфолинобензо[b]тиофен-2-карбоновой кислоты (10,2 мг, 71 %).
LC/MS ESI (+): 357 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 13,68 (ушир.с, 1H), 8,84 (с, 1H), 8,05 (ушир.с, 1H), 7,83 (д, 1H, J=8,8 Гц), 7,50 (д, 1H, J=8,8 Гц), 3,80-3,82 (м, 4H), 3,18-3,20 (м, 4H), 3,07 (с, 3H)
Промежуточное соединение 18) Синтез гидрохлорида 5-(метилсульфонамидо)тиено[3,2-b]пиридин-2-карбоновой кислоты
(a) Синтез метил-5-бромтиено[3,2-b]пиридин-2-карбоксилата
Процедуру синтеза Промежуточного соединения 13-a повторяли за исключением использования 6-бром-3-фторпиколинальдегида (300,0 мг, 1,47 ммоль), получая метил-5-бромтиено[3,2-b]пиридин-2-карбоксилат (368,0 мг, 92 %).
LC/MS ESI (+): 272 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 8,57 (д, 1H, J=8,8 Гц), 8,20 (с, 1H), 7,75 (д, 1H, J=8,4 Гц), 3,93 (с, 3H)
(b) Синтез 5-бромтиено[3,2-b]пиридин-2-карбоновой кислоты
Процедуру синтеза Промежуточного соединения 13-d повторяли за исключением использования метил-5-бромтиено[3,2-b]пиридин-2-карбоксилата (368,0 мг, 1,35 ммоль), получая 5-бромтиено[3,2-b]пиридин-2-карбоновую кислоту без очистки.
LC/MS ESI (+): 258 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 8,53 (д, 1H, J=8,8 Гц), 8,10 (с, 1H), 7,72 (д, 1H, J=8,4 Гц)
(c) Синтез 5-аминотиено[3,2-b]пиридин-2-карбоновой кислоты
Процедуру синтеза Промежуточного соединения 9-a повторяли за исключением использования 5-бромтиено[3,2-b]пиридин-2-карбоновой кислоты, получая 5-аминотиено[3,2-b]пиридин-2-карбоновую кислоту без очистки.
LC/MS ESI (+): 195 (M+1)
(d) Синтез метил-5-аминотиено[3,2-b]пиридин-2-карбоксилата
Процедуру синтеза Промежуточного соединения 9-b повторяли за исключением использования 5-аминотиено[3,2-b]пиридин-2-карбоновой кислоты, получая метил-5-аминотиено[3,2-b]пиридин-2-карбоксилат (259,0 мг, 3 стадии выход: 92 %).
LC/MS ESI (+): 209 (M+1)
(e) Синтез метил-5-(метилсульфонамидо)тиено[3,2-b]пиридин-2-карбоксилата
Процедуру синтеза Промежуточного соединения 9-с повторяли за исключением использования метил-5-аминотиено[3,2-b]пиридин-2-карбоксилата (288,0 мг, 1,38 ммоль), получая метил 5-(метилсульфонамидо)тиено[3,2-b]пиридин-2-карбоксилат (159,0 мг, 40 %).
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,93 (с, 1H), 8,48 (д, 1H, J=8,8 Гц), 8,06 (с, 1H), 7,12 (д, 1H, J=8,8 Гц), 3,92 (с, 3H), 3,42 (с, 3H)
(f) Синтез гидрохлорида 5-(метилсульфонамидо)тиено[3,2-b]пиридин-2-карбоновой кислоты
Процедуру синтеза Промежуточного соединения 9-d повторяли за исключением использования метил-5-(метилсульфонамидо)тиено[3,2-b]пиридин-2-карбоксилата (159,0 мг, 0,56 ммоль), получая гидрохлорид 5-(метилсульфонамидо)тиено[3,2-b]пиридин-2-карбоновой кислоты (93,5 мг, 54 %).
LC/MS ESI (+): 273 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 13,75 (ушир.с, 1H), 10,87 (с, 1H), 8,45 (д, 1H, J=8,8 Гц), 7,95 (с, 1H), 7,09 (д, 1H, J=8,8 Гц), 3,41 (с, 3H)
Промежуточное соединение 19) Синтез гидрохлорида 5-(метилсульфонамидо)тиено[2,3-c]пиридин-2-карбоновой кислоты
Процедуру синтеза Промежуточного соединения 18 повторяли за исключением использования 2-хлор-5-фторизоникотинальдегида (500,0 мг, 3,13 ммоль), получая гидрохлорид 5-(метилсульфонамидо)тиено[2,3-c]пиридин-2-карбоновой кислоты (94,0 мг).
LC/MS ESI (+): 273 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 13,93 (ушир.с, 1H), 10,58 (ушир.с, 1H), 9,09 (с, 1H), 8,11 (с, 1H), 7,55 (с, 1H), 3,30 (с, 3H)
Промежуточное соединение 20) Синтез 5-(метилсульфонамидо)тиено[2,3-b]пиридин-2-карбоновой кислоты
(a) Синтез метилтиено[2,3-b]пиридин-2-карбоксилата
2-хлорникотинальдегид (300,0 мг, 2,12 ммоль) растворяли в безводном DMF (2,1 мл) и H2O (210,0 мкл) и медленно добавляли при комнатной температуре метил-2-меркаптоацетат (0,2 мл, 2,37 ммоль) и K2CO3 (327,0 мг, 2,37 ммоль). Реакционную смесь нагревали при 35°C в течение 12 часов. Реакционную смесь экстрагировали EtOAc, промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 1:5), получая метилтиено[2,3-b]пиридин-2-карбоксилат (288,0 мг, 70 %) в форме грязно-белого масла.
LC/MS ESI (+): 194 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 8,70 (дд, 1H, J=4,8, 1,6 Гц), 8,17 (дд, 1H, J=8,4, 1,6 Гц), 8,02 (с, 1H), 7,38 (дд, 1H, J=8,0, 4,8 Гц), 3,98 (с, 3H)
(b) Синтез 2-(метоксикарбонил)тиено[2,3-b]пиридин 7-оксида
Метилтиено[2,3-b]пиридин-2-карбоксилат (112,0 мг, 0,58 ммоль) растворяли в 35% H2O2 (190 мкл) и AcOH (170,0 мкл), и температуру реакции повышали до 55°C. Реакционную смесь нагревали в течение 2 часов, добавляли воду, чтобы остановить реакцию, экстрагировали CH2Cl2, Реакционную смесь промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 1:1), получая 2-(метоксикарбонил)тиено[2,3-b]пиридин 7-оксида (80,0 мг, 66 %) в форме твердого вещества белого цвета.
LC/MS ESI (+): 210 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 8,40 (д, 1H, J=6,0 Гц), 8,05 (с, 1H), 7,81 (д, 1H, J=8,4 Гц), 7,39 (дд, 1H, J=8,0, 6,4 Гц), 3,99 (с, 3H)
(c) Синтез 2-(метоксикарбонил)-5-нитротиено[2,3-b]пиридин 7-оксид
2-(Метоксикарбонил)тиено[2,3-b]пиридин 7-оксид (1,5 г, 7,21 ммоль) растворяли в AcOH (9,8 мл) и медленно добавляли HNO3 (430,0 мкл, 6,85 ммоль). Реакционную смесь нагревали при 120°C в течение 8 часов, охлаждали до комнатной температуры. И реакционную смесь концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 1:3), получая 2-(метоксикарбонил)-5-нитротиено[2,3-b]пиридин 7-оксид (478,0 мг, 26 %) в форме твердого вещества белого цвета.
LC/MS ESI (+): 255 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 9,20 (д, 1H, J=1,6 Гц), 8,61 (д, 1H, J=1,6 Гц), 8,18 (с, 1H), 4,02 (с, 3H)
(d) Синтез метил-5-аминотиено[2,3-b]пиридин-2-карбоксилата
2-(Метоксикарбонил)-5-нитротиено[2,3-b]пиридин 7-оксид (478,0 мг, 1,88 ммоль) растворяли в THF (40,0 мл). Под атмосферой газообразного водорода добавляли Ra-Ni, и реакционную смесь перемешивали при комнатной температуре в течение 12 часов, фильтровали через Целит и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 1:1), получая метил-5-аминотиено[2,3-b]пиридин-2-карбоксилат (175,0 мг, 45 %) в форме грязно-белого масла.
LC/MS ESI (+): 209 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 8,25 (ушир.с, 1H), 7,84 (с, 1H), 7,38 (д, 1H, J=2,4 Гц), 3,95 (с, 3H), 3,80 (ушир.с, 2H)
(e) Синтез метил-5-(метилсульфонамидо)тиено[2,3-b]пиридин-2-карбоксилата
Процедуру синтеза Промежуточного соединения 13-с повторяли за исключением использования метил-5-аминотиено[2,3-b]пиридин-2-карбоксилата (175,0 мг, 0,84 ммоль), получая метил-5-(метилсульфонамидо)тиено[2,3-b]пиридин-2-карбоксилат (234,0 мг, 93 %).
LC/MS ESI (+): 287 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 8,51 (д, 1H, J=2,4 Гц), 8,19 (д, 1H, J=2,4 Гц), 7,99 (с, 1H), 5,03 (с, 1H), 3,98 (с, 3H), 3,07 (с, 3H)
(f) Синтез 5-(метилсульфонамидо)тиено[2,3-b]пиридин-2-карбоновой кислоты
Процедуру синтеза Промежуточного соединения 13-d повторяли за исключением использования метил-5-(метилсульфонамидо)тиено[2,3-b]пиридин-2-карбоксилата (234,0 мг, 0,82 ммоль), получая 5-(метилсульфонамидо)тиено[2,3-b]пиридин-2-карбоновую кислоту (188,0 мг, 74 %).
LC/MS ESI (+): 273 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 10,17 (с, 1H) 8,56 (д, 1H, J=2,4 Гц), 8,25 (д, 1H, J=2,4 Гц), 8,14 (с, 1H), 3,09 (с, 3H)
Промежуточное соединение 21) Синтез 6-нитробензо[d]тиазол-2-карбоновой кислоты
Смесь 2-метил-6-нитробензо[d]тиазола (50,0 мг, 0,26 ммоль), KMnO4 (81,0 мг, 0,51 ммоль) и H2O (1,0 мл) нагревали при 105°C в течение 1 часа, и KMnO4 (81,0 мг, 0,51 ммоль) добавляли дважды с временным интервалом 1 часа с последующим перемешиванием в течение 2 часов. Температуру реакции понижали до комнатной температуры, и реакционную смесь фильтровали через Целит и концентрировали при пониженном давлении, получая 6-нитробензо[d]тиазол-2-карбоновую кислоту (40,0 мг, 70 %) в форме твердого вещества коричневого цвета.
LC/MS ESI (+): 225 (M+1)
Промежуточное соединение 22) Синтез 5-нитро-1H-бензо[d]имидазол-2-карбоновой кислоты
4-нитробензол-1,2-диамин (2,0 г, 13,1 ммоль) растворяли в AcOH (40,0 мл) и метил-2,2,2-трихлорацетимидат (1,8 мл, 14,4 ммоль), NH4Cl (310,0 мг, 5,88 ммоль) и DIPEA (2,1 мл, 11,8 ммоль) добавляли при 0°C с последующим перемешиванием при комнатной температуре в течение 2 часов. Реакционную смесь экстрагировали, используя CH2Cl2, и органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток растворяли в THF (30,0 мл) и добавляли 1н. водный раствор NaOH (100,0 мл) с последующим перемешиванием при комнатной температуре в течение 2 часов. Реакционную смесь нейтрализовали, добавляя 1н. водный раствор HCl (рН 7), и осадок отфильтровывали и промывали водой, получая 5-нитро-1H-бензо[d]имидазол-2-карбоновую кислоту (820,0 мг, 30 %) в форме твердого вещества белого цвета.
LC/MS ESI (+): 208 (M+1)
Промежуточное соединение 23) Синтез гидрохлорида 6-(метилсульфонамидо)имидазо[1,2-a]пиридин-2-карбоновой кислоты
(a) Синтез этил-6-нитроимидазо[1,2-a]пиридин-2-карбоксилата
5-нитропиридин-2-амин (1,5 г, 10,80 ммоль) и этил-3-бром-2-оксопропаноат (1,6 мл, 13,00 ммоль) растворяли в EtOH (15,0 мл) с последующим нагреванием с обратным холодильником в течение 16 часов. После завершения реакции, реакционную смесь фильтровали, получая твердое вещество светло-желтого цвета. Фильтрат экстрагировали EtOAc, промывали насыщ. водным раствором NaHCO3 и солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 2:1), получая этил-6-нитроимидазо[1,2-a]пиридин-2-карбоксилат (2,3 г, 90 %) в форме твердого вещества желтого цвета.
LC/MS ESI (+): 236 (M+1)
1H-ЯМР (300 МГц, CDCl3): δ 9,30 (с, 1H), 8,38 (с, 1H), 8,06 (д, 1H, J=10,0 Гц), 7,84 (д, 1H, J=10,4 Гц), 4,50 (кв., 2H, J=7,2 Гц), 1,46 (т, 3H, J=7,2 Гц)
(b) Синтез метил-6-аминоимидазо[1,2-a]пиридин-2-карбоксилата
Процедуру синтеза Промежуточного соединения 13-b повторяли за исключением использования этил-6-нитроимидазо[1,2-a]пиридин-2-карбоксилата (300,0 мг, 1,28 ммоль), получая метил-6-аминоимидазо[1,2-a]пиридин-2-карбоксилат (67,1 мг, 27 %).
LC/MS ESI (+): 192 (M+1)
1H-ЯМР (300 МГц, CDCl3): δ 8,02 (с, 1H), 7,54 (с, 1H), 7,51 (д, 1H, J=9,6 Гц), 6,87 (д, 1H, J=9,6 Гц), 3,96 (с, 3H), 3,53 (ушир.с, 2H)
(c) Синтез метил-6-(метилсульфонамидо)имидазо[1,2-a]пиридин-2-карбоксилата
Процедуру синтеза Промежуточного соединения 13-с повторяли за исключением использования метил-6-аминоимидазо[1,2-a]пиридин-2-карбоксилата (67,0 мг, 0,35 ммоль), получая метил-6-(метилсульфонамидо)имидазо[1,2-a]пиридин-2-карбоксилат (72,4 мг, 77 %).
LC/MS ESI (+): 270 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 9,82 (с, 1H), 8,60 (с, 1H), 8,50 (с, 1H), 7,62 (д, 1H, J=9,2 Гц), 7,24 (д, 1H, J=9,6 Гц), 3,82 (с, 3H), 3,04 (с, 3H)
(d) Синтез гидрохлорида 6-(метилсульфонамидо)имидазо[1,2-a]пиридин-2-карбоновой кислоты
Процедуру синтеза Промежуточного соединения 13-d повторяли за исключением использования метил-6-(метилсульфонамидо)имидазо[1,2-a]пиридин-2-карбоксилата (71,0 мг, 0,26 ммоль), получая гидрохлорид 6-(метилсульфонамидо)имидазо[1,2-a]пиридин-2-карбоновой кислоты (48,5 мг, 63 %).
LC/MS ESI (+): 256 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 9,81 (с, 1H), 8,55 (с, 1H), 8,51 (с, 1H), 7,63 (д, 1H, J=9,6 Гц), 7,24 (д, 1H, J=9,6 Гц), 3,05 (с, 3H)
Промежуточное соединение 24) Синтез 5-(метилсульфонил)-4,5,6,7-тетрагидротиено[3,2-c]пиридин-2-карбоновой кислоты
(a) Синтез трет-бутил-4-хлор-5-формил-3,6-дигидропиридин-1(2H)-карбоксилата
DMF (387,0 мкл, 5,02 ммоль) охлаждали до 0°C и медленно добавляли POCl3 (374,0 мкл, 4,02 ммоль). Результант разбавляли CH2Cl2 (1,0 мл), и реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь охлаждали снова до 0°C и медленно добавляли раствор трет-бутил-4-оксопиперидин-1-карбоксилата (500,0 мг, 2,51 ммоль) в CH2Cl2 (5,0 мл). После перемешивания при комнатной температуре в течение 2 часов, реакционную смесь лили в раствор NaOAc в воде со льдом. Реакционную смесь снова экстрагировали CH2Cl2, промывали дистиллированной водой, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток не очищали, получая трет-бутил-4-хлор-5-формил-3,6-дигидропиридин-1(2H)-карбоксилат в форме бесцветной жидкости.
(b) Синтез 5-(трет-бутил)-2-метил-6,7-дигидротиено[3,2-c]пиридин-2,5(4H)-дикарбоксилата
Процедуру синтеза Промежуточного соединения 13-a повторяли за исключением использования трет-бутил-4-хлор-5-формил-3,6-дигидропиридин-1(2H)-карбоксилата, получая 5-(трет-бутил)-2-метил-6,7-дигидротиено[3,2-c]пиридин-2,5(4H)-дикарбоксилат (165,0 мг, 2 стадии выход: 22 %).
1H-ЯМР (300 МГц, CDCl3): δ 7,50 (с, 1H), 4,49 (с, 2H), 3,87 (с, 3H), 3,73 (м, 2H), 2,87 (м, 2H), 1,49 (с, 9H)
(c) Синтез метил-4,5,6,7-тетрагидротиено[3,2-c]пиридин-2-карбоксилата
5-(трет-бутил)-2-метил-6,7-дигидротиено[3,2-c]пиридин-2,5(4H)-дикарбоксилат (163,0 мг, 0,55 ммоль) растворяли в CH2Cl2 (2,7 мл) и медленно добавляли TFA (0,5 мл) с последующим перемешиванием при комнатной температуре в течение 3 часов. Реакционную смесь экстрагировали EtOAc, промывали насыщ. водным раствором NaHCO3 и солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток высушивали, получая метил-4,5,6,7-тетрагидротиено[3,2-c]пиридин-2-карбоксилат (96,0 мг, 89 %) в форме твердого вещества желтого цвета.
LC/MS ESI (+): 198 (M+1)
1H-ЯМР (300 МГц, CDCl3): δ 7,45 (с, 1H), 3,93 (с, 2H), 3,86 (с, 3H), 3,16-3,19 (м, 2H), 2,83-2,88 (м, 2H), 1,88 (ушир.с, 1H)
(d) Синтез метил-5-(метилсульфонил)-4,5,6,7-тетрагидротиено[3,2-c]пиридин-2-карбоксилата
Процедуру синтеза Промежуточного соединения 13-с повторяли за исключением использования метил-4,5,6,7-тетрагидротиено[3,2-c]пиридин-2-карбоксилата (94,0 мг, 0,48 ммоль), получая метил-5-(метилсульфонил)-4,5,6,7-тетрагидротиено[3,2-c]пиридин-2-карбоксилат (92,6 мг, 71 %).
LC/MS ESI (+): 276 (M+1)
1H-ЯМР (300 МГц, CDCl3): δ 7,49 (с, 1H), 4,40 (с, 2H), 3,88 (с, 3H), 3,63-3,65 (м, 2H), 3,01-3,03 (м, 2H), 2,87 (с, 3H)
(e) Синтез 5-(метилсульфонил)-4,5,6,7-тетрагидротиено[3,2-c]пиридин-2-карбоновой кислоты
Процедуру синтеза Промежуточного соединения 13-d повторяли за исключением использования метил-5-(метилсульфонил)-4,5,6,7-тетрагидротиено[3,2-c]пиридин-2-карбоксилата (91,0 мг, 0,33 ммоль), получая 5-(метилсульфонил)-4,5,6,7-тетрагидротиено[3,2-c]пиридин-2-карбоновую кислоту (80,7 мг, 94 %).
LC/MS ESI (+): 262 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 13,03 (с, 1H), 7,56 (с, 1H), 4,32 (с, 2H), 3,49-3,51 (м, 2H), 2,97-2,99 (м, 5H)
Промежуточное соединение 25) Синтез 5-(метилсульфонамидо)-4,5,6,7-тетрагидротиено[3,2-c]пиридин-2-карбоновой кислоты
(a) Синтез этил-5-амино-4,5,6,7-тетрагидротиено[3,2-c]пиридин-2-карбоксилата
Этил-4,5,6,7-тетрагидротиено[3,2-c]пиридин-2-карбоксилат (340,0 мг, 1,61 ммоль) растворяли в смеси EtOH/H2O (6,0 мл/12,0 мл) и добавляли аминосерную кислоту (182,0 мг, 1,61 ммоль) и K2CO3 (444,8 мг, 3,22 ммоль) с последующим перемешиванием при комнатной температуре в течение 13 часов. EtOH выпаривали при пониженном давлении. Реакционную смесь экстрагировали EtOAc, промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, CH2Cl2 : MeOH = 9:1), получая этил-5-амино-4,5,6,7-тетрагидротиено[3,2-c]пиридин-2-карбоксилат (95,9 мг, 26 %) в форме желтой жидкости.
LC/MS ESI (+): 227 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 7,50 (с, 1H), 4,25 (кв., 2H, J=7,1 Гц), 3,73 (ушир.с, 2H), 3,57 (с, 2H), 2,82-2,91 (м, 4H), 1,27 (т, 3H, J=7,1 Гц)
(b) Синтез этил-5-(метилсульфонамидо)-4,5,6,7-тетрагидротиено[3,2-c]пиридин-2-карбоксилата
Процедуру синтеза Промежуточного соединения 6-a повторяли за исключением использования этил-5-амино-4,5,6,7-тетрагидротиено[3,2-c]пиридин-2-карбоксилата (95,0 мг, 0,42 ммоль), получая этил-5-(метилсульфонамидо)-4,5,6,7-тетрагидротиено[3,2-c]пиридин-2-карбоксилат (53,0 мг, 42 %).
LC/MS ESI (+): 305 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 8,56 (с, 1H), 7,54 (с, 1H), 4,26 (кв., 2H, J=7,1 Гц), 3,92 (с, 2H), 3,11-3,15 (м, 2H), 2,96-3,00 (м, 5H), 1,27 (т, 3H, J=7,1 Гц)
(c) Синтез 5-(метилсульфонамидо)-4,5,6,7-тетрагидротиено[3,2-c]пиридин-2-карбоновой кислоты
Процедуру синтеза Промежуточного соединения 6-b повторяли за исключением использования этил-5-(метилсульфонамидо)-4,5,6,7-тетрагидротиено[3,2-c]пиридин-2-карбоксилата (53,0 мг, 0,17 ммоль), получая 5-(метилсульфонамидо)-4,5,6,7-тетрагидротиено[3,2-c]пиридин-2-карбоновую кислоту (39,0 мг, 81 %).
LC/MS ESI (+): 277 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 12,95 (ушир.с, 1H), 8,55 (с, 1H), 7,44 (с, 1H), 3,90 (с, 2H), 3,10-3,14 (м, 2H), 2,96-2,97 (м, 5H)
Промежуточное соединение 26) Синтез 6-хлор-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоновой кислоты
(a) Синтез метил-6-хлор-5-нитробензо[b]тиофен-2-карбоксилат
4-хлор-2-фтор-5-нитробензальдегид (9,6 г, 47,16 ммоль) растворяли в безводном DMF (100,0 мл) и добавляли метил-2-меркаптоацетат (4,0 мл, 44,73 ммоль) и K2CO3 (13,0 г, 94,06 ммоль) с последующим перемешиванием при комнатной температуре в течение 3 часов, и нагревали при 50°C в течение 2 часов. Реакционную смесь лили в воду со льдом, и твердое вещество коричневого цвета отфильтровывали и экстрагировали CH2Cl2, Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4 и концентрировали при пониженном давлении, получая метил-6-хлор-5-нитробензо[b]тиофен-2-карбоксилат (10,2 г) в форме желтого соединения без очистки.
(b) Синтез метил-5-амино-6-хлорбензо[b]тиофен-2-карбоксилата
Процедуру синтеза Промежуточного соединения 13-b повторяли за исключением использования сырого метил-6-хлор-5-нитробензо[b]тиофен-2-карбоксилата (10,2 г), получая метил-5-амино-6-хлорбензо[b]тиофен-2-карбоксилат (9,0 г, 2 стадии выход: 79 %).
1H-ЯМР (400 МГц, ДМСО-d6): δ 7,98 (с, 1H), 7,96 (с, 1H), 7,30 (с, 1H), 5,49 (ушир.с, 2H), 3,85 (с, 3H)
(c) Синтез метил-6-хлор-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксилата
Процедуру синтеза Промежуточного соединения 6-a повторяли за исключением использования метил-5-амино-6-хлорбензо[b]тиофен-2-карбоксилата (4,0 г, 16,55 ммоль), получая метил-6-хлор-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксилат (3,2 г, 60 %).
1H-ЯМР (400 МГц, ДМСО-d6): δ 9,62 (с, 1H), 8,37 (с, 1H), 8,23 (с, 1H), 8,11 (с, 1H), 3,90 (с, 3H), 3,07 (с, 3H).
(d) Синтез 6-хлор-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоновой кислоты
Процедуру синтеза Промежуточного соединения 6-b повторяли за исключением использования метил-6-хлор-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксилата (3,2 г, 9,85 ммоль), получая 6-хлор-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоновую кислоту (3,0 г, 100 %).
1H-ЯМР (400 МГц, ДМСО-d6): δ 13,62 (ушир.с, 1H), 9,61 (с, 1H), 8,34 (с, 1H), 8,13 (с, 1H), 8,09 (с, 1H), 3,07 (с, 3H).
Промежуточное соединение 27) Синтез 3-гидрокси-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоновой кислоты
(a) Синтез метил-3-гидрокси-5-нитробензо[b]тиофен-2-карбоксилата
Метил-2-хлор-5-нитробензоат (1,0 г, 4,64 ммоль) растворяли в безводном DMF (23,0 мл) и добавляли метил-2-меркаптоацетат (390,0 мг, 4,41 ммоль) и K2CO3 (1920,0 мг, 13,89 ммоль) с последующим нагреванием при 80°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 1:1), добавляли CH2Cl2 (10,0 мл) и перемешивали в течение 10 минут. Нерастворимое твердое вещество отфильтровывали, получая метил-3-гидрокси-5-нитробензо[b]тиофен-2-карбоксилат (1,2 г, 97 %) в форме твердого вещества коричневого цвета.
1H-ЯМР (400 МГц, ДМСО-d6): δ 8,33 (с, 1H), 8,06 (д, 1H, J=8,7 Гц), 7,75 (д, 1H, J=8,7 Гц), 3,59 (с, 3H)
(b) Синтез метил-5-амино-3-гидроксибензо[b]тиофен-2-карбоксилата
Процедуру синтеза Промежуточного соединения 13-b повторяли за исключением использования метил-3-гидрокси-5-нитробензо[b]тиофен-2-карбоксилата (160,0 мг, 0,64 ммоль), получая метил-5-амино-3-гидроксибензо[b]тиофен-2-карбоксилат (220,0 мг, 100 %).
LC/MS ESI (+): 224 (M+1)
(c) Синтез метил-3-гидрокси-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксилата
Процедуру синтеза Промежуточного соединения 6-a повторяли за исключением использования метил-5-амино-3-гидроксибензо[b]тиофен-2-карбоксилата (50,0 мг, 0,24 ммоль), получая метил-3-гидрокси-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксилат (70,0 мг, 97 %).
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,57 (ушир.с, 1H), 9,93 (с, 1H), 7,89 (д, 1H, J=8,7 Гц), 7,41 (дд, 1H, J=8,7, 2,1 Гц), 3,85 (с, 3H), 3,00 (с, 3H)
(d) Синтез 3-гидрокси-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоновой кислоты
Процедуру синтеза Промежуточного соединения 6-b повторяли за исключением использования метил-3-гидрокси-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксилата (57,0 мг, 0,19 ммоль), получая 3-гидрокси-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоновую кислоту (35,0 мг, 61 %) в форме твердого вещества желтого цвета.
LC/MS ESI (+): 288 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,60 (ушир.с, 1H), 9,92 (с, 1H), 7,90 (д, 1H, J=8,7 Гц), 7,71 (д, 1H, J=1,9 Гц), 7,42 (дд, 1H, J=8,7, 2,1 Гц), 3,01 (с, 3H)
Промежуточное соединение 28) Синтез 5-хлор-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоновой кислоты
(a) Синтез 1-бром-4-(бромметил)-2-хлор-5-фторбензол
1-бром-2-хлор-5-фтор-4-метилбензол (1,0 г, 4,48 ммоль) растворяли в 1,2-дихлорэтане (45,0 мл) и добавляли NBS (955,8 мг, 4,48 ммоль) и AIBN (73,6 мг, 0,45 ммоль) с последующим нагреванием при 90°C в течение 15 часов. Реакционную смесь экстрагировали CH2Cl2, промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 9:1), получая 1-бром-4-(бромметил)-2-хлор-5-фторбензол (880,0 мг, 65 %) в форме бесцветной жидкости.
1H-ЯМР (400 МГц, CDCl3): δ 7,51 (д, 1H, J=7,1 Гц), 7,40 (д, 1H, J=8,8 Гц), 4,42 (с, 2H)
(b) Синтез 4-бром-5-хлор-2-фторбензальдегида
1-бром-4-(бромметил)-2-хлор-5-фторбензол (780,0 мг, 2,58 ммоль) растворяли в безводном CH3CN (25,8 мл) и добавляли N-метилморфолин-N-оксид (604,5 мг, 5,16 ммоль) и молекулярное сито (2,0 г, 4Å) с последующим перемешиванием при комнатной температуре в течение 5 часов. Реакционную смесь экстрагировали EtOAc, промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 9:1), получая 4-бром-5-хлор-2-фторбензальдегид (404,8 мг, 66 %) в форме твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3): δ 10,26 (с, 1H), 7,94 (д, 1H, J=6,6 Гц), 7,54 (д, 1H, J=9,2 Гц)
(c) Синтез метил-6-бром-5-хлорбензо[b]тиофен-2-карбоксилата
Процедуру синтеза 26-a Промежуточного соединения повторяли за исключением использования 4-бром-5-хлор-2-фторбензальдегида (404,8 мг, 1,71 ммоль), получая метил-6-бром-5-хлорбензо[b]тиофен-2-карбоксилат (311,7 мг, 60 %).
1H-ЯМР (400 МГц, CDCl3): δ 8,14 (с, 1H), 7,97 (с, 1H), 7,94 (с, 1H), 3,95 (с, 3H)
(d) Синтез метил-5-хлор-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоксилата
Метил-6-бром-5-хлорбензо[b]тиофен-2-карбоксилат (311,7 мг, 1,02 ммоль) и метансульфонамид (145,5 мг, 1,53 ммоль) растворяли в 1,4-диоксане (20,0 мл) и добавляли Pd2(bda)3 (0) (93,4 мг, 0,10 ммоль), Xantphos (177,1 мг, 0,31 ммоль) и Cs2CO3 (664,7 мг, 2,04 ммоль) с последующим нагреванием с обратным холодильником при 100°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры, экстрагировали EtOAc, промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 2:1) с последующим добавлением EtOH (5,0 мл) и перемешиванием в течение 10 минут. Результант отфильтровывали, получая метил-5-хлор-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоксилат (165,7 мг, 51 %) в форме твердого вещества желтого цвета.
LC/MS ESI (+): 320 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 9,70 (с, 1H), 8,22 (с, 1H), 8,16 (с, 1H), 8,14 (с, 1H), 3,89 (с, 3H), 3,11 (с, 3H)
(e) Синтез 5-хлор-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоновой кислоты
Процедуру синтеза Промежуточного соединения 6-b повторяли за исключением использования метил-5-хлор-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоксилата (195,0 мг, 0,61 ммоль), получая 5-хлор-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоновую кислоту (160,7 мг, 86 %).
1H-ЯМР (400 МГц, ДМСО-d6): δ 13,62 (ушир.с, 1H), 9,67 (ушир.с, 1H), 8,20 (с, 1H), 8,14 (с, 1H), 8,03 (с, 1H), 3,12 (с, 3H)
Промежуточное соединение 29) Синтез 6-бром-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоновой кислоты
(a) Синтез 4-бром-2-фтор-5-нитробензальдегида
4-бром-2-фторбензальдегид (2,0 г, 9,85 ммоль) растворяли в концентрированной серной кислоте (5,2 мл, 98,50 ммоль), и 60%-ый HNO3 (1,0 мл, 12,80 ммоль) добавляли при 0°C. Реакционную смесь перемешивали при комнатной температуре в течение 4 часов и экстрагировали CH2Cl2, Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток перекристаллизовывали, используя i-PR2O, получая 4-бром-2-фтор-5-нитробензальдегид (900,0 мг, 37 %) в форме твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3): δ 10,31 (с, 1H), 8,42 (д, 1H, J=6,4 Гц), 7,67 (д, 1H, J=9,0 Гц).
(b) Синтез метил-6-бром-5-нитробензо[b]тиофен-2-карбоксилата
Процедуру синтеза Промежуточного соединения 26-a повторяли за исключением использования 4-бром-2-фтор-5-нитробензальдегида (500 мг, 2,02 ммоль), получая желтое соединение метил-6-бром-5-нитробензо[b]тиофен-2-карбоксилата (550,0 мг).
(c) Синтез метил-5-амино-6-бромбензо[b]тиофен-2-карбоксилата
Процедуру синтеза Промежуточного соединения 13-b повторяли за исключением использования сырого метил-6-бром-5-нитробензо[b]тиофен-2-карбоксилата (550,0 мг), получая метил-5-амино-6-бромбензо[b]тиофен-2-карбоксилат (180,0 мг, 2 стадии выход: 31 %).
LC/MS ESI (+): 286 (M+1)
(d) Синтез метил-6-бром-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксилата
Процедуру синтеза Промежуточного соединения 6-a повторяли за исключением использования метил-5-амино-6-бромбензо[b]тиофен-2-карбоксилата (180,0 мг, 0,63 ммоль), получая метил-6-бром-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксилат (185,7 мг, 81 %).
1H-ЯМР (400 МГц, CDCl3): δ 8,08 (с, 1H), 8,06 (с, 1H), 7,94 (с, 1H), 6,76 (с, 1H), 3,89 (с, 3H), 2,95 (с, 3H).
(e) Синтез 6-бром-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоновой кислоты
Процедуру синтеза Промежуточного соединения 6-b повторяли за исключением использования метил-6-бром-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксилата (185,7 мг, 0,51 ммоль), получая 6-бром-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоновую кислоту (200,0 мг, 74 %).
1H-ЯМР (400 МГц, ДМСО-d6): δ 9,52 (с, 1H), 8,48 (с, 1H), 8,05-8,07 (м, 2H), 3,08 (с, 3H)
Промежуточное соединение 30) Синтез 6-фтор-5-((тетрагидрофуран)-3-сульфонамидо)бензо[b]тиофен-2-карбоновой кислоты
(a) Синтез метил-5-[бис(тетрагидрофуран-3-илсульфонил)амино]-6-фтор-бензотиофен-2-карбоксилата
Метил-5-амино-6-фторбензо[b]тиофен-2-карбоксилат (120,0 мг, 0,53 ммоль) растворяли в CH2Cl2 (5,3 мл) и добавляли тетрагидрофуран-3-сульфонил хлорид (180,4 мг, 1,06 ммоль) и DIPEA (0,2 мл, 1,17 ммоль). Реакционную смесь перемешивали в течение 15 часов, добавляли воду, чтобы остановить реакцию. Реакционную смесь экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4 и концентрировали при пониженном давлении, получая метил-5-[бис(тетрагидрофуран-3-илсульфонил)амино]-6-фтор-бензотиофен-2-карбоксилат (109,0 мг).
LC/MS ESI (+): 494 (M+1)
(b) Синтез 6-фтор-5-((тетрагидрофуран)-3-сульфонамидо)бензо[b]тиофен-2-карбоновой кислоты
Процедуру синтеза Промежуточного соединения 6-b повторяли за исключением использования сырого метил-5-[бис(тетрагидрофуран-3-илсульфонил)амино]-6-фтор-бензотиофен-2-карбоксилата (109,0 мг), получая 6-фтор-5-((тетрагидрофуран)-3-сульфонамидо)бензо[b]тиофен-2-карбоновую кислоту (90,0 мг, 2 стадии выход: 49 %).
LC/MS ESI (+): 346 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 12,07 (с, 1H), 9,97 (с, 1H), 8,13 (с, 1H), 8,06-8,11 (м, 2H), 3,87 (м, 4H), 3,68 (м, 1H), 2,18-2,22 (м, 2H)
Промежуточное соединение 31) Синтез 6-хлор-5-(2-метоксиэтил)сульфонамидо)бензо[b]тиофен-2-карбоновой кислоты
(a) Синтез метил-5-[бис(2-метоксиэтилсульфонил)амино]-6-хлор-бензотиофен-2-карбоксилата
Метил-5-амино-6-хлорбензо[b]тиофен-2-карбоксилат (400,0 мг, 1,65 ммоль) растворяли в CH2Cl2 (6,0 мл) и добавляли 2-метоксиэтан-1-сульфонил хлорид (0,4 мл, 3,64 ммоль) и DIPEA (0,9 мл, 4,95 ммоль). Реакционную смесь перемешивали в течение 1 часа, добавляли воду, чтобы остановить реакцию, и затем экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 1:1), получая метил-5-[бис(2-метоксиэтилсульфонил)амино]-6-хлор-бензотиофен-2-карбоксилат (350,0 мг, 43 %) в форме грязно-белого масла.
LC/MS ESI (+): 486 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 8,08 (с, 1H), 8,04 (с, 1H), 8,02 (с, 1H), 4,09-4,16 (м, 2H), 3,97 (с, 3H), 3,89-3,92 (м, 4H), 3,81-3,87 (м, 2H), 3,40 (с, 6H)
(b) Синтез 6-хлор-5-((2-метоксиэтил)сульфонамидо)бензо[b]тиофен-2-карбоновой кислоты
Процедуру синтеза Промежуточного соединения 6-b повторяли за исключением использования метил-5-[бис(2-метоксиэтилсульфонил)амино]-6-хлор-бензотиофен-2-карбоксилата (350,0 мг, 0,72 ммоль), получая 6-хлор-5-((2-метоксиэтил)сульфонамидо),бензо[b]тиофен-2-карбоновую кислоту (220,0 мг, 87 %).
LC/MS ESI (+): 350 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 9,64 (с, 1H), 8,33 (с, 1H), 8,07-8,11 (м, 2H), 3,74 (т, 2H, J=6,4 Гц), 3,46 (т, 2H, J=6,4 Гц), 3,24 (с, 3H)
Промежуточное соединение 32) Синтез (3-метокси-5-нитрофенил) (3-(трифторметокси)фенил метанона
(a) Синтез 3-метокси-5-нитробензойной кислоты
К смеси LiOMe (3,6 г, 94,28 ммоль) и HMPA (100,0 мл) 3,5-динитробензойную кислоту (5,0 г, 23,57 ммоль) добавляли при комнатной температуре. Реакционную смесь перемешивали в течение 17 часов и нагревали при 80°C в течение 17 часов и затем охлаждали до комнатной температуры. Реакционную смесь лили в смесь 6M H2SO4 и воду со льдом и экстрагировали Et2O. Органический экстракт промывали 1н. HCl и солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении, получая 3-метокси-5-нитробензойной кислоту (4,0 г, 86 %) в форме твердого вещества желтого цвета.
1H-ЯМР (300 МГц, ДМСО-d6): δ 13,76 (ушир.с, 1H), 8,21 (м, 1H), 7,95 (т, 1H, J=2,7 Гц), 7,82 (дд, 1H, J=2,7, 1,1 Гц), 3,94 (с, 3H)
(b) Синтез 3-метокси-5-нитробензоил хлорида
3-Метокси-5-нитробензойную кислоту (6,8 г, 34,34 ммоль) растворяли в безводном CH2Cl2 (10,0 мл) и добавляли (COCl)2 (6,0 мл, 68,68 ммоль) и каталитическое количество безводного DMF. Перемешивание осуществляли при комнатной температуре в течение 3 часов, и реакционную смесь концентрировали при пониженном давлении, с последующим добавлением i-PR2O, перемешиванием в течение 30 минут и затем фильтрацией. Фильтрат концентрировали при пониженном давлении, получая 3-метокси-5-нитробензоил хлорид (7,0 г, 95 %) в форме твердого вещества грязно-белого цвета.
(c) Синтез (3-метокси-5-нитрофенил)(3-(трифторметокси)фенил метанона
3-Метокси-5-нитробензоил хлорид (350,0 мг, 1,62 ммоль) и (3-(трифторметокси)фенилбороновую кислоту (257,0 мг, 1,25 ммоль) растворяли в безводном толуоле (12,0 мл) и добавляли Pd(dppf)2Cl2·CH2Cl2 (51,0 мг, 0,06 ммоль) и K3PO4·H2O (575,0 мг, 2,50 ммоль). Реакционную смесь нагревали при 110°C в течение 2 часов, и температуру реакции понижали до комнатной температуры. К реакционной смеси добавляли воду с последующей экстракцией EtOAc. Органический экстракт промывали насыщ. водным раствором NaHCO3 и солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 5:1), получая (3-метокси-5-нитрофенил)(3-(трифторметокси)фенил метанон (232,4 мг, 55 %) в форме грязно-белого масла.
1H-ЯМР (300 МГц, ДМСО-d6): δ 8,00-8,03 (м, 2H), 7,83 (м, 1H), 7,71-7,79 (м, 3H), 7,69 (м, 1H), 3,95 (с, 3H)
Промежуточное соединение 33) Синтез 3-(дифторметокси)-5-нитробензойной кислоты
(a) Синтез метил-3-гидрокси-5-нитробензоата
К раствору 3-гидрокси-5-нитробензойной кислоты (3,7 г, 20,00 ммоль) в MeOH (70,0 мл), SOCl2 (12,0 мл) добавляли при 0°C. Реакционную смесь перемешивали при 6°C в течение 3 часов и концентрировали при пониженном давлении. К остатку добавляли воду с последующей экстракцией EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении, получая метил-3-гидрокси-5-нитробензоат (3,9 г) в форме твердого вещества грязно-белого цвета без очистки.
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,96 (с, 1H), 8,08 (м, 1H), 7,78 (м, 1H), 7,70 (м, 1H), 3,90 (с, 3H)
(b) Синтез метил-3-(дифторметокси)-5-нитробензоата
К раствору сырого метил-3-гидрокси-5-нитробензоата (3,9 г) в безводном DMF (150,0 мл) при комнатной температуре добавляли 2-хлор-2,2-дифторацетат натрия (5,0 г, 33,30 ммоль) и Na2CO3 (1,8 г, 165,00 ммоль). Реакционную смесь нагревали при 100°C в течение 30 минут и охлаждали до комнатной температуры. К реакционной смеси добавляли воду с последующей экстракцией EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = от 5:95 до 30:70), получая метил-3-(дифторметокси)-5-нитробензоат (2,5 г, 2 стадии выход: 61 %) в форме твердого вещества белого цвета.
1H-ЯМР (300 МГц, CDCl3): δ 8,73 (м, 1H), 8,19 (т, 1H, J=2,1 Гц), 8,13 (с, 1H), 6,65 (т, 1H, J=71,7 Гц), 4,00 (с, 3H)
(c) Синтез 3-(дифторметокси)-5-нитробензойной кислоты
Метил-3-(дифторметокси)-5-нитробензоат (2,5 г, 10,10 ммоль) растворяли в смеси THF/H2O (50,0 мл, 4/1 об./об.) и LiOH·H2O (485,0 мг, 20,20 ммоль) добавляли при 0°C. Реакционную смесь перемешивали при 5°C в течение 12 часов и концентрировали при пониженном давлении. Остаток подкисляли до рН 3-4 с помощью 1н. водного раствора HCl и экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении, получая 3-(дифторметокси)-5-нитробензойную кислоту (2,4 г, 100 %) в форме твердого вещества белого цвета.
1H-ЯМР (300 МГц, ДМСО-d6): δ 14,25 (ушир.с, 1H), 8,47 (с, 1H), 8,22 (с, 1H), 8,06 (с, 1H), 7,53 (т, 1H, J=72,9 Гц)
Промежуточное соединение 34) Синтез (2-фторфенил)(3-нитрофенил)метанона
К раствору 1-бром-2-фторбензола (1,0 г, 5,71 ммоль) в безводном THF (15,0 мл) раствор 1,7 М трет-BuLi в пентане (3,5 мл, 6,00 ммоль) добавляли при -78°C с последующим перемешиванием в течение 30 минут. ZnI2 (1,9 г, 6,00 ммоль) растворяли в безводном THF (10,0 мл) и добавляли к реакционной смеси с последующим перемешиванием при 0°C в течение 30 минут. Реакционную смесь добавляли к раствору 3-нитробензоил хлорида (1,1 г, 5,71 ммоль) и Pd2(dba)3·CHCl3 (296,0 мг, 0,29 ммоль) в безводном THF (15,0 мл) при 0°C с последующим перемешиванием при комнатной температуре в течение 12 часов. К реакционной смеси добавляли воду, чтобы остановить реакцию, с последующей экстракцией CH2Cl2, Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (амин силикагель, н-гексан : EtOAc = 5:1), получая (2-фторфенил)(3-нитрофенил)метанон (490,0 мг, 35 %) в форме грязно-белого масла.
1H-ЯМР (300 МГц, CDCl3): δ 8,63 (с, 1H), 8,45 (д, 1H, J=8,0 Гц), 8,17 (д, 1H, J=8,0 Гц), 7,59-7,73 (м, 3H), 7,34 (т, 1H, J=7,6 Гц), 7,20 (т, 1H, J=8,0 Гц)
Промежуточное соединение 35) Синтез (3-бром-5-нитрофенил)(3-метоксифенил)метанона
3-бром-5-нитробензоил хлорид (2,7 г, 10,06 ммоль) растворяли в безводном Et2O (100,0 мл) и добавляли (3-метоксифенил)бороновую кислоту (1,5 г, 10,06 ммоль), Pd(dba)2 (289,0 мг, 0,50 ммоль), PPh3 (264,0 мг, 1,01 ммоль) и тиофен-2-карбоксилат меди (1,9 г, 10,06 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 12 часов, фильтровали через Целит и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (амин силикагель, н-гексан : EtOAc = 9:1), получая (3-бром-5-нитрофенил)(3-метоксифенил)метанон (1,2 г, 35 %) в форме грязно-белого масла.
1H-ЯМР (300 МГц, CDCl3): δ 8,58 (т, 1H, J=1,9 Гц), 8,54 (м, 1H), 8,25 (т, 1H, J=1,9 Гц), 7,44 (т, 1H, J=8,0 Гц), 7,35 (м, 1H), 7,29 (д, 1H, J=7,6 Гц), 7,22 (дд, 1H, J=9,2, 2,7 Гц), 3,88 (с, 3H)
Промежуточное соединение 36) Синтез (3-бром-5-нитрофенил)(4-фторфенил)метанона
К раствору смеси 3-бром-5-нитробензоил хлорида (1,1 г, 4,15 ммоль) и фторбензола (8,0 мл) AlCl3 (1,7 г, 12,50 ммоль) добавляли при 0°C. Реакционную смесь нагревали при 50°C в течение 5 часов, охлаждали до комнатной температуры и вливали в воду со льдом с последующей экстракцией CH2Cl2, Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 5:1), получая (3-бром-5-нитрофенил)(4-фторфенил)метанон (1,2 г, 86 %) в форме бесцветного масла.
1H-ЯМР (300 МГц, CDCl3): δ 8,59 (т, 1H, J=1,9 Гц), 8,50 (дд, 1H, J=2,3, 1,5 Гц), 8,22 (т, 1H, J=1,5 Гц), 7,85 (дд, 2H, J=8,8, 5,3 Гц), 7,24 (т, 2H, J=8,8 Гц)
Промежуточное соединение 37) Синтез 1-(дихлор(3-(трифторметокси)фенил метил)-3-метокси-5-нитробензола
(3-метокси-5-нитрофенил)(3-(трифторметокси)фенил метанон (264,0 мг, 0,77 ммоль) растворяли в 1,2-дибромэтане (7,0 мл) и добавляли PCl5 (805,9 мг, 3,87 ммоль). Реакционную смесь нагревали при 110°C в течение 24 часов и охлаждали до комнатной температуры. Реакционную смесь вливали в NaHCO3, растворенный в воде со льдом, с последующим энергичным перемешиванием. Реакционную смесь экстрагировали CH2Cl2, и органический экстракт высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (амин силикагель, н-гексан : EtOAc = 5:1), получая 1-(дихлор(3-(трифторметокси)фенил метил)-3-метокси-5-нитробензол (243,2 мг, 79 %) в форме грязно-белого масла.
1H-ЯМР (300 МГц, ДМСО-d6): δ 7,94 (т, 1H, J=1,9 Гц), 7,85 (т, 1H, J=1,9 Гц), 7,61-7,68 (м, 3H), 7,55 (ушир.с, 1H), 7,50 (т, 1H, J=1,9 Гц), 3,91 (с, 3H)
Промежуточное соединение 38) Синтез 1-метокси-3-нитро-5-(2-(3-(трифторметокси)фенилпропан-2-ил)бензола
В CH2Cl2 (3,0 мл) раствор 1,0 М TiCl4 в CH2Cl2 (123,0 мкл, 0,12 ммоль) и раствор 1,0 М диметилцинка в гептане (1,8 мл, 1,84 ммоль) добавляли при -40°C с последующим перемешиванием в течение 30 минут. Раствор 1-(дихлор(3-(трифторметокси)фенил метил)-3-метокси-5-нитробензола (243,2 мг, 0,61 ммоль) в CH2Cl2 (3,0 мл) медленно добавляли при -40°C. Реакционную смесь перемешивали при 0°C в течение 2 часов, добавляли воду, чтобы остановить реакцию, и затем экстрагировали CH2Cl2, Органический экстракт высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (амин силикагель, н-гексан : EtOAc = 9:1), получая 1-метокси-3-нитро-5-(2-(3-(трифторметокси)фенилпропан-2-ил)бензол (164,0 мг, 75 %) в форме грязно-белого масла.
1H-ЯМР (300 МГц, ДМСО-d6): δ 7,58-7,60 (м, 2H), 7,45 (м, 1H), 7,29 (дт, 1H, J=8,0, 1,1 Гц), 7,21-7,25 (м, 3H), 3,84 (с, 3H), 1,70 (с, 6H)
Промежуточное соединение 39) Синтез 3-метокси-5-(2-(3-(трифторметокси)фенилпропан-2-ил)анилина
1-Метокси-3-нитро-5-(2-(3-(трифторметокси)фенилпропан-2-ил)бензол (164,0 мг, 0,46 ммоль) растворяли в MeOH (4,0 мл). Под атмосферой газообразного водорода добавляли Ra-Ni, и реакцию проводили при комнатной температуре в течение 12 часов. Реакционную смесь фильтровали через Целит и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 4:1), получая 3-метокси-5-(2-(3-(трифторметокси)фенилпропан-2-ил)анилин (121,7 мг, 81 %) в форме грязно-белого масла.
LC/MS ESI (+): 326 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 7,40 (т, 1H, J=8,0 Гц), 7,23 (д, 1H, J=8,0 Гц), 7,15 (д, 1H, J=8,0 Гц), 7,10 (с, 1H), 5,98-6,00 (м, 2H), 5,92 (т, 1H, J=1,9 Гц), 5,01 (с, 2H), 3,60 (с, 3H), 1,55 (с, 6H)
Промежуточное соединение 40) Синтез 3-бром-5-(2-(3-(дифторметокси)фенилпропан-2-ил)анилина
1-бром-3-(2-(3-(дифторметокси)фенилпропан-2-ил)-5-нитробензол (106,6 мг, 0,28 ммоль) растворяли в смеси MeOH/H2O (3,0 мл, 9/1 об./об.) и Zn (270,7 мг, 4,14 ммоль) и NH4Cl (73,8 мг, 1,38 ммоль) добавляли при комнатной температуре. Реакционную смесь обрабатывали ультразвуком при 40°C в течение 40 минут и затем охлаждали до комнатной температуры, фильтровали через Целит и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (амин силикагель, н-гексан : EtOAc = 4:1), получая 3-бром-5-(2-(3-(дифторметокси)фенилпропан-2-ил)анилин (91,5 мг, 93 %) в форме грязно-белого масла.
LC/MS ESI (+): 356 (M+1)
Промежуточное соединение 41) Синтез 3-(2-(3-бром-5-нитрофенил)пропан-2-ил)фенола
К раствору 1-бром-3-(2-(3-метоксифенил)пропан-2-ил)-5-нитробензола (602,0 мг, 1,72 ммоль) в безводном CH2Cl2 (8,0 мл) раствор 1,0 М BBr3 в CH2Cl2 (8,6 мл, 8,60 ммоль) добавляли при 0°C с последующим перемешиванием при комнатной температуре в течение 3,5 часов. Добавляли воду при 0°C, чтобы остановить реакцию, с последующей экстракцией CH2Cl2, Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 4:1), получая 3-(2-(3-бром-5-нитрофенил)пропан-2-ил)фенол (570,0 мг, 98 %) в форме грязно-белого масла.
1H-ЯМР (300 МГц, ДМСО-d6): δ 9,31 (с, 1H), 8,22 (т, 1H, J=1,9 Гц), 7,95 (т, 1H, J=1,9 Гц), 7,82 (т, 1H, J=1,9 Гц), 7,11 (т, 1H, J=8,4 Гц), 6,68 (д, 1H, J=8,4 Гц), 6,61-6,63 (м, 2H), 1,65 (с, 6H)
Промежуточное соединение 42) Синтез 2-(3-(2-(3-бром-5-нитрофенил)пропан-2-ил)фенокси)ацетамид
3-(2-(3-бром-5-нитрофенил)пропан-2-ил)фенол (123,0 мг, 0,37 ммоль) растворяли в безводном DMF (3,5 мл) и добавляли K2CO3 (152,0 мг, 1,10 ммоль) и 2-йодацетамид (135,0 мг, 0,73 ммоль). Реакционную смесь перемешивали при 30°C в течение 76 часов, добавляли воду и затем экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 1:2), получая 2-(3-(2-(3-бром-5-нитрофенил)пропан-2-ил)фенокси)ацетамид (129,1 мг, 83 %) в форме твердого вещества белого цвета.
LC/MS ESI (+): 393 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 8,22 (м, 1H), 7,96 (м, 1H), 7,83 (м, 1H), 7,51 (ушир.с, 1H), 7,36 (ушир.с, 1H), 7,25 (тд, 1H, J=8,4, 3,1 Гц), 6,78-6,89 (м, 3H), 4,38 (с, 2H), 1,68 (с, 6H)
Промежуточное соединение 43) Синтез 1-бром-3-(2-(3-(дифторметокси)фенилпропан-2-ил)-5-нитробензола
3-(2-(3-бром-5-нитрофенил)пропан-2-ил)фенол (122,2 мг, 0,36 ммоль) растворяли в смеси CH3CN/H2O (3,6 мл, 1/1 об./об.) и добавляли KOH (407,0 мг, 7,26 ммоль) и диэтил(бромдифторметил)фосфонат (129,0 мкл, 0,73 ммоль). Реакционную смесь нагревали при 40°C в течение 5 часов и добавляли воду, чтобы остановить реакцию, с последующей экстракцией EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 9:1), получая 1-бром-3-(2-(3-(дифторметокси)фенилпропан-2-ил)-5-нитробензола (106,6 мг, 70 %) в форме грязно-белого масла.
1H-ЯМР (300 МГц, ДМСО-d6): δ 8,24 (м, 1H), 7,98 (м, 1H), 7,86 (м, 1H), 7,38 (т, 1H, J=7,6 Гц), 7,25 (т, 1H, J=74,4 Гц), 7,12 (д, 1H, J=7,6 Гц), 7,08 (с, 1H), 7,05 (д, 1H, J=8,0 Гц), 1,71 (с, 6H)
Промежуточное соединение 44) Синтез 4-(3-(2-(3-хлор-5-нитрофенил)пропан-2-ил)-5-(1,1,2,2-тетрафторэтокси)бензил)-1-метил-1H-пиразола
1-(бромметил)-3-(2-(3-хлор-5-нитрофенил)пропан-2-ил)-5-(1,1,2,2-тетрафторэтокси)бензол (150,0 мг, 0,24 ммоль), 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол (54,5 мг, 0,26 ммоль), Pd(PPh3)4 (27,5 мг, 0,02 ммоль) и Na2CO3 (75,4 мг, 0,71 ммоль) добавляли к смеси DME/H2O (4,5 мл, 2/1 об./об.) в закрытой пробирке. Реакционную смесь нагревали при 100°C в течение 4 часов и охлаждали до комнатной температуры с последующей экстракцией EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 1:1), получая 4-(3-(2-(3-хлор-5-нитрофенил)пропан-2-ил)-5-(1,1,2,2-тетрафторэтокси)бензил)-1-метил-1H-пиразол (25,9 мг, 22 %) в форме желтого масла.
LC/MS ESI (+): 486 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 8,07 (м, 1H), 7,97 (м, 1H), 7,48 (м, 1H), 7,28 (с, 1H), 7,04 (с, 1H), 6,94 (с, 1H), 6,92 (с, 1H), 6,89 (с, 1H), 5,87 (тт, 1H, J=53,1, 2,7 Гц), 3,85 (с, 3H), 3,79 (с, 2H), 1,70 (с, 6H)
Пример 1) Синтез N-(3-(2-(4-фторфенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
3-(2-(4-фторфенил)пропан-2-ил)анилин (36,0 мг, 0,16 ммоль), гидрохлорид 6-(метилсульфонамидо)-1H-индол-2-карбоновой кислоты (50,0 мг, 0,17 ммоль) и HATU (66,0 мг, 0,17 ммоль) растворяли в безводном DMF (1,6 мл) и добавляли DIPEA (84,0 мкл, 0,48 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 15 часов и затем экстрагировали CH2Cl2. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (амин силикагель, CH2Cl2 : MeOH = 95:5), получая N-(3-(2-(4-фторфенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид (37,0 мг, 50 %) в форме твердого вещества белого цвета.
LC/MS ESI (+): 466 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,68 (с, 1H), 10,08 (с, 1H), 9,60 (с, 1H), 7,73 (д, 1H, J=8,4 Гц), 7,58-7,62 (м, 2H), 7,36 (с, 2H), 7,24-7,30 (м, 3H), 7,10 (т, 2H, Гц J=8,8), 6,97 (дд, 2H J=8,8, 1,9 гц), 2,93 (с, 3H), 1,65 (с, 6H)
Способом синтеза согласно Примеру 1 синтезировали соединения с Примера 2 по Пример 106, и данные каждого примера являются следующими.
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,69 (с, 1H), 10,09 (с, 1H), 9,60 (с, 1H), 7,73 (д, 1H, J=8,0 Гц), 7,58~7,64 (м, 2H), 7,36 (с, 2H), 7,22~7,32 (м, 5H), 7,16 (т, 1H, J=6,9 Гц), 6,95~6,99 (м, 2H), 2,93 (с, 3H), 1,66 (с, 6H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,58 (с, 1H), 10,08 (с, 1H), 8,86 (ушир.с, 1H), 7,72 (д, 1H, J=8,4 Гц), 7,62 (с, 1H), 7,38 (с, 1H), 7,21~7,30 (м, 5H), 7,07~7,13 (м, 2H), 6,96 (д, 1H, J=8,0 Гц), 3,85 (с, 3H), 2,90 (с, 3H), 1,65 (с, 6H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,68 (с, 1H), 10,08 (с, 1H), 9,61 (с, 1H), 7,60 (д, 1H, J=8,8 Гц), 7,41~7,47 (м, 2H), 7,36 (с, 2H), 7,17~7,28 (м, 4H), 6,97 (дд, 1H, J=8,8, 1,9 Гц), 6,51 (с, 1H), 3,73 (с, 3H), 2,93 (с, 3H), 1,65 (с, 6H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,61 (с, 1H), 10,05 (с, 1H), 9,55 (с, 1H), 7,72 (д, 1H, J=8,0 Гц), 7,62 (с, 1H), 7,54 (д, 1H, J=8,8 Гц), 7,33 (с, 2H), 7,24~7,29 (м, 3H), 7,07~7,13 (м, 3H), 6,95~6,98 (м, 2H), 2,47 (с, 3H), 1,65 (с, 6H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 12,39 (с, 1H), 10,35 (с, 1H), 8,00 (с, 1H), 7,93 (д, 1H, J=8,8 Гц), 7,75 (дд, 1H, J=8,8, 1,1 Гц), 7,64 (с, 1H), 7,61 (дд, 1H, J=9,2, 1,5 Гц), 7,58 (с, 1H), 7,25~7,33 (м, 3H), 7,08~7,14 (м, 2H), 7,01 (дд, 1H, J=8,0, 1,1 Гц), 3,20 (с, 3H), 1,66 (с, 6H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,67 (с, 1H), 10,07 (с, 1H), 9,60 (с, 1H), 7,70 (д, 1H, J=8,8 Гц), 7,52~7,60 (м, 3H), 7,36 (с, 2H), 7,21~7,33 (м, 3H), 7,04 (дд, 1H J=12,2, 8,0 Гц), 6,96 (д, 1H, J=8,8 Гц), 6,89 (д, 1H, J=7,3 Гц), 2,92 (с, 3H), 1,66 (с, 6H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,68 (с, 1H), 10,10 (с, 1H), 9,61 (ушир.с, 1H), 7,76 (д, 1H, J=7,4 Гц), 7,65 (с, 1H), 7,60 (д, 1H, J=8,8 Гц), 7,43 (т, 1H, J=7,9 Гц), 7,36 (с, 2H), 7,25~7,32 (м, 2H), 7,15~7,20 (м, 2H), 6,96 (д, 2H, J=7,9 Гц), 2,93 (с, 3H), 1,67 (с, 6H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,69 (с, 1H), 10,11 (с, 1H), 9,61 (с, 1H), 7,76 (д, 1H, J=8,4 Гц), 7,60~7,64 (м, 2H), 7,37 (с, 2H), 7,29 (т, 1H, J=8,0 Гц), 6,97 (д, 2H, J=8,4 Гц), 6,79 (д, 2H, J=6,5 Гц), 6,70 (с, 1H), 3,75 (с, 3H), 2,93 (с, 3H), 1,65 (с, 6H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,70 (с, 1H), 10,13 (с, 1H), 9,62 (с, 1H), 7,60~7,71 (м, 3H), 7,38 (с, 2H), 7,30 (т, 1H, J=7,7 Гц), 7,04 (д, 1H, J=7,7 Гц), 6,98 (д, 1H, J=8,5 Гц), 6,90 (с, 1H), 6,81 (с, 1H), 6,76 (с, 1H), 4,16~4,24 (м, 1H), 3,77 (с, 3H), 2,94 (с, 3H), 1,58 (д, 3H, J=7,4 Гц)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,68 (с, 1H), 10,07 (с, 1H), 9,60 (с, 1H), 7,70 (д, 1H, J=8,0 Гц), 7,54~7,61 (м, 3H), 7,36 (с, 2H), 7,25 (т, 1H, J=8,1 Гц), 7,04~7,14 (м, 2H), 6,97 (дд, 1H J=8,5, 1,8 Гц), 6,91 (д, 1H, J=8,1 Гц), 2,93 (с, 3H), 1,65 (с, 6H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,68 (с, 1H), 10,09 (с, 1H), 9,61 (с, 1H), 7,74 (д, 1H, J=8,1 Гц), 7,58~7,62 (м, 2H), 7,37 (с, 2H), 7,27 (т, 1H, J=7,3 Гц), 7,20 (дд, 1H J= 8,8, 7,7 Гц), 6,97 (дд, 2H J=8,8, 1,9 Гц), 6,74~6,81 (м, 3H), 3,70 (с, 3H), 2,93 (с, 3H), 1,64 (с, 6H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,68 (с, 1H), 10,08 (с, 1H), 9,62 (с, 1H), 7,61 (д, 1H, J=8,8 Гц), 7,47 (с, 1H), 7,37 (с, 2H), 7,22 (с, 1H), 6,97 (д, 1H, J=8,8 Гц), 6,81 (с, 1H), 6,78 (с, 1H), 6,72 (с, 1H), 6,52 (с, 1H), 3,76 (с, 3H), 3,73 (с, 3H), 2,93 (с, 3H), 1,63 (с, 6H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,71 (с, 1H), 10,22 (с, 1H), 9,64 (с, 1H), 8,04 (с, 1H), 7,58~7,63 (м, 2H), 7,37 (с, 2H), 7,28 (дд, 2H J=8,8, 5,3 Гц), 7,09~7,16 (м, 3H), 6,98 (дд, 1H J=8,8, 1,5 Гц), 2,93 (с, 3H), 1,64 (с, 6H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,71 (с, 1H), 10,21 (с, 1H), 9,64 (с, 1H), 8,04 (с, 1H), 7,53~7,64 (м, 3H), 7,36 (с, 2H), 7,10~7,16 (м, 2H), 7,06 (с, 1H), 6,97 (дд, 1H J=8,8, 1,9 Гц), 2,93 (с, 3H), 1,64 (с, 6H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,73 (с, 1H), 10,24 (с, 1H), 9,65 (с, 1H), 8,09 (с, 1H), 7,59~7,64 (м, 2H), 7,38 (с, 2H), 7,12 (с, 1H), 6,98 (дд, 1H J=8,8, 1,8 Гц), 6,80~6,82 (м, 2H), 6,73 (с, 1H), 3,77 (с, 3H), 2,94 (с, 3H), 1,64 (с, 6H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,75 (с, 1H), 10,25 (с, 1H), 9,65 (с, 1H), 7,72 (с, 1H), 7,62 (д, 1H, J=8,6 Гц), 7,46 (м, 1H), 7,36~7,38 (м, 2H), 7,28 (дд, 2H, J=8,8, 5,5 Гц), 7,23 (т, 1H, J=74,0 Гц), 7,09~7,17 (м, 2H), 6,98 (дд, 1H, J=8,4, 1,7 Гц), 6,76 (м, 1H), 2,94 (с, 3H), 1,65 (с, 6H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,68 (с, 1H), 10,21 (с, 1H), 9,60 (с, 1H), 8,06 (с, 1H), 717,60~7,63 (м, 2H), 7,51 (с, 1H), 7,38 (с, 1H), 7,37 (с, 1H), 7,34 (с, 1H), 7,24 (т, 1H, J=8,0 Гц), 7,08 (с, 1H), 6,99 (дд, 1H, J=9,2, 1,9 Гц), 6,90 (с, 1H), 6,83 (д, 1H, J=8,0 Гц), 6,77 (д, 1H, J=8,4 Гц), 4,38 (с, 2H), 2,94 (с, 3H), 1,64 (с, 6H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,58 (с, 1H), 10,19 (с, 1H), 8,77 (с, 1H), 8,04 (с, 1H), 7,61 (с, 1H), 7,41 (с, 1H), 7,26~7,31 (м, 3H), 7,23 (с, 1H), 7,09~7,16 (м, 3H), 3,86 (с, 3H), 2,92 (с, 3H), 1,65 (с, 6H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,68 (с, 1H), 10,21 (с, 1H), 9,61 (с, 1H), 8,07 (с, 1H), 717,60~7,63 (м, 2H), 7,34~7,39 (м, 3H), 7,23 (т, 1H, J=74,4 Гц), 7,08~7,11 (м, 2H), 6,97~7,05 (м, 3H), 2,94 (с, 3H), 1,65 (с, 6H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,68 (с, 1H), 10,21 (с, 1H), 9,59 (с, 1H), 7,92~7,93 (м, 1H), 7,60 (д, 1H, J=8,4 Гц), 7,54 (с, 1H), 7,36~7,38 (м, 2H), 7,26~7,30 (м, 2H), 7,09~7,15 (м, 2H), 6,96~7,00 (м, 2H), 2,93 (с, 3H), 1,64 (с, 6H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,73 (с, 1H), 10,25 (с, 1H), 9,64 (с, 1H), 8,09 (с, 1H), 7,57~7,65 (м, 2H), 7,37 (с, 2H), 7,12 (с, 1H), 6,98 (дд, 1H, J=8,4, 1,7 Гц), 6,75~6,80 (м, 2H), 6,73 (с, 1H), 4,02 (кв., 2H, J=7,0 Гц), 2,94 (с, 3H), 1,64 (с, 6H), 1,30 (т, 3H, J=7,0 Гц)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,67 (с, 1H), 10,20 (с, 1H), 9,59 (с, 1H), 8,04 (м, 1H), 7,61 (д, 1H, J=8,4 Гц), 7,56 (м, 1H), 7,49 (м, 1H), 7,35~7,38 (м, 3H), 7,24 (дд, 1H, J=11,1, 8,8 Гц), 7,06 (м, 1H), 6,99 (дд, 1H, J=8,8, 1,9 Гц), 2,94 (с, 3H), 1,66 (с, 6H)
1H-ЯМР (400 МГц, ДМСО-d6): δ 11,73 (с, 1H), 10,26 (с, 1H), 9,65 (с, 1H), 7,96 (с, 1H), 7,63 (д, 1H, J=8,8 Гц), 7,55 (с, 1H), 7,38 (с, 2H), 7,00 (с, 1H), 6,99 (д, 1H, J=8,8 Гц), 6,81 (с, 2H), 6,73 (с, 1H), 3,77 (с, 3H), 2,94 (с, 3H), 1,65 (с, 6H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 12,01 (с, 1H), 10,25 (с, 1H), 7,74 (д, 1H, J=8,4 Гц), 7,70 (с, 1H), 7,62 (с, 1H), 7,52 (д, 1H, J=8,8 Гц), 7,46 (с, 1H), 7,24~7,31 (м, 3H), 7,20 (дд, 1H, J=9,2, 1,5 Гц), 7,07~7,13 (м, 2H), 6,99 (д, 1H, J=8,4 Гц), 1,65 (с, 6H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 10,39 (ушир.с, 1H), 9,92 (м, 1H), 8,29 (с, 1H), 8,01 (д, 1H, J=8,8 Гц), 7,98 (м, 1H), 7,70 (м, 1H), 7,61 (м, 1H), 7,25~7,37 (м, 4H), 7,08~7,16 (м, 2H), 7,01 (д, 1H, J=8,8 Гц), 3,01 (с, 3H), 1,66 (с, 6H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,37 (с, 1H), 9,86 (с, 1H), 8,28 (с, 1H), 8,01 (д, 1H, J=8,8 Гц), 7,78 (д, 1H, J=1,9 Гц), 7,68 (дд, 1H, J=7,6, 1,5 Гц), 7,56~7,63 (м, 1H), 7,53~7,54 (м, 1H), 7,35 (дд, 1H, J=8,8, 2,2 Гц), 7,27 (т, 1H, J=8,0 Гц), 7,05~7,15 (м, 2H), 6,93 (д, 1H, J=8,8 Гц), 3,01 (с, 3H), 1,65 (с, 6H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,44 (с, 1H), 9,74 (ушир.с, 1H), 7,62~7,75 (м, 5H), 7,23~7,36 (м, 4H), 7,07~7,13 (м, 2H), 7,00 (д, 1H, J=8,0 Гц), 2,97(с, 3H), 1,64(с, 6H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,44 (с, 1H), 9,74 (с, 1H), 7,54~7,74 (м, 6H), 7,34 (дд, 1H, J=8,8, 2,3 Гц), 7,26 (т, 1H, J=8,0 Гц), 7,04~7,11 (м, 2H), 6,93 (д, 1H, J=8,4 Гц), 2,97 (с, 3H), 1,64 (с, 6H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,38 (с, 1H), 10,07 (с, 1H), 8,27 (с, 1H), 7,94 (д, 1H, J=8,8 Гц), 7,81 (д, 1H, J=1,5 Гц), 7,68 (д, 1H, J=8,0 Гц), 7,59~7,60 (м, 1H), 7,22~7,32 (м, 4H), 7,07~7,14 (м, 2H), 6,99 (д, 1H, J=8,0 Гц), 3,07 (с, 3H), 1,64 (с, 6H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 10,38 (с, 1H), 9,87 (с, 1H), 8,28 (с, 1H), 8,01 (д, 1H, J=8,8 Гц), 7,78 (д, 1H, J=1,9 Гц), 7,66 (д, 1H, J=8,4 Гц), 7,52~7,58 (м, 2H), 7,21~7,36 (м, 4H), 7,02 (дд, 1H, J=12,2, 8,4 Гц), 6,93 (д, 1H, J=8,0 Гц), 3,01 (с, 3H), 1,66 (с, 6H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 10,53 (с, 1H), 9,88 (с, 1H), 8,28 (с, 1H), 8,00~8,03 (м, 2H), 7,79 (д, 1H, J=2,3 Гц), 7,55 (т, 1H, J=1,9 Гц), 7,35 (дд, 1H, J=8,8, 2,3 Гц), 7,25~7,30 (м, 2H), 7,10~7,16 (м, 3H), 3,01 (с, 3H), 1,66 (с, 6H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,33 (с, 1H), 9,77 (с, 1H), 8,27 (с, 1H), 8,00 (д, 1H, J=8,8 Гц), 7,79 (д, 1H, J=1,9 Гц), 7,70 (д, 1H, J=7,9 Гц), 7,63 (с, 1H), 7,36 (дд, 1H, J=8,8, 2,3 Гц), 7,31 (т, 1H, J=7,9 Гц), 7,10 (д, 1H, J=7,9 Гц), 6,80 (с, 1H), 6,76 (с, 1H), 6,70 (с, 1H), 3,76 (с, 3H), 3,00 (с, 3H), 1,66 (с, 6H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,31 (с, 1H), 9,78 (с, 1H), 8,27 (с, 1H), 7,99 (д, 1H, J=8,8 Гц), 7,78 (д, 1H, J=1,9 Гц), 7,42 (с, 1H), 7,36 (дд, 1H, J=8,8, 2,3 Гц), 7,21 (с, 1H), 6,81 (с, 1H), 6,76 (с, 1H), 6,71 (с, 1H), 6,56 (с, 1H), 3,76 (с, 3H), 3,74 (с, 3H), 3,00 (с, 3H), 1,64 (с, 6H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 10,51 (с, 1H), 9,88 (с, 1H), 8,27 (с, 1H), 8,00~8,03 (м, 2H), 7,78 (д, 1H, J=2,2 Гц), 7,57~7,65 (м, 1H), 7,48 (с, 1H), 7,35 (дд, 1H, J=8,5, 2,2 Гц), 7,09~7,17 (м, 3H), 3,01 (с, 3H), 1,64 (с, 6H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 10,54 (с, 1H), 9,88 (с, 1H), 8,28 (с, 1H), 8,00~8,03 (м, 2H), 7,79 (д, 1H, J=2,2 Гц), 7,57 (с, 1H), 7,35 (дд, 1H, J=8,8, 2,2 Гц), 7,16 (с, 1H), 6,81 (с, 2H), 6,72 (с, 1H), 3,77 (с, 3H), 3,01 (с, 3H), 1,64 (с, 6H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,41 (с, 1H), 9,88 (с, 1H), 8,28 (с, 1H), 8,00 (д, 1H, J=8,5 Гц), 7,78 (д, 1H, J=1,8 Гц), 7,71 (д, 1H, J=8,1 Гц), 7,63 (с, 1H), 7,44 (т, 1H, J=8,1 Гц), 7,34 (дд, 1H, J=8,8, 2,2 Гц), 7,31 (т, 1H, J=8,1 Гц), 7,25 (д, 1H, J=7,7 Гц), 7,19 (д, 1H, J=8,1 Гц), 7,15 (с, 1H), 7,00 (д, 1H, J=7,7 Гц), 3,00 (с, 3H), 1,67 (с, 6H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,39 (с, 1H), 9,87 (с, 1H), 8,29 (с, 1H), 8,00 (д, 1H, J=8,5 Гц), 7,77 (д, 1H, J=2,2 Гц), 7,69 (д, 1H, J=8,1 Гц), 7,60 (с, 1H), 7,34 (дд, 1H, J=8,8, 2,2 Гц), 7,28 (т, 1H, J=8,1 Гц), 7,21 (т, 1H, J=7,7 Гц), 7,00 (д, 1H, J=8,5 Гц), 6,75~6,80 (м, 3H), 3,70 (с, 3H), 3,00 (с, 3H), 1,64 (с, 6H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 10,55 (с, 1H), 9,89 (с, 1H), 8,29 (с, 1H), 8,02 (д, 1H, J=8,6 Гц), 7,79 (д, 1H, J=2,1 Гц), 7,66 (м, 1H), 7,43 (с, 1H), 7,36 (дд, 1H, J=8,6, 2,1 Гц), 7,28 (дд, 2H, J=8,8, 5,5 Гц), 7,23 (т, 1H, J=74,0 Гц), 7,13 (т, 2H, J = 8,9 Гц), 6,80 (м, 1H), 3,02 (с, 3H), 1,65 (с, 6H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,52 (с, 1H), 9,84 (с, 1H), 8,28 (с, 1H), 8,02 (д, 1H, J=8,8 Гц), 7,87 (т, 1H, J=1,5 Гц), 7,79 (д, 1H, J=1,9 Гц), 7,51 (с, 1H), 7,36 (дд, 1H, J=8,8, 1,9 Гц), 7,26~7,31 (м, 2H), 7,10~7,16 (м, 2H), 7,00 (т, 1H, J=1,9 Гц), 3,01 (с, 3H), 1,65 (с, 6H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 10,50 (с, 1H), 9,84 (с, 1H), 8,29 (с, 1H), 8,02 (д, 1H, J=8,5 Гц), 7,79 (с, 1H), 7,68 (с, 1H), 7,47 (с, 1H), 7,36 (д, 1H, J=8,6 Гц), 7,22 (т, 1H, J=74,0 Гц), 6,70~6,83 (м, 4H), 3,77 (с, 3H), 3,01 (с, 3H), 1,65 (с, 6H)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,51 (с, 1H), 9,82 (с, 1H), 8,23 (с, 1H), 7,96 (д, 1H, J=8,8 Гц), 7,84 (с, 1H), 7,74 (д, 1H, J=1,6 Гц), 7,46 (с, 1H), 7,30 (дд, 1H, J=8,8, 2,2 Гц), 6,98 (с, 1H), 6,74 (с, 2H), 6,67 (с, 1H), 3,71 (с, 3H), 2,96 (с, 3H), 1,58 (с, 6H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,51 (с, 1H), 9,84 (с, 1H), 8,28 (с, 1H), 8,01~8,03 (м, 2H), 7,79 (с, 1H), 7,58 (с, 1H), 7,52 (с, 1H), 7,33~7,38 (м, 2H) 7,24 (т, 1H, J=8,0 Гц), 7,13 (с, 1H), 6,89 (с, 1H), 6,76~6,84 (м, 2H), 4,38 (с, 2H), 3,01 (с, 3H), 1,64 (с, 6H)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,53 (с, 1H), 9,88 (ушир.с, 1H), 8,28 (с, 1H), 8,01~8,03 (м, 2H), 7,79 (м, 1H), 7,64 (с, 1H), 7,52 (с, 1H), 7,45 (с, 1H), 7,36 (м, 1H), 7,18 (м, 1H), 7,08 (с, 1H), 7,02 (дд, 1H, J=11,3, 9,0 Гц), 6,86 (м, 1H), 4,45 (с, 2H), 3,01 (с, 3H), 1,63 (с, 6H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,55 (с, 1H), 9,89 (с, 1H), 8,29 (с, 1H), 7,99~8,03 (м, 2H), 7,78 (д, 1H, J=1,9 Гц), 7,61 (м, 1H), 7,52 (с, 1H), 7,35 (дд, 1H, J=8,8, 1,9 Гц), 7,25 (с, 1H), 7,21 (т, 1H, J=8,0 Гц), 7,10 (м, 1H), 6,87 (м, 1H), 6,78 (м, 1H), 6,70 (м, 1H), 3,01 (с, 3H), 1,62 (с, 6H), 1,38 (с, 6H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,52 (с, 1H), 9,85 (с, 1H), 8,28 (с, 1H), 8,00~8,03 (м, 2H), 7,79 (д, 1H, J=1,9 Гц), 7,59 (с, 1H), 7,34~7,39 (м, 2H) 7,24 (т, 1H, J=74,0 Гц), 7,15 (с, 1H), 7,09 (д, 1H, J=8,0 Гц), 7,01~7,04 (м, 2H), 3,01 (с, 3H), 1,65 (с, 6H)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,53 (с, 1H), 9,88 (с, 1H), 8,27 (с, 1H), 8,01~8,03 (м, 2H), 7,79 (м, 1H), 7,51 (с, 2H), 7,34~7,41 (м, 2H), 7,25 (дд, 1H, J=11,1, 9,3 Гц), 7,10 (с, 1H), 3,01 (с, 3H), 1,66 (с, 6H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 10,55 (с, 1H), 9,88 (ушир.с, 1H), 8,28 (с, 1H), 8,00~8,06 (м, 2H), 7,79 (д, 1H, J=2,0 Гц), 7,57 (с, 1H), 7,35 (дд, 1H, J=8,8, 2,1 Гц), 7,16 (с, 1H), 6,75~6,80 (м, 2H), 6,72 (с, 1H), 4,02 (кв., 2H, J=7,0 Гц), 3,01 (с, 3H), 1,63 (с, 6H), 1,30 (т, 3H, J=6,9 Гц)
1H-ЯМР(300 МГц, ДМСО-d6): δ 10,56 (с, 1H), 9,86 (ушир.с, 1H), 8,29 (с, 1H), 8,00~8,07 (м, 2H), 7,79 (д, 1H, J=2,1 Гц), 7,58 (с, 1H), 7,36 (дд, 1H, J=8,7, 2,1 Гц), 7,17 (с, 1H), 6,78 (с, 1H), 6,69~6,74 (м, 2H), 4,63 (м, 1H), 3,01 (с, 3H), 1,63 (с, 6H), 1,23 (д, 6H, J=6,0 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,53 (с, 1H), 9,89 (с, 1H), 8,28 (с, 1H), 8,02 (д, 1H, J=8,8 Гц), 7,98 (с, 1H), 7,79 (д, 1H, J=1,8 Гц), 7,59 (с, 1H), 7,36 (дд, 1H, J=8,8, 2,0 Гц), 7,28 (т, 1H, J=7,7 Гц), 7,18 (д, 1H, J=7,7 Гц), 7,09~7,12 (м, 3H), 3,51 (с, 4H), 3,42 (с, 2H), 3,01 (с, 3H), 2,29 (с, 4H), 1,64 (с, 6H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,26 (с, 1H), 9,87 (с, 1H), 8,00 (д, 1H, J=8,4 Гц), 7,68 (д, 1H, J=1,9 Гц), 7,57~7,60 (м, 2H), 7,37 (дд, 1H, J=8,8, 1,9 Гц), 7,23~7,30 (м, 3H), 7,07~7,13 (м, 2H), 6,97 (д, 1H, J=8,0 Гц), 3,01 (с, 3H), 2,54 (с, 3H), 1,63 (с, 6H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,25 (с, 1H), 9,86 (с, 1H), 7,99 (д, 1H, J=8,4 Гц), 7,68 (д, 1H, J=1,9 Гц), 7,57~7,60 (м, 2H), 7,37 (дд, 1H, J=8,4, 2,2 Гц), 7,23~7,30 (м, 3H), 7,07~7,13 (м, 2H), 6,97 (д, 1H, J=7,6 Гц), 3,01 (с, 3H), 2,54 (с, 3H), 1,63 (с, 6H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,47 (с, 1H), 9,83 (с, 1H), 8,27 (с, 1H), 7,98~8,02 (м, 2H), 7,78 (д, 1H, J=2,0 Гц), 7,53 (с, 1H), 7,35 (дд, 1H, J=8,7, 2,1 Гц), 7,19~7,23 (м, 2H), 7,09~7,15 (м, 2H), 7,05 (с, 1H), 3,00 (с, 3H), 2,08 (кв., 4H, J= 7,5 Гц), 0,59 (т, 6H, J=7,2 Гц)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,33 (с, 1H), 9,80 (ушир.с, 1H), 8,28 (с, 1H), 8,01 (д, 1H, J=8,8 Гц), 7,79 (д, 1H, J=1,9 Гц), 7,42 (с, 1H), 7,35 (дд, 1H, J=8,8, 2,3 Гц), 7,15 (с, 1H), 6,77 (с, 1H), 6,75 (с, 1H), 6,66 (с, 1H), 6,50 (с, 1H), 3,75 (с, 3H), 3,73 (с, 3H), 3,01 (с, 3H), 2,05 (кв., 4H, J=7,3 Гц), 0,60 (т, 6H, J=7,3 Гц)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,65 (с, 1H), 10,04 (с, 1H), 9,59 (ушир.с, 1H), 7,60 (д, 1H, J=8,8 Гц), 7,48 (с, 1H), 7,38 (д, 1H, J=1,9 Гц), 7,35 (д, 1H, J=1,9 Гц), 7,18 (с, 1H), 6,98 (дд, 1H, J=8,4, 1,9 Гц), 6,76 (с, 2H), 6,66 (с, 1H), 6,47 (с, 1H), 3,75 (с, 3H), 3,73 (с, 3H), 2,93 (с, 3H), 2,07 (кв., 4H, J=7,3 Гц), 0,61 (т, 6H, J=7,3 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,66 (с, 1H), 10,17 (с, 1H), 8,53 (с, 1H), 8,28 (с, 1H), 8,20 (с, 1H), 8,03 (с, 1H), 7,58 (с, 1H), 7,19 (с, 1H), 6,82 (с, 2H), 6,74 (с, 1H), 3,78 (с, 3H), 3,08 (с, 3H), 1,65 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,68 (с, 1H), 10,14 (с, 1H), 8,54 (с, 1H), 8,29 (с, 1H), 8,21 (с, 1H), 7,90 (с, 1H), 7,53 (с, 1H), 7,07 (с, 1H), 6,82 (с, 2H), 6,74 (с, 1H), 3,78 (с, 3H), 3,09 (с, 3H), 1,66 (с, 6H)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,55 (с, 1H), 9,87 (ушир.с, 1H), 8,28 (с, 1H), 8,02 (д, 1H, J=8,6 Гц), 7,90 (с, 1H), 7,79 (с, 1H), 7,52 (с, 1H), 7,35 (д, 1H, J=8,6 Гц), 7,04 (с, 1H), 6,72~6,78 (м, 3H), 4,01 (кв., 2H, J=6,8 Гц), 3,01 (с, 3H), 1,64 (с, 6H), 1,30 (т, 3H, J=6,8 Гц)
1H-ЯМР (400 МГц, ДМСО-d6): δ 11,72 (с, 1H), 10,25 (с, 1H), 9,64 (с, 1H), 7,96 (с, 1H), 7,62 (д, 1H, J=8,6 Гц), 7,55 (с, 1H), 7,37~7,39 (м, 2H), 6,97~7,00 (м, 2H), 6,73~6,78 (м, 3H), 4,03 (кв., 2H, J=6,8 Гц), 2,94 (с, 3H), 1,64 (с, 6H), 1,30 (т, 3H, J=6,8 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,90 (с, 1H), 10,55 (с, 1H), 8,44 (д, 1H, J=8,9 Гц), 8,40 (с, 1H), 8,05 (м, 1H), 7,60 (м, 1H), 7,17 (м, 1H), 7,04 (д, 1H, J=8,8 Гц), 6,77 (с, 2H), 6,72 (с, 1H), 4,02 (кв., 2H, J=7,0 Гц), 3,42 (с, 3H), 1,64 (с, 6H), 1,30 (т, 3H, J=7,0 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,70 (с, 1H), 10,54 (ушир.с, 1H), 9,09 (с, 1H), 8,26 (с, 1H), 8,03 (м, 1H), 7,55 (с, 1H), 7,51 (с, 1H), 7,20 (м, 1H), 6,78 (с, 2H), 6,72 (с, 1H), 4,02 (кв., 2H, J=7,2 Гц), 3,30 (с, 3H), 1,64 (с, 6H), 1,30 (т, 3H, J=6,8 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,54 (с, 1H), 9,86 (ушир.с, 1H), 8,26 (с, 1H), 8,01 (д, 1H, J=8,7 Гц), 7,87 (м, 1H), 7,79 (д, 1H, J=1,9 Гц), 7,49~7,52 (м, 1H), 7,47 (с, 1H), 7,34~7,39 (м, 2H), 7,25 (дд, 1H, J=11,1, 9,0 Гц), 6,97 (м, 1H), 3,00 (с, 3H), 1,66 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6); 10,56 (с, 1H), 9,86 (с, 1H), 8,28 (с, 1H), 8,02 (д, 1H, J=8,7 Гц), 7,79 (с, 1H), 7,68 (д, 1H, J=11,0 Гц), 7,35~7,38 (м, 2H), 6,79~6,86 (м, 3H), 6,72 (с, 1H), 3,76 (с, 3H), 3,01 (с, 3H), 1,65 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,54 (с, 1H), 9,86 (ушир.с, 1H), 8,28 (с, 1H), 8,02 (д, 1H, J=8,7 Гц), 7,87 (с, 1H), 7,79 (с, 1H), 7,54 (с, 1H), 7,20~7,37 (м, 6H), 7,00 (с, 1H), 3,01 (с, 3H), 1,65 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,56 (с, 1H), 9,90 (с, 1H), 8,29 (с, 1H), 8,03 (д, 1H, J=8,8 Гц), 7,90 (т, 1H, J=2,0 Гц), 7,80 (д, 1H, J=2,0 Гц), 7,52 (т, 1H, J=1,6 Гц), 7,34~7,40 (м, 2H), 7,07~7,11 (м, 2H), 7,05~7,06 (м, 2H), 3,02 (с, 3H), 1,67 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,74 (ушир.с, 1H), 8,82 (ушир.с, 1H), 8,50 (с, 1H), 7,84 (м, 2H), 7,55 (д, 1H, J=8,8 Гц), 7,52 (с, 1H), 7,06 (с, 1H), 6,77 (с, 1H), 6,74 (м, 1H), 6,72 (с, 1H), 4,60~4,66 (м, 1H), 3,84 (м, 4H), 3,22~3,26 (ушир.с, 3H), 3,02~3,05 (м, 4H), 1,66 (с, 6H), 1,24 (д, 6H, J=6,0 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,53 (с, 1H), 9,86 (ушир.с, 1H), 8,27 (с, 1H), 8,00 (д, 1H, J=8,7 Гц), 7,87 (с, 1H), 7,77 (д, 1H, J=2,0 Гц), 7,48 (с, 1H), 7,33 (дд, 1H, J=8,7, 2,0 Гц), 7,03 (с, 1H), 6,60~6,70 (м, 1H), 6,58~6,61 (м, 2H), 3,72 (с, 3H), 2,99 (с, 3H), 1,61 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,56 (с, 1H), 9,89 (с, 1H), 8,28 (с, 1H), 8,02 (д, 1H, J=8,0 Гц), 7,91 (с, 1H), 7,79 (с, 1H), 7,54 (с, 1H), 7,36 (д, 1H, J=8,0 Гц), 7,06 (с, 1H), 6,78 (с, 1H), 6,74 (с, 1H), 6,72 (с, 1H), 4,59~4,68 (м, 1H), 3,01 (с, 3H), 1,65 (с, 6H), 1,25 (д, 6H, J=6,0 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,68 (с, 1H), 10,14 (с, 1H), 8,54 (с, 1H), 8,28 (с, 1H), 8,20 (с, 1H), 7,90 (с, 1H), 7,54 (с, 1H), 7,08 (с, 1H), 6,78 (с, 1H), 6,74 (с, 1H), 6,72 (с, 1H), 4,61~4,67 (м, 1H), 3,07 (с, 3H), 1,65 (с, 6H), 1,25 (д, 6H, J=5,9 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,89 (с, 1H), 10,57 (с, 1H), 8,45 (д, 1H, J=8,9 Гц), 8,41 (с, 1H), 7,92 (м, 1H), 7,56 (м, 1H), 7,03~7,06 (м, 2H), 6,77 (с, 1H), 6,72 (м, 1H), 6,71 (с, 1H), 4,60~4,66 (м, 1H), 3,42 (с, 3H), 1,64 (с, 6H), 1,23 (д, 6H, J=6,0 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,73 (с, 1H), 10,54 (ушир.с, 1H), 9,10 (с, 1H), 8,27 (с, 1H), 7,90 (м, 1H), 7,52 (с, 2H), 7,08 (м, 1H), 6,77 (с, 1H), 6,73 (с, 1H), 6,71 (с, 1H), 4,60~4,66 (м, 1H), 3,31 (с, 3H), 1,64 (с, 6H), 1,24 (д, 6H, J=6,0 Гц)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,55 (с, 1H), 9,87 (ушир.с, 1H), 8,28 (с, 1H), 8,02 (д, 1H, J=8,6 Гц), 7,90 (с, 1H), 7,80 (с, 1H), 7,52 (с, 1H), 7,36 (д, 1H, J=8,8 Гц), 7,04 (с, 1H), 6,71~6,80 (м, 3H), 3,75 (д, 2H, J=6,4 Гц), 3,01 (с, 3H), 1,93~2,04 (м, 1H), 1,64 (с, 6H), 0,96 (д, 6H, J=6,6 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,56 (с, 1H), 9,89 (с, 1H), 8,29 (с, 1H), 8,03 (д, 1H, J=8,8 Гц), 7,91 (с, 1H), 7,81 (с, 1H), 7,53 (с, 1H), 7,37 (д, 1H, J=8,8 Гц), 7,05 (с, 1H), 6,80 (с, 2H), 6,73 (с, 1H), 3,94 (т, 2H, J=6,4 Гц), 3,03 (с, 3H), 1,69~1,74 (м, 2H), 1,65 (с, 6H), 0,97 (т, 3H, J=7,2 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,43 (с, 1H), 9,83 (ушир.с, 1H), 8,57 (с, 1H), 8,54 (с, 1H), 8,04 (м, 1H), 7,80 (м, 1H), 7,64 (д, 1H, J=9,6 Гц), 7,27 (дд, 1H, J=9,6, 1,6 Гц), 6,96 (м, 1H), 6,69 (с, 1H), 6,67 (м, 1H), 6,64 (с, 1H), 4,53~4,59 (м, 1H), 3,00 (с, 3H), 1,63 (с, 6H), 1,23 (д, 6H, J=6,0 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,57 (с, 1H), 9,88 (с, 1H), 8,29 (с, 1H), 8,03 (д, 1H, J=8,8 Гц), 7,91 (с, 1H), 7,80 (д, 1H, J=2,0 Гц), 7,55 (с, 1H), 7,37 (дд, 1H, J=8,8, 2,0 Гц), 7,05 (с, 1H), 6,84 (с, 2H), 6,80 (с, 1H), 4,78 (д, 2H, J=2,4 Гц), 3,02 (с, 3H), 1,80 (с, 3H) 1,66 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,55 (с, 1H), 9,86 (ушир.с, 1H), 8,28(с, 1H), 8,02 (д, 1H, J=8,7 Гц), 7,90 (с, 1H), 7,80 (с, 1H), 7,53 (с, 1H), 7,36(д, 1H, J=8,7 Гц), 7,05 (с, 1H), 6,79 (с, 1H), 6,68 (с, 1H), 6,62 (с, 1H), 5,30~5,35 (м, 1H), 4,87 (дд, 2H, J=6,8, 6,4 Гц), 4,51 (дд, 2H, J=7,2, 4,8 Гц), 3,01 (с, 3H), 1,65 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,55 (с, 1H), 9,85 (ушир.с, 1H), 8,28 (с, 1H), 8,02 (д, 1H, J=8,7 Гц), 7,91 (с, 1H), 7,79 (с, 1H), 7,54 (с, 1H), 7,36 (д, 1H, J=8,7 Гц), 7,04 (с, 1H), 7,00 (с, 1H), 6,96 (с, 1H), 6,87 (с, 1H), 5,23 (с, 2H), 3,01 (с, 3H), 1,66 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,55 (с, 1H), 9,87 (ушир.с, 1H), 8,29 (с, 1H), 8,02 (д, 1H, J=8,4 Гц), 7,91 (м, 1H), 7,79 (с, 1H), 7,54 (с, 1H), 7,36 (д, 1H, J=8,7 Гц), 7,05 (м, 1H), 6,83 (с, 2H), 6,75 (с, 1H), 5,96~6,06 (м, 1H), 5,40 (дд, 1H, J=17,3, 1,6 Гц), 5,27 (дд, 1H, J=10,8, 1,7 Гц), 4,60 (д, 2H, J=5,4 Гц), 3,01 (с, 3H), 1,66 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,55 (с, 1H), 9,88 (ушир.с, 1H), 8,29 (с, 1H), 8,03 (д, 1H, J=8,4 Гц), 7,91 (м, 1H), 7,80 (м, 1H), 7,55 (с, 1H), 7,37 (дд, 1H, J=8,8, 2,4 Гц), 7,06 (м, 1H), 6,95 (с, 1H), 6,87 (м, 1H), 6,78 (с, 1H), 3,86~3,91 (м, 1H), 3,02 (с, 3H), 1,66 (с, 6H), 0,78 (м, 2H), 0,67 (м, 2H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,57 (с, 1H), 9,88 (с, 1H), 8,28 (с, 1H), 8,03 (д, 1H, J=8,4 Гц), 7,93 (с, 1H), 7,80 (с, 1H), 7,56 (с, 1H), 7,37 (д, 1H, J=8,8 Гц), 7,27 (с, 1H), 7,24 (с, 1H), 7,14 (с, 1H), 7,07 (с, 1H), 6,82 (тт, 1H, J=56,0, 3,2 Гц), 3,02 (с, 3H), 1,69 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 11,21 (с, 1H), 10,19 (ушир.с, 1H), 8,26 (д, 1H, J=8,7 Гц), 8,10 (с, 1H), 8,05 (с, 1H), 7,86 (с, 1H), 7,51 (дд, 1H, J=8,7, 2,0 Гц), 7,13 (с, 1H), 6,83 (с, 1H), 6,79 (с, 1H), 6,77 (с, 1H), 4,67~4,70 (м, 1H), 3,11 (с, 3H), 1,70 (с, 6H), 1,29 (д, 6H, J=6,0 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,57 (с, 1H), 9,87 (с, 1H), 8,29 (с, 1H), 8,02 (д, 1H, J=8,8 Гц), 7,80 (с, 1H), 7,68 (д, 1H, J=10,8 Гц), 7,40 (с, 1H), 7,36 (д, 1H, J=8,8 Гц), 6,85 (д, 1H, J=10,4 Гц), 6,76 (с, 1H), 6,73 (с, 1H), 6,70 (с, 1H), 4,59~4,65 (м, 1H), 3,01 (с, 3H), 1,64 (с, 6H), 1,23 (д, 6H, J=6,0 Гц)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,55 (с, 1H), 9,87 (ушир.с, 1H), 8,28 (с, 1H), 8,02 (д, 1H, J=8,7 Гц), 7,90 (с, 1H), 7,79 (с, 1H), 7,53 (с, 1H), 7,36 (д, 1H, J=8,7 Гц), 7,04 (с, 1H), 6,92 (с, 1H), 6,89 (с, 1H), 6,80 (с, 1H), 6,37 (тт, 1H, J=54,3, 3,3 Гц), 4,37 (тд, 2H, J=14,7, 3,3 Гц), 3,01 (с, 3H), 1,65 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,61 (с, 1H), 9,77 (ушир.с, 1H), 8,29 (с, 1H), 8,09 (д, 1H, J=10,4 Гц), 7,99 (д, 1H, J=7,6 Гц), 7,90 (м, 1H), 7,53 (с, 1H), 7,06 (м, 1H), 6,78 (с, 1H), 6,74 (м, 1H), 6,72 (с, 1H), 4,62~4,65 (м, 1H), 3,06 (с, 3H), 1,65 (с, 6H), 1,25 (д, 6H, J=6,0 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,59 (с, 1H), 9,88 (ушир.с, 1H), 8,29 (с, 1H), 8,03 (д, 1H, J=8,8 Гц), 7,80 (м, 1H), 7,71 (д, 1H, J=10,9 Гц), 7,42 (с, 1H), 7,37 (дд, 1H, J=8,7, 2,1 Гц), 7,26 (с, 1H), 7,23 (с, 1H), 7,13 (с, 1H), 6,89 (д, 1H, J=10,2 Гц), 6,81 (тт, 1H, J=51,9, 3,0 Гц), 3,02 (с, 3H), 1,69 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,76 (с, 1H), 10,54 (с, 1H), 9,10 (с, 1H), 8,27 (с, 1H), 7,70 (д, 1H, J=10,9 Гц), 7,52 (с, 1H), 7,41 (с, 1H), 7,26 (с, 1H), 7,23 (с, 1H), 7,13 (с, 1H), 6,93 (д, 1H, J=10,4 Гц), 6,81 (тт, 1H, J=51,9, 3,0 Гц), 3,31 (с, 3H), 1,69 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,55 (с, 1H), 9,88 (с, 1H), 8,28 (с, 1H), 8,06 (с, 1H), 8,03 (д, 1H, J=8,8 Гц), 7,80 (с, 1H), 7,60 (с, 1H), 7,36 (дд, 1H, J=8,8, 1,6 Гц), 7,27 (с, 1H), 7,24 (с, 1H), 7,19 (с, 1H), 7,14 (с, 1H), 6,82 (тт, 1H, J=52,0, 3,2 Гц), 3,02 (с, 3H), 1,69 (с, 6H)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,55 (с, 1H), 9,85 (ушир.с, 1H), 8,28 (с, 1H), 8,02 (д, 1H, J=8,5 Гц), 7,90 (с, 1H), 7,79 (с, 1H), 7,55 (с, 1H), 7,36 (д, 1H, J=8,7 Гц), 7,05 (с, 1H), 7,00 (с, 1H), 6,98 (с, 1H), 6,84 (с, 1H), 4,85 (кв., 2H, J=8,8 Гц), 3,00 (с, 3H), 1,67 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,71 (с, 1H), 10,53 (ушир.с, 1H), 9,10 (с, 1H), 8,26 (с, 1H), 8,04 (с, 1H), 7,57 (с, 1H), 7,52 (с, 1H), 7,26 (с, 1H), 7,22 (с, 2H), 7,12 (с, 1H), 6,80 (т, 1H, J=52,0 Гц), 3,33 (с, 3H), 1,68 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,57 (с, 1H), 9,91 (ушир.с, 1H), 8,28 (с, 1H), 8,01 (д, 1H, J=8,9 Гц), 7,91 (с, 1H), 7,78 (с, 1H), 7,54 (с, 1H), 7,34 (д, 1H, J=8,9 Гц), 7,05 (с, 1H), 6,84 (с, 1H), 6,80 (с, 1H), 6,75 (с, 1H), 4,10 (т, 2H, J=5,5 Гц), 3,54~3,57 (м, 4H), 3,05 (с, 3H), 2,65 (т, 2H, J=5,5 Гц), 2,41~2,46 (м, 4H), 1,65 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,57 (с, 1H), 9,90 (ушир.с, 1H), 8,28 (с, 1H), 8,01 (д, 1H, J=8,7 Гц), 7,91 (с, 1H), 7,77 (с, 1H), 7,49 (с, 1H), 7,34 (д, 1H, J=8,7 Гц), 7,06 (с, 1H), 6,98 (с, 1H), 6,91 (с, 1H), 6,68 (с, 1H), 4,52~4,64 (м, 1H), 2,99 (с, 3H), 1,64 (с, 6H), 1,21 (д, 6H, J=6,0 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,57 (с, 1H), 9,88 (ушир.с, 1H), 8,28 (с, 1H), 8,01 (д, 1H, J=8,7 Гц), 7,91 (с, 1H), 7,77 (с, 1H), 7,49 (с, 1H), 7,34 (д, 1H, J=8,7 Гц), 7,07 (с, 1H), 6,87 (с, 1H), 6,79 (с, 1H), 6,65 (с, 1H), 4,59~4,63 (м, 1H), 3,00 (с, 3H), 1,62 (с, 6H), 1,22 (д, 6H, J=6,0 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,67 (с, 1H), 9,75 (ушир.с, 1H), 8,46 (с, 1H), 7,89~7,92 (м, 2H), 7,49~7,53 (м, 2H), 7,06 (м, 1H), 6,78 (с, 1H), 6,71~6,72 (м, 2H), 4,60~4,66 (м, 1H), 3,05 (с, 3H), 1,64 (с, 6H), 1,23 (д, 6H, J=6,0 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,57 (с, 1H), 9,88 (с, 1H), 8,28 (с, 1H), 8,02 (д, 1H, J=8,8 Гц), 7,90 (с, 1H), 7,79 (д, 1H J=2,0 Гц), 7,52 (с, 1H), 7,35 (дд, 1H, J=8,8, 2,0 Гц), 7,05 (с, 1H), 6,82 (с, 1H), 6,78 (с, 1H), 6,73 (с, 1H), 4,04 (т, 2H J=5,6 Гц), 3,01 (с, 3H), 2,57 (т, 2H J=5,6 Гц), 2,17 (с, 6H), 1,64 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,57 (с, 1H), 9,90 (с, 1H), 8,29 (с, 1H),
8,03 (д, 1H, J=8,8 Гц), 7,90 (с, 1H), 7,80 (с, 1H), 7,55 (с, 1H), 7,36 (д, 1H, J=8,8 Гц), 7,07 (с, 1H), 6,90 (с, 1H), 6,80 (с, 1H), 6,75 (с, 1H), 4,60~4,62 (м, 1H), 3,64~3,67 (м, 2H), 3,10~3,20 (м, 2H), 3,02 (с, 3H), 1,86~1,91 (м, 2H), 1,65 (с, 6H), 1,53~1,44 (м, 2H), 1,39 (с, 9H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,54 (с, 1H), 8,26 (с, 1H), 7,99 (д, 1H, J=8,8 Гц), 7,90 (с, 1H), 7,76 (с, 1H), 7,53 (с, 1H), 7,33 (д, 1H, J=8,8 Гц), 7,05 (с, 1H), 6,82 (с, 1H), 6,74 (с, 1H), 6,71 (с, 1H), 4,37~4,46 (м, 1H), 2,98 (с, 3H), 2,88~2,92 (м, 2H), 2,53~2,57 (м, 2H), 1,84~1,89 (м, 2H), 1,64 (с, 6H), 1,38~1,42 (м, 2H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,29 (с, 1H), 7,86 (м, 1H), 7,76 (с, 1H), 7,45 (с, 1H), 7,01 (м, 1H), 6,77 (с, 1H), 6,71 (с, 1H), 6,69 (с, 1H), 4,59~4,65 (м, 1H), 4,32 (с, 2H), 3,49~3,52 (м, 2H), 2,98 (с, 5H), 1,62 (с, 6H), 1,23 (д, 6H, J=6,0 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 11,97 (с, 1H), 10,40 (ушир.с, 2H), 8,75 (с, 1H), 8,07 (с, 1H), 7,59 (с, 1H), 7,49 (с, 1H), 7,15 (с, 1H), 7,07 (с, 1H), 6,82 (с, 1H), 6,80 (с, 1H), 6,73 (с, 1H), 3,78 (с, 3H), 3,24 (с, 3H), 1,64 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 12,18 (с, 1H), 10,49 (с, 1H), 9,95 (с, 1H), 8,60 (с, 1H), 8,07 (с, 1H), 7,59 (с, 1H), 7,34 (с, 1H), 7,32 (с, 1H), 7,18 (с, 1H), 6,81 (с, 2H), 6,73 (с, 1H), 3,77 (с, 3H), 3,19 (с, 3H), 1,65 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 12,12 (с, 1H), 10,63 (ушир.с, 1H), 10,22 (с, 1H), 8,04 (д, 1H, J=8,4 Гц), 7,95 (с, 1H), 7,53 (с, 1H), 7,31 (с, 1H), 7,00 (с, 1H), 6,71~6,77 (м, 4H), 4,61~4,64 (м, 1H), 3,43 (с, 3H), 1,64 (с, 6H), 1,23 (д, 6H, J=5,9 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 11,98 (ушир.с, 1H), 10,41 (ушир.с, 2H), 8,75 (с, 1H), 7,94(с, 1H), 7,54 (с, 1H), 7,48 (с, 1H), 7,07 (с, 1H), 7,03(с, 1H), 6,77 (с, 1H), 6,73 (с, 1H), 6,71 (с, 1H), 4,61~4,64 (м, 1H), 3,23 (с, 3H), 1,64 (с, 6H), 1,23 (д, 6H, J=5,5 Гц)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,43 (с, 1H), 9,98 (ушир.с, 1H), 7,85 (с, 2H), 7,50 (с, 1H), 7,33 (с, 1H), 7,01 (с, 1H), 6,69~6,76 (м, 2H), 4,60~4,66 (м, 2H), 3,02 (с, 3H), 1,64 (с, 6H), 1,24 (д, 6H, J=5,9 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,56 (с, 1H), 10,19 (ушир.с, 1H), 8,27 (с, 1H), 8,00 (д, 1H, J=8,8 Гц), 7,91 (с, 1H), 7,78 (с, 1H), 7,53 (с, 1H), 7,36 (дд, 1H, J=8,7, 2,1 Гц), 7,05 (с, 1H), 6,77 (с, 1H), 6,72 (с, 1H), 6,71 (с, 1H), 4,60~4,66 (м, 1H), 3,51~3,54 (м, 4H), 3,07~3,10 (м, 4H), 1,64 (с, 6H), 1,23 (д, 6H, J=6,0 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,21 (с, 1H), 8,55 (с, 1H), 7,86 (м, 1H), 7,68 (с, 1H), 7,48 (м, 1H), 6,99 (м, 1H), 6,76 (с, 1H), 6,71 (м, 1H), 6,69 (с, 1H), 4,62 (м, 1H), 3,93 (с, 2H), 3,12~3,15 (м, 2H), 2,97~3,00 (м, 5H), 1,62 (с, 6H), 1,23 (д, 6H, J=6,0 Гц)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,64 (с, 1H), 9,68 (ушир.с, 1H), 8,34 (с, 1H), 8,29 (с, 1H), 8,03 (с, 1H), 7,89 (с, 1H), 7,52 (с, 1H), 7,05 (с, 1H), 6,77 (с, 1H), 6,72 (с, 1H), 6,70 (с, 1H), 4,60 (м, 1H), 3,05 (с, 3H), 1,64 (с, 6H), 1,23 (д, 6H, J=5,9 Гц)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,46 (с, 1H), 9,79 (ушир.с, 1H), 8,21 (с, 1H), 7,95 (д, 1H, J=8,8 Гц), 7,81 (с, 1H), 7,72 (с, 1H), 7,46 (с, 1H), 7,29 (дд, 1H, J=8,8, 2,0 Гц), 7,16 (т, 1H, J=8,8 Гц), 6,94 (с, 1H), 6,10~6,73 (м, 3H), 3,66 (с, 3H), 2,94 (с, 3H), 1,57 (с, 6H)
Пример 107) Синтез N-(3-этинил-5-(2-(4-фторфенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
(a) Синтез N-(3-(2-(4-фторфенил)пропан-2-ил)-5-((триметилсилил)этинил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
N-(3-бром-5-(2-(4-фторфенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид (56,0 мг, 0,10 ммоль), CuI (12,0 мг, 0,06 ммоль) и Pd(t-Bu3P)2 (31,0 мг, 0,06 ммоль) высушивали при пониженном давлении и растворяли в безводном 1,4-диоксане (1,0 мл) в закрытой пробирке. Добавляли этинилтриметилсилан (189,0 мкл, 1,34 ммоль), Et3N (186,0 мкл, 1,34 ммоль) с последующим нагреванием при 130°C в течение 14 часов, и реакционную смесь охлаждали до комнатной температуры. К реакционной смеси добавляли воду и затем экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (амин силикагель, CH2Cl2 : MeOH = 20:1), получая N-(3-(2-(4-фторфенил)пропан-2-ил)-5-((триметилсилил)этинил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид (30,0 мг, 50 %) в форме твердого вещества грязно-белого цвета.
LC/MS ESI (+): 562 (M+1)
(b) Синтез N-(3-этинил-5-(2-(4-фторфенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
К раствору N-(3-(2-(4-фторфенил)пропан-2-ил)-5-((триметилсилил)этинил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида (30,0 мг, 0,05 ммоль) в безводном THF (1,0 мл) добавляли 1н. раствор TBAF в THF (106,0 мкл, 0,10 моль) с последующим перемешиванием при комнатной температуре в течение 1 часа. Добавляли воду и затем экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (амин силикагель, CH2Cl2 : MeOH = 20:1), получая N-(3-этинил-5-(2-(4-фторфенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид (10,0 мг, 38 %) в форме твердого вещества грязно-белого цвета.
LC/MS ESI (+): 490 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,68 (с, 1H), 10,15 (с, 1H), 9,58 (ушир.с, 1H), 7,92 (с, 1H), 7,60-7,64 (м, 2H), 7,38 (д, 1H, J=1,3 Гц), 7,36 (д, 1H, J=1,3 Гц), 7,24-7,30 (м, 2H), 7,09-7,16 (м, 2H), 7,03 (с, 1H), 6,98 (дд, 1H, J=8,2, 1,5 Гц), 4,15 (с, 1H), 2,84 (с, 3H), 1,65 (с, 6H)
Способом синтеза согласно Примеру 107 синтезировали соединения Примера 108 и Примера 109, и данные для каждого примера являются следующими.
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,48 (с, 1H), 9,88 (ушир.с, 1H), 8,28 (с, 1H), 8,02 (д, 1H, J=8,8 Гц), 7,87 (с, 1H), 7,78 (д, 1H, J=1,9 Гц), 7,61 (с, 1H), 7,35 (дд, 1H, J=8,8, 1,9 Гц), 7,25~7,29 (м, 2H), 7,07~7,15 (м, 3H), 4,20 (с, 1H), 3,00 (с, 3H), 1,64 (с, 6H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,43 (с, 1H), 9,83 (ушир.с, 1H), 8,26 (с, 1H), 8,01 (д, 1H, J=8,6 Гц), 7,86 (т, 1H, J=1,5 Гц), 7,78 (д, 1H, J=1,9 Гц), 7,56~7,64 (м, 2H), 7,35 (дд, 1H, J=8,8, 2,1 Гц), 7,06~7,16 (м, 2H), 7,02 (с, 1H), 4,15 (с, 1H), 3,01 (с, 3H), 1,65 (с, 6H)
Пример 110) Синтез 3-хлор-N-(3-(2-(4-фторфенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
(a) Синтез 3-хлор-N-(3-(2-(4-фторфенил)пропан-2-ил)фенил)-6-нитробензо[b]тиофен-2-карбоксамида
3-хлор-6-нитробензо[b]тиофен-2-карбоновую кислоту (50,0 мг, 0,19 ммоль), 3-(2-(4-фторфенил)пропан-2-ил)анилин (49,0 мг, 0,21 ммоль), HATU (81,0 мг, 0,21 ммоль) и DIPEA (51,0 мкл, 0,29 ммоль) растворяли в безводном DMF (4,0 мл) с последующим нагреванием при 40°C в течение 24 часов. Реакционную смесь экстрагировали EtOAc, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (амин силикагель, н-гексан : EtOAc = 4:1), получая 3-хлор-N-(3-(2-(4-фторфенил)пропан-2-ил)фенил)-6-нитробензо[b]тиофен-2-карбоксамид (37,0 мг, 41 %) в форме твердого вещества желтовато-коричневого цвета.
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,69 (с, 1H), 9,28 (с, 1H), 8,39 (дд, 1H, J=8,8, 2,2 Гц), 8,13 (д, 1H, J=8,8 Гц), 7,57-7,61 (м, 2H), 7,10-7,34 (м, 3H), 6,34-6,39 (м, 3H), 1,64 (с, 6H)
(b) Синтез 6-амино-3-хлор-N-(3-(2-(4-фторфенил)пропан-2-ил)фенил)бензо[b]тиофен-2-карбоксамида
3-хлор-N-(3-(2-(4-фторфенил)пропан-2-ил)фенил)-6-нитробензо[b]тиофен-2-карбоксамид (35,0 мг, 0,08 ммоль), Zn (73,6 мг, 1,13 ммоль) и NH4Cl (20,0 мг, 0,38 ммоль) растворяли в смеси THF/MeOH/H2O (3,0 мл, 1/0,5/0,5 об./об.) и обрабатывали ультразвуком в течение 1,5 часов. Фильтрацией и концентрацией при пониженном давлении получали 6-амино-3-хлор-N-(3-(2-(4-фторфенил)пропан-2-ил)фенил)бензо[b]тиофен-2-карбоксамид в форме твердого вещества белого цвета.
LC/MS ESI (+): 439 (M+1)
(c) Синтез 3-хлор-N-(3-(2-(4-фторфенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
6-амино-3-хлор-N-(3-(2-(4-фторфенил)пропан-2-ил)фенил)бензо[b]тиофен-2-карбоксамид растворяли в пиридине (1,0 мл) и метансульфонил хлорид (7,6 мкл, 0,10 ммоль) медленно добавляли при 0°C. Реакционную смесь перемешивали при комнатной температуре в течение 2 часов и экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (амин силикагель, CH2Cl2 : MeOH = 20:1), получая 3-хлор-N-(3-(2-(4-фторфенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (20,9 мг, 2 стадии выход: 54 %) в форме твердого вещества белого цвета.
LC/MS ESI (+): 517 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,40 (с, 1H), 10,24 (с, 1H), 7,90 (м, 1H), 7,88 (д, 1H, J=8,8 Гц), 7,56-7,60 (м, 2H), 7,42 (дд, 1H, J=8,8, 1,9 Гц), 7,23-7,31 (м, 3H), 7,07-7,13 (м, 2H), 7,00 (д, 1H, J=7,6 Гц), 3,11 (с, 3H), 1,63 (с, 6H)
Способом синтеза согласно Примеру 110 синтезировали соединения с Примера 111 по Пример 113, и данные для каждого примера являются следующими.
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,56 (с, 1H), 10,28 (с, 1H), 7,88~7,93 (м, 3H), 7,75 (д, 1H, J=8,5 Гц), 7,56~7,64 (м, 1H), 7,50 (т, 1H, J=7,7 Гц), 7,36~7,44 (м, 2H), 7,31 (д, 1H, J=7,7 Гц), 7,19~7,25 (м, 1H), 3,10 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,59 (с, 1H), 9,72 (ушир.с, 1H), 7,99 (с, 1H), 7,87 (д, 1H, J=8,1 Гц), 7,75 (с, 1H), 7,56~7,64 (м, 1H), 7,48 (т, 1H, J=8,1 Гц), 7,36~7,44 (м, 1H), 7,28~7,30 (м, 1H), 7,22~7,26 (м, 1H), 7,20 (с, 1H), 6,90 (с, 1H), 3,97 (с, 3H), 3,00 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,39 (с, 1H), 9,71 (ушир.с, 1H), 7,73 (д, 1H, J=7,6 Гц), 7,70 (с, 1H), 7,63 (с, 1H), 7,23~7,30 (м, 3H), 7,18 (м, 1H), 7,07~7,13 (м, 2H), 6,98 (д, 1H, J=8,0 Гц), 6,94 (с, 1H), 3,95 (с, 3H), 2,99 (с, 3H), 1,64 (с, 6H)
Пример 114) Синтез N-(3-хлор-5-(2-(3-(проп-1-ин-1-ил)-5-(трифторметокси)фенилпропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
(a) Синтез 3-(2-(3-хлор-5-нитрофенил)пропан-2-ил)-5-(трифторметокси)фенил трифторметансульфоната
3-(2-(3-хлор-5-нитрофенил)пропан-2-ил)-5-(трифторметокси)фенол (100,0 мг, 0,27 ммоль) растворяли в CH2Cl2 (2,7 мл), и пиридин (109,0 мкл, 1,35 ммоль) и Tf2O (45,0 мкл, 0,27 ммоль) медленно добавляли при 0°C. Смесь перемешивали при 0°C в течение 2 часов и затем экстрагировали CH2Cl2, Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 9:1), получая 3-(2-(3-хлор-5-нитрофенил)пропан-2-ил)-5-(трифторметокси)фенил трифторметансульфонат (120,0 мг, 88 %) в форме бесцветной жидкости.
1H-ЯМР (400 МГц, CDCl3): δ 8,13 (т, 1H, J=1,9 Гц), 7,99 (т, 1H, J=1,9 Гц), 7,45 (т, 1H, J=1,8 Гц), 7,08-7,10 (м, 2H), 7,04 (т, 1H, J=1,9 Гц), 1,75 (с, 6H)
(b) Синтез 1-хлор-3-нитро-5-(2-(3-(проп-1-ин-1-ил)-5-(трифторметокси)фенилпропан-2-ил)бензола
3-(2-(3-хлор-5-нитрофенил)пропан-2-ил)-5-(трифторметокси)фенил трифторметансульфонат (280,0 мг, 0,55 ммоль) растворяли в безводном DMF (5,5 мл) и 1-(триметилсилил)-1-пропин (123,0 мкл, 0,83 ммоль), Pd(PPh3) 4 (64,0 мг, 0,06 ммоль), CuI (21,0 мг, 0,11 ммоль) и DIPEA (480,0 мкл, 2,75 ммоль) добавляли при комнатной температуре. Смесь нагревали при 90°C в течение 15 часов и затем экстрагировали CH2Cl2, Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : CH2Cl2 = 4:1), получая 1-хлор-3-нитро-5-(2-(3-(проп-1-ин-1-ил)-5-(трифторметокси)фенилпропан-2-ил)бензол (120,0 мг, 55 %) в форме бесцветной жидкости.
1H-ЯМР (400 МГц, CDCl3): δ 8,08 (т, 1H, J=1,9 Гц), 7,99 (т, 1H, J=1,9 Гц), 7,46 (т, 1H, J=1,8 Гц), 7,11-7,13 (м, 2H), 6,94 (с, 1H), 2,04 (с, 3H), 1,70 (с, 6H)
(c) Синтез 3-хлор-5-(2-(3-(проп-1-ин-1-ил)-5-(трифторметокси)фенилпропан-2-ил)анилина
Процедуру синтеза Промежуточного соединения 40 повторяли за исключением использования 1-хлор-3-нитро-5-(2-(3-(проп-1-ин-1-ил)-5-(трифторметокси)фенилпропан-2-ил)бензола (120,0 мг, 0,30 ммоль), получая 3-хлор-5-(2-(3-(проп-1-ин-1-ил)-5-(трифторметокси)фенилпропан-2-ил)анилин (93,0 мг, 84 %).
LC/MS ESI (+): 368 (M+1)
(d) Синтез N-(3-хлор-5-(2-(3-(проп-1-ин-1-ил)-5-(трифторметокси)фенилпропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид
Процедуру синтеза Примера 1 повторяли за исключением использования 3-хлор-5-(2-(3-(проп-1-ин-1-ил)-5-(трифторметокси)фенилпропан-2-ил)анилина (55,0 мг, 0,15 ммоль), получая N-(3-хлор-5-(2-(3-(проп-1-ин-1-ил)-5-(трифторметокси)фенилпропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (40,0 мг, 43 %).
LC/MS ESI (+): 621 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,55 (с, 1H), 9,90 (ушир.с, 1H), 8,27 (с, 1H), 8,01 (д, 1H, J=8,6 Гц), 7,92 (с, 1H), 7,78 (с, 1H), 7,52 (с, 1H), 7,35 (д, 1H, J=8,6 Гц), 7,20-7,36 (м, 3H), 7,07 (с, 1H), 2,99 (с, 3H), 2,04 (с, 3H), 1,67 (с, 6H)
Пример 115) Синтез N-(3-бром-5-(2-(3-((4-метилпиперазин-1-ил)метил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
(a) Синтез (3-(2-(3-бром-5-нитрофенил)пропан-2-ил)фенил)метанола
Метил-3-(2-(3-бром-5-нитрофенил)пропан-2-ил)бензоат (100,0 мг, 0,26 ммоль) растворяли в безводном THF (2,6 мл) и LiAlH4 (15,0 мг, 0,40 ммоль) или раствор 1,0 М DIBAL в THF (400,0 мкл, 0,40 ммоль) добавляли при 0°C. Смесь перемешивали при 0°C в течение 1 часа и затем экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 2:1), получая (3-(2-(3-бром-5-нитрофенил)пропан-2-ил)фенил)метанол (52,0 мг, 56 %) в форме твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3): δ 8,21 (с, 1H), 8,05 (с, 1H), 7,65 (с, 1H), 7,32 (т, 1H, J=7,6 Гц), 7,21-7,26 (м, 2H), 7,10 (д, 1H, J=7,8 Гц), 4,89 (д, 2H, J=5,9 Гц), 1,73 (с, 6H)
(b) Синтез 3-(2-(3-бром-5-нитрофенил)пропан-2-ил)бензил метансульфоната
(3-(2-(3-бром-5-нитрофенил)пропан-2-ил)фенил)метанол (40,0 мг, 0,11 ммоль) растворяли в безводном CH2Cl2 (1,1 мл) и метансульфонил хлорид (10,0 мкл, 0,13 ммоль) и DIPEA (40,0 мкл, 0,23 ммоль) добавляли при комнатной температуре. Смесь перемешивали при комнатной температуре в течение 3 часов и затем экстрагировали CH2Cl2, Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 4:1), получая 3-(2-(3-бром-5-нитрофенил)пропан-2-ил)бензил метансульфонат (20,0 мг, 41 %) в форме твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3): δ 8,22 (с, 1H), 8,01 (с, 1H), 7,64 (с, 1H), 7,37 (т, 1H, J=7,6 Гц), 7,31 (д, 1H, J=7,6 Гц), 7,25 (с, 1H), 7,22 (д, 1H, J=7,7 Гц), 4,89 (с, 2H), 2,92 (с, 3H), 1,73 (с, 6H)
(c) Синтез 1-(3-(2-(3-бром-5-нитрофенил)пропан-2-ил)бензил)-4-метилпиперазина
3-(2-(3-бром-5-нитрофенил)пропан-2-ил)бензил метансульфонат (20,0 мг, 0,05 ммоль) растворяли в безводном CH2Cl2 (0,5 мл) и 1-метилпиперазин (10,0 мкл, 0,09 ммоль) и DIPEA (24,0 мкл, 0,14 ммоль) добавляли при комнатной температуре. Смесь перемешивали при комнатной температуре в течение 15 часов и экстрагировали CH2Cl2, Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, CH2Cl2 : MeOH = 20:1), получая 1-(3-(2-(3-бром-5-нитрофенил)пропан-2-ил)бензил)-4-метилпиперазин (22,0 мг, колич.) в форме бесцветной жидкости.
1H-ЯМР (400 МГц, CDCl3): δ 8,20 (с, 1H), 8,04 (с, 1H), 7,64 (с, 1H), 7,26 (т, 1H, J=7,6 Гц), 7,19 (д, 1H, J=7,6 Гц), 7,07-7,11 (м, 2H), 3,48 (с, 2H), 2,43 (ушир.с, 8H), 2,28 (с, 3H), 1,72 (с, 6H)
(d) Синтез 3-бром-5-(2-(3-((4-метилпиперазин-1-ил)метил)фенил)пропан-2-ил)анилина
Процедуру синтеза Промежуточного соединения 40 повторяли за исключением использования 1-(3-(2-(3-бром-5-нитрофенил)пропан-2-ил)бензил)-4-метилпиперазина (35,0 мг, 0,08 ммоль), получая 3-бром-5-(2-(3-((4-метилпиперазин-1-ил)метил)фенил)пропан-2-ил)анилин (30,0 мг, 92 %).
LC/MS ESI (+): 402 (M+1)
(e) Синтез N-(3-бром-5-(2-(3-((4-метилпиперазин-1-ил)метил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
Процедуру синтеза Примера 1 повторяли за исключением использования 3-бром-5-(2-(3-((4-метилпиперазин-1-ил)метил)фенил)пропан-2-ил)анилина (30,0 мг, 0,07 ммоль), получая N-(3-бром-5-(2-(3-((4-метилпиперазин-1-ил)метил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (2,5 мг, 6 %).
LC/MS ESI (+): 655 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,55 (с, 1H), 9,89 (с, 1H), 8,29 (с, 1H), 8,04 (д, 1H, J=8,7 Гц), 7,96 (с, 1H), 7,79 (д, 1H, J=1,6 Гц), 7,62 (с, 1H), 7,36 (дд, 1H, J=8,7, 1,9 Гц), 7,30 (т, 1H, J=7,2 Гц), 7,10-7,19 (м, 4H), 3,51 (с, 2H), 3,02 (с, 3H), 2,70 (ушир.с, 4H), 2,26 (ушир.с, 4H), 1,65 (с, 3H), 1,23 (с, 6H)
Способом синтеза согласно Примеру 115 синтезировали соединения с Примера 116 по Примеру 125, и данные для каждого примера являются следующими.
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,50 (с, 1H), 9,34 (ушир.с, 1H), 8,24 (с, 1H), 7,98 (с, 1H), 7,94 (д, 1H, J=8,8 Гц), 7,72 (с, 1H), 7,61 (с, 1H), 7,38~7,45 (м, 1H), 7,26~7,31 (м, 2H), 7,09~7,19 (м, 3H), 3,46 (с, 2H), 3,25 (ушир.с, 4H), 2,94 (с, 3H), 2,25 (ушир.с, 4H), 1,64 (с, 6H), 1,34 (с, 9H)
1H-ЯМР (400 МГц, ДМСО-d6): δ 11,72 (с, 1H), 10,24 (с, 1H), 9,65 (ушир.с, 1H), 8,06 (с, 1H), 7,60~7,62 (м, 2H), 7,31~7,43 (м, 6H), 7,05 (с, 1H), 6,97 (д, 1H, J=8,6 Гц), 3,71 (с, 2H), 3,24 (ушир.с, 4H), 2,93 (с, 3H), 2,67 (ушир.с, 4H), 1,65 (с, 6H), 1,35 (с, 9H)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,54 (с, 1H), 8,28 (с, 1H), 7,99~8,03 (м, 2H), 7,78 (с, 1H), 7,59 (с, 1H), 7,35 (дд, 1H, J=8,8, 1,9 Гц), 7,27 (т, 1H, J=7,8 Гц), 7,16 (д, 1H, J=7,8 Гц), 7,09~7,12 (м, 3H), 3,50 (с, 2H), 3,00 (с, 3H), 2,66 (ушир.с, 4H), 2,24 (ушир.с, 4H), 1,64 (с, 6H)
1H-ЯМР (400 МГц, ДМСО-d6): δ 11,70 (с, 1H), 10,22 (с, 1H), 9,65 (ушир.с, 1H), 8,04 (с, 1H), 7,57~7,66 (м, 2H), 7,36~7,39 (м, 2H), 6,96~7,28 (м, 6H), 3,44 (с, 2H), 2,93 (с, 3H), 2,81 (ушир.с, 4H), 2,30 (ушир.с, 4H), 1,64 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,53 (с, 1H), 9,82 (ушир.с, 1H), 8,28 (с, 1H), 8,00~8,03 (м, 2H), 7,79 (д, 1H, J=1,9 Гц), 7,73 (с, 1H), 7,58 (с, 1H), 7,35 (дд, 1H, J=8,7, 2,1 Гц), 7,29 (т, 1H, J=7,1 Гц), 7,25 (с, 1H), 7,16~7,17 (м, 2H), 7,10 (с, 1H), 7,02 (д, 1H, J=7,6 Гц), 6,88 (с, 1H), 5,17 (с, 2H), 3,00 (с, 3H), 1,63 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,55 (с, 1H), 10,19 (ушир.с, 1H), 8,27(с, 1H), 7,90 (д, 1H, J=8,7 Гц), 7,86 (с, 1H), 7,76 (с, 1H), 7,55 (с, 1H), 7,33 (дд, 1H, J=8,7, 2,0 Гц), 7,07 (с, 1H), 6,98~7,90 (м, 2H), 6,72 (с, 1H), 4,48~4,54 (м, 1H), 4,21~4,27 (м, 3H), 3,70~3,78 (м, 2H), 2,97 (с, 3H), 1,90~2,30 (м, 3H), 1,62 (с, 6H), 1,20 (д, 6H, J=6,0 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,51 (с, 1H), 9,87 (ушир.с, 1H), 8,27 (с, 1H), 8,01 (д, 1H, J=8,7 Гц), 7,98 (м, 1H), 7,78 (д, 1H, J=2,0 Гц), 7,58 (м, 1H), 7,35 (дд, 1H, J=8,7, 2,1 Гц), 7,11 (м, 1H), 6,66~6,68 (м, 2H), 6,62 (м, 1H), 4,55 (м, 1H), 3,50~3,52 (м, 4H), 3,37 (с, 2H), 3,00 (с, 3H), 2,29 (ушир.с, 4H), 1,61 (с, 6H), 1,23 (д, 6H, J=6,0 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,51 (с, 1H), 9,97 (ушир.с, 1H), 8,26 (с, 1H), 7,97~7,99 (м, 2H), 7,75 (с, 1H), 7,60 (с, 1H), 7,33 (д, 1H, J=8,9 Гц), 7,11 (с, 1H), 6,66~6,68 (м, 2H), 6,63 (с, 1H), 4,56 (м, 1H), 3,41 (с, 2H), 3,26 (ушир.с, 4H), 2,97 (с, 3H), 2,25 (ушир.с, 4H), 1,61 (с, 6H), 1,34 (с, 9H), 1,24 (д, 6H, J=5,8 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,52 (с, 1H), 8,28 (с, 1H), 8,02 (д, 1H, J=8,7 Гц), 7,99 (м, 1H), 7,79 (д, 1H, J=1,9 Гц), 7,59 (м, 1H), 7,36 (дд, 1H, J=8,7, 2,1 Гц), 7,10 (м, 1H), 6,66~6,68 (м, 2H), 6,62 (м, 1H), 4,55 (м, 1H), 3,51 (с, 1H), 3,38 (с, 2H), 3,01 (с, 3H), 2,71~2,74 (м, 4H), 2,29 (ушир.с, 4H), 1,61 (с, 6H), 1,24 (д, 6H, J=5,9 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,54 (с, 1H), 9,86 (ушир.с, 1H), 8,28 (с, 1H), 8,02 (д, 1H, J=8,8 Гц), 7,86 (с, 1H), 7,79 (с, 1H), 7,55 (с, 1H), 7,36 (дд, 1H, J=8,4, 1,6 Гц), 6,99 (с, 1H), 6,70 (м, 2H), 6,61 (м, 1H), 4,54~4,57 (м, 1H), 3,48~3,52 (м, 4H), 3,02 (с, 3H), 2,38~2,40 (м, 2H), 1,62~1,66 (м, 10H), 1,24 (д, 6H, J=5,6 Гц)
Пример 126) Синтез N-(3-хлор-5-(2-(3-изопропокси-5-(морфолинометил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
(a) Синтез 1-(бромметил)-3-(2-(3-хлор-5-нитрофенил)пропан-2-ил)-5-изопропоксибензола
1-хлор-3-(2-(3-изопропокси-5-метилфенил)пропан-2-ил)-5-нитробензол (500,0 мг, 1,44 ммоль) растворяли в безводном CCl4 (15,0 мл) и NBS (256,0 мг, 1,44 ммоль) и AIBN (24,0 мг, 0,14 ммоль) добавляли при комнатной температуре. Смесь нагревали с обратным холодильником при 90°C в течение 3 часов, с последующим охлаждением до комнатной температуры и экстракцией CH2Cl2, Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 9:1), получая 1-(бромметил)-3-(2-(3-хлор-5-нитрофенил)пропан-2-ил)-5-изопропоксибензол (310,0 мг, 51 %) в форме желтой жидкости.
1H-ЯМР (400 МГц, CDCl3): δ 8,05 (т, 1H, J=1,9 Гц), 8,00 (т, 1H, J=1,9 Гц), 7,49 (т, 1H, J=1,8 Гц), 6,79 (с, 1H), 6,75 (с, 1H), 6,62 (с, 1H), 4,48-4,55 (м, 1H), 4,42 (с, 2H), 1,69 (с, 6H), 1,32 (д, 6H, J=6,0 Гц)
(b) Синтез 4-(3-(2-(3-хлор-5-нитрофенил)пропан-2-ил)-5-изопропоксибензил)морфолина
1-(бромметил)-3-(2-(3-хлор-5-нитрофенил)пропан-2-ил)-5-изопропоксибензол (86,0 мг, 0,20 ммоль) растворяли в безводном CH2Cl2 (3,1 мл) и морфолин (54,0 мкл, 0,62 ммоль) и DIPEA (162,0 мкл, 0,93 ммоль) добавляли при комнатной температуре. Смесь перемешивали при комнатной температуре в течение 2 часов и экстрагировали CH2Cl2, Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 7:3), получая 4-(3-(2-(3-хлор-5-нитрофенил)пропан-2-ил)-5-изопропоксибензил)морфолин (66,0 мг, 76 %) в форме бесцветной жидкости.
1H-ЯМР (400 МГц, CDCl3): δ 8,04 (т, 1H, J=1,9 Гц), 7,99 (т, 1H, J=1,9 Гц), 7,49 (т, 1H, J=1,8 Гц), 6,76 (с, 1H), 6,66 (с, 1H), 6,62 (с, 1H), 4,48-4,58 (м, 1H), 3,68 (т, 4H, J=4,6 Гц), 3,43 (с, 2H), 2,40 (т, 4H, J=4,3 Гц), 1,69 (с, 6H), 1,32 (д, 6H, J=6,0 Гц)
(c) Синтез 3-хлор-5-(2-(3-изопропокси-5-(морфолинометил)фенил)пропан-2-ил)анилина
Процедуру синтеза Промежуточного соединения 40 повторяли за исключением использования 4-(3-(2-(3-хлор-5-нитрофенил)пропан-2-ил)-5-изопропоксибензил)морфолина (66,0 мг, 0,15 ммоль), получая 3-хлор-5-(2-(3-изопропокси-5-(морфолинометил)фенил)пропан-2-ил)анилин (61,0 мг, колич.).
LC/MS ESI (+): 403 (M+1)
(d) Синтез N-(3-хлор-5-(2-(3-изопропокси-5-(морфолинометил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
Процедуру синтеза Примера 1 повторяли за исключением использования 3-хлор-5-(2-(3-изопропокси-5-(морфолинометил)фенил)пропан-2-ил)анилина (61,0 мг, 0,15 ммоль), получая N-(3-хлор-5-(2-(3-изопропокси-5-(морфолинометил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (35,0 мг, 36 %).
LC/MS ESI (+): 656 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,53 (с, 1H), 9,89 (ушир.с, 1H), 8,28 (с, 1H), 8,01 (д, 1H, J=8,7 Гц), 7,87 (с, 1H), 7,78 (с, 1H), 7,54 (с, 1H), 7,35 (д, 1H, J=8,7 Гц), 7,00 (с, 1H), 6,63-6,69 (м, 3H), 4,54-4,59 (м, 1H), 3,53 (ушир.с, 4H), 3,40 (с, 2H), 3,00 (с, 3H), 2,30 (ушир.с, 4H), 1,63 (с, 6H), 1,24 (д, 6H, J=6,0 Гц)
Способом синтеза согласно Примеру 126 синтезировали соединения с Примера 127 по Пример 141, и данные для каждого примера являются следующими.
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,45 (с, 1H), 9,88 (ушир.с, 1H), 8,21 (с, 1H), 7,93 (д, 1H, J=8,7 Гц), 7,79 (с, 1H), 7,70 (с, 1H), 7,47 (с, 1H), 7,27 (д, 1H, J=8,7 Гц), 6,94 (с, 1H), 6,57~6,60 (м, 3H), 4,48~4,51 (м, 1H), 3,40 (ушир.с, 4H), 3,33 (с, 2H), 2,92 (с, 3H), 2,22 (ушир.с, 4H), 1,55 (с, 6H), 1,17 (д, 6H, J=6,0 Гц), 1,04 (с, 9H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,46 (с, 1H), 9,85 (ушир.с, 1H), 8,19 (с, 1H), 7,92 (д, 1H, J=8,6 Гц), 7,79 (с, 1H), 7,69 (с, 1H), 7,48 (с, 1H), 7,27 (д, 1H, J=8,9 Гц), 6,93 (с, 1H), 6,56~6,63 (м, 3H), 4,46~4,50 (м, 1H), 3,39 (с, 2H), 3,00 (ушир.с, 4H), 2,91 (с, 3H), 2,76 (с, 3H), 2,35 (ушир.с, 4H), 1,56 (с, 6H), 1,17 (д, 6H, J=6,0 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,53 (с, 1H), 9,86 (ушир.с, 1H), 8,28 (с, 1H), 8,01 (д, 1H, J=8,7 Гц), 7,85 (с, 1H), 7,79 (с, 1H), 7,56 (с, 1H), 7,36 (д, 1H, J=8,7 Гц), 7,00 (с, 1H), 6,70 (с, 2H), 6,63 (с, 1H), 4,56 (м, 1H), 3,45 (с, 2H), 3,28 (ушир.с, 4H), 3,05 (м, 1H), 3,01 (с, 3H), 2,40 (ушир.с, 4H), 1,62 (с, 6H), 1,21~1,25 (м, 12H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,51 (с, 1H), 9,86 (с, 1H), 8,28 (с, 1H), 8,02 (д, 1H, J=8,8 Гц), 7,86 (с, 1H), 7,79 (м, 1H), 7,51 (с, 1H), 7,36 (дд, 1H, J=8,7, 1,6 Гц), 7,02 (с, 1H), 6,64~6,66 (м, 3H), 4,55 (м, 1H), 4,40 (т, 2H, J=6,4 Гц), 4,31 (т, 2H, =6,0 Гц), 3,39 (с, 2H), 3,28 (м, 1H), 3,01 (с, 3H), 2,33 (ушир.с, 4H), 2,18 (ушир.с, 4H), 1,62 (с, 6H), 1,24 (д, 6H, J=5,9 Гц)
1H-ЯМР(400 МГц, DMO-d6): δ 10,53 (с, 1H), 9,86 (ушир.с, 1H), 8,28 (с, 1H), 8,01 (д, 1H, J=8,7 Гц), 7,86 (с, 1H), 7,79 (с, 1H), 7,54 (с, 1H), 7,36 (д, 1H, J=8,9 Гц), 7,00 (с, 1H), 6,63~6,68 (м, 3H), 4,52~4,57 (м, 1H), 3,43 (с, 2H), 3,10 (ушир.с, 4H), 3,01 (с, 3H), 2,70 (с, 6H), 2,36 (ушир.с, 4H), 1,62 (с, 6H), 1,24 (д, 6H, J=5,9 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,53 (с, 1H), 9,86 (с, 1H), 8,28 (с, 1H),
8,02 (д, 1H, J=8,8 Гц), 7,84 (с, 1H), 7,79 (д, 1H, J=1,6 Гц), 7,55 (с, 1H), 7,36 (дд, 1H, J=8,8, 2,0 Гц), 7,01 (с, 1H), 6,73 (с, 2H), 6,62 (с, 1H), 4,51~4,61 (м, 1H), 3,60 (с, 2H), 3,07 (ушир.с, 4H), 3,01 (с, 3H), 2,84 (ушир.с, 4H), 1,63 (с, 6H), 1,23 (д, 6H, J=2,0 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,53 (с, 1H), 9,85 (ушир.с, 1H), 8,27 (с, 1H), 8,00 (д, 1H, J=8,7 Гц), 7,85 (с, 1H), 7,78 (с, 1H), 7,54 (с, 1H), 7,35 (д, 1H, J=8,8 Гц), 7,00 (с, 1H), 6,62~6,68 (м, 3H), 4,53~4,57 (м, 1H), 3,37 (с, 2H), 3,04 (ушир.с, 4H), 3,00 (с, 3H), 2,64 (с, 6H), 2,29 (ушир.с, 4H), 1,62 (с, 6H), 1,23 (д, 6H, J=5,9 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,53 (с, 1H), 9,86 (ушир.с, 1H), 8,28 (с, 1H), 8,02 (д, 1H, J=8,7 Гц), 7,86 (с, 1H), 7,79 (с, 1H), 7,53 (с, 1H), 7,36 (д, 1H, J=8,8 Гц), 6,98 (с, 1H), 6,65 (с, 2H), 6,61 (с, 1H), 4,54 (м, 1H), 4,20 (с, 4H), 3,45 (ушир.с, 2H), 3,01 (с, 3H), 2,18 (ушир.с, 4H), 1,69 (ушир.с, 4H), 1,61 (с, 6H), 1,23 (д, 6H, J=5,9 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,53 (с, 1H), 9,86 (ушир.с, 1H), 8,28 (с, 1H), 8,01 (д, 1H, J=8,7 Гц), 7,84(с, 1H), 7,80 (с, 1H), 7,55 (с, 1H), 7,35 (д, 1H, J=8,6 Гц), 7,01 (с, 1H), 6,64~6,70 (м, 3H), 4,53~4,59 (м, 1H), 3,46 (с, 2H), 3,32 (ушир.с, 4H), 3,00 (с, 3H), 2,90~2,97 (м, 1H), 2,42 (ушир.с, 4H), 1,63 (с, 6H), 1,24 (д, 6H, J=5,9 Гц), 1,18 (д, 6H, J=6,9 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,54 (с, 1H), 9,86 (ушир.с, 1H), 8,28 (с, 1H), 8,01 (д, 1H, J=8,7 Гц), 7,78 (д, 1H, J=1,9 Гц), 7,63 (д, 1H, J=11,1 Гц), 7,41 (с, 1H), 7,35 (дд, 1H, J=8,7, 2,1 Гц), 6,82 (д, 1H, J=10,3 Гц), 6,71 (с, 2H), 6,62 (с, 1H), 4,55 (м, 1H), 3,45 (с, 2H), 3,27~3,29 (м, 4H), 3,05 (м, 1H), 3,01 (с, 3H), 2,39~2,41 (м, 4H), 1,62 (с, 6H), 1,21~1,24 (м, 12H)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,54 (с, 1H), 9,86 (ушир.с, 1H), 8,28 (с, 1H), 8,01 (д, 1H, J=8,7 Гц), 7,78 (с, 1H), 7,63 (д, 1H, J=10,9 Гц), 7,34~7,38 (м, 2H), 6,82 (д, 1H, J=10,4 Гц), 6,61~6,82 (м, 3H), 4,51~4,57 (м, 1H), 3,51 (ушир.с, 4H), 3,38 (с, 2H), 3,01 (с, 3H), 2,30 (ушир.с, 4H), 1,62 (с, 6H), 1,23 (д, 6H, J=6,0 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,55 (с, 1H), 9,87 (ушир.с, 1H), 8,28 (с, 1H), 8,00 (д, 1H, J=8,7 Гц), 7,90 (м, 1H), 7,78 (д, 1H, J=2,0 Гц), 7,53 (м, 1H), 7,42 (с, 1H), 7,35 (дд, 1H, J=8,7, 2,1 Гц), 7,23 (с, 1H), 7,15 (с, 1H), 7,01 (м, 1H), 6,93 (с, 1H), 6,87 (с, 1H), 6,61~6,87 (м, 1H), 3,78 (с, 2H), 3,75 (с, 3H), 2,99 (с, 3H), 1,64 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,54 (с, 1H), 9,87 (с, 1H), 8,28 (с, 1H), 8,02 (с, 1H), 8,01 (д, 1H, J=8,7 Гц), 7,80 (с, 1H), 7,60 (с, 1H), 7,36 (д, 1H, J=8,8 Гц), 7,15 (с, 1H), 7,13 (с, 1H), 7,09 (с, 1H), 7,02 (с, 1H), 6,78 (т, 1H, J=52,0 Гц), 3,54 (с, 2H), 3,11~3,18 (м, 4H), 3,05 (с, 3H), 2,71 (с, 6H), 2,38~2,53 (м, 4H), 1,66 (с, 6H)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,55 (с, 1H), 9,85 (ушир.с, 1H), 8,28 (с, 1H), 8,02 (д, 1H, J=8,7 Гц), 7,79 (с, 1H), 7,65 (д, 1H, J=11,0 Гц), 7,40 (с, 1H), 7,36 (д, 1H, J=10,4 Гц), 7,14 (с, 1H), 7,07 (с, 1H), 6,97 (с, 1H), 6,83 (д, 1H, J=10,4 Гц), 6,77 (т, 1H, J=2,0 Гц), 3,53 (ушир.с, 4H), 3,48 (с, 2H), 3,01 (с, 3H), 2,31 (ушир.с, 4H), 1,66 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,50 (с, 1H), 9,87 (с, 1H), 8,26 (с, 1H), 8,02 (с, 1H), 8,01 (д, 1H, J=8,8 Гц), 7,78 (с, 1H), 7,57 (с, 1H), 7,35 (д, 1H, J=8,4 Гц), 7,16 (с, 1H), 7,09 (с, 1H), 7,05 (с, 1H), 7,01 (с, 1H), 6,77 (т, 1H, J=52,0 Гц), 4,40 (т, 2H, J=6,0 Гц), 4,32 (т, 2H, J=6,0 Гц), 3,48 (с, 2H), 3,26~3,28 (м, 1H), 3,00 (с, 3H) 2,34 (с, 4H) 2,18 (с, 4H), 1,65 (с, 6H)
Пример 142) Синтез N-(3-хлор-5-(2-(3-изопропокси-5-(1-метил-1H-пиразол-5-ил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
(a) Синтез 5-(3-(2-(3-хлор-5-нитрофенил)пропан-2-ил)-5-изопропоксифенил)-1-метил-1H-пиразола
Процедуру синтеза Промежуточного соединения 44 повторяли за исключением использования 1-бром-3-(2-(3-хлор-5-нитрофенил)пропан-2-ил)-5-изопропоксибензола (50,0 мг, 0,12 ммоль), получая 5-(3-(2-(3-хлор-5-нитрофенил)пропан-2-ил)-5-изопропоксифенил)-1-метил-1H-пиразол (32,0 мг, 64 %).
LC/MS ESI (+): 414 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 8,07 (с, 1H), 8,03 (с, 1H), 7,54 (с, 1H), 7,54 (с, 1H), 7,50 (с, 1H), 6,78 (с, 1H), 6,74 (с, 1H), 6,27 (с, 1H), 4,53-4,56 (м, 1H), 3,83 (с, 3H), 1,73 (с, 6H), 1,34 (д, 6H, J=6,0 Гц)
(b) Синтез 3-хлор-5-(2-(3-изопропокси-5-(1-метил-1H-пиразол-5-ил)фенил)пропан-2-ил)анилина
Процедуру синтеза Промежуточного соединения 40 повторяли за исключением использования 5-(3-(2-(3-хлор-5-нитрофенил)пропан-2-ил)-5-изопропоксифенил)-1-метил-1H-пиразола (32,0 мг, 0,08 ммоль), получая 3-хлор-5-(2-(3-изопропокси-5-(1-метил-1H-пиразол-5-ил)фенил)пропан-2-ил)анилин (22,0 мг, 76 %).
LC/MS ESI (+): 384 (M+1)
(c) Синтез N-(3-хлор-5-(2-(3-изопропокси-5-(1-метил-1H-пиразол-5-ил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
Процедуру синтеза Примера 1 повторяли за исключением использования 3-хлор-5-(2-(3-изопропокси-5-(1-метил-1H-пиразол-5-ил)фенил)пропан-2-ил)анилина (16,0 мг, 0,06 ммоль), получая N-(3-хлор-5-(2-(3-изопропокси-5-(1-метил-1H-пиразол-5-ил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (15,0 мг, 42 %).
LC/MS ESI (+): 637 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,56 (с, 1H), 9,88 (ушир.с, 1H), 8,28 (с, 1H), 8,02 (д, 1H, J=8,7 Гц), 7,89 (с, 1H), 7,79 (с, 1H), 7,58 (с, 1H), 7,44 (с, 1H), 7,35 (д, 1H, J=8,7 Гц), 7,10 (с, 1H), 6,88 (с, 2H), 6,75 (с, 1H), 6,39 (с, 1H), 4,63-4,69 (м, 1H), 3,80 (с, 3H), 3,01 (с, 3H), 1,68 (с, 6H), 1,25 (д, 6H, J=6,0 Гц)
Способом синтеза согласно Примеру 142 синтезировали соединения с Примера 143 по Пример 147, и данные для каждого примера являются следующими.
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,56 (с, 1H), 9,88 (ушир.с, 1H), 8,28 (с, 1H), 8,13 (с, 1H), 8,01 (д, 1H, J=8,7 Гц), 7,89 (с, 1H), 7,84 (с, 1H), 7,78 (с, 1H), 7,54 (с, 1H), 7,35 (д, 1H, J=8,7 Гц), 7,05 (с, 1H), 7,11 (с, 1H), 6,95 (с, 1H), 6,47 (с, 1H), 4,60~4,66 (м, 1H), 3,83 (с, 3H), 3,01 (с, 3H), 1,66 (с, 6H), 1,23 (д, 6H, J=6,0 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,58 (с, 1H), 8,28 (с, 1H), 7,98 (д, 1H, J=8,8 Гц), 7,86 (с, 1H), 7,76 (с, 1H), 7,54 (с, 1H), 7,34 (дд, 1H, J=8,8, 1,6 Гц), 7,00 (с, 1H), 6,43 (с, 1H), 6,34 (с, 1H), 6,16 (с, 1H), 4,48~4,60 (м, 1H), 3,40~3,46 (м, 5H), 3,13 (с, 3H), 2,99~3,05 (м, 2H), 3,00 (с, 3H), 1,61 (с, 6H), 1,20 (д, 6H, J=6,0 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,53 (с, 1H), 9,86 (ушир.с, 1H), 8,23 (с, 1H), 7,98 (д, 1H, J=8,9 Гц), 7,82 (с, 1H), 7,72 (с, 1H), 7,40 (с, 1H), 7,29 (д, 1H, J=8,7 Гц), 6,94 (с, 1H), 6,33 (с, 1H), 6,22 (с, 1H), 6,07 (с, 1H), 4,46~4,48 (м, 1H), 3,62(ушир.с, 4H), 2,98 (с, 3H), 2,94 (ушир.с, 4H), 1,54 (с, 6H), 1,17 (д, 6H, J=6,0 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,57 (с, 1H), 9,90 (с, 1H), 8,31 (с, 1H),
8,04 (д, 1H, J=8,8 Гц), 7,89 (с, 1H), 7,80 (с, 1H), 7,54 (с, 1H), 7,37 (дд, 1H, J=8,8, 2,0 Гц), 7,02 (с, 1H), 5,98 (с, 1H), 5,95 (с, 1H), 5,89 (с, 1H), 4,48~4,54 (м, 1H), 3,15~3,18 (м, 4H), 3,03 (с, 3H), 1,90~1,93 (м, 4H), 1,61 (с, 6H), 1,21 (д, 6H, J=6,0 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,45 (с, 1H), 9,81 (ушир.с, 1H), 8,22 (с, 1H), 7,95 (д, 1H, J=8,8 Гц), 7,81 (с, 1H), 7,73 (с, 1H), 7,45 (с, 1H), 7,29 (дд, 1H, J=8,8, 2,2 Гц), 6,94 (с, 1H), 6,32 (с, 1H), 6,20 (с, 1H), 6,04 (с, 1H), 4,44~4,46 (м, 1H), 2,99~3,00 (м, 4H), 2,94 (с, 3H), 2,30~2,35 (м, 4H), 2,13 (с, 3H), 1,53 (с, 6H), 1,13 (д, 6H, J=6,0 Гц)
Пример 148) Синтез N-(6-хлор-4-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин-2-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
(a) Синтез 2,6-дихлор-N-метокси-N-метилизоникотинамида
2,6-дихлоризоникотиновую кислоту (192,0 мг, 1,00 ммоль) растворяли в безводном CH2Cl2 (10,0 мл) и добавляли (COCl)2 (130,0 мкл, 1,50 ммоль) и каталитическое количество безводного DMF. Смесь перемешивали при 0°C в течение 1 часа и высушивали в течение 1 часа при пониженном давлении. Остаток растворяли в безводном CH2Cl2 (10,0 мл) и N,O-диметилгидроксиламин (292,0 мг, 3,00 ммоль) и пиридин (480,0 мкл, 6,00 ммоль) добавляли при 0°C. Реакционную смесь экстрагировали CH2Cl2, Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (амин силикагель, н-гексан : EtOAc = 1:4), получая 2,6-дихлор-N-метокси-N-метилизоникотинамид (220,0 мг, 94 %) в форме твердого вещества белого цвета.
LC/MS ESI (+): 235 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,50 (с, 2H), 3,58 (с, 3H), 3,38 (с, 3H)
(b) Синтез (2,6-дихлорпиридин-4-ил)(3-метокси-5-(трифторметокси)фенил)метанона
1-бром-3-метокси-5-(трифторметокси)бензол (5,0 г, 18,72 ммоль) растворяли в THF (70,0 мл), и трет-BuLi (11,9 мл, 20,16 ммоль) медленно добавляли при -78°C с последующим перемешиванием в течение 2 часов. 2,6-дихлор-N-метокси-N-метилизоникотинамид (3,4 г, 14,40 ммоль) растворяли в THF (7,6 мл) и добавляли к реакционной смеси с последующим перемешиванием при 0°C в течение 2 часов. Реакционную смесь экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : CH2Cl2 = 1:10), получая (2,6-дихлорпиридин-4-ил)(3-метокси-5-(трифторметокси)фенил)метанон (2,8 г, 55 %) в форме твердого вещества желтого цвета.
LC/MS ESI (+): 366 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,53 (с, 2H) 7,24 (с, 1H), 7,19 (с, 1H), 7,06 (с, 1H), 3,89 (с, 3H)
(c) Синтез 2,6-дихлор-4-(дихлор(3-метокси-5-(трифторметокси)фенил)метил)пиридина
Процедуру синтеза Промежуточного соединения 37 повторяли за исключением использования (2,6-дихлорпиридин-4-ил) (3-метокси-5-(трифторметокси)фенил)метанона (2,8 г, 7,64 ммоль), получая 2,6-дихлор-4-(дихлор(3-метокси-5-(трифторметокси)фенил)метил)пиридин (1,9 г, 60 %).
LC/MS ESI (+): 420 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,45 (с, 2H) 7,05 (с, 1H), 7,03 (с, 1H), 6,82 (с, 1H), 3,85 (с, 3H)
(d) Синтез 2,6-дихлор-4-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридина
В CH2Cl2 (30,0 мл) раствор 1,0 М TiCl4 в CH2Cl2 (9,0 мл, 9,00 ммоль) и раствор 1,2 М диметилцинка в толуоле (22,6 мл, 27,06 ммоль) добавляли при -40°C с последующим перемешиванием в течение 30 минут. Раствор 2,6-дихлор-4-(дихлор(3-метокси-5-(трифторметокси)фенил)метил)пиридина (1,9 г, 5,0 ммоль) в CH2Cl2 (15,0 мл) медленно добавляли при -40°C, и реакционную смесь нагревали до комнатной температуры с последующим перемешиванием в течение 12 часов. Добавляли воду, чтобы остановить реакцию, и затем экстрагировали CH2Cl2, Органический экстракт высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (амин силикагель, н-гексан : EtOAc = 1:1), получая 2,6-дихлор-4-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин (540,0 мг, 31 %) в форме грязно-белого масла.
LC/MS ESI (+): 380 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,07 (с, 2H) 6,66 (с, 1H), 6,62 (с, 2H), 3,79 (с, 3H), 1,64 (с, 6H)
(e-I) Синтез 6-хлор-4-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин-2-амина (способ I)
В 2,6-дихлор-4-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин (70,0 мг, 0,18 ммоль) добавляли 35%-ый раствор NH4OH в H2O (3,0 мл) и 1,4-диоксан (1,0 мл). Смесь перемешивали при 160°C в течение 12 часов и затем охлаждали до комнатной температуры и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (амин силикагель, н-гексан : EtOAc = 1:9), получая 6-хлор-4-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин-2-амин (40,0 мг, 60 %) в форме грязно-белого масла.
LC/MS ESI (+): 361 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 6,66 (с, 2H), 6,63 (с, 1H), 6,50 (с, 1H), 6,18 (с, 1H), 4,48 (ушир.с, 2H), 3,78 (с, 3H), 1,58 (с, 6H)
(e-II) Синтез 6-хлор-4-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин-2-амина (способ II)
2,6-дихлор-4-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин (50,0 мг, 0,13 ммоль), NaN3 (17,0 мг, 0,26 ммоль), Cu2O (18,7 мг, 0,13 ммоль) и L-пролин (19,5 мг, 0,17 ммоль) растворяли в ДМСО (1,0 мл) с последующим перемешиванием при 100°C в течение 12 часов. Реакционную смесь охлаждали до комнатной температуры и экстрагировали EtOAc, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (амин силикагель, н-гексан : EtOAc = 9:1), получая 6-хлор-4-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин-2-амин (18,0 мг, 38 %) в форме грязно-белого масла.
(f) Синтез N-(6-хлор-4-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин-2-ил)-5-нитробензо[b]тиофен-2-карбоксамида
5-нитробензо[b]тиофен-2-карбоновую кислоту (13,3 мг, 0,06 ммоль) растворяли в безводном CH2Cl2 (1,0 мл) и добавляли (COCl)2 (5,3 мкл, 0,06 ммоль) и каталитическое количество безводного DMF. Смесь перемешивали при 0°C в течение 1 часа и высушивали в течение 1 часа при пониженном давлении. Остаток растворяли в безводном пиридине (1,0 мл) и 6-хлор-4-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин-2-амин (10,0 мг, 0,03 ммоль) добавляли при 0°C. Реакционную смесь экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (амин силикагель, н-гексан : EtOAc = 1:4), получая N-(6-хлор-4-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин-2-ил)-5-нитробензо[b]тиофен-2-карбоксамид (11,0 мг, 72 %) в форме твердого вещества желтого цвета.
LC/MS ESI (+): 566 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 8,81 (д, 1H, J=2,0 Гц), 8,55 (с, 1H), 8,33 (дд, 1H, J=8,8, 2,0 Гц), 8,27 (д, 1H, J=1,2 Гц), 8,04 (д, 1H, J=8,8 Гц), 8,03 (с, 1H), 6,90 (д, 1H, J=1,2 Гц), 6,69 (т, 1H, J=2,0 Гц), 6,67 (с, 1H), 6,05 (с, 1H), 3,79 (с, 3H), 1,70 (с, 6H)
(g) Синтез 5-амино-N-(6-хлор-4-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин-2-ил)бензо[b]тиофен-2-карбоксамида
Процедуру синтеза Промежуточного соединения 40 повторяли за исключением использования N-(6-хлор-4-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин-2-ил)-5-нитробензо[b]тиофен-2-карбоксамида (10,0 мг, 0,02 ммоль), получая 5-амино-N-(6-хлор-4-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин-2-ил)бензо[b]тиофен-2-карбоксамид (9,0 мг, 91 %).
LC/MS ESI (+): 536 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 8,46 (с, 1H), 8,31 (д, 1H, J=1,2 Гц), 7,72 (с, 1H), 7,65 (д, 1H, J=8,8 Гц), 7,13 (д, 1H, J=2,0 Гц), 6,91 (дд, 1H, J=8,8, 2,0 Гц), 6,83 (д, 1H, J=1,6 Гц), 6,66-6,68 (м, 2H), 6,63-6,64 (м, 1H), 3,80-3,82 (м, 2H), 3,78 (с, 3H), 1,69 (с, 6H)
(h) Синтез N-(6-хлор-4-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин-2-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
Процедуру синтеза Промежуточного соединения 6-a повторяли за исключением использования 5-амино-N-(6-хлор-4-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин-2-ил)бензо[b]тиофен-2-карбоксамида (9,0 мг, 0,02 ммоль), получая N-(6-хлор-4-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин-2-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (1,7 мг, 17 %).
LC/MS ESI (+): 614 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 11,42 (с, 1H), 9,88 (с, 1H), 8,50 (с, 1H), 8,10 (с, 1H), 7,98 (д, 1H, J=8,4 Гц), 7,70 (с, 1H), 7,32 (д, 1H, J=8,4 Гц), 7,12 (с, 1H), 6,85 (с, 2H), 6,78 (с, 1H), 3,78 (с, 3H), 2,97 (с, 3H), 1,66 (с, 6H)
Пример 149) Синтез N-(2-хлор-6-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин-4-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
Процедуру синтеза Примера 148 повторяли за исключением использования 4,6-дихлорпиколиновой кислоты (3,0 г, 15,63 ммоль), получая N-(2-хлор-6-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин-4-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (49,6 мг).
LC/MS ESI (+): 614 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,86 (с, 1H), 9,96 (с, 1H), 8,31 (с, 1H), 8,02 (д, 1H, J=8,8 Гц), 7,88 (с, 1H), 7,80 (с, 1H), 7,54 (с, 1H), 7,36 (д, 1H, J=8,8 Гц), 6,82 (с, 2H), 6,75 (с, 1H), 3,77 (с, 3H), 3,00 (с, 3H), 1,66 (с, 6H)
Пример 150) Синтез N-(4-хлор-6-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин-2-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
Процедура синтеза Примера 148 повторяли за исключением использования 4,6-дихлорпиколиновой кислоты (3,0 г, 15,63 ммоль), получая N-(4-хлор-6-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин-2-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (5,7 мг).
LC/MS ESI (+): 614 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 11,05 (с, 1H), 9,91 (с, 1H), 8,57 (с, 1H), 8,09 (д, 1H, J=1,6 Гц), 8,03 (д, 1H, J=8,8 Гц), 7,78 (с, 1H), 7,37 (дд, 1H, J=8,8, 1,6 Гц), 7,19 (д, 1H, J=1,6 Гц), 6,86 (т, 1H, J=2,0 Гц), 6,80 (с, 2H), 3,77 (с, 3H), 3,02 (с, 3H), 1,75 (с, 6H)
Пример 151) Синтез N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-2-(метилсульфонамидо)тиено[2,3-b]пиразин-6-карбоксамида
(a) Синтез метил-5-хлор-4-нитротиофен-2-карбоксилата
5-хлор-4-нитротиофен-2-карбоновую кислоту (1,0 г, 4,82 ммоль) растворяли в MeOH (50,0 мл) и медленно добавляли SOCl2 (699,0 мкл, 9,63 ммоль). После нагревания с обратным холодильником в течение 20 часов, реакционную смесь концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 4:1), получая метил-5-хлор-4-нитротиофен-2-карбоксилат (797,5 мг, 75 %) в форме твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3): δ 8,18 (с, 1H), 3,94 (с, 3H)
(b) Синтез метил-5-((2-этокси-2-оксоэтил)амино)-4-нитротиофен-2-карбоксилат
Метил-5-хлор-4-нитротиофен-2-карбоксилат (697,5 мг, 3,15 ммоль) растворяли в безводном CH3CN (31,0 мл) и H-Gly-OEt·HCl (483,2 мг, 3,46 ммоль) и K2CO3 (1,1 г, 7,87 ммоль) добавляли при комнатной температуре. Смесь нагревали с обратным холодильником при 70°C в течение 3 часов и затем охлаждали до комнатной температуры. Реакционную смесь лили в воду со льдом. Полученное твердое вещество отфильтровывали, получая метил-5-((2-этокси-2-оксоэтил)амино)-4-нитротиофен-2-карбоксилат (713,2 мг, 79 %) в форме твердого вещества желтого цвета.
LC/MS ESI (+): 289 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 8,74 (с, 1H), 8,04 (с, 1H), 4,33 (кв., 2H, J=7,1 Гц), 4,10 (д, 2H, J=5,4 Гц), 3,87 (с, 3H), 1,34 (т, 3H, J=7,1 Гц)
(c) Синтез метил-2-оксо-1,2,3,4-тетрагидротиено[2,3-b]пиразин-6-карбоксилата
Метил-5-((2-этокси-2-оксоэтил)амино)-4-нитротиофен-2-карбоксилат (713,2 мг, 2,47 ммоль) растворяли в смеси AcOH/H2O (14,3 мл, 20/3 об./об.) и Fe (414,4 мг, 7,42 ммоль) добавляли при комнатной температуре. Смесь нагревали с обратным холодильником при 70°C в течение 24 часов и затем охлаждали до комнатной температуры. Реакционную смесь лили в воду со льдом, и полученное твердое вещество отфильтровывали, получая метил-2-оксо-1,2,3,4-тетрагидротиено[2,3-b]пиразин-6-карбоксилат (415,0 мг, 79 %) в форме твердого вещества зеленого цвета.
LC/MS ESI (+): 213 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,26 (с, 1H), 7,20 (с, 1H), 7,06 (с, 1H), 3,87-3,89 (м, 2H), 3,69 (с, 3H)
(d) Синтез метил-2-оксо-1,2-дигидротиено[2,3-b]пиразин-6-карбоксилата
Метил-2-оксо-1,2,3,4-тетрагидротиено[2,3-b]пиразин-6-карбоксилат (415,0 мг, 1,96 ммоль) растворяли в безводном THF (20,0 мл) и MnO2 (849,8 мг, 9,78 ммоль) добавляли при комнатной температуре с последующим перемешиванием в течение 10 дней. Реакционную смесь фильтровали через Целит и концентрировали при пониженном давлении, получая метил-2-оксо-1,2-дигидротиено[2,3-b]пиразин-6-карбоксилат (220,5 мг, 54 %) в форме твердого вещества коричневого цвета.
LC/MS ESI (+): 211 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 12,76 (ушир.с, 1H), 8,13 (ушир.с, 1H), 7,62 (ушир.с, 1H), 3,89 (с, 3H)
(e) Синтез метил-2-хлортиено[2,3-b]пиразин-6-карбоксилата
Смесь метил-2-оксо-1,2-дигидротиено[2,3-b]пиразин-6-карбоксилата (220,5 мг, 1,05 ммоль) и PОCl3 (5,9 мл, 62,94 ммоль) нагревали с обратным холодильником при 110°C в течение 15 часов, и реакционную смесь концентрировали при пониженном давлении. Остаток растворяли в EtOAc, промывали насыщ. водным раствором NaHCO3 и солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении, получая метил-2-хлортиено[2,3-b]пиразин-6-карбоксилат (205,2 мг, 86 %) в форме твердого вещества коричневого цвета.
LC/MS ESI (+): 229 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 8,61 (с, 1H), 8,10 (с, 1H), 4,01 (с, 3H)
(f) Синтез 2-хлортиено[2,3-b]пиразин-6-карбоновой кислоты
Метил-2-хлортиено[2,3-b]пиразин-6-карбоксилат (298,0 мг, 1,30 ммоль) растворяли в смеси THF/EtOH (10,0 мл, 1/1 об./об.), и 2,0 н. водный раствор NaOH (3,26 мл, 6,52 ммоль) добавляли при комнатной температуре с последующим перемешиванием при комнатной температуре в течение 7 часов. Реакционную смесь концентрировали при пониженном давлении, и полученный остаток растворяли в воде. 1 н. водный раствор HCl добавляли для подкисления до рН 1-2, Полученный твердый осадок отфильтровывали и высушивали при пониженном давлении, получая 2-хлортиено[2,3-b]пиразин-6-карбоновую кислоту (179,8 мг, 64 %) в форме твердого вещества коричневого цвета.
LC/MS ESI (+): 215 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 8,89 (с, 1H), 8,14 (с, 1H)
(g) Синтез 2-хлор-N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)тиено[2,3-b]пиразин-6-карбоксамида
Процедуру синтеза Примера 1 повторяли за исключением использования 2-хлортиено[2,3-b]пиразин-6-карбоновой кислоты (179,8 мг, 0,84 ммоль), получая 2-хлор-N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)тиено[2,3-b]пиразин-6-карбоксамид (295,4 мг, 60 %) в форме твердого вещества желтого цвета.
LC/MS ESI (+): 584 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 8,60 (с, 1H), 7,88 (с, 1H), 7,83 (с, 1H), 7,75 (м, 1H), 7,22 (м, 1H), 7,07 (м, 1H), 6,64-6,66 (м, 2H), 6,59 (м, 1H), 4,48 (м, 1H), 1,66 (с, 6H), 1,32 (д, 6H, J=6,0 Гц)
(h) Синтез N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-2-((4-метоксибензил)амино)тиено[2,3-b]пиразин-6-карбоксамида
К раствору 2-хлор-N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)тиено[2,3-b]пиразин-6-карбоксамида (295,4 мг, 0,51 ммоль) в безводном 1,4-диоксане (10,0 мл) добавляли (4-метоксифенил)метанамин (99,0 мкл, 0,76 ммоль), Pd(OAc)2 (11,3 мг, 0,05 ммоль), Xantphos (40,9 мг, 0,07 ммоль) и Cs2CO3 (493,6 мг, 1,52 ммоль). Смесь вводили в реакцию в микроволновом реакторе мощностью 100 Вт при 120°C в течение 30 минут и охлаждали до комнатной температуры. Добавляли воду, с последующей экстракцией EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 1:1), получая N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-2-((4-метоксибензил)амино)тиено[2,3-b]пиразин-6-карбоксамид (112,5 мг, 33 %) в форме твердого вещества желтого цвета.
LC/MS ESI (+): 685 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,95 (с, 1H), 7,72-7,74 (м, 3H), 7,32 (д, 2H, J=8,3 Гц), 7,21 (с, 1H), 7,02 (с, 1H), 6,90 (д, 2H, J=8,1 Гц), 6,65 (с, 2H), 6,59 (с, 1H), 4,99 (м, 1H), 4,58 (д, 2H, J=5,4 Гц), 4,48 (м, 1H), 3,81 (с, 3H), 1,65 (с, 6H), 1,32 (д, 6H, J=6,0 Гц)
(i) Синтез 2-амино-N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)тиено[2,3-b]пиразин-6-карбоксамида
N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-2-((4-метоксибензил)амино),тиено[2,3-b]пиразин-6-карбоксамид (112,5 мг, 0,16 ммоль) растворяли в безводном CH2Cl2 (3,2 мл) и TFA (1,6 мл) добавляли при комнатной температуре. Смесь перемешивали при 40°C в течение 19 часов и затем концентрировали при пониженном давлении. Остаток подщелачивали насыщ. водным раствором NaHCO3 (9) и экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 1:2), получая 2-амино-N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)тиено[2,3-b]пиразин-6-карбоксамид (80,0 мг, 86 %) в форме твердого вещества желтого цвета.
LC/MS ESI (+): 565 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 8,06 (с, 1H), 7,72-7,73 (м, 2H), 7,67 (с, 1H), 7,23 (с, 1H), 7,03 (с, 1H), 7,65 (с, 2H), 6,59 (с, 1H), 4,75 (с, 2H), 4,47 (м, 1H), 1,66 (с, 6H), 1,32 (д, 6H, J=6,0 Гц)
(j) Синтез 2-[бис(метилсульфонил)амино]-N-[3-хлор-5-[1-[3-изопропокси-5-(трифторметокси)фенил]-1-метил-этил] фенил]тиено[2,3-b]пиразин-6-карбоксамида
2-амино-N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)тиено[2,3-b]пиразин-6-карбоксамид (20,0 мг, 0,04 ммоль) растворяли в безводном CH2Cl2 (0,7 мл), и DIPEA (12,3 мкл, 0,07 ммоль) и метансульфонил хлорид (4,1 мкл, 0,05 ммоль) добавляли при комнатной температуре. Смесь перемешивали при комнатной температуре в течение 16 часов и добавляли воду, с последующей экстракцией CH2Cl2, Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 1:1), получая 2-[бис(метилсульфонил)амино]-N-[3-хлор-5-[1-[3-изопропокси-5-(трифторметокси)фенил]-1-метил-этил] фенил]тиено[2,3-b]пиразин-6-карбоксамид (9,2 мг, 36 %) в форме твердого вещества желтого цвета.
LC/MS ESI (+): 721 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 8,61 (с, 1H), 7,94 (с, 1H), 7,92 (с, 1H), 7,73 (с, 1H), 7,21 (с, 1H), 7,06 (с, 1H), 6,64-6,65 (м, 2H), 6,59 (с, 1H), 4,48 (м, 1H), 3,64 (с, 6H), 1,65 (с, 6H), 1,32 (д, 6H, J=6,0 Гц)
(k) Синтез N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-2-(метилсульфонамидо)тиено[2,3-b]пиразин-6-карбоксамида
N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-2-(N-(метилсульфонил)метилсульфонамидо)тиено[2,3-b]пиразин-6-карбоксамид (9,2 мг, 0,01 ммоль) растворяли в THF (0,2 мл), и 1,0 н. KOH водный раствор (38,2 мкл, 0,04 ммоль) добавляли при комнатной температуре. Смесь перемешивали при комнатной температуре в течение 3 часов и добавляли воду с последующей экстракцией CH2Cl2, Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 1:2), получая N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-2-(метилсульфонамидо)тиено[2,3-b]пиразин-6-карбоксамид (4,0 мг, 50 %) в форме твердого вещества белого цвета.
LC/MS ESI (+): 643 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 11,40 (с, 1H), 10,64 (с, 1H), 8,41 (с, 1H), 8,32 (с, 1H), 7,91 (с, 1H), 7,55 (с, 1H), 7,08 (с, 1H), 6,77 (с, 1H), 6,73 (с, 1H), 6,71 (с, 1H), 4,63 (м, 1H), 3,39 (с, 3H), 1,64 (с, 6H), 1,23 (д, 6H, J=5,5 Гц)
Пример 152) Синтез N-(3-(2-(4-бромфенил)пропан-2-ил)-5-хлорфенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
(a) Синтез 1-(2-(4-бромфенил)пропан-2-ил)-3-хлор-5-нитробензола
1-(2-бромпропан-2-ил)-3-хлор-5-нитробензол (166-b Пример) (200,0 мг, 0,72 ммоль) и монобромбензол (1,1 мл, 10,77 ммоль) растворяли в 1,2-дихлорэтане (7,0 мл), и AlCl3 (287,2 мг, 2,15 ммоль) добавляли при комнатной температуре. Смесь перемешивали при комнатной температуре в течение 12 часов и добавляли воду с последующей экстракцией CH2Cl2, Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 9:1), получая 1-(2-(4-бромфенил)пропан-2-ил)-3-хлор-5-нитробензол (255,4 мг, 100 %) в форме твердого вещества желтого цвета.
1H-ЯМР (400 МГц, CDCl3): δ 8,06 (с, 1H), 8,00 (с, 1H), 7,46 (с, 1H), 7,44 (д, 2H, J=8,6 Гц), 7,07 (д, 2H, J=8,6 Гц), 1,70 (с, 6H)
(b) Синтез 3-(2-(4-бромфенил)пропан-2-ил)-5-хлоранилина
Процедуру синтеза Промежуточного соединения 40 повторяли за исключением использования 1-(2-(4-бромфенил)пропан-2-ил)-3-хлор-5-нитробензола (84,2 мг, 0,24 ммоль), получая 3-(2-(4-бромфенил)пропан-2-ил)-5-хлоранилин (67,1 мг, 87 %).
LC/MS ESI (+): 324 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,38 (д, 1H, J=8,6 Гц), 7,09 (д, 1H, J=8,6 Гц), 6,60 (м, 1H), 6,51 (м, 1H), 6,32 (м, 1H), 3,65 (с, 2H), 1,59 (с, 6H)
(c) Синтез N-(3-(2-(4-бромфенил)пропан-2-ил)-5-хлорфенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
Процедуру синтеза Примера 1 повторяли за исключением использования 3-(2-(4-бромфенил)пропан-2-ил)-5-хлоранилина (67,1 мг, 0,21 ммоль), получая N-(3-(2-(4-бромфенил)пропан-2-ил)-5-хлорфенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (40,4 мг, 34 %).
LC/MS ESI (+): 577 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,53 (с, 1H), 9,87 (с, 1H), 8,27 (с, 1H), 8,02 (д, 1H, J=8,7 Гц), 7,89 (с, 1H), 7,79 (с, 1H), 7,49-7,51 (м, 3H), 7,36 (д, 1H, J=8,7 Гц), 7,21 (д, 2H, J=8,0 Гц), 7,03 (с, 1H), 3,01 (с, 3H), 1,64 (с, 6H)
Способом синтеза согласно Примеру 152 синтезировали соединения с Примера 153 по Пример 163, и данные для каждого примера являются следующими.
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,55 (с, 1H), 9,89 (с, 1H), 8,28 (с, 1H), 8,02 (д, 1H, J=9,0 Гц), 7,87 (с, 1H), 7,78 (с, 1H), 7,51 (с, 1H), 7,36 (д, 1H, J=9,0 Гц), 7,00 (с, 1H), 6,76~6,87 (м, 3H), 3,72 (с, 3H), 3,69 (с, 3H), 3,01 (с, 3H), 1,63 (с, 6H)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,50 (с, 1H), 9,88 (с, 1H), 8,29 (с, 1H), 8,02 (д, 1H, J=8,7 Гц), 7,81 (с, 1H), 7,78 (с, 1H), 7,39 (с, 1H), 7,33~7,36 (м, 2H), 6,85 (т, 1H, J=1,7 Гц), 6,55 (дд, 1H, J=8,6, 2,5 Гц), 6,49 (д, 1H, J=2,5 Гц), 3,75 (с, 3H), 3,40 (с, 3H), 3,01 (с, 3H), 1,58 (с, 6H)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,55 (с, 1H), 9,87 (с, 1H), 8,29 (с, 1H), 8,02 (д, 1H, J=8,7 Гц), 7,86 (с, 1H), 7,78 (с, 1H), 7,51 (с, 1H), 7,35 (д, 1H, J=8,7 Гц), 7,16 (д, 2H, J=8,8 Гц), 6,99 (с, 1H), 6,87 (д, 2H, J=8,8 Гц), 3,72 (с, 3H), 3,01 (с, 3H), 1,62 (с, 6H)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,51 (с, 1H), 9,89 (с, 1H), 8,30 (с, 1H), 8,03 (д, 1H, J=8,7 Гц), 7,85 (с, 1H), 7,80 (с, 1H), 7,39 (с, 1H), 7,36 (д, 1H, J=8,7 Гц), 7,00 (с, 1H), 6,84~6,90 (м, 3H), 3,77 (с, 3H), 3,31 (с, 3H), 3,02 (с, 3H), 1,61 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,54 (с, 1H), 9,87 (с, 1H), 8,28 (с, 1H), 8,02 (д, 1H, J=8,7 Гц), 7,88 (с, 1H), 7,79 (с, 1H), 7,51 (с, 1H), 7,36 (д, 1H, J=8,6 Гц), 7,17~7,22 (м, 4H), 7,00 (с, 1H), 3,01 (с, 3H), 2,45 (с, 3H), 1,63 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,53 (с, 1H), 9,87 (с, 1H), 8,27 (с, 1H), 8,02 (д, 1H, J=8,7 Гц), 7,88 (с, 1H), 7,79 (с, 1H), 7,49 (с, 1H), 7,34~7,38 (м, 3H), 7,27 (д, 2H, J=8,0 Гц), 7,03 (с, 1H), 3,01 (с, 3H), 1,64 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,57 (с, 1H), 9,88 (ушир.с, 1H), 8,29 (с, 1H), 8,02 (д, 1H, J=8,8 Гц), 7,90 (с, 1H), 7,79 (д, 1H, J=1,6 Гц), 7,58 (с, 1H), 7,49 (д, 2H, J=8,3 Гц), 7,48 (с, 1H), 7,34~7,38 (м, 3H), 7,08 (с, 1H), 6,39 (д, 1H, J=1,7 Гц), 3,85 (с, 3H), 3,01 (с, 3H), 1,70 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,55 (с, 1H), 9,87 (с, 1H), 8,28 (с, 1H), 8,01 (д, 1H, J=8,7 Гц), 7,90 (с, 1H), 7,78 (с, 1H), 7,64 (д, 2H, J=8,0 Гц), 7,55 (с, 1H), 7,47 (д, 2H, J=8,0 Гц), 7,36 (д, 1H, J=8,7 Гц), 7,06 (с, 1H), 3,02 (с, 3H), 2,75 (с, 3H), 1,70 (с, 6H)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,56 (с, 1H), 9,87 (ушир.с, 1H), 8,27 (с, 1H), 8,01 (д, 1H, J=8,7 Гц), 7,91 (с, 1H), 7,87 (д, 2H, J=7,9 Гц), 7,78 (с, 1H), 7,51~7,54 (м, 3H), 7,35 (д, 1H, J=8,8 Гц), 7,06 (с, 1H), 3,20 (с, 3H), 3,00 (с, 3H), 1,69 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,54 (с, 1H), 9,88 (с, 1H), 8,28 (с, 1H), 8,02 (д, 1H, J=8,7 Гц), 7,89 (с, 1H), 7,80 (с, 1H), 7,48 (с, 1H), 7,34~7,37 (м, 3H), 7,05~7,06 (м, 2H), 3,01 (с, 3H), 1,65 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,66 (с, 1H), 8,30 (с, 1H), 8,18 (д, 1H, J=7,4 Гц), 8,14 (д, 1H, J=10,5 Гц), 7,87 (с, 1H), 7,49 (с, 1H), 7,37 (д, 2H, J=8,7 Гц), 7,27 (д, 2H, J=8,7 Гц), 7,04 (с, 1H), 3,28 (с, 3H), 3,12 (с, 3H), 1,64 (с, 6H)
Пример 164) Синтез N-(3-хлор-5-(2-(пиперидин-1-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
(a) Синтез 1-(2-(3-хлор-5-нитрофенил)пропан-2-ил)пиперидина
1-(2-бромпропан-2-ил)-3-хлор-5-нитробензол (Пример 166-b) (30,0 мг, 0,11 ммоль) растворяли в пиперидине (183,0 мг, 2,14 ммоль) с последующим перемешиванием при комнатной температуре в течение 2 дней. Реакционную смесь экстрагировали CH2Cl2, и органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 9:1), получая 1-(2-(3-хлор-5-нитрофенил)пропан-2-ил)пиперидин (35,0 мг, колич.) в форме бесцветной жидкости.
1H-ЯМР (400 МГц, CDCl3): δ 8,31 (с, 1H), 8,20 (с, 1H), 7,90 (с, 1H), 2,37 (т, 4H, J=4,3 Гц), 1,55 (т, 4H, J=5,2 Гц), 1,42-1,46 (м, 2H), 1,33 (с, 6H)
(b) Синтез 3-хлор-5-(2-(пиперидин-1-ил)пропан-2-ил)анилина
Процедуру синтеза Промежуточного соединения 40 повторяли за исключением использования 1-(2-(3-хлор-5-нитрофенил)пропан-2-ил)пиперидина (35,0 мг, 0,11 ммоль), получая 3-хлор-5-(2-(пиперидин-1-ил)пропан-2-ил)анилин (25,0 мг, 90 %).
LC/MS ESI (+): 253 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 6,90 (с, 1H), 6,79 (с, 1H), 6,52 (с, 1H), 3,67 (ушир.с, 2H), 2,38 (ушир.с, 4H), 1,48-1,54 (м, 4H), 1,40-1,43 (м, 2H), 1,25 (с, 6H)
(c) Синтез N-(3-хлор-5-(2-(пиперидин-1-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
Процедуру синтеза Примера 1 повторяли за исключением использования 3-хлор-5-(2-(пиперидин-1-ил)пропан-2-ил)анилина (25,0 мг, 0,10 ммоль), получая N-(3-хлор-5-(2-(пиперидин-1-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (27,0 мг, 53 %).
LC/MS ESI (+): 506 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,53 (с, 1H), 9,83 (с, 1H), 8,28 (с, 1H), 7,97 (д, 1H, J=8,7 Гц), 7,82 (с, 1H), 7,73-7,75 (м, 2H), 7,30 (д, 1H, J=8,7 Гц), 7,20 (с, 1H), 2,96 (с, 3H), 2,31 (ушир.с, 4H), 1,44 (ушир.с, 4H), 1,33 (ушир.с, 2H), 1,21 (с, 6H)
Способом синтеза согласно Примеру 164, синтезировали соединение Примера 165, и данные являются следующими.
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,60 (с, 1H), 9,58 (ушир.с, 1H), 8,26~8,28 (м, 2H), 7,97 (с, 1H), 7,80 (с, 1H), 7,73 (с, 1H), 7,21 (с, 1H), 2,98 (с, 3H), 2,27~2,34 (м, 4H), 1,39~1,46 (м, 4H), 1,32~1,34 (м, 2H), 1,21 (с, 6H)
Пример 166) Синтез N-(3-(2-(1H-пиррол-2-ил)пропан-2-ил)-5-хлорфенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
(a) Синтез 1-хлор-3-нитро-5-(проп-1-ен-2-ил)бензола
1-бром-3-хлор-5-нитробензол (5,0 г, 21,15 ммоль), 4,4,5,5-тетраметил-2-(проп-1-ен-2-ил)-1,3,2-диоксаборолан (4,0 мл, 21,15 ммоль), Pd(PPh3)4 (1,2 г, 1,06 ммоль) и Na2CO3 (6,7 г, 63,44 ммоль) добавляли к смеси DME/H2O (105,0 мл, 2/1 об./об.) с последующим нагреванием с обратным холодильником при 80°C в течение 7 часов. Реакционную смесь охлаждали до комнатной температуры и затем экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 9:1), получая смесь 1-хлор-3-нитро-5-(проп-1-ен-2-ил)бензола и 1-бром-3-хлор-5-нитробензола (4,2 г) в форме желтого масла.
1H-ЯМР (400 МГц, CDCl3): δ 8,20 (м, 1H), 8,11 (м, 1H), 7,74 (м, 1H), 5,52 (с, 1H), 5,30 (м, 1H), 2,18-2,19 (м, 3H)
(b) Синтез 1-(2-бромпропан-2-ил)-3-хлор-5-нитробензола
Смесь 1-хлор-3-нитро-5-(проп-1-ен-2-ил)бензола и 1-бром-3-хлор-5-нитробензола (4,2 г) растворяли в безводном Et2O (50,0 мл), и 33%-ый раствор HBr в AcOH (25,9 мл, 147,76 ммоль) добавляли при 0°C с последующим перемешиванием при комнатной температуре в течение 12 часов. Добавляли большое количество Et2O, и органический слой промывали H2O, насыщ. водным раствором NaHCO3 и солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 20:1), получая 1-(2-бромпропан-2-ил)-3-хлор-5-нитробензол (3,0 г, 2 стадии выход: 51 %) в форме желтого масла.
1H-ЯМР (400 МГц, CDCl3): δ 8,34 (м, 1H), 8,14 (м, 1H), 7,93 (м, 1H), 2,21 (с, 6H)
(c) Синтез 2-(2-(3-хлор-5-нитрофенил)пропан-2-ил)-1H-пиррола и 3-(2-(3-хлор-5-нитрофенил)пропан-2-ил)-1H-пиррола
1-(2-бромпропан-2-ил)-3-хлор-5-нитробензол (150 мг, 0,43 ммоль) и пиррол (1,1 мл, 16,17 ммоль) растворяли в 1,2-дихлорэтане (5,4 мл), и AlCl3 (215,6 мг, 1,62 ммоль) добавляли при комнатной температуре. Смесь нагревали при 30°C в течение 4 дней и добавляли воду. Полученную реакционную смесь фильтровали через Целит и экстрагировали CH2Cl2, Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 9:1), получая 2-(2-(3-хлор-5-нитрофенил)пропан-2-ил)-1H-пиррол (166-C-1) (37,2 мг, 33 %) в форме желтого масла и 3-(2-(3-хлор-5-нитрофенил)пропан-2-ил)-1H-пиррол (166-C-2) (20,0 мг, 18 %) в форме твердого вещества желтого цвета.
(166-C-1) 2-(2-(3-хлор-5-нитрофенил)пропан-2-ил)-1H-пиррол
LC/MS ESI (+): 265 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 8,05, (м, 1H), 8,01 (м, 1H), 7,74 (ушир.с, 1H), 7,47 (м, 1H), 6,73 (м, 1H), 6,18 (м, 1H), 6,13 (м, 1H), 1,72 (с, 6H)
(166-C-2) 3-(2-(3-хлор-5-нитрофенил)пропан-2-ил)-1H-пиррол
LC/MS ESI (+): 265 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 8,08-8,13 (м, 2H), 8,01 (м, 1H), 7,61 (м, 1H), 6,78 (м, 1H), 6,63 (м, 1H), 5,99 (м, 1H), 1,67 (с, 6H)
(d) Синтез 3-(2-(1H-пиррол-2-ил)пропан-2-ил)-5-хлоранилина
Процедуру синтеза Промежуточного соединения 40 повторяли за исключением использования 2-(2-(3-хлор-5-нитрофенил)пропан-2-ил)-1H-пиррола (44,2 мг, 0,17 ммоль), получая 3-(2-(1H-пиррол-2-ил)пропан-2-ил)-5-хлоранилин (35,0 мг, 89 %).
LC/MS ESI (+): 235 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,69 (ушир.с, 1H), 6,65-6,67 (м, 2H), 6,51 (м, 1H), 6,34 (м, 1H), 6,14 (м, 1H), 6,09 (м, 1H), 3,65 (с, 2H), 1,61 (с, 6H)
(e) Синтез N-(3-(2-(1H-пиррол-2-ил)пропан-2-ил)-5-хлорфенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
Процедуру синтеза Примера 1 повторяли за исключением использования 3-(2-(1H-пиррол-2-ил)пропан-2-ил)-5-хлоранилина (35,0 мг, 0,15 ммоль), получая N-(3-(2-(1H-пиррол-2-ил)пропан-2-ил)-5-хлорфенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (35,1 мг, 56 %).
LC/MS ESI (+): 488 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,57 (с, 1H), 10,48 (с, 1H), 9,89 (с, 1H), 8,30 (с, 1H), 8,02 (д, 1H, J=8,7 Гц), 7,84 (м, 1H), 7,80 (д, 1H, J=2,0 Гц), 7,53 (м, 1H), 7,36 (дд, 1H, J=8,7, 2,1 Гц), 6,89 (м, 1H), 6,63 (м, 1H), 5,91-5,94 (м, 2H), 3,01 (с, 3H), 1,61 (с, 6H)
Пример 167) Синтез N-(3-(2-(1H-пиррол-3-ил)пропан-2-ил)-5-хлорфенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
(a) Синтез 3-(2-(1H-пиррол-3-ил)пропан-2-ил)-5-хлоранилина
Процедуру синтеза Промежуточного соединения 13-с повторяли за исключением использования 3-(2-(3-хлор-5-нитрофенил)пропан-2-ил)-1H-пиррола (Пример 166-C-2) (20,0 мг, 0,08 ммоль), получая 3-(2-(1H-пиррол-3-ил)пропан-2-ил)-5-хлоранилин (14,3 мг, 81 %).
LC/MS ESI (+): 235 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 8,00 (ушир.с, 1H), 6,72-6,75 (м, 2H), 6,58 (м, 1H), 6,47-6,50 (м, 2H), 6,04 (м, 1H), 3,62 (с, 2H), 1,58 (с, 6H)
(b) Синтез N-(3-(2-(1H-пиррол-3-ил)пропан-2-ил)-5-хлорфенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
Процедуру синтеза Примера 1 повторяли за исключением использования 3-(2-(1H-пиррол-3-ил)пропан-2-ил)-5-хлоранилина (14,3 мг, 0,06 ммоль), получая N-(3-(2-(1H-пиррол-3-ил)пропан-2-ил)-5-хлорфенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (13,7 мг, 46 %).
LC/MS ESI (+): 488 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,54-10,55 (м, 2H), 9,89 (с, 1H), 8,31 (с, 1H), 8,02 (д, 1H, J=8,7 Гц), 7,81 (м, 1H), 7,79 (д, 1H, J=2,0 Гц), 7,62 (м, 1H), 7,36 (дд, 1H, J=8,7, 2,1 Гц), 7,01 (м, 1H), 6,67 (м, 1H), 6,59 (м, 1H), 5,86 (м, 1H), 3,02 (с, 3H), 1,57 (с, 6H)
Способом синтеза согласно Примерам 166 и 167 синтезировали соединения с Примера 168 по Пример 185, и данные для каждого примера являются следующими.
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,54 (с, 1H), 9,89 (с, 1H), 8,31 (с, 1H), 8,02 (д, 1H, J=8,8 Гц), 7,83 (с, 1H), 7,80 (с, 1H), 7,60 (с, 1H), 7,36 (д, 1H, J=8,8 Гц), 7,02 (с, 1H), 6,60 (с, 1H), 6,53 (с, 1H), 5,81 (с, 1H), 3,56 (с, 3H), 3,02 (с, 3H), 1,55 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,59 (с, 1H), 9,87 (с, 1H), 8,29 (с, 1H), 8,02 (д, 1H, J=8,7 Гц), 7,88 (с, 1H), 7,79 (с, 1H), 7,49 (с, 1H), 7,36 (д, 1H, J=8,7 Гц), 6,88 (с, 1H), 6,61 (с, 1H), 6,10 (с, 1H), 5,94 (с, 1H), 3,09 (с, 3H), 3,01 (с, 3H), 1,61 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,57 (с, 1H), 9,86 (с, 1H), 8,30 (с, 1H), 8,02 (д, 1H, J=8,7 Гц), 7,88 (с, 1H), 7,80 (с, 1H), 7,65 (с, 1H), 7,35~7,40 (м, 2H), 7,08 (с, 1H), 6,97~6,99 (м, 2H), 3,02 (с, 3H), 1,74 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,55 (с, 1H), 9,87 (ушир.с, 1H), 8,29 (с, 1H), 8,02 (д, 1H, J=8,7 Гц), 7,85 (с, 1H), 7,79 (м, 1H), 7,57 (с, 1H), 7,46 (дд, 1H, J=4,9, 2,9 Гц), 7,36 (дд, 1H, J=8,8, 1,5 Гц), 7,31 (м, 1H), 6,99 (с, 1H), 6,90 (д, 1H, J=4,9 Гц), 3,01 (с, 3H), 1,65 (с, 6H)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,63 (с, 1H), 9,62 (с, 1H), 8,35 (с, 1H), 8,29 (с, 1H), 8,03 (с, 1H), 7,87 (с, 1H), 7,48 (с, 1H), 7,37 (д, 2H, J=8,6 Гц), 7,27(д, 2H, J=8,6 Гц), 7,03 (с, 1H), 3,06 (с, 3H), 1,64 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,63 (с, 1H), 9,55 (с, 1H), 8,50 (с, 1H), 8,27 (с, 1H), 8,02 (с, 1H), 7,87 (с, 1H), 7,48 (с, 1H), 7,37 (д, 2H, J=8,6 Гц), 7,27(д, 2H, J=8,6 Гц), 7,04 (с, 1H), 3,07 (с, 3H), 1,64 (с, 6H)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,58 (с, 1H), 9,90 (с, 1H), 8,29 (с, 1H), 8,01 (д, 1H, J=8,7 Гц), 7,90 (с, 1H), 7,78 (с, 1H), 7,63 (с, 1H), 7,34 (д, 1H, J=8,7 Гц), 7,12 (с, 1H), 6,98 (д, 1H, J=3,9 Гц), 6,85 (д, 1H, J=3,9 Гц), 3,00 (с, 3H), 1,70 (с, 6H)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,63 (с, 1H), 9,69 (с, 1H), 8,26 (с, 2H), 7,98 (с, 1H), 7,90 (с, 1H), 7,62 (с, 1H), 7,13 (с, 1H), 6,98 (д, 1H, J=3,8 Гц), 6,85 (д, 1H, J=3,8 Гц), 2,98 (с, 3H), 1,70 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,55 (с, 1H), 9,89 (ушир.с, 1H), 8,30 (с, 1H), 8,01 (д, 1H, J=8,7 Гц), 7,84 (с, 1H), 7,79 (с, 1H), 7,55 (с, 1H), 7,35 (дд, 1H, J=8,7, 1,5 Гц), 6,97 (с, 1H), 6,78~6,82 (м, 2H), 3,63 (с, 3H), 3,01 (с, 3H), 1,62 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,57 (с, 1H), 9,88 (ушир.с, 1H), 8,29 (с, 1H), 8,00 (д, 1H, J=8,8 Гц), 7,87 (с, 1H), 7,78 (с, 1H), 7,62 (с, 1H), 7,34 (дд, 1H, J=8,7, 2,1 Гц), 7,06 (с, 1H), 6,57 (д, 1H, J=3,9 Гц), 6,10 (д, 1H, J=3,9 Гц), 3,78 (с, 3H), 3,00 (с, 3H), 1,65 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,57 (с, 1H), 9,89 (ушир.с, 1H), 8,30 (с, 1H), 8,02 (д, 1H, J=8,7 Гц), 7,88 (м, 1H), 7,80 (м, 1H), 7,64 (м, 1H), 7,36 (дд, 1H, J=8,7, 2,1 Гц), 7,07 (м, 1H), 6,74 (д, 1H, J=3,4 Гц), 6,63 (м, 1H), 3,01 (с, 3H), 2,37 (с, 3H), 1,69 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,66 (с, 1H), 9,64 (с, 1H), 8,34 (с, 1H), 8,31 (с, 1H), 8,03 (с, 1H), 7,87 (м, 1H), 7,62 (м, 1H), 7,08 (м, 1H), 6,74 (д, 1H, J=3,5 Гц), 6,63 (м, 1H), 3,05 (с, 3H), 2,37 (с, 3H), 1,69 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,69 (с, 1H), 9,64 (с, 1H), 8,36 (с, 1H), 8,32 (с, 1H), 8,05 (с, 1H), 7,88 (м, 1H), 7,64 (м, 1H), 7,09 (м, 1H), 6,74 (д, 1H, J=3,5 Гц), 6,67 (дд, 1H, J=3,5, 0,8 Гц), 3,02~3,09 (м, 4H), 1,70 (с, 6H), 1,22 (д, 6H, J=6,8 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,66 (с, 1H), 9,64 (с, 1H), 8,33 (с, 1H), 8,30 (с, 1H), 8,02 (с, 1H), 7,88 (м, 1H), 7,62 (м, 1H), 7,09 (м, 1H), 6,95 (м, 1H), 6,77 (д, 1H, J=1,3 Гц), 3,04 (с, 3H), 2,17 (д, 3H, J=0,9 Гц), 1,70 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,64 (с, 1H), 9,64 (ушир.с, 1H), 8,35 (с, 1H), 8,29 (с, 1H), 8,04 (с, 1H), 7,87 (с, 1H), 7,49 (с, 1H), 7,28 (дд, 2H, J=8,4, 5,7 Гц), 7,13 (т, 2H, J=8,8 Гц), 7,03 (с, 1H), 3,06 (с, 3H), 1,64 (с, 6H)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,64 (с, 1H), 9,65 (ушир.с, 1H), 8,35 (с, 1H), 8,30 (с, 1H), 8,03 (с, 1H), 7,87 (с, 1H), 7,51 (с, 1H), 7,17 (д, 2H, J=8,8 Гц), 7,00 (с, 1H), 6,88 (д, 2H, J=8,8 Гц), 3,74 (с, 3H), 3,06 (с, 3H), 1,63 (с, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,65 (с, 1H), 9,68 (ушир.с, 1H), 8,23 (с, 1H), 8,19 (с, 1H), 8,12 (с, 1H), 7,88 (м, 1H), 7,49 (м, 1H), 7,37 (д, 2H, J=8,7 Гц), 7,27 (д, 2H, J=8,7 Гц), 7,03 (м, 1H), 3,09 (с, 3H), 1,64 (с, 6H)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,63 (с, 1H), 9,67 (ушир.с, 1H), 8,34 (с, 1H), 8,30 (с, 1H), 8,05 (с, 1H), 7,89 (с, 1H), 7,49 (с, 1H), 7,39 (д, 2H, J=8,8 Гц), 7,28 (д, 2H, J=8,8 Гц), 7,05 (с, 1H), 3,74 (т, 2H, J=6,4 Гц), 3,47~3,41 (м, 2H), 3,24 (с, 3H), 1,65 (с, 6H)
Пример 186) Синтез 6-хлор-N-(3-хлор-5-(2-(5-Цианотиофен-2-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
(a) Синтез 5-(2-(3-хлор-5-нитрофенил)пропан-2-ил)тиофен-2-карбонитрила
2-бром-5-(2-(3-хлор-5-нитрофенил)пропан-2-ил)тиофен (250,0 мг, 0,69 ммоль) и CuCN (62,0 мг, 0,69 ммоль) растворяли в безводном DMF (1,0 мл), и температуру реакции увеличивали до 140°C, с последующим перемешиванием в течение 5 часов. Реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 7:1), получая 5-(2-(3-хлор-5-нитрофенил)пропан-2-ил)тиофен-2-карбонитрил (56,0 мг, 26 %) в форме желтой жидкости.
1H-ЯМР (400 МГц, CDCl3): δ 8,21 (с, 1H), 8,07 (с, 1H), 7,56 (с, 1H), 7,51 (д, 1H, J=4,0 Гц), 6,85 (д, 1H, J=4,0 Гц), 1,84 (с, 6H)
(b) Синтез 5-(2-(3-амино-5-хлорфенил)пропан-2-ил)тиофен-2-карбонитрила
Процедуру синтеза Промежуточного соединения 40 повторяли за исключением использования 5-(2-(3-хлор-5-нитрофенил)пропан-2-ил)тиофен-2-карбонитрила (54,0 мг, 0,18 ммоль), получая 5-(2-(3-амино-5-хлорфенил)пропан-2-ил)тиофен-2-карбонитрил (35,0 мг, 72 %).
LC/MS ESI (+): 277 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,45 (д, 1H, J=4,0 Гц), 6,81 (д, 1H, J=4,0 Гц), 6,65 (с, 1H), 6,56 (с, 1H), 6,41 (с, 1H), 3,72 (ушир.с, 2H), 1,72 (с, 6H)
(c) Синтез 6-хлор-N-(3-хлор-5-(2-(5-Цианотиофен-2-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
Процедуру синтеза Примера 1 повторяли за исключением использования 5-(2-(3-амино-5-хлорфенил)пропан-2-ил)тиофен-2-карбонитрила (35,0 мг, 0,13 ммоль), получая 6-хлор-N-(3-хлор-5-(2-(5-Цианотиофен-2-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (10,0 мг, 14 %).
LC/MS ESI (+): 564 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,59 (с, 1H), 9,59 (ушир.с, 1H), 8,24 (с, 1H), 8,21 (с, 1H), 7,95 (с, 1H), 7,84 (с, 1H), 7,80 (д, 1H, J=3,6 Гц), 7,54 (с, 1H), 7,11-7,12 (м, 2H), 2,95 (с, 3H), 1,71 (с, 6H)
Пример 187) Синтез N-(3-хлор-5-(2-(1-этил-1H-пиррол-2-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
(a) Синтез 2-(2-(3-хлор-5-нитрофенил)пропан-2-ил)-1-этил-1H-пиррола
2-(2-(3-хлор-5-нитрофенил)пропан-2-ил)-1H-пиррол (66,0 мг, 0,25 ммоль) растворяли в безводном DMF (5,0 мл), и 60%-ый NaH в минеральном масле (11,0 мг, 0,28 ммоль) добавляли при 0°C. Реакционную смесь перемешивали при 0°C в течение 30 минут и добавляли этил йодид (57,0 мг, 0,37 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа и экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 9:1), получая 2-(2-(3-хлор-5-нитрофенил)пропан-2-ил)-1-этил-1H-пиррол (47,0 мг, 64 %) в форме желтой жидкости.
1H-ЯМР (400 МГц, CDCl3): δ 8,05 (с, 1H), 8,00 (с, 1H), 7,43 (с, 1H), 6,67 (т, 1H, J=2,4 Гц), 6,17 (д, 2H, J=2,4 Гц), 3,37 (кв., 2H, J=7,2 Гц), 1,70 (с, 6H), 1,08 (т, 3H, J=7,2 Гц)
(b) Синтез 3-хлор-5-(2-(1-этил-1H-пиррол-2-ил)пропан-2-ил)анилина
Процедуру синтеза Промежуточного соединения 40 повторяли за исключением использования 2-(2-(3-хлор-5-нитрофенил)пропан-2-ил)-1-этил-1H-пиррола (47,0 мг, 0,16 ммоль), получая 3-хлор-5-(2-(1-этил-1H-пиррол-2-ил)пропан-2-ил)анилин (31,0 мг, 73 %).
LC/MS ESI (+): 263 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 6,62-6,64 (м, 2H), 6,50 (с, 1H), 6,29 (с, 1H), 6,13 (т, 1H, J=2,8 Гц), 6,10 (м, 1H), 3,64 (ушир.с, 2H), 3,45 (кв., 2H, J=7,2 Гц), 1,60 (с, 6H), 1,09 (т, 3H, J=7,2 Гц)
(c) Синтез N-(3-хлор-5-(2-(1-этил-1H-пиррол-2-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
Процедуру синтеза Примера 1 повторяли за исключением использования 3-хлор-5-(2-(1-этил-1H-пиррол-2-ил)пропан-2-ил)анилина (31,0 мг, 0,12 ммоль), получая N-(3-хлор-5-(2-(1-этил-1H-пиррол-2-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (30,0 мг, 50 %).
LC/MS ESI (+): 516 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,60 (с, 1H), 9,87 (ушир.с, 1H), 8,31 (с, 1H), 8,03 (д, 1H, J=8,8 Гц), 7,89 (с, 1H), 7,80 (с, 1H), 7,52 (с, 1H), 7,37 (д, 1H, J=8,8 Гц), 6,90 (с, 1H), 6,74 (с, 1H), 6,05 (м, 1H), 6,02 (м, 1H), 3,42 (кв., 2H, J=7,2 Гц), 3,02 (с, 3H), 1,62 (с, 6H), 0,98 (т, 3H, J=7,2 Гц)
Пример 188) Синтез 6-хлор-N-(3-хлор-5-(2-(4-хлорфенил)пропан-2-ил)фенил)-5-((2-гидроксиэтил)сульфонамидо)бензо[b]тиофен-2-карбоксамида
6-хлор-N-(3-хлор-5-(2-(4-хлорфенил)пропан-2-ил)фенил)-5-((2-метоксиэтил)сульфонамидо)бензо[b]тиофен-2-карбоксамид (63,0 мг, 0,10 ммоль) растворяли в толуоле (1,0 мл), и 1,0M BBr3, растворенный в CH2Cl2 (30,6 мкл, 0,31 ммоль), медленно добавляли при 0°C. Температуру реакции увеличивали до комнатной температуры, и реакционную смесь перемешивали в течение 15 часов и экстрагировали EtOAc. Органический экстракт промывали водой, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали хроматографией на колонках с обратной фазой (C18-силикагель, 0,1 % муравьиной кислоты в CH3CN: 0,1 % муравьиной кислоты в H2O = 7:3), получая 6-хлор-N-(3-хлор-5-(2-(4-хлорфенил)пропан-2-ил)фенил)-5-((2-гидроксиэтил)сульфонамидо)бензо[b]тиофен-2-карбоксамид (34,0 мг, 56 %) в форме твердого вещества белого цвета.
LC/MS ESI (+): 597 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,63 (с, 1H), 9,62 (ушир.с, 1H), 8,35 (с, 1H), 8,29 (с, 1H), 8,06 (с, 1H), 7,89 (с, 1H), 7,49 (с, 1H), 7,39 (д, 2H, J=8,8 Гц), 7,28 (д, 2H, J=8,8 Гц), 7,05 (с, 1H), 5,04 (ушир.с, 1H), 3,80-3,84 (м, 2H), 3,30-3,32 (м, 2H), 1,65 (с, 6H)
Пример 189) Синтез N-(3-хлор-5-(2-(пиримидин-2-илокси)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
(a) Синтез 2-((2-(3-хлор-5-нитрофенил)пропан-2-ил)окси)пиримидина
1-(2-бромпропан-2-ил)-3-хлор-5-нитробензол (Пример 166-b) (24,0 мг, 0,09 ммоль) растворяли в безводном DMF (0,9 мл), и K2CO3 (24,0 мг, 0,17 ммоль) и пиримидин-4(3H)-он (17,0 мг, 0,17 ммоль) добавляли при комнатной температуре. Смесь перемешивали при комнатной температуре в течение 15 часов, и реакционную смесь экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, EtOAc), получая 2-((2-(3-хлор-5-нитрофенил)пропан-2-ил)окси)пиримидин (11,0 мг, 44 %) в форме бесцветной жидкости.
1H-ЯМР (400 МГц, CDCl3): δ 8,57 (с, 1H), 8,11 (с, 1H), 7,92-7,97 (м, 2H), 7,47 (с, 1H), 6,34 (д, 1H, J=6,5 Гц), 1,99 (с, 6H)
(b) Синтез 3-хлор-5-(2-(пиримидин-2-илокси)пропан-2-ил)анилина
Процедуру синтеза Промежуточного соединения 40 повторяли за исключением использования 2-((2-(3-хлор-5-нитрофенил)пропан-2-ил)окси)пиримидина (11,0 мг, 0,04 ммоль), получая 3-хлор-5-(2-(пиримидин-2-илокси)пропан-2-ил)анилин (4,0 мг, 38 %).
LC/MS ESI (+): 264 (M+1)
(c) Синтез N-(3-хлор-5-(2-(пиримидин-2-илокси)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
Процедуру синтеза Примера 1 повторяли за исключением использования 3-хлор-5-(2-(пиримидин-2-илокси)пропан-2-ил)анилина (4,0 мг, 0,01 ммоль), получая N-(3-хлор-5-(2-(пиримидин-2-илокси)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (2,0 мг, 35 %).
LC/MS ESI (+): 517 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,51 (с, 1H), 9,85 (ушир.с, 1H), 8,75 (с, 1H), 8,21 (с, 1H), 7,97 (д, 1H, J=6,5 Гц), 7,87-7,90 (м, 2H), 7,68 (с, 1H), 7,43 (с, 1H), 7,26 (д, 1H, J=8,1 Гц), 7,01 (с, 1H), 6,29 (д, 1H, J=6,5 Гц), 2,89 (с, 3H), 1,89 (с, 6H)
Пример 190) Синтез N-(3-хлор-5-(2-(6-оксопиридазин-1(6H)-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
(a) Синтез 2-(2-(3-хлор-5-нитрофенил)пропан-2-ил)пиридазин-3 (2H)-она
1-(2-бромпропан-2-ил)-3-хлор-5-нитробензол (Пример 166-b) (24,0 мг, 0,09 ммоль) растворяли в безводном DMF (0,9 мл), и K2CO3 (24,0 мг, 0,17 ммоль) и пиридазин-3(2H)-он (17,0 мг, 0,17 ммоль) добавляли при комнатной температуре. Смесь перемешивали при комнатной температуре в течение 15 часов, и реакционную смесь экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 1:1), получая 2-(2-(3-хлор-5-нитрофенил)пропан-2-ил)пиридазин-3(2H)-он (13,0 мг, 51 %) в форме бесцветной жидкости.
1H-ЯМР (400 МГц, CDCl3): δ 8,07 (с, 1H), 7,94 (с, 1H), 7,89 (с, 1H), 7,50 (с, 1H), 7,24 (д, 1H, J=3,7 Гц), 6,80 (д, 1H, J=9,3 Гц), 1,93 (с, 6H)
(b) Синтез 2-(2-(3-амино-5-хлорфенил)пропан-2-ил)пиридазин-3 (2H)-она
Процедуру синтеза Промежуточного соединения 40 повторяли за исключением использования 2-(2-(3-хлор-5-нитрофенил)пропан-2-ил)пиридазин-3(2H)-она (13,0 мг, 0,05 ммоль), получая 2-(2-(3-амино-5-хлорфенил)пропан-2-ил)пиридазин-3(2H)-он (2,0 мг, 15 %).
LC/MS ESI (+): 264 (M+1)
(c) Синтез N-(3-хлор-5-(2-(6-оксопиридазин-1(6H)-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
Процедуру синтеза Примера 1 повторяли за исключением использования 2-(2-(3-амино-5-хлорфенил)пропан-2-ил)пиридазин-3(2H)-она (2,0 мг, 0,01 ммоль), получая N-(3-хлор-5-(2-(6-оксопиридазин-1(6H)-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (3,0 мг, 72 %).
LC/MS ESI (+): 517 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,54 (с, 1H), 9,87 (ушир.с, 1H), 8,27 (с, 1H), 8,06 (с, 1H), 8,01 (д, 1H, J=8,7 Гц), 7,87 (с, 1H), 7,78 (с, 1H), 7,48 (дд, 1H, J=9,3, 3,8 Гц), 7,40 (с, 1H), 7,35 (д, 1H, J=8,7 Гц), 6,96 (с, 1H), 6,83 (д, 1H, J=9,3 Гц), 3,00 (с, 3H), 1,83 (с, 6H)
Пример 191) Синтез N-(3-хлор-5-(2-(пиридин-4-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
(a) Синтез 3-хлор-5-метоксибензонитрила
3,5-дихлорбензонитрил (1,5 г, 8,72 ммоль) растворяли в безводном DMF (10,0 мл) и медленно добавляли 35%-ый раствор NaOMe в MeOH (4,0 мл) с последующим перемешиванием в течение 72 часов. Реакционную смесь экстрагировали EtOAc, промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 1:3), получая 3-хлор-5-метоксибензонитрил (970,0 мг, 63 %) в форме твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3): δ 7,23 (т, 1H, J=1,6 Гц), 7,12 (т, 1H, J=2,0 Гц), 7,05 (дд, 1H, J=2,4, 1,2 Гц), 3,84 (с, 3H)
(b) Синтез (3-хлор-5-метоксифенил)(пиридин-4-ил)метанона
4-бромпиридин (1,8 г, 11,4 ммоль) растворяли в Et2O (7,5 мл) и n-BuLi (9,8 мл, 15,7 ммоль) медленно добавляли при -78°C и перемешивали в течение 1 часа. 3-хлор-5-метоксибензонитрил (1,2 г, 7,16 ммоль) растворяли в Et2O (10,0 мл) и добавляли к реакционной смеси с последующим перемешиванием при 0°C в течение 12 часов. Реакцию останавливали с помощью 1н. HCl, и реакционную смесь экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (амин силикагель, н-гексан : CH2Cl2 = 1:1), получая (3-хлор-5-метоксифенил)(пиридин-4-ил)метанон (950,0 мг, 56 %) в форме грязно-белого масла.
LC/MS ESI (+): 248 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 8,83 (д, 2H, J=5,2 Гц), 7,58 (д, 2H, J=6,0 Гц), 7,32 (т, 1H, J=1,6 Гц), 7,24 (с, 1H), 7,17 (т, 1H, J=2,0 Гц), 3,86 (с, 3H)
(c) Синтез 4-(дихлор(3-хлор-5-метоксифенил)метил)пиридина
Процедуру синтеза Промежуточного соединения 37 повторяли за исключением использования (3-хлор-5-метоксифенил)(пиридин-4-ил)метанона (950,0 мг, 2,55 ммоль), получая 4-(дихлор(3-хлор-5-метоксифенил)метил)пиридин (510,0 мг, 43 %).
LC/MS ESI (+): 302 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 8,68 (д, 2H, J=6,0 Гц), 7,51 (д, 2H, J=6,0 Гц), 7,15 (с, 1H), 7,02 (т, 1H, J=2,0 Гц), 6,91 (т, 1H, J=2,0 Гц), 3,80 (с, 3H)
(d) Синтез 4-(2-(3-хлор-5-метоксифенил)пропан-2-ил)пиридина
Процедуру синтеза Промежуточного соединения 38 повторяли за исключением использования 4-(дихлор(3-хлор-5-метоксифенил)метил)пиридина (200,0 мг, 0,66 ммоль), получая 4-(2-(3-хлор-5-метоксифенил)пропан-2-ил)пиридин (71,4 мг, 41 %).
LC/MS ESI (+): 262 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 8,52 (ушир.с, 2H), 7,13 (ушир.с, 2H), 6,78 (т, 1H, J=1,6 Гц), 6,75 (т, 1H, J=2,0 Гц), 6,61 (т, 1H, J=2,0 Гц), 3,75 (с, 3H), 1,64 (с, 6H)
(f) Синтез 3-хлор-5-(2-(пиридин-4-ил)пропан-2-ил)фенола
Процедуру синтеза Промежуточного соединения 41 повторяли за исключением использования 4-(2-(3-хлор-5-метоксифенил)пропан-2-ил)пиридина (183,0 мг, 0,49 ммоль), получая 3-хлор-5-(2-(пиридин-4-ил)пропан-2-ил)фенол (157,0 мг, 91 %).
LC/MS ESI (+): 248 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 8,37 (д, 2H, J=5,2 Гц), 7,15 (д, 2H, J=5,2 Гц), 6,87 (с, 1H), 6,76 (с, 1H), 6,30 (с, 1H), 1,63 (с, 6H)
(g) Синтез 3-хлор-5-(2-(пиридин-4-ил)пропан-2-ил)фенил трифторметансульфоната
Процедуру синтеза 114-a Примера повторяли за исключением использования 3-хлор-5-(2-(пиридин-4-ил)пропан-2-ил)фенола (80,0 мг, 0,32 ммоль), получая 3-хлор-5-(2-(пиридин-4-ил)пропан-2-ил)фенил трифторметансульфонат (40,0 мг, 33 %).
LC/MS ESI (+): 380 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 8,55 (д, 2H, J=5,2 Гц), 7,21 (с, 1H), 7,18 (с, 1H), 7,10 (д, 2H, J=5,2 Гц), 6,99 (с, 1H), 1,68 (с, 6H)
(h) Синтез 3-хлор-5-(2-(пиридин-4-ил)пропан-2-ил)анилина
3-хлор-5-(2-(пиридин-4-ил)пропан-2-ил)фенил трифторметансульфонат (40,0 мг, 0,11 ммоль), бензофенон имин (21,0 мкл, 0,13 ммоль), Pd2dba3CHCl3 (11,0 мг, 0,01 ммоль) rac-биNAP (13,7 мг, 0,02 ммоль) и Cs2CO3 (51,3 мг, 0,16 ммоль) растворяли в THF (3,0 мл), с последующим нагреванием с обратным холодильником в течение 2 дней. Реакционную смесь экстрагировали EtOAc, промывали солевым раствором, высушивали над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток растворяли в THF (2,0 мл) и добавляли 2 н. водный раствор HCl (0,5 мл) с последующим перемешиванием при комнатной температуре в течение 3 часов. Реакционную смесь экстрагировали CH2Cl2, промывали насыщ. водным раствором NaHCO3, высушивали над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (амин силикагель, CH2Cl2 : MeOH = 20:1), получая 3-хлор-5-(2-(пиридин-4-ил)пропан-2-ил)анилин (6,8 мг, 2 стадии выход: 26 %) в форме желтой жидкости.
LC/MS ESI (+): 247 (M+1)
1H-ЯМР (300 МГц, CDCl3): δ 8,50 (м, 2H), 7,13 (д, 2H, J=5,6 Гц), 6,60 (м, 1H), 6,54 (м, 1H), 6,31 (м, 1H), 3,68 (ушир.с, 2H), 1,61 (с, 6H)
(i) Синтез N-(3-хлор-5-(2-(пиридин-4-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
Процедуру синтеза Примера 1 повторяли за исключением использования 3-хлор-5-(2-(пиридин-4-ил)пропан-2-ил)анилина (6,0 мг, 0,02 ммоль), получая N-(3-хлор-5-(2-(пиридин-4-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (3,3 мг, 28 %).
LC/MS ESI (+): 500 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,56 (с, 1H), 9,88 (ушир.с, 1H), 8,51 (д, 2H, J=5,6 Гц), 8,29 (с, 1H,), 8,03 (д, 1H, J=8,4 Гц), 7,91 (с, 1H), 7,80 (с, 1H), 7,52 (с, 1H), 7,37 (дд, 1H, J=8,8, 2,0 Гц), 7,27 (д, 2H, J=6,4 Гц), 7,07 (с, 1H), 3,02 (с, 3H), 1,67 (с, 6H)
Пример 192) Синтез 2-((3-бром-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)карбамоил)бензо[b]тиофен-5-ил дигидрофосфата
(a) Синтез метил-5-метоксибензо[b]тиофен-2-карбоксилата
Процедуру синтеза Промежуточного соединения 14-1 повторяли за исключением использования 2-фтор-5-метоксибензальдегида (900,0 мг, 5,84 ммоль), получая метил-5-метоксибензо[b]тиофен-2-карбоксилат (270,0 мг, 21 %).
LC/MS ESI (+): 223 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,96 (с, 1H), 7,69 (д, 1H, J=8,9 Гц), 7,25 (д, 1H, J=2,4 Гц), 7,09 (дд, 1H, J=8,9, 2,4 Гц), 3,92 (с, 3H), 3,86 (с, 3H)
(b) Синтез метил-5-гидроксибензо[b]тиофен-2-карбоксилата
Процедуру синтеза Промежуточного соединения 42 повторяли за исключением использования метил-5-метоксибензо[b]тиофен-2-карбоксилата (261,0 мг, 1,17 ммоль), получая метил-5-гидроксибензо[b]тиофен-2-карбоксилат (192,0 мг, 79 %).
LC/MS ESI (+): 209 (M+1)
(c) Синтез 5-гидроксибензо[b]тиофен-2-карбоновой кислоты
Процедуру синтеза Промежуточного соединения 13-d повторяли за исключением использования метил-5-гидроксибензо[b]тиофен-2-карбоксилата (191,0 мг, 0,92 ммоль), получая 5-гидроксибензо[b]тиофен-2-карбоновую кислоту (180,0 мг, 99 %).
LC/MS ESI (+): 195 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 13,28 (ушир.с, 1H), 9,62 (с, 1H), 7,79 (д, 1H, J=8,8 Гц), 7,30 (с, 1H), 7,00 (д, 1H, J=8,8 Гц)
(d) Синтез N-(3-бром-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-гидроксибензо[b]тиофен-2-карбоксамида
Процедуру синтеза Промежуточного соединения 13-d повторяли за исключением использования 5-гидроксибензо[b]тиофен-2-карбоновой кислоты (30 мг, 0,15 ммоль), получая N-(3-бром-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-гидроксибензо[b]тиофен-2-карбоксамид (15,0 мг, 16 %).
LC/MS ESI (+): 608 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,65-7,79 (м, 3H), 7,22-7,24 (м, 2H), 7,18-7,19 (м, 1H), 7,00-7,04 (м, 1H), 6,98-6,99 (м, 1H), 6,61-6,63 (м, 2H), 6,55-6,59 (м, 1H), 5,50 (ушир.с, 1H), 4,40-4,49 (м, 1H), 1,60 (с, 6H), 1,29 (д, 6H, J=6,0 Гц)
(e) Синтез 2-((3-бром-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)карбамоил)бензо[b]тиофен-5-ил дигидрофосфата
N-(3-бром-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-гидроксибензо[b]тиофен-2-карбоксамид (13,9 мг, 0,02 ммоль) растворяли в безводном THF (1,5 мл) и добавляли Et3N (38,0 мкл, 0,23 ммоль) и PОCl3 (22,0 мкл, 0,23 ммоль). После перемешивания при комнатной температуре в течение 2 часов, добавляли холодную H2O (1,0 мл) с последующим перемешиванием при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении. Остаток очищали хроматографией на колонках с обратной фазой (C18-силикагель, CH3CN : H2O = 4:6), получая 2-((3-бром-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)карбамоил)бензо[b]тиофен-5-ил дигидрофосфат (2,0 мг, 13 %) в форме твердого вещества белого цвета.
LC/MS ESI (+): 688 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,55 (с, 1H), 8,20 (с, 1H), 8,02 (с, 1H), 7,84 (д, 1H, J=8,7 Гц), 7,72 (с, 1H), 7,60 (с, 1H), 7,32 (д, 1H, J=8,7 Гц), 7,13 (с, 1H), 6,76 (с, 1H), 6,71 (с, 1H), 6,70 (с, 1H), 4,55-4,68 (м, 1H), 1,63 (с, 6H), 1,22 (д, 6H, J=5,5 Гц)
Пример 193) Синтез 2-((3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)карбамоил)бензо[b]тиофен-5-ил дигидрофосфата
Процедуру синтеза Примера 192 повторяли за исключением использования метил-5-гидроксибензо[b]тиофен-2-карбоксилата (86,7 мг, 0,45 ммоль), получая 2-((3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)карбамоил)бензо[b]тиофен-5-ил дигидрофосфат (5,0 мг).
LC/MS ESI (+): 644 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,59 (с, 1H), 8,26 (с, 1H), 8,00 (д, 1H, J=8,7 Гц), 7,90 (с, 1H), 7,74 (с, 1H), 7,54 (с, 1H), 7,32 (д, 1H, J=8,7 Гц), 7,03 (с, 1H), 6,75 (с, 1H), 6,72 (с, 1H), 6,71 (с, 1H), 4,59-4,65 (м, 1H), 1,64 (с, 6H), 1,23 (д, 6H, J=5,5 Гц)
Пример 194) Синтез трет-бутил(2-((3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)карбамоил)бензо[b]тиофен-5-ил)карбамата
(a) Синтез этил-5-((трет-бутоксикарбонил)амино)бензо[b]тиофен-2-карбоксилата
Этил-5-аминобензо[b]тиофен-2-карбоксилат (500,0 мг, 2,26 ммоль), Bос2O (592,0 мг, 2,71 ммоль) растворяли в THF (45,0 мл) с последующим нагреванием с обратным холодильником в течение 18 часов. Реакционную смесь экстрагировали EtOAc, промывали с использованием 1н. водного раствора HCl, высушивали над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 4:1), получая этил-5-((трет-бутоксикарбонил)амино)бензо[b]тиофен-2-карбоксилат (684,8 мг, 94 %) в форме твердого вещества красного цвета.
1H-ЯМР (400 МГц, CDCl3): δ 8,04 (с, 1H), 7,97 (с, 1H), 7,74 (д, 1H, J=8,8 Гц), 7,33 (дд, 1H, J=8,8, 2,4 Гц), 6,57 (с, 1H), 4,40 (кв., 2H, J=7,2 Гц), 1,54 (с, 9H), 1,41 (т, 3H, J=7,2 Гц)
(b) Синтез 5-((трет-бутоксикарбонил)амино)бензо[b]тиофен-2-карбоновой кислоты
Этил-5-((трет-бутоксикарбонил)амино)бензо[b]тиофен-2-карбоксилат (684,0 мг, 2,13 ммоль) растворяли в MeOH (3,0 мл) и добавляли 2н. водный раствор NaOH (2,13 мл) с последующим нагреванием при 60°C в течение 2 часов и 30 минут. Реакционную смесь концентрировали при пониженном давлении. H2O добавляли к полученному остатку для разбавления, и 1н. водный раствор HCl добавляли для подкисления до рН 1-2, Осадок отфильтровывали. Твердое вещество светло-красного цвета высушивали, получая 5-((трет-бутоксикарбонил)амино)бензо[b]тиофен-2-карбоновую кислоту (603,0 мг, 97 %).
1H-ЯМР (400 МГц, ДМСО-d6): δ 9,53 (с, 1H), 8,19 (с, 1H), 7,99 (с, 1H), 7,88 (д, 1H, J=8,8 Гц), 7,46 (дд, 1H, J=8,8, 2,0 Гц), 1,49 (с, 9H)
(c) Синтез трет-бутил(2-((3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)карбамоил)бензо[b]тиофен-5-ил)карбамата
Процедуру синтеза Промежуточного соединения 13-с повторяли за исключением использования 5-((трет-бутоксикарбонил)амино)бензо[b]тиофен-2-карбоновой кислоты (603,0 мг, 2,06 ммоль), получая трет-бутил(2-((3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)карбамоил)бензо[b]тиофен-5-ил)карбамат (1,1 г, 77 %).
LC/MS ESI (+): 663 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,54 (с, 1H), 9,54 (с, 1H), 8,23 (с, 1H), 8,13 (с, 1H), 7,91-7,93 (м, 2H), 7,54-7,56 (м, 2H), 7,05 (с, 1H), 6,78 (с, 1H), 6,73 (с, 1H), 6,72 (с, 1H), 4,61-4,67 (м, 1H), 1,65 (с, 6H), 1,51 (с, 9H), 1,25 (д, 6H, J=6,0 Гц)
Пример 195) Синтез N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-((2-метоксиэтил)сульфонамидо)бензо[b]тиофен-2-карбоксамида
(a) Синтез 5-амино-N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)бензо[b]тиофен-2-карбоксамида
Трет-бутил(2-((3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)карбамоил)бензо[b]тиофен-5-ил)карбамат (Пример 194) (930,0 мг, 1,40 ммоль) растворяли в CH2Cl2 (14,0 мл) и добавляли TFA (1,4 мл) с последующим перемешиванием при комнатной температуре в течение 2 часов. Реакционную смесь экстрагировали CH2Cl2, промывали насыщ. водным раствором NaHCO3 и солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 1:1), получая 5-амино-N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)бензо[b]тиофен-2-карбоксамид (734,0 мг, 93 %) в форме желтой жидкости.
1H-ЯМР (400 МГц, CDCl3): δ 7,74-7,75 (м, 1H), 7,70 (с, 1H), 7,67 (ушир.с, 1H), 7,63 (д, 1H, J=8,4 Гц), 7,19-7,20 (м, 1H), 7,11 (д, 1H, J = 2,0 Гц), 7,00-7,01 (м, 1H), 6,90 (дд, 1H, J=8,4, 2,0 Гц), 6,65 (д, 2H, J=2,4 Гц), 6,59 (с, 1H), 4,44-4,51 (м, 1H), 3,79 (с, 2H), 1,65 (с, 6H), 1,31 (д, 6H, J=6,0 Гц)
(b) Синтез N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-((2-метоксиэтил)сульфонамидо)бензо[b]тиофен-2-карбоксамида
Процедура синтеза Промежуточного соединения 13-с повторяли за исключением использования 5-амино-N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)бензо[b]тиофен-2-карбоксамида (40,0 мг, 0,07 ммоль), получая N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-((2-метоксиэтил)сульфонамидо)бензо[b]тиофен-2-карбоксамид (36,6 мг, 75 %).
LC/MS ESI (+): 685 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,55 (с, 1H), 9,93 (с, 1H), 8,29 (с, 1H), 8,02 (д, 1H, J=8,8 Гц), 7,91 (м, 1H), 7,80 (м, 1H), 7,55 (с, 1H), 7,36 (дд, 1H, J=8,8, 2,1 Гц), 7,06 (м, 1H), 6,78 (с, 1H), 6,73 (с, 1H), 6,72 (с, 1H), 4,62-4,65 (м, 1H), 3,68 (т, 2H, J=6,0 Гц), 3,38 (т, 2H, J=6,1 Гц), 3,19 (с, 3H), 1,65 (с, 6H), 1,25 (д, 6H, J=6,0 Гц)
Способом синтеза согласно Примеру 195 синтезировали соединения с Примера 196 по Пример 206, и данные для каждого примера являются следующими.
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,55 (с, 1H), 10,03 (ушир.с, 1H), 8,29 (с, 1H), 8,02 (д, 1H, J=8,7 Гц), 7,92 (м, 1H), 7,79 (м, 1H), 7,54 (с, 1H), 7,36 (дд, 1H, J=8,8, 2,1 Гц), 7,06 (м, 1H), 6,78 (с, 1H), 6,74 (м, 1H), 6,72 (с, 1H), 4,61~4,67 (м, 1H), 3,84~3,88 (м, 1H), 3,58~3,71 (м, 2H), 3,33~3,37 (м, 1H), 3,25~3,28 (м, 2H), 2,56~2,63 (м, 1H), 2,05~2,13 (м, 1H), 1,65 (с, 6H), 1,57~1,64 (м, 1H), 1,25 (д, 6H, J=6,0 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,56 (с, 1H), 9,94 (ушир.с, 1H), 8,28 (с, 1H), 8,00 (д, 1H, J=9,1 Гц), 7,92 (с, 1H), 7,79 (с, 1H), 7,54 (с, 1H), 7,35 (д, 1H, J=8,5 Гц), 7,06 (с, 1H), 6,79 (м, 1H), 6,74 (м, 1H), 6,72 (с, 1H), 4,62~4,66 (м, 1H), 4,19~4,22 (м, 1H), 3,58~3,72 (м, 2H), 3,29~3,30 (м, 2H), 2,02~2,07 (м, 1H), 1,78~1,81 (м, 2H), 1,58~1,65 (м, 7H), 1,25 (д, 6H, J=5,5 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,56 (с, 1H), 9,99 (ушир.с, 1H), 8,28 (с, 1H), 8,01 (д, 1H, J=8,7 Гц), 7,92 (с, 1H), 7,78 (с, 1H), 7,54 (с, 1H), 7,34 (д, 1H, J=8,3 Гц), 7,06 (с, 1H), 6,79 (с, 1H), 6,74 (с, 1H), 6,72 (с, 1H), 4,61~4,67 (м, 1H), 3,80 (д, 2H, J=10,7 Гц), 3,26~3,32 (м, 2H), 3,07 (м, 2H), 2,09~2,13 (м, 1H), 1,75 (м, 1H), 1,71 (м, 1H), 1,65 (с, 6H), 1,22~1,34 (м, 8H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,63 (ушир.с, 1H), 10,55 (с, 1H), 8,22 (с, 1H), 7,95~7,98 (м, 1H), 7,90 (с, 1H), 7,61~7,62 (м, 1H), 7,51 (с, 1H), 7,18~7,20 (м, 1H), 7,04 (с, 1H), 6,77 (с, 1H), 6,70~6,72 (м, 2H), 4,61~4,64 (м, 1H), 2,45 (с, 3H), 2,22 (с, 3H), 1,63 (с, 6H), 1,23 (д, 6H, J=5,7 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,53 (с, 1H), 10,29 (ушир.с, 1H), 8,21 (с, 1H), 8,17 (ушир.с, 1H), 7,90 (с, 2H), 7,67 (с, 2H), 7,51 (с, 1H), 7,20~7,24 (м, 1H), 7,04 (с, 1H), 6,77 (с, 1H), 6,71~6,72 (м, 2H), 4,60~4,66 (м, 1H), 3,79 (с, 3H), 1,63 (с, 6H), 1,23 (д, 6H, J=5,7 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,53~10,57 (м, 2H), 8,22 (с, 1H), 7,91 (с, 2H), 7,82 (с, 1H), 7,70 (с, 1H), 7,53 (с, 1H), 7,26 (д, 1H, J=8,9 Гц), 7,05 (с, 1H), 6,79 (с, 1H), 6,72 (м, 2H), 6,62 (с, 1H), 4,61~4,67 (м, 1H), 3,87 (с, 3H), 1,65 (с, 6H), 1,25 (д, 6H, J=5,7 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,55 (с, 1H), 9,99 (ушир.с, 1H), 8,27 (с, 1H), 7,99 (д, 1H, J=8,4 Гц), 7,92 (с, 1H), 7,78 (с, 1H), 7,54 (с, 1H), 7,36 (д, 1H, J=8,6 Гц), 7,06 (с, 1H), 6,79 (с, 1H), 6,72~6,73 (м, 2H), 4,61~4,67 (м, 1H), 3,07~3,13 (м, 2H), 1,65 (с, 6H), 1,19~1,25 (м, 9H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,53 (с, 1H), 9,97 (ушир.с, 1H), 8,25 (с, 1H), 7,96 (д, 1H, J=8,5 Гц), 7,90 (с, 1H), 7,78 (с, 1H), 7,53 (с, 1H), 7,36 (д, 1H, J=8,3 Гц), 7,04 (с, 1H), 6,77 (с, 1H), 6,71~6,72 (м, 2H), 4,60~4,66 (м, 1H), 3,19~3,27 (м, 1H), 1,64 (с, 6H), 1,23 (д, 12H, J=5,9 Гц)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,56 (с, 1H), 10,08 (с, 1H), 8,28 (с, 1H), 8,02 (д, 1H, J=8,7 Гц), 7,90 (с, 1H), 7,81 (с, 1H), 7,53 (с, 1H), 7,36 (д, 1H, J=8,7 Гц), 7,05 (с, 1H), 6,70~6,78 (м, 3H), 4,59~4,66 (м, 1H), 3,89~4,00 (м, 2H), 3,77~3,86 (м, 2H), 3,59~3,65 (м, 1H), 2,07~2,17 (м, 2H), 1,64 (с, 6H), 1,23 (д, 6H, J=6,0 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,55 (с, 1H), 10,26 (ушир.с, 1H), 8,28 (с, 1H), 8,03 (д, 1H, J=8,8 Гц), 7,91 (м, 1H), 7,81 (д, 1H, J=1,9 Гц), 7,53 (с, 1H), 7,38 (дд, 1H, J=8,7, 2,0 Гц), 7,05 (с, 1H), 6,78 (с, 1H), 6,71~6,72 (м, 2H), 4,63 (м, 1H), 3,51 (м, 1H), 3,14~3,25 (м, 4H), 2,40~2,42 (м, 2H), 2,04~2,14 (м, 2H), 1,64 (с, 6H), 1,24 (д, 6H, J=6,0 Гц)
1H-ЯМР(400 МГц, CDCl3): δ 8,09 (с, 1H), 7,83~7,85 (м, 2H), 7,77 (с, 2H), 7,32 (д, 1H, J=8,9 Гц), 7,02 (с, 1H), 6,90 (с, 1H), 6,65 (с, 2H), 6,58 (с, 1H), 4,74 (м, 1H), 4,47 (м, 1H), 3,94 (м, 1H), 3,26 (м, 1H), 3,05 (м, 1H), 2,54 (м, 1H), 2,12~2,21 (м, 2H), 2,07 (с, 3H), 1,78~1,88 (м, 2H), 1,65 (с, 6H), 1,31 (д, 6H, J=6,0 Гц)
Пример 207) Синтез N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(винилсульфонамидо)бензо[b]тиофен-2-карбоксамида
Процедуру синтеза Примера 195-a повторяли за исключением использования 5-амино-N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)бензо[b]тиофен-2-карбоксамида (20,0 мг, 0,04 ммоль), получая N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(винилсульфонамидо)бензо[b]тиофен-2-карбоксамид (14,0 мг, 59 %).
LC/MS ESI (+): 653 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,55 (с, 1H), 10,16 (ушир.с, 1H), 8,26 (с, 1H), 7,99 (д, 1H, J=8,1 Гц), 7,91 (с, 1H), 7,72 (с, 1H), 7,54 (с, 1H), 7,29 (д, 1H, J=8,6 Гц), 7,05 (с, 1H), 6,81-6,84 (м, 1H), 6,78 (с, 1H), 6,74 (с, 1H), 6,72 (с, 1H), 6,12 (д, 1H, J=16,6 Гц), 6,03 (д, 1H, J=9,4 Гц), 4,62-4,67 (м, 1H), 1,65 (с, 6H), 1,25 (д, 6H, J=5,9 Гц)
Пример 208) Синтез N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-((2-(диметиламино)этил) сульфонамидо)бензо[b]тиофен-2-карбоксамида
N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(винилсульфонамидо)бензо[b]тиофен-2-карбоксамид (Пример 207) (10,0 мг, 0,02 ммоль) растворяли в THF (0,5 мл) и добавляли раствор 2,0 М NHMe2 в THF (76,5 мкл, 0,15 ммоль). Смесь перемешивали при комнатной температуре в течение 17 часов, и реакционную смесь концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (амин силикагель, CH2Cl2 : MeOH = 20:1), получая N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-((2-(диметиламино)этил)сульфонамидо)бензо[b]тиофен-2-карбоксамид (10,0 мг, 93 %) в форме твердого вещества белого цвета.
LC/MS ESI (+): 698 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,54 (с, 1H), 9,94 (ушир.с, 1H), 8,27 (с, 1H), 8,00 (д, 1H, J=7,6 Гц), 7,91 (с, 1H), 7,78 (с, 1H), 7,54 (с, 1H), 7,36 (д, 1H, J=6,8 Гц), 7,05 (с, 1H), 6,78 (с, 1H), 6,74 (с, 1H), 6,72 (с, 1H), 4,61-4,67 (м, 1H), 3,22-3,26 (м, 2H), 2,63-2,68 (м, 2H), 2,08 (с, 6H), 1,65 (с, 6H), 1,25 (д, 6H, J=6,0 Гц)
Способом синтеза согласно Примеру 208 синтезировали соединения Примера 209 и Примера 210, и данные для каждого примера являются следующими.
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,54 (с, 1H), 9,95 (ушир.с, 1H), 8,28 (с, 1H), 8,01 (д, 1H, J=8,8 Гц), 7,91 (с, 1H), 7,80 (м, 1H), 7,54 (с, 1H), 7,37 (дд, 1H, J=9,1, 1,9 Гц), 7,06 (с, 1H), 6,78 (с, 1H), 6,74 (с, 1H), 6,72 (с, 1H), 4,61~4,67 (м, 1H), 3,46~3,48 (м, 4H), 3,29~3,30 (м, 2H), 2,68~2,72 (м, 2H), 2,29~2,30 (м, 4H), 1,65 (с, 6H), 1,25 (д, 6H, J=6,0 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,54 (с, 1H), 9,98 (ушир.с, 1H), 8,28 (с, 1H), 8,02 (д, 1H, J=8,6 Гц), 7,96 (ушир.с, 1H), 7,91 (с, 1H), 7,80 (с, 1H), 7,55 (с, 1H), 7,37 (д, 1H, J=8,4 Гц), 7,05 (с, 1H), 6,78 (с, 1H), 6,74 (с, 1H), 6,72 (с, 1H), 4,61~4,67 (м, 1H), 3,26~3,30 (м, 2H), 2,88~2,92 (м, 2H), 2,47 (с, 3H), 1,65 (с, 6H), 1,25 (д, 6H, J=6,0 Гц)
Пример 211) Синтез N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(1,1-диоксидо-1,2-тиазинан-2-ил)бензо[b]тиофен-2-карбоксамида
(a) Синтез N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-((4-хлорбутил)сульфонамидо)бензо[b]тиофен-2-карбоксамида
Процедуру синтеза Примера 195-a повторяли за исключением использования 5-амино-N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)бензо[b]тиофен-2-карбоксамида (50,0 мг, 0,09 ммоль), получая N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-((4-хлорбутил)сульфонамидо)бензо[b]тиофен-2-карбоксамид (46,9 мг, 74 %).
LC/MS ESI (+): 717 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 10,57 (с, 1H), 10,00 (с, 1H), 8,29 (с, 1H), 8,03 (д, 1H, J=3,2 Гц), 7,92 (с, 1H), 7,80 (с, 1H), 7,54 (с, 1H), 7,37 (д, 1H, J=8,8 Гц), 7,06 (с, 1H), 6,79 (с, 1H), 6,73 (д, 2H, J=6,0 Гц), 4,63-4,66 (м, 1H), 3,63-3,65 (м, 2H), 3,17-3,20 (м, 2H), 1,81 (м, 4H), 1,65 (с, 6H), 1,25 (д, 6H, J=5,6 Гц)
(b) Синтез N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(1,1-диоксидо-1,2-тиазинан-2-ил)бензо[b]тиофен-2-карбоксамида
N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-((4-хлорбутил)сульфонамидо)бензо[b]тиофен-2-карбоксамид (43,0 мг, 0,06 ммоль) и K2CO3 (16,6 мг, 0,12 ммоль) растворяли в безводном DMF (1,2 мл) с последующим нагреванием при 50°C в течение 13 часов. Реакционную смесь экстрагировали EtOAc, промывали солевым раствором, высушивали над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (амин силикагель, CH2Cl2 : MeOH = 20:1), получая N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(1,1-диоксидо-1,2-тиазинан-2-ил)бензо[b]тиофен-2-карбоксамид (33,5 мг, 82 %) в форме твердого вещества белого цвета.
LC/MS ESI (+): 681 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,68 (с, 1H), 8,32 (с, 1H), 8,08 (д, 1H, J=8,7 Гц), 7,94 (с, 1H), 7,92 (с, 1H), 7,54 (с, 1H), 7,47 (д, 1H, J=9,0 Гц), 7,07 (с, 1H), 6,79 (с, 1H), 6,73 (м, 2H), 4,61-4,67 (м, 1H), 3,74 (м, 2H), 3,35-3,38 (м, 2H), 2,20 (м, 2H), 1,86 (м, 2H), 1,65 (с, 6H), 1,25 (д, 6H, J=5,8 Гц)
Пример 212) Синтез N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(1,1-диоксидоизотиазолидин-2-ил)бензо[b]тиофен-2-карбоксамида
Процедуру синтеза Примера 211 повторяли за исключением использования 5-амино-N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)бензо[b]тиофен-2-карбоксамида (50,0 мг, 0,09 ммоль), получая N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(1,1-диоксидоизотиазолидин-2-ил)бензо[b]тиофен-2-карбоксамид (36,0 мг, 68 %).
LC/MS ESI (+): 667 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,64 (с, 1H), 8,29 (с, 1H), 8,08 (д, 1H, J=9,0 Гц), 7,91 (с, 1H), 7,74 (с, 1H), 7,54 (с, 1H), 7,48 (д, 1H, J=8,8 Гц), 7,06 (с, 1H), 6,79 (с, 1H), 6,72-6,74 (м, 2H), 4,61-4,67 (м, 1H), 3,85 (м, 2H), 3,57 (м, 2H), 2,44-2,47 (м, 2H), 1,65 (с, 6H), 1,25 (д, 6H, J=5,8 Гц)
Пример 213) Синтез N-(3-йод-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
(a) Синтез 1-йод-3-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)-5-нитробензола
1-бром-3-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)-5-нитробензол (370,0 мг, 0,85 ммоль), NaI (255,0 мг, 1,70 ммоль), CuI (8,1 мг, 0,04 ммоль), и транс-N,N’-диметилциклогексан-1,2-диамин (13,4 мкл, 0,09 ммоль) растворяли в 1,4-диоксане (2,0 мл) с последующим нагреванием с обратным холодильником при 110°C в течение ночи. Насыщ. водный раствор NaHCO3 добавляли, чтобы остановить реакцию, и реакционную смесь экстрагировали EtOAc, промывали солевым раствором, высушивали над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 4:1), получая 1-йод-3-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)-5-нитробензол (362,0 мг, 88 %) в форме желтой жидкости.
1H-ЯМР (400 МГц, CDCl3): δ 8,41 (с, 1H), 8,05 (с, 1H), 7,82 (с, 1H), 6,64 (с, 2H), 6,62 (с, 1H), 3,78 (с, 3H), 1,68 (с, 6H)
(b) Синтез 3-(2-(3-йод-5-нитрофенил)пропан-2-ил)-5-(трифторметокси)фенола
Процедуру синтеза Промежуточного соединения 41 повторяли за исключением использования 1-йод-3-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)-5-нитробензола (360,0 мг, 0,75 ммоль), получая 3-(2-(3-йод-5-нитрофенил)пропан-2-ил)-5-(трифторметокси)фенол (279,0 мг, 80 %).
1H-ЯМР (400 МГц, CDCl3): δ 8,41 (с, 1H), 8,05 (с, 1H), 7,82 (с, 1H), 6,62 (д, 2H, J=6,0 Гц), 6,55 (с, 1H), 5,05 (с, 1H), 1,68 (с, 6H)
(c) Синтез 1-йод-3-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)-5-нитробензола
Процедуру синтеза Промежуточного соединения 42 повторяли за исключением использования 3-(2-(3-йод-5-нитрофенил)пропан-2-ил)-5-(трифторметокси)фенола (279,0 мг, 0,60 ммоль), получая 1-йод-3-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)-5-нитробензол (286,0 мг, 94 %).
1H-ЯМР (400 МГц, CDCl3): δ 8,40 (с, 1H), 8,05 (с, 1H), 7,83 (с, 1H), 6,59-6,61 (м, 3H), 4,45-4,51 (м, 1H), 1,68 (с, 6H), 1,32 (д, 6H, J=6,4 Гц)
(d) Синтез 3-йод-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)анилина
Процедуру синтеза Промежуточного соединения 40 повторяли за исключением использования 1-йод-3-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)-5-нитробензола (260,0 мг, 0,51 ммоль), получая 3-йод-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)анилин (247,0 мг, колич.).
1H-ЯМР (400 МГц, CDCl3): δ 6,97 (с, 1H), 6,88 (с, 1H), 6,63 (с, 2H), 6,56 (с, 1H), 6,39 (с, 1H), 4,45-4,48 (м, 1H), 3,59 (с, 2H), 1,57 (с, 6H), 1,27 (д, 6H, J=6,4 Гц)
(e) Синтез N-(3-йод-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
Процедуру синтеза Примера 1 повторяли за исключением использования 3-йод-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)анилина (211,0 мг, 0,43 ммоль), получая N-(3-йод-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (200,0 мг, 64 %).
LC/MS ESI (+): 733 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,49 (с, 1H), 9,88 (ушир.с, 1H), 8,28 (с, 1H), 8,20 (с, 1H), 8,03 (д, 1H, J=8,8 Гц), 7,80 (с, 1H), 7,62 (с, 1H), 7,37 (д, 1H, J=8,6 Гц), 7,34 (с, 1H), 6,78 (с, 1H), 6,72 (с, 1H), 6,71 (с, 1H), 4,61-4,67 (м, 1H), 3,02 (с, 3H), 1,63 (с, 6H), 1,25 (д, 6H, J=5,7 Гц)
Пример 214) Синтез 3-йод-N-(3-йод-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
(a) Синтез N-(3-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)-5-(триметилстаннил)фенил-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
N-(3-йод-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (Пример 213) (20,0 мг, 0,03 ммоль), (SnMe3)2 (11,0 мг, 0,03 ммоль) и Pd(PPh3)4 (3,1 мг, 3,0 мкМ) растворяли в толуоле (1,0 мл) с последующим нагреванием при 105°C в течение 1 часа и 30 минут. Реакционную смесь концентрировали при пониженном давлении, и остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 2:1), получая N-(3-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)-5-(триметилстаннил)фенил-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (19,8 мг, 95 %) в форме твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3): δ 7,87 (д, 1H, J=7,6 Гц), 7,83 (с, 1H), 7,79 (с, 1H), 7,71 (с, 1H), 7,65 (с, 1H), 7,40 (с, 1H), 7,28 (д, 1H, J=8,8 Гц), 7,10 (с, 1H), 6,70 (с, 1H), 6,67 (с, 1H), 6,58 (с, 1H), 6,40 (с, 1H), 4,44-4,51 (м, 1H), 3,04 (с, 3H), 1,60 (с, 6H), 1,31 (д, 6H, J=6,0 Гц), 0,28 (т, 9H, J=27,2 Гц)
(b) Синтез 3-йод-N-(3-йод-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
N-(3-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)-5-(триметилстаннил)фенил-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (17,4 мг, 0,02 ммоль), NaI (17,2 мг, 0,12 ммоль), N-хлорсукцинимид (24,6 мг, 0,18 ммоль) и AcOH (5,0 мкл) растворяли в MeOH (0,5 мл) с последующим перемешиванием при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (амин силикагель, CH2Cl2 : MeOH = 20:1), получая 3-йод-N-(3-йод-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (1,4 мг, 7 %) в форме твердого вещества белого цвета.
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,66 (с, 1H), 9,71 (с, 1H), 8,48 (с, 1H), 8,19 (с, 1H), 8,03 (м, 1H), 7,64 (с, 1H), 7,57 (д, 1H, J=8,9 Гц), 7,33 (с, 1H), 6,77 (с, 1H), 6,71 (м, 2H), 4,60-4,66 (м, 1H), 3,05 (с, 3H), 1,63 (с, 6H), 1,24 (д, 6H, J=5,9 Гц)
Пример 215 и Пример 216) Синтез N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-фтор-5-(N-метилметилсульфонамидо)бензо[b]тиофен-2-карбоксамида и N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-фтор-N-метил-5-(N-метилметилсульфонамидо)бензо[b]тиофен-2-карбоксамида
N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-фтор-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (Пример 84) (30,0 мг, 0,05 ммоль), CH3I (8,4 мкл, 0,14 ммоль) и K2CO3 (12,6 мг, 0,09 ммоль) растворяли в безводном DMF (1,0 мл) с последующим перемешиванием при комнатной температуре в течение 14 часов. Реакционную смесь экстрагировали EtOAc, промывали солевым раствором, высушивали над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 1:1) получить твердые соединения белого цвета N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-фтор-5-(N-метилметилсульфонамидо)бензо[b]тиофен-2-карбоксамид (20,2 мг, 66 %) и N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-фтор-N-метил-5-(N-метилметилсульфонамидо)бензо[b]тиофен-2-карбоксамид (10,6 мг, 34 %).
Пример 215)
LC/MS ESI (+): 673 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,70 (с, 1H), 8,31 (с, 1H), 8,20 (д, 1H, J=7,4 Гц), 8,16 (д, 1H, J=10,5 Гц), 7,90 (м, 1H), 7,53 (с, 1H), 7,07 (м, 1H), 6,79 (с, 1H), 6,74 (м, 1H), 6,72 (с, 1H), 4,61-4,67 (м, 1H), 3,29 (с, 3H), 3,14 (с, 3H), 1,65 (с, 6H), 1,25 (д, 6H, J=6,0 Гц)
Пример 216)
LC/MS ESI (+): 687 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 7,97 (д, 1H, J=7,4 Гц), 7,92 (д, 1H, J=10,5 Гц), 7,49 (м, 1H), 7,31 (м, 1H), 7,21 (м, 2H), 6,76 (м, 1H), 6,69 (с, 1H), 6,61 (с, 1H), 4,57-4,63 (м, 1H), 3,36 (с, 3H), 3,23 (с, 3H), 3,08 (с, 3H), 1,55 (с, 6H), 1,21 (д, 6H, J=6,0 Гц)
Способом синтеза согласно Примерам 215 и 216 синтезировали соединения с Примера 217 по Пример 221, и данные для каждого примера являются следующими.
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,69 (с, 1H), 8,32 (с, 1H), 8,18 (д, 1H, J=7,3 Гц), 8,14 (д, 1H, J=10,2 Гц), 7,90 (м, 1H), 7,53 (с, 1H), 7,07 (м, 1H), 6,79 (с, 1H), 6,74 (м, 1H), 6,72 (с, 1H), 4,61~4,67 (м, 1H), 3,75 (м, 2H), 3,42 (м, 4H), 3,19 (с, 3H), 2,40~2,43 (м, 2H), 2,30 (м, 4H), 1,65 (с, 6H), 1,25 (д, 6H, J=6,0 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 7,97~7,99 (м, 1H), 7,92 (д, 1H, J=10,3 Гц), 7,54 (с, 1H), 7,38 (с, 1H), 7,16 (с, 1H), 7,04 (с, 1H), 6,71 (с, 2H), 6,59 (с, 1H), 4,59 (м, 1H), 3,94 (ушир.с, 2H), 3,68 (с, 2H), 3,41 (м, 8H), 3,13 (с, 3H), 2,34 (с, 4H), 2,25 (с, 8H), 1,50 (с, 6H), 1,21 (м, 6H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,70 (с, 1H), 8,31 (с, 1H), 8,14~8,17 (м, 2H), 7,90 (м, 1H), 7,52 (с, 1H), 7,06 (м, 1H), 6,78 (с, 1H), 6,72 (м, 1H), 6,71 (с, 1H), 4,60~4,66 (м, 1H), 3,69~3,71 (м, 2H), 3,16 (с, 3H), 2,29~2,32 (м, 2H), 2,10 (с, 6H), 1,64 (с, 6H), 1,23 (д, 6H, J=6,0 Гц)
1H-ЯМР(400 МГц, ДМСО-d6);
d 10,71 (с, 1H), 8,30 (с, 1H), 8,10 (д, 1H, J=8,7 Гц), 8,03 (д, 1H, J=2,0 Гц), 7,76 (т, 1H, J=1,8 Гц), 7,56 (дд, 1H, J=8,7, 2,1 Гц), 7,51 (д, 2H, J=8,9 Гц), 7,36 (т, 1H, J=2,0 Гц), 7,18 (д, 2H, J=8,9 Гц), 6,93 (т, 1H, J=2,0 Гц), 3,32 (с, 3H), 2,99 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,65 (с, 1H), 8,32 (с, 1H), 8,11 (д, 1H, J=8,7 Гц), 8,03 (д, 1H, J=2,0 Гц), 7,89 (т, 1H, J=1,8 Гц), 7,56 (дд, 1H, J=8,7, 2,1 Гц), 7,51 (с, 1H), 7,38 (д, 2H, J=8,7 Гц), 7,28 (д, 2H, J=8,7 Гц), 7,05 (с, 1H), 3,33 (с, 3H), 3,00 (с, 3H), 1,65 (с, 6H)
Пример 222 и Пример 223) Синтез N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид 1,1-диоксида и N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид 1-оксида
N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (Пример 68) (10,0 мг, 0,02 ммоль) и mCPBA (10,8 мг, 0,05 ммоль) растворяли в CH2Cl2 (1,0 мл) с последующим перемешиванием при комнатной температуре в течение 7 часов. Реакционную смесь экстрагировали CH2Cl2, промывали насыщ. водным раствором NaHCO3 и солевым раствором, высушивали над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 1:1), получая твердые соединения белого цвета N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид 1,1-диоксид (1,2 мг, 11 %) и N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид 1-оксид (0,7 мг, 7 %).
Пример 222)
LC/MS ESI (+): 673 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,61 (ушир.с, 1H), 10,53 (с, 1H), 8,32 (с, 1H), 7,87 (д, 1H, J=8,3 Гц), 7,81 (м, 1H), 7,50 (м, 1H), 7,39-7,41 (м, 2H), 7,08 (м, 1H), 6,77 (с, 1H), 6,71 (м, 1H), 6,70 (с, 1H), 4,60-4,66 (м, 1H), 3,15 (с, 3H), 1,63 (с, 6H), 1,23 (д, 6H, J=6,0 Гц)
Пример 223)
LC/MS ESI (+): 657 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,64 (с, 1H), 10,43 (ушир.с, 1H), 8,11 (с, 1H), 7,98 (д, 1H, J=8,2 Гц), 7,84 (м, 1H), 7,57 (м, 1H), 7,44 (с, 1H), 7,36 (дд, 1H, J=8,3, 1,6 Гц), 7,07 (с, 1H), 6,77 (с, 1H), 6,70-6,72 (м, 2H), 4,60-4,66 (м, 1H), 3,12 (с, 3H), 1,63 (с, 6H), 1,23 (д, 6H, J=5,9 Гц)
Пример 224) Синтез N-(3-(2-(3-Цианофенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
(a) Синтез 3-(3-метоксибензоил)бензонитрила
В 3-метоксибензоил хлориде (540,0 мг, 3,16 ммоль) и Pd2dba3∙CHCl3 (164,0 мг, 0,16 ммоль) раствор 0,5 М йодида (3-Цианофенил)цинка (II) в THF (6,3 мл, 6,30 ммоль) добавляли при 0°C. Смесь перемешивали при комнатной температуре в течение 3 часов и добавляли насыщ. водный раствор NH4Cl (15,0 мл), с последующей экстракцией CH2Cl2, Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 4:1), получая 3-(3-метоксибензоил)бензонитрил (450,0 мг, 57 %) в форме твердого вещества белого цвета.
1H-ЯМР (300 МГц, CDCl3): δ 8,08 (с, 1H), 8,04 (д, 1H, J=7,8 Гц), 7,87 (д, 1H, J=7,8 Гц), 7,84 (т, 1H, J=7,8 Гц), 7,42 (т, 1H, J=7,8 Гц), 7,34 (с, 1H), 7,28 (д, 1H, J=7,8 Гц), 7,19 (д, 1H, J=8,2 Гц), 3,88 (с, 3H)
(b) Синтез 3-(2-(3-метоксифенил)пропан-2-ил)бензонитрила
3-(3-Метоксибензоил)бензонитрил (350,0 мг, 1,47 ммоль) растворяли в дибромэтане (10,0 мл) и добавляли PCl5 (1,5 г, 6,96 ммоль). Реакционную смесь перемешивали при 110°C в течение 7 часов, добавляли воду со льдом и экстрагировали CH2Cl2, Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (амин силикагель, н-гексан : EtOAc = 1:4), получая 3-(дихлор(3-метоксифенил)метил)бензонитрил (258,0 мг) в форме желтого масла. CH2Cl2 (9,0 мл) охлаждали до -40°C и добавляли раствор 1,0 М TiCl4 в CH2Cl2 (0,2 мл, 0,17 ммоль) и раствор 1,0 М диметилцинка в н-гептане (2,6 мл, 2,64 ммоль). После перемешивания в течение 30 минут отделенный 3-(дихлор(3-метоксифенил)метил)бензонитрил (258,0 мг, 0,88 ммоль) растворенный в CH2Cl2 (2,2 мл), добавляли при -40°C. После перемешивания при 0°C в течение 2 часов, реакционную смесь экстрагировали CH2Cl2, Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 4:1), получая 3-(2-(3-метоксифенил)пропан-2-ил)бензонитрил (156,0 мг, 42 %) в форме бесцветного масла.
1H-ЯМР (300 МГц, CDCl3): δ 7,53 (с, 1H), 7,43-7,48 (м, 2H), 7,35 (т, 1H, J=7,5 Гц), 7,22 (т, 1H, J=7,6 Гц), 6,74-6,77 (м, 3H), 3,78 (с, 3H), 1,67 (с, 6H)
(c) Синтез 3-(2-(3-гидроксифенил)пропан-2-ил)бензонитрила
3-(2-(3-Метоксифенил)пропан-2-ил)бензонитрил (156,0 мг, 0,62 ммоль) растворяли в CH2Cl2 (6,0 мл), и раствор 1,0 М BBr3 в CH2Cl2 (1,9 мл, 1,86 ммоль) медленно добавляли при 0°C. Реакционную смесь нагревали до комнатной температуры с последующим перемешиванием в течение 1 часа, и реакционную смесь экстрагировали CH2Cl2, Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (амин силикагель, н-гексан : EtOAc = 4:6), получая 3-(2-(3-гидроксифенил)пропан-2-ил)бензонитрил (90,0 мг, 61 %) в форме бесцветного масла.
1H-ЯМР (300 МГц, CDCl3): δ 7,54 (с, 1H), 7,46 (т, 2H, J=7,3 Гц), 7,36 (т, 1H, J=7,5 Гц), 7,17 (т, 1H, J=7,8 Гц), 6,76 (д, 1H, J=7,8 Гц), 6,65-6,70 (м, 2H), 4,78 (с, 1H), 1,66 (с, 6H)
(d) Синтез 3-(2-(3-Цианофенил)пропан-2-ил)фенил трифторметансульфоната
3-(2-(3-гидроксифенил)пропан-2-ил)бензонитрил (90,0 мг, 0,38 ммоль) растворяли в CH2Cl2 (4,0 мл), и Tf2O (96,0 мкл, 0,57 ммоль) добавляли при 0°C. Реакционную смесь нагревали до комнатной температуры с последующим перемешиванием в течение 3 часов, и реакционную смесь экстрагировали CH2Cl2, Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (амин силикагель, н-гексан : EtOAc = 4:1), получая 3-(2-(3-Цианофенил)пропан-2-ил)фенил трифторметансульфонат (110,0 мг, 78 %) в форме бесцветного масла.
1H-ЯМР (300 МГц, CDCl3): δ 7,48-7,54 (м, 2H), 7,35-7,43 (м, 3H), 7,19 (д, 1H, J=7,9 Гц), 7,14 (д, 1H, J=8,2 Гц), 7,08 (т, 1H, J=2,0 Гц), 1,70 (с, 6H)
(e) Синтез 3-(2-(3-аминофенил)пропан-2-ил)бензонитрила
3-(2-(3-Цианофенил)пропан-2-ил)фенил трифторметансульфонат (110,0 мг, 0,30 ммоль) растворяли в безводном THF (12,0 мл) и добавляли Pd2(dba)3 (32,0 мг, 0,03 ммоль), rac-биNAP (28,0 мг, 0,05 ммоль) и бензофенонимин (60,0 мкл, 0,36 ммоль). Смесь нагревали с обратным холодильником при 100°C в течение 5 часов. Реакционную смесь охлаждали до комнатной температуры. Реакционную смесь экстрагировали CH2Cl2, промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток растворяли в безводном THF (12,0 мл) и добавляли 2н. водный раствор HCl (1,6 мл, 3,00 ммоль). Смесь перемешивали при комнатной температуре в течение 5 часов, и реакционную смесь экстрагировали CH2Cl2, Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (амин силикагель, н-гексан : EtOAc = 4:1), получая 3-(2-(3-аминофенил)пропан-2-ил)бензонитрил (30,0 мг, 42 %) в форме желтого масла.
LC/MS ESI (+): 237 (M+1)
1H-ЯМР (300 МГц, CDCl3): δ 7,54 (т, 1H, J=1,5 Гц), 7,43-7,48 (м, 2H), 7,34 (т, 1H, J=7,5 Гц), 7,08 (т, 1H, J=7,6 Гц), 6,59 (д, 1H, J=7,7 Гц), 6,54 (д, 1H, J=8,0 Гц), 6,48 (т, 1H, J=2,0 Гц), 3,61 (ушир.с, 2H), 1,64 (с, 6H)
(f) Синтез N-(3-(2-(3-Цианофенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
5-(метилсульфонамидо)бензо[b]тиофен-2-карбоновую кислоту (36,0 мг, 0,13 ммоль), 3-(2-(3-аминофенил)пропан-2-ил)бензонитрил (30,0 мг, 0,13 ммоль) и HATU (53,0 мг, 0,14 ммоль) растворяли в безводном DMF (1,3 мл) и добавляли DIPEA (44,0 мкл, 0,24 ммоль). Смесь перемешивали при 40°C в течение 3 часов, и реакционную смесь экстрагировали CH2Cl2, Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (амин силикагель, CH2Cl2 : MeOH = 95:5), получая N-(3-(2-(3-Цианофенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (35,0 мг, 56 %) в форме твердого вещества белого цвета.
LC/MS ESI (+): 490 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,40 (с, 1H), 9,87 (с, 1H), 8,28 (с, 1H), 8,01 (д, 1H, J=9,2 Гц), 7,67-7,78 (м, 4H), 7,59 (с, 1H), 7,47-7,55 (м, 2H), 7,28-7,36 (м, 2H), 7,00 (д, 1H, J=8,4 Гц), 3,00 (с, 3H), 1,66 (с, 6H)
Пример 225) Синтез N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-нитро-1H-индол-2-карбоксамида
(a) Синтез 2’,4’-дифтор-[1,1’-бифенил]-3-амина
3-броманилин (2,0 г, 11,60 ммоль), (2,4-дифторфенил)бороновую кислоту (1,9 г, 12,20 ммоль), Pd(PPh3)4 (1,3 г, 1,16 ммоль) и Na2CO3 (3,7 г, 34,90 ммоль) растворяли в смеси DME/H2O (150,0 мл, 4/1 об./об.) с последующим перемешиванием при 85°C в течение 4 часов. Реакционную смесь охлаждали до комнатной температуры и экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 2:1), получая 2’,4’-дифтор-[1,1’-бифенил]-3-амин (1,6 г, 67 %) в форме бесцветного масла.
LC/MS ESI (+): 206 (M+1)
1H-ЯМР (300 МГц, CDCl3): δ 7,36-7,42 (м, 1H), 7,22 (т, 1H, J=7,8 Гц), 6,82-6,96 (м, 3H), 6,81 (д, 1H, J=1,7 Гц), 6,69 (д, 1H, J=8,0 Гц), 3,68 (ушир.с, 2H)
(b) Синтез N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-нитро-1H-индол-2-карбоксамида
6-нитро-1H-индол-2-карбоновую кислоту (100,0 мг, 0,49 ммоль), 2’,4’-дифтор-[1,1’-бифенил]-3-амин (109,0 мг, 0,53 ммоль), EDC (186,0 мг, 0,97 ммоль), HOBt (131,0 мг, 0,97 ммоль) и DIPEA (422,0 мкл, 2,43 ммоль) растворяли в безводном DMF (4,0 мл) с последующим перемешиванием при 10°C в течение 24 часов. Реакционную смесь экстрагировали EtOAc, и органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 2:1), получая N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-нитро-1H-индол-2-карбоксамид (110,0 мг, 58 %) в форме твердого вещества желтого цвета.
LC/MS ESI (+): 394 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 12,50 (ушир.с, 1H), 10,70 (с, 1H), 8,38 (с, 1H), 8,02 (д, 1H, J=1,5 Гц), 7,91-7,94 (м, 3H), 7,57-7,65 (м, 2H), 7,51 (т, 1H, J=7,8 Гц), 7,37-7,44 (м, 1H), 7,20-7,31 (м, 2H)
Способом синтеза согласно Примеру 225 синтезировали соединения с Примера 226 по Пример 246, и данные каждого примера иллюстрированы следующим образом.
1H-ЯМР (300 МГц, ДМСО-d6): δ 12,50 (ушир.с, 1H), 10,61 (ушир.с, 1H), 8,37 (с, 1H), 7,85~7,93 (м, 5H), 7,76 (т, 1H, J=7,4 Гц), 7,64 (т, 1H, J=7,4 Гц), 7,59 (с, 1H), 7,10~7,47 (м, 2H), 7,09 (д, 1H, J=7,6 Гц)
1H-ЯМР (300 МГц, ДМСО-d6): δ 12,50 (с, 1H), 10,61 (с, 1H), 8,79 (с, 1H), 8,11 (дд, 1H, J=9,0, 2,3 Гц), 7,84~7,91 (м, 3H), 7,76 (т, 2H, J=7,4 Гц), 7,64 (т, 1H, J=7,8 Гц), 7,62 (д, 1H, J=9,2 Гц), 7,44~7,49 (м, 2H), 7,08 (д, 1H, J=7,6 Гц)
1H-ЯМР (300 МГц, ДМСО-d6): δ 12,39 (ушир.с, 1H), 10,25 (с, 1H), 8,67 (д, 1H, J=2,3 Гц), 8,11 (дд, 1H, J=9,2, 2,3 Гц), 7,85 (д, 1H, J=7,3 Гц), 7,72~7,87 (м, 3H), 7,64 (д, 1H, J=6,5 Гц), 7,58 (д, 1H, J=9,2 Гц), 7,43~7,48 (м, 2H), 7,08 (д, 1H, J=8,0 Гц), 2,60 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 8,83 (с, 1H), 7,75 (дд, 1H, J=8,1, 2,1 Гц), 7,64 (дд, 1H, J=8,1, 1,2 Гц), 7,61 (д, 1H, J=2,1 Гц), 7,56 (с, 1H), 7,22~7,47 (м, 5H), 7,07 (д, 1H, J=7,2 Гц), 4,59~4,70 (м, 2H), 3,71 (дд, 1H, J=18,3, 10,8 Гц), 3,28 (м, 1H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 8,82 (с, 1H), 7,31~7,78 (м, 9H), 7,23 (с, 1H), 7,10 (д, 1H, J=2,1 Гц), 4,59~4,70 (м, 2H), 3,71 (дд, 1H, J=17,7, 10,5 Гц), 3,28 (дд, 1H, J=17,7, 8,1 Гц)
1H-ЯМР (300 МГц, ДМСО-d6): δ 8,85 (с, 1H), 7,76 (дд, 1H, J=8,1, 1,8 Гц), 7,72 (д, 1H, J=1,5 Гц), 7,63~7,65 (м, 2H), 7,40 (т, 2H, J=7,8 Гц), 7,29 (с, 1H), 7,24 (с, 1H), 6,87~6,98 (м, 2H), 4,62~4,73 (м, 2H), 3,72 (дд, 1H, J=17,7, 10,8 Гц), 3,28 (дд, 1H, J=17,7, 8,4 Гц)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,41 (с, 1H), 9,34 (с, 1H), 8,38~8,44 (м, 2H), 7,96~8,00 (м, 2H), 7,86 (д, 1H, J=7,2 Гц), 7,65~7,76 (м, 2H), 7,43~7,50 (м, 2H), 7,13 (д, 1H, J=8,1 Гц)
1H-ЯМР (300 МГц, ДМСО-d6): δ 14,11 (ушир.с, 1H), 11,19 (с, 1H), 8,56 (с, 1H), 8,22 (дд, 1H, J=9,0, 2,2 Гц), 8,14 (с, 1H), 7,98 (д, 1H, J=8,0 Гц), 7,84 (д, 1H, J=9,0 Гц), 7,60 (м, 1H), 7,50 (т, 1H, J=7,9 Гц), 7,40 (м, 1H), 7,31 (д, 1H, J=8,1 Гц), 7,24 (дт, 1H, J=8,6, 2,4 Гц)
1H-ЯМР (300 МГц, ДМСО-d6): δ 14,07 (ушир.с, 1H), 11,19 (с, 1H), 8,55 (с, 1H), 8,21 (дд, 1H, J=9,1, 2,2 Гц), 7,96~8,02 (м, 2H), 7,82~7,87 (м, 2H), 7,75 (т, 1H, J=7,3 Гц), 7,64 (т, 1H, J=7,4 Гц), 7,43~7,49 (м, 2H), 7,10 (д, 1H, J=7,6 Гц)
1H-ЯМР (300 МГц, ДМСО-d6): δ 14,12 (ушир.с, 1H), 11,27 (с, 1H), 8,59 (ушир.с, 1H), 8,24 (д, 1H, J=8,8 Гц), 7,95~8,04 (м, 2H), 7,75~7,91 (м, 2H), 7,64 (дт, 1H, J=8,4, 2,3 Гц), 7,44~7,54 (м, 2H), 7,10 (д, 1H, J = 7,3 Гц)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,62 (с, 1H), 10,27 (с, 1H), 8,83 (с, 1H), 7,97 (с, 1H), 7,88 (д, 1H, J=8,0 Гц), 7,56~7,64 (м, 1H), 7,47 (т, 1H, J=8,4 Гц), 7,40~7,44 (м, 2H), 7,36 (с, 1H), 7,19~7,25 (м, 3H), 3,86 (с, 3H), 2,92 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,59 (с, 1H), 9,89 (ушир.с, 1H), 8,35 (с, 1H), 8,03 (д, 2H, J=8,8 Гц), 7,81~7,84 (м, 2H), 7,20~7,65 (м, 6H), 3,03 (с, 3H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 10,64 (с, 1H), 9,76 (ушир.с, 1H), 8,02 (ушир.с, 1H), 7,86 (м, 1H), 7,20~7,76 (м, 9H), 2,97 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 12,04 (с, 1H), 10,43 (с, 1H), 7,98 (с, 1H), 7,89 (д, 1H, J=8,0 Гц), 7,74 (с, 1H), 7,47~7,65 (м, 4H), 7,36~7,40 (м, 1H), 7,20~7,28 (м, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 12,40 (с, 1H), 10,54 (с, 1H), 8,03 (с, 1H), 7,99 (с, 1H), 7,96 (д, 1H, J=8,8 Гц), 7,90 (дд, 1H, J=8,0, 1,9 Гц), 7,57~7,65 (м, 3H), 7,51 (т, 1H, J=8,0 Гц), 7,37~7,44 (м, 1H), 7,20~7,30 (м, 2H), 3,21 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,44 (с, 1H), 9,88 (с, 1H), 8,02 (д, 1H, J=8,8 Гц), 7,93 (с, 1H), 7,75 (д, 1H, J=8,0 Гц), 7,70 (д, 1H, J=1,9 Гц), 7,55~7,63 (м, 1H), 7,48 (т, 1H, J=8,0 Гц), 7,36~7,43 (м, 2H), 7,29 (д, 1H, J=7,6 Гц), 7,19~7,26 (м, 1H), 3,01 (с, 3H), 2,58 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,58 (с, 1H), 10,07 (с, 1H), 8,33 (с, 1H), 7,96~7,98 (м, 2H), 7,80~7,83 (м, 2H), 7,56~7,64 (м, 1H), 7,49 (т, 1H, J=8,0 Гц), 7,36~7,44 (м, 1H), 7,19~7,33 (м, 3H), 3,08 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,44 (с, 1H), 9,88 (с, 1H), 8,02 (д, 1H, J=8,8 Гц), 7,93 (с, 1H), 7,75 (д, 1H, J=8,4 Гц), 7,70 (д, 1H, J=1,9 Гц), 7,55~7,63 (м, 1H), 7,48 (т, 1H, J=8,0 Гц), 7,35~7,43 (м, 2H), 7,29 (д, 1H, J=8,0 Гц), 7,19~7,26 (м, 1H), 3,02 (с, 3H), 2,58 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 12,50 (с, 1H), 10,61 (с, 1H), 8,38 (с, 1H), 7,85~7,97 (м, 4H), 7,88 (дд, 1H, J=9,5, 2,7 Гц), 7,61~7,68 (м, 2H), 7,55 (д, 1H, J=5,7 Гц), 7,48 (т, 1H, J=7,8 Гц), 7,09 (д, 1H, J=7,4 Гц)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,73 (с, 1H), 10,47 (с, 1H), 9,63 (ушир.с, 1H), 8,43 (т, 1H, J=1,7 Гц), 8,31 (м, 1H), 7,82 (м, 1H), 7,63~7,74 (м, 2H), 7,40~7,48 (м, 3H), 7,27 (дт, 1H, J=8,6, 2,4 Гц), 6,99 (дд, 1H, J=8,6, 2,0 Гц), 2,94 (с, 3H), 2,65 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 13,16 (с, 1H), 11,75 (с, 1H), 10,36 (с, 1H), 9,61 (ушир.с, 1H), 8,36 (с, 1H), 7,86 (с, 1H), 7,63~7,75 (м, 2H), 7,41~7,54 (м, 4H), 7,29 (дт, 1H, J=8,4, 2,7 Гц), 6,99 (дд, 1H, J=8,6, 1,7 Гц), 2,95 (с, 3H)
Пример 247) Синтез N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-1-метил-6-нитро-1H-индол-2-карбоксамида
N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-нитро-1H-индол-2-карбоксамид (266,0 мг, 0,68 ммоль) растворяли в безводном DMF (6,0 мл) и добавляли K2CO3 (207,0 мг, 1,50 ммоль) и CH3I (47,0 мкл, 0,75 ммоль) с последующим перемешиванием при комнатной температуре в течение 3 часов. Реакционную смесь экстрагировали EtOAc, и органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток перекристаллизовывали со смесью EtOAc/i-PR2O/MeOH и фильтровали, получая N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-1-метил-6-нитро-1H-индол-2-карбоксамид (163,0 мг, 59 %) в форме твердого вещества желтого цвета.
LC/MS ESI (+): 408 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,70 (с, 1H), 8,63 (с, 1H), 7,92-8,02 (м, 3H), 7,83 (м, 1H), 7,55-7,64 (м, 1H), 7,37-7,52 (м, 3H), 7,21-7,31 (м, 2H), 4,13 (с, 3H)
Пример 248) Синтез N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-1-метил-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
(a) Синтез 6-амино-N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-1-метил-1H-индол-2-карбоксамида
N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-1-метил-6-нитро-1H-индол-2-карбоксамид (Пример 247) (150,0 мг, 0,37 ммоль) растворяли в смеси MeOH/H2O (4,0 мл, 9/1 об./об.) и добавляли Zn (242,0 мг, 3,70 ммоль) и NH4Cl (60,0 мг, 1,12 ммоль) и обрабатывали ультразвуком при 40°C в течение 2 часов. Реакционную смесь фильтровали через Целит и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (амин силикагель, EtOAc: н-гексан = 30:70), получая 6-амино-N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-1-метил-1H-индол-2-карбоксамид (40,0 мг, 29 %) в форме твердого вещества серого цвета.
LC/MS ESI (+): 378 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,13 (с, 1H), 7,98 (с, 1H), 7,79 (д, 1H, J=5,4 Гц), 7,58 (т, 1H, J=2,4 Гц), 7,32-7,45 (м, 3H), 7,20-7,22 (м, 2H), 6,90 (ушир.с, 1H), 6,51 (м, 2H), 5,22 (ушир.с, 2H), 3,85 (с, 3H)
(b) Синтез N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-1-метил-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
6-амино-N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-1-метил-1H-индол-2-карбоксамид (40,0 мг, 0,11 ммоль) растворяли в пиридине (2,0 мл) и метансульфонил хлорид (9,4 мкл, 0,12 ммоль) медленно добавляли при 0°C. Реакционную смесь нагревали до комнатной температуры с последующим перемешиванием в течение 15 часов, и реакционную смесь экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (амин силикагель, EtOAc : н-гексан = 60:40), получая N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-1-метил-6-(метилсульфонамидо)-1H-индол-2-карбоксамид (23,4 мг, 47 %) в форме твердого вещества белого цвета.
LC/MS ESI (+): 456 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,40 (с, 1H), 9,74 (с, 1H), 8,00 (м, 1H), 7,83 (м, 1H), 7,66 (д, 1H, J=8,4 Гц), 7,55-7,61 (м, 1H), 7,33-7,49 (м, 4H), 7,22-7,26 (м, 2H), 7,03 (дд, 1H, J=8,4, 1,5 Гц), 3,97 (с, 3H), 2,99 (с, 3H)
Способом синтеза согласно Примерам 247 и 248 синтезировали соединения с Примера 249 по Пример 253, и данные для каждого примера являются следующими.
1H-ЯМР (300 МГц, ДМСО-d6): δ 8,42 (с, 1H), 8,07 (дд, 1H, J=9,0, 1,5 Гц), 7,96 (с, 1H), 7,77 (д, 1H, J=7,4 Гц), 7,75 (д, 1H, J=8,8 Гц), 7,70 (д, 1H, J=8,8 Гц), 7,62 (с, 1H), 7,58 (д, 1H, J=7,8 Гц), 7,45 (м, 3H), 7,19 (д, 1H, J=7,3 Гц), 7,08 (с, 1H), 4,18 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 8,66 (д, 1H, J=1,9 Гц), 8,25 (дд, 1H, J=9,2, 2,1 Гц), 7,97 (с, 1H), 7,77 (д, 1H, J=7,6 Гц), 7,70 (дд, 1H, J=8,0, 1,1 Гц), 7,62 (с, 1H), 7,58 (д, 1H, J=7,8 Гц), 7,45 (м, 4H), 7,18 (м, 2H), 4,14 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,69 (с, 1H), 8,66 (д, 1H, J=2,2 Гц), 8,13 (дд, 1H, J=9,2, 2,2 Гц), 7,78~7,86 (м, 5H), 7,63 (т, 1H, J=7,7 Гц), 7,45 (т, 2H, J=7,7 Гц), 7,08 (д, 1H, J=7,4 Гц), 4,55 (т, 2H, J=5,5 Гц), 3,38 (т, 4H, J=4,4 Гц), 2,56 (т, 2H, J=5,9 Гц), 2,51 (с, 3H), 2,31 (т, 4H, J=4,4 Гц)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,76 (с, 1H), 8,66 (д, 1H, J=2,2 Гц), 7,98~8,01 (м, 1H), 7,93 (с, 1H), 7,81~7,90 (м, 4H), 7,78 (т, 1H, J=7,6 Гц), 7,42~7,48 (м, 2H), 7,33 (с, 1H), 7,07 (д, 1H, J=8,4 Гц), 4,80 (т, 2H, J=5,5 Гц), 3,35 (т, 4H, J=4,4 Гц), 2,53~2,58 (м, 2H), 2,27~2,36 (м, 4H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,39 (с, 1H), 9,71 (с, 1H), 7,81~7,87 (м, 3H), 7,74 (т, 1H, J=7,3 Гц), 7,66 (д, 1H, J=8,6 Гц), 7,64 (т, 1H, J=7,4 Гц), 7,40~7,45 (м, 2H), 7,31~7,34 (м, 2H), 7,01~7,06 (м, 2H), 3,95 (с, 3H), 2,99 (с, 3H)
Пример 254) Синтез 2-((2-((2’,4’-дифтор-[1,1’-бифенил]-3-ил)карбамоил)-1H-индол-6-ил)окси)-2-метилпропановой кислоты
(a) Синтез N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-метокси-1H-индол-2-карбоксамида
6-Метокси-1H-индол-2-карбоновую кислоту (69,0 мг, 0,36 ммоль), 2’,4’-дифтор-[1,1’-бифенил]-3-амин (70,0 мг, 0,34 ммоль), HATU (155,0 мг, 0,41 ммоль) и DIPEA (89,0 мкл, 0,51 ммоль) растворяли в безводном DMF (1,0 мл) с последующим перемешиванием при 40°C в течение 12 часов. Реакционную смесь экстрагировали EtOAc, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (амин силикагель, н-гексан : EtOAc = 3:1), получая N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-метокси-1H-индол-2-карбоксамид (118,0 мг, 92 %) в форме твердого вещества грязно-белого цвета.
LC/MS ESI (+): 379 (M+1)
(b) Синтез N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-гидрокси-1H-индол-2-карбоксамида
К раствору N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-метокси-1H-индол-2-карбоксамида (118,0 мг, 0,31 ммоль) в CH2Cl2 раствор 1,0 М BBr3 в CH2Cl2 (3,1 мл, 3,10 ммоль) медленно добавляли при 0°C. Реакционную смесь экстрагировали EtOAc, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 2:1), получая N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-гидрокси-1H-индол-2-карбоксамид (21,0 мг, 19 %) в форме твердого вещества грязно-белого цвета.
LC/MS ESI (+): 365 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,34 (с, 1H), 10,14 (с, 1H), 9,29 (с, 1H), 7,96 (д, 1H, J=1,2 Гц), 7,87 (м, 1H), 7,55-7,64 (м, 1H), 7,33-7,54 (м, 4H), 7,19-7,26 (м, 2H), 6,81 (д, 1H, J=1,8 Гц), 6,60 (дд, 1H, J=8,7, 2,1 Гц)
(c) Синтез этил-2-((2-((2’,4’-дифтор-[1,1’-бифенил]-3-ил)карбамоил)-1H-индол-6-ил)окси)-2-метилпропаноата
N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-гидрокси-1H-индол-2-карбоксамид (30,0 мг, 0,08 ммоль) растворяли в ДМСО (5,0 мл) и добавляли KOH (7,0 мг, 0,12 ммоль) с последующим перемешиванием при комнатной температуре в течение 10 минут. Этил α-бромизобутират (13,2 мкл, 0,09 ммоль) добавляли при комнатной температуре с последующим перемешиванием в течение 12 часов. Реакционную смесь экстрагировали EtOAc, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 2:1), получая этил-2-((2-((2’,4’-дифтор-[1,1’-бифенил]-3-ил)карбамоил)-1H-индол-6-ил)окси)-2-метилпропаноат (20,0 мг, 51 %) в форме твердого вещества грязно-белого цвета.
LC/MS ESI (+): 479 (M+1)
(d) Синтез 2-((2-((2’,4’-дифтор-[1,1’-бифенил]-3-ил)карбамоил)-1H-индол-6-ил)окси)-2-метилпропановой кислоты
Этил-2-((2-((2’,4’-дифтор-[1,1’-бифенил]-3-ил)карбамоил)-1H-индол-6-ил)окси)-2-метилпропаноат (26,0 мг, 0,05 ммоль) растворяли в смеси THF/MeOH/H2O (4,0 мл, 1/2,4/0,6 об./об.) и добавляли LiOH·H2O (3,0 мг, 0,13 ммоль). После перемешивания при комнатной температуре в течение 12 часов и после завершения реакции, реакционную смесь концентрировали при пониженном давлении. Остаток растворяли в H2O (1,0 мл) и подкисляли до рН 1-2 с помощью 1н. HCl. Осадок отфильтровывали и высушивали при пониженном давлении, получая 2-((2-((2’,4’-дифтор-[1,1’-бифенил]-3-ил)карбамоил)-1H-индол-6-ил)окси)-2-метилпропановую кислоту (7,7 мг, 35 %) в форме твердого вещества белого цвета.
LC/MS ESI (+): 451 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 13,0 (ушир.с, 1H), 11,57 (с, 1H), 10,22 (с, 1H), 7,97 (с, 1H), 7,94 (м, 1H), 7,25-7,63 (м, 5H), 7,19-7,23 (м, 2H), 6,91 (д, 1H, J=2,4 Гц), 6,68 (дд, 1H, J=8,7, 2,4 Гц), 1,53 (с, 6H)
Способом синтеза согласно Примеру 254 синтезировали соединения Примера 255 и Примера 256, и данные для каждого примера являются следующими.
1H-ЯМР (300 МГц, ДМСО-d6): δ 9,13 (ушир.с, 1H), 7,80 (д, 2H, J=11,4 Гц), 7,68 (м, 1H), 7,57 (д, 1H, J=8,7 Гц), 7,41~7,49 (м, 2H), 7,30 (м, 1H), 6,86~6,90 (м, 5H), 4,68 (с, 2H), 4,29 (кв., 2H, J=7,2 Гц), 1,32 (т, 3H, J=7,2 Гц)
1H-ЯМР (300 МГц, ДМСО-d6): δ 13,13 (ушир.с, 1H), 11,56 (ушир.с, 1H), 10,22 (ушир.с, 1H), 7,97 (м, 1H), 7,87 (д, 1H, J=8,0 Гц), 7,56~7,64 (м, 2H), 7,36~7,49 (м, 3H), 7,20~7,25 (м, 2H), 6,85 (м, 1H), 6,75 (дд, 1H, J=8,8, 2,3 Гц), 4,68 (с, 2H)
Пример 257) Синтез N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-((N-метилсульфамоил)амино)-1H-индол-2-карбоксамида
(a) Синтез N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-нитро-1H-индол-2-карбоксамида
6-нитро-1H-индол-2-карбоновую кислоту (300,0 мг, 1,46 ммоль), 2’,4’-дифтор-[1,1’-бифенил]-3-амин (328,0 мг, 1,60 ммоль), EDC (556,0 мг, 2,91 ммоль), HOBt (393,0 мг, 2,91 ммоль) и DIPEA (1,3 мл, 7,28 ммоль) растворяли в безводном DMF (15,0 мл), с последующим перемешиванием при 10°C в течение 24 часов. Реакционную смесь экстрагировали EtOAc, промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 2:1), получая N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-нитро-1H-индол-2-карбоксамид (392,0 мг, 69 %) в форме твердого вещества желтого цвета.
LC/MS ESI (+): 394 (M+1)
(b) Синтез трет-бутил-2-((2’,4’-дифтор-[1,1’-бифенил]-3-ил)карбамоил)-6-нитро-1H-индол-1-карбоксилата
N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-нитро-1H-индол-2-карбоксамид (392,0 мг, 1,00 ммоль), Bос2O (239,0 мг, 1,10 ммоль) и Et3N (278,0 мкл, 1,99 ммоль) растворяли в безводном DMF (4,0 мл) с последующим перемешиванием при комнатной температуре в течение 24 часов. Реакционную смесь экстрагировали EtOAc, и органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 2:1), получая трет-бутил-2-((2’,4’-дифтор-[1,1’-бифенил]-3-ил)карбамоил)-6-нитро-1H-индол-1-карбоксилат (302,0 мг, 62 %) в форме твердого вещества желтого цвета.
LC/MS ESI (+): 494 (M+1)
(c) Синтез трет-бутил-6-амино-2-((2’,4’-дифтор-[1,1-бифенил]-3-ил)карбамоил)-1H-индол-1-карбоксилата
трет-бутил-2-((2’,4’-дифтор-[1,1’-бифенил]-3-ил)карбамоил)-6-нитро-1H-индол-1-карбоксилат (302,0 мг, 0,61 ммоль), Zn (600,0 мг, 9,18 ммоль) и NH4Cl (164,0 мг, 3,06 ммоль) растворяли в смеси MeOH/H2O (2,5 мл, 4/1 об./об.) и обрабатывали ультразвуком в течение 2 часов. Реакционную смесь экстрагировали CH2Cl2, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, CH2Cl2 : MeOH = 99:1), получая трет-бутил-6-амино-2-((2’,4’-дифтор-[1,1’-бифенил]-3-ил)карбамоил)-1H-индол-1-карбоксилат (218,0 мг, 77 %) в форме твердого вещества белого цвета.
LC/MS ESI (+): 464 (M+1)
(d) Синтез трет-бутил-2-((2’,4’-дифтор-[1,1’-бифенил]-3-ил)карбамоил)-6-((N-метилсульфамоил)амино)-1H-индол-1-карбоксилата
трет-бутил-6-амино-2-((2’,4’-дифтор-[1,1’-бифенил]-3-ил)карбамоил)-1H-индол-1-карбоксилат (35,0 мг, 0,08 ммоль) и DMAP (32,0 мг, 0,26 ммоль) растворяли в CH3CN (3,0 мл), и метилсульфамоил хлорид (11,0 мг, 0,08 ммоль) медленно добавляли при 0°C, с последующим нагреванием с обратным холодильником при 100°C в течение 48 часов. Реакционную смесь экстрагировали EtOAc, промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении, получая трет-бутил-2-((2’,4’-дифтор-[1,1’-бифенил]-3-ил)карбамоил)-6-((N-метилсульфамоил)амино)-1H-индол-1-карбоксилат (44,5 мг) в форме твердого вещества белого цвета.
LC/MS ESI (+): 557 (M+1)
(e) Синтез N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-((N-метилсульфамоил)амино)-1H-индол-2-карбоксамида
Сырой трет-бутил-2-((2’,4’-дифтор-[1,1’-бифенил]-3-ил)карбамоил)-6-((N-метилсульфамоил)амино)-1H-индол-1-карбоксилат (44,5 мг) растворяли в CH2Cl2 (2,0 мл) и медленно добавляли TFA (0,5 мл). После перемешивания при комнатной температуре в течение 1 часа добавляли 1н. водный раствор NaOH, чтобы остановить реакцию. Реакционную смесь экстрагировали EtOAc, промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, CH2Cl2 : MeOH = 99:1), получая N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-6-((N-метилсульфамоил)амино)-1H-индол-2-карбоксамид (14,3 мг, 2 стадии выход: 41 %) в форме твердого вещества грязно-белого цвета.
LC/MS ESI (+): 457 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,65 (с, 1H), 10,23 (с, 1H), 9,60 (с, 1H), 7,98 (м, 1H), 7,86-7,89 (м, 1H), 7,56-7,64 (м, 2H), 7,47 (т, 1H, J=7,8 Гц), 7,35-7,43 (м, 3H), 7,19-7,26 (м, 2H), 7,16 (д, 1H, J=5,1 Гц), 6,98 (дд, 1H, J=9,0, 1,7 Гц), 2,47 (д, 3H, J=5,0 Гц)
Способом синтеза согласно Примеру 257 синтезировали соединения с Примера 258 по Пример 279, и данные для каждого примера являются следующими.
1H-ЯМР (300 МГц, ДМСО-d6): δ 9,17 (с, 1H), 7,86 (с, 1H), 7,70~7,77 (м, 2H), 7,55~7,61 (м, 2H), 7,36~7,51 (м, 3H), 7,25 (д, 1H, J=7,4 Гц), 7,13 (д, 1H, J=7,4 Гц), 6,93 (д, 1H, J=1,9 Гц), 6,81 (д, 1H, J=1,5 Гц), 6,78 (дд, 1H, J=8,6, 2,1 Гц), 3,60 (с, 2H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,80 (с, 1H), 10,30 (с, 1H), 9,38 (с, 1H), 7,83~7,89 (м, 3H), 7,75 (т, 1H, J=7,8 Гц), 7,64 (т, 1H, J=7,8 Гц), 7,52 (д, 1H, J=1,7 Гц), 7,39~7,47 (м, 4H), 7,13 (дд, 1H, J=8,5, 1,9 Гц), 7,05 (д, 1H, J=7,6 Гц), 2,90 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 9,35 (с, 1H), 7,87 (с, 1H), 7,73 (м, 2H), 7,60~7,65 (м, 2H), 7,57 (д, 1H, J=7,3 Гц), 7,51 (д, 1H, J=7,6 Гц), 7,41~7,46 (м, 2H), 7,37 (д, 1H, J=7,4 Гц), 7,16 (д, 1H, J=8,2 Гц), 6,98 (м, 2H), 6,57 (с, 1H), 3,02 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 9,99 (с, 1H), 9,35 (ушир.с, 1H), 7,86 (с, 1H), 7,69 (дд, 1H, J=7,8, 2,0 Гц), 7,51~7,57 (м, 1H), 7,33~7,44 (м, 2H), 7,16~7,22 (м, 2H), 6,91 (д, 1H, J=7,8 Гц), 6,51 (с, 1H), 6,41 (д, 1H, J=7,8 Гц), 6,21 (с, 1H), 4,37~4,44 (м, 1H), 3,24~3,27 (м, 1H), 2,97~3,06 (м, 1H), 2,89 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,00 (с, 1H), 9,35 (ушир.с, 1H), 7,68~7,75 (м, 3H), 7,56~7,60 (м, 1H), 7,34~7,48 (м, 2H), 6,89~7,00 (м, 2H), 6,49 (с, 1H), 6,38~6,42 (м, 1H), 6,15~6,20 (м, 1H), 4,39~4,43 (м, 1H), 3,24~3,27 (м, 1H), 2,97~3,07 (м, 1H), 2,87 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,94 (с, 1H), 8,97 (д, 1H, J=2,1 Гц), 8,20 (дд, 1H, J=8,8, 2,1 Гц), 7,96 (д, 1H, J=8,6 Гц), 7,83~7,86 (м, 2H), 7,72~7,78 (м, 2H), 7,64 (т, 1H, J=7,6 Гц), 7,44 (кв., 2H, J=7,8 Гц), 7,28 (д, 1H, J=0,8 Гц), 7,07 (д, 1H, J=7,4 Гц), 1,47 (с, 9H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,78 (с, 1H), 10,36 (с, 1H), 10,28 (с, 1H), 7,84~7,89 (м, 3H), 7,75 (т, 1H, J=7,8 Гц), 7,61~7,67 (м, 2H), 7,42~7,46 (м, 4H), 7,05 (д, 1H, J=7,6 Гц), 6,99 (дд, 1H, J=8,4, 1,5 Гц), 4,42 (кв., 2H, J=9,7 Гц)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,63 (с, 1H), 10,21 (с, 1H), 9,33 (ушир.с, 1H), 7,83~7,88 (м, 3H), 7,72 (т, 1H, J=7,6 Гц), 7,64 (т, 1H, J=8,0 Гц), 7,56 (д, 1H, J=8,8 Гц), 7,40~7,47 (м, 2H), 7,33~7,36 (м, 2H), 6,94~6,99 (м, 4H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,73 (с, 1H), 9,83 (с, 1H), 9,59 (с, 1H), 8,27 (д, 1H, J=2,6 Гц), 8,09 (д, 1H, J=8,5 Гц), 7,74~7,86 (м, 3H), 7,74 (т, 1H, J=7,4 Гц), 7,63 (т, 1H, J=7,2 Гц), 7,36~7,46 (м, 3H), 7,03 (дд, 1H, J=8,5, 1,1 Гц), 6,98 (д, 1H, J=7,5 Гц), 2,92 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,64 (с, 1H), 10,22 (с, 1H), 9,82 (с, 1H), 7,81~7,88 (м, 3H), 7,75 (т, 1H, J=7,6 Гц), 7,55~7,66 (м, 2H), 7,45 (дд, 1H, J=7,4, 2,3 Гц), 7,42 (д, 1H, J=8,0 Гц), 7,38 (д, 2H, J=1,5 Гц), 7,04 (д, 1H, J=7,4 Гц), 6,98 (дд, 1H, J=9,0, 1,9 Гц), 2,69 (с, 6H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,87 (с, 1H), 11,81 (ушир.с, 1H), 10,34 (с, 1H), 7,83~7,89 (м, 3H), 7,70~7,77 (м, 2H), 7,64 (т, 1H, J=7,6 Гц), 7,41~7,47 (м, 4H), 7,05 (д, 1H, J=7,6 Гц), 6,98 (дд, 1H, J=8,6, 1,7 Гц)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,65 (с, 1H), 10,21 (с, 1H), 9,57 (ушир.с, 1H), 7,83~7,88 (м, 3H), 7,75 (т, 1H, J=7,4 Гц), 7,64 (т, 1H, J=7,4 Гц), 7,57 (д, 1H, J=8,6 Гц), 7,34~7,46 (м, 4H), 7,13 (м, 1H), 7,03 (м, 1H), 6,97 (дд, 1H, J=8,6, 1,7 Гц), 2,47 (д, 3H, J=5,0 Гц)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,7 (с, 1H), 10,3 (с, 1H), 9,63 (с, 1H), 7,98 (д, 1H, J=1,5 Гц), 7,88 (дд, 1H, J=8,2, 1,5 Гц), 7,56~7,74 (м, 2H), 7,48 (т, 1H, J=8,0 Гц), 7,36~7,44 (м, 3H), 7,20~7,26 (м, 2H), 6,99 (дд, 1H, J=8,6, 1,7 Гц), 2,94 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 8,97 (с, 1H), 7,79~7,90 (м, 2H), 7,65~7,68 (м, 1H), 7,41~7,49 (м, 3H), 7,28~7,30 (м, 1H), 6,89~7,00 (м, 3H), 6,65~6,68 (м, 1H), 6,62 (дд, 1H, J=8,6, 2,1 Гц), 3,80 (ушир.с, 2H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,81 (с, 1H), 10,33 (с, 1H), 9,39 (ушир.с, 1H), 7,98 (д, 1H, J=1,4 Гц), 7,88 (д, 1H, J=7,9 Гц), 7,57~7,65 (м, 1H), 7,37~7,52 (м, 5H), 7,20~7,28 (м, 2H), 7,13 (дд, 1H, J=8,8, 2,3 Гц), 2,90 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6);
d 11,79 (с, 1H), 10,36 (с, 1H), 10,31 (с, 1H), 7,99 (м, 1H), 7,88 (д, 1H, J=8,2 Гц), 7,67 (д, 1H, J=8,8 Гц), 7,56~7,62 (м, 1H), 7,48 (т, 1H, J=8,0 Гц), 7,37~7,44 (м, 3H), 7,20~7,27 (м, 2H), 6,99 (дд, 1H, J=8,6, 1,9 Гц), 4,42 (кв., 2H, J=9,7 Гц)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,65 (с, 1H), 10,24 (с, 1H), 9,33 (с, 1H), 7,98 (м, 1H), 7,86~7,89 (м, 1H), 7,55~7,64 (м, 2H), 7,40~7,50 (м, 2H), 7,34~7,38 (м, 2H), 7,20~7,26 (м, 2H), 6,96~7,00 (м, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,74 (с, 1H), 9,85 (с, 1H), 9,60 (с, 1H), 8,28 (д, 1H, J=2,4 Гц), 8,11 (д, 1H, J=8,5 Гц), 7,99 (с, 1H), 7,81 (д, 1H, J=8,3 Гц), 7,59 (м, 1H), 7,36~7,46 (м, 3H), 7,17~7,26 (м, 2H), 7,04 (д, 1H, J=8,1 Гц), 2,93 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6);d11,64 (с, 1H), 10,25 (с, 1H), 9,82 (ушир.с, 1H), 7,97 (м, 1H), 7,87 (м, 1H), 7,56~7,64 (м, 2H), 7,50 (т, 1H, J=7,8 Гц), 7,36~7,44 (м, 3H), 7,20~7,26 (м, 2H), 6,98 (дд, 1H, J=8,6, 1,7 Гц), 2,69 (с, 6H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 9,29 (с, 1H), 7,86 (с, 1H), 7,61~7,71 (м, 3H), 7,43~7,49 (м, 3H), 7,34~7,41 (м, 1H), 7,27~7,31 (м, 1H), 7,12 (д, 1H, J=7,8 Гц), 6,99~7,00 (м, 1H), 6,91 (д, 1H, J=2,0 Гц), 6,52 (с, 1H), 3,03 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,72 (с, 1H), 10,95 (с, 1H), 9,68 (с, 1H), 8,49 (д, 1H, J=5,1 Гц), 8,44 (с, 1H), 7,74 (м, 1H), 7,58~7,62 (м, 2H), 7,42~7,52 (м, 2H), 7,26~7,36 (м, 2H), 7,01 (м, 1H), 2,58 (м, 1H), 0,89~0,91 (м, 4H)
1H-ЯМР(300 МГц) ДМСО-d6): δ 11,74 (с, 1H), 10,95 (с, 1H), 9,67 (с, 1H), 8,49 (д, 1H, J=5,1 Гц), 8,44 (с, 1H), 7,69~7,77 (м, 1H), 7,60~7,62 (м, 2H), 7,44~7,49 (м, 1H), 7,40 (с, 1H), 7,26~7,35 (м, 2H), 6,96~7,00 (м, 1H), 2,95 (с, 3H),
Пример 280) Синтез N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-N-метил-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
(a) Синтез 2’,4’-дифтор-N-метил-[1,1’-бифенил]-3-амина
К смеси 2’,4’-дифтор-[1,1’-бифенил]-3-амина (150,0 мг, 0,73 ммоль) и триэтилортоформиата (3,0 мл) добавляли каталитическое количество TFA, с последующим нагреванием с обратным холодильником в течение 5 часов. Реакционную смесь концентрировали при пониженном давлении, и остаток растворяли в EtOH (2,0 мл). NaBH4 (276,0 мг, 7,30 ммоль) медленно добавляли при 0°C с последующим нагреванием с обратным холодильником в течение 2 часов. Добавляли воду, чтобы остановить реакцию, и реакционную смесь экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (амин силикагель, н-гексан : EtOAc = 9:1), получая 2’,4’-дифтор-N-метил-[1,1’-бифенил]-3-амин (140,0 мг, 88 %) в форме бесцветного масла.
1H-ЯМР (300 МГц, CDCl3): δ 7,36-7,44 (м, 1H), 7,23-7,28 (м, 1H), 6,82-6,96 (м, 3H), 6,72 (д, 1H, J=1,8 Гц), 6,63 (дд, 1H, J=7,5, 2,4 Гц), 4,02 (ушир.с, 1H), 2,88 (с, 3H)
(b) Синтез N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-N-метил-6-нитро-1H-индол-2-карбоксамида
6-нитро-1H-индол-2-карбоновую кислоту (51,0 мг, 0,25 ммоль), 2’,4’-дифтор-N-метил-[1,1’-бифенил]-3-амин (60,0 мг, 0,27 ммоль), EDC (58,0 мг, 0,30 ммоль) и HOBt (41,0 мг, 0,30 ммоль) растворяли в безводном DMF (2,5 мл) и добавляли DIPEA (65,0 мкл, 0,37 ммоль) с последующим перемешиванием при комнатной температуре в течение 24 часов. Реакционную смесь экстрагировали EtOAc, и органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 9:1), получая N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-N-метил-6-нитро-1H-индол-2-карбоксамид (30,0 мг, 30 %) в форме твердого вещества желтого цвета.
LC/MS ESI (+): 394 (M+1)
(c) Синтез N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-N-метил-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
Процедуру синтеза Примера 257 повторяли за исключением использования N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-N-метил-6-нитро-1H-индол-2-карбоксамида (45,0 мг, 0,11 ммоль), получая N-(2’,4’-дифтор-[1,1’-бифенил]-3-ил)-N-метил-6-(метилсульфонамидо)-1H-индол-2-карбоксамид (5,0 мг, 4 стадии выход: 10 %) в форме твердого вещества белого цвета.
LC/MS ESI (+): 456 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,60 (с, 1H), 9,55 (с, 1H), 7,55-7,63 (м, 5H), 7,37-7,43 (м, 2H), 7,33 (м, 1H), 7,25 (д, 1H, J=8,4 Гц), 7,19-7,25 (м, 1H), 6,82 (дд, 1H, J=8,4, 1,8 Гц), 3,42 (с, 3H), 2,89 (с, 3H)
Пример 281) Синтез N-(5’-метокси-2’-(трифторметил)-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
(a) Синтез 5’-метокси-2’-(трифторметил)-[1,1’-бифенил]-3-амина
Гидрохлорид (3-аминофенил)бороновой кислоты (324,0 мг, 1,87 ммоль) и 2-бром-4-метокси-1-(трифторметил)бензол (500,0 мг, 1,96 ммоль) растворяли в смеси DME/H2O (25,0 мл, 4/1 об./об.) и добавляли Pd(PPh3)4 (216,0 мг, 0,19 ммоль) и Na2CO3 (1,2 г, 11,20 ммоль) с последующим перемешиванием при 85°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 2:1), получая 5’-метокси-2’-(трифторметил)-[1,1’-бифенил]-3-амин (334,0 мг, 67 %) в форме бесцветного масла.
LC/MS ESI (+): 268 (M+1)
(b) Синтез N-(5’-метокси-2’-(трифторметил)-[1,1’-бифенил]-3-ил)-6-нитро-1H-индол-2-карбоксамида
5’-Метокси-2’-(трифторметил)-[1,1’-бифенил]-3-амин (200,0 мг, 0,75 ммоль), 6-нитро-1H-индол-2-карбоновую кислоту (154,0 мг, 0,75 ммоль) и HATU (341,0 мг, 0,90 ммоль) растворяли в безводном DMF (3,0 мл) и медленно добавляли DIPEA (196,0 мкл, 1,12 ммоль). После перемешивания при 18°C в течение 3 часов, реакционную смесь экстрагировали EtOAc, и органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали хроматографией на колонках (н-гексан : EtOAc = 2:1), получая N-(5’-метокси-2’-(трифторметил)-[1,1’-бифенил]-3-ил)-6-нитро-1H-индол-2-карбоксамид (320,0 мг, 94 %) в форме твердого вещества желтого цвета.
LC/MS ESI (+): 456 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 12,56 (с, 1H), 10,58 (с, 1H), 8,37 (с, 1H), 7,94 (д, 2H, J=1,3 Гц), 7,84-7,91 (м, 2H), 7,78 (д, 1H, J=8,8 Гц), 7,61 (д, 1H, J=1,1 Гц), 7,46 (т, 1H, J=7,8 Гц), 7,16 (дд, 1H, J=8,2, 2,9 Гц), 7,10 (д, 1H, J=8,2 Гц), 6,94 (д, 1H, J=2,5 Гц), 3,87 (с, 3H)
(c) Синтез трет-бутил-2-((5’-метокси-2’-(трифторметил)-[1,1’-бифенил]-3-ил)карбамоил)-6-нитро-1H-индол-1-карбоксилата
N-(5’-метокси-2’-(трифторметил)-[1,1’-бифенил]-3-ил)-6-нитро-1H-индол-2-карбоксамид (320,0 мг, 0,70 ммоль), Bос2O (169,0 мг, 0,77 ммоль) и Et3N (294,0 мкл, 2,11 ммоль) растворяли в безводном DMF (4,0 мл) с последующим перемешиванием при 17°C в течение 24 часов. Реакционную смесь экстрагировали EtOAc, и органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 2:1), получая трет-бутил-2-((5’-метокси-2’-(трифторметил)-[1,1’-бифенил]-3-ил)карбамоил)-6-нитро-1H-индол-1-карбоксилат (163,0 мг, 42 %) в форме твердого вещества желтого цвета.
LC/MS ESI (+): 556 (M+1)
(d) Синтез трет-бутил-2-((5’-метокси-2’-(трифторметил)-[1,1’-бифенил]-3-ил)карбамоил)-6-(метилсульфонамидо)-1H-индол-1-карбоксилата
трет-бутил-2-((5’-метокси-2’-(трифторметил)-[1,1’-бифенил]-3-ил)карбамоил)-6-нитро-1H-индол-1-карбоксилат (163,0 мг, 0,29 ммоль) растворяли в смеси MeOH/H2O (5,0 мл, 9/1 об./об.) и добавляли Zn (288,0 мг, 4,40 ммоль) и NH4Cl (78,0 мг, 1,47 ммоль). Реакционную смесь обрабатывали ультразвуком в течение 1 часа, фильтровали через Целит и концентрировали при пониженном давлении. Остаток экстрагировали EtOAc, и органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток растворяли в пиридине (3,0 мл), и метансульфонил хлорид (25,0 мкл, 0,32 ммоль) медленно добавляли при 0°C. Реакционную смесь экстрагировали EtOAc, и органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 2:1) получить трет-бутил-2-((5’-метокси-2’-(трифторметил)-[1,1’-бифенил]-3-ил)карбамоил)-6-(метилсульфонамидо)-1H-индол-1-карбоксилат (143,0 мг, 2 стадии выход: 81 %) в форме твердого вещества белого цвета.
LC/MS ESI (+): 604 (M+1)
(e) Синтез N-(5’-метокси-2’-(трифторметил)-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
трет-бутил-2-((5’-метокси-2’-(трифторметил)-[1,1’-бифенил]-3-ил)карбамоил)-6-(метилсульфонамидо)-1H-индол-1-карбоксилат (143,0 мг, 0,24 ммоль) растворяли в CH2Cl2 (2,0 мл), и TFA (0,5 мл) добавляли при 15°C. После перемешивания в течение 1 часа, реакцию останавливали 1н. водным раствором NaOH. Реакционную смесь экстрагировали EtOAc, и органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (силикагель, н-гексан : EtOAc = 2:1), получая N-(5’-метокси-2’-(трифторметил)-[1,1’-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид (26,0 мг, 22 %) в форме твердого вещества белого цвета.
LC/MS ESI (+): 504 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,73 (с, 1H), 10,30 (с, 1H), 9,63 (с, 1H), 7,85 (м, 2H), 7,77 (д, 1H, J=9,2 Гц), 7,63 (д, 1H, J=8,6 Гц), 7,39-7,45 (м, 3H), 7,13-7,17 (м, 1H), 7,05 (д, 1H, J=8,0 Гц), 6,98 (дд, 1H, J=8,4, 1,1 Гц), 6,93 (д, 1H, J=2,3 Гц), 3,86 (с, 3H), 2,94 (с, 3H)
Пример 282) Синтез N-(5’-метокси-2’-(трифторметил)-[1,1’-бифенил]-3-ил)-6-нитро-1H-индол-2-карбоксамида
Способом синтеза согласно Примеру 281-b синтезировали N-(5’-метокси-2’-(трифторметил)-[1,1’-бифенил]-3-ил)-6-нитро-1H-индол-2-карбоксамид.
LC/MS ESI (+): 456 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 12,56 (с, 1H), 10,58 (с, 1H), 8,37 (с, 1H), 7,94 (д, 2H, J=1,3 Гц), 7,84-7,91 (м, 2H), 7,78 (д, 1H, J=8,8 Гц), 7,61 (д, 1H, J=1,1 Гц), 7,46 (т, 1H, J=7,8 Гц), 7,16 (дд, 1H, J=8,2, 2,9 Гц), 7,10 (д, 1H, J=8,2 Гц), 6,94 (д, 1H, J=2,5 Гц), 3,87 (с, 3H)
Способом синтеза согласно Примеру 280 или Примерам 281 и 282 синтезировали соединения с Примера 283 по Пример 300, и данные для каждого примера являются следующими.
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,74 (с, 1H), 10,31 (с, 1H), 9,64 (с, 1H), 8,26 (с, 1H), 8,15 (д, 1H, J=7,6 Гц), 7,88~7,93 (м, 2H), 7,62~7,71 (м, 4H), 7,48 (т, 1H, J=8,0 Гц), 7,38~7,42 (м, 2H), 7,07 (д, 1H, J=8,4 Гц), 6,98 (дд, 1H, J=8,4, 1,9 Гц), 2,94 (с, 3H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,74 (с, 1H), 10,32 (с, 1H), 9,66 (ушир.с, 1H), 8,43 (с, 1H), 8,23 (д, 1H, J=7,7 Гц), 7,87~7,91 (м, 2H), 7,68 (д, 1H, J=8,8 Гц), 7,63 (д, 1H, J=8,5 Гц), 7,47 (т, 1H, J=7,7 Гц), 7,39 (д, 2H, J=6,3 Гц), 7,06 (д, 1H, J=7,7 Гц), 6,98 (дд, 1H, J=8,5, 1,8 Гц), 2,94 (с, 3H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,73 (с, 1H), 10,33 (с, 1H), 9,62 (ушир.с, 1H), 8,54~8,60 (м, 2H), 7,90~7,94 (м, 2H), 7,78 (д, 1H, J=8,8 Гц), 7,63 (д, 1H, J=8,4 Гц), 7,50 (т, 1H, J=8,8 Гц), 7,38~7,40 (м, 2H), 7,10 (д, 1H, J=8,8 Гц), 6,98 (дд, 1H, J=8,8, 1,5 Гц), 2,93 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 12,56 (с, 1H), 10,62 (с, 1H), 8,37 (с, 1H), 8,17~8,20 (м, 1H), 8,05 (д, 1H, J=8,2 Гц), 7,87~7,94 (м, 5H), 7,61 (м, 1H), 7,51 (т, 1H, J=7,8 Гц), 7,14 (д, 1H, J=7,8 Гц), 3,91 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,73 (с, 1H), 10,30 (с, 1H), 9,63 (с, 1H), 8,18 (д, 1H, J=8,8 Гц), 8,05 (д, 1H, J=8,0 Гц), 7,86~7,92 (м, 3H), 7,63 (д, 1H, J=8,6 Гц), 7,47 (т, 1H, J=7,8 Гц), 7,37~7,41 (м, 2H), 7,09 (д, 1H, J=7,8 Гц), 6,98 (дд, 1H, J=8,4, 1,9 Гц), 3,91 (с, 3H), 2,94 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 12,56 (с, 1H), 10,59 (с, 1H), 8,37 (с, 1H), 7,89~7,96 (м, 3H), 7,82 (м, 1H), 7,59~7,65 (м, 2H), 7,44~7,53 (м, 2H), 7,07~7,11 (м, 1H), 3,98 (с, 3H), 3,82 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,72 (с, 1H), 10,27 (с, 1H), 9,64 (с, 1H), 7,88 (дд, 1H, J=8,0, 1,1 Гц), 7,81 (с, 1H), 7,62~7,64 (м, 2H), 7,51 (с, 1H), 7,39~7,46 (м, 3H), 7,04 (д, 1H, J=7,6 Гц), 6,98 (дд, 1H, J=8,6, 1,9 Гц), 3,98 (с, 3H), 3,82 (с, 3H), 2,94 (с, 3H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,73 (с, 1H), 10,29 (с, 1H), 9,63 (ушир.с, 1H), 8,93 (д, 1H, J=5,7 Гц), 8,33 (дд, 1H, J=7,6, 1,5 Гц), 7,99 (с, 1H), 7,92 (д, 1H, J=8,8 Гц), 7,68~7,71 (м, 1H), 7,63 (д, 1H, J=8,4 Гц), 7,37~7,50 (м, 3H), 7,16~7,19 (м, 1H), 6,98 (дд, 1H, J=8,4, 1,5 Гц), 2,94 (с, 3H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,75 (с, 1H), 10,33 (с, 1H), 9,66 (с, 1H), 8,90(д, 1H, J=5,9 Гц), 8,74 (с, 1H), 7,88~7,94 (м, 3H), 7,64(д, 1H, J=8,5 Гц), 7,49 (т, 1H, J=7,7 Гц), 7,40 (дд, 2H, J=8,5, 1,1 Гц), 7,72 (д, 1H, J=7,7 Гц), 6,98 (дд, 1H, J=8,5, 1,8 Гц), 2,94 (с, 3H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 12,54 (с, 1H), 10,63 (с, 1H), 8,81 (д, 1H, J=4,6 Гц), 8,37 (с, 1H), 7,80~8,02 (м, 5H), 7,82 (дд, 1H, J=7,6, 4,6 Гц), 7,62 (с, 1H), 7,52 (т, 1H, J=8,0 Гц), 7,14 (д, 1H, J=7,6 Гц)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,75 (с, 1H), 10,32 (с, 1H), 9,66 (ушир.с, 1H), 8,80 (д, 1H, J=5,5 Гц), 7,98 (д, 1H, J=7,7 Гц), 7,89~7,91 (м, 2H), 7,81 (дд, 1H, J=7,7, 4,8 Гц), 7,63 (д, 1H, J=8,5 Гц), 7,48 (т, 1H, J=7,7 Гц), 7,40 (д, 2H, J=8,1 Гц), 7,09 (д, 1H, J=7,4 Гц), 6,98 (дд, 1H, J=8,5, 1,8 Гц), 2,50 (с, 3H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,73 (с, 1H), 10,33 (с, 1H), 9,64 (ушир.с, 1H), 8,59 (с, 1H), 8,08 (с, 1H), 7,90~7,93 (м, 2H), 7,63 (д, 1H, J=8,8 Гц), 7,50 (т, 1H, J=8,4 Гц), 7,39 (д, 2H, J=6,5 Гц), 7,11 (д, 1H, J=8,0 Гц), 6,98 (дд, 1H, J=8,4, 1,9 Гц), 2,94 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 12,57 (с, 1H), 10,60 (с, 1H), 8,38 (с, 1H), 8,00 (с, 1H), 7,95 (с, 2H), 7,90 (д, 1H, J=9,0 Гц), 7,64 (с, 1H), 7,49 (т, 1H, J=8,1 Гц), 7,25~7,36 (м, 2H), 6,98~7,07 (м, 2H), 3,82 (с, 3H)
1H-ЯМР (300 МГц, CDCl3): δ 8,08 (с, 1H), 7,93 (с, 1H), 7,77 (ушир.с, 2H), 7,57 (д, 1H, J=8,4 Гц), 7,44 (т, 1H, J=8,4 Гц), 7,15~7,39 (м, 2H), 7,05 (т, 1H, J=9,6 Гц), 6,97 (с, 2H), 6,85 (с, 1H), 6,45 (с, 1H), 3,83 (с, 3H), 3,04 (с, 3H), 1,30 (с, 9H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 12,58 (с, 1H), 11,32 (с, 1H), 8,52 (д, 1H, J=5,1 Гц) 8,47 (с, 1H), 8,38 (с, 1H), 7,92 (с, 2H), 7,82 (с, 1H), 7,42 (д, 1H, J=5,1 Гц), 7,31 (т, 1H, J=9,0 Гц), 7,06~7,18 (м, 2H), 3,82 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 12,57 (с, 1H), 10,63 (с, 1H), 8,37 (с, 1H), 7,93~8,00 (м, 6H), 7,77 (д, 1H, J=8,1 Гц), 7,62 (с, 1H), 7,51 (т, 1H, J=8,1 Гц), 7,26 (д, 1H, J=7,8 Гц), 3,88 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,74 (с, 1H), 10,31 (с, 1H), 9,64 (с, 1H), 7,90~8,00 (м, 4H), 7,76 (д, 1H, J=8,4 Гц), 7,62 (д, 1H, J=8,4 Гц), 7,46 (т, 1H, J=8,7 Гц), 7,39 (д, 2H, J=4,8 Гц), 7,20 (д, 1H, J=8,1 Гц), 6,97 (дд, 1H, J=8,7, 1,8 Гц), 3,88 (с, 3H), 2,94 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,75 (с, 1H), 11,01 (с, 1H), 9,68 (с, 1H), 8,51 (д, 1H, J=5,1 Гц), 8,36 (с, 1H), 8,03 (дд, 1H, J=8,4, 2,1 Гц), 8,00 (д, 1H, J=2,1 Гц), 7,81 (д, 1H, J=8,4 Гц), 7,63 (д, 1H, J=2,1 Гц), 7,60 (д, 1H, J=9,0 Гц), 7,39 (с, 1H), 7,29 (дд, 1H, J=5,1, 1,5 Гц), 6,97 (д, 1H, J=8,4 Гц), 3,89 (с, 3H), 2,95 (с, 3H)
Пример 301) Синтез N-(5-Циано-2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
(a) Синтез 2',4'-дифтор-5-нитро-[1,1'-бифенил]-3-карбонитрила
3-бром-5-нитробензонитрил (200,0 мг, 0,89 ммоль), (2,4-дифторфенил)бороновую кислоту (167,0 мг, 1,06 ммоль), Pd(PPh3)4 (102,0 мг, 0,09 ммоль) и Na2CO3 (280,0 мг, 2,64 ммоль) добавляли к смеси DME/H2O (9,0 мл, 4/1 об./об.), с последующим перемешиванием при 90°C в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры и экстрагировали EtOAc, и органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 4:1), получая 2',4'-дифтор-5-нитро-[1,1'-бифенил]-3-карбонитрил (187,0 мг, 82%) в форме твердого вещества белого цвета.
1H-ЯМР (300 МГц, CDCl3): δ 8,60 (с, 1H), 8,52 (с, 1H), 8,13 (с, 1H), 7,44-7,52 (м, 1H), 6,99-7,11 (м, 2H)
(b) Синтез 5-амино-2',4'-дифтор-[1,1'-бифенил]-3-карбонитрила
2',4'-дифтор-5-нитро-[1,1'-бифенил]-3-карбонитрил (184,0 мг, 0,89 ммоль) растворяли в смеси MeOH/H2O (7,0 мл, 9/1 об./об.) и добавляли Zn (693,0 мг, 10,60 ммоль) и NH4Cl (189,0 мг, 3,54 ммоль). Реакционную смесь обрабатывали ультразвуком в течение 2 часов, фильтровали через Целит и концентрировали при пониженном давлении. Остаток экстрагировали EtOAc, и органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (амин силикагель, n-Hex : EtOAc = 1:1), получая 5-амино-2',4'-дифтор-[1,1'-бифенил]-3-карбонитрил (160,0 мг, 99%) в форме бесцветного масла.
LC/MS ESI (+): 231 (M+1)
(c) Синтез N-(5-Циано-2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
5-амино-2',4'-дифтор-[1,1'-бифенил]-3-карбонитрил (70,0 мг, 0,28 ммоль), гидрохлорид 6-(метилсульфонамидо)-1H-индол-2-карбоновой кислоты (70,0 мг, 0,30 ммоль) и HATU (115,0 мг, 0,30 ммоль) растворяли в безводном DMF (2,8 мл) и медленно добавляли DIPEA (72,0 мкл, 0,41 ммоль). После перемешивания при комнатной температуре в течение 72 часов, реакционную смесь экстрагировали EtOAc, и органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (амин силикагель, CH2Cl2 : MeOH = 40:1), получая N-(5-Циано-2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид (5,8 мг, 5%) в форме твердого вещества белого цвета.
LC/MS ESI (+): 467 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,80 (с, 1H), 10,57 (с, 1H), 9,67 (с, 1H), 8,35 (с, 1H), 8,23 (с, 1H), 7,75 (с, 1H), 7,65-7,72 (м, 2H), 7,46-7,51 (м, 1H), 7,40-7,43 (м, 2H), 7,28 (тд, 1H, J=8,8, 2,3 Гц), 7,00 (дд, 1H, J=8,8, 1,9 Гц), 2,95 (с, 3H)
Способом синтеза согласно Примеру 301 синтезировали соединения с Примера 302 по Пример 336, и данные для каждого примера являются следующими.
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,74 (с, 1H), 10,40 (с, 1H), 9,65 (с, 1H), 8,19 (с, 1H), 7,96 (с, 1H), 7,60~7,68 (м, 2H), 7,40~7,47 (м, 4H), 7,24 (тд, 1H, J=8,8, 2,3 Гц), 6,99 (дд, 1H, J=8,8, 1,5 Гц), 2,94 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,64 (с, 1H), 10,39 (с, 1H), 8,84 (с, 1H), 8,19 (с, 1H), 7,96 (с, 1H), 7,60~7,68 (м, 1H), 7,36~7,47 (м, 4H), 7,21~7,28 (м, 2H), 3,86 (с, 3H), 2,93 (с, 3H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 10,71 (ушир.с, 1H), 9,93 (ушир.с, 1H), 8,34 (с, 1H), 8,14 (м, 1H), 8,03 (д, 1H, J=8,7 Гц), 7,95 (м, 1H), 7,83 (м, 1H), 7,61~7,69 (м, 1H), 7,36~7,50 (м, 3H), 7,22~7,28 (м, 1H), 3,03 (с, 3H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 10,79 (ушир.с, 1H), 9,78 (ушир.с, 1H), 8,17 (м, 1H), 8,00 (с, 1H), 7,79 (с, 1H), 7,59~7,72 (м, 3H), 7,26~7,48 (м, 3H), 7,23 (м, 1H), 2,98 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,68 (с, 1H), 10,37 (с, 1H), 9,60 (с, 1H), 8,19 (с, 1H), 7,96 (с, 1H), 7,62~7,68 (м, 1H), 7,58 (д, 1H, J=8,8 Гц), 7,43~7,46 (м, 2H), 7,36~7,40 (м, 2H), 7,24 (тд, 1H, J=8,4, 2,3 Гц), 7,12 (ушир.с, 1H), 6,98 (дд, 1H, J=8,8, 1,9 Гц), 2,47 (с, 3H))
1H-ЯМР (300 МГц, ДМСО-d6): δ 12,07 (с, 1H), 10,55 (с, 1H), 8,19 (с, 1H), 7,97 (с, 1H), 7,75 (с, 1H), 7,60~7,68 (м, 1H), 7,56 (д, 1H, J=8,8 Гц), 7,52 (с, 1H), 7,39~7,46 (м, 2H), 7,21~7,27 (м, 2H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,58 (с, 1H), 9,96 (ушир.с, 1H), 8,07 (с, 1H), 8,01 (д, 1H, J=8,4 Гц), 7,90 (с, 1H), 7,69 (с, 1H), 7,59~7,67 (м, 1H), 7,48 (с, 1H), 7,36~7,46 (м, 2H), 7,20~7,27 (м, 1H), 3,00 (с, 3H), 2,58 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,70 (с, 1H), 10,09 (с, 1H), 8,32 (с, 1H), 8,12 (с, 1H), 7,98 (д, 1H, J=8,8 Гц), 7,94 (с, 1H), 7,83 (с, 1H), 7,60~7,68 (м, 1H), 7,39~7,47 (м, 2H), 7,32 (дд, 1H, J=8,8, 1,9 Гц), 7,21~7,27 (м, 1H), 3,08 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,59 (с, 1H), 9,87 (с, 1H), 8,06 (с, 1H), 8,02 (д, 1H, J=8,4 Гц), 7,89 (с, 1H), 7,70 (д, 1H, J=1,9 Гц), 7,59~7,67 (м, 1H), 7,48 (с, 1H), 7,37~7,46 (м, 2H), 7,20~7,26 (м, 1H), 3,02 (с, 3H), 2,58 (с, 3H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,79 (с, 1H), 10,46 (с, 1H), 9,68 (ушир.с, 1H), 7,86~7,88 (м, 1H), 7,77 (д, 1H, J=1,1 Гц), 7,60~7,71 (м, 2H), 7,38~7,45 (м, 3H), 7,24 (дт, 1H, J=8,8, 1,9 Гц), 7,12 (д, 1H, J=9,5 Гц), 7,00 (дд, 1H, J=8,8, 1,9 Гц), 2,95 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,77 (с, 1H), 10,57 (с, 1H), 9,68 (с, 1H), 8,32 (с, 1H), 8,27 (с, 1H), 7,65~7,74 (м, 2H), 7,57 (с, 1H), 7,41~7,50 (м, 3H), 7,27 (дт, 1H, J=8,8, 2,7 Гц), 7,02 (дд, 1H, J=8,4, 1,9 Гц), 2,95 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,72 (с, 1H), 10,24 (с, 1H), 9,64 (с, 1H), 7,57~7,65 (м, 4H), 7,36~7,43 (м, 3H), 7,22 (тд, 1H, J=7,6, 1,9 Гц), 6,99 (дд, 1H, J=8,8, 1,5 Гц), 6,81 (с, 1H), 3,82 (с, 3H), 2,95 (с, 3H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,80 (с, 1H), 10,56 (с, 1H), 9,68 (ушир.с, 1H), 8,35 (с, 1H), 8,07 (с, 1H), 7,83 (дд, 1H, J=9,5, 2,7 Гц), 7,64~7,72 (м, 2H), 7,55~7,62 (м, 2H), 7,40 (д, 2H, J=6,1 Гц), 7,00 (дд, 1H, J=8,4, 1,5 Гц), 2,93 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,41 (с, 1H), 9,88 (с, 1H), 8,02 (д, 1H, J=8,4 Гц), 7,70 (д, 1H, J=2,3 Гц), 7,56~7,64 (м, 1H), 7,50 (с, 1H), 7,45 (с, 1H), 7,35~7,42 (м, 2H), 7,18~7,24 (м, 1H), 6,84 (с, 1H), 3,81 (с, 3H), 3,01 (с, 3H), 2,57 (с, 3H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 10,55 (с, 1H), 9,90 (ушир.с, 1H), 8,34 (с, 1H), 8,03 (д, 1H, J=8,8 Гц), 7,81 (с, 1H), 7,52~7,65 (м, 1H), 7,56 (д, 1H, J=2,3 Гц), 7,52 (д, 1H, J=2,3 Гц), 7,35~7,43 (м, 2H), 7,21 (дт, 1H, J=8,8, 1,9 Гц), 6,85 (с, 1H), 3,82 (с, 3H), 3,02 (с, 3H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,71 (с, 1H), 10,42 (с, 1H), 9,62 (ушир.с, 1H), 8,53~8,56 (м, 1H), 8,31 (с, 1H), 8,20 (с, 1H), 7,63~7,72 (м, 3H), 7,39~7,47 (м, 3H), 7,27 (дт, 1H, J=8,4, 2,7 Гц), 6,99 (дд, 1H, J=8,8, 1,9 Гц), 2,95 (с, 3H), 2,81 (д, 3H, J=4,6 Гц),
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,73 (с, 1H), 10,38 (с, 1H), 9,64 (ушир.с, 1H), 8,04 (с, 1H), 7,94 (с, 1H), 7,60~7,68 (м, 2H), 7,38~7,45 (м, 3H), 7,21~7,27 (m 2H), 7,00 (дд, 1H, J=8,4, 1,5 Гц), 3,00 (с, 6H), 2,95 (с, 3H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,73 (с, 1H), 10,39 (с, 1H), 9,64 (ушир.с, 1H), 8,04 (с, 1H), 7,94 (с, 1H), 7,60~7,68 (м, 2H), 7,37~7,45 (м, 3H), 7,22~7,27 (m 2H), 7,00 (дд, 1H, J=8,4, 1,9 Гц), 3,38~3,67 (м, 4H), 2,95 (с, 3H), 1,46~1,70 (м, 6H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,74 (с, 1H), 10,41 (с, 1H), 9,65 (ушир.с, 1H), 8,07 (с, 1H), 7,97 (с, 1H), 7,61~7,70 (м, 2H), 7,39~7,47 (м, 3H), 7,23~7,28 (m 2H), 7,01 (дд, 1H, J=8,8, 1,9 Гц), 3,35~3,72 (м, 8H), 2,96 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,75 (с, 1H), 9,74 (с, 1H), 8,34 (с, 1H), 8,10 (д, 1H, J=10,3 Гц), 7,99~8,02 (м, 2H), 7,90 (с, 1H), 7,65 (м, 1H), 7,42 (м, 1H), 7,36 (с, 1H), 7,24 (м, 1H), 3,07 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,73 (с, 1H), 9,90 (с, 1H), 8,34 (с, 1H), 8,04 (д, 1H, J=8,7 Гц), 8,00 (с, 1H), 7,90 (с, 1H), 7,82 (с, 1H), 7,65 (дд, 1H, J=15,6, 8,8 Гц), 7,44 (т, 1H, J=11,1 Гц), 7,36~7,39 (м, 2H), 7,25 (т, 1H, J=8,3 Гц), 3,03 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,72 (с, 1H), 9,90 (с, 1H), 8,34 (с, 1H), 8,03~8,06 (м, 2H), 7,98 (с, 1H), 7,83 (с, 1H), 7,60 (с, 1H), 7,37 (д, 1H, J=8,7 Гц), 7,29 (с, 1H), 7,22 (с, 1H), 7,02 (с, 1H), 3,80 (с, 3H), 3,03 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,77 (с, 1H), 9,79 (с, 1H), 8,34 (с, 1H), 8,11 (д, 1H, J=10,3 Гц), 8,01~8,03 (м, 2H), 7,97 (с, 1H), 7,60 (с, 1H), 7,29 (с, 1H), 7,22 (с, 1H), 7,02 (с, 1H), 3,89 (с, 3H), 3,07 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,86 (с, 1H), 8,36 (с, 1H), 8,24 (д, 1H, J=7,6 Гц), 8,17 (д, 1H, J=10,4 Гц), 8,02 (т, 1H, J=2,0 Гц), 7,98 (с, 1H), 7,60 (с, 1H), 7,31 (т, 1H, J=2,0 Гц), 7,24 (с, 1H), 7,03 (с, 1H), 3,91 (с, 3H), 3,31 (с, 3H), 3,15 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,73 (с, 1H), 10,10 (с, 1H), 8,34 (с, 1H), 8,05 (д, 1H, J=8,4 Гц), 8,01 (с, 1H), 7,91 (с, 1H), 7,84 (с, 1H), 7,63~7,69 (м, 1H), 7,42~7,48 (м, 1H), 7,38~7,40 (м, 2H), 7,24~7,29 (м, 1H), 3,91~4,02 (м, 2H), 3,80~3,88 (м, 2H), 3,64 (кв., 1H, J=6,4 Гц) 2,13~2,19 (м, 2H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,71 (с, 1H), 10,11 (с, 1H), 8,34 (с, 1H), 8,04 ~8,06 (м, 2H), 7,99 (с, 1H), 7,85 (с, 1H), 7,61 (с, 1H), 7,40 (д, 1H, J=8,4 Гц), 7,30 (с, 1H), 7,23 (с, 1H), 7,03 (с, 1H), 3,93~4,01 (м, 2H), 3,91 (с, 3H), 3,79~3,88 (м, 2H), 3,64 (кв., 1H, J=6,8 Гц) 2,13~2,16 (м, 2H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,85 (с, 1H), 8,36 (с, 1H), 8,24 (д, 1H, J=7,2 Гц), 8,17 (д, 1H, J=10,4 Гц), 8,00 (т, 1H, J=2,0 Гц), 7,91 (с, 1H), 7,59~7,70 (м, 1H), 7,45 (тд, 1H, J=10,2, 2,0 Гц), 7,38 (с, 1H), 7,26 (тд, 1H, J=8,0, 2,4 Гц), 3,30 (с, 3H), 3,15 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,71 (с, 1H), 9,95 (с, 1H), 8,27 (с, 1H), 7,97~8,00 (м, 3H), 7,89 (с, 1H), 7,65 (м, 1H), 7,45 (м, 1H), 7,36 (с, 1H), 7,25 (м, 1H), 3,80~3,96 (м, 4H), 3,66 (м, 1H), 2,16~2,18 (м, 2H)
1H-ЯМР (400 МГц, ДМСО-d6): δ 11,33 (ушир.с, 1H), 9,81 (ушир.с, 1H), 8,50 (с, 1H), 8,19 (с, 1H), 8,02 (м, 1H), 7,96 (д, 1H, J=8,8 Гц), 7,71 (д, 1H, J=2,0 Гц), 7,58 (с, 1H), 7,40 (м, 1H), 7,31 (дд, 1H, J=8,8, 2,0 Гц), 7,24 (тд, 1H, J=8,8, 3,0 Гц), 2,94 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,66 (с, 1H), 9,91 (ушир.с, 1H), 8,33 (с, 1H), 8,03 (д, 1H, J=8,7 Гц), 8,01 (с, 1H), 7,96 (с, 1H), 7,87 (с, 1H), 7,83 (с, 1H), 7,70 (м, 1H), 7,58 (с, 1H), 7,54 (м, 1H), 7,37 (дд, 1H, J=8,7, 2,0 Гц), 3,02 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,81 (с, 1H), 9,65 (с, 1H), 8,36 (с, 1H), 8,34 (с, 1H), 8,07 (с, 1H), 7,98 (с, 1H), 7,89 (с, 1H), 7,65 (дд, 1H, J=15,4, 8,7 Гц), 7,43 (тд, 1H, J=10,2, 2,3 Гц), 7,37 (с, 1H), 7,24 (тд, 1H, J=8,4, 2,3 Гц), 3,07 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,63 (с, 1H), 9,88 (ушир.с, 1H), 8,32 (с, 1H), 8,03 (д, 1H, J=8,7 Гц), 7,86 (с, 1H), 7,83 (с, 1H), 7,79 (с, 1H), 7,37 (дд, 1H, J=8,7, 1,8 Гц), 7,26 (с, 1H), 6,90 (с, 1H), 6,28 (м, 1H), 6,10 (м, 1H), 3,72 (с, 3H), 3,02 (с, 3H)
1H-ЯМР (400 МГц, ДМСО-d6): δ 12,21 (ушир.с, 1H), 10,35 (ушир.с, 1H), 9,89 (с, 1H), 7,96 (с, 1H), 7,89~7,91 (м, 2H), 7,81 (с, 1H), 7,65 (дд, 1H, J=15,6, 8,7 Гц), 7,32~7,44 (м, 3H), 7,23 (т, 1H, J=8,3 Гц), 3,03 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,67 (с, 1H), 9,89 (ушир.с, 1H), 8,33 (с, 1H), 8,03 (д, 1H, J=8,7 Гц), 7,99 (с, 1H), 7,91 (с, 1H), 7,82 (с, 1H), 7,61~7,66 (м, 2H), 7,56 (с, 1H), 7,37 (дд, 1H, J=8,7, 2,1 Гц), 7,18 (м, 1H), 3,02 (с, 3H)
Пример 337) Синтез N-(6-хлор-4-(2,4-дифторфенил)пиридин-2-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
(a) Синтез 2,6-дихлор-4-(2,4-дифторфенил)пиридина
Процедуру синтеза Примера 301-a повторяли за исключением использования 2,6-дихлор-4-йодпиридина (100,0 мг, 0,37 ммоль), получая 2,6-дихлор-4-(2,4-дифторфенил)пиридин (90,0 мг, 95%).
LC/MS ESI (+): 260 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,46 (м, 1H), 7,43 (с, 1H), 7,42 (с, 1H), 6,96-7,06 (м, 2H)
(b) Синтез 6-хлор-4-(2,4-дифторфенил)пиридин-2-амина
2,6-дихлор-4-(2,4-дифторфенил)пиридин (70,0 мг, 0,27 ммоль), NaN3 (34,9 мг, 0,54 ммоль), Cu2O (38,4 мг, 0,27 ммоль) и L-пролин (30,9 мг, 0,27 ммоль) растворяли в ДМСО (2,0 мл) с последующим перемешиванием при 100°C в течение 2 часов. После охлаждения до комнатной температуры, реакционную смесь экстрагировали EtOAc, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (амин силикагель, n-Hex : EtOAc = 9:1), получая 6-хлор-4-(2,4-дифторфенил)пиридин-2-амин (20,0 мг, 31%).
LC/MS ESI (+): 241 (M+1)
(c) Синтез N-(6-хлор-4-(2,4-дифторфенил)пиридин-2-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
Процедуру синтеза Примера 1 повторяли за исключением использования 6-хлор-4-(2,4-дифторфенил)пиридин-2-амина (5,0 мг, 0,02 ммоль), получая N-(6-хлор-4-(2,4-дифторфенил)пиридин-2-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (520,0 мкг, 5%).
LC/MS ESI (+): 494 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 11,52 (с, 1H), 8,51 (с, 1H), 8,38 (с, 1H), 7,94 (м, 1H), 7,78 (м, 1H), 7,69 (с, 1H), 7,47-7,52 (м, 2H), 7,27-7,32 (м, 2H), 2,93 (с, 3H)
Пример 338) Синтез N-(3-хлор-5-(пиразин-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
(a) Синтез 2-(3-хлор-5-нитрофенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана
1-бром-3-хлор-5-нитробензол (236,5 мг, 1,00 ммоль) и 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолан) (279,0 мг, 1,10 ммоль) растворяли в безводном ДМСО (2,0 мл) и добавляли Pd(dppf)2Cl2·CH2Cl2 (40,8 мг, 0,05 ммоль) и KOAc (294,0 мг, 3,00 ммоль). Реакционную смесь перемешивали при 120°C в течение 30 минут и охлаждали до комнатной температуры. После добавления воды, реакционную смесь экстрагировали EtOAc. Органический экстракт промывали насыщенным водным раствором NaHCO3 и солевым раствором, высушивали над безводным Na2SO4 и концентрировали при пониженном давлении, получая 2-(3-хлор-5-нитрофенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (280,0 мг).
LC/MS ESI (+): 202 (M+1): бороновую кислоту подтверждали масс-спектрометрией
(b) Синтез 2-(3-хлор-5-нитрофенил)пиразина
Процедуру синтеза Примера 301-a повторяли за исключением использования сырого 2-(3-хлор-5-нитрофенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (100,0 мг), получая 2-(3-хлор-5-нитрофенил)пиразин (44,0 мг, 53%).
LC/MS ESI (+): 236 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 9,12 (с, 1H), 8,81 (с, 1H), 8,72 (с, 1H), 8,66 (с, 1H), 8,40 (с, 1H), 8,32 (с, 1H)
(c) Синтез 3-хлор-5-(пиразин-2-ил)анилина
Процедуру синтеза Промежуточного соединения 39 повторяли за исключением использования 2-(3-хлор-5-нитрофенил)пиразина (44,0 мг, 0,19 ммоль), получая 3-хлор-5-(пиразин-2-ил)анилин (35,0 мг, 92%).
LC/MS ESI (+): 206 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ, 8,96 (с, 1H), 8,62 (с, 1H), 8,53 (с, 1H), 7,36 (с, 1H), 7,23 (с, 1H), 6,78 (с, 1H), 3,90 (ушир.с, 2H)
(d) Синтез N-(3-хлор-5-(пиразин-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
Процедуру синтеза Примера 1 повторяли за исключением использования 3-хлор-5-(пиразин-2-ил)анилина (35,0 мг, 0,17 ммоль), получая N-(3-хлор-5-(пиразин-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (10,0 мг, 13%).
LC/MS ESI (+): 459 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,73 (с, 1H), 9,85 (ушир.с, 1H), 9,24 (с, 1H), 8,71 (с, 1H), 8,63 (с, 1H), 8,44 (с, 1H), 8,29 (с, 1H), 8,06 (с, 1H), 7,95 (д, 1H, J=8,8 Гц), 7,93 (с, 1H), 7,73 (с, 1H), 7,29 (д, 1H, J=8,8 Гц), 2,93 (с, 3H)
Способом синтеза согласно Примеру 338 синтезировали соединения Примера 339 и Примера 340, и данные для каждого примера являются следующими.
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,86 (с, 1H), 9,90 (ушир.с, 1H), 9,35 (с, 1H), 8,85 (с, 1H), 8,45 (с, 1H), 8,39 (с, 1H), 8,22 (с, 1H), 8,03~8,06 (м, 2H), 7,83 (с, 1H), 7,37 (д, 1H, J=8,8 Гц), 3,02 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,68 (с, 1H), 9,88 (ушир.с, 1H), 8,32 (с, 1H), 8,04 (д, 1H, J=8,7 Гц), 7,93 (с, 1H), 7,83 (с, 1H), 7,82 (с, 1H), 7,76 (с, 1H), 7,37 (дд, 1H, J=8,7, 1,8 Гц), 7,36 (с, 1H), 7,17 (с, 1H), 3,74 (с, 3H), 3,02 (с, 3H)
Пример 341 и Пример 342) Синтез N-(5-бром-2',4'-дифтор-[1,1'-бифенил]-3-ил)-1-метил-6-(N-метилметилсульфонамидо)-1H-индол-2-карбоксамида и N-(5-бром-2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-(N-метилметилсульфонамидо)-1H-индол-2-карбоксамида
N-(5-бром-2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид (Пример 302) (26,5 мг, 0,05 ммоль), MeI (3,8 мкл, 0,06 ммоль) и K2CO3 (10,6 мг, 0,08 ммоль) растворяли в безводном DMF (1,0 мл) с последующим перемешиванием при комнатной температуре в течение 1 часа. Реакционную смесь экстрагировали EtOAc, и органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (амин силикагель, n-Hex : EtOAc = 2:1), получая соединения в форме твердых веществ белого цвета N-(5-бром-2',4'-дифтор-[1,1'-бифенил]-3-ил)-1-метил-6-(N-метилметилсульфонамидо)-1H-индол-2-карбоксамид (8,8 мг, 31%) и N-(5-бром-2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-(N-метилметилсульфонамидо)-1H-индол-2-карбоксамид (16,0 мг, 59%).
Пример 341)
LC/MS (ESI)+: 548 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,58 (с, 1H), 8,16 (с, 1H), 7,98 (с, 1H), 7,73 (д, 1H, J=8,4 Гц), 7,59-7,66 (м, 2H), 7,39-7,46 (м, 3H), 7,26 (дд, 1H, J=8,0, 3,1 Гц), 7,18 (д, 1H, J=8,8 Гц), 4,03 (с, 3H), 3,32 (с, 3H), 2,99 (с, 3H)
Пример 342)
1H-ЯМР (300 МГц, ДМСО-d6): δ 12,34 (с, 1H), 10,47 (с, 1H), 8,08 (с, 1H), 7,94 (с, 1H), 7,60-7,70 (м, 1H), 7,39-7,48 (м, 5H), 7,21-7,30 (м, 2H), 3,30 (с, 3H), 2,95 (с, 3H)
Способами синтеза согласно Примерам 341 и 342 синтезировали соединения с Примера 343 по Пример 348, и данные для каждого примера являются следующими.
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,47 (с, 1H), 7,82~7,87 (м, 3H), 7,73~7,77 (м, 2H), 7,61~7,67 (м, 2H), 7,40~7,46 (м, 2H), 7,35 (с, 1H), 7,18 (дд, 1H, J=8,6, 1,7 Гц), 7,05 (д, 1H, J=7,8 Гц), 4,01 (с, 3H), 3,31 (с, 3H), 2,99 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,90 (с, 1H), 10,37 (с, 1H), 7,99 (д, 1H, J=1,5 Гц), 7,89 (д, 1H, J=8,0 Гц), 7,72 (д, 1H, J=8,4 Гц), 7,57~7,65 (м, 1H), 7,36~7,51 (м, 4H), 7,21~7,28 (м, 2H), 7,16 (дд, 1H, J=8,4, 1,9 Гц), 3,28 (с, 3H), 2,95 (с, 3H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 10,47 (с, 1H), 8,02 (д, 1H, J=1,5 Гц), 7,84 (дд, 1H, J=8,0, 1,6 Гц), 7,72 (д, 1H, J=8,4 Гц), 7,66 (д, 1H, J=1,5 Гц), 7,50~7,64 (м, 1H), 7,40~7,47 (м, 2H), 7,39 (с, 1H), 7,19~7,25 (м, 2H), 7,19 (дд, 1H, J=8,4, 1,9 Гц), 4,03 (с, 3H), 3,32 (с, 3H), 2,99 (с, 3H)
1H-ЯМР(300 МГц, CDCl3+ДМСО-d6): δ 10,74 (с, 1H), 9,46 (с, 1H), 7,83~7,87 (м, 1H), 7,75~7,77 (м, 2H), 7,67 (д, 1H, J=8,6 Гц), 7,59 (т, 1H, J=7,3 Гц), 7,47~7,52 (м, 2H), 7,36~7,42 (м, 3H), 7,08~7,15 (м, 2H), 3,38 (с, 3H), 2,88 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,43 (с, 1H), 7,71 (д, 1H, J=9,2 Гц), 7,65 (с, 1H), 7,58~7,65 (м, 2H), 7,53 (с, 1H), 7,38~7,43 (м, 1H), 7,36 (с, 1H), 7,16~7,22 (м, 2H), 6,82 (с, 1H), 4,02 (с, 3H), 3,82 (с, 3H), 3,32 (с, 3H), 2,99 (с, 3H)
Пример 349) Синтез N-(2',4'-дифтор-5-(6-фторпиридин-3-ил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
(a) Синтез 5-бром-2',4'-дифтор-[1,1'-бифенил]-3-амина
3,5-диброманилин (2,3 г, 9,06 ммоль), (2,4-дифторфенил)бороновую кислоту (1,4 г, 9,06 ммоль), Pd(PPh3)4 (1,0 г, 0,91 ммоль) и Na2CO3 (2,9 г, 27,18 ммоль) добавляли к смеси DME/H2O (85,0 мл, 4/1 об./об.) с последующим перемешиванием при 85°C в течение 4 часов. Реакционную смесь охлаждали до комнатной температуры и экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 4:1), получая 5-бром-2',4'-дифтор-[1,1'-бифенил]-3-амин (1,1 г, 43%) в форме твердого вещества желтого цвета.
LC/MS ESI (+): 284 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 7,50 (тд, 1H, J=8,8, 6,9 Гц), 7,33 (ддд, 1H, J=11,1, 9,5, 2,7 Гц), 7,15 (м, 1H), 6,77 (м, 1H), 6,73 (м, 1H), 6,66 (м, 1H), 5,56 (с, 2H)
(b) Синтез 2',4'-дифтор-5-(6-фторпиридин-3-ил)-[1,1'-бифенил]-3-амина
5-бром-2',4'-дифтор-[1,1'-бифенил]-3-амин (50,0 мг, 0,76 ммоль), (6-фторпиридин-3-ил)бороновую кислоту (50,0 мг, 0,35 ммоль), Pd(dppf)Cl2 (14,0 мг, 0,02 ммоль) и K2CO3 (49,0 мг, 0,35 ммоль) добавляли к смеси DMA/H2O (2,2 мл, 9/1 об./об.). Реакцию осуществляли в микроволновом реакторе мощностью 100 Вт при 100°C в течение 30 минут. Реакционную смесь охлаждали до комнатной температуры и затем экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 2:1), получая 2',4'-дифтор-5-(6-фторпиридин-3-ил)-[1,1'-бифенил]-3-амин (32,0 мг, 61%) в форме бесцветного масла.
LC/MS ESI (+): 301 (M+1)
1H-ЯМР (300 МГц, CDCl3): δ 8,42 (м, 1H), 7,97 (тд, 1H, J=8,4, 2,5 Гц), 7,44 (м, 1H), 6,89-7,02 (м, 4H), 6,84-6,85 (м, 2H), 3,89 (ушир.с, 2H)
(c) Синтез N-(2',4'-дифтор-5-(6-фторпиридин-3-ил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
Гидрохлорид 6-(метилсульфонамидо)-1H-индол-2-карбоновой кислоты (29,0 мг, 0,10 ммоль), 2',4'-дифтор-5-(6-фторпиридин-3-ил)-[1,1'-бифенил]-3-амин (30,0 мг, 0,10 ммоль) и HATU (42,0 мг, 0,11 ммоль) растворяли в безводном DMF (2,0 мл) и добавляли DIPEA (26,0 мкл, 0,15 ммоль). Реакционную смесь перемешивали при 40°C в течение 14 часов, и реакционную смесь экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 2:3), получая N-(2',4'-дифтор-5-(6-фторпиридин-3-ил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид (22,0 мг, 40 %) в форме твердого вещества белого цвета.
LC/MS ESI (+): 537 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,74 (с, 1H), 10,41 (с, 1H), 9,66 (с, 1H), 8,61 (д, 1H, J=1,9 Гц), 8,35 (дт, 1H, J=8,4, 2,7 Гц), 8,17 (м, 1H), 8,08 (м, 1H), 7,76 (м, 1H), 7,66 (д, 1H, J=8,6 Гц), 7,57 (ушир.с, 1H), 7,41-7,48 (м, 3H), 7,35 (дд, 1H, J=8,6, 2,9 Гц), 7,26 (дт, 1H, J=8,6, 2,9 Гц), 6,99 (дд, 1H, J=8,6, 1,5 Гц), 2,95 (с, 3H)
Способом синтеза согласно Примеру 349 синтезировали соединения с Примера 350 по Пример 363, и данные для каждого примера являются следующими.
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,71 (с, 1H), 10,29 (с, 1H), 9,64 (ушир.с, 1H), 7,90~7,94 (м, 2H), 7,59~7,67 (м, 2H), 7,31~7,45 (м, 4H), 7,19~7,27 (м, 2H), 6,98 (дд, 1H, J=8,8, 1,9 Гц), 6,36~6,37 (м, 1H), 6,31~6,33 (м, 1H), 2,94 (с, 3H), 1,30 (с, 9H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 13,02 (ушир.с, 1H), 11,71 (с, 1H), 10,27 (с, 1H), 9,63 (ушир.с, 1H), 8,22~8,24 (м, 1H), 8,01~8,04 (м, 1H), 7,91~7,93 (м, 1H), 7,83 (с, 1H), 7,63~7,76 (м, 2H), 7,48 (с, 1H), 7,35~7,45 (м, 3H), 7,25 (дт, 1H, J=7,7, 1,8 Гц), 6,98 (дд, 1H, J=8,5, 1,8 Гц), 2,95 (с, 3H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,73 (с, 1H), 11,41 (ушир.с, 1H), 10,27 (с, 1H), 9,64 (ушир.с, 1H), 8,07 (с, 1H), 7,77 (с, 1H), 7,63~7,71 (м, 2H), 7,53 (с, 1H), 7,38~7,46 (м, 3H), 7,26 (дт, 1H, J=8,4, 2,3 Гц), 7,00 (дд, 1H, J=8,8, 1,9 Гц), 6,88 (с, 1H), 6,52 (с, 1H), 6,16 (дд, 1H, J=5,3, 2,3 Гц), 2,95 (с, 3H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,76 (с, 1H), 10,33 (с, 1H), 9,65 (ушир.с, 1H), 7,98 (с, 1H), 7,91 (с, 1H), 7,63~7,71 (м, 2H), 7,38~7,45 (м, 3H), 7,29 (д, 1H, J=1,5 Гц), 7,24 (дт, 1H, J=9,6, 2,6 Гц), 6,99 (дд, 1H, J=8,5, 1,8 Гц), 6,89 (т, 1H, J=2,6 Гц), 6,27 (дд, 1H, J=3,7, 1,8 Гц), 6,10 (дд, 1H, J=3,7, 2,6 Гц), 3,74 (с, 3H), 2,94 (с, 3H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,74 (с, 1H), 10,37 (с, 1H), 9,64 (ушир.с, 1H), 8,19 (с, 1H), 7,97 (с, 1H), 7,53~7,74 (м, 5H), 7,39~7,47 (м, 3H), 7,26 (дт, 1H, J=8,8, 1,9 Гц), 7,19 (дд, 1H, J=5,3, 3,8 Гц), 7,00 (дд, 1H, J=8,4, 1,9 Гц), 2,95 (с, 3H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,75 (с, 1H), 10,35 (с, 1H), 9,66 (ушир.с, 1H), 8,16 (с, 1H), 7,95 (д, 1H, J=1,5 Гц), 7,92 (дд, 1H, J=3,1, 1,5 Гц), 7,64~7,74 (м, 3H), 7,57~7,58 (м, 2H), 7,39~7,47 (м, 3H), 7,25 (дт, 1H, J=8,8, 1,9 Гц), 7,00 (дд, 1H, J=8,4, 1,9 Гц), 2,95 (с, 3H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,74 (с, 1H), 10,44 (с, 1H), 9,56 (ушир.с, 1H), 8,70 (д, 2H, J=6,1 Гц), 8,27 (с, 1H), 8,12 (с, 1H), 7,65~7,73 (м, 1H), 7,73 (д, 2H, J=6,1 Гц), 7,57~7,60 (м, 2H), 7,35~7,42 (м, 3H), 7,26 (дт, 1H, J=8,4, 1,9 Гц), 7,00 (дд, 1H, J=8,8, 1,9 Гц), 2,95 (с, 3H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,74 (с, 1H), 10,41 (с, 1H), 9,64 (ушир.с, 1H), 8,94 (с, 1H), 8,61 (д, 1H, J=5,0 Гц), 8,05~8,20 (м, 3H), 7,74~7,78 (м, 1H), 7,63~7,67 (м, 1H), 7,51~7,58 (м, 2H), 7,36~7,47 (м, 3H), 7,26 (дт, 1H, J=8,4, 1,9 Гц), 6,99 (дд, 1H, J=8,4, 1,9 Гц), 2,94 (с, 3H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,76 (с, 1H), 10,47 (с, 1H), 9,67 (ушир.с, 1H), 9,15 (с, 1H), 8,42 (д, 1H, J=8,0 Гц), 8,28 (с, 1H), 8,13 (с, 1H), 8,04 (д, 1H, J=8,4 Гц), 7,72~7,80 (м, 1H), 7,65~7,77 (м, 2H), 7,39~7,46 (м, 3H), 7,25 (дт, 1H, J=8,8, 2,3 Гц), 7,00 (дд, 1H, J=8,4, 1,9 Гц), 2,96 (с, 3H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,75 (с, 1H), 10,46 (с, 1H), 9,66 (ушир.с, 1H), 9,15 (с, 1H), 8,41 (дд, 1H, J=8,0, 2,3 Гц), 8,27 (с, 1H), 8,15~8,18 (м, 2H), 7,64~7,82 (м, 3H), 7,39~7,47 (м, 3H), 7,27 (дт, 1H, J=8,8, 2,3 Гц), 7,00 (дд, 1H, J=8,8, 1,9 Гц), 2,95 (с, 3H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,76 (с, 1H), 10,45 (с, 1H), 9,67 (ушир.с, 1H), 9,25 (с, 1H), 9,19 (с, 2H), 8,23 (с, 1H), 8,13 (с, 1H), 7,73~7,81 (м, 1H), 7,65~7,68 (м, 2H), 7,41~7,46 (м, 3H), 7,27 (дт, 1H, J=8,8, 1,9 Гц), 7,00 (дд, 1H, J=8,4, 1,9 Гц), 2,96 (с, 3H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,72 (с, 1H), 10,33 (с, 1H), 9,64 (ушир.с, 1H), 8,62 (с, 2H), 8,05 (с, 1H), 7,99 (с, 1H), 7,71~7,74 (м, 1H), 7,64 (д, 1H, J=8,5 Гц), 7,48 (с, 1H), 7,34~7,45 (м, 3H), 7,25 (дт, 1H, J=7,7, 1,8 Гц), 7,00 (дд, 1H, J=8,8, 1,8 Гц), 6,87 (с, 2H), 2,94 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,70 (с, 1H), 10,38 (с, 1H), 9,68 (с, 1H), 8,07 (с, 2H), 7,62~7,73 (м, 3H), 7,37~7,46 (м, 5H), 7,25 (тд, 2H, J=8,4, 2,7 Гц), 6,98 (дд, 1H, J=8,8, 1,9 Гц), 2,93 (с, 3H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,72 (с, 1H), 10,38 (с, 1H), 9,65 (ушир.с, 1H), 7,97 (с, 1H), 7,94 (с, 1H), 7,64 (д, 1H, J=8,4 Гц), 7,56~7,66 (м, 1H), 7,38~7,46 (м, 3H), 7,21~7,28 (м, 2H), 6,99 (дд, 1H, J=8,4, 1,5 Гц), 4,16 (с, 2H), 2,94 (с, 3H)
Пример 364) Синтез N-(2',4'-дифтор-5-(6-гидроксипиридин-3-ил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
(a) Синтез 5-(5-амино-2',4'-дифтор-[1,1'-бифенил]-3-ил)пиридин-2-ола
2',4'-дифтор-5-(6-фторпиридин-3-ил)-[1,1'-бифенил]-3-амин (32,0 мг, 0,11 ммоль) растворяли в 1,4-диоксане (2,0 мл), и смесь 6н. HCl/1,4-диоксан (444,0 мкл) медленно добавляли при 0°C. Смесь перемешивали при 100°C в течение 2 часов и затем подщелачивали насыщ. водным раствором NaHCO3 (pH 9), и реакционную смесь экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (амин силикагель, n-Hex : EtOAc = 1:1), получая 5-(5-амино-2',4'-дифтор-[1,1'-бифенил]-3-ил)пиридин-2-ол (20,0 мг, 63%) в форме твердого вещества желтого цвета.
LC/MS ESI (+): 299 (M+1)
(b) Синтез N-(2',4'-дифтор-5-(6-гидроксипиридин-3-ил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
6-(метилсульфонамидо)-1H-индол-2-карбоновую кислоту (29,0 мг, 0,10 ммоль), 5-(5-амино-2',4'-дифтор-[1,1'-бифенил]-3-ил)пиридин-2-ол (30,0 мг, 0,10 ммоль), HATU (42,0 мг, 0,11 ммоль) и DIPEA (26,0 мкл, 0,15 ммоль) растворяли в безводном DMF (2,0 мл) с последующим перемешиванием при 40°C в течение 12 часов. Реакционную смесь экстрагировали EtOAc, и органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток сначала очищали флэш-хроматографией на колонках, и остаток очищали флэш-хроматографией на колонках (амин силикагель, n-Hex : EtOAc = 1:1), получая N-(2',4'-дифтор-5-(6-гидроксипиридин-3-ил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид (7,6 мг, 14%) в форме твердого вещества белого цвета.
LC/MS ESI (+): 535 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,82 (ушир.с, 1H), 11,65 (с, 1H), 10,25 (с, 1H), 9,57 (с, 1H), 7,95-8,00 (м, 2H), 7,86 (дд, 1H, J=9,5, 3,0 Гц), 7,63-7,77 (м, 3H), 7,34-7,42 (м, 4H), 7,23 (дт, 1H, J=8,3, 2,8 Гц), 7,00 (дд, 1H, J=8,6, 1,9 Гц), 6,49 (д, 1H, J=9,3 Гц), 2,95 (с, 3H)
Пример 365) Синтез N-(5-этинил-2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
(a) Синтез 2',4'-дифтор-5-((триметилсилил)этинил)-[1,1'-бифенил]-3-амина
5-бром-2',4'-дифтор-[1,1'-бифенил]-3-амин (100,0 мг, 0,35 ммоль), этинилтриметилсилан (149,0 мкл, 1,06 ммоль), Pd(t-Bu3P)2 (180,0 мг, 0,04 ммоль), CuI (67,0 мг, 0,04 ммоль) и Et3N (147,0 мкл, 1,06 ммоль) добавляли к 1,4-диоксану (3,0 мл) с последующим перемешиванием при 40°C в течение 17 минут, и реакционную смесь охлаждали до комнатной температуры и затем экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 2:1), получая 2',4'-дифтор-5-((триметилсилил)этинил)-[1,1'-бифенил]-3-амин (75,0 мг, 71%) в форме твердого вещества белого цвета.
LC/MS ESI (+): 302 (M+1)
1H-ЯМР (300 МГц, CDCl3): δ 7,36 (м, 1H), 7,00 (м, 1H), 6,84-6,95 (м, 2H), 6,76-6,80 (м, 2H), 3,72 (ушир.с, 2H), 1,57 (с, 9H)
(b) Синтез 5-этинил-2',4'-дифтор-[1,1'-бифенил]-3-амина
2',4'-дифтор-5-((триметилсилил)этинил)-[1,1'-бифенил]-3-амин (71,0 мг, 0,24 ммоль) растворяли в безводном MeOH (2,0 мл) и добавляли K2CO3 (33,0 мг, 0,24 ммоль). Реакционную смесь перемешивали при 17°C в течение 3 часов, и реакционную смесь экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 20:1), получая 5-этинил-2',4'-дифтор-[1,1'-бифенил]-3-амин (45,0 мг, 83%) в форме твердого вещества желтого цвета.
LC/MS ESI (+): 230 (M+1)
1H-ЯМР (300 МГц, CDCl3): δ 7,36 (м, 1H), 7,00 (м, 1H), 6,86-6,96 (м, 2H), 6,80-6,83 (м, 2H), 3,72 (ушир.с, 2H), 3,04 (с, 1H)
(c) Синтез N-(5-этинил-2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
Гидрохлорид 6-(метилсульфонамидо)-1H-индол-2-карбоновой кислоты (57,0 мг, 0,20 ммоль), 5-этинил-2',4'-дифтор-[1,1'-бифенил]-3-амин (45,0 мг, 0,20 ммоль), HATU (82,0 мг, 0,22 ммоль) и DIPEA (51,0 мкл, 0,29 ммоль) растворяли в безводном DMF (2,0 мл) с последующим перемешиванием при 16°C в течение 16 часов. Реакционную смесь экстрагировали EtOAc, и органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 1:1), получая N-(5-этинил-2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид (28,9 мг, 32%) в форме твердого вещества белого цвета.
LC/MS ESI (+): 466 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,74 (с, 1H), 10,35 (с, 1H), 9,65 (с, 1H), 8,05 (м, 1H), 8,00 (м, 1H), 7,60-7,68 (м, 2H), 7,39-7,46 (м, 3H), 7,34 (м, 1H), 7,24 (дт, 1H, J=8,4, 2,5 Гц), 6,99 (дд, 1H, J=8,6, 1,9 Гц), 4,30 (с, 1H), 2,95 (с, 3H)
Пример 366) Синтез N-(5-(2,2-дифторэтокси)-2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
(a) Синтез 2',4'-дифтор-5-нитро-[1,1'-бифенил]-3-ола
2,4-дифтор-3'-метокси-5'-нитро-1,1'-бифенил (753,0 мг, 2,84 ммоль) растворяли в безводном CH2Cl2 (28,4 мл), и 1,0 M раствор BBr3 в CH2Cl2 (11,4 мл) медленно добавляли при 0°C. Смесь перемешивали при 0°C в течение 10 часов, медленно добавляли MeOH. Реакционную смесь экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 4:1), получая 2',4'-дифтор-5-нитро-[1,1'-бифенил]-3-ол (187,0 мг, 82%) в форме твердого вещества желтого цвета.
1H-ЯМР (300 МГц, CDCl3): δ 7,96 (с, 1H), 7,69-7,71 (м, 1H), 7,32-7,49 (м, 1H), 7,32-7,33 (м, 1H), 6,93-7,04 (м, 2H), 5,48 (с, 1H)
(b) Синтез 3'-(2,2-дифторэтокси)-2,4-дифтор-5'-нитро-1,1'-бифенила
2',4'-дифтор-5-нитро-[1,1'-бифенил]-3-ол (100,0 мг, 0,40 ммоль) растворяли в безводном DMF (2,0 мл) и добавляли K2CO3 (110,0 мг, 0,80 ммоль) и 2-йод-1,1-дифторэтан (42,0 мкл, 0,48 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 24 часов, и реакционную смесь экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 3:1), получая 3'-(2,2-дифторэтокси)-2,4-дифтор-5'-нитро-1,1'-бифенил (107,0 мг, 91%) в форме твердого вещества белого цвета.
1H-ЯМР (300 МГц, CDCl3): δ 8,05 (с, 1H), 7,76-7,78 (м, 1H), 7,41-7,49 (м, 2H), 6,95-7,04 (м, 2H), 6,14 (тт, 1H, J=54,6, 3,8 Гц), 4,32 (тд, 2H, J=12,6, 3,8 Гц)
(c) Синтез 5-(2,2-дифторэтокси)-2',4'-дифтор-[1,1'-бифенил]-3-амина
3'-(2,2-дифторэтокси)-2,4-дифтор-5'-нитро-1,1'-бифенил (107,0 мг, 0,34 ммоль) растворяли в смеси MeOH/H2O (3,4 мл, 8/1 об./об.) и добавляли Zn (333,0 мг, 5,09 ммоль) и NH4Cl (91,0 мг, 1,70 ммоль). Реакционную смесь обрабатывали ультразвуком в течение 2 часов, фильтровали через Целит и концентрировали при пониженном давлении. Остаток экстрагировали EtOAc, и органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (амин силикагель, n-Hex : EtOAc = 1:1), получая 5-(2,2-дифторэтокси)-2',4'-дифтор-[1,1'-бифенил]-3-амин (96,0 мг, 99%) в форме бесцветного масла.
LC/MS ESI (+): 286 (M+1)
(d) Синтез N-(5-(2,2-дифторэтокси)-2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
Гидрохлорид 6-(метилсульфонамидо)-1H-индол-2-карбоновой кислоты (44,8 мг, 0,15 ммоль), 5-(2,2-дифторэтокси)-2',4'-дифтор-[1,1'-бифенил]-3-амин (48,5 мг, 0,17 ммоль) и HATU (64,6 мг, 0,17 ммоль) растворяли в безводном DMF (3,0 мл). Медленно добавляли DIPEA (40,0 мкл, 0,23 ммоль) с последующим перемешиванием при комнатной температуре в течение 24 часов. Реакционную смесь экстрагировали EtOAc, и органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (амин силикагель, CH2Cl2 : MeOH = 30:1), получая N-(5-(2,2-дифторэтокси)-2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид (8,7 мг, 11%) в форме твердого вещества белого цвета.
LC/MS ESI (+): 522 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,73 (с, 1H), 10,27 (с, 1H), 9,64 (с, 1H), 7,60-7,68 (м, 4H), 7,36-7,44 (м, 3H), 7,23 (тд, 1H, J=8,4, 1,9 Гц), 6,99 (дд, 1H, J=8,4, 1,9 Гц), 6,91 (с, 1H), 6,44 (тт, 1H, J=54,6, 3,4 Гц), 4,39 (тд, 2H, J=14,9, 3,4 Гц), 2,94 (с, 3H)
Способом синтеза согласно Примеру 366 синтезировали соединения с Примера 367 по Пример 370, и данные для каждого примера являются следующими.
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,70 (с, 1H), 10,21 (с, 1H), 9,64 (с, 1H), 7,56~7,65 (м, 4H), 7,34~7,42 (м, 3H), 7,21 (тд, 1H, J=8,4, 2,3 Гц), 6,99 (дд, 1H, J=8,8, 1,5 Гц), 6,80 (с, 1H), 3,81 (д, 2H, J=6,5 Гц), 2,94 (с, 3H), 1,98~2,11 (м, 1H), 1,01 (д, 6H, J=6,9 Гц)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,74 (с, 1H), 10,34 (с, 1H), 9,64 (с, 1H), 7,59~7,71 (м, 4H), 7,39~7,46 (м, 3H), 7,22~7,29 (м, 1H), 6,97~7,00 (м, 2H), 5,24 (с, 2H), 2,94 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,75 (с, 1H), 10,42 (с, 1H), 9,65 (с, 1H), 7,84~7,85 (м, 2H), 7,60~7,69 (м, 2H), 7,40~7,47 (м, 3H), 7,32 (т, 1H, J=74,0 Гц), 7,26 (дт, 1H, J=8,8, 2,3 Гц), 7,07 (ушир.с, 1H), 6,99 (дд, 1H, J=8,6, 1,9 Гц), 2,94 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,73 (с, 1H), 9,80 (с, 1H), 8,33 (с, 1H), 8,03 (д, 1H, J=8,8 Гц), 7,81~7,84 (м, 2H), 7,77 (с, 1H), 7,64 (м, 1H), 7,35~7,48 (м, 2H), 7,33 (т, 1H, J=73,8 Гц), 7,26 (т, 1H, J=8,1 Гц), 7,10 (с, 1H), 3,02 (с, 3H)
Пример 371) Синтез N-(2',4'-дифтор-5-(пиперидин-1-ил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
(a) Синтез 1-(3-йод-5-нитрофенил)пиперидина
1-фтор-3-йод-5-нитробензол (500,0 мг, 1,87 ммоль) растворяли в безводном DMF (10,0 мл) и добавляли K2CO3 (518,0 мг, 3,75 ммоль) и пиперидин (185,0 мкл, 1,87 ммоль). Смесь перемешивали при 130°C в течение 16 часов, и реакционную смесь экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 10:1), получая 1-(3-йод-5-нитрофенил)пиперидин (330,0 мг, 53%) в форме твердого вещества белого цвета.
LC/MS ESI (+): 333 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 7,73 (с, 1H), 7,59-7,63 (м, 2H), 3,28-3,32 (м, 4H), 1,53-1,64 (м, 6H)
(b) Синтез 1-(2',4'-дифтор-5-нитро-[1,1'-бифенил]-3-ил)пиперидина
1-(3-йод-5-нитрофенил)пиперидин (250,0 мг, 0,75 ммоль), (2,4-дифторфенил)бороновую кислоту (125,0 мг, 0,79 ммоль), Pd(PPh3)4 (87,0 мг, 0,09 ммоль) и Na2CO3 (239,0 мг, 2,26 ммоль) добавляли к смеси DME/H2O (7,5 мл, 4/1 об./об.) с последующим перемешиванием при 85°C в течение 4 часов. Реакционную смесь охлаждали до комнатной температуры и экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 4:1), получая 1-(2',4'-дифтор-5-нитро-[1,1'-бифенил]-3-ил)пиперидин (260,0 мг, 100%) в форме твердого вещества белого цвета.
LC/MS ESI (+): 319 (M+1)
(c) Синтез 2',4'-дифтор-5-(пиперидин-1-ил)-[1,1'-бифенил]-3-амин
1-(2',4'-дифтор-5-нитро-[1,1'-бифенил]-3-ил)пиперидин (260,0 мг, 0,82 ммоль) растворяли в смеси THF/MeOH/H2O (10,0 мл, 1/2/0,5 об./об.), и Zn (534,0 мг, 8,17 ммоль) и NH4Cl (131,0 мг, 2,45 ммоль) добавляли при комнатной температуре. Реакционную смесь обрабатывали ультразвуком в течение 1 часа, охлаждали до комнатной температуры, фильтровали через Целит и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, CH2Cl2 : MeOH = 97:3), получая 2',4'-дифтор-5-(пиперидин-1-ил)-[1,1'-бифенил]-3-амин (98,0 мг, 42%) в форме твердого вещества грязно-белого цвета.
LC/MS ESI (+): 289 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 7,46 (тд, 1H, J=9,0, 6,9 Гц), 7,23-7,30 (м, 1H), 7,11 (м, 1H), 6,18-6,19 (м, 2H), 6,14 (м, 1H), 4,99 (с, 2H), 3,05-3,19 (м, 4H), 1,51-1,59 (м, 6H)
(d) Синтез N-(2',4'-дифтор-5-(пиперидин-1-ил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
Гидрохлорид 6-(метилсульфонамидо)-1H-индол-2-карбоновой кислоты (50,0 мг, 0,17 ммоль), 2',4'-дифтор-5-(пиперидин-1-ил)-[1,1'-бифенил]-3-амин (50,0 мг, 0,17 ммоль), HATU (72,0 мг, 0,19 ммоль) и DIPEA (45,0 мкл, 0,26 ммоль) растворяли в безводном DMF (3,0 мл) с последующим перемешиванием при 40°C в течение 14 часов. Реакционную смесь экстрагировали EtOAc, и органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, CH2Cl2 : MeOH = 30:1), получая N-(2',4'-дифтор-5-(пиперидин-1-ил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид (23,0 мг, 26%) в форме твердого вещества белого цвета.
LC/MS ESI (+): 525 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,65 (с, 1H), 10,06 (с, 1H), 9,61 (ушир.с, 1H), 7,54-7,64 (м, 2H), 7,44-7,46 (м, 2H), 7,31-7,39 (м, 3H), 7,19 (дт, 1H, J=8,4, 2,5 Гц), 6,98 (д, 1H, J=8,4 Гц), 6,76 (ушир.с, 1H), 3,20-3,23 (м, 4H), 2,94 (с, 3H), 1,57-1,65 (м, 6H)
Способом синтеза согласно Примеру 371 синтезировали соединения с Примера 372 по Пример 376, и данные для каждого примера являются следующими.
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,67 (с, 1H), 10,07 (с, 1H), 9,63 (ушир.с, 1H), 7,55~7,65 (м, 2H), 7,30~7,40 (м, 5H), 7,20 (дт, 1H, J=8,8, 2,5 Гц), 6,99 (дд, 1H, J=8,6, 1,5 Гц), 6,56 (ушир.с, 1H), 2,97 (с, 6H), 2,95 (с, 3H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,6 (с, 1H), 10,0 (с, 1H), 9,55 (ушир.с, 1H), 7,62 (д, 1H, J=8,6 Гц), 7,54 (м, 1H), 7,35 (м, 3H), 7,18 (м, 3H), 6,98 (дд, 1H, J=8,6, 1,5 Гц), 6,40 (м, 1H), 5,90 (м, 1H), 2,93 (с, 3H), 2,72 (д, 3H, J=5,0 Гц)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,66 (с, 1H), 10,11 (с, 1H), 9,61 (ушир.с, 1H), 7,55~7,64 (м, 2H), 7,46~7,50 (м, 2H), 7,32~7,39 (м, 3H), 7,20 (дт, 1H, J=8,8, 2,5 Гц), 6,98 (дд, 1H, J=8,8, 1,5 Гц), 6,80 (ушир.с, 1H), 3,77 (т, 4H, J=4,6 Гц), 3,17 (т, 4H, J=4,6 Гц), 2,94 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,37 (с, 1H), 9,87 (с, 1H), 8,33 (с, 1H), 8,02 (д, 1H, J=8,4 Гц), 7,80 (д, 1H, J=1,9 Гц), 7,54~7,62 (м, 1H), 7,30~7,39 (м, 3H), 7,16~7,25 (м, 2H), 6,58 (с, 1H), 3,02 (с, 3H), 2,96 (с, 6H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,41 (с, 1H), 9,75 (с, 1H), 7,74 (с, 1H), 7,70 (д, 1H, J=8,8 Гц), 7,65 (с, 1H), 7,53~7,61 (м, 1H), 7,31~7,38 (м, 3H), 7,28 (с, 1H), 7,19 (тд, 1H, J=8,4, 2,7 Гц), 6,58 (с, 1H), 2,98 (с, 3H), 2,95 (с, 6H)
Пример 377) Синтез N-(5'-карбамоил-4'-метокси-2'-(трифторметил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
(a) Синтез 4-метокси-3'-(6-(метилсульфонамидо)-1H-индол-2-карбоксамидо)-6-(трифторметил)-[1,1'-бифенил]-3-карбоновой кислоты
Метил-4-метокси-3'-(6-(метилсульфонамидо)-1H-индол-2-карбоксамидо)-6-(трифторметил)-[1,1'-бифенил]-3-карбоксилат (30,0 мг, 0,05 ммоль) растворяли в MeOH (1,0 мл) и добавляли 1н. NaOH водным раствором (300,0 мкл). Реакционную смесь перемешивали при 10°C в течение 17 часов, подкисляли до pH 3 1н. водным раствором HCl и экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении, получая 4-метокси-3'-(6-(метилсульфонамидо)-1H-индол-2-карбоксамидо)-6-(трифторметил)-[1,1'-бифенил]-3-карбоновую кислоту (29,0 мг, 99%) в форме твердого вещества белого цвета.
LC/MS ESI (+): 548 (M+1)
(b) Синтез N-(5'-карбамоил-4'-метокси-2'-(трифторметил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
4-Метокси-3'-(6-(метилсульфонамидо)-1H-индол-2-карбоксамидо)-6-(трифторметил)-[1,1'-бифенил]-3-карбоновую кислоту (29,0 мг, 0,05 ммоль), NH4Cl (14,0 мг, 0,27 ммоль), EDC (15,0 мг, 0,08 ммоль) и HOBt (11,0 мг, 0,08 ммоль) растворяли в безводном DMF (3,0 мл) и добавляли DIPEA (28,0 мкл, 0,20 ммоль). После перемешивания при 7°C в течение 16 часов, реакционную смесь экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, CH2Cl2 : MeOH = 20:1), получая N-(5'-карбамоил-4'-метокси-2'-(трифторметил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид (3,0 мг, 10%) в форме твердого вещества белого цвета.
LC/MS ESI (+): 547 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,73 (с, 1H), 10,26 (с, 1H), 9,63 (с, 1H), 7,77-7,88 (м, 4H), 7,68 (с, 1H), 7,63 (д, 1H, J=8,6 Гц), 7,37-7,48 (м, 4H), 6,96-7,04 (м, 2H), 4,02 (с, 3H), 2,94 (с, 3H)
Пример 378) Синтез N-(5'-карбамоил-4'-гидрокси-2'-(трифторметил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
N-(5'-карбамоил-4'-метокси-2'-(трифторметил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид (25,0 мг, 0,05 ммоль) растворяли в безводном CH2Cl2 (2,0 мл), и 1,0 M раствор BBr3 в CH2Cl2 (229,0 мкл) медленно добавляли при 0°C. После перемешивания при 7°C в течение 17 часов, медленно добавляли MeOH, с последующей экстракцией EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, CH2Cl2 : MeOH = 20:1), получая N-(5'-карбамоил-4'-гидрокси-2'-(трифторметил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид (2,0 мг, 8%) в форме твердого вещества белого цвета.
LC/MS ESI (+): 533 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 13,26 (с, 1H), 11,73 (с, 1H), 10,26 (с, 1H), 9,64 (с, 1H), 8,61 (ушир.с, 1H), 8,17 (ушир.с, 1H), 7,97 (с, 1H), 7,86-7,89 (м, 1H), 7,80 (м, 1H), 7,63 (д, 1H, J=8,6 Гц), 7,39-7,45 (м, 3H), 7,31 (с, 1H), 7,03-7,06 (м, 1H), 6,98 (дд, 1H, J=8,8, 1,7 Гц), 2,94 (с, 3H)
Способом синтеза согласно Примеру 377 синтезировали соединения с Примера 379 по Пример 381, и данные для каждого примера являются следующими.
1H-ЯМР (500 МГц, ДМСО-d6): δ 11,71 (с, 1H), 10,26 (с, 1H), 9,62 (с, 1H), 8,24 (с, 1H), 8,09 (д, 1H, J=8,1 Гц), 7,97 (д, 1H, J=8,6 Гц) 7,94 (с, 1H), 7,90 (д, 1H, J=7,0 Гц), 7,86 (с, 1H), 7,62~7,66 (м, 2H), 7,47 (т, 1H, J=8,0 Гц), 7,40 (м, 2H), 7,09 (д, 1H, J=7,3 Гц), 6,99 (д, 1H, J=9,0 Гц), 2,94 (с, 3H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,74 (с, 1H), 10,30 (с, 1H), 9,94 (с, 1H), 8,14 (с, 1H), 7,89~7,97 (м, 4H), 7,67 (д, 1H, J=8,1 Гц), 7,62 (д, 1H, J=8,7 Гц), 7,46~7,52 (м, 2H), 7,40 (д, 2H, J=5,4 Гц), 7,20 (д, 1H, J=7,2 Гц), 6,97 (дд, 1H, J=8,7, 1,8 Гц), 2,94 (с, 3H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,75 (с, 1H), 10,99 (с, 1H), 9,67 (с, 1H), 8,50 (д, 1H, J=5,4 Гц), 8,37 (с, 1H), 8,17 (с, 1H), 7,95~8,00 (м, 2H), 7,73 (д, 1H, J=8,4 Гц), 7,56~7,62 (м, 3H), 7,39 (с, 1H), 7,29 (дд, 1H, J=3,6, 1,2 Гц), 6,96 (дд, 1H, J=8,4, 1,5 Гц), 2,94 (с, 3H)
Пример 382) Синтез N-(2',4'-дифтор-5-(6-метоксипиридин-3-ил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
N-(5-бром-2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид (30,0 мг, 0,06 ммоль), (6-метоксипиридин-3-ил)бороновую кислоту (11,0 мг, 0,07 ммоль), Pd(PPh3)4 (20,0 мг, 0,02 ммоль) и Na2CO3 (18,0 мг, 0,17 ммоль) добавляли к смеси DME/H2O (0,6 мл, 5/1 об./об.) с последующим перемешиванием при 80°C в течение 14 часов. Реакционную смесь охлаждали до комнатной температуры и затем экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 1:1), получая N-(2',4'-дифтор-5-(6-метоксипиридин-3-ил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид (4,0 мг, 13%) в форме твердого вещества белого цвета.
LC/MS ESI (+): 549 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,71 (с, 1H), 10,37 (с, 1H), 9,64 (ушир.с, 1H), 8,51 (д, 1H, J=2,4 Гц), 8,09 (с, 1H), 8,05 (дд, 1H, J=8,3, 2,4 Гц), 8,01 (с, 1H), 7,69-7,73 (м, 1H), 7,62 (д, 1H, J=8,8 Гц), 7,48 (s 1H), 7,37-7,42 (м, 3H), 7,24 (дт, 1H, J=8,3, 2,4 Гц), 6,97 (дд, 1H, J=8,8, 2,0 Гц), 6,95 (д, 1H, J=8,8 Гц), 3,90 (с, 3H), 2,93 (с, 3H)
Способом синтеза согласно Примеру 382 синтезировали соединения Примера 383, и даннеы для этого примера являются следующими.
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,75 (с, 1H), 10,40 (с, 1H), 9,63 (ушир.с, 1H), 8,62 (с, 1H), 8,08 (с, 1H), 7,92 (с, 1H), 7,84 (т, 1H, J=7,9 Гц), 7,57~7,77 (м, 4H), 7,40~7,47 (м, 2H), 7,27 (т, 1H, J=8,8 Гц), 6,98 (дд, 1H, J=8,3, 1,9 Гц), 6,84 (д, 1H, J=8,3 Гц), 3,99 (с, 3H), 2,94 (с, 3H)
Пример 384) Синтез N-(2',4'-дифтор-5-(6-гидроксипиридин-2-ил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
N-(2',4'-дифтор-5-(6-метоксипиридин-2-ил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид (13,0 мг, 0,02 ммоль) растворяли в безводном CH2Cl2 (28,4 мл), и 1,0 M раствор BBr3 в CH2Cl2 (118,0 мкл) медленно добавляли при 0°C. Реакционную смесь перемешивали при 25°C в течение 17 часов и медленно добавляли MeOH. Реакционную смесь экстрагировали EtOAc и органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 3:1), получая N-(2',4'-дифтор-5-(6-гидроксипиридин-2-ил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид (3,0 мг, 24%) в форме твердого вещества белого цвета.
LC/MS ESI (+): 535 (M+1)
1H-ЯМР (300 МГц, CD3OD): δ 8,14 (т, 1H, J=1,9 Гц), 8,00 (м, 1H), 7,63-7,72 (м, 3H), 7,58 (м, 1H), 7,47 (м, 1H), 7,36 (д, 1H, J=0,9 Гц), 7,09-7,16 (м, 2H), 7,01 (дд, 1H, J=8,6, 1,9 Гц), 6,73 (м, 1H), 6,57 (м, 1H), 2,96 (с, 3H)
Пример 385) Синтез N-(4'-амино-2'-(трифторметил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
6-(метилсульфонамидо)-N-(4'-нитро-2'-(трифторметил)-[1,1'-бифенил]-3-ил)-1H-индол-2-карбоксамид (48,0 мг, 0,09 ммоль) растворяли в смеси MeOH/H2O (10,0 мл, 9/1 об./об.) и добавляли Zn (90,0 мг, 1,38 ммоль) и NH4Cl (25,0 мг, 0,46 ммоль). Реакционную смесь обрабатывали ультразвуком в течение 2 часов, фильтровали через Целит и концентрировали при пониженном давлении. Остаток экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (амин силикагель, CH2Cl2 : MeOH = 20:1), получая N-(4'-амино-2'-(трифторметил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид (30,0 мг, 67%) в форме бесцветного масла.
LC/MS ESI (+): 489 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,72 (с, 1H), 10,19 (с, 1H), 9,63 (ушир.с, 1H), 7,79 (д, 1H, J=9,5 Гц), 7,73 (с, 1H), 7,62 (д, 1H, J=8,4 Гц), 7,33-7,41 (м, 3H), 7,04 (д, 1H, J=8,4 Гц), 6,94-7,00 (м, 3H), 6,82 (дд, 1H, J=7,3, 1,5 Гц), 5,66 (ушир.с, 2H), 2,93 (с, 3H)
Пример 386) Синтез N-(4'-(метиламино)-2'-(трифторметил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
N-(4'-амино-2'-(трифторметил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид (30,0 мг, 0,06 ммоль) растворяли в триэтоксиметане (2,0 мл) и добавляли каталитическое количество TFA. После перемешивания при 80°C в течение 4 часов, реакционную смесь концентрировали при пониженном давлении. Остаток растворяли в EtOH (2,0 мл) и добавляли NaBH4 (23,0 мг, 0,61 ммоль). После перемешивания при 70°C в течение 2 часов, реакционную смесь концентрировали при пониженном давлении, и остаток экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, CH2Cl2 : MeOH = 20:1), получая N-(4'-(метиламино)-2'-(трифторметил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид (6,0 мг, 20%) в форме твердого вещества белого цвета.
LC/MS ESI (+): 503 (M+1)
1H-ЯМР (300 МГц, CDCl3): δ 11,71 (с, 1H), 10,19 (с, 1H), 9,63 (ушир.с, 1H), 7,80 (д, 1H, J=8,8 Гц), 7,74 (с, 1H), 7,62 (д, 1H, J=8,4 Гц), 7,33-7,41 (м, 3H), 7,13 (д, 1H, J=8,4 Гц), 6,97 (д, 1H, J=1,5 Гц), 6,96 (д, 1H, J=1,9 Гц), 6,90 (д, 1H, J=2,3 Гц), 6,81 (дд, 1H, J=8,4, 1,9 Гц), 6,25 (кв., 1H, J=5,0 Гц), 2,93 (с, 3H), 2,75 (д, 3H, J=5,0 Гц)
Пример 387) Синтез N-(3-(дифтор(фенил)метил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
(a) Синтез 1-(дифтор(фенил)метил)-3-нитробензола
(3-нитрофенил)(фенил)метанон (0,3 г, 1,32 ммоль) растворяли в CH2Cl2 (2,0 мл) в закрытой пробирке и добавляли 50% раствор Deoxo-Fluor в THF (7,9 мл, 3,96 ммоль). THF отгоняли при пониженном давлении с последующим перемешиванием при 90°C в течение 8 часов. Реакционную смесь охлаждали до комнатной температуры и экстрагировали CH2Cl2, Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 4:1), получая 1-(дифтор(фенил)метил)-3-нитробензол (280,0 мг, 85%) в форме желтого масла.
1H-ЯМР (300 МГц, CDCl3): δ 8,39 (с, 1H), 8,31 (д, 1H, J=8,0 Гц), 7,85 (д, 1H, J=7,6 Гц), 7,63 (т, 1H, J=8,0 Гц), 7,44-7,53 (м, 5H)
(b) Синтез 3-(дифтор(фенил)метил)анилина
1-(дифтор(фенил)метил)-3-нитробензол (280,0 мг, 1,12 ммоль) растворяли в MeOH (5,0 мл). В атмосфере газообразного водорода добавляли Ra-Ni (100,0 мг, 1,70 ммоль) с последующим перемешиванием при комнатной температуре в течение 1 часа. Реакционную смесь фильтровали через Целит и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (амин силикагель, n-Hex : EtOAc = 4:1), получая 3-(дифтор(фенил)метил)анилин (200,0 мг, 81%) в форме твердого вещества белого цвета.
LC/MS ESI (+): 220 (M+1)
(c) Синтез N-(3-(дифтор(фенил)метил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
Гидрохлорид 6-(метилсульфонамидо)-1H-индол-2-карбоновой кислоты (35,0 мг, 0,14 ммоль), 3-(дифтор(фенил)метил)анилин (30,0 мг, 0,14 ммоль) и HATU (57,0 мг, 0,15 ммоль) растворяли в безводном DMF (1,4 мл) и добавляли DIPEA (37,0 мкл, 0,21 ммоль). После перемешивания при комнатной температуре в течение 15 часов, реакционную смесь экстрагировали CH2Cl2, Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (амин силикагель, CH2Cl2 : MeOH = 95:5), получая N-(3-(дифтор(фенил)метил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид (23,0 мг, 36%) в форме твердого вещества белого цвета.
LC/MS ESI (+): 456 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,74 (с, 1H), 10,34 (с, 1H), 9,64 (с, 1H), 7,96-8,00 (м, 2H), 7,63 (д, 1H, J=8,8 Гц), 7,47-7,56 (м, 6H), 7,39 (с, 2H), 7,26 (д, 1H, J=7,6 Гц), 6,98 (дд, 1H, J=8,4, 1,9 Гц), 2,94 (с, 3H)
Способом синтеза согласно Примеру 387 синтезировали соединения с Примера 388 по Пример 390, и данные для каждого примера являются следующими.
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,75 (с, 1H), 10,36 (с, 1H), 9,64 (с, 1H), 8,77 (д, 2H, J=6,1 Гц), 7,97~8,01 (м, 2H), 7,63 (д, 1H, J=8,4 Гц), 7,58 (д, 2H, J=6,1 Гц), 7,52 (т, 1H, J=8,0 Гц), 7,39 (с, 2H), 7,29 (д, 1H, J=8,4 Гц), 6,98 (дд, 1H, J=8,5, 1,7 Гц), 2,94 (с, 3H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,73 (с, 1H), 10,34 (с, 1H), 9,64 (с, 1H), 8,66 (д, 1H, J=5,0 Гц), 7,96~8,02 (м, 3H), 7,84 (д, 1H, J=7,6 Гц), 7,63 (д, 1H, J=8,8 Гц), 7,55 (дд, 1H, J=7,6, 4,6 Гц), 7,48 (т, 1H, J=7,6 Гц), 7,39 (дд, 2H, J=5,3, 1,9 Гц), 7,28 (д, 1H, J=8,8 Гц), 6,98 (дд, 1H, J=8,8, 1,9 Гц), 2,94 (с, 3H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,76 (с, 1H), 10,36 (с, 1H), 9,65 (с, 1H), 8,11 (s, 1H), 7,98~8,07 (м, 3H), 7,90 (д, 1H, J=8,4 Гц), 7,76 (т, 1H, J=8,0 Гц), 7,64 (д, 1H, J=8,0 Гц), 7,53 (т, 1H, J=8,8 Гц), 7,40 (с, 2H), 7,31 (д, 1H, J=8,0 Гц), 6,99 (дд, 1H, J=8,4, 1,9 Гц), 2,95 (с, 3H)
Пример 391) Синтез N-(3-((3-Цианофенил)дифторметил)-5-(2,2-дифторэтокси)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
(a) Синтез 4-метоксибензил-3-((4-метоксибензил)окси)-5-нитробензоата
3-Гидрокси-5-нитробензойную кислоту (5,0 г, 27,17 ммоль) растворяли в безводном DMF (60,0 мл) и добавляли K2CO3 (15,0 г, 108,68 ммоль) и 4-метоксибензил хлорид (11,1 мл, 81,51 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов и нагревали при 65°C в течение 3 часов, добавляли воду, чтобы остановить реакцию. Реакционную смесь экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток перекристаллизовывали смесью EtOAc/n-Hex, и осадок отфильтровывали, получая 4-метоксибензил-3-((4-метоксибензил)окси)-5-нитробензоат (10,6 г, 92%) в форме твердого вещества желтого цвета.
1H-ЯМР (300 МГц, ДМСО-d6): δ 8,18 (м, 1H), 8,03 (м, 1H), 7,87 (м, 1H), 7,39-7,44 (м, 4H), 6,93-6,97 (м, 4H), 5,31 (с, 2H), 5,22 (с, 2H), 3,76 (с, 3H), 3,75 (с, 3H)
(b) Синтез 3-((4-метоксибензил)окси)-5-нитробензойной кислоты
4-Метоксибензил-3-((4-метоксибензил)окси)-5-нитробензоат (1,5 г, 3,54 ммоль) растворяли в смеси MeOH/THF/H2O (32,0 мл, 2/1/0,5 об./об.) и добавляли NaOH (283,0 мг, 7,08 ммоль) с последующим перемешиванием при комнатной температуре в течение 20 часов. Реакционную смесь концентрировали при пониженном давлении, и остаток растворяли в воде. 1н. HCl добавляли для подкисления до pH 1-2, и осадок отфильтровывали и высушивали при пониженном давлении, получая 3-((4-метоксибензил)окси)-5-нитробензойной кислоту (1,1 г, 98%) в форме твердого вещества грязно-белого цвета.
1H-ЯМР (300 МГц, ДМСО-d6): δ 13,78 (ушир.с, 1H), 8,21 (м, 1H), 8,02 (м, 1H), 7,88 (м, 1H), 7,42 (д, 2H, J=8,4 Гц), 6,97 (д, 2H, J=8,8 Гц), 5,23 (с, 2H), 3,76 (с, 3H)
(c) Синтез 3-((4-метоксибензил)окси)-5-нитробензоил хлорида
3-((4-Метоксибензил)окси)-5-нитробензойной кислоту (472,0 мг, 1,56 ммоль) растворяли в безводном CH2Cl2 (20,0 мл) и добавляли (CОCl)2 (149,0 мкл, 1,71 ммоль) и каталитическое количество безводного DMF. После перемешивания при 0°C в течение 2 часов, реакционную смесь высушивали при пониженном давлении, получая 3-((4-метоксибензил)окси)-5-нитробензоил хлорид (501,9 мг) в форме твердого вещества желтого цвета.
(d) Синтез 3-(3-((4-метоксибензил)окси)-5-нитробензоил)бензонитрила
К раствору сырого 3-((4-метоксибензил)окси)-5-нитробензоил хлорида (501,9 мг) и Pd2(dba)3·CHCl3 (80,5 мг, 0,08 ммоль) в безводном THF (15,0 мл) 0,5 M раствор 3-Цианофенилцинк йодида в THF (3,42 мл, 1,71 ммоль) добавляли при 0°C с последующим перемешиванием в течение 41 часов. Добавляли воду, чтобы остановить реакцию, и реакционную смесь экстрагировали CH2Cl2, Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 3:1), получая 3-(3-((4-метоксибензил)окси)-5-нитробензоил)бензонитрил (181,8 мг, 2 step yield: 30%) в форме твердого вещества грязно-белого цвета.
1H-ЯМР (300 МГц, ДМСО-d6): δ 8,17-8,21 (м, 2H), 8,06-8,10 (м, 2H), 8,02 (м, 1H), 7,79 (т, 1H, J=8,0 Гц), 7,74 (м, 1H), 7,42 (д, 2H, J=8,4 Гц), 6,97 (д, 2H, J=8,4 Гц) 5,25 (с, 2H), 3,76 (с, 3H)
(e) Синтез 3-(дифтор(3-((4-метоксибензил)окси)-5-нитрофенил)метил)бензонитрила
В 3-(3-((4-метоксибензил)окси)-5-нитробензоил)бензонитрил (180,0 мг, 0,46 ммоль) в закупоренной пробирке добавляли 50% раствор Deoxo-Fluor в THF (985,0 мкл, 2,32 ммоль), и THF отгоняли при пониженном давлении с последующим перемешиванием при 90°C в течение 5 часов. Реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 4:1), получая 3-(дифтор(3-((4-метоксибензил)окси)-5-нитрофенил)метил)бензонитрил (100,6 мг, 53%) в форме желтого масла.
1H-ЯМР (300 МГц, ДМСО-d6): δ 8,25 (с, 1H), 7,98-8,03 (м, 3H), 7,92 (м, 1H), 7,69-7,75 (м, 2H), 7,40 (д, 2H, J=8,4 Гц), 6,94 (д, 2H, J=8,8 Гц), 5,21 (с, 2H), 3,75 (с, 3H)
(f) Синтез 3-(дифтор(3-гидрокси-5-нитрофенил)метил)бензонитрила
3-(дифтор(3-((4-метоксибензил)окси)-5-нитрофенил)метил)бензонитрил (455,0 мг, 1,11 ммоль) растворяли в CH2Cl2 (5,0 мл), и TFA (2,5 мл) добавляли при комнатной температуре. После перемешивания при комнатной температуре в течение 1 часа, реакционную смесь концентрировали при пониженном давлении. Остаток экстрагировали CH2Cl2, и органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 2:1), получая 3-(дифтор(3-гидрокси-5-нитрофенил)метил)бензонитрил (300,0 мг, 100%) в форме бесцветного масла.
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,07 (ушир.с, 1H), 8,20 (с, 1H), 8,02 (д, 1H, J=8,0 Гц), 7,97 (д, 1H, J=8,0 Гц), 7,79 (с, 1H), 7,73 (т, 1H, J=8,0 Гц), 7,66 (т, 1H, J=2,3 Гц), 7,36 (т, 1H, J=1,9 Гц)
(g) Синтез 3-((3-(2,2-дифторэтокси)-5-нитрофенил)дифторметил)бензонитрила
3-(дифтор(3-гидрокси-5-нитрофенил)метил)бензонитрил (120,0 мг, 0,41 ммоль) растворяли в толуоле (5,0 мл) и добавляли 2,2-дифторэтанол (52,0 мкл, 0,83 ммоль) и (цианометилен)трибутилфосфоран (216,0 мкл, 0,83 ммоль) с последующим перемешиванием при 120°C в течение 40 часов. Реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 5:1), получая 3-((3-(2,2-дифторэтокси)-5-нитрофенил)дифторметил)бензонитрил (115,4 мг, 79%) в форме твердого вещества желтого цвета.
LC/MS ESI (+): 377 (M+Na)
1H-ЯМР (300 МГц, ДМСО-d6): δ 8,27 (с, 1H), 8,00-8,06 (м, 3H), 7,96 (т, 1H, J=2,3 Гц), 7,70-7,75 (м, 2H), 6,43 (тт, 1H, J=54,2, 3,1 Гц), 4,58 (тд, 2H, J=14,5, 3,1 Гц)
(h) Синтез 3-(дифтор(3-изобутокси-5-нитрофенил)метил)бензонитрила
3-(дифтор(3-гидрокси-5-нитрофенил)метил)бензонитрил (87,0 мг, 0,30 ммоль) растворяли в безводном DMF (5,0 мл) и добавляли 1-бром-2-метилпропан (39,0 мкл, 0,36 ммоль) и K2CO3 (83,0 мг, 0,60 ммоль) с последующим перемешиванием при комнатной температуре в течение 40 часов. Реакционную смесь экстрагировали EtOAc, и органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 5:1), получая 3-(дифтор(3-изобутокси-5-нитрофенил)метил)бензонитрил (69,6 мг, 67%) в форме твердого вещества белого цвета.
LC/MS ESI (+): 369 (M+Na)
1H-ЯМР (300 МГц, ДМСО-d6): δ 8,26 (с, 1H), 8,03 (т, 2H, J=8,0 Гц), 7,95 (с, 1H), 7,83 (т, 1H, J=2,3 Гц), 7,73 (т, 1H, J=8,0 Гц), 7,63 (с, 1H), 3,93 (д, 2H, J=6,9 Гц), 1,97-2,10 (м, 1H), 0,99 (д, 6H, J=6,5 Гц)
(i) Синтез 3-((3-амино-5-(2,2-дифторэтокси)фенил)дифторметил)бензонитрила
3-((3-(2,2-дифторэтокси)-5-нитрофенил)дифторметил)бензонитрил (114,0 мг, 0,33 ммоль) растворяли в смеси THF/MeOH/H2O (6,6 мл, 1/1/0,1 об./об.), и Zn (322,0 мг, 4,92 ммоль) и NH4Cl (88,0 мг, 1,64 ммоль) добавляли при комнатной температуре. Реакционную смесь обрабатывали ультразвуком при 40°C в течение 1,5 часов, охлаждали до комнатной температуры, фильтровали через Целит и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (амин силикагель, n-Hex : EtOAc = 5:1), получая 3-((3-амино-5-(2,2-дифторэтокси)фенил)дифторметил)бензонитрил (78,0 мг, 73%) в форме твердого вещества белого цвета.
LC/MS ESI (+): 325 (M+1)
(j) Синтез N-(3-((3-Цианофенил)дифторметил)-5-(2,2-дифторэтокси)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
Гидрохлорид 6-(метилсульфонамидо)-1H-индол-2-карбоновой кислоты (34,9 мг, 0,12 ммоль), 3-((3-амино-5-(2,2-дифторэтокси)фенил)дифторметил)бензонитрил (39,0 мг, 0,12 ммоль), HATU (54,8 мг, 0,14 ммоль) и DIPEA (63,0 мкл, 0,36 ммоль) растворяли в безводном DMF (1,0 мл) с последующим перемешиванием при 40°C в течение 19 часов. Реакционную смесь экстрагировали EtOAc, и органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (амин силикагель, CH2Cl2 : MeOH = 20:1), получая N-(3-((3-Цианофенил)дифторметил)-5-(2,2-дифторэтокси)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид (22,6 мг, 34%) в форме твердого вещества белого цвета.
LC/MS ESI (+): 561 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,72 (с, 1H), 10,32 (с, 1H), 9,64 (с, 1H), 8,12 (с, 1H), 8,03 (д, 1H, J=8,0 Гц), 7,92 (д, 1H, J=8,0 Гц), 7,72-7,78 (м, 2H), 7,61-7,64 (м, 2H), 7,38 (с, 1H), 7,37 (с, 1H), 6,69-7,00 (м, 2H), 6,42 (т, 1H, J=54,6 Гц), 4,40 (тд, 2H, J=14,1, 3,8 Гц), 2,93 (с, 3H)
Способом синтеза согласно Примеру 391 синтезировали соединения Примера 392 и Примера 393, и данные для каждого примера являются следующими.
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,71 (с, 1H), 10,27 (с, 1H), 9,64 (с, 1H), 8,11 (с, 1H), 8,03 (д, 1H, J=7,6 Гц), 7,90 (д, 1H, J=8,0 Гц), 7,75 (т, 1H, J=8,0 Гц), 7,61~7,65 (м, 2H), 7,55 (с, 1H), 7,38 (с, 2H), 6,98 (дд, 1H, J=8,8, 1,9 Гц), 6,86 (с, 1H) 3,79 (д, 2H, J=6,5 Гц), 2,94 (с, 3H), 2,04 (м, 1H), 1,00 (д, 6H, J=6,9 Гц)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,76 (с, 1H), 10,40 (с, 1H), 9,65 (с, 1H), 8,12 (с, 1H), 8,04 (д, 1H, J=7,6 Гц), 7,92 (д, 1H, J=8,0 Гц), 7,73~7,80 (м, 2H), 7,62~7,65 (м, 2H), 7,37~7,39 (м, 2H), 7,06 (с, 1H), 6,98 (дд, 1H, J=8,8, 1,9 Гц), 5,25 (с, 2H), 2,94 (с, 3H)
Пример 394) Синтез N-(3-((4-метоксифенил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
(a) Синтез (4-метоксифенил)(3-нитрофенил)сульфана
1-бром-3-нитробензол (500,0 мг, 2,48 ммоль) растворяли в 1,4-диоксане (10,0 мл) и добавляли 4-метоксибензолтиол (383,0 мг, 2,73 ммоль), Pd2dba3·CHCl3 (227,0 мг, 0,22 ммоль), Xantphos (287,0 мг, 0,50 ммоль) и DIPEA (0,9 мл, 5,46 ммоль), с последующим нагреванием с обратным холодильником при 100°C в течение 15 часов. Реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. Остаток экстрагировали EtOAc, и органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (амин силикагель, n-Hex), получая (4-метоксифенил)(3-нитрофенил)сульфан (501,0 мг, 77%) в форме желтого масла.
1H-ЯМР (300 МГц, CDCl3): δ 7,89-7,95 (м, 2H), 7,48 (д, 2H J=8,8 Гц), 7,36-7,40 (м, 2H), 6,97 (д, 2H, J=8,8 Гц), 3,86 (с, 3H).
(b) Синтез (1-((4-метоксифенил)сульфонил)-3-нитробензола
(4-Метоксифенил)(3-нитрофенил)сульфан (501,0 мг, 1,92 ммоль) растворяли в CH2Cl2 (10,0 мл) и добавляли mCPBA (994,0 мг, 5,76 ммоль) с последующим перемешиванием при комнатной температуре в течение 15 часов. Реакционную смесь концентрировали при пониженном давлении, и остаток экстрагировали CH2Cl2, Органический экстракт промывали насыщ. водным раствором NaHCO3 и солевым раствором, высушивали над безводным Na2SO4 и концентрировали при пониженном давлении, получая (1-((4-метоксифенил)сульфонил)-3-нитробензол (548,0 мг, 100%) в форме твердого вещества желтого цвета.
1H-ЯМР (300 МГц, CDCl3): δ 8,74 (с, 1H), 8,40 (д, 1H, J=8,0 Гц), 8,25 (д, 1H, J=7,6 Гц), 7,92 (д, 2H, J=9,2 Гц), 7,72 (т, 1H, J=8,0 Гц), 7,01 (д, 2H, J=9,2 Гц), 3,87 (с, 3H)
(c) Синтез 3-((4-метоксифенил)сульфонил)анилина
(1-((4-Метоксифенил)сульфонил)-3-нитробензол (548,0 мг, 1,92 ммоль) растворяли в MeOH (5,0 мл). В атмосфере газообразного водорода добавляли избыток Ra-Ni (0,2 г, 3,41 ммоль) с последующим перемешиванием при комнатной температуре в течение 2 часов. Реакционную смесь фильтровали через Целит и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 4:1), получая 3-((4-метоксифенил)сульфонил)анилин (285,0 мг, 56%) в форме твердого вещества светло-желтого цвета.
LC/MS ESI (+): 264 (M+1)
(d) Синтез N-(3-((4-метоксифенил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
Гидрохлорид 6-(метилсульфонамидо)-1H-индол-2-карбоновой кислоты (70,0 мг, 0,28 ммоль), 3-((4-метоксифенил)сульфонил)анилин (77,0 мг, 0,29 ммоль) и HATU (128,0 мг, 0,34 ммоль) растворяли в безводном DMF (1,0 мл) и добавляли DIPEA (73,0 мкл, 0,42 ммоль). После перемешивания при 80°C в течение 15 часов, реакционную смесь экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (амин силикагель, CH2Cl2 : MeOH = 95:5), получая N-(3-((4-метоксифенил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид (1,2 мг, 1%) в форме твердого вещества желтого цвета.
LC/MS ESI (+): 500 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,78 (с, 1H), 10,53 (с, 1H), 9,69 (с, 1H), 8,42 (с, 1H), 8,10 (м, 1H), 7,81-7,92 (м, 2H) 7,57-7,69 (м, 3H), 7,36-7,56 (м, 2H), 7,11-7,23 (м, 2H), 6,98 (м, 1H), 3,89 (с, 3H), 2,98 (с, 3H)
Способом синтеза согласно Примеру 394 синтезировали соединения с Примера 395 по Пример 399, и данные для каждого примера являются следующими.
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,77 (с, 1H), 10,52 (с, 1H), 9,66 (с, 1H), 8,45 (с, 1H), 8,11 (м, 1H), 7,95~7,97 (м, 2H) 7,59~7,74 (м, 6H), 7,40 (м, 2H), 6,97 (м, 1H), 2,45 (с, 3H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,78 (с, 1H), 10,54 (с, 1H), 9,65 (с, 1H), 8,45 (с, 1H), 8,14 (м, 1H), 8,00 (м, 1H), 7,92 (с, 1H), 7,73~7,82 (м, 3H), 7,62~7,65 (м, 2H), 7,39~7,42 (м, 2H), 6,98 (м, 1H), 2,94 (с, 3H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,78 (с, 1H), 10,50 (с, 1H), 9,68 (с, 1H), 7,97~8,06 (м, 3H), 7,79~7,80 (м, 3H) 7,64 (д, 1H, J=8,1 Гц), 7,39~7,41 (м, 2H), 7,27 (с, 1H), 7,00 (м, 1H), 3,86 (с, 3H), 2,94 (с, 3H)
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,81 (с, 1H), 10,81 (с, 1H), 9,68 (ушир.с, 1H), 8,75 (с, 1H), 8,55 (с, 1H), 8,07~8,17 (м, 3H) 7,78~7,92 (м, 2H), 7,67 (д, 1H, J=8,4 Гц), 7,42 (д, 2H, J=10,7 Гц), 6,99 (дд, 1H, J=8,4, 1,5 Гц), 2,95 (с, 3H)
Пример 400) Синтез N-(3-изобутокси-5-((3-(трифторметокси)фенил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
(a) Синтез 3-нитро-5-((3-(трифторметокси)фенил)сульфонил)фенола
1-Метокси-3-нитро-5-((3-(трифторметокси)фенил)сульфонил)бензол (0,3 г, 0,80 ммоль) растворяли в CH2Cl2 (5,0 мл), и 1,0 M раствор BBr3 в CH2Cl2 (8,0 мл, 8,00 ммоль) добавляли при 0°C. После перемешивания при комнатной температуре в течение 15 часов, реакционную смесь экстрагировали CH2Cl2, Органический экстракт промывали насыщ. водным раствором NaHCO3 и солевым раствором, высушивали над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 2:1), получая 3-нитро-5-((3-(трифторметокси)фенил)сульфонил)фенол (213,0 мг, 68%) в форме аморфного твердого вещества розового цвета.
1H-ЯМР (300 МГц, CDCl3): δ 8,30 (т, 1H, J=1,9 Гц), 7,89-7,93 (м, 2H), 7,82 (с, 1H), 7,75 (дд, 1H, J=2,3, 1,9 Гц), 7,63 (т, 1H, J=8,4 Гц), 7,50 (д, 1H, J=8,4 Гц), 6,83 (с, 1H).
(b) Синтез 1-изобутокси-3-нитро-5-((3-(трифторметокси)фенил)сульфонил)бензола
3-нитро-5-((3-(трифторметокси)фенил)сульфонил)фенол (100,0 мг, 0,28 ммоль) растворяли в THF (2,0 мл) и добавляли 2-метилпропан-1-ол (21,0 мг, 0,28 ммоль), DIAD (54,0 мкл, 0,28 ммоль) и PPh3 (73,0 мг, 0,28 ммоль) с последующим перемешиванием при комнатной температуре в течение 15 часов. Реакционную смесь концентрировали при пониженном давлении, и остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 3:1), получая 1-изобутокси-3-нитро-5-((3-(трифторметокси)фенил)сульфонил)бензол (54,0 мг, 46%) в форме желтого масла.
LC/MS ESI (+): 420 (M+1)
(c) Синтез 3-изобутокси-5-(3-(трифторметокси)фенилсульфонил)анилина
1-изобутокси-3-нитро-5-((3-(трифторметокси)фенил)сульфонил)бензол (54,0 мг, 0,13 ммоль) растворяли в смеси THF/MeOH/H2O (1,6 мл, 10/5/0,1 об./об.) и добавляли Zn (85,0 мг, 1,30 ммоль) и NH4Cl (20,9 мг, 0,39 ммоль). Реакционную смесь обрабатывали ультразвуком при 40°C в течение 1 часа. Реакционную смесь фильтровали через Целит и экстрагировали CH2Cl2, Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (амин силикагель, n-Hex : EtOAc = 60:40), получая 3-изобутокси-5-(3-(трифторметокси)фенилсульфонил)анилин (17,2 мг, 34%) в форме желтого масла.
LC/MS ESI (+): 390 (M+1)
(d) Синтез N-(3-изобутокси-5-((3-(трифторметокси)фенил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
Гидрохлорид 6-(метилсульфонамидо)-1H-индол-2-карбоновой кислоты (17,2 мг, 0,04 ммоль), 3-изобутокси-5-((3-(трифторметокси)фенил)сульфонил)анилин (13,5 мг, 0,05 ммоль) и HATU (21,7 мг, 0,06 ммоль) растворяли в безводном DMF (3,0 мл) и добавляли DIPEA (11,5 мкл, 0,07 ммоль). После перемешивания при 50°C в течение 15 часов, реакционную смесь экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, CH2Cl2 : MeOH = 96:4), получая N-(3-изобутокси-5-((3-(трифторметокси)фенил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид (1,9 мг, 7%) в форме твердого вещества белого цвета.
LC/MS ESI (+): 626 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,76 (ушир.с, 1H), 10,46 (ушир.с, 1H), 9,67 (ушир.с, 1H), 7,97-8,05 (м, 3H), 7,75-7,84 (м, 3H), 7,64 (д, 1H, J=8,4 Гц), 7,40 (м, 2H), 7,25 (м, 1H), 7,00 (дд, 1H, J=8,4, 1,5 Гц), 3,84 (д, 2H, J=6,5 Гц), 2,95 (с, 3H), 2,02-2,06 (м, 1H), 0,99 (д, 6H, J=6,9 Гц)
Способом синтеза согласно Примеру 400 синтезировали соединение Примера 401, и данные для этого примера являются следующими.
1H-ЯМР(300 МГц, ДМСО-d6): δ 11,78 (с, 1H), 10,51 (с, 1H), 9,67 (м, 1H), 8,03~8,09 (м, 3H), 7,76~7,87 (м, 3H), 7,65 (д, 1H, J=8,4 Гц), 7,39~7,41 (м, 3H), 7,00 (дд, 1H, J=9,0, 1,8 Гц), 6,43 (т, 1H, J=71,7 Гц), 4,47 (тд, 2H, J=14,7, 3,3 Гц), 2,94 (с, 3H)
Пример 402) Синтез N-(3-((3-Цианофенил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
(a) Синтез трет-бутил(3-меркаптофенил)карбамат
3-аминобензолтиол (456,2 мг, 3,64 ммоль) и Bос2O (835,0 мг, 3,83 ммоль) растворяли в ацетоне (5,0 мл) при 0°C и медленно добавляли 5% водный раствор NaHCO3 (2,5 мл). Смесь перемешивали при 0°C в течение 30 минут и при комнатной температуре в течение 48 часов. Реакционную смесь экстрагировали EtOAc, и органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 5:1), получая трет-бутил(3-меркаптофенил)карбамат (297,0 мг, 36%) в форме твердого вещества белого цвета.
1H-ЯМР (300 МГц, ДМСО-d6): δ 9,35 (с, 1H), 7,48 (с, 1H), 7,07-7,12 (м, 2H), 6,87 (дт, 1H, J=6,9, 1,9 Гц), 5,39 (с, 1H), 1,46 (с, 9H)
(b) Синтез трет-бутил(3-((3-Цианофенил)тио)фенил)карбамата
Трет-бутил(3-меркаптофенил)карбамат (100,0 мг, 0,37 ммоль) растворяли в 1,4-диоксане (3,0 мл) и добавляли 3-бромбензонитрил (67,0 мг, 0,37 ммоль) и Pd2dba3 (38,0 мг, 0,04 ммоль), Xantphos (42,6 мг, 0,07 ммоль) и DIPEA (128,0 мкл, 0,74 ммоль) с последующим нагреванием с обратным холодильником при 100°C в течение 15 часов. Реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. Остаток экстрагировали EtOAc, и органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 5:1), получая трет-бутил(3-((3-Цианофенил)тио)фенил)карбамат (100,8 мг, 84%) в форме желтого масла.
1H-ЯМР (500 МГц, ДМСО-d6): δ 9,48 (с, 1H), 7,71-7,73 (м, 1H), 7,67 (с, 1H), 7,59 (с, 1H), 7,52-7,55 (м, 2H), 7,47 (д, 1H, J=8,4 Гц), 7,33 (т, 1H, J=7,6 Гц), 7,03 (д, 1H, J=8,0 Гц), 1,45 (с, 9H)
(c) Синтез трет-бутил(3-((3-Цианофенил)сульфонил)фенил)карбамата
Трет-бутил(3-((3-Цианофенил)тио)фенил)карбамат (618,0 мг, 1,89 ммоль) растворяли в CH2Cl2 (10,0 мл) и добавляли mCPBA (1,0 г, 5,68 ммоль) с последующим перемешиванием при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении, и остаток экстрагировали CH2Cl2, Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (амин силикагель, n-Hex : EtOAc = 1:1), получая трет-бутил(3-((3-Цианофенил)сульфонил)фенил)карбамат (545,0 мг, 80%) в форме твердого вещества белого цвета.
1H-ЯМР (300 МГц, ДМСО-d6): δ 9,78 (с, 1H), 8,42 (с, 1H), 8,16-8,23 (м, 3H), 7,83 (т, 1H, J=7,6 Гц), 7,60-7,67 (м, 2H), 7,52 (т, 1H, J=7,6 Гц), 1,47 (с, 9H)
(d) Синтез 3-((3-аминофенил)сульфонил)бензонитрила
Трет-бутил(3-((3-Цианофенил)сульфонил)фенил)карбамат (546,0 мг, 1,52 ммоль) растворяли в CH2Cl2 (5,0 мл) и добавляли TFA (2,5 мл, 32,65 ммоль) с последующим перемешиванием при комнатной температуре в течение 14 часов. Реакционную смесь концентрировали при пониженном давлении, и остаток экстрагировали CH2Cl2, Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 1:1), получая 3-((3-аминофенил)сульфонил)бензонитрил (240,0 мг, 61%) в форме твердого вещества желтого цвета.
1H-ЯМР (300 МГц, ДМСО-d6): δ 8,37 (т, 1H, J=1,5 Гц), 8,14-8,19 (м, 2H), 7,82 (т, 1H, J=8,0 Гц), 7,23 (т, 1H, J=8,0 Гц), 7,05-7,11 (м, 2H), 6,80 (дд, 1H, J=8,0, 2,3 Гц), 5,71 (с, 2H)
(e) Синтез N-(3-((3-Цианофенил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
Гидрохлорид 6-(метилсульфонамидо)-1H-индол-2-карбоновой кислоты (70,0 мг, 0,28 ммоль), 3-((3-аминофенил)сульфонил)бензонитрил (59,1 мг, 0,23 ммоль) и HATU (104,6 мг, 0,28 ммоль) растворяли в безводном DMF (1,0 мл) и добавляли DIPEA (58,0 мкл, 0,33 ммоль). После перемешивания при 60°C в течение 13 часов, реакционную смесь экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (амин силикагель, CH2Cl2 : MeOH = 95:5), получая N-(3-((3-Цианофенил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид (14,3 мг, 13%) в форме твердого вещества грязно-белого цвета.
LC/MS ESI (+): 495 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,78 (с, 1H), 10,54 (с, 1H), 9,67 (с, 1H), 8,48 (с, 1H), 8,47 (с, 1H), 8,27 (д, 1H, J=8,0 Гц), 8,20 (д, 1H, J=7,6 Гц), 8,14 (д, 1H, J=7,6 Гц), 7,86 (т, 1H, J=8,0 Гц), 7,76 (д, 1H, J=7,6 Гц), 7,65 (т, 1H, J=7,6 Гц), 7,65 (д, 1H, J=8,4 Гц), 7,42 (с, 1H), 7,39 (с, 1H), 6,99 (дд, 1H, J=8,4, 1,5 Гц), 2,94 (с, 3H)
Способом синтеза согласно Примеру 402 синтезировали соединения с Примера 403 по Пример 417, и данные для каждого примера являются следующими.
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,74 (с, 1H), 10,54 (с, 1H), 9,66 (с, 1H), 8,73 (д, 1H, J=4,6 Гц), 8,48 (с, 1H), 8,15~8,26 (м, 3H), 7,61~7,73 (м, 4H), 7,43 (с, 1H), 7,38 (с, 1H), 6,98 (д, 1H, J=8,4 Гц), 2,93 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,78 (с, 1H), 10,54 (с, 1H), 9,66 (с, 1H), 9,14 (д, 1H, J=2,3 Гц), 8,89 (д, 1H, J=4,2 Гц), 8,49 (с, 1H), 8,36 (д, 1H, J=8,0 Гц), 8,14 (д, 1H, J=7,3 Гц), 7,63~7,77 (м, 4H), 7,42 (с, 1H), 7,39 (с, 1H), 6,99 (дд, 1H, J=8,4, 1,5 Гц), 2,94 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,78 (с, 1H), 10,53 (с, 1H), 9,66 (с, 1H), 8,47 (м, 1H), 8,14 (м, 1H), 7,98 (с, 1H), 7,93 (д, 1H, J=7,8 Гц), 7,62~7,83 (м, 5H), 7,32~7,45 (м, 2H), 6,99 (дд, 1H, J=8,4, 1,7 Гц), 2,95 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,77 (с, 1H), 10,58 (с, 1H), 9,66 (с, 1H), 8,49~8,54 (м, 2H), 8,43 (д, 1H, J=7,8 Гц), 8,33 (м, 1H), 8,24 (м, 1H), 7,53~7,73 (м, 3H), 7,39~7,44 (м, 2H), 6,99 (дд, 1H, J=8,6, 1,7 Гц), 2,95 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,78 (с, 1H), 10,54 (с, 1H), 9,66 (с, 1H), 8,70 (д, 1H, J=1,9 Гц), 8,60 (д, 1H, J=2,9 Гц), 8,49 (м, 1H), 8,14 (м, 1H), 7,79~7,82 (м, 2H), 7,62~7,68 (м, 2H), 7,37~7,44 (м, 2H), 6,99 (дд, 1H, J=8,8, 1,9 Гц), 3,93 (с, 3H), 2,95 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,75 (с, 1H), 10,53 (с, 1H), 9,65 (с, 1H), 8,56 (м, 1H), 8,16 (м, 1H), 8,02 (м, 1H), 7,79 (д, 1H, J=7,4 Гц), 7,61~7,73 (м, 3H), 7,39~7,43 (м, 2H), 7,13 (д, 1H, J=8,4 Гц), 6,99 (дд, 1H, J=8,4, 1,1 Гц), 3,83 (с, 3H), 2,95 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,76 (с, 1H), 10,50 (с, 1H), 9,64 (ушир.с, 1H), 8,56 (с, 1H), 8,48 (с, 1H), 8,29 (д, 1H, J=8,4 Гц), 8,08 (д, 1H, J=7,6 Гц), 8,01 (д, 1H, J=5,3 Гц), 7,83 (дд, 1H, J=8,4, 1,5 Гц), 7,69 (д, 2H, J=5,7 Гц), 7,63 (дд, 2H, J=8,0, 3,8 Гц), 7,39 (д, 2H, J=7,3 Гц), 6,99 (дд, 1H, J=8,4, 1,9 Гц), 2,94 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,78 (с, 1H), 10,53 (с, 1H), 9,67 (ушир.с, 1H), 8,82 (с, 1H), 8,49 (с, 1H), 8,09~8,14 (м, 1H), 7,98 (дд, 1H, J=8,8, 1,9 Гц), 7,61~7,74 (м, 5H), 7,41 (д, 1H, J=8,4 Гц), 7,01 (дд, 1H, J=8,4, 1,5 Гц), 2,95 (с, 3H), 2,86 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,78 (с, 1H), 10,53 (с, 1H), 9,66 (ушир.с, 1H), 8,46 (с, 1H), 8,15 (д, 1H, J=8,0 Гц), 7,99 (с, 1H), 7,83 (с, 1H) 7,78 (д, 1H, J=7,6 Гц), 7,70~7,73 (м, 1H), 7,62~7,67 (м, 2H), 7,41 (д, 2H, J=8,8 Гц), 7,00 (дд, 1H, J=8,4, 1,9 Гц), 3,91 (с, 3H), 2,95 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,77 (с, 1H), 10,54 (с, 1H), 9,67 (с, 1H), 8,46 (с, 1H), 8,13 (д, 1H, J=7,8 Гц), 7,91~7,96 (м, 2H), 7,61~7,70 (м, 5H), 7,38~7,42 (м, 2H), 6,98 (д, 1H, J=8,4 Гц), 4,21 (с, 2H), 2,94 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,78 (с, 1H), 10,53 (с, 1H), 9,65 (ушир.с, 1H), 8,52 (д, 1H, J=2,3 Гц), 8,48 (т, 1H, J=1,9 Гц), 8,38 (д, 1H, J=6,1 Гц), 8,29 (дд, 1H, J=8,8, 2,3 Гц), 8,14~8,17 (м, 1H), 7,91 (д, 1H, J=8,8 Гц), 7,73~7,76 (м, 1H), 7,61~7,67 (м, 2H), 7,40 (дд, 2H, J=8,8, 1,5 Гц), 7,00 (дд, 1H, J=8,4, 1,9 Гц), 6,48 (д, 1H, J=6,1 Гц), 2,94 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,78 (с, 1H), 10,53 (с, 1H), 9,66 (с, 1H), 8,46 (с, 1H), 8,14 (д, 1H, J=8,0 Гц), 8,09 (с, 1H), 7,93~7,98 (м, 2H), 7,74 (д, 1H, J=8,4 Гц), 7,59~7,67 (м, 3H), 7,42 (с, 1H), 7,40 (с, 1H), 6,99 (д, 1H, J=9,2 Гц), 2,95 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,76 (с, 1H), 10,52 (с, 1H), 9,65 (ушир.с, 1H), 8,42 (с, 1H), 8,07~8,11 (м, 1H), 7,56~7,66 (м, 3H), 7,41 (д, 2H, J=10,3 Гц), 7,23 (т, 1H, J=8,0 Гц), 6,97~7,09 (м, 1H), 6,97~7,02 (м, 2H), 6,78 (дд, 1H, J=8,0, 2,3 Гц), 5,70 (ушир.с, 2H), 2,95 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,78 (с, 1H), 10,52 (с, 1H), 9,66 (с, 1H), 8,46 (с, 1H), 8,14 (д, 1H, J=8,4 Гц), 7,97~7,99 (м, 2H), 7,81 (д, 1H, J=7,6 Гц), 7,61~7,73 (м, 4H), 7,42 (с, 1H), 7,39 (с, 1H), 6,99 (дд, 1H, J=8,4, 1,9 Гц), 4,48 (с, 1H), 2,95 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,79 (с, 1H), 11,30 (ушир.с, 1H), 10,54 (с, 1H), 9,66 (ушир.с, 1H), 8,45 (с, 1H), 8,15 (д, 1H, J=8,9 Гц), 7,61~7,77 (м, 4H), 7,52 (с, 1H), 7,39~7,43 (м, 3H), 6,99 (дд, 1H, J=8,4, 2,1 Гц), 2,95 (с, 3H)
Пример 418) Синтез N-(3-бром-5-((7-фтор-3,4-дигидроизохинолин-2(1H)-ил)сульфонил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
(a) Синтез 2-((3-бром-5-нитрофенил)сульфонил)-7-фтор-1,2,3,4-тетрагидроизохинолина
7-фтор-1,2,3,4-тетрагидроизохинолин (100,0 мг, 0,66 ммоль) растворяли в CH2Cl2 (5,0 мл) и добавляли DIPEA (172,0 мкл, 0,99 ммоль) и 3-бром-5-нитробензолсульфонил хлорид (198,0 мг, 0,66 ммоль) с последующим перемешиванием в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении, и остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : CH2Cl2 = 1:3), получая 2-((3-бром-5-нитрофенил)сульфонил)-7-фтор-1,2,3,4-тетрагидроизохинолин (270,0 мг, 98%) в форме твердого вещества белого цвета.
LC/MS ESI (+): 415 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 8,55-8,57 (м, 2H), 8,26 (д, 1H, J=1,6 Гц), 7,06 (дд, 1H, J=8,4, 5,2 Гц), 6,89 (тд, 1H, J=8,4, 2,8 Гц), 6,80 (дд, 1H, J=8,8, 2,8 Гц), 4,37 (с, 2H), 3,51 (т, 2H, J=6,0 Гц), 2,91 (т, 2H, J=6,0 Гц)
(b) Синтез 3-бром-5-((7-фтор-3,4-дигидроизохинолин-2(1H)-ил)сульфонил)анилина
Процедуру синтеза Промежуточного соединения 40 повторяли за исключением использования 2-((3-бром-5-нитрофенил)сульфонил)-7-фтор-1,2,3,4-тетрагидроизохинолина (130,0 мг, 0,31 ммоль), получая 3-бром-5-((7-фтор-3,4-дигидроизохинолин-2(1H)-ил)сульфонил)анилин (105,0 мг, 87%).
LC/MS ESI (+): 385 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,28 (с, 1H), 7,06 (дд, 1H, J=8,4, 6,0 Гц), 7,00 (с, 1H), 6,98 (с, 1H), 6,87 (тд, 1H, J=8,4, 2,4 Гц), 6,76 (дд, 1H, J=9,6, 6,4 Гц), 4,26 (с, 2H), 3,99 (ушир.с, 2H), 3,39 (т, 2H, J=6,0 Гц), 2,90 (т, 2H, J=6,0 Гц)
(c) Синтез N-(3-бром-5-((7-фтор-3,4-дигидроизохинолин-2(1H)-ил)сульфонил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
Процедуру синтеза Примера 1 повторяли за исключением использования 3-бром-5-((7-фтор-3,4-дигидроизохинолин-2(1H)-ил)сульфонил)анилина (70,9 мг, 0,31 ммоль), получая N-(3-бром-5-((7-фтор-3,4-дигидроизохинолин-2(1H)-ил)сульфонил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (32,8 мг, 28%).
LC/MS ESI (+): 638 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,88 (с, 1H), 9,89 (с, 1H), 8,34 (с, 2H), 8,27 (т, 1H, J=1,6 Гц), 8,05 (д, 1H, J=8,8 Гц), 7,83 (д, 1H, J=2,0 Гц), 7,67 (т, 1H, J=1,6 Гц), 7,39 (дд, 1H, J=8,8, 2,0 Гц), 7,15 (дд, 1H, J=8,4, 6,0 Гц), 7,08 (дд, 1H, J=10,0, 2,8 Гц), 6,99 (дд, 1H, J=8,4, 2,8 Гц), 4,33 (с, 2H), 3,42 (т, 2H, J=6,0 Гц), 3,03 (с, 3H), 2,84 (т, 2H, J=6,0 Гц)
Пример 419) Синтез N-(3-бром-5-((5,7-дифтор-3,4-дигидроизохинолин-2(1H)-ил)сульфонил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
Процедуру синтеза Примера 418 повторяли за исключением использования 5,7-дифтор-1,2,3,4-тетрагидроизохинолина (100,0 мг, 0,58 ммоль), получая N-(3-бром-5-((5,7-дифтор-3,4-дигидроизохинолин-2(1H)-ил)сульфонил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (12,7 мг).
LC/MS ESI (+): 656 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,90 (с, 1H), 9,91 (с, 1H), 8,34-8,35 (м, 2H), 8,29 (с, 1H), 8,07 (д, 1H, J=8,4 Гц), 7,85 (д, 1H, J=2,0 Гц), 7,68 (т, 1H, J=1,6 Гц), 7,40 (дд, 1H, J=8,8, 2,0 Гц), 7,06 (м, 2H), 4,37 (с, 2H), 3,48 (т, 2H, J=6,0 Гц), 3,04 (с, 3H), 2,76 (т, 2H, J=6,0 Гц)
Пример 420) Синтез N-(3-бром-5-((4,4-дифторпиперидин-1-ил)сульфонил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
Процедуру синтеза Примера 418 повторяли за исключением использования 4,4-дифторпиперидина (58,0 мг, 0,33 ммоль), получая N-(3-бром-5-((4,4-дифторпиперидин-1-ил)сульфонил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (30,0 мг).
LC/MS ESI (+): 608 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,91 (с, 1H), 9,90 (ушир.с, 1H), 8,39 (с, 1H), 8,34 (с, 1H), 8,22 (с, 1H), 8,04 (д, 1H, J=8,7 Гц), 7,82 (с, 1H), 7,66 (с, 1H), 7,38 (дд, 1H, J=8,7, 2,1 Гц), 3,15-3,18 (м, 4H), 3,02 (с, 3H), 2,05-2,15 (м, 4H)
Пример 421) Синтез 5-(метилсульфонамидо)-N-(3-(1-фенилциклопропил)фенил)бензо[b]тиофен-2-карбоксамида
(a) Синтез 1-нитро-3-(1-фенилвинил)бензола
Бром(метил)трифенилфосфоран (1,2 г, 4,40 ммоль) растворяли в THF (7,6 мл), и n-BuLi (2,8 мл, 4,40 ммоль) медленно добавляли при 0°C с последующим перемешиванием в течение 30 минут. Реакционную смесь при 0°C медленно добавляли к смеси (3-нитрофенил)(фенил)метанона (500,0 мг, 2,20 ммоль), растворенного в THF (1,8 мл). После перемешивания при комнатной температуре в течение 12 часов, реакционную смесь экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : CH2Cl2 = 2:1), получая 1-нитро-3-(1-фенилвинил)бензол (321,0 мг, 65%) в форме твердого вещества желтого цвета.
1H-ЯМР (300 МГц, CDCl3): δ 8,22 (с, 1H), 8,18 (д, 1H, J=7,3 Гц), 7,66 (д, 1H, J=7,7 Гц), 7,51-7,53 (м, 1H), 7,36-7,39 (м, 3H), 7,28-7,36 (м, 2H), 5,61 (с, 1H), 5,57 (с, 1H)
(b) Синтез 1-нитро-3-(1-фенилциклопропил)бензола
1-нитро-3-(1-фенилвинил)бензол (319,0 мг, 1,42 ммоль) и CH2I2 (1,1 мл, 14,20 ммоль) растворяли в 1,2-дихлорэтане и медленно добавляли 1,0 M раствор Et2Zn в гексане (7,1 мл, 7,08 ммоль) с последующим перемешиванием при комнатной температуре в течение 12 часов. Реакционную смесь фильтровали через Целит и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 4:1), получая смесь соединений в форме твердого вещества желтого цвета 1-нитро-3-(1-фенилвинил)бензола и 1-нитро-3-(1-фенилциклопропил)бензола (129,0 мг).
(c) Синтез 1-(2,2-дибром-1-фенилциклопропил)-3-нитробензола
1-нитро-3-(1-фенилвинил)бензол (135,0 мг, 0,60 ммоль), CHBr3 (71,2 мкл, 0,82 ммоль) и бензилтриэтиламмоний хлорид (24,6 мг, 0,11 ммоль) растворяли в 1,2-дихлорэтане (0,6 мл) и добавляли NaOH (910,0 мг, 22,8 ммоль), ратсворенный в H2O (0,9 мл). После перемешивания при 40°C в течение 24 часов, реакционную смесь экстрагировали CH2Cl2, Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 9:1), получая 1-(2,2-дибром-1-фенилциклопропил)-3-нитробензол (151,6 мг, 63%) в форме бесцветного масла.
1H-ЯМР (300 МГц, CDCl3): δ 8,34-8,35 (м, 1H), 8,09-8,13 (м, 1H), 7,88-7,92 (м, 1H), 7,49-7,54 (м, 3H), 7,33-7,39 (м, 2H), 7,25-7,31 (м, 1H), 2,58 (д, 1H, J=8,0 Гц), 2,52 (д, 1H, J=8,0 Гц)
(d) Синтез 3-(1-фенилциклопропил)анилина
Смесь 1-нитро-3-(1-фенилвинил)бензола и 1-нитро-3-(1-фенилциклопропил)бензола (129,0 мг), Zn (562,0 мг) и NH4Cl (153,0 мг) растворяли в смеси THF/MeOH/H2O (12,0 мл, 1/1/0,5 об./об.) и обрабатывали ультразвуком при 40°C в течение 3 часов. Реакционную смесь фильтровали через Целит и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : CH2Cl2 = 1:1), получая смесь соединений в форме твердого вещества белого цвета 3-(1-фенилвинил)анилина и 3-(1-фенилциклопропил)анилина (59,0 мг).
LC/MS ESI (+): 210 (M+1)
(e) Синтез 5-(метилсульфонамидо)-N-(3-(1-фенилциклопропил)фенил)бензо[b]тиофен-2-карбоксамида
5-(метилсульфонамидо)бензо[b]тиофен-2-карбоновую кислоту (81,0 мг, 0,30 ммоль), смесь 3-(1-фенилвинил)анилина и 3-(1-фенилциклопропил)анилина (58,0 мг) и HATU (125,0 мг, 0,33 ммоль) растворяли в безводном DMF (3,0 мл) и добавляли DIPEA (78,0 мкл, 0,45 ммоль). После перемешивания при 40°C в течение 24 часов, реакционную смесь экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток сначала очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 1:2). Остаток затем очищали хроматографией на колонке с обратной фазой (C18-силикагель, CH3CN : H2O = 52:48), получая 5-(метилсульфонамидо)-N-(3-(1-фенилциклопропил)фенил)бензо[b]тиофен-2-карбоксамид (8,5 мг, 7%) в форме твердого вещества белого цвета.
LC/MS ESI (+): 463 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,41 (с, 1H), 9,87 (с, 1H), 8,29 (с, 1H), 8,01 (д, 1H, J=8,8 Гц), 7,78 (д, 1H, J=2,2 Гц), 7,63-7,66 (м, 2H), 7,35 (дд, 1H, J=8,8, 2,2 Гц), 7,16-7,33 (м, 6H), 7,01 (д, 1H, J=7,7 Гц), 3,01 (с, 3H), 1,27 (с, 4H)
Способом синтеза согласно Примеру 421 синтезировали соединения с Примера 422 по Пример 433, и данные для каждого примера являются следующими.
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,66 (с, 1H), 10,08 (с, 1H), 9,59 (с, 1H), 7,70 (д, 1H, J=8,4 Гц), 7,67 (с, 1H), 7,61 (д, 1H, J=8,4 Гц), 7,37 (дд, 2H, J=4,6, 2,3 Гц), 7,19~7,32 (м, 6H), 6,96~7,00 (м, 2H), 2,94 (с, 3H), 1,27 (с, 4H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,48 (с, 1H), 9,85 (с, 1H), 8,29 (с, 1H), 8,01 (д, 1H, J=8,8 Гц), 7,84 (д, 1H, J=8,1 Гц), 7,77 (с, 1H), 7,67 (с, 1H), 7,33~7,43 (м, 7H), 7,10 (д, 1H, J=7,7 Гц), 5,53 (с, 1H), 5,50 (с, 1H), 3,01 (с, 3H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,39 (с, 1H), 9,85 (с, 1H), 8,28 (с, 1H), 8,01 (д, 1H, J=8,8 Гц), 7,79 (д, 1H, J=1,9 Гц), 7,63~7,65 (м, 2H), 7,35 (дд, 1H, J=8,8, 1,9 Гц), 7,26~7,31 (м, 3H), 7,09~7,15 (м, 2H), 6,99 (д, 1H, J=7,3 Гц), 3,01 (с, 3H), 1,26 (с, 4H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,66 (с, 1H), 10,07 (с, 1H), 9,58 (с, 1H), 7,69 (д, 1H, J=8,0 Гц), 7,64 (с, 1H), 7,60 (д, 1H, J=8,8 Гц), 7,38 (с, 1H), 7,36 (с, 1H), 7,24~7,32 (м, 3H), 7,08~7,14 (м, 2H), 6,93~7,00 (м, 2H), 2,94 (с, 3H), 1,26 (с, 4H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,49 (с, 1H), 9,85 (с, 1H), 8,27 (с, 1H), 8,02 (д, 1H, J=8,8 Гц), 7,94 (с, 1H), 7,80 (с, 1H), 7,56~7,64 (м, 1H), 7,49 (с, 1H), 7,36 (дд, 1H, J=8,8, 1,9 Гц), 7,19~7,26 (м, 1H), 7,11 (д, 1H, J=7,3 Гц), 7,03 (с, 1H), 3,01 (с, 3H), 1,23~1,38 (м, 4H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,37 (с, 1H), 9,87 (ушир.с, 1H), 8,28 (с, 1H), 8,01 (д, 1H, J=8,4 Гц), 7,78 (д, 1H, J=1,9 Гц), 7,34~7,38 (м, 2H), 7,27 (с, 1H), 6,77~6,80 (м, 2H), 6,72 (с, 1H), 6,60 (с, 1H), 3,77 (с, 3H), 3,74 (с, 3H), 3,01 (с, 3H), 1,29~1,30 (м, 4H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,72 (с, 1H), 10,23 (с, 1H), 9,62 (с, 1H), 7,65 (с, 1H), 7,62 (д, 1H, J=9,2 Гц) 7,48 (с, 1H), 7,38 (с, 2H), 7,30~7,34 (м, 2H+0,3H), 7,11~7,21 (м, 2H+0,4H), 6,98 (д, 1H+0,3H, J=8,0 Гц), 6,71 (с, 1H), 2,93 (с, 3H), 1,29 (с, 4H)
1H-ЯМР (300 МГц, ДМСО-d6): δ 10,51 (с, 1H), 9,83 (ушир.с, 1H), 8,28 (с, 1H), 8,01 (д, 1H, J=8,4 Гц), 7,79 (с, 1H), 7,59 (с, 1H), 7,46 (с, 1H), 7,30~7,38 (м, 3H), 7,21 (т, 1H, J=73,6 Гц), 7,11~7,21 (м, 2H), 6,76 (с, 1H), 3,01 (с, 3H), 1,29 (с, 4H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,71 (с, 1H), 8,31 (ушир.с, 1H), 8,21 (д, 1H, J=7,4 Гц), 8,15 (д, 1H, J=10,5 Гц), 7,85 (м, 1H), 7,60 (с, 1H), 7,11 (с, 1H), 6,78 (м, 2H), 6,73 (с, 1H), 4,63~4,66 (м, 1H), 3,30 (с, 3H), 3,14 (с, 3H), 1,32~1,34 (м, 4H), 1,25 (д, 6H, J=6,0 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,56 (с, 1H), 9,87 (ушир.с, 1H), 8,29 (с, 1H), 8,02 (д, 1H, J=8,7 Гц), 7,85 (с, 1H), 7,80 (д, 1H, J=2,0 Гц), 7,59 (с, 1H), 7,36 (дд, 1H, J=8,7, 2,1 Гц), 7,09 (с, 1H), 6,76 (с, 1H), 6,75 (с, 1H), 6,72 (с, 1H), 4,62~4,68 (м, 1H), 3,02 (с, 3H), 1,32 (д, 4H, J=9,5 Гц), 1,23 (д, 6H, J=6,0 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,53 (с, 1H), 9,89 (ушир.с, 1H), 8,26 (с, 1H), 7,99 (д, 1H, J=8,7 Гц), 7,84 (с, 1H), 7,76 (с, 1H), 7,54 (с, 1H), 7,38 (д, 2H, J=8,4 Гц), 7,33 (д, 1H, J=8,7 Гц), 7,28 (д, 2H, J=8,4 Гц), 7,02 (с, 1H), 2,98 (с, 3H), 1,31 (д, 4H, J=6,2 Гц)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,66 (с, 1H), 9,65 (с, 1H), 8,36 (с, 1H), 8,30 (с, 1H), 8,05 (с, 1H), 7,84 (т, 1H, J=1,9 Гц), 7,53 (с, 1H), 7,39 (д, 2H, J=8,5 Гц), 7,29 (д, 2H, J=8,5 Гц), 7,04 (т, 1H, J=1,6 Гц), 3,07 (с, 3H), 1,32 (д, 4H, J=5,9 Гц)
Пример 434) Синтез N-(3-бензоилфенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
Гидрохлорид 6-(метилсульфонамидо)-1H-индол-2-карбоновой кислоты (30,0 мг, 0,12 ммоль), 3-аминобензофенон (26,0 мг, 0,13 ммоль) и HATU (49,0 мг, 0,13 ммоль) растворяли в безводном DMF (2,0 мл) и добавляли DIPEA (42,0 мкл, 0,24 ммоль). После перемешивания при 30°C в течение 2 часов, реакционную смесь экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 2:3), получая N-(3-бензоилфенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид (20,0 мг, 38%) в форме твердого вещества белого цвета.
LC/MS ESI (+): 434 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,76 (с, 1H), 10,42 (с, 1H), 9,64 (ушир.с, 1H), 8,24 (с, 1H), 8,16 (д, 1H, J=8,0 Гц), 7,78 (д, 2H, J=6,9 Гц), 7,71 (т, 1H, J=7,3 Гц), 7,62 (м, 4H), 7,47 (д, 1H, J=7,6 Гц), 7,41 (дд, 2H, J=8,8, 1,9 Гц), 6,99 (дд, 1H, J=8,4, 1,9 Гц), 2,94 (с, 3H)
Пример 435) Синтез N-(3-(1-гидрокси-1-фенилэтил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
(a) Синтез 1-(3-нитрофенил)-1-фенилэтанола
(3-нитрофенил)(фенил)метанон (100,0 мг, 0,44 ммоль) растворяли в толуоле (4,0 мл) и добавляли 1 M раствор Al(CH3)3 в н-гептане (1,8 мл, 1,76 ммоль) и каталитическое количество AcOH, с последующим нагреванием с обратным холодильником при 110°C в течение 15 часов. Реакционную смесь охлаждали до комнатной температуры и экстрагировали CH2Cl2, Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 4:1), получая 1-(3-нитрофенил)-1-фенилэтанола (50,0 мг, 47%) в форме бесцветного масла.
1H-ЯМР (300 МГц, CDCl3): δ 8,35 (с, 1H), 8,09 (д, 1H, J=8,1 Гц), 7,73 (д, 1H, J=7,8 Гц), 7,28-7,49 (м, 6H), 2,29 (с, 1H), 2,00 (с, 3H)
(b) Синтез 1-(3-аминофенил)-1-фенилэтанола
1-(3-нитрофенил)-1-фенилэтанол (50,0 мг, 0,21 ммоль) растворяли в смеси MeOH/H2O (2,2 мл, 10/1 об./об.) и добавляли Zn (54,0 мг, 0,82 ммоль) и NH4Cl (44,0 мг, 0,82 ммоль), и затем обрабатывали ультразвуком при 40°C в течение 1 часа. Реакционную смесь фильтровали через Целит и экстрагировали CH2Cl2, Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 5:1), получая 1-(3-аминофенил)-1-фенилэтанола (17,0 мг, 38%) в форме бесцветного масла.
LC/MS ESI (+): 214 (M+1)
(c) Синтез N-(3-(1-гидрокси-1-фенилэтил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
Гидрохлорид 6-(метилсульфонамидо)-1H-индол-2-карбоновой кислоты (22,0 мг, 0,09 ммоль), 1-(3-аминофенил)-1-фенилэтанол (17,0 мг, 0,08 ммоль), HATU (34,0 мг, 0,09 ммоль) и DIPEA (21,0 мкл, 0,17 ммоль) растворяли в безводном DMF (0,8 мл) с последующим перемешиванием при комнатной температуре в течение 15 часов. Реакционную смесь экстрагировали CH2Cl2, и органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (амин силикагель, CH2Cl2 : MeOH = 9:1), получая N-(3-(1-гидрокси-1-фенилэтил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид (15,0 мг, 39%) в форме твердого вещества белого цвета.
LC/MS ESI (+): 450 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,68 (с, 1H), 10,13 (с, 1H), 9,61 (с, 1H), 7,81 (с, 1H), 7,75 (д, 1H, J=8,0 Гц), 7,60 (д, 1H, J=8,8 Гц), 7,44 (д, 2H, J=8,0 Гц), 7,38 (с, 2H), 7,13-7,31 (м, 5H), 6,98 (дд, 1H J=8,4, 1,9 Гц), 5,75 (с, 1H), 2,93 (с, 3H), 1,84 (с, 3H)
Пример 436 и Пример 437) Синтез 6-(N-(2-амино-2-оксоэтил)метилсульфонамидо)-N-(3-(2-(3-гидрокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-1H-индол-2-карбоксамида и N-(3-(2-(3-(2-амино-2-оксоэтокси)-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-(N-(2-амино-2-оксоэтил)метилсульфонамидо)-1H-индол-2-карбоксамида
(a) Синтез N-3-(2-(3-гидрокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида
К раствору N-(3-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамида (30,0 мг, 0,05 ммоль) в безводном CH2Cl2 (1,0 мл) при 0°C добавляли 1,0 M раствор BBr3 в CH2Cl2 (160,0 мкл, 0,16 ммоль) с последующим перемешиванием при комнатной температуре в течение 1 часа и 20 минут. При 0°C добавляли воду, чтобы остановить реакцию, и реакционную смесь экстрагировали CH2Cl2, Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (амин силикагель, CH2Cl2 : MeOH = 9:1), получая N-(3-(2-(3-гидрокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид (28,7 мг, 98%) в форме грязно-белого масла.
LC/MS ESI (+): 548 (M+1)
(b) Синтез 6-(N-(2-амино-2-оксоэтил)метилсульфонамидо)-N-(3-(2-(3-гидрокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-1H-индол-2-карбоксамида
N-(3-(2-(3-гидрокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид (48,0 мг, 0,09 ммоль) растворяли в безводном DMF (1,5 мл) и добавляли K2CO3 (18,2 мг, 0,13 ммоль) и 2-йодацетамид (19,5 мг, 0,11 ммоль). Реакционную смесь нагревали при 40°C в течение 12 часов, добавляли воду, чтобы остановить реакцию, и реакционную смесь экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (амин силикагель, CH2Cl2 : MeOH = 9:1), получая 6-(N-(2-амино-2-оксоэтил)метилсульфонамидо)-N-(3-(2-(3-гидрокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-1H-индол-2-карбоксамид (6,8 мг, 13%) в форме твердого вещества белого цвета и N-(3-(2-(3-(2-амино-2-оксоэтокси)-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-(N-(2-амино-2-оксоэтил)метилсульфонамидо)-1H-индол-2-карбоксамид (2,1 мг, 4%) в форме твердого вещества белого цвета.
Пример 436)
LC/MS ESI (+): 605 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,92 (с, 1H), 10,22 (с, 1H), 9,94 (с, 1H), 7,78 (д, 1H, J=8,0 Гц), 7,68 (д, 1H, J=8,8 Гц), 7,65 (с, 1H), 7,60 (с, 1H), 7,46 (с, 1H), 7,42 (с, 1H), 7,30 (т, 1H, J=8,0 Гц), 7,18-7,21 (м, 2H), 6,98(д, 1H, J=7,6 Гц), 6,61 (с, 2H), 6,53 (с, 1H), 4,25 (с, 2H), 3,12 (с, 3H), 1,62 (с, 6H)
Пример 437)
LC/MS ESI (+): 662 (M+1)
1H-ЯМР (300 МГц, ДМСО-d6): δ 11,93 (с, 1H), 10,22 (с, 1H), 7,78 (м, 1H), 7,66-7,69 (м, 2H), 7,63 (с, 1H), 7,59 (м, 1H), 7,42-7,46 (м, 3H), 7,30 (т, 1H, J=8,0 Гц), 7,17-7,21 (м, 2H), 6,97 (м, 1H), 6,91 (м, 1H), 6,78 (м, 1H), 6,73 (м, 1H), 4,44 (с, 2H), 4,24 (с, 2H), 3,12 (с, 3H), 1,65 (с, 6H)
Пример 438) Синтез N-(3-хлор-5-((2,4-дифторфенил)амино)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
(a) Синтез N-(3-хлор-5-нитрофенил)-2,4-дифторанилина
1-бром-3-хлор-5-нитробензол (100,0 мг, 0,42 ммоль), 2,4-дифторанилин (35,6 мкл, 0,35 ммоль), Pd2(dba)3·CHCl3 (18,3 мг, 0,02 ммоль), BINAP (21,9 мг, 0,04 ммоль) и NaOt-Bu (47,5 мг, 0,49 ммоль) добавляли к безводному толуолу (3,5 мл). Реакцию осуществляли в микроволновом реакторе мощностью 150 Вт при 110°C в течение 30 минут, и реакционную смесь охлаждали до комнатной температуры. Добавляли воду, и реакционную смесь экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 9:1), получая N-(3-хлор-5-нитрофенил)-2,4-дифторанилин (76,6 мг, 76%) в форме твердого вещества желтого цвета.
LC/MS ESI (+): 285 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,68 (м, 1H), 7,58 (м, 1H), 7,31 (м, 1H), 7,11 (м, 1H), 6,91-7,00 (м, 2H), 5,79 (с, 1H)
(b) Синтез 5-хлор-N1-(2,4-дифторфенил)бензол-1,3-диамина
Процедуру синтеза Примера 400-с повторяли за исключением использования N-(3-хлор-5-нитрофенил)-2,4-дифторанилина (76,6 мг, 0,27 ммоль), получая 5-хлор-N1-(2,4-дифторфенил)бензол-1,3-диамин (64,5 мг, 95%) в форме красного масла.
LC/MS ESI (+): 255 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,27 (м, 1H), 6,80-6,91 (м, 2H), 6,36 (м, 1H), 6,26 (м, 1H), 6,13 (м, 1H), 5,46 (с, 1H), 3,68 (с, 2H)
(c) Синтез N-(3-хлор-5-((2,4-дифторфенил)амино)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
Процедуру синтеза Примера 1 повторяли за исключением использования 5-хлор-N1-(2,4-дифторфенил)бензол-1,3-диамина (64,5 мг, 0,25 ммоль), получая N-(3-хлор-5-((2,4-дифторфенил)амино)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (67,6 мг, 53%) в форме твердого вещества грязно-белого цвета.
LC/MS ESI (+): 508 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,41 (с, 1H), 9,87 (ушир.с, 1H), 8,27 (с, 1H), 8,19 (с, 1H), 8,00 (д, 1H, J=8,8 Гц), 7,78 (д, 1H, J=2,0 Гц), 7,33-7,41 (м, 4H), 7,22 (с, 1H), 7,10 (м, 1H), 6,59 (м, 1H), 3,00 (с, 3H)
Пример 439) Синтез N-(3-хлор-5-((2,4-дифторфенил)(метил)амино)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
К раствору N-(3-хлор-5-((2,4-дифторфенил)амино)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида (Пример 438) (22,3 мг, 0,04 ммоль) в безводном CH3CN (0,4 мл) добавляли 37 вес.% водный раствор формальдегида (49,0 мкл, 0,66 ммоль), AcOH (3,8 мкл, 0,07 ммоль) и NaBH3CN (5,5 мг, 0,09 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 21 часов, добавляли воду и экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 1:1), получая N-(3-хлор-5-((2,4-дифторфенил)(метил)амино)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (3,9 мг, 17%) в форме твердого вещества белого цвета.
LC/MS ESI (+): 522 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,36 (с, 1H), 9,87 (ушир.с, 1H), 8,23 (с, 1H), 7,98 (д, 1H, J=8,6 Гц), 7,76 (с, 1H), 7,41-7,52 (м, 3H), 7,33 (д, 1H, J=7,3 Гц), 7,22 (м, 1H), 6,93 (с, 1H), 6,46 (с, 1H), 3,22 (с, 3H), 2,98 (с, 3H)
Пример 440) Синтез N-(3-хлор-5-((4-хлорфенил)(метил)амино)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
(a) Синтез 3-хлор-N-(4-хлорфенил)-5-нитроанилина
1-бром-3-хлор-5-нитробензол (200,0 мг, 0,85 ммоль) и 4-хлоранилин (89,9 мг, 0,71 ммоль) растворяли в толуоле (3,5 мл) и добавляли Pd2(dba)3⋅CHCl3 (36,5 мг, 0,04 ммоль), BINAP (43,9 мг, 0,07 ммоль) и NaOt-Bu (94,9 мг, 0,99 ммоль) с последующим перемешиванием в микроволновом реакторе при 110°C в течение 30 минут. После охлаждения до комнатной температуры, реакционную смесь экстрагировали EtOAc, промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 4:1), получая 3-хлор-N-(4-хлорфенил)-5-нитроанилин (107,1 мг, 54%) в форме твердого вещества оранжевого цвета.
LC/MS ESI (+): 283 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,67 (с, 1H), 7,65 (с, 1H), 7,35 (д, 2H, J=8,6 Гц), 7,20 (с, 1H), 7,09 (д, 2H, J=8,6 Гц), 5,94 (с, 1H)
(b) Синтез 3-хлор-N-(4-хлорфенил)-N-метил-5-нитроанилина
3-хлор-N-(4-хлорфенил)-5-нитроанилин (70,7 мг, 0,25 ммоль) растворяли в безводном DMF (2,5 мл), и 60% NaH в минеральном масле (15,0 мг, 0,38 ммоль) добавляли при 0°C. Реакционную смесь перемешивали при 0°C в течение 30 минут и добавляли CH3I (31,1 мкл, 0,50 ммоль). После перемешивания при комнатной температуре в течение 5 часов, остаток экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 4:1), получая 3-хлор-N-(4-хлорфенил)-N-метил-5-нитроанилин (68,1 мг, 92%) в форме твердого вещества желтого цвета.
LC/MS ESI (+): 297 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,59 (м, 1H), 7,47 (м, 1H), 7,40 (д, 2H, J=8,7 Гц), 7,13 (д, 2H, J=8,7 Гц), 6,97 (м, 1H), 3,34 (с, 3H)
(c) Синтез 5-хлор-N1-(4-хлорфенил)-N1-метилбензол-1,3-диамина
Процедуру синтеза Промежуточного соединения 40 повторяли за исключением использования 3-хлор-N-(4-хлорфенил)-N-метил-5-нитроанилина (73,3 мг, 0,25 ммоль), получая 5-хлор-N1-(4-хлорфенил)-N1-метилбензол-1,3-диамин (59,1 мг, 90%) в форме коричневой жидкости.
LC/MS ESI (+): 267 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,26 (д, 2H, J=8,9 Гц), 7,00 (д, 2H, J=8,9 Гц), 6,31 (м, 1H), 6,25 (м, 1H), 6,08 (м, 1H), 3,64 (с, 2H), 3,23 (с, 3H)
(d) Синтез N-(3-хлор-5-((4-хлорфенил)(метил)амино)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
Процедуру синтеза Примера 1 повторяли за исключением использования 5-хлор-N1-(4-хлорфенил)-N1-метилбензол-1,3-диамина (29,5 мг, 0,11 ммоль), получая N-(3-хлор-5-((4-хлорфенил)(метил)амино)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (19,7 мг, 35%).
LC/MS ESI (+): 520 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,44 (с, 1H), 9,87 (ушир.с, 1H), 8,26 (с, 1H), 8,01 (д, 1H, J=8,7 Гц), 7,79 (д, 1H, J=1,9 Гц), 7,52 (м, 1H), 7,42 (д, 2H, J=8,8 Гц), 7,35 (дд, 1H, J=8,7, 2,1 Гц), 7,24 (м, 1H), 7,19 (д, 2H, J=8,8 Гц), 6,72 (м, 1H), 3,27 (с, 3H), 3,01 (с, 3H)
Способом синтеза согласно Примеру 440 синтезировали соединения Примера 441 и Примера 442, и данные для каждого примера являются следующими.
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,53 (с, 1H), 9,62 (с, 1H), 8,34 (с, 1H), 8,27 (с, 1H), 8,03 (с, 1H), 7,51 (с, 1H), 7,42 (д, 2H, J=8,7 Гц), 7,18~7,22 (м, 3H), 6,73 (с, 1H), 3,27 (с, 3H), 3,06 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,46 (с, 1H), 9,61 (с, 1H), 8,33 (с, 1H), 8,25 (с, 1H), 8,02 (с, 1H), 7,41~7,52 (м, 3H), 7,21 (м, 1H), 6,90 (с, 1H), 6,48 (с, 1H), 3,22 (с, 3H), 3,05 (с, 3H)
Пример 443) Синтез N-(3-хлор-5-((3-изопропокси-5-(трифторметокси)фенил)(метил)амино)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
(a) Синтез 3-изопропокси-N-метил-5-(трифторметокси)анилина
1-бром-3-изопропокси-5-(трифторметокси)бензол (300,0 мг, 1,00 ммоль) и 2,0 M раствор метиламина в THF (7,5 мл, 15,0 ммоль) добавляли к толуолу (5,0 мл) и добавляли Pd2(dba)3·CHCl3 (51,9 мг, 0,05 ммоль), BINAP (93,7 мг, 0,15 ммоль) и Cs2CO3 (490,2 мг, 1,51 ммоль) с последующим перемешиванием при 100°C в течение 16 часов. После охлаждения до комнатной температуры, реакционную смесь экстрагировали EtOAc, промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 9:1), получая 3-изопропокси-N-метил-5-(трифторметокси)анилин (120,9 мг, 48%) в форме твердого вещества желтого цвета.
LC/MS ESI (+): 250 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 6,11 (с, 1H), 6,03-6,04 (м, 2H), 4,48 (м, 1H), 3,82 (с, 1H), 2,81 (д, 3H, J=4,3 Гц), 1,32 (д, 6H, J=6,0 Гц)
(b) Синтез 3-хлор-N-(3-изопропокси-5-(трифторметокси)фенил)-N-метил-5-нитроанилина
3-Изопропокси-N-метил-5-(трифторметокси)анилин (120,9 мг, 0,49 ммоль) и 1-бром-3-хлор-5-нитробензол (137,6 мг, 0,58 ммоль) добавляли к толуолу (2,4 мл) и добавляли Pd2(dba)3·CHCl3 (25,1 мг, 0,02 ммоль), BINAP (30,2 мг, 0,05 ммоль) и NaOt-Bu (65,3 мг, 0,68 ммоль) с последующим перемешиванием при 110°C в течение 40 минут с использованием микроволнового реактора. Реакционную смесь охлаждали до комнатной температуры, экстрагировали EtOAc, промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 9:1), получая 3-хлор-N-(3-изопропокси-5-(трифторметокси)фенил)-N-метил-5-нитроанилин (151,3 мг, 77%) в форме желтой жидкости.
LC/MS ESI (+): 405 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,66 (с, 1H), 7,59 (с, 1H), 7,11 (с, 1H), 6,55-6,60 (м, 3H), 4,50 (м, 1H), 3,35 (с, 3H), 1,35 (д, 6H, J=6,0 Гц)
(c) Синтез 5-хлор-N1-(3-изопропокси-5-(трифторметокси)фенил)-N1-метилбензол-1,3-диамина
Процедуру синтеза Промежуточного соединения 40 повторяли за исключением использования 3-хлор-N-(3-изопропокси-5-(трифторметокси)фенил)-N-метил-5-нитроанилина (151,3 мг, 0,37 ммоль), получая 5-хлор-N1-(3-изопропокси-5-(трифторметокси)фенил)-N1-метилбензол-1,3-диамин (123,7 мг, 88%) as a brown liquid.
LC/MS ESI (+): 375 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 6,45 (с, 1H), 6,37-6,40 (м, 2H), 6,36 (с, 1H), 6,33 (с, 1H), 6,24 (с, 1H), 4,46 (м, 1H), 3,69 (с, 2H), 3,29 (с, 3H), 1,31 (д, 6H, J=6,0 Гц)
(d) Синтез N-(3-хлор-5-((3-изопропокси-5-(трифторметокси)фенил)(метил)амино)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
Процедуру синтеза Примера 1 повторяли за исключением использования 5-хлор-N1-(3-изопропокси-5-(трифторметокси)фенил)-N1-метилбензол-1,3-диамина (40,0 мг, 0,11 ммоль), получая N-(3-хлор-5-((3-изопропокси-5-(трифторметокси)фенил)(метил)амино)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (25,4 мг, 38%).
LC/MS ESI (+): 628 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,51 (с, 1H), 9,87 (ушир.с, 1H), 8,27 (с, 1H), 8,01 (д, 1H, J=8,7 Гц), 7,79 (м, 1H), 7,64 (с, 1H), 7,44 (с, 1H), 7,36 (дд, 1H, J=8,8, 1,7 Гц), 6,90 (с, 1H), 6,52-6,55 (м, 3H), 4,61 (м, 1H), 3,29 (с, 3H), 3,01 (с, 3H), 1,25 (д, 6H, J=6,0 Гц)
Пример 444) Синтез N-(3-хлор-5-(2,4-дифторфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
(a) Синтез 1-(3-хлор-5-нитрофенокси)-2,4-дифторбензола
1-бром-3-хлор-5-нитробензол (100,0 мг, 0,42 ммоль), 2,4-дифторфенол (40,4 мкл, 0,42 ммоль), CuI (40,3 мг, 0,21 ммоль), N,N-диметилглицин (43,6 мг, 0,42 ммоль) и Cs2CO3 (413,5 мг, 1,27 ммоль) добавляли к безводному 1,4-диоксану (2,1 мл). Реакцию осуществляли в микроволновом реакторе мощностью 100 Вт при 90°C в течение 1 часа, и реакционную смесь охлаждали до комнатной температуры. Добавляли воду с последующей экстракцией EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 9:1), получая 1-(3-хлор-5-нитрофенокси)-2,4-дифторбензол (31,1 мг, 26%) в форме желтого масла.
1H-ЯМР (400 МГц, CDCl3): δ 7,93 (м, 1H), 7,61 (м, 1H), 7,24 (м, 1H), 7,18 (м, 1H), 6,94-7,05 (м, 2H)
(b) Синтез 3-хлор-5-(2,4-дифторфенокси)анилина
Процедуру синтеза Промежуточного соединения 40 повторяли за исключением использования 1-(3-хлор-5-нитрофенокси)-2,4-дифторбензола (31,1 мг, 0,11 ммоль), получая 3-хлор-5-(2,4-дифторфенокси)анилин (22,3 мг, 80%) в форме желтовато-коричневого масла.
LC/MS ESI (+): 256 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 7,09 (м, 1H), 6,95 (м, 1H), 6,87 (м, 1H), 6,39 (м, 1H), 6,27 (м, 1H), 6,13 (м, 1H), 3,76 (с, 2H)
(c) Синтез N-(3-хлор-5-(2,4-дифторфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
Процедуру синтеза Примера 1 повторяли за исключением использования 3-хлор-5-(2,4-дифторфенокси)анилина (22,3 мг, 0,08 ммоль), получая N-(3-хлор-5-(2,4-дифторфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (11,5 мг, 27%) в форме твердого вещества белого цвета.
LC/MS ESI (+): 509 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,57 (с, 1H), 9,87 (ушир.с, 1H), 8,24 (с, 1H), 7,99 (д, 1H, J=8,7 Гц), 7,77 (с, 1H), 7,73 (с, 1H), 7,56 (м, 1H), 7,45 (м, 1H), 7,34 (д, 1H, J=8,7 Гц), 7,30 (с, 1H), 7,21 (м, 1H), 6,89 (с, 1H), 2,98 (с, 3H)
Способом синтеза согласно Примеру 444 синтезировали соединения с Примера 445 по Пример 485, и данные для каждого примера являются следующими.
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,54 (с, 1H), 9,80 (с, 1H), 8,20 (с, 1H), 7,95 (д, 1H, J=8,7 Гц), 7,73 (с, 1H), 7,69 (с, 1H), 7,44 (д, 2H, J=8,9 Гц), 7,28~7,31 (м, 2H), 7,11 (д, 2H, J=8,9 Гц), 6,85 (с, 1H), 2,95 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6):
δ 10,58 (с, 1H), 9,87 (ушир.с, 1H), 8,26 (с, 1H), 8,01 (д, 1H, J=8,8 Гц), 7,79 (м, 1H), 7,72 (с, 1H), 7,36 (дд, 1H, J=8,7, 2,0 Гц), 7,28~7,33 (м, 3H), 7,19~7,22 (м, 2H), 6,86 (м, 1H), 3,01 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,56 (с, 1H), 9,86 (ушир.с, 1H), 8,26 (с, 1H), 8,01 (д, 1H, J=8,7 Гц), 7,78 (д, 1H, J=1,9 Гц), 7,69 (м, 1H), 7,35 (дд, 1H, J=8,7, 2,1 Гц), 7,27 (м, 1H), 7,11 (д, 2H, J=9,1 Гц), 7,02 (д, 2H, J=9,1 Гц), 6,78 (м, 1H), 3,78 (с, 3H), 3,00 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,61 (с, 1H), 9,86 (ушир.с, 1H), 8,26 (с, 1H), 8,01 (д, 1H, J=8,7 Гц), 7,79 (д, 1H, J=1,9 Гц), 7,76 (м, 1H), 7,53 (м, 1H), 7,32~7,37 (м, 3H), 7,20 (м, 1H), 6,96 (м, 1H), 3,00 (с, 3H)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,69 (с, 1H), 9,63 (с, 1H), 8,31 (с, 1H), 8,26 (с, 1H), 8,01 (с, 1H), 7,75 (с, 1H), 7,51(д, 2H, J=8,8 Гц), 7,34 (с, 1H), 7,17(д, 2H, J=8,8 Гц), 6,92 (с, 1H), 3,03 (с, 3H)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,65 (с, 1H), 9,88 (ушир.с, 1H), 8,28 (с, 1H), 8,02 (д, 1H, J=8,8 Гц), 7,80 (с, 2H), 7,60 (т, 1H, J=8,0 Гц), 7,45 (с, 1H), 7,37 (д, 1H, J=8,8 Гц), 7,25 (д, 1H, J=8,8 Гц), 7,20 (с, 1H), 7,17 (д, 1H, J=8,4 Гц), 6,99 (с, 1H), 3,01 (с, 3H)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,60 (с, 1H), 9,80 (ушир.с, 1H), 8,21 (с, 1H), 7,95 (д, 1H, J=8,8 Гц), 7,85 (д, 2H, J=8,8 Гц), 7,74 (д, 2H, J=5,6 Гц), 7,43 (с, 1H), 7,29 (д, 1H, J=8,8 Гц), 7,19 (д, 2H, J=8,4 Гц), 7,00 (с, 1H), 2,94 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6):δ 10,64 (с, 1H), 9,87 (ушир.с, 1H), 8,27 (с, 1H), 8,02 (д, 1H, J=8,7 Гц), 7,79~7,80 (м, 2H), 7,43 (с, 1H), 7,36 (дд, 1H, J=8,7, 1,9 Гц), 6,97 (с, 1H), 6,76 (с, 1H), 6,69 (м, 1H), 6,66 (с, 1H), 4,68 (м, 1H). 3,01 (с, 3H), 1,26 (д, 6H, J=6,0 Гц)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,64 (с, 1H), 9,49 (с, 1H), 8,42 (с, 1H), 8,19 (с, 1H), 7,96 (с, 1H), 7,68 (с, 1H), 7,44(д, 2H, J=8,8 Гц), 7,28 (с, 1H), 7,11(д, 2H, J=8,8 Гц), 6,86 (с, 1H), 2,99 (с, 3H)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,62 (с, 1H), 9,93 (ушир.с, 1H), 8,26 (с, 1H), 7,99 (д, 1H, J=8,8 Гц), 7,77~7,80 (м, 2H), 7,47 (д, 2H, J=8,8 Гц), 7,41 (с, 1H), 7,35 (д, 1H, J=8,4 Гц), 7,26 (д, 2H, J=8,8 Гц), 6,96 (с, 1H), 2,99 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,64 (с, 1H), 9,86 (ушир.с, 1H), 8,27 (с, 1H), 8,02 (д, 1H, J=8,7 Гц), 7,79 (м, 1H), 7,78 (м, 1H), 7,69 (т, 1H, J=7,9 Гц), 7,59 (д, 1H, J=7,8 Гц), 7,49 (с, 1H), 7,40~7,44 (м, 2H), 7,36 (дд, 1H, J=8,7, 2,0 Гц), 6,98 (с, 1H), 3,01 (с, 3H)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,63 (с, 1H), 9,93 (ушир.с, 1H), 8,27 (с, 1H), 8,01 (д, 1H, J=8,0 Гц), 7,79 (с, 2H), 7,49 (т, 1H, J=8,0 Гц), 7,40 (с, 1H), 7,31~7,37 (м, 2H), 7,26 (с, 1H), 7,13 (дд, 1H, J=8,0, 4,0 Гц), 6,97 (с, 1H), 3,00 (с, 3H)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,61 (с, 1H), 9,88 (ушир.с, 1H), 8,29 (с, 1H), 8,03 (д, 1H, J=8,4 Гц), 7,80 (с, 1H), 7,75 (с, 1H), 7,35~7,39 (м, 3H), 6,89 (с, 1H), 6,83 (дд, 1H, J=8,0, 2,0 Гц), 6,73 (с, 1H), 6,69 (дд, 1H, J=8,0, 2,0 Гц), 3,78 (с, 3H), 3,02 (с, 3H)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,67 (с, 1H), 9,89 (ушир.с, 1H), 8,29 (с, 1H), 8,04 (д, 1H, J=8,8 Гц), 7,92 (с, 1H), 7,82~7,83 (м, 2H), 7,71 (с, 1H), 7,66 (т, 1H, J=2,0 Гц), 7,44 (с, 1H), 7,37 (дд, 1H, J=8,8, 2,0 Гц), 7,06 (с, 1H), 3,03 (с, 3H)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,65 (с, 1H), 9,88 (ушир.с, 1H), 8,29 (с, 1H), 8,04 (д, 1H, J=8,8 Гц), 7,80~7,81 (м, 2H), 7,65~7,73 (м, 3H), 7,49~7,52 (м, 1H), 7,41 (т, 1H, J=2,0 Гц), 7,38 (дд, 1H, J=8,8, 2,0 Гц), 7,00 (с, 1H), 3,03 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,60 (с, 1H), 9,89 (ушир.с, 1H), 8,27 (с, 1H), 8,01 (д, 1H, J=8,7 Гц), 7,79 (д, 1H, J=2,0 Гц), 7,76 (м, 1H), 7,54 (м, 1H), 7,34~7,42 (м, 3H), 7,02 (м, 1H), 6,92 (м, 1H), 3,00 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,60 (с, 1H), 9,89 (ушир.с, 1H), 8,26 (с, 1H), 8,01 (д, 1H, J=8,7 Гц), 7,79 (д, 1H, J=2,0 Гц), 7,76 (м, 1H), 7,48~7,54 (м, 2H), 7,33~7,37 (м, 2H), 7,20 (м, 1H), 6,93 (м, 1H), 3,00 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,58 (с, 1H), 9,90 (ушир.с, 1H), 8,25 (с, 1H), 8,00 (д, 1H, J=8,7 Гц), 7,86 (д, 1H, J=2,5 Гц), 7,76~7,78 (м, 2H), 7,53 (дд, 1H, J=8,7, 2,5 Гц), 7,33~7,36 (м, 2H), 7,25 (м, 1H), 6,92 (м, 1H), 2,99 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,64 (с, 1H), 9,89 (ушир.с, 1H), 8,28 (с, 1H), 8,01 (д, 1H, J=8,8 Гц), 7,79~7,81 (м, 2H), 7,45 (м, 1H), 7,35 (дд, 1H, J=8,7, 2,1 Гц), 7,11 (tt, 1H, J=9,4, 2,3 Гц), 7,02 (м, 1H), 6,90~6,97 (м, 2H), 3,00 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,65 (с, 1H), 9,89 (ушир.с, 1H), 8,28 (с, 1H), 8,02 (д, 1H, J=8,8 Гц), 7,80~7,82 (м, 2H), 7,48 (м, 1H), 7,41 (м, 1H), 7,36 (дд, 1H, J=8,7, 2,1 Гц), 7,26 (д, 2H, J=1,8 Гц), 7,03 (м, 1H), 3,01 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,64 (с, 1H), 9,89 (ушир.с, 1H), 8,27 (с, 1H), 8,01 (д, 1H, J=8,8 Гц), 7,79~7,82 (м, 4H), 7,46 (с, 1H), 7,35 (дд, 1H, J=8,7, 2,0 Гц), 7,29 (д, 2H, J=8,6 Гц), 7,05 (с, 1H), 3,00 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,63 (с, 1H), 9,89 (ушир.с, 1H), 8,27 (с, 1H), 8,02 (д, 1H, J=8,8 Гц), 7,78~7,80 (м, 2H), 7,66 (т, 1H, J=8,7 Гц), 7,40 (м, 1H), 7,33~7,37 (м, 2H), 7,02 (м, 1H), 6,99 (м, 1H), 3,01 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,66 (с, 1H), 9,89 (ушир.с, 1H), 8,28 (с, 1H), 8,02 (д, 1H, J=8,7 Гц), 7,80~7,82 (м, 2H), 7,46 (м, 1H), 7,42 (м, 1H), 7,36 (дд, 1H, J=8,7, 2,1 Гц), 7,30 (м, 1H), 7,21 (м, 1H), 7,05 (м, 1H), 3,01 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,57 (с, 1H), 9,88 (ушир.с, 1H), 8,20 (с, 1H), 7,94 (д, 1H, J=8,7 Гц), 7,72~7,73 (м, 2H), 7,69 (д, 1H, J=8,9 Гц), 7,36~7,37 (м, 2H), 7,28 (дд, 1H, J=8,7, 2,1 Гц), 7,14 (дд, 1H, J=8,9, 2,8 Гц), 6,95 (с, 1H), 2,93 (с, 3H)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,66 (с, 1H), 9,90 (ушир.с, 1H), 8,29 (с, 1H), 8,02 (м, 1H), 7,82 (с, 1H), 7,80 (м, 1H), 7,44 (с, 1H), 7,31~7,38 (м, 2H), 7,09~7,12 (м, 2H), 7,04 (с, 1H), 3,01 (с, 3H)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,63 (с, 1H), 9,89 (ушир.с, 1H), 8,28 (с, 1H), 8,03 (д, 1H, J=9,2 Гц), 7,81 (с, 1H), 7,78 (с, 1H), 7,63 (т, 1H, J=9,2 Гц), 7,51 (м, 1H), 7,40 (с, 1H), 7,37 (дд, 1H, J=8,8, 2,0 Гц), 7,27 (м, 1H), 6,96 (с, 1H), 3,02 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,76 (с, 1H), 9,67 (с, 1H), 8,27 (с, 1H), 8,24 (с, 1H), 7,98 (с, 1H), 7,78 (с, 1H), 7,67 (с, 1H), 7,28~7,31 (м, 2H), 7,21 (с, 1H), 2,98 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,70 (с, 1H), 9,58 (с, 1H), 8,81 (с, 1H), 8,28 (с, 1H), 8,22 (с, 1H), 7,97 (с, 1H), 7,72 (с, 1H), 7,69 (с, 1H), 7,45 (с, 1H), 6,99 (с, 1H), 2,98 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,77 (с, 1H), 9,67 (ушир.с, 1H), 8,32 (с, 1H), 8,28 (с, 1H), 8,02 (с, 1H), 7,79 (с, 1H), 7,54 (с, 1H), 7,04 (д, 1H, J=4,1 Гц), 7,03 (с, 1H), 6,77 (д, 1H, J=4,1 Гц), 3,03 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,73 (с, 1H), 9,63 (ушир.с, 1H), 8,36 (с, 1H), 8,29 (с, 1H), 8,05 (с, 1H), 7,78 (м, 1H), 7,37 (м, 1H), 6,96 (м, 1H), 6,92 (м, 1H), 6,77 (м, 1H), 6,71 (м, 1H), 3,79 (с, 3H), 3,06 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,66 (с, 1H), 10,24 (с, 1H), 8,20 ~8,24 (м, 2H), 7,95 (с, 1H), 7,78 (м, 1H), 7,37 (м, 1H), 6,96 (м, 1H), 6,66 (м, 1H), 6,63 (м, 1H), 6,43 (м, 1H), 2,94 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,70 (с, 1H), 9,64 (с, 1H), 8,34 (с, 1H), 8,28 (с, 1H), 8,04 (с, 1H), 7,76 (м, 1H), 7,49~7,54 (м, 2H), 7,32 (м, 1H), 7,20 (м, 1H), 6,94 (м, 1H), 3,05 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,73 (с, 1H), 9,65 (с, 1H), 8,35 (с, 1H), 8,28 (с, 1H), 8,04 (с, 1H), 7,78 (м, 1H), 7,66 (т, 1H, J=8,7 Гц), 7,39 (м, 1H), 7,35 (дд, 1H, J=10,4, 2,7 Гц), 7,00~7,04 (м, 2H), 3,05 (с, 3H)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,62 (с, 1H), 9,57 (ушир.с, 1H), 8,28 (с, 1H), 8,21 (с, 1H), 7,97 (с, 1H), 7,66 (с, 1H), 7,22~7,26 (м, 3H), 7,12~7,16 (м, 2H), 6,80 (с, 1H), 2,98 (с, 3H)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,68 (с, 1H), 9,58 (ушир.с, 1H), 8,28 (с, 1H), 8,21 (с, 1H), 7,97 (с, 1H), 7,72 (с, 1H), 7,50 (т, 1H, J=8,0 Гц), 7,35 (с, 1H), 7,08~7,18 (м, 3H), 6,92 (с, 1H), 2,98 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,73 (с, 1H), 9,69 (ушир.с, 1H), 8,32 (с, 1H), 8,27 (с, 1H), 8,02 (с, 1H), 7,78 (с, 1H), 7,46 (д, 2H, J=8,7 Гц), 7,37 (с, 1H), 7,25 (д, 2 H, J=9,0 Гц), 6,96 (с, 1H), 3,03 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,63 (с, 1H), 9,60 (ушир.с, 1H), 8,25 (с, 1H), 8,20 (с, 1H), 7,95 (с, 1H), 7,69 (с, 1H), 7,48 (м, 1H), 7,35 (м, 1H), 7,28 (м, 1H), 6,96 (м, 1H), 6,87 (т, 1H, J=1,9 Гц), 2,96 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,77 (с, 1H), 9,67 (с, 1H), 8,35 (с, 1H), 8,28 (с, 1H), 8,04 (с, 1H), 7,80~7,82 (м, 3H), 7,44 (с, 1H), 7,30 (д, 2H, J=8,3 Гц), 7,07 (с, 1H), 3,05 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,74 (с, 1H), 9,63 (ушир.с, 1H), 8,33 (с, 1H), 8,28 (с, 1H), 8,03 (с, 1H), 7,80 (м, 1H), 7,42 (м, 1H), 7,31 (дт, 1H, J=8,6, 2,0 Гц), 7,07~7,11 (м, 2H), 7,03 (м, 1H), 3,04 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,67 (с, 1H), 9,66 (ушир.с, 1H), 8,24~8,26 (м, 2H), 7,98 (м, 1H), 7,77 (м, 1H), 7,39 (м, 1H), 6,95 (м, 1H), 6,72 (дт, 1H, J=10,9, 2,2 Гц), 6,56~6,60 (м, 2H), 3,78 (с, 3H), 2,98 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,73 (с, 1H), 9,68 (с, 1H), 8,22~8,23 (м, 2H), 8,14 (с, 1H), 7,75 (м, 1H), 7,51 (д, 2H, J=8,9 Гц), 7,35 (м, 1H), 7,18 (д, 2H, J=8,9 Гц), 6,93 (м, 1H), 3,11 (с, 3H)
Пример 486) Синтез 6-хлор-N-(3-хлор-5-(циклогексилокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
(a) Синтез 1-хлор-3-(циклогексилокси)-5-нитробензола
3-хлор-5-нитрофенол (50,0 мг, 0,29 ммоль) растворяли в безводном THF (2,9 мл), и циклогексанол (58,0 мг, 0,58 ммоль), 2,2 M раствор DEAD в толуоле (0,3 мл, 0,58 ммоль) и PPh3 (152,0 мг, 0,58 ммоль) добавляли при 0°C. Реакционную смесь перемешивали при комнатной температуре в течение 15 часов, и остаток экстрагировали EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 9:1), получая 1-хлор-3-(циклогексилокси)-5-нитробензол (45,0 мг, 61%) в форме бесцветной жидкости.
1H-ЯМР (400 МГц, CDCl3): δ 7,76 (с, 1H), 7,62 (с, 1H), 7,19 (с, 1H), 4,33 (м, 1H), 1,95-1,99 (м, 2H), 1,79-1,82 (м, 2H), 1,55-1,61 (м, 2H), 1,37-1,47 (м, 4H)
(b) Синтез 3-хлор-5-(циклогексилокси)анилина
Процедуру синтеза Промежуточного соединения 40 повторяли за исключением использования 1-хлор-3-(циклогексилокси)-5-нитробензола (45,0 мг, 0,18 ммоль), получая 3-хлор-5-(циклогексилокси)анилин (22,0 мг, 55%) в форме бесцветной жидкости.
LC/MS ESI (+): 226 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 6,31 (с, 1H), 6,26 (с, 1H), 6,10 (с, 1H), 4,15 (м, 1H), 3,67 (ушир.с, 2H), 1,93-1,97 (м, 2H), 1,76-1,79 (м, 2H), 1,44-1,53 (м, 2H), 1,25-1,39 (м, 4H)
(c) Синтез 6-хлор-N-(3-хлор-5-(циклогексилокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
Процедуру синтеза Примера 1 повторяли за исключением использования 3-хлор-5-(циклогексилокси)анилина (33,0 мг, 0,11 ммоль), получая 6-хлор-N-(3-хлор-5-(циклогексилокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (8,0 мг, 18%).
LC/MS ESI (+): 513 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,52 (с, 1H), 9,59 (ушир.с, 1H), 8,25 (с, 1H), 8,22 (с, 1H), 7,96 (с, 1H), 7,41 (с, 1H), 7,28 (с, 1H), 6,73 (с, 1H), 4,28 (м, 1H), 2,96 (с, 3H), 1,84-1,89 (м, 2H), 1,63-1,68 (м, 2H), 1,21-1,49 (м, 6H)
Пример 487) Синтез 6-хлор-N-(3-хлор-5-((5-метилтиофен-2-ил)окси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
(a) Синтез 5-(3-хлор-5-нитрофенокси)тиофен-2-карбальдегида
3-хлор-5-нитрофенол (200,0 мг, 1,15 ммоль) и 5-бромтиофен-2-карбальдегид (136,0 мкл, 0,32 ммоль) растворяли в ДМСО (4,0 мл) и добавляли K2CO3 (318,4 мг, 2,30 ммоль) с последующим перемешиванием в a microwave при 90°C в течение 3 часов. После охлаждения до комнатной температуры, реакционную смесь экстрагировали EtOAc, промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 5:1), получая 5-(3-хлор-5-нитрофенокси)тиофен-2-карбальдегид (130,0 мг, 40%) в форме бесцветной жидкости.
LC/MS ESI (+): 284 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ, 9,81 (с, 1H), 8,07 (с, 1H), 7,90 (с, 1H), 7,62 (д, 1H, J=4,0 Гц), 7,49 (с, 1H), 6,71 (д, 1H, J=4,0 Гц)
(b) Синтез 3-хлор-5-((5-метилтиофен-2-ил)окси)анилина
5-(3-хлор-5-нитрофенокси)тиофен-2-карбальдегид (88,0 мг, 0,31 ммоль) и гидразин моногидрат (35,7 мкл, 0,93 ммоль) растворяли в диэтилен гликоле (0,1 мл) с последующим перемешиванием при 180°C в течение 1 часа. После охлаждения до 100°C KOH (52,1 мг, 0,93 ммоль) добавляли к реакционной смеси с последующим перемешиванием при 120°C в течение еще 2 часов. После охлаждения до комнатной температуры, реакционную смесь экстрагировали Et2O, промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 4:1), получая 3-хлор-5-((5-метилтиофен-2-ил)окси)анилин (40,0 мг, 54%) в форме желтой жидкости.
LC/MS ESI (+): 240 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ, 6,44-6,46 (м, 2H), 6,38 (с, 1H), 6,36 (д, 1H, J=3,6 Гц), 6,25 (с, 1H), 3,76 (ушир.с, 2H), 2,41 (с, 3H)
(c) Синтез 6-хлор-N-(3-хлор-5-((5-метилтиофен-2-ил)окси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
Процедуру синтеза Примера 1 повторяли за исключением использования 3-хлор-5-((5-метилтиофен-2-ил)окси)анилина (35,0 мг, 0,15 ммоль), получая 6-хлор-N-(3-хлор-5-((5-метилтиофен-2-ил)окси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (4,0 мг, 5%).
LC/MS ESI (+): 527 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,68 (с, 1H), 9,69 (ушир.с, 1H), 8,24 (с, 1H), 8,21 (с, 1H), 7,95 (с, 1H), 7,68 (с, 1H), 7,42 (с, 1H), 6,87 (с, 1H), 6,54-6,58 (м, 2H), 2,95 (с, 3H), 2,34 (с, 3H)
Пример 488) Синтез 4-бром-N-(3-хлор-5-(2-(3-изопропокси-5-метилфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
(a) Синтез 3-хлор-5-(2-(3-изопропокси-5-метилфенил)пропан-2-ил)анилина
Процедуру синтеза Промежуточного соединения 33 повторяли за исключением использования 1-хлор-3-(2-(3-изопропокси-5-метилфенил)пропан-2-ил)-5-нитробензола (125,4 мг, 0,36 ммоль), получая 3-хлор-5-(2-(3-изопропокси-5-метилфенил)пропан-2-ил)анилин (102,4 мг, 89%) в форме твердого вещества желтого цвета.
LC/MS ESI (+): 318 (M+1)
1H-ЯМР (400 МГц, CDCl3): δ 6,65 (м, 1H), 6,58 (с, 1H), 6,56 (м, 1H), 6,53 (с, 1H), 6,49 (м, 1H), 6,36 (м, 1H), 4,48 (м, 1H), 3,62 (с, 2H), 2,27 (с, 3H), 1,58 (с, 6H), 1,30 (д, 6H, J=6,1 Гц)
(b) Синтез N-(3-хлор-5-(2-(3-изопропокси-5-метилфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
Процедуру синтеза Примера 1 повторяли за исключением использования 3-хлор-5-(2-(3-изопропокси-5-метилфенил)пропан-2-ил)анилина (102,4 мг, 0,32 ммоль), получая N-(3-хлор-5-(2-(3-изопропокси-5-метилфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (140,3 мг, 76%) в форме твердого вещества грязно-белого цвета.
LC/MS ESI (+): 571 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,53 (с, 1H), 9,94 (с, 1H), 8,28 (с, 1H), 8,00 (д, 1H, J=8,7 Гц), 7,88 (с, 1H), 7,77 (м, 1H), 7,52 (с, 1H), 7,34 (дд, 1H, J=8,7, 1,9 Гц), 7,00 (с, 1H), 6,60 (с, 1H), 6,58 (с, 1H), 6,48 (с, 1H), 4,53 (м, 1H), 2,99 (с, 3H), 2,24 (с, 3H), 1,61 (с, 6H), 1,22 (д, 6H, J=6,0 Гц)
(c) Синтез 4-бром-N-(3-хлор-5-(2-(3-изопропокси-5-метилфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
К раствору N-(3-хлор-5-(2-(3-изопропокси-5-метилфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида (50,0 мг, 0,09 ммоль) в безводном 1,4-диоксане (2,0 мл), NBS (15,6 мг, 0,09 ммоль) и AIBN (2,8 мг, 0,02 ммоль) добавляли при комнатной температуре. Реакционную смесь нагревали при 80°C в течение 4 часов, при комнатной температуре добавляли воду с последующей экстракцией EtOAc. Органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, CH2Cl2 : MeOH = 95:5), получая 4-бром-N-(3-хлор-5-(2-(3-изопропокси-5-метилфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (23,0 мг, 40%) в форме твердого вещества белого цвета.
LC/MS ESI (+): 649 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,78 (с, 1H), 9,61 (с, 1H), 8,48 (с, 1H), 8,08 (д, 1H, J=8,7 Гц), 7,89 (с, 1H), 7,54-7,56 (м, 2H), 7,02 (с, 1H), 6,61 (с, 1H), 6,58 (с, 1H), 6,49 (с, 1H), 4,53 (м, 1H), 3,08 (с, 3H), 2,24 (с, 3H), 1,62 (с, 6H), 1,22 (д, 6H, J=6,0 Гц).
Пример 489) Синтез N-(2-хлор-6-(4-хлорфенокси)пиридин-4-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
(a) Синтез 2-хлор-6-(4-хлорфенокси)пиридин-4-амина
2,6-дихлорпиридин-4-амин (2,0 г, 12,27 ммоль) и 4-хлорфенол (3,2 г, 24,54 ммоль) растворяли в безводном ДМСО (123,0 мл) и добавляли K2CO3 (3,4 г, 24,54 ммоль) с последующим перемешиванием при 150°C в течение 2 дней. После охлаждения до комнатной температуры к реакционной смеси добавляли насыщенный водный раствор NH4Cl (15,0 мл). Затем реакционную смесь экстрагировали EtOAc, промывали солевым раствором, высушивали над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с обратной фазой (C18-силикагель, 0,1% муравьиной кислоты в CH3CN : 0,1% муравьиной кислоты в H2O = 65:35), очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 2:1), получая 2-хлор-6-(4-хлорфенокси)пиридин-4-амин (690,0 мг, 22%) в форме твердого вещества белого цвета.
LC/MS ESI (+): 255 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 7,32 (д, 2H, J=8,8 Гц), 7,05 (д, 2H, J=8,8 Гц), 6,33 (д, 1H, J=1,6 Гц), 5,91 (д, 1H, J=1,6 Гц), 4,29 (ушир.с, 2H)
(b) Синтез 5-(метилсульфонамидо)бензо[b]тиофен-2-карбонил хлорида
5-(метилсульфонамидо)бензо[b]тиофен-2-карбоновую кислоту (300,0 мг, 1,11 ммоль) растворяли в безводном CH2Cl2 (10,0 мл) и добавляли оксалил хлорид (0,15 мл, 1,66 ммоль) и каталитическое количество безводного DMF. После перемешивания при 110°C в течение 30 минут, реакционную смесь охлаждали до комнатной температуры и высушивали в течение 1 часа при пониженном давлении. Получали 320,0 мг 5-(метилсульфонамидо)бензо[b]тиофен-2-карбонил хлорида в форме желтой жидкости.
(c) Синтез N-(2-хлор-6-(4-хлорфенокси)пиридин-4-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
5-(метилсульфонамидо)бензо[b]тиофен-2-карбонил хлорид (39,0 мг, 0,14 ммоль) и 2-хлор-6-(4-хлорфенокси)пиридин-4-амин (23,0 мг, 0,09 ммоль) растворяли в безводном 1,4-диоксане (0,3 мл), с последующим перемешиванием при 75ºC в течение 15 часов. Остаток экстрагировали EtOAc, и органический экстракт промывали солевым раствором, высушивали над безводным Na2SO4, и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 2:1), получая N-(2-хлор-6-(4-хлорфенокси)пиридин-4-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (15,0 мг, 33%) в форме твердого вещества белого цвета.
LC/MS ESI (+): 508 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 10,90 (ушир.с, 1H), 9,98 (ушир.с, 1H), 8,33 (с, 1H), 8,05 (д, 1H, J=8,8 Гц), 7,83 (д, 1H, J=1,6 Гц), 7,67 (с, 1H), 7,53 (д, 2H, J=8,8 Гц), 7,83 (дд, 1H, J=4,4, 1,0 Гц), 7,32 (с, 1H), 7,26 (д, 2H, J=8,8 Гц), 3,02 (с, 3H)
Способом синтеза согласно Примеру 489 синтезировали соединения с Примера 490 по Пример 492, и данные для каждого примера являются следующими.
1H-ЯМР (400 МГц, ДМСО-d6): δ 11,08 (с, 1H), 9,69 (ушир.с, 1H), 8,33 (д, 2H, J=6,4 Гц), 8,06 (с, 1H), 7,67 (с, 1H), 7,53 (д, 2H, J=8,8 Гц), 7,31 (с, 1H), 7,27 (д, 2H, J=8,8 Гц), 3,03 (с, 3H)
1H-ЯМР (400 МГц, ДМСО-d6): δ 11,03 (ушир.с, 1H), 9,86 (ушир.с, 1H), 8,41 (д, 1H, J=2,9 Гц), 8,35 (с, 1H), 8,05 (д, 1H, J=8,7 Гц), 7,82~7,85 (м, 2H), 7,68 (д, 1H, J=1,4 Гц), 7,64 (д, 1H, J=8,7 Гц), 7,45 (д, 1H, J=1,4 Гц), 7,38 (дд, 1H, J=8,7, 2,1 Гц), 3,05 (с, 3H)
1H-ЯМР (400 МГц, ДМСО-d6): δ 11,19 (ушир.с, 1H), 9,66 (ушир.с, 1H), 8,40 (д, 1H, J=2,9 Гц), 8,33(с, 1H), 8,32(с, 1H), 8,05 (с, 1H), 7,83 (дд, 1H J=8,7, 3,0 Гц), 7,67 (д, 1H, J=1,2 Гц), 7,64 (д, 1H, J=8,7 Гц), 7,43 (д, 1H, J=1,2 Гц), 3,01 (с, 3H)
Пример 493) Синтез N-(2-хлор-6-((6-(трифторметил)пиридин-3-ил)окси)пиридин-4-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
(a) Синтез 2-хлор-4-йод-6-((6-(трифторметил)пиридин-3-ил)окси)пиридина
2,6-дихлор-4-йодпиридин (500,0 мг, 1,83 ммоль) и 6-(трифторметил)пиридин-3-ол (298,0 мг, 1,83 ммоль) растворяли в безводном DMF (9,1 мл) и добавляли K2CO3 (378,0 мг, 2,74 ммоль) с последующим перемешиванием при 100°C в течение 3 часов. После охлаждения до комнатной температуры, реакционную смесь экстрагировали EtOAc, промывали солевым раствором, высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : EtOAc = 9:1), получая 2-хлор-4-йод-6-((6-(трифторметил)пиридин-3-ил)окси)пиридин (170,0 мг, 23%) в форме твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3): δ 8,60 (с, 1H), 7,69-7,77 (м, 2H), 7,51 (с, 1H), 7,38 (с, 1H)
(b) Синтез 2-хлор-6-((6-(трифторметил)пиридин-3-ил)окси)пиридин-4-амина
Процедуру синтеза Примера 337-b повторяли за исключением использования 2-хлор-4-йод-6-((6-(трифторметил)пиридин-3-ил)окси)пиридина (230,0 мг, 0,57 ммоль), получая 2-хлор-6-((6-(трифторметил)пиридин-3-ил)окси)пиридин-4-амин (90,0 мг, 54%) в форме твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3): δ 8,56 (с, 1H), 7,64-7,75 (м, 2H), 6,40 (с, 1H), 6,12 (с, 1H), 4,41 (ушир.с, 2H)
(c) Синтез N-(2-хлор-6-((6-(трифторметил)пиридин-3-ил)окси)пиридин-4-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
Процедуру синтеза Примера 489-с повторяли за исключением использования 2-хлор-6-((6-(трифторметил)пиридин-3-ил)окси)пиридин-4-амина (26,0 мг, 0,09 ммоль), получая N-(2-хлор-6-((6-(трифторметил)пиридин-3-ил)окси)пиридин-4-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (17,8 мг, 37%) в форме твердого вещества белого цвета.
LC/MS ESI (+): 543 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6): δ 11,03 (ушир.с, 1H), 9,86 (ушир.с, 1H), 8,69 (д, 1H, J=2,4 Гц), 8,30 (с, 1H), 7,95-8,01 (м, 3H), 7,79 (д, 1H, J=2,0 Гц), 7,65 (д, 1H, J=1,4 Гц), 7,46 (д, 1H, J=1,4 Гц), 7,33 (дд, 1H, J=8,7, 2,1 Гц), 2,97 (с, 3H).
Способом синтеза согласно Примеру 493 синтезировали соединения с Примера 494 по Пример 496, и данные для каждого примера являются следующими.
1H-ЯМР (400 МГц, ДМСО-d6): δ 11,19 (ушир.с, 1H), 9,66 (ушир.с, 1H), 8,74 (д, 1H, J=2,4 Гц), 8,38 (с, 1H), 8,36 (с, 1H), 8,10 (с, 1H), 8,00~8,06 (м, 2H), 7,70 (д, 1H, J=1,4 Гц), 7,51 (д, 1H, J=1,4 Гц), 3,07 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 11,07 (ушир.с, 1H), 9,93 (ушир.с, 1H), 8,35 (с, 1H), 8,06 (д, 1H, J=8,8 Гц), 7,85~7,87 (м, 3H), 7,72 (с, 1H), 7,39~7,46 (м, 4H), 3,03 (с, 3H)
1H-ЯМР(400 МГц, ДМСО-d6): δ 11,14 (ушир.с, 1H), 9,68 (ушир.с, 1H), 8,35~8,37 (м, 2H), 8,09 (с, 1H), 7,86 (д, 2H, J=8,4 Гц), 7,72 (д, 1H, J=1,6 Гц), 7,45 (д, 2H, J=8,4 Гц), 7,42 (д, 1H, J=1,6 Гц), 3,07 (с, 3H)
Пример 497) Синтез N-(3-хлор-5-(2-(4-хлорфенил)пропан-2-ил)фенил)-6-метокси-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
(a) Синтез 2-фтор-4-метокси-5-нитробензальдегида
2-фтор-4-метоксибензальдегид (1,0 г, 6,49 ммоль) растворяли в концентрированной H2SO4 (6,0 мл), и 70% водный раствор HNO3 (0,8 мл, 6,49 ммоль) и концентрированную H2SO4 (0,8 мл, 14,92 ммоль) медленно добавляли при -15°C с последующим перемешиванием в течение 2 часов. Реакционную смесь вливали в воду со льдом, и осадок отфильтровывали, растворяли в CH2Cl2 и нейтрализовали насыщенным водным раствором NaHCO3, Органический слой высушивали над безводным Na2SO4, концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонках (силикагель, n-Hex : CH2Cl2 = 3:1), получая 2-фтор-4-метокси-5-нитробензальдегид (1,2 г, 91%) в форме твердого вещества белого цвета.
1H-ЯМР (400 МГц, CDCl3): δ 10,21 (с, 1H), 8,46 (д, 1H, J=7,2 Гц), 6,88 (д, 1H, J=11,6 Гц), 4,06 (с, 3H)
(b) Синтез метил-6-метокси-5-нитробензо[b]тиофен-2-карбоксилата
Процедуру синтеза Промежуточного соединения 26-a повторяли за исключением использования 2-фтор-4-метокси-5-нитробензальдегида (1,2 г, 5,93 ммоль), получая метил-6-метокси-5-нитробензо[b]тиофен-2-карбоксилат (1,3 г, 81%) в форме твердого вещества желтого цвета.
1H-ЯМР (400 МГц, CDCl3): δ 8,34 (с, 1H), 8,03 (с, 1H), 7,47 (с, 1H), 4,04 (с, 3H), 3,96 (с, 3H)
(c) Синтез метил-5-амино-6-метоксибензо[b]тиофен-2-карбоксилата
Процедуру синтеза Промежуточного соединения 13-b повторяли за исключением использования метил-6-метокси-5-нитробензо[b]тиофен-2-карбоксилата (1,3 г, 4,83 ммоль), получая метил-5-амино-6-метоксибензо[b]тиофен-2-карбоксилат (1,1 г, 93%) в форме твердого вещества желтого цвета.
1H-ЯМР (400 МГц, CDCl3): δ 7,84 (с, 1H), 7,17 (с, 1H), 7,12 (с, 1H), 3,95 (ушир.с, 5H), 3,91 (с, 3H)
(d) Синтез метил-6-метокси-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксилата
Процедуру синтеза Промежуточного соединения 6-a повторяли за исключением использования метил-5-амино-6-метоксибензо[b]тиофен-2-карбоксилата (200,0 мг, 0,84 ммоль), получая метил-6-метокси-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксилат (266,0 мг, 100%) в форме твердого вещества желтого цвета.
1H-ЯМР (400 МГц, CDCl3): δ 8,00 (с, 1H), 7,96 (с, 1H), 7,32 (с, 1H), 6,89 (с, 1H), 3,99 (с, 3H), 3,94 (с, 3H), 2,98 (с, 3H)
(e) Синтез 6-метокси-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоновой кислоты
Процедуру синтеза Промежуточного соединения 6-b повторяли за исключением использования метил-6-метокси-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксилата (266,0 мг, 0,84 ммоль), получая 6-метокси-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоновую кислоту (246,0 мг, 97%) в форме твердого вещества белого цвета.
1H-ЯМР (300 МГц, ДМСО-d6): δ 13,33 (ушир.с, 1H), 9,08 (ушир.с, 1H), 8,02 (с, 1H), 7,86 (с, 1H), 7,72 (с, 1H), 3,91 (с, 3H), 2,98 (с, 3H)
(f) Синтез N-(3-хлор-5-(2-(4-хлорфенил)пропан-2-ил)фенил)-6-метокси-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамида
Процедуру синтеза Примера 1 повторяли за исключением использования 6-метокси-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоновой кислоты (50,0 мг, 0,17 ммоль), получая N-(3-хлор-5-(2-(4-хлорфенил)пропан-2-ил)фенил)-6-метокси-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид (22,1 мг, 24%) в форме твердого вещества белого цвета.
LC/MS ESI (+): 563 (M+1)
1H-ЯМР (400 МГц, ДМСО-d6); δ 10,48 (ушир.с, 1H), 9,11 (ушир.с, 1H), 8,22 (с, 1H), 7,88 (м, 1H), 7,81 (с, 1H), 7,74 (с, 1H), 7,50 (м, 1H), 7,38 (д, 2H, J=8,7 Гц), 7,28 (д, 2H, J=8,7 Гц), 7,02 (м, 1H), 3,92 (с, 3H), 2,97 (с, 3H), 1,65 (с, 6H)
Способом синтеза согласно Примеру 497 синтезировали соединение Примера 498, и данные для этого примера являются следующими.
1H-ЯМР(400 МГц, ДМСО-d6): δ 10,53 (ушир.с, 1H), 9,12 (ушир.с, 1H), 8,19 (с, 1H), 7,81 (с, 1H), 7,75 (м, 1H), 7,72 (м, 1H), 7,52 (д, 2H, J=8,9 Гц), 7,36 (м, 1H), 7,19 (д, 2H, J=8,9 Гц), 6,91 (м, 1H), 3,91 (с, 3H), 2,95 (с, 3H)
Экспериментальные примеры
Эксперименты проводили, как показано ниже для соединений, полученных в Примерах, приведенных выше.
Экспериментальный Пример 1) Эксперимент по ингибированию активностей STAT3 и STAT1 с помощью теста репортерного гена
1-1) Эксперимент по ингибированию активности STAT3
Линию клеток рака предстательной железы человека (стабильная линия клеток LNCaP; плазмида pSTAT3-TA-luc), которая содержит стабильно оперативный промотор STAT3, культивировали в среде RPMI1640 (Cat No. 11875, Life Technologies), содержащей 10% зародышевую бычью сыворотку (FBS) (Cat No. SH30396, Thermo Scientific) и 150 мкг/мл раствора G-418 (Cat No. 04 727 894 001, Rосhe). Тест репортерного гена с использованием стабильной линии клеток LNCaP проводили в среде RPMI1640, содержащей 3% DCC-FBS без раствора G-418, Стабильные клетки LNCaP высевали в два (2) белых 96-луночных планшета с плотностью 30000 клеток/50 мкл в каждую лунку. Клетки культивировали при 37°C в атмосфере 5% CO2 в течение 24 часов и затем обрабатывали соединениями, приведенными в Примерах, которые разбавляли в различных концентрациях. Затем IL-6 добавляли в каждую лунку в конечной концентрации 10 нг/мл. После завершения обработки соединениями и IL-6, клетки культивировали при 37°C в атмосфере 5% CO2 в течение времени от 24 дo 48 часов. Планшеты наблюдали под микроскопом, и исследовали и фиксировали осаждение лекарственного средства и особые наблюдения.
Люциферазный тест и тестирование жизнеспособности клеток проводили, соответственно, с одним или двумя планшетами. Для люциферазного теста жидкую среду в 96-луночном планшете удаляли и затем 20 мкл буфера для пассивного лизиса клеток добавляли в каждую лунку. После взбалтывания планшета в течение 30 минут, люциферазную активность каждой лунки измеряли в считывателе микропланшетов PHERAstarTM (BМG LABTECH), используя систему для люциферазного теста (Cat No. E1501, Promega). Для тестирования жизнеспособности клеток 96-луночный планшет оставляли при комнатной температуре в течение 30 минут, добавляли 20 мкл/лунка раствора CellTiter-Glo (Cat No. G7573, Promega) и взбалтывали в течение 10 минут в указанном порядке, чтобы измерить цитотоксичность, вызванную соединениями, приведенными в Примерах, с использованием считывателя микропланшетов PHERAstarTM (BМG LABTECH). Клетки без 0,1% ДМСО и стимуляции использовали в качестве отрицательного контроля, и клетки с 0,1% ДМСО и стимуляцией использовали в качестве положительного контроля.
1-2) Эксперимент по ингибированию активности STAT1
Линию клеток остеосаркомы человека (стабильная линия клеток U2OS; pGL4-STAT1-TA-luc), которая содержала стабильно оперативный промотор STAT1, культивировали в среде McCoy 5'A (Cat No. 16600, Life Technologies), содержащей 10% FBS (Cat No. SH30396, Thermo Scientific) и 1000 мкг /мл раствора G418 (Cat No. 04 727 894 001, Rосhe). Тест репортерного гена с использованием стабильной линии клеток U2OS проводили в среде McCoy 5'A, содержащей 10% FBS без раствора G-418, Стабильные клетки U2OS высевали в два (2) белых 96-луночных планшета с плотностью 25000 клеток/50 мкл в каждую лунку. Клетки культивировали при 37°C в атмосфере 5% CO2 в течение времени от 8 дo 24 часов и затем обрабатывали соединениями, приведенными в Примерах, которые разбавляли в различных концентрациях. Затем IFN-γ добавляли в каждую лунку с конечной концентрацией 50 нг/мл. После завершения обработки соединениями и IFN-γ, клетки культивировали при 37°C в атмосфере 5% CO2 в течение 24 часов. Планшеты наблюдали под микроскопом, и исследовали и фиксировали осаждение лекарственного средства и особые наблюдения.
Люциферазный тест и тестирование жизнеспособности клеток проводили, соответственно, с одним или двумя планшетами. Для люциферазного теста жидкую среду в 96-луночном планшете удаляли и затем 20 мкл буфера для пассивного лизиса клеток добавляли в каждую лунку. После взбалтывания планшета в течение 30 минут, люциферазную активность каждой лунки измеряли в считывателе микропланшетов PHERAstarTM (BМG LABTECH), используя систему для люциферазного теста (Cat No. E1501, Promega). Для тестирования жизнеспособности клеток 96-луночный планшет оставляли при комнатной температуре в течение 30 минут, добавляли 20 мкл/лунка раствора CellTiter-Glo (Cat No. G7573, Promega) и взбалтывали в течение 10 минут в указанном порядке, чтобы измерить цитотоксичность, вызванную соединениями, приведенными в Примерах, с использованием считывателя микропланшетов PHERAstarTM (BМG LABTECH). Клетки без 0,1% ДМСО и стимуляции использовали в качестве отрицательного контроля, и клетки с 0,1% ДМСО и стимуляцией использовали в качестве положительного контроля.
Результаты оценки ингибирующего эффекта соединений, приведенных в Примерах, на димеризацию STAT3 и STAT1, полученные в тестах репортерного гена STAT3 и STAT1, показаны ниже в Таблице 38.
pSTAT3
pSTAT1
pSTAT3
pSTAT1
Как показано в Таблице 38, соединения согласно настоящему изобретению демонтсрируют превосходный ингибирующий эффект в отношении активности белка STAT3, но почти не показывают ингибирующего эффекта в отношении активности белка STAT1.
Экспериментальный пример 2) Тест на ингибирование роста клеток
Ингибирующий эффект соединений согласно настоящему изобретению в отношении роста раковых клеток оценивали, как показано ниже. Линии раковых клеток, включая линию клеток рака желудка (AGS), линии клеток рака молочной железы (MDA-MB-231, MDA-MB-468 и BT-549), линии клеток рака предстательной железы (LNCaP и DU-145), линию клеток рака толстой кишки (HCT116), линию клеток рака яичника (SW626), линию клеток рака печени (Hep3B), линию клеток рака почек (ACHN), линию клеток рака легкого (NCI-H23) и линии клеток рака крови (HEL92.1.7 и U266) культивировали согласно протоколу, предоставленному каждым поставщиком. Среду, дополненную 10 нг/мл IL-6, использовали для LNCaP, линии клеток рака предстательной железы, при обработке лекарственным средством. Каждый тип клеток, используемых в экспериментах, субкультивировали в 96-луночном планшете, подсчитывая точное число клеток с использованием цитометра на основе изображений TaliTM (Life Technologies). В 96-луночном планшете AGS, HCT116 и DU-145 использовали с плотностью 3000 клеток/лунка; NCI-H23, SW626, Hep3B, ACHN, BT-549, MDA-MB-231, HEL92.1.7 и U266 использовали с плотностью 5000 клеток/лунка; и LNCaP и MDA-MB-468 использовали с плотностью 10000 клеток/лунка. Клетки обрабатывали соединениями, перечисленными в Примерах, которые разбавляли в различных концентрациях. После завершения обработки соединениями, клетки AGS, HCT116, SW626, DU145, NCI-H23, Hep3B, ACHN, BT-549, LNCaP, HEL92.1.7 и U266 культивировали при 37°C в атмосфере 5% CO2 в течение времени от 72 до 96 часов, и клетки MDA-MB-231 и MDA-MB-468 культивировали при 37°C на воздухе в течение времени от 72 до 96 часов. Затем клетки наблюдали под микроскопом, и исследовали и фиксировали осаждение лекарственного средства и особые наблюдения. И затем 96-луночный планшет оставляли при комнатной температуре в течение 30 минут, добавляли 20 мкл/лунка раствора CellTiter-Glo (Cat No. G7573, Promega) и взбалтывали в течение 10 минут, после чего подвергали измерению с использованием считывателя микропланшетов PHERAstarTM (BМG LABTECH) согласно протоколу поставщика. Лунки, в которые добавляли только культуральную жидкость без высевания клеток использовали в качестве отрицательного контроля, тогда как лунки, в которых культуральная жидкость содержала 0,1% ДМСО вместо соединений, перечисленных в Примерах, использовали в качестве положительного контроля.
Результаты ингибирующего эффекта соединений, полученных в Примерах, в отношении роста раковых клеток показаны ниже в Таблицах 39-46.
LNCap
LNCap
LNCap
LNCap
MDA-MB-231
MDA-MB-231
MDA-MB-231
MDA-MB-231
AGS
AGS
AGS
AGS
DU-145
DU-145
DU-145
DU-145
U-266
U-266
U-266
U-266
HEL92.1.7
HEL92.1.7
HEL92.1.7
HEL92,1,7
MDA-MB-468
ACHN
HCT-116
Hep3B
SW626
NCI-H23
BT-549
NCI-H508
SW1417
HCC1500
MDA-MB-361
NCI-H661
NCI-H1650
Raji
IM-9
C-33A
Как показано в Таблицах 39-46, соединения согласно настоящему изобретению демонстрировали превосходный ингибирующий эффект в отношении роста различных видов раковых клеток.
Хотя изобретение было описано в отношении приведенных выше частных вариантов осуществления, следует понимать, что специалист может вносить в изобретение различные модификации и изменения, которые также входят в объем изобретения, определяемого приложенной формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2734390C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2711502C2 |
| ИНГИБИТОРЫ ГЛИКОЛАТОКСИДАЗЫ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ | 2018 |
|
RU2805308C2 |
| БЕНЗОТИАЗОЛЬНЫЕ СОЕДИНЕНИЯ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ НЕЙРОДЕГЕНЕРАТИВНЫХ РАССТРОЙСТВ | 2018 |
|
RU2778370C2 |
| ПРОИЗВОДНЫЕ ЗАМЕЩЕННОГО ДИГИДРОПИРАНОИНДОЛ-3,4-ДИОНА КАК ИНГИБИТОРЫ ИНГИБИТОРА-1 АКТИВАТОРА ПЛАЗМИНОГЕНА (PAI-1) | 2003 |
|
RU2337910C2 |
| ПРОТИВОИНФЕКЦИОННЫЕ СОЕДИНЕНИЯ | 2011 |
|
RU2576662C2 |
| МОДУЛЯТОРЫ АТФ-СВЯЗЫВАЮЩИХ ТРАНСПОРТЕРОВ | 2010 |
|
RU2552353C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛОПИРИДИНА В КАЧЕСТВЕ БЛОКАТОРОВ TTX-S | 2013 |
|
RU2652117C2 |
| ПРОИЗВОДНОЕ ИНДАНОНА, ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ ИЛИ ЭНАНТИОМЕР, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ ВИРУСНОГО ЗАБОЛЕВАНИЯ | 2012 |
|
RU2574591C2 |
| ЗАМЕЩЕННЫЕ ТРИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И СПОСОБ ПРИМЕНЕНИЯ | 2016 |
|
RU2744766C2 |
Изобретение относится к соединению формулы:
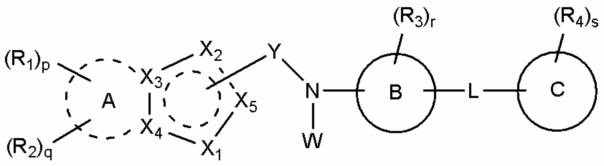 (I),
(I),
в которой A обозначает насыщенный или ненасыщенный C5-6 карбоцикл или 5-10-членный гетероцикл; B обозначает бензол или 5-12-членный гетероцикл, содержащий 1-3 атома азота; C обозначает бензол, 5-12-членный гетероцикл или C3-6 карбоцикл; Y обозначает -C(=O)-, связанный с X2 или X5; X1 обозначает -O-, -S-, -S(=O)-, -S(=O)2- или -N(W1)-; X2 обозначает атом углерода, связанный с Y, или -N=, -NH-, -C(W2)= или -CH(W2)-, не связанный с Y; X3 и X4 каждый независимо обозначает атом углерода или азота; X5 обозначает атом углерода, связанный с Y, или -CH=, не связанный с Y; причем 5-членное кольцо, включающее X1-X5, является ароматическим или неароматическим; W обозначает водород, галоген или C1-6 алкил; W1 обозначает водород, C1-6 алкил, C1-6 алкоксикарбонил или 5-8-членный гетероциклил-C1-4 алкил; W2 обозначает водород, галоген, C1-6 алкил или 5-8-членный гетероциклил-C1-4 алкил; L обозначает -(CR9R10)m-, -(CR9R10)m-O-, -NH-, -N(C1-6 алкил)-, -S(=O)2-, -C(=O)-, -C(=CH2)- или C3-7 циклоалкилен, причем m означает целое число от 0 до 3 и R9 и R10 обозначают, каждый независимо, водород, гидрокси, галоген или C1-6 алкил; R1 обозначает нитро, амино, C1-6 алкилсульфонил, галогенC1-6 алкокси или любую из следующих структурных формул i) - iv):
i)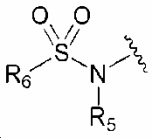 , ii)
, ii)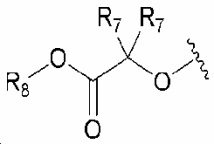 , iii)
, iii) 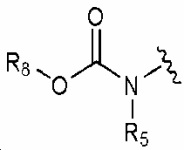 и iv)
и iv) 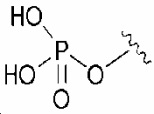 ;
;
R2 обозначает водород, галоген, нитро, амино, C1-6алкокси, галогенC1-6алкокси, C1-6 алкилсульфонил или 5- или 6-членный гетероциклоалкил; R3 обозначает водород, галоген, циано, C1-6 алкил, галогенC1-6 алкил, цианоC1-6 алкил, C1-6 алкилкарбонил, C1-6 алкокси, галогенC1-6 алкокси, цианоC1-6 алкокси, C1-6 алкиламино, диC1-6 алкиламино, C1-6 алкилтио, C1-6 алкиламинокарбонил, диC1-6 алкиламинокарбонил, C2-8 алкинил, C6-10 арил, галогенC6-10 арил, 5-10-членный гетероциклил или 5-10-членный гетероциклилкарбонил, причем гетероциклильная часть может быть замещена одним-тремя заместителями; R4 обозначает водород, галоген, гидрокси, циано, нитро, амино, оксо, аминосульфонил, сульфониламидо, C1-6 алкиламино, C1-6 алкил, галогенC1-6 алкил, цианоC1-6 алкил, C1-6 алкокси, галогенC1-6 алкокси, цианоC1-6 алкокси, C3-8 циклоалкилокси, C2-8 алкинил, C1-6 алкиламино-C1-6 алкокси, диC1-6 алкиламино-C1-6 алкокси, C1-6 алкоксикарбонил, карбамоил, карбамоил-C1-6 алкокси, C1-6 алкилтио, C1-6 алкилсульфинил, C1-6 алкилсульфонил, 5-10-членный гетероциклил, 5-10-членный гетероциклил-C1-6 алкил, 5-10-членный гетероциклил-C1-6 алкокси или 5-10-членный гетероциклилокси, причем гетероциклильная часть может быть замещена одним или двумя заместителями; R6 обозначает C1-6 алкил, галогенC1-6 алкил, C1-6 алкоксиC1-6 алкил, C1-6 алкилкарбонилC1-6 алкил, C2-7 алкенил, амино, аминоC1-6 алкил, C3-7 циклоалкил, 5-10-членный гетероциклил или 5-10-членный гетероциклил-C1-6 алкил, или конденсирован с R5, образуя C3-4 алкилен, причем аминогруппа может быть замещена одним или двумя заместителями, R7 и R8 обозначают, каждый независимо, водород или C1-6 алкил; p означает 1 и q означает 0 или 1; r означает целое число от 0 до 3, и, когда r = 2 или больше, группы R3 являются одинаковыми или разными; и s означает целое число от 0 до 3, и, когда s = 2 или больше, группы R4 являются одинаковыми или разными, которое имеет ингибирующий эффект в отношении активации белка STAT3 и может быть использовано для профилактики или лечения заболеваний, связанных с активацией белка STAT3. 5 н. и 12 з.п. ф-лы, 46 табл., 497 пр.
1. Соединение, выбранное из группы, состоящей из гетероциклического производного, представленного формулой (I), и его фармацевтически приемлемой соли и стереоизомера:
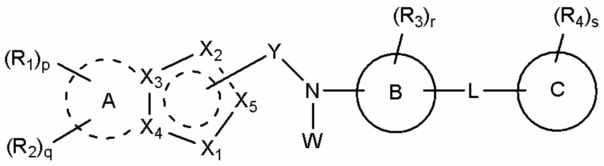 (I),
(I),
в которой
A обозначает насыщенный или ненасыщенный C5-6 карбоцикл или 5-10-членный гетероцикл, содержащий 1-3 гетероатома, выбранных из N, O и S;
B обозначает бензол или 5-12-членный гетероцикл, содержащий 1-3 атома азота;
C обозначает бензол, 5-12-членный гетероцикл, содержащий 1-3 гетероатома, выбранных из N, O и S, или C3-6 карбоцикл;
Y обозначает -C(=O)-, связанный с X2 или X5;
X1 обозначает -O-, -S-, -S(=O)-, -S(=O)2- или -N(W1)-;
X2 обозначает атом углерода, связанный с Y, или -N=, -NH-, -C(W2)= или -CH(W2)-, не связанный с Y;
X3 и X4 каждый независимо обозначает атом углерода или азота;
X5 обозначает атом углерода, связанный с Y, или -CH=, не связанный с Y;
причем 5-членное кольцо, включающее X1-X5, является ароматическим или неароматическим;
W обозначает водород, галоген или C1-6 алкил;
W1 обозначает водород, C1-6 алкил, C1-6 алкоксикарбонил или 5-8-членный гетероциклил-C1-4 алкил, содержащий 1 или 2 гетероатома, выбранных из N и O;
W2 обозначает водород, галоген, C1-6 алкил или 5-8-членный гетероциклил-C1-4 алкил, содержащий 1 или 2 гетероатома, выбранных из N и О;
L обозначает -(CR9R10)m-, -(CR9R10)m-O-, -NH-, -N(C1-6 алкил)-, -S(=O)2-, -C(=O)-, -C(=CH2)- или C3-7 циклоалкилен, причем m означает целое число от 0 до 3 и R9 и R10 обозначают, каждый независимо, водород, гидрокси, галоген или C1-6 алкил;
R1 обозначает нитро, амино, C1-6 алкилсульфонил, галогенC1-6алкокси или любую из следующих структурных формул i) - iv):
i)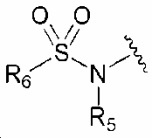 , ii)
, ii)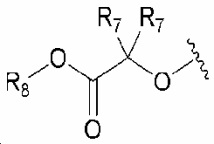 , iii)
, iii) 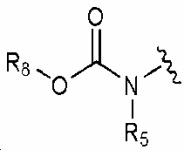 и iv)
и iv)  ;
;
R2 обозначает водород, галоген, нитро, амино, C1-6алкокси, галогенC1-6алкокси, C1-6 алкилсульфонил или 5- или 6-членный гетероциклоалкил, содержащий 1-3 гетероатома, выбранных из N, O и S;
R3 обозначает водород, галоген, циано, C1-6 алкил, галогенC1-6 алкил, цианоC1-6 алкил, C1-6 алкилкарбонил, C1-6 алкокси, галогенC1-6 алкокси, цианоC1-6 алкокси, C1-6 алкиламино, диC1-6 алкиламино, C1-6 алкилтио, C1-6 алкиламинокарбонил, диC1-6 алкиламинокарбонил, C2-8 алкинил, C6-10 арил, галогенC6-10 арил, 5-10-членный гетероциклил, содержащий 1-3 гетероатома, выбранных из N, O и S, или 5-10-членный гетероциклилкарбонил, содержащий 1-3 гетероатома, выбранных из N, O и S, причем гетероциклильная часть может быть замещена одним-тремя заместителями, выбранными из группы, состоящей из галогена, гидрокси, циано, амино, C1-6 алкила, галогенC1-6 алкила, C1-6 алкокси и C1-6 алкоксикарбонила;
R4 обозначает водород, галоген, гидрокси, циано, нитро, амино, оксо, аминосульфонил, сульфониламидо, C1-6 алкиламино, C1-6 алкил, галогенC1-6 алкил, цианоC1-6 алкил, C1-6 алкокси, галогенC1-6 алкокси, цианоC1-6 алкокси, C3-8 циклоалкилокси, C2-8 алкинил, C1-6 алкиламино-C1-6 алкокси, диC1-6 алкиламино-C1-6 алкокси, C1-6 алкоксикарбонил, карбамоил, карбамоил-C1-6 алкокси, C1-6 алкилтио, C1-6 алкилсульфинил, C1-6 алкилсульфонил, 5-10-членный гетероциклил, содержащий 1-3 гетероатома, выбранных из N, O и S, 5-10-членный гетероциклил-C1-6 алкил, содержащий 1-3 гетероатома, выбранных из N, O и S, 5-10-членный гетероциклил-C1-6 алкокси, содержащий 1-3 гетероатома, выбранных из N, O и S, или 5-10-членный гетероциклилокси, содержащий 1-3 гетероатома, выбранных из N, O и S, причем гетероциклильная часть может быть замещена одним или двумя заместителями, выбранными из группы, состоящей из гидрокси, оксо, C1-6 алкила, C1-6 алкилкарбонила, C1-6 алкоксикарбонила, C1-6 алкилсульфонила, диC1-3 алкилсульфонила, C1-6 алкилкарбонила, C1-6 алкиламинокарбонила, диC1-3 алкиламинокарбонила, C1-6 алкиламиносульфонила и незамещенного или C1-6 алкилзамещенного 5-10-членного гетероциклила, содержащего 1-3 гетероатома, выбранных из N, O и S;
R5 обозначает водород, C1-6 алкил, карбамоилC1-6 алкил, C1-6 алкиламиноC1-6 алкил, диC1-6 алкиламиноC1-6 алкил или 5-10-членный гетероциклилC1-6 алкил, содержащий 1-3 гетероатома, выбранных из N, O и S, или конденсирован с R6, образуя C3-4 алкилен;
R6 обозначает C1-6 алкил, галогенC1-6 алкил, C1-6 алкоксиC1-6 алкил, C1-6 алкилкарбонилC1-6 алкил, C2-7 алкенил, амино, аминоC1-6 алкил, C3-7 циклоалкил, 5-10-членный гетероциклил, содержащий 1-3 гетероатома, выбранных из N, O и S, или 5-10-членный гетероциклил-C1-6 алкил, содержащий 1-3 гетероатома, выбранных из N, O и S, или конденсирован с R5, образуя C3-4 алкилен, причем аминогруппа может быть замещена одним или двумя заместителями, выбранными из гидрокси или C1-6 алкила, и гетероциклильная часть может быть замещена одним-четырьмя заместителями, выбранными из группы, состоящей из оксо, C1-6 алкила и C1-6 алкилкарбонила;
R7 и R8 обозначают, каждый независимо, водород или C1-6 алкил;
p означает 1 и q означает 0 или 1;
r означает целое число от 0 до 3, и, когда r = 2 или больше, группы R3 являются одинаковыми или разными; и
s означает целое число от 0 до 3, и, когда s = 2 или больше, группы R4 являются одинаковыми или разными;
все указанные гетероциклические или гетероциклильные группы, каждая независимо, имеют насыщенное или ненасыщенное единственное кольцо или множество колец и содержат 1-3 гетероатома, выбранных из N, O или S; и
все указанные арильные группы, каждая независимо, имеют ароматическое единственное кольцо или множество колец.
2. Соединение по п. 1, в котором
A обозначает насыщенный или ненасыщенный C5-6 карбоцикл или 5-10-членный гетероцикл, содержащий 1-3 гетероатома, выбранных из N, O или S;
B обозначает бензол или 5-12-членный гетероцикл, содержащий 1-3 атома N;
C обозначает бензол или 5-12-членный гетероцикл, содержащий 1-3 гетероатома, выбранных из N, O или S;
Y обозначает -C(=O)-, связанный с X5;
X1 обозначает -O-, -S-, -S(=O)-, -S(=O)2- или -N(W1)-;
X2 обозначает -N=, -C(W2)= или -CH(W2)-, не связанный с Y;
X3 и X4 обозначают атом углерода;
X5 обозначает атом углерода, связанный с Y;
причем 5-членное кольцо, включающее X1-X5, является ароматическим или неароматическим;
L обозначает -(CR9R10)m-, -(CR9R10)m-O-, -NH-, -N(C1-6 алкил)-, -S(=O)2-, -C(=O)-, -C(=CH2)- или C3-7 циклоалкилен, причем m означает целое число от 0 до 3 и R9 и R10 обозначают, каждый независимо, водород, гидрокси, галоген или C1-6 алкил;
R1 обозначает нитро, амино, C1-6 алкилсульфонил, галогенC1-6 алкокси или любую из следующих структурных формул i) - iv):
i) , ii)
, ii) , iii)
, iii)  и iv)
и iv)  ;
;
R2 обозначает водород, галоген, C1-6 алкокси, галогенC1-6 алкокси или C1-6 алкилсульфонил;
R3 обозначает водород, галоген, циано, C1-6 алкил, галогенC1-6 алкил, цианоC1-6 алкил, C1-6 алкилкарбонил, C1-6 алкокси, галогенC1-6 алкокси, цианоC1-6 алкокси, C1-6 алкиламино, диC1-6 алкиламино, C1-6 алкилтио, C1-6 алкиламинокарбонил, диC1-6 алкиламинокарбонил, C2-8 алкинил, C6-10 арил, 5-10-членный гетероарил, содержащий 1 или 2 гетероатома, выбранных из N или S, 5-10-членный гетероциклоалкил, содержащий 1 или 2 гетероатома, выбранных из N или O, или 5-10-членный гетероциклоалкилкарбонил, содержащий 1 или 2 гетероатома, выбранных из N или O;
R4 обозначает водород, галоген, гидрокси, циано, нитро, амино, оксо, аминосульфонил, сульфониламидо, C1-6 алкиламино, C1-6 алкил, галогенC1-6 алкил, цианоC1-6 алкил, C1-6 алкокси, галогенC1-6 алкокси, цианоC1-6 алкокси, C3-8 циклоалкилокси, C2-8алкинил, C1-6 алкиламино-C1-6 алкокси, C1-6 алкоксикарбонил, карбамоил, карбамоил-C1-6 алкокси, C1-6 алкилтио, C1-6 алкилсульфонил, 5-10-членный гетероциклил-C1-6 алкил, содержащий 1 или 2 гетероатома, выбранных из N или O, 5-10-членный гетероциклил-C1-6 алкокси, содержащий 1 или 2 гетероатома, выбранных из N или O, или 5-10-членный гетероциклилокси, содержащий 1 или 2 гетероатома, выбранных из N или O, причем гетероциклильная часть может быть замещена одним или двумя заместителями, выбранными из группы, состоящей из гидрокси, C1-6 алкоксикарбонила, C1-6 алкилсульфонила, C1-6 алкилкарбонила, C1-6 алкиламинокарбонила, C1-6 алкиламиносульфонила и незамещенного или C1-6 алкилзамещенного 5-10-членного гетероциклила, содержащего 1 или 2 гетероатома, выбранных из N, O или S;
R5 обозначает водород, C1-6 алкил, карбамоилC1-6 алкил, C1-6 алкиламино-C1-6 алкил или 5-10-членный гетероциклоалкил-C1-6 алкил, содержащий 1-3 гетероатома, выбранных из N, O или S;
R6 обозначает C1-6 алкил, галогенC1-6 алкил, C1-6 алкоксиC1-6 алкил, C1-6 алкилкарбонилC1-6 алкил, алкенил C2-7, амино, аминоC1-6 алкил, C3-7 циклоалкил, 5-10-членный гетероциклил, содержащий от одного до трех гетероатомов, выбранных из N, O или S, или 5-10-членный гетероциклилC1-6 алкил, содержащий 1-3 гетероатома, выбранных из N, O или S, причем аминогруппа может быть замещена одним или двумя заместителями, выбранными из гидрокси или C1-6 алкила, и гетероциклильная часть может быть замещена одним-четырьмя заместителями, выбранными из группы, состоящей из C1-6 алкила и C1-6 алкилкарбонила;
R7 и R8 обозначают, каждый независимо, водород или C1-6 алкил;
p = 1 и q = 0 или 1;
r означает целое число от 0 до 3, и, когда r = 2 или больше, группы R3 являются одинаковыми или разными; и
s означает целое число от 0 до 3, и, когда s = 2 или больше, группы R4 являются одинаковыми или разными;
все указанные гетероциклические или гетероциклильные группы, каждая независимо, имеют насыщенное или ненасыщенное единственное кольцо или множество колец;
все указанные гетероциклоалкильные группы, каждая независимо, имеют насыщенное единственное кольцо или множество колец; и
все указанные арильные или гетероарильные группы, каждая независимо, имеют ароматическое единственное кольцо или множество колец.
3. Соединение по п. 2, в котором
A обозначает насыщенный или ненасыщенный C6 карбоцикл или 6-членный гетероцикл, содержащий 1-3 атома N,
B обозначает бензол или 5-10-членный гетероцикл, содержащий 1-3 атома N,
C обозначает бензол или 5-12-членный гетероарил, содержащий 1-3 гетероатома, выбранных из N, O или S,
L обозначает -(CR9R10)m-, -O-, -NH-, -N(C1-6 алкил)-, -S(=O)2-, -C(=O)-, -C(=CH2)- или C3-7 циклоалкилен, причем m означает целое число от 0 до 3 и R9 и R10 обозначают, каждый независимо, водород, гидрокси, галоген или C1-6 алкил; и
R1 обозначает нитро, амино или любую из следующих структурных формул i) - iv):
i) , ii)
, ii) , iii)
, iii)  и iv)
и iv)  ;
;
в которых R5-R8 имеют те же самые значения, как определено в п. 2;
все указанные гетероциклические группы, каждая независимо, имеют насыщенное или ненасыщенное единственное кольцо или множество колец; и
указанная гетероарильная группа имеет ароматическое единственное кольцо или множество колец.
4. Соединение по п. 2, в котором
A обозначает насыщенный или ненасыщенный C3-10 карбоцикл или 5-10-членный гетероцикл, содержащий 1-3 гетероатома, выбранных из N, O или S;
B обозначает бензол или 9-12-членный гетероцикл, содержащий 1-3 атома N;
C обозначает бензол или 5-10-членный гетероцикл, содержащий 1-3 гетероатома, выбранных из N, O или S;
R3 обозначает водород, галоген, циано, C1-6 алкил, галогенC1-6 алкил, цианоC1-6 алкил, C1-6 алкокси, галогенC1-6 алкокси, цианоC1-6 алкокси, C1-6 алкиламино, диC1-6 алкиламино, C1-6 алкиламинокарбонил, диC1-6 алкиламинокарбонил, C2-8 алкинил, 5-10-членный гетероциклил, содержащий от одного до трех гетероатомов, выбранных из N, O или S, или 5-10-членный гетероциклоалкилкарбонил, содержащий 1 или 2 гетероатома, выбранных из N или O, причем гетероциклильная часть может быть замещена одним-тремя заместителями, выбранными из группы, состоящей из галогена, гидрокси, циано, амино, C1-6 алкила, галогенC1-6 алкила, C1-6 алкокси и C1-6 алкоксикарбонила; и
r = 0 или 1;
все указанные гетероциклические группы и гетероциклильные группы, каждая независимо, имеют насыщенное или ненасыщенное единственное кольцо или множество колец; и
указанная гетероциклоалкильная группа имеет насыщенное единственное кольцо или множество колец.
5. Соединение по п. 4, в котором A обозначает насыщенный или ненасыщенный C6 карбоцикл или 6-членный гетероцикл, содержащий 1-3 атома N.
6. Соединение по п. 4, в котором
B обозначает 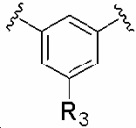 или
или 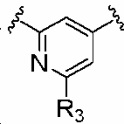 и
и
R3 имеет значения, определенные в п. 4,
7. Соединение по п. 1, в котором
А обозначает бензол или 6-членный гетероцикл, содержащий 1-3 атома N;
B обозначает бензол или 6-10-членный гетероцикл, содержащий 1-3 атома N;
C обозначает бензол, 6-10-членный гетероцикл, содержащий 1-3 гетероатома, выбранных из N, O или S, или C5-6 карбоцикл;
Y обозначает -C(=O)-, связанный с X2 или X5;
X1 обозначает -O-, -S-, -S(=O)-, -S(=O)2- или -N(W1)-;
X2 обозначает атом углерода, связанный с Y, или -NH-, -C(W2)= или -CH(W2)-, не связанный с Y;
X3 и X4 обозначают, каждый независимо, атом углерода или азота;
X5 обозначает атом углерода, связанный с Y, или -CH=, не связанный с Y;
причем 5-членное кольцо, включающее X1-X5, является ароматическим или неароматическим;
W обозначает водород, C1-3 алкил или 5- или 6-членный гетероциклоалкил-C1-3 алкил, содержащий 1 или 2 гетероатома, выбранных из N или O;
W1 обозначает водород, C1-3 алкил, трет-бутоксикарбонил или 5- или 6-членный гетероциклоалкил-C1-3 алкил, содержащий 1 или 2 гетероатома, выбранных из N или O;
W2 обозначает водород, галоген или C1-3 алкил;
L обозначает -(CR9R10)m-, -O-, -S(=O)2-, C3-6 циклоалкилен, -NH-, -N(C1-3 алкил)-, -C(=CH2)- или -C(=O)-, в которых m = 0 или 1 и R9 и R10 обозначают, каждый независимо, водород, галоген, гидрокси или C1-3 алкил;
R1 обозначает любую из следующих структурных формул i) - iv):
i) , ii)
, ii) , iii)
, iii)  и iv)
и iv)  ;
;
R2 обозначает водород, галоген, нитро, амино, C1-3 алкокси, галогенC1-3 алкокси, C1-3 алкилсульфонил или 5- или 6-членный гетероциклоалкил, содержащий 1 или 2 гетероатома, выбранных из N или O;
R3 обозначает водород, галоген, C1-3 алкилкарбонил, циано, цианоC1-3 алкил, C1-3 алкил, галогенC1-3 алкил, C2-3 алкинил, галогенC1-3 алкокси, цианоC1-3 алкокси, C1-6 алкокси, C1-3 алкиламино, диC1-3 алкиламино, C1-3 алкиламинокарбонил, диC1-3 алкиламинокарбонил, фенил, галогенфенил, 5- или 6-членный гетероциклил или 5- или 6-членный гетероциклилкарбонил, причем гетероциклильная часть содержит 1-3 гетероатома, выбранных из N, O или S, и в случае необходимости замещена одним-тремя заместителями, выбранными из группы, состоящей из галогена, гидрокси, циано, амино, C1-3 алкила, галогенC1-3 алкила, C1-3 алкокси и трет-бутоксикарбонила;
R4 обозначает водород, оксо, гидрокси, нитро, циано, галоген, аминосульфонил, амино, C1-3 алкиламино, диC1-3 алкиламино-C1-3 алкокси, C1-3 алкилтио, C1-3 алкилсульфинил, C1-3 алкилсульфонил, C1-3 алкил, цианоC1-3 алкил, C2-4 алкинил, C1-3 алкокси, цианоC1-3 алкокси, галогенC1-3 алкокси, карбамоил-C1-3 алкокси, C3-6 циклоалкилокси, 4-10-членный гетероциклил, 4-10-членный гетероциклилокси или 4-10-членный гетероциклил-C1-3 алкил, причем гетероциклильная часть содержит 1-3 гетероатома, выбранных из N, O или S, и в случае необходимости замещена одним или двумя заместителями, выбранными из группы, состоящей из гидрокси, оксо, C1-3 алкила, t-бутилкарбонила, трет-бутоксикарбонила, C1-3 алкилсульфонила, диC1-3 алкилсульфонила, диC1-3 алкиламинокарбонила, 4-6-членного гетероциклила и C1-6 алкилзамещенного 4-6-членного гетероциклила;
R5 обозначает водород, C1-3 алкил, карбамоилC1-3 алкил, диC1-3 алкиламино-C1-3 алкил или морфолино-C1-3 алкил или конденсирован с R6, образуя C3-4 алкилен;
R6 обозначает C1-3 алкил, галогенC1-3 алкил, C1-3 алкоксиC1-3 алкил, C2-3 алкенил, амино, аминоC1-3 алкил, C3-6 циклоалкил, 5- или 6-членный гетероциклил или 5- или 6-членный гетероциклил-C1-3 алкил или конденсирован с R5, образуя C3-4 алкилен, причем гетероциклильная часть содержит 1-3 гетероатома, выбранных из N, O или S, и в случае необходимости замещена одним-четырьмя заместителями, выбранными из группы, состоящей из водорода, оксо, C1-3 алкила и ацетила, и аминогруппа не замещена или замещена одним или двумя заместителями, выбранными из гидрокси или C1-3 алкила;
R7 обозначает водород или C1-3 алкил;
R8 обозначает водород или C1-6 алкил;
p означает 1 и q означает 0 или 1;
r = 0 или 1; и
s означает целое число от 0 до 3, и, когда s = 2 или больше, группы R4 являются одинаковыми или разными;
все указанные гетероциклические и гетероциклильные группы, каждая независимо, имеют насыщенное или ненасыщенное единственное или двойное кольцо.
8. Соединение по п. 7, в котором
B обозначает  или
или  и
и
R3 имеет значения, определенные в п. 7,
9. Соединение по п. 7, в котором
m = 1 и
R9 и R10 обозначают, каждый независимо, галоген, гидрокси или C1-3 алкил.
10. Соединение по п. 7, в котором
m = 0 и
R3 обозначает водород, фенил, галогенфенил, насыщенный или ненасыщенный 5- или 6-членный гетероциклил или 5-6-членный гетероциклилкарбонил, причем гетероциклильная часть содержит 1-3 гетероатома, выбранных из N, O или S, и в случае необходимости замещена одним-тремя заместителями, выбранными из группы, состоящей из галогена, гидрокси, циано, амино, C1-3 алкила, галогенC1-3 алкила, C1-3 алкокси и трет-бутоксикарбонила.
11. Соединение по п. 7, в котором
X1 обозначает -S- или -NH-;
X2 обозначает -CH=, не связанный с Y;
X3 и X4 обозначают атом углерода и
R1 обозначает структурную формулу i).
12. Соединение выбранное из группы, состоящей из следующих соединений:
1) N-(3-(2-(4-фторфенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
2) 6-(метилсульфонамидо)-N-(3-(2-фенилпропан-2-ил)фенил)-1H-индол-2-карбоксамид;
3) N-(3-(2-(4-фторфенил)пропан-2-ил)фенил)-5-метокси-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
4) N-(3-метокси-5-(2-(3-(трифторметокси)фенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
5) N-(3-(2-(4-фторфенил)пропан-2-ил)фенил)-6-((N-метилсульфамоил)амино)-1H-индол-2-карбоксамид;
6) N-(3-(2-(4-фторфенил)пропан-2-ил)фенил)-6-(метилсульфонил)-1H-индол-2-карбоксамид;
7) N-(3-(2-(2-фторфенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
8) 6-(метилсульфонамидо)-N-(3-(2-(3-(трифторметокси)фенил)пропан-2-ил)фенил)-1H-индол-2-карбоксамид;
9) N-(3-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
10) N-(3-(1-(3-метокси-5-(трифторметокси)фенил)этил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
11) N-(3-(2-(2,4-дифторфенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
12) N-(3-(2-(3-метоксифенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
13) N-(3-метокси-5-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
14) N-(3-бром-5-(2-(4-фторфенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
15) N-(3-бром-5-(2-(2,4-дифторфенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
16) N-(3-бром-5-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
17) N-(3-(дифторметокси)-5-(2-(4-фторфенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
18) N-(3-(2-(3-(2-амино-2-оксоэтокси)фенил)пропан-2-ил)-5-бромфенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
19) N-(3-бром-5-(2-(4-фторфенил)пропан-2-ил)фенил)-5-метокси-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
20) N-(3-бром-5-(2-(3-(дифторметокси)фенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
21) N-(3-хлор-5-(2-(4-фторфенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
22) N-(3-бром-5-(2-(3-этокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
23) N-(3-бром-5-(2-(2-фтор-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
24) N-(3-хлор-5-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
25) N-(3-(2-(4-фторфенил)пропан-2-ил)фенил)-5-(трифторметокси)-1H-индол-2-карбоксамид;
26) N-(3-(2-(4-фторфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
27) N-(3-(2-(2,4-дифторфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
28) N-(3-(2-(4-фторфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензофуран-2-карбоксамид;
29) N-(3-(2-(2,4-дифторфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензофуран-2-карбоксамид;
30) N-(3-(2-(4-фторфенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
31) N-(3-(2-(2-фторфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
32) N-(3-бром-5-(2-(4-фторфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
33) N-(3-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
34) N-(3-метокси-5-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
35) N-(3-бром-5-(2-(2,4-дифторфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
36) N-(3-бром-5-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
37) 5-(метилсульфонамидо)-N-(3-(2-(3-(трифторметокси)фенил)пропан-2-ил)фенил)бензо[b]тиофен-2-карбоксамид;
38) N-(3-(2-(3-метоксифенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
39) N-(3-(дифторметокси)-5-(2-(4-фторфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
40) N-(3-хлор-5-(2-(4-фторфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
41) N-(3-(дифторметокси)-5-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
42) N-(3-хлор-5-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
43) N-(3-(2-(3-(2-амино-2-оксоэтокси)фенил)пропан-2-ил)-5-бромфенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
44) N-(3-(2-(5-(2-амино-2-оксоэтокси)-2-фторфенил)пропан-2-ил)-5-бромфенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
45) N-(3-(2-(3-((1-амино-2-метил-1-оксопропан-2-ил)окси)фенил)пропан-2-ил)-5-бромфенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
46) N-(3-бром-5-(2-(3-(дифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
47) N-(3-бром-5-(2-(2-фтор-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
48) N-(3-бром-5-(2-(3-этокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
49) N-(3-бром-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
50) N-(3-бром-5-(2-(3-(морфолинометил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
51) N-(3-(2-(4-фторфенил)пропан-2-ил)фенил)-3-метил-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
52) N-(3-(2-(4-фторфенил)пропан-2-ил)фенил)-3-метил-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
53) N-(3-бром-5-(3-(4-фторфенил)пентан-3-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
54) N-(3-метокси-5-(3-(3-метокси-5-(трифторметокси)фенил)пентан-3-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
55) N-(3-метокси-5-(3-(3-метокси-5-(трифторметокси)фенил)пентан-3-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
56) N-(3-бром-5-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)тиено[2,3-b]пиридин-2-карбоксамид;
57) N-(3-хлор-5-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)тиено[2,3-b]пиридин-2-карбоксамид;
58) N-(3-хлор-5-(2-(3-этокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
59) N-(3-хлор-5-(2-(3-этокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
60) N-(3-бром-5-(2-(3-этокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)тиено[3,2-b]пиридин-2-карбоксамид;
61) N-(3-бром-5-(2-(3-этокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)тиено[2,3-c]пиридин-2-карбоксамид;
62) N-(3-хлор-5-(2-(2-фтор-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
63) N-(3-фтор-5-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
64) N-(3-хлор-5-(2-фенилпропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
65) N-(3-хлор-5-(2-(3-фторфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
66) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)-4-морфолинобензо[b]тиофен-2-карбоксамид;
67) N-(3-хлор-5-(2-(3-фтор-5-метоксифенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
68) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
69) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)тиено[2,3-b]пиридин-2-карбоксамид;
70) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)тиено[3,2-b]пиридин-2-карбоксамид;
71) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)тиено[2,3-c]пиридин-2-карбоксамид;
72) N-(3-хлор-5-(2-(3-изобутокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
73) N-(3-хлор-5-(2-(3-пропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
74) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)имидазо[1,2-a]пиридин-2-карбоксамид;
75) N-(3-(2-(3-(бут-2-ин-1-илокси)-5-(трифторметокси)фенил)пропан-2-ил)-5-хлорфенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
76) N-(3-хлор-5-(2-(3-(оксетан-3-илокси)-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
77) N-(3-хлор-5-(2-(3-(цианометокси)-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
78) N-(3-(2-(3-(аллилокси)-5-(трифторметокси)фенил)пропан-2-ил)-5-хлорфенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
79) N-(3-хлор-5-(2-(3-циклопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
80) N-(3-хлор-5-(2-(3-(1,1,2,2-тетрафторэтокси)-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
81) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[d]тиазол-2-карбоксамид;
82) N-(3-фтор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
83) N-(3-хлор-5-(2-(3-(2,2-дифторэтокси)-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
84) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-фтор-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
85) N-(3-фтор-5-(2-(3-(1,1,2,2-тетрафторэтокси)-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
86) N-(3-фтор-5-(2-(3-(1,1,2,2-тетрафторэтокси)-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)тиено[2,3-c]пиридин-2-карбоксамид;
87) N-(3-бром-5-(2-(3-(1,1,2,2-тетрафторэтокси)-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
88) N-(3-хлор-5-(2-(3-(2,2,2-трифторэтокси)-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
89) N-(3-бром-5-(2-(3-(1,1,2,2-тетрафторэтокси)-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)тиено[2,3-c]пиридин-2-карбоксамид;
90) N-(3-хлор-5-(2-(3-(2-морфолиноэтокси)-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
91) N-(3-(2-(3-бром-5-изопропоксифенил)пропан-2-ил)-5-хлорфенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
92) N-(3-хлор-5-(2-(3-хлор-5-изопропоксифенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
93) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-4-фтор-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
94) N-(3-хлор-5-(2-(3-(2-(диметиламино)этокси)-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
95) трет-бутил-4-(3-(2-(3-хлор-5-(5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамидо)фенил)пропан-2-ил)-5-(трифторметокси)фенокси)пиперидин-1-карбоксилат;
96) N-(3-хлор-5-(2-(3-(пиперидин-4-илокси)-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
97) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонил)-4,5,6,7-тетрагидротиено[3,2-c]пиридин-2-карбоксамид;
98) N-(3-бром-5-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-пирролo[3,2-c]пиридин-2-карбоксамид;
99) N-(3-бром-5-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)-1H-пирролo[2,3-c]пиридин-2-карбоксамид 2,2,2-трифторацетат;
100) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-пирролo[2,3-b]пиридин-2-карбоксамид;
101) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-пирролo[3,2-c]пиридин-2-карбоксамид;
102) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-4-(метилсульфонамидо)тиофен-2-карбоксамид;
103) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(морфолин-4-сульфонамидо)бензо[b]тиофен-2-карбоксамид;
104) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)-4,5,6,7-тетрагидротиено[3,2-c]пиридин-2-карбоксамид;
105) 6-хлор-N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
106) N-(3-хлор-5-(2-(3-метоксифенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
107) N-(3-этинил-5-(2-(4-фторфенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
108) N-(3-этинил-5-(2-(4-фторфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
109) N-(3-(2-(2,4-дифторфенил)пропан-2-ил)-5-этинилфенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
110) 3-хлор-N-(3-(2-(4-фторфенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
111) 3-хлор-N-(2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
112) N-(2',4'-дифтор-[1,1'-бифенил]-3-ил)-7-метокси-5-(метилсульфонамидо)бензофуран-2-карбоксамид;
113) N-(3-(2-(4-фторфенил)пропан-2-ил)фенил)-7-метокси-5-(метилсульфонамидо)бензофуран-2-карбоксамид;
114) N-(3-хлор-5-(2-(3-(проп-1-ин-1-ил)-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
115) N-(3-бром-5-(2-(3-((4-метилпиперазин-1-ил)метил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
116) трет-бутил-4-(3-(2-(3-бром-5-(5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамидо)фенил)пропан-2-ил)бензил)пиперазин-1-карбоксилат;
117) трет-бутил-4-(3-(2-(3-бром-5-(6-(метилсульфонамидо)-1H-индол-2-карбоксамидо)фенил)пропан-2-ил)бензил)пиперазин-1-карбоксилат;
118) N-(3-бром-5-(2-(3-(пиперазин-1-илметил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
119) N-(3-бром-5-(2-(3-(пиперазин-1-илметил)фенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
120) N-(3-(2-(3-((1H-имидазол-1-ил)метил)фенил)пропан-2-ил)-5-бромфенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
121) N-(3-хлор-5-(2-(3-((2-гидроксиазетидин-1-ил)метил)-5-изопропоксифенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
122) N-(3-бром-5-(2-(3-изопропокси-5-(морфолинометил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
123) трет-бутил-4-(3-(2-(3-бром-5-(5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамидо)фенил)пропан-2-ил)-5-изопропоксибензил)пиперазин-1-карбоксилат;
124) N-(3-бром-5-(2-(3-изопропокси-5-(пиперазин-1-илметил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
125) N-(3-хлор-5-(2-(3-изопропокси-5-(пирролидин-1-илметил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
126) N-(3-хлор-5-(2-(3-изопропокси-5-(морфолинометил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
127) N-(3-хлор-5-(2-(3-изопропокси-5-((4-пивалоилпиперазин-1-ил)метил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
128) N-(3-хлор-5-(2-(3-изопропокси-5-((4-(метилсульфонил)пиперазин-1-ил)метил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
129) N-(3-хлор-5-(2-(3-изопропокси-5-((4-(5-изопропил-1,2,4-оксадиазол-3-ил)пиперазин-1-ил)метил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
130) N-(3-хлор-5-(2-(3-изопропокси-5-((4-(оксетан-3-ил)пиперазин-1-ил)метил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
131) N-(3-хлор-5-(2-(3-((4-(N,N-диметилсульфамоил)пиперазин-1-ил)метил)-5-изопропоксифенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
132) N-(3-хлор-5-(2-(3-((1,1-диоксидотиоморфолино)метил)-5-изопропоксифенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
133) 4-(3-(2-(3-хлор-5-(5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамидо)фенил)пропан-2-ил)-5-изопропоксибензил)-N,N-диметилпиперазин-1-карбоксамид;
134) N-(3-(2-(3-((2-окса-7-азаспиро[3,5]нонан-7-ил)метил)-5-изопропоксифенил)пропан-2-ил)-5-хлорфенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
135) N-(3-хлор-5-(2-(3-изопропокси-5-((4-(5-изопропил-1,3,4-оксадиазол-2-ил)пиперазин-1-ил)метил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
136) N-(3-фтор-5-(2-(3-изопропокси-5-((4-(5-изопропил-1,2,4-оксадиазол-3-ил)пиперазин-1-ил)метил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
137) N-(3-фтор-5-(2-(3-изопропокси-5-(морфолинометил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
138) N-(3-хлор-5-(2-(3-((1-метил-1H-пиразол-4-ил)метил)-5-(1,1,2,2-тетрафторэтокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
139) N-(3-бром-5-(2-(3-((4-(N,N-диметилсульфамоил)пиперазин-1-ил)метил)-5-(1,1,2,2-тетрафторэтокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
140) N-(3-фтор-5-(2-(3-(морфолинометил)-5-(1,1,2,2-тетрафторэтокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
141) N-(3-бром-5-(2-(3-((4-(оксетан-3-ил)пиперазин-1-ил)метил)-5-(1,1,2,2-тетрафторэтокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
142) N-(3-хлор-5-(2-(3-изопропокси-5-(1-метил-1H-пиразол-5-ил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
143) N-(3-хлор-5-(2-(3-изопропокси-5-(1-метил-1H-пиразол-4-ил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
144) N-(3-хлор-5-(2-(3-(3-гидрокси-4-метилпиперазин-1-ил)-5-изопропоксифенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
145) N-(3-хлор-5-(2-(3-изопропокси-5-морфолинофенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
146) N-(3-хлор-5-(2-(3-изопропокси-5-(пирролидин-1-ил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
147) N-(3-хлор-5-(2-(3-изопропокси-5-(4-метилпиперазин-1-ил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
148) N-(6-хлор-4-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин-2-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
149) N-(2-хлор-6-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин-4-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
150) N-(4-хлор-6-(2-(3-метокси-5-(трифторметокси)фенил)пропан-2-ил)пиридин-2-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
151) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-2-(метилсульфонамидо)тиено[2,3-b]пиразин-6-карбоксамид;
152) N-(3-(2-(4-бромфенил)пропан-2-ил)-5-хлорфенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
153) N-(3-хлор-5-(2-(3,4-диметоксифенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
154) N-(3-хлор-5-(2-(2,4-диметоксифенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
155) N-(3-хлор-5-(2-(4-метоксифенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
156) N-(3-хлор-5-(2-(2,5-диметоксифенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
157) N-(3-хлор-5-(2-(4-(метилтио)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
158) N-(3-хлор-5-(2-(4-хлорфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
159) N-(3-хлор-5-(2-(4-(1-метил-1H-пиразол-5-ил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
160) N-(3-хлор-5-(2-(4-(метилсульфинил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
161) N-(3-хлор-5-(2-(4-(метилсульфонил)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
162) N-(3-хлор-5-(2-(3,4-дифторфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
163) N-(3-хлор-5-(2-(4-хлорфенил)пропан-2-ил)фенил)-6-фтор-5-(N-метилметилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
164) N-(3-хлор-5-(2-(пиперидин-1-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
165) 6-хлор-N-(3-хлор-5-(2-(пиперидин-1-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
166) N-(3-(2-(1H-пиррол-2-ил)пропан-2-ил)-5-хлорфенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
167) N-(3-(2-(1H-пиррол-3-ил)пропан-2-ил)-5-хлорфенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
168) N-(3-хлор-5-(2-(1-метил-1H-пиррол-3-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
169) N-(3-хлор-5-(2-(1-метил-1H-пиррол-2-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
170) N-(3-хлор-5-(2-(тиофен-2-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
171) N-(3-хлор-5-(2-(тиофен-3-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
172) 6-хлор-N-(3-хлор-5-(2-(4-хлорфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
173) 6-бром-N-(3-хлор-5-(2-(4-хлорфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
174) N-(3-хлор-5-(2-(5-хлортиофен-2-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
175) 6-хлор-N-(3-хлор-5-(2-(5-хлортиофен-2-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
176) N-(3-хлор-5-(2-(2-метокситиофен-3-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
177) N-(3-хлор-5-(2-(5-метокситиофен-2-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
178) N-(3-хлор-5-(2-(5-метилтиофен-2-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
179) 6-хлор-N-(3-хлор-5-(2-(5-метилтиофен-2-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
180) 6-хлор-N-(3-хлор-5-(2-(5-изопропилтиофен-2-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
181) 6-хлор-N-(3-хлор-5-(2-(4-метилтиофен-2-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
182) 6-хлор-N-(3-хлор-5-(2-(4-фторфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
183) 6-хлор-N-(3-хлор-5-(2-(4-метоксифенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
184) 5-хлор-N-(3-хлор-5-(2-(4-хлорфенил)пропан-2-ил)фенил)-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
185) 6-хлор-N-(3-хлор-5-(2-(4-хлорфенил)пропан-2-ил)фенил)-5-((2-метоксиэтил)сульфонамидо)бензо[b]тиофен-2-карбоксамид;
186) 6-хлор-N-(3-хлор-5-(2-(5-цианотиофен-2-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
187) N-(3-хлор-5-(2-(1-этил-1H-пиррол-2-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
188) 6-хлор-N-(3-хлор-5-(2-(4-хлорфенил)пропан-2-ил)фенил)-5-((2-гидроксиэтил)сульфонамидо)бензо[b]тиофен-2-карбоксамид;
189) N-(3-хлор-5-(2-(пиримидин-2-илокси)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
190) N-(3-хлор-5-(2-(6-оксопиридазин-1(6H)-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
191) N-(3-хлор-5-(2-(пиридин-4-ил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
192) 2-((3-бром-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)карбамоил)бензо[b]тиофен-5-ил дигидрофосфат;
193) 2-((3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)карбамоил)бензо[b]тиофен-5-ил дигидрофосфат;
194) трет-бутил (2-((3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)карбамоил)бензо[b]тиофен-5-ил)карбамат;
195) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-((2-метоксиэтил)сульфонамидо)бензо[b]тиофен-2-карбоксамид;
196) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(((тетрагидрофуран-3-ил)метил)сульфонамидо)бензо[b]тиофен-2-карбоксамид;
197) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(((тетрагидрофуран-2-ил)метил)сульфонамидо)бензо[b]тиофен-2-карбоксамид;
198) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(((тетрагидро-2H-пиран-4-ил)метил)сульфонамидо)бензо[b]тиофен-2-карбоксамид;
199) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-((3,5-диметилизоксазол)-4-сульфонамидо)бензо[b]тиофен-2-карбоксамид;
200) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-((1-метил-1H-пиразол)-3-сульфонамидо)бензо[b]тиофен-2-карбоксамид;
201) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-((1-метил-1H-пиразол)-4-сульфонамидо)бензо[b]тиофен-2-карбоксамид;
202) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(этилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
203) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-((1-метилэтил)сульфонамидо)бензо[b]тиофен-2-карбоксамид;
204) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-((тетрагидрофуран)-3-сульфонамидо)бензо[b]тиофен-2-карбоксамид;
205) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-((1,1-диоксидотетрагидро-2H-тиопиран)-4-сульфонамидо)бензо[b]тиофен-2-карбоксамид;
206) 5-((1-ацетилпиперидин)-4-сульфонамидо)-N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)бензо[b]тиофен-2-карбоксамид;
207) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(винилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
208) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-((2-(диметиламино)этил)сульфонамидо)бензо[b]тиофен-2-карбоксамид;
209) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-((2-морфолиноэтил)сульфонамидо)бензо[b]тиофен-2-карбоксамид;
210) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-((2-(гидрокси(метил)амино)этил)сульфонамидо)бензо[b]тиофен-2-карбоксамид;
211) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(1,1-диоксидо-1,2-тиазинан-2-ил)бензо[b]тиофен-2-карбоксамид;
212) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(1,1-диоксидоизотиазолидин-2-ил)бензо[b]тиофен-2-карбоксамид;
213) N-(3-йод-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
214) 3-йод-N-(3-йод-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
215) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-фтор-5-(N-метилметилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
216) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-фтор-N-метил-5-(N-метилметилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
217) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-фтор-5-(N-(2-морфолиноэтил)метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
218) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-фтор-N-(2-морфолиноэтил)-5-(N-(2-морфолиноэтил)метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
219) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(N-(2-(диметиламино)этил)метилсульфонамидо)-6-фторбензо[b]тиофен-2-карбоксамид;
220) N-(3-хлор-5-(4-хлорфенокси)фенил)-5-(N-метилметилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
221) N-(3-хлор-5-(2-(4-хлорфенил)пропан-2-ил)фенил)-5-(N-метилметилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
222) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид 1,1-диоксид;
223) N-(3-хлор-5-(2-(3-изопропокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид 1-оксид;
224) N-(3-(2-(3-цианофенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
225) N-(2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-нитро-1H-индол-2-карбоксамид;
226) 6-нитро-N-(2'-(трифторметил)-[1,1'-бифенил]-3-ил)-1H-индол-2-карбоксамид;
227) 5-нитро-N-(2'-(трифторметил)-[1,1'-бифенил]-3-ил)-1H-индол-2-карбоксамид;
228) 3-метил-5-нитро-N-(2'-(трифторметил)-[1,1'-бифенил]-3-ил)-1H-индол-2-карбоксамид;
229) N-(4'-фтор-2'-(трифторметил)-[1,1'-бифенил]-3-ил)-6-нитроиндолин-2-карбоксамид;
230) 6-нитро-N-(2'-(трифторметил)-[1,1'-бифенил]-3-ил)индолин-2-карбоксамид;
231) N-(2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-нитроиндолин-2-карбоксамид;
232) 6-нитро-N-(2'-(трифторметил)-[1,1'-бифенил]-3-ил)бензо[d]тиазол-2-карбоксамид;
233) N-(2',4'-дифтор-[1,1'-бифенил]-3-ил)-5-нитро-1H-бензо[d]имидазол-2-карбоксамид;
234) 5-нитро-N-(2'-(трифторметил)-[1,1'-бифенил]-3-ил)-1H-бензо[d]имидазол-2-карбоксамид;
235) N-(4'-фтор-2'-(трифторметил)-[1,1'-бифенил]-3-ил)-5-нитро-1H-бензо[d]имидазол-2-карбоксамид;
236) N-(2',4'-дифтор-[1,1'-бифенил]-3-ил)-5-метокси-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
237) N-(2',4'-дифтор-[1,1'-бифенил]-3-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
238) N-(2',4'-дифтор-[1,1'-бифенил]-3-ил)-5-(метилсульфонамидо)бензофуран-2-карбоксамид;
239) N-(2',4'-дифтор-[1,1'-бифенил]-3-ил)-5-(трифторметокси)-1H-индол-2-карбоксамид;
240) N-(2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-(метилсульфонил)-1H-индол-2-карбоксамид;
241) N-(2',4'-дифтор-[1,1'-бифенил]-3-ил)-3-метил-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
242) N-(2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
243) N-(2',4'-дифтор-[1,1'-бифенил]-3-ил)-3-метил-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
244) N-(4'-фтор-2'-(трифторметил)-[1,1'-бифенил]-3-ил)-6-нитро-1H-индол-2-карбоксамид;
245) N-(5-ацетил-2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
246) N-(4-(2,4-дифторфенил)-1H-индазол-6-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
247) N-(2',4'-дифтор-[1,1'-бифенил]-3-ил)-1-метил-6-нитро-1H-индол-2-карбоксамид;
248) N-(2',4'-дифтор-[1,1'-бифенил]-3-ил)-1-метил-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
249) 1-метил-6-нитро-N-(2'-(трифторметил)-[1,1'-бифенил]-3-ил)-1H-индол-2-карбоксамид;
250) 1-метил-5-нитро-N-(2'-(трифторметил)-[1,1'-бифенил]-3-ил)-1H-индол-2-карбоксамид;
251) 3-метил-1-(2-морфолиноэтил)-5-нитро-N-(2'-(трифторметил)-[1,1'-бифенил]-3-ил)-1H-индол-2-карбоксамид;
252) 1-(2-морфолиноэтил)-6-нитро-N-(2'-(трифторметил)-[1,1'-бифенил]-3-ил)-1H-индол-2-карбоксамид;
253) 1-метил-6-(метилсульфонамидо)-N-(2'-(трифторметил)-[1,1'-бифенил]-3-ил)-1H-индол-2-карбоксамид;
254) 2-((2-((2',4'-дифтор-[1,1'-бифенил]-3-ил)карбамоил)-1H-индол-6-ил)окси)-2-метилпропановая кислота;
255) этил 2-((2-((2',4'-дифтор-[1,1'-бифенил]-3-ил)карбамоил)-1H-индол-6-ил)окси)ацетат;
256) 2-((2-((2',4'-дифтор-[1,1'-бифенил]-3-ил)карбамоил)-1H-индол-6-ил)окси)уксусная кислота;
257) N-(2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-((N-метилсульфамоил)амино)-1H-индол-2-карбоксамид;
258) 5-амино-N-(2'-(трифторметил)-[1,1'-бифенил]-3-ил)-1H-индол-2-карбоксамид;
259) 5-(метилсульфонамидо)-N-(2'-(трифторметил)-[1,1'-бифенил]-3-ил)-1H-индол-2-карбоксамид;
260) 6-(метилсульфонамидо)-N-(2'-(трифторметил)-[1,1'-бифенил]-3-ил)-1H-индол-2-карбоксамид;
261) N-(2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)индолин-2-карбоксамид;
262) N-(4'-фтор-2'-(трифторметил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)индолин-2-карбоксамид;
263) трет-бутил 6-нитро-2-((2'-(трифторметил)-[1,1'-бифенил]-3-ил)карбамоил)-1H-индол-1-карбоксилат;
264) 6-(2,2,2-трифторэтилсульфонамидо)-N-(2'-(трифторметил)-[1,1'-бифенил]-3-ил)-1H-индол-2-карбоксамид;
265) 6-(сульфамоиламино)-N-(2'-(трифторметил)-[1,1'-бифенил]-3-ил)-1H-индол-2-карбоксамид;
266) 6-(метилсульфонамидо)-N-(2'-(трифторметил)-[1,1'-бифенил]-3-ил)-1H-индол-3-карбоксамид;
267) 6-((N,N-диметилсульфамоил)амино)-N-(2'-(трифторметил)-[1,1'-бифенил]-3-ил)-1H-индол-2-карбоксамид;
268) N-(2'-(трифторметил)-[1,1'-бифенил]-3-ил)-6-(трифторметилсульфонамидо)-1H-индол-2-карбоксамид;
269) 6-((N-метилсульфамоил)амино)-N-(2'-(трифторметил)-[1,1'-бифенил]-3-ил)-1H-индол-2-карбоксамид;
270) N-(2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
271) 6-амино-N-(2',4'-дифтор-[1,1'-бифенил]-3-ил)-1H-индол-2-карбоксамид;
272) N-(2',4'-дифтор-[1,1'-бифенил]-3-ил)-5-(метилсульфонамидо)-1H-индол-2-карбоксамид;
273) N-(2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-(2,2,2-трифторэтилсульфонамидо)-1H-индол-2-карбоксамид;
274) N-(2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-(сульфамоиламино)-1H-индол-2-карбоксамид;
275) N-(2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-3-карбоксамид;
276) N-(2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-((N,N-диметилсульфамоил)амино)-1H-индол-2-карбоксамид;
277) N-(4'-фтор-2'-(трифторметил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
278) 6-(циклопропансульфонамидо)-N-(4-(2,4-дифторфенил)пиридин-2-ил)-1H-индол-2-карбоксамид;
279) N-(4-(2,4-дифторфенил)пиридин-2-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
280) N-(2',4'-дифтор-[1,1'-бифенил]-3-ил)-N-метил-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
281) N-(5'-метокси-2'-(трифторметил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
282) N-(5'-метокси-2'-(трифторметил)-[1,1'-бифенил]-3-ил)-6-нитро-1H-индол-2-карбоксамид;
283) 6-(метилсульфонамидо)-N-(4'-сульфамоил-2'-(трифторметил)-[1,1'-бифенил]-3-ил)-1H-индол-2-карбоксамид;
284) N-(4'-циано-2'-(трифторметил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
285) 6-(метилсульфонамидо)-N-(4'-нитро-2'-(трифторметил)-[1,1'-бифенил]-3-ил)-1H-индол-2-карбоксамид;
286) метил-3'-(6-нитро-1H-индол-2-карбоксамидо)-6-(трифторметил)-[1,1'-бифенил]-3-карбоксилат;
287) метил-3'-(6-(метилсульфонамидо)-1H-индол-2-карбоксамидо)-6-(трифторметил)-[1,1'-бифенил]-3-карбоксилат;
288) метил-4-метокси-3'-(6-нитро-1H-индол-2-карбоксамидо)-6-(трифторметил)-[1,1'-бифенил]-3-карбоксилат;
289) метил-4-метокси-3'-(6-(метилсульфонамидо)-1H-индол-2-карбоксамидо)-6-(трифторметил)-[1,1'-бифенил]-3-карбоксилат;
290) 6-(метилсульфонамидо)-N-(3-(3-(трифторметил)пиридин-2-ил)фенил)-1H-индол-2-карбоксамид;
291) 6-(метилсульфонамидо)-N-(3-(4-(трифторметил)пиридин-3-ил)фенил)-1H-индол-2-карбоксамид;
292) 6-нитро-N-(3-(2-(трифторметил)пиридин-3-ил)фенил)-1H-индол-2-карбоксамид;
293) 6-(метилсульфонамидо)-N-(3-(2-(трифторметил)пиридин-3-ил)фенил)-1H-индол-2-карбоксамид;
294) N-(3-(6-хлор-4-(трифторметил)пиридин-3-ил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
295) N-(2'-фтор-4'-метокси-[1,1'-бифенил]-3-ил)-6-нитро-1H-индол-2-карбоксамид;
296) трет-бутил-2-((2'-фтор-4'-метокси-[1,1'-бифенил]-3-ил)карбамоил)-6-(метилсульфонамидо)-1H-индол-1-карбоксилат;
297) N-(4-(2-фтор-5-метоксифенил)пиридин-2-ил)-6-нитро-1H-индол-2-карбоксамид;
298) метил-6-хлор-3'-(6-нитро-1H-индол-2-карбоксамидо)-[1,1'-бифенил]-3-карбоксилат;
299) метил-6-хлор-3'-(6-(метилсульфонамидо)-1H-индол-2-карбоксамидо)-[1,1'-бифенил]-3-карбоксилат;
300) метил-4-хлор-3-(2-(6-(метилсульфонамидо)-1H-индол-2-карбоксамидо)пиридин-4-ил)бензоат;
301) N-(5-циано-2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
302) N-(5-бром-2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
303) N-(5-бром-2',4'-дифтор-[1,1'-бифенил]-3-ил)-5-метокси-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
304) N-(5-бром-2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-(метилсульфонил)-1H-индол-2-карбоксамид;
305) N-(5-бром-2',4'-дифтор-[1,1'-бифенил]-3-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
306) N-(5-бром-2',4'-дифтор-[1,1'-бифенил]-3-ил)-5-(метилсульфонамидо)бензофуран-2-карбоксамид;
307) N-(5-бром-2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-((N-метилсульфамоил)амино)-1H-индол-2-карбоксамид;
308) N-(5-бром-2',4'-дифтор-[1,1'-бифенил]-3-ил)-5-(трифторметокси)-1H-индол-2-карбоксамид;
309) N-(5-бром-2',4'-дифтор-[1,1'-бифенил]-3-ил)-3-метил-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
310) N-(5-бром-2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
311) N-(5-бром-2',4'-дифтор-[1,1'-бифенил]-3-ил)-3-метил-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
312) 6-(метилсульфонамидо)-N-(2',4',5-трифтор-[1,1'-бифенил]-3-ил)-1H-индол-2-карбоксамид;
313) N-(2',4'-дифтор-5-(трифторметил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
314) N-(2',4'-дифтор-5-метокси-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
315) N-(5-циано-4'-фтор-2'-(трифторметил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
316) N-(2',4'-дифтор-5-метокси-[1,1'-бифенил]-3-ил)-3-метил-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
317) N-(2',4'-дифтор-5-метокси-[1,1'-бифенил]-3-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
318) N-(2',4'-дифтор-5-(метилкарбамоил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
319) N-(5-(диметилкарбамоил)-2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
320) N-(2',4'-дифтор-5-(пиперидин-1-карбонил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
321) N-(2',4'-дифтор-5-(морфолин-4-карбонил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
322) N-(5-хлор-2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-фтор-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
323) N-(5-хлор-2',4'-дифтор-[1,1'-бифенил]-3-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
324) N-(5-хлор-3'-метокси-5'-(трифторметокси)-[1,1'-бифенил]-3-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
325) N-(5-хлор-3'-метокси-5'-(трифторметокси)-[1,1'-бифенил]-3-ил)-6-фтор-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
326) N-(5-хлор-3'-метокси-5'-(трифторметокси)-[1,1'-бифенил]-3-ил)-6-фтор-5-(N-метилметилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
327) N-(5-хлор-2',4'-дифтор-[1,1'-бифенил]-3-ил)-5-((тетрагидрофуран)-3-сульфонамидо)бензо[b]тиофен-2-карбоксамид;
328) N-(5-хлор-3'-метокси-5'-(трифторметокси)-[1,1'-бифенил]-3-ил)-5-((тетрагидрофуран)-3-сульфонамидо)бензо[b]тиофен-2-карбоксамид;
329) N-(5-хлор-2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-фтор-5-(N-метилметилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
330) N-(5-хлор-2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-фтор-5-((тетрагидрофуран)-3-сульфонамидо)бензо[b]тиофен-2-карбоксамид;
331) N-(4-хлор-6-(2,4-дифторфенил)пиридин-2-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
332) N-(3-хлор-5-(тиофен-3-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
333) 6-хлор-N-(5-хлор-2',4'-дифтор-[1,1'-бифенил]-3-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
334) N-(3-хлор-5-(1-метил-1H-пиррол-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
335) N-(5-хлор-2',4'-дифтор-[1,1'-бифенил]-3-ил)-3-гидрокси-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
336) N-(3-хлор-5-(тиофен-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
337) N-(6-хлор-4-(2,4-дифторфенил)пиридин-2-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
338) N-(3-хлор-5-(пиразин-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
339) N-(3-хлор-5-(6-хлорпиразин-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
340) N-(3-хлор-5-(1-метил-1H-имидазол-5-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
341) N-(5-бром-2',4'-дифтор-[1,1'-бифенил]-3-ил)-1-метил-6-(N-метилметилсульфонамидо)-1H-индол-2-карбоксамид;
342) N-(5-бром-2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-(N-метилметилсульфонамидо)-1H-индол-2-карбоксамид;
343) 1-метил-6-(N-метилметилсульфонамидо)-N-(2'-(трифторметил)-[1,1'-бифенил]-3-ил)-1H-индол-2-карбоксамид;
344) N-(2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-(N-метилметилсульфонамидо)-1H-индол-2-карбоксамид;
345) N-(2',4'-дифтор-[1,1'-бифенил]-3-ил)-1-метил-6-(N-метилметилсульфонамидо)-1H-индол-2-карбоксамид;
346) 6-(N-метилметилсульфонамидо)-N-(2'-(трифторметил)-[1,1'-бифенил]-3-ил)-1H-индол-2-карбоксамид;
347) N-(2',4'-дифтор-5-метокси-[1,1'-бифенил]-3-ил)-6-(N-метилметилсульфонамидо)-1H-индол-2-карбоксамид;
348) N-(2',4'-дифтор-5-метокси-[1,1'-бифенил]-3-ил)-1-метил-6-(N-метилметилсульфонамидо)-1H-индол-2-карбоксамид;
349) N-(2',4'-дифтор-5-(6-фторпиридин-3-ил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
350) трет-бутил-2-(2',4'-дифтор-5-(6-(метилсульфонамидо)-1H-индол-2-карбоксамидо)-[1,1'-бифенил]-3-ил)-1H-пиррол-1-карбоксилат;
351) N-(2',4'-дифтор-5-(1H-пиразол-3-ил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
352) N-(2',4'-дифтор-5-(1H-пиррол-2-ил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
353) N-(2',4'-дифтор-5-(1-метил-1H-пиррол-2-ил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
354) N-(2',4'-дифтор-5-(тиофен-2-ил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
355) N-(2',4'-дифтор-5-(тиофен-3-ил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
356) N-(2',4'-дифтор-5-(пиридин-4-ил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
357) N-(2',4'-дифтор-5-(пиридин-3-ил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
358) N-(2',4'-дифтор-5-(6-(трифторметил)пиридин-3-ил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
359) N-(5-(6-цианопиридин-3-ил)-2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
360) N-(2',4'-дифтор-5-(пиримидин-5-ил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
361) N-(5-(2-аминопиримидин-5-ил)-2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
362) 6-(метилсульфонамидо)-N-(2,2'',4,4''-тетрафтор-[1,1':3',1''-терфенил]-5'-ил)-1H-индол-2-карбоксамид;
363) N-(5-(цианометил)-2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
364) N-(2',4'-дифтор-5-(6-гидроксипиридин-3-ил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
365) N-(5-этинил-2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
366) N-(5-(2,2-дифторэтокси)-2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
367) N-(2',4'-дифтор-5-изобутокси-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
368) N-(5-(цианометокси)-2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
369) N-(5-(дифторметокси)-2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
370) N-(5-(дифторметокси)-2',4'-дифтор-[1,1'-бифенил]-3-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
371) N-(2',4'-дифтор-5-(пиперидин-1-ил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
372) N-(5-(диметиламино)-2',4'-дифтор-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
373) N-(2',4'-дифтор-5-(метиламино)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
374) N-(2',4'-дифтор-5-морфолино-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
375) N-(5-(диметиламино)-2',4'-дифтор-[1,1'-бифенил]-3-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
376) N-(5-(диметиламино)-2',4'-дифтор-[1,1'-бифенил]-3-ил)-5-(метилсульфонамидо)бензофуран-2-карбоксамид;
377) N-(5'-карбамоил-4'-метокси-2'-(трифторметил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
378) N-(5'-карбамоил-4'-гидрокси-2'-(трифторметил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
379) N-(5'-карбамоил-2'-(трифторметил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
380) N-(5'-карбамоил-2'-хлор-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
381) N-(4-(5-карбамоил-2-хлорфенил)пиридин-2-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
382) N-(2',4'-дифтор-5-(6-метоксипиридин-3-ил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
383) N-(2',4'-дифтор-5-(6-метоксипиридин-2-ил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
384) N-(2',4'-дифтор-5-(6-гидроксипиридин-2-ил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
385) N-(4'-амино-2'-(трифторметил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
386) N-(4'-(метиламино)-2'-(трифторметил)-[1,1'-бифенил]-3-ил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
387) N-(3-(дифтор(фенил)метил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
388) N-(3-(дифтор(пиридин-4-ил)метил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
389) N-(3-(дифтор(пиридин-2-ил)метил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
390) N-(3-((3-цианофенил)дифторметил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
391) N-(3-((3-цианофенил)дифторметил)-5-(2,2-дифторэтокси)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
392) N-(3-((3-цианофенил)дифторметил)-5-изобутоксифенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
393) N-(3-(цианометокси)-5-((3-цианофенил)дифторметил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
394) N-(3-((4-метоксифенил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
395) 6-(метилсульфонамидо)-N-(3-(фенилсульфонил)фенил)-1H-индол-2-карбоксамид;
396) 6-(метилсульфонамидо)-N-(3-((3-(трифторметокси)фенил)сульфонил)фенил)-1H-индол-2-карбоксамид;
397) N-(3-метокси-5-((3-(трифторметокси)фенил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
398) 6-(метилсульфонамидо)-N-(3-((3-(трифторметокси)фенил)сульфонил)-5-(трифторметил)фенил)-1H-индол-2-карбоксамид;
399) N-(3-циано-5-((3-(трифторметокси)фенил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
400) N-(3-изобутокси-5-((3-(трифторметокси)фенил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
401) N-(3-(2,2-дифторэтокси)-5-((3-(трифторметокси)фенил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
402) N-(3-((3-цианофенил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
403) 6-(метилсульфонамидо)-N-(3-(пиридин-2-илсульфонил)фенил)-1H-индол-2-карбоксамид;
404) 6-(метилсульфонамидо)-N-(3-(пиридин-3-илсульфонил)фенил)-1H-индол-2-карбоксамид;
405) N-(3-((3-хлорфенил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
406) N-(3-((6-цианопиридин-2-ил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
407) N-(3-((5-метоксипиридин-3-ил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
408) N-(3-((6-метоксипиридин-2-ил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
409) N-(3-(бензо[b]тиофен-5-илсульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
410) N-(3-((2-метилбензо[d]тиазол-6-ил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
411) N-(3-((3-циано-5-метоксифенил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
412) N-(3-((3-(цианометил)фенил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
413) 6-(метилсульфонамидо)-N-(3-((4-оксо-4H-хромен-7-ил)сульфонил)фенил)-1H-индол-2-карбоксамид;
414) N-(3-((3-бромфенил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
415) N-(3-((3-аминофенил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
416) N-(3-((3-этинилфенил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
417) N-(3-((3-циано-5-гидроксифенил)сульфонил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
418) N-(3-бром-5-((7-фтор-3,4-дигидроизохинолин-2(1H)-ил)сульфонил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
419) N-(3-бром-5-((5,7-дифтор-3,4-дигидроизохинолин-2(1H)-ил)сульфонил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
420) N-(3-бром-5-((4,4-дифторпиперидин-1-ил)сульфонил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
421) 5-(метилсульфонамидо)-N-(3-(1-фенилциклопропил)фенил)бензо[b]тиофен-2-карбоксамид;
422) 6-(метилсульфонамидо)-N-(3-(1-фенилциклопропил)фенил)-1H-индол-2-карбоксамид;
423) 5-(метилсульфонамидо)-N-(3-(1-фенилвинил)фенил)бензо[b]тиофен-2-карбоксамид;
424) N-(3-(1-(4-фторфенил)циклопропил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
425) N-(3-(1-(4-фторфенил)циклопропил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
426) N-(3-бром-5-(1-(2,4-дифторфенил)циклопропил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
427) N-(3-метокси-5-(1-(3-метокси-5-(трифторметокси)фенил)циклопропил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
428) N-(3-(дифторметокси)-5-(1-(4-фторфенил)циклопропил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
429) N-(3-(дифторметокси)-5-(1-(4-фторфенил)циклопропил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
430) N-(3-хлор-5-(1-(3-изопропокси-5-(трифторметокси)фенил)циклопропил)фенил)-6-фтор-5-(N-метилметилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
431) N-(3-хлор-5-(1-(3-изопропокси-5-(трифторметокси)фенил)циклопропил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
432) N-(3-хлор-5-(1-(4-хлорфенил)циклопропил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
433) 6-хлор-N-(3-хлор-5-(1-(4-хлорфенил)циклопропил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
434) N-(3-бензоилфенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
435) N-(3-(1-гидрокси-1-фенилэтил)фенил)-6-(метилсульфонамидо)-1H-индол-2-карбоксамид;
436) 6-(N-(2-амино-2-оксоэтил)метилсульфонамидо)-N-(3-(2-(3-гидрокси-5-(трифторметокси)фенил)пропан-2-ил)фенил)-1H-индол-2-карбоксамид;
437) N-(3-(2-(3-(2-амино-2-оксоэтокси)-5-(трифторметокси)фенил)пропан-2-ил)фенил)-6-(N-(2-амино-2-оксоэтил)метилсульфонамидо)-1H-индол-2-карбоксамид;
438) N-(3-хлор-5-((2,4-дифторфенил)амино)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
439) N-(3-хлор-5-((2,4-дифторфенил)(метил)амино)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
440) N-(3-хлор-5-((4-хлорфенил)(метил)амино)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
441) 6-хлор-N-(3-хлор-5-((4-хлорфенил)(метил)амино)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
442) 6-хлор-N-(3-хлор-5-((2,4-дифторфенил)(метил)амино)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
443) N-(3-хлор-5-((3-изопропокси-5-(трифторметокси)фенил)(метил)амино)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
444) N-(3-хлор-5-(2,4-дифторфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
445) N-(3-хлор-5-(4-хлорфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
446) N-(3-хлор-5-(4-фторфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
447) N-(3-хлор-5-(4-метоксифенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
448) N-(3-хлор-5-(2,5-дифторфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
449) 6-хлор-N-(3-хлор-5-(4-хлорфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
450) N-(3-хлор-5-(3-(трифторметокси)фенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
451) N-(3-хлор-5-(4-цианофенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
452) N-(3-хлор-5-(3-изопропокси-5-(трифторметокси)фенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
453) 6-бром-N-(3-хлор-5-(4-хлорфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
454) N-(3-хлор-5-(4-(трифторметокси)фенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
455) N-(3-хлор-5-(3-(трифторметил)фенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
456) N-(3-хлор-5-(3-хлорфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
457) N-(3-хлор-5-(3-метоксифенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
458) N-(3-хлор-5-(3-хлор-5-цианофенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
459) N-(3-хлор-5-(3-цианофенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
460) N-(3-хлор-5-(3,4-дифторфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
461) N-(3-хлор-5-(3-хлор-4-фторфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
462) N-(3-хлор-5-(2,4-дихлорфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
463) N-(3-хлор-5-(3,5-дифторфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
464) N-(3-хлор-5-(3,5-дихлорфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
465) N-(3-хлор-5-(4-(трифторметил)фенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
466) N-(3-хлор-5-(4-хлор-3-фторфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
467) N-(3-хлор-5-(3-хлор-5-(трифторметокси)фенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
468) N-(3-хлор-5-(4-хлор-3-(трифторметокси)фенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
469) N-(3-хлор-5-(3-хлор-5-фторфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
470) N-(3-хлор-5-(4-фтор-3-(трифторметокси)фенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
471) 6-хлор-N-(3-хлор-5-(тиазол-2-илокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
472) 6-хлор-N-(3-хлор-5-(тиазол-5-илокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
473) 6-хлор-N-(3-хлор-5-((5-хлортиофен-2-ил)окси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
474) 6-хлор-N-(3-хлор-5-(3-хлор-5-метоксифенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
475) 6-хлор-N-(3-хлор-5-(3-хлор-5-гидроксифенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
476) 6-хлор-N-(3-хлор-5-(3-хлор-4-фторфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
477) 6-хлор-N-(3-хлор-5-(4-хлор-3-фторфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
478) 6-хлор-N-(3-хлор-5-(4-фторфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
479) 6-хлор-N-(3-хлор-5-(3-(трифторметокси)фенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
480) 6-хлор-N-(3-хлор-5-(4-(трифторметокси)фенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
481) 6-хлор-N-(3-хлор-5-(3,4-дифторфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
482) 6-хлор-N-(3-хлор-5-(4-(трифторметил)фенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
483) 6-хлор-N-(3-хлор-5-(3-хлор-5-фторфенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
484) 6-хлор-N-(3-хлор-5-(3-фтор-5-метоксифенокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
485) 5-хлор-N-(3-хлор-5-(4-хлорфенокси)фенил)-6-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
486) 6-хлор-N-(3-хлор-5-(циклогексилокси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
487) 6-хлор-N-(3-хлор-5-((5-метилтиофен-2-ил)окси)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
488) 4-бром-N-(3-хлор-5-(2-(3-изопропокси-5-метилфенил)пропан-2-ил)фенил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
489) N-(2-хлор-6-(4-хлорфенокси)пиридин-4-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
490) 6-хлор-N-(2-хлор-6-(4-хлорфенокси)пиридин-4-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
491) N-(2-хлор-6-((6-хлорпиридин-3-ил)окси)пиридин-4-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
492) 6-хлор-N-(2-хлор-6-((6-хлорпиридин-3-ил)окси)пиридин-4-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
493) N-(2-хлор-6-((6-(трифторметил)пиридин-3-ил)окси)пиридин-4-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
494) 6-хлор-N-(2-хлор-6-((6-(трифторметил)пиридин-3-ил)окси)пиридин-4-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
495) N-(2-хлор-6-(4-(трифторметил)фенокси)пиридин-4-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
496) 6-хлор-N-(2-хлор-6-(4-(трифторметил)фенокси)пиридин-4-ил)-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид;
497) N-(3-хлор-5-(2-(4-хлорфенил)пропан-2-ил)фенил)-6-метокси-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид и
498) N-(3-хлор-5-(4-хлорфенокси)фенил)-6-метокси-5-(метилсульфонамидо)бензо[b]тиофен-2-карбоксамид.
13. Фармацевтическая композиция для профилактики или лечения заболевания, связанного с активацией белка STAT3, включающая эффективное количество соединения по любому из пп. 1-12, в качестве активного ингредиента, и фармацевтически приемлемый носитель.
14. Фармацевтическая композиция по п. 13, где заболевание, связанное с активацией белка STAT3, выбрано из группы, состоящей из солидных опухолей, гематологического рака или рака крови, радио- или хемо-резистентного рака, метастатического рака, воспалительных заболеваний, иммунологических заболеваний, диабета, дегенерации желтого пятна, инфекции папилломавируса человека и туберкулеза.
15. Фармацевтическая композиция по п. 13, где заболевание, связанное с активацией белка STAT3, выбрано из группы, состоящей из рака молочной железы, рака легкого, рака желудка, рака предстательной железы, рака матки, рака яичника, рака почки, рака поджелудочной железы, рака печени, рака толстой кишки, рака кожи, рака головы и шеи, рака щитовидной железы, остеосаркомы, острого или хронического лейкоза, множественной миеломы, B- или Т-клеточной лимфомы, неходжкинской лимфомы, аутоиммунных заболеваний, включающих ревматоидный артрит, псориаз, гепатит, воспалительное заболевание кишечника, болезнь Крона, диабет, дегенерацию желтого пятна, инфекцию папилломавируса человека и туберкулез.
16. Применение соединения по любому из пп. 1-12 для получения лекарственного средства для профилактики или лечения заболевания, связанного с активацией белка STAT3.
17. Способ профилактики или лечения заболевания, связанного с активацией белка STAT3, у млекопитающего, который включает введение млекопитающему соединения, определенного в любом из пп. 1-12.
| WO 2005085177 A2, 15.09.2005 | |||
| WO 2003006454 A2, 23.01.2003 | |||
| Christelle Doebelin et all., "Trisubstitution of pyridine through sequential and regioselective palladium cross-coupling reactions affording analogs of known GPR54 antagonists ", The Royal Society of Chemistry Adv., 2013, 3, 10296-10300, DOI: 10.1039/c3ra41985a | |||
| Lisa M | |||
| Eubanks, "An in vitro and in vivo disconnect uncovered through high-throughput identification of botulinum neurotoxin A antagonists ", PNAS, vol | |||
| Счетная таблица | 1919 |
|
SU104A1 |
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| WO 2003022806 A2, 20.03.2003 | |||
| RU 2012152354 A, 27.06.2014 | |||
| EA 201070618 A1, 30.12.2010. | |||
Авторы
Даты
2019-03-13—Публикация
2014-06-03—Подача