Настоящая заявка испрашивает приоритет по предварительной заявке на патент Австралии с номером AU 2016902883, поданной 22 июля 2016 г., содержание которой включено в данный документ посредством ссылки во всей своей полноте. Настоящая заявка также испрашивает приоритет по предварительной заявке на патент США с номером 62/483118, поданной 4 апреля 2017 г., содержание которой включено в данный документ посредством ссылки во всей своей полноте.
ЗАЯВЛЕНИЕ В ОТНОШЕНИИ ФИНАНСИРУЕМОГО ИЗ ФЕДЕРАЛЬНОГО БЮДЖЕТА ИССЛЕДОВАНИЯ
Настоящее изобретение, отчасти, было осуществлено при государственной поддержке в рамках GM 48677, присужденного Национальными институтами здравоохранения. Правительство имеет определенные права на настоящее изобретение.
ОБЛАСТЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Настоящее изобретение в целом относится к аналогам инсулина. Более конкретно, настоящее изобретение относится к аналогам инсулина короткого действия, содержащим укороченные В-цепи. Настоящее изобретение также относится к кристаллической структуре инсулина из яда улиток-конусов и к способам применения информации о кристаллической структуре и связанной с ней информации для скрининга и конструирования аналогов инсулина, которые взаимодействуют с инсулиновым рецептором или модулируют его.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Инсулин представляет собой полипептидный гормон, который играет центральную роль в регуляции метаболизма глюкозы, репродуктивной и когнитивной функций. Мономер человеческого инсулина состоит из двух полипептидных цепей, А- и В-цепей, которые ковалентно связаны двумя дисульфидными мостиками (CysA7-CysB7 и CysA19-B20). А-цепь состоит из 21 аминокислоты, а В-цепь состоит из 30 аминокислот. Третий дисульфидный мостик расположен в пределах А-цепи (CysA6-CysA11). В организме инсулин существует в виде мономеров, димеров и гексамеров. Гексамер состоит из трех димеров инсулина, удерживающихся вместе с помощью двух ионов цинка, расположенных в центре. Человеческий инсулин запасается в β-клетках поджелудочной железы в виде гексамера. Биологически активная форма, которая связывается с инсулиновым рецептором, является мономерной. Преобразование инсулина из гексамера в мономер имеет решающее значение для его биодоступности.
Нарушение регуляции инсулина связано с зачастую тяжелыми формами клинических проявлений, такими как сахарный диабет, гипергликемия, а также другие подобные состояния. Сахарный диабет (называемый диабетом) представляет собой группу нарушений, которая характеризуется высокими уровнями содержания сахара в крови в течение длительного периода времени. Диабет может возникать, если поджелудочная железа не вырабатывает достаточно инсулина или если организм не реагирует должным образом на инсулин. Введение инсулина или аналогов инсулина остается наиболее эффективным способом лечения состояний, таких как диабет. Лечение диабета зачастую предусматривает введение комбинации инсулина короткого действия, инсулина для введения до приема пищи, а также инсулина более длительного действия для поддержания базальных уровней гормона.
Аналоги инсулина короткого действия характеризуются быстрым проявлением активности. Как правило, они либо являются мономерными, либо быстро диссоциируют в мономерную форму при инъекции пораженному индивидууму. Эти аналоги инсулина отличаются по структуре от нормального человеческого инсулина наличием модификаций в С-концевой области В-цепи (остатки В26-В30), которые оказывают отрицательное воздействие в отношении мультимеризации инсулина. Однако дополнительное усечение В-цепи с С-конца с целью предотвращения самоассоциации привело к практически полной потере активности, предположительно из-за того, что PheB24 имеет критически важное значение для активности. Например, дезоктапептид[В23-В30]-инсулин (DOI), представляющий собой мономерный аналог, сохраняет менее чем 0,1% биологической активности (Bao at al., 1997). PheB24 находится непосредственно за β-изгибом типа 1, образованным остатками GlyB20-GluB21-ArgB22-GlyB23, в направлении С-конца, при этом в видах инсулина позвоночных как триплет PheB24-PheB25-TyrB26, так и β-изгиб типа 1 являются высококонсервативными.
Существует необходимость в новых аналогах инсулина и способах конструирования таких аналогов, которые являются мономерными, быстродействующими и сохраняют активность в отношении передачи сигнала с участием инсулинового рецептора человека.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения определяли характеристики нового идентифицированного инсулина Con-Ins G1 из яда Conus geographus и показали, что он является мономерным, но при этом связывается с инсулиновым рецептором человека и сохраняет активность в отношении передачи сигнала. Авторы настоящего изобретения дополнительно успешно получили кристаллы Con-Ins G1 и установили его трехмерную структуру с применением рентгеновской кристаллографии. Данные о структуре, представленные в данном документе, позволили впервые идентифицировать ключевые положения и взаимодействия аминокислот, которые обеспечивают возможность сохранения у Con-Ins G1 его активности, несмотря на отсутствие триплета ароматических аминокислот PheB24-PheB25-TyrB26 из человеческого инсулина.
В одном аспекте настоящее изобретение предусматривает аналог инсулина, содержащий пептид, представляющий собой А-цепь, и пептид, представляющий собой В-цепь, где В-цепь содержит ароматический или большой алифатический остаток в положении, соответствующем аминокислоте номер 20 в В-цепи человеческого инсулина, и/или ароматический или большой алифатический остаток в положении, соответствующем аминокислоте номер 15 в В-цепи человеческого инсулина, где аналог содержит по меньшей мере одну аминокислоту, которая встречается в человеческом инсулине, но отсутствует в соответствующем положении инсулина из яда Conus geographus, и где пептид, представляющий собой А-цепь, и пептид, представляющий собой В-цепь, связаны друг с другом посредством по меньшей мере одной пары цистеиновых остатков.
В некоторых вариантах осуществления ароматический остаток выбран из группы, состоящей из тирозина, фенилаланина, триптофана, гистидина и 4-метилфенилаланина. В некоторых вариантах осуществления большой алифатический остаток выбран из группы, состоящей из изолейцина, циклогексилаланина, циклопентилаланина и метионина. В некоторых вариантах осуществления ароматический или большой алифатический остаток в положении, соответствующем аминокислоте номер 20 в В-цепи человеческого инсулина, выбран из группы, состоящей из тирозина, фенилаланина, 4-метилфенилаланина, гистидина, триптофана, метионина, циклопентилаланина и циклогексилаланина. В некоторых вариантах осуществления ароматический или большой алифатический остаток в положении, соответствующем аминокислоте номер 15 в В-цепи человеческого инсулина, выбран из группы, состоящей из тирозина, фенилаланина, 4-метилфенилаланина, гистидина, триптофана, метионина, циклопентилаланина и циклогексилаланина.
В некоторых вариантах осуществления В-цепь усечена по С-терминальному концу по сравнению с человеческим инсулином. В некоторых вариантах осуществления в В-цепи отсутствуют одна или несколько или все из девяти С-концевых аминокислот человеческого инсулина. В некоторых вариантах осуществления в В-цепи отсутствует по меньшей мере PheB24 человеческого инсулина. В некоторых вариантах осуществления в В-цепи отсутствует по меньшей мере триплет ароматических аминокислот человеческой В-цепи (аминокислоты PheB24-PheB25-TyrB26 человеческого инсулина).
В некоторых вариантах осуществления аналог инсулина содержит пептид, представляющий собой А-цепь, содержащий последовательность
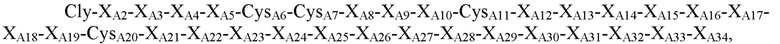
где XA2=Val или Ile; XA3=Val или Ala; XA4=Glu, Asp, Cys или гамма-карбоксиглутамат; XA5=Gln, Glu, гамма-карбоксиглутамат, His или Val; CysA6, CysA7 и CysA11 независимо представляют собой Cys или селеноцистеин; XA8=Thr, His, Asp, Gln, Tyr, Lys, Ala или Val; XA9=Ser, Arg, Asn, Gly, His или Lys; XA10=Ile, Pro, Tyr, Ala, Ser, Val, Phe, His или Thr; XA12=Ser или Thr; XA13=Leu, Asn, Val, Arg или Asp; XA14=Tyr, Ala, Gln, His, Asp или Glu; XA15=Gln, Glu или Thr; XA16=Phe, Leu или Ala; XA17=Glu, Gln, Lys, Arg, Ile, Met, Thr или Ser; XA18=Lys, Ser, Thr, Asn, Gln или Glu; XA19=Tyr или Phe; CysA20=Cys, селеноцистеин, амидированный Cys или амидированный селеноцистеин; XA21=Asn, Pro, His, Ser, Gly, Ala или отсутствует; XA22=Pro, Asn, Thr, Leu, Ser или отсутствует; XA23=Thr, Leu, Val, Ser или отсутствует; XA24=Arg, Thr, Met, Gln, Leu или отсутствует; XA25=Glu, Gly или отсутствует; XA26=Ser, Leu или отсутствует; XA27-XA31 независимо представляют собой Ser или отсутствуют; XA32=Ala, Ser или отсутствует; XA33=Ala, Val или отсутствует; и XA34=Ala или отсутствует (SEQ ID NO: 1); и пептид, представляющий собой В-цепь, содержащий последовательность
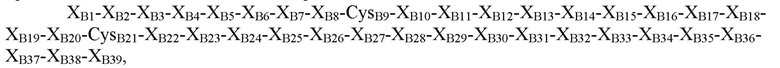
где XB1=Thr, Asn, Ser или отсутствует; XB2=Phe, Ser, Asn, Thr, Gln или отсутствует; XB3=Ala, Asp, Gly, Pro, Leu, Phe или His; XB4=Ala, Thr, Pro, Asp, Val или Gly; XB5=Asn, Pro, His, Thr, Arg, Lys, Ser или гидроксипролин; XB6=Lys, Glu, Asn, Asp, Arg, Gln или Gly; XB7=His, Tyr, Arg или Ile; XB8=Arg, Thr, Ile, Ser, Leu, Tyr или Lys; CysB9=Cys или селеноцистеин; XB10=Gly, Gln или Asp; XB11=Ser, Leu, Gly или Pro; XB12=His, Glu, гамма-карбоксиглутамат, Asp или Asn; XB13=Ile, Leu, Asp, Val или Ala; XB14=Thr, Ala, Pro, Val или Arg; XB15=Asn, Asp, Ala, Val, Thr, Pro или Glu; XB16=Ala, Ser, Gln, His, Thr, Tyr, Arg или Gly; XB17=Thr, Tyr, Pro, Leu или Gly; XB18=Tyr, Met, Val, Gln, Ile, Asp, Gly, Asn или Leu; XB19=Leu, Asp, Gln, Gly, Lys, Glu, Arg, Ser или Thr; XB20=Val, Leu или Lys; CB21=Cys, амидированный Cys, селеноцистеин или амидированный селеноцистеин; XB22=Val, Tyr, Phe, His, Gly, Gln, Leu, амидированный His, амидированный Val или отсутствует; XB23=Glu, Asp, Arg, Ser, Gly или отсутствует; XB24=Arg, Asp, Val или отсутствует; XB25=Gly, Leu, Val или отсутствует; XB26=Phe, Val, Ile или отсутствует; XB27=Phe, Asn, Pro, Glu или отсутствует; XB28=Tyr, Cys, His или отсутствует; XB29=Thr, His, Ile, Leu, Ser, Tyr или отсутствует; XB30=Pro, Glu, Leu, Ile, Arg или отсутствует; XB31=Ile, Lys или отсутствует; XB32=Ala, Asp, Ser, Thr, Lys, Leu, Gln или отсутствует; XB33=Cys или отсутствует; XB34=Glu, Pro, Val или отсутствует; XB35=Glu, Gly или отсутствует; XB36=Glu, Gly или отсутствует; XB37=Glu, Val или отсутствует; XB38=Ala, Asp или отсутствует; и XB39=Ala или отсутствует (SEQ ID NO: 2).
В некоторых вариантах осуществления пептид, представляющий собой В-цепь, содержит последовательность
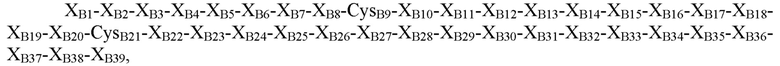
где XB1=Thr, Asn, Ser или отсутствует; XB2=Phe, Ser, Asn, Thr, Gln или отсутствует; XB3=Asp, Gly, Pro, Leu, Phe или His; XB4=Thr, Pro, Asp, Val или Gly; XB5=Asn, Pro, His, Thr, Arg, Ser или гидроксипролин; XB6=Lys, Glu, Asn, Asp, Arg, Gln или Gly; XB7=His, Tyr, Arg или Ile; XB8=Arg, Thr, Ile, Ser, Leu, Tyr или Lys; CysB9=Cys или селеноцистеин; XB10=Gly, Gln или Asp; XB11=Ser, Leu, Gly или Pro; XB12=His, Glu, гамма-карбоксиглутамат, Asp или Asn; XB13=Ile, Leu, Asp, Val или Ala; XB14=Thr, Ala, Pro, Val или Arg; XB15=Asn, Asp, Ala, Val, Thr, Pro или Glu; XB16=Ala, Ser, Gln, His, Tyr, Arg или Gly; XB17=Tyr или Leu; XB18=Tyr, Met, Val, Gln, Ile, Asp, Gly, Asn или Leu; XB19=Leu, Asp, Gln, Gly, Lys, Glu, Arg или Thr; XB20=Val, Leu или Lys; CB21=Cys, амидированный Cys, селеноцистеин или амидированный селеноцистеин; XB22=Tyr, Phe или His; XB23=Glu, Arg, Ser, Gly или отсутствует; XB24=Arg, Asp, Val или отсутствует; XB25=Gly, Leu, Val или отсутствует; XB26=Phe, Val, Ile или отсутствует; XB27=Phe, Asn, Pro, Glu или отсутствует; XB28=Tyr, Cys, His или отсутствует; XB29=Thr, His, Leu, Tyr или отсутствует; XB30=Pro, Glu, Leu, Ile, Arg или отсутствует; XB31=Ile, Lys или отсутствует; XB32=Thr, Lys, Leu, Gln или отсутствует; XB33=Cys или отсутствует; XB34=Glu, Pro, Val или отсутствует; XB35=Glu, Gly или отсутствует; XB36=Glu, Gly или отсутствует; XB37=Glu, Val или отсутствует; XB38=Ala, Asp или отсутствует; и XB39=Ala или отсутствует (SEQ ID NO: 3).
В некоторых вариантах осуществления пептид, представляющий собой В-цепь, содержит последовательность
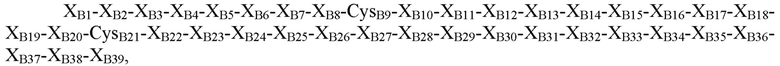
где XB1=Thr, Asn, Ser или отсутствует; XB2=Phe, Ser, Asn, Thr, Gln или отсутствует; XB3=Asp, Gly, Pro, Leu, Phe или His; XB4=Thr, Pro, Asp, Val или Gly; XB5=Asn, Pro, His, Thr, Arg, Ser или гидроксипролин; XB6=Lys, Glu, Asn, Asp, Arg, Gln или Gly; XB7=His, Tyr, Arg или Ile; XB8=Arg, Thr, Ile, Ser, Leu, Tyr или Lys; CysB9=Cys или селеноцистеин; XB10=Gly, Gln или Asp; XB11=Ser, Leu, Gly или Pro; XB12=His, Glu, гамма-карбоксиглутамат, Asp или Asn; XB13=Ile, Leu, Asp, Val или Ala; XB14=Thr, Ala, Pro, Val или Arg; XB15=Asn, Asp, Ala, Val, Thr, Pro или Glu; XB16=Ala, Ser, Gln, His, Tyr, Arg или Gly; XB17=Tyr или Leu; XB18=Tyr, Met, Val, Gln, Ile, Asp, Gly, Asn или Leu; XB19=Leu, Asp, Gln, Gly, Lys, Glu, Arg или Thr; XB20=Val, Leu или Lys; CB21=Cys, амидированный Cys, селеноцистеин или амидированный селеноцистеин; XB22=Tyr, Phe или His; XB23=Glu, Arg, Ser, Gly или отсутствует; и XB24, XB25, XB26, XB27, XB28, XB29, XB30, XB31 XB32, XB33, XB34, XB35, XB36, XB37, XB38 и XB39 отсутствуют (SEQ ID NO: 4).
В некоторых вариантах осуществления пептид, представляющий собой В-цепь, содержит последовательность

где XB1=Thr, Asn, Ser или отсутствует; XB2=Phe, Ser, Asn, Thr, Gln или отсутствует; XB3=Asp, Gly, Pro, Leu, Phe или His; XB4=Thr, Pro, Asp, Val или Gly; X XB5=Asn, Pro, His, Thr, Arg, Ser или гидроксипролин; XB6=Lys, Glu, Asn, Asp, Arg, Gln или Gly; XB7=His, Tyr, Arg или Ile; XB8=Arg, Thr, Ile, Ser, Leu, Tyr или Lys; CysB9=Cys или селеноцистеин; XB12=His, Glu, гамма-карбоксиглутамат, Asp или Asn; XB13=Ile, Leu, Asp, Val или Ala; XB14=Thr, Ala, Pro, Val или Arg; XB15=Asn, Asp, Ala, Val, Thr, Pro или Glu; XB16=Ala, Ser, Gln, His, Tyr, Arg или Gly; XB17=Tyr или Leu; XB18=Tyr, Met, Val, Gln, Ile, Asp, Gly, Asn или Leu; XB19=Leu, Asp, Gln, Gly, Lys, Glu, Arg или Thr; XB20=Val, Leu или Lys; CB21=Cys, амидированный Cys, селеноцистеин или амидированный селеноцистеин; XB22=Tyr, Phe или His; XB23=Glu, Arg, Ser, Gly или отсутствует; XB24=Arg, Asp, Val или отсутствует; XB25=Gly, Leu, Val или отсутствует; XB26=Phe, Val, Ile или отсутствует; XB27=Phe, Asn, Pro, Glu или отсутствует; XB28=Tyr, Cys, His или отсутствует; XB29=Thr, His, Leu, Tyr или отсутствует; XB30=Pro, Glu, Leu, Ile, Arg или отсутствует; XB31=Ile, Lys или отсутствует; XB32=Thr, Lys, Leu, Gln или отсутствует; XB33=Cys или отсутствует; XB34=Glu, Pro, Val или отсутствует; XB35=Glu, Gly или отсутствует; XB36=Glu, Gly или отсутствует; XB37=Glu, Val или отсутствует; XB38=Ala, Asp или отсутствует; и XB39=Ala или отсутствует (SEQ ID NO: 5).
В некоторых вариантах осуществления пептид, представляющий собой В-цепь, содержит последовательность
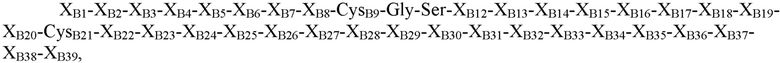
где XB1=Thr, Asn, Ser или отсутствует; XB2=Phe, Ser, Asn, Thr, Gln или отсутствует; XB3=Asp, Gly, Pro, Leu, Phe или His; XB4=Thr, Pro, Asp, Val или Gly; XB5=Asn, Pro, His, Thr, Arg, Ser или гидроксипролин; XB6=Lys, Glu, Asn, Asp, Arg, Gln или Gly; XB7=His или Tyr; XB8=Arg, Thr, Ile, Ser, Leu, Tyr или Lys; CysB9=Cys или селеноцистеин; XB12=His, Glu, гамма-карбоксиглутамат, Asp или Asn; XB13=Ile, Leu, Asp, Val или Ala; XB14=Thr, Ala, Pro, Val или Arg; XB15=Asn, Asp, Ala, Val, Thr, Pro или Glu; XB16=Ala, Ser, Gln, His, Tyr, Arg или Gly; XB17=Tyr или Leu; XB18=Tyr, Met, Val, Gln, Ile, Asp, Gly, Asn или Leu; XB19=Leu, Asp, Gln, Gly, Lys, Glu, Arg или Thr; XB20=Val или Leu; CB21=Cys, амидированный Cys, селеноцистеин или амидированный селеноцистеин; XB22=Tyr, Phe или His; XB23=Glu, Arg, Ser, Gly или отсутствует; XB24=Arg, Asp, Val или отсутствует; XB25=Gly, Leu, Val или отсутствует; XB26=Phe, Val, Ile или отсутствует; XB27=Phe, Asn, Pro, Glu или отсутствует; XB28=Tyr, Cys, His или отсутствует; XB29=Thr, His, Leu, Tyr или отсутствует; XB30=Pro, Glu, Leu, Ile, Arg или отсутствует; XB31=Ile, Lys или отсутствует; XB32=Thr, Lys, Leu, Gln или отсутствует; XB33=Cys или отсутствует; XB34=Glu, Pro, Val или отсутствует; XB35=Glu, Gly или отсутствует; XB36=Glu, Gly или отсутствует; XB37=Glu, Val или отсутствует; XB38=Ala, Asp или отсутствует; и XB39=Ala или отсутствует (SEQ ID NO: 6).
В некоторых вариантах осуществления пептид, представляющий собой В-цепь, содержит последовательность XB1-XB2-XB3-XB4-XB5-XB6-XB7-XB8-CysB9-Gly-Ser-XB12-XB13-XB14-XB15-XB16-XB17-XB18-XB19-XB20-CysB21-XB22-XB23, где XB1=Thr, Asn или отсутствует; XB2=Phe, Ser или отсутствует; XB3=Phe или Asp; XB4=Thr или Val; XB5=Pro, Asn или гидроксипролин; XB6=Lys, Asn или Gln; XB7=His или Tyr; XB8=Arg, Ile или Leu; XB12=His, Asp, Glu или гамма-карбоксиглутамат; CysB9=Cys или селеноцистеин; XB13=Val, Ile или Leu; XB14=Thr, Ala, Pro или Val; XB15=Glu, Val, Asn или Asp; XB16=Ser, Gln, Tyr или Ala; XB17=Tyr или Leu; XB18=Tyr, Asp, Met или Val; XB19=Leu, Asp, Gln или Lys; XB20=Leu или Val; CysB21=Cys, амидированный Cys, селеноцистеин или амидированный селеноцистеин; XB22=Tyr или Gly; и XB23=Glu, Arg, Gly или отсутствует (SEQ ID NO: 7).
В некоторых вариантах осуществления пептид, представляющий собой В-цепь, содержит последовательность XB1-XB2-XB3-XB4-XB5-XB6-His-XB8-CysB9-Gly-Ser-XB12-XB13-XB14-XB15-XB16-XB17-XB18-XB19-XB20-CysB21-XB22-XB23, где XB1=Thr или отсутствует; XB2=Phe или отсутствует; XB3=Phe или Asp; XB4=Thr или Val; XB5=Pro, Asn или гидроксипролин; XB6=Lys или Gln; XB8=Arg или Leu; XB12=His, Glu или гамма-карбоксиглутамат; XB13=Ile или Leu; XB14=Thr или Val; XB15=Glu или Asn; XB16=Ser или Ala; XB17=Tyr или Leu, XB18=Tyr или Met; XB19=Leu или Asp, XB20=Leu или Val; XB22=Tyr; и XB23=Glu или Arg (SEQ ID NO: 8).
В некоторых вариантах осуществления XB17 и XB22 представляют собой Tyr. В некоторых вариантах осуществления XB22 представляет собой Tyr. В некоторых вариантах осуществления XB17 представляет собой Tyr.
В некоторых вариантах осуществления пептид, представляющий собой А-цепь, содержит последовательность
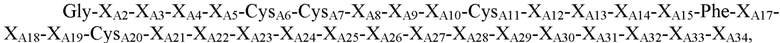
где XA2=Val или Ile; XA3=Val или Ala; XA4=Glu, гамма-карбоксиглутамат или Cys; XA5=Gln, Glu, гамма-карбоксиглутамат, His или Val; CysA6, CysA7 и CysA11 независимо представляют собой Cys или селеноцистеин; XA8=Thr, His, Asp, Gln, Tyr, Lys или Val; XA9=Ser, Arg, Asn, His или Lys; XA10=Ile, Pro, Tyr, Ala, Ser, Phe, His или Thr; XA12=Ser или Thr; XA13=Leu, Asn, Val или Asp; XA14=Tyr, Ala, Gln, Asp или Glu; XA15=Gln, Glu, или Thr; или Ala; XA17=Glu, Lys, Arg, Ile, Met, Thr или Ser; XA18=Lys, Thr, Asn, Gln или Glu; XA19=Tyr или Phe; CysA20=Cys, селеноцистеин, амидированный Cys или амидированный селеноцистеин; XA21=Asn, Pro, His, Ser, Gly, Ala или отсутствует; XA22=Pro, Asn, Thr, Leu, Ser или отсутствует; XA23=Thr, Leu, Val, Ser или отсутствует; XA24=Arg, Thr, Met, Gln, Leu или отсутствует; XA25=Glu, Gly или отсутствует; XA26=Ser, Leu или отсутствует; XA27-XA31 независимо представляют собой Ser или отсутствуют; XA32=Ala, Ser или отсутствует; XA33=Ala, Val или отсутствует; и XA34=Ala или отсутствует (SEQ ID NO: 9).
В некоторых вариантах осуществления аналог инсулина содержит пептид, представляющий собой А-цепь, содержащий последовательность Gly-XA2-Val-XA4-XA5-CysA6-CysA7-XA8-XA9-XA10-CysA11-Ser-XA13-XA14-XA15-XA16-XA17-XA18-Tyr-CysA20-XA21, где XA2 представляет собой Val или Ile, XA4 представляет собой Glu или гамма-карбоксиглутамат, XA5 представляет собой His или Gln, XA8 представляет собой His или Thr, XA9 представляет собой Arg или Ser, XA10 представляет собой Pro или Ile, XA13 представляет собой Asn или Leu, XA14 представляет собой Ala или Tyr, XA15 представляет собой Glu или Gln, XA16 представляет собой Phe или Leu, XA17 представляет собой Lys или Glu, XA18 представляет собой Lys или Asn, и XA21 представляет собой Asn или отсутствует (SEQ ID NO: 10); и пептид, представляющий собой В-цепь, содержащий последовательность XB1-XB2-XB3-XB4-XB5-XB6-His-XB8-CysB9-Gly-Ser-XB12-XB13-XB14-XB15-XB16-XB17-XB18-XB19-XB20-CysB21-XB22-XB23, где XB1=Thr или отсутствует; XB2=Phe или отсутствует; XB3=Phe или Asp; XB4=Thr или Val; XB5=Pro, Asn или гидроксипролин; XB6=Lys или Gln; XB8=Arg или Leu; XB12=His, Glu или гамма-карбоксиглутамат; XB13=Ile или Leu; XB14=Thr или Val; XB15=Glu или Asn; XB16=Ser или Ala; XB17=Tyr или Leu; XB18=Tyr или Met; XB19=Leu или Asp, XB20=Leu или Val; XB22=Gly или Tyr; и XB23=Glu или Arg (SEQ ID NO: 11).
В некоторых вариантах осуществления аналог инсулина содержит пептид, представляющий собой А-цепь, содержащий последовательность Gly-XA2-Val-XA4-XA5-CysA6-CysA7-XA8-XA9-XA10-CysA11-Ser-XA13-XA14-XA15-Phe-XA17-XA18-Tyr-CysA20-XA21, где XA2 представляет собой Val или Ile, XA4 представляет собой Glu или гамма-карбоксиглутамат, XA5 представляет собой His или Gln, XA8 представляет собой His или Thr, XA9 представляет собой Arg или Ser, XA10 представляет собой Pro или Ile, XA13 представляет собой Asn или Leu, XA14 представляет собой Ala или Tyr, XA15 представляет собой Glu или Gln, XA17 представляет собой Lys или Glu, XA18 представляет собой Lys или Asn, и XA21 представляет собой Asn или отсутствует (SEQ ID NO: 12); и пептид, представляющий собой В-цепь, содержащий последовательность XB1-XB2-XB3-XB4-XB5-XB6-His-XB8-CysB9-Gly-Ser-XB12-XB13-XB14-XB15-XB16-XB17-XB18-XB19-XB20-CysB21-Tyr-XB23, где XB1=Thr или отсутствует; XB2=Phe или отсутствует; XB3=Phe или Asp; XB4=Thr или Val; XB5=Pro, Asn или гидроксипролин; XB6=Lys или Gln; XB8=Arg или Leu; XB12=His, Glu или гамма-карбоксиглутамат; XB13=Ile или Leu; XB14=Thr или Val; XB15=Glu или Asn; XB16=Ser или Ala; XB17=Tyr или Leu; XB18=Tyr или Met; XB19=Leu или Asp, XB20=Leu или Val; и XB23=Glu или Arg (SEQ ID NO: 13).
В некоторых вариантах осуществления аналог инсулина содержит пептид, представляющий собой А-цепь, содержащий последовательность Gly-Val-Val-XA4-XA5-CysA6-CysA7-XA8-XA9-XA10-CysA11-Ser-XA13-XA14-XA15-Phe-XA17-XA18-Tyr-CysA20-XA21, где XA4 представляет собой Glu или гамма-карбоксиглутамат, XA5 представляет собой His или Gln, XA8 представляет собой His или Thr, XA9 представляет собой Arg или Ser, XA10 представляет собой Pro или Ile, XA13 представляет собой Asn или Leu, XA14 представляет собой Ala или Tyr, XA15 представляет собой Glu или Gln, XA17 представляет собой Lys или Glu, XA18 представляет собой Lys или Asn, и XA21 представляет собой Asn или отсутствует (SEQ ID NO: 14); и пептид, представляющий собой В-цепь, содержащий последовательность XB1-XB2-XB3-XB4-XB5-XB6-His-Arg-CysB9-Gly-Ser-XB12-Ile-XB14-XB15-XB16-XB17-XB18-XB19-Leu-CysB21-Tyr-XB23, где XB1=Thr или отсутствует; XB2=Phe или отсутствует; XB3=Phe или Asp; XB4=Thr или Val; XB5=Pro, Asn или гидроксипролин; XB6=Lys или Gln; XB12=His, Glu или гамма-карбоксиглутамат; XB14=Thr или Val; XB15=Glu или Asn; XB16=Ser или Ala; XB17=Tyr или Leu; XB18=Tyr или Met; XB19=Leu или Asp, и XB23=Glu или Arg (SEQ ID NO: 15).
В варианте осуществления аналог инсулина идентичен человеческому инсулину за исключением усеченной с С-конца В-цепи и ароматического остатка или большого алифатического остатка в положении аминокислоты номер 15 и/или 20 в В-цепи. Примеры представлены без ограничения тремя нижеприведенными вариантами осуществления, где Хаа представляет собой ароматический остаток или большой алифатический остаток.
В некоторых вариантах осуществления аналог инсулина содержит пептид, представляющий собой А-цепь, содержащий последовательность Gly-Ile-Val-Glu-Gln-Cys-Cys-Thr-Ser-Ile-Cys-Ser-Leu-Tyr-Gln-Leu-Glu-Asn-Tyr-Cys-Asn (SEQ ID NO: 16); и пептид, представляющий собой В-цепь, содержащий последовательность Phe-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-His-Leu-Val-Glu-Ala-Xaa-Tyr-Leu-Val-Cys-Gly-Glu, где Хаа представляет собой ароматический остаток или большой алифатический остаток (SEQ ID NO: 17).
В некоторых вариантах осуществления аналог инсулина содержит пептид, представляющий собой А-цепь, содержащий последовательность Gly-Ile-Val-Glu-Gln-Cys-Cys-Thr-Ser-Ile-Cys-Ser-Leu-Tyr-Gln-Leu-Glu-Asn-Tyr-Cys-Asn (SEQ ID NO: 18); и пептид, представляющий собой В-цепь, содержащий последовательность Phe-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-His-Leu-Val-Glu-Ala-Leu-Tyr-Leu-Val-Cys-Xaa-Glu, где Хаа представляет собой ароматический остаток или большой алифатический остаток (SEQ ID NO: 19).
В некоторых вариантах осуществления аналог инсулина содержит пептид, представляющий собой А-цепь, содержащий последовательность Gly-Ile-Val-Glu-Gln-Cys-Cys-Thr-Ser-Ile-Cys-Ser-Leu-Tyr-Gln-Leu-Glu-Asn-Tyr-Cys-Asn (SEQ ID NO: 20); и пептид, представляющий собой В-цепь, содержащий последовательность Phe-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-His-Leu-Val-Glu-Ala-Xaa-Tyr-Leu-Val-Cys-Xaa-Glu (SEQ ID NO: 21), где Хаа представляет собой ароматический остаток или большой алифатический остаток.
В некоторых вариантах осуществления аналог инсулина содержит ряд модифицированных аминокислот. В некоторых вариантах осуществления аналог инсулина содержит одно или несколько или все из следующего:
i) XA4 представляет собой гамма-карбоксиглутамат,
ii) XB5 = гидроксипролин; и
iii) XB12 = гамма-карбоксиглутамат.
В некоторых вариантах осуществления CysB9 из пептида, представляющего собой В-цепь, связан с CysA6 из пептида, представляющего собой А-цепь. В некоторых вариантах осуществления CysB21 из пептида, представляющего собой В-цепь, связан с CysA20 из пептида, представляющего собой А-цепь. В некоторых вариантах осуществления CysA7 связан с CysA11.
В некоторых вариантах осуществления пептид, представляющий собой А-цепь, и пептид, представляющий собой В-цепь, связаны друг с другом за счет одной пары их соответствующих терминальных концов. В некоторых вариантах осуществления пептид, представляющий собой А-цепь, и пептид, представляющий собой В-цепь, связаны друг с другом за счет обоих терминальных концов.
В некоторых вариантах осуществления аналог инсулина характеризуется IC50 в отношении человеческого рецептора IR-B, составляющей менее 10-6 М. В некоторых вариантах осуществления аналог инсулина не связывается с человеческим IGF-IR или слабо связывается с IGF-IR. В некоторых вариантах осуществления аналог характеризуется аффинностью (Kd) в отношении человеческого IGF-IR, составляющей менее 100 нМ.
В некоторых вариантах осуществления аналог инсулина является преимущественно мономерным. В некоторых вариантах осуществления аналог является на по меньшей мере 75% мономерным в растворе.
В некоторых вариантах осуществления аналог инсулина характеризуется повышенной биодоступностью при введении человеку по сравнению с человеческим инсулином. В некоторых вариантах осуществления аналог инсулина характеризуется пиковой биодоступностью в диапазоне от 0,5 до 3 часов после введения человеку. В некоторых вариантах осуществления аналог инсулина характеризуется началом проявления активности в течение 10 минут после введения.
В дополнительном аспекте настоящее изобретение предусматривает фармацевтическую композицию, содержащую аналог инсулина, определенный в данном документе, или его фармацевтически приемлемую соль и один или несколько фармацевтически приемлемых носителей.
В еще одном дополнительном аспекте настоящее изобретение предусматривает способ лечения и/или предупреждения связанного с инсулином состояния, предусматривающий введение терапевтически эффективного количества аналога инсулина, определенного в данном документе, субъекту, нуждающемуся в этом. В некоторых вариантах осуществления связанное с инсулином состояние представляет собой гипергликемию, инсулинорезистентность, диабет 1 типа, гестационный диабет или диабет 2 типа.
В еще одном дополнительном аспекте настоящее изобретение предусматривает способ снижения уровней глюкозы в крови, предусматривающий введение терапевтически эффективного количества аналога инсулина, определенного в данном документе, субъекту, нуждающемуся в этом.
В еще одном дополнительном аспекте настоящее изобретение предусматривает применение аналога инсулина, определенного в данном документе, в изготовлении лекарственного препарата для лечения и/или предупреждения связанного с инсулином состояния у субъекта. В еще одном дополнительном аспекте настоящее изобретение предусматривает применение аналога инсулина, определенного в данном документе, в изготовлении лекарственного препарата для снижения уровней глюкозы в крови у субъекта.
В еще одном дополнительном аспекте настоящее изобретение предусматривает аналог инсулина, определенный в данном документе, для применения в лечении и/или предупреждении связанного с инсулином состояния у субъекта. В еще одном дополнительном аспекте настоящее изобретение предусматривает аналог инсулина, определенный в данном документе, для применения в обеспечении снижения уровней глюкозы в крови у субъекта.
В еще одном дополнительном аспекте настоящее изобретение предусматривает пептиды, включающие пептид, представляющий собой А-цепь инсулина, и пептид, представляющий собой В-цепь инсулина, где пептид, представляющий собой В-цепь, содержит замену по аминокислоте 10 и аминокислоте 20. В некоторых случаях замена по аминокислоте 20 представляет собой G20Y, G20F или G20P. В некоторых случаях замена по аминокислоте 10 представляет собой Н10Е, H10D или H10Q.
В некоторых вариантах осуществления пептиды включают пептид, представляющий собой А-цепь инсулина, и пептид, представляющий собой В-цепь инсулина, где пептид, представляющий собой В-цепь, содержит замену по аминокислоте 10 и аминокислоте 20, и при этом дополнительно по меньшей мере одна замена содержится в пептиде, представляющем собой А-цепь. В некоторых случаях по меньшей мере одна замена в пептиде, представляющем собой А-цепь, представляет собой Т8Н, T8Y, T8K или S9R.
В некоторых вариантах осуществления пептиды включают пептид, представляющий собой А-цепь инсулина, и пептид, представляющий собой В-цепь инсулина, где пептид, представляющий собой В-цепь, содержит замену по аминокислоте 10 и аминокислоте 20, и при этом дополнительно по меньшей мере две замены содержатся в пептиде, представляющем собой А-цепь. В некоторых случаях по меньшей мере две замены в пептиде, представляющем собой А-цепь, представляют собой две из замен, выбранных из Т8Н, T8Y, T8K и S9R.
В некоторых вариантах осуществления пептид представляет собой дезоктапептид-инсулин. В некоторых случаях пептид, представляющий собой В-цепь, содержит последовательность 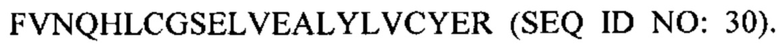 В некоторых случаях А-цепь содержит последовательность
В некоторых случаях А-цепь содержит последовательность 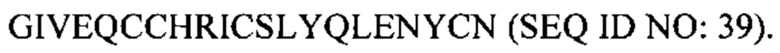
В некоторых вариантах осуществления пептид, представляющий собой А-цепь, и пептид, представляющий собой В-цепь, связаны посредством по меньшей мере одной дисульфидной связи. В некоторых вариантах осуществления пептид является мономерным.
В некоторых вариантах осуществления пептид, представляющий собой А-цепь инсулина, на по меньшей мере 70% идентичен пептиду, представляющему собой А-цепь человеческого инсулина дикого типа.
В еще одном аспекте настоящее изобретение предусматривает фармацевтические композиции, содержащие аналог, пептид или соединение инсулина, определенные в данном документе. В некоторых вариантах осуществления настоящее изобретение предусматривает фармацевтические композиции, содержащие пептид, включающий пептид, представляющий собой А-цепь инсулина, и пептид, представляющий собой В-цепь инсулина, где пептид, представляющий собой В-цепь, содержит замену по аминокислоте 10 и аминокислот 20, и фармацевтически приемлемый носитель.
В еще одном аспекте настоящее изобретение предусматривает способы повышения активации инсулинового рецептора у субъекта, предусматривающие введение терапевтически эффективного количества аналога, пептида или соединения инсулина, определенных в данном документе. В некоторых вариантах осуществления настоящее изобретение предусматривает способы повышения активации инсулинового рецептора у субъекта, предусматривающие введение терапевтически эффективного количества пептида, включающего пептид, представляющий собой А-цепь инсулина, и пептид, представляющий собой В-цепь инсулина, где пептид, представляющий собой В-цепь, содержит замену по аминокислоте 10 и аминокислоте 20, субъекту, нуждающемуся в этом.
В еще одном аспекте настоящее изобретение предусматривает способы снижения уровня сахара в крови у субъекта, предусматривающие введение терапевтически эффективного количества аналога, пептида или соединения инсулина, определенных в данном документе. В некоторых вариантах осуществления настоящее изобретение предусматривает способы снижения уровня содержания сахара в крови у субъекта, предусматривающие введение терапевтически эффективного количества пептида, включающего пептид, представляющий собой А-цепь инсулина, и пептид, представляющий собой В-цепь инсулина, где пептид, представляющий собой В-цепь, содержит замену по аминокислоте 10 и аминокислоте 20, субъекту, нуждающемуся в этом.
В еще одном аспекте настоящее изобретение предусматривает способы лечения диабета 1 типа у субъекта, предусматривающие введение терапевтически эффективного количества аналога, пептида или соединения инсулина, определенных в данном документе. В некоторых вариантах осуществления настоящее изобретение предусматривает способы лечения диабета 1 типа у субъекта, предусматривающие введение терапевтически эффективного количества пептида, включающего пептид, представляющий собой А-цепь инсулина, и пептид, представляющий собой В-цепь инсулина, где пептид, представляющий собой В-цепь, содержит замену по аминокислоте 10 и аминокислоте 20, субъекту, нуждающемуся в этом. В некоторых случаях у субъекта до введения пептида был диагностирован диабет 1 типа.
В еще одном дополнительном аспекте предусмотрен терапевтический белок, содержащий пептид, представляющий собой А-цепь, связанный с пептидом, представляющим собой В-цепь, посредством по меньшей мере одной дисульфидной связи, где А-цепь содержит последовательность 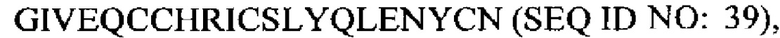 и где пептид, представляющий собой В-цепь, содержит последовательность
и где пептид, представляющий собой В-цепь, содержит последовательность 
В еще одном дополнительном аспекте настоящее изобретение предусматривает способ изменения структуры или модификации полипептида, который, как известно, связывается с инсулиновым рецептором (IR), предусматривающий осуществление основанной на структуре оценки по отношению к структуре, определенной атомными координатами из приложения I или их подмножеством, и изменение структуры или химическую модификацию полипептида по результатам оценки. В некоторых вариантах осуществления основанная на структуре оценка предусматривает сравнение структуры, определенной атомными координатами из приложения I или их подмножеством, с атомными координатами инсулина или их подмножеством. В некоторых вариантах осуществления основанная на структуре оценка дополнительно предусматривает молекулярное моделирование комплекса, образованного структурой, определенной атомными координатами из приложения I или их подмножеством, и атомными координатами инсулинового рецептора или их подмножеством. В некоторых вариантах осуществления способ дополнительно предусматривает осуществление синтеза или получение полипептида, подвергнутого изменению структуры или химической модификации, и тестирование в отношении его способности связываться с IR. В некоторых вариантах осуществления способ дополнительно предусматривает осуществление синтеза или получение полипептида, подвергнутого изменению структуры или химической модификации, и определение способности полипептида, подвергнутого изменению структуры или химической модификации, модулировать активацию IR. В некоторых вариантах осуществления способ дополнительно предусматривает осуществление синтеза или получение полипептида, подвергнутого изменению структуры или химической модификации, и определение способности полипептида, подвергнутого изменению структуры или химической модификации, снижать уровни глюкозы в крови. В некоторых вариантах осуществления полипептид, который, как известно, связывается с IR, представляет собой инсулин. В некоторых вариантах осуществления инсулин представляет собой человеческий инсулин. В другом аспекте также предусмотрен полипептид, который был подвергнут изменению структуры или модификации с помощью способа, определенного в данном документе. В некоторых вариантах осуществления полипептид является мономерным.
В другом аспекте настоящее изобретение предусматривает выделенную молекулу, которая является агонистом IR, где молекула идентифицирована и/или сконструирована на основании 3D-структуры Con-Ins G1, определенной атомными координатами из приложения I или их подмножеством. В некоторых вариантах осуществления молекула представляет собой пептид, полипептид или пептидомиметик. В некоторых вариантах осуществления молекула является мономерной. В некоторых вариантах осуществления молекула характеризуется IC50 в отношении человеческого рецептора IR-B, составляющей менее 10-6 М.
В другом аспекте настоящее изобретение предусматривает способ идентификации соединения, которое связывается с IR, при этом способ включает:
i) создание модели трехмерной структуры полипептида, характеризующегося
a) структурой, определенной атомными координатами из приложения I или их подмножеством, или
b) структурой, которая при наложении на соответствующие атомы остова структуры а) характеризуется среднеквадратическим отклонением, составляющим менее приблизительно 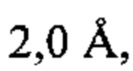 и
и
ii) конструирование соединения, которое потенциально связывается с IR, или осуществление скрининга в отношении него.
В некоторых вариантах осуществления создание модели трехмерной структуры предусматривает создание модели полипептида, связанного с IR или его областями. В некоторых вариантах осуществления способ дополнительно предусматривает осуществление синтеза соединения, которое потенциально связывается с IR. В некоторых вариантах осуществления соединение модулирует по меньшей мере одну биологическую активность IR. В некоторых вариантах осуществления соединение является мономерным. В некоторых вариантах осуществления способ дополнительно предусматривает тестирование соединения, сконструированного или отобранного с помощью скрининга на стадии ii), в отношении его способности модулировать уровни глюкозы в крови. В некоторых вариантах осуществления стадии i) и ii) осуществляют in silico.
В другом аспекте настоящее изобретение предусматривает способ идентификации соединения, которое имитирует активность инсулина, с применением компьютера, при этом способ включает:
i) создание модели трехмерной структуры полипептида, характеризующегося
a) структурой, определенной атомными координатами из приложения I или их подмножеством, или
b) структурой, которая при наложении на соответствующие атомы остова структуры а) характеризуется среднеквадратическим отклонением, составляющим менее приблизительно 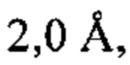 и
и
ii) конструирование соединения, которое имитирует активность инсулина, или осуществление скрининга в отношении него.
В некоторых вариантах осуществления создание модели трехмерной структуры предусматривает создание модели полипептида, связанного с IR или его областями. В некоторых вариантах осуществления способ дополнительно предусматривает осуществление синтеза соединения, которое потенциально связывается с IR. В некоторых вариантах осуществления соединение модулирует по меньшей мере одну биологическую активность IR. В некоторых вариантах осуществления соединение является мономерным. В некоторых вариантах осуществления способ дополнительно предусматривает тестирование соединения, сконструированного или отобранного с помощью скрининга на стадии ii), в отношении его способности модулировать уровни глюкозы в крови. В некоторых вариантах осуществления стадии i) и ii) осуществляют in silico.
В дополнительном аспекте настоящее изобретение предусматривает соединение, идентифицированное с помощью способа, определенного в данном документе.
В дополнительном аспекте настоящее изобретение предусматривает кристалл полипептида Con-Ins G1, характеризующийся пространственной группой симметрии Р432 с размерами элементарной ячейки 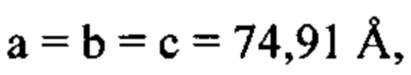 при этом отклонение размера любой ячейки составляет не более приблизительно 2%.
при этом отклонение размера любой ячейки составляет не более приблизительно 2%.
В дополнительном аспекте настоящее изобретение предусматривает структуру полипептида Con-Ins G1, определенную атомными координатами из приложения I.
В дополнительном аспекте настоящее изобретение предусматривает применение структуры полипептида Con-Ins G1, определенной атомными координатами из приложения I, в качестве структурной модели. В некоторых вариантах осуществления структурную модель применяют для идентификации аналогов инсулина. Настоящее изобретение также предусматривает аналоги инсулина, идентифицированные посредством применения, определенного в данном документе.
В еще одном аспекте настоящее изобретение предусматривает фармацевтическую композицию, содержащую аналог, молекулу полипептида и/или соединение инсулина, определенные в данном документе.
Любой вариант осуществления, указанный в данном документе, при его применении в отношении другого варианта осуществления следует использовать с необходимыми изменениями, если конкретно не указано иное. Например, как будет понятно специалисту в данной области техники, примеры аналогов инсулина, пептидов и состояний здоровья, перечисленные в данном документе для способов по настоящему изобретению, в равной степени применимы к применению и фармацевтическим композициям по настоящему изобретению. Также предполагается, что варианты осуществления настоящего изобретения включают стадии изготовления, такие как включение соединения в фармацевтическую композицию при изготовлении лекарственного препарата.
Во всем данном описании, если конкретно не указано иное или если иное не подразумевается контекстом, ссылку на одну стадию, композицию, группу стадий или группу композиций следует считать таковой, которая охватывает одну или множество (т.е. одну или несколько) этих стадий, композиций, групп стадий или групп композиций.
Дополнительные преимущества раскрытого способа и композиций будут частично изложены в последующем описании и частично будут понятны из описания, или их можно установить при практическом осуществлении раскрытых способа и композиций. Преимущества раскрытых способа и композиций будут реализованы и достигнуты посредством элементов и комбинаций, конкретно указанных в прилагаемой формуле изобретения.
Далее в данном документе настоящее изобретение описывается с помощью следующих неограничивающих примеров и со ссылкой на прилагаемые фигуры. Объем настоящего изобретения не ограничен конкретными вариантами осуществления, описанными в данном документе, которые предназначены только для цели иллюстрации. Функционально эквивалентные продукты, композиции и способы, несомненно, входят в объем настоящего изобретения, описанного в данном документе.
КРАТКОЕ ОПИСАНИЕ ПРИЛАГАЕМЫХ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
В прилагаемых графических материалах, которые включены в настоящее описание и составляют его часть, проиллюстрированы несколько вариантов осуществления раскрытых способа и композиций, и вместе с описанием они служат для объяснения принципов раскрытых способа и композиций.
Фигура 1. Сравнение с последовательностью человеческого инсулина. Последовательность Con-Ins G1 и ее сравнение с последовательностью человеческого инсулина. Консервативные цистеиновые остатки и триплет ароматических аминокислот заштрихованы серым цветом. Дисульфидные связи обозначены сплошной линией, соединяющей два цистеиновых остатка. γ: γ-карбоксилированный глутамат; О: гидроксипролин; *: С-концевое амидирование.
Фигура 2. Определение характеристик Con-Ins G1. Анализ конкурентного связывания Con-Ins G1 (n=9), sCon-Ins G1 без РТМ (n=9) и человеческого инсулина (n=21) с человеческим IR (изоформой В). Планки погрешностей отображают SEM (если планки погрешностей отсутствуют, они меньше, чем размер маркера). sCon-Ins G1: Con-Ins G1 с диселенидной связью между SecA6 и SecA10.
Фигура 3. Опосредованная инсулином передача сигнала, измеренная посредством анализа фосфорилирования Akt. Анализ sCon-Ins G1, sCon-Ins G1 без PTM и hIns (n=4) в отношении фосфорилирования Akt. Планки погрешностей отображают SEM (если планки погрешностей отсутствуют, они меньше, чем размер маркера).
Фигура 4а. Структура Con-Ins G1, установленная с помощью рентгеновской кристаллографии. Наложение Con-Ins G1 и hIns (запись "1MSO" в PDB). Остовы В- и А-цепей Con-Ins G1 выделены серым цветом, а остовы В- и А-цепей hIns выделены черным цветом и белым цветом (соответственно).
Фигура 4b. Гидрофобная сердцевина Con-Ins G1. Структура сердцевины Con-Ins G1 по сравнению с таковой hIns. Остовы В- и А-цепей Con-Ins G1 выделены серым цветом, а остовы В- и А-цепей hIns выделены черным цветом и белым цветом (соответственно).
Фигуры 4с, 4d и 4е. Посттрансляционные модификации Con-Ins G1. Взаимодействия боковых цепей GlaA4, GlaB10 и НурВ3 (соответственно, при этом взаимодействие GlaA4 сравнивается с таковым GluA4 hIns). Остовы В- и А-цепей Con-Ins G1 выделены серым цветом, а остовы В- и А-цепей hIns выделены черным цветом и белым цветом (соответственно).
Фигура 5. Структура Con-Ins G1, установленная с помощью рентгеновской кристаллографии. Стереоскопическое изображение, на котором показано расположение мономеров внутри кристалла Con-Ins G1 вокруг кристаллографической оси четвертого порядка. Четыре молекулы сульфата (центр) смоделированы - с нефиксированными координатами и эффективным заполнением, составляющим для каждого 0,25 - в виде относительно невыразительной области разности электронной плотности на оси четвертого порядка. Сульфат-ион образует часть зарядово-компенсированного кластера, содержащего амино-концевую группу GlyA1 и карбоксилатную группу боковой цепи GlaA4 из каждого мономера Con-Ins G1.
Фигура 6. Связывание Con-ins G1 с hIR. Молекулярная модель Con-Ins G1 в контексте первичного инсулин-связывающего участка инсулинового рецептора человека. Наложенные остатки В22-В27 hIns (в форме, когда он связан с hIR, из записи "4OGA" в PDB) обозначены черным цветом. На фигуре проиллюстрировано, как боковая цепь TyrB15 Con-Ins G1 после смещения со своего положения, характерного для конформации без рецептора, может вместе с таковой TyrB20 Con-Ins G1 действовать в качестве замены таковой PheB24 hIns при образовании комплекса Con-Ins G1/hIR. А-цепь Con-Ins G1 (на переднем плане) является прозрачной для наглядности.
Фигура 7. TyrB15 и TyrB20. Представление разности электронной плотности (2mFнабл.-DFрасч.) в области остатков TyrB15 и TyrB20 Con-Ins G1 в виде изоповерхности, построенной на уровне 1,5 σ. Боковые цепи обоих этих остатков выглядят неупорядоченными по сравнению с боковыми цепями соседних остатков (например, боковыми цепями TyrA19).
Фигура 8. GlaA4 Con-Ins G1. Схематическая диаграмма, на которой показано взаимодействие боковой цепи РТМ-остатка GlaA4 Con-Ins G1 с боковой цепью остатка Asn711 hIR αСТ, наблюдаемое в рамках молекулярной модели комплекса Con-Ins G1 с первичным участком связывания hIR. Поверхность молекулы является поверхностью домена L1 hIR.
Фигура 9. Опосредованная инсулином передача сигнала, измеренная посредством анализа фосфорилирования Akt. Анализ hIns, hIns[DOI] и hIns[TyrB15, TyrB20, DOI] в отношении фосфорилирования Akt.
Фигура 10. Определение характеристик Con-Ins G1. Анализ Con-Ins G1 методом седиментационного равновесия при 30000 об./мин. (черные точки) и 45000 об./мин. (серые точки) с наилучшим соответствием (линии) отдельной молекуле с кажущейся MW 5380±55 г/моль.
Фигура 11. Con-InsG1 в комплексе совместно с Fv83-7.IR310.T и IR-A704-719. Две ортогональные проекции наложения двух копий области асимметрической единицы кристаллической структуры комплекса Con-InsG1 в комплексе совместно с Fv83-7.IR310.T и IR-A704-719. На каждой панели одна копия показана в виде линий, соединяющих Сα-атомы, серого цвета с относительно жирными связями, а другая - в виде линий, соединяющих Сα-атомы, черного цвета с относительно тонкими связями. Наложение основано на общих остатках в фрагменте IR310.T. Домены CR и присоединенные к ним Fv83-7 опущены для наглядности.
Фигура 12. Con-InsG1 в комплексе совместно с Fv83-7.IR310.T и IR-A704-719. Наложение кристаллической структуры Con-InsG1 в комплексе совместно с Fv83-7.IR310.T и IR-А704-719 и кристаллической структуры hIns в комплексе совместно с Fab83-7.IR310.T и IR-A704-719 (запись "4OGA" в PDB). Комплекс Con-InsG1 показан в виде линий, соединяющих Сα-атомы, светло-серого цвета (с более жирными линиями), а комплекс hIns - в виде линий, соединяющих Сα-атомы, черного цвета (с более тонкими линиями, за исключением остатков В22-В30, которые показаны жирными линиями черного цвета). Наложение основано на общих остатках в фрагменте IR310.T. Богатый цистеином домен IR310.T и присоединенный к нему фрагмент антитела опущены для наглядности.
Фигура 13. TyrB15 и TyrB20. Наложение hIns в комплексе с Fab83-7, IR310.T и IR-A704-719 (запись "4OGA" в PDB; меченный) и Con-Ins G1 в комплексе с Fv83-7, IR310.T и IR-A704-719 (метки подчеркнуты) на основании общего домена L1 IR310.T. Домен L1 IR310.T показан в ленточном представлении, тогда как hIns, Con-Ins G1 и IR-A704-719 показаны в виде линий, соединяющих Сα-атомы. Домен CR IR310.T опущен для наглядности. Боковые цепи и Сα-атомы Phe714 hIR, LeuB15 и PheB24 hIns и TyrB15 Con-Ins G1 показаны в виде шаростержневой модели. Пространственное соответствие боковых цепей PheB24 hIns и TyrB15 Con-InsG1 является очевидным. Для TyrB20 Con-Ins G1 отсутствуют интерпретируемые значения электронной плотности. Соответствующие А-цепи Con-Ins G1 и hIns опущены для наглядности.
Фигура 14. Молекулярное моделирование hIns[DOI], связанного с компонентами, которые содержат первичный участок связывания (участок 1) hIR. Молекулярная модель hIns[DOI] в комплексе с доменом L1 IR (остатки Gly5-Cys155) и сегментом IR-A704-719 (остатки Phe705-Ser719 изоформы IR-A). Сегмент IR-A704-719 показан в ленточном представлении и окрашен в темно-серый цвет. А-цепь и В-цепь hIns[DOI] показаны в ленточном представлении и помечены. Прозрачная поверхность молекулы является поверхностью домена L1 hIR. Домен L1 hIR показан в ленточном представлении с показанной боковой цепью Tyr67.
Фигура 15. Молекулярное моделирование hIns[TyrB15, DOI], связанного с компонентами, которые содержат первичный участок связывания (участок 1) hIR. Молекулярная модель hIns[TyrB15, DOI] в комплексе с доменом L1 IR (остатки Gly5-Cys155) и сегментом IR-A от Phe705 до Ser719 (IR-A704-719). Сегмент IR-A704-719 показан в ленточном представлении и окрашен в темно-серый цвет. А-цепь и В цепь hIns[TyrB15, DOI] показаны в ленточном представлении и помечены. Поверхность молекулы является поверхностью домена L1 hIR. На фигуре проиллюстрировано, как боковая цепь TyrB15 врезается в гидрофобную сердцевину места контакта DOI-(IR-A704-719)-L1, занимая пространство, в ином случае занимаемое LeuB15 hIns.
Фигура 16. Молекулярное моделирование hIns[DOI, TyrB20], связанного с компонентами, которые содержат первичный участок связывания (участок 1) hIR. Молекулярная модель hIns[TyrB20, DOI] в комплексе с доменом L1 IR (остатки Gly5-Cys155) и IR-A704-719. На фигуре проиллюстрировано, как боковая цепь TyrB20 оставалась в участке связывания В24 hIns, при этом все другие взаимодействия с рецептором оказались подобными таковым, характерным для нативной молекулы. Сегмент IR-A704-719 показан в ленточном представлении и окрашен в темно-серый цвет. А-цепь и В цепь hIns[TyrB20, DOI] показаны в ленточном представлении и помечены. Прозрачная поверхность молекулы является поверхностью домена L1 hIR. Домен L1 hIR показан в ленточном представлении с показанной боковой цепью Tyr67.
Фигура 17. Позиционное сканирование hIns[DOI]. Окончательный вклад мутаций в каждом участке hIns[DOI] в отношении ΔΔG (ккал/моль).
Фигура 18. Позиционное сканирование hIns[TyrB15, DOI]. Окончательный вклад мутаций в каждом участке hIns[TyrB15, DOI] в отношении ΔΔG (ккал/моль).
Фигура 19. Позиционное сканирование hIns[TyrB20, DOI]. Окончательный вклад мутаций в каждом участке hIns[TyrB20, DOI] в отношении ΔΔG (ккал/моль).
Фигура 20. Схематическое изображение равновесия мультимера инсулина. На фигуре показано, что мономеризация инсулина замедляет скорость всасывания.
Фигура 21. Полный химический синтез человеческого инсулина, представляющего собой DOI. На фигуре показан полный химический синтез человеческого инсулина, представляющего собой DOI. Изопептид Thr-Ser (заключен в красную рамку) применяли для повышения растворимости А-цепи инсулина.
Фигура 22. Активация опосредованной инсулином передачи сигнала с помощью иллюстративных аналогов инсулина. На фигуре показаны эффекты Tyr В15 и Tyr В20 в отношении активации hIR. Также показана последовательность каждого применяемого пептида.
Фигура 23. Активация опосредованной инсулином передачи сигнала с помощью иллюстративных аналогов инсулина. На фигуре показаны эффекты Glu B10, Tyr В20 в отношении активации hIR. Также показана последовательность каждого применяемого пептида.
Фигура 24. Активация опосредованной инсулином передачи сигнала с помощью иллюстративных аналогов инсулина. На фигуре 24А и 24В соответственно показаны последовательности пептидов/модифицированные аминокислоты и эффекты остатков В20 в отношении активации опосредованной инсулином передачи сигнала.
Фигура 25. Активация опосредованной инсулином передачи сигнала с помощью иллюстративных аналогов инсулина. На фигуре показаны эффекты His А8, Arg А9 в отношении активации hIR. Также показана последовательность каждого применяемого пептида.
Фигура 26. Активация опосредованной инсулином передачи сигнала с помощью иллюстративных аналогов инсулина. На фигуре показан индивидуальный эффект А8, А9, В10 и В20 в отношении активации hIR.
Фигура 27. Активация опосредованной инсулином передачи сигнала с помощью видов инсулина из яда. На фигуре показана активация опосредованной инсулином передачи сигнала под действием нескольких видов инсулина из яда, эффективность которых сопоставима с таковой Con-Ins G1 (верхняя панель). Выравнивание последовательностей этих видов инсулина из яда (нижняя панель). Остатки в положении 9 и 10 в А-цепи и 10 и 20 в В-цепи выделены. γ и * обозначают посттрансляционные модификации (гамма-карбоксиглутамат и С-концевое амидирование соответственно).
УКАЗАТЕЛЬ К ПЕРЕЧНЮ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO: 1-41: аналоги инсулина, пептиды и/или соединения согласно вариантам осуществления настоящего изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Общие методики и определения
Если конкретно не определено иное, все технические и научные термины, используемые в данном документе, следует понимать как имеющие то же значение, которое обычно понимается средним специалистом в данной области техники (например, молекулярной генетики, фармакологии, кристаллографии белков, химии белков, биохимии и т.п.).
Если не указано иное, методики, используемые в настоящем изобретении, представляют собой стандартные процедуры, хорошо известные специалистам в данной области техники. Такие методики описаны и объясняются в литературе, в таких источниках, как J. Perbal, A Practical Guide to Molecular Cloning, John Wiley и Sons (1984), J. Sambrook et al. Molecular Cloning: A Laboratory Manual, Cold Spring Harbour Laboratory Press (1989), T.A. Brown (editor), Essential Molecular Biology: A Practical Approach, Volumes 1 и 2, IRL Press (1991), D.M. Glover и B.D. Hames (editors), DNA Cloning: A Practical Approach, Volumes 1-4, IRL Press (1995 и 1996), и F.M. Ausubel et al. (editors), Current Protocols in Molecular Biology, Greene Pub. Associates и Wiley-Interscience (1988, включая все обновления до настоящего времени), Ed Harlow и David Lane (editors) Antibodies: A Laboratory Manual, Cold Spring Harbour Laboratory, (1988), и J.E. Coligan et al. (editors) Current Protocols in Immunology, John Wiley & Sons (включая все обновления до настоящего времени).
Во всем данном описании слово "содержат", или такие вариации, как "содержит" или "содержащий", будут пониматься как подразумевающие включение указанных элемента, целого числа или стадии или группы элементов, целых чисел или стадий без исключения любых других элемента, целого числа или стадии или группы элементов, целых чисел или стадий.
Термин "и/или", например "X и/или Y", следует понимать как означающий либо "X и Y", либо "X или Y", и следует принимать как обеспечивающий однозначное подтверждение для обоих значений или для любого из значений. Кроме того, формы единственного числа, используемые в настоящей заявке и в прилагаемой формуле изобретения, в целом можно понимать как означающие "один или несколько", если не указано иное или не ясно из контекста, что они указывают на единственное число.
Термин "инсулин" означает человеческий инсулин, свиной инсулин, инсулин морской свинки, инсулин кур, мышиный инсулин, бычий инсулин или инсулин из яда. В некоторых вариантах осуществления инсулин означает человеческий инсулин. Термин "инсулин из яда" означает инсулин из яда улитки-конуса. Предпочтительно инсулин из яда означает Con-Ins G1.
Термин "аналог инсулина", как используется в данном документе, относится к любому средству, которое способно имитировать активность инсулина. В некоторых вариантах осуществления аналог инсулина представляет собой по меньшей мере агониста инсулинового рецептора. В некоторых вариантах осуществления аналог инсулина связывается с инсулиновым рецептором. Предпочтительно аналоги инсулина могут представлять собой пептиды, полипептиды, белки или пептидомиметики. В некоторых вариантах осуществления аналог инсулина представляет собой пептид. Как будет понятно специалисту в данной области техники, если контекст не указывает иное, термины "аналог инсулина", "пептид" и "пептид инсулина" используются взаимозаменяемо. Аналоги инсулина также включают агонисты IR, молекулы, соединения и т.п., идентифицированные с помощью способов, раскрытых в данном документе.
Термин "пептид", как используется в данном документе, относится к полимеру на основе аминокислот, который имеет длину, находящуюся в диапазоне от двух до приблизительно пятидесяти аминокислот (например, имеет длину, составляющую 4, 6, 8, 10, 12, 15, 20, 25, 30, 35, 40 или 45 аминокислот). Термин пептид охватывает как немодифицированные пептиды, так и модифицированные пептиды и пептиды, дериватизированные другим химическим способом (например, фосфорилированные, сульфатированные, амидированные и т.п.). В некоторых вариантах осуществления пептид может представлять собой не встречающийся в природе олигомерный пептид, как, например, описанные в работе Sadowsky et al. (2005) и Sadowsky et al. (2007). Термин "полипептид" или "белок", как используется в данном документе взаимозаменяемо, относится к полимеру на основе аминокислот, который обычно имеет общую длину, составляющую более приблизительно 50 аминокислот, и, как правило, характеризуется устойчивыми характерными вторичной и третичной структурами. Термин "полипептид" или "белок" может также включать комбинацию таких полимеров (например, двух или более), которые ассоциируют с образованием устойчивой третичной, четвертичной структуры, возникающей либо в результате их нековалентной, либо ковалентной ассоциации.
В некоторых вариантах осуществления пептид, белок или полипептид содержат аминокислоты, которые в естественных условиях встречаются у субъекта, подлежащего лечению. В некоторых вариантах осуществления пептид или полипептид содержат одну или несколько не встречающихся в природе аминокислот, модифицированных аминокислот или синтетических аналогов аминокислот. Такие аминокислоты включают без ограничения D-изомеры обычных аминокислот, 2,4-диаминомасляную кислоту, α-аминоизомасляную кислоту, 4-аминомасляную кислоту, 2-аминомасляную кислоту, 6-аминогексановую кислоту, 2-аминоизомасляную кислоту, 3-аминопропионовую кислоту, орнитин, норлейцин, норвалин, гидроксипролин, саркозин, цитруллин, гомоцитруллин, цистеиновую кислоту, трет-бутилглицин, трет-бутилаланин, фенилглицин, циклогексилаланин, циклопентилаланин, β-аланин, фторированные аминокислоты, сконструированные аминокислоты, такие как β-метиламинокислоты, Сα-метиламинокислоты, Nα-метиламинокислоты, и аналоги аминокислот в целом. Также в объем включены пептиды, полипептиды или белки, которые дифференциально модифицируют во время или после синтеза, например, путем биотинилирования, бензилирования, гликозилирования, ацетилирования, фосфорилирования, амидирования, дериватизации с помощью известных защитных/блокирующих групп, протеолитического расщепления, связывания с молекулой антитела или другим клеточным лигандом и т.д. Эти модификации могут служить для повышения стабильности и/или биологической активности пептида, белка или полипептида.
Термин "модификация" аминокислоты относится к замене аминокислоты или дериватизации аминокислоты путем добавления химических групп к аминокислоте и/или их удаления из аминокислоты и включает замену с помощью любой из 20 аминокислот, которые обычно встречаются в человеческих белках, а также нетипичных или не встречающихся в природе аминокислот. Коммерческие источники нетипичных аминокислот включают Sigma-Aldrich (Милуоки, Висконсин), ChemPep Inc. (Майами, Флорида) и Genzyme Pharmaceuticals (Кембридж, Массачусетс). Нетипичные аминокислоты можно заказывать у коммерческих поставщиков, синтезировать de novo или получать путем химической модификации или дериватизации из встречающихся в природе аминокислот.
Как используется в данном документе, аминокислотная "замена" относится к замещению одного аминокислотного остатка другим аминокислотным остатком. Заменяющей аминокислотой может быть любая из 20 аминокислот, которые обычно встречаются в человеческих белках, а также нетипичные или не встречающиеся в природе аминокислоты.
Термины "пептид, представляющий собой А-цепь" и "пептид, представляющий собой В-цепь" являются взаимозаменяемыми с "пептид, представляющий собой А-цепь инсулина" и "пептид, представляющий собой В-цепь инсулина".
Как используется в данном документе, ссылка на соединение, которое представляет собой "его производное", относится к соединению, которое разработано или модифицировано на основании соединения-предшественника и характеризуется подобной, но новой структурой, и которое характеризуется биологической активностью, подобной таковой у соединения-предшественника. В некоторых вариантах осуществления соединение-предшественник представляет собой малую молекулу, пептид, полипептид, белок или аналог инсулина, описанные в данном документе. В некоторых вариантах осуществления соединение-предшественник представляет собой пептид, полипептид, белок или аналог инсулина, который можно модифицировать таким образом, чтобы он включал любую химическую модификацию, содержал одну или несколько замен, делеций и/или добавлений любых молекул, ассоциированных с белком или пептидом, таких как углеводы, липиды и/или белки или пептиды. В одном варианте осуществления "производные" белков, полипептидов или пептидов включают такие модифицированные аналоги, полученные в результате гликозилирования, ацетилирования, фосфорилирования, амидирования, пальмитоилирования, миристоилирования, изопренилирования, липидирования, алкилирования, дериватизации, введения защитных/блокирующих групп, протеолитического расщепления или связывания с антителом или другим клеточным лигандом.
По всему тексту настоящей заявки все ссылки на конкретное положение аминокислоты в виде буквы и числа (например, положение А5 или В5) относятся к аминокислоте в данном положении либо А-цепи (например, положение А5), либо В-цепи (например, положение В5) в соответствующей А-цепи или В-цепи инсулина Con-G1 Ins из яда Conus geographus, или соответствующему положению аминокислоты в любом из его аналогов. Например, ссылка в данном документе на "положение В17" при отсутствии какого-либо дополнительного уточнения будет означать соответствующее положение В15 В-цепи человеческого инсулина, так как Con-Ins G1 имеет два дополнительных N-концевых остатка в В-цепи.
Как используется в данном документе, фраза "в положении, соответствующем аминокислоте номер" относится к относительному положению аминокислоты при сравнении с окружающими аминокислотами по отношению к определенной аминокислотной последовательности. Например, в некоторых вариантах осуществления при сравнении с человеческим инсулином (см. фигуру 1) В-цепь аналога инсулина по настоящему изобретению может иметь одну или две дополнительные N-концевые аминокислоты, такие как присутствующие в Con-Ins G1. В одном примере после выполнения выравнивания белков специалист в данной области техники легко поймет, что лейцин (15-я аминокислота) в В-цепи встречающегося в природе человеческого инсулина соответствует 17-й аминокислоте в В-цепи Con-Ins G1 (см. фигуру 1). В предпочтительном варианте осуществления настоящего изобретения эта 15-я аминокислота в В-цепи встречающегося в природе человеческого инсулина представляет собой ароматический остаток или большой алифатический остаток и/или 20-я аминокислота в В-цепи встречающегося в природе человеческого инсулина представляет собой ароматический остаток или большой алифатический остаток.
Термин "мономерный инсулин" относится к инсулину и аналогам инсулина, которые менее склонны к образованию молекул более высокого порядка (таких как димеры, тетрамеры, гексамеры и т.д.), чем человеческий инсулин. Предпочтительно инсулин или аналог инсулина являются полностью или в значительной степени мономерными, например, мономерными на по меньшей мере 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98%, 99% или 100%.
Как будет понятно специалистам в данной области техники, термин "терапевтический" относится к лечению, терапии или лекарственному средству, с помощью которого можно лечить заболевание или состояние или с помощью которого можно уменьшать интенсивность одного или нескольких симптомов, ассоциированных с заболеванием или состоянием. Как используется в данном документе, "терапевтический" может относиться к терапевтическому соединению, включая без ограничения белки, пептиды, нуклеиновые кислоты (например, CpG-олигонуклеотиды), малые молекулы, вакцины, аллергенные экстракты, антитела, средства генной терапии, другие биологические препараты или малые молекулы.
Как используется в данном документе, термин "субъект" относится к любому организму, восприимчивому к связанным с инсулином нарушениям. Как будет понятно специалисту в данной области техники, термины "субъект" и "пациент" могут использоваться взаимозаменяемо. Например, субъектом может являться представитель млекопитающих, птичьих, членистоногих, хордовых, земноводных или рептилий. Иллюстративные субъекты включают без ограничения человека, примата, сельскохозяйственных животных (например, овцу, корову, курицу, лошадь, осла, свинью), домашних животных (например, собак, котов), лабораторных подопытных животных (например, мышей, кроликов, крыс, морских свинок, хомячков), дикое животное в неволе (например, лису, оленя). В одном примере субъектом является млекопитающее. В одном примере субъектом является человек.
Термин "лечение", как используется в данном документе, включает профилактику конкретного нарушения или состояния, или облегчение симптомов, ассоциированных с конкретным нарушением или состоянием, и/или предупреждение или устранение указанных симптомов. Например, как используется в данном документе, термин "лечение диабета", в целом, будет относиться к поддержанию уровней глюкозы в крови в пределах приемлемых уровней и может включать повышение или снижение уровней глюкозы в крови, в зависимости от рассматриваемой ситуации.
Как будет понятно специалисту в данной области техники, аналоги инсулина будут вводить в терапевтически эффективном количестве. Термины "эффективное количество" или "терапевтически эффективное количество", как используется в данном документе, относятся к количеству вводимого аналога инсулина, которое является достаточным для ослабления до некоторой степени одного или нескольких симптомов заболевания или состояния, в отношении которых осуществляется лечение. Результатом может быть уменьшение и/или ослабление признаков, симптомов или причин заболевания или любое другое требуемое изменение биологической системы. Например, в случае одного симптома это может быть предупреждение или лечение гипергликемии. "Эффективное количество" аналога инсулина представляет собой количество, эффективное для достижения требуемого фармакологического эффекта или улучшения в виде терапевтического эффекта без чрезмерных нежелательных побочных эффектов. Исключительно в качестве примера, терапевтически эффективные количества можно определять путем проведения стандартных экспериментов, включая без ограничения клиническое испытание с повышением дозы. Термин "терапевтически эффективное количество" включает, например, профилактически эффективное количество. Следует понимать, что "эффективное количество" или "терапевтически эффективное количество" может меняться для каждого конкретного субъекта вследствие отличий в метаболизме соединения в зависимости от возраста, веса, общего состояния здоровья субъекта, состояния, в отношении которого осуществляется лечение, тяжести состояния, в отношении которого осуществляется лечение, и решения лечащего врача. Таким образом, не всегда возможно указать точное "эффективное количество". Однако в каждом отдельном случае средний специалист в данной области техники может определить соответствующее "эффективное" количество с помощью стандартных экспериментов. Если применяют более одного терапевтического средства в комбинации, "терапевтически эффективное количество" каждого терапевтического средства может относиться к количеству терапевтического средства, которое будет терапевтически эффективным при его применении в отдельности, или оно может относиться к уменьшенному количеству, которое является терапевтически эффективным за счет его комбинации с одним или несколькими дополнительными терапевтическими средствами.
Термин "начало проявления" активности, как используется в данном документе, относится к промежутку времени, который проходит до того, как инсулин достигнет кровяного русла и начнет снижать уровни глюкозы в крови, "пик" относится к периоду времени, когда аналог инсулина наиболее эффективно снижает уровни глюкозы в крови, и "продолжительность" относится к тому, как долго инсулин продолжает действовать, т.е. снижать уровни глюкозы в крови. Специалисту в данной области техники известно, что начало проявления, пик и продолжительность действия аналога инсулина могут меняться в зависимости от таких факторов, как пациент, состояние пациента и путь введения.
Термин "IR", как используется в данном документе, включает IR дикого типа и его варианты, включая аллельные варианты, и встречающиеся в природе мутантные формы, и варианты, созданные способами генной инженерии. Для специалиста в данной области техники будет очевидно, что IR может быть получен от других видов, которые конкретно не раскрыты в данном документе. Кроме того, для специалиста в данной области техники не составит труда идентифицировать такой другой подходящий IR, учитывая известную консервативность последовательностей IR у организмов от примитивных до млекопитающих и людей.
Кристаллы инсулина из яда
В одном аспекте настоящее изобретение предусматривает кристалл, содержащий инсулин из яда. Как используется в данном документе, термин "кристалл" означает структуру (такую как трехмерный (3D) твердый агрегат), в которой плоские грани пересекаются под определенными углами и в которой наблюдается правильная структура (такая как внутренняя структура) из составляющих химических молекул. Термин "кристалл" относится, в частности, к твердой физической кристаллической форме, такой как экспериментально полученный кристалл.
Кристаллы согласно настоящему изобретению можно получать с применением инсулина из яда организмов рода Conus, таких как Conus geographus и Conus tulipa. Некоторые варианты осуществления относятся к видам инсулина из яда Conus geographus. Однако инсулин из яда может также быть получен от других видов. Как правило, эти виды инсулина содержат А-цепь из 20 аминокислот и В-цепь из 23 аминокислот, однако длина А- и В-цепей может варьировать. Аминокислоты в А- и В-цепях могут быть подвергнуты посттрансляционной модификации; приведенные в качестве примера посттрансляционные модификации включают без ограничения следующее: глутаминовая кислота может быть замещена γ-карбоксилированной глутаминовой кислотой (также называемой сопряженным основанием, представляющим собой гамма-карбоксиглутамат), пролин может быть замещен гидроксипролином, С-конец может подвергаться амидированию, цистеин может быть замещен селеноцистеином. Специалисту в данной области техники будет понятно, что возможны и другие посттрансляционные модификации.
В предпочтительном варианте осуществления инсулин из яда представляет собой Con-Ins G1 и имеет последовательность, показанную ниже: А-цепь:
GVVyHCCHRPCSNAEFKKYC* (SEQ ID NO: 22);
В-цепь:
TFDTOKHRCGSylTNSYMDLCYR (SEQ ID NO: 23),
где у представляет собой γ-карбоксилированную глутаминовую кислоту, О представляет собой гидроксипролин, и * С-конец А-цепи является амидированным. Однако полипептид, представляющий собой инсулин, можно также получить от другого вида или из отличной от нативной сконструированной последовательности.
Кристаллы можно получать из последовательностей дикого типа или их вариантов, включая встречающиеся в природе мутантные формы, а также варианты, созданные способами генной инженерии. Как правило, варианты имеют последовательность, идентичную на по меньшей мере 90, 95 или 98% соответствующей последовательности инсулина из яда дикого типа.
Получение кристалла, содержащего инсулин из яда, описано ниже.
В предпочтительных вариантах осуществления настоящее изобретение предусматривает кристалл Con-Ins G1, характеризующийся пространственной группой симметрии Р432 с размерами элементарной ячейки а=b=с=74,91 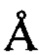 , при этом отклонение размера любой ячейки составляет не более приблизительно 2%.
, при этом отклонение размера любой ячейки составляет не более приблизительно 2%.
В предпочтительном варианте осуществления кристалл, содержащий инсулин из яда, характеризуется атомными координатами, изложенными в приложении I. Как используется в данном документе, термин "атомные координаты" относится к набору значений, которые определяют положение одного или нескольких атомов по отношению к системе координат. Специалистам в данной области техники будет понятно, что атомные координаты могут варьироваться, при этом не оказывая существенного влияния на точность моделей, полученных на их основе; таким образом, хотя настоящее изобретение предусматривает очень точное определение предпочтительной атомной структуры, следует понимать, что незначительные отклонения представляются возможными, и подразумевается, что такие отклонения охватываются формулой изобретения. Предпочтительными являются варианты, у которых среднеквадратическое отклонение (RMSD) координат х, у и z для всех атомов остова, отличных от атома водорода, составляет менее 2,0  (предпочтительно менее 1,5
(предпочтительно менее 1,5  , 1,3
, 1,3  , 1
, 1 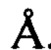 , 0,7
, 0,7 или менее 0, 3
или менее 0, 3  ) по сравнению с координатами, указанными в приложении I. Специалисты в данной области техники с легкостью поймут, что жесткое вращение и/или трансляция ЗВ-модели по атомным координатам не изменяет структуру рассматриваемой молекулы.
) по сравнению с координатами, указанными в приложении I. Специалисты в данной области техники с легкостью поймут, что жесткое вращение и/или трансляция ЗВ-модели по атомным координатам не изменяет структуру рассматриваемой молекулы.
Кристаллическая структура инсулина из яда
В дополнительных аспектах также предусмотрена кристаллическая структура инсулина из яда или его области. В некоторых вариантах осуществления инсулин из яда представляет собой Con-Ins G1. В некоторых вариантах осуществления кристаллическая структура инсулина из яда представляет собой структуру Con-Ins G1, определенную атомными координатами из приложения I.
Атомные координаты, полученные для инсулина из яда экспериментальным путем, показаны в приложении I. Однако специалисту в данной области будет понятно, что набор атомных координат, определенных с помощью рентгеновской кристаллографии, характеризуется стандартной ошибкой. Соответственно, любой набор структурных координат для инсулина из яда, который при наложении (используя атомы остова) на атомные координаты, перечисленные в приложении I, характеризуется среднеквадратическим отклонением атомов остова белка, составляющим менее 0,75  , будет считаться идентичным.
, будет считаться идентичным.
Настоящее изобретение также предусматривает атомные координаты инсулина из яда, которые практически соответствуют атомным координатам, перечисленным в приложении I. Структура, которая "практически соответствует" заданному набору атомных координат, представляет собой структуру, где по меньшей мере приблизительно 50% такой структуры характеризуется RMSD, составляющим менее приблизительно 2,0  для атомов остова в элементах вторичной структуры каждого домена, предпочтительно менее приблизительно 1,5
для атомов остова в элементах вторичной структуры каждого домена, предпочтительно менее приблизительно 1,5  для атомов остова в элементах вторичной структуры каждого домена, и более предпочтительно менее приблизительно 1,3
для атомов остова в элементах вторичной структуры каждого домена, и более предпочтительно менее приблизительно 1,3  для атомов остова в элементах вторичной структуры каждого домена, и еще более предпочтительно менее приблизительно 1,0
для атомов остова в элементах вторичной структуры каждого домена, и еще более предпочтительно менее приблизительно 1,0 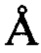 , менее приблизительно 0,7
, менее приблизительно 0,7 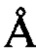 , менее приблизительно 0,5
, менее приблизительно 0,5 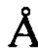 ., и наиболее предпочтительно менее приблизительно 0,3
., и наиболее предпочтительно менее приблизительно 0,3  для атомов остова в элементах вторичной структуры каждого домена.
для атомов остова в элементах вторичной структуры каждого домена.
В более предпочтительном варианте осуществления структура, которая практически соответствует заданному набору атомных координат, представляет собой структуру, где по меньшей мере приблизительно 75% такой структуры характеризуется упомянутым значением RMSD, и более предпочтительно по меньшей мере приблизительно 90% такой структуры характеризуется упомянутым значением RMSD, и наиболее предпочтительно приблизительно 100% такой структуры характеризуется упомянутым значением RMSD.
В еще более предпочтительном варианте осуществления вышеприведенное определение "практически соответствует" может быть расширено для включения атомов боковых цепей аминокислот. Как используется в данном документе, фраза "общие боковые цепи аминокислот" относится к боковым цепям аминокислот, которые являются общими как для структуры, которая практически соответствует заданному набору атомных координат, так и для структуры, которая фактически представлена такими атомными координатами.
Следует понимать, что набор атомных координат для полипептида представляет собой относительный набор точек, который определяет форму в трех измерениях. Таким образом, представляется возможным, что совершенно другой набор координат может определять подобную или идентичную форму. Более того, небольшие отклонения отдельных координат будут оказывать незначительное влияние на общую форму.
Отклонения в значениях координат могут возникать вследствие математических преобразований структурных координат. Например, структурные координаты, изложенные в приложении I, можно преобразовывать путем перестановки структурных координат на основании кристаллографических данных, разделения структурных координат, добавления целых чисел к наборам структурных координат или их вычитания, инверсии структурных координат или любой их комбинации.
В качестве альтернативы модификация в кристаллической структуре, обусловленная мутациями, добавлениями, заменами и/или делециями аминокислот или другими изменениями в любых компонентах, которые составляют кристалл, может также быть причиной отклонений в структурных координатах.
Для определения того, являются ли молекулярный комплекс или его часть достаточно подобными полной структуре вышеописанного инсулина из яда или ее частям, применяют различные вычислительные анализы. Такие анализы могут осуществляться с применением программного обеспечения, известного специалисту в данной области техники, например, PDBeFOLD (Krissinel и Henrick, 2004), DALI (Holm и  , 2010), LSQMAN (Kleywegt и Jones, 1994) и CHIMERA (Pettersen et al. 2004).
, 2010), LSQMAN (Kleywegt и Jones, 1994) и CHIMERA (Pettersen et al. 2004).
Сравнения, как правило, включают расчет оптимальных значений трансляции и вращения, необходимых для того, чтобы среднеквадратическое отклонение подгонки по указанным парам эквивалентных атомов представляло собой абсолютный минимум. Это число указывают в ангстремах. Соответственно, структурные координаты инсулина из яда, входящие в объем настоящего изобретения, включают структурные координаты, которые соотносятся с атомными координатами, перечисленными в приложение I, путем трансляций и/или вращений всего тела. Соответственно, исходя из вышеперечисленных значений RMSD, предполагается, что по меньшей мере атомы остова структур накладываются оптимальным образом, при этом для достижения оптимальной подгонки, необходимой для расчета значения RMSD, может потребоваться трансляция и/или вращение.
В некоторых вариантах осуществления также предусмотрены подмножества указанных атомных координат, перечисленных в приложение I, и подмножества, которые практически соответствуют им. Предпочтительные подмножества определяют одну или несколько областей инсулина из яда, например, (i) А-цепь, (ii) В-цепь, (iii) гидрофобную сердцевину (например, в Con-Ins G1 гидрофобная сердцевина содержит боковые цепи остатков ValA2, CysA6, CysA11, PheA16, TyrA19, ArgB6, IleB11, TyrB15 и LeuB18), (iv) PTM и остатки, взаимодействующие с РТМ, (v) рецептор-связывающую поверхность (например, IR-связывающую поверхность Con-Ins G1); (vi) TyrB15 и остатки, взаимодействующие с TyrB15; (vii) TyrB20 и остатки, взаимодействующие с TyrB20; (viii) PheA16 и остатки, взаимодействующие с PheA16, (ix) подмножества остатков, находящиеся в непосредственной близости от соответствующих концов А-цепи.
Трехмерную структуру инсулина из яда или его области, которая практически соответствует указанному набору атомных координат, можно смоделировать с помощью подходящей компьютерной программы для моделирования, такой как MODELER (Sali и Blundell, 1993), реализованной в пакете программного обеспечения для определения гомологии Insight II (Insight II (97.0), MSI, Сан-Диего), с применением информации, например, полученной из следующих данных: (1) аминокислотная последовательность инсулина из яда; (2) аминокислотная последовательность связанной(связанных) части(частей) белка, представленной(представленных) указанным набором атомных координат, характеризующихся трехмерной конфигурацией; и (3) атомные координаты указанной трехмерной конфигурации. Трехмерную структуру инсулина из яда, которая практически соответствует указанному набору атомных координат, можно также вычислить с помощью способа, такого как молекулярное замещение, который подробно описан ниже.
Как правило, структурные координаты/атомные координаты загружают на носитель, считываемый с помощью вычислительной машины, для последующей вычислительной обработки. Таким образом, модели и/или атомные координаты преимущественно хранят на носителях, считываемых с помощью вычислительной машины, таких как магнитные или оптические носители и запоминающее устройство с произвольным доступом или постоянное запоминающее устройство, включая ленты, дискеты, жесткие диски, CD-ROM и DVD, карты флэш-памяти или чипы, серверы и интернет. Вычислительная машина, как правило, представляет собой компьютер. Настоящее изобретение также предусматривает носитель, считываемый с помощью компьютера, на котором записаны данные, представляющие модель и/или атомные координаты Con-Ins G1. Также предусмотрены носители, считываемые с помощью компьютера, на которых записаны данные координат согласно приложению I или их подмножество или и то, и другое, где указанные данные координат определяют трехмерную структуру Con-Ins G1 или области Con-Ins G1.
Настоящее изобретение также предусматривает набор атомных координат, показанных в приложении I, или их подмножество или и то, и другое, при этом указанные координаты определяют трехмерную структуру инсулина из яда. Структурные координаты/атомные координаты можно применять на компьютере для получения представления, например изображения, трехмерной структуры кристалла инсулина улитки-конуса, которое можно вывести на экран компьютера и/или представить в электронном виде.
Структурные координаты/атомные координаты и модели, полученные на их основе, можно также применять для различных целей, таких как поиск новых лекарственных средств, подбор биологических реагентов (связывающего белка) и рентгеновский кристаллографический анализ других кристаллов белков. В одном аспекте предусмотрено применение структуры Con-Ins G1 в качестве структурной модели. В некоторых вариантах осуществления структурную модель можно применять для идентификации аналогов инсулина. Настоящее изобретение также охватывает аналоги инсулина, идентифицированные с применением структуры Con-Ins G1 в качестве структурной модели.
Трехмерную структуру Con-Ins G1 или его области можно применять для создания моделей, применимых для разработки лекарственных средств и осуществления скрининга in silico в отношении соединений-кандидатов, которые взаимодействуют с IR и/или модулируют его. При разработке модели можно также использовать другие физико-химические характеристики, например, образование связей, электростатические свойства и т.д.
В целом, термин "in silico" относится к созданию в компьютерной памяти, т.е., на кремниевом или другом подобном чипе. Если не указано иное, "in silico" означает "виртуальный". Предполагается, что термин "in silico", когда он используется в данном документе, относится к способам скрининга, основанным на применении компьютерных моделей, а не на экспериментах in vitro или in vivo.
Молекулярное замещение
Кристаллическую структуру Con-Ins G1, предусмотренную в данном документе, можно также применять для моделирования/решения структуры нового кристалла с помощью молекулярного замещения.
В некоторых аспектах настоящее изобретение также предусматривает применение структуры инсулина из яда или ее подмножества в качестве структурной модели.
В некоторых вариантах осуществления атомные координаты инсулина из яда, такие как изложенные в приложении I, или области инсулина из яда можно применять для определения по меньшей мере части трехмерной структуры молекулярного комплекса, который содержит по меньшей мере некоторые структурные признаки, подобные инсулину из яда. В частности, можно получать информацию о структуре другого кристаллизованного инсулина из яда или аналога инсулина. Это может быть достигнуто с помощью любой из ряда хорошо известных методик, включая молекулярное замещение.
Способы молекулярного замещения в целом известны специалистам в данной области техники, например, PHASER (McCoy et al. 2007). Способы молекулярного замещения в целом описаны в Brunger, 1997; Navaza и Saludjian, 1997; Tong и Rossmann, 1997; Bentley, 1997; Lattman, 1985; Rossmann, 1972.
В целом, в отношении кристалла кристаллизованной целевой структуры собирают данные дифракции рентгеновских лучей. Данные дифракции рентгеновских лучей преобразуют для расчета функции Паттерсона. Функцию Паттерсона кристаллизованной целевой структуры сравнивают с функцией Паттерсона, рассчитанной с использованием известной структуры (называемой в данном документе поисковой структурой). Функцию Паттерсона кристаллизованной целевой структуры вращают относительно функции Паттерсона поисковой структуры для определения правильной ориентации кристаллизованной целевой структуры в кристалле. Затем рассчитывают функцию трансляции для определения положения целевой структуры относительно осей кристалла. После размещения кристаллизованной целевой структуры в правильной ориентации в элементарной ячейке, можно рассчитать начальные фазы для экспериментальных данных. Эти фазы необходимы для расчета карты электронной плотности, с помощью которой можно установить структурные отличия и уточнить структуру. Предпочтительно структурные признаки (например, аминокислотная последовательность, консервативные дисульфидные связи и бета-тяжи или бета-складчатые слои) поисковой молекулы соотносятся с кристаллизованной целевой структурой.
Для карты электронной плотности можно, в свою очередь, применять любую хорошо известную методику построения модели и уточнения структуры с получением конечной точной структуры неизвестного кристаллизованного молекулярного комплекса (например, см. Jones et al. 1991; Brunger et al. 1998).
Получение точных значений для фаз с помощью способов, отличных от молекулярного замещения, является времязатратным процессом, который включает многократные циклы приближений и уточнений и в значительной степени затрудняет решение кристаллических структур. Однако, если решена кристаллическая структура белка, содержащего по меньшей мере некоторую гомологичную часть, фазы из известной структуры обеспечивают удовлетворительную оценку фаз неизвестной структуры. Путем применения молекулярного замещения все структурные координаты инсулина из яда, предусмотренные в данном документе (и изложенные в приложении I), или их часть можно применять для определения структуры кристаллизованной молекулы/молекулярного комплекса, структура которой/которого неизвестна, быстрее и эффективнее, чем при попытках определения такой информации ab initio.
С помощью этого способа можно установить структуру любой части любой кристаллизованной молекулы/молекулярного комплекса, которые характеризуются достаточной степенью гомологии с любой частью инсулина из яда. Этот способ особенно применим в отношении определения структуры аналогов инсулина, которые были сконструированы с применением способов, описанных в данном документе.
Все из молекул/молекулярных комплексов, упоминаемых в данном документе, можно изучать с применением хорошо известных методик дифракции рентгеновских лучей и можно уточнять относительно данных рентгеновского анализа с разрешением 1,5-3,5 А до значения R, составляющего приблизительно 0,25 или меньше, с применением компьютерного программного обеспечения, такого как X-PLOR (Йельский университет, распространяемое Molecular Simulations, Inc.; см. Brunger, 1996), REFMAC (Murshudov et al. 1997), PHENIX (Adams et al. 2010) и BUSTER (распространяемое Global Phasing Ltd, Bricogne et al. 2011). Таким образом, эту информацию можно применять для оптимизации известных аналогов инсулина, и, что более важно, для конструирования новых или улучшенных аналогов инсулина.
Способы кристаллизации инсулина из яда
Настоящее изобретение также предусматривает способ получения кристаллов, содержащих инсулин из яда. Кристаллические формы инсулина из яда, раскрытые в данном документе, можно получить с помощью следующих способов кристаллизации.
В одном аспекте настоящее изобретение предусматривает способ кристаллизации инсулина из яда, включающий стадии:
(a) получения водного раствора инсулина из яда;
(b) необязательного концентрирования раствора из стадии (а) и
(c) разбавления раствора из стадии (а) или стадии (b) раствором осаждающего средства таким образом, чтобы конечная концентрация инсулина из яда находилась в диапазоне от 0,5 мг/мл до 10 мг/мл.
Водный раствор инсулина из яда, полученный на стадии (а), может являться забуференным или незабуференным. Можно применять любой подходящий буфер, известный специалисту в данной области техники. Неограничивающие примеры для растворов инсулина из яда включают Tris-HCl, натрий-фосфатный и триэтаноламиновый буфер. В случае, если требуемое значение рН не получено, регулировку рН можно осуществлять путем добавления основания или кислоты, таких как хлорид аммония, ацетат натрия, гидроксид натрия, гидроксид калия или хлористоводородная кислота. Предпочтительно раствор из стадии (а) содержит 10 мМ HCl.
Необязательно раствор можно затем необязательно концентрировать. В некоторых вариантах осуществления раствор концентрируют путем фильтрования на центрифуге. Однако можно применять любую подходящую методику, известную специалисту в данной области техники. После стадии концентрирования (b) концентрация инсулина из яда должна находиться в диапазоне от 1,0 мг/мл до 20 мг/мл. Предпочтительно концентрация инсулина из яда составляет примерно 4,0 мг/мл. Эти значения представляют собой концентрацию инсулина из яда в конце стадии (b) перед разбавлением забуференным раствором осаждающего средства на стадии (с). Концентрацию инсулина из яда в концентрированном растворе из стадии (b), или в ходе концентрирования на стадии (b), или после концентрирования на стадии (b) можно определить, например, с помощью количественного анализа белков по Бредфорду или с помощью других стандартных способов, включая спектроскопию поглощения в УФ-области спектра.
На стадии (с) к раствору из стадии (b) добавляют раствор осаждающего средства. Предпочтительно раствор из стадии (b) разбавляют раствором осаждающего средства в соотношении, составляющем от 1:4 до 4:1 (раствор из стадии (b):забуференный раствор осаждающего средства), наиболее предпочтительно в соотношении 1:1.
Раствор осаждающего средства может содержать по меньшей мере одну малую органическую амфифильную молекулу и/или по меньшей мере одну неорганическую соль. В некоторых вариантах осуществления малая органическая амфифильная молекула может быть выбрана из группы, включающей глицерин, этиленгликоль, простой бутиловый эфир, бензамидин, диоксан, этанол, изопропанол, бутанол, пентанол, метилпентандиол, пентандиол, гександиол, гептандиол, дитиотреитол, MES, Tris, Tris-HCl, Bis-Tris, имидазол, бицин, триметиламин-N-оксид, янтарную кислоту, DL-малат, CHES, CAPS, глицин, CAPSO, ADA, MOPS, Bis-Tris-пропан, SPG, MIB, PCB, MMT, N-[2-гидроксиэтил]пиперазин-N'-[2-этансульфоновую кислоту] (HEPES), TRIS, сахарозу и их комбинации или состоящей из них. В предпочтительном варианте осуществления малая органическая амфифильная молекула включает DL-малат, TRIS и MES. В некоторых вариантах осуществления малая органическая амфифильная молекула может действовать в качестве буфера. В некоторых вариантах осуществления значение рН малых органических амфифильных молекул в растворе можно регулировать в диапазоне от приблизительно 2,0 до приблизительно 11,0 и до любого значения рН в этом диапазоне, например, 2,0, 2,5, 3,0, 3,5, 4,0, 4,5, 5,0, 5,5, 6,0, 6,5, 7,0, 7,5, 8,0, 8,5, 9,0, 9,5, 10,0, 10,5 и 11,0. В некоторых вариантах осуществления значение рН находится в диапазоне от приблизительно 8,0 до приблизительно 10,0. В предпочтительном варианте осуществления значение рН составляет 9,0.
В некоторых вариантах осуществления количество всех малых органических амфифильных молекул в растворе осаждающего средства находится в диапазоне от 1% вес/объем до 50% вес/объем, предпочтительно от 5% вес/объем до 20% вес/объем и более предпочтительно от 8% вес/объем до 12% вес/объем малой органической амфифильной молекулы по отношению к общему весу забуференного раствора осаждающего средства. В предпочтительном варианте осуществления забуференный раствор осаждающего средства содержит 10% вес/объем малой органической амфифильной молекулы.
Термин "по меньшей мере одна малая органическая амфифильная молекула" означает, что могут применяться смеси вышеупомянутых малых органических амфифильных молекул. В случае применения смесей малых органических амфифильных молекул используемое количество относится к общему количеству всех малых органических амфифильных молекул вместе.
Раствор осаждающего средства может также содержать неорганическую соль. В некоторых вариантах осуществления неорганические соли выбраны из группы, включающей хлорид аммония, сульфат аммония, ацетат аммония, фторид аммония, бромид аммония, йодид аммония, нитрид аммония, хлорид кадмия, сульфат кадмия, хлорид кальция, ацетат кальция, хлорид цезия, сульфат цезия, хлорид кобальта, хлорид трехвалентного железа, ацетат лития, хлорид лития, нитрат лития, сульфат лития, ацетат магния, формиат магния, нитрат магния, хлорид никеля, ацетат калия, бромид калия, фторид калия, формиат калия, йодид калия, нитрат калия, тиоцианат калия, тартрат калия/натрия, ацетат натрия, бромид натрия, фторид натрия, йодид натрия, нитрат натрия, фосфат натрия, сульфат натрия, тиоцианат натрия, хлорид цинка, сульфат цинка, ацетат цинка, хлорид магния, хлорид натрия, какодилат натрия, гидроксид натрия, хлорид калия, гидроксид калия, сульфат калия, ацетат натрия, тартрат натрия, формиат аммония, тартрат диаммония, малонат натрия, тартрат динатрия, сукцинат натрия и сукцинат натрия и их комбинации или состоящей из них. В предпочтительном варианте осуществления неорганическая соль представляет собой сульфат аммония.
В некоторых вариантах осуществления количество по меньшей мере одной неорганической соли в растворе осаждающего средства находится в диапазоне от приблизительно 50 мМ до приблизительно 4000 мМ, от приблизительно 1000 мМ до приблизительно 3000 мМ, от приблизительно 1500 мМ до приблизительно 2500 мМ или приблизительно 2000 мМ. В случае применения более одной неорганической соли вышеупомянутая концентрация относится к концентрации всех неорганических солей вместе, а не к концентрации каждой отдельной соли, используемой в смеси неорганических солей.
В некоторых вариантах осуществления раствор осаждающего средства может являться забуференным. Можно применять любой буфер, известный специалисту в данной области техники. В некоторых вариантах осуществления буфер содержит лимонную кислоту, ацетат натрия, цитрат натрия, какодилат натрия, HEPES натрия, TRIS HCl, CAPSO, CAPS, малат натрия, MES натрия и т.п. и их комбинации или состоит из них. В некоторых вариантах осуществления раствор осаждающего средства может характеризоваться значением рН в диапазоне от приблизительно 2,0 до приблизительно 11,0 и любым значением рН в этом диапазоне, например, 2,0, 2,5, 3,0, 3,5, 4,0, 4,5, 5,0, 5,5, 6,0, 6,5, 7,0, 7,5, 8,0, 8,5, 9,0, 9,5, 10,0, 10,5 и 11,0. В некоторых вариантах осуществления раствор осаждающего средства может характеризоваться значением рН в диапазоне от приблизительно 8,0 до приблизительно 10,0. В предпочтительном варианте осуществления раствор осаждающего средства может характеризоваться значением рН, составляющим 9,0.
В некоторых вариантах осуществления забуференный раствор осаждающего средства содержит более 1 М по меньшей мере одной неорганической соли и/или от 5% по весу до 20% по весу по меньшей мере одной малой органической амфифильной молекулы. В предпочтительном варианте осуществления раствор осаждающего средства содержит 2,0 М сульфата аммония и 10% DL-малат-MES-Tris (рН 9,0).
Теоретически по меньшей мере одно осаждающее средство в разбавленном растворе из стадии (с) конкурирует с молекулами белка за воду, что приводит к перенасыщению белка. В норме кристаллы могут расти только из перенасыщенных состояний, и, таким образом, они могут расти из осадков. Соли, полимеры и органические растворители являются подходящими осаждающими средствами. В дополнение к вышеперечисленным компонентам забуференного раствора осаждающего средства раствор из стадии (с) может содержать дополнительные осаждающие средства.
В некоторых вариантах осуществления для кристаллизации применяют способы висячей капли или сидячей капли. Методика "висячей капли посредством диффузии в парах" является наиболее популярным способом кристаллизации макромолекул. С помощью этого способа каплю, состоящую из смеси образца и реагента, подвергают уравновешиванию посредством испарения с резервуаром с жидкостью, представляющей собой реагент. Как правило, капля содержит реагент в более низкой концентрации, чем таковая в резервуаре. Для достижения равновесия водяной пар покидает каплю и в конечном итоге попадает в резервуар. Поскольку вода покидает каплю, происходит увеличение относительного перенасыщения образца. При переходе воды из капли в резервуар увеличивается концентрация как образца, так и реагента. Равновесие достигается, когда концентрация реагента в капле является примерно такой же, как в резервуаре.
Аналоги инсулина
Инсулин дикого типа содержит пептид, представляющий собой А-цепь, и пептид, представляющий собой В-цепь. А-цепь человеческого инсулина дикого типа представлена последовательностью GIVEQCCTSICSLYQLENYCN (SEQ ID NO: 24). В-цепь человеческого инсулина дикого типа представлена последовательностью FVNQHLCGSHLVEALYLVCGERGFFYTPKT (SEQ ID NO: 25).
Авторы настоящего изобретения определили трехмерную структуру Con-G1 Ins, мономерного инсулина, в котором отсутствует эквивалентный человеческому инсулину триплет ароматических аминокислот PheB24-PheB25-TyrB26. Не ограничиваясь теорией, полагают, что боковая цепь TyrB15 может компенсировать отсутствие критически важного в отношении вовлечения IR остатка PheB24 человеческого инсулина. Также полагают, что боковая цепь TyrB20 Con-Ins G1 может быть вовлечена в компенсацию отсутствия эквивалентного человеческому инсулину PheB24. Потенциальную важность этих остатков нельзя предсказать на основании анализа последовательности. Полученные результаты в отношении структуры, представленные в данном документе, обеспечивают основание для разработки нового класса терапевтических аналогов человеческого инсулина, которые по своей природе являются мономерными и быстродействующими.
В одном аспекте настоящее изобретение предусматривает аналог инсулина, содержащий пептид, представляющий собой А-цепь, и пептид, представляющий собой В-цепь, где В-цепь содержит ароматический или большой алифатический остаток в положении, соответствующем аминокислоте номер 15 в В-цепи человеческого инсулина, и/или ароматический или большой алифатический остаток в положении, соответствующем аминокислоте номер 20 в В-цепи человеческого инсулина, где аналог содержит по меньшей мере одну аминокислоту, которая встречается в человеческом инсулине, но отсутствует в соответствующем положении инсулина из Conus geographus, и где пептид, представляющий собой А-цепь, и пептид, представляющий собой В-цепь, связаны друг с другом посредством по меньшей мере одной пары цистеиновых остатков. В некоторых вариантах осуществления ароматический остаток или большой алифатический остаток может представлять собой встречающуюся в природе или не встречающуюся в природе аминокислоту.
На основании структуры сокристалла комплекса инсулин-IR обнаружили, что боковая цепь PheB24 играет уникальную роль в качестве "якоря" в неполярном кармане (называемом относящимся к В24 карманом связывания), образованном с помощью IR и В-цепи инсулина (Meriting et al. 2014). Не ограничиваясь теорией, настоящее изобретение предполагает, что замены с помощью большого алифатического или ароматического остатка в положении 15 и/или положении 20 В-цепи человеческого инсулина могут компенсировать отсутствие PheB24 путем встраивания в относящийся к В24 карман связывания. Предполагается, что боковые цепи большого алифатического или ароматического остатков могут являться физически и химически совместимыми с относящимся к В24 карманом связывания.
В некоторых вариантах осуществления ароматический или большой алифатический остаток в положении, соответствующем аминокислоте номер 15 в В-цепи человеческого инсулина, выбран из группы, состоящей из тирозина, фенилаланина, 4-метилфенилаланина, гистидина, триптофана, метионина, циклопентилаланина и циклогексилаланина. В некоторых вариантах осуществления ароматический или большой алифатический остаток в положении, соответствующем аминокислоте номер 20 в В-цепи человеческого инсулина, выбран из группы, состоящей из тирозина, фенилаланина, 4-метилфенилаланина, гистидина, триптофана, метионина, циклопентилаланина и циклогексилаланина. Ароматический или большой алифатический остаток может представлять собой встречающуюся в природе или не встречающуюся в природе аминокислоту.
В некоторых вариантах осуществления В-цепь содержит ароматический остаток в положении, соответствующем аминокислоте номер 15 в В-цепи человеческого инсулина, и/или ароматический остаток в положении, соответствующем аминокислоте номер 20 в В-цепи человеческого инсулина. Ароматический остаток может представлять собой встречающуюся в природе или не встречающуюся в природе аминокислоту. Например, ароматическая аминокислота может представлять собой тирозин, фенилаланин, триптофан, гистидин, 4-ацетилфенилаланин и т.п.
В некоторых вариантах осуществления аналог инсулина содержит тирозин в положении, соответствующем аминокислоте номер 15 в В-цепи человеческого инсулина. В некоторых вариантах осуществления аналог инсулина содержит тирозин в положении, соответствующем аминокислоте номер 20 в В-цепи человеческого инсулина. В некоторых вариантах осуществления аналог инсулина содержит тирозин в положении, соответствующем аминокислоте номер 15 в В-цепи человеческого инсулина, и/или тирозин в положении, соответствующем аминокислоте номер 20 в В-цепи человеческого инсулина. В некоторых вариантах осуществления аналог инсулина содержит фенилаланин в положении, соответствующем аминокислоте номер 15 в В-цепи человеческого инсулина, и/или фенилаланин в положении, соответствующем аминокислоте номер 20 в В-цепи человеческого инсулина. В некоторых вариантах осуществления аналог инсулина содержит триптофан в положении, соответствующем аминокислоте номер 15 в В-цепи человеческого инсулина, и/или триптофан в положении, соответствующем аминокислоте номер 20 в В-цепи человеческого инсулина. В некоторых вариантах осуществления аналог инсулина содержит 4-ацетилфенилаланин в положении, соответствующем аминокислоте номер 15 в В-цепи человеческого инсулина, и/или 4-ацетилфенилаланин в положении, соответствующем аминокислоте номер 20 в В-цепи человеческого инсулина.
В некоторых вариантах осуществления В-цепь содержит большой алифатический остаток в положении, соответствующем аминокислоте номер 15 в В-цепи человеческого инсулина, и/или большой алифатический остаток в положении, соответствующем аминокислоте номер 20 в В-цепи человеческого инсулина. Как используется в данном документе, "большой алифатический" остаток имеет боковую цепь, которая больше, чем боковая цепь лейцина (встречающегося в природе в человеческом инсулине в положении 15 и 20). Например, в некоторых вариантах осуществления боковая цепь большого алифатического остатка может содержать такое же или большее число атомов, отличных от водорода, по сравнению с лейцином. В некоторых вариантах осуществления боковая цепь большого алифатического остатка характеризуется большим объемом боковой цепи по сравнению с лейцином. В некоторых вариантах осуществления боковая цепь большого алифатического остатка имеет большую молекулярную массу по сравнению с лейцином. В некоторых вариантах осуществления боковая цепь большого алифатического остатка характеризуется большей конформационной гибкостью по сравнению с лейцином. "Большой алифатический" остаток может представлять собой встречающуюся в природе аминокислоту или может представлять собой не встречающуюся в природе аминокислоту. Например, большой алифатический остаток может представлять собой метионин, изолейцин, циклопентилаланин или циклогексилаланин и т.п.
В некоторых вариантах осуществления аналог инсулина содержит метионин в положении, соответствующем аминокислоте номер 15 в В-цепи человеческого инсулина. В некоторых вариантах осуществления аналог инсулина содержит метионин в положении, соответствующем аминокислоте номер 20 в В-цепи человеческого инсулина. В некоторых вариантах осуществления аналог инсулина содержит циклогексилаланин в положении, соответствующем аминокислоте номер 15 в В-цепи человеческого инсулина, и/или циклогексилаланин в положении, соответствующем аминокислоте номер 20 в В-цепи человеческого инсулина. В некоторых вариантах осуществления аналог инсулина содержит циклопентилаланин в положении, соответствующем аминокислоте номер 15 в В-цепи человеческого инсулина, и/или циклопентилаланин в положении, соответствующем положению 20 в В-цепи человеческого инсулина.
В некоторых вариантах осуществления аналоги инсулина содержат модифицированные В цепи, в которых отсутствует триплет ароматических аминокислот PheB24-PheB25-TyrB26, считающийся важным для связывания IR, и в большинстве случаев содержат более короткие В-цепи по сравнению с человеческим инсулином. В некоторых вариантах осуществления В-цепь усечена по С-терминальному концу по сравнению с человеческим инсулином. В некоторых вариантах осуществления в В-цепи отсутствуют одна или несколько из девяти С-концевых аминокислот человеческого инсулина, например, в В-цепи отсутствуют одна, две, три, четыре, пять, шесть, семь, восемь или девять С-концевых аминокислот человеческого инсулина. В некоторых вариантах осуществления в В-цепи отсутствует по меньшей мере PheB24 человеческого инсулина. В некоторых вариантах осуществления в В-цепи отсутствует по меньшей мере триплет ароматических аминокислот человеческой В-цепи (аминокислоты PheB24-PheB25-TyrB26 человеческого инсулина). Эти остатки могут отсутствовать или могут быть заменены таким образом, что аминокислоты в положениях, соответствующих аминокислотам номер 24, 25 и/или 26 в В-цепи человеческого инсулина, не представляют собой фенилаланин, фенилаланин или тирозин соответственно.
В некоторых вариантах осуществления аналог инсулина содержит пептид, представляющий собой А-цепь, содержащий последовательность
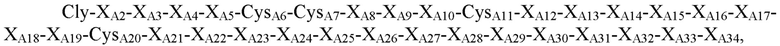
где ХА2=Val или Ile; ХА3=Val или Ala; ХА4=Glu, Asp, гамма-карбоксиглутамат или Cys; ХА5=Gln, Glu, гамма-карбоксиглутамат, His или Val; CysA6, CysA7 и CysA11 независимо представляют собой Cys или селеноцистеин; XA8=Thr, His, Asp, Gln, Tyr, Lys, Ala или Val; XA9=Ser, Arg, Asn, Gly, His или Lys; XA10=Ile, Pro, Tyr, Ala, Ser, Val, Phe, His или Thr; XA12=Ser или Thr; XA13=Leu, Asn, Val, Arg или Asp; XA14; Tyr, Ala, Gln, His, Asp или Glu; XA15=Gln, Glu или Thr; XA16=Phe, Leu или Ala; XA17=Glu, Gln, Lys, Arg, Ile, Met, Thr или Ser; XA18=Lys, Ser, Thr, Asn, Gln или Glu; XA19=Tyr или Phe; CysA20=Cys, селеноцистеин, амидированный Cys или амидированный селеноцистеин; XA21=Asn, Pro, His, Ser, Gly, Ala или отсутствует; XA22=Pro, Asn, Thr, Leu, Ser или отсутствует; XA23=Thr, Leu, Val, Ser или отсутствует; XA24=Arg, Thr, Met, Gln, Leu или отсутствует; XA25=Glu, Gly или отсутствует; XA26=Ser, Leu или отсутствует; XA27-XA31 независимо представляют собой Ser или отсутствуют; XA32=Ala, Ser или отсутствует; XA33=Ala, Val или отсутствует; и XA34=Ala или отсутствует (SEQ ID NO: 1); и
пептид, представляющий собой В-цепь, содержащий последовательность
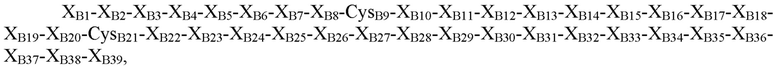
где XB1=Thr, Asn, Ser или отсутствует; ХВ2=Phe, Ser, Asn, Thr, Gln или отсутствует; ХВ3=Ala, Asp, Gly, Pro, Leu, Phe или His; ХВ4=Ala, Thr, Pro, Asp, Val или Gly; XB5=Asn, Pro, His, Thr, Arg, Lys, Ser или гидроксипролин; ХВ6=Lys, Glu, Asn, Asp, Arg, Gln или Gly; ХВ7=His, Tyr, Arg или Ile; XB8=Arg, Thr, Ile, Ser, Leu, Tyr или Lys; CysB9=Cys или селеноцистеин; ХВ10=Gly, Gln или Asp; ХВ11=Ser, Leu, Gly или Pro; XB12=His, Glu, гамма-карбоксиглутамат, Asp или Asn; ХВ13=Ile, Leu, Asp, Val или Ala; XB14=Thr, Ala, Pro, Val или Arg; XB15=Asn, Asp, Ala, Val, Thr, Pro или Glu; XB16=Ala, Ser, Gln, His, Thr, Tyr, Arg или Gly; ХВ17=Thr, Tyr, Pro, Leu или Gly; XB18=Tyr, Met, Val, Gln, Ile, Asp, Gly, Asn или Leu; XB19=Leu, Asp, Gln, Gly, Lys, Glu, Arg, Ser или Thr; ХВ20=Val, Leu или Lys; CB21=Cys, амидированный Cys, селеноцистеин или амидированный селеноцистеин; ХВ22=Val, Tyr, Phe, His, Gly, Gln, Leu, амидированный His, амидированный Val или отсутствует; ХВ23=Glu, Asp, Arg, Ser, Gly или отсутствует; ХВ24=Arg, Asp, Val или отсутствует; ХВ25=Gly, Leu, Val или отсутствует; ХВ26=Phe, Val, Ile или отсутствует; ХВ27=Phe, Asn, Pro, Glu или отсутствует; ХВ28=Tyr, Cys, His или отсутствует; ХВ29=Thr, His, Ile, Leu, Ser, Tyr или отсутствует; ХВ30=Pro, Glu, Leu, Ile, Arg или отсутствует; ХВ31=Ile, Lys или отсутствует; ХВ32=Ala, Asp, Ser, Thr, Lys, Leu, Gln или отсутствует; ХВ33=Cys или отсутствует; ХВ34=Glu, Pro, Val или отсутствует; ХВ35=Glu, Gly или отсутствует; ХВ36=Glu, Gly или отсутствует; ХВ37=Glu, Val или отсутствует; ХВ38=Ala, Asp или отсутствует; и ХВ39=Ala или отсутствует (SEQ ID NO: 2).
В некоторых вариантах осуществления аналог инсулина содержит пептид, представляющий собой В-цепь, содержащий последовательность
где XB1=Thr, Asn, Ser или отсутствует; ХВ2=Phe, Ser, Asn, Thr, Gln или отсутствует; ХВ3=Asp, Gly, Pro, Leu, Phe или His; ХВ4=Thr, Pro, Asp, Val или Gly; XB5=Asn, Pro, His, Thr, Arg, Ser или гидроксипролин; ХВ6=Lys, Glu, Asn, Asp, Arg, Gln или Gly; ХВ7=His, Tyr, Arg или Ile; XB8=Arg, Thr, Ile, Ser, Leu, Tyr или Lys; CysB9=Cys или селеноцистеин; XB10=Gly, Gln или Asp; XB11=Ser, Leu, Gly или Pro; XB12=His, Glu, гамма-карбоксиглутамат, Asp или Asn; ХВ13=Ile, Leu, Asp, Val или Ala; XB14=Thr, Ala, Pro, Val или Arg; XB15=Asn, Asp, Ala, Val, Thr, Pro или Glu; XB16=Ala, Ser, Gln, His, Tyr, Arg или Gly; ХВ17=Tyr или Leu; XB18=Tyr, Met, Val, Gln, Ile, Asp, Gly, Asn или Leu; XB19=Leu, Asp, Gln, Gly, Lys, Glu, Arg или Thr; ХВ20=Val, Leu или Lys; CB21=Cys, амидированный Cys, селеноцистеин или амидированный селеноцистеин; ХВ22=Tyr, Phe или His; ХВ23=Glu, Arg, Ser, Gly или отсутствует; ХВ24=Arg, Asp, Val или отсутствует; ХВ25=Gly, Leu, Val или отсутствует; ХВ26=Phe, Val, Не или отсутствует; ХВ27=Phe, Asn, Pro, Glu или отсутствует; ХВ28=Tyr, Cys, His или отсутствует; ХВ29=Thr, His, Leu, Tyr или отсутствует; ХВ30=Pro, Glu, Leu, Не, Arg или отсутствует; ХВ31=Ile, Lys или отсутствует; ХВ32=Thr, Lys, Leu, Gln или отсутствует; ХВ33=Cys или отсутствует; ХВ34=Glu, Pro, Val или отсутствует; ХВ35=Glu, Gly или отсутствует; ХВ36=Glu, Gly или отсутствует; ХВ37=Glu, Val или отсутствует; ХВ38=Ala, Asp или отсутствует; и ХВ39=Ala или отсутствует (SEQ ID NO: 3).
В некоторых вариантах осуществления аналог инсулина содержит пептид, представляющий собой В-цепь, содержащий последовательность
где XB1=Thr, Asn, Ser или отсутствует; ХВ2=Phe, Ser, Asn, Thr, Gln или отсутствует; ХВ3=Asp, Gly, Pro, Leu, Phe или His; ХВ4=Thr, Pro, Asp, Val или Gly; XB5=Asn, Pro, His, Thr, Arg, Ser или гидроксипролин; ХВ6=Lys, Glu, Asn, Asp, Arg, Gln или Gly; ХВ7=His, Tyr, Arg или Ile; XB8=Arg, Thr, Ile, Ser, Leu, Tyr или Lys; CysB9=Cys или селеноцистеин; XB10=Gly, Gln или Asp; ХВ11=Ser, Leu, Gly или Pro; XB12=His, Glu, гамма-карбоксиглутамат, Asp или Asn; ХВ13=Ile, Leu, Asp, Val или Ala; XB14=Thr, Ala, Pro, Val или Arg; XB15=Asn, Asp, Ala, Val, Thr, Pro или Glu; XB16=Ala, Ser, Gln, His, Tyr, Arg или Gly; ХВ17=Tyr или Leu; XB18=Tyr, Met, Val, Gln, Ile, Asp, Gly, Asn или Leu; XB19=Leu, Asp, Gln, Gly, Lys, Glu, Arg или Thr; ХВ20=Val, Leu или Lys; СВ21=Cys, амидированный Cys, селеноцистеин или амидированный селеноцистеин; ХВ22=Tyr, Phe или His; ХВ23=Glu, Arg, Ser, Gly или отсутствует; и ХВ24, ХВ25, ХВ26, ХВ27, ХВ28, ХВ29, ХВ30, ХВ31 ХВ32, ХВ33, ХВ34, ХВ35, ХВ36, ХВ37, ХВ38 и ХВ39 отсутствуют (SEQ ID NO: 4).
В некоторых вариантах осуществления аналог инсулина содержит пептид, представляющий собой В-цепь, содержащий последовательность
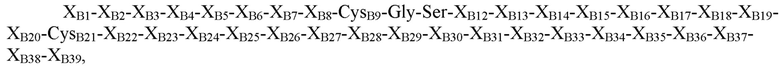
где XB1=Thr, Asn, Ser или отсутствует; ХВ2=Phe, Ser, Asn, Thr, Gln или отсутствует; ХВ3=Asp, Gly, Pro, Leu, Phe или His; ХВ4=Thr, Pro, Asp, Val или Gly; XB5=Asn, Pro, His, Thr, Arg, Ser или гидроксипролин; ХВ6=Lys, Glu, Asn, Asp, Arg, Gln или Gly; ХВ7=His, Tyr, Arg или Ile; XB8=Arg, Thr, Ile, Ser, Leu, Tyr или Lys; CysB9=Cys или селеноцистеин; ХВ12=His, Glu, гамма-карбоксиглутамат, Asp или Asn; ХВ13=Ile, Leu, Asp, Val или Ala; XB14=Thr, Ala, Pro, Val или Arg; XB15=Asn, Asp, Ala, Val, Thr, Pro или Glu; XB16=Ala, Ser, Gln, His, Tyr, Arg или Gly; ХВ17=Tyr или Leu; XB18=Tyr, Met, Val, Gln, Ile, Asp, Gly, Asn или Leu; XB19=Leu, Asp, Gln, Gly, Lys, Glu, Arg или Thr; ХВ20=Val, Leu или Lys; СВ21=Cys, амидированный Cys, селеноцистеин или амидированный селеноцистеин; ХВ22=Tyr, Phe или His; ХВ23=Glu, Arg, Ser, Gly или отсутствует; ХВ24=Arg, Asp, Val или отсутствует; ХВ25=Gly, Leu, Val или отсутствует; ХВ26=Phe, Val, Ile или отсутствует; ХВ27=Phe, Asn, Pro, Glu или отсутствует; ХВ28=Tyr, Cys, His или отсутствует; ХВ29=Thr, His, Leu, Tyr или отсутствует; ХВ30=Pro, Glu, Leu, Ile, Arg или отсутствует; ХВ31=Ile, Lys или отсутствует; ХВ32=Thr, Lys, Leu, Gln или отсутствует; ХВ33=Cys или отсутствует; ХВ34=Glu, Pro, Val или отсутствует; ХВ35=Glu, Gly или отсутствует; ХВ36=Glu, Gly или отсутствует; ХВ37=Glu, Val или отсутствует; ХВ38=Ala, Asp или отсутствует; и ХВ39=Ala или отсутствует (SEQ ID NO: 5).
В некоторых вариантах осуществления аналог инсулина содержит пептид, представляющий собой В-цепь, содержащий последовательность
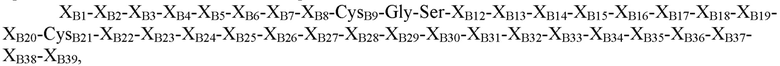
где XB1=Thr, Asn, Ser или отсутствует; ХВ2=Phe, Ser, Asn, Thr, Gln или отсутствует; ХВ3=Asp, Gly, Pro, Leu, Phe или His; ХВ4=Thr, Pro, Asp, Val или Gly; XB5=Asn, Pro, His, Thr, Arg, Ser или гидроксипролин; ХВ6=Lys, Glu, Asn, Asp, Arg, Gln или Gly; ХВ7=His или Tyr; XB8=Arg, Thr, Ile, Ser, Leu, Tyr или Lys; CysB9=Cys или селеноцистеин; ХВ12=His, Glu, гамма-карбоксиглутамат, Asp или Asn; ХВ13=Ile, Leu, Asp, Val или Ala; XB14=Thr, Ala, Pro, Val или Arg; XB15=Asn, Asp, Ala, Val, Thr, Pro или Glu; XB16=Ala, Ser, Gln, His, Tyr, Arg или Gly; ХВ17=Tyr или Leu; XB18=Tyr, Met, Val, Gln, Ile, Asp, Gly, Asn или Leu; XB19=Leu, Asp, Gln, Gly, Lys, Glu, Arg или Thr; ХВ20=Val или Leu; CB21=Cys, амидированный Cys, селеноцистеин или амидированный селеноцистеин; ХВ22=Tyr, Phe или His; ХВ23=Glu, Arg, Ser, Gly или отсутствует; ХВ24=Arg, Asp, Val или отсутствует; ХВ25=Gly, Leu, Val или отсутствует; ХВ26=Phe, Val, Ile или отсутствует; ХВ27=Phe, Asn, Pro, Glu или отсутствует; ХВ28=Tyr, Cys, His или отсутствует; ХВ29=Thr, His, Leu, Tyr или отсутствует; ХВ30=Pro, Glu, Leu, Ile, Arg или отсутствует; ХВ31=Ile, Lys или отсутствует; ХВ32=Thr, Lys, Leu, Gln или отсутствует; ХВ33=Cys или отсутствует; ХВ34=Glu, Pro, Val или отсутствует; ХВ35=Glu, Gly или отсутствует; ХВ36=Glu, Gly или отсутствует; ХВ37=Glu, Val или отсутствует; ХВ38=Ala, Asp или отсутствует; и ХВ39=Ala или отсутствует (SEQ ID NO: 6).
В некоторых вариантах осуществления аналог инсулина содержит пептид, представляющий собой В-цепь, содержащий последовательность ХВ1-ХВ2-ХВ3-ХВ4-ХВ5-XB6-XB7-XB8-CysB9-Gly-Ser-XB12-XB13-XB14-XB15-XB16-XB17-XB18-XB19-XB20-CysB21-XB22-ХВ23, где XB1=Thr, Asn или отсутствует; ХВ2=Phe, Ser или отсутствует; ХВ3=Phe или Asp; ХВ4=Thr или Val; XB5=Pro, Asn или гидроксипролин; ХВ6=Lys, Asn или Gln; ХВ7=His или Tyr; XB8=Arg, Ile или Leu; ХВ12=His, Asp, Glu или гамма-карбоксиглутамат; CysB9=Cys или селеноцистеин; ХВ13=Val, Ile или Leu; ХВ14=Thr, Ala, Pro или Val; XB15=Glu, Val, Asn или Asp; XB16=Ser, Gln, Tyr или Ala; ХВ17=Tyr или Leu; XB18=Tyr, Asp, Met или Val; XB19=Leu, Asp, Gln или Lys; ХВ20=Leu или Val; CysB21=Cys, амидированный Cys, селеноцистеин или амидированный селеноцистеин; ХВ22=Tyr или Gly; и ХВ23=Glu, Arg, Gly или отсутствует (SEQ ID NO: 7).
В некоторых вариантах осуществления аналог инсулина содержит пептид, представляющий собой В-цепь, содержащий последовательность ХВ1-ХВ2-ХВ3-ХВ4-ХВ5-XB6-His-XB8-CysB9-Gly-Ser-XB12-XB13-XB14-XB15-XB16-XB17-XB18-XB19-XB20-CysB21-XB22-ХВ23, где ХВ1=Thr или отсутствует; ХВ2=Thr или отсутствует; ХВ3=Phe или Asp; ХВ4=Thr или Val; XB5=Pro, Asn или гидроксипролин; ХВ6=Lys или Gln; XB8=Arg или Leu; XB12=His, Glu или гамма-карбоксиглутамат; ХВ13=Ile или Leu; ХВ14=Thr или Val; XB15=Glu или Asn; XB16=Ser или Ala; ХВ17=Tyr или Leu, XB18=Tyr или Met; XB19=Leu или Asp, ХВ20=Leu или Val; ХВ22=Tyr; и ХВ23=Glu или Arg (SEQ ID NO: 8).
В некоторых вариантах осуществления остатки в положениях ХВ17 и ХВ22 представляют собой тирозин. В некоторых вариантах осуществления ХВ22 представляет собой Tyr. В некоторых вариантах осуществления ХВ17 представляет собой Tyr.
В некоторых вариантах осуществления аналог инсулина содержит пептид, представляющий собой А-цепь, содержащий последовательность
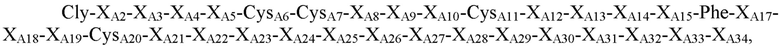
где XA2=Val или Ile; XA3=Val или Ala; XA4=Glu, гамма-карбоксиглутамат или Cys; XA5=Gln, Glu, гамма-карбоксиглутамат, His или Val; CysA6, CysA7 и CysA11 независимо представляют собой Cys или селеноцистеин; XA8=Thr, His, Asp, Gln, Tyr, Lys или Val; XA9=Ser, Arg, Asn, His или Lys; XA10=Ile, Pro, Tyr, Ala, Ser, Phe, His или Thr; XA12=Ser или Thr; XA13=Leu, Asn, Val или Asp; XA14=Tyr, Ala, Gln, Asp или Glu; XA15=Gln, Glu, или Thr; или Ala; XA17=Glu, Lys, Arg, Ile, Met, Thr или Ser; XA18=Lys, Thr, Asn, Gln или Glu; XA19=Tyr или Phe; CysA20=Cys, селеноцистеин, амидированный Cys или амидированный селеноцистеин; XA21=Asn, Pro, His, Ser, Gly, Ala или отсутствует; XA22=Pro, Asn, Thr, Leu, Ser или отсутствует; XA23=Thr, Leu, Val, Ser или отсутствует; XA24=Arg, Thr, Met, Gln, Leu или отсутствует; XA25=Glu, Gly или отсутствует; XA26=Ser, Leu или отсутствует; XA27-XA31 независимо представляют собой Ser или отсутствуют; XA32=Ala, Ser или отсутствует; XA33=Ala, Val или отсутствует; и XA34=Ala или отсутствует (SEQ ID NO: 9).
В некоторых вариантах осуществления аналог инсулина содержит пептид, представляющий собой А-цепь, содержащий последовательность Gly-XA2-Val-XA4-XA5-CysA6-CysA7-XA8-XA9-XA10-CysA11-Ser-XA13-XA14-XA15-XA16-XA17-XA18-Tyr-CysA20-XA21, где XA2 представляет собой Val или Ile, XA4 представляет собой Glu или гамма-карбоксиглутамат, XA5 представляет собой His или Gln, XA8 представляет собой His или Thr, XA9 представляет собой Arg или Ser, XA10 представляет собой Pro или Ile, XA13 представляет собой Asn или Leu, XA14 представляет собой Ala или Tyr, XA15 представляет собой Glu или Gln, XA16 представляет собой Phe или Leu, XA17 представляет собой Lys или Glu, XA18 представляет собой Lys или Asn, и XA21 представляет собой Asn или отсутствует (SEQ ID NO: 10); и
пептид, представляющий собой В-цепь, содержащий последовательность XB1-XB2-XB3-XB4-XB5-XB6-His-XB8-CysB9-Gly-Ser-XB12-XB13-XB14-XB15-XB16-XB17-XB18-XB19-XB20-CysB21-XB22-XB23, где XB1=Thr или отсутствует; XB2=Phe или отсутствует; XB3=Phe или Asp; XB4=Thr или Val; XB5=Pro, Asn или гидроксипролин; XB6=Lys или Gln; XB8=Arg или Leu; XB12=His, Glu или гамма-карбоксиглутамат; XB13=Ile или Leu; XB14=Thr или Val; XB15=Glu или Asn; XB16=Ser или Ala; XB17=Tyr или Leu; XB18=Tyr или Met; XB19=Leu или Asp, XB20=Leu или Val; XB22=Gly или Tyr; и XB23=Glu или Arg (SEQ ID NO: 11).
В некоторых вариантах осуществления аналог инсулина содержит пептид, представляющий собой А-цепь, содержащий последовательность Gly-XA2-Val-XA4-XA5-CysA6-CysA7-XA8-XA9-XA10-CysA11-Ser-XA13-XA14-XA15-Phe-XA17-XA18-Tyr-CysA20-XA21, где XA2 представляет собой Val или Ile, XA4 представляет собой Glu или гамма-карбоксиглутамат, XA5 представляет собой His или Gln, XA8 представляет собой His или Thr, XA9 представляет собой Arg или Ser, XA10 представляет собой Pro или Ile, XA13 представляет собой Asn или Leu, XA14 представляет собой Ala или Tyr, XA15 представляет собой Glu или Gln, XA17 представляет собой Lys или Glu, XA18 представляет собой Lys или Asn, и XA21 представляет собой Asn или отсутствует (SEQ ID NO: 12); и пептид, представляющий собой В-цепь, содержащий последовательность XB1-XB2-XB3-XB4-XB5-XB6-His-XB8-CysB9-Gly-Ser-XB12-XB13-XB14-XB15-XB16-XB17-XB18-XB19-XB20-CysB21-Tyr-XB23, где XB1=Thr или отсутствует; XB2=Phe или отсутствует; XB3=Phe или Asp; XB4=Thr или Val; XB5=Pro, Asn или гидроксипролин; XB6=Lys или Gln; XB8=Arg или Leu; XB12=His, Glu или гамма-карбоксиглутамат; XB13=Ile или Leu; XB14=Thr или Val; XB15=Glu или Asn; XB16=Ser или Ala; XB17=Tyr или Leu; XB18=Tyr или Met; XB19=Leu или Asp, XB20=Leu или Val; и XB23=Glu или Arg (SEQ ID NO: 13).
В некоторых вариантах осуществления аналог инсулина содержит пептид, представляющий собой А-цепь, содержащий последовательность Gly-Val-Val-XA4-XA5-CysA6-CysA7-XA8-XA9-XA10-CysA11-Ser-XA13-XA14-XA15-Phe-XA17-XA18-Tyr-CysA20-XA21, где ХА4 представляет собой Glu или гамма-карбоксиглутамат, XA5 представляет собой His или Gln, XA8 представляет собой His или Thr, ХА9 представляет собой Arg или Ser, ХА10 представляет собой Pro или Ile, ХА13 представляет собой Asn или Leu, ХА14 представляет собой Ala или Tyr, XA15 представляет собой Glu или Gln, ХА17 представляет собой Lys или Glu, XA18 представляет собой Lys или Asn, и ХА21 представляет собой Asn или отсутствует (SEQ ID NO: 14); и пептид, представляющий собой В-цепь, содержащий последовательность XB1-XB2-XB3-XB4-XB5-XB6-His-Arg-CysB9-Gly-Ser-XB12-Ile-XB14-XB15-XB16-XB17-XB18-XB19-Leu-CysB21-Tyr-XB23, где XB1=Thr или отсутствует; XB2=Phe или отсутствует; XB3=Phe или Asp; XB4=Thr или Val; XB5=Pro, Asn или гидроксипролин; XB6=Lys или Gln; XB12=His, Glu или гамма-карбоксиглутамат; XB14=Thr или Val; XB15=Glu или Asn; XB16=Ser или Ala; XB17=Tyr или Leu; XB18=Tyr или Met; XB19=Leu или Asp, и XB23=Glu или Arg (SEQ ID NO: 15).
В некоторых вариантах осуществления аналог инсулина содержит пептид, представляющий собой А-цепь, содержащий последовательность Gly-XA2-Val-XA4-XA5-CysA6-CysA7-XA8-XA9-XA10-CysA11-Ser-XA13-XA14-XA15-Phe-XA17-XA18-Tyr-CysA20-XA21, где ХА2 представляет собой Val или Ile, ХА4 представляет собой Glu или гамма-карбоксиглутамат, XA5 представляет собой His или Gln, XA8 представляет собой His или Thr, XA9 представляет собой Arg или Ser, ХА10 представляет собой Pro или Ile, ХА13 представляет собой Asn или Leu, ХА14 представляет собой Ala или Tyr, XA15 представляет собой Glu или Gln, ХА17 представляет собой Lys или Glu, XA18 представляет собой Lys или Asn, и ХА21 представляет собой Asn или отсутствует (SEQ ID NO: 26); и пептид, представляющий собой В-цепь, содержащий последовательность ХВ1-ХВ2-ХВ3-ХВ4-ХВ5-XB6-His-XB8-CysB9-Gly-Ser-XB12-XB13-XB14-XB15-XB16-Tyr-XB18-XB19-XB20-CysB21-XB22-ХВ23, где XB1=Thr или отсутствует; ХВ2=Phe или отсутствует; ХВ=Phe или Asp; ХВ4=Thr или Val; XB5=Pro, Asn или гидроксипролин; ХВ6=Lys или Gln; Xbs=Arg или Leu; XB12=His, Glu или гамма-карбоксиглутамат; ХВ13=Ile или Leu; ХВ14=Thr или Val; XB15=Glu или Asn; XB16=Ser или Ala; XB18=Tyr или Met; XB19=Leu или Asp, ХВ20=Leu или Val; ХВ22=Gly или Tyr; и ХВ23=Glu или Arg (SEQ ID NO: 27).
В некоторых вариантах осуществления аналог инсулина содержит пептид, представляющий собой А-цепь, содержащий последовательность Gly-Val-Val-XA4-XA5-CysA6-CysA7-XA8-ХА9-XA10-CysA11-Ser-XA13-XA14-XA15-Phe-XA17-XA18-Tyr-CysA20-XA21, где XA4 представляет собой Glu или гамма-карбоксиглутамат, XA5 представляет собой His или Gln, XA8 представляет собой His или Thr, XA9 представляет собой Arg или Ser, XA10 представляет собой Pro или Ile, XA13 представляет собой Asn или Leu, XA14 представляет собой Ala или Tyr, XA15 представляет собой Glu или Gln, XA17 представляет собой Lys или Glu, XA18 представляет собой Lys или Asn, и XA21 представляет собой Asn или отсутствует (SEQ ID NO: 28); и пептид, представляющий собой В-цепь, содержащий последовательность ХВ1-ХВ2-ХВ-ХВ4-ХВ5-ХВ6-His-Arg-CysB9-Gly-Ser-ХВ12-Ile-ХВ14-ХВ15-XB16-Tyr-XB18-XB19-Leu-CysB21-XB22-XB23, где XB1=Thr или отсутствует; ХВ2=Phe или отсутствует; ХВ3=Phe или Asp; ХВ4=Thr или Val; XB5=Pro, Asn или гидроксипролин; ХВ6=Lys или Gln; XB12-His, Glu или гамма-карбоксиглутамат; ХВ14=Thr или Val; XB15=Glu или Asn; XB16=Ser или Ala; XB18=Tyr или Met; XB19=Leu или Asp, ХВ22=Gly или Tyr; и ХВ23=Glu или Arg (SEQ ID NO: 29).
В некоторых вариантах осуществления аналог инсулина содержит пептид, представляющий собой А-цепь, содержащий последовательность Gly-Ile-Val-Glu-Gln-Cys-Cys-Thr-Ser-Ile-Cys-Ser-Leu-Tyr-Gln-Leu-Glu-Asn-Tyr-Cys-Asn (SEQ ID NO: 16); и пептид, представляющий собой В-цепь, содержащий последовательность Phe-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-His-Leu-Val-Glu-Ala-Xaa-Tyr-Leu-Val-Cys-Gly-Glu, где Хаа представляет собой ароматический остаток или большой алифатический остаток (SEQ IDNO: 17).
В некоторых вариантах осуществления аналог инсулина содержит пептид, представляющий собой А-цепь, содержащий последовательность Gly-Ile-Val-Glu-Gln-Cys-Cys-Thr-Ser-Ile-Cys-Ser-Leu-Tyr-Gln-Leu-Glu-Asn-Tyr-Cys-Asn (SEQ ID NO: 18); и пептид, представляющий собой В-цепь, содержащий последовательность Phe-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-His-Leu-Val-Glu-Ala-Leu-Tyr-Leu-Val-Cys-Xaa-Glu, где Хаа представляет собой ароматический остаток или большой алифатический остаток (SEQ ID NO: 19).
В некоторых вариантах осуществления аналог инсулина содержит пептид, представляющий собой А-цепь, содержащий последовательность Gly-Ile-Val-Glu-Gln-Cys-Cys-Thr-Ser-Ile-Cys-Ser-Leu-Tyr-Gln-Leu-Glu-Asn-Tyr-Cys-Asn (SEQ ID NO: 20); и пептид, представляющий собой В-цепь, содержащий последовательность Phe-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-His-Leu-Val-Glu-Ala-Xaa-Tyr-Leu-Val-Cys-Xaa-Glu, где Хаа представляет собой ароматический остаток или большой алифатический остаток (SEQ ID NO: 21).
Ранее был идентифицирован ряд модификаций человеческого инсулина, которые повышают аффинность аналога в отношении IR. Например, замещение ThrA8 человеческого инсулина на гистидин приводит к трехкратному повышению аффинности в отношении IR (Glendorf et al. (2011)). В некоторых вариантах осуществления аналог инсулина содержит остаток гистидина в положении, соответствующем ThrA8 человеческого инсулина.
Аналоги инсулина могут содержать одну или несколько не встречающихся в природе аминокислот, модифицированных аминокислот или синтетических аналогов аминокислот, некоторые из которых указаны в последовательностях, представленных в данном документе. Например, такие аминокислоты включают без ограничения D-изомеры обычных аминокислот, 2,4-диаминомасляную кислоту, α-аминоизомасляную кислоту, 4-аминомасляную кислоту, 2-аминомасляную кислоту, 6-аминогексановую кислоту, 2-аминоизомасляную кислоту, 3-аминопропио новую кислоту, орнитин, норлейцин, норвалин, гидроксипролин, саркозин, цитруллин, гамма-карбоксиглутамат, гидроксипролин, гомоцитруллин, цистеиновую кислоту, трет-бутилглицин, трет-бутилаланин, фенилглицин, циклогексилаланин, циклопентилаланин, селеноцистеин, амидированный цистеин, амидированный селеноцистеин, β-аланин, фторированные аминокислоты, сконструированные аминокислоты, такие как β-метиламинокислоты, Сα-метиламинокислоты, Nα-метиламинокислоты, и аналоги аминокислот в целом. Также в объем включены пептиды, которые дифференциально модифицируют во время или после синтеза, например, путем биотинилирования, бензилирования, гликозилирования, ацетилирования, фосфорилирования, амидирования, дериватизации с помощью известных защитных/блокирующих групп, протеолитического расщепления, связывания с молекулой антитела или другим клеточным лигандом и т.д.
Как раскрыто в данном документе, синтетический аналог Con-Ins G1, содержащий РТМ, был в четыре раза более активным в отношении человеческого IR-B, чем аналог без РТМ (см. примеры). В некоторых вариантах осуществления один или несколько остатков Glu можно заместить гамма-карбоксиглутаматом (Gla), например, в положениях Glu ХА4 или XA5 различных А-цепей или в положении Glu XB12 некоторых В-цепей. В некоторых вариантах осуществления один или несколько остатков Pro можно заместить гидроксипролином (Hyp), например, в положении Pro XB5 определенных В цепей. В некоторых вариантах осуществления С-терминальные концы могут быть амидированы, как, например, терминальный конец различных А-цепей может содержать, среди прочего, амидированный Cys (*). В некоторых вариантах осуществления аналог инсулина содержит одно или несколько из следующего: (i) XA4 представляет собой гамма-карбоксиглутамат, ii) XB5=гидроксипролин; и iii) ХВ12 = гамма-карбоксиглутамат. Авторами настоящего изобретения обнаружено, что по меньшей мере некоторые из этих РТМ способствуют связыванию Con-Ins G1 с IR.
Аналоги инсулина содержат пептид, представляющий собой А-цепь, и пептид, представляющий собой В-цепь, которые связаны друг с другом посредством по меньшей мере одной пары цистеиновых остатков. В некоторых вариантах осуществления CysB9 из пептида, представляющего собой В-цепь, связан с CysA6 из пептида, представляющего собой А-цепь, CysB21 из пептида, представляющего собой В-цепь, связан с CysB20 из пептида, представляющего собой А-цепь, и/или CysA7 связан с CysA11.
В некоторых вариантах осуществления пептид, представляющий собой А-цепь, и пептид, представляющий собой В-цепь, могут быть связаны друг с другом за счет одного или нескольких терминальных концов. В некоторых вариантах осуществления пептид, представляющий собой А-цепь, и пептид, представляющий собой В-цепь, связаны друг с другом за счет терминального конца. Например, N-конец пептида, представляющего собой А-цепь, может быть соединен с N- или С-концом пептида, представляющего собой В-цепь, С-конец пептида, представляющего собой А-цепь, может быть соединен с N- или С-концом пептида, представляющего собой В-цепь, С-конец пептида, представляющего собой А-цепь, может быть связан с N-концом пептида, представляющего собой А-цепь, или С-конец пептида, представляющего собой В-цепь, может быть соединен с N-концом пептида, представляющего собой В-цепь. В некоторых вариантах осуществления пептид, представляющий собой А-цепь, и пептид, представляющий собой В-цепь, связаны друг с другом за счет обоих терминальных концов. Таким образом, хотя в некоторых вариантах осуществления аналог инсулина является ациклическим, в других случаях аналоги инсулина могут являться циклическими, и при этом сохранять описанный паттерн связывания по Cys. В таких вариантах осуществления аналог инсулина имеет циклизированный остов, вследствие чего А- и В-цепи не имеют свободного N- или С-конца (для варианта осуществления, в котором соединены оба терминальных конца). Связь при одном или нескольких терминальных концах может представлять собой непосредственную связь между аминокислотами остовов пептидов, представляющих собой А- и В-цепь, или между ними может быть линкер из одной или нескольких аминокислот или других линкерных молекул.
В некоторых вариантах осуществления химические группы, остатки или группы остатков, которые, как известно специалисту в данной области, улучшают стабильность, можно добавлять к С-концу и/или N-концу. В некоторых вариантах осуществления химические группы, остатки или группы остатков, которые, как известно специалисту в данной области, улучшают биодоступность, можно добавлять к С-концу и/или N-концу. В некоторых вариантах осуществления такие остатки или группы, которые можно добавлять к N-концу, могут также замещать Gly в аналогах инсулина. В некоторых вариантах осуществления флуоресцентные метки можно присоединять либо к С-концу, либо к N-концу.
Пептиды, представляющие собой аналоги инсулина, раскрытые в данном документе, можно получать с помощью любой методики или любого способа, известных специалисту в данной области техники, и любая из этих методик или любой из этих способов считаются находящимися в пределах объема настоящего изобретения. Например, методики включают без ограничения химический синтез, твердофазный пептидный синтез, рекомбинантную экспрессию, комбинацию пептидного синтеза и рекомбинантной экспрессии и т.п. Иллюстративные методики дополнительно описаны в разделе "Примеры". Аналог инсулина можно получать в различных формах, например, нативной, в виде продуктов слияния, гликозилированной, липидизированной и т.д.
Аналоги инсулина предпочтительно получают в практически чистой форме (т.е. практически не содержащей белков клетки-хозяина или других загрязнителей). Как правило, аналог инсулина является практически чистым, если он составляет по меньшей мере 60% по весу от общего присутствующего белка. Например, аналог инсулина составляет по меньшей мере 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98%, по меньшей мере приблизительно 99%, более предпочтительно по меньшей мере 90% по весу от общего присутствующего белка.
Настоящее изобретение также предусматривает соли или производные аналогов инсулина. Термин "соль", как используется в данном документе, обозначает кислые и/или основные соли, образованные с помощью неорганических или органических кислот и/или оснований, предпочтительно основные соли. Не смотря на то, что обычно предпочтительными являются фармацевтически приемлемые соли, в особенности при использовании аналогов инсулина в качестве лекарственных препаратов, другие соли находят применение, например, при обработке этих соединений или в тех случаях, когда предполагаются типы применения, отличные от применения в качестве лекарственного препарата. Соли этих соединений можно получать с помощью любой методики, известной специалисту в данной области техники.
Термин "фармацевтически приемлемая соль", как используется в данном документе, относится к солям соединений, которые сохраняют биологическую активность исходного соединения и которые не являются нежелательными с биологической или иной точки зрения. Многие из соединений, раскрытых в данном документе, могут образовывать кислые и/или основные соли благодаря присутствию амино- и/или карбоксильных групп или групп, подобных им. Фармацевтически приемлемые соли присоединения основания можно получать из неорганических и органических оснований. Соли, полученные из неорганических оснований, включают, исключительно в качестве примера, соли натрия, калия, лития, аммония, кальция и магния. Соли, полученные из органических оснований, включают без ограничения соли первичных, вторичных и третичных аминов. Фармацевтически приемлемые соли присоединения кислоты можно получать из неорганических и органических кислот. Соли, полученные из неорганических кислот, включают соли хлористоводородной кислоты, бромистоводородной кислоты, серной кислоты, азотной кислоты, фосфорной кислоты и т.п. Соли, полученные из органических кислот, включают соли уксусной кислоты, пропионовой кислоты, гликолевой кислоты, пировиноградной кислоты, щавелевой кислоты, яблочной кислоты, малоновой кислоты, янтарной кислоты, малеиновой кислоты, фумаровой кислоты, винной кислоты, лимонной кислоты, бензойной кислоты, коричной кислоты, миндальной кислоты, метансульфоновой кислоты, этансульфоновой кислоты, р-толуолсульфоновой кислоты, салициловой кислоты и т.п.
Термин "производное", как используется в данном документе, включает альфа-аминокислоты, где одна или несколько боковых групп, которые присутствуют во встречающихся в природе альфа-аминокислотах, были модифицированы. Таким образом, например, встречающиеся в природе аминокислоты можно замещать с помощью различных некодируемых или модифицированных аминокислот, таких как соответствующая D-аминокислота или N-метиламинокислота. Другие модификации известны специалисту в данной области техники и включают замену гидроксильной, тиольной, амино- и карбоксильной функциональных групп на химически подобные группы, например, замену -SH на -SeH в цистеине.
В некоторых вариантах осуществления аналог инсулина, его соль или производное способны связываться с IR. Предпочтительно IR представляет собой человеческий рецептор IR-B. В некоторых вариантах осуществления IC50 или аффинность (Kd) в отношении человеческого рецептора IR-B составляют менее 10-4 М, 10-5 М, 10-6 М, 10-7 М, 10-8 М, 10-9 М или 10-10 М. Предпочтительно IC50 в отношении человеческого рецептора IR-B составляет менее 10-6 М.
В некоторых вариантах осуществления аналог инсулина, его соль или производное не связывается с IGF-IR или слабо связывается с IGF-IR. Как используется в данном документе, "слабо" относится к аналогу инсулина, который не связывается с IGF-IR с аффинностью, достаточной для того, чтобы привести к активации IGF-IR и/или вызвать передачу сигнала посредством IGF-IR. В некоторых вариантах осуществления аналог инсулина характеризуется IC50 или Kd в отношении IGF-IR, составляющими менее 10-9 М, 10-8 М, 10-7 М, 10-6 М, 10-5 М или 10-4 М, предпочтительно аналог инсулина характеризуется аффинностью (Kd) в отношении IGF-IR, составляющей менее 100 нМ.
В некоторых вариантах осуществления аналог инсулина, его соль или производное являются преимущественно мономерными в растворе. В некоторых вариантах осуществления аналог инсулина является мономерным на по меньшей мере 50%, аналог инсулина является мономерным на по меньшей мере 60%, аналог инсулина является мономерным на по меньшей мере 70%, аналог инсулина является мономерным на по меньшей мере 75%, аналог инсулина является мономерным на по меньшей мере 80%, аналог инсулина является мономерным на по меньшей мере 85%, аналог инсулина является мономерным на по меньшей мере 90%, аналог инсулина является мономерным на по меньшей мере 95%, аналог инсулина является мономерным на по меньшей мере 98%, аналог инсулина является мономерным на по меньшей мере 99% или аналог инсулина является мономерным на примерно 100%. В некоторых вариантах осуществления аналог инсулина является мономерным. В некоторых вариантах осуществления аналог инсулина может являться по меньшей мере частично мономерным и диссоциировать с образованием мономерной формы при введении субъекту. В некоторых вариантах осуществления аналог инсулина является мономерным или диссоциирует с образованием мономерной формы в кровяном русле субъекта.
В некоторых вариантах осуществления аналог инсулина, его соль или производное представляют собой аналог инсулина короткого действия. В некоторых вариантах осуществления характеризуется повышенной биодоступностью при введении человеку по сравнению с человеческим инсулином. В некоторых вариантах осуществления аналог инсулина, его соль или производное характеризуются пиковой биодоступностью в диапазоне от 10 минут до 6 часов после введения человеку. В некоторых вариантах осуществления максимальная концентрация аналога инсулина в плазме крови после введения наблюдается раньше, чем максимальная концентрация человеческого инсулина в плазме крови после введения. Например, пиковая доступность аналога инсулина, его соли или производного наблюдается в диапазоне от 10 минут до 4 часов после введения, в диапазоне от 15 минут до 3 часов после введения, в диапазоне от 30 минут до 1 часа после введения или в диапазоне от 40 до 55 минут после введения. В некоторых вариантах осуществления аналог инсулина, его соль или производное характеризуются началом проявления активности в течение 2 мин., 5 мин., 10 минут, 15 минут, 20 минут или 30 минут после введения. Предпочтительно начало проявления активности находится в диапазоне от 10 до 30 минут после введения.
Аналоги инсулина по настоящему изобретению также включают аналоги, сконструированные или идентифицированные с применением способа по настоящему изобретению, и аналоги, которые способны распознавать целевой участок связывания и связываться с ним.
Целевые участки связывания включают физиологических партнеров по связыванию инсулина, таких как IR, а также области физиологических партнеров по связыванию. Например, целевой участок связывания может представлять собой короткий полипептид, определяющий эпитоп (например, соответствующий петлевой структуре, определенной ниже в качестве целевого участка связывания), или миметик, например, пептидомиметик, имитирующий петлевую структуру.
В некоторых вариантах осуществления целевой участок связывания представляет собой инсулиновый рецептор, предпочтительно инсулиновый рецептор человека. В некоторых вариантах осуществления целевой участок связывания представляет собой область IR, участвующую в стыковке инсулина с рецептором. В некоторых вариантах осуществления область IR включает низкоаффинные целевые участки связывания, содержащие одно или несколько из следующего: домен L1, пептид СТ и домен CR эктодомена IR. Что касается домена L1, целевой участок связывания предпочтительно содержит части поверхности молекулы, образованные центральным β-листом L1, и части поверхности молекулы, образованные вторым LRR, который содержит Phe39, или петлей в четвертом LRR звене L1, или предпочтительно обоими. Что касается домена CR, целевой участок связывания предпочтительно содержит модуль 6 домена CR.
В некоторых вариантах осуществления низкоаффинный целевой участок связывания может содержать одну или несколько аминокислот из одной или нескольких следующих аминокислотных последовательностей: (i) аминокислоты 1-156; (ii) аминокислоты 704-719 и (iii) аминокислоты 157-310.
Что касается аминокислот 1-156, целевой участок связывания предпочтительно содержит по меньшей мере одну аминокислоту из аминокислотной последовательности 1-68, предпочтительно 1-55 и более предпочтительно из аминокислотной последовательности 27-55. Целевой участок связывания предпочтительно содержит по меньшей мере одну аминокислоту, выбранную из Arg14, Asn15, Gln34, Leu36, Leu37, Phe39, Pro43-Phe46, Phe64, Leu87, Phe88, Asn90 и Phe89, более предпочтительно по меньшей мере одну аминокислоту, выбранную из Arg14, Asn15, Gln34, Leu37, Phe39, Pro43-Phe46, Phe64, еще более предпочтительно по меньшей мере одну аминокислоту, выбранную из Phe39 и Pro43-Phe46, и наиболее предпочтительно по меньшей мере Phe39.
Что касается аминокислот 157-310, целевой участок связывания предпочтительно содержит по меньшей мере одну аминокислоту из аминокислотной последовательности 192-310, более предпочтительно по меньшей мере одну аминокислоту из последовательности 227-303, еще более предпочтительно по меньшей мере одну аминокислоту, выбранную из последовательности 259-284.
В другом аспекте настоящее изобретение также предусматривает пептиды, содержащие пептид, представляющий собой А-цепь инсулина, и пептид, представляющий собой В-цепь инсулина, где пептид, представляющий собой В-цепь, содержит замену по аминокислоте 10 и аминокислоте 20. Раскрыты пептиды, содержащие пептид, представляющий собой А-цепь, и пептид, представляющий собой В-цепь, где пептид, представляющий собой В-цепь, содержит замену по аминокислоте 10 и аминокислоте 20 по сравнению с человеческим инсулином дикого типа. В некоторых случаях любая консервативная аминокислотная замена может присутствовать в положениях 10, 20 или в обоих положениях. Например, в одном или обоих положениях может быть заменена другая гидрофильная аминокислота, полярная аминокислота или алифатическая аминокислота.
В некоторых вариантах раскрытых пептидов замена по аминокислоте 20 в пептиде, представляющем собой В-цепь, может представлять собой G20Y, G20F или G20P. В некоторых случаях замена по аминокислоте 20 представляет собой G20Y. В некоторых случаях замена по аминокислоте 20 может представлять собой G20P, и пептид дополнительно содержит замену по аминокислоте 21, где замена по аминокислоте 21 может представлять собой G21H. В некоторых случаях аминокислотная замена может представлять собой любую консервативную замену глицина.
В некоторых вариантах раскрытых пептидов замена по аминокислоте 10 в пептиде, представляющем собой В-цепь, может представлять собой Н10Е, H10D или H10Q. В некоторых случаях замена по аминокислоте 10 представляет собой Н10Е. В некоторых случаях аминокислотная замена может представлять собой любую консервативную замену гистидина.
В некоторых случаях как пептид, представляющий собой А-цепь инсулина, так и пептид, представляющий собой В-цепь, могут содержать замены по сравнению с инсулином дикого типа. Раскрыты пептиды, содержащие пептид, представляющий собой А-цепь инсулина, и пептид, представляющий собой В-цепь инсулина, где пептид, представляющий собой В-цепь, содержит замену по аминокислоте 10 и аминокислоте 20, и при этом дополнительно по меньшей мере одна замена содержится в пептиде, представляющем собой А-цепь. В некоторых случаях по меньшей мере одна замена может находиться в положении 8 или 9. В некоторых случаях по меньшей мере одна замена в пептиде, представляющем собой А-цепь, может представлять собой Т8Н, T8Y, T8K или S9R. В некоторых случаях любая консервативная аминокислотная замена может присутствовать в положении 8 или 9 или в обоих положениях. Например, может быть заменена другая гидрофильная аминокислота или могут быть заменены другие полярные аминокислоты.
Раскрыты пептиды, содержащие пептид, представляющий собой А-цепь инсулина, и пептид, представляющий собой В-цепь инсулина, где пептид, представляющий собой В-цепь, содержит замену по аминокислоте 10 и аминокислоте 20, и при этом дополнительно по меньшей мере две замены содержатся в пептиде, представляющем собой А-цепь. В некоторых случаях по меньшей мере две замены могут находиться в положениях 8 и 9. В некоторых случаях по меньшей мере две замены в пептиде, представляющем собой А-цепь, могут быть выбраны из Т8Н, T8Y, T8K и S9R. В некоторых случаях любая консервативная аминокислотная замена может присутствовать в положении 8 или 9 или в обоих положениях. Например, в одном или обоих положениях может быть заменена другая гидрофильная аминокислота или могут быть заменены другие полярные аминокислоты.
В некоторых случаях в пептиде, представляющем собой В-цепь, отсутствует одна или несколько, но не более восьми С-концевых аминокислот по сравнению с диким типом. Таким образом, раскрытые пептиды могут представлять собой пептиды, представляющие собой дезоктапептид-инсулин (в котором отсутствуют последние 8 аминокислот с С-конца В-цепи человеческого инсулина). Например, в некоторых случаях раскрытые пептиды могут содержать пептид, представляющий собой В-цепь, который содержит последовательность
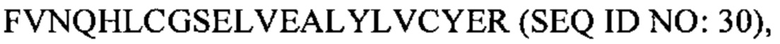
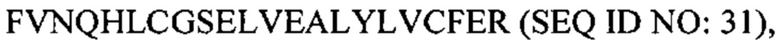

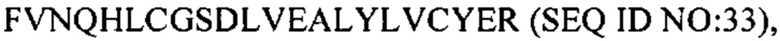
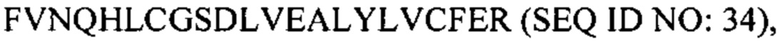
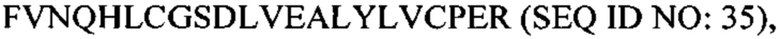
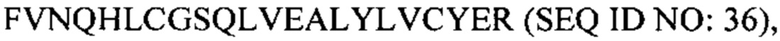
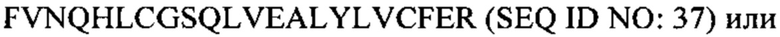
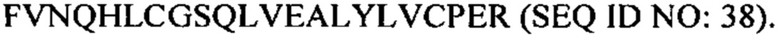
В некоторых случаях раскрытые пептиды могут содержать А-цепь, содержащую последовательность 
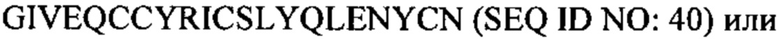
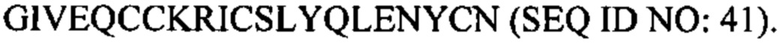
В некоторых случаях раскрытых пептидов пептид, представляющий собой А-цепь, и пептид, представляющий собой В-цепь, могут быть связаны посредством по меньшей мере одной дисульфидной связи. В некоторых случаях пептид, представляющий собой А-цепь, и пептид, представляющий собой В-цепь, могут быть связаны посредством по меньшей мере двух дисульфидных связей.
В некоторых случаях раскрытые пептиды представляют собой мономеры. Другими словами, в некоторых случаях раскрытые пептиды с меньшей вероятностью образуют димеры, тетрамеры, гексамеры и т.д.
В некоторых случаях раскрытых пептидов пептид, представляющий собой А-цепь инсулина, может быть на по меньшей мере 70% идентичным пептиду, представляющему собой А-цепь человеческого инсулина дикого типа. В некоторых случаях пептид, представляющий собой А-цепь инсулина, может быть на по меньшей мере 60, 65, 70, 75, 80, 85, 90, 95, 99% идентичным пептиду, представляющему собой А-цепь человеческого инсулина дикого типа. В некоторых случаях определенной процентной идентичности можно достичь путем делеции одной или нескольких аминокислот с N-терминального или С-терминального конца раскрытых пептидов.
В некоторых вариантах раскрытых пептидов пептид, представляющий собой В-цепь инсулина, может быть на по меньшей мере 70% идентичным пептиду, представляющему собой В-цепь человеческого инсулина дикого типа. В некоторых случаях пептид, представляющий собой В-цепь инсулина, может быть на по меньшей мере 60, 65, 70, 75, 80, 85, 90, 95, 99% идентичным пептиду, представляющему собой В-цепь человеческого инсулина дикого типа. В некоторых случаях определенной процентной идентичности можно достичь путем делеции одной или нескольких аминокислот с N-терминального или С-терминального конца раскрытых пептидов.
В некоторых случаях раскрытые пептиды могут содержать одну или несколько не встречающихся в природе аминокислот, модифицированных аминокислот или синтетических аналогов аминокислот. Такие аминокислоты включают без ограничения D-изомеры обычных аминокислот, 2,4-диаминомасляную кислоту, α-аминоизомасляную кислоту, 4-аминомасляную кислоту, 2-аминомасляную кислоту, 6-аминогексановую кислоту, 2-аминоизомасляную кислоту, 3-аминопропионовую кислоту, орнитин, норлейцин, норвалин, гидроксипролин, саркозин, цитруллин, гомоцитруллин, цистеиновую кислоту, трет-бутилглицин, трет-бутилаланин, фенилглицин, циклогексилаланин, циклопентилаланин, β-аланин, фторированные аминокислоты, сконструированные аминокислоты, такие как β-метиламинокислоты, Сα-метиламинокислоты, Nα-метиламинокислоты, и аналоги аминокислот в целом. Также в объем включены пептиды, которые дифференциально модифицируют во время или после синтеза, например, путем биотинилирования, бензилирования, гликозилирования, ацетилирования, фосфорилирования, амидирования, дериватизации с помощью известных защитных/блокирующих групп, протеолитического расщепления, связывания с молекулой антитела или другим клеточным лигандом и т.д. Эти модификации могут служить для повышения стабильности и/или биологической активности пептида.
В дополнительных случаях раскрытых пептидов предусмотрены терапевтические белки, содержащие пептид, представляющий собой А-цепь, связанный с пептидом, представляющим собой В-цепь, посредством по меньшей мере одной дисульфидной связи, где А-цепь содержит последовательность 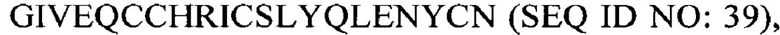 и где пептид, представляющий собой В-цепь, содержит последовательность
и где пептид, представляющий собой В-цепь, содержит последовательность 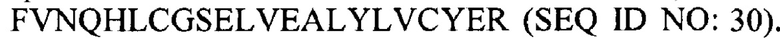
Понятно, что раскрытые терапевтические белки можно использовать в фармацевтических композициях и применять в рамках лечения нарушений, включая диабет.
Способы конструирования аналогов инсулина
Трехмерную структуру инсулина из яда, предусмотренную настоящим изобретением, можно применять для конструирования аналогов инсулина (также называемых в данном документе агонистами IR, молекулами и соединениями), в частности аналогов инсулина короткого действия. В одном аспекте предусмотрено применение структуры Con-Ins G1, определенной атомными координатами из приложения I, в качестве структурной модели. В некоторых вариантах осуществления структурную модель применяют для идентификации аналогов инсулина.
В некоторых вариантах осуществления предусмотрен способ идентификации, конструирования или скрининга в отношении соединения, которое потенциально может взаимодействовать с IR. Способ предусматривает осуществление основанной на структуре идентификации, конструирования или скрининга в отношении соединения на основании взаимодействий соединения со структурой IR, определенной с помощью трехмерной структуры Con-Ins G1 или ее подмножества.
Настоящее изобретение также применимо для улучшения свойств известных молекул, связывающихся с IR. Например, известные молекулы, связывающиеся с IR, можно подвергнуть скринингу в сопоставлении с 3D-структурой Con-Ins G1, определенной атомными координатами из приложения I или их частью, и оценке способности к самоассоциации и возможности взаимодействия с IR. Исходя из этой оценки, известную молекулу, связывающуюся с IR, можно подвергать изменению структуры (т.е. химической модификации) таким образом, чтобы придать ей одно или несколько из следующих свойств: (i) снизить уровень самоассоциации, (ii) повысить ее аффинность в отношении низкоаффинного участка связывания IR (т.е. участка связывания, определяющего селективность), (iii) повысить ее аффинность в отношении высокоаффинного участка связывания IR (т.е. участка связывания, определяющего передачу сигнала) и (iv) понизить ее аффинность в отношении связывания с IGF-1R.
В некоторых вариантах осуществления предусмотрен способ изменения структуры или модификации полипептида, который, как известно, связывается с IR или областью IR. Способ предусматривает осуществление основанной на структуре оценки по отношению к структуре, определенной атомными координатами из приложения I или их подмножеством, и изменение структуры или химическую модификацию полипептида по результатам оценки. В некоторых вариантах осуществления основанная на структуре оценка предусматривает сравнение структуры, определенной атомными координатами из приложения I или их подмножества, с атомными координатами инсулина или их подмножеством. В некоторых вариантах осуществления основанная на структуре оценка дополнительно предусматривает молекулярное моделирование комплекса, образованного структурой, определенной атомными координатами из приложения I или их подмножеством, и атомными координатами инсулинового рецептора или их подмножеством. В некоторых вариантах осуществления модель определена атомными координатами из приложения II или их подмножеством.
В некоторых вариантах осуществления способ дополнительно предусматривает осуществление синтеза или получение полипептида, подвергнутого изменению структуры или химической модификации, и тестирование в отношении его способности связываться с IR. В некоторых вариантах осуществления определяют способность полипептида, подвергнутого изменению структуры или химической модификации, модулировать активацию IR. В некоторых вариантах осуществления можно определять способность полипептида, подвергнутого изменению структуры или химической модификации, снижать уровни глюкозы в крови.
В некоторых вариантах осуществления полипептид, который, как известно, связывается с IR, представляет собой инсулиноподобный фактор роста (IGF). Подходящие IGF включают IGF от людей, свиней, крупного рогатого скота, птиц, мышей и т.п. В некоторых вариантах осуществления IGF представляет собой человеческий IGF-I или IGF-II.
В предпочтительном варианте осуществления полипептид, который, как известно, связывается с IR, представляет собой инсулин. Подходящий инсулин включает человеческий инсулин, свиной инсулин, бычий инсулин, овечий инсулин, мышиный инсулин, инсулин морской свинки и т.п. В некоторых вариантах осуществления инсулин представляет собой человеческий инсулин.
Как используется в данном документе, термин "моделирование" включает количественный и качественный анализ молекулярной структуры и/или функции на основании информации об атомной структуре и моделей взаимодействия. Термин "моделирование" включает традиционные численные модели на основе молекулярной динамики и минимизации энергии, интерактивные компьютерно-графические модели, модифицированные модели на основе молекулярной механики, модели на основе метрической геометрии и других структурных ограничений.
Методики молекулярного моделирования можно применять по отношению к атомным координатам Con-Ins G1 или его области для получения ряда 3D-моделей и для изучения структуры участков связывания, таких как участок связывания IR и другие белковые мишени.
Область Con-Ins G1, как обозначено в данном документе, может быть определена с помощью одной аминокислоты (или ее боковой цепи), с помощью непрерывной последовательности аминокислот или с помощью двух или более отдельных аминокислот и/или фрагментов из аминокислот. Такие отдельные аминокислоты и/или фрагменты из аминокислот могут существовать в непосредственной пространственной близости друг к другу в трехмерной структуре или могут характеризоваться возможностью перехода в непосредственную пространственную близость, например, при связывании подходящего лиганда. Соответственно, области Con-Ins G1 содержат аминокислотные последовательности, участвующие в связывании с IR, как в начальном селективном низкоаффинном связывании, так и в последующем высокоаффинном связывании с другим мономером в димере IR.
Эти методики можно также применять для осуществления скрининга в отношении малых и больших химических структурных элементов, которые способны связываться с IR и модулировать активность IR, или для их конструирования. При скрининге может использоваться скрининговая система на основе 3D-модели или компьютерная скрининговая система.
В некоторых вариантах осуществления такие способы моделирования предназначены для конструирования или отбора химических структурных элементов (например, полипептида, пептида, пептидомиметика, соединения и т.п.), которые обладают стереохимической комплементарностью в отношении конкретных областей IR. Под "стереохимической комплементарностью" подразумевается, что соединение или его часть образуют достаточное количество энергетически выгодных контактов с рецептором для того, чтобы обеспечить абсолютное уменьшение свободной энергии при связывании с рецептором.
Следует понимать, что для подавления связывания молекулы или комплекса, который в обычных условиях взаимодействует с эктодоменом IR, комплементарность между химическими структурными элементами и участком рецептора необязательно должна распространяться на все остатки участка рецептора.
Для идентификации химических структурных элементов, обладающих стереокомплементарностью в отношении области IR, можно применять ряд способов. Например, способ может начинаться с визуального изучения структуры Con-Ins G1 на экране компьютера, основанной на атомных координатах Con-Ins G1 или его области из приложения I, полученных из носителя данных, считываемого с помощью вычислительной машины. В некоторых вариантах осуществления способ может начинаться с молекулярного моделирования комплекса, образованного структурой, определенной атомными координатами из приложения I или их подмножеством, и атомными координатами инсулинового рецептора или их подмножеством. Можно применять программное обеспечение для моделирования, которое хорошо известно и доступно из уровня техники, например, MODELLER (v9.15) (Webb и Sali, (2014)). За этой стадией моделирования может следовать минимизация энергии с помощью силовых полей стандартной молекулярной механики, таких как CHARMM (Guvench et al. 2011; Best et al. 2012). За моделированием и минимизацией энергии могут следовать симуляции методом молекулярной динамики с применением программного обеспечения, известного из уровня техники, например, NAMD (Phillips et al. 2005). Кроме того, существует ряд более специализированных компьютерных программ для облегчения процесса отбора связывающихся фрагментов по настоящему изобретению.
Также предусмотрены полипептид или его соль или аналог, которые были подвергнуты изменению структуры или модификации с помощью способа изменения структуры или модификации полипептида, определенного в данном документе. Предпочтительно полипептид, подвергнутый изменению структуры или модификации, является мономерным или диссоциирует с образованием мономера при введении субъекту.
Предпочтительными областями IR являются области, определяющие специфичность, например, области, описанные выше как целевые участки связывания.
В другом аспекте предусмотрена выделенная молекула, которая является агонистом IR, где молекула идентифицирована и/или сконструирована на основании 3D-структуры Con-Ins G1, определенной атомными координатами из приложения I или их подмножеством. Подходящие молекулы включают пептиды, полипептиды или пептидомиметики.
Термин "пептидомиметик", как используется в данном документе, обозначает молекулу, которая имитирует биологическую активность пептида, но больше не является полностью пептидной по химической природе. В узком определении пептидомиметик представляет собой молекулу, которая больше не содержит каких-либо пептидных связей (то есть амидных связей между аминокислотами). Однако термин пептидомиметик можно применять для описания молекул, которые больше не являются полностью пептидными по своей природе, таких как псевдопептиды, полупептиды и пептоиды. Независимо от того, являются ли они полностью или частично отличными от пептида, пептидомиметики по настоящему изобретению предусматривают пространственное расположение реакционноспособных химических фрагментов, которое очень напоминает трехмерное расположение активных групп в пептиде, на основании которого создан пептидомиметик. В результате такой подобной геометрии активного сайта пептидомиметик оказывает воздействия на биологические системы, которые сходны с биологической активностью пептида.
Подходящие пептидомиметики на основе инсулина из яда можно разработать с применением легко доступных методик и/или способов, описанных в данном документе. Таким образом, например, пептидные связи можно заместить отличными от пептидных связями, что позволит пептидомиметику принимать структуру, сходную со структурой исходного пептида, и, следовательно, обеспечит ему подобную биологическую активность. Дополнительные модификации также можно осуществлять путем замещения химических групп аминокислот другими химическими группами с подобной структурой. Разработку пептидомиметиков, получаемых из инсулина из яда, можно облегчить путем ссылки на трехмерную структуру этих остатков, предусмотренных в приложении I, или их подмножество. Эту информацию о структуре можно применять для проведения поиска в базах данных трехмерной структуры для идентификации молекул, характеризующихся подобной структурой, с применением программ, таких как MACCS-3D и ISIS/3D (Molecular Design Ltd., Сан-Леандро, Калифорния), ChemDBS-3D (Chemical Design Ltd., Оксфорд, Великобритания) и Sybyl/3DB Unity (Tripos Associates, Сент-Луис, Миссури).
Специалистам в данной области техники будет понятно, что при конструировании пептидомиметиков может быть необходимым небольшое структурное изменение или корректировка химической структуры, сконструированной или идентифицированной с применением способов по настоящему изобретению. В целом, миметики, идентифицированные или сконструированные с применением способов по настоящему изобретению, можно синтезировать химическим способом, а затем тестировать в отношении способности модулировать активность инсулинового рецептора с применением любого из способов, описанных в данном документе. Способы по настоящему изобретению являются особенно полезными, поскольку при их применении можно достичь значительного уменьшения количества потенциальных миметиков, которые необходимо подвергнуть скринингу в отношении их способности модулировать активность инсулинового рецептора.
В некоторых вариантах осуществления выделенная молекула способна связываться с IR. Предпочтительно IR представляет собой человеческий рецептор IR-B. В некоторых вариантах осуществления IC50 или Kd в отношении человеческого рецептора IR-B составляют более 10-4 М, 10-5 М, 10-6 М, 10-7 М, 10-8 М, 10-9 М или 10-10 М. Предпочтительно IC50 или Kd в отношении человеческого рецептора IR-B составляют более 10-6 М. В некоторых вариантах осуществления выделенная молекула не связывается с IGF-IR или слабо связывается с IGF-IR. Предпочтительно выделенная молекула характеризуется аффинностью (Kd) в отношении IGF-IR, составляющей менее 100 нМ.
В некоторых вариантах осуществления выделенная молекула является преимущественно мономерной в растворе. В некоторых вариантах осуществления выделенная молекула является мономерной на по меньшей мере 50%, выделенная молекула является мономерной на по меньшей мере 60%, выделенная молекула является мономерной на по меньшей мере 70%, выделенная молекула является мономерной на по меньшей мере 75%, выделенная молекула является мономерной на по меньшей мере 80%, выделенная молекула является мономерной на по меньшей мере 85%, выделенная молекула является мономерной на по меньшей мере 90%, выделенная молекула является мономерной на по меньшей мере 95%, выделенная молекула является мономерной на по меньшей мере 98%, выделенная молекула является мономерной на по меньшей мере 99% или выделенная молекула является мономерной на примерно 100%. В некоторых вариантах осуществления выделенная молекула может быть по меньшей мере частично мономерной и диссоциировать с образованием мономерной формы при введении субъекту. В некоторых вариантах осуществления выделенная молекула является мономерной или диссоциирует с образованием мономерной формы в кровяном русле субъекта.
Настоящее изобретение является также применимым в отношении идентификации и/или конструирования аналогов инсулина, которые не связываются с IGF-1R или связываются с ним лишь слабо. Например, аналоги инсулина, идентифицированные с применением способов по настоящему изобретению, можно подвергать скринингу in silico, in vitro и/или in vivo в отношении их способности связываться с IGF-IR. Любые аналоги инсулина, в отношении которых установлено или предполагается, что они связываются с IGF-IR, можно подвергать изменению структуры таким образом, чтобы повысить их селективность в отношении IR.
В некоторых вариантах осуществления аналог инсулина (который включает выделенную молекулу, соединение или агонист IR), идентифицированный с помощью способов, представленных в данном документе, не связывается с IGF-IR или слабо связывается с IGF-IR. В некоторых вариантах осуществления аналог инсулина характеризуется IC50 или Kd в отношении IGF-IR, составляющими менее 10-9 М, 10-8 М, 10-7 М, 10-6 М, 10-5 М или 10-4 М, предпочтительно аналог инсулина характеризуется аффинностью (Kd) в отношении IGF-IR, составляющей менее 100 нМ.
Настоящее изобретение также предусматривает способ идентификации соединения, которое связывается с IR, при этом способ включает:
i) создание модели трехмерной структуры полипептида, характеризующегося
a) структурой, определенной атомными координатами из приложения I или их подмножеством, или
b) структурой, которая при наложении на соответствующие атомы остова структуры а) характеризуется среднеквадратическим отклонением, составляющим менее приблизительно 2,0  , и
, и
ii) конструирование соединения, которое потенциально связывается с IR, или осуществление скрининга в отношении него.
В некоторых вариантах осуществления создание модели трехмерной структуры предусматривает создание модели полипептида, связанного с IR или его областями. Предпочтительными областями IR являются области, определяющие специфичность, например, области, описанные выше как целевые участки связывания. В некоторых вариантах осуществления модель определена атомными координатами из приложения II или их подмножеством.
Модель может являться адаптивной в том смысле, что она допускает небольшие изменения поверхности для улучшения прилегания между соединением-кандидатом и белком, например, с помощью небольших перемещений боковых цепей или основной цепи.
В некоторых вариантах осуществления способы дополнительно предусматривают осуществление синтеза соединения, которое потенциально связывается с IR. В некоторых вариантах осуществления соединение модулирует по меньшей мере одну биологическую активность IR. В некоторых вариантах осуществления способ может дополнительно предусматривать тестирование соединения, сконструированного или отобранного с помощью скрининга на стадии ii), в отношении его способности модулировать по меньшей мере одну биологическую активность IR. Например, способ может дополнительно предусматривать тестирование соединения, сконструированного или отобранного с помощью скрининга на стадии ii), в отношении его способности модулировать уровни глюкозы в крови. В некоторых вариантах осуществления стадии i) и ii) осуществляют in silico.
Настоящее изобретение также предусматривает способ идентификации соединения, которое имитирует активность инсулина, с применением компьютера, при этом способ включает:
i) создание модели трехмерной структуры полипептида, характеризующегося
a) структурой, определенной атомными координатами из приложения I или их подмножеством, или
b) структурой, которая при наложении на соответствующие атомы остова структуры а) характеризуется среднеквадратическим отклонением, составляющим менее приблизительно 2,0  , и
, и
ii) конструирование соединения, которое имитирует активность инсулина, или осуществление скрининга в отношении него.
В некоторых вариантах осуществления создание модели трехмерной структуры предусматривает создание модели полипептида, связанного с IR или его областями. В некоторых вариантах осуществления модель определена атомными координатами из приложения II или их подмножеством. Предпочтительными областями IR являются области, определяющие специфичность, например, области, описанные выше как целевые участки связывания.
В некоторых вариантах осуществления способы дополнительно предусматривают осуществление синтеза соединения, которое потенциально связывается с IR. В некоторых вариантах осуществления соединение модулирует по меньшей мере одну биологическую активность IR. В некоторых вариантах осуществления способ может дополнительно предусматривать тестирование соединения, сконструированного или отобранного с помощью скрининга на стадии ii), в отношении его способности модулировать по меньшей мере одну биологическую активность IR. Например, способ может дополнительно предусматривать тестирование соединения, сконструированного или отобранного с помощью скрининга на стадии ii), в отношении его способности модулировать уровни глюкозы в крови. В некоторых вариантах осуществления стадии i) и ii) осуществляют in silico.
В некоторых вариантах осуществления соединения, идентифицированные с помощью способов по настоящему изобретению, способны связываться с IR. Предпочтительно IR представляет собой человеческий рецептор IR-B. В некоторых вариантах осуществления IC50 в отношении человеческого рецептора IR-B составляет менее 10-4 М, 10-5 М, 10-6 М, 10-7 М, 10-8 М, 10-9 М или 10-10 М. Предпочтительно, IC50 в отношении человеческого рецептора IR-B составляет менее 10-6 М.
В некоторых вариантах осуществления соединения, идентифицированные с помощью способов по настоящему изобретению, не связываются с IGF-IR или слабо связываются с IGF-IR. В некоторых вариантах осуществления аналог инсулина характеризуется IC50 или Kd в отношении IGF-IR, составляющими менее 10-9 М, 10-8 М, 10-7 М, 10-6 М, 10-5 М или 10-4 М, предпочтительно аналог инсулина характеризуется аффинностью (Kd) в отношении IGF-IR, составляющей менее 100 нМ.
В некоторых вариантах осуществления соединения, идентифицированные с помощью способов по настоящему изобретению, являются преимущественно мономерными в растворе. В некоторых вариантах осуществления соединение является мономерным на по меньшей мере 50%, соединение является мономерным на по меньшей мере 60%, соединение является мономерным на по меньшей мере 70%, соединение является мономерным на по меньшей мере 75%, соединение является мономерным на по меньшей мере 80%, соединение является мономерным на по меньшей мере 85%, соединение является мономерным на по меньшей мере 90%, соединение является мономерным на по меньшей мере 95%, соединение является мономерным на по меньшей мере 98%, соединение является мономерным на по меньшей мере 99% или соединение является мономерным на примерно 100%. В некоторых вариантах осуществления соединение может являться по меньшей мере частично мономерным и диссоциировать с образованием мономерной формы при введении субъекту. В некоторых вариантах осуществления соединение является мономерным или диссоциирует с образованием мономерной формы в кровяном русле субъекта.
Как сразу поймут специалисты в данной области техники, способы по настоящему изобретению предусматривают рациональный способ конструирования и отбора белков, представляющих собой аналоги инсулина, которые взаимодействуют с инсулиновым рецептором. В некоторых случаях эти белки могут потребовать дополнительной разработки с целью повышения активности. Такая дополнительная разработка является стандартной в данной области техники, и для ее выполнения будет использоваться информация о структуре, представленная в настоящей заявке. Подразумевается, что в конкретных вариантах осуществления способы по настоящему изобретению включают такие стадии дополнительной разработки.
После того, как аналог инсулина был сконструирован или отобран с помощью вышеуказанных способов, эффективность, с которой этот аналог инсулина может связываться с мишенью, такой как IR, можно тестировать и оптимизировать с помощью вычислительной оценки. Например, аналог инсулина, который был сконструирован или отобран как имеющий возможность связывания с IR, должен также предпочтительно перемещаться в зону, не перекрывающую таковую, занимаемую участком связывания, когда он связан с нативным IR. Аналог инсулина, сконструированный или отобранный в качестве связывающегося с IR, можно дополнительно оптимизировать вычислительным способом таким образом, чтобы в связанном состоянии он предпочтительно характеризовался отсутствием отталкивающего электростатического взаимодействия с целевым белком. Такие некомплементарные (например, электростатические) взаимодействия включают отталкивающие взаимодействия между зарядами, между диполями и между зарядом и диполем. Конкретно, сумма всех электростатических взаимодействий между соединением и аналогом инсулина, когда аналог инсулина связан с IR, предпочтительно вносит нейтральный или благоприятный вклад в энтальпию связывания.
После осуществления оптимального отбора или конструирования аналога инсулина, как описано выше, затем можно осуществлять замены по некоторым из его атомов или боковых групп для улучшения или модификации его свойств связывания. В целом, первичные замены являются консервативными, т.е. замещающая группа будет характеризоваться примерно такими же размером, формой, гидрофобностью и зарядом, что и исходная группа. Разумеется, следует понимать, что компонентов, о которых в уровне техники известно, что они меняют конформацию, следует избегать. Такие аналоги инсулина с заменой можно затем анализировать в отношении эффективности их прилегания к IR с помощью тех же компьютеризированных способов, подробно описанных выше.
Специализированное компьютерное программное обеспечение для оценки энергии деформации и электростатического взаимодействия соединения доступно из уровня техники. Примеры программ, разработанных для таких применений, включают Gaussian 92, пересмотренная версия С (Frisch, Gaussian, Inc., Питтсбург, Пенсильвания); AMBER, версия 4.0 (Kollman, Калифорнийский университет в Сан-Франциско); QUANTA/CHARMM (Molecular Simulations, Inc., Барлингтон, Массачусетс) и Insight II/Discover (Biosysm Technologies Inc., Сан-Диего, Калифорния).
Настоящее изобретение охватывает аналоги инсулина (включая агонисты IR, молекулы, соединения и т.п.), идентифицированные с применением способа, описанного в данном документе. Некоторые варианты осуществления также относятся к фармацевтическим композициям, содержащим аналоги инсулина (включая агонисты IR, молекулы, соединения и т.п.), идентифицированные с применением способа, описанного в данном документе.
Скрининговые анализы и подтверждение связывания и биологической активности
Аналоги инсулина (которые включают соединения и молекулы, идентифицированные с применением способов по настоящему изобретению) по настоящему изобретению предпочтительно оценивают с помощью ряда проводимых in vitro и in vivo анализов функциональной активности IR и/или IGF-1R для подтверждения их способности взаимодействовать с IR и/или IGF-1R и модулировать их активность. Например, соединения можно тестировать в отношении их способности связываться с IR и/или IGF-1R и/или в отношении их способности модулировать, например активировать или прерывать, передачу сигнала, осуществляемую с помощью IR и/или IGF-1R.
Если скрининговый анализ представляет собой анализ связывания, IR или IGF-1R можно соединять с меткой, где метка может непосредственно или опосредованно обеспечивать обнаруживаемый сигнал. Различные метки включают радиоактивные изотопы, флуоресцентные молекулы, хемилюминесцентные молекулы, ферменты, специфически связывающиеся молекулы, частицы, например магнитные частицы, и т.п. Специфически связывающиеся молекулы включают пары, такие как биотин и стрептавидин, дигоксин и антидигоксин и т.д. Что касается участников специфического связывания, комплементарный участник обычно метят с помощью молекулы, которая обеспечивает обнаружение, в соответствии с известными процедурами.
В скрининговый анализ могут быть включены различные другие реагенты. К ним относятся такие реагенты, как соли, нейтральные белки, например альбумин, детергенты и т.д., которые применяются для облегчения оптимального связывания белков и/или уменьшения неспецифических или фоновых взаимодействий. Можно применять реагенты, которые улучшают эффективность анализа, такие как ингибиторы протеаз, ингибиторы нуклеаз, противомикробные средства и т.д. Компоненты добавляют в любом порядке, который обеспечивает требуемое связывание. Процедуры инкубирования осуществляют при любой температуре, которая способствует оптимальной активности, как правило, от 4 до 40°С.
Непосредственное связывание соединений с IR или IGF-1R можно также осуществлять с помощью поверхностного плазмонного резонанса (BIAcore) (рассмотрено в Morton и Myszka, 1998). В данном случае рецептор иммобилизируют на СМ5 или другом сенсорном чипе либо путем непосредственного химического связывания с помощью аминогруппы или связывания посредством тиол-дисульфидного обмена (Nice и Catimel, 1999), либо путем захвата эктодомена рецептора в виде слитого с Fc белка на соответствующим образом дериватизированной сенсорной поверхности (Morten и Myszka, 1998). Потенциальный аналог инсулина (называемый аналитом) пропускают по сенсорной поверхности при соответствующей скорости потока и соответствующем диапазоне концентраций. Классический способ анализа состоит в сборе откликов для широкого диапазона концентраций аналита. Диапазон концентраций обеспечивает достаточный объем информации о реакции, и с применением алгоритма подгонки, такого как CLAMP (см. Morton и Myszka, 1998), можно определить константы скорости реакции (Morton и Myszka, 1998; Nice и Catimel, 1999). Обычно поверхность лиганда восстанавливают в конце каждого цикла связывания аналита. Восстановление поверхности гарантирует, что в начале каждого цикла для аналита будет доступно одинаковое количество участков связывания лиганда.
Периоды инкубирования подбирают таким образом, чтобы обеспечить оптимальную активность, но их также можно оптимизировать для обеспечения быстрого высокопроизводительного скрининга. Обычно от 0,1 до 1 часа будет достаточно. В большинстве случаев параллельно прогоняют несколько анализируемых смесей с разными концентрациями тестируемого средства с получением отличающегося отклика на эти концентрации. Как правило, одна из этих концентраций служит в качестве отрицательного контроля, т.е. такая концентрация составляет ноль или находится ниже уровня обнаружения.
Основной формат анализа конкурентного связывания рецептора in vitro, который лежит в основе гетерогенного скрининга в отношении аналогов инсулина, являющихся заменителями нативного инсулина, может иметь следующий вид: степень занятости активного сайта IR или IGF-1R количественно определяют с помощью флуориметрического анализа с временным разрешением (TRFD), как описано Denley et al. (2004). Клетки R-IR-A, R-IR-B и P6 применяют в качестве источников IR-A, IR-B и IGF-1R соответственно. Клетки лизируют с помощью буфера для лизиса (20 мМ HEPES, 150 мМ NaCl, 1,5 мМ MgCl2, 10% (об./об.) глицерин, 1% (об./об.) Triton Х-100, 1 мМ EGTA, рН 7,5) в течение 1 часа при 4°С. Лизаты центрифугируют в течение 10 минут при 3500 об./мин. и затем добавляют в количестве 100 мкл на лунку в белый планшет Greiner Lumitrac 600, предварительно покрытый антителом 83-7 к инсулиновому рецептору или антителом 24-31 к IGF-1R. Ни одно из захватывающих антител не препятствует связыванию рецептора с инсулином, IGF-I или IGF-II. Меченный европием инсулин или меченный европием IGF-I, генерирующие флуоресцентный сигнал, составляющий примерно 100000 импульсов, добавляют в каждую лунку вместе с различными количествами немеченного конкурирующего аналога инсулина и инкубируют в течение 16 часов при 4°С. Лунки промывают с помощью 20 мМ Tris, 150 мМ NaCl, 0,05% (об./об.) Tween 20 (TBST) и добавляют усиливающий раствор DELFIA (100 мкл/лунка). Флуоресценцию с временным разрешением измеряют с применением фильтров с длиной волны возбуждения 340 нм и длиной волны излучения 612 нм с помощью флуориметра Polarstar™ от BMG Lab Technologies или Wallac Victor II (EG & G Wallac, Inc.).
Примеры других подходящих анализов, которые можно использовать для оценки связывания соединений с IR и биологической активности соединений в отношении IR, хорошо известны из уровня техники. Например, подходящие анализы можно найти в международной публикации согласно РСТ номер WO 03/027246. Примеры подходящих анализов включают следующие.
(i) Аутофосфорилирование рецептора (как описано Denley et al. (2004). Клетки R-IR-A, R-IR-B или P6 высевают в 96-луночный плоскодонный планшет Falcon в количестве 2,5×104 клеток/лунка и выращивают в течение ночи при 37°С, 5% СО2. Клетки промывают в течение 4 часов в бессывороточной среде перед обработкой одним из инсулина, IGF-I или IGF-II в 100 мкл DMEM с 1% BSA в течение 10 минут при 37°С, 5% СО2. К клеткам добавляют буфер для лизиса, содержащий 2 мМ Na3VO4 и 1 мг/мл NaF, и рецепторы из лизатов захватывают на 96-луночных планшетах, предварительно покрытых антителом 83-7 или 24-31 и блокированных с помощью 1x TBST/0,5% BSA. После инкубирования в течение ночи при 4°С планшеты промывают с помощью 1 х TBST. Фосфорилированный рецептор обнаруживают с помощью меченного европием антитела PY20 к фосфотирозину (130 нг/лунка, комнатная температура, 2 часа). Добавляют усиливающий раствор DELFIA (100 мкл/лунка) и осуществляют обнаружение флуоресценции с временным разрешением, как описано выше.
(ii) Поглощение глюкозы с применением 2-дезокси-[U-14С]-глюкозы (как описано Olefsky, 1978). Адипоциты на стадии 8-12 дней после дифференцировки в 24-луночном планшете дважды промывают в бикарбонатном буфере Кребса-Рингера (25 мМ Hepes, рН 7,4, содержащий 130 мМ NaCl, 5 мМ KCl, KH2PO4, 1,3 мМ MgSO4⋅7H2O, 25 мМ NaHCO3 и 1,15 мМ CaCl2), дополненном 1% (вес/объем) BSA степени чистоты для RIA и 2 мМ пируватом натрия. Адипоцитам обеспечивают возможность достижения равновесного состояния в течение 90 мин. при 37°С перед добавлением инсулина или в течение 30 мин. перед добавлением агониста или антагониста. Инсулин (Actrapid, Novogen) добавляют в диапазоне концентраций от 0,7 до 70 нМ в течение 30 мин. при 37°С. Агонист или антагонист (от 0 до 500 мМ) добавляют к адипоцитам в течение 90 мин. с последующим добавлением нативного инсулина в случае антагонистов. Поглощение 50 мМ 2-дезоксиглюкозы и 0,5 мКи 2-дезокси-[U-14С]-глюкозы (NEN, PerkinElmer Life Sciences) на лунку измеряют в течение последних 10 мин. стимуляции агонистом с помощью сцинциляционного счетчика.
(iii) Транслокация переносчика глюкозы GLUT4 с применением "газонов" из плазматической мембраны (как описано Robinson и James (1992) и Marsh et al. (1995)).
(iv) Транслокация GLUT4 с применением "газонов" из плазматической мембраны (как описано Marsh et al. 1995). Фибробласты 3T3-L1 выращивают на покровных стеклах в 6-луночных планшетах и подвергают дифференцировке в адипоциты. Через 8-12 дней после дифференциации адипоциты подвергают сывороточному голоданию в течение 18 ч. в DMEM, содержащей 0,5% FBS. Клетки дважды промывают в бикарбонатном буфере Кребса-Рингера, рН 7,4 и обеспечивают возможность достижения равновесного состояния в течение 90 мин. при 37°С перед добавлением инсулина (100 нМ) или в течение 30 мин. перед добавлением соединения (100 мкМ). После обработок адипоциты промывают в 0,5 мг/мл растворе поли-L-лизина в PBS, подвергают гипотоническому шоку путем трех промывок в 1:3 (об./об.) буфере для мембран (30 мМ Hepes, рН 7,2, содержащий 70 мМ KCl, 5 мМ MgCl2, 3 мМ EGTA и свежедобавленные 1 мМ DTT и 2 мМ PMSF) на льду. Промытые клетки затем обрабатывают ультразвуком с применением ультразвукового диспергатора зондового типа (Microson) в режиме 0 в 1:1 (об./об.) буфере для мембран на льду с получением "газона" из фрагментов плазматической мембраны, которые остаются прикрепленными к покровному стеклу. Фрагменты фиксируют в 2% (вес/объем) растворе параформальдегида в буфере для мембран в течение 20 мин. при 22°С и фиксатор гасят с помощью 100 мМ глицина в PBS. Фрагменты плазматической мембраны затем блокируют в 1% (вес/объем) растворе Blotto в буфере для мембран в течение 60 мин. при 22°С и подвергают иммуномечению с помощью полученного в лабораторных условиях и подвергнутого аффинной очистке кроличьего поликлонального антитела к GLUT4 (клон R10, полученный к пептиду, охватывающему 19 С-концевых аминокислот GLUT4) и вторичного антитела, представляющего собой антитело козы к антителу кролика, меченного Alexa 488 (Molecular Probes; 1:200). Покровные стекла устанавливают поверх предметных стекол с применением реагента FluoroSave (Calbiochem) и получают изображения с применением конфокального лазерного сканирующего иммунофлуоресцентного микроскопа OptiScan (Optiscan, Виктория, Австралия). Данные анализируют с применением программного обеспечения для обработки изображений ImageJ (NIH). В каждом эксперименте для каждого условия изучают по меньшей мере шесть полей, и настройки коэффициента усиления конфокального микроскопа сохраняют на протяжении периода проведения экспериментов для сведения к минимуму изменчивости между экспериментами.
Активность аналога инсулина можно определять с применением анализа адипоцитов. Инсулин увеличивает поглощение 3Н-глюкозы адипоцитами и ее превращение в липид. Встраивание 3Н в липидную фазу определяют с помощью разделения липидной фазы в сцинтилляционной смеси, которая не содержит водорастворимые 3Н-продукты. Определяют влияние аналогов инсулина на встраивание 3Н-глюкозы при субмаксимальной дозе инсулина. Способ адаптирован из Moody et al. (1974). Эпидидимальные жировые тела мыши вырезают, измельчают в буфер для расщепления (Кребса-Рингера: 25 мМ HEPES, 4% HSA, 1,1 мМ глюкозы, 0,4 мг/мл коллагеназы типа 1, рН 7,4) и подвергают расщеплению в течение вплоть до 1,5 часа при 36,5°С. После фильтрации, промывания (Кребса-Рингера: HEPES, 1% HSA) и ресуспендирования в аналитическом буфере (Кребса-Рингера: HEPES, 1% HSA) свободные жировые клетки переносят с помощью пипетки в 96-луночные планшеты Picoplate, содержащие тестируемый раствор.
Анализ начинают путем добавления 3Н-глюкозы (например, TRK 239 Amersham) в конечной концентрации 0,45 мМ глюкозы. Анализируемую смесь инкубируют в течение 2 часов при 36,5°С во встряхивателе-инкубаторе с держателем башенного типа Labshaker, 400 об./мин., затем прекращают путем добавления сцинтилляционной жидкости на основе Permablend/толуол (или эквивалентной) и планшеты герметично закрывают с последующим выдерживанием в течение по меньшей мере 1 часа и обнаружением с помощью счетчика Packard Top Counter или эквивалентного. Стандартную кривую для полного нативного инсулина (по 8 дозам) получают в качестве контроля в каждом планшете.
Данные представляют в графическом виде, отражающем влияние аналога инсулина на поглощение 3Н-глюкозы, при этом данные сравнивают с ответом на нативный инсулин. Анализ также можно проводить при базальной или максимальной концентрации инсулина.
Для тестирования активности аналога инсулина in vivo можно осуществлять анализ уровня глюкозы в крови после внутривенной инъекции на крысах линии Wistar следующим образом. Самцов крыс линии Mol:Wistar с весом приблизительно 300 г делят на две группы. Образец крови объемом 10 мкл отбирают из хвостовой вены для определения концентрации глюкозы в крови. Затем крыс анестезируют (например, с помощью гипнорма/дормикума) в момент времени t=30 мин. и снова измеряют уровень глюкозы в крови в момент времени t=-20 мин. и в момент времени t=0 мин. После отбора образца в момент времени t=0 крысам в хвостовую вену вводят среду-носитель или тестируемое вещество в изотоническом водном буфере при концентрации, соответствующей объему инъекции 1 мл/кг. Уровень глюкозы в крови измеряют в моменты времени 5, 10, 20, 30, 40, 60, 80, 120 и 180 мин. Введение анестезирующего средства повторяют с интервалом 20 мин.
Аналоги инсулина, соединения и/или молекулы, сконструированные или отобранные согласно способам по настоящему изобретению, можно также оценивать с помощью ряда биофизических способов. Подходящие способы включают рентгеновскую кристаллографию, аналитическое ультрацентрифугирование, эксклюзионную хроматографию, изотермическую калориметрию и т.п. Например, в отношении аналогов инсулина (которые включают соединения и молекулы, идентифицированные с применением способов по настоящему изобретению) можно осуществлять дополнительное подтверждение путем кристаллизации аналога и определения структуры, как описано в данном документе. Например, состояние мультимеризации в растворе можно определить с помощью аналитического ультрацентрифугирования. Аналитическое ультрацентрифугирование осуществляют при 20°C с применением аналитической центрифуги Beckman XLI в кюветах с длиной оптического пути 12 мм. Образец, содержащий соединение, разбавляют в 10 мМ HCl в 10 мМ Tris, 50 мМ NaCl, рН 7,4 до конечной концентрации 100 мкг/мл. Специалисту в данной области техники будет понятно, что можно применять другие буферы, соли и т.п. Например, можно также получить образцы, которые содержат 0,2 мМ ZnCl2, 2 мМ CaCl2, 1 мМ фосфата натрия (рН 7,4) или 0,1 М сульфата аммония. Для нейтрализации любого изменения рН добавляют равный объем 10 мМ NaOH. Образец применяют в общем объеме 100 мкл.
Значения радиального распределения концентраций определяют путем измерения поглощения при 220 нм. Седиментационное равновесие было установлено при 30000 и 45000 об./мин., что оценивалось с помощью последовательных сканограмм поглощения с интервалом в 1 ч. Для данных, полученных при двух скоростях, осуществляют совместную подгонку к отдельной идеально осаждающейся молекуле в SEDPHAT (Houtman et al. 2007) с применением значений плотности раствора и парциального удельного объема растворителя, полученных путем оценки композиции с применением SEDNTERP (Laue et al. 1992). За исключением дисульфидов, все посттрансляционные модификации не учитываются при оценке парциального удельного объема соединения.
Клинические показания, пути введения, дозировки и фармацевтические композиции
Аналоги инсулина, соединения и молекулы, имеющие отношение к настоящему изобретению, являются полезными при лечении состояний, которые реагируют на активацию и/или модуляцию IR. Эти состояния включают состояния, при которых показана регуляция метаболизма глюкозы и/или уровней глюкозы в крови.
Состояния, которые реагируют на активацию и/или модуляцию IR, включают без ограничения сахарный диабет (например, диабет 1 типа, диабет 2 типа, гестационный диабет), гипергликемию, инсулинорезистентность, нарушение толерантности к глюкозе и т.п. В некоторых вариантах осуществления состояние представляет собой связанное с инсулином состояние. Связанные с инсулином состояния включают без ограничения гипергликемию, инсулинорезистентность, диабет 1 типа, гестационный диабет или диабет 2 типа.
Аналоги инсулина по настоящему изобретению подходят для применения у субъекта, такого как млекопитающее, включая человека, для регулирования метаболизма глюкозы. Соответственно, предусмотрено способы регулирования метаболизма глюкозы. Некоторые варианты осуществления относятся к способу регулирования метаболизма глюкозы путем введения субъекту, нуждающемуся в этом, терапевтически эффективного количества такого аналога инсулина. Некоторые варианты осуществления относятся к способу лечения связанного с инсулином состояния, предусматривающему введение терапевтически эффективного количества аналога инсулина, определенного в данном документе, субъекту, нуждающемуся в этом. Некоторые варианты осуществления относятся к способу лечения диабета путем введения субъекту, нуждающемуся в этом, терапевтически эффективного количества аналога инсулина. Диабет включает без ограничения диабет 1 типа, диабет 2 типа или гестационный диабет. Некоторые варианты осуществления относятся к способу лечения гипергликемии путем введения субъекту, нуждающемуся в этом, терапевтически эффективного количества такого аналога инсулина. Некоторые варианты осуществления относятся к способу лечения инсулинорезистентности путем введения субъекту, нуждающемуся в этом, терапевтически эффективного количества такого аналога инсулина. Некоторые варианты осуществления относятся к способу лечения нарушения толерантности к глюкозе путем введения субъекту, нуждающемуся в этом, терапевтически эффективного количества такого аналога инсулина. Некоторые варианты осуществления относятся к способу снижения уровней глюкозы в крови у субъекта путем введения субъекту, нуждающемуся в этом, терапевтически эффективного количества такого аналога инсулина.
Например, раскрыты способы лечения диабета 1 типа у субъекта, предусматривающие введение терапевтически эффективного количества пептида, содержащего пептид, представляющий собой А-цепь инсулина, и пептид, представляющий собой В-цепь инсулина, где пептид, представляющий собой В-цепь, содержит замену по аминокислоте 10 и аминокислоте 20, субъекту, нуждающемуся в этом. В некоторых случаях замена по аминокислоте 20 в пептиде, представляющем собой В-цепь, может представлять собой G20Y, G20F или G20P. В некоторых вариантах раскрытых пептидов замена по аминокислоте 10 в пептиде, представляющем собой В-цепь, может представлять собой Н10Е, H10D или H10Q. В некоторых случаях может присутствовать любая комбинация замен по аминокислотам 10 и 20 в В-цепи. В некоторых случаях А-цепь введенного пептида может также содержать по меньшей мере одну замену. Например, в некоторых случаях по меньшей мере одна замена в пептиде, представляющем собой А-цепь, может представлять собой Т8Н, T8Y, T8K или S9R. В некоторых случаях аминокислотная замена может присутствовать в положении 8 или 9 или в обоих положениях. Таким образом, в некоторых случаях может присутствовать любая комбинация раскрытых замен в пептиде, представляющем собой В-цепь, и замен в пептиде, представляющем собой А-цепь. Также в данном документе раскрыты способы лечения диабета 1 типа у субъекта, предусматривающие введение терапевтически эффективного количества аналога инсулина, определенного в данном документе. В некоторых случаях у субъекта до введения пептида был диагностирован диабет 1 типа. В некоторых случаях у субъекта до введения пептида было диагностировано наличие риска развития диабета 1 типа.
Также предусмотрено применение аналога инсулина, соединения или молекулы, определенных в данном документе, в изготовлении лекарственного препарата. Некоторые варианты осуществления относятся к применению аналога инсулина, определенного в данном документе, в изготовлении лекарственного препарата для регулирования метаболизма глюкозы у субъекта. Некоторые варианты осуществления относятся к применению аналога инсулина, определенного в данном документе, в изготовлении лекарственного препарата для лечения и/или предупреждения связанного с инсулином состояния у субъекта. Некоторые варианты осуществления относятся к применению аналога инсулина, определенного в данном документе, в изготовлении лекарственного препарата для лечения и/или предупреждения диабета у субъекта. Некоторые варианты осуществления относятся к применению аналога инсулина, определенного в данном документе, в изготовлении лекарственного препарата для лечения и/или предупреждения гипергликемии у субъекта. Некоторые варианты осуществления относятся к применению аналога инсулина, определенного в данном документе, в изготовлении лекарственного препарата для лечения и/или предупреждения инсулинорезистентности у субъекта. Некоторые варианты осуществления относятся к применению аналога инсулина, определенного в данном документе, в изготовлении лекарственного препарата для лечения и/или предупреждения нарушения толерантности к глюкозе у субъекта. Некоторые варианты осуществления относятся к применению аналога инсулина, определенного в данном документе, в изготовлении лекарственного препарата для снижения уровней глюкозы в крови у субъекта.
Некоторые варианты осуществления также относятся к аналогу инсулина, определенному в данном документе, для применения в регулировании метаболизма глюкозы у субъекта. Некоторые варианты осуществления относятся к аналогу инсулина, определенному в данном документе, для применения в лечении и/или предупреждении связанного с инсулином состояния у субъекта. Некоторые варианты осуществления относятся к аналогу инсулина, определенному в данном документе, для применения в лечении и/или предупреждении диабета у субъекта. Некоторые варианты осуществления относятся к аналогу инсулина, определенному в данном документе, для применения в лечении и/или предупреждении гипергликемии у субъекта. Некоторые варианты осуществления относятся к аналогу инсулина, определенному в данном документе, для применения в лечении и/или предупреждении инсулинорезистентности у субъекта. Некоторые варианты осуществления относятся к аналогу инсулина, определенному в данном документе, для применения в лечении и/или предупреждении нарушения толерантности к глюкозе у субъекта. Некоторые варианты осуществления относятся к аналогу инсулина, определенному в данном документе, для применения в обеспечении снижения уровней глюкозы в крови у субъекта.
В некоторых вариантах осуществления введение аналога инсулина приводит к снижению уровней глюкозы в крови. Предпочтительно аналог инсулина представляет собой аналог инсулина короткого действия, так что введение аналога инсулина приводит к снижению уровней глюкозы в крови в течение 60 минут после введения. В некоторых вариантах осуществления введение аналога инсулина приводит к снижению уровней глюкозы в крови в течение нескольких минут, 40 минут, 30 минут, 20 минут, 10 минут или 5 минут после введения. В некоторых вариантах осуществления введение аналога инсулина приводит к снижению уровней глюкозы в крови в течение 1 часа, 2 часов, 3 часов, 4 часов, 5 часов, 6 часов, 7 часов, 8 часов, 9 часов, 10 часов, 11 часов или 12 часов. В любом из способов, раскрытых в данном документе, можно вводить предпочтительные соединения, которые подробно обсуждались в данном документе. Уровни содержания глюкозы в крови можно измерять с помощью любых способов, известных специалисту в данной области техники.
Способы повышения активации инсулинового рецептора
Раскрыты способы повышения активации инсулинового рецептора у субъекта, предусматривающие введение терапевтически эффективного количества любого из раскрытых аналога инсулина, пептида, соединения, молекулы или фармацевтических композиций субъекту, нуждающемуся в этом. В некоторых случаях субъект, нуждающийся в этом, может представлять собой субъекта, у которого, как известно, имеется пониженная активация инсулинового рецептора по сравнению со стандартным уровнем активации. В некоторых случаях стандартный уровень активации в отношении активации инсулинового рецептора может основываться на уровнях, установленных у здоровых индивидуумов. В некоторых случаях стандартный уровень активации в отношении активации инсулинового рецептора может основываться на уровнях, установленных у субъекта, который подвергался лечению до определения необходимости в повышении активации инсулинового рецептора.
Например, раскрыты способы повышения активации инсулинового рецептора у субъекта, предусматривающие введение терапевтически эффективного количества пептида, содержащего пептид, представляющий собой А-цепь инсулина, и пептид, представляющий собой В-цепь инсулина, где пептид, представляющий собой В-цепь, содержит замену по аминокислоте 10 и аминокислоте 20, субъекту, нуждающемуся в этом. В некоторых случаях замена по аминокислоте 20 в пептиде, представляющем собой В-цепь, может представлять собой G20Y, G20F или G20P. В некоторых вариантах раскрытых пептидов замена по аминокислоте 10 в пептиде, представляющем собой В-цепь, может представлять собой Н10Е, H10D или H10Q. В некоторых случаях может присутствовать любая комбинация замен по аминокислотам 10 и 20 в В-цепи. В некоторых случаях А-цепь введенного пептида может также содержать по меньшей мере одну замену. Например, в некоторых случаях по меньшей мере одна замена в пептиде, представляющем собой А-цепь, может представлять собой Т8Н, T8Y, T8K или S9R. В некоторых случаях аминокислотная замена может присутствовать в положении 8 или 9 или в обоих положениях. Таким образом, в некоторых случаях может присутствовать любая комбинация раскрытых замен в пептиде, представляющем собой В-цепь, и замен в пептиде, представляющем собой А-цепь. Также раскрыты способы повышения активации инсулинового рецептора у субъекта, предусматривающие введение терапевтически эффективного количества аналога инсулина, определенного в данном документе.
Способы снижения уровня содержания сахара в крови
Раскрыты способы снижения уровня сахара в крови у субъекта, предусматривающие введение терапевтически эффективного количества любого из раскрытых аналогов инсулина, пептидов, соединений или фармацевтических композиций субъекту, нуждающемуся в этом.
В некоторых случаях субъект, нуждающийся в этом, может представлять собой субъекта, у которого, как известно, имеется повышенный уровень содержания сахара в крови по сравнению со стандартным уровнем содержания сахара в крови. В некоторых случаях стандартный уровень активации в отношении активации инсулинового рецептора может основываться на уровнях, установленных у здоровых индивидуумов. В некоторых случаях стандартный уровень активации в отношении активации инсулинового рецептора может основываться на уровнях, установленных у субъекта, который подвергался лечению до определения необходимости в повышении активации инсулинового рецептора.
Например, раскрыты способы снижения уровня содержания сахара в крови у субъекта, предусматривающие введение терапевтически эффективного количества пептида, содержащего пептид, представляющий собой А-цепь инсулина, и пептид, представляющий собой В-цепь инсулина, где пептид, представляющий собой В-цепь, содержит замену по аминокислоте 10 и аминокислоте 20, субъекту, нуждающемуся в этом. В некоторых случаях замена по аминокислоте 20 в пептиде, представляющем собой В-цепь, может представлять собой G20Y, G20F или G20P. В некоторых вариантах раскрытых пептидов замена по аминокислоте 10 в пептиде, представляющем собой В-цепь, может представлять собой Н10Е, H10D или H10Q. В некоторых случаях может присутствовать любая комбинация замен по аминокислотам 10 и 20 в В-цепи. В некоторых случаях А-цепь введенного пептида может также содержать по меньшей мере одну замену. Например, в некоторых случаях по меньшей мере одна замена в пептиде, представляющем собой А-цепь, может представлять собой Т8Н, T8Y, T8K или S9R. В некоторых случаях аминокислотная замена может присутствовать в положении 8 или 9 или в обоих положениях. Таким образом, в некоторых случаях может присутствовать любая комбинация раскрытых замен в пептиде, представляющем собой В-цепь, и замен в пептиде, представляющем собой А-цепь. Также раскрыты способы снижения уровня сахара в крови у субъекта, предусматривающие введение терапевтически эффективного количества аналога инсулина, определенного в данном документе.
Введение и дозировки
Описанные пути введения и дозировки предназначены только в качестве руководства. Специалисту в данной области техники будет понятно на основании раскрытия, изложенного в данном документе, что конкретные схемы введения дозировок для композиций, составов, способов и применений, охваченных в данном документе, можно определить эмпирическим путем посредством осуществления клинических и/или фармакокинетических экспериментов, и что такие дозировки можно регулировать согласно предварительно заданным критериям в отношении эффективности и/или токсичности. Также будет понятно, что конкретная дозировка и схема лечения для любого конкретного пациента будут зависеть от ряда факторов, включая активность и концентрацию конкретных используемых соединений, характеристики пациента, такие как возраст, вес и ответ конкретного пациента, комбинацию активных ингредиентов, решение лечащего врача и природу и тяжесть состояния, в отношении которого осуществляется лечение. Приведенные ниже дозировки представляют собой иллюстрацию среднестатистического случая. Разумеется, могут быть отдельные случаи, когда оправданы более высокие или более низкие диапазоны дозировки, и они находятся в пределах объема настоящего изобретения.
В соответствии со способами и путями применения, описанными в данном документе, субъект может получать терапевтически эффективное количество аналога инсулина в одной или нескольких дозах. Фактическое вводимое количество и скорость и динамика введения будут варьировать в зависимости от пути введения, характера требуемого благоприятного эффекта, природы и тяжести состояния, в отношении которого осуществляется лечение, состояния субъекта, подлежащего лечению, и, прежде всего, от решения наблюдающего ветеринарного врача или медицинского работника. Назначение лечения, например, решения в отношении дозировки, временных рамок и т.д., входит в сферу ответственности наблюдающего ветеринарного врача или медицинского работника и, как правило, при этом учитывается природа нарушения, состояние отдельного пациента, место доставки, способ введения и другие факторы, известные специалистам-практикам.
Специалисту в данной области техники будет понятно, что один или несколько аналогов вместе или по отдельности можно вводить по любому подходящему графику, например, от одного или нескольких раз в день до одного или нескольких раз в неделю; включая один раз в два дня, в течение любого количества дней или недель или любой их вариации. Обычно аналог инсулина вводят один, два, три, четыре или больше раз в день. Однако аналог инсулина можно также вводить по мере необходимости, например, когда уровни глюкозы в крови превышают нормальный диапазон или когда необходимо снизить уровни глюкозы в крови. Обычно соединение или композицию по настоящему изобретению вводят вместе с приемом пищи, до или после приема пищи. Предпочтительно аналог инсулина вводят перед каждым приемом пищи, например, перед завтраком, обедом и ужином. В некоторых вариантах осуществления соединение или композицию вводят за 5, 10, 20, 30, 40, 50 или 60 минут до приема пищи. В некоторых вариантах осуществления соединение или композицию вводят непосредственно перед приемом пищи.
Аналог инсулина, а также фармацевтические композиции, описанные в данном документе, можно вводить любым путем, известным специалисту в данной области техники, причем наибольший интерес представляет парентеральный путь. Соответственно, в одном варианте осуществления настоящего изобретения аналоги инсулина вводят парентеральным путем, как, например, с помощью инъекции или инфузии. Другие подходящие пути введения, например энтеральный (например, пероральное введение), находятся в пределах объема настоящего изобретения. В конкретном варианте осуществления парентеральный путь является предпочтительным и включает внутривенную, внутрисуставную, внутрибрюшинную, подкожную, внутримышечную, внутригрудинную инъекцию и инфузию, а также введение сублингвальным, чрескожным, местным, чрезслизистым, в том числе назальным, путем или с помощью ингаляции, такой как, например, ингаляция с доставкой в легкие.
Аналоги инсулина можно вводить в подходящей среде-носителе, или их можно вводить в форме подходящей фармацевтической композиции. Такие композиции также находятся в пределах объема настоящего изобретения. Далее описаны подходящие фармацевтические композиции.
Фармацевтические композиции
Специалисту в данной области техники будет понятно, что аналоги инсулина, описанные в данном документе, можно составлять в виде фармацевтических композиций. Такие композиции могут включать аналог инсулина и один или несколько фармацевтически приемлемых носителей.
Как используется в данном документе, термин "фармацевтически приемлемый носитель" включает любые возможные твердые вещества или растворители (такие как буферы на основе забуференного фосфатом солевого раствора, вода, солевой раствор), дисперсионные среды, средства для покрытия, антибактериальные и противогрибковые средства, изотонические средства и средства, задерживающие всасывание, и т.п., которые совместимы с фармацевтическим средством для введения. Фармацевтически приемлемые носители должны быть 'приемлемыми' в том смысле, что они должны быть совместимыми с другими ингредиентами композиции и не быть вредными для принимающего их лица. Подходящие фармацевтические носители описаны в "Remington's Pharmaceutical Sciences" под редакцией Е.W. Martin (Mack Publishing Co., Истон, Пенсильвания); Gennaro, A.R., Remington: The Science и Practice of Pharmacy, 20th Edition (Lippincott, Williams и Wilkins), 2000; Liberman, et al. Eds., Pharmaceutical Dosage Forms, Marcel Decker, New York, N.Y., 1980; и Kibbe, et al. Eds., Handbook of Pharmaceutical Excipients (3rd Ed.), American Pharmaceutical Association, Washington, 1999. В целом, подходящие фармацевтически приемлемые носители известны из уровня техники, и их выбор осуществляют в зависимости от целевого назначения. Например, фармацевтически приемлемые носители, которые можно применять в настоящем изобретении, включают без ограничения носители, подходящие для инъекционных или инфузионных композиций. В композиции можно также включать дополнительные активные соединения. Применение таких сред и средств для фармацевтически активных веществ хорошо известно из уровня техники. Фармацевтические композиции описаны в ряде источников, которые хорошо известны и легко доступны специалистам в данной области техники, например, Remington's Pharmaceutical Sciences (Martin E.W., Easton Pa., Mack Publishing Company, 19th ed., 1995).
Количество фармацевтически приемлемого носителя будет зависеть от уровня содержания соединения и любых других необязательных ингредиентов, которые специалист в данной области техники сможет отнести к отличным от носителя (например, другие активные средства). Составы по настоящему изобретению могут содержать фармацевтически приемлемый носитель в количестве, например, от приблизительно 5% до 99,99%, или от 25% до приблизительно 99,9%, или от 30% до 90% по весу композиции. Фармацевтически приемлемый носитель может обеспечивать баланс композиции при отсутствии других вспомогательных веществ.
Необязательно фармацевтическая композиция по настоящему изобретению дополнительно содержит другие дополнительные компоненты, например, ингредиенты, обеспечивающие терапевтический и/или профилактический эффект. Таким образом, в дополнительном аспекте настоящее изобретение относится к фармацевтической композиции, содержащей соединение по настоящему изобретению, один или несколько фармацевтически приемлемых носителей вместе с одним или несколькими другими активными средствами. В целом, количество другого активного средства, присутствующего в фармацевтической композиции, является достаточным для обеспечения дополнительного благоприятного эффекта либо отдельно, либо в комбинации с другими ингредиентами в композиции.
Специалисту в данной области техники будет понятно, что эти необязательные компоненты можно классифицировать по их терапевтическому или эстетическому эффекту или их предполагаемому способу действия. Однако также следует понимать, что эти необязательные компоненты в некоторых случаях могут обеспечивать более одного терапевтического или эстетического эффекта или действовать посредством более одного способа действия. Таким образом, классификации в данном документе сделаны для удобства и не предназначены для ограничения компонента конкретным применением или применениями, которые перечислены. Также, если применимо, фармацевтически приемлемые соли компонентов применимы в данном документе.
Если в фармацевтическом составе по настоящему изобретению присутствуют другие активные средства, доза соединения может быть такой же, либо отличаться от той, которую используют, если другие дополнительные компоненты отсутствуют. Специалисты в данной области техники легко определят соответствующие дозы.
Фармацевтическую композицию составляют так, чтобы она была совместимой с ее предполагаемым путем введения, например, локальным или системным. Примеры путей введения включают парентеральный, например, внутривенное, внутрикожное, подкожное, пероральное, назальное, местное, чрескожное, чрезслизистое и ректальное введение. Пероральное и назальное введение включают введение посредством ингаляции. Растворы или суспензии, используемые для парентерального, внутрикожного или подкожного применения, могут включать следующие компоненты: стерильный разбавитель, такой как вода для инъекций, солевой раствор, нелетучие масла, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители; антибактериальные средства, такие как бензиловый спирт или метилпарабены; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие средства, такие как этилендиаминтетрауксусная кислота; буферы, такие как буферы на основе ацетатов, цитратов или фосфатов, и средства для регулирования тоничности, такие как хлорид натрия или декстроза. Значение рН можно регулировать с помощью кислот или оснований, таких как хлористоводородная кислота или гидроксид натрия. Препарат для парентерального введения можно заключать в ампулы, одноразовые шприцы или флаконы с несколькими дозами, выполненные из стекла или пластика.
Фармацевтические композиции, подходящие для инъекционного применения, включают стерильные водные растворы (если они являются водорастворимыми) или дисперсии, неводные растворы и стерильные порошки для приготовления стерильных инъекционных растворов или дисперсии для немедленного приема. Что касается внутривенного введения, подходящие носители включают физиологический раствор, бактериостатическую воду, Cremophor EL (BASF, Парсиппани, Нью-Джерси) или забуференный фосфатом солевой раствор (PBS). Во всех случаях композиция должна быть стерильной и должна быть текучей до такой степени, чтобы сохранялась возможность ее легкого введения через шприц. Она должна быть стабильной в условиях производства и хранения и защищенной от загрязняющего действия микроорганизмов, таких как бактерии и грибы. Носитель может представлять собой растворитель или дисперсионную среду, содержащую, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и т.п.) и их подходящие смеси. Надлежащую текучесть можно поддерживать, например, путем применения покрытия, такого как лецитин, путем поддержания необходимого размера частиц в случае дисперсии и путем применения поверхностно-активных веществ. Предотвращения действия микроорганизмов можно достичь с помощью различных антибактериальных и противогрибковых средств, например, парабенов, хлорбутанола, фенола, аскорбиновой кислоты, тимерозала и т.п. Изотонические средства, например, сахара, многоатомные спирты, такие как маннит, сорбит, хлорид натрия, также можно включать в композицию. Длительного всасывания инъекционных композиций можно достичь путем включения в композицию средства, которое замедляет всасывание, такого как моностеарат алюминия или желатин.
Стерильные инъекционные растворы можно получить путем включения активного соединения в необходимом количестве в соответствующий растворитель при необходимости с одним из ингредиентов, перечисленных выше, или с их комбинацией с последующей стерилизацией путем фильтрации. В целом, дисперсии получают путем включения полинуклеотида в стерильную среду-носитель, которая содержит основную дисперсионную среду и другие необходимые ингредиенты из перечисленных выше. В случае стерильных порошков для получения стерильных инъекционных растворов подходящие способы получения включают вакуумную сушку и сублимационную сушку, в результате которых получают порошковую форму активного ингредиента с любым дополнительным требуемым ингредиентом из его раствора, предварительно подвергнутого стерилизующей фильтрации.
Композиции для перорального применения обычно включают инертный разбавитель или пищевой носитель. Для перорального введения с целью терапии активное соединение можно объединять с наполнителями и применять в форме таблеток, пастилок или капсул, например, желатиновых капсул. Композиции для перорального применения также можно получить с применением жидкого носителя для применения в качестве жидкости для полоскания рта. Фармацевтически совместимые связывающие средства и/или вспомогательные вещества можно включать в качестве части композиции. Таблетки, пилюли, капсулы, пастилки и т.п. могут содержать любое из следующих ингредиентов или соединений подобной природы: связующее вещество, такое как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; наполнитель, такой как крахмал или лактоза, разрыхляющее вещество, такое как альгиновая кислота, PRIMOGEL или кукурузный крахмал; смазывающее вещество, такое как стеарат магния или стеротес; скользящее вещество, такое как коллоидный диоксид кремния; подсластитель, такой как сахароза или сахарин; или ароматизирующее вещество, такое как перечномятный ароматизатор, метилсалицилат или апельсиновый ароматизатор.
Составы, подходящие для введения посредством ингаляции путем вдыхания через нос, включают, если носитель представляет собой твердое вещество, крупнодисперсный порошок, характеризующийся размером частиц, например, в диапазоне от приблизительно 20 до приблизительно 500 микрон, который вводят способом, которым принимают лекарственный порошок для вдыхания через нос, т.е., путем быстрого вдыхания через носовой канал из контейнера с порошком, удерживаемого на близком расстоянии от носа. Подходящие составы, где носитель представляет собой жидкость для введения с помощью небулайзера, включают водные или масляные растворы средства. Для введения путем ингаляции средство (средства) можно доставлять в форме капель или аэрозоля, распыляемого из находящегося под давлением контейнера или распылителя, который содержит подходящий пропеллент, например, газ, такой как диоксид углерода, или небулайзера. Такие способы включают способы, описанные в патенте США 6468798.
Системное введение также можно осуществлять чрезслизистым или чрескожным способами. В случае чрезслизистого или чрескожного введения в составе используются пенетранты, соответствующие барьеру, через который необходимо проникнуть. Такие пенетранты в целом известны из уровня техники и включают, например в случае чрезслизистого введения, детергенты, соли желчных кислот и производные фузидовой кислоты. Чрезслизистое введение можно осуществлять посредством применения назальных спреев, капель или суппозиториев. В случае чрескожного введения активное соединение (например, полинуклеотиды по настоящему изобретению) составляют в виде мазей, бальзамов, гелей или кремов, как в целом известно из уровня техники.
Фармацевтические композиции можно получать любым из способов, хорошо известных специалисту в области техники, предусматривающей составление фармацевтических препаратов. В целом, композиции получают путем равномерного и однородного приведения в контакт аналога инсулина, молекулы или соединения с жидкими носителями или тонкодисперсными твердыми носителями или обеими. Затем, при необходимости продукту придают форму требуемого состава. В случае парентерального введения в одном варианте осуществления аналоги инсулина, соединения или молекулы по настоящему изобретению можно составлять путем смешивания при требуемой степени чистоты с фармацевтически приемлемым носителем в виде единичной инъекционной лекарственной формы (раствора, суспензии или эмульсии).
В некоторых вариантах осуществления фармацевтическая композиция содержит терапевтически эффективное количество аналога инсулина, пептида, соединения или молекулы согласно настоящему изобретению. Содержание аналога инсулина, пептида, соединения или молекулы по настоящему изобретению в фармацевтической композиции по настоящему изобретению составляет, например, от приблизительно 0,1 до приблизительно 100% вес/вес фармацевтической композиции.
Наборы
Вышеописанные вещества, а также другие вещества можно упаковывать вместе в любой подходящей комбинации в виде набора, пригодного для осуществления раскрытого способа или облегчения его осуществления. Целесообразно, если компоненты набора в заданном наборе предназначены и приспособлены для совместного применения в раскрытом способе. Раскрыты наборы, содержащие один или несколько из раскрытых аналогов инсулина. Например, раскрыты наборы, содержащие одно или несколько из раскрытых аналогов инсулина, пептидов, соединений или фармацевтических композиций.
Настоящее изобретение теперь будет дополнительно описано со ссылкой на следующие примеры, которые являются исключительно иллюстративными и неограничивающими. Примеры ссылаются на фигуры.
ПРИМЕРЫ
Пример 1. Пептидный синтез Con-Ins G1
Твердофазный пептидный синтез цепи А и цепи В Con-Ins G1
Обе цепи А и В Con-Ins G1 синтезировали с применением химического подхода с использованием Fmoc (9-флуоренилметилоксикарбонила) на автоматическом микроволновом синтезаторе пептидов СЕМ Liberty 1 (СЕМ Corporation, Мэтьюс, Северная Каролина). Для синтеза А-цепи применяли предварительно нагруженную Fmoc-Cys(Trt) амидную MBHA смолу Ринка (0,21 ммоль/г) (Peptides International, Луисвилл, Кентукки), а для синтеза В-цепи применяли предварительно нагруженную Fmoc-Arg(Pbf) смолу Ванга (0,4 ммоль/г) (AnaSpec, EGT., Фримонт, Калифорния). Защищенные по Nα с помощью Fmoc аминокислоты с защитой боковой цепи получали из коммерческих источников: Bachem Inc. (Торранс, Калифорния), Chem-Impex International (Вуд Дейл, Иллинойс), Genzyme (Кембридж, Массачусетс), Novabiochem (Сан-Диего, Калифорния), Р3 Biosystem (Луисвилл, Кентукки) и Reanal (Будапешт, Венгрия). Синтез сложного γ,γ-ди-трет-бутилового эфира Fmoc-γ-карбокси-L-глутаминовой кислоты (Fmoc-Gla(OtBu)2-OH) осуществляли на месте (Rivier et al. 1987). Защита боковой цепи для аминокислот была следующей: Lys, трет-бутилоксикарбонил (Boc); Hyp, Ser, Thr и Tyr, простой трет-бутиловый эфир (tBu); Asn, Cys и His, тритил (Trt); Arg, 2,2,4,6,7-пентаметилдигидроксибензофуран-5-сульфонил (Pbf); Glu, Gla и Asp, сложный трет-бутиловый эфир (OtBu); Cys, ацетамидометил (Acm); Cys, 4-метокситритил (Mmt); Cys, S-трет-бутилтионил (S-t-Bu).
Для обеспечения возможности образования правильных внутри- и межмолекулярных дисульфидных связей в качестве защитной группы для боковой цепи CysA7 и CysB7 применяли Acm, в качестве защитной группы для боковой цепи CysA20 и CysB19 применяли Trt, боковую цепь CysA11 защищали с помощью Mmt, а боковую цепь CysA6 защищали с помощью S-t-Bu. Обе цепи синтезировали в масштабе 0,1 ммоль. Реакции присоединения осуществляли на смоле в присутствии 5-кратного молярного избытка защищенных с помощью Fmoc аминокислот, растворенных в DMF (кроме His, который растворяли в NMP), с активацией с помощью смеси HATU [2-(1Н-9-(азабензотриазол-1-ил)-1,1,3,3-тетраметиламминия гексафторфосфат] : DIEA [N,N-диизопропилэтиламин] : АА [защищенные аминокислоты] (0,9:2:1) при 0 Вт в течение 2 мин., затем при 35 Вт, при максимальной температуре 60°C в течение 10 мин. Arg всегда подвергали реакции присоединения в два этапа: при комнатной температуре в течение 25 мин., затем при 15 Вт, при максимальной температуре 50°C в течение 12 мин. Cys, His и Gla подвергали реакции присоединения при 40 Вт, при максимальной температуре 50°C в течение 6 мин. Удаление защитной группы Fmoc осуществляли с помощью 20% раствора пиперидина, содержащего 0,1 М HOBt в DMF, в два этапа (каждый раз с применением свежего реагента), при этом начальное удаление защитной группы осуществляли в течение 2 мин. при 35 Вт с последующим удалением защитной группы в течение 5 мин. при 35 Вт, при максимальной температуре 60°C.
А-цепь Con-Ins G1: образование внутримолекулярной дисульфидной связи, отщепление и очистка
Образование внутримолекулярного дисульфидного мостика между CysA6 и CysA11 осуществляли на смоле с применением неокислительного способа (Galande et al. 2005). На первой стадии S-t-Bu из CysA6 удаляли путем восстановления с освобождением свободного тиола путем обработки смолы (760 мг) с помощью 20% меркаптоэтанола (ME) (Fluka) и 1% N-метилморфолина (NMM) в 8 мл диметилформамида (DMF) в течение ночи при комнатной температуре. Смолу промывали с помощью DMF и высушивали. Затем смолу вводили в реакцию с 10-кратным избытком 2,2'-дитиобис(5-нитропиридина) (DTNB) ~1 ммоль (Sigma-Aldrich, Сент-Луис, Миссури) в 8 мл дихлорметана (DCM) в течение 1 ч. с образованием CysA6, защищенного с помощью S-5-нитропиридинсульфенила (5-Npys). После отмывания избытка реагентов с помощью DCM смолу обрабатывали с помощью 1% трифторуксусной кислоты (TFA) в 8 мл дихлорметана (DCM) в присутствии 2 мкл триизопропилсилана (TIS) в качестве акцептора в течение 20 мин. с одновременным удалением защитной группы из CysA11(Mmt) и образованием дисульфидного мостика между CysA6 и CysA11.
Отщепление А-цепи от смолы (720 мг) и одновременное удаление защитных групп в ней осуществляли путем перемешивания смолы с 10 мл реагента, содержащего смесь (ТРА/вода/TIS : 95/2,5/2,5), в течение 2 ч. За этим следовали осаждение пептида с применением охлажденного на льду безводного простого этилового эфира, затем экстракция с помощью смеси 0,1% TFA/40% вода/60% ацетонитрил и лиофилизация. Пептид очищали с помощью системы для препаративной HPLC от Waters (Милфорд, Массачусетс) с применением картриджа PrepPak от Waters (2,5×10 см), заполненного Bondapak C18 (размер частиц 15-20 мкм, 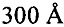 ), в системе растворителей А: 0,1% TFA/вода, В: 0,1% TFA/40% вода/60% ACN при линейном градиенте растворителя В, варьирующем от 5% до 65% за 60 мин. при скорости потока 20 мл/мин. Получали 18,7 мг (7,7 мкмоль) А-цепи. Массу пептида подтверждали с помощью MS с ионизацией электрораспылением (ESI) с измерением на приборе LTQ Orbitrap XL от ThermoScientific (Уолтем, Массачусетс) (рассчитанная моноизотопная МН+1: 2422,03 Да; определенное значение моноизотопной МН+1 2422,01 Да).
), в системе растворителей А: 0,1% TFA/вода, В: 0,1% TFA/40% вода/60% ACN при линейном градиенте растворителя В, варьирующем от 5% до 65% за 60 мин. при скорости потока 20 мл/мин. Получали 18,7 мг (7,7 мкмоль) А-цепи. Массу пептида подтверждали с помощью MS с ионизацией электрораспылением (ESI) с измерением на приборе LTQ Orbitrap XL от ThermoScientific (Уолтем, Массачусетс) (рассчитанная моноизотопная МН+1: 2422,03 Да; определенное значение моноизотопной МН+1 2422,01 Да).
В-цепь Con-Ins G1: отщепление и очистка
Отщепление В-цепи от смолы и одновременное удаление защитных групп в ней осуществляли путем перемешивания 500 мг смолы с 10 мл реагента, содержащего смесь (TFA/тиоанизол/3,6-диокса-1,8-октандитиол (DODT, TCI America, Портленд, Орегон)/вода : 87,5/5/2,5/5), в течение 2 ч. с последующим осуществлением осаждения пептида с применением охлажденного на льду безводного простого этилового эфира, затем экстракции с помощью смеси 0,1% TFA/40% вода/60% ACN и лиофилизации. Пептид очищали с помощью препаративной HPLC (как описано для очистки А-цепи, за исключением того, что градиент растворителя В варьировали от 20 до 80% за 60 мин.), при этом получали 25,9 мг (9 мкмоль) В-цепи. Массу пептида подтверждали с помощью ESI-MS (рассчитанное значение моноизотопной МН+1 2868,24 Да; определенное значение моноизотопной МН+1 2868,22 Да).
Лигирование А-цепи и В-цепи с помощью DMSO с образованием частично свернутого Con-Ins G1 (содержащего одну дисульфидную связь)
А-цепь и В-цепь (по 7 мкмоль каждой) совместно растворяли в 0,1% растворе TFA/вода (7,1 мл) и добавляли к смеси 14,5 мл DMSO, 14,25 мл воды, 35,6 мл 0,2 M Tris, содержащей 2 мМ EDTA, рН 7,5. Окисление контролировали с помощью аналитической HPLC. После выдерживания в течение 25 ч. при комнатной температуре реакционную смесь гасили с помощью 8% муравьиной кислоты (1 мл), разбавляли с помощью 0,1% TFA до общего объема 225 мл и очищали с помощью препаративной HPLC при градиенте В, варьирующем от 15 до 75% за 60 мин. Получали 4,5 мг гетеродимера (0,85 мкмоль, выход 12,1% в пересчете на исходное количество 7 мкмоль). Подлинность пептида подтверждали с помощью ESI-MS (рассчитанная моноизотопная МН+1: 5287,25 Да; определенная моноизотопная МН+1: 5287,19 Да).
Окисление с помощью I2 с образованием полностью окисленного Con-Ins G1
4,5 мг (0,85 мкмоль) Con-Ins G1 (частично свернутого) растворяли в 6,2 мл 2,5% раствора TFA/вода, и добавляли 55 мкл раствора I2 (50 мг I2 в 5 мл МеОН), и перемешивали в течение 60 мин. Смесь гасили путем добавления 1 М раствора аскорбиновой кислоты до тех пор, пока раствор не сменит цвет из желтого на прозрачный. Реакционную смесь разбавляли с помощью 60 мл воды и загружали в препаративную колонку для RP-HPLC. Получали 1,5 мг (0,29 мкмоль) полностью окисленного Con-Ins G1 (выход 35% в пересчете на исходное количество частично свернутого продукта, содержащего одну межцепочечную дисульфидную связь, и 4% в пересчете на исходное количество очищенной А-цепи). Подлинность пептида подтверждали с помощью ESI-MS на масс-спектрометре LTQ Orbitrap XL от ThermoScientific (Уолтем, Массачусетс) (рассчитанная моноизотопная МН+1: 5143,16 Да; определенная моноизотопная МН+1: 5143,16 Да).
Чистоту пептида оценивали с помощью RP-HPLC и капиллярного электрофореза. Количественную RP-HPLC осуществляли с применением системы AKTApurifier 10 от GE Healthcare (Питтсбург, Пенсильвания) и колонки Kinetex ХВ-С18 (4,6×100 мм, размер частиц 5,0 мкм, размер пор 100 Å) от Phenomenex (Торранс, Калифорния). Система растворителей содержала растворитель А=0,1% TFA в воде и растворитель В=60% ACN, 40% А. Обеспечивали градиент от 20 до 80% В за 30 мин. при скорости потока 1,0 мл/мин. Выявление осуществляли при 214 и 280 нм. Было определено, что чистота пептида составляла 89%. Капиллярный электрофорез (СЕ) осуществляли с применением прибора GPA 100 от Groton Biosystems (Боксбороу, Массачусетс). Буфер для электрофореза представлял собой 0,1 М фосфат натрия (15% ацетонитрила), рН 2,5. Разделение осуществляли путем приложения 20 кВ к капилляру (0,75 мкм × 100 см). Выявление осуществляли при 214 нм. Оцененная чистота пептида составляла 80%.
Синтез и очистка sCon-Ins G1
Con-Ins G1, содержащий в А-цепи модификации, представляющие собой замены CysA6, A11 на SecA6, A11 (называемый sCon-Ins G1; Sec = селеноцистеин), синтезировали химическим способом, очищали и окисляли, как описано Safavi-Hemami et al. (2015), за исключением того, что применяли скорректированные коэффициенты экстинкции для количественного определения В-цепи (2,980 М-1⋅см-1) и полностью окисленного sCon-Ins G1 (4,470 М-1⋅см-1). Синтез sCon-Ins G1[GluA4, ProB3, GluB10] осуществляли, как описано для sCon-Ins G1 (Safavi-Hemami et al. (2015)). Постадийное образование дисульфидных связей в sCon-Ins G1[GluA4, ProB3, GluB10] подробно описано ниже.
А-цепь sCon-Ins G1[GluA4]: отщепление, восстановление с помощью DTT и очистка
Обеспечивали отщепление пептида от 125 мг смолы в течение 1,5 ч. с применением 1 мл обогащенного реагента K (TFA/вода/фенол/тиоанизол/1,2-этандитиол, 82,5/5,0/5,0/5,0/2,5 по объему), который получали с применением 2 мл TFA (Fisher Scientific, Фэр-Лон, Нью-Джерси), 66 мкл H2O, 12 мг 2,2-дитиобис(5-нитропиридина) (DTNP; Aldrich; Сент-Луис, Миссури) и 150 мг фенола с последующим добавление 25 мкл тиоанизола. Смесь для отщепления фильтровали и осаждали с помощью 10 мл холодного простого метил-трет-бутилового эфира (МТВЕ; Fisher Scientific, Фэр-Лон, Нью-Джерси). Неочищенный пептид осаждали путем центрифугирования при 7000 × g в течение 6 мин. и промывали один раз с помощью 10 мл холодного МТВЕ. Для индуцирования образования внутримолекулярной диселенидной связи (между SecA6 и SecA10) промытый осадок пептида растворяли в 50% ACN (Fisher Scientific; Фэр-Лон, Нью-Джерси) (объем/объем) в воде и добавляли 2 мл 100 мМ дитиотреитола (DTT, EMD Chemicals, Гиббстаун, Нью-Джерси) в 1 мл 0,2 М Tris⋅HCl (Sigma, Сент-Луис, Миссури), содержащем 2 мМ EDTA (Mallinckrodt, Сент-Луис, Миссури), рН 7,5, 1 мл воды, и аккуратно перемешивали вихревым способом, и обеспечивали протекание реакции в течение 2 ч. Затем ее гасили с помощью 8% муравьиной кислоты (объем/объем) (Fisher Scientific, Фэр-Лон, Нью-Джерси), разбавляли с помощью 0,1% TFA (объем/объем) в воде и очищали с помощью обращенно-фазовой (RP) HPLC с применением полупрепаративной колонки С18 Vydac (218ТР510, 250×10 мм, размер частиц 5 мкм; Grace, Колумбия, Мэриленд) с элюированием линейным градиентом растворителя В, варьирующим от 10 до 40% за 30 мин. при скорости потока 4 мл/мин. Растворители для HPLC представляли собой 0,1% (объем/объем) TFA в воде (растворитель А) и 0,1% TFA (объем/объем) в 90% водном ACN (объем/объем) (растворитель В). Для контроля элюента поглощение УФ-излучения измеряли при 220 и 280 нм. Чистоту пептида оценивали с помощью аналитической RP-HPLC на колонке С18 Vydac (218ТР54, 250×4,6 мм, размер частиц 5 мкм, Grace, Колумбия, Мэриленд) с применением линейного градиента растворителя В, варьирующего от 10 до 40% за 30 мин. со скоростью потока 1 мл/мин. Количественное определение пептида осуществляли путем измерения поглощения УФ-излучения при 280 нм с применением коэффициента экстинкции (ε), составляющего 1490 М-1⋅см-1. Из 135 мг смолы получали 3,8 мг А-цепи. Массу пептида подтверждали с помощью MS с ионизацией электрораспылением (ESI) (рассчитанная моноизотопная МН+1: 2473,674, определенная моноизотопная МН+1: 2472,924). Значения молекулярной массы рассчитывали с применением ProteinProspector (версия 5.12.1).
В-цепь sCon-Ins G1[ProB3, GluB10]: отщепление и очистка
Обеспечивали отщепление пептида от 94 мг смолы путем обработки в течение 3 ч. с помощью 1 мл реагента K, а затем фильтровали, осаждали и промывали, как описано выше. Промытый осадок пептида очищали, как описано выше, за исключением того, что градиент растворителя В варьировал от 15 до 45%. Такой же градиент применяли для оценки чистоты линейного пептида, как описано выше, и количественное определение пептида проводили с применением значения 8, составляющего 2980 М-1⋅см-1. Из 94 мг смолы, подвергнутой реакции отщепления, получали 2,37 мг В-цепи. Массу пептида подтверждали с помощью ESI-MS (рассчитанная моноизотопная МН+1: 2808,24, определенная моноизотопная МН+1: 2808,25).
Лигирование А-цепи и В-цепи с помощью меди с образованием sCon-Ins G1[GluA4, ProB3, GluB10]
В общей сложности 100 нмоль каждой из цепей объединяли и высушивали с применением SpeedVac. Смесь пептидов растворяли в 100 мкл 0,1% TFA (объем/объем) и добавляли к смеси из 800 мкл CuCl2⋅H2O (J.T. Baker, Филипсбург, Нью-Джерси), 100 мкл 1М Tris⋅HCl, содержащего 10 нМ EDTA, рН 7,5. Конечная концентрация пептида составляла 100 мкМ. Реакционную смесь оставляли на 24 ч. при комнатной температуре и затем гасили с помощью 8% муравьиной кислоты (объем/объем), разбавляли с помощью 0,1% TFA и очищали с помощью RP-HPLC с применением препаративной колонки С18 Vydac с элюированием линейным градиентом от 15 до 45% растворителя В за 30 мин. при скорости потока 4 мл/мин. Чистоту sCon-Ins G1 оценивали с помощью аналитической RP-HPLC с применением того же градиента, что и для полупрепаративной очистки, при скорости потока 1 мл/мин. Количественное определение sCon-Ins G1[GluA4, ProB3, GluB10] осуществляли при 280 нм с применением значения ε, составляющего 4470 М-1⋅см-1. Выход реакции составлял 28%. Из 900 нмоль смеси 1:1 А- и В-цепей получали 1,36 мг требуемого продукта. Подлинность пептида подтверждали с помощью ESI-MS (рассчитанная моноизотопная МН+1: 5278,15; определенная моноизотопная МН+1: 5278,15).
Образование полностью свернутого sCon-Ins G1[GluA4, ProB3, GluB10] с помощью йода (I2)
Раствор I2 (Acros Organics, Гел, Бельгия) получали следующим образом. К 5 мл ACN добавляли 10 мг I2. После перемешивания в течение 20 мин. I2 полностью растворялся и добавляли 15 мл воды и 600 мкл TFA. В общей сложности 300 мкл смеси на основе I2 добавляли к 149 нмоль (чистота 90%) и 106 нмоль (чистота 72%) частично свернутого sCon-Ins G1[GluA4, Cys(Acm)7, ProB3, C(Acm)B7, GluB10], каждый из которых был растворен в 300 мкл 0,1% TFA. Реакционные смеси инкубировали в течение 5 мин., гасили с помощью 10 мкл 1 М L-аскорбиновой кислоты (Sigma, Сент-Луис, Миссури), разбавляли с помощью 0,1% TFA в воде до общего объема 4,5 мл и очищали, как описано для частично свернутого sCon-Ins G1[GluA4, ProB3, GluB10]. Чистоту конечного продукта (полностью свернутого sCon-Ins G1[GluA4, ProB3, GluB10]) оценивали с помощью аналитической RP-HPLC на колонке С18 Vydac (218ТР54, 250×4,6 мм, размер частиц 5 мкм) с применением того же градиента, что и для полупрепаративной очистки, при скорости потока 1 мл/мин., и было определено, что она составляла 97%. Количественное определение sCon-Ins G1[GluA4, ProB3, GluB10] осуществляли, как описано для частично свернутого продукта. Выход реакции составлял 14%, при этом получали 0,18 мг требуемого продукта. Подлинность пептида подтверждали с помощью ESI-MS (рассчитанная моноизотопная МН+1: 5134,84; определенная моноизотопная МН+1: 5134,07).
Синтез и очистка hIns[DOI] и hIns[TyrB15, TyrB20, DOI]
hIns[DOI] представляет собой мономерный аналог человеческого инсулина, в В-цепи которого отсутствуют остатки 23-30. hIns[DOI] и hIns[TyrB15, TyrB20, DOI] синтезировали химическим способом, очищали и окисляли в соответствии со стандартными процедурами.
Пример 2. Связывание Con-Ins G1 с инсулиновым рецептором человека и активация передачи сигнала
Связывание с инсулиновым рецептором
Способность Con-Ins G1 связываться с инсулиновым рецептором человека (hIR) определяли с помощью анализа конкурентного связывания. Анализы конкурентного связывания осуществляли с применением солюбилизированного иммунозахваченного человеческого IR (изоформа В) с меченным европием человеческим инсулином и повышающихся концентраций инсулина из яда, как описано ранее (Denley et al. 2004). Флуоресценцию с временным разрешением измеряли с применением фильтров с длиной волны возбуждения 340 нм и длиной волны излучения 612 нм с помощью флуориметра Polarstar (BMGLab Technologies, Морнингтон, Австралия). Значения IC50 рассчитывали с применением Prism 6 путем подгонки кривой с помощью нелинейного регрессионного анализа (по одному участку связывания). Осуществляли по меньшей мере три анализа с тремя повторностями на измеряемый параметр.
Было обнаружено, что инсулин из яда С. geographus sCon-Ins G1 является только в тридцать раз менее активным в отношении человеческого рецептора IR-B, чем hIns (sCon-Ins G1: log [IC50 (нМ)]=1,24±0,06; hIns: log [IC50 (нМ)]=-0,26±0,02), не смотря на то, что в нем отсутствует какой-либо эквивалент ArgB23 - ThrB30 hIns (фигуры 1 и 2).
Анализ активации передачи сигнала посредством инсулина
Способность Con-Ins G1 индуцировать опосредованную инсулином передачу сигнала оценивали путем анализа фосфорилирования Akt. Вкратце, уровни pAkt Ser473 измеряли в клеточной линии фибробластов мыши, NIH 3Т3, сверхэкспрессирующей человеческий IR-B. Клеточную линию культивировали в DMEM с 10% фетальной бычьей сыворотки (FBS), 100 ЕД/мл пенициллина-стрептомицина и 2 мкг/мл пуромицина. Для анализа 40000 клеток на лунку высевали в 96-луночные планшеты с культуральной средой, содержащей 1% FBS. Через 24 ч. в каждую лунку после удаления исходной среды с помощью пипетки вносили по 50 мкл раствора инсулина. После обработки в течение 30 мин. раствор инсулина удаляли и применяли набор HTRF pAkt Ser473 (Cisbio, Массачусетс, США) для измерения внутриклеточного уровня pAkt Ser473. Вкратце, клетки сначала обрабатывали буфером для лизиса клеток (50 мкл на лунку) в течение 1 ч. при легком встряхивании. Затем 16 мкл клеточного лизата добавляли к 4 мкл реагента для выявления в белом 384-луночном планшете. После инкубирования в течение 4 ч. планшет считывали на планшет-ридере Synergy Neo (BioTek, Вермонт, США) и данные обрабатывали согласно протоколу производителя. В общей сложности анализы повторяли четыре раза. Значения EC50 рассчитывали (с применением Prism 6) путем подгонки кривой с помощью нелинейного регрессионного анализа (по одному участку связывания).
Было обнаружено, что Con-Ins G1 является только в приблизительно десять раз менее активным, чем hIns в анализе фосфорилирования Akt (sCon-Ins G1: log [EC50 (нМ)]=0,90±0,05; Con-Ins G1: log [EC50 (нМ)]=0,78±0,15; hIns: log [EC50 (нМ)]=-0,20±0,20; фигура 3). Результаты авторов настоящего изобретения свидетельствуют о наличии в составе Con-Ins G1 структурных мотивов, которые обеспечивают сильную активность, несмотря на отсутствие в белке из яда эквивалента канонического триплета ароматических аминокислот либо эквивалента С-концевого сегмента В-цепи в целом.
Пример 3. Кристаллическая структура Con-Ins G1
Кристаллизация и сбор данных
Con-Ins G1 синтезировали, как описано выше. Con-Ins G1 готовили для кристаллизации в 10 мМ HCl при концентрации 4 мг/мл.
Для первичных исследований кристаллизации применяли роботизированный скрининг с применением метода висячей капли с использованием разреженной матрицы 192 условий, который осуществляли на базе CSIRO Collaborative Crystallisation Centre (Парквиль, Австралия). Один кристалл экстрагировали из лунки с условиями, включающими наличие 2,0 М сульфата аммония с 10% DL-малата-MES-Tris (рН 9,0), и затем помещали непосредственно (без криозащитного средства) в криопетлю для сбора данных дифракции при 100K на канале излучения МХ2 в синхротроне Australian Synchrotron 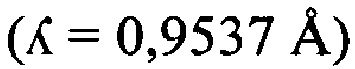 . Данные обрабатывали до разрешения
. Данные обрабатывали до разрешения 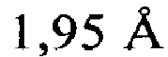 с применением XDS (Kabsch (2010)). Пространственная группа симметрии представляет собой Р432 с размерами элементарной ячейки
с применением XDS (Kabsch (2010)). Пространственная группа симметрии представляет собой Р432 с размерами элементарной ячейки 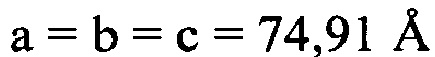 . Исходя из того, что кажущаяся молекулярная масса мономера составляла 5143 Да и на асимметрическую единицу приходилась 1 молекула, содержание растворителя оценили как составляющее 64%.
. Исходя из того, что кажущаяся молекулярная масса мономера составляла 5143 Да и на асимметрическую единицу приходилась 1 молекула, содержание растворителя оценили как составляющее 64%.
Решение и уточнение структуры
Решение структуры осуществляли с помощью молекулярного замещения с применением в качестве исходной модели мономерного инсулина из записи "3I3Z" в PDB и с применением программного обеспечения PHASER (McCoy et al, 2007). Для уточнения кристаллической структуры использовали PHENIX (Adams et al. 2010) с последующей итераций с помощью построения модели в COOT (Emsley и Cowtan, 2004). Один сульфат-ион, наблюдаемый вблизи оси четвертого порядка, моделировали без ограничений по его ориентации или положению, что осуществлялось в PHENIX путем установки значения его занятости равным единице, а не 0,25. Статистические показатели обработки и уточнения данных представлены в таблице 1. Конечная модель характеризовалась соотношением Rwork/Rfree, составляющим 0,208/0,217. Все остатки в конечной модели находились в благоприятной области карты Рамачандрана.

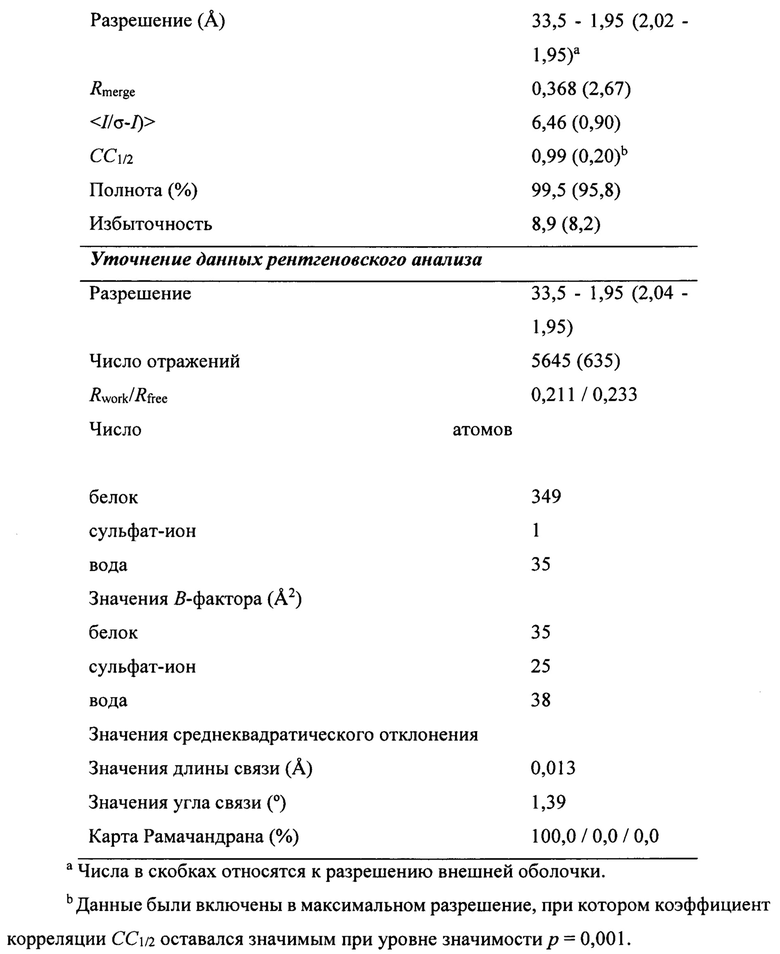
Пример 4. Структура Con-Ins G1
Из структуры видно, что общая вторичная структура Con-Ins G1 схожа со структурой hIns, при этом N-концевые остатки В-цепи образуют выступающий участок, сходный с выступающим участком hIns в классическом Т-состоянии (фигура 4а) (Т-состояние характеризуется тем, что остатки В1-В8 находятся в выступающей конформации, загнутой к А-цепи в спиральной сборке). Как и ожидалось ввиду отсутствия остатков, эквивалентных остаткам В22-В30 hIns, в кристаллографической элементарной ячейке отсутствует место контакта, напоминающее место контакта в димере hIns. Все места контакта между мономерами в кристалле являются редкими, кроме тех, которые образованы между мономерами Con-Ins G1, упакованными вокруг оси четвертого порядка, каждое из которых занимает  поверхности молекулы. Четыре мономера определяют расположение видимого сульфат-иона, лежащего вблизи оси четвертого порядка, который образует часть зарядово-компенсированного кластера с амидами GlyA1 и одной карбоксилатной группой боковой цепи каждого GlaA4 (фигура 5). На основании данных определения седиментационного равновесия, представленных ниже, авторы настоящего изобретения заключили, что эта ассоциация представляет собой артефакт кристаллизации.
поверхности молекулы. Четыре мономера определяют расположение видимого сульфат-иона, лежащего вблизи оси четвертого порядка, который образует часть зарядово-компенсированного кластера с амидами GlyA1 и одной карбоксилатной группой боковой цепи каждого GlaA4 (фигура 5). На основании данных определения седиментационного равновесия, представленных ниже, авторы настоящего изобретения заключили, что эта ассоциация представляет собой артефакт кристаллизации.
Гидрофобная сердцевина Con-Ins G1 включает боковые цепи остатков ValA2, CysA6, CysA11, PheA16, TyrA19, ArgB6, IleB11, TyrB15 и LeuB18 (фигура 4b). Из них три являются идентичными остаткам в человеческом инсулине (CysA6, CysA11 и TyrA19), три отличаются консервативно (ValA2→Ile, IleB11→Leu и LeuB18→Val) и три отличаются в значительной степени (ArgB6→Leu, PheA16→Leu и TyrB15→Leu). В hIns LeuB15, являющийся эквивалентом TyrB15 в Con-Ins G1, частично прилегает к сердцевине и частично к боковой цепи PheB24 hIns; замена на Tyr несколько уменьшает доступную гидрофобную поверхность мономера Con-Ins G1 в отсутствие эквивалента В24 hIns. Наличие более объемной боковой цепи PheA16 Con-Ins G1 (по сравнению с боковой цепью LeuA16 hIn), как оказалось, ассоциировано с изменением в TyrB15: боковая цепь TyrB15 стоит дальше от сердцевины белка по сравнению с его аналогом в hIns, при этом (большое) ароматическое кольцо PheA16 компенсирует это в отношении упаковки (фигура 4b).
Пример 5. Моделирование по гомологии и молекулярная динамика
Чтобы получить представление о структурных принципах, которые обеспечивают активность Con-Ins G1 в отношении инсулинового рецептора позвоночных в отсутствие эквивалента ключевого остатка PheB24 hIns, обеспечивающего вовлечение рецептора, авторы изобретения создали модель Con-Ins G1, связанного с элементами инсулинового рецептора человека (hIR), которые формируют первичный участок связывания гормона. Модели Con-Ins G1 в комплексе с модулем L1-CR IR (остатки Gly5 - Lys310) и сегментом αСТ IR (остатки Phe705 - Ser719 изоформы IR-A) создавали с применением MODELLER (v9.15) (Webb и Sali, (2014)), при этом в качестве матриц использовали приведенные выше кристаллическую структуру Con-Ins G1, кристаллическую структуру компонентов участка 1 IR в комплексе с hIns (запись "4OGA" в PDB; Menting et al. 2014) и ЯМР-структуру А-цепи инсулина (запись "2HIU" в PDB; Hua et al. 1995). Все модели включали посттрансляционные модификации Con-Ins G1 и один N-связанный остаток N-ацетил-D-глюкозамина при каждом из остатков Asn16, Asn25, Asn111, Asn215 и Asn255 IR (Sparrow et al. 2008).
Симуляции методом молекулярной динамики (MD) осуществляли с использованием GROMACS (v5.0.4) (Pronk et al. 2013) с силовым полем CHARMM36 (Guvench et al. 2011; Best et al. 2012) и начинали с модели комплекса Con-Ins G1/IR, которая характеризовалась наиболее низкой целевой функцией в Modeller. Предполагалось, что ионизируемые остатки, включая карбоксиглутаминовые кислоты, находились в их заряженном состоянии. Каждую систему сольватировали с применением модели воды TIP3P в кубической ячейке, выступающей на  за пределы всех атомов. Ионы натрия и хлора добавляли для нейтрализации системы и обеспечения конечного значения ионной силы, составляющего 0,1 М. Белок и растворитель (включая ионы) сопрягали по отдельности с масштабированием скорости к термостату при 300 К, применяемому со временем соударения 0,1 пс. Все симуляции осуществляли с одной отсечкой по невалентным взаимодействиям, составляющей
за пределы всех атомов. Ионы натрия и хлора добавляли для нейтрализации системы и обеспечения конечного значения ионной силы, составляющего 0,1 М. Белок и растворитель (включая ионы) сопрягали по отдельности с масштабированием скорости к термостату при 300 К, применяемому со временем соударения 0,1 пс. Все симуляции осуществляли с одной отсечкой по невалентным взаимодействиям, составляющей 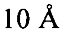 , и с применением схемы отсечки Верле с поиском соседей с интервалом обновления списка соседей, составляющим 25 шагов (50 фс); временной шаг, который применяли во всех симуляциях, составлял 2 фс.
, и с применением схемы отсечки Верле с поиском соседей с интервалом обновления списка соседей, составляющим 25 шагов (50 фс); временной шаг, который применяли во всех симуляциях, составлял 2 фс.
Периодические граничные условия применяли при методе Эвальда "частиц в ячейках", применяемого с целью учета дальнодействующих электростатических взаимодействий, с применением ширины решетки  и интерполяцией сплайнами шестого порядка. Все значения длины связи ограничивали с применением алгоритма Р-LINCS. Симуляции заключались в исходной минимизация с последующими 50 пс MD, при этом все атомы белка являлись ограниченными. После выполнения MD с ограничением в положении симуляции методом MD продолжали в течение дополнительных 10 нс с применением ограничений положения в отношении Сα-атомов IR, за исключением С-концевых остатков αСТ (остатки Val715 - Ser719). После выполнения MD с ограничением по Сα-атому симуляции продолжали без ограничений в течение дополнительных 50 нс. Координаты конечной модели представлены в приложении II.
и интерполяцией сплайнами шестого порядка. Все значения длины связи ограничивали с применением алгоритма Р-LINCS. Симуляции заключались в исходной минимизация с последующими 50 пс MD, при этом все атомы белка являлись ограниченными. После выполнения MD с ограничением в положении симуляции методом MD продолжали в течение дополнительных 10 нс с применением ограничений положения в отношении Сα-атомов IR, за исключением С-концевых остатков αСТ (остатки Val715 - Ser719). После выполнения MD с ограничением по Сα-атому симуляции продолжали без ограничений в течение дополнительных 50 нс. Координаты конечной модели представлены в приложении II.
TyrB15
Характерным признаком, который обнаруживается исходя из модели, является то, что боковая цепь TyrB15 Con-Ins G1 повернута относительно ее конформации в кристаллической структуре авторов настоящего изобретения для избежания стерического столкновения с остатком Phe714 αСТ hIR. Вращение направляет боковую цепь TyrB15 Con-Ins G1 в карман, занимаемый PheB24 hIns в комплексе с рецептором, что позволяет предположить, что TyrB15 Con-Ins G1, таким образом, является заменой для PheB24 hIns в отношении вовлечения рецептора (фигура 6). Такое вращение боковой цепи TyrB15 также обеспечивает вовлечение ключевым остатком Phe714 αСТ hIR серцевины белка из яда (фигура 6). В отличие от этого, виды инсулина позвоночных содержат лейцин в положении В15, которое является строго консервативным.
TyrB20
Боковая цепь TyrB20 Con-Ins G1 прилегает к боковой цепи TyrB15 Con-Ins G1 и может также участвовать в компенсации отсутствия эквивалента PheB24 hIns. Необходимо отметить, что кристаллографическая разность электронной плотности, связанная с боковой цепью TyrB15, в некоторой степени плохо определяется, что согласуется с такой подвижностью (фигура 7). В отличие от этого, виды инсулина позвоночных содержат глицин в положении В20, которое является строго консервативным.
РТМ
Con-Ins G1 содержит следующие четыре посттрансляционные модификации (РТМ): остатки А4 и В10 представляют собой γ-карбоксиглутамат (Gla) в отличие от Glu и His (соответственно) в hIns, остаток В3 представляет собой гидроксипролин (Hyp) в отличие от Asn в hIns, и С-концевой остаток CysA20 А-цепи является амидированным (фигура 1); следует отметить, что нумерация В-цепи Con-Ins G1 начинается с -1 для обеспечения сравнения с hIns). Такие модификации обычно наблюдаются в конотоксинах, но были выявлены ранее в видах инсулина (Safavi-Hemami et al. 2015). Синтетический аналог Con-Ins G1, содержащий РТМ, был в четыре раза более активным в отношении человеческого IR-B, чем аналог без РТМ (фигура 2), и индуцировал фосфорилирование Akt с эффективностью в восемь раз большей, чем аналог без РТМ (фигура 3).
В результате изучения четырех РТМ в структуре Con-Ins выявлено, что все они, за исключением амидирования CysA20, вероятно, играют роль в стабилизации структуры Con-Ins G1. Обе карбоксилатные группы боковой цепи GlaA4 формируют полярные взаимодействия с N-концевой аминогруппой GlyA1, как и одна карбоксилатная группа боковой цепи GluA4 hIns (фигура 4с). Эти дополнительные взаимодействия в Con-Ins G1 могут способствовать стабилизации короткой N-концевой спирали А-цепи. Одна карбоксилатная группа боковой цепи GlaB10 образует водородную связь с амидом остова CysB7 и может играть роль в стабилизации N-концевой области В-цепи; причем эквивалентного взаимодействия не существует в hIns, при этом HisB10 hIns участвует в образовании гексамера (фигура 4d). Гидроксильная группа боковой цепи НурВ3 эквивалентно расположена относительно атома кислорода амида боковой цепи AsnB3 hIns и может образовывать (длинную) Н-связь с амидом остова SerA12 (фигура 4е). С-концевой амид CysA20 не взаимодействует с оставшейся частью белка из яда.
В модели, представленной в примере 5, единственный РТМ-остаток, взаимодействующий с рецептором, представляет собой GlaB4, при этом данное взаимодействие является эквивалентным таковому между GluB4 hIns и Asn711 αСТ (фигура 8).
Пример 6. Активация передачи сигнала посредством hIns G1 DOI L15Y.G20Y
Способность hIns[DOI] и hIns[TyrB15, TyrB20, DOI] индуцировать опосредованную инсулином передачу сигнала оценивали путем анализа фосфорилирования Akt, как описано выше. Вкратце, уровни pAkt Ser473 измеряли в клеточной линии фибробластов мыши, NIH 3Т3, сверхэкспрессирующей человеческий IR-B. Клеточную линию культивировали в DMEM с 10% фетальной бычьей сыворотки (FBS), 100 ЕД/мл пенициллина-стрептомицина и 2 мкг/мл пуромицина. Для анализа 40000 клеток на лунку высевали в 96-луночные планшеты с культуральной средой, содержащей 1% FBS. Через 24 ч. в каждую лунку после удаления исходной среды с помощью пипетки вносили по 50 мкл раствора инсулина. После обработки в течение 30 мин. раствор инсулина удаляли и применяли набор HTRF pAkt Ser473 (Cisbio, Массачусетс, США) для измерения внутриклеточного уровня pAkt Ser473. Вкратце, клетки сначала обрабатывали буфером для лизиса клеток (50 мкл на лунку) в течение 1 ч. при легком встряхивании. Затем 16 мкл клеточного лизата добавляли к 4 мкл реагента для выявления в белом 384-луночном планшете. После инкубирования в течение 4 ч. планшет считывали на планшет-ридере Synergy Neo (BioTek, Вермонт, США) и данные обрабатывали согласно протоколу производителя. В общей сложности анализы повторяли четыре раза. Значения ЕС50 рассчитывали (с применением Prism 6) путем подгонки кривой с помощью нелинейного регрессионного анализа (по одному участку связывания).
Было обнаружено, что hIns[TyrB15, TyrB20, DOI] был в приблизительно пять раз более активным, чем hIns[DOI] в анализе фосфорилирования Akt (фигура 9). Результаты авторов настоящего изобретения свидетельствуют о способности мутации в положении 15 и 20 В-цепи человеческого инсулина по меньшей мере частично компенсировать отсутствие 8 С-концевых остатков.
Пример 7. Свойства раствора Con-Ins G1
Состояние самоассоциации Con-Ins G1 в растворе при 100 мкг/мл анализировали с применением анализа седиментационного равновесия. Вкратце, аналитическое ультрацентрифугирование осуществляли при 20°C с применением аналитической центрифуги Beckman XLI в кюветах с длиной оптического пути 12 мм. Con-Ins G1 разбавляли из исходного раствора с концентрацией 10 мг/мл в 10 мМ HCl в 10 мМ Tris, 50 мМ NaCl, рН 7,4 до конечной концентрации 100 мкг/мл. Для нейтрализации любого изменения рН добавляли равный объем 10 мМ NaOH. Образец применяли в общем объеме 100 мкл. Получали идентичные образцы, также содержащие 0,2 мМ ZnCl2, 2 мМ CaCl2, 1 мМ фосфата натрия (рН 7,4) или 0,1 М сульфата аммония. Значения радиального распределения концентраций определяли путем измерения поглощения при 220 нм. Седиментационное равновесие было установлено при 30000 и 45000 об./мин., что оценивали с помощью последовательных сканограмм поглощения с интервалом в 1 ч. Для данных, полученных при двух скоростях, осуществляли совместную подгонку к отдельной идеально осаждающейся молекуле в SEDPHAT (Houtman et al. 2007) с применением значений плотности раствора и парциального удельного объема растворителя, полученных путем оценки композиции с применением SEDNTERP (Laue et al. 1992). За исключением дисульфидов, все посттрансляционные модификации не учитывали при оценке парциального удельного объема Con-Ins G1. Сообщенные ошибки описывают точность подгонки при уровне достоверности 0,68, оцененном согласно симуляциям Монте-Карло, реализованным в SEDPHAT.
Данные (полученные при 30000 и 45000 об./мин.) хорошо описаны для Con-Ins G1, представляющего собой отдельную осаждающуюся молекулу с кажущейся MW 5380±55 г/моль (фигура 10). Хотя подгонка является превосходной (уменьшенный χ2=0,95), масса согласно наилучшей подгонке немного превышает ожидаемую. Вероятно, это отражает неточную оценку парциального удельного объема белка, который авторы настоящего изобретения определяли исходя из аминокислотного состава, не учитывая присутствующие посттрансляционные модификации. Однако возможно, что данное повышение предсказанной массы является результатом присутствия небольшого количества молекул с более высокой молекулярной массой. По большей части это будет приравниваться к присутствию 5% димерного Con-Ins G1. На основании рассчитанной теоретической массы, составляющей 5143, авторы настоящего изобретения заключили, что Con-Ins G1 является преимущественно мономерным в растворе. Мономерная природа Con-Ins G1, таким образом, согласуется с отсутствием эквивалента С-концевой части В-цепи человеческого инсулина (аминокислоты В22-В30), которая, как было показано, имеет критически важное значение в отношении олигомеризации инсулина.
Авторы настоящего изобретения также осуществляли тестирование в отношении того, изменяют ли Zn2+, Са2+, SO42- или РО43- состояние агрегации Con-Ins G1; в частности, в случае Zn2+ для тестирования того, может ли ион опосредовать мультимеризацию Con-Ins G1, что он делает для hIns, и в случае SO42- для тестирования того, может ли ион участвовать в опосредовании тетрамерного расположения, наблюдаемого в кристалле. В присутствии каждого из этих соответствующих ионов наблюдали подобные профили седиментационного равновесия, в раной степени хорошо описанные отдельной осаждающейся молекулой и без значительного изменения в кажущейся MW (данные не показаны). Соответственно, авторы настоящего изобретения заключили, что Con-Ins G1 остается преимущественно мономерным в присутствии каждого из этих ионов, по меньшей мере при концентрации не более 100 мкг/мл.
Пример 8. Кристаллическая структура Con-Ins G1 в комплексе с фрагментами инсулинового рецептора человека, которые воспроизводят первичный гормон-связывающий участок рецептора
Кристаллизация и сбор данных.
Первичный инсулин-связывающий участок ("участок 1") инсулинового рецептора человека (hIR) может быть воссоздан в минимизированном домене и пригоден для кристаллографического анализа взаимодействия инсулина или аналогов инсулин с участком 1 (Menting et al. 2013) (Lawrence et al. 2016). Неотъемлемой частью данного способа является дополнительное присоединение фрагментов моноклонального антитела 83-7 (Soos et al. 1986) к домену CR из фрагмента рецептора для содействия кристаллизации. Данную методику применяли для получения кристаллов Con-Ins G1 в комплексе совместно с элементами, которые воссоздают участок 1 hIR.
Con-Ins G1 синтезировали, как описано в примере 1. Con-Ins G1 ресуспендировали в 10 мМ HCl.
Конструкцию IR310.T hIR (т.е. остатки 1-310 hIR с последующим N-концевым остаточным Leu-Val-Pro-Arg участком расщепления тромбина и включая вариант популяции Tyr144His) получали и очищали, как описано в Menting et al. 2013. Fv83-7, модуль вариабельного домена моноклонального антитела 83-7 (Soos et al. 1986), получали и очищали, как описано в (Lawrence et al. 2016). Затем обеспечивали образование комплекса IR310.Т с Fv83-7, и комплекс очищали, как описано в Lawrence et al. 2016. Затем комплекс Fv83-7.IR310.T подвергали обработке эндоглюкозидазой Н, как описано в Lawrence et al. 2016.
Пептид IR-A704-719 изоформы A hIR синтезировали по контракту в Genscript (США).
Con-Ins G1 в комплексе с фрагментами инсулинового рецептора человека, которые воспроизводят первичный гормон-связывающий участок рецептора, получали путем объединения подвергнутых обработке EndoH Fv83.7.IR310.T, IR-A704-719 и Con-Ins G1, как показано в таблице 2.
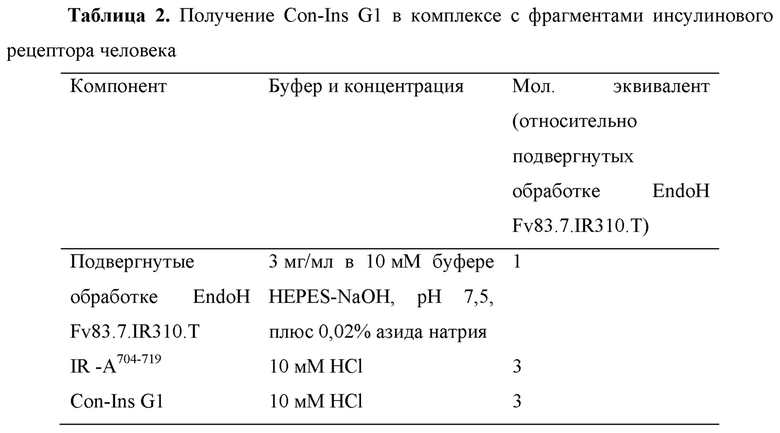
Для первичных исследований кристаллизации применяли роботизированный скрининг с применением метода сидячей капли с использованием разреженной матрицы 576 условий, который осуществляли на базе CSIRO Collaborative Crystallisation Centre (Парквиль, Австралия). Каждая капля содержала объемное соотношение лунка : комплекс 1:1. Рост кристалла наблюдали с применением 1,8-2,0 М сульфата аммония или 1,8-2,0 М сульфата аммония с любым одним из 0,1 М Tris-HCl, рН 7,5; MOPS-NaOH, рН 7,0 и MES-NaOH, рН 6,5.
Состояния кристаллизации оптимизировали и отдельные кристаллы той же смеси белок : пептид : Con-Ins G1 выращивали с применением формата висячей капли в 24-луночных планшетах Linbro и буфера для резервуара, содержащего 1,8-2,0 М сульфата аммония или 1,8-2,0 М сульфата аммония, 0,1 М Tris-HCl, рН 7,5. Другие буферы (например, MOPS-NaOH, рН 7,0 и MES-NaOH, рН 6,5) также испытывали и получали дифрагирующие подобным образом кристаллы. Отдельный кристалл, выращенный из раствора 1,7 М сульфата аммония, 50 мМ MOPS-NaOH, рН 7,0, обеспечивал наилучшие данные дифракции.
Обеспечивали криозащиту отдельного кристалла Con-Ins G1 в комплексе совместно с IR-A704-719 и подвергнутого обработке EndoH комплекса Fv83.7.IR310.T путем переноса в раствор, состоящий из буфера для резервуара плюс 30% глицерина, и экстракции в криопетле. Петлю затем погружали непосредственно в баню с жидким азотом. Данные дифракции с разрешением 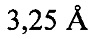 собирали на канале излучения МХ2 в синхротроне Australian Synchrotron (Мельбурн, Австралия). Данные интегрировали и объединяли с применением пакета XDS (Kabsch, 2010); статистические показатели обработки данных представлены в таблице 3. Пространственная группа симметрии представляет собой I222 с размерами элементарной ячейки а=106,16, b=227,12 и
собирали на канале излучения МХ2 в синхротроне Australian Synchrotron (Мельбурн, Австралия). Данные интегрировали и объединяли с применением пакета XDS (Kabsch, 2010); статистические показатели обработки данных представлены в таблице 3. Пространственная группа симметрии представляет собой I222 с размерами элементарной ячейки а=106,16, b=227,12 и 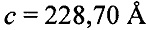 . Исходя из того, что кажущаяся молекулярная масса комплекса составляла 63440 Да и на асимметрическую единицу приходилось 2 комплекса, содержание растворителя оценили как составляющее 77%.
. Исходя из того, что кажущаяся молекулярная масса комплекса составляла 63440 Да и на асимметрическую единицу приходилось 2 комплекса, содержание растворителя оценили как составляющее 77%.
Решение и уточнение структуры
Решение структуры осуществляли с помощью молекулярного замещения с применением PHASER (McCoy et al. 2007) с использованием в качестве модели поиска отдельный компонент Fv83-7.IR310.T записи "40GA" в PDB (Menting et al. 2014). Две копии были расположены в асимметрической единице. Электронная плотность, соответствующая двум копиям Con-InsG1 (связанным раздельно с двумя соответствующими фрагментами L1+IR-A704-709 IR) были видимы на карте разности электронной плотности. Остатки Con-Ins G1 затем встраивали объективно в карту электронной плотности. Для уточнения данных рентгеновской кристаллографии применяли PHENIX (Adams et al. 2010). Конечные стадии уточнения включали уточнение TLS, сдержанное уточнение отдельного В-фактора и торсионные ограничения NCS. Статистические показатели конечного уточнения представлены в таблице 3. Конечная модель включала остатки, подробно описанные в таблице 4.



Пример 9. Con-Ins G1 в комплексе с фрагментами инсулинового рецептора человека
Для двух копий комплекса в кристаллографической асимметрической единице были показаны только ограниченные различия в общей структуре (фигура 11), и, таким образом, описание в данном документе будет ограничено комплексом 1.
Наложение кристаллической структуры комплекса Con-InsG1 и кристаллической структуры hIns в комплексе совместно с Fab83-7.IR310.T и IR-A704-719 (запись "4OGA" в PDB; Menting et al. 2014) представлено на фигуре 12. Общая структура Con-Ins G1 в комплексе с фрагментами инсулинового рецептора человека подобна таковой эквивалентной подструктуры в структуре hIns в комплексе с IR310.T, IR-A704-719 и Fab 83-7. Характерное различие заключается в том, что для комплекса Con-InsG1 интерпретируемые значения электронной плотности были явными для трех остатков, расположенных с N-конца относительно В7 Con-Ins G1. Конечная модель, таким образом, включает остатки В4, В5 и В6 Con-Ins G1. Напротив, в структуре совместного комплекса человеческого инсулина В-цепь hIns может быть смоделирована только начиная с остатка В7 в направлении С-конца.
На фигуре 13 показано наложение структуры комплекса Con-Ins G1, определенной в данном документе, и структуры человеческого инсулина в комплексе с IR310.T, IR-A704-719 и Fab 83-7, с фокусированием внимания на остатке TyrB15 Con-Ins G1. Как видно, боковая цепь TyrB15 смещена со своего положения, характерного для конформации без рецептора, для расположения в том же положении, которое занято боковой цепью PheB24 hIns, в комплексе на основе человеческого инсулина. Структура комплекса поддерживает заключение из примера 5 о том, что TyrB15 способствует компенсации отсутствия PheB24. Для TyrB20 Con-Ins G1 отсутствуют интерпретируемые значения электронной плотности.
Пример 10. Молекулярное моделирование hIns[DOI], hIns[TyrB15, DOI] и hIns[TyrB20 DOI] с компонентами, которые предусматривают первичный участок связывания (участок 1) инсулинового рецептора человека
Модели дезоктаинсулина (hIns[DOI]: человеческого инсулина, в В-цепи которого отсутствуют восемь С-концевых остатков) в комплексе с доменом L1 IR (остатки Gly5 - Cys155) и IR-A705-714 создавали с помощью MODELLER (v9.16) (Webb & Sali, 2014) с применением кристаллической структуры компонентов участка 1 IR в комплексе с человеческим инсулином (hIns) (запись "4OGA" в PDB; Menting et al. 2014) и ЯМР-структуры А-цепи инсулина (запись "2KJJ" в PDB). Все модели включали посттрансляционные модификации одного соответствующего N-связанного остатка N-ацетил-D-глюкозамина при каждом из остатков Asn16, Asn25 и Asn111 IR.
Симуляции методом молекулярной динамики (MD) осуществляли с применением пакета программ GROMACS (v5.1.2) (Abraham et al. 2015) и модифицированной версии силового поля CHARMM36 (Guvench et al. 2011; Best et al. 2012), начиная с модели комплекса hIns[DOI]-IR, которая характеризовалась наиболее низкой целевой функцией в MODELLER. Каждую систему помещали в сольватированную кубическую ячейку одноточечной модели воды TIP3P, выступающую на  за пределы всех атомов, с применением периодических граничных условий вдоль всех осей. Предполагалось, что ионизируемые остатки находились в их заряженном состоянии, и конечное значение ионной силы, составляющее 0,1 М, получали посредством нейтрализации системы и добавления достаточного количества ионов натрия и хлора. Сопряжение по температуре осуществляли в 2 группах, при этом белок и растворитель сопрягали независимо с масштабированием скорости (Bussi et al. 2007), термостат при 300 K, в обеих группах применяли временную константу 0,1 пс. Сопряжение по изотропном давлении осуществляли согласно методике Berendsen (Berendsen et al. 1984) с применением эталонного давления 1 бар и временной константы 0,5 пс. Все симуляции осуществляли с универсальной отсечкой по невалентным взаимодействиям, составляющей
за пределы всех атомов, с применением периодических граничных условий вдоль всех осей. Предполагалось, что ионизируемые остатки находились в их заряженном состоянии, и конечное значение ионной силы, составляющее 0,1 М, получали посредством нейтрализации системы и добавления достаточного количества ионов натрия и хлора. Сопряжение по температуре осуществляли в 2 группах, при этом белок и растворитель сопрягали независимо с масштабированием скорости (Bussi et al. 2007), термостат при 300 K, в обеих группах применяли временную константу 0,1 пс. Сопряжение по изотропном давлении осуществляли согласно методике Berendsen (Berendsen et al. 1984) с применением эталонного давления 1 бар и временной константы 0,5 пс. Все симуляции осуществляли с универсальной отсечкой по невалентным взаимодействиям, составляющей  , с учетом дальнодействующих электростатических взаимодействий с применением метода Эвальда "частиц в ячейках" (Essmann et al. 1995) с шириной решетки
, с учетом дальнодействующих электростатических взаимодействий с применением метода Эвальда "частиц в ячейках" (Essmann et al. 1995) с шириной решетки  и интерполяцией сплайнами шестого порядка. Схему отсечки Верле с поиском соседей применяли с интервалом обновления списка соседей, составляющим 25 шагов (50 фс); временной шаг, применяемый во всех симуляциях, составлял 2 фс. Все значения длины связи ограничивали с помощью алгоритма P-LINCS (Hess, 2008). Симуляции подвергали исходной резкой достаточной минимизации с последующими 50 пс MD, при этом все атомы белка являлись ограниченными. После выполнения MD с ограничением положения симуляции методом MD продолжали в течение дополнительных 100 нс
и интерполяцией сплайнами шестого порядка. Схему отсечки Верле с поиском соседей применяли с интервалом обновления списка соседей, составляющим 25 шагов (50 фс); временной шаг, применяемый во всех симуляциях, составлял 2 фс. Все значения длины связи ограничивали с помощью алгоритма P-LINCS (Hess, 2008). Симуляции подвергали исходной резкой достаточной минимизации с последующими 50 пс MD, при этом все атомы белка являлись ограниченными. После выполнения MD с ограничением положения симуляции методом MD продолжали в течение дополнительных 100 нс
Анализ взаимодействия аналога инсулина с рецептором осуществляли с применением пакета программ FoldX (Schymkowitz, et al. 2005) после 100 нс MD. Программу FoldX RepairPDB применяли, чтобы удостовериться в отсутствие нецелесообразных торсионных углов или ван-дер-ваальсовых столкновений в структурах перед осуществлением позиционного сканирования, указывающего полученный в результате вклад мутаций в каждом участке hIns[DOI] в отношении ΔΔG.
Дезоктаинсулин (hIns[DOI])
Взаимодействия, осуществленные hIns[DOI], сохраняют подобные взаимодействия в месте контакта инсулина и рецептора, наблюдаемом в структуре нативного hIns, установленной с помощью рентгеновской кристаллографии, с рецептором (запись "4OGA" в PDB), в частности, взаимодействия, обеспеченные между гидрофобным карманом, образованным остатками ValB12, LeuB15 В-домена и остатками Asn15, Leu37, Phe39 и Phe714 рецептора. Отсутствие С-концевых остатков В-цепи приводит в результате к прекращению разматывания спирали В-цепи, что приводит в результате к временному солевому мостику между ArgB22 и GluA17. Это также обеспечивает смещение спирали В-цепи ближе к IR-L1, что приводит в результате к смещенному π-π параллельному стэкингу между TyrB16 и Tyr67 IR-L1. Конечная модель показана на фигуре 14.
Дезоктаинсулин-TyrB15 (hIns[TyrB15, DOI])
Спустя период времени 100 нс взаимодействия, наблюдаемые с hIns[TyrB15, DOI], были подобны таковым, осуществленным с hIns[DOI]. Спираль В-цепи отображает сдвиг ближе к домену L1 IR с подобным π-π стэкингом между TyrB16 и Tyr67 IR-L1. Гибкость С-концевых остатков В-цепи подобным образом обеспечивает образование временного солевого мостика между ArgB22 и GluA17. Присутствие Tyr в положении В15 обеспечивает врезание в гидрофобную сердцевину места контакта DOI-(IR-A704-719)-L1, занимая пространство, в ином случае занимаемое LeuB15 hIns. Конечная модель показана на фигуре 15.
Дезоктаинсулин-TyrB20 (hIns[TyrB20, DOI])
Исходная сравнительная модель включала ограничение, чтобы удостовериться, что TyrB20 занимает участок связывания hInsB24. После 100 нс MD TyrB20 оставался в участке связывания В24 hIns, при этом все другие взаимодействия с рецептором оказались подобными таковым, характерным для нативной молекулы. В отличие от hIns[DOI], нативный π-π параллельный смещенный стэкинг между TyrB16 и Phe39 L1 IR сохранялся, однако образованный за счет отсутствия С-концевых остатков В-цепи солевой мостик между ArgB22 и GluA17 был аналогичным наблюдаемому в hIns[DOI]. Конечная модель показана на фигуре 16.
Анализ мутаций с помощью позиционного сканирования посредством FoldX
Программа для позиционного сканирования FoldX обеспечивает качественную интерпретацию положений в пределах hIns[DOI], которые могут вмещать мутации, и тех, которые не могут (фигуры 17, 18 и 19). В пределах hIns[DOI] и hIns[TyrB20, DOI] доступные для растворителя остатки в А-цепи, в частности остатки GluA4, GlnA5 и ThrA8, указывают на небольшой общий положительный или отрицательный эффект в отношении большинства мутаций. Он отличается от такового у аналога hIns[TyrB15, DOI], у которого вместо этого обеспечивалось положительное влияние на мутации этих остатков. Мутации, возникающие в пределах гидрофобной сердцевины на поверхности взаимодействия, неудивительно дают основание предположить о большем эффекте во всех моделях, и все модели предполагают, что связанные дисульфидной связью цистеины могут давать значительные преимущества в отношении ΔΔG, однако эти данные исключили из-за важности дисульфидных взаимодействий, оказываемых на общую структуру аналогов. Мутации в остатках TyrA14, AsnA18, HisB5 и GluB21 указали на то, что мутации аналога DOI-TyrB20 в этих положениях были преимущественными, где они не присутствовали в аналоге DOI; указывая на более благоприятное взаимодействие. Однако аналог DOI-TyrB15 обеспечивал результаты, аналогичные совокупным результатам DOI и DOI-TyrB20, что позволяет предположить лишь о незначительных различиях во всех участках, за исключением HisB5. Мутации в положениях AsnB3 и GlnB4 указали обратное, однако это предположительно является следствием ориентации В-цепи в близости от спирали В-цепи в этой рамке, и таким образом, является артефактом методики отбора образца.
Выводы
Симуляции методом MD аналогов hIns, hIns[DOI], hIns[TyrB15, DOI] и hIns[TyrB20, DOI], в комплексе с доменом L1 IR и IR-A705-719 и последующий анализ мутаций обеспечивают представление о способе связывания hIns[DOI], несмотря на отсутствие ключевых в отношении вовлечения рецептора остатков, в частности PheB24. Симуляции указывают на то, что замена тирозина в положении В20 может служить в качестве замены PheB24 в hIns, занимая примерно то же положение, и она является стабильной в течение времени симуляции. Симуляция hIns[DOI] (в котором отсутствует PheB24 и любая попытка заменить его мутацией в В15 или В20) во взаимодействии с фрагментами инсулинового рецептора показывает, что его вовлечение в целом подобно таковому hIns с L1 IR и IR-A705-719, но с едва отличимыми различиями в участках между доменом L1 IR и В-цепью аналога. Сдвиг В-цепи в сторону домена L1 IR не наблюдается в комплексе с hIns[TyrB20, DOI], вследствие стерического столкновения, которое возникнет, однако наблюдается в hIns[TyrB15, DOI], что позволяет предположить, что влияние замены в В20 отличается от влияния замены в В15. Расчеты в отношении мутаций посредством FoldX позволяют предположить, что столь же благоприятные мутации существуют в участках, на которые не оказывало воздействие полученное в результате изменение в положении связывания при мутации В20, при этом данные различия располагаются вдали от гидрофобной сердцевины.
Пример 11. Разработка мономерных аналогов человеческого инсулина
Стратегия исследования новых аналогов инсулина
Как описано в данном документе, недавнее открытие мономерного варианта инсулина (Con-Ins-G1) в яде хищной улитки способствовало исследованиям в отношении раскрытых пептидов. Были разработаны способы и получены данные, которые объясняют то, как Con-Ins-G1 одновременно избегает димеризации и сохраняет возможность связывания рецептора и опосредованной инсулином передачи сигнала и за счет этого действует очень быстро. Кроме того, сведения из фундаментальных открытий использовали для разработки белка, который отличается от последовательности человеческого инсулина только по четырем аминокислотным положениям, при этом является мономерным, быстродействующим и проявляет эффективность, сопоставимую с таковой подлинного человеческого инсулина.
Сведения, полученные из исследования Con-Ins-G1, использовали для разработки мономерного человеческого инсулина, который характеризуется только четырьмя аминокислотными заменами по сравнению с человеческим "укороченным" белком.
Чтобы обойти ограничения структуры человеческого инсулина, решения заимствовали от природы: охотящиеся за рыбой улитки-конусы Conus geographus в процессе эволюции приспособились применять специализированный инсулин из их яда, который индуцирует парализующий гипогликемический шок у рыбы за несколько секунд. Последовательность инсулина из яда Con-Ins-G1 устанавливали с применением комбинации секвенирования генома и масс-спектрометрии (фигура 1). В частности, наблюдали четыре посттрансляционные модификации: замена А4 Glu и B10 Glu на гамма-карбоксиглутаминовую кислоту, Gla; замена В3 Pro на 2-гидроксилпролин и С-концевое амидирование на А-цепи. Вследствие низкого содержания этого инсулина из яда его нельзя выделить из животного. Вместо этого получали синтетический аналог (sCon-Ins-G1), в котором для простоты синтеза внутримолекулярную дисульфидную связь в А-цепи заменяли на диселенидную связь. При инъекции рыбе sCon-Ins-G1 индуцирует гипогликемический шок, и его присутствие в воде замедляет подвижность рыбы. Помимо его воздействий на рыбу, наиболее характерной особенностью Con-Ins-G1 является то, что он представляет собой наиболее короткую молекулу инсулина с "укороченной" В-цепью, о которой сообщалось до настоящего времени. Поскольку укороченный человеческий инсулин (дезоктапептид-инсулин, DOI) является мономерным, это свидетельствовало о том, что Con-Ins-G1 является мономерным и что его можно применять в качестве UFI (инсулина ультракороткого действия). В Con-Ins-G1 отсутствует два сегмента, которые в человеческом инсулине участвуют в связывании с инсулиновым рецептором человека (hIR). Первый, А21 Asn человеческого инсулина, вступает в контакт с участком связывания 1 hIR, и его удаление вызывает 100-кратное снижение аффинности связывания. Второй, триплет ароматических аминокислот (В24-В26), в случае человеческого инсулина представляет собой один элемент для связывания с hIR, при этом связывание осуществляется посредством контактов в участке связывания 1 hIR. Удаление этих остатки приводит к 1000-кратному снижению аффинности.
Несмотря на эти проблемы, Con-Ins-G1 (вместо аналога, содержащего селен) синтезировали химическим способом и было показано, что он связывается с hIR с аффинностью только в 30 раз меньшей, чем таковая у человеческого инсулина. Этот неожиданный результат поднял ключевой вопрос: как Con-Ins-G1 связывается с hIR без ключевых ароматических остатков, использующихся в человеческом инсулине? Было обнаружено, что структура Con-Ins-G1 характеризуется остовом, почти идентичным остову человеческого инсулина. Путем подгонки структуры Con-Ins-G1 к опубликованной совместной структуре человеческого инсулина с hIR было сделано заключение, что В15 Tyr и В20 Tyr Con-Ins G1 (Leu и Gly в человеческом инсулине) взаимодействуют с человеческим IR, замещая таким образом роль, выполняемую В24 Phe человеческого инсулина. Эти убедительные результаты служат обоснованием для разработки человеческого мономерного UFI на основании структуры инсулина улитки.
Разработка мономерных аналогов человеческого инсулина в качестве прототипов терапевтических средств
Разработка инсулина ультракороткого действия (UFI) представляет собой следующий важный шаг в разработке аналогов инсулина. Фундаментальной проблемой в изменении структуры человеческого инсулина является то, что те же остатки, которые участвуют в связывании с рецептором, также опосредуют образование димера. Таким образом, открытие инсулина из яда Con-Ins-G1 представляет собой важный шаг вперед в создании мономерного инсулина ультракороткого действия, поскольку в нем отсутствуют эти остатки (и, таким образом, он не димеризуется), но сохраняется способность связываться с инсулиновым рецептором и активировать его. Однако существует опасение, что низкая идентичность последовательности между Con-Ins-G1 и человеческим инсулином может вызвать иммунный ответ, особенно с учетом того, что диабет является хроническим заболеванием, требующим ежедневных инъекций инсулина. Таким образом, вместо того, чтобы разрабатывать UFI на основании инсулина из яда, можно начать с каркаса человеческого DOI (дезоктапептида (В23-30) человеческого инсулина), поскольку он является мономерным и поскольку близкие аналоги этого усеченного человеческого инсулина, вероятно, будут переноситься иммунной системой человека, как показывает текущее клиническое применение аналогов инсулина, содержащих две или три мутации. Однако проблема заключается в том, что DOI практически неактивен (в 1000 раз слабее, чем человеческий инсулин). Данные указывают на то, что в Con-Ins-G1 используются В15 Tyr и/или В20 Tyr для компенсации потери В24 Phe, и дополнительно указывают на наличие дополнительных модификаций, которые увеличивают аффинность Con-Ins-G1. Используя эти сведения, на основании DOI можно разработать активный аналог, представляющий собой UFI, в качестве прототипа терапевтического средства для лечения диабета.
Разработка биологически активного мономерного инсулина на основании человеческого DOI
Традиционно DOI синтезировали ферментативным путем посредством гидролиза человеческого инсулина с помощью трипсина, что не подходит для синтеза аналога. Поэтому для получения DOI был разработан модульный способ синтеза. Основной проблемой для синтеза человеческого инсулина является гидрофобный характер А-цепи. Посредством применения изоацильной пептидной пары в положении А8-А9 Thr-Ser в А-цепь вводили дополнительный заряженный остаток (амин) для повышения ее растворимости (фигура 21). После образования дисульфидной связи изоацил-пептид подвергали ацильному сдвигу О-N при рН 8 с получением последовательности DOI. Этот синтетический DOI характеризуется такой же молекулярной массой (по данным MALDI) и активностью в отношении активации hIR, что и DOI, синтезированный ферментативным путем, что доказывает надежность разработанного способа.
Было продемонстрировано, что два Tyr в положениях В15 и В20 Con-Ins-G1 являются важными для активации hIR. Для проверки гипотезы о том, что мутации в этих двух участках будут повышать эффективность активации hIR, синтезировали три аналога DOI с мутациями, представляющими собой замену В15 Leu и/или В20 Gly на Tyr. Как показано на фигуре 22, два аналога с В20 Tyr характеризуются 5-кратным повышением эффективности активации hIR, тогда как аналог DOI с В15 Tyr сходен с DOI. Это демонстрирует, что В20 Tyr в отдельности может повышать эффективность DOI, вероятно, вследствие компенсации потери В24 Phe. Для дополнительного повышения эффективности синтезировали аналог DOI, который дополнительно содержал BIO Glu, что представляет собой замену по В10, которая обеспечивает наиболее сильное связывание с hIR. Это обеспечило повышение эффективности еще в 5 раз по сравнению с В20 Tyr в отдельности и позволило получить эффективность, сходную с эффективностью Con-Ins-G1 (фигура 23). Это демонстрирует, что мутации из инсулина из яда можно перенести на DOI человека для разработки биологически активных аналогов.
Кристаллические структуры Con-Ins-G1 и ConIns G1 в комплексе с фрагментами участка 1 инсулинового рецептора человека характеризуются недостаточной четкостью электронной плотности для остатка В20, что свидетельствует о том, что он может быть гибким. Также возможно, что боковая цепь заместителя, представляющего собой тирозин, в этом положении может обеспечивать не оптимальное вовлечение инсулинового рецептора. Поэтому гипотезу о том, что замены, отличные от Tyr, могут дополнительно повышать эффективность, проверяли путем синтеза ряда аналогов DOI В10Е, В20Х, где X представляет собой ароматические аминокислоты (фигура 24А). Интересно отметить, что большие заместители, такие как индольная (Trp) и бифенильная группа, обуславливают более высокую эффективности в отношении активации hIR (фигура 24В). Эффективность аналога, содержащего бифенил, составляет 10% от эффективности человеческого инсулина (в 3 раза выше, чем DOI N10E, B20Y). Это демонстрирует эффективность междисциплинарного подхода с использованием как белковой инженерии, так и структурной биологии. Эффективность DOI увеличивалась в 100 раз при внесении мутаций в два положения. Замещенные галогеном нафтильные и бифенильные группы в В20 можно применять для дополнительной оптимизации эффективности аналога DOI.
Поскольку положение А8 является важным для взаимодействия с участком связывания 2 hIR, мутацию А8 His можно внести в текущий аналог, являющийся прототипом, и осуществить его анализ в отношении активации hIR. Как А8 His, так и А9 Arg (исходные остатки в Con-Ins-G1) вносили в аналог DOI с B10 Glu и В20 Tyr, аналог, являющийся прототипом (фигура 23). Эта форма DOI с четырьмя мутациями характеризуется эффективностью в отношении активации hIR, которая сопоставима с таковой человеческого инсулина (фигура 25). Мутации в Con-Ins-G1 способствуют связыванию с участком 2 IR. Для изучения взаимодействия между инсулином и участком связывания 2 можно применять рентгеновскую кристаллографию. Для дополнительной оптимизации взаимодействия с участком связывания 2 hIR попытки по конструированию белка могут также распространяться на триплет А8-А10 с применением подхода медицинской химии, подобного работе над В20. В настоящее время наилучший аналог DOI отличается от исходной последовательности человеческого инсулина только по 4 остаткам, потому вероятно, что иммуногенность мономерных аналогов DOI будет сходной с иммуногенностью аналогов инсулина, одобренных FDA, которые используются в клинической практике.
Было продемонстрировано, что каждая мутация в А8, А9, В10 и В20 оказывает отдельные эффекты в отношении влияния на активацию hIR (фигура 26).
Оценка прототипов, представляющих собой мономерный инсулин, в мышиных моделях диабета, обработанных STZ
После идентификации эффективных мономерных аналогов инсулина можно проводить оценку свойств in vivo. Тест на толерантность к инсулину можно осуществлять на мышах, обработанных STZ, для подтверждения способности в отношении снижения уровня глюкозы in vivo. Двумя ключевыми признаками аналога, представляющего собой UFI, являются быстрое начало проявления активности и короткая продолжительность действия. Уровни аналога, представляющего собой UFI, в сыворотке крови измеряют с применением HPLC в сочетании с масс-спектрометрией (LC/MS/MS) у мышей с диабетом после осуществления подкожных инъекций для измерения его скорости всасывания (с применением инсулина лизпро в качестве контроля). Для мономерных инсулинов можно отметить более высокую скорость всасывания по сравнению с димерным инсулином лизпро. Кроме того, для количественного анализа начала проявления и продолжительности действия аналогов, представляющих собой UFI, in vivo можно применять гликемические клэмп-тесты путем определения количества глюкозы, поступающей с инфузией, необходимого для поддержания целевого уровня глюкозы. С помощью эугликемического гиперинсулинемического клэмп-теста стало возможным показать, что аналоги, представляющие собой UFI, характеризуются более коротким началом проявления и более короткой продолжительностью действия вследствие уменьшения выраженности эффектов депо в подкожной ткани. Комбинация этих свойств может в значительной степени снизить риск гипогликемии.
Специалисты в данной области техники с легкостью поймут, что в отношении настоящего изобретения могут быть осуществлены многочисленные отклонения и/или модификации, показанные в конкретных вариантах осуществления, без отступления от сущности или объема настоящего изобретения, описанного в широком смысле. Следовательно, варианты осуществления настоящего изобретения следует рассматривать во всех отношениях как иллюстративные, а не ограничивающие. Для специалистов в данной области техники будут очевидными много эквивалентов конкретных вариантов осуществления способа и композиций, описанных в данном документе, или они смогут их установить, используя не более чем обычные эксперименты. Предполагается, что такие эквиваленты охватываются следующей формулой изобретения.
Все публикации, обсуждаемые и/или упоминаемые в данном документе, включены в данный документ во всей их полноте.
Любое обсуждение документов, актов, материалов, устройств, статей или подобного, которые включены в настоящее описание, предназначено исключительно для обеспечения контекста для настоящего изобретения. Это не следует рассматривать как признание того, что любые или все из этих материалов являются частью предшествующего уровня техники или были общеизвестными в области, относящейся к настоящему изобретению, как она существовала до даты приоритета каждого пункта формулы изобретения данной заявки.
ССЫЛКИ
Abraham et al. (2015) SoftwareX 1-2, 19-25.
Adams et al. (1969) Nature 224, 491-495.
Adams. et al. (2010) D. Biol. Crystallogr. 66, 213-221.
Bao et al. (1997) Proc. Natl. Acad. Sci. USA 94, 2975-2980.
Bentley (1997) Meth. Enzym., 276, 611-619.
Berendsen et al. (1984) J. Chem. Phys. 81, 3684-3690.
Best et al. (2012) J. Chem. Theory Comput. 8, 3257-3273.
Bricogne et al. (2011) BUSTER версия 2.10, Кембридж, Великобритания: Global Phasing Ltd.
Brunger (1996). справочное руководство по X-PLOR 3.851 (Йельский университет, Нью-Хейвен, Коннектикут).
Brunger (1997) Meth. Enzym., 276, 558-580,
Brunger et al. (1998) D. Biol. Crystallogr., 54, 905-921.
Bussi et al. (2007). J. Chem. Phys. 126: 014101.
Chen et al. (1998) J. Biol. Chem. 273, 16248-16258.
Cnudde et al. (2011) J. Biol. Inorg. Chem. 16, 257-266.
Dai et al. (2011) J. Inorg. Biochem. 105, 52-57.
Denley et al. (2004) Mol. Endocrinol. 18, 2502-2512.
Dodson и Steiner (1998) Curr. Opin. Struct. Biol. 8, 189-194.
Emsley и Cowtan (2004) D. Biol. Crystallogr. 60, 2126-2132.
Essmann et al. (1995) J Chem Phys 103, 8577-8593.
Galande et al. (2005) J. Comb. Chem. 7, 174-177.
Glendorf et al. (2011) PLoS One. 6, e20288.
Guvench et al. (2011) J. Chem. Theory Comput. 7, 3162-3180.
Heni et al. (2015) Nat. Rev. Endocrinol. 11, 701-711.
Hess (2008) J. Chem. Theory Comput. 4, 116-122.
Holm и  (2010) Nucl. Acids Res. 38, W545-549.
(2010) Nucl. Acids Res. 38, W545-549.
Houtman et al. (2007) Protein Sci. 16, 30-42.
Hua et al. (1995) Nat. Struct. Biol. 2, 129-138.
Jones et al. (1991) Acta Crystallogr., A 47, 110-119).
Kabsch (2010) Biol. Crystallogr. 66, 133-144.
Kleywegt и Jones (1994). CCP4/ESF-EACBM Newsletter on Protein Crystallography, 31 November 1994, 9-14. [http://xray.bmc.uu.se/usf/factory_4.html]
Krissinel и Henrick (2004) Acta Cryst. D60, 2256-2268.
King (2011) Expert Opin. Biol. Ther. 11, 1469-1484.
Lattman (1985) Meth. Enzymol., 115, 55-77.
Laue et al. (1992) в Analytical Ultracentrifugation in Biochemistry и Polymer Science 90-125.
Lawrence et al. (2016). J. Biol. Chem. 291, 15473-15481.
McCoy et al. (2007) J. Appl. Crystallogr. 40, 658-674.
Marsh et al. (1995) J. Cell Biol., 130, 1081-1091.
Menting et al. (2013) Nature 493, 241-245.
Menting et al. (2014) Proc. Natl. Acad. Sci. USA 111, E3395-E3404.
Moody et al. (1974) Horm. Metab. Res. 6(1), 12-6,
Morton и Myszka (1998) Methods Enzymol., 295, 268-294.
Murshudov et al. (1997) Acta Crystallogr. D. Biol. Crystallogr. 53, 240-255.
Muttenthaler et al. (2010) Biopolymers 94, 423-432.
Navaza и Saludjian (1997) Meth. Enzym. 276, 581-594.
Nice и Catimel (1999) Bioessays, 21, 339-352,
Olefsky (1978) Biochem. J., 172, 137-145.
Owens (2002) Nat. Rev. Drug Discov. 1, 529-540.
Pettersen et al. (2004) J Comput Chem. 25, 1605-12.
Phillips et al. (2005) J Comput Chem. 26, 1781-1802.
Pronk et al. (2013) Bioinformatics 29, 845-854.
Rivier et al. (1987) Biochemistry 26, 8508-8512.
Robinson и James (1992) Am. J. Physiol., 263, E383-E393.
Rossmann (1972) Int. Sci. Rev. Ser., No. 13, Gordon & Breach, New York.
Sambrook et al. (2001) Molecular Cloning: A Laboratory Manual, 3rd ed. Cold Spring Harbor Laboratory Press.
Safavi-Hemami et al. (2015) Proc. Natl. Acad. Sci. USA 112, 1743-1748.
Schymkowitz et al. (2005) Nucleic Acids Res. 33, W382-8.
Smith et al. (2003) D. Biol. Crystallogr. 59, 474-482.
Soos et al. (1986). Biochem. J. 235, 199-208.
Sparrow et al. (2008) Struct. Funct. Bioinform. 71, 426-439.
Tong и Rossmann (1997) Meth. Enzym. 276:594-611.
Walewska et al. (2009) Angew. Chem. Int. Ed. Engl. 48, 2221-2224.
Webb и Sali (2014) Curr. Protoc. Bioinformatics 47, 5.6.1-5.6.32.
Weiss (2009) Vitam. Horm. 80, 33-49.
Zambelli et al. (2016) Pharmacol. Res., электронная публикация перед печатью.
ПРИЛОЖЕНИЕ I: АТОМНЫЕ КООРДИНАТЫ ДЛЯ ИНСУЛИНА CON-INS G1 (А-ЦЕПЬ И В-ЦЕПЬ)
Формат включает следующие поля, разделенные двоеточием: (1) название атома, (2) тип остатка, (3) название цепи, (4) номер остатка, (5-7) координаты xyz, (8) температурный В-фактор.






















ПРИЛОЖЕНИЕ II: АТОМНЫЕ КООРДИНАТЫ ДЛЯ МОДЕЛИ
ИНСУЛИНА CON-INS G1 (А- И В-ЦЕПИ), СВЯЗАННОГО С ИНСУЛИНОВЫМ РЕЦЕПТОРОМ (ЦЕПИ E, F И X)
Формат включает следующие поля, разделенные двоеточием: (1) название атома, (2) тип остатка, (3) название цепи, (4) номер остатка, (5-7) координаты xyz.












































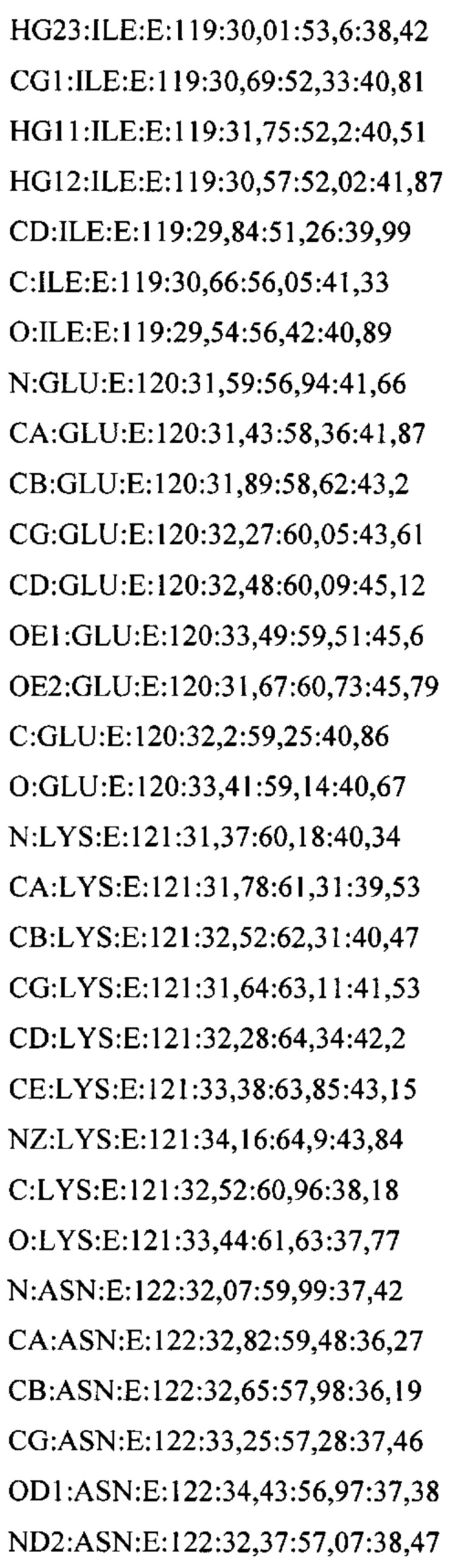







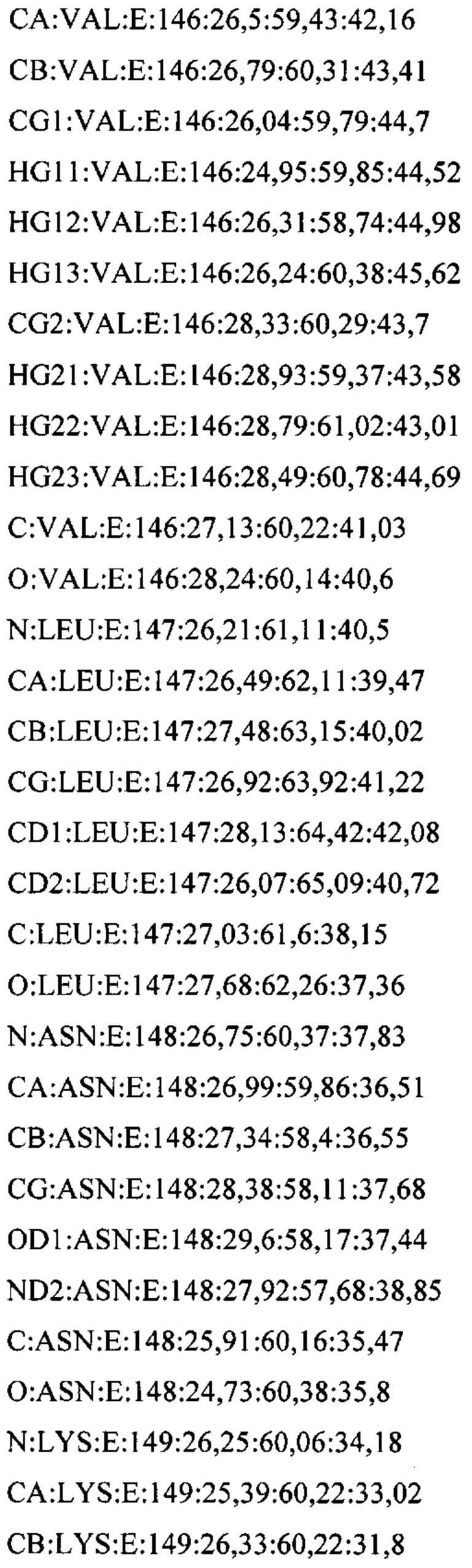

















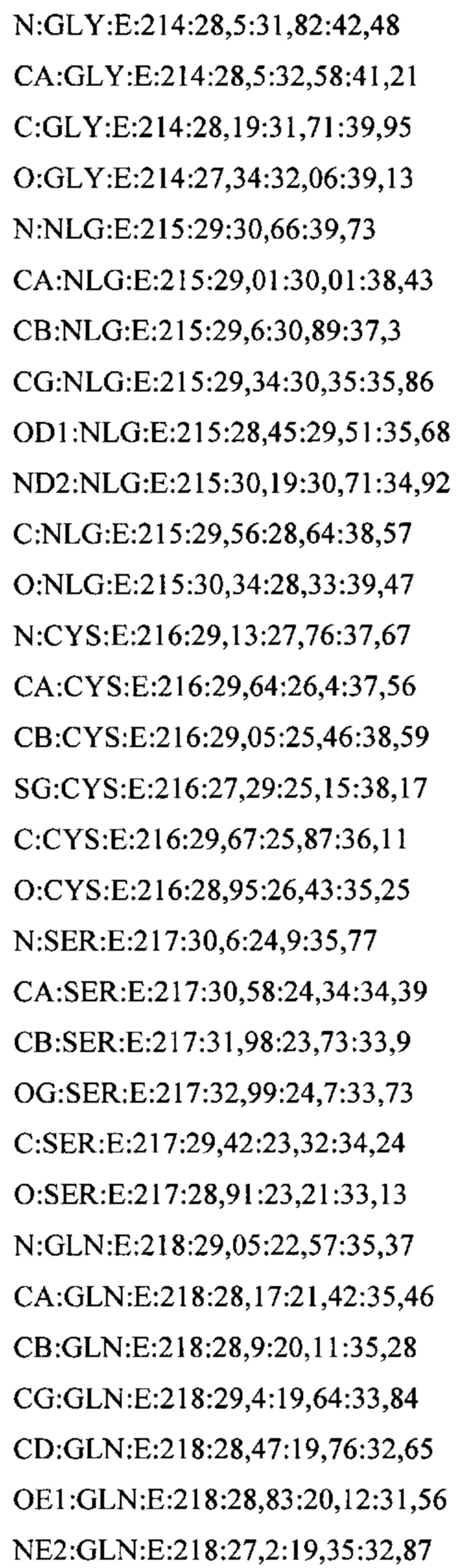
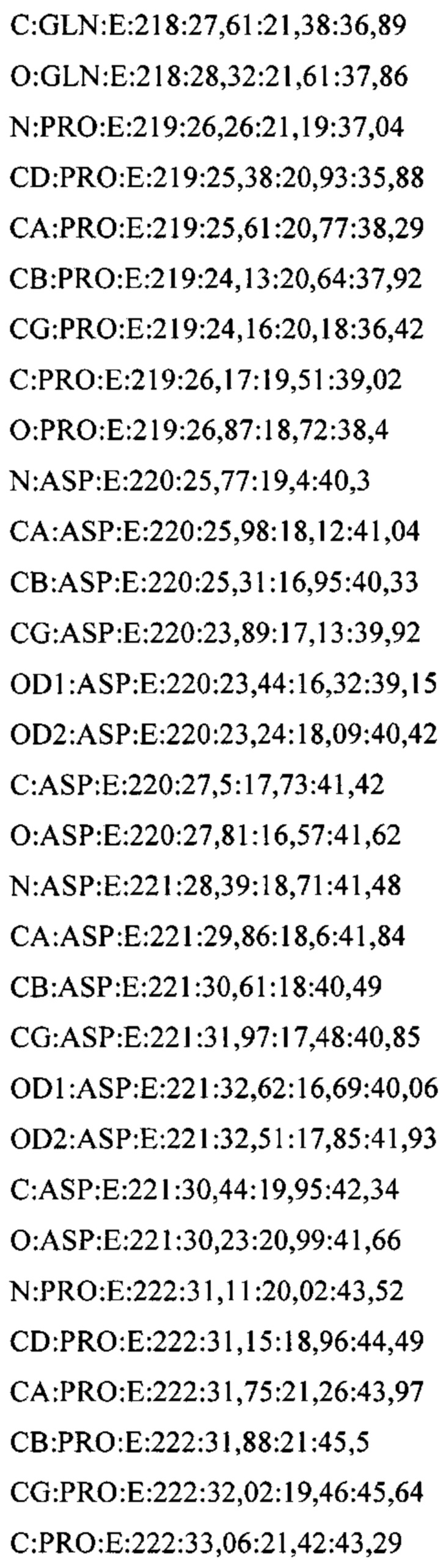






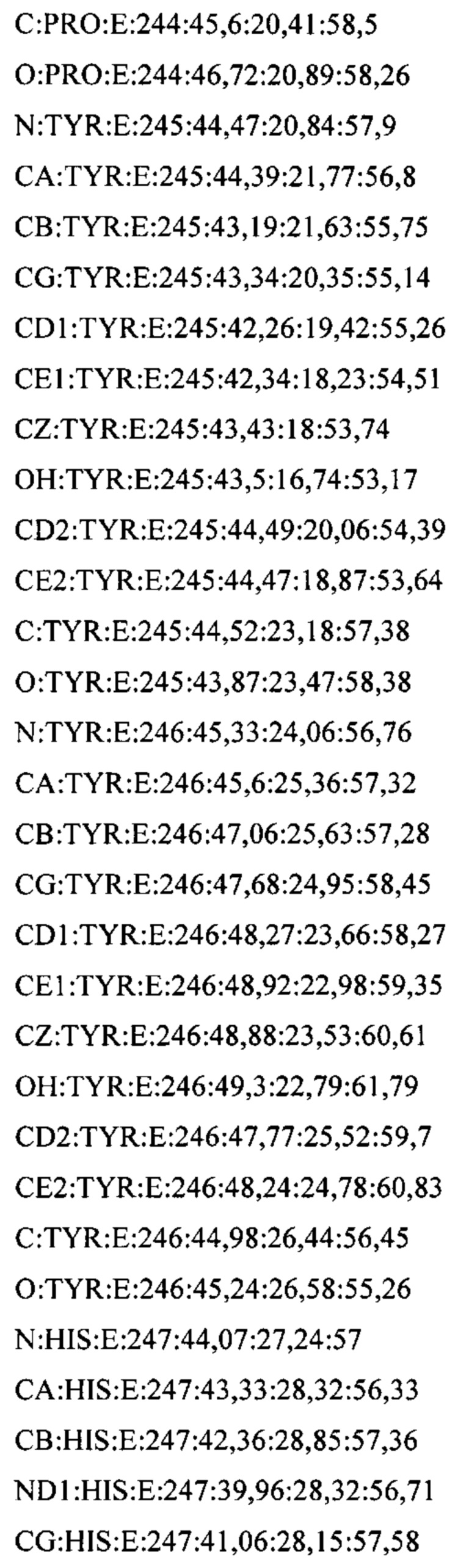




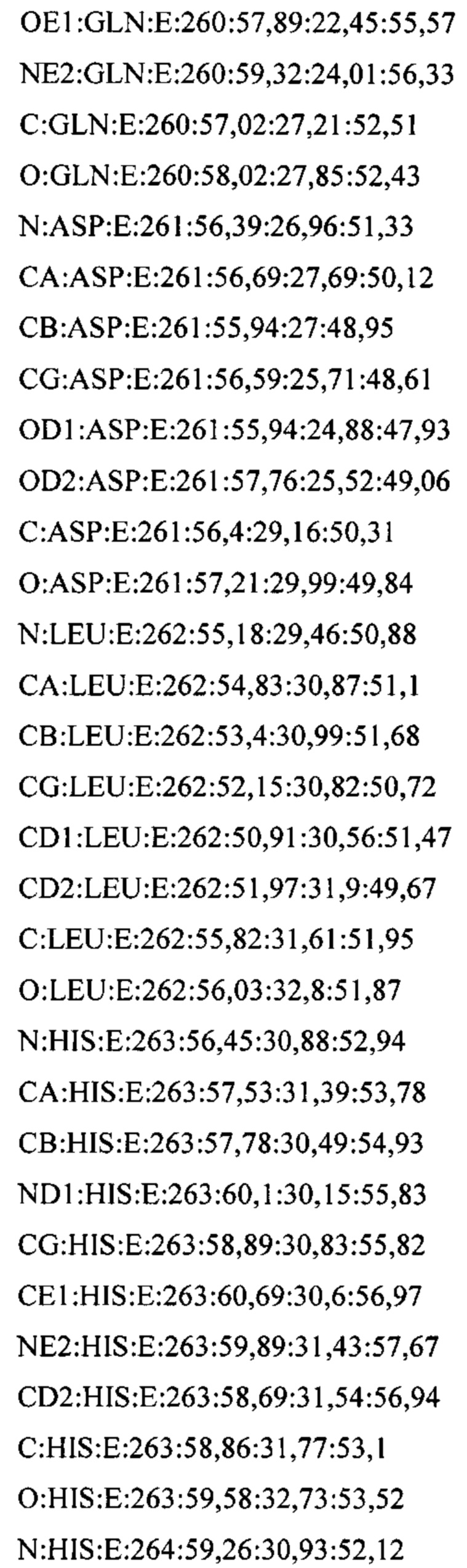
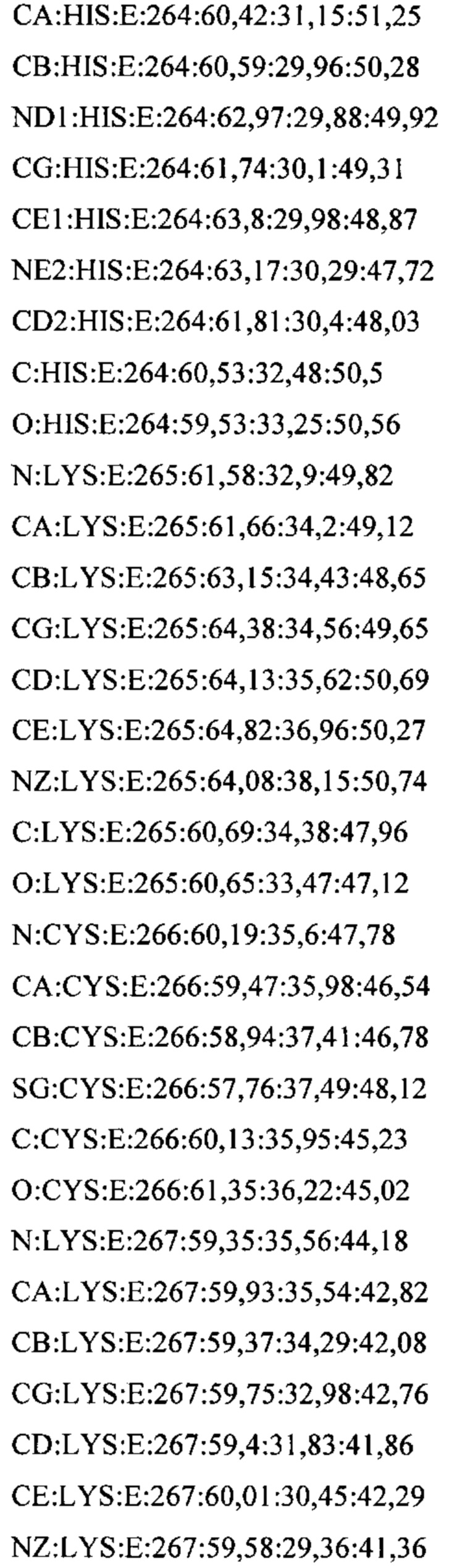








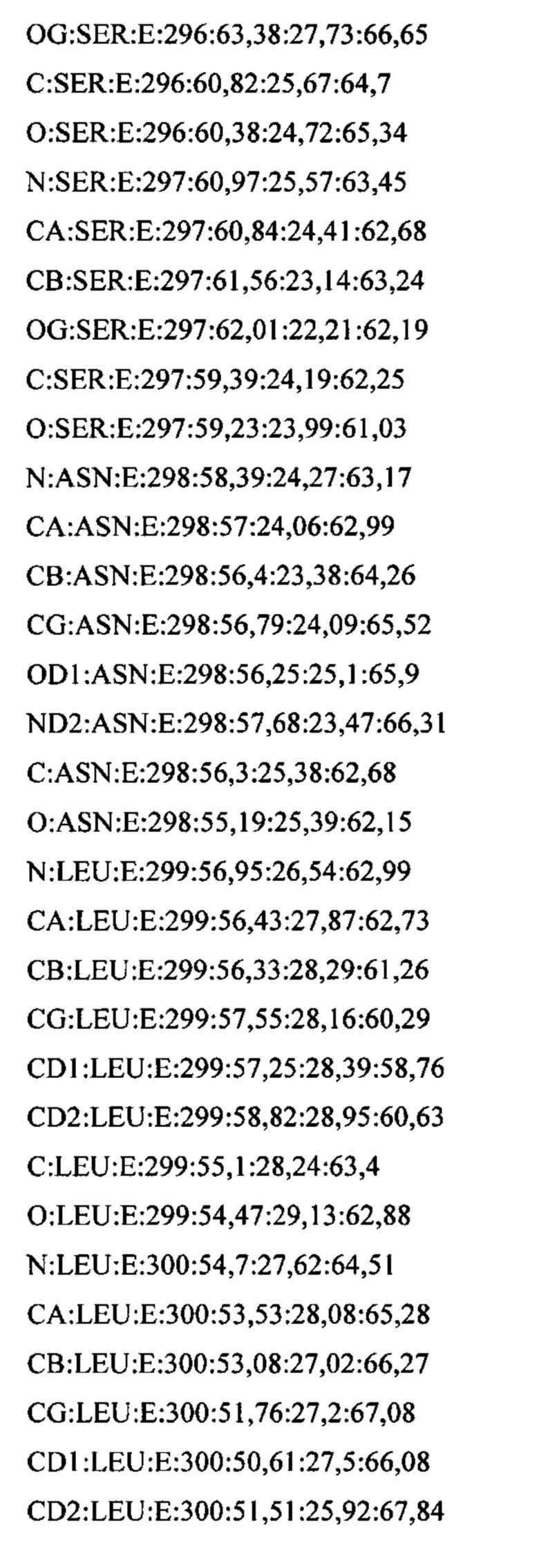








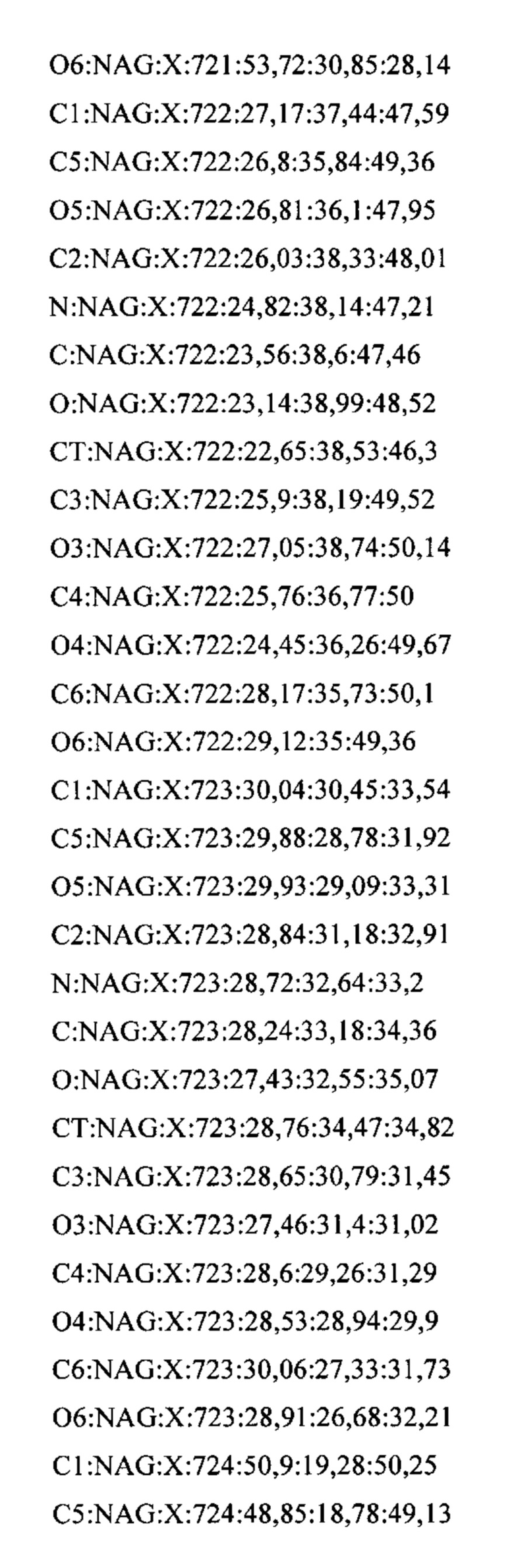

--->
SEQUENCE LISTING
<110> The Walter and Eliza Hall Institute of Medical Research
La Trobe University
University of Utah Research Foundation
<120> Insulin Analogs
<130> 525952
<160> 41
<170> PatentIn version 3.5
<210> 1
<211> 34
<212> PRT
<213> Artificial Sequence
<220>
<223> A chain
<220>
<221> X
<222> (2)..(2)
<223> Val or Ile
<220>
<221> X
<222> (3)..(3)
<223> Val or Ala
<220>
<221> X
<222> (4)..(4)
<223> Glu, Asp, Cys or gamma carboxyglutamate
<220>
<221> X
<222> (5)..(5)
<223> Gln, Glu, gamma carboxyglutamate, His or Val
<220>
<221> X
<222> (6)..(6)
<223> Cys or selenocysteine
<220>
<221> X
<222> (7)..(7)
<223> Cys or selenocysteine
<220>
<221> X
<222> (8)..(8)
<223> Thr, His, Asp, Gln, Tyr, Lys, Ala or Val
<220>
<221> X
<222> (9)..(9)
<223> Ser, Arg, Asn, Gly, His or Lys
<220>
<221> X
<222> (10)..(10)
<223> Ile, Pro, Tyr, Ala, Ser, Val, Phe, His or Thr
<220>
<221> X
<222> (11)..(11)
<223> Cys or selenocysteine
<220>
<221> X
<222> (12)..(12)
<223> Ser or Thr
<220>
<221> X
<222> (13)..(13)
<223> Leu, Asn, Val, Arg or Asp
<220>
<221> X
<222> (14)..(14)
<223> Tyr, Ala, Gln, His, Asp or Glu
<220>
<221> X
<222> (15)..(15)
<223> Gln, Glu or Thr
<220>
<221> X
<222> (16)..(16)
<223> Phe, Leu, or Ala
<220>
<221> X
<222> (17)..(17)
<223> Glu, Gln, Lys, Arg, Ile, Met, Thr or Ser
<220>
<221> X
<222> (18)..(18)
<223> Lys, Ser, Thr, Asn, Gln or Glu
<220>
<221> X
<222> (19)..(19)
<223> Tyr or Phe
<220>
<221> X
<222> (20)..(20)
<223> Cys, selenocysteine, amidated Cys, or amidated selenocysteine
<220>
<221> X
<222> (21)..(21)
<223> Asn, Pro, His, Ser, Gly, Ala, or is absent
<220>
<221> X
<222> (22)..(22)
<223> Pro, Asn, Thr, Leu, Ser or is absent
<220>
<221> X
<222> (23)..(23)
<223> Thr, Leu, Val, Ser or is absent
<220>
<221> X
<222> (24)..(24)
<223> Arg, Thr, Met, Gln, Leu or is absent
<220>
<221> X
<222> (25)..(25)
<223> Glu, Gly or is absent
<220>
<221> X
<222> (26)..(26)
<223> Ser, Leu or is absent
<220>
<221> X
<222> (27)..(31)
<223> Ser or absent
<220>
<221> X
<222> (32)..(32)
<223> Ala, Ser or is absent
<220>
<221> X
<222> (33)..(33)
<223> Ala, Val or is absent
<220>
<221> X
<222> (34)..(34)
<223> Ala or is absent
<400> 1
Gly Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
1 5 10 15
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
20 25 30
Xaa Xaa
<210> 2
<211> 39
<212> PRT
<213> Artificial Sequence
<220>
<223> B chain
<220>
<221> X
<222> (1)..(1)
<223> Thr, Asn, Ser or is absent
<220>
<221> X
<222> (2)..(2)
<223> Phe, Ser, Asn, Thr, Gln or is absent
<220>
<221> X
<222> (3)..(3)
<223> Ala, Asp, Gly, Pro, Leu, Phe, or His
<220>
<221> X
<222> (4)..(4)
<223> Ala, Thr, Pro, Asp, Val or Gly
<220>
<221> X
<222> (5)..(5)
<223> Asn, Pro, His, Thr, Arg, Ser or hydroxyproline
<220>
<221> X
<222> (6)..(6)
<223> Lys, Glu, Asn, Asp, Arg, Gln or Gly
<220>
<221> X
<222> (7)..(7)
<223> His, Tyr, Arg or Ile
<220>
<221> X
<222> (8)..(8)
<223> Arg, Thr, Ile, Ser, Leu, Tyr or Lys
<220>
<221> X
<222> (9)..(9)
<223> Cys or selenocysteine
<220>
<221> X
<222> (10)..(10)
<223> Gly, Gln or Asp
<220>
<221> X
<222> (11)..(11)
<223> Ser, Leu, Gly or Pro
<220>
<221> X
<222> (12)..(12)
<223> His, Glu, gamma carboxyglutamate, Asp, or Asn
<220>
<221> X
<222> (13)..(13)
<223> Ile, Leu, Asp, Val or Ala
<220>
<221> X
<222> (14)..(14)
<223> Thr, Ala, Pro, Val or Arg
<220>
<221> X
<222> (15)..(15)
<223> Asn, Asp, Ala, Val, Thr, Pro or Glu
<220>
<221> X
<222> (16)..(16)
<223> Ala, Ser, Gln, His, Tyr, Arg or Gly
<220>
<221> X
<222> (17)..(17)
<223> Thr, Tyr, Pro, Leu or Gly
<220>
<221> X
<222> (18)..(18)
<223> Tyr, Met, Val, Gln, Ile, Asp, Gly, Asn or Leu
<220>
<221> X
<222> (19)..(19)
<223> Leu, Asp, Gln, Gly, Lys, Glu, Arg or Thr
<220>
<221> X
<222> (20)..(20)
<223> Val, Leu or Lys
<220>
<221> X
<222> (21)..(21)
<223> Cys, amidated Cys, selenocysteine or amidated selenocysteine
<220>
<221> X
<222> (22)..(22)
<223> Val, Tyr, Phe, His, Gly, Gln, Leu, amidated His, amidated Val or
is absent
<220>
<221> X
<222> (23)..(23)
<223> Glu, Arg, Ser, Gly or is absent
<220>
<221> X
<222> (24)..(24)
<223> Arg, Asp, Val or is absent
<220>
<221> X
<222> (25)..(25)
<223> Gly, Leu, Val or is absent
<220>
<221> X
<222> (26)..(26)
<223> Phe, Val, Ile or is absent
<220>
<221> X
<222> (27)..(27)
<223> Phe, Asn, Pro, Glu or is absent
<220>
<221> X
<222> (28)..(28)
<223> Tyr, Cys, His or is absent
<220>
<221> X
<222> (29)..(29)
<223> Thr, His, Ile, Leu, Ser, Tyr or is absent
<220>
<221> X
<222> (30)..(30)
<223> Pro, Glu, Leu, Ile, Arg or is absent
<220>
<221> X
<222> (31)..(31)
<223> Ile, Lys or is absent
<220>
<221> X
<222> (32)..(32)
<223> Ala, Asp, Ser, Thr, Lys, Leu, Gln or is absent
<220>
<221> X
<222> (33)..(33)
<223> Cys or is absent
<220>
<221> X
<222> (34)..(34)
<223> Glu, Pro, Val or is absent
<220>
<221> X
<222> (35)..(35)
<223> Glu, Gly or is absent
<220>
<221> X
<222> (36)..(36)
<223> Glu, Gly or is absent
<220>
<221> X
<222> (37)..(37)
<223> Glu, Val or is absent
<220>
<221> X
<222> (38)..(38)
<223> Ala, Asp or is absent
<220>
<221> X
<222> (39)..(39)
<223> Ala or is absent
<400> 2
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
1 5 10 15
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
20 25 30
Xaa Xaa Xaa Xaa Xaa Xaa Xaa
35
<210> 3
<211> 39
<212> PRT
<213> Artificial Sequence
<220>
<223> B chain
<220>
<221> X
<222> (1)..(1)
<223> Thr, Asn, Ser or is absent
<220>
<221> X
<222> (2)..(2)
<223> Phe, Ser, Asn, Thr, Gln or is absent
<220>
<221> X
<222> (3)..(3)
<223> Asp, Gly, Pro, Leu, Phe, or His
<220>
<221> X
<222> (4)..(4)
<223> Thr, Pro, Asp, Val or Gly
<220>
<221> X
<222> (5)..(5)
<223> Asn, Pro, His, Thr, Arg, Ser or hydroxyproline
<220>
<221> X
<222> (6)..(6)
<223> Lys, Glu, Asn, Asp, Arg, Gln or Gly
<220>
<221> X
<222> (7)..(7)
<223> His, Tyr, Arg or Ile
<220>
<221> X
<222> (8)..(8)
<223> Arg, Thr, Ile, Ser, Leu, Tyr or Lys
<220>
<221> X
<222> (9)..(9)
<223> Cys or selenocysteine
<220>
<221> X
<222> (10)..(10)
<223> Gly, Gln or Asp
<220>
<221> X
<222> (11)..(11)
<223> Ser, Leu, Gly or Pro
<220>
<221> X
<222> (12)..(12)
<223> His, Glu, gamma carboxyglutamate, Asp, or Asn
<220>
<221> X
<222> (13)..(13)
<223> Ile, Leu, Asp, Val or Ala
<220>
<221> X
<222> (14)..(14)
<223> Thr, Ala, Pro, Val or Arg
<220>
<221> X
<222> (15)..(15)
<223> Asn, Asp, Ala, Val, Thr, Pro or Glu
<220>
<221> X
<222> (16)..(16)
<223> Ala, Ser, Gln, His, Tyr, Arg or Gly
<220>
<221> X
<222> (17)..(17)
<223> Tyr or Leu
<220>
<221> X
<222> (18)..(18)
<223> Tyr, Met, Val, Gln, Ile, Asp, Gly, Asn or Leu
<220>
<221> X
<222> (19)..(19)
<223> Leu, Asp, Gln, Gly, Lys, Glu, Arg or Thr
<220>
<221> X
<222> (20)..(20)
<223> Val, Leu or Lys
<220>
<221> X
<222> (21)..(21)
<223> Cys, amidated Cys, selenocysteine or amidated selenocysteine
<220>
<221> X
<222> (22)..(22)
<223> Tyr, Phe or His
<220>
<221> X
<222> (23)..(23)
<223> Glu, Arg, Ser, Gly or is absent
<220>
<221> X
<222> (24)..(24)
<223> Arg, Asp, Val or is absent
<220>
<221> X
<222> (25)..(25)
<223> Gly, Leu, Val or is absent
<220>
<221> X
<222> (26)..(26)
<223> Phe, Val, Ile or is absent
<220>
<221> X
<222> (27)..(27)
<223> Phe, Asn, Pro, Glu or is absent
<220>
<221> X
<222> (28)..(28)
<223> Tyr, Cys, His or is absent
<220>
<221> X
<222> (29)..(29)
<223> Thr, His, Leu, Tyr or is absent
<220>
<221> X
<222> (30)..(30)
<223> Pro, Glu, Leu, Ile, Arg or is absent
<220>
<221> X
<222> (31)..(31)
<223> Ile, Lys or is absent
<220>
<221> X
<222> (32)..(32)
<223> Thr, Lys, Leu, Gln or is absent
<220>
<221> X
<222> (33)..(33)
<223> Cys or is absent
<220>
<221> X
<222> (34)..(34)
<223> Glu, Pro, Val or is absent
<220>
<221> X
<222> (35)..(35)
<223> Glu, Gly or is absent
<220>
<221> X
<222> (36)..(36)
<223> Glu, Gly or is absent
<220>
<221> X
<222> (37)..(37)
<223> Glu, Val or is absent
<220>
<221> X
<222> (38)..(38)
<223> Ala, Asp or is absent
<220>
<221> X
<222> (39)..(39)
<223> Ala or is absent
<400> 3
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
1 5 10 15
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
20 25 30
Xaa Xaa Xaa Xaa Xaa Xaa Xaa
35
<210> 4
<211> 39
<212> PRT
<213> Artificial Sequence
<220>
<223> B chain
<220>
<221> X
<222> (1)..(1)
<223> Thr, Asn, Ser or is absent
<220>
<221> X
<222> (2)..(2)
<223> Phe, Ser, Asn, Thr, Gln or is absent
<220>
<221> X
<222> (3)..(3)
<223> Asp, Gly, Pro, Leu, Phe, or His
<220>
<221> X
<222> (4)..(4)
<223> Thr, Pro, Asp, Val or Gly
<220>
<221> X
<222> (5)..(5)
<223> Asn, Pro, His, Thr, Arg, Ser or hydroxyproline
<220>
<221> X
<222> (6)..(6)
<223> Lys, Glu, Asn, Asp, Arg, Gln or Gly
<220>
<221> X
<222> (7)..(7)
<223> His, Tyr, Arg or Ile
<220>
<221> X
<222> (8)..(8)
<223> Arg, Thr, Ile, Ser, Leu, Tyr or Lys
<220>
<221> X
<222> (9)..(9)
<223> Cys or selenocysteine
<220>
<221> X
<222> (10)..(10)
<223> Gly, Gln or Asp
<220>
<221> X
<222> (11)..(11)
<223> Ser, Leu, Gly or Pro
<220>
<221> X
<222> (12)..(12)
<223> His, Glu, gamma carboxyglutamate, Asp, or Asn
<220>
<221> X
<222> (13)..(13)
<223> Ile, Leu, Asp, Val or Ala
<220>
<221> X
<222> (14)..(14)
<223> Thr, Ala, Pro, Val or Arg
<220>
<221> X
<222> (15)..(15)
<223> Asn, Asp, Ala, Val, Thr, Pro or Glu
<220>
<221> X
<222> (16)..(16)
<223> Ala, Ser, Gln, His, Tyr, Arg or Gly
<220>
<221> X
<222> (17)..(17)
<223> Tyr or Leu
<220>
<221> X
<222> (18)..(18)
<223> Tyr, Met, Val, Gln, Ile, Asp, Gly, Asn or Leu
<220>
<221> X
<222> (19)..(19)
<223> Leu, Asp, Gln, Gly, Lys, Glu, Arg or Thr
<220>
<221> X
<222> (20)..(20)
<223> Val, Leu or Lys
<220>
<221> X
<222> (21)..(21)
<223> Cys, amidated Cys, selenocysteine or amidated selenocysteine
<220>
<221> X
<222> (22)..(22)
<223> Tyr, Phe or His
<220>
<221> X
<222> (23)..(23)
<223> Glu, Arg, Ser, Gly or is absent
<220>
<221> X
<222> (24)..(39)
<223> absent
<400> 4
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
1 5 10 15
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
20 25 30
Xaa Xaa Xaa Xaa Xaa Xaa Xaa
35
<210> 5
<211> 39
<212> PRT
<213> Artificial Sequence
<220>
<223> B chain
<220>
<221> X
<222> (1)..(1)
<223> Thr, Asn, Ser or is absent
<220>
<221> X
<222> (2)..(2)
<223> Phe, Ser, Asn, Thr, Gln or is absent
<220>
<221> X
<222> (3)..(3)
<223> Asp, Gly, Pro, Leu, Phe, or His
<220>
<221> X
<222> (4)..(4)
<223> Thr, Pro, Asp, Val or Gly
<220>
<221> X
<222> (5)..(5)
<223> Asn, Pro, His, Thr, Arg, Ser or hydroxyproline
<220>
<221> X
<222> (6)..(6)
<223> Lys, Glu, Asn, Asp, Arg, Gln or Gly
<220>
<221> X
<222> (7)..(7)
<223> His, Tyr, Arg or Ile
<220>
<221> X
<222> (8)..(8)
<223> Arg, Thr, Ile, Ser, Leu, Tyr or Lys
<220>
<221> X
<222> (9)..(9)
<223> Cys or selenocysteine
<220>
<221> X
<222> (12)..(12)
<223> His, Glu, gamma carboxyglutamate, Asp, or Asn
<220>
<221> X
<222> (13)..(13)
<223> Ile, Leu, Asp, Val or Ala
<220>
<221> X
<222> (14)..(14)
<223> Thr, Ala, Pro, Val or Arg
<220>
<221> X
<222> (15)..(15)
<223> Asn, Asp, Ala, Val, Thr, Pro or Glu
<220>
<221> X
<222> (16)..(16)
<223> Ala, Ser, Gln, His, Tyr, Arg or Gly
<220>
<221> X
<222> (17)..(17)
<223> Tyr or Leu
<220>
<221> X
<222> (18)..(18)
<223> Tyr, Met, Val, Gln, Ile, Asp, Gly, Asn or Leu
<220>
<221> X
<222> (19)..(19)
<223> Leu, Asp, Gln, Gly, Lys, Glu, Arg or Thr
<220>
<221> X
<222> (20)..(20)
<223> Val, Leu or Lys
<220>
<221> X
<222> (21)..(21)
<223> Cys, amidated Cys, selenocysteine or amidated selenocysteine
<220>
<221> X
<222> (22)..(22)
<223> Tyr, Phe or His
<220>
<221> X
<222> (23)..(23)
<223> Glu, Arg, Ser, Gly or is absent
<220>
<221> X
<222> (24)..(24)
<223> Arg, Asp, Val or is absent
<220>
<221> X
<222> (25)..(25)
<223> Gly, Leu, Val or is absent
<220>
<221> X
<222> (26)..(26)
<223> Phe, Val, Ile or is absent
<220>
<221> X
<222> (27)..(27)
<223> Phe, Asn, Pro, Glu or is absent
<220>
<221> X
<222> (28)..(28)
<223> Tyr, Cys, His or is absent
<220>
<221> X
<222> (29)..(29)
<223> Thr, His, Leu, Tyr or is absent
<220>
<221> X
<222> (30)..(30)
<223> Pro, Glu, Leu, Ile, Arg or is absent
<220>
<221> X
<222> (31)..(31)
<223> Ile, Lys or is absent
<220>
<221> X
<222> (32)..(32)
<223> Thr, Lys, Leu, Gln or is absent
<220>
<221> X
<222> (33)..(33)
<223> Cys or is absent
<220>
<221> X
<222> (34)..(34)
<223> Glu, Pro, Val or is absent
<220>
<221> X
<222> (35)..(35)
<223> Glu, Gly or is absent
<220>
<221> X
<222> (36)..(36)
<223> Glu, Gly or is absent
<220>
<221> X
<222> (37)..(37)
<223> Glu, Val or is absent
<220>
<221> X
<222> (38)..(38)
<223> Ala, Asp or is absent
<220>
<221> X
<222> (39)..(39)
<223> Ala or is absent
<400> 5
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Gly Ser Xaa Xaa Xaa Xaa Xaa
1 5 10 15
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
20 25 30
Xaa Xaa Xaa Xaa Xaa Xaa Xaa
35
<210> 6
<211> 39
<212> PRT
<213> Artificial Sequence
<220>
<223> B chain
<220>
<221> X
<222> (1)..(1)
<223> Thr, Asn, Ser or is absent
<220>
<221> X
<222> (2)..(2)
<223> Phe, Ser, Asn, Thr, Gln or is absent
<220>
<221> X
<222> (3)..(3)
<223> Asp, Gly, Pro, Leu, Phe, or His
<220>
<221> X
<222> (4)..(4)
<223> Thr, Pro, Asp, Val or Gly
<220>
<221> X
<222> (5)..(5)
<223> Asn, Pro, His, Thr, Arg, Ser or hydroxyproline
<220>
<221> X
<222> (6)..(6)
<223> Lys, Glu, Asn, Asp, Arg, Gln or Gly
<220>
<221> X
<222> (7)..(7)
<223> His or Tyr
<220>
<221> X
<222> (8)..(8)
<223> Arg, Thr, Ile, Ser, Leu, Tyr or Lys
<220>
<221> X
<222> (9)..(9)
<223> Cys or selenocysteine
<220>
<221> X
<222> (12)..(12)
<223> His, Glu, gamma carboxyglutamate, Asp, or Asn
<220>
<221> X
<222> (13)..(13)
<223> Ile, Leu, Asp, Val or Ala
<220>
<221> X
<222> (14)..(14)
<223> Thr, Ala, Pro, Val or Arg
<220>
<221> X
<222> (15)..(15)
<223> Asn, Asp, Ala, Val, Thr, Pro or Glu
<220>
<221> X
<222> (16)..(16)
<223> Ala, Ser, Gln, His, Tyr, Arg or Gly
<220>
<221> X
<222> (17)..(17)
<223> Tyr or Leu
<220>
<221> X
<222> (18)..(18)
<223> Tyr, Met, Val, Gln, Ile, Asp, Gly, Asn or Leu
<220>
<221> X
<222> (19)..(19)
<223> Leu, Asp, Gln, Gly, Lys, Glu, Arg or Thr
<220>
<221> X
<222> (20)..(20)
<223> Val or Leu
<220>
<221> X
<222> (21)..(21)
<223> Cys, amidated Cys, selenocysteine or amidated selenocysteine
<220>
<221> X
<222> (22)..(22)
<223> Tyr, Phe or His
<220>
<221> X
<222> (23)..(23)
<223> Glu, Arg, Ser, Gly or is absent
<220>
<221> X
<222> (24)..(24)
<223> Arg, Asp, Val or is absent
<220>
<221> X
<222> (25)..(25)
<223> Gly, Leu, Val or is absent
<220>
<221> X
<222> (26)..(26)
<223> Phe, Val, Ile or is absent
<220>
<221> X
<222> (27)..(27)
<223> Phe, Asn, Pro, Glu or is absent
<220>
<221> X
<222> (28)..(28)
<223> Tyr, Cys, His or is absent
<220>
<221> X
<222> (29)..(29)
<223> Thr, His, Leu, Tyr or is absent
<220>
<221> X
<222> (30)..(30)
<223> Pro, Glu, Leu, Ile, Arg or is absent
<220>
<221> X
<222> (31)..(31)
<223> Ile, Lys or is absent
<220>
<221> X
<222> (32)..(32)
<223> Thr, Lys, Leu, Gln or is absent
<220>
<221> X
<222> (33)..(33)
<223> Cys or is absent
<220>
<221> X
<222> (34)..(34)
<223> Glu, Pro, Val or is absent
<220>
<221> X
<222> (35)..(35)
<223> Glu, Gly or is absent
<220>
<221> X
<222> (36)..(36)
<223> Glu, Gly or is absent
<220>
<221> X
<222> (37)..(37)
<223> Glu, Val or is absent
<220>
<221> X
<222> (38)..(38)
<223> Ala, Asp or is absent
<220>
<221> X
<222> (39)..(39)
<223> Ala or is absent
<400> 6
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Gly Ser Xaa Xaa Xaa Xaa Xaa
1 5 10 15
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
20 25 30
Xaa Xaa Xaa Xaa Xaa Xaa Xaa
35
<210> 7
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> B chain
<220>
<221> X
<222> (1)..(1)
<223> Thr, Asn or is absent
<220>
<221> X
<222> (2)..(2)
<223> Phe, Ser or is absent
<220>
<221> X
<222> (3)..(3)
<223> Phe or Asp
<220>
<221> X
<222> (4)..(4)
<223> Thr or Val
<220>
<221> X
<222> (5)..(5)
<223> Pro, Asn or hydroxyproline
<220>
<221> X
<222> (6)..(6)
<223> Lys, Asn or Gln
<220>
<221> X
<222> (7)..(7)
<223> His or Tyr
<220>
<221> X
<222> (8)..(8)
<223> Arg, Ile or Leu
<220>
<221> X
<222> (9)..(9)
<223> Cys or selenocysteine
<220>
<221> X
<222> (12)..(12)
<223> His, Asp, Glu or gamma carboxyglutamate
<220>
<221> X
<222> (13)..(13)
<223> Val, Ile or Leu
<220>
<221> X
<222> (14)..(14)
<223> Thr, Ala, Pro, or Val
<220>
<221> X
<222> (15)..(15)
<223> Glu, Val, Asn or Asp
<220>
<221> X
<222> (16)..(16)
<223> Ser, Gln, Tyr or Ala
<220>
<221> X
<222> (17)..(17)
<223> Tyr or Leu
<220>
<221> X
<222> (18)..(18)
<223> Tyr, Asp, Met or Val
<220>
<221> X
<222> (19)..(19)
<223> Leu, Asp, Gln or Lys
<220>
<221> X
<222> (20)..(20)
<223> Leu or Val
<220>
<221> X
<222> (21)..(21)
<223> Cys, amidated Cys, selenocysteine or amidated selenocysteine
<220>
<221> X
<222> (22)..(22)
<223> Tyr or Gly
<220>
<221> X
<222> (23)..(23)
<223> Glu, Arg, Gly or is absent
<400> 7
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Gly Ser Xaa Xaa Xaa Xaa Xaa
1 5 10 15
Xaa Xaa Xaa Xaa Xaa Xaa Xaa
20
<210> 8
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> B chain
<220>
<221> X
<222> (1)..(1)
<223> Thr or is absent
<220>
<221> X
<222> (2)..(2)
<223> Phe or is absent
<220>
<221> X
<222> (3)..(3)
<223> Phe or Asp
<220>
<221> X
<222> (4)..(4)
<223> Thr or Val
<220>
<221> X
<222> (5)..(5)
<223> Pro, Asn or hydroxyproline
<220>
<221> X
<222> (6)..(6)
<223> Lys or Gln
<220>
<221> X
<222> (8)..(8)
<223> Arg or Leu
<220>
<221> X
<222> (12)..(12)
<223> His, Glu or gamma carboxyglutamate
<220>
<221> X
<222> (13)..(13)
<223> Ile or Leu
<220>
<221> X
<222> (14)..(14)
<223> Thr, or Val
<220>
<221> X
<222> (15)..(15)
<223> Glu, or Asn
<220>
<221> X
<222> (16)..(16)
<223> Ser or Ala
<220>
<221> X
<222> (17)..(17)
<223> Tyr or Leu
<220>
<221> X
<222> (18)..(18)
<223> Tyr or Met
<220>
<221> X
<222> (19)..(19)
<223> Leu or Asp
<220>
<221> X
<222> (20)..(20)
<223> Leu or Val
<220>
<221> X
<222> (22)..(22)
<223> Tyr
<220>
<221> X
<222> (23)..(23)
<223> Glu, Arg, Gly or is absent
<400> 8
Xaa Xaa Xaa Xaa Xaa Xaa His Xaa Cys Gly Ser Xaa Xaa Xaa Xaa Xaa
1 5 10 15
Xaa Xaa Xaa Xaa Cys Xaa Xaa
20
<210> 9
<211> 34
<212> PRT
<213> Artificial Sequence
<220>
<223> A chain
<220>
<221> X
<222> (2)..(2)
<223> Val or Ile
<220>
<221> X
<222> (3)..(3)
<223> Val or Ala
<220>
<221> X
<222> (4)..(4)
<223> Glu, gamma carboxyglutamate or Cys
<220>
<221> X
<222> (5)..(5)
<223> Gln, Glu, gamma carboxyglutamate, His or Val
<220>
<221> X
<222> (6)..(7)
<223> Cys or selenocysteine
<220>
<221> X
<222> (8)..(8)
<223> Thr, His, Asp, Gln, Tyr, Lys or Val
<220>
<221> X
<222> (9)..(9)
<223> Ser, Arg, Asn, His or Lys
<220>
<221> X
<222> (10)..(10)
<223> Ile, Pro, Tyr, Ala, Ser, Phe, His or Thr
<220>
<221> X
<222> (11)..(11)
<223> Cys or selenocysteine
<220>
<221> X
<222> (12)..(12)
<223> Ser or Thr
<220>
<221> X
<222> (13)..(13)
<223> Leu, Asn, Val or Asp
<220>
<221> X
<222> (14)..(14)
<223> Tyr, Ala, Gln, Asp or Glu
<220>
<221> X
<222> (15)..(15)
<223> Gln, Glu or Thr; or Ala
<220>
<221> X
<222> (17)..(17)
<223> Glu, Lys, Arg, Ile, Met, Thr or Ser
<220>
<221> X
<222> (18)..(18)
<223> Lys, Thr, Asn, Gln or Glu
<220>
<221> X
<222> (19)..(19)
<223> Tyr or Phe
<220>
<221> X
<222> (20)..(20)
<223> Cys, selenocysteine, amidated Cys, or amidated selenocysteine
<220>
<221> X
<222> (21)..(21)
<223> Asn, Pro, His, Ser, Gly, Ala, or is absent
<220>
<221> X
<222> (22)..(22)
<223> Pro, Asn, Thr, Leu, Ser or is absent
<220>
<221> X
<222> (23)..(23)
<223> Thr, Leu, Val, Ser or is absent
<220>
<221> X
<222> (24)..(24)
<223> Arg, Thr, Met, Gln, Leu or is absent
<220>
<221> X
<222> (25)..(25)
<223> Glu, Gly or is absent
<220>
<221> X
<222> (26)..(26)
<223> Ser, Leu or is absent
<220>
<221> X
<222> (27)..(31)
<223> Ser or is absent
<220>
<221> X
<222> (32)..(32)
<223> Ala, Ser or is absent
<220>
<221> X
<222> (33)..(33)
<223> Ala, Val or is absent
<220>
<221> X
<222> (34)..(34)
<223> Ala or is absent
<400> 9
Gly Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Phe
1 5 10 15
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
20 25 30
Xaa Xaa
<210> 10
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> A chain
<220>
<221> X
<222> (2)..(2)
<223> Val or Ile
<220>
<221> X
<222> (4)..(4)
<223> Glu or gamma carboxyglutamate
<220>
<221> X
<222> (5)..(5)
<223> His or Gln
<220>
<221> X
<222> (6)..(7)
<223> Cys or selenocysteine
<220>
<221> X
<222> (8)..(8)
<223> His or Thr
<220>
<221> X
<222> (9)..(9)
<223> Arg or Ser
<220>
<221> X
<222> (10)..(10)
<223> Pro or Ile
<220>
<221> X
<222> (11)..(11)
<223> Cys or selenocysteine
<220>
<221> X
<222> (13)..(13)
<223> Asn or Leu
<220>
<221> X
<222> (14)..(14)
<223> Ala or Tyr
<220>
<221> X
<222> (15)..(15)
<223> Glu or Gln
<220>
<221> X
<222> (16)..(16)
<223> Phe or Leu
<220>
<221> X
<222> (17)..(17)
<223> Lys or Glu
<220>
<221> X
<222> (18)..(18)
<223> Lys or Asn
<220>
<221> X
<222> (20)..(20)
<223> Cys, selenocysteine, amidated Cys, or amidated selenocysteine
<220>
<221> X
<222> (21)..(21)
<223> Asn or absent
<400> 10
Gly Xaa Val Xaa Xaa Cys Cys Xaa Xaa Xaa Cys Ser Xaa Xaa Xaa Xaa
1 5 10 15
Xaa Xaa Tyr Cys Xaa
20
<210> 11
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> B chain
<220>
<221> X
<222> (1)..(1)
<223> Thr or is absent
<220>
<221> X
<222> (2)..(2)
<223> Phe or is absent
<220>
<221> X
<222> (3)..(3)
<223> Phe or Asp
<220>
<221> X
<222> (4)..(4)
<223> Thr or Val
<220>
<221> X
<222> (5)..(5)
<223> Pro, Asn or hydroxyproline
<220>
<221> X
<222> (6)..(6)
<223> Lys or Gln
<220>
<221> X
<222> (8)..(8)
<223> Arg or Leu
<220>
<221> X
<222> (9)..(9)
<223> Cys or selenocysteine
<220>
<221> X
<222> (12)..(12)
<223> His, Glu or gamma carboxyglutamate
<220>
<221> X
<222> (13)..(13)
<223> Ile or Leu
<220>
<221> X
<222> (14)..(14)
<223> Thr, or Val
<220>
<221> X
<222> (15)..(15)
<223> Glu, or Asn
<220>
<221> X
<222> (16)..(16)
<223> Ser or Ala
<220>
<221> X
<222> (17)..(17)
<223> Tyr or Leu
<220>
<221> X
<222> (18)..(18)
<223> Tyr or Met
<220>
<221> X
<222> (19)..(19)
<223> Leu or Asp
<220>
<221> X
<222> (20)..(20)
<223> Leu or Val
<220>
<221> X
<222> (21)..(21)
<223> Cys, selenocysteine, amidated Cys, or amidated selenocysteine
<220>
<221> X
<222> (22)..(22)
<223> Gly or Tyr
<220>
<221> X
<222> (23)..(23)
<223> Glu or Arg
<400> 11
Xaa Xaa Xaa Xaa Xaa Xaa His Xaa Cys Gly Ser Xaa Xaa Xaa Xaa Xaa
1 5 10 15
Xaa Xaa Xaa Xaa Xaa Xaa Xaa
20
<210> 12
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> A chain
<220>
<221> X
<222> (2)..(2)
<223> Val or Ile
<220>
<221> X
<222> (4)..(4)
<223> Glu or gamma carboxyglutamate
<220>
<221> X
<222> (5)..(5)
<223> His or Gln
<220>
<221> X
<222> (8)..(8)
<223> His or Thr
<220>
<221> X
<222> (9)..(9)
<223> Arg or Ser
<220>
<221> X
<222> (10)..(10)
<223> Pro or Ile
<220>
<221> X
<222> (13)..(13)
<223> Asn or Leu
<220>
<221> X
<222> (14)..(14)
<223> Ala or Tyr
<220>
<221> X
<222> (15)..(15)
<223> Glu or Gln
<220>
<221> X
<222> (17)..(17)
<223> Lys or Glu
<220>
<221> X
<222> (18)..(18)
<223> Lys or Asn
<220>
<221> X
<222> (21)..(21)
<223> Asn or absent
<400> 12
Gly Xaa Val Xaa Xaa Cys Cys Xaa Xaa Xaa Cys Ser Xaa Xaa Xaa Phe
1 5 10 15
Xaa Xaa Tyr Cys Xaa
20
<210> 13
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> B chain
<220>
<221> X
<222> (1)..(1)
<223> Thr or is absent
<220>
<221> X
<222> (2)..(2)
<223> Phe or is absent
<220>
<221> X
<222> (3)..(3)
<223> Phe or Asp
<220>
<221> X
<222> (4)..(4)
<223> Thr or Val
<220>
<221> X
<222> (5)..(5)
<223> Pro, Asn or hydroxyproline
<220>
<221> X
<222> (6)..(6)
<223> Lys or Gln
<220>
<221> X
<222> (8)..(8)
<223> Arg or Leu
<220>
<221> X
<222> (12)..(12)
<223> His, Glu or gamma carboxyglutamate
<220>
<221> X
<222> (13)..(13)
<223> Ile or Leu
<220>
<221> X
<222> (14)..(14)
<223> Thr, or Val
<220>
<221> X
<222> (15)..(15)
<223> Glu, or Asn
<220>
<221> X
<222> (16)..(16)
<223> Ser or Ala
<220>
<221> X
<222> (17)..(17)
<223> Tyr or Leu
<220>
<221> X
<222> (18)..(18)
<223> Tyr or Met
<220>
<221> X
<222> (19)..(19)
<223> Leu or Asp
<220>
<221> X
<222> (20)..(20)
<223> Leu or Val
<220>
<221> X
<222> (23)..(23)
<223> Glu or Arg
<400> 13
Xaa Xaa Xaa Xaa Xaa Xaa His Xaa Cys Gly Ser Xaa Xaa Xaa Xaa Xaa
1 5 10 15
Xaa Xaa Xaa Xaa Cys Tyr Xaa
20
<210> 14
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> A chain
<220>
<221> X
<222> (4)..(4)
<223> Glu or gamma carboxyglutamate
<220>
<221> X
<222> (5)..(5)
<223> His or Gln
<220>
<221> X
<222> (6)..(7)
<223> Cys or selenocysteine
<220>
<221> X
<222> (8)..(8)
<223> His or Thr
<220>
<221> X
<222> (9)..(9)
<223> Arg or Ser
<220>
<221> X
<222> (10)..(10)
<223> Pro or Ile
<220>
<221> X
<222> (11)..(11)
<223> Cys or selenocysteine
<220>
<221> X
<222> (13)..(13)
<223> Asn or Leu
<220>
<221> X
<222> (14)..(14)
<223> Ala or Tyr
<220>
<221> X
<222> (15)..(15)
<223> Glu or Gln
<220>
<221> X
<222> (17)..(17)
<223> Lys or Glu
<220>
<221> X
<222> (18)..(18)
<223> Lys or Asn
<220>
<221> X
<222> (20)..(20)
<223> Cys, selenocysteine, amidated Cys, or amidated selenocysteine
<220>
<221> X
<222> (21)..(21)
<223> Asn or absent
<400> 14
Gly Val Val Xaa Xaa Cys Cys Xaa Xaa Xaa Cys Ser Xaa Xaa Xaa Phe
1 5 10 15
Xaa Xaa Tyr Cys Xaa
20
<210> 15
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> B chain
<220>
<221> X
<222> (1)..(1)
<223> Thr or is absent
<220>
<221> X
<222> (2)..(2)
<223> Phe or is absent
<220>
<221> X
<222> (3)..(3)
<223> Phe or Asp
<220>
<221> X
<222> (4)..(4)
<223> Thr or Val
<220>
<221> X
<222> (5)..(5)
<223> Pro, Asn or hydroxyproline
<220>
<221> X
<222> (6)..(6)
<223> Lys or Gln
<220>
<221> X
<222> (12)..(12)
<223> His, Glu or gamma carboxyglutamate
<220>
<221> X
<222> (14)..(14)
<223> Thr, or Val
<220>
<221> X
<222> (15)..(15)
<223> Glu, or Asn
<220>
<221> X
<222> (16)..(16)
<223> Ser or Ala
<220>
<221> X
<222> (17)..(17)
<223> Tyr or Leu
<220>
<221> X
<222> (18)..(18)
<223> Tyr or Met
<220>
<221> X
<222> (19)..(19)
<223> Leu or Asp
<220>
<221> X
<222> (23)..(23)
<223> Glu or Arg
<400> 15
Xaa Xaa Xaa Xaa Xaa Xaa His Arg Cys Gly Ser Xaa Ile Xaa Xaa Xaa
1 5 10 15
Xaa Xaa Xaa Leu Cys Tyr Xaa
20
<210> 16
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> A chain
<400> 16
Gly Ile Val Glu Gln Cys Cys Thr Ser Ile Cys Ser Leu Tyr Gln Leu
1 5 10 15
Glu Asn Tyr Cys Asn
20
<210> 17
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> B chain
<220>
<221> X
<222> (15)..(15)
<223> aromatic residue or large aliphatic residue
<400> 17
Phe Val Asn Gln His Leu Cys Gly Ser His Leu Val Glu Ala Xaa Tyr
1 5 10 15
Leu Val Cys Gly Glu
20
<210> 18
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> A chain
<400> 18
Gly Ile Val Glu Gln Cys Cys Thr Ser Ile Cys Ser Leu Tyr Gln Leu
1 5 10 15
Glu Asn Tyr Cys Asn
20
<210> 19
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> B chain
<220>
<221> X
<222> (20)..(20)
<223> aromatic residue or large aliphatic residue
<400> 19
Phe Val Asn Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu Tyr
1 5 10 15
Leu Val Cys Xaa Glu
20
<210> 20
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> A chain
<400> 20
Gly Ile Val Glu Gln Cys Cys Thr Ser Ile Cys Ser Leu Tyr Gln Leu
1 5 10 15
Glu Asn Tyr Cys Asn
20
<210> 21
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> B chain
<220>
<221> X
<222> (15)..(15)
<223> aromatic residue or large aliphatic residue
<220>
<221> X
<222> (20)..(20)
<223> aromatic residue or large aliphatic residue
<400> 21
Phe Val Asn Gln His Leu Cys Gly Ser His Leu Val Glu Ala Xaa Tyr
1 5 10 15
Leu Val Cys Xaa Glu
20
<210> 22
<211> 20
<212> PRT
<213> Conus geographus
<220>
<221> X
<222> (4)..(4)
<223> gamma-carboxylated glutamic acid
<220>
<221> X
<222> (20)..(20)
<223> amidated Cys (at N-terminus)
<400> 22
Gly Val Val Xaa His Cys Cys His Arg Pro Cys Ser Asn Ala Glu Phe
1 5 10 15
Lys Lys Tyr Xaa
20
<210> 23
<211> 23
<212> PRT
<213> Conus geographus
<220>
<221> X
<222> (5)..(5)
<223> hydroxyproline
<220>
<221> X
<222> (12)..(12)
<223> gamma-carboxylated glutamic acid
<400> 23
Thr Phe Asp Thr Tyr Lys His Arg Cys Gly Ser Xaa Ile Thr Asn Ser
1 5 10 15
Tyr Met Asp Leu Cys Tyr Arg
20
<210> 24
<211> 21
<212> PRT
<213> Homo sapiens
<400> 24
Gly Ile Val Glu Gln Cys Cys Thr Ser Ile Cys Ser Leu Tyr Gln Leu
1 5 10 15
Glu Asn Tyr Cys Asn
20
<210> 25
<211> 30
<212> PRT
<213> Homo sapiens
<400> 25
Phe Val Asn Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu Tyr
1 5 10 15
Leu Val Cys Gly Glu Arg Gly Phe Phe Tyr Thr Pro Lys Thr
20 25 30
<210> 26
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> A chain
<220>
<221> X
<222> (2)..(2)
<223> Val or Ile
<220>
<221> X
<222> (4)..(4)
<223> Glu or gamma carboxyglutamate,
<220>
<221> X
<222> (5)..(5)
<223> His or Gln
<220>
<221> X
<222> (8)..(8)
<223> His or Thr
<220>
<221> X
<222> (9)..(9)
<223> Arg or Ser
<220>
<221> X
<222> (10)..(10)
<223> Pro or Ile,
<220>
<221> X
<222> (13)..(13)
<223> Asn or Leu
<220>
<221> X
<222> (14)..(14)
<223> Ala or Tyr
<220>
<221> X
<222> (15)..(15)
<223> Glu or Gln
<220>
<221> X
<222> (17)..(17)
<223> Lys or Glu
<220>
<221> X
<222> (18)..(18)
<223> Lys or Asn
<220>
<221> X
<222> (21)..(21)
<223> Asn or absent
<400> 26
Gly Xaa Val Xaa Xaa Cys Cys Xaa Xaa Xaa Cys Ser Xaa Xaa Xaa Phe
1 5 10 15
Xaa Xaa Tyr Cys Xaa
20
<210> 27
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> B chain
<220>
<221> X
<222> (1)..(1)
<223> Thr or is absent
<220>
<221> X
<222> (2)..(2)
<223> Phe or is absent
<220>
<221> X
<222> (3)..(3)
<223> Phe or Asp
<220>
<221> X
<222> (4)..(4)
<223> Thr or Val
<220>
<221> X
<222> (5)..(5)
<223> Pro, Asn or hydroxyproline
<220>
<221> X
<222> (6)..(6)
<223> Lys or Gln
<220>
<221> X
<222> (8)..(8)
<223> Arg or Leu
<220>
<221> X
<222> (12)..(12)
<223> His, Glu or gamma carboxyglutamate
<220>
<221> X
<222> (13)..(13)
<223> Ile or Leu
<220>
<221> X
<222> (14)..(14)
<223> Thr, or Val
<220>
<221> X
<222> (15)..(15)
<223> Glu, or Asn
<220>
<221> X
<222> (16)..(16)
<223> Ser or Ala
<220>
<221> X
<222> (18)..(18)
<223> Tyr or Met
<220>
<221> X
<222> (19)..(19)
<223> Leu or Asp
<220>
<221> X
<222> (20)..(20)
<223> Leu or Val
<220>
<221> X
<222> (22)..(22)
<223> Gly or Tyr
<220>
<221> X
<222> (23)..(23)
<223> Glu or Arg
<400> 27
Xaa Xaa Xaa Xaa Xaa Xaa His Xaa Cys Gly Ser Xaa Xaa Xaa Xaa Xaa
1 5 10 15
Tyr Xaa Xaa Xaa Cys Xaa Xaa
20
<210> 28
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> A chain
<220>
<221> X
<222> (4)..(4)
<223> Glu or gamma carboxyglutamate
<220>
<221> X
<222> (5)..(5)
<223> His or Gln
<220>
<221> X
<222> (8)..(8)
<223> His or Thr
<220>
<221> X
<222> (9)..(9)
<223> Arg or Ser
<220>
<221> X
<222> (10)..(10)
<223> Pro or Ile
<220>
<221> X
<222> (13)..(13)
<223> Asn or Leu
<220>
<221> X
<222> (14)..(14)
<223> Ala or Tyr
<220>
<221> X
<222> (15)..(15)
<223> Glu or Gln
<220>
<221> X
<222> (17)..(17)
<223> Lys or Glu
<220>
<221> X
<222> (18)..(18)
<223> Lys or Asn
<220>
<221> X
<222> (21)..(21)
<223> Asn or absent
<400> 28
Gly Val Val Xaa Xaa Cys Cys Xaa Xaa Xaa Cys Ser Xaa Xaa Xaa Phe
1 5 10 15
Xaa Xaa Tyr Cys Xaa
20
<210> 29
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> B chain
<220>
<221> X
<222> (1)..(1)
<223> Thr or is absent
<220>
<221> X
<222> (2)..(2)
<223> Phe or is absent
<220>
<221> X
<222> (3)..(3)
<223> Phe or Asp
<220>
<221> X
<222> (4)..(4)
<223> Thr or Val
<220>
<221> X
<222> (5)..(5)
<223> Pro, Asn or hydroxyproline
<220>
<221> X
<222> (6)..(6)
<223> Lys or Gln
<220>
<221> X
<222> (12)..(12)
<223> His, Glu or gamma carboxyglutamate
<220>
<221> X
<222> (14)..(14)
<223> Thr, or Val
<220>
<221> X
<222> (15)..(15)
<223> Glu, or Asn
<220>
<221> X
<222> (16)..(16)
<223> Ser or Ala
<220>
<221> X
<222> (18)..(18)
<223> Tyr or Met
<220>
<221> X
<222> (19)..(19)
<223> Leu or Asp
<220>
<221> X
<222> (22)..(22)
<223> Gly or Tyr
<220>
<221> X
<222> (23)..(23)
<223> Glu or Arg
<400> 29
Xaa Xaa Xaa Xaa Xaa Xaa His Arg Cys Gly Ser Xaa Ile Xaa Xaa Xaa
1 5 10 15
Tyr Xaa Xaa Leu Cys Xaa Xaa
20
<210> 30
<211> 22
<212> PRT
<213> Artificial Sequence
<220>
<223> B Chain
<400> 30
Phe Val Asn Gln His Leu Cys Gly Ser Glu Leu Val Glu Ala Leu Tyr
1 5 10 15
Leu Val Cys Tyr Glu Arg
20
<210> 31
<211> 22
<212> PRT
<213> Artificial Sequence
<220>
<223> B chain
<400> 31
Phe Val Asn Gln His Leu Cys Gly Ser Glu Leu Val Glu Ala Leu Tyr
1 5 10 15
Leu Val Cys Phe Glu Arg
20
<210> 32
<211> 22
<212> PRT
<213> Artificial Sequence
<220>
<223> B chain
<400> 32
Phe Val Asn Gln His Leu Cys Gly Ser Glu Leu Val Glu Ala Leu Tyr
1 5 10 15
Leu Val Cys Pro Glu Arg
20
<210> 33
<211> 22
<212> PRT
<213> Artificial Sequence
<220>
<223> B chain
<400> 33
Phe Val Asn Gln His Leu Cys Gly Ser Asp Leu Val Glu Ala Leu Tyr
1 5 10 15
Leu Val Cys Tyr Glu Arg
20
<210> 34
<211> 22
<212> PRT
<213> Artificial Sequence
<220>
<223> B chain
<400> 34
Phe Val Asn Gln His Leu Cys Gly Ser Asp Leu Val Glu Ala Leu Tyr
1 5 10 15
Leu Val Cys Phe Glu Arg
20
<210> 35
<211> 22
<212> PRT
<213> Artificial Sequence
<220>
<223> B chain
<400> 35
Phe Val Asn Gln His Leu Cys Gly Ser Asp Leu Val Glu Ala Leu Tyr
1 5 10 15
Leu Val Cys Pro Glu Arg
20
<210> 36
<211> 22
<212> PRT
<213> Artificial Sequence
<220>
<223> B chain
<400> 36
Phe Val Asn Gln His Leu Cys Gly Ser Gln Leu Val Glu Ala Leu Tyr
1 5 10 15
Leu Val Cys Tyr Glu Arg
20
<210> 37
<211> 22
<212> PRT
<213> Artificial Sequence
<220>
<223> B chain
<400> 37
Phe Val Asn Gln His Leu Cys Gly Ser Gln Leu Val Glu Ala Leu Tyr
1 5 10 15
Leu Val Cys Phe Glu Arg
20
<210> 38
<211> 22
<212> PRT
<213> Artificial Sequence
<220>
<223> B chain
<400> 38
Phe Val Asn Gln His Leu Cys Gly Ser Gln Leu Val Glu Ala Leu Tyr
1 5 10 15
Leu Val Cys Pro Glu Arg
20
<210> 39
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> A chain
<400> 39
Gly Ile Val Glu Gln Cys Cys His Arg Ile Cys Ser Leu Tyr Gln Leu
1 5 10 15
Glu Asn Tyr Cys Asn
20
<210> 40
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> A chain
<400> 40
Gly Ile Val Glu Gln Cys Cys Tyr Arg Ile Cys Ser Leu Tyr Gln Leu
1 5 10 15
Glu Asn Tyr Cys Asn
20
<210> 41
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> A chain
<400> 41
Gly Ile Val Glu Gln Cys Cys Lys Arg Ile Cys Ser Leu Tyr Gln Leu
1 5 10 15
Glu Asn Tyr Cys Asn
20
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ПЕПТИДЫ И ИХ ПРИМЕНЕНИЕ В ЛЕЧЕНИИ ЗАБОЛЕВАНИЙ, НАРУШЕНИЙ ИЛИ СОСТОЯНИЙ, АССОЦИИРОВАННЫХ С МУТАНТНЫМ р53 | 2017 |
|
RU2762089C2 |
| ИММУНОЦИТОКИНЫ НА ОСНОВЕ IL-15 И IL-15Rα ДОМЕНА SUSHI | 2012 |
|
RU2763298C2 |
| Фармацевтическая композиция, содержащая инсулин и глюкагон | 2019 |
|
RU2823246C2 |
| НОВЫЕ АНТИ-HLA-А2 АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2805674C2 |
| АНТИ-HLA-A2 АНТИТЕЛА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2782276C2 |
| ПРИМЕНЕНИЕ АНТИТЕЛА ПРОТИВ О-АЦЕТИЛИРОВАННОГО ГАНГЛИОЗИДА GD2 ДЛЯ УЛУЧШЕНИЯ ТЕРАПЕВТИЧЕСКОГО ПОТЕНЦИАЛА ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2017 |
|
RU2771173C2 |
| ПЕПТИДНЫЕ ИНГИБИТОРЫ РЕЦЕПТОРА ИНТЕРЛЕЙКИНА-23 ДЛЯ ПЕРОРАЛЬНОГО ПРИЕМА И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ КИШЕЧНИКА | 2015 |
|
RU2736637C2 |
| ИСКУССТВЕННЫЕ НЕИЗБИРАТЕЛЬНЫЕ ЭПИТОПЫ КЛЕТОК Т-ХЕЛПЕРОВ КАК ИММУННЫЕ СТИМУЛЯТОРЫ ДЛЯ СИНТЕТИЧЕСКИХ ПЕПТИДНЫХ ИММУНОГЕНОВ | 2019 |
|
RU2839585C2 |
| ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ КОНЪЮГАТА ТРОЙНОГО АГОНИСТА ДЛИТЕЛЬНОГО ДЕЙСТВИЯ, ОБЛАДАЮЩЕГО АКТИВНОСТЯМИ В ОТНОШЕНИИ ВСЕХ ИЗ РЕЦЕПТОРОВ ГЛЮКАГОНА /GLP-1/GIP, ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ ЛЕГКОГО | 2020 |
|
RU2829342C1 |
| СОЕДИНЕНИЯ-АГОНИСТЫ GIP И СПОСОБЫ | 2015 |
|
RU2716985C2 |
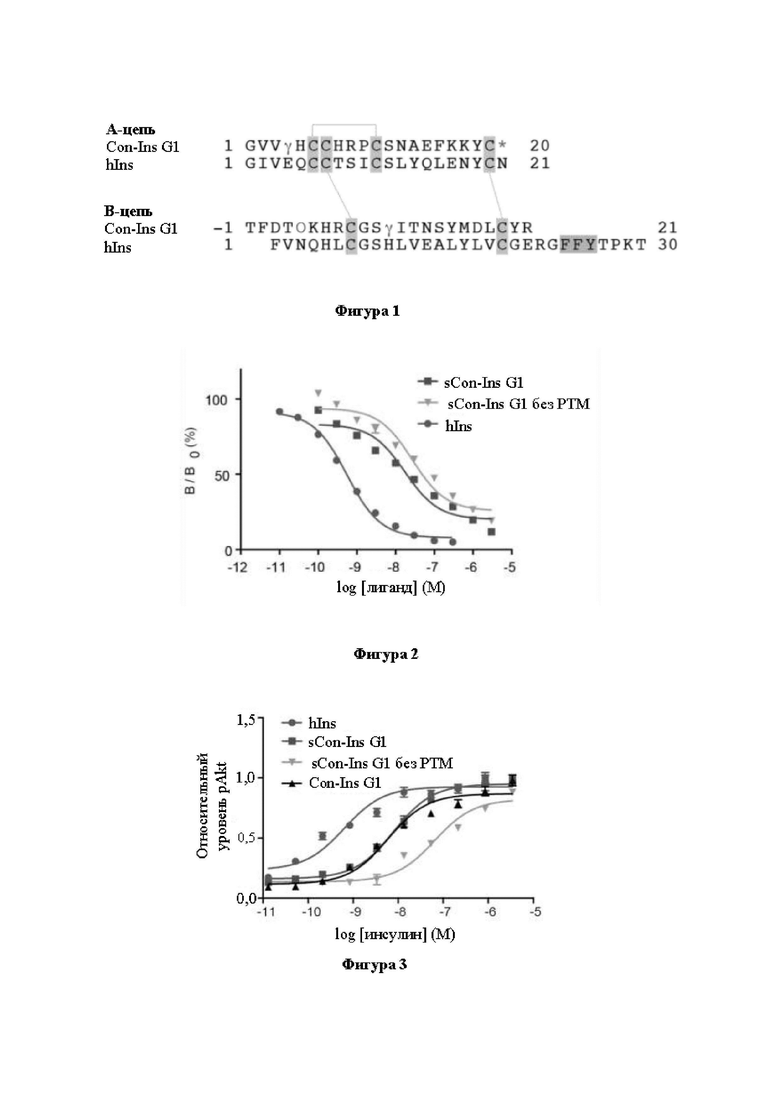
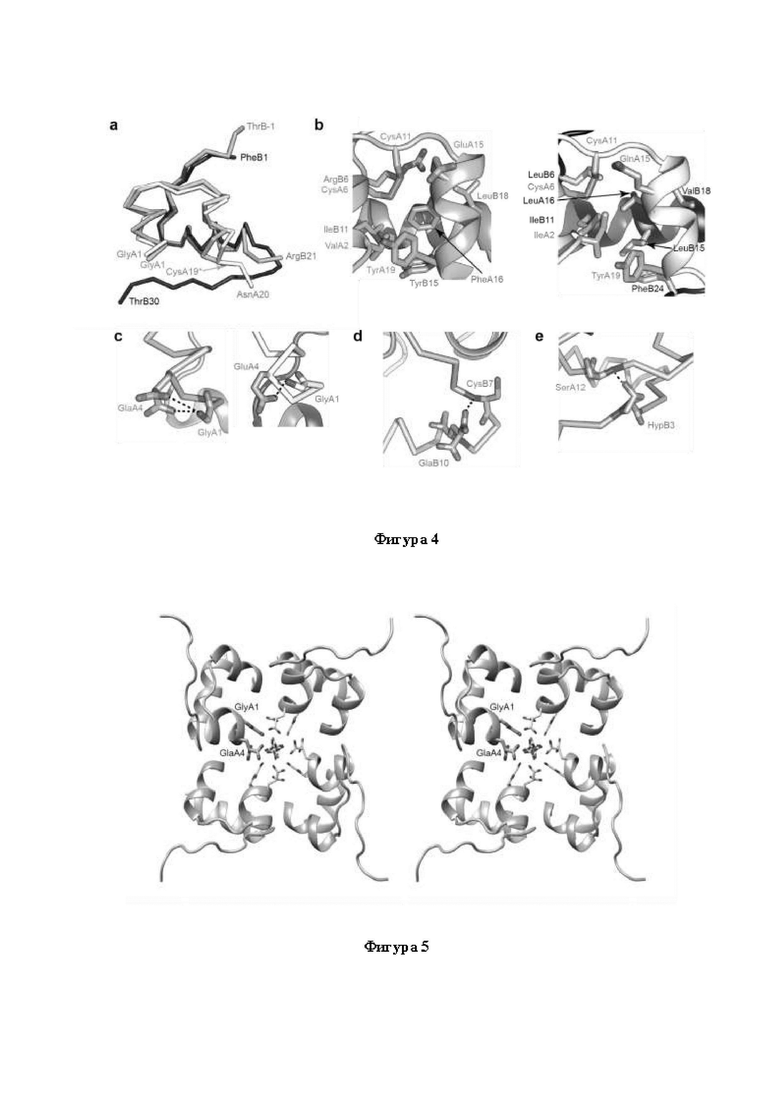
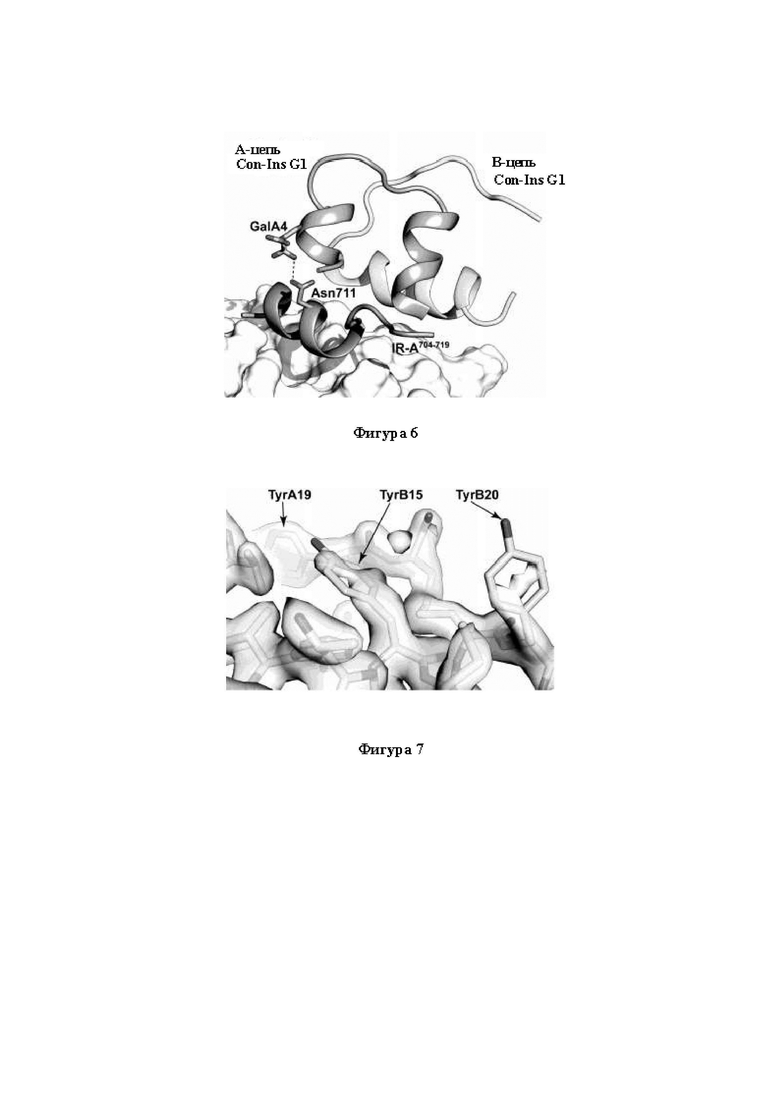

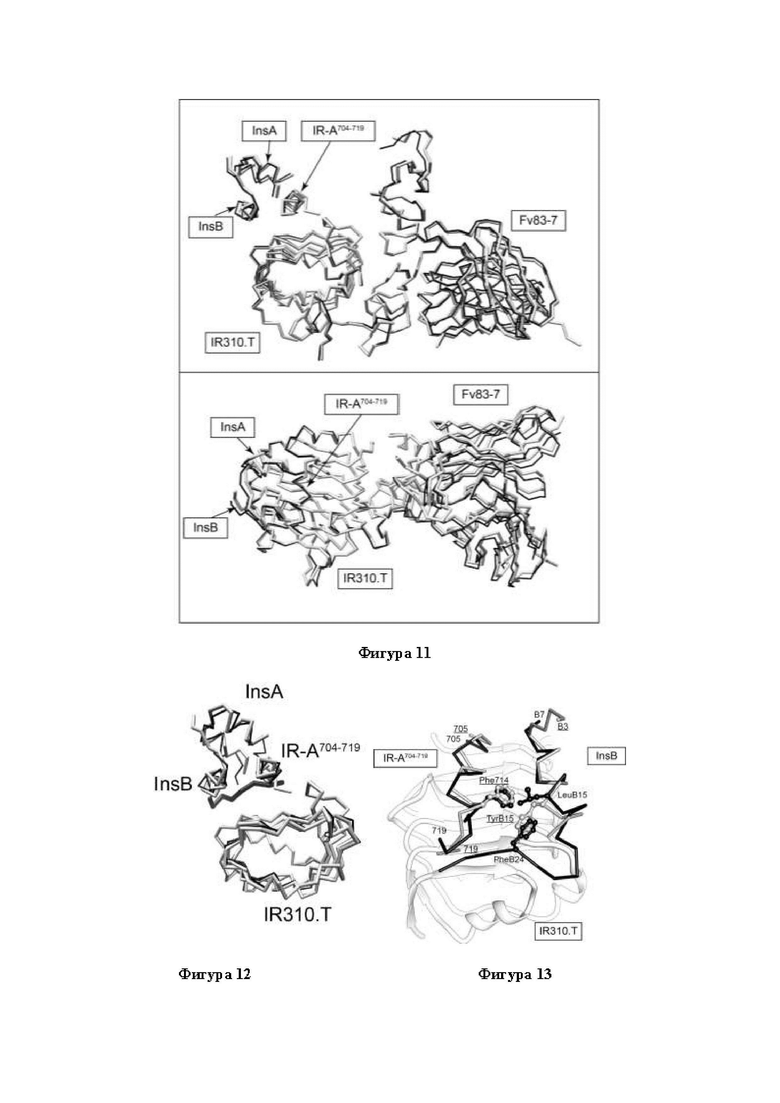
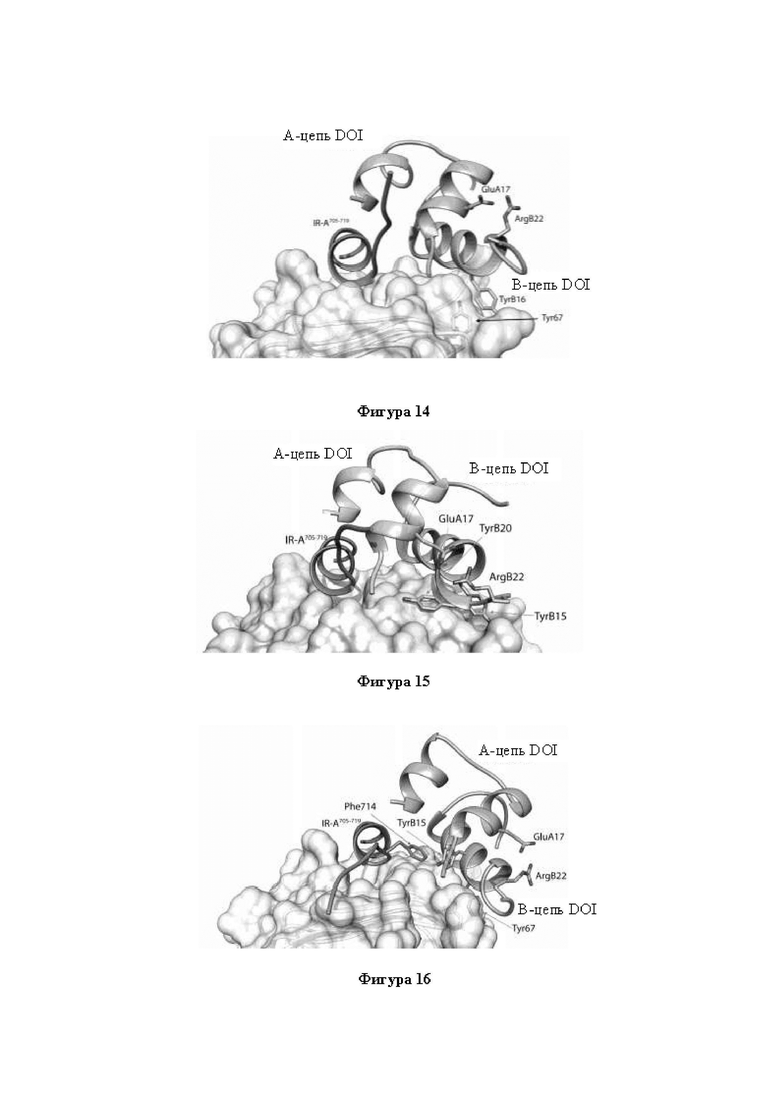



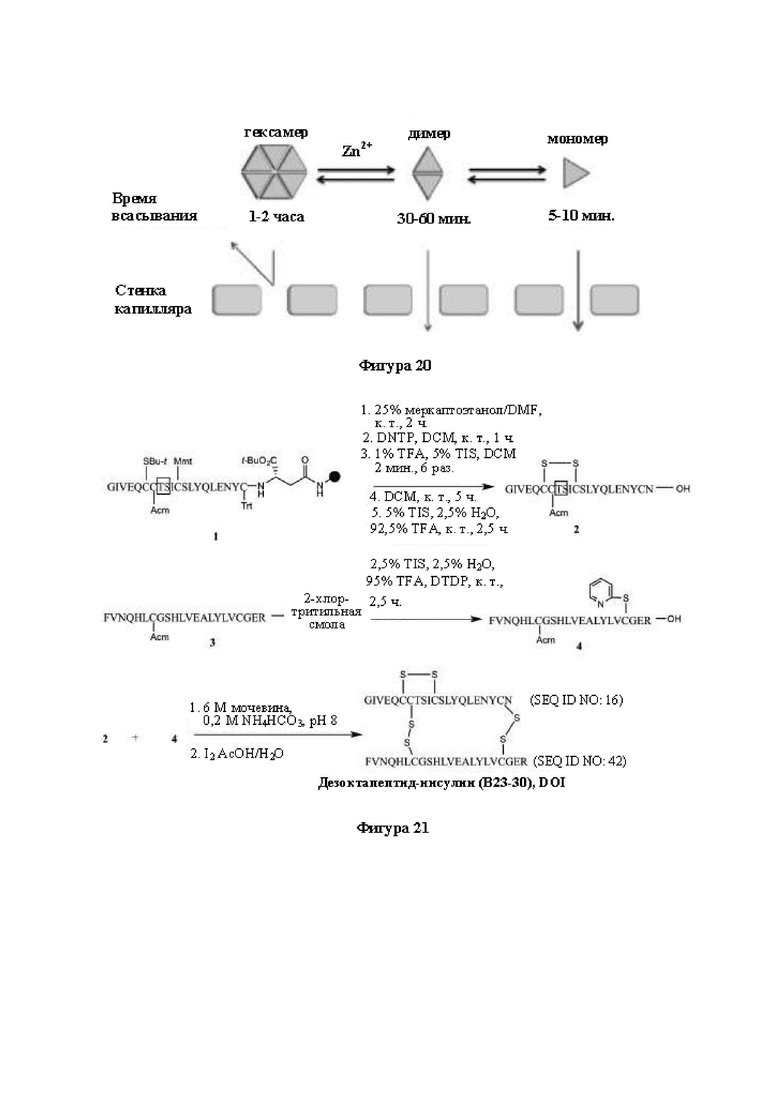
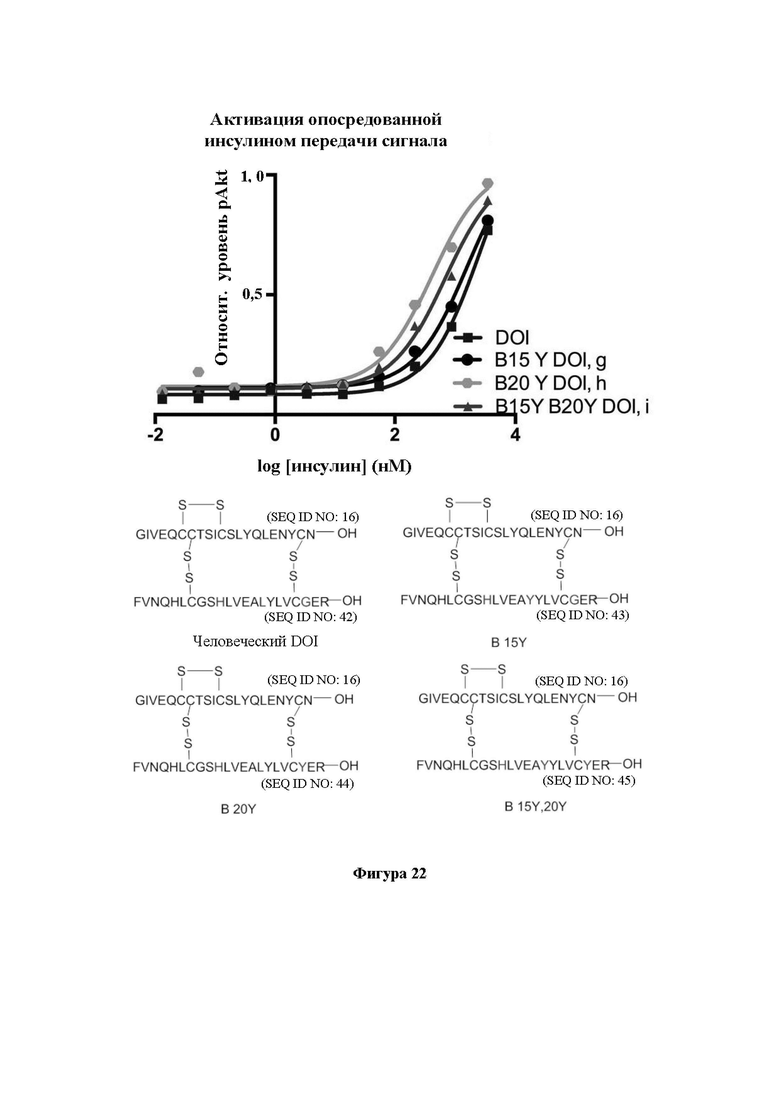
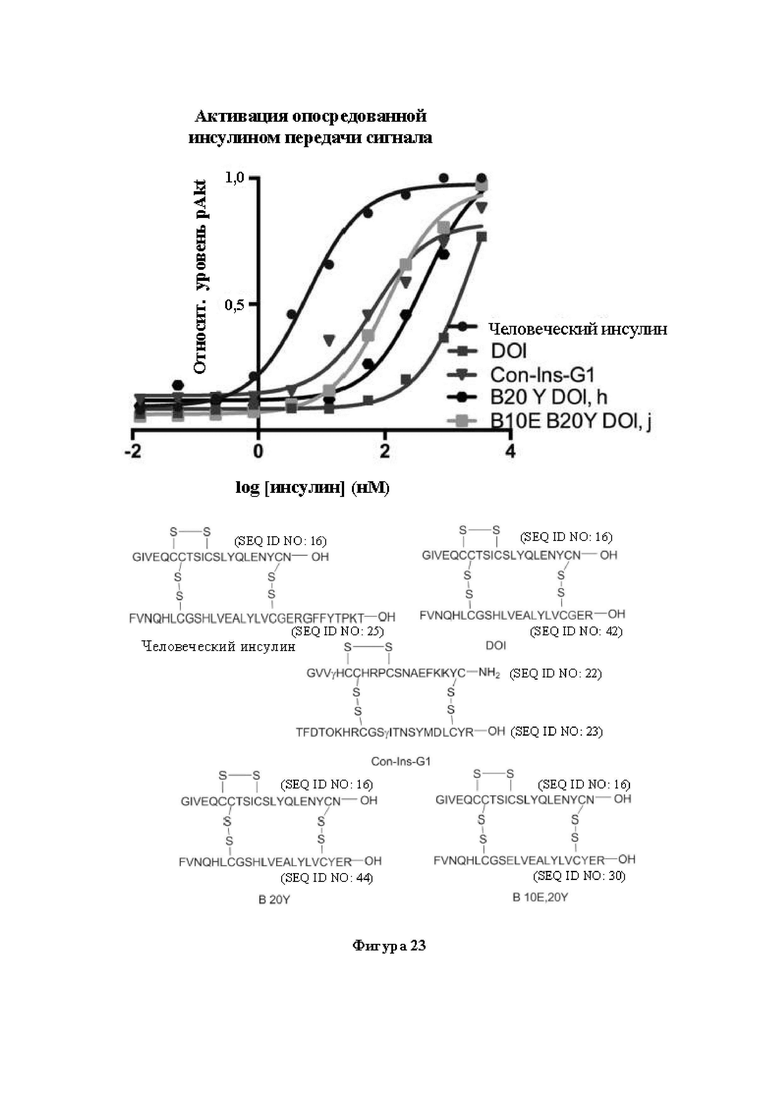
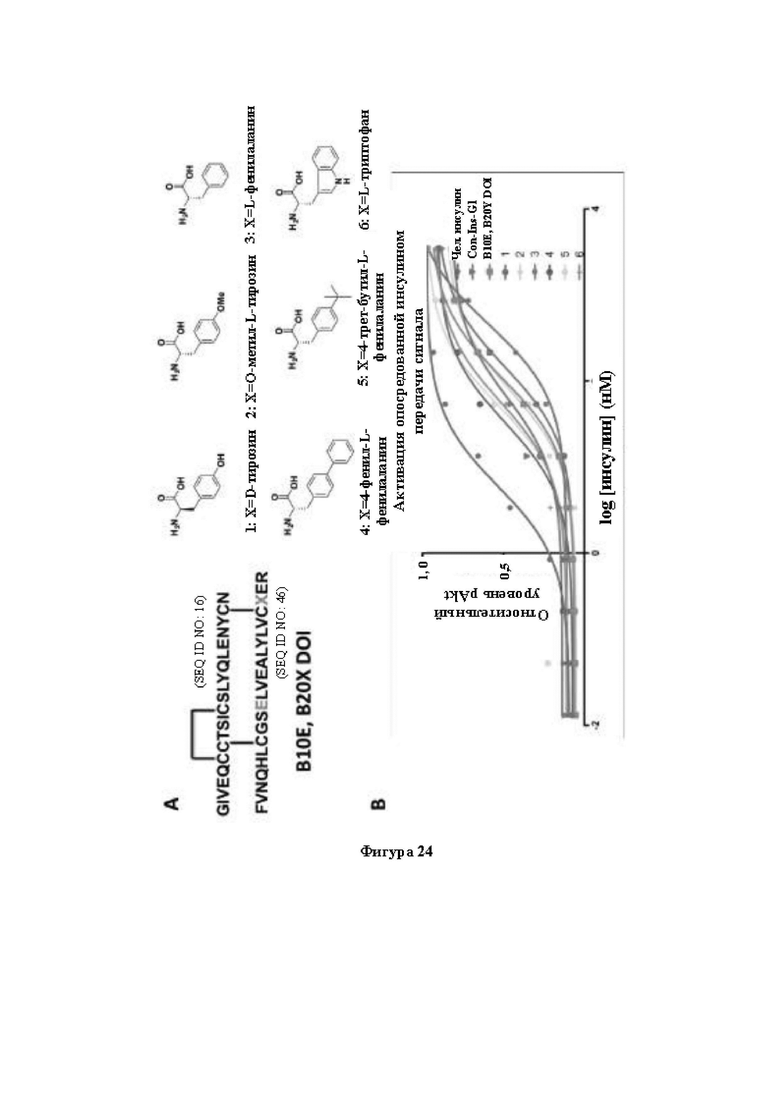
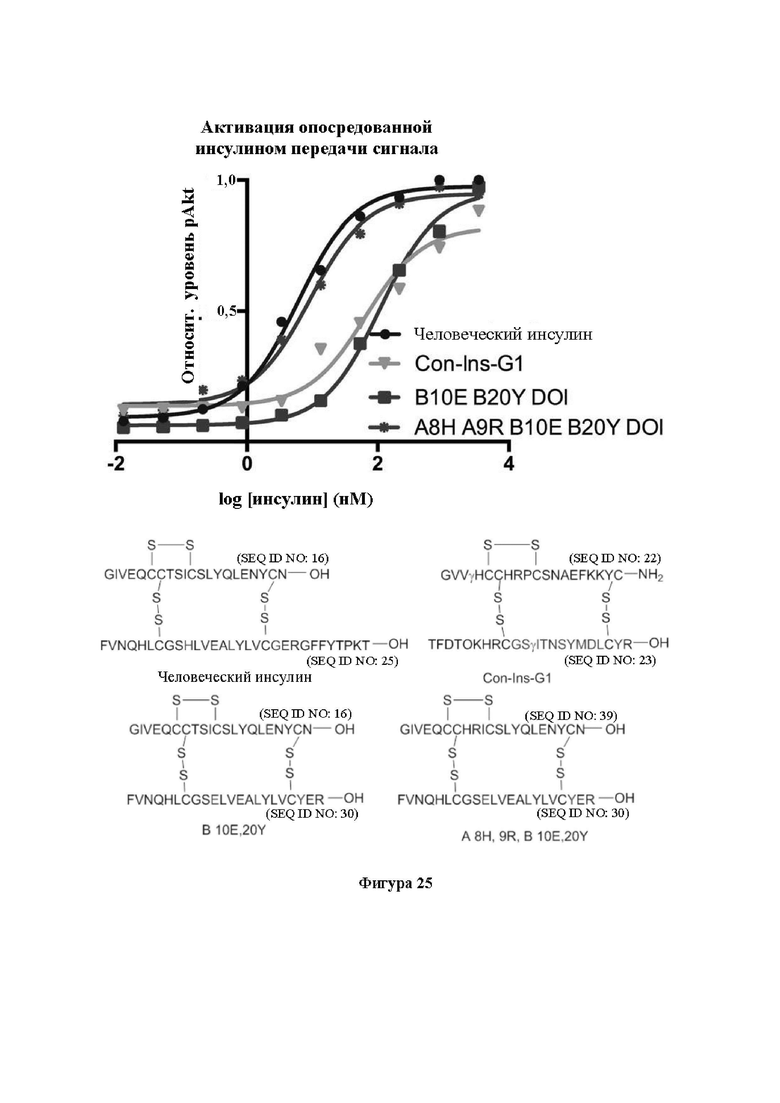
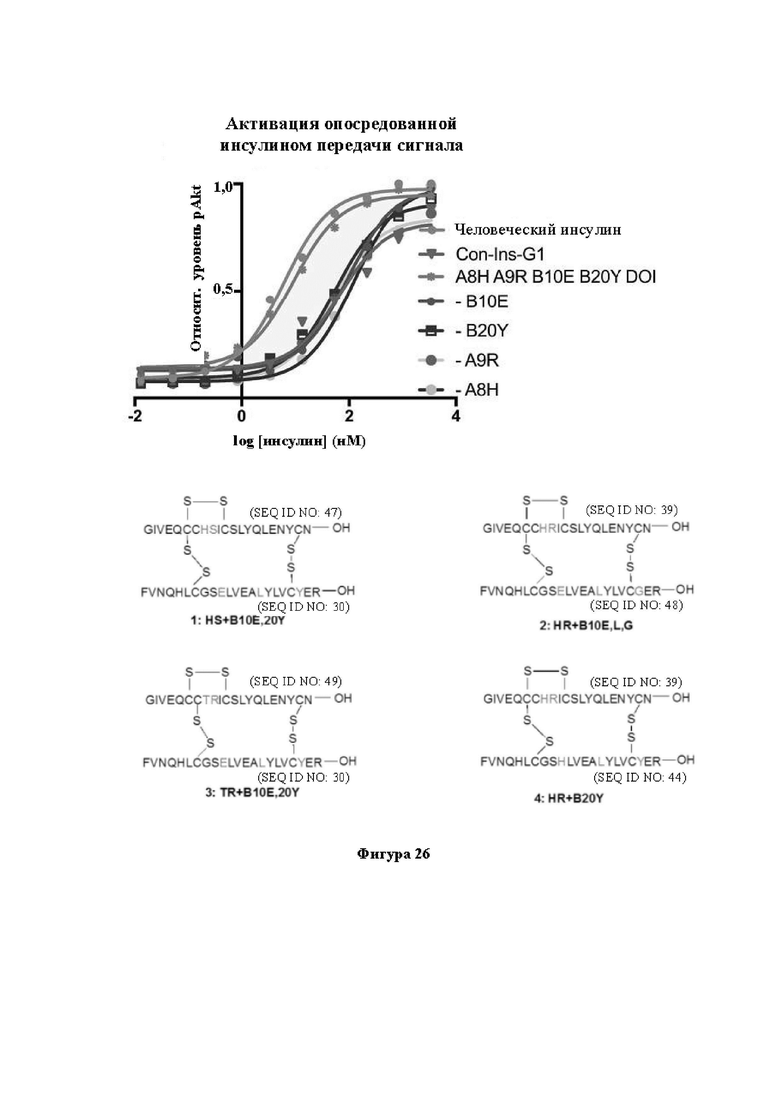
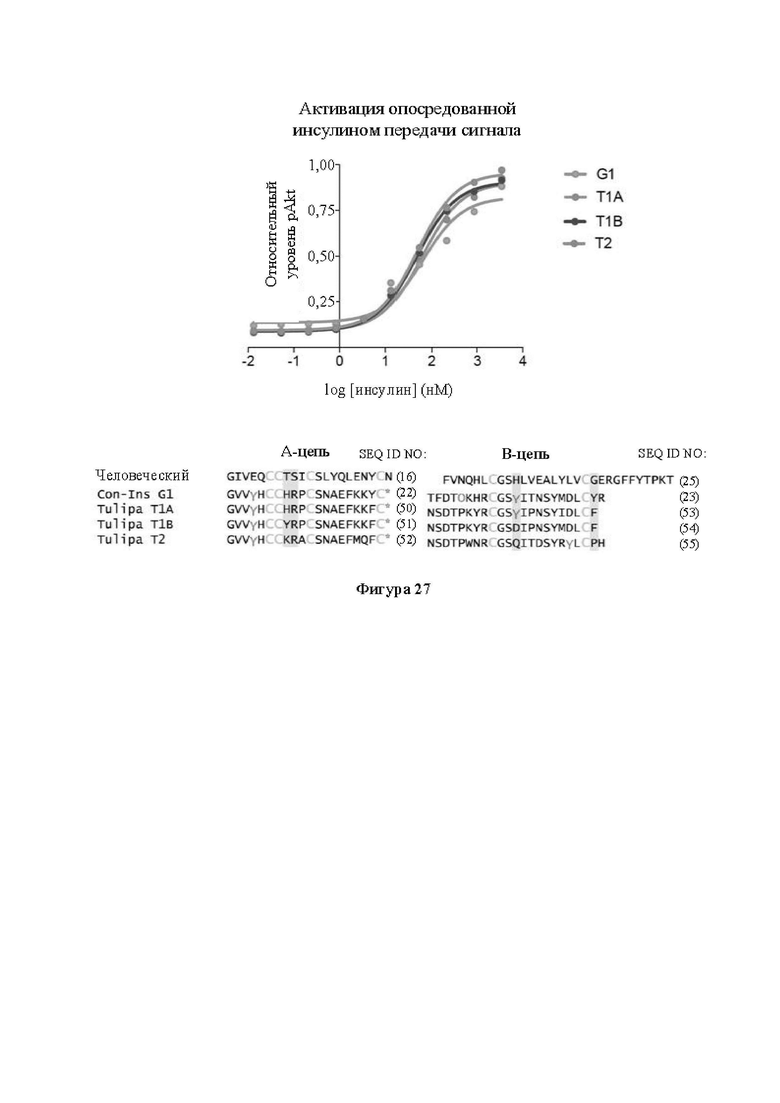
Настоящее изобретение относится к области биотехнологии, конкретно к аналогам инсулина, и может быть использовано в медицине. Изобретение раскрывает пептид, являющийся быстродействующим аналогом инсулина, отличается от известных аналогов тем, что представлен в мономерной форме и сохраняет активность в отношении передачи сигнала с участием инсулинового рецептора человека. Изобретение может быть применимо в медицинской практике для снижения уровня сахара в крови у пациента, в том числе и в ходе терапии диабета I типа. 5 н. и 11 з.п. ф-лы, 11 пр., 4 табл., 27 ил.
1. Пептид, содержащий А-цепь и В-цепь, причем А-цепь содержит последовательность, представленную в SEQ ID NO: 1, которая содержит
Gly-XA2-XA3-XA4-XA5-CysA6-CysA7-XA8-XA9-XA10-CysA11-XA12-XA13-XA14-XA15-XA16-XA17-XA18-XA19-CysA20-XA21-XA22-XA23-XA24-XA25-XA26-XA27-XA28-XA29-XA30-XA31-XA32-XA33-XA34,
причем XA2 = Ile; XA3 = Val; XA4 = Glu; XA5 = Gln; XA6 = Cys, XA7 = Cys; XA8 = His; XA8 = Arg; XA10 = Ile; XA11 = Cys; XA12 = Ser; XA13 = Leu; XA14 = Tyr; XA15 = Gln; XA16 = Leu; XA17 = Glu; XA18 = Asn; XA19 = Tyr; XA20 = Cys, XA21 = Asn, Pro, His, Ser, Gly, Ala, или отсутствует; и с XA22 по XA34 = отсутствует, и
причем В-цепь содержит последовательность, представленную в SEQ ID NO: 30,
причем указанный пептид является быстродействующим аналогом инсулина.
2. Пептид по п. 1, в котором А-цепь имеет последовательность
GIVEQCCHRICSLYQLENYCG (SEQ ID NO: 58).
3. Пептид по п. 1, в котором А-цепь имеет последовательность
GIVEQCCHRICSLYQLENYCG (SEQ ID NO: 58) и
В-цепь имеет последовательность
FVNQHLCGSELVEALYLVCYER (SEQ ID NO: 30).
4. Пептид по п. 3, в котором А-цепь и В-цепь связаны посредством по меньшей мере одной дисульфидной связи.
5. Пептид по п. 4, в котором А-цепь и В-цепь связаны посредством по меньшей мере двух дисульфидных связей.
6. Пептид по п. 5, в котором А-цепь и В-цепь связаны посредством по меньшей мере трех дисульфидных связей.
7. Пептид по п. 6, в котором указанные по меньшей мере две дисульфидные связи образованы между первым остатком Cys и третьим остатком Cys в А-цепи, или между вторым остатком Cys в А-цепи и первым остатком Cys в В-цепи, или между четвертым остатком Cys в А-цепи и вторым остатком в Cys В-цепи.
8. Пептид по п. 7, в котором имеются дисульфидные связи между первым остатком Cys и третьим остатком Cys в А-цепи, между вторым остатком Cys в А-цепи и первым остатком Cys в В-цепи и между четвертым остатком Cys в А-цепи и вторым остатком в Cys В-цепи.
9. Пептид по п. 1, который представляет собой мономер.
10. Пептид по п. 1, который представляет собой дез-октапептид инсулин.
11. Пептид по п. 1, где (a) аналог инсулина характеризуется IC50 в отношении человеческого рецептора IR-B, составляющей менее 10-6 M; и/или
(b) по меньшей мере 75% аналога является на мономерным в растворе; и/или
(c) пептид характеризуется повышенной биодоступностью при введении человеку по сравнению с человеческим инсулином; и/или
(d) пептид характеризуется пиковой биодоступностью в диапазоне от 0,5 до 3 часов после введения человеку; и/или
(e) пептид характеризуется началом проявления активности в течение 10 минут после введения; и/или
(f) пептид не связывается с человеческим IGF-IR или слабо связывается с человеческим IGF-IR; и/или
(g) пептид характеризуется аффинностью (Kd) в отношении человеческого IGF-IR, составляющей менее 100 нМ.
12. Фармацевтическая композиция для лечения и/или предупреждения связанного с инсулином состояния у субъекта, содержащая пептид по п. 1 и фармацевтически приемлемый носитель.
13. Способ повышения активации инсулинового рецептора у субъекта, включающий введение терапевтически эффективного количества пептида п. 1 субъекту, нуждающемуся в этом.
14. Способ снижения уровня сахара в крови у субъекта, включающий введение терапевтически эффективного количества пептида по п. 1 субъекту, нуждающемуся в этом.
15. Способ по п. 14, в котором у субъекта до введения пептида был диагностирован диабет I типа.
16. Способ лечения диабета I типа у субъекта, включающий введение терапевтически эффективного количества пептида по п. 1 субъекту, нуждающемуся в этом.
| WO 2012174480 A2, 20.12.2012 | |||
| WO 2005095443 A1, 13.10.2005 | |||
| US 20080146492 A1, 19.06.2008 | |||
| SIMON J | |||
| et al.: "Evolution of preproinsulin gene in birds" Mol | |||
| Phylogenet | |||
| Evol | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| BAJAJ M | |||
| et al.: "Coypu insulin | |||
| Primary structure, conformation and biological properties of a hystricomorph | |||
Авторы
Даты
2022-04-01—Публикация
2017-07-21—Подача