Область техники
Приоритет
Для настоящей заявки испрашивается приоритет в соответствии с предварительной заявкой США, регистрационный № 60/957923, поданной 24 августа 2007, полное содержание которой таким образом включено в данное описание в виде ссылки.
Область техники
Настоящее изобретение относится к новой комбинированной терапии рака поджелудочной железы, в которой используются антигенный пептид и химиотерапевтическое средство.
Предшествующий уровень техники
Рак поджелудочной железы имеет одну из наивысших степеней смертности среди всех злокачественных новообразований, и 5-летняя выживаемость пациентов составляет 4%. Каждый год приблизительно у 28000 пациентов диагностируют рак поджелудочной железы, и почти все пациенты умирают от этого заболевания (Greenlee R.T. et al., (2001) CA Cancer J Clin 51: 15-36). Плохой прогноз этого злокачественного заболевания является результатом трудности ранней диагностики и плохого ответа на существующие методы лечения (Greenlee R.T. et al., (2001) CA Cancer J Clin 51: 15-36, Klinkenbijl J.H. (1999) Ann Surg, 230: 776-82; обсуждение 782-4). В частности, в настоящее время не идентифицировано опухолевых маркеров, которые позволяют получить надежный скрининг на ранних, потенциально излечимых стадиях заболевания.
Исследования, направленные на определение канцерогенных механизмов, выявили ряд целевых молекул-кандидатов для разработки противоопухолевых средств. Например, было показано, что ингибитор фарнезилтрансферазы (FTI) является эффективным в лечении Ras-зависимых опухолей в моделях на животных (Sun J. Et al., (1998) Oncogene, 16:1467-73). Такое фармацевтическое средство было впоследствии разработано для ингибирования путей передачи сигнала роста, связанных с Ras, которые зависят от посттранскрипционного фарнезилирования. В клинических исследованиях у людей, в которых противоопухолевые средства применяли в комбинации с антиHER2 моноклональным антителом, трастузумабом, с целью антагонизирования протоонкогена HER2/neu было достигнуто улучшение клинического ответа и улучшение общего коэффициента выживаемости у пациенток с раком молочной железы. Ингибитор тирозинкиназы STI-571 представляет собой ингибитор, который селективно деактивирует сшитый белок bcr-ab1. Такое фармацевтическое средство было впоследствии разработано для лечения хронического миелоидного лейкоза, где постоянная активация тирозинкиназы bcr-ab1 играет существенную роль в трансформации лейкоцитов. Такие фармацевтические средства созданы для ингибирования канцерогенной активности специфических генетических продуктов (Molina MA et al., (2000) Cancer Res., 16:4744-9). Следовательно, в раковых клетках генетические продукты со стимулированной экспрессией обычно служат потенциальными мишенями для разработки новых противоопухолевых средств. Альтернативно, ингибиторы синтеза нуклеиновых кислот также могут использоваться в качестве противоопухолевых средств. Например, гемцитабин (Gemzar®) является препаратом первого ряда выбора для лечения рака поджелудочной железы. Комбинированная терапия гемцитабином и паклитакселом также применялась для лечения рака поджелудочной железы.
Между тем, опухолевый ангиогенез существенно вовлечен в прогрессирование опухолей. Ранее было продемонстрировано, что эффективная вакцина против ангиогенеза опухоли может быть разработана в соответствии с подходом, направленным на эндотелиальные клетки, нацеленным на рецепторы эндотелиального фактора роста (VEGFR) 1 и 2, так как молекулы HLA I класса на эндотелиальных клетках не подавляются (Wada S. Et al., Cancer Res 2005 Jun 1, 65(11):4939-46; Ishizaki H. Et al., Clin Cancer Res 2006 Oct 1, 12(19):5841-9). Также ранее были описаны пептиды, которые индуцируют цитотоксические Т-лимфоциты (CTL), специфичные для клеток, экспрессирующих VEGFR, и таким образом подавляют опухолевый ангиогенез со специфическим и эффективным CTL ответом (см. WO/2004/024766, включенную в виде ссылки в настоящее описание).
Настоящее изобретение направлено на существующую необходимость в данной области техники в улучшении терапии рака поджелудочной железы, обеспечивая новую комбинированную терапию рака поджелудочной железы, в которой используется антигенный пептид, особенно антигенные пептиды и вакцины от рака, которые нацелены на VEGFR, и химиотерапевтическое средство, такое как гемцитабин.
Раскрытие изобретения
Сущность изобретения
В свете состояния области лечения рака, задачей настоящего изобретения является обнаружение средств для усиления терапевтического эффекта химиотерапии. VEGFR2 сильно экспрессируется в эндотелиальных клетках опухолевой ткани, и считают, что он вовлечен в пролиферацию эндотелиальных клеток по сигналу VEGF. Соответственно, настоящее изобретение сфокусировано на возможных вакцинах для лечения рака, которые нацелены на VEGFR2 (KDR/flk-1; называемый ниже как KDR). Впоследствии было обнаружено, что терапевтический эффект химиотерапевтических средств, таких как гемцитабин, потенцируется пептидами VEGFR2 (KDR/flk-1; называемый ниже как KDR), которые индуцируют цитотоксические Т-клетки против клеток, экспрессирующих VEGFR2. Следовательно, задачей настоящего изобретения является предоставить:
[1]. Способ лечения рака у пациента, который включает стадию введения пациенту (i) и (ii);
(i) одного или более пептидов, выбираемых из группы, состоящей из:
(а) одного или более пептидов, имеющих последовательность аминокислот, выбираемую из группы, состоящей из RFVPDGNRI (SEQ ID NO:1), VYSSEEAEL (SEQ ID NO:2), GYRIYDVVL (SEQ ID NO:3), SYMISYAGM (SEQ ID NO:4), KKWEFPRDRL (SEQ ID NO:5), DFLTLEHLI (SEQ ID NO:6);
(b) пептида (a), где 1, 2 или несколько аминокислот замещены, удалены или добавлены, и где указанный пептид обладает способностью к индуцированию цитотоксических Т-клеток;
(с) пептида по (b) где второй аминокислотой с N-конца является фенилаланин, тирозин, метионин или триптофан;
(d) пептида по (b) или (с) где С-концевой аминокислотой является фенилаланин, лейцин, изолейцин, триптофан или метионин;
(е) одного или более пептидов, имеющих последовательность аминокислот, выбираемую из группы, состоящей из AMFFWLLLV (SEQ ID NO:7), VIAMFFWLL (SEQ ID NO:8), AVIAMFFWL (SEQ ID NO:9), KLIEIGVQT (SEQ ID NO:10), YMISYAGMV (SEQ ID NO:11), IQSDVWSFGV (SEQ ID NO:12), и VLAMFFWLL (SEQ ID NO:13).
(f) пептида по (е) где 1, 2 или несколько аминокислот замещены, удалены или добавлены, и где указанный пептид обладает способностью к индуцированию цитотоксических Т-клеток;
(g) пептида по (f), где второй аминокислотой с N-конца является лейцин или метионин; и
(h) пептида по (f) или (g), где С-концевой аминокислотой является валин или лейцин.
(ii) одного или более химиотерапевтических средств, выбираемых из группы, состоящей из гемцитабина, его фармацевтически приемлемой соли и его пролекарства.
[2]. Способ по [1], где пациент является HLA-A24-положительным или HLA-A02-положительным.
[3]. Способ по [1], где рак представляет собой рак поджелудочной железы.
[4]. Набор для лечения рака у пациента, содержащий фармацевтические композиции, которые включают в качестве активного ингредиента соответственно (i) и (ii), и фармацевтически приемлемый носитель;
(i) один или более пептидов, выбираемых из группы, состоящей из (а)-(h) [1]-(i); и
(ii) одно или более химиотерапевтических средств, выбираемых из группы, состоящей из гемцитабина, его фармацевтически приемлемой соли и его пролекарства.
[5]. Набор по [4], где пациент является HLA-A24-положительным или HLA-A02-положительным.
[6]. Набор по [4], где раком является рак поджелудочной железы.
[7]. Противораковое средство для лечения рака у пациента, которое включает (i) в комбинации с (ii);
(i) один или более пептидов, выбираемых из группы, состоящей из (а)-(h) [1]-(i); и
(ii) одно или более химиотерапевтических средств, выбираемых из группы, состоящей из гемцитабина, его фармацевтически приемлемой соли и его пролекарства.
[8]. Противораковое средство по [7], где пациент является HLA-A24-положительным или HLA-A02-положительным.
[9]. Противораковое средство по [7], где раком является рак поджелудочной железы.
[10]. Применение комбинации (i) и (ii) в лечении рака у пациента;
(i) один или более пептидов, выбираемых из группы, состоящей из (а)-(h) [1]-(i); и
(ii) одно или более химиотерапевтических средств, выбираемых из группы, состоящей из гемцитабина, его фармацевтически приемлемой соли и его пролекарства.
[11]. Применение [10], где пациент является HLA-A24-положительным или HLA-A02-положительным.
[12]. Применение [10], где раком является рак поджелудочной железы.
[13]. Применение одного или более пептидов, выбираемых из группы, состоящей из (а)-(h) [1]-(i) для получения фармацевтической композиции, которая усиливает терапевтический эффект гемцитабина.
[14]. Применение [13], где усиливаемый терапевтический эффект представляет собой терапевтический эффект гемцитабина в лечении рака у пациента, где пациент является HLA-A24-положительным или HLA-A02-положительным.
[15]. Применение [14], где раком является рак поджелудочной железы.
Специалисту в области техники понятно, что один или более аспектов настоящего изобретения могут соответствовать определенным задачам, тогда как один или более других аспектов могут соответствовать другим определенным задачам. Каждая задача может применяться не равнозначно во всех ее отношениях к каждому аспекту настоящего изобретения. По существу, предшествующие задачи могут быть рассмотрены альтернативно в отношении любого другого аспекта настоящего изобретения. Эти и другие задачи и характеристики изобретения будут более очевидны после прочтения следующего подробного описания в сочетании с сопутствующими чертежами и примерами. Однако необходимо понимать, что и вышеуказанная сущность изобретения и следующее подробное описание являются предпочтительным вариантом осуществления изобретения и не ограничивают изобретение или другие альтернативные варианты осуществления изобретения.
Краткое описание чертежей
Различные аспекты и применения настоящего изобретения будут очевидны специалисту в области техники при рассмотрении краткого описания чертежей и подробного описания настоящего изобретения и его предпочтительных вариантов осуществления, которые следуют:
Фиг.1 представляет собой протокол введения антигенного пептида и химиотерапевтического средства, используемый в настоящих примерах.
Фиг.2 представляет собой результаты проточного цитометрического анализа необученных Т-клеток, клеток памяти и эффекторных Т-клеток среди CD8-положительных Т-клеток, где функциональные фракции лимфоцитов определяли путем окрашивания перфорином.
Фиг.3 представляет собой количественные изменения регуляторных Т-клеток (например, CD25-высокие и Foxp3-положительные клетки, среди CD4-положительных Т-клеток) до и после введения вакцины, измеряемые проточной цитометрией после четырехцветного окрашивания.
Фиг.4 представляет собой результаты ПЭТ сканирования в Случае 3, особенно лимфаденопатии около места введения после вакцинации.
Фиг.5 представляет собой изменения концентрации опухолевых маркеров с течением времени в Случае 3.
Фиг.6 представляет собой уровень специфической CTL реакции, возникшей в Случае 3 до и после вакцинации.
Фиг.7 представляет собой серию КТ сканирований в случае 4, изображающих уменьшающий эффект лечения на первичный фокус рака поджелудочной железы.
Фиг.8 представляет собой серию КТ сканирований в случае 4, изображающих эффект уменьшения опухоли в отношении метастатического фокуса 1 рака поджелудочной железы в печени.
Фиг.9 представляет собой серию КТ сканирований в случае 4, изображающих эффект уменьшения опухоли в отношении метастатического фокуса 2 рака поджелудочной железы в печени.
Фиг.10 представляет собой изменения опухолевых маркеров, СЕА и СА19-9, возникшие в Случае 4 в течение курса лечения.
Фиг.11 представляет собой специфическую реакцию CTL, возникшую в Случае 4 до и после вакцинации.
Фиг.12 представляет собой серию КТ сканирований в Случае 6, отображающих эффект уменьшения опухоли в отношении первичного фокуса рака поджелудочной железы.
Фиг.13 представляет собой серию ПЭТ сканирований в Случае 6, отображающих эффект уменьшения опухоли в отношении первичного фокуса рака поджелудочной железы.
Фиг.14 представляет собой специфическую CTL реакцию, возникшую в Случае 6 до и после вакцинации.
Фиг.15 представляет собой серию КТ сканирований в случае 7, отображающих изменения первичного фокуса рака поджелудочной железы.
Фиг.16 представляет собой изменения опухолевого маркера СА125, возникшие в Случае 7 в течение курса лечения.
Фиг.17 представляет собой специфическую CTL реакцию, возникшую в Случае 7 до и после вакцинации.
Фиг.18 представляет собой серию КТ сканирований в Случае 10, отображающих изменения первичного фокуса рака поджелудочной железы.
Фиг.19 представляет собой изменения опухолевого маркера СА125, возникшие в Случае 10 в течение курса лечения.
Подробное описание изобретения
Хотя методы и материалы, сходные или эквивалентные описанным в настоящем описании, могут быть использованы в осуществлении или исследовании вариантов осуществления настоящего изобретения, далее описаны предпочтительные методы и материалы. Однако необходимо понимать, что настоящее изобретение не ограничивается определенными молекулами, композициями, методиками или протоколами, описанными в настоящем описании, так как они могут варьироваться в соответствии с обычными экспериментами и оптимизацией. Также необходимо понимать, что терминология, используемая в описании, предназначена только для целей описания определенных версий или вариантов осуществления изобретения и не предназначена для ограничения рамок настоящего изобретения, которые ограничиваются только приложенной формулой изобретения.
Если не указано иначе, все технические и научные термины, используемые в настоящем описании, имеют такое же значение, как в общем понимает обычный специалист в области техники, к которой принадлежит настоящее изобретение. Однако, в случае конфликта, настоящая спецификация, включая определения, будет определяющей. Соответственно, в условиях настоящего изобретения применяются следующие определения:
Определения:
Понятия в единственном числе, как используются в настоящем описании, означают "по меньшей мере, один", если специально не указано иначе.
В рамках настоящего изобретения термин "несколько", когда применяется к добавлению, удалению и/или замене аминокислот, означает 3-7, предпочтительно 3-5, более предпочтительно 3-4, еще более предпочтительно 3 остатка аминокислот.
Как используется в настоящем описании, термин "организм" относится к любому живому существу, состоящему из, по меньшей мере, одной клетки. Живой организм может быть таким простым как, например, единичная эукариотическая клетка или таким комплексным, как млекопитающее, включая человека.
Как используется в настоящем описании, термин "биологический образец" относится к целому организму или подгруппе его тканей, клеток или составляющих частей (например, ткани организма, включая, но не ограничиваясь перечисленным, кровь, слизь, лимфатическую жидкость, синовиальную жидкость, спинномозговую жидкость, слюну, амниотическую жидкость, амниотическую пуповинную кровь, мочу, влагалищную жидкость и сперму). Термин "биологический образец" дополнительно относится к гомогенату, лизату, экстракту, культуре клеток или культуре тканей, полученных из целого организма или подгруппы его клеток, тканей или составляющих частей, или их фракции или части. Наконец, "биологический образец" относится к среде, такой как питательная среда или гель, в которой организм размножается, которая содержит клеточные компоненты, такие как белки или полинуклеотиды.
Термины "полипептид", "пептид" и "белок" используются в настоящем описании взаимозаменяемо и относятся к полимеру остатков аминокислот. Термины применяются к полимерам аминокислот, в которых один или более остатков аминокислот представляют собой модифицированный остаток или неестественный остаток, такой как искусственный химический миметик соответствующей естественной аминокислоты, а также полимерам естественных аминокислот.
Термины "полинуклеотиды", "олигонуклеотиды", "нуклеотиды", "нуклеиновые кислоты" и "молекулы нуклеиновых кислот" используются взаимозаменяемо в настоящем описании в отношении полимеров остатков нуклеиновых кислот и, если специально не указано иначе, соответствуют аминокислотам, называемым их общепринятыми однобуквенными кодами. Подобно аминокислотам, они охватывают полимеры и естественных и неестественных нуклеиновых кислот.
Термин "химиотерапевтическое средство", как используется в настоящем описании, относится к химическому соединению, применимому в лечении рака. Примеры химиотерапевтических соединений включают, но не ограничиваются перечисленным, следующие и их фармацевтически приемлемые соли, кислоты и производные: алкилирующие агенты, такие как тиотепа и циклофосфамид; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включающие альтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилоломеламин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, хлорфосфамид, ифосфамид, меклорэтамин, мекролэтамин оксид гидрохлорид, мелфалан, новембиехин, фенестерин, преднимустин, трофосфамид, урацил иприт; нитрозомочевины, такие как кармустин, хлорзотоцин, фотемустин, ломустин, нимустин, ранимустин; антибиотики, такие как аклациномизины, актиномицин, отрамицин, блеомицины, кактиномицин, калихеамицин, карабицин, карминомицин, карцинофилин, хромонинцины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин, эпирубицин, эзорубицин, идамбицин, марцелломицин, митомицины, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, порфиромицин, пуромицин, квеламицин, родоубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; пуриновые аналоги, такие как флударабин, 6-меркаптопурин, триамиприн, тиогуанин; пиримидиновые аналоги, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин, 5-FU; андрогены, такие как калустерон, дромостанолона пропионат, эпитиостанол, мепитиостан, тестолактон; антиадреналы, такие как аминоглютетимид, митотан, трилостан; средства, восполняющие недостаток фолиевой кислоты, такие как фолиновая кислота; ацеглатон; гликозид альдофосфамида; аминолевулиновая кислота; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демеколцин; диазиквон; элфорнитин; ацетат эллиптиния; этоглюцид; нитрат галлия; гидроксимочевина; лентинан; лонидамин; митогуазон; митоксантрон; мопидамол; нитракрин; пентостатин; фенамет; пирарубицин; подофиллиновая кислота; 2-этилгидразид; прокарбазин; PSK&коммат; разоксан; сизафрран; спирогерманий; тенуазоновая кислота; триазиквон; 2,2',2"-трихлортриэтиламин; уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид; ("Ara-C"); циклофосфамид; тиотепа; таксоиды, например, паклитаксел (TAXOLO, Bristol-Myers Squibb Oncology, Princeton, NJ) и доксетаксел (TAXOTEW, Rh6ne-Poulenc Rorer, Antony, France); хлорамбицил; гемцитабин; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин; платина; этопозид (VP-16); ифосфамид; митомицин С; митоксантрон; винкристин; винорелбин; навелбин; новантрон; тенипозид; дауномицин; аминоптерин; кселода; ибандронат; СРТ-11; ингибитор топоизомеразы RFS2000; дифторметилорнитин (DMFO); ретиноевая кислота; эсперамицины; и капецитабин. Также в настоящее определение включают антигормональные агенты, которые действуют, регулируя или ингибируя действие гормонов на опухоли, такие как антиэстрогены, включая, например, тамоксифен, ралоксифен, 4(5)-имидазолы, ингибирующие ароматазу, 4-гидрокситамоксифен, триоксифен, кеоксифен, онапристон и торемифен (Fareston); и антиандрогены, такие как флутамид, нилутамид, бикалутамид, лейпролид и госерелин; и фармацевтически приемлемые соли, кислоты или производные любого из вышеуказанного.
Антигенные пептиды
Как отмечено выше, настоящее изобретение относится к средствам, которые усиливают или улучшают терапевтический эффект химиотерапии, в частности, антигенным пептидам, которые нацелены на VEGFR2, индуцируют цитотоксические Т-клетки против клеток, экспрессирующих VEGFR2, и впоследствии усиливают или улучшают терапевтический эффект химиотерапевтических средств, таких как гемцитабин.
Антигенные пептиды, имеющие субпоследовательности VEGFR2, могут быть использованы для способа, набора или композиции по настоящему изобретению. Антигенные пептиды, подходящие для применения в рамках настоящего изобретения, предпочтительно имеют последовательность аминокислот, выбираемую из показанных ниже.
VYSSEEAEL (SEQ ID NO:2),
GYRIYDVVL (SEQ ID NO:3),
SYMISYAGM (SEQ ID NO:4),
RFVPDGNRI (SEQ ID NO:1),
KKWEFPRDRL (SEQ ID NO:5), или
DFLTLEHLI (SEQ ID NO:6).
Известно, что мутантные или модифицированные пептиды, пептиды, имеющие последовательности аминокислот, модифицированные делецией, добавлением и/или заменой одного или более остатков аминокислот определенной последовательности аминокислот, сохраняют их исходную биологическую активность (Mark D.F. et al., Proc.Natl.Acad.Sci. USA (1984) 81, 5662-5666, Zoller M.J. and Smith M., Nucleic Acids Research (1982) 10, 6487-6500, Wang A. Et al., Science 224,1431-1433, Dalbadie-McFarland G. Et al. Proc.Natl.Acad. Sci. USA (1982) 79, 6409-6413). Соответственно, настоящее изобретение предусматривает варианты и модификации вышеуказанных последовательностей. В частности, антигенные пептиды, в которых одна, две или несколько аминокислот замещены или добавлены к одной из последовательностей аминокислот, упомянутых выше, также обнаруживают применение в условиях настоящего изобретения, с условием, что полученные модифицированные пептиды сохраняют необходимую способность к индуцированию цитотоксических Т-клеток. Такие модифицированные пептиды, обладающие способностью к индуцированию CTL, а также последовательностью аминокислот, как упомянуто выше, в которой одна, две или несколько аминокислот замещены или добавлены, предусматриваются в настоящем описании, с условием, что они не соответствуют последовательности аминокислот другого белка.
Соответственно в одном предпочтительном варианте осуществления изобретения вторая аминокислота с N-конца предпочтительно замещена фенилаланином, тирозином, метионином или триптофаном, или С-концевая аминокислота предпочтительно заменена фениаланином, лейцином, изолейцином, триптофаном или метионином; или одна или более аминокислот добавлены к N-концу и/или С-концу.
Альтернативно, нонапептиды и декапептиды, выбираемые из пептидов, имеющих последовательность аминокислот, показанную ниже, также являются предпочтительными как пептиды, обладающие выраженной способностью к индуцированию CTL.
AMFFWLLLV (SEQ ID NO:7),
VIAMFFWLL (SEQ ID NO:8),
AVIAMFFWL (SEQ ID NO:9),
KLIEIGVQT (SEQ ID NO:10),
YMISYAGMV (SEQ ID NO:11),
IQSDVWSFGV (SEQ ID NO:12) или
VLAMFFWLL (SEQ ID NO:13).
В условиях настоящего изобретения также могут быть использованы пептиды со способностью к индуцированию цитотоксических Т-клеток, где одна, две или несколько аминокислот замещены или добавлены к одной из последовательностей аминокислот, как упомянуто выше. Пептиды, имеющие последовательности аминокислот, состоящие из девяти или десяти аминокислот, как упомянуто выше, в которых одна, две или несколько аминокислот замещены или добавлены, могут обладать способностью к индуцированию CTL, пока они не соответствуют последовательности аминокислот другого белка. В частности, например, вторая аминокислота с N-конца предпочтительно замещена лейцином или метионином, или С-концевая аминокислота предпочтительно замещена валином или лейцином; или одна или две аминокислоты добавлены на N-конце и/или С-конце.
Примером такого модифицированного пептида является пептид VIAMFFWLL (SEQ ID NO:8), в котором вторая аминокислота с N-конца замещена лейцином (VLAMFFWLL (SEQ ID NO:13)); однако, настоящее изобретение не ограничено этим примером. Клоны CTL, полученные при стимуляции такими модифицированными пептидами, могут распознавать исходные пептиды и вызывать повреждение.
Примеры предусмотренных вставок в последовательности аминокислот включают амино- и/или карбоксиконцевые сшивки, варьирующиеся по длине от одного до нескольких остатков, а также вставки внутри последовательности единичного или множественных остатков аминокислот. Примеры концевых вставок включают N-концевой метионил-остаток или антитело, сшитое с цитотоксическим полипептидом. Пептиды, используемые для настоящего изобретения, также могут содержать модификации, такие как гликозилирование, окисление боковой цепи или фосфорилирование, пока модификации не нарушают биологическую активность пептидов, как описано в настоящем описании. Другие модификации включают сшивки с N- или С-концом пептида фермента или полипептида, которые увеличивают период полужизни антитела в сыворотке. Примеры последних включают D-аминокислоты или другие аминокислотные миметики.
В рамках вставок аминокислот, где один или более остатков аминокислот добавляют к пептиду по настоящему изобретению, настоящее изобретение также предусматривает сшитые белки. Сшитые белки обычно состоят из интересующего полипептида или белка с полипептидом или белком с известными свойствами. Сшитые белки могут быть получены методиками, хорошо известными специалисту в области техники, например, связыванием ДНК, кодирующей пептид по настоящему изобретению, с ДНК, кодирующей другие пептиды или белки, так что рамки соответствуют, вставляя сшитую ДНК в вектор экспрессии и экспрессируя ее в организме-хозяине. Не существует ограничений по отношению к пептидам или белкам, которые могут быть сшитыми с белком по настоящему изобретению. Однако примеры известных пептидов, которые могут быть использованы в условиях сшитых белков, включают, но не ограничиваются перечисленным, FLAG (Hopp T.P. et al., Biotechnology (1988) 6, 1204-1210), 6×His, содержащий шесть His (гистидин) остатков, 10×His, агглютинин вируса гриппа (НА), фрагмент человеческого c-myc, VSP-GP фрагмент, фрагмент p18HIV, T7-tag, HSV-tag, E-tag, антигенный фрагмент SV40T, lck tag, фрагмент альфа-тубулина, B-tag, фрагмент протеина С и подобные. Примеры белков, которые могут быть сшиты с белком по изобретению, включают GST (глютатион-S-трансферазу), агглютинин вируса гриппа (НА), постоянный участок иммуноглобулина, бета-галактозидазу, МВР (белок, связывающий мальтозу) и подобные. В условиях замещений аминокислот, замещаемый остаток аминокислоты предпочтительно мутирован в другую аминокислоту, в которой сохраняются свойства боковой цепи аминокислоты (процесс, известный как консервативная замена аминокислоты). Примеры свойств боковых цепей аминокислот представляют собой гидрофобные аминокислоты (A, I, L. M, F, P, W, Y, V), гидрофильные аминокислоты (R, D, N, C, E, Q, G, H, K, S, T) и боковые цепи, имеющие следующие функциональные группы или характеристики в общем: алифатические боковые цепи (G, A, V, L, I, P); боковые цепи, содержащие гидроксильную группу (S, T, Y); боковые цепи, содержащие атом серы (С, М); боковые цепи, содержащие карбоновую кислоту и амид (D, N, E, Q); боковые цепи, содержащие основание (R, K, H); и боковые цепи, содержащие ароматический компонент (H, F, Y, W). Обратите внимание, группы в скобках указывают однобуквенные коды аминокислот.
Антигенные пептиды по настоящему изобретению могут быть получены с использованием хорошо известных методик. Например, пептиды могут быть получены синтетически, с использованием или методики рекомбинантной ДНК или химического синтеза. Пептиды могут быть синтезированы отдельно или в виде более длинных полипептидов, состоящих из двух или более пептидов. Такие пептиды являются предпочтительно изолированными, т.е. по существу свободными от других естественных белков и их фрагментов клеток-хозяев.
Антигенные пептиды по настоящему изобретению могут быть представлены в смеси или могут быть конъюгированы друг с другом с использованием стандартных методик. Например, пептиды могут экспрессироваться в виде единственной полипептидной последовательности. Пептиды в комбинации могут быть одинаковыми или различными. При введении пептидов по настоящему изобретению пептиды представлены с высокой плотностью на HLA антигенах антигенпредставляющих клеток, которые в свою очередь индуцируют CTL, которые специфически реагируют с комплексом, образуемым между указанным пептидом и HLA антигеном. Альтернативно, антигенпредставляющие клетки, имеющие иммобилизованные пептиды по настоящему изобретению на поверхности клеток, полученные выделением дендритных клеток от пациентов, могут быть стимулированы пептидами по настоящему изобретению. Повторное введение таких клеток соответствующему пациенту индуцирует CTL и, в результате, агрессивность в отношении клеток-мишеней может быть повышена.
Фармацевтические композиции и способы их применения
Настоящее изобретение обеспечивает лекарственные средства для лечения и/или профилактики рака поджелудочной железы, используемые в комбинации с химиотерапевтическим средством, таким как гемцитабин. Пептиды, используемые для изобретения, обнаруживают особое применение в лечении рака поджелудочной железы.
Стимуляция дендритных клеток in vivo и in vitro антигенными пептидами по настоящему изобретению может быть легко осуществлена путем воздействия на клетки высокой концентрации пептидов, что способствует тому, что такие пептиды заменяют пептиды, исходно иммобилизованные на клетках. Следовательно, для применения в рамках настоящего изобретения антигенные пептиды должны иметь, по меньшей мере, определенный уровень способности связывания с HLA антигенами.
Фармацевтические препараты, содержащие такие пептиды, могут непосредственно вводиться в виде пептидов как таковых, или могут вводиться в виде фармацевтических композиций, которые рецептированы обычными методами рецептирования. В таких случаях фармацевтические препараты могут соответствующим образом включать в добавление к пептидам носители, вспомогательные вещества и подобные, которые обычно используются для фармацевтических препаратов, без определенных ограничений. Фармацевтические препараты могут быть использованы для лечения и профилактики рака поджелудочной железы в комбинации с гемцитабином.
Фармацевтические препараты для лечения и/или профилактики рака поджелудочной железы, включающие антигенный пептид по настоящему изобретению в качестве активного ингредиента, могут вводиться с адъювантами, которые эффективно индуцируют клеточный иммунитет; могут вводиться с другими активными ингредиентами, такими как противоопухолевые средства; и могут вводиться в гранулярной форме. Подходящие добавки описаны в литературе (Clin. Microbiol. Rev.,7: 277-289, 1994). Более того, фармацевтические препараты по настоящему изобретению могут вводиться в виде препаратов липосом, в виде гранулярной композиции, связанной с шариками нескольких микрометров в диаметре и в виде композиций, с которыми связаны липиды.
Способы введения могут осуществляться, например, перорально, внутрикожно или подкожно, или посредством внутривенной инъекции или подобных. Может быть применимо системное введение или местное введение в окружение целевой опухоли или непосредственно в целевую опухоль. Дозы пептида по настоящему изобретению могут быть скорректированы соответствующим образом, в зависимости от подвергаемого лечению заболевания, возраста и массы тела пациента, способов введения и подобного. Обычно от 0,001 мг до 1000 мг, предпочтительно от 0,001 мг до 1000 мг, более предпочтительно от 0,1 мг до 10 мг пептидов предпочтительно вводят один раз в несколько дней или несколько месяцев. В частности, с целью усиления терапевтического эффекта гемцитабина, в предпочтительном варианте осуществления изобретения от 0,5 мг до 2,0 мг пептидов можно вводить один раз в несколько дней - несколько месяцев, более предпочтительно в неделю (7 дней) в комбинации с гемцитабином. Специалист в области техники может соответствующим образом выбрать подходящие дозы.
Альтернативно, в рамках настоящего изобретения внутриклеточные пузырьки, которые представляют собой комплексы, образованные между пептидами по настоящему изобретению и HLA-антигенами на их поверхности, могут быть использованы для целей настоящего изобретения. Такие внутриклеточные пузырьки называются экзосомами. Экзосомы могут быть получены, например, в соответствии со способами, специфически описанными в Опубликованном Японском Переводе Международных Публикаций №№ Hei 11-510507 и 2000-512161. Экзосомы могут предпочтительно быть получены с использованием антиген-представляющих клеток, полученных от пациентов, которых планируют лечить или проводить профилактику. Экзосомы по настоящему изобретению могут быть введены в виде вакцин от рака, относительно пептидов по настоящему изобретению.
Тип используемых HLA антигенов должен соответствовать таковому пациента, нуждающегося в лечении и/или профилактики. Например, для японцев часто соответствующими являются HLA-A24 или HLA-A02, особенно HLA-A2402 или HLA-A0201.
Подобным образом, в рамках настоящего изобретения выделенные цитотоксические Т-клетки, которые индуцируют пептидами, также могут быть использованы для целей настоящего изобретения. Цитотоксические Т-клетки, которые были индуцированы стимуляцией антиген-представляющими клетками, которые представляют пептиды по настоящему изобретению, предпочтительно получают от пациентов, являющихся мишенью лечения и/или профилактики. Цитотоксические Т-клетки можно вводить отдельно или, с целью противоопухолевого действия, в комбинации с другими лекарственными препаратами, включая пептиды, экзосомы и так далее по настоящему изобретению. Полученные цитотоксические Т-клетки действуют специфически против клеток-мишеней, представляющих пептиды по настоящему изобретению, или предпочтительно, против клеток-мишеней, представляющих такие же пептиды, используемые для индукции. Клетками-мишенями могут быть клетки, которые эндогенно экспрессируют KDR, или клетки, которые вынуждают экспрессировать KDR. Более того, клетки, которые представляют пептиды по настоящему изобретению на поверхности в результате стимуляции такими пептидами, также могут быть нацеленными.
В рамках настоящего изобретения антиген-представляющие клетки, которые представляют собой комплексы между HLA антигенами и пептидами, также могут быть использованы для целей настоящего изобретения. Антиген-представляющие клетки, которые получают при контакте с пептидами или с нуклеотидами, кодирующими пептиды, предпочтительно получают от пациентов, которых планируют для лечения и/или профилактики. Антиген-представляющие клетки могут вводиться в виде вакцин отдельно или в комбинации с другими лекарственными средствами, такими как пептиды по настоящему изобретению, экзосомы и цитотоксические Т-клетки.
В рамках настоящего изобретения пептиды предпочтительно вводят в комбинации с гемцитабином. Гемцитабин представляет собой общее название, данное соединению моногидрохлориду 2'-деокси-2',2'-дифторцитидина (b-изомер). Фармацевтическая композиция, состоящая из соли гидрохлорида гемцитабина (гемцитабин HCl), обычно является коммерчески доступной в виде Gemzar (торговое наименование). В рамках настоящего изобретения, по меньшей мере, одно из гемцитабина, фармацевтически приемлемой соли гемцитабина или его пролекарства может вводиться в комбинации с вышеупомянутыми пептидами. Соответственно, если не указано иначе, в настоящем описании ссылки на гемцитабин включают его соль или пролекарство.
Гемцитабин представляет собой химиотерапевтическое средство, которое уже находится в клиническом применении в виде терапевтического средства для лечения нескольких видов рака, включая рак поджелудочной железы. Стандартный терапевтический протокол для введения гемцитабина взрослому для лечения рака поджелудочной железы включает введение 1000 мг/м2 гемцитабина в неделю в течение до семи недель. Гемцитабин обычно вводят путем внутривенной инфузии. В лечении рака поджелудочной железы обычно схему трех недель введения с последующей одной неделей отсутствия лечения устанавливают как один цикл, и лечение продолжают и повторяют при необходимости. В течение этого периода доза гемцитабина может корректироваться с использованием в качестве индикатора гематологической токсичности или подобного. В настоящем изобретении пептиды вводят в соответствии с такой схемой лечения для гемцитабина. Антигенные пептиды по настоящему изобретению могут вводиться на любой стадии в течение периода введения гемцитабина. Альтернативно, пока CTL, которые индуцируются антигенными пептидами по настоящему изобретению, сохраняют их активность in vivo, такие пептиды могут вводиться перед введением гемцитабина. Обычно целесообразно вводить их по той же схеме как для введения гемцитабина, таким образом минимизируя временные затраты пациента.
Как обнаружено в настоящем описании, введение пептидов, полученных из VEGFR2, имеющих последовательности аминокислот, такие как RFVPDGNRI (SEQ ID NO: 1), может улучшать терапевтические эффекты гемцитабина. Последовательности аминокислот примерных пептидов, полученных из VEGFR2, которые могут быть использованы в рамках настоящего изобретения, дополнительно описаны ниже. В рамках настоящего изобретения, модифицированные или мутированные варианты таких последовательностей аминокислот также могут быть использованы в настоящем изобретении, пока они сохраняют желаемую способность индукции CTL.
VYSSEEAEL (SEQ ID NO:2),
GYRIYDVVL (SEQ ID NO:3),
SYMISYAGM (SEQ ID NO:4),
RFVPDGNRI (SEQ ID NO:1),
KKWEFPRDRL (SEQ ID NO:5),
DFLTLEHLI (SEQ ID NO:6)
AMFFWLLLV (SEQ ID NO:7),
VIAMFFWLL (SEQ ID NO:8),
AVIAMFFWL (SEQ ID NO:9),
KLIEIGVQT (SEQ ID NO:10),
YMISYAGMV (SEQ ID NO:11),
IQSDVWSFGV (SEQ ID NO:12), или
VLAMFFWLL (SEQ ID NO:13).
Следовательно, настоящее изобретение обеспечивает средства, которые усиливают терапевтический эффект гемцитабина в отношении рака поджелудочной железы, такие средства включают в качестве активного ингредиента вышеописанные пептиды, полученные из VEGFR2. Альтернативно, настоящее изобретение обеспечивает применение пептидов, полученных из VEGFR2, в получении фармацевтических композиций, которые усиливают терапевтический эффект гемцитабина в отношении рака поджелудочной железы. Более того, настоящее изобретение обеспечивает комбинированное применение (комбинацию) пептидов, полученных из VEGFR2, в течение терапии рака поджелудочной железы с использованием гемцитабина.
В соответствии с настоящим изобретением пептиды, полученные из VEGFR2, могут быть использованы в комбинации с гемцитабином для лечения рака поджелудочной железы. В частности, настоящее изобретение обеспечивает набор для лечения рака поджелудочной железы, который состоит из фармацевтической композиции, которая содержит в качестве активных ингредиентов, каждый из фармацевтически приемлемого носителя, вышеупомянутых пептидов, полученных из VEGFR2, и гемцитабина. Более того, настоящее изобретение обеспечивает противораковые средства для лечения рака поджелудочной железы, которые включают комбинацию вышеупомянутых пептидов, полученных из VEGFR2, и гемцитабина. Альтернативно, настоящее изобретение обеспечивает набор для лечения рака поджелудочной железы, который включает вышеупомянутые пептиды, полученные из VEGFR2, и инструкцию, в которой указано, что терапевтический эффект гемцитабина усиливается при введении пептидов в комбинации с гемцитабином пациентам с раком поджелудочной железы.
В другом варианте осуществления настоящее изобретение также обеспечивает применение комбинации пептидов, полученных из VEGFR2, и одного или более химиотерапевтических средств, выбираемых из группы, состоящей из гемцитабина, его фармацевтически приемлемой соли и его пролекарства в получении фармацевтической композиции для лечения рака, включая рак поджелудочной железы. Альтернативно, в другом варианте осуществления изобретения, настоящее изобретение обеспечивает применение пептидов, полученных из VEGFR2, в получении фармацевтической композиции для лечения рака, включая рак поджелудочной железы, где фармацевтическую композицию используют в комбинации с одним или более химиотерапевтическими средствами, выбираемыми из группы, состоящей из гемцитабина, его фармацевтически приемлемой соли и его пролекарства. В другом варианте осуществления настоящее изобретение дополнительно обеспечивает применение пептидов, полученных из VEGFR2, в получении фармацевтической композиции для усиления терапевтического эффекта одного или более химиотерапевтических средств, выбираемых из группы, состоящей из гемцитабина, его фармацевтически приемлемой соли и его пролекарства, для лечения рака, включая рак поджелудочной железы.
Альтернативно, настоящее изобретение дополнительно обеспечивает способ или процесс для получения фармацевтической композиции для усиления терапевтического эффекта одного или более химиотерапевтических средств, выбираемых из группы, состоящей из гемцитабина, его фармацевтически приемлемой соли и его пролекарства, для лечения рака, включая рак поджелудочной железы, где способ или процесс включают стадию рецептирования фармацевтически или физиологически приемлемого носителя с пептидами, полученными из VEGFR2, в качестве активных ингредиентов. В другом варианте осуществления настоящее изобретение дополнительно обеспечивает способ или процесс для получения фармацевтической композиции для усиления терапевтического эффекта одного или более химиотерапевтических средств, выбираемых из группы, состоящей из гемцитабина, его фармацевтически приемлемой соли и его пролекарства, для лечения рака, включая рак поджелудочной железы, где способ или процесс включает стадию смешивания пептидов, полученных из VEGFR2, с фармацевтически или физиологически приемлемым носителем.
В другом варианте осуществления настоящее изобретение также обеспечивает способ или процесс для получения набора для лечения рака, включая рак поджелудочной железы, где способ или процесс включает стадию комбинирования или упаковки фармацевтической композиции, включающей пептиды, полученные из VEGFR2, и фармацевтически или физиологически приемлемый носитель, вместе с одним или более химиотерапевтическими средствами, выбираемыми из группы, состоящей из гемцитабина, его фармацевтически приемлемой соли и его пролекарства. Альтернативно, в другом варианте осуществления настоящее изобретение также обеспечивает применение комбинации пептидов, полученных из VEGFR2, и одного или более химиотерапевтических средств, выбираемых из группы, состоящей из гемцитабина, его фармацевтически приемлемой соли и его пролекарства, в получении набора для лечения рака, включая рак поджелудочной железы.
В вышеупомянутых вариантах осуществления настоящего изобретения пациент, у которого будут лечить рак, может быть HLA-A24-положительным или HLA-A02 положительным. Рак, который лечат, включает рак поджелудочной железы.
ПРИМЕРЫ
Далее настоящее изобретение описано подробно со ссылками на примеры, в частности на клиническое исследование, оценивающее применение пептидного эпитопа, который нацелен на новые кровеносные сосуды опухоли, в комбинации с гемцитабином для лечения неоперабельного выраженного рецидива рака поджелудочной железы. Однако, материалы, методы и подобные, описанные в настоящем описании, только иллюстрируют аспекты изобретения и никаким образом не предназначены для ограничения рамок настоящего изобретения. Как таковые, материалы, методы и любые подобные или эквиваленты описанных в настоящем описании могут быть использованы в осуществлении или исследовании настоящего изобретения.
Введение
Далее описано клиническое исследование нового метода вакцинальной химиотерапии для пациентов с неоперабельным рецидивирующим раком поджелудочной железы на поздней стадии, в котором пептидные эпитопы, полученные из рецептора сосудистого эндотелиального фактора роста 2 (VEGFR2/KDR), смешивали с неполным адъювантом Фрейнда (IFA), затем вводили пациентам подкожно. Ожидают, что пептидные вакцины проявляют противоопухолевые эффекты посредством ингибирования неоваскуляризации опухолей. Их использовали в настоящем описании в комбинации с гемцитабином, существующим стандартом для химиотерапии рака поджелудочной железы. Настоящее клиническое исследование предназначено для подтверждения безопасности новой вакцинальной химиотерапии, направленной на ингибирование новых кровеносных сосудов опухоли, и получение противоопухолевых эффектов посредством химиотерапии при увеличении дозы вводимых пептидных эпитопов в группе из трех пациентов. Дополнительной целью было оценить скорость ответа, время выживаемости и иммунные ответы.
Хирургическая резекция представляет собой необходимое лечение рака поджелудочной железы; однако, раннее выявление затруднено и к моменту постановки диагноза, приблизительно 60% пациентов находятся в ситуации, когда резекция невозможна [Matsuno S. Et al. Int J Clin Oncol. 5:153-157, 2000., Pantalone D et al., 18:41-46, 2001]. В настоящее время гемцитабин используют в качестве стандартного лечения неоперабельного рака поджелудочной железы; однако, хотя средний период выживаемости и однолетняя выживаемость улучшились по сравнению с группами, которым вводили отдельно 5FU, они составили 5,7 месяцев и 18% соответственно, и являются совсем не удовлетворительными. Более того, частота ответа составила 5,4%-14,3%, что невелико, [Burris HA et al. J Clin Oncol 15:2403-2413, 1997., Casper ES et al., 12:29-34, 1994, Carmichael J et al. Br J Cancer,; 73:101-105, 1996, Rothenberg ML et al. Ann Oncol. 7:347-53,1996] и существует необходимость в исследовании новых терапевтических методов, которые могут улучшить частоту ответа и время выживаемости при комбинированном применении с гемцитабином.
С другой стороны, в последние годы изучали механизм, посредством которых Т-клетки распознают антигены и, кроме того, были обнаружены белки, распознаваемые CTL в качестве антигенов опухоли и были начаты исследования терапевтических методов с использованием опухолевых антигенов или генов антигенов. Иммунотерапия с использованием такого определенного антигенного пептида отторжения опухоли была быстро приспособлена для злокачественной меланомы и с 1998 года сообщали о достижениях преимущественно Rosenberg et al. [Celis E. et al. Cancer Biology 6:329-336, 1995., Marchard M. et al. Int J Cancer 63:883-885, 1995]. После этого было осуществлено комбинированное применение с IL-2 или GM-CSF, разработка протоколов для введения множества антигенных пептидов отторжения опухоли, разработка модифицированных пептидов и клинические исследования пептидов, стимулирующих дендритные клетки, и к настоящему времени на противоопухолевую иммунотерапию с использованием антигенных пептидов отторжения опухоли обращают внимание как на терапевтический метод, который дополняет обычные терапевтические методы, такие как хирургическая операция и химиотерапия.
Были обнаружены опухолевые антигены, распознаваемые и атакуемые цитотоксическими Т-клетками (CTL), и после этого идентифицировали антигены, специфичные для опухоли, один после другого, и в настоящее время осуществляют клинические исследования вакцинальной терапии рака с использованием пептидных эпитопов, которые являются специфической иммунотерапией, нацеленной на такие антигены. Однако также были выявлены новые проблемы. Даже если сильные CTL могут быть индуцированы, сниженная экспрессия молекул MHC или ее отсутствие в опухолевых клетках, отсутствие целевых молекул в опухолевых клетках и подобные могут вызывать потерю противоопухолевых эффектов CTL. Более того, опухолевые антигенные пептиды, которые идентифицированы к настоящему времени, присутствуют в определенных типах опухолей, но они не охватывают все опухоли. Следовательно, для решения таких проблем клетками-мишенями CTL в вакцинальной терапии были установлены эндотелиальные клетки новых сосудов опухоли вместо опухолевых клеток, как таковых, и была рецептирована вакцинальная терапия, нацеленная на молекулы новых кровеносных сосудов опухоли. В качестве целевых молекул внимание было сфокусировано на рецепторе сосудистого эндотелиального фактора роста 2 (VEGFR2/KDR), который почти не экспрессируется в нормальных эндотелиальных клетках, но высоко экспрессируется в эндотелиальных клетках новых сосудов опухоли и представляет собой рецептор фактора роста сосудистых эндотелиальных клеток, необходимый для роста таких клеток.
Известно, что VEGFR2 экспрессируется в опухолевых тканях множества солидных опухолей, таких как рак молочной железы, рак толстой кишки, рак почки, злокачественная меланома и рак легких [Folkman J. Nature Biotechnol. 15, 510,1997, Folkman J. EXS 79, 1-8, 1997]. Также была выявлено, что экспрессия VEGFR2 тесно связана с пролиферацией раковых клеток [Kranz A. Et al., Int J Cancer 84:293-298, 1999, Nakopoulou L., et al. Hum Pathol 33:863-870, 2002., Reden L. Et al., Breast Cancer Res. And Treat. 82:147-154, 2003].
С другой стороны, относительно того, может ли VEGFR2 или нет стать мишенью для иммунотерапии, результаты основных исследований вакцинации с помощью белка и ДНК VEGFR2 показали, что противоопухолевый эффект осуществлялся посредством супрессии новых кровеносных сосудов опухоли, независимо от типа опухоли; следовательно, было подтверждено, что VEGFR2-специфичные цитотоксические Т-клетки ответственны за этот противоопухолевый эффект. Вышеуказанное показало, что VEGFR2 может стать мишенью для иммунотерапии опухоли [Yiwen, Li et al J.Exp.Med 195, 1575-1584,2002. Niethammer, A.G. et al. Nature Med. 8, 1369-1375, 2002]. Более того, в результате основного анализа авторами было доказано присутствие у людей клонов CTL, которые распознают и повреждают VEGFR2, и было идентифицировано несколько типов HLA-A24 или А02-ограниченных пептидных эпитопов, способных индуцировать активные CTL. CTL, индуцированные такими пептидными эпитопами, повреждают культивируемые человеческие эндотелиальные клетки пупочной вены (HUVEC), которые эндогенно экспресируют VEGFR2 HLA-ограниченным образом. Более того, в исследовании in vivo противоопухолевых эффектов с использованием А2/Kb трансгенных мышей, экспрессирующих HLA, выраженные противоопухолевые эффекты независимо от типа рака были подтверждены с использованием вакцинальной терапии рака с использованием пептидных эпитопов, полученных из VEGFR2. Так как CTL также могут быть получены из периферической крови пациентов с раком с использованием пептидов, используемых в настоящем клиническом исследовании, было обнаружено, что клетки - предшественники CTL, также существуют у пациентов с раком [Wada S, Cancer Res. 65, 4939-4946, 2005]. В соответствии с вышесказанным, при введении настоящих пептидов и путем индукции VEGFR2-специфичных CTL у пациентов, неоваскуляризация опухоли может быть подавлена, и может быть получен выраженный противоопухолевый эффект.
Следовательно, была изобретена новая вакцинальная химиотерапия, от которой ожидалось, что пептидная вакцина проявляет противоопухолевые эффекты посредством ингибирования неоваскуляризации опухоли в комбинации с гемцитабином, который является существующей стандартной химиотерапией против рака поджелудочной железы. RFVPDGNRI (SEQ ID NO:1), (VYSSEEAEL (SEQ ID NO:2), GYRIYDVVL (SEQ ID NO:3), SYMISYAGM (SEQ ID NO:4), RFVPDGNRI (SEQ ID NO:1), KKWEFPRDRL (SEQ ID NO:5), DFLTLEHLI (SEQ ID NO:6), AMFFWLLLV (SEQ ID NO:7), VIAMFFWLL (SEQ ID NO:8), AVIAMFFWL (SEQ ID NO:9), KLIEIGVQT (SEQ ID NO:10), YMISYAGMV (SEQ ID NO:11), IQSDVWSFGV (SEQ ID NO:12), или VLAMFFWLL (SEQ ID NO:13). [Wada S. Cancer Res. 65, 4939-4946, 2005., WO2004/024766], которые получали из VEGFR2 и они представляют собой HLA-A24 или HLA-A02 ограниченные пептидные эпитопы, использовали в композициях вакцин для комбинированного применения.
Сущность обоснования является следующей:
1. VEGFR2 является важной молекулой, вовлеченной в рост эндотелиальных клеток новообразованных опухолевых сосудов, и такой пептид может быть использован для индукции специфических CTL in vitro [Wada S. Cancer Res. 65, 4939-4946, 2005, WO2004/024766].
2. Специфические CTL могут быть индуцированы in vitro также из мононуклеарных клеток периферической крови пациентов с раком с использованием полученных из VEGFR2 HLA-A24 или HLA-A02 ограниченных пептидных эпитопов [Wada S., Cancer Res. 65, 4939-4946,2005].
3. Большинство японцев несут HLA-A24 или HLA-A02 [Date Y., et al. Tissue antigen, 47, 93-101, 1996].
4. Они являются биохимически стабильными и подходят для клинических исследований [Wada S, Cancer Res. 65, 4939-4946, 2005].
5. Гемцитабин уже одобрен в качестве химиотерапевтического средства от рака поджелудочной железы.
6. Известно, что гемцитабин усиливает иммунокомпетентность, такую как способность к индуцированию CTL [Correale P, et al. J Immunol. 175, 820-828, 2005., Dauer M., et al. J Immunother. 28, 332-342, 2005] и можно ожидать эффекты от комбинированного применения с композициями вакцин.
Настоящее клиническое исследование было проведено на основании вышеупомянутого обоснования.
Материалы и методы
Пациенты:
Исследуемых пациентов выбирали в соответствии со следующими критериями включения и критериями исключения.
Критерии включения:
1. Первичный рак поджелудочной железы, для которого резекция была расценена как невозможная из-за: отдаленных метастазов, таких как метастазы в печени, метастазы в брюшине, и костные метастазы при различной диагностике, такой как визуализационная диагностика посредством КТ или ультразвукового обследования; отдаленные метастазы в лимфатические узлы, как определено в Классификации Японского общества поджелудочной железы карциномы поджелудочной железы, 5-е издание; или инфильтрации в крупные сосуды (брюшная аорта, основная печеночная артерия, левая и правая печеночные артерии, верхняя брыжеечная артерия и верхние брыжеечные вены, которые не могут быть реконструированы); или рецидив рака поджелудочной железы.
2. Тогда как наличие или отсутствие повреждений, оцениваемых посредством RECIST, является необъективным, оценка клинических эффектов в отношении опухоли должна быть возможной.
3. Статус характеристик ECOG 0-2.
4. Возраст 20 или старше и 80 или меньше на момент получения согласия.
5. Ожидаемый прогноз в отношении жизни должен составлять три месяца или больше при начале лечения гемцитабином и вакциной.
6. Если пациент получал какое-то хирургическое лечение, пациент должен восстановиться от воздействия операции. Альтернативно, должно пройти четыре недели или более с предшествующего лечения.
7. Функции основных органов должны быть сохранены: функция костного мозга (количество лейкоцитов 2000/мм3 или более и 15000/мм3 или менее и количество тромбоцитов 7,5/мм3 или более); функция печени (GOT 150 МЕ/л или менее, GPT 150 МЕ/л или менее и общ. бил. 3,0 г/дл или менее); и функция почек (Кр 3,0 или менее).
8. Наличие подходящих HLA.
9. Отсутствие в анамнезе лечения основного заболевания с использованием гемцитабина.
Критерии исключения:
1. Беременные женщины (женщины, способные забеременеть, должны предпринимать контрацептивные меры после начала настоящего клинического исследования).
2. Кормящие женщины (кормление должно быть приостановлено после начала настоящего клинического исследования).
3. Пациенты, желающие забеременеть (соответствующие контрацептивные меры должны предприниматься и мужчинами и женщинами в течение периода исследования).
4. Пациенты, имеющие активную инфекцию, которую трудно контролировать.
5. Пациенты, для которых следующие фармацевтические средства должны вводиться в течение исследования:
системное введение надпочечниковых стероидов; или системное введение иммунодепрессантов,
6. Пациенты, имеющие неконтролируемый двойной рак.
7. Пациенты, имеющие травматические повреждения, которые еще не зажили.
8. Пациенты, у которых предположительно имеется паралич кишечника или интерстициальная пневмония.
9. Пациенты, определенные врачом или лечащим врачом как несоответствующие.
План лечения:
Выбор исследуемых пациентов с раком:
Испытуемые пациенты представляли собой несущих подходящие HLA и имеющих первичный рак поджелудочной железы, для которого радикальная резекции была расценена как невозможная, или имеющих рецидив рака поджелудочной железы. Случаи, когда рак поджелудочной железы был наиболее ожидаемо вероятен при визуализационной диагностике, также включали в испытуемых пациентов.
Способ исследования экспрессии HLA:
Внешнее обследование было запрошено в SRL, Inc (Tokyo).
Доза гемцитабина:
1000 мг/м2 гемцитабина (гемцитабин HCl), которая является стандартной лечебной дозировкой и введение, одобренное для покрытия страховкой, осуществляли в течение трех недель с последующей одной неделей отсутствия введения.
Доза и способ для введения пептидов и адъюванта:
0,5 мг, 1 мг и 2 мг синтезированного пептида смешивали с 0,5 мл, 1 мл и 2 мл неполного адъюванта Фрейнда (MONTANIDE*ISA51VG, SEPPIC, France), соответственно, и вводили подкожно в предплечье или около паховой области пациентов.
Схема введения:
Схема введения показана на фиг. 1. Один курс устанавливали как 28 дней с начала первого введения.
Метод увеличения дозы и группа из трех пациентов:
Дозировку и введение гемцитабина (1000 мг/мм2, три недели введения и одна неделя отсутствия введения) фиксировали, и вводимую дозу вакцины повышали относительно дозы пептида 0,5 мг, 1 мг и 2 мг. В частности, 0,5 мг пептида вводили трем пациентам. Если ни у одного пациента не проявлялась явная коррелирующая гематологическая токсичность 4 степени (NCI-CTC версия 3,0) или выше (исключая тошноту/рвоту) или гематологическая токсичность 3 степени (NCI-CTC версия 3,0) или выше, пептид в следующей дозе 1 мг вводили трем пациентам. Если побочные эффекты проявлялись у двух или более пациентов, настоящее клиническое исследование прекращали. Если побочные эффекты проявлялись у одного пациента, еще трех пациентов дополнительно регистрировали на той же дозе и если побочные эффекты проявлялись в одном случае из этих шести пациентов, исследование продвигалось к следующей дозе. Если побочные эффекты наблюдали у еще одного пациента на этой стадии, настоящее клиническое исследование прекращали. Повышение дозы с 1 мг до 2 мг проводили таким же образом.
Контроль качества:
Относительно вводимого пептида, cGMP классифицированные пептиды (Neo-MPS, San Diego) были даром от Human Genome Center, Institute of Medical Science, University of Tokyo. Относительно адъюванта, GMP классифицированный по жалобам неполный адъювант Фрейнда (MONTANIDE*ISA51VG) покупали от SEPPIC Co., France. Хранение пептидов и получение пептидных вакцин осуществляли в Фармацевтическом отделении больницы медицинского университета Вакаяма.
Относительно "Предварительного тестового введения":
Во избежание неожиданных побочных эффектов, таких как анафилактический шок, 10 мг пептида вводили подкожно в качестве предварительного тестового введения перед первым введением вакцины в место, отличное от места конкретного введения, и проводили мониторинг в течение 30 минут. Если не наблюдали местной реакции 3 или более высокой степени или системного нежелательного явления, осуществляли конкретное введение. В отношении "предварительного тестового введения" местных нежелательных явлений и системных нежелательных явлений не наблюдалось ни у кого из пациентов.
Результаты
Оценка данных исследования:
Оценка безопасности:
Оценка безопасности была нацелена на пациентов, которые получили, по меньшей мере, одно введение гемцитабина и пептидов. Наличие и степень нежелательных явлений определяли относительно обычных критериев токсичности Национального Института Рака (NCI-CTC) (японский перевод, издание JCOG) 3 версия.
Иммунологические оценки:
Перед введением вакцины получали 50 мл периферической крови после завершения каждого курса (день 28 после первого введения) и мононуклеарные клетки периферической крови (PBMC) выделяли и измеряли центрифугированием по плотности Ficoll-paque.
Анализ реакции CTL:
Реакцию CTL, возникающую в ответ на введение пептидов, измеряли с использованием ELISPOT анализа IFN-гамма (ELISPOT Human IFN-gamma set, BD). В частности, Стимулятор получали введением VEGFR2-169 (SEQ ID NO:1) и HIV-A24 пептидов в A24-LCL (HLA-A*2402-положительные), и HIV пептиды использовали в качестве отрицательного контроля. Исследование проводили в трех ячейках одновременно для каждого соотношения R/S и Стимулятора, и среднее значение рассчитывали в отношении количества пятен на одну ячейку. Количество пятен считывали на счетчике ELISPOT (IMMUNOSPOT, Cellular Technology Ltd.). Значение, полученное вычитанием количества пятен при введении HIV из количества пятен при введении VEGFR2-169, принимали как специфичные пятна продукции IFN-гамма в отношении VEGFR2-169 (Специфические пятна). Если увеличение специфических пятен продукции IFN-гамма наблюдали после одного курса и после двух курсов, расценивали, что из-за введения вакцины возникал иммунный ответ.
Популяционный анализ CD8-положительных Т-клеток (фиг. 2):
Существует ли изменение в пропорции каждой из фракций Т-клеток - необученных, клеток памяти, эффекторных клеток памяти и эффекторных Т-клеток среди CD8-положительных клеток анализировали проточной цитометрией (FACS Calibur, BD) с четырехцветным окрашиванием. Как показано на фиг. 2, получали лимфоцитарную фракцию PBMC и отбирали CD8-положительную фракцию. CD8-положительную фракцию дополнительно обрабатывали с использованием CD27(BD) и CD45RA(SD) для получения эффекторной фракции (CD27-отрицательные/CD45RA-положительные), эффекторной фракции памяти (CD27-отрицательные/CD45RA-положительные), фракции памяти (CD27-положительные/CD45RA-отрицательные), и необученной фракции (CD27-положительные/CD45RA-положительные). Одновременно функциональные фракции лимфоцитов определяли посредством проведения окрашивания (Cytofix/Cytoperm kit, BD).
Анализ регуляторных Т-клеток (фиг. 3):
Клетки с высоким содержанием CD25 и Foxp3-положительные среди CD4-положительных Т-клеток указывали как регуляторные Т-клетки и их количественное изменение до и после введения вакцины измеряли проточной цитометрией (Facs Calibur, BD) после четырехцветного окрашивания. В частности, как на фиг. 3, собирали лимфоцитарную фракцию PBMC и после обработки с использованием CD4 и CD25 и рассчитывали долю клеток с высоким содержанием CD25 и Foxp3-положительных (Human Regulatory Staining kit, eBioscience) среди CD4-положительных Т-клеток.
Оценка клинической эффективности:
Циторедуктивные эффекты
Пациентов, которые завершили, по меньшей мере, один курс, определенный настоящим протоколом, выбирали в качестве субъектов. Для опухолей, которые могут быть определены посредством визуализации, клинические эффекты оценивали после конечной вакцинации в каждом курсе, преимущественно в соответствии с "New guidelines to evaluate the effect of treatment in solid tumors (RECIST quideline Version 2) Japanese translation, JCOG edition". Даже в случаях, когда на момент клинической оценки четырехнедельный период не был завершен, их отмечали как объективные ответы и их клиническую значимость оценивали как контрольные данные. КТ и ПЭТ использовали для оценки противоопухолевого эффекта.
Время выживаемости:
Проводили длительное наблюдение и оценивали время выживаемости и коэффициент выживаемости.
Результаты пациентов:
На каждом уровне принимали участие три человека, и оценка безопасности стала возможной. Случаи на 31 июля суммированы в таблице 1 (см. ниже).
Пациент 1 (уровень I/0,5 мг)
Пациент 1 - шестидесятивосьмилетняя женщина, которая ранее получала лечение химиотерапией с использованием TS-1, стала нечувствительной и после этого была зарегистрирована в настоящем исследовании. Провели два курса, однако, системные нежелательные явления отсутствовали и местные нежелательные явления в месте вакцинации также отсутствовали (таблица 1, см. ниже). Оценка изображений была PD. Маркеры опухоли также повысились. В соответствии с иммунологическим мониторингом, специфических CTL-реакций против вводимого пептида не наблюдали (таблица 2, см. ниже). Перед вакцинацией они находились в нормальном диапазоне регуляторных Т-клеток (нормальное среднее было 3,9+/-1,2%), однако, повышение сверх нормального диапазона наблюдали после одного курса и также после двух курсов (таблица 6, см. ниже). Пациентка умерла от ухудшения основного заболевания через 3,3 месяца после первой вакцинации.
Пациент 2 (уровень I/0,5 мг)
Пациент 2 - шестидесятишестилетний мужчина, который получил две вакцинации, но был переведен в другую больницу по его просьбе и впоследствии выпал из исследования (таблица 1, см. ниже). Системные нежелательные явления отсутствовали и местные нежелательные явления в месте вакцинации также отсутствовали.
Пациент 3 (уровень I/0,5 мг)
Пациент 3 - шестидесятилетний мужчина. Был проведен один курс. Наблюдали нейтропению 3 степени и дисфункцию печени в качестве системных нежелательных явлений (таблица 1, см. ниже). Отмена гемцитабина на одну неделю позволила восстановиться от обоих состояний, и затем введение продолжили. Наблюдали уплотнение и покраснение 2 степени в месте введения и лимфаденопатию (отек паховой области) около места инъекции в качестве местных нежелательных явлений. При использовании ПЭТ в отечном месте наблюдали изображения, показывающие выраженное накопление (фиг. 4) и в результате биопсии наблюдали гистопатологически выраженное воспаление, что предполагает иммунный ответ в ответ на введение пептида. Оценка изображений была SD и опухолевые маркеры снизились (CF19-9) (фиг. 5). В соответствии с иммунологическим мониторингом наблюдали специфическую реакцию CTL против вводимых пептидов (фиг. 6) и в анализе CD8-положительной фракции Т-клеток, наблюдали увеличение фракции необученных Т-клеток и фракции эффекторных Т-клеток (таблица 3, см. ниже). Регуляторные Т-клетки были выше нормального диапазона (нормальное среднее составляло 3,9+/-1,2%) перед началом вакцинации, но снижались до нормального диапазона после одного курса (таблица 6, см. ниже). После этого пациент умер от ухудшения основного заболевания через 7,3 месяцев после первичной вакцинации.
Пациент 4 (Уровень I/0,5 мг)
Пациент 4 - шестидесятиоднолетний мужчина. Было проведено два курса. Системные нежелательные явления отсутствовали, относительно местных нежелательных явлений наблюдали уплотнение и покраснение 2 степени в месте введения (таблица 1, см. ниже). Оценка изображений была - Объективный Ответ. В частности первичный фокус в области хвоста поджелудочной железы был обнаружен как SD после одного курса и после двух курсов он явно уменьшился и полученный эффект сохранялся в течение приблизительно двух месяцев (фиг. 7). Фокус метастазов в печени в области воротной вены стал полностью невиден после двух курсов (фиг. 8). Фокус метастазов в печени около желчного пузыря стал невиден после одного курса и практически исчез после двух курсов (фиг. 9). С другой стороны, опухолевые маркеры (СА19-9 и СЕА), которые были на высоком уровне перед вакцинацией, снизились после одного курса и после двух курсов, и тенденция к снижению опухолевых маркеров продолжалась еще один месяц после (фиг. 10). В соответствии с иммунологическим мониторингом наблюдали специфическую реакцию CTL против вводимых пептидов (фиг. 11). Регуляторные Т-клетки находились в нормальном диапазоне перед началом вакцинации, после одного курса и после двух курсов (таблица 6, см. ниже). Через 6,3 месяцев после первой вакцинации пациент был жив.
Пациент 5 (уровень II/1 мг)
Пациент 5 - шестидесятипятилетний мужчина. Было проведено два курса. Системные нежелательные явления и местные нежелательные явления отсутствовали (таблица 1, см. ниже). Оценка изображений была PD. Опухолевые маркеры также повысились. В соответствии с иммунологическим мониторингом наблюдали специфическую реакцию CTL против вводимых пептидов (таблица 2, см. ниже) и в анализе CD8-положительной фракции Т-клеток наблюдали увеличение фракции необученных Т-клеток и фракции эффекторных Т-клеток (таблица 4, см. ниже). Регуляторные Т-клетки находились в нормальном диапазоне до начала вакцинации, после одного курса и после двух курсов (таблица 6, см. ниже). После этого пациент умер от ухудшения основного заболевания через 4,5 месяца после первичной вакцинации.
Пациент 6 (уровень II/1 мг)
Пациент 6 - пятидесятисемилетняя женщина. Было проведено два курса. Наблюдали нейтропению 3 степени в качестве системного нежелательного явления (таблица 1, см. ниже). Отмена GEM на одну неделю позволила восстановиться, и затем введение было продолжено. Наблюдали уплотнение и покраснение в месте введения и лимфаденопатию (паховое набухание) около места введения в качестве местных нежелательных явлений. Оценка изображений была Объективный Ответ. В частности, первичный фокус в области головки поджелудочной железы уменьшился после двух курсов и полученный эффект сохранялся в течение около 2,5 месяцев (фиг. 12). Результаты ПЭТ сканирования, полученные перед вакцинацией и после завершения двух курсов сравнивали. Накопление в опухоли явно уменьшилось после двух курсов (фиг. 13). При сравнении значений SUV, которые объективно показывают количество накопления в опухоли, снижение с 6 до 4,5 четко предполагает, что имеет место противоопухолевый эффект. Более того, опухолевый маркер (опухолевые маркеры, иные чем DOPAN2, были нормальными с момента регистрации) снизился после двух курсов и эффекты снижения продолжались еще два месяца спустя (таблица 7, см. ниже). В соответствии с иммунологическим мониторингом наблюдали специфическую реакцию CTL против вводимых пептидов (фиг. 14), и во фракции CD8 положительных Т-клеток наблюдали увеличение фракции необученных Т-клеток и снижение фракции эффекторных Т-клеток (таблица 4, см. ниже). Регуляторные Т-клетки находились в нормальном диапазоне до начала вакцинации, после одного курса и после двух курсов (таблица 6, см. ниже). Через шесть месяцев после первой вакцинации QOL оставалось хорошим и пациент был жив.
Пациент 7 (Уровень II/1 мг)
Пациент 7 - шестидесятидевятилетний мужчина. Было проведено два курса. Наблюдали нейтропению 3 степени в качестве системного нежелательного явления (таблица 1, см. ниже). Отмена GEM на одну неделю позволила восстановиться, и затем введение было продолжено. Наблюдали уплотнение 2 степени и покраснение в месте введения и лимфаденопатию (набухание паховой области) около места введения в качестве местных нежелательных явлений. Оценка изображений была SD (фиг. 15). В частности, первичный фокус в области головки поджелудочной железы не показал каких-либо изменений в размерах после двух курсов и этот эффект сохранялся в течение около двух месяцев (фиг. 15). Более того, опухолевый маркер (опухолевые маркеры, иные чем СА125, были нормальными с момента регистрации) снизился после одного курса и эффект снижения продолжался даже через два месяца после (фиг. 16). В соответствии с иммунологическим мониторингом наблюдали специфическую реакцию CTL против вводимых пептидов (фиг. 17), и в анализе фракции CD8 положительных Т-клеток наблюдали увеличение фракции необученных Т-клеток и увеличение фракции эффекторных Т-клеток (таблица 4, см. ниже). Регуляторные Т-клетки находились в нормальном диапазоне до начала вакцинации, после одного курса и после двух курсов (таблица 6, см. ниже). Через 4,3 после первой вакцинации, QOL оставалось хорошим, и пациент был жив.
Пациент 8 (уровень III/2 мг)
Пациент 8 - пятидесятивосьмилетний мужчина. Один курс был завершен, и когда начали проводить второй курс, возникло желудочно-кишечное кровотечение из увеличившейся опухоли. Случай был расценен как увеличение опухоли, и исследование было прекращено (таблица 1, см. ниже). Дисфункцию печени наблюдали в качестве системного нежелательного явления. Местные нежелательные явления отсутствовали. Оценка изображений по завершению одного курса была PD. Опухолевые маркеры также увеличились.
Пациент 9 (Уровень III/2 мг)
Пациент 9 - семидесятитрехлетний мужчина. После одного введения исследование было приостановлено из-за сужения желудочно-кишечного тракта, вызванного увеличением опухоли (таблица 1, см. ниже).
Пациент 10 (Уровень III/2 мг)
Пациент 9 - шестидесятидвухлетний мужчина. Был проведен один курс. Системные нежелательные явления отсутствовали, и в качестве местных нежелательных явлений, наблюдали уплотнение и покраснение 2 степени и меньше (таблица 1, см. ниже). Оценка изображений была SD (фиг. 18). Кроме того, опухолевый маркер (опухолевые маркеры, иные чем СА125, были нормальными с момента регистрации) снизился и снижение опухолевого маркера продолжалось в течение приблизительно одного месяца (фиг. 19). В соответствии с иммунологическим мониторингом наблюдали специфическую реакцию CTL против вводимых пептидов (таблица 2, см. ниже), и в анализе фракции CD8 положительных Т-клеток наблюдали увеличение фракции необученных Т-клеток и снижение фракции эффекторных Т-клеток (таблица 5, см. ниже). Регуляторные Т-клетки имели высокое значение 6,4 перед началом вакцинации, но снизились до нормальных значений 2,1 после одного курса (таблица 6, см. ниже).
Сравнение отдельно с гемцитабином
В таблице 8 (см. ниже) с точки зрения противоопухолевых эффектов у пациентов и с точки зрения реакции ЗГЧ (DTH), которая является одним из иммунных ответов, проводили сравнение с данными, полученными до настоящего времени отдельно с гемцитабином. Противоопухолевые эффекты сравнивали в отношении степени контроля заболевания (количество CR + количество PR+ количество SD/все случаи) и явной степени выраженности противоопухолевого эффекта (объективный ответ). Тогда как частота оставалась 45%-48% для GEM отдельно, частота существенно превысила 62,5% для настоящего протокола. Объективный ответ также возрос в два раза и более. Реакция ЗГЧ, которая является одним из типов иммунных ответов, наблюдалась очень часто. Так как ее часто наблюдали отдельно для VEGFR2 (личное общение), расценили, что гемцитабин усиливает иммунные ответы. Действительно, в случаях, когда имела место реакция ЗГЧ, клинически были получены реакции SD или выше, и случаи PD и случаи, в которых отсутствовала ЗГЧ, полностью соответствовали. Следовательно, случаи, в которых развивался некоторый тип иммунного ответа, также расценивали как клинически эффективные.
Резюме пациентов клинического исследования
пол
вакцинации
нежелательные
явления
нежелательные
явления
0,5 мг
поражение печени
покраснение/
лимфаденопатия
покраснение
метастазы в печени
1 мг
покраснение/
лимфаденопатия
2 мг
кровоизлияние в опухоли
метастазы в печени
покраснение
Специфическая реакция CTL/реакция ЗГЧ против вводимых пептидов
0,5 мг
1 мг
2 мг
Анализ фракций CD8-положительных Т-клеток уровня I
НИ - не исследовали
Анализ фракций CD8-положительных Т-клеток уровня II
Анализ фракций CD8-положительных Т-клеток уровня III
НИ: не исследовали
Анализ CD4-положительных/с высоким содержанием CD25/Foxp3-положительных регуляторных Т клеток
CD4+CD25высокие Foxp3+: 3,9% (± 1,2)
Изменения опухолевых маркеров, возникшие в случае 6 в течение курса лечения
4 недели до проведения
До проведения
После 1 курса
После 2 курса
После 1 месяца
После 2 месяцев
Резюме противоопухолевых эффектов и реакций ЗГЧ, ассоциированных с лечением по настоящему изобретению
Обсуждение
Очевидно, что рак поджелудочной железы является трудноизлечимым и представляет собой опухоль с наихудшим прогнозом. В настоящее время единственной фармацевтической терапией против рака поджелудочной железы является гемцитабин, но клинически, она все еще неудовлетворительна.
С другой стороны, после идентификации пептидных эпитопов против опухолевых антигенов возникли огромные ожидания в отношении вакцинальной терапии рака; однако хорошо известен тот факт, что клинические результаты в настоящее время не оправдали такие ожидания. Основной причиной является низкая экспрессия или отсутствие молекул МНС в опухолевых клетках. В частности, даже если сильные CTL индуцируются с использованием вакцин, при отсутствии молекул МНС противоопухолевые эффекты не могут быть достигнуты.
Меры против низкой экспрессии и отсутствия молекул МНС являются очень важными задачами, учитывая тот факт, что даже когда реакции CTL, вызванные вакцинами, могут быть определены с помощью иммунологического мониторинга, они непосредственно не связаны с противоопухолевыми эффектами. Более того, гетерогенность опухолей также является важной проблемой. Даже когда CTL могут быть индуцированы против одного опухолевого антигена, в случае, когда экспрессируемая молекула не является необходимой молекулой для роста опухоли, такая молекула удаляется, так что она больше не является мишенью CTL, и опухоль может продолжить расти. С целью решения основных проблем, связанных с противоопухолевыми эффектами таких вакцинальных терапий, авторы изобретения сфокусировали свое внимание на VEGFR2, который усиленно экспрессируется в эндотелиальных клетках новых сосудов опухолей и идентифицирован как пептидный эпитоп, который может быть использован в качестве вакцин [Wada S. Cancer Res. 65, 4939-4946, 2005, WO 2004/024766].
Обычно комбинированное применение вакцинальной терапии и химиотерапии рассматривалось несовместимым на основании их биологических характеристик. Однако с точки зрения иммунитета опухоли, такого как обнаружение регуляторных Т-клеток и их устранение, было предложено их комбинированное применение с химиотерапией. Следовательно, были запланированы клинические исследования для оценки, можно ли ожидать эффектов комбинированного применения терапии гемцитабином и пептидными вакцинами, нацеленными на новые кровеносные сосуды опухоли, в отношении рака поджелудочной железы.
В результате, во-первых, было обнаружено, что это полностью приемлемо в отношении безопасности. Относительно увеличения дозы, анализы системных нежелательных явлений 3 степени или выше (при завершении одного курса), показали, что нейтропения и дисфункция печени возникали в одном случае из трех пациентов на уровне I, двух случаях из трех пациентов на уровне II и одном случае из двух пациентов на уровне III; однако отмена лекарственного препарата или введение G-CSF позволили продолжить введение. В соответствии с вышеуказанным, в настоящее время все уровни находятся в приемлемом диапазоне. Так как она представляет собой вакцинальную терапию, нацеленную на эндотелиальные клетки вновь образованных сосудов опухоли, вызывали вопросы склонность к кровотечениям и другие нежелательные явления; однако перед проведением процедуры было доказано, что теоретическая основа, такая как невысокая экспрессия в эндотелиальных клетках нормальных сосудов, является в некоторой степени правильной. Когда повышение дозы, проанализированное с точки зрения иммунологического мониторинга и клинические эффекты анализировали в отношении реакции ЗГЧ, CTL реакции и степени контроля заболевания, все были положительными в двух случаях из трех пациентов на уровне I, и одном случае из двух пациентов на уровне III. На уровне II, отдельно CTL реакции были положительными в трех случаях из трех пациентов (реакция ЗГЧ и степень контроля заболевания были такими же, как на уровнях I и III). Так как количество случаев небольшое, вышеуказанное предполагает возможность, что уровень II будет рекомендуемой дозой.
В отношении противоопухолевых эффектов, тогда как эффекты комбинированного применения явно наблюдали для вакцинальной терапии, вероятность того, что вакцина усиливает противоопухолевый эффект гемцитабина обсуждается. Как в сравнении таблицы 8, очевидный эффект уменьшения опухоли превосходил в два раза или более эффект гемцитабина отдельно. Это обозначает, что непосредственный противоопухолевый эффект гемцитабина усиливался вакциной. В частности, возможно, что индуцированные вакциной CTL разрушали эндотелиальные клетки вновь образованных сосудов опухоли, так что гемцитабин оказался способен эффективно достигать опухоли, и в результате имел место выраженный противоопухолевый эффект. Затем обсуждалась возможность того, что гемцитабин усиливает противоопухолевые эффекты вакцины. Анализ иммунного ответа против вводимого пептида подтвердил, что сильная реакция CTL индуцировалась преимущественно в клинически эффективных случаях, включая SD случаи. Более того, так как реакции ЗГЧ усиливались, это убедительно указывает на возможность того, что гемцитабин усиливает реакцию CTL, которая является основным элементом противоопухолевых эффектов вакцины. Клинически также были обнаружены четыре из пяти случаев, для которых противоопухолевые эффекты продолжались в течение длительного периода времени, включая SD (пациент 4: один месяц; пациент 6: два месяца; пациент 7: два месяца и пациент 10: один месяц) и было расценено как результат длительного противоопухолевого эффекта вакцины. В частности, это предполагает возможность того, что CTL эффективно индуцируются гемцитабином и такие CTL дают длительные противоопухолевые эффекты. Более того, существует возможность, что опухоль подвергается клеточной смерти из-за гемцитабина, и это действует синергически с противоопухолевыми иммунными реакциями, активированными вакцинами. Таким образом, усиление противоопухолевых эффектов, включая продление продолжительности жизни без увеличения побочных эффектов, может быть убедительно ожидаемо для вакцинальной терапии с использованием гемцитабина и пептидов VEGFR2 в комбинации. Это может быть расценено как важная новость в отношении улучшения исходов лечения для рака поджелудочной железы с плохим прогнозом.
Промышленная применимость
В настоящем описании было обнаружено, что терапевтический эффект химиотерапевтических средств от рака поджелудочной железы, например, гемцитабина, может быть существенно улучшен или усилен при комбинации с соответствующими антигенными пептидами, например, KDR пептидом, идентифицированным как вакцина от рака в WO 2004/024766, содержание которого включено в виде ссылки в настоящее описание полностью. По существу, настоящее изобретение обеспечивает улучшенный метод для лечения рака поджелудочной железы у пациента, нуждающегося в этом.
Все публикации, базы данных, последовательности, патенты и патентные заявки, указанные в настоящем описании, включены в настоящее описание в виде ссылки.
Тогда как изобретение описано подробно и со ссылками на специфические варианты его осуществления, специалисту в области техники очевидно, что в нем могут быть сделаны различные изменения и модификации, без отклонения от рамок и сущности изобретения, границы которого установлены приложенной формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЭПИТОПНЫЕ ПЕПТИДЫ RAB6KIFL/KIF20A И СОДЕРЖАЩИЕ ИХ ВАКЦИНЫ | 2009 |
|
RU2532105C2 |
| ПЕПТИДЫ ЭПИТОПОВ MYBL2 И СОДЕРЖАЩИЕ ИХ ВАКЦИНЫ | 2009 |
|
RU2496787C2 |
| ПЕПТИДЫ ТЕМ8 И СОДЕРЖАЩИЕ ИХ ВАКЦИНЫ | 2008 |
|
RU2498993C2 |
| ПЕПТИДНЫЕ ВАКЦИНЫ ПРОТИВ РАКА С ЭКСПРЕССИЕЙ ПОЛИПЕПТИДОВ MPHOSPH1 ИЛИ DEPDC1 | 2007 |
|
RU2469044C2 |
| ПЕПТИДЫ ТТК И ВАКЦИНЫ, ИХ СОДЕРЖАЩИЕ | 2010 |
|
RU2531348C2 |
| ПЕПТИДЫ KNTC2 И СОДЕРЖАЩИЕ ИХ ВАКЦИНЫ | 2014 |
|
RU2671395C2 |
| БЕЛКИ, ОТНОСЯЩИЕСЯ К СЕМЕЙСТВУ Всl-2, И ИХ ФРАГМЕНТЫ И ИХ ПРИМЕНЕНИЕ У ПАЦИЕНТОВ СО ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛЬЮ | 2004 |
|
RU2367468C2 |
| ПЕПТИДЫ UBE2T И СОДЕРЖАЩИЕ ИХ ВАКЦИНЫ | 2013 |
|
RU2663350C2 |
| ПЕПТИД FOXM1 И ВКЛЮЧАЮЩЕЕ ЕГО МЕДИЦИНСКОЕ СРЕДСТВО | 2008 |
|
RU2487886C2 |
| ПЕПТИДНЫЕ ВАКЦИНЫ ДЛЯ РАКОВ, ЭКСПРЕССИРУЮЩИХ ОПУХОЛЕСПЕЦИФИЧЕСКИЕ АНТИГЕНЫ | 2008 |
|
RU2464275C2 |




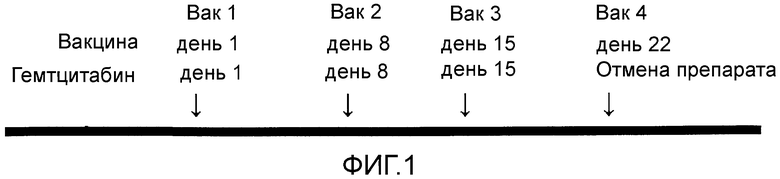
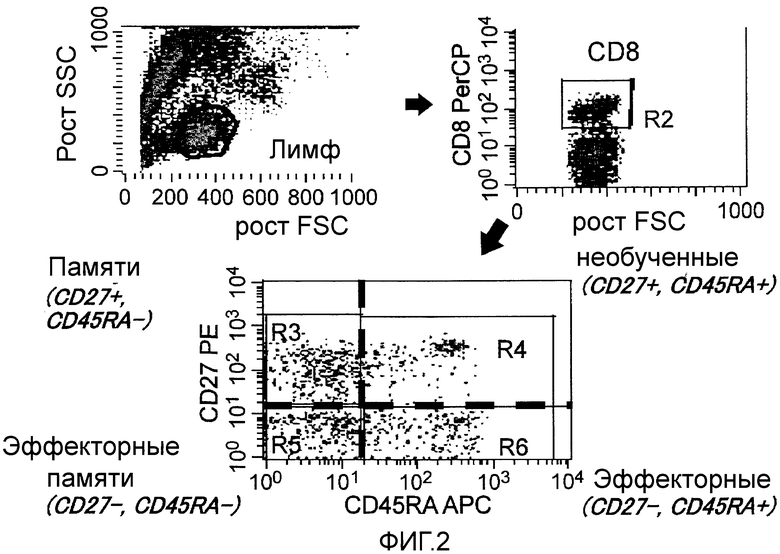
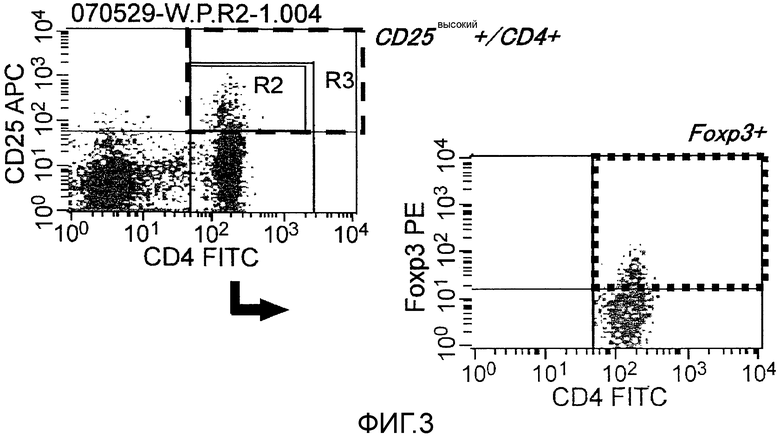
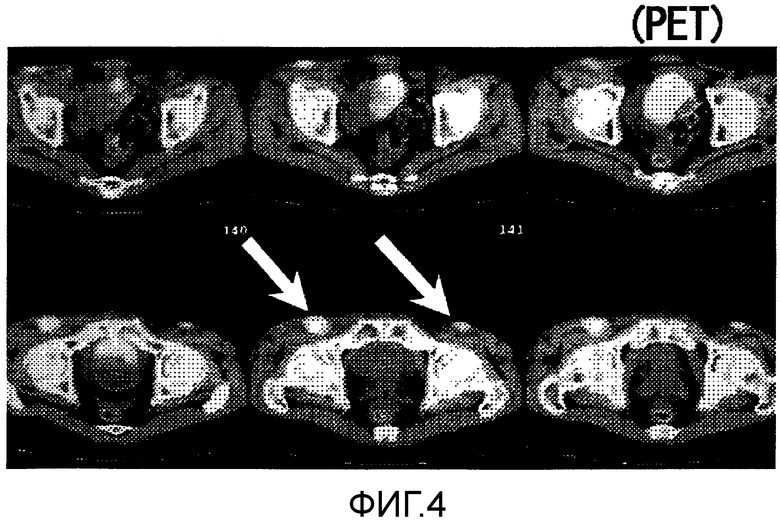
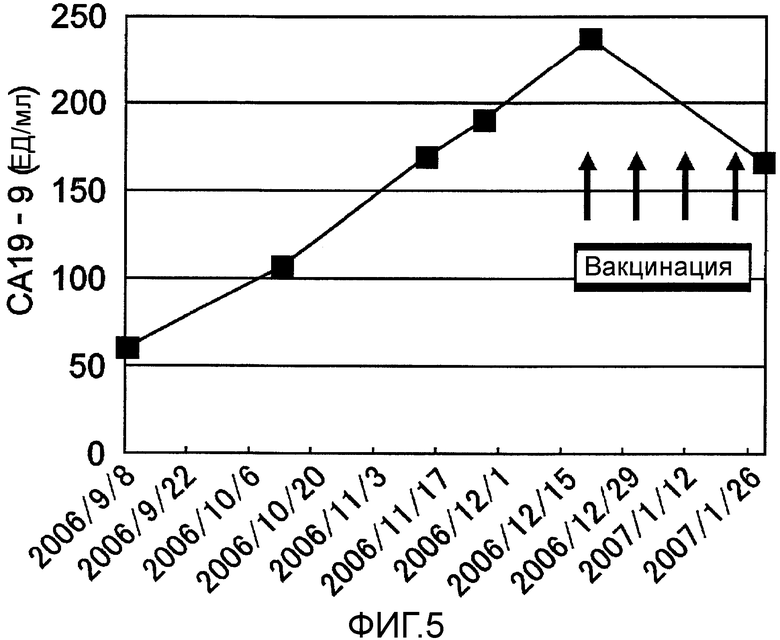
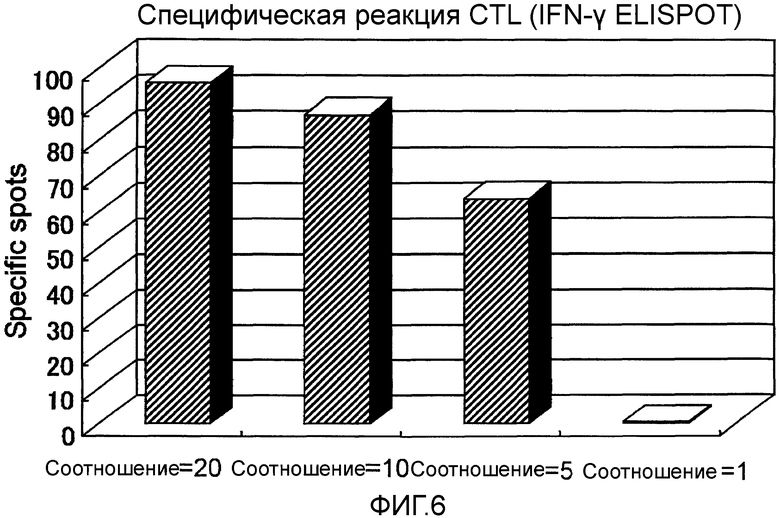
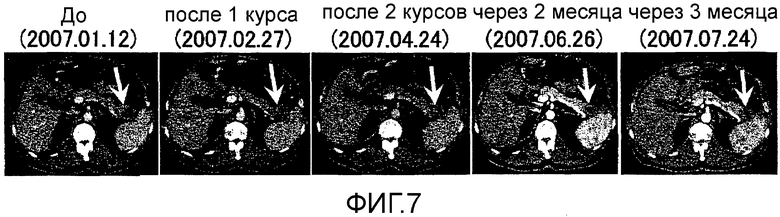
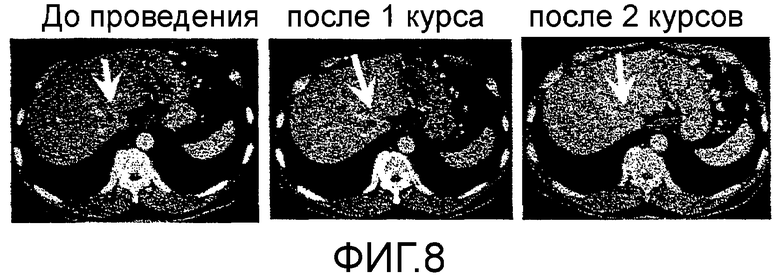
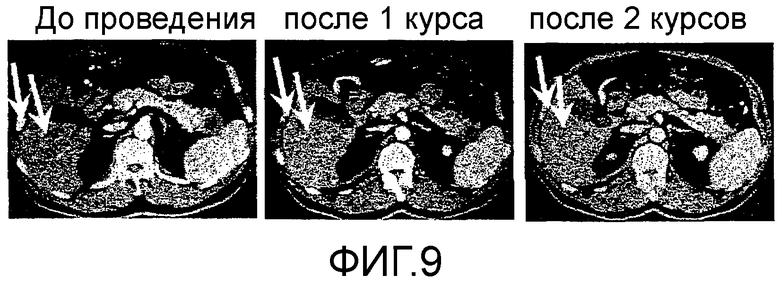
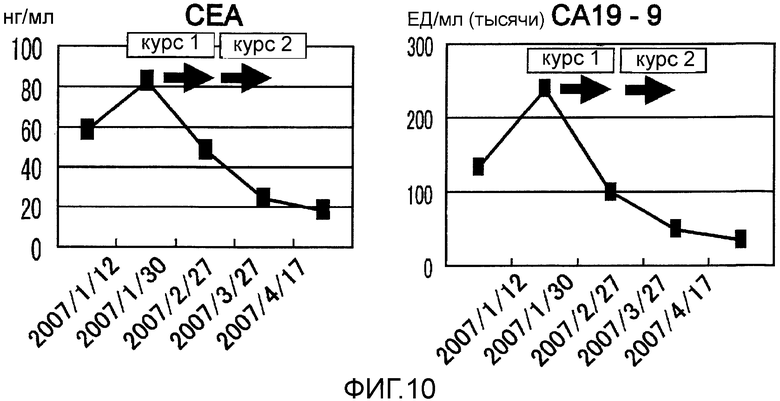
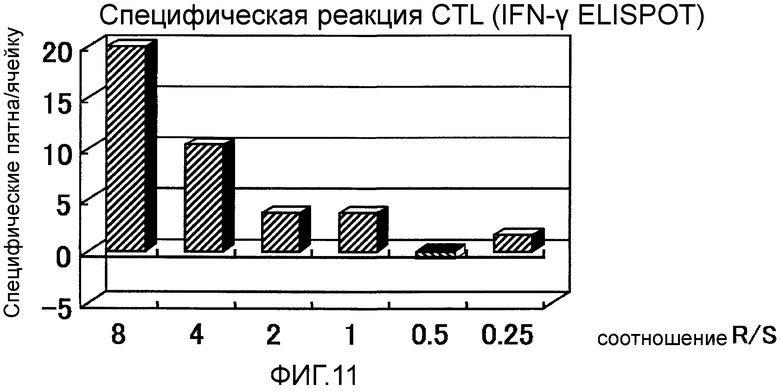
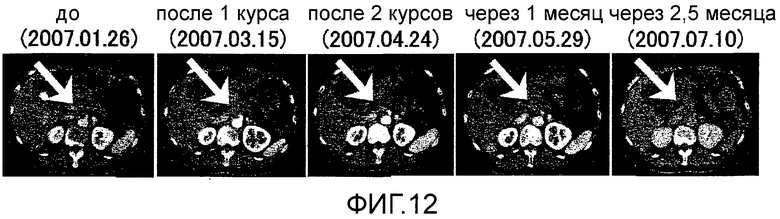

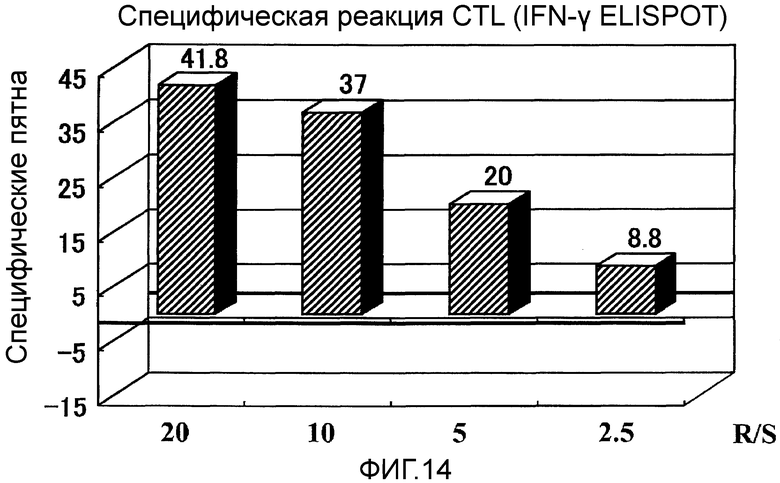
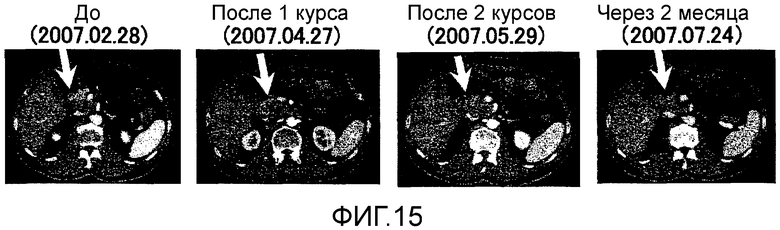
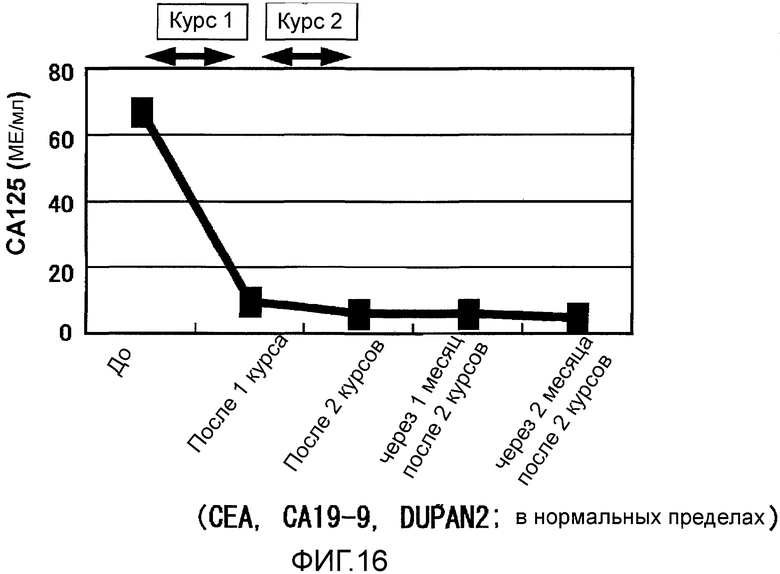
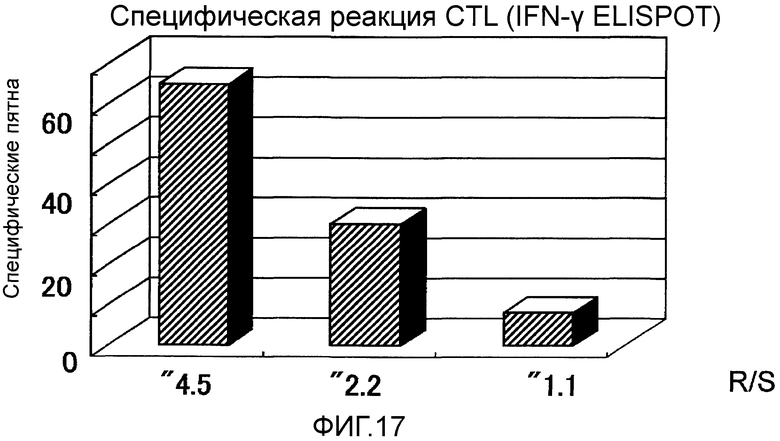
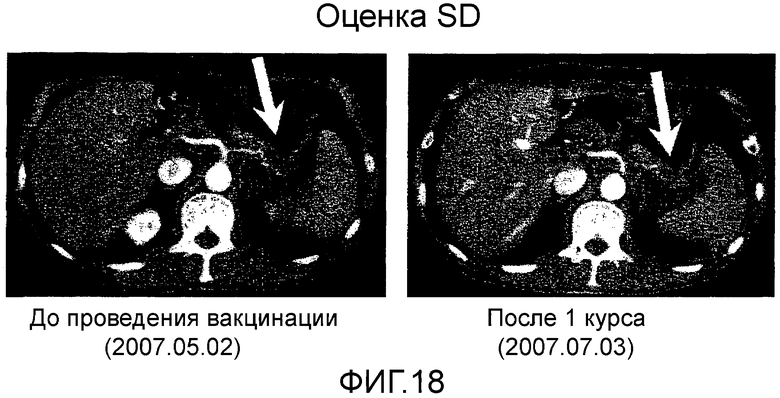
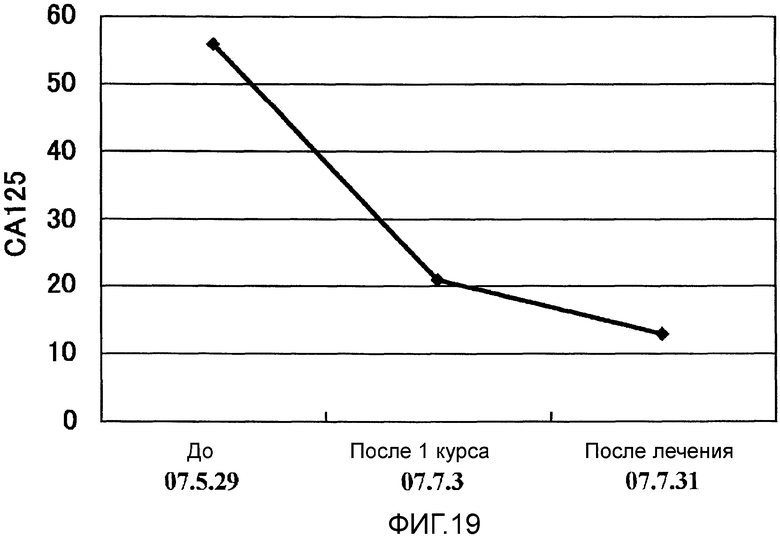
Группа изобретений относится к медицине, а именно к комбинированной терапии рака поджелудочной железы с использованием антигенных пептидов VEGFR2, которые индуцируют цитотоксические клетки. Также раскрыт метод и средство потенцирования терапевтического эффекта химиотерапевтических средств, таких как гемцитабин, а также применение для получения фармацевтической композиции для лечения рака у пациента. Группа изобретений обеспечивает усиление противоопухолевого эффекта гемцитабина. 7 н. и 14 з.п. ф-лы, 8 табл.
1. Способ лечения рака у пациента, где данный способ включает введение указанному пациенту (i) и (ii)
(i) одного или более пептидов, индуцирующих CTL, выбираемых из группы, состоящей из:
(a) одного или более пептидов, имеющих последовательность аминокислот, выбираемую из группы, состоящей из RFVPDGNRI (SEQ ID NO:1), VYSSEEAEL (SEQ ID NO:2), GYRIYDVVL (SEQ ID NO:3), SYMISYAGM (SEQ ID NO:4), KWEFPRDRL (SEQ ID NO:5) и DFLTLEHLI (SEQ ID NO:6);
(b) пептида по (а), в котором 1 или 2 аминокислоты замещены, где замещения 1 или 2 аминокислот являются одним или обоими из следующих замещений:
(A) вторая аминокислота с N-конца аминокислотной последовательности SEQ ID NO: 1, 2, 3, 4, 5 или 6 замещена фенилаланином, тирозином, метионином или триптофаном;
(B) С-концевая аминокислота аминокислотной последовательности SEQ ID NO: 1, 2, 3, 4, 5 или 6 замещена фенилаланином, лейцином, изолейцином, триптофаном или метионином;
и где указанный пептид обладает способностью к индуцированию цитотоксических Т-клеток;
(c) одного или более пептидов, имеющих последовательность аминокислот, выбираемую из группы, состоящей из AMFFWLLLV (SEQ ID NO:7), VIAMFFWLL (SEQ ID NO:8), AVIAMFFWL (SEQ ID NO:9), KLIEIGVQT (SEQ ID NO:10), YMISYAGMV (SEQ ID NO:11), IQSDVWSFGV (SEQ ID NO:12), и VLAMFFWLL (SEQ ID NO:13); и (d) пептида по (с), в котором 1 или 2 аминокислоты замещены, где замещения 1 или 2 аминокислот являются одним или обоими из следующих замещений:
(A) вторая аминокислота с N-конца аминокислотной последовательности SEQ ID NO: 7, 8, 9, 10, 11, 12 или 13 замещена лейцином или метионином; и
(B) С-концевая аминокислота аминокислотной последовательности SEQ ID NO: 7, 8, 9, 10, 11, 12 или 13 замещена валином или лейцином;
и где указанный пептид обладает способностью к индуцированию цитотоксических Т-клеток;
(ii) одного или более химиотерапевтических средств, выбираемых из группы, состоящей из гемцитабина, его фармацевтически приемлемой соли и его пролекарства.
2. Способ по п.1, где указанный пациент является HLA-A24-положительным или НLА-А02-положительным.
3. Способ по п.1, где указанным раком является рак поджелудочной железы.
4. Набор для лечения рака у пациента, где указанный набор включает фармацевтические композиции, содержащие (i) и (ii) в качестве активного ингредиента, соответственно, и фармацевтически приемлемый носитель;
(i) один или более пептидов, индуцирующих CTL, выбираемых из группы, состоящей из:
(а) одного или более пептидов, имеющих последовательность аминокислот, выбираемую из группы, состоящей из RFVPDGNRI (SEQ ID NO:1), VYSSEEAEL (SEQ ID NO:2), GYRIYDVVL (SEQ ID NO:3), SYMISYAGM (SEQ ID NO:4), KWEFPRDRL (SEQ ID NO:5) и DFLTLEHLI (SEQ ID NO:6);
(b) пептида по (а), в котором 1 или 2 аминокислоты замещены, где замещения 1 или 2 аминокислот являются одним или обоими из следующих замещений:
(A) вторая аминокислота с N-конца аминокислотной последовательности SEQ ID NO:1, 2, 3, 4, 5 или 6 замещена фенилаланином, тирозином, метионином или триптофаном;
(B) С-концевая аминокислота аминокислотной последовательности SEQ ID NO:1, 2, 3, 4, 5 или 6 замещена фенилаланином, лейцином, изолейцином, триптофаном или метионином;
и где указанный пептид обладает способностью к индуцированию цитотоксических Т-клеток;
(c) одного или более пептидов, имеющих последовательность аминокислот, выбираемую из группы, состоящей из AMFFWLLLV (SEQ ID NO:7), VIAMFFWLL (SEQ ID NO:8), AVIAMFFWL (SEQ ID NO:9), KLIEIGVQT (SEQ ID NO:10), YMISYAGMV (SEQ ID NO:11), IQSDVWSFGV (SEQ ID NO:12), и VLAMFFWLL (SEQ ID NO:13);
(d) пептида по (с), в котором 1 или 2 аминокислоты замещены, где замещения 1 или 2 аминокислот являются одним или обоими из следующих замещений:
(A) вторая аминокислота с N-конца аминокислотной последовательности SEQ ID NO: 7, 8, 9, 10, 11, 12 или 13 замещена лейцином или метионином; и
(B) С-концевая аминокислота аминокислотной последовательности SEQ ID NO: 7, 8, 9, 10, 11, 12 или 13 замещена валином или лейцином;
и где указанный пептид обладает способностью к индуцированию цитотоксических Т-клеток;
(ii) одно или более химиотерапевтических средств, выбираемых из группы, состоящей из гемцитабина, его фармацевтически приемлемой соли и его пролекарства.
5. Набор по п.4, где указанный пациент является HLA-A24-положительным или НLА-А02-положительным.
6. Набор по п.4, где указанным раком является рак поджелудочной железы.
7. Противораковое средство для лечения рака у пациента, где указанное средство включает (i) в комбинации с (ii)
(i) один или более пептидов, индуцирующих CTL, выбираемых из группы, состоящей из:
(a) одного или более пептидов, имеющих последовательность аминокислот, выбираемую из группы, состоящей из RFVPDGNRI (SEQ ID NO:1), VYSSEEAEL (SEQ ID NO:2), GYRIYDVVL (SEQ ID NO:3), SYMISYAGM (SEQ ID NO:4), KWEFPRDRL (SEQ ID NO:5) и DFLTLEHLI (SEQ ID NO:6);
(b) пептида по (а), в котором 1 или 2 аминокислоты замещены, где замещения 1 или 2 аминокислот являются одним или обоими из следующих замещений:
(A) вторая аминокислота с N-конца аминокислотной последовательности SEQ ID NO:1, 2, 3, 4, 5 или 6 замещена фенилаланином, тирозином, метионином или триптофаном;
(B) С-концевая аминокислота аминокислотной последовательности SEQ ID NO:1, 2, 3, 4, 5 или 6 замещена фенилаланином, лейцином, изолейцином, триптофаном или метионином; и где указанный пептид обладает способностью к индуцированию цитотоксических Т-клеток;
(c) одного или более пептидов, имеющих последовательность аминокислот, выбираемую из группы, состоящей из AMFFWLLLV (SEQ ID NO:7), VIAMFFWLL (SEQ ID NO:8), AVIAMFFWL (SEQ ID NO:9), KLIEIGVQT (SEQ ID NO:10), YMISYAGMV (SEQ ID NO:11), IQSDVWSFGV (SEQ ID NO:12), и VLAMFFWLL (SEQ ID NO:13); и
(d) пептида по (с), в котором 1 или 2 аминокислоты замещены, где замещения 1 или 2 аминокислот являются одним или обоими из следующих замещений:
(A) вторая аминокислота с N-конца аминокислотной последовательности SEQ ID NO:7, 8, 9, 10, 11, 12 или 13 замещена лейцином или метионином; и
(B) С-концевая аминокислота аминокислотной последовательности SEQ ID NO: 7, 8, 9, 10, 11, 12 или 13 замещена валином или лейцином;
и где указанный пептид обладает способностью к индуцированию цитотоксических Т-клеток;
(ii) одно или более химиотерапевтических средств, выбираемых из группы, состоящей из гемцитабина, его фармацевтически приемлемой соли и его пролекарства.
8. Противораковое средство по п.7, где указанный пациент является HLA-А24-положительным или НLА-А02-положительным.
9. Противораковое средство по п.7, где указанным раком является рак поджелудочной железы.
10. Применение комбинации (i) и (ii) в лечении рака у пациента;
(i) один или более пептидов, индуцирующих CTL, выбираемых из группы, состоящей из:
(a) одного или более пептидов, имеющих последовательность аминокислот, выбираемую из группы, состоящей из RFVPDGNRI (SEQ ID NO:1), VYSSEEAEL (SEQ ID NO:2), GYRIYDVVL (SEQ ID NO:3), SYMISYAGM (SEQ ID NO:4), KWEFPRDRL (SEQ ID NO:5) и DFLTLEHLI (SEQ ID NO:6);
(b) пептида по (а), в котором 1 или 2 аминокислоты замещены, где замещения 1 или 2 аминокислот являются одним или обоими из следующих замещений:
(А) вторая аминокислота с N-конца аминокислотной последовательности SEQ ID NO:1, 2, 3, 4, 5 или 6 замещена фенилаланином, тирозином, метионином или триптофаном;
(В) С-концевая аминокислота аминокислотной последовательности SEQ ID NO: 1, 2, 3, 4, 5 или 6 замещена фенилаланином, лейцином, изолейцином, триптофаном или метионином;
и где указанный пептид обладает способностью к индуцированию цитотоксических Т-клеток;
(c) одного или более пептидов, имеющих последовательность аминокислот, выбираемую из группы, состоящей из AMFFWLLLV (SEQ ID NO:7), VIAMFFWLL (SEQ ID NO:8), AVIAMFFWL (SEQ ID NO:9), KLIEIGVQT (SEQ ID NO:10), YMISYAGMV (SEQ ID NO:11), IQSDVWSFGV (SEQ ID NO:12) и VLAMFFWLL (SEQ ID NO:13);
(d) пептида по (с), в котором 1 или 2 аминокислоты замещены, где замещения 1 или 2 аминокислот являются одним или обоими из следующих замещений:
(A) вторая аминокислота с N-конца аминокислотной последовательности SEQ ID NO:7, 8, 9, 10, 11, 12 или 13 замещена лейцином или метионином; и
(B) С-концевая аминокислота аминокислотной последовательности SEQ ID NO:7, 8, 9, 10, 11, 12 или 13 замещена валином или лейцином;
и где указанный пептид обладает способностью к индуцированию цитотоксических Т-клеток;
(ii) одно или более химиотерапевтических средств, выбираемых из группы, состоящей из гемцитабина, его фармацевтически приемлемой соли и его пролекарства.
11. Применение по п.10, где указанный пациент является HLA-A24-положительным или НLА-А02-положительным.
12. Применение по п.10, где указанным раком является рак поджелудочной железы.
13. Способ для усиления терапевтического эффекта гемцитабина для лечения рака, где указанный способ включает стадию введения пациенту одного или более пептидов, индуцирующих CTL, выбираемых из группы, состоящей из:
(a) одного или более пептидов, имеющих последовательность аминокислот, выбираемую из группы, состоящей из RFVPDGNRI (SEQ ID NO:1), VYSSEEAEL (SEQ ID NO:2), GYRIYDVVL (SEQ ID NO:3), SYMISYAGM (SEQ ID NO:4), KWEFPRDRL (SEQ ID NO:5) и DFLTLEHLI (SEQ ID NO:6);
(b) пептида по (а), в котором 1 или 2 аминокислоты замещены, где замещения 1 или 2 аминокислот являются одним или обоими из следующих замещений:
(A) вторая аминокислота с N-конца аминокислотной последовательности SEQ ID NO:1, 2, 3, 4, 5 или 6 замещена фенилаланином, тирозином, метионином или триптофаном;
(B) С-концевая аминокислота аминокислотной последовательности SEQ ID NO: 1, 2, 3, 4, 5 или 6 замещена фенилаланином, лейцином, изолейцином, триптофаном или метионином;
и где указанный пептид обладает способностью к индуцированию цитотоксических Т-клеток;
(c) одного или более пептидов, имеющих последовательность аминокислот, выбираемую из группы, состоящей из AMFFWLLLV (SEQ ID NO:7), VIAMFFWLL (SEQ ID NO:8), AVIAMFFWL (SEQ ID NO:9), KLIEIGVQT (SEQ ID NO:10), YMISYAGMV (SEQ ID NO:11), IQSDVWSFGV (SEQ ID NO:12) и VLAMFFWLL (SEQ ID NO:13); и
(d) пептида по (с), в котором 1 или 2 аминокислоты замещены, где замещения 1 или 2 аминокислот являются одним или обоими из следующих замещений:
(А) вторая аминокислота с N-конца аминокислотной последовательности SEQ ID NO:7, 8, 9, 10, 11, 12 или 13 замещена лейцином или метионином; и
(В) С-концевая аминокислота аминокислотной последовательности SEQ ID NO:7, 8, 9, 10, 11, 12 или 13 замещена валином или лейцином; и где указанный пептид обладает способностью к индуцированию цитотоксических Т-клеток.
14. Способ по п.13, где пациент является НLА-А24-положительным или НLА-А02-положительным.
15. Способ по п.13, где указанным раком является рак поджелудочной железы.
16. Применение одного или более пептидов, индуцирующих CTL, выбираемых из группы, состоящей из
(a) одного или более пептидов, имеющих последовательность аминокислот, выбираемую из группы, состоящей из RFVPDGNRI (SEQ ID NO:1), VYSSEEAEL (SEQ ID NO:2), GYRIYDVVL (SEQ ID NO:3), SYMISYAGM (SEQ ID NO:4), KWEFPRDRL (SEQ ID NO:5) и DFLTLEHLI (SEQ ID NO:6);
(b) пептида по (а), в котором 1 или 2 аминокислоты замещены, где замещения 1 или 2 аминокислот являются одним или обоими из следующих замещений:
(A) вторая аминокислота с N-конца аминокислотной последовательности SEQ ID NO: 1, 2, 3, 4, 5 или 6 замещена фенилаланином, тирозином, метионином или триптофаном;
(B) С-концевая аминокислота аминокислотной последовательности SEQ ID NO:1, 2, 3, 4, 5 или 6 замещена фенилаланином, лейцином, изолейцином, триптофаном или метионином;
и где указанный пептид обладает способностью к индуцированию цитотоксических Т-клеток;
(c) одного или более пептидов, имеющих последовательность аминокислот, выбираемую из группы, состоящей из AMFFWLLLV (SEQ ID NO:7), VIAMFFWLL (SEQ ID NO:8), AVIAMFFWL (SEQ ID NO:9), KLIEIGVQT (SEQ ID NO:10), YMISYAGMV (SEQ ID NO:11), IQSDVWSFGV (SEQ ID NO:12) и VLAMFFWLL (SEQ ID NO:13); и (d) пептида по (с), где 1 и 2 аминокислоты замещены, где замещения 1 или 2 аминокислот являются одним или обоими из следующих замещений:
(A) вторая аминокислота с N-конца аминокислотной последовательности SEQ ID NO:7, 8, 9, 10, 11, 12 или 13 замещена лейцином или метионином; и
(B) С-концевая аминокислота аминокислотной последовательности SEQ ID NO:7, 8, 9, 10, 11, 12 или 13 замещена валином или лейцином;
и где указанный пептид обладает способностью к индуцированию цитотоксических Т-клеток;
для получения фармацевтической композиции для усиления терапевтического эффекта гемцитабина для лечения рака у пациента.
17. Применение по п.16, где указанный пациент является HLA-A24-положительным или НLА-А02-положительным.
18. Применение по п.16, где указанным раком является рак поджелудочной железы.
19. Средство для усиления терапевтического эффекта гемцитабина, где указанное терапевтическое средство включает один или более пептидов, индуцирующих CTL, выбираемых из группы, состоящей из:
(a) одного или более пептидов, имеющих последовательность аминокислот, выбираемую из группы, состоящей из RFVPDGNRI (SEQ ID NO:1), VYSSEEAEL (SEQ ID NO:2), GYRIYDVVL (SEQ ID NO:3), SYMISYAGM (SEQ ID NO:4), KWEFPRDRL (SEQ ID NO:5) и DFLTLEHLI (SEQ ID NO:6);
(b) пептида по (а), в котором 1 или 2 аминокислоты замещены, где замещения 1 или 2 аминокислот являются одним или обоими из следующих замещений:
(A) вторая аминокислота с N-конца аминокислотной последовательности SEQ ID NO:1, 2, 3, 4, 5 или 6 замещена фенилаланином, тирозином, метионином или триптофаном;
(B) С-концевая аминокислота аминокислотной последовательности SEQ ID NO:1, 2, 3, 4, 5 или 6 замещена фенилаланином, лейцином, изолейцином, триптофаном или метионином;
и где указанный пептид обладает способностью к индуцированию цитотоксических Т-клеток;
(c) одного или более пептидов, имеющих последовательность аминокислот, выбираемую из группы, состоящей из AMFFWLLLV (SEQ ID NO:7), VIAMFFWLL (SEQ ID NO:8), AVIAMFFWL (SEQ ID NO:9), KLIEIGVQT (SEQ ID NO:10), YMISYAGMV (SEQ ID NO:11), IQSDVWSFGV (SEQ ID NO: 12) и VLAMFFWLL (SEQ ID NO:13);
(d) пептида по (с), в котором 1 или 2 аминокислоты замещены, где замещения 1 или 2 аминокислот являются одним или обоими из следующих замещений:
(A) вторая аминокислота с N-конца аминокислотной последовательности SEQ ID NO: 7, 8, 9, 10, 11, 12 или 13 замещена лейцином или метионином; и
(B) С-концевая аминокислота аминокислотной последовательности SEQ ID NO: 7, 8, 9, 10, 11, 12 или 13 замещена валином или лейцином;
и где указанный пептид обладает способностью к индуцированию цитотоксических Т-клеток;
в качестве активного ингредиента.
20. Средство по п.19, где усиливаемый терапевтический эффект представляет собой терапевтический эффект гемцитабина в лечении рака у пациента, где указанный пациент является НLА-А24-положительным или HLА-А02-положительным.
21. Средство по п.20, где указанным раком является рак поджелудочной железы.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Int | |||
| J.Cancer, 2002, Nov.10, 102(2); 101-8, PMID: 12385004 реферат | |||
| WO 2004024766 A1, 25.03.2004 | |||
| WADA S et al | |||
| Rationale for | |||
Авторы
Даты
2013-01-20—Публикация
2008-08-19—Подача