Настоящее изобретение относится к способу и установке для удаления выбранных газов из воздуха. Изобретение имеет особенную применимость для извлечения диоксида углерода (СО2) из воздуха и будет описано в связи с такими полезными вариантами применения, хотя рассматриваются и другие варианты выгодного употребления.
Существуют убедительные свидетельства в пользу предположения, что существует строгая корреляция между резким возрастанием количества диоксида углерода (СО2) в атмосфере с соразмерным повышением глобальных температур поверхности. Этот эффект общеизвестен как Глобальное Потепление. Среди разнообразных источников выбросов диоксида углерода (СО2) есть громадное число мелких широко распространенных производителей выбросов, которые непрактично подавлять в месте расположения источника. Кроме того, крупномасштабные источники выбросов, такие как энергетические предприятия, работающие на углеводородном топливе, не являются полностью защищенными от выделения диоксида углерода (СО2) в атмосферу. В совокупности эти главные источники, а также прочие, ведут к резкому убыстрению роста концентрации атмосферного диоксида углерода (СО2). Пока регулируются источники всех производителей выбросов, требуются другие технологии улавливания возрастающих, хотя и относительно низких, фоновых уровней атмосферного диоксида углерода (СО2). Предпринимаются усилия, направленные на развитие существующих технологий сокращения выбросов, а также на разработку новых и нестандартных способов прямого улавливания атмосферного диоксида углерода (СО2). Эти усилия нуждаются в методологиях управления образующимися потоками концентрированных выбросов диоксида углерода (СО2) таким образом, чтобы предотвращать их возвращение в атмосферу.
Образование диоксида углерода (СО2) происходит во множестве отраслей производственной деятельности, таких как производство электрической энергии на электростанциях, работающих на угле, и при использовании углеводородов, которые типично являются главными компонентами топлив, которые сжигаются в установках для горения, таких как двигатели. Выхлопные газы, выбрасываемые из таких установок для горения, содержат газообразный диоксид углерода (СО2), который в настоящее время просто выпускается в атмосферу. Однако ввиду роста количества газов, обусловливающих парниковый эффект, выбросы диоксида углерода (СО2) из всех источников должны быть ограничены. Для мобильных источников наилучшим вариантом скорее всего является улавливание диоксида углерода (СО2) непосредственно из воздуха, нежели из подвижного устройства внутреннего сгорания, такого как автомобиль или самолет. Преимущество удаления диоксида углерода (СО2) из воздуха состоит в том, что тем самым устраняется необходимость хранения диоксида углерода (СО2) в подвижном устройстве.
Извлечение диоксида углерода (СО2) из окружающего воздуха сделало бы возможным применение топлив на основе углерода и восприятие как неактуальной проблемы связанных с этим выбросов парниковых газов. Поскольку диоксид углерода (СО2) не является ни ядовитым, ни вредным в количестве нескольких частей на миллион, но создает экологические проблемы просто фактом накопления в атмосфере, возможно удаление диоксида углерода (СО2) из воздуха, чтобы компенсировать равного уровня выбросы, где бы то ни было и в разное время.
Однако большинство прототипных способов имеет результатом неэффективное улавливание диоксида углерода (СО2) из воздуха, поскольку эти процессы нагревают или охлаждают воздух, или изменяют давление воздуха в значительных количествах. В результате чистая убыль диоксида углерода (СО2) является пренебрежимо малой, так как процесс очистки может вывести диоксид углерода (СО2) в атмосферу в качестве побочного продукта в производстве электрической энергии, потребной для энергоснабжения процесса.
В своих вышеназванных патентных заявках авторы настоящего изобретения описывают применение функционализированных ионообменных смол для извлечения диоксида углерода (СО2) из окружающего воздуха. В частности, в своей вышеназванной патентной заявке '326 авторы настоящего изобретения описывают употребление сильноосновных ионообменных смол, действие которых весьма зависит от влажности, то есть ионообменной смолы, имеющей способность поглощать диоксид углерода (СО2) при снижении влажности, и выделять диоксид углерода (СО2), когда влажность растет. Настоящее изобретение представляет усовершенствования устройств для улавливания из воздуха с использованием ионообменных смол (IER).
Как применяемый здесь, термин «ионный обмен» имеет отношение к обратимому процессу, в котором ионы высвобождаются из нерастворимого твердофазного материала в обмен на другие ионы в окружающем растворе; для целей настоящего обсуждения данный термин употребляется, даже если степень гидратации ионообменной смолы настолько минимальна, что видимой влаги на ионообменной смоле не наблюдается, и поэтому содержащуюся воду в общем нельзя было бы рассматривать как создающую раствор.
В дальнейшем авторы настоящего изобретения также рассмотрят увлажнение ионообменной смолы. Термин «увлажнение» будет относиться к воздействию на смолу жидкой воды или к повышенным уровням давления водяного пара. Повышенные значения давления водяного пара, если только недвусмысленно не оговорено нечто иное, имеют отношение к величинам парциального давления водяного пара, превышающим таковые, воздействию которых смола подвергалась ранее, например, когда она поглощала диоксид углерода (СО2).
Общеупотребительные ионообменные смолы, имеющиеся в продаже на рынке, составлены каркасом из полистирола или целлюлозы, в который введены аминогруппы для создания анионной формы, обычно с использованием промежуточного хлорметилирования. Как только производится введение ковалентно связанной аминогруппы, она становится способной действовать как центр ионного обмена благодаря ее способности образовывать ионы. Однако существуют и другие ионообменные материалы, и таковые тоже могли бы быть использованы для поглощения диоксида углерода (СО2) из атмосферы.
В зависимости от способа получения, смола может быть обработана для придания ей специфических свойств, и одна цель настоящего изобретения состоит в конструировании смолы, обладающей конкретными характеристиками, каковые пригодны для специальных вариантов употребления. Одним важным средством контроля является степень сшивания между полимерными цепями. Сшивание, показанное на фиг. 2, представляет собой способ соединения двух полимерных цепей общей ковалентной связью. Это выполняют встраиванием между двумя сшиваемыми цепями бензольного цикла, общего для обеих таковых.
В ионообменной смоле степень сшивания обусловливает способность смолы удерживать воду. Благодаря ионной природе смолы, вода имеет высокое сродство к ионам, нейтрализующим совокупный заряд смолы, и тем самым смола привлекает воду. Количество воды, которая находится в равновесии со смолой, представляет собой тот фактор, который обусловливает относительные концентрации ионных солей, содержащихся внутри смолы. В свою очередь, фактическое значение рН может определять кинетические параметры реакции в абсорбции диоксида углерода (СО2).
Степень функционализации полимера можно регулировать вариацией концентраций реактантов при проведении реакции хлорметилирования, и, впоследствии, условиями аминирования, при котором происходит ковалентное связывание аминогрупп. Число функциональных групп на единицу объема определяет обменную емкость смолы. Конечно, при большем числе аминогрупп может быть запасено большее количество ионов; с другой стороны, если наличествует слишком мало центров ионного связывания, кулоновские силы притяжения внутри смолы не смогут обеспечить интенсивный ионный обмен. Пространственные затруднения в более плотно связанных полимерных цепях также могут оказывать влияние на типы атомов, которые могут быть вовлечены в обмен.
Тип аминогруппы также является фактором приспособления продукта к конкретным условиям применения. Присоединяемая молекула может быть простой в химическом плане, такой как аммиак, или более сложной молекулой, такой как 2-аминодипропаноламин, и т.д. Путем замещения атомов водорода в аминогруппе другими органическими цепями можно в значительной степени регулировать основность ионогенных групп, введенных в смолу. Подвижность анионов, исполняющих роль противоионов, нейтрализующих заряды присоединенных аммониевых катионов, также будет влиять на кинетические характеристики абсорбции диоксида углерода (СО2) смолой. Например, маленький анион, такой как хлорид (Cl-) или гидроксид (ОН-), обычно является гораздо более подвижным внутри смолы даже в том случае, если к атому азота присоединены многие дополнительные группы, тогда как крупный анион, такой как карбонат (СО3 2-) или нитрат (NO3 -), является относительно малоподвижным и более легко фиксируется при введении дополнительных органических фрагментов в аминогруппу.
Тип амина, который присоединяют к смоле, весьма сильно влияет на степень диссоциации на ионы, каковой может подвергаться аммонийный фрагмент. Атом азота способен формировать три ковалентных связи, но положительно заряженный ион может образовываться при создании четвертой ковалентной связи. Аммиак и вода реагируют с образованием гидроксида аммония, NH3+H2O↔NH4 +OH-. Однако аммиак является слабым основанием, и равновесие реакции сильно сдвинуто в сторону исходного аммиака (NH3). Однако когда аммиак присоединяют к полимерному скелету, можно регулировать степень смещения равновесия. В случае молекулы R-NH2 аминогруппа в нейтральном состоянии может существовать как амин R-NH2, или же может образовывать катионный центр в аммонийной форме R-NH3 +. Величина заряда катионного центра будет зависеть от выбора фрагмента R. Далее, существует возможность замещения нескольких атомов водорода в молекуле и тем самым изменения степени ионизации. Предельным случаем является таковой, где к атому азота присоединены четыре органических остатка - с образованием четвертичного аммония - и при этом он постоянно остается в положительно заряженном состоянии. В известном смысле, азот уже больше не может участвовать в равновесном процессе с возвращением к аммиаку NH3 ввиду того, что все четыре связи полностью насыщены связыванием с полимерной матрицей. Поскольку гидроксид-ион связывается только как ион при центре с положительным зарядом, который формируется четвертичным аммониевым фрагментом, полученное основание оказывается полностью ионизированным. В этом отношении смола, содержащая четвертичные аммониевые группы, известна как сильноосновная смола. Когда структура аммониевого соединения обеспечивает полную ионизацию, таковое действует как любое другое сильное основание, такое как гидроксид натрия (NaOH). Чтобы достигнуть полной ионизации, нет необходимости присоединять аммониевый фрагмент к твердому полимеру, как это имеет место в случае гидроксида тетраметиламония или ряда прочих других полностью ионизированных органических жидкостей. Эти соединения рассматриваются как эквивалентные сильным основаниям щелочноземельных металлов, и некоторые из таких ионных жидкостей отмечены как сильные поглотители диоксида углерода (СО2). Поэтому можно использовать многие из этих ионных жидкостей в качестве сорбентов, которые могут удалять диоксид углерода (СО2) из воздуха.
Как можно видеть из вышеизложенного, степень, в которой аминогруппа может действовать как основание, также можно регулировать подбором типов групп, которые присоединены к атому азота. Точно так же, как сильное основание можно сформировать заполнением всех доступных реакционных центров углеродсодержащими группами, слабое основание может быть создано ограничением присоединяемых групп.
Непосредственное применение ионообменных смол (IER) выявило интересные характеристики, такие как высокое сродство к воде и механизм внутренней циркуляции ионов. Проявление этого свойства захватывать диоксид углерода (СО2) определяется способностью создавать эффективную поверхность, насыщенную гидроксид-анионами (ОН-), без необходимости постоянного увлажнения. Авторы настоящего изобретения утверждают, что они не только в состоянии создавать активную поверхность, насыщенную гидроксид-анионами (ОН-), но и могут также регулировать значение рН поверхности с использованием вышеназванных характеристик. Далее, авторы настоящего изобретения показали, что абсорбция диоксида углерода (СО2) зависит от содержания воды в полимерной матрице.
Способность создавать твердую поверхность, которая действует подобно раствору сильного основания, имеет несколько преимуществ, не ограничивающихся следующим:
1. Безопасность: Поскольку гидроксильная (ОН-) функциональная группа присоединена к твердой поверхности, она не способна перемещаться или мигрировать и может быть удалена только замещением. Поэтому нет опасности непредумышленного высвобождения в окружающую среду сильноосновного химического вещества. Нет также свободной жидкости, которая способна образовывать аэрозоли в потоке обработанного воздуха, которые могли бы быть вынесены в окружающую среду. Фактически производители полимеров рассматривают ионообменные смолы (IER) как совершенно безопасные, если только они не контактируют с сильными окислителями.
2. Удаление побочных продуктов, поступающих из окружающей среды: Вследствие того, что воздухосборник контактирует с чрезвычайно большими объемами воздуха, воздухосборники склонны накапливать пыль, пыльцу и другие загрязняющие примеси из воздуха. Это обстоятельство создает проблемы в случае конструкции с газо-жидкостным контактом. Для удаления загрязняющих примесей потребовались бы предварительное фильтрование поступающего воздуха выше по потоку или дополнительное фильтрование в процессе последующего разделения ниже по потоку, которые увеличили бы стоимость сооружения и эксплуатации. Поскольку гидроксид-анионы (ОН-) соединены с твердой поверхностью исключительно ионными связями, твердую поверхность можно без труда отмыть от загрязняющих примесей, таких как грязь и мусор, без ущерба для поверхности и зафиксированных на таковой анионов. Промывной раствор, типично питьевая вода, затем может быть надежно утилизирован без последующей обработки благодаря тому, что он не содержит никаких твердых примесей или химических веществ, перешедших в раствор. По существу, это подобно смыванию грязи с полимерной сетки.
3. Структура: Поскольку аминогруппы могут быть введены во многие полимеры, непосредственным расположением аминных функциональных групп на структурно стабильных поверхностях можно не только создать контактную поверхность, но и обеспечить ее функционирование в качестве фактического воздухосборника. Это упрощает механическую компоновку, снижает расходы на изготовление и ускоряет сборку.
4. Динамические характеристики потока ионов: Эксперименты показали, что в ионообменных смолах проявляется механизм внутренней регенерации поверхности. Без намерения вдаваться в какую-нибудь теорию, представляется, что скорее всего это обуславливается удерживанием воды внутри смолы и существованием градиентов концентраций ионов, которые устанавливаются при контакте с воздухом. Когда насыщенная гидроксид-ионами (ОН-) поверхность контактирует с потоком, содержащим диоксид углерода (СО2), кислотно-основное взаимодействие между протонами (Н+) и гидроксид-ионами (ОН-) образует воду, в результате чего на смоле вместо гидроксид-ионов (ОН-) остаются бикарбонатные группы (НСО3-). Благодаря тому, что внутри смолы насыщенные гидроксид-ионами (ОН-) поверхности находятся на множестве уровней, формируется концентрационный градиент, который становится движущей силой перемещения ионов внутри смолы. Высокая концентрация карбонатных или бикарбонатных ионов на поверхности и низкая концентрация таковых внутри смолы обусловливают миграцию карбонат-ионов внутрь, тогда как в то же самое время противоположный концентрационный градиент также заставляет гидроксид-анионы (ОН-) изнутри смолы мигрировать к поверхности. Оба градиента в совокупности способствуют друг другу и проявляются в степенях, каковые не создают существенных помех кинетическим параметрам абсорбции газа.
5. Потеря воды: Зачастую очень важным фактором, который обычно не учитывался при проектировании коллекторов, является потеря воды, которая связана с системами контакта, основанными на водных растворах. В общем, потеря воды составляет величину, примерно в 10-100 раз превышающую количество собранного диоксида углерода (СО2), а возможно, и больше. При использовании же коллектора с действующей «всухую» функционализированной твердой поверхностью потеря воды резко сокращается.
6. Контроль величины рН: Ввиду уменьшения количества гидратационной воды в результате сшивания можно более эффективно регулировать значение рН твердого материала. Далее, величину рН можно также корректировать увеличением относительной плотности распределения гидроксидных (ОН-) групп на твердой поверхности.
После выполнения серии экспериментов стало ясно, что почти сухие смолы, без видимых признаков прилипшей к таковым жидкости, могут абсорбировать значительные количества диоксида углерода (СО2) и достигать такого уровня поглощения, когда по существу одна молекула диоксида углерода (СО2) приходится на аминный центр. Влажная смола не может удержать больше, чем одну молекулу диоксида углерода (СО2) на два аминных центра. В указанном первом случае смола достигла состояния карбонизации, каковое эквивалентно бикарбонатной соли, в то время как в последнем случае эквивалентная соль представляет собой карбонат. Данные также наводят на мысль, что кинетические характеристики реакции в случае сухого материала не испытывают резких изменений при переходе системы из состояния частичного насыщения, которое находится на уровне ниже карбонатного, к состоянию насыщения, каковое существенно превышает карбонатное. Это согласуется с системой, в которой сосуществуют карбонатные ионы и бикарбонатные ионы.
Следствием этих химических условий является возможность абсорбировать значительные количества диоксида углерода (СО2) из воздуха (либо окружающего наружного воздуха, либо воздуха в помещении) и высвобождать значительное количество диоксида углерода (СО2) из полимерного сорбента простым воздействием на таковой увеличенными количествами воды, либо в форме жидкости, либо в виде водяного пара.
Поэтому есть возможность инициировать высвобождение диоксида углерода (СО2) из твердого сорбента и вновь уловить его расположенным поблизости жидким сорбентом, который может удалять диоксид углерода (СО2) при этом парциальном давлении из потока газа. Авторы настоящего изобретения называют этот эффект как колебание водосодержания, когда увлажнение ионообменного материала выполняют с помощью жидкой воды, и как колебание влажности, когда увлажнение производится путем повышения парциального давления водяного пара.
Если смолу подвергают воздействию чистой жидкой воды, способность воды удерживать высвобожденный диоксид углерода (СО2) очень ограничена, и большая часть диоксида углерода (СО2) будет накапливаться в газовой фазе, соседствующей с водяной пленкой, которая смачивает материал. Эксперименты показали, что парциальное давление диоксида углерода (СО2) над такими смоченными жидкостью ионообменными смолами может превышать величину давления в 50 мбар (5 кПа). Однако в воду можно внести основание, и тем самым иметь диоксид углерода (СО2) скорее содержащимся в растворе, нежели испарившимся в окружающее газовое пространство. Этим обосновывается применяемое авторами настоящего изобретения карбонатное промывание ионообменной смолы. Вода в растворе побуждает смолу выделять избыток диоксида углерода (СО2), и высвобожденный диоксид углерода (СО2) превращает раствор из карбонатного раствора в бикарбонатный раствор. Этот насыщенный бикарбонатный раствор затем можно дополнительно обработать для извлечения из него диоксида углерода (СО2) и вновь преобразовать его в карбонатный раствор, который готов для промывания следующей порции смолы, которая была частично или полностью насыщена диоксидом углерода (СО2).
Один подход к выделению диоксида углерода (СО2) из бикарбоната состоит в применении батареи электродиализных ячеек, которая предназначена для расщепления соли (здесь бикарбоната, например, бикарбоната натрия) на основание (здесь карбонат, например, карбонат натрия) и кислоту (здесь угольную кислоту, которая распадается на воду (Н2О) и диоксид углерода (СО2) и тем самым высвобождает диоксид углерода (СО2)). В случае такой слабой кислоты, как диоксид углерода (СО2), в качестве средства для разложения соли можно использовать только катионную мембрану, которая пропускает катионы (например, ионы натрия) из кислотной камеры в основную камеру, без образования разбавленного солевого потока посередине. Такая конструкция составлена последовательностью батарей, включающих биполярные и катионные мембраны. Фигура Х показывает конкретное исполнение такой конструкции, которая работала в качестве такого средства разложения соли.
Существуют другие способы извлечения диоксида углерода (СО2) из бикарбонатного раствора и регенерации карбонатного раствора. Во-первых, есть ряд вариантов электрохимического разделения. Например, можно также использовать обычное устройство для разложения соли, в котором применяется последовательность биполярных, катионных, анионных мембран. В этом случае солевой раствор разбавляют и возвращают в виде разбавленного потока воды. Можно также использовать батарею, в которой батарея представляет собой последовательность биполярных и анионных мембран. В этом случае сквозь мембрану проходят уже не катионы, а бикарбонат-анионы.
Не все схемы извлечения являются электрохимическими по природе. Можно нагревать раствор и тем самым стимулировать выделение диоксида углерода (СО2); можно охлаждать раствор и тем самым способствовать осаждению бикарбоната натрия, который является менее растворимым, чем карбонат натрия, и затем в последующей стадии прокаливать бикарбонат натрия с образованием диоксида углерода (СО2), водяного пара и карбоната натрия.
Вместо употребления неорганического солевого раствора можно также использовать растворы аминов для улавливания диоксида углерода (СО2), который высвобождается с мембраны. В этом случае важно соблюдать химическую совместимость смолы и раствора амина, так как есть возможность разложения смолы органическим амином в растворе. В этом случае тоже можно применять способы извлечения, которые конкретно рассчитаны на работу с жидкими аминами. Применение слабоосновных аминов, или использование солевых растворов с очень слабой щелочной реакцией, упрощается тем обстоятельством, что высвобождение диоксида углерода (СО2) стимулируется присутствием воды.
В общем, извлечению диоксида углерода (СО2) из сильноосновной ионообменной смолы очень сильно способствует то обстоятельство, что движущей силой высвобождения диоксида углерода (СО2) является присутствие воды в жидкой или парообразной форме. Если вода имеет низкую щелочность, выделяемый диоксид углерода (СО2) высвобождается из воды в окружающее газовое пространство, где он может быть утилизирован в последующих стадиях обработки. Способ, в котором скорее используют водяной пар, нежели жидкую воду, для увлажнения поверхностей смолы, имеет дополнительное преимущество в том, что в нем для создания колебания влажности можно употреблять морскую воду или иным образом загрязненную воду. Сокращается не только потеря воды при последующем высушивании смолы, но из экономических соображений применение соленой воды или прочих форм так называемой «серой» (оборотной) воды оказывается выгодным благодаря снижению расходов на потребление воды.
В случае, когда колебание индуцируют водяным паром, диоксид углерода (СО2) будет высвобождаться в газовую фазу, и тем самым возникает необходимость улавливать его оттуда другими способами. Для такого извлечения есть несколько вариантов. Первый состоит в употреблении вторичного сорбента, который можно выбрать из широкого ассортимента. Преимущественным является применение сорбента, который связывает диоксид углерода (СО2) более слабо, чем это делает сухая смола. В общем это возможно, поскольку присутствие воды в жидкой или парообразной форме значительно повышает равновесное парциальное давление диоксида углерода (СО2) и тем самым снижает минимальную требуемую энергию связывания второго сорбента. На основании экспериментальных данных, колебание водосодержания или влажности обусловливает использование второго сорбента, действующего при парциальном давлении диоксида углерода (СО2), которое значительно превышает 50 миллибар (5 кПа). Вторые сорбенты, которые не нуждаются в непосредственном контакте со смолами, могут включать, но не ограничиваются таковыми, еще одну смолу, например, слабоосновную смолу, раствор жидкого амина, щелочной солевой раствор с частичным содержанием карбоната и/или бикарбоната или без такового, слои активированного угля, слои цеолита и т.д.
Для удовлетворения вышеописанных потребностей настоящее изобретение описывает способ и установку в нескольких вариантах исполнения с использованием способа улавливания диоксида углерода (СО2).
В одном аспекте настоящее изобретение, которое в одной серии вариантов исполнения включает приведение газового потока, который содержит диоксид углерода (СО2), в контакт со смолой, чтобы полностью или частично насытить ее диоксидом углерода (СО2), увлажнение смолы жидкой водой или водяным паром, чтобы инициировать частичное высвобождение абсорбированного диоксида углерода (СО2), улавливание водяного пара и диоксида углерода из смолы для извлечения диоксида углерода (СО2) из потока газа, и отделение диоксида углерода от водяного пара одним из нескольких способов. В еще одной серии вариантов осуществления увлажнение производят щелочным промывным раствором, который действует как сорбент диоксида углерода (СО2), в котором вода в растворе стимулирует высвобождение из смолы диоксида углерода (СО2), который затем поглощается промывным раствором или содержится в таковом благодаря его щелочности.
Настоящее изобретение представляет несколько материалов субстратов, которые повышают эффективность улавливания диоксида углерода смолой и высвобождение диоксида углерода в воду. Для стимулирования и ускорения процесса к воде может быть добавлена карбоангидраза. Смола может быть альтернативно увлажнена влажным воздухом или водяным паром или жидкой водой. Эксперименты показали, что в создании покрытых жидкостью поверхностей необходимости нет. В одном варианте осуществления процесс проводят в вертикальной башенной установке.
В еще одном аспекте способ согласно настоящему изобретению может включать применение вторичных сорбентов, таких как слабоосновный жидкий амин или гидрофобный активированный уголь, чтобы способствовать связыванию диоксида углерода (СО2) и отделению водяного пара. Вторичными сорбентами, которые не загрязняют или иным образом не повреждают первичный полимерный сорбент, можно напрямую вымывать диоксид углерода (СО2) из смолы.
Настоящее изобретение также представляет способ, в котором ионообменную смолу помещают во множество камер, соединенных последовательно, в которых указанная первая камера содержит смолу, которая была насыщена диоксидом углерода из газового потока наиболее недавно, и каждая последующая камера содержит смолу, которая была увлажнена, и диоксид углерода, собранный в течение более продолжительного периода времени, нежели в предшествующей камере, и так далее, вплоть до последней камеры. Многочисленные камеры соединены множеством вентилей, которые обеспечивают возможность использовать любую из множества камер в качестве указанной первой камеры.
Еще один аспект настоящего изобретения включает геометрические формы коллектора, которые будут обеспечивать возможность изменения от больших величин порового пространства для обмена «твердое тело-газ» и до меньших значений порового пространства для обмена «твердое тело-водяной пар» и «твердое тело-жидкость». Изменение будет достигаться либо регулированием размера пор, либо применением структур, которые имеют поры более чем одного размера. Сюда входят также системы с фиксированной величиной пор.
В еще одном дополнительном аспекте настоящее изобретение включает способ улавливания диоксида углерода (СО2), в котором функционализированную среду промывают основным раствором, создавая выходной поток с высокой концентрацией карбоната или бикарбоната. Выходной поток может быть затем направлен, например, в электродиализную ячейку, в которой отделяется диоксид углерода (СО2).
Далее признаки и преимущества настоящего изобретения будут очевидными из нижеследующего подробного описания с привлечением сопроводительных чертежей, в которых
Фиг. 1 представляет иллюстрацию процесса ионного обмена в соответствии с прототипом;
Фиг. 2 схематически показывает ковалентные связи в ионообменной смоле в соответствии с прототипом;
Фиг. 3 схематически показывает способ ионного обмена для улавливания диоксида углерода (СО2) в соответствии с настоящим изобретением, в котором для высвобождения диоксида углерода (СО2) из смолы добавляют воду;
Фиг. 4 схематически показывает способ с использованием слабоосновного жидкого амина для улавливания диоксида углерода (СО2) в соответствии с настоящим изобретением;
Фиг. 5 схематически показывает способ ионного обмена для улавливания диоксида углерода (СО2) в соответствии с одним вариантом осуществления настоящего изобретения, в котором используют расположенные последовательно многочисленные камеры;
Фиг. 6 схематически показывает способ ионного обмена для улавливания диоксида углерода (СО2), где для регулирования потока между камерами используются вентили в соответствии с настоящим изобретением;
Фиг. 7 схематически показывает способ ионного обмена для улавливания диоксида углерода (СО2), в котором применяют активированный уголь в соответствии с одним вариантом осуществления настоящего изобретения;
Фиг. 8 представляет чертеж, показывающий вертикальные цилиндрические колонны в соответствии с настоящим изобретением;
Фиг. 9А и 9В представляют чертежи, показывающие спиральные геометрические формы в регулируемом коллекторе соответственно одному варианту осуществления настоящего изобретения;
Фиг. 10А и 10В представляют чертежи, показывающие геометрическую структуру из плоских листов в регулируемом коллекторе соответственно одному варианту осуществления настоящего изобретения;
Фиг. 11А и 11В представляют чертежи, показывающие складной коллектор соответственно одному варианту осуществления настоящего изобретения;
Фиг. 12А-12F представляют чертежи, показывающие фиксированную геометрическую структуру коллектора соответственно другим вариантам осуществления настоящего изобретения;
Фиг. 13 представляет схематическое изображение установки согласно настоящему изобретению, имеющей электродиализную ячейку соответственно одному варианту осуществления настоящего изобретения; и
Фиг. 14 представляет схематическое изображение установки согласно настоящему изобретению, имеющей электродиализную ячейку соответственно альтернативному варианту осуществления настоящего изобретения.
Настоящее изобретение основывается на использовании колебания равновесного давления диоксида углерода (СО2) при изменении уровней содержания влаги, при изменении температуры и при изменении давления. Комбинация этих изменений открывает ряд подходов к извлечению диоксида углерода (СО2) из смолы, контактирующей с воздухом. Установка, представленная в настоящем описании, способна удалять диоксид углерода из окружающего воздуха в широком диапазоне условий, она также способна удалять диоксид углерода из других газовых смесей. В то время как вариант исполнения предпочтителен для использования при низких концентрациях диоксида углерода (СО2) (то есть менее чем 1%), можно также извлекать диоксид углерода из газовых смесей, которые содержат диоксид углерода (СО2) в количестве, варьирующем от 1% до 98%.
Авторы настоящего изобретения нашли, что сухая ионообменная смола, контактирующая с окружающим воздухом, может абсорбировать диоксид углерода (СО2) и спустя некоторое время достигает равновесного насыщения, которое пропорционально парциальному давлению диоксида углерода (СО2) в воздухе. Вместо воздуха могут быть также использованы подобные газовые смеси с низкими парциальными давлениями диоксида углерода (СО2), варьирующими от 1 до 200000 миллионных долей (м.д., ppm). В случае, когда смолу подвергали воздействию окружающего воздуха с количеством около 400 ppm диоксида углерода (СО2) в смеси, можно увлажнить контактирующий с воздухом материал смолы и извлечь диоксид углерода (СО2) при парциальном давлении, например, 80000 ppm или более. Таким образом, присутствие влаги весьма сильно повышает равновесное парциальное давление диоксида углерода (СО2) над смолой. В результате можно промыть смолу водой и уловить диоксид углерода (СО2) из газа, который контактирует с водой. Альтернативно, можно уловить диоксид углерода (СО2) из водного раствора, который абсорбирует диоксид углерода (СО2) благодаря тому, что он имеет щелочность, необходимую для связывания диоксида углерода (СО2), который высвободился из смолы. Щелочность может быть обеспечена в форме растворов гидроксидов (например, NaOH или КОН), она может быть создана в форме карбонатных растворов, например, Na2CO3, К2СО3, или даже смесей карбонатных и бикарбонатных растворов, которые имеют меньшее содержание бикарбонатов, чем то, которое может быть достигнуто при контакте со смолой, подвергнутой воздействию воздуха.
Авторы настоящего изобретения также экспериментально показали, что достаточно подвергнуть ионообменные смолы воздействию воздуха с повышенной влажностью, нежели непосредственно вводить ее в контакт с жидкой водой, и обусловить этим значительное высвобождение диоксида углерода (СО2) из смолы. Эксперименты показали, что равновесное парциальное давление диоксида углерода (СО2) над смолой, которая по своему содержанию диоксида углерода (СО2) пришла в равновесие с окружающим воздухом, приближенно является функцией скорее абсолютной влажности, нежели относительной влажности в системе. На самом деле парциальное давление диоксида углерода (СО2) над смолой не испытывает существенных изменений при колебаниях температуры, но является весьма чувствительным к изменению абсолютной влажности газа, с которым смола контактирует.
Эксперименты также показали, что воздействие водяного пара при определенном давлении может стимулировать высвобождение диоксида углерода (СО2) из смолы даже при отсутствии других составных частей воздуха, например, таких, как кислород и азот. Поэтому в одном аспекте изобретения авторы такового загрузили материал смолы в картридж или иным образом поместили в камеру, которую можно вакуумировать перед приведением ее содержимого в контакт с водяным паром и/или жидкой водой.
В одном аспекте изобретения авторы такового подвергли смолу воздействию воздуха в разнообразных геометрических структурах и компоновках. После того как смола была насыщена или частично насыщена диоксидом углерода (СО2) из воздуха и тем самым пришла в равновесие с парциальным давлением диоксида углерода (СО2), которое составляет менее 400 ppm, авторы настоящего изобретения высвободили диоксид углерода (СО2) в газовое пространство, в котором парциальное давление диоксида углерода (СО2) может достигать 50000 микробар (5 кПа) или более.
Авторы настоящего изобретения в некоторых патентных заявках, поданных ими ранее, описали применение сильноосновной смолы Типа 1 и Типа 2, функционализированной аминами с образованием третичных аминных и четвертичных аммониевых производных для абсорбирования диоксида углерода (СО2) из воздуха. Как описано в таковых, диоксид углерода (СО2) поглощается и удерживается в смоле как карбонат или бикарбонат. Более конкретно, как описано в Патентной Заявке США 11/866,326, существенным признаком этих сильноосновных смол является то, что они абсорбируют гораздо больше диоксида углерода (СО2), когда они являются сухими, нежели когда они увлажнены. В то время как работоспособность зависит от влажности воздуха, температуры смолы и состояния насыщения смолы диоксидом углерода (СО2), авторы настоящего изобретения обнаружили, что равновесное парциальное давление над увлажненной смолой примерно в 200 раз выше, чем над сухой смолой, при сходном уровне насыщения диоксидом углерода (СО2). Например, авторы настоящего изобретения нашли, что смола, которая в своем сухом состоянии была подвергнута воздействию сухого окружающего воздуха, после обработки водой может наполнить небольшое воздушное пространство диоксидом углерода (СО2) с парциальным давлением, превышающим 60 мбар (60000 микробар) (6 кПа). Смола, которая находится в равновесии с раствором карбоната/бикарбоната натрия, который, в свою очередь, находится в равновесии с диоксидом углерода (СО2) в воздухе, связывает лишь слегка больше чем один атом углерода в составе карбонатного или бикарбонатного иона на каждые два положительных заряда на поверхности смолы. С другой стороны, если смола приведена в равновесие с имеющим низкую влажность воздухом при отсутствии жидкой воды, число углеродсодержащих ионов, приходящихся на связанный ион, достигает единицы. Это свойство смолы может быть использовано для достижения колебания давления, обусловленного влажностью, в целях улавливания и накопления диоксида углерода.
По мере повышения влажности воздуха равновесное парциальное давление диоксида углерода (СО2) над матрицей резко возрастает. Например, авторы настоящего изобретения протестировали образец смолы весом 6 г из материала анионообменной мембраны, производимого фирмой SnowPure, LLC, Сан-Клементе, Калифорния1. (Сноска [1]: Изготовитель описывает свой материал как включающий измельченный анионообменный полимер, примешанный к полипропиленовой матрице и экструдированный в виде листа согласно указаниям Патентов США № 6503957 и 6716888). Мембрану разрезали на «похожие на лапшу» пряди толщиной 1 мм и шириной 1 мм. Количество этого материала, которое при 3 частях на тысячу (ppt) воды в атмосфере при комнатной температуре находится в равновесии с диоксидом углерода (СО2), парциальное давление которого составляет 40 ppm, может повысить парциальное давление диоксида углерода (СО2) в стеклянном колпаке емкостью 20 литров до уровня выше 1200 ppm, когда содержание водяного пара в воздухе возрастает до 30 частей на тысячу (ppt). Далее, мембранный материал весом 10 г, из которого было высвобождено приблизительно 100 см3 диоксида углерода (СО2), абсорбировал еще 100 см3 диоксида углерода (СО2) после высушивания, и затем в первом цикле высвобождения диоксида углерода (СО2) после увлажнения довел содержание диоксида углерода (СО2) в стеклянном колпаке до 3700 ppm. Таким образом, оказывается, что высушенный материал смолы перегруппировывается, размещая в себе бикарбонатные ионы более эффективно, нежели карбонатные ионы. Благодаря этому отчетливому колебанию способности поглощать углерод оказалось достаточным всего лишь повысить влажность воздуха над смолой, чтобы побудить смолу высвобождать диоксид углерода (СО2), который был абсорбирован.
Без намерения вдаваться в какую-нибудь теорию, представляется, что смола по мере высушивания перегруппировывается, по меньшей мере частично, в пользу размещения скорее бикарбонатных ионов, нежели карбонатных ионов. Однако авторы настоящего изобретения наблюдали, что скорость поглощения диоксида углерода (СО2) постепенно снижается по мере роста насыщения. Нет какой-то резкой границы между карбонатно-гидроксидным и карбонатно-бикарбонатным режимами для сухих смол, наводящей на мысль, что механизм поглощения не изменяется, когда система переходит из одного состояния с остаточными гидроксид-ионами в другое с остаточными карбонатными ионами. Одно возможное объяснение заключается в том, что в более или менее сухой системе карбонатные ионы могут преобразовываться с диссоциацией на бикарбонатные ионы и гидроксид-ионы, даже если в водном растворе равновесие этой реакции сильно сдвинуто в сторону карбонатов за счет бикарбонатов. Один возможный способ выявить это состоит в том, что бикарбонатные ионы будут осаждаться на поверхности смолы гораздо легче, чем карбонатные ионы, и тем самым они могли бы удалять часть карбоната из раствора в форме бикарбонатов. Во всяком случае, эффективное значение рН на поверхности представляется более высоким, чем если бы оно определялось содержанием диоксида углерода в водной системе.
Благодаря этому явно выраженному колебанию способности поглощать углерод, в принципе, достаточно повысить влажность воздуха над смолой, чтобы побудить смолу высвобождать диоксид углерода (СО2), который был абсорбирован. Одна возможность состоит в погружении смолы в воду, чтобы высвободить диоксид углерода (СО2). Этот способ показан на фиг. 3. Само по себе кратковременное увлажнение материала может оказаться недостаточным для выделения большей части связанного диоксида углерода (СО2). Высвобождение диоксида углерода (СО2) из материала постоянно продолжается в течение продолжительного времени, но по большей части происходит выделение диоксида углерода (СО2), который может быть связан с поверхностью смолы. Еще один вариант осуществления настоящего изобретения предусматривает воздействие воздуха на увлажненную смолу, в противоположность погружению смолы на всем протяжении выделения диоксида углерода (СО2). Поскольку время является основным ограничением для этой конструкции, рекомендуется, чтобы установка была относительно крупной и позволяла удалять газ из ее объема в течение продолжительного периода времени.
Работа в условиях неглубокого вакуума, где азот и кислород воздуха фактически были удалены из системы, не замедляет кинетику процесса. Возможно, это обусловлено генерированием потока газа из увлажненного материала смолы, который представляет собой смесь водяного пара и диоксида углерода (СО2), которые выделились из смолы. Парциальное давление последнего может достигать 60 миллибар (6 кПа). Парциальное давление первого будет зависеть от температуры, но должно составлять около 30 миллибар (3 кПа) или менее. Компоновка системы должна быть рассчитана на дросселирование течения таким образом, чтобы медленное высвобождение диоксида углерода (СО2) могло продолжаться при удерживании системы в условиях, близких к равновесным. Если откачивать диоксид углерода (СО2) слишком быстро, кинетические характеристики быстрого выделения водяного пара будут изменять отношение выделяемого диоксида углерода (СО2) к образующемуся водяному пару в пользу высвобождения водяного пара. Это привело бы к охлаждению системы, обусловливая необходимость подведения дополнительной теплоты. Если воду улавливать в конденсационной ловушке, то энергия для охлаждения будет быстро расти. Поэтому важно сохранять систему вблизи состояния равновесия, которое обеспечивает максимально допустимый расход потока.
В условиях обезвоженного атмосферного воздуха диоксид углерода (СО2) поглощается из воздуха. Как только смола достигает высокого уровня насыщения, в котором она по существу преобразуется из своей карбонатной формы в насыщенную бикарбонатную форму, материал смолы помещают в камеру, которая предварительно вакуумирована, и затем наполняют водяным паром и жидкой водой, которую перемешивают до состояния, в котором все поверхности смолы всецело увлажнены. Альтернативно, смолу можно привести в контакт только с водяными парами. Однако скорость выделения диоксида углерода (СО2) из смолы является гораздо более высокой, когда смола смочена, нежели когда она просто соприкасается с водяными парами. Действительно, повышается не только скорость выделения, но растет и парциальное давление диоксида углерода (СО2).
Авторы настоящего изобретения нашли, что может быть полезным добавление небольших количеств карбоангидразы к воде, чтобы улучшить кинетические характеристики реакции в процессе переноса диоксида углерода (СО2) из смолы в воду и в окружающую газовую среду. В некоторых конструкциях может быть преимущественным начинать с помещения насыщенного диоксидом углерода (СО2) материала смолы в контейнер, который предварительно вакуумирован для удаления избыточного воздуха. Затем смолу увлажняют так, чтобы она высвобождала диоксид углерода (СО2). Это ведет к созданию давления диоксида углерода (СО2) в камере на уровне 50 мбар (5 кПа), к каковому добавляются от около 20 до 30 мбар (2-3 кПа) давления водяного пара (Н2О). Содержание воды можно изменить повышением и понижением температуры в системе.
Теперь можно откачивать полученный газ из системы, и по мере сжатия газа вода в газе будет конденсироваться, тогда как диоксид углерода (СО2) становится все более и более сжатым. В конечном итоге можно довести давление до уровня давления в трубопроводе для диоксида углерода (СО2). Если желательно, диоксид углерода (СО2) можно осушить перед закачиванием в баллон или отправкой его потребителю.
Хотя увлажнение материала смолы обеспечивает возможность высвобождения диоксида углерода (СО2) из смолы, это высвобождение является относительно медленным. Кратковременное увлажнение самого материала недостаточно для выделения большей части связанного диоксида углерода (СО2). Однако авторы настоящего изобретения обнаружили, что высвобождение диоксида углерода (СО2) из материала постоянно продолжается в течение продолжительного времени, но по большей части происходит выделение диоксида углерода (СО2), который может быть связан с поверхностью смолы.
В эксперименте, выполненном с использованием 6 г материала мембраны, нарезанного на ленточки, и после 15 минут промывания смолы деминерализованной (DI) водой, смола все еще могла выделять диоксид углерода (СО2) и повышать содержание диоксида углерода (СО2) в замкнутой системе контейнера в виде колпака до уровня около 1200 ppm. Будучи оставленной лежать в течение ночи, но с возможностью высыхать, смола вновь поглотила весь этот диоксид углерода (СО2) и затем еще некоторое количество, понизив содержание диоксида углерода (СО2) в колпаке-контейнере до уровня около 40 ppm. Повышение влажности в колпаке-контейнере до 30 ppm привело к выделению диоксида углерода (СО2), которое достигло уровня около 1400 ppm. Высвобождение этого диоксида углерода (СО2) и промывание ленточек смолы деминерализованной (DI) водой привело бы к гораздо более быстрому выделению диоксида углерода (СО2), которое повысило бы давление в колпаке до уровня около 1800 ppm. Второй эксперимент привел к значению, существенно превышающему 1100 ppm, и в третьем все еще было достигнуто значение 700 ppm. В целом система высвободила по меньшей мере 1000+1400+500+300~3300 ppm. В пересчете это составляет приблизительно 66 см3 диоксида углерода (СО2), или около 2/3 емкости поглощения диоксида углерода (СО2), который был первоначально собран промытой карбонатом мембраной. Общая емкость материала мембраны могла бы составлять около 6 миллимолей, или около 120 см3. В результате представляется, что чистая вода как таковая может вызывать сильное колебание связывания диоксида углерода (СО2) матрицей. Неясно, сколько диоксида углерода (СО2) выделилось из матрицы во время цикла промывания вне стеклянного колпака. Пока система провела несколько минут в воде, могло бы высвободиться значительное количество диоксида углерода (СО2). Данные, полученные в конце эксперимента, наводят на мысль, что скорость выделения диоксида углерода (СО2) несколько снижается во время цикла промывания, по-видимому, поскольку в цикле промывания дополнительное количество диоксида углерода (СО2) было удалено с несколько более высокой скоростью. Однако общее количество диоксида углерода (СО2), которое было удалено во время цикла промывания, ограничено относительно малой величиной, если учесть, сколько было выделено в промежуточные периоды неподвижного состояния.
Скорость декарбонизации материала мембраны, когда таковая находится в воде, не измеряли. Однако наблюдалось, что карбоангидраза оказывала незначительное действие на скорость высвобождения диоксида углерода (СО2) из увлажненной мембраны, что позволяет предположить, что медленной стадией процесса является выделение диоксида углерода (СО2) из мембраны.
Альтернативно, как показано в Фиг. 4, авторы настоящего изобретения могут извлекать диоксид углерода (СО2) из газового потока с использованием других схем отделения, таких как слабоосновный жидкий амин для стадии вторичной абсорбции. Этот амин должен быть способен снижать содержание диоксида углерода (СО2) в газовой смеси так, что парциальное давление диоксида углерода (СО2) падает, например, до значения около 20-30 мбар (2-3 кПа). Это может быть гораздо более слабый сорбент, чем первичная смола, которую авторы настоящего изобретения используют для улавливания диоксида углерода (СО2), и это позволяет авторам настоящего изобретения употреблять очень слабоосновные амины, или смолы на основе слабоосновных аминов. В случае, когда смола повреждена в результате промывания смолы, можно пустить поток промывного амина поверх других поверхностей, которые благодаря увлажнению смолы могут абсорбировать значительное количество диоксида углерода (СО2).
В еще одном дополнительном варианте осуществления изобретения авторы такового могли использовать такой же тип смолы, как в устройстве для улавливания из воздуха, но работали на ином уровне кривой насыщения. Эту смолу оставляли увлажненной и для удаления диоксида углерода (СО2) подвергали воздействию переменной температуры.
В то время как высокое содержание водяного пара или влаги в воздухе должно быть достаточным для высвобождения диоксида углерода (СО2), авторы настоящего изобретения могли использовать жидкую воду для выделения диоксида углерода (СО2). Однако применение скорее водяного пара, нежели жидкой воды, может сократить износ и повреждение смолы. В этом плане также возможно употребление воды, которая содержит соли или прочие примеси.
Обычно является преимущественным удаление избыточного водяного пара из смеси диоксида углерода (СО2) с парами воды путем сжатия газа, чтобы водяной пар пришел в состояние пересыщения и сконденсировался. Однако можно удалять воду с использованием охлажденной ловушки, после, которой, в принципе могла бы следовать вторая охлаждаемая ловушка для диоксида углерода (СО2). Этот способ представляет особенный интерес, если конденсация воды может, по меньшей мере частично, сопровождаться охлаждением нагретой смолы обратно до более низких температур окружающей среды. Если установка первоначально действует с использованием оборотной воды или морской воды, конденсация воды будет создавать отдельный поток чистой воды, которую можно было бы отводить в качестве побочного продукта.
Существует ряд способов сокращения водопотребления. Например, можно посылать водяной пар через смолу короткими импульсами, регулируя импульсы так, чтобы они были слишком короткими для глубокого проникновения водяного пара в смолу, но достаточными для пульсирующего высвобождения диоксида углерода (СО2) с поверхности смолы. Впоследствии диффузия изнутри смолы будет перераспределять внутреннее насыщение смолы, и импульсы подачи водяного пара могут быть повторены несколько раз, пока общее содержание диоксида углерода (СО2) не снизится в значительной степени.
Большая часть диоксида углерода (СО2), который был собран на сухой смоле, может быть удалена вновь либо воздействием на сухую смолу воздухом, насыщенным влагой, либо погружением в жидкую воду. В частности, в варианте осуществления, который касается колебания водосодержания, износ и повреждение материала малы, и материал может выдерживать много циклов такого колебания водосодержания. Амплитуда колебания может охватывать вплоть до половины потенциальной емкости смолы в отношении диоксида углерода (СО2), но практические реализации могут быть ориентированы на слегка меньшие колебания степени насыщения.
Если оценивать мембрану округленными числами, скорость высвобождения составляет около 1 миллимоля диоксида углерода (СО2) для 10 г образца в течение 15 минут, или около 1×10-4 миллимоля/г/сек. Поскольку для материала, который использовали авторы настоящего изобретения, макроскопическая площадь поверхности составляет около 40 см2/г, авторы настоящего изобретения получили скорость выделения на уровне 2,5×10-5 моля/м2/сек. Скорости поглощения являются сравнимыми, хотя обычно проявляются слегка более медленными. Это также означает, что 50 г образца будут производить около 0,1 см3/сек, или около 100 см3 газа в течение примерно 15 минут.
Из теоретических соображений, кинетические параметры течения процесса не замедляются при работе в условиях неглубокого вакуума, где азот и кислород воздуха были по существу удалены из системы. Эксперименты подтвердили это наблюдение. В условиях пониженного давления можно генерировать газовый поток из увлажненного материала смолы, который по существу представляет собой смесь водяного пара в равновесии с температурой в камере, и диоксида углерода (СО2), который выделяется из смолы. Давление диоксида углерода (СО2) в камере может составлять до 60 миллибар (6 кПа), но быстро падает по мере снижения степени насыщения смолы диоксидом углерода (СО2). При комнатной температуре парциальное давление водяного пара составляет около 30 миллибар (3 кПа). Можно поднять парциальное давление водяного пара в камере путем повышения температуры. В самом деле, это создает гибридную систему, которая сочетает колебания влажности/водосодержания с колебанием температуры. В системе, которая была нагрета, можно снизить давление водяного пара охлаждением выходного потока относительно температуры окружающей среды. Тем самым концентрация водяного пара в камере будет снижена до равновесного давления при температуре окружающей среды.
Поскольку на высвобождение диоксида углерода (СО2) из смолы до достижения равновесия с окружающим газом затрачивается продолжительное время, внутреннее устройство системы должно быть рассчитано на дросселирование потока таким образом, чтобы медленное высвобождение диоксида углерода (СО2) могло поддерживать систему вблизи условий равновесного парциального давления диоксида углерода (СО2). Если потоку позволить протекать слишком быстро, то быстрая кинетика выделения водяного пара будет изменять отношение высвобождающегося диоксида углерода (СО2) к возникающему водяному пару в пользу избыточного выделения воды. Это могло бы обусловливать чрезмерное охлаждение системы и тем самым привело бы к необходимости дополнительного подведения теплоты. Если воду удаляют с помощью конденсационной ловушки, то энергия, затрачиваемая на охлаждение газового потока, будет быстро нарастать, если отношение водяного пара к диоксиду углерода (СО2) в газовой смеси становится неблагоприятным. Пригодным отношением диоксида углерода (СО2) к воде в смеси является отношение 1:1. Это предпочтительно для поддержания системы вблизи точки равновесия, что соответствует приемлемому максимальному расходу потока.
Вода может быть удалена из этой смеси с низким давлением несколькими способами. Первый состоит в охлаждении газа для конденсации воды. Пока температура системы держится выше температуры окружающей среды, это практически не требует расхода энергии, но энергопотребление становится серьезным, если конденсация происходит в условиях, где температура является более низкой, чем в окружающей среде. Один путь избежать этого состоит в сжатии газовой смеси «Н2О/СО2». Когда парциальное давление водяного пара (Н2О) повышается, это будет стимулировать конденсацию при температурах выше условий окружающей среды, и тем самым можно удалить воду с предельно низкими затратами энергии. Действительно, в одной серии вариантов осуществления можно инициировать конденсации при температурах выше (повышенной) рабочей температуры в камере и тем самым компенсировать существенную долю потребной для этого теплоты, используя теплоту конденсации. На самом деле система действует с помощью эффективного теплового насоса, который переносит теплоту конденсации в систему при повышенных температурах.
На основе этих условий авторы настоящего изобретения разработали систему колебания водосодержания (или влажности), где в сухих условиях диоксид углерода (СО2) захватывается из воздуха. Из экспериментальных результатов оказалось, что уровень влажности главным образом характеризуется абсолютной влажностью, но не относительной влажностью. Это основывается на том наблюдении, что при постоянной абсолютной влажности содержание диоксида углерода (СО2) в замкнутом стеклянном колпаке, где воздух находится в контакте со смолой, не изменялось, когда температура повышалась от значения, близкого к точке росы, до более высоких температур, например, выше на 10-20°С. С другой стороны, изменение влажности вызывало бы сильное колебание равновесного содержания диоксида углерода (СО2). Этот результат позволяет предположить, что цикл «влажный-сухой» также возможен во влажном/холодном климате, а также в климате пустыни. Когда смола достигает высокой степени насыщения, которая в сухом климате означает, что она по существу переведена из своей карбонатной формы в полностью бикарбонатную форму, материал смолы загружают в камеру, которая предварительно была вакуумирована, и затем заполняют таковую водяным паром и/или жидкой водой, которую перемешивают до момента, когда все поверхности смолы основательно увлажняются. Затем система высвобождает диоксид углерода (СО2), и, при наличии достаточного количества материала в камере, система может достичь давления диоксида углерода (СО2), которое превышает давление водяного пара в камере. Чтобы создать такое высокое давление диоксида углерода (СО2) (от около 30 до 60 миллибар (3-6 кПа)), может быть предусмотрена цепочка камер, как на фиг. 5, которые насыщены водяным паром при условиях, близких к условиям окружающей среды (около 30 миллибар (3 кПа) водяного пара), но при переменных температурах так, что давление насыщенного водяного пара падает от конца выше по потоку (где водяной пар поступает, до конца ниже по потоку, где диоксид углерода (СО2) и водяной пар удаляются). В этой системе поток газа поддерживается постольку, поскольку водяной пар и диоксид углерода (СО2) выводятся на конце цепочки, расположенном ниже по потоку. Последняя камера в цепочке содержит смолу, которая только что была возвращена из стадии насыщения воздухом, которая способна выводить парциальное выделение диоксида углерода (СО2) на уровень, столь же или даже более высокий, чем давление водяного пара. Камеры, расположенные выше по потоку, содержат смолы, которые в течение более длительного времени были подвергнуты воздействию теплой влажной окружающей среды.
Камеры предпочтительно будут почти нацело заполнены материалом смолы, поскольку, чем больше поровый объем, тем труднее будет достигнуть высокого парциального давления диоксида углерода (СО2) в системе. Камеры могли бы физически перемещаться в цепочке, когда новую смолу добавляют на конце для выхода газа, и смолу, обедненную диоксидом углерода (СО2), удаляют на другом конце. Вместо того чтобы передвигать отдельные камеры или менять картриджи, которые можно было бы вставлять в эти камеры, авторы настоящего изобретения могут также изменять порядок переключения вентилей для камер. В этом подходе каждая камера может быть либо соединена со своей соседкой ниже по потоку, либо может представлять собой систему конечной экстракции. Каждая камера на своей входной стороне также могла бы быть соединена с соседней камерой выше по потоку или с источником водяного пара и входным патрубком для газа продувки. Есть возможность перекрыть вентили одного блока, опорожнить и вновь заполнить его и вновь открыть вентили, так что по существу он теперь будет составлять другой конец цепочки. Этим путем смолы могут перемещаться по цепочке, даже не сдвигаясь с места.
Если только диоксид углерода (СО2) не абсорбируется из потока, оставляя водяной пар незатронутым, или если оба газообразных компонента просто не выкачиваются и сжимаются, водяной пар может быть сконденсирован для отделения его от потока диоксида углерода (СО2). Конденсация может происходить на выходном конце цепочки, или, более вероятно, в промежуточных камерах, где температура падает от камеры к камере, приводя к все более низким давлениям водяного пара по мере протекания газового потока. Конденсация водяного пара будет формировать течение в сторону конца системы с низким давлением.
Ниже по потоку относительно последней камеры диоксид углерода (СО2) может быть удален с помощью конденсации/сублимации при предельно низких температурах (между -80°С и -100°С), или с помощью нагнетательных насосов, которые перемещают газ в еще один резервуар, находящийся под высоким давлением. Альтернативно, диоксид углерода (СО2) может быть удален с использованием сорбента, такого как холодный жидкий метанол, жидкие амины или карбонат натрия. Другие варианты включают гидрофобные сорта активированного угля.
С привлечением Фиг. 6, в одиночной камере с 6 г анионообменного материала SnowPure и после 15-минутного промывания смолы в деминерализованной (DI) воде, смола все еще может выделять диоксид углерода (СО2) и повышать содержание диоксида углерода (СО2) в системе до уровня около 1200 ppm. Будучи оставленной лежать в течение ночи, но с возможностью высыхать, смола вновь поглотила весь этот диоксид углерода (СО2) и затем еще некоторое количество, понизив содержание диоксида углерода (СО2) в контейнере до уровня около 40 ppm. Повышение влажности в контейнере до 30 ppm привело к выделению диоксида углерода (СО2), которое достигло уровня около 1400 ppm. Высвобождение этого диоксида углерода (СО2) и промывание ленточек смолы деминерализованной (DI) водой ведет к гораздо более быстрому выделению диоксида углерода (СО2), которое повышает давление в колпаке до уровня около 1800 ppm. Повторный эксперимент привел к значению, существенно превышающему 1100 ppm, и в третьем повторении все еще было достигнуто значение 700 ppm. В целом система высвободила приблизительно 3300 ppm. В пересчете это составляет приблизительно 66 см3 диоксида углерода (СО2), или около 2/3 емкости поглощения диоксида углерода (СО2), который был первоначально собран промытой карбонатом мембраной. Общая емкость материала мембраны составляет около 6 миллимолей, или около 120 см3. В результате представляется, что чистая вода как таковая может вызывать сильное колебание связывания диоксида углерода (СО2) матрицей. Неясно, сколько диоксида углерода (СО2) выделилось из матрицы во время цикла промывания вне измерительной системы стеклянного колпака. Пока система провела несколько минут в воде, где могло бы высвободиться значительное количество диоксида углерода (СО2), данные, полученные в конце эксперимента, наводят на мысль, что скорость выделения диоксида углерода (СО2) несколько снижается во время цикла промывания, по-видимому, поскольку в цикле промывания дополнительное количество диоксида углерода (СО2) было удалено с несколько более высокой скоростью. Однако общее количество диоксида углерода (СО2), которое было удалено во время цикла промывания, ограничено относительно малой величиной, если учесть, сколько было выделено в промежуточные периоды неподвижного состояния.
Если оценивать мембрану округленными числами, скорость высвобождения составляет около 1 миллимоля диоксида углерода (СО2) для 10 г образца в течение 15 минут, или около 1×10-4 миллимоля/г/сек. Для материала, имеющего макроскопическую площадь поверхности около 40 см2/г, авторы настоящего изобретения получили скорость выделения на уровне 2,5×10-5 моля/м2/сек. Скорости поглощения являются сравнимыми, хотя обычно проявляются слегка более медленными. Эксперименты также показали, что 50 г образца будут производить около 0,1 см3/сек, или около 100 см3 газа в течение примерно 15 минут.
Конструкционный признак заключается в том, что предусмотрен ряд камер в этой последовательности. Смолы в различных камерах были вовлечены в процесс дегазирования с периодами времени различной продолжительности. Смолы могут перемещаться из камеры в камеру, или, более вероятно, можно переключать вентили, чтобы отсоединить камеру от продутого конца в цепочке, извлечь ее содержимое и заполнить ее смолой, которая теперь оказывается на непродутом конце цепочки. Газ в каждой камере состоит из водяного пара, диоксида углерода (СО2) и, возможно, инертного газа-носителя для продувки. Сумма трех значений парциальных давлений равномерно снижается от входного конца системы к выходному концу системы. Давление газа-носителя может быть снижено повышением скорости потока, но давление водяного пара более или менее приближено к равновесному состоянию с жидкой водой в этом месте. Давление диоксида углерода (СО2) должно нарастать в направлении продувки. Если водяной пар составляет значительную часть общего давления, то градиент давления водяного пара контролирует течение и должен определяться падением температуры от одной камеры к следующей, тогда как давление диоксида углерода (СО2) будет нарастать от одной камеры к следующей, так как каждая камера добавляет некоторое количество диоксида углерода (СО2) к потоку. Вклад каждой камеры будет ограничен скоростью, с которой материал может выделять диоксид углерода (СО2), и равновесным давлением, какового может достигнуть конкретная смола. Смола на входном конце почти полностью утратила весь свой диоксид углерода (СО2), тем самым добавляя очень мало к общему продукту; последний блок ниже по потоку, в принципе, может добавить не более 60 миллибар (6 кПа). Чтобы это произошло, входной конец либо имеет давление водяного пара, превышающее 70 миллибар (7 кПа), либо имеет место значительный вклад газа-носителя, который еще должен быть отделен от диоксида углерода (СО2).
Один такой газ-носитель, который должен быть сконденсирован и выведен из системы, мог бы представлять собой пары метанола, при допущении, что последней стадией системы является накопление диоксида углерода (СО2) в холодном метаноле. Другая альтернатива относится к воде, в каковом случае температура воды на входном конце должна быть достаточно высокой для генерирования парциального давления на уровне по меньшей мере 60 миллибар (6 кПа). Поскольку водяной пар перемещается из одной камеры к следующей, он будет попадать в среды с более низкими температурами и тем самым будет частично конденсироваться, создавая профиль давления, который побуждает весь газ протекать от конца с низким содержанием диоксида углерода (СО2) к концу системы с высоким содержанием диоксида углерода (СО2).
В одном варианте осуществления конденсируют всю оставшуюся воду и затем откачивают наружу диоксид углерода (СО2). Другие варианты осуществления относятся к абсорбции диоксида углерода (СО2) и последующей регенерации сорбента. Эти сорбенты могут представлять собой холодный метанол, жидкие амины или аммиак, или карбонат натрия. Прочие варианты включают гидрофобные сорта активированного угля.
Еще одно дополнительное изобретение иллюстрировано на фиг. 7. Это изобретение основано на том наблюдении, что активированный уголь оказался способным абсорбировать диоксид углерода (СО2), будучи увлажненным, и высвобождать абсорбированный диоксид углерода (СО2) при высушивании. Это поведение является противоположным таковому для ионообменных смол. Соответственно этому, данное обстоятельство делает возможным объединить ионообменные смолы и активированный уголь в одной последовательности. Воздух протекает через систему, начиная с сухого активированного угля и увлажненных материалов смолы. По мере того, как воздух высушивает смолу, он переносит водяной пар на уголь. Смола по мере высыхания поглощает диоксид углерода (СО2), и активированный уголь поглощает диоксид углерода (СО2) по мере восприятия влаги. Как только смола становится сухой, систему реверсируют, и свежий воздух протекает через активированный уголь и высвобождает влагу с переносом обратно к ионообменным смолам. Когда уголь высыхает, он выделяет диоксид углерода (СО2), повышая парциальное давление диоксида углерода (СО2), где он может быть сконцентрирован и удален. Признак и преимущество объединения ионообменного материала и активированного угля этим путем состоят в том, что экономится вода, и для реверсирования воздушного потока требуется простая система вентилей.
Изобретение без труда поддается модифицированию. Например, вместо активированного угля могут быть использованы другие материалы, такие как цеолит.
Таким образом, очевидно, что с использованием ионообменных смол колебание влажности может быть применено для отделения и улавливания окружающего диоксида углерода (СО2). При выстраивании нескольких устройств для улавливания из воздуха друг за другом удаленный из окружающего воздуха диоксид углерода (СО2) может быть сконцентрирован.
Применение ионообменных смол для удаления диоксида углерода (СО2), самих по себе или в сочетании с активированным углем или цеолитом в последовательности, имеет то преимущество, что сильнодействующие химические вещества, такие как гидроксид натрия, в прошлом типично употреблявшиеся в скрубберах для улавливания диоксида углерода (СО2), могут быть исключены из обращения. Кроме того, с использованием колебания влажности по существу в замкнутой системе сберегается вода.
С привлечением Фиг. 8, устройство для улавливания диоксида углерода (СО2) из воздуха могло бы включать множество вертикальных цилиндрических колонн 100, содержащих материал, поглощающий диоксид углерода (СО2). Предпочтительно, но не обязательно, поглощающий диоксид углерода (СО2) материал включает чувствительный к влаге ионообменный материал, как описанный ранее. Каждая колонна 100 имеет множество входных воздушных патрубков 102, расположенных по соседству с нижним концом таковой, и множество выходных воздушных патрубков 104, соседствующих с верхним концом. Альтернативно, стенки колонн могут быть открыты, чтобы обеспечить воздуху возможность протекать через любой уровень над основанием. Воздух поступает во входные патрубки 102, где он протекает вверх в колоннах 100 в контакте с материалом, поглощающим диоксид углерода (СО2). Воздушный поток может представлять собой естественное конвективное течение, или же, если желательно, с нагнетанием от вентилятора. Входные патрубки 102 и выходные патрубки 104 могут быть по отдельности закрыты задвижками (не показаны) так, что влажность внутри колонн может быть повышена, и захваченный диоксид углерода (СО2) высвобождается из смолы и концентрируется. Альтернативно, смола может быть промыта жидкой водой для удаления захваченного диоксида углерода (СО2), который концентрируется в основании, в котором также содержится трубопроводная и вентильная система, и т.д. (не показана). Альтернативно, поглощающий диоксид углерода (СО2) материал может включать влажный сорбент, такой как амин или карбонат или другой поглотитель диоксида углерода (СО2), который закачивают и разбрызгивают или пропускают потоком вниз через материал матрицы в колонне. В предпочтительном варианте осуществления изобретения несколько колонн 100 соединены вместе подземными коммуникациями, где жидкие стоки из колонн подвергают обработке для удаления диоксида углерода (СО2) и концентрируют удаленный диоксид углерода (СО2). Возможны также и прочие изменения.
В еще одном аспекте настоящего изобретения функционализированную твердую структуру в коллекторе можно оптимизировать по условиям газообмена, парового обмена, жидкостного обмена и механическим характеристикам. Для газового обмена поровые пространства/каналы будут достаточно большими, чтобы поддерживать падение давления на низком уровне, свести к минимуму турбулентность и предотвратить утолщение приповерхностного слоя, которое препятствовало бы доступу диоксида углерода (СО2) к функциональным группам. Там, где газовый поток представляет собой окружающий воздух, например, если один литр функционального твердого материала имеет один моль центров обмена, он будет поглощать около 22,4 литра чистого диоксида углерода (СО2) до насыщения этих центров с образованием бикарбоната. Если рассматривать средний уровень поглощения как 100 частей на миллион по объему (ppmV) диоксида углерода (СО2) на объем воздуха, то для насыщения функциональных групп потребуется пропустить 224000 литров воздуха через один литр твердого материала. Это потребовало бы сокращения воздушного потока по мере насыщения твердого материала, поскольку поглощение диоксида углерода (СО2) снижается по мере насыщения.
Для парового и жидкостного обмена отношение твердого материала к поровому пространству обычно является более высоким. Например, в имеющихся в продаже на рынке системах для обработки воды слой типичной ионообменной смолы имеет поровое пространство приблизительно от 30 до 40%. Зерна имеют размер около 0,5 миллиметра, оставляя даже более мелкие промежуточные поровые пространства. Поэтому для большинства вариантов применения коллектор должен представлять собой обратимую систему с первичной и вторичной пористостью, которые различаются по размерам.
Конструкция также включает систему с фиксированной величиной пор для случаев, где в газовом, паровом и жидкостном обмене используется один и тот же размер пор, или когда механические соображения благоприятствуют системе с фиксированным поровым пространством.
В еще одном аспекте настоящее изобретение представляет усовершенствования геометрических параметров коллектора, в котором используется функционализированная твердая среда коллектора для удаления диоксида углерода (СО2) из газового потока. Поглотительная среда, к примеру, может состоять из твердого вещества, на котором или в котором иммобилизованы аминогруппы.
С привлечением фиг. 9А и 9В, настоящее изобретение представляет коллектор с регулируемым размером пор в спиральной геометрии, включающий инертный центральный вал 205 со стопорным механизмом; инертной сеткой или другой пористой средой в листовой форме 206; и функционализированной поглотительной средой в листовой форме 207. Один пористый лист и один лист поглотительной среды закреплены на валу и намотаны на него так, что ближний к центру и отдаленный от центра слои рулона состоят из пористого листа. Этим обеспечивается то, что поглотительная среда всегда сендвичеобразно размещена между пористыми листами для возможности контакта с газом, водяным паром или жидкостью на обеих сторонах листа поглотительной среды. В зависимости от диаметра рулона используются более чем одна мембрана и пористый слой, так что расширение порового пространства требует меньшего вращения центрального вала. Например, три слоя требуют поворота, втрое меньшего, чем для одного слоя.
Пористый лист создает проход для потока газа, водяного пара и/или жидкости. Этот проток может быть по структуре прямым, спиральным, извилистым, ламинарным или турбулентным. Пористый лист также определяет минимальную ширину порового пространства, которая достигается, когда рулон стягивается с уплотнением вокруг вала. Поровое пространство может быть расширено поворотом вала против направления намотки, или сужено поворотом вала в направлении намотки. Вал и пористый лист изготавливают из материалов, которые инертны в отношении потоков газа, водяного пара и жидкости, воздействию которых они подвергаются.
В альтернативном варианте осуществления, показанном в фиг. 10А и 10В, настоящее изобретение представляет коллектор с регулируемым размером пор в плосколистовой геометрии, включающий инертную сетку или другую пористую среду в листовой форме 211, или в виде сжимаемого слоя 212, и функционализированную поглотительную среду в листовой форме 213. Коллектор с плосколистовой геометрией имеет перемежающиеся слои сетки или другой пористой среды и поглотительной среды. Во время протока/обмена текучей среды слои прижимаются друг к другу для достижения наименьшей ширины проточных каналов между листами поглотительной среды. Минимальная толщина проточного канала и поровое пространство внутри этого канала определяется используемой пористой средой. Во время газового потока/обмена проточный канал может быть отрегулирован на оптимальную толщину раздвиганием листов. Оптимальная дистанция отдаления определяется скоростью обмена поглотительной среды и потока жидкости или газа, а также расходом потока жидкости и газа.
В еще одном альтернативном варианте осуществления, показанном в фиг. 11А и 11В, настоящее изобретение представляет складной коллектор, имеющий первичную и вторичную пористость. Первичную пористость оптимизируют для потока газа. Стенки каналов, используемых для потока газа, сформированы из поглотительной среды. Сама поглотительная среда имеет вторичную пористость, которая оптимизирована для потока текучей среды. Когда насыщение газом завершается и поглотительная среда оказывается насыщенной диоксидом углерода (СО2), первичную пористость сдавливают, оставляя только вторичную пористость для парового или флюидного обмена.
Простейшая геометрия для этого коллектора представляет собой серию листов поглотительной среды с открытыми ячеистыми порами. Для газового обмена листы разнесены друг от друга на расстояние, оптимизированное для скорости поглощения диоксида углерода (СО2) поглотительной средой и соответственно длине листов. Для парового и флюидного обмена листы сдвигают вместе, и флюид протекает через поры поглотительной среды. Другие геометрические формы показаны в фиг. 12А-12F и включают сжимаемые квадратные или прямоугольные каналы, и т.д.
В фиксированном коллекторе употребляются один или несколько фиксированных поровых размеров. Геометрия пор варьирует. Примеры геометрических форм пор представляют собой круглые, квадратные, прямоугольные, треугольные, шестиугольные или по-разному сформованные каналы. Конструкция также включает геометрию пены с открытыми ячейками или прочие нерегулярные соединенные формы, определяемые формой поглотительной среды.
В еще одном аспекте настоящего изобретения, показанном на фиг. 13, процесс ионного обмена может быть дополнен использованием электродиализной (ED) ячейки. Ионообменная смола может быть промыта с использованием раствора основания, такого как карбонат натрия (Na2CO3), предпочтительно имеющим значение рН 11-12. Полученный выходной поток, который в примере карбоната натрия в качестве промывной жидкости будет представлять собой главным образом бикарбонат натрия (NaHCO3), предпочтительно имеет величину рН 9-10.
Выходной поток затем направляют на кислотную сторону электродиализной (ED) ячейки, где реакция контролируется биполярными и катионными мембранами. После начального прогона кислотная сторона ячейки стабилизируется при значении рН, близком к нейтральному, в каковой момент диоксид углерода (СО2) выделяется и улавливается. Под влиянием осмотического давления вода перетекает на основную сторону ячейки. Раствор основания поддерживается при величине рН около 12 и может быть также использован для пополнения промывной текучей среды.
Вследствие разницы значений рН и состава промывной текучей среды и выходного потока для каждого из них могут быть использованы отдельные резервуары.
Альтернативно, как показано на фиг. 14, раствор основания для электродиализной (ED) ячейки и промывная текучая среда могут содержаться в одном и том же резервуаре. Этот резервуар может содержать сепаратор для разделения двух растворов оснований, имеющих два различающихся значения рН. В предпочтительном варианте осуществления величина рН промывной текучей среды составляет 12, и значение рН раствора основания, подаваемого в электродиализную (ED) ячейку, составляет 11. Выходной поток может содержаться в отдельном резервуаре до поступления в кислотную сторону электродиализной (ED) ячейки. Кроме того, выходной поток, который предпочтительно имеет величину рН 9-10, может быть использован для разбавления части раствора основания, употребляемого для промывания, для доведения величины рН до 11.
Следует подчеркнуть, что вышеописанные варианты осуществления настоящего способа, в частности, и «предпочтительные» варианты осуществления, представляют собой только возможные примеры исполнения и изложены только для четкого понимания принципов изобретения. Многие различные варианты исполнения описанных здесь способов могут быть оформлены и/или произведены без выхода за пределы смысла и области изобретения. Все эти и прочие такие модификации и вариации предполагаются включенными здесь в пределы этого описания и защищены нижеследующими пунктами формулы изобретения. Поэтому область изобретения не предполагается ограниченной ничем, кроме того, что указано в прилагаемых пунктах формулы изобретения.
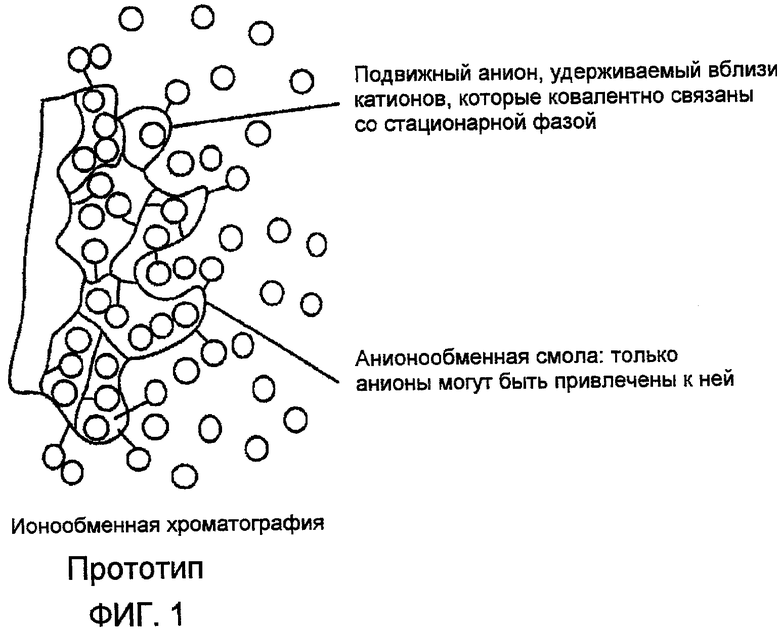
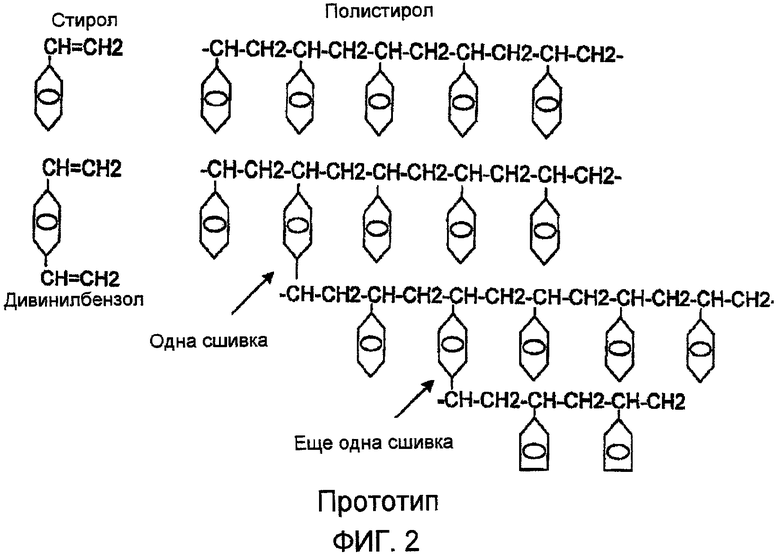
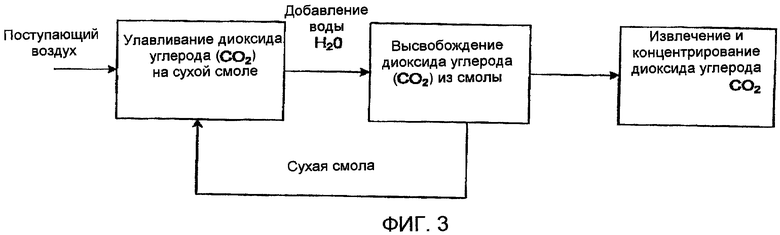
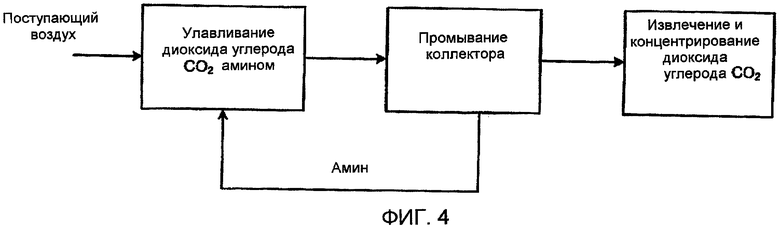
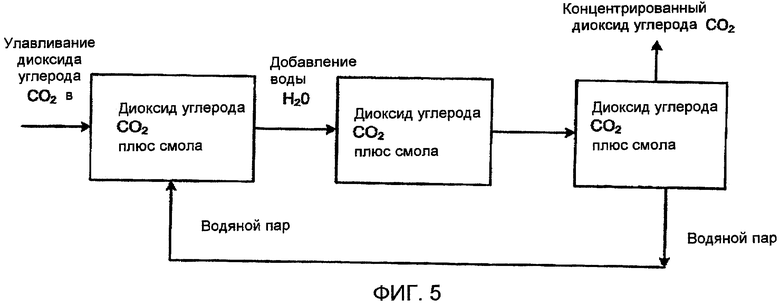
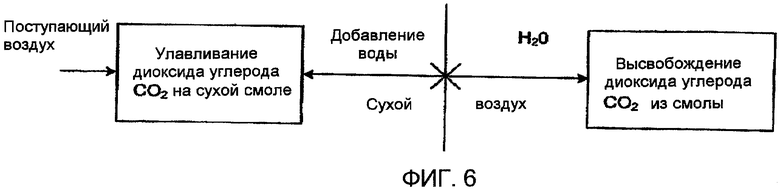
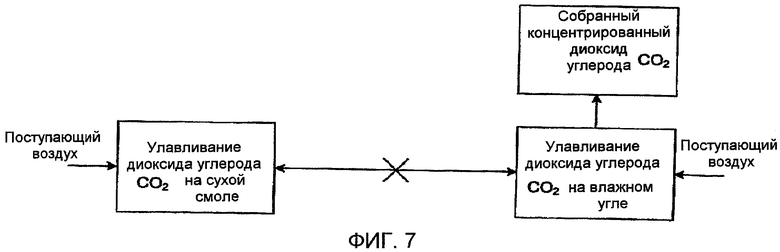
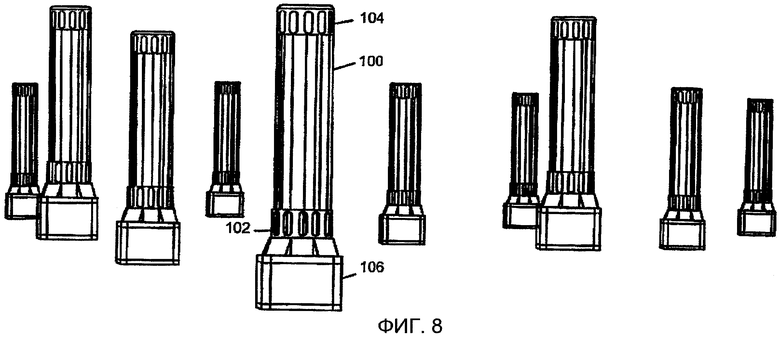
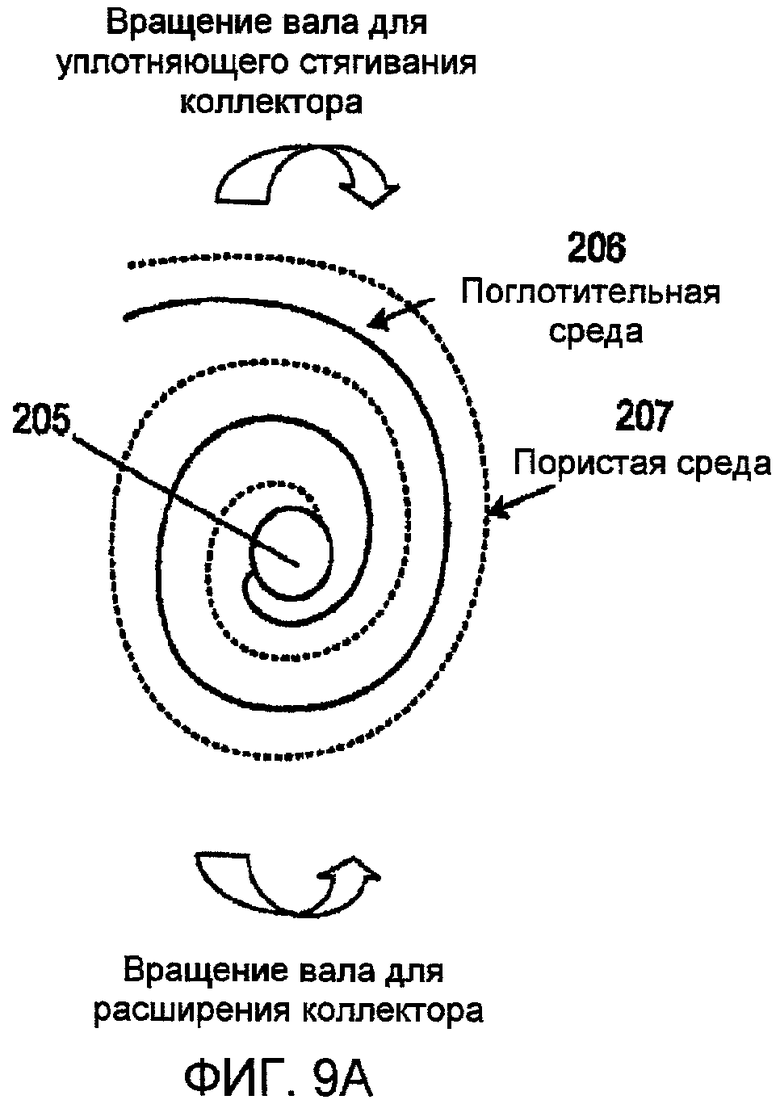
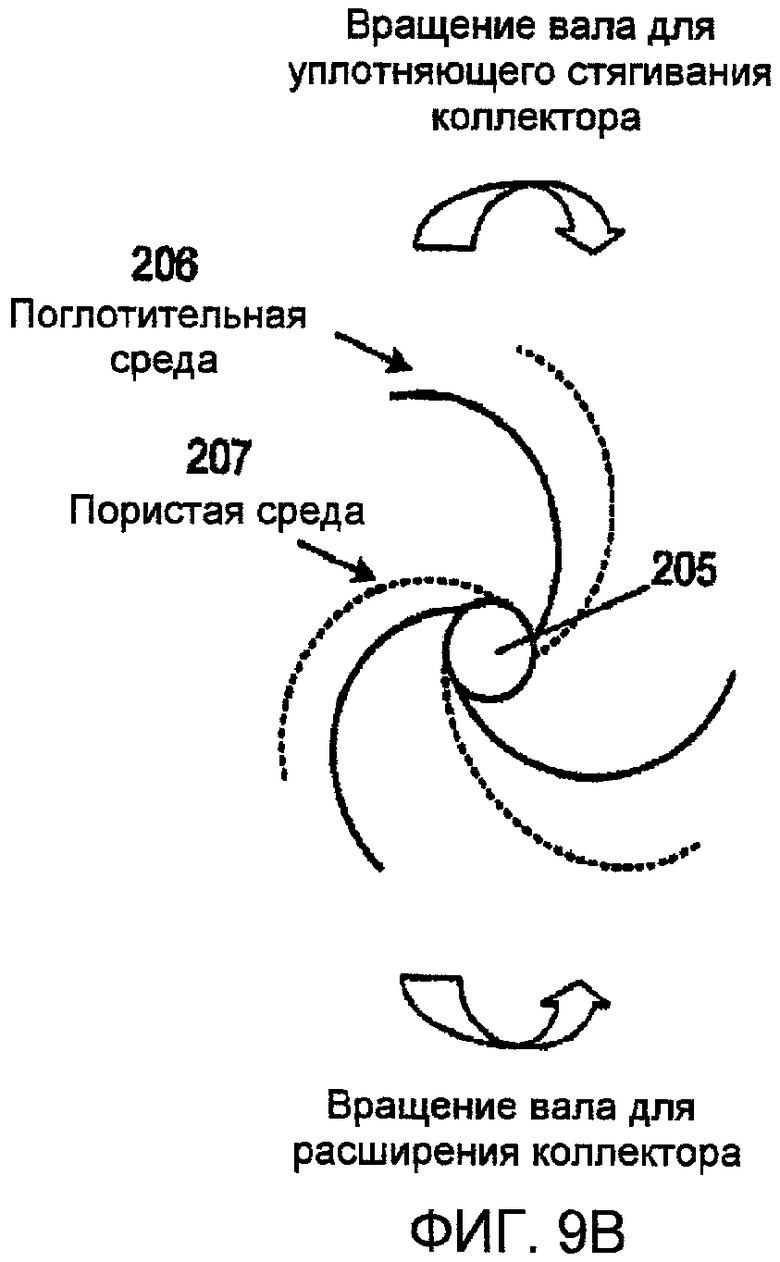
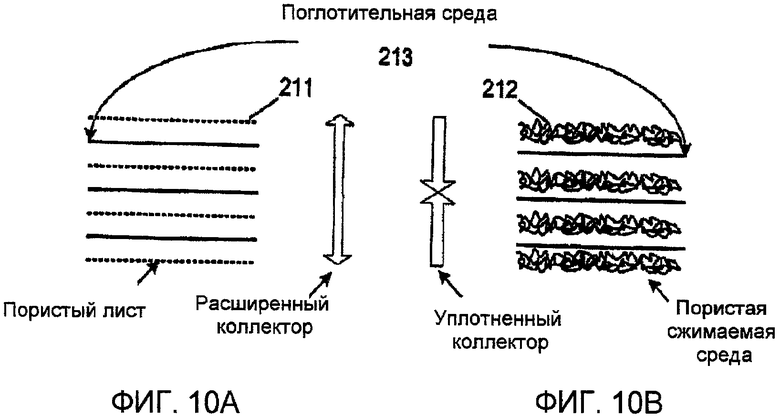
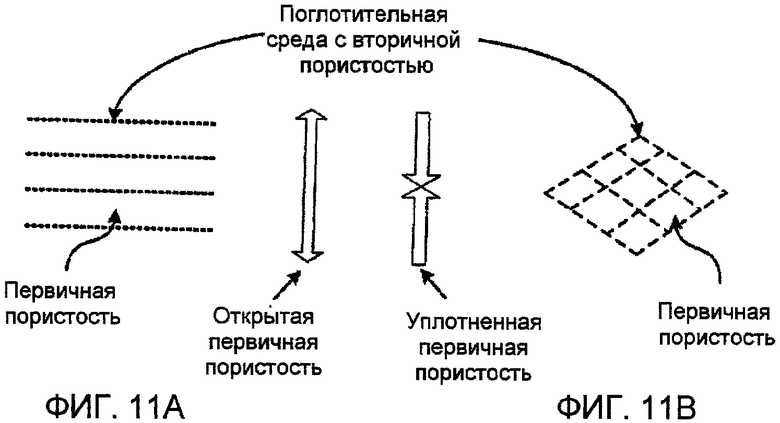
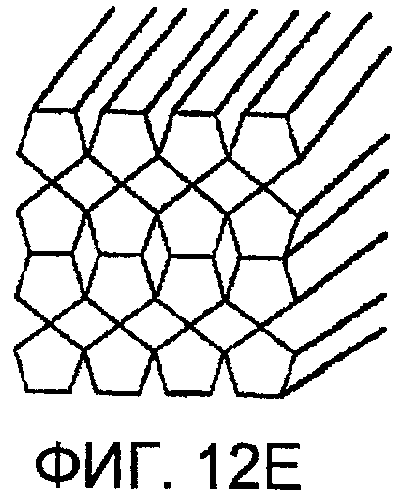
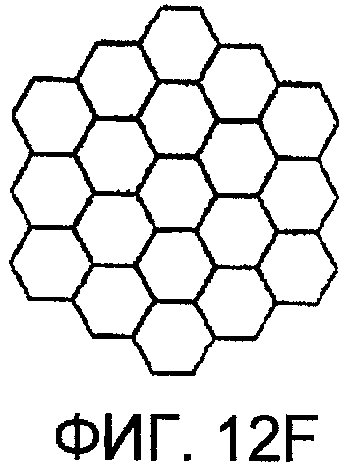
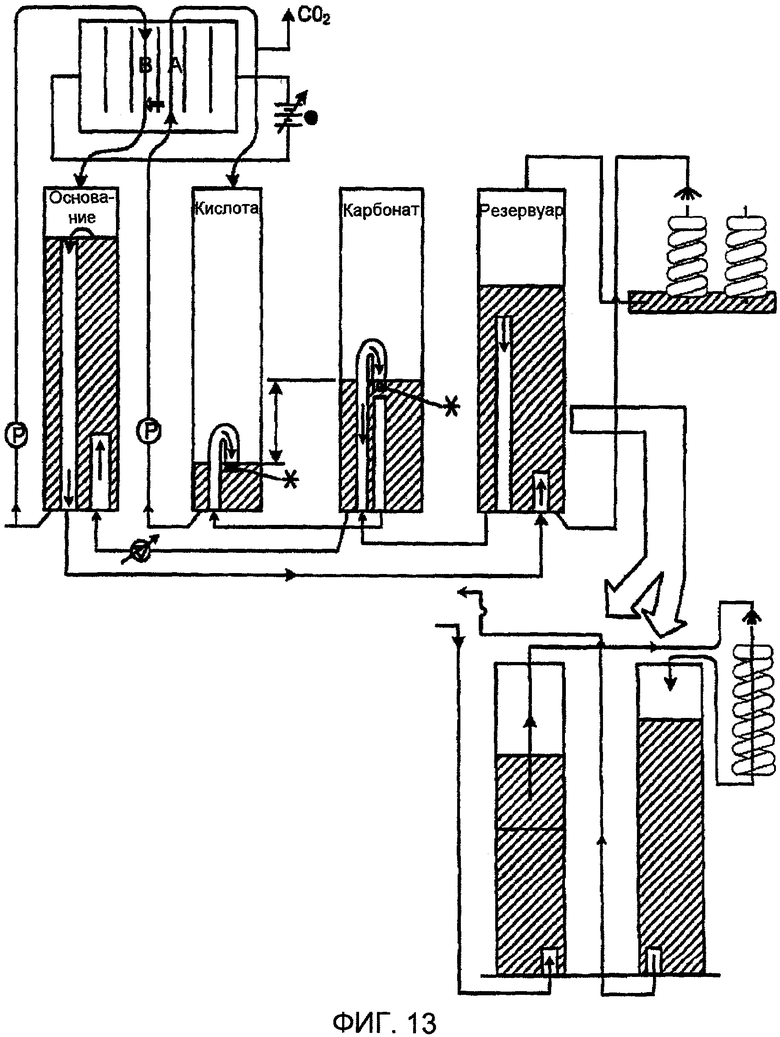
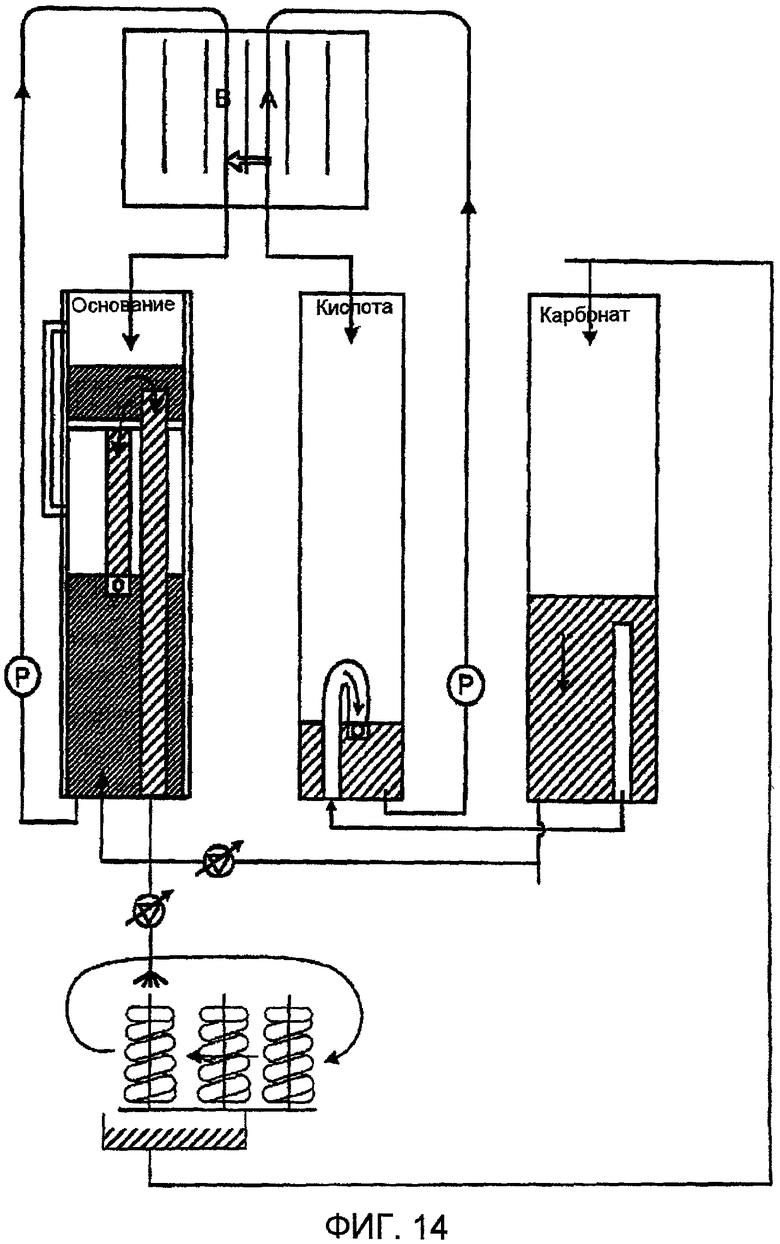
Представлен способ удаления диоксида углерода из газового потока, включающий приведение газа в контакт со смолой, увлажнение смолы водой, улавливание водяного пара и диоксида углерода из смолы и отделение диоксида углерода от водяного пара. Смола может быть помещена в камеру или многочисленные камеры, соединенные последовательно, в которых первая камера содержит смолу, которая первой контактировала с газом, и каждая последующая камера содержит смолу, которая была увлажнена, и диоксид углерода, собранный в течение более продолжительного периода времени, чем в предшествующей камере, и так далее, до последней камеры. Вторичные сорбенты могут быть использованы для дополнительного отделения диоксида углерода от водяного пара. Изобретение позволяет удалять побочные продукты, поступающие из окружающей среды. 7 н. и 8 з.п. ф-лы, 22 ил.
1. Способ удаления СО2 из газа, включающий приведение указанного газа в контакт с материалом, поглощающим СО2, в камере, откачивание газа из камеры, увлажнение указанного материала, поглощающего СО2, улавливание водяного пара и СО2 из указанного материала, поглощающего СО2, и отделение указанного СО2 от указанного водяного пара.
2. Способ по п.1, в котором материал, поглощающий СО2, предпочтительно содержит ионообменную смолу, и увлажняют погружением в соленую воду, оборотную воду или загрязненную воду, или воду, необязательно содержащую карбоангидразу, или воздействием водяного пара или влажным воздухом, или воздействием коротких импульсов водяного пара, и необязательно удаление воды в качестве побочного продукта.
3. Способ по п.1 или 2, в котором СО2 отделяют от водяного пара снижением температуры или повышением давления водяного пара и СО2 в камере.
4. Способ по п.1, в котором вторичный сорбент, предпочтительно слабоосновный жидкий амин, используют для отделения СО2 от водяного пара, и, если желательно, СО2 извлекают из вторичного сорбента повышением температуры.
5. Способ удаления СО2 из газа, включающий:
приведение указанного газа в контакт с материалом, поглощающим СО2, содержащийся в многочисленных камерах, в котором многочисленные камеры соединены последовательно;
увлажнение указанного материала, поглощающего СО2, водой, где вода поступает в первую камеру и выходит через последнюю камеру;
улавливание водяного пара и СО2 из указанного материала, поглощающего СО2; и
отделение указанного СО2 от указанного водяного пара.
6. Способ по п.5, отличающийся одним или несколькими из следующих признаков:
(a) где указанные многочисленные камеры соединены через множество вентилей, которые обеспечивают любой из указанных многочисленных камер возможность служить в качестве указанной первой камеры или указанной последней камеры;
(b) в котором указанная первая камера содержит материал, поглощающий СО2, которая была наиболее недавно насыщена или частично насыщена СО2 из указанного газа, и каждая последующая камера содержит материал, поглощающий СО2, который был увлажнен, и СО2, собранный в течение более продолжительного периода времени, чем в предыдущей камере, и так далее, до указанной последней камеры; и
(c) где материал, поглощающий СО2, содержит ионообменную смолу.
7. Установка для улавливания СО2 из воздуха, включающая вертикальную колонну, имеющую по меньшей мере один входной воздушный патрубок вблизи донной части колонны и по меньшей мере один выходной воздушный патрубок вблизи верха колонны, камеру, размещенную между по меньшей мере одним входным воздушным патрубком и по меньшей мере одним выходным воздушным патрубком, содержащую материал, поглощающий СО2, для улавливания СО2, и источник воды для увлажнения материала, поглощающего СО2, для высвобождения СО2.
8. Установка по п.7, отличающаяся одним или более из следующих признаков:
(а) где вода находится в форме влажного воздуха;
(b) дополнительно включающая множество задвижек для закрывания по отдельности по меньшей мере одного входного воздушного патрубка и/или выходного воздушного патрубка;
(c) дополнительно включающая вентиляторы для регулирования потока воздуха через колонну; и
(d) где материал, поглощающий СО2, содержит ионообменную смолу.
9. Коллектор для улавливания СО2 из газового потока, включающий пористый материал и материал, поглощающий СО2, где коллектор имеет регулируемую геометрию для приспособления к газовому обмену и жидкостному обмену в последовательном порядке.
10. Коллектор по п.9, отличающийся одним или более из следующих признаков:
(а) где геометрия коллектора является регулируемой для максимизации скорости обмена;
(b ) где пористый материал размещен между множеством листов материала, поглощающего СО2, и в котором пористый материал является сжимаемым для регулирования геометрии коллектора;
(c) где пористый материал находится в форме листов, которые размещены попеременно между множеством листов материала, поглощающего СО2, и в котором сжимаемые листы пористого материала сжимаются для регулирования геометрии коллектора;
(d) где пористый материал и материал, поглощающий СО2, каждый находится в листовой форме, и в котором по меньшей мере один лист пористого материала и по меньшей мере один лист материала, поглощающего СО2, присоединены к центральному валу, и в котором геометрия коллектора является регулируемой вращением центрального вала; и
(e) где материал, поглощающий СО2, содержит ионообменную смолу.
11. Коллектор для улавливания СО2 из газа, включающий функционализированный материал со складной геометрией, в котором коллектор имеет первичную пористость для газового обмена и вторичную пористость для жидкостного обмена.
12. Способ удаления СО2 из газа, включающий улавливание СО2 материалом первичного сорбента, промывание материала первичного сорбента промывной текучей средой для создания выходного потока, помещение выходного потока в электродиализную ячейку на кислотную сторону, и доведение величины рН кислотной стороны электродиализной ячейки до нейтрального значения рН путем высвобождения СО2.
13. Способ по п. 12, отличающийся одним или более из следующих признаков:
(a) где промывная текучая среда имеет значение рН между 11-12, и выходной поток имеет величину рН 9-10;
(b) где текучую среду с основной стороны электродиализной ячейки используют в качестве промывной текучей среды;
(c) где осмотическое давление перемещает воду с кислотной стороны на основную сторону электродиализной ячейки; и
(d) где материал сорбента содержит ионообменную смолу.
14. Способ удаления СО2 из газа, включающий направление потока указанного газа в контакт с материалом, поглощающим СО2, в первой камере, откачивание указанного газа из указанной первой камеры, увлажнение указанного материала, поглощающего СО2, водой, извлечение водяного пара и СО2 из указанного материала, поглощающего СО2, и отделение указанного СО2 от указанного водяного пара.
15. Способ по п. 14, отличающийся одним или более из следующих признаков:
(а) дополнительно включающий помещение материала, поглощающего СО2, в указанную первую камеру перед стадией откачивания указанного газа из указанной первой камеры;
(b) где после откачивания указанного газового потока указанная первая камера находится под пониженным давлением неглубокого вакуума;
(c) где указанный материал, поглощающий CO2, увлажняют водой в форме водяного пара или погружением в воду, соленую воду, оборотную воду, загрязненную воду или воду, необязательно содержащую карбоангидразу, и необязательно удаление воды в качестве побочного продукта;
(d) где указанный СО2 отделяют от указанного водяного пара повышением давления для конденсирования водяного пара;
(e) где указанный СО2 отделяют от указанного водяного пара с использованием слабоосновного амина;
(f) где многочисленные камеры соединены последовательно, и в котором вода поступает в первую камеру и выходит через последнюю камеру, причем СО2 и водяной пар собирают из указанной последней камеры, и в котором указанные многочисленные камеры предпочтительно соединены множеством вентилей, которые позволяют любой из указанных многочисленных камер служить в качестве указанной первой камеры или указанной последней камеры;
(g) где указанная первая камера содержит материал, поглощающий СО2, который был наиболее недавно насыщен СО2 из указанного газового потока, и каждая последующая камера содержит материал, поглощающий СО2, который был увлажнен, и СО2, собранный в течение более продолжительного периода времени, чем в предыдущей камере, и так далее до указанной последней камеры;
(h) где материал, поглощающий СО2, содержит ионообменную смолу.
| US 2006186562 А1, 24.08.2006 | |||
| US 2007004023 A1, 04.01.2007 | |||
| US 2006249020 A1, 09.11.2006 | |||
| US 2005204915 A1, 22.09.2005 | |||
| ПОЛУЧЕНИЕ ВОДОРОДА ИЗ УГЛЕРОДСОДЕРЖАЩЕГО МАТЕРИАЛА | 2000 |
|
RU2272782C2 |
| СПОСОБ ВЫДЕЛЕНИЯ УГЛЕРОДА-14 ИЗ ОБЛУЧЕННОГО НЕЙТРОНАМИ ГРАФИТА | 2001 |
|
RU2212074C2 |
Авторы
Даты
2013-01-20—Публикация
2008-04-17—Подача