Текст описания приведен в факсимильном виде.











































































Изобретение относится к области биотехнологии. Описан способ получения композиции, включающей (i) вирусоподобные частицы, причем указанные вирусоподобные частицы являются вирусоподобными частицами РНК-содержащего бактериофага, и (ii) олигонуклеотид, причем указанный олигонуклеотид упакован в указанные вирусоподобные частицы. Также описан способ получения нуклеотидной композиции, включающей олигонуклеотиды, применимые в указанном выше способе. Также описана нуклеотидная композиция, получаемая способом настоящего изобретения, и ее применение. Указанная композиция предпочтительно обладает чистотой по меньшей мере 98%, наиболее предпочтительно по меньшей мере 99%. Изобретение может быть использовано в медицине. 3 н. и 22 з.п. ф-лы, 6 ил., 1 табл., 14 пр.
1. Способ получения нуклеотидной композиции, содержащей олигонуклеотид, который включает следующие стадии:
(а) обеспечения олигонуклеотида в растворе I, причем указанный олигонуклеотид содержит по меньшей мере один участок поли-G, причем указанный раствор I имеет щелочной рН, причем предпочтительно величина указанного рН равна 8-13, более предпочтительно величина указанного рН равна 12,
(б) дезагрегации указанного олигонуклеотида, причем указанная дезагрегация включает стадии:
(i) регуляции температуры раствора I до температуры I, причем указанная температура I составляет 4-70°С, предпочтительно 45-70°С, более предпочтительно примерно 50°С, и наиболее предпочтительно 50°С,
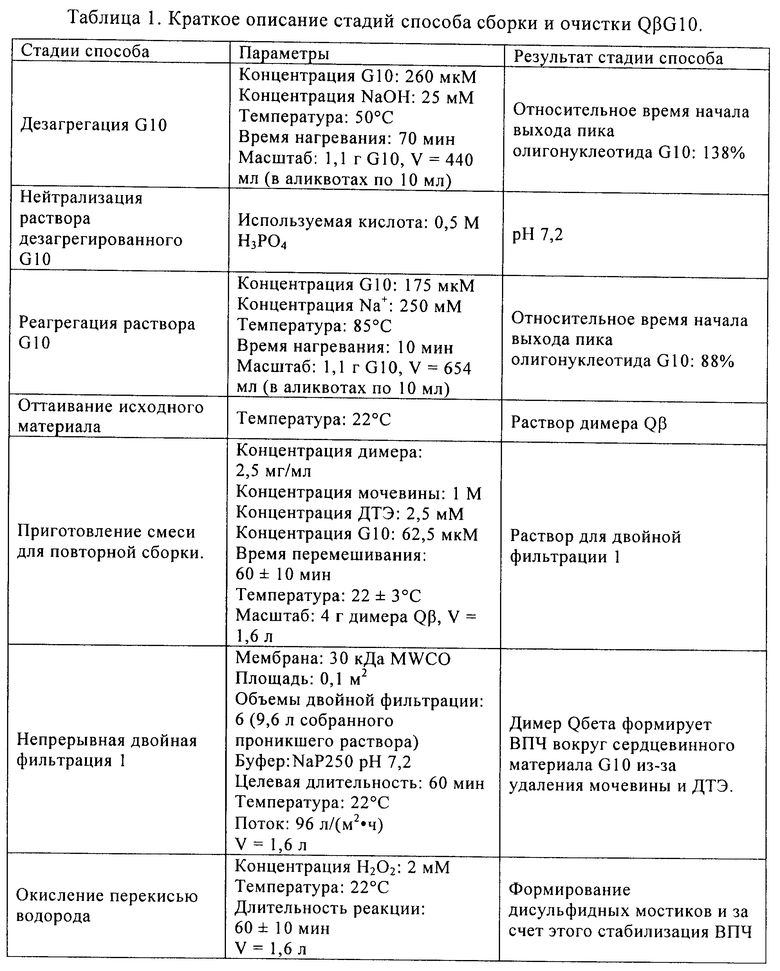
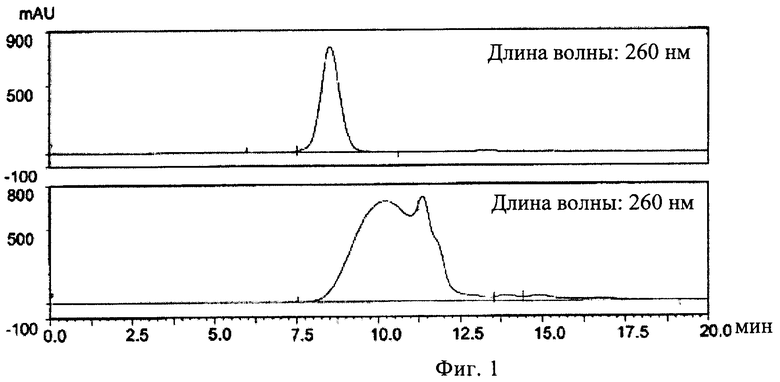
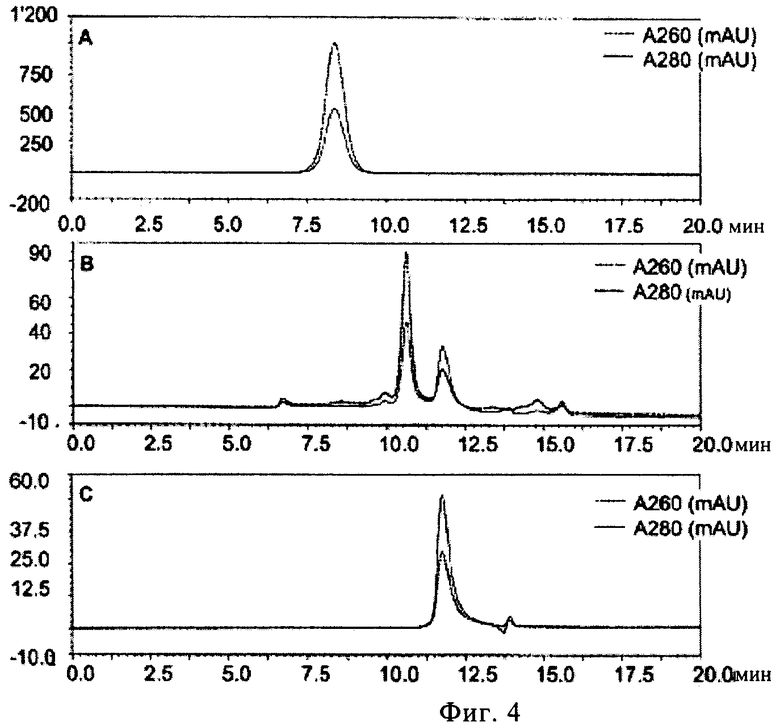
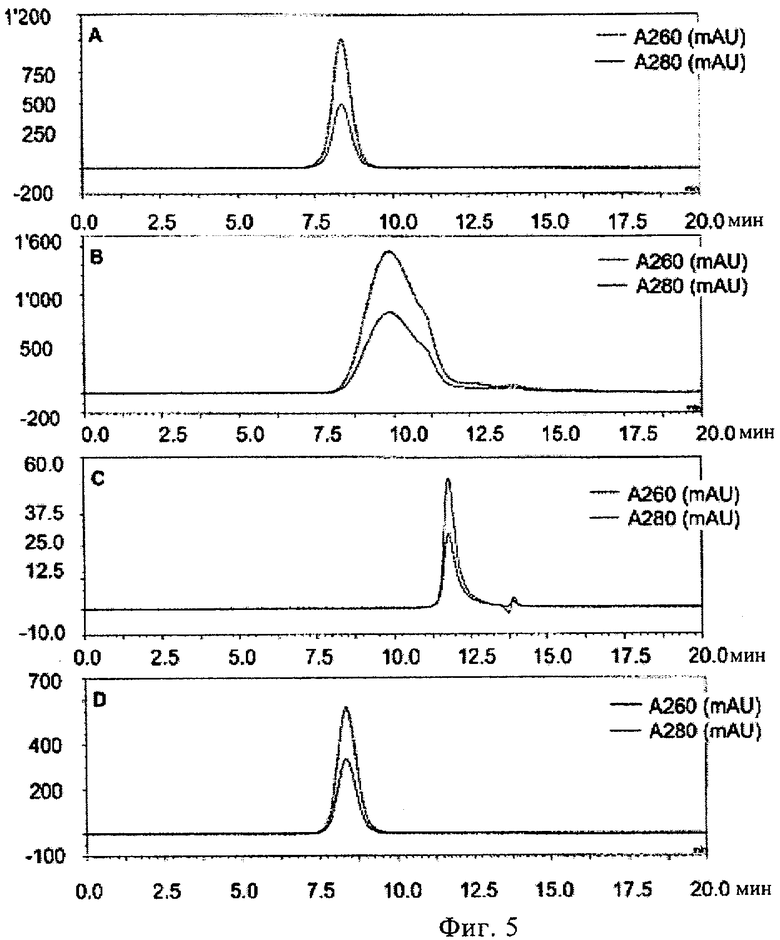
(ii) инкубирования указанного олигонуклеотида в указанном растворе I при указанной температуре I, причем указанное инкубирование проводят до тех пор, пока указанный олигонуклеотид характеризуется относительным временем начала выхода пика примерно 110% в гель хроматографии с использованием капсида бактериофага Qв в качестве стандарта, и
(iii) регуляции температуры указанного раствора I до температуры II, причем указанная температура II составляет 0-70°С, причем предпочтительно указанная температура II ниже температуры I, и также предпочтительно температура II составляет 0-25°С, наиболее предпочтительно 0-2°С,
(в) регуляции рН указанного раствора I до величины 5-8, причем предпочтительно указанную регуляцию указанной величины рН указанного раствора I проводят до тех пор, пока указанный рН составляет величину 6-7, и
(г) агрегирования указанного олигонуклеотида, причем указанное агрегирование включает стадии:
(i) обеспечения указанного олигонуклеотида в растворе II, причем величина рН указанного раствора II составляет 5-8 и указанный раствор содержит по меньшей мере 20 мМ катиона, причем указанный катион выбран из группы, состоящей из Na+, K+, NH4 +, Li+, Са2+ и Mg2+, причем предпочтительно указанный раствор II содержит 200-275 мМ указанного катиона, предпочтительно 250 мМ,
(ii) регуляции температуры раствора II до температуры III, причем указанная температура III составляет 50-99°С, предпочтительно 80-90°С, более предпочтительно примерно 85°С, и наиболее предпочтительно 85°С, (iii) инкубирования указанного олигонуклеотида в растворе II при температуре III, причем указанное инкубирование проводят до тех пор, пока указанный олигонуклеотид характеризуется относительным временем начала выхода пика 50-110% в гель хроматографии с использованием капсида бактериофага Qв в качестве стандарта, и
(iv) регуляции температуры раствора II до температуры IV, причем указанная температура IV ниже 50°С, причем предпочтительно указанная температура IV составляет 0-25°С, более предпочтительно 0-2°С.
2. Способ по п.1, в котором указанную регуляцию температуры указанного раствор I до температуры II проводят со скоростью изменения температуры по меньшей мере 3,6°С/мин.
3. Способ по п.1, в котором указанную регуляцию температуры раствора II до температуры IV проводят со скоростью изменения температуры по меньшей мере 3,6°С/мин.
4. Способ по п.1, в котором указанный раствор I включает гидроксид щелочного металла, предпочтительно гидроксида калия или гидроксида натрия, наиболее предпочтительно гидроксида натрия, причем концентрация указанного гидрохлорида составляет 10-200 мМ, предпочтительно примерно 25 мМ, наиболее предпочтительно 25 мМ.
5. Способ по п.1, в котором указанную регуляцию рН указанного раствора I осуществляют добавлением кислоты в указанный раствор I, причем предпочтительно указанная кислота является фосфорной кислотой.
6. Способ по п.1, в котором указанный катион является Na+ или K+, причем предпочтительно указанный катион является Na+.
7. Способ по п.1, в котором концентрация указанного олигонуклеотида в указанном растворе I составляет от 50 мкМ до 2 мМ, наиболее предпочтительно 260 мкМ.
8. Способ по п.1, в котором концентрация указанного олигонуклеотида в указанном растворе II составляет от 50 мкМ до 2 мМ, предпочтительно 100-300 мкМ, наиболее предпочтительно 175 мкМ.
9. Способ по п.1, в котором указанное инкубирование указанного олигонуклеотида в растворе II при температуре III проводят до тех пор, пока указанный олигонуклеотид характеризуется относительным временем начала выхода пика 80-95%, предпочтительно 80-90%, еще более предпочтительно 83-90%, еще более предпочтительно 85-90%, и наиболее предпочтительно 88% в гель хроматографии с использованием капсида бактериофага Qв в качестве стандарта.
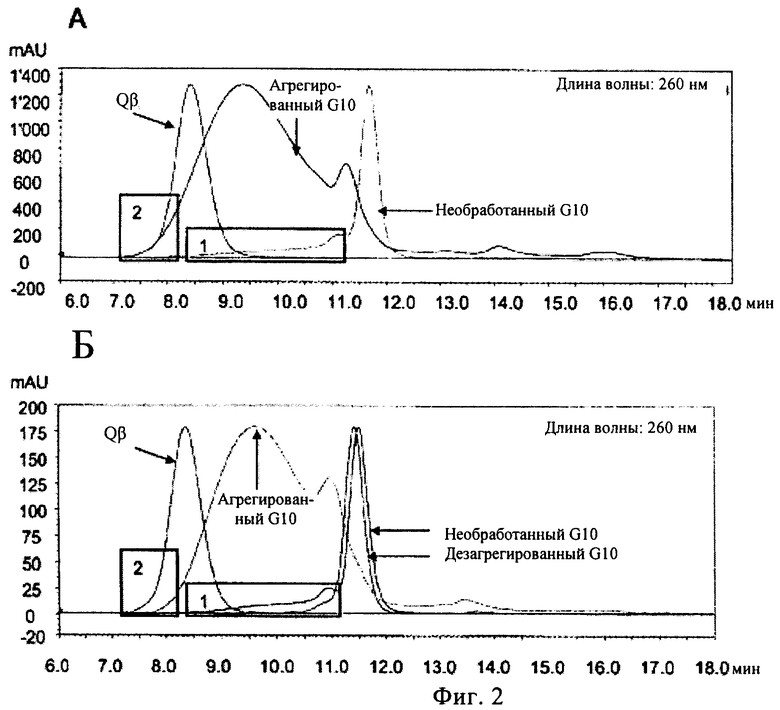
10. Способ по п.1, в котором указанный олигонуклеотид содержит с 5'-конца по меньшей мере 3 и не более 15 единиц гуанозина, и с 3'-конца по меньшей мере 3 и не более 15 единиц гуанозина, причем предпочтительно указанный олигонуклеотид содержит палиндромную последовательность, также предпочтительно указанной палиндромной последовательностью является последовательность GACGATCGTC (SEQ ID NO:1).
11. Способ по п.1, в котором указанный олигонуклеотид имеет последовательность нуклеиновой кислоты, выбранную из группы, состоящей из:
(а) «G4-4» GGGGGACGATCGTCGGGG (SEQ ID NO:2);
(б) «G5-5» GGGGGGACGATCGTCGGGGG (SEQ ID NO:3);
(в) «G6-6» GGGGGGGACGATCGTCGGGGGG (SEQ ID NO:4);
(г) «G7-7» GGGGGGGGACGATCGTCGGGGGGG (SEQ ID NO:5);
(д) «G8-8» GGGGGGGGGACGATCGTCGGGGGGGG (SEQ ID NO:6);
(е) «G9-9» GGGGGGGGGGACGATCGTCGGGGGGGGG (SEQ ID NO:7);
(ж) «G10» GGGGGGGGGGGACGATCGTCGGGGGGGGGG (SEQ ID NO:8);
(з) «G11» GGGGGGGGGGGGACGATCGTCGGGGGGGGGGG (SEQ ID NO:9).
12. Способ по одному из предшествующих пунктов, в котором указанный олигонуклеотид имеет последовательность нуклеиновой кислоты «G8-8» GGGGGGGGGACGATCGTCGGGGGGGG (SEQ ID NO:6).
13. Способ по п.1, в котором указанный олигонуклеотид имеет последовательность нуклеиновой кислоты «G10» GGGGGGGGGGGACGATCGTCGGGGGGGGGG (SEQ ID NO:8).
14. Нуклеотидная композиция для упаковки в вирусоподобную частицу РНК бактериофага, включающая олигонуклеотид, причем указанная композиция может быть получена способом по одному из пп.1-13, причем предпочтительно указанный олигонуклеотид характеризуется относительным временем начала выхода пика 50-110%, предпочтительно 80-95%, более предпочтительно 80-90%, еще более предпочтительно 83-90%, еще более предпочтительно 85-90%, и наиболее предпочтительно 88% в гель хроматографии с использованием капсида бактериофага Qв в качестве стандарта.
15. Нуклеотидная композиция по п.14, в которой указанный олигонуклеотид имеет последовательность нуклеиновой кислоты «G8-8» GGGGGGGGGACGATCGTCGGGGGGGG (SEQ ID NO:6) или «G10» GGGGGGGGGG GACGATCGTCGGGGGGGGGG (SEQ ID NO:8), причем предпочтительно указанный олигонуклеотид имеет последовательность нуклеиновой кислоты «G10» GGGGGGGGGGGACGATCGTCGGGGGGGGGG (SEQ ID NO:8).
16. Способ получения композиции, включающей (i) вирусоподобную частицу, которая является вирусоподобной частицей РНК-содержащего бактериофага, и (ii) олигонуклеотид, причем указанный олигонуклеотид упакован в указанную вирусоподобную частицу, включающий стадии:
(а) обеспечения белка оболочки указанного РНК-содержащего бактериофага,
(б) обеспечения олигонуклеотида,
(i) причем указанный олигонуклеотид включает по меньшей мере один отрезок поли-G, и
(ii) причем указанный олигонуклеотид характеризуется относительным временем выхода пика 50-110% в гель хроматографии с использованием капсида бактериофага Qв в качестве стандарта,
(в) получения смеси, причем указанная смесь включает:
(i) указанный белок оболочки, причем предпочтительно концентрация указанного белка оболочки в указанной смеси составляет 1-4 мг/мл, более предпочтительно 2,5 мг/мл, и/или также предпочтительно концентрация указанного олигонуклеотида в указанной смеси составляет 25-100 мкМ, более предпочтительно 62,5 мкМ,
(ii) агент, способный предупреждать самосборку указанного белка оболочки, причем предпочтительно указанный агент является денатурирующим соединением, выбранным из мочевины и гуанидиния гидрохлорида, также предпочтительно указанное денатурирующее соединение является мочевиной, и также предпочтительно концентрация указанной мочевины в указанной смеси составляет 0,25-7,2 М, предпочтительно 1 М,
(iii) указанный олигонуклеотид,
(г) удаления указанного агента из указанной смеси, и
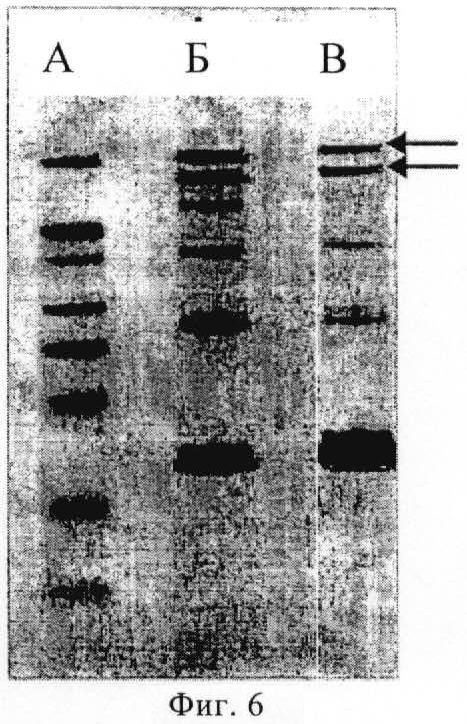
(д) допущения самосборки указанного белка оболочки в вирусоподобную частицу.
17. Способ по п.16, в котором указанный белок оболочки включает, или, в другом варианте, в значительной степени состоит из рекомбинантных белков или их фрагментов РНК-содержащего бактериофага, причем предпочтительно указанный бактериофаг выбран из группы, состоящей из:
(а) бактериофага Qβ,
(б) бактериофага R17,
(в) бактериофага fr,
(г) бактериофага GA,
(д) бактериофага SP,
(е) бактериофага MS2,
(ж) бактериофага M11,
(з) бактериофага MX1,
(и) бактериофага NL95,
(к) бактериофага f2,
(л) бактериофага РР7 и
(м) бактериофага АР205.
18. Способ по п.16, в котором указанным РНК-содержащим бактериофагом является бактериофаг Qβ.
19. Способ по п.16, в котором указанный белок оболочки включает или предпочтительно состоит из последовательности, выбранной из группы, состоящей из:
(а) SEQ ID NO:10 (Qβ CP),
(б) смесь SEQ ID NO:10 и SEQ ID NO:11 (Qβ A1 белок),
(в) SEQ ID NO:12 (белок оболочки R17),
(г) SEQ ID NO:13 (белок оболочки fr),
(д) SEQ ID NO:14 (белок оболочки GA),
(е) SEQ ID NO:15 (белок оболочки SP),
(ж) смесь SEQ ID NO:15 и SEQ ID NO:16,
(з) SEQ ID NO:17 (белок оболочки MS2),
(и) SEQ ID NO:18 (белок оболочки M11),
(к) SEQ ID NO:19 (белок оболочки MX1),
(л) SEQ ID NO:20 (белок оболочки NL95),
(м) SEQ ID NO:21 (белок оболочки f2),
(н) SEQ ID NO:22 (белок оболочки РР7) и
(о) SEQ ID NO:23 (белок оболочки АР205).
20. Способ по п.16, в котором мольное соотношение указанного олигонуклеотида и указанного белка оболочки в указанной смеси составляет 0,5-1,2, предпочтительно 0,7.
21. Способ по п.16, в котором указанный агент также является окислительным агентом, причем предпочтительно указанным окислительным агентом является дитиоэритол (ДТЭ), и также предпочтительно концентрация указанного ДТЭ в указанной смеси составляет 1-25 мМ, более предпочтительно 2,5 мМ.
22. Способ по п.16, в котором указанное удаление указанного агента из указанной смеси осуществляют первой заменой буфера на первый буфер, причем указанный первый буфер включает натрий хлорид, причем предпочтительно концентрация указанного натрия хлорида в указанном первом буфере составляет 0-1 М, предпочтительно 0-550 мМ, более предпочтительно 0-350 мМ, еще более предпочтительно 50-350 мМ, и наиболее предпочтительно 250 мМ.
23. Способ по п.16, в котором указанный способ дополнительно включает стадию контакта указанной вирусоподобной частицы с окисляющим агентом, причем предпочтительно указанный окисляющий агент выбран из группы, включающей:
(а) перекись водорода, причем предпочтительно концентрация указанной перекиси водорода составляет 0,25-50 мМ, предпочтительно 2 мМ,
(б) кислород,
(в) глутатион,
(г) Cu2+ и
(д) Fe3+.
24. Способ по п.16, причем указанный способ дополнительно включает стадию очистки указанной вирусоподобной частицы, и в котором предпочтительно указанная очистка включает вторую замену буфера на второй буфер, причем указанный второй буфер является фармацевтически приемлемым буфером.
25. Способ по п.16, в котором выход белка составляет по меньшей мере 75%, и/или в котором выход олигонуклеотида составляет по меньшей мере 75%.
| WO 2004084940 А, 07.10.2004 | |||
| KERKMANN MIREN ЕТ AL | |||
| Spontaneous formation of nucleic acid-based nanoparticles is responsible for high interferon-alpha induction by CpG-A in plasmacytoid dendritic cells | |||
| JOURNAL OF BIOLOGICAL CHEMISTRY, v.280, №9, March 2005 (2005-03), p | |||
| Вальцевой станок для смазки клеем фанер | 1927 |
|
SU8086A1 |
| WO 03024480 A2, 27.03.2003. | |||
Авторы
Даты
2013-02-27—Публикация
2007-06-12—Подача