Изобретение относится к химической и фармацевтической отраслям промышленности и касается химической функционализации фуллерена С60, а именно, разработки способа получения нового класса серосодержащих производных фуллерена С60. Изобретение может найти применение в биомедицинских исследованиях и в фармакологии, а также в органической фотовольтаике при разработке перспективных светопреобразующих материалов для органических солнечных батарей.
Фуллерены были открыты в 1985 году при масс-спектрометрическом анализе продуктов лазерного испарения графита [W.Kroto, J.R.Heath, S.C.O'Brien, R.F.Curl, R.E.Smalley. С60: Buckminsterfullerene, Nature, 318, 162-163 (1985)]. После разработки методов получения фуллеренов в макроколичествах путем электродугового испарения графита [W.Krätchmer, L.D.Lamb, К.Fostiropoulos, D.R.Huffman. С60: a new form of carbon. Nature, 347, 354-358 (1990)] или при неполном сгорании углеводородов [Н.Murayama. S.Tomonoh. J.M.Alford, M.E.Karpuk. Fullerene production in tons and more: From science to industry. Full. Nunotub. Carbon Nanostruct., 12, 1-9 (2004)] и эффективных методов разделения фуллеренов [К.Nagata, E.Dejima, Y.Kikuchi. M.Hashiguchi. Kilogram-scale [60]fullerene separation from a fullerene mixture: Selective complexation offullerenes with 1,8-diazabicyclo[5.4.0]undec-7-ene (DBU). Chem. Lett., 34, 178-179 (2005)] низший фуллерен С60 высокой чистоты стал доступен в килограммовых количествах по цене менее 15€/г [http://www.neotechproduct.ru/str6.php?lang=rus].
В результате многолетних исследований фуллеренов и их производных среди них были обнаружены соединения, обладающие ценными свойствами, которые могут найти практическое применение. Так, производные фуллеренов С60 и С70 являются перспективными материалами для органических солнечных батарей, КПД которых достигает 7-8% [Y.Liang, Z.Xu, J.Xia, S.-T.Tsai, Y.Wu, G.Li, C.Ray, L.Yu, For the Bright Future-Bulk Heterojunction Polymer Solar Cells with Power Conversion Efficiency of 7.4%. Adv. Mater. 22, 1-4, (2010)], а также незаменимыми компонентами полевых транзисторов [T.D.Anthopoulos, С.Tanase et al. Ambipolar Organic Field-Effect Transistors Based on a Solution-Processed Methanofullerene. Adv. Mater., 16, 2174 (2004)]. Кроме того, некоторые производные фуллеренов могут найти применение в качестве высокотемпературных сверхпроводников [M.J.Rosseinsky. Recent developments in the chemistry and physics of metal fullerides. Chem. Mater., 10, 2665-2685 (1998)], протонных проводников [R.Maruyama. Electrochemical mass-flow control of hydrogen using a fullerene-based proton conductor. Electrochemica Acta, 48, 85-89 (2002)], материалов нелинейной оптики [L.W.Tutt, A.Kost. Optical limiting performance of С60 and С70 solutions. Nature, 356, 225-226 (1992)] и др.
Одна из наиболее важных перспектив практического применения соединений фуллеренов - их использование в медицинских исследованиях. На сегодняшний день уже известны водорастворимые производные фуллеренов, в основном содержащие ионогенные группы - аминные [О.Troshina, P.Troshin, A.Peregudov, V.Kozlovski, R.Lyubovskaya. Photoaddition of N-Substituted Piperazines to С60: An Efficient Approach to the Synthesis of Water-Soluble Fullerene Derivatives. Chem. Eur. Journal, 12, 5569-5577 (2006)] и карбоксильные [М.Brettereich, A.Hirsch. A highly water-soluble dendro[60]fullerene. Tetrahedron Letters, 39, 2731-2734 (1998); 13 - O.Troshina, P.Troshin, A.Peregudov, V.Kozlovskiy, J.Balzarini, R.Lyubovskaya. Chlorofullerene С60Сl6: a precursor for straightforward preparation of highly water-soluble polycarboxylic fullerene derivatives active against HIV. Org. Biomol. Chem., 5, 2783-2791 (2007)], являющиеся потенциальными противовирусными (в т.ч. анти-ВИЧ) [S.Wilson in «Perspectives of Fullerene Nanotechnology», E.Osawa Ed. 2001, Kluver Academ; 15 - Патент РФ №RU 2236852 Cl «Средство для ингибирования репродукции оболочечных вирусов, способ его получения, фармацевтическая композиция и способ ингибирования вирусных инфекций», ЗАО "Деско", директор Л.Д.Раснецов] и нейрозащитными препаратами [A.Lin, S.Fang, S.Lin, С.Chou, Т.Luh, L.Но. Local carboxyfullerene protects cortical infarction in rat brain. NeuroScience Research, 43, 317-321 (2002)]. Некоторые производные фуллеренов показали высокую противоопухолевую активность в условиях фотодинамической [Y.Tabata, Т.Ishii, Т.Aoyama, R.Oki, Y.Hirano, О.Ogawa, Y.Ikada in ((Perspectives of Fullerene Nanotechnology)), E.Osawa (Ed.) 2001, Kluver Academ. Publ., Dordrecht-Boston-London.; Андреев С.М. Лаптев В.П. Панферова Н.Г. Романова В.С., Петров В.В. Овчинников А.E., Патент РФ RU 2005140680 А «Фармацевтическая композиция для фотодинамической терапии и способ лечения онкологического заболевания с ее использованием»] и химической [К.YASUHIKO, О.KENK, IDEAL STAR INC, патент JP 2005053904 (А) «Fullerene and anticancer therapeutic agent»; Заявка на патент - № pCT/RU2007/000337. 2007 «Полифункциональные аминокислотные производные фуллерена С60, содержащие биологически активные группировки, пептиды или белки, способы их получения (варианты), применение их в качестве доноров монооксида азота и в качестве вазодилататоров, а также способ ингибирования процесса метастазирования». Котельников А.И., Романова B.C., Богданов Г.Н., Коновалова Н.П., Котельникова Р.А., Файнгольд И.И, Фрог Е.С., Писаренко О.И., Бубнов Ю.Н., Давыдов М.И., Алдошин С.М.] терапии раковых опухолей. Таким образом, из всего сказанного выше можно сделать вывод о большой практической ценности производных фуллерена.
Задачей изобретения является расширение арсенала производных фуллеренов.
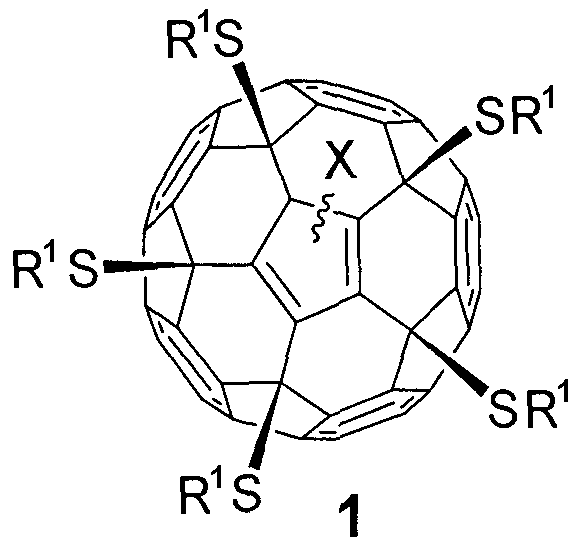
Поставленная задача решается новым классом серосодержащих производных фуллеренов общей формулы 1, а именно:
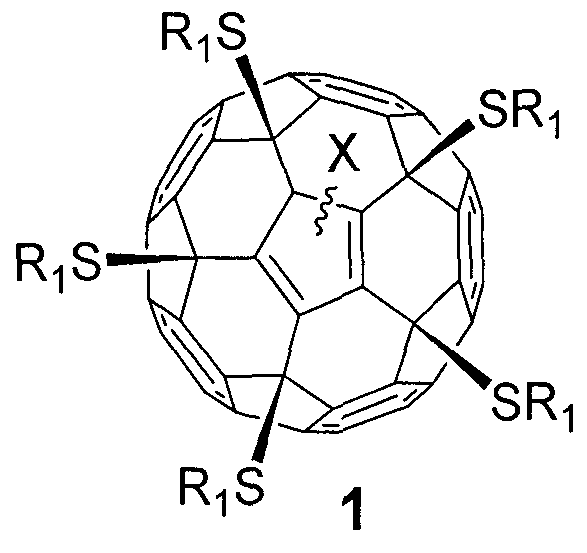 ,
,
где в общей формуле 1 Х означает:
- отрицательный заряд («-»), локализованный на фуллереновом каркасе, или
- атом водорода (-Н), или
- атом хлора (-Сl).
где в общей формуле 1 фрагмент S-R1 определяется как:
- остаток тиокислоты или ее сложного эфира, присоединенный к фуллереновому каркасу через атом серы, как это графически показано в формуле 1, a R1 имеет вид XCOOR; Х - линейный или разветвленный алкиленовый (CnH2n; n=1-20) радикал; R - атом водорода (-Н), линейный или разветвленный алкильный (СnН2n+1; n=1-20), алкенильный (CnH2n-1; n=1-20) или алкинильный радикал (CnH2n-3; n=1-20);
- остаток амида тиокислоты, присоединенный к фуллереновому каркасу через атом серы, как это графически показано в формуле 1, где R1 имеет вид XCONRR'; Х - линейный или разветвленный алкиленовый (CnH2n; n=1-20) радикал; R и R' - атомы водорода или линейные, или разветвленные алкильные (CnH2n+1; n=1-20) радикалы;
- остаток тиола, где R1 - атом водорода или линейный, или разветвленный алкильный (CnH2n+1; n=1-20) радикал или насыщенный (СnН2n-2; n=3-8) цикл;
- фрагмент общей формулы -S(CH2)nOR, присоединенный к фуллереновому каркасу через атом серы, как это графически показано в формуле 1, где R - атом водорода или линейный, или разветвленный алкильный (СnН2n+1; n=1-20), алкенильный (CnH2n-1; n=1-20) или алкинильный радикал (СnН2n-3; n=1-20), а также насыщенный (СnН2n-2; n=3-8), ненасыщенный (CnH2n-4; n=5-8, CnH2n-6; n=5-8, CnH2n-8; n=8) или ароматический цикл;
- фрагмент общей формулы -S(CH2)nNRR' или -S(CH2)nN+RR'R”X-, присоединенный к фуллереновому каркасу через атом серы, как это графически показано в формуле 1, где R, R' и R" - атомы водорода или линейные, или разветвленные алкильные (CnH2n+1; n=1-20) радикалы, а также насыщенные (СnН2n-2; n=3-8) циклы; X" - любой анион,
как потенциальные материалы для органической электроники и биомедицины.
Кроме того, поставленная задача решается способом получения серосодержащих производных фуллеренов формулы 1.
Сущность заявляемого изобретения заключается в следующем.
Заявляемые серосодержащие производные фуллеренов, описывающиеся общей формулой 1, являются новым, ранее неизвестным классом соединений фуллеренов. Предполагается, что эти производные фуллеренов найдут применение в фармакологических и медицинских исследованиях в качестве биосовместимой формы фуллерена. В то же время перспективным может быть их использование в органической фотовольтаике в качестве материалов для органических солнечных батарей.
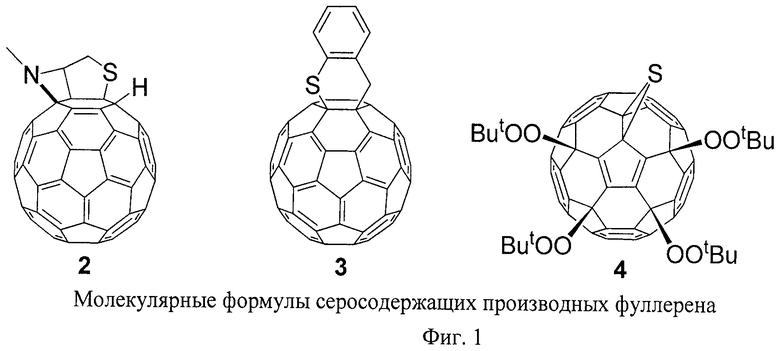
На сегодняшний день известно не так много серосодержащих производных фуллерена, в которых есть ковалентная связь между атомами серы и атомами углерода фуллеренового каркаса. В качестве примеров таких производных можно привести продукт внутримолекулярного присоединения тиолов к двойной связи С60 2 [М.Izquierdo, S.Osuna, S.Filippone, A.Martin-Domenech, M.Sola, N.Martin. Eur. J.Org. Chem., 6231-6238 (2009)], соединение 3, образующееся в результате реакции Дильса-Альдера [М.Ohno, S.Kojima, Y.Shirakawa, S.Eguchi. Tetrahedron Lett., 36, 6899 (1995)], а также соединение 4, в котором имеется тиирановый цикл [X.Yang, S.Huang, Z.Jia, Z.Xiao, Z.Jiang, Q.Zhang, L.Gan, B.Zheng, G.Yuan, S.Zhang. J.Org. Chem., 73, 2518-2526 (2008)] (Фиг.1). Однако все эти производные фуллерена сложно считать близкими структурными аналогами серосодержащих производных фуллеренов общей формулы 1, т.к. в их состав входит всего один атом серы, ковалентно связанный с фуллереновым каркасом, и они являются продуктами реакций циклизации или циклоприсоединения.
Наиболее близкими структурными аналогами заявляемых серосодержащих производных фуллерена являются описанные ранее смеси соединений общей формулы С60(SR')n с неустановленными составом и строением [Y.Takaguchi, Y.Katayose, Y.Yanagimoto, J.Motoyoshiya, H.Aoyama, T.Wakahara, Y.Maeda, T.Akasaka. Chem. Lett., 32, 1124 (2003) (n=2), 26 - L.Y.Chiang, United States Patent "Polyorganofullerenes", №6046361 от 4.04.2000 (n=2-30)].
Имеется ряд принципиальных отличий заявляемых соединений общей формулы 1 от известных ранее аналогов. Во-первых, соединения общей формулы 1 имеют четко установленную структуру с пятью фрагментами SR1, присоединенными к фуллереновому каркасу вокруг одного пятичленного цикла. Во-вторых, в структуре 1 реализуется циклопентадиенильный мотив присоединения аддендов к каркасу фуллерена С60, а не мотивы [1,2]-присоединения по [6,6]-связи фуллеренового каркаса, как в С60(SR')2 или рандемизованного полиприсоединения, как в C60(SR')n. В-третьих, соединения общей формулы 1 содержат в своей структуре дополнительный фрагмент X, ответственный за проявление соединениями формулы 1 специфических свойств.
Наиболее сильно отличаются способы синтеза соединений. Так, известно, что соединения С60(SR')2 получают по реакции фотохимического присоединения дисульфидов к фуллереновому каркасу, протекающей в присутствии дифенилдиселенида в качестве инициатора радикальной реакции. Этот способ применим лишь к ограниченному кругу субстратов и отличается низкими выходами целевого продукта реакции. Полимеркаптофуллерены C60(SR')n получают по реакции полисульфо - (С60(SO4)n) или полинитрофуллеренов (С60(NO2)n) с тиолами или тиокислотами, протекающей в присутствии основания - триэтиламина или 1,8-диазабицикло[5.4.0]ундецена-7 (ДБУ). Образующиеся соединения являются сложными смесями продуктов с неустановленными составом и строением.
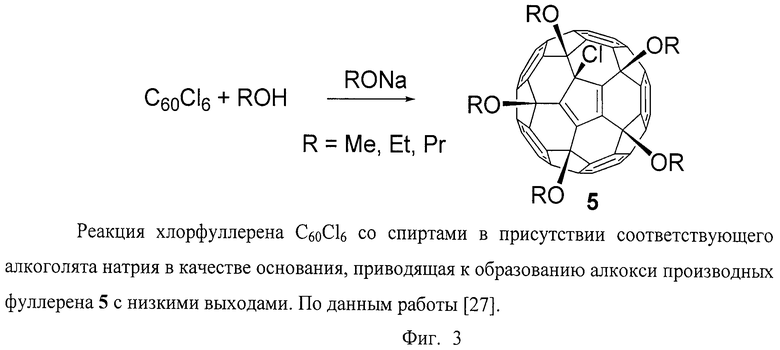
Прототипом заявляемого способа получения серосодержащих производных фуллерена является способ, согласно которому хлорфуллерен С60Сl6 взаимодействует со спиртами, реакция протекает в присутствии соответствующего алкоголята натрия в качестве основания (Фиг.3) [A.G.Avent, P.R.Birkett, A.D.Darwish, S.Houlton, R.Taylor, K.S.Т.Thomson, X.Wei, "Formation and characterization of alkoxy derivatives of [60]fullerene", J.Chem. Soc., Perkin Trans. 2, 2001, 782-786]. Данная реакция приводит к производным фуллеренов с пятью присоединенными алкокси-группами, что делает их сходными с соединениями общей формулы 1. Выход целевого продукта по реакции низкий (менее 60 процентов). Также можно отметить низкую скорость протекания реакции (более одного часа).
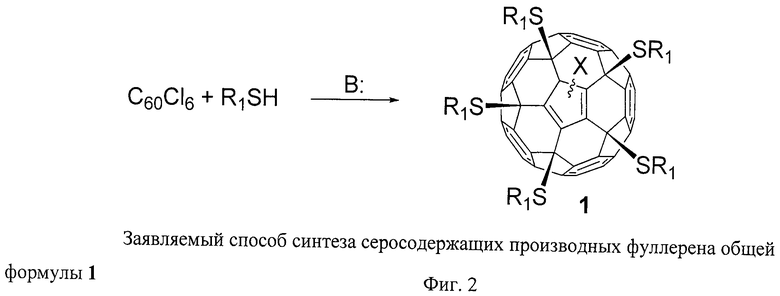
Заявляемый способ получения серосодержащих производных фуллерена общей формулы 1 основан на взаимодействии хлорфуллерена С60Сl6 с соответствующими производными тиокислот, тиокислотами и тиолами в присутствии основания (Фиг.2). В качестве основания можно использовать карбонаты и гидрокарбонаты щелочных металлов (успешно были использованы K2СО3, NaHCO3, Na2CO3, Сs2СО3), соли карбоновых кислот со щелочными металлами (высокие выходы были получены при использовании CH3COONa), фосфаты щелочных металлов (например, K3РO4). Наиболее предпочтительны органические основания, такие как третичные амины: триэтиламин, диизопропилэтиламин и др., позволяющие проводить реакцию при комнатной температуре в течение нескольких минут. В реакции потенциально могут использоваться в качестве оснований и любые другие соединения, к которым может применяться термин «основания» ввиду их способности связывать выделяющийся в реакции НСl.
Принципиальным отличием данного изобретения является использование соответствующих тиолов и аналогичных им соединений в качестве реагентов для функционализации хлорфуллерена С60Сl6. К преимуществам заявляемого способа получения серосодержащих производных фуллерена можно также отнести использование мягких оснований (ацетата натрия, карбоната калия или третичных аминов), быстроту протекания синтезов (5 мин - 1 ч) и высокие выходы продуктов (от 60% до 95%).
Наиболее гладко реакции протекают при температуре 15-60°С и, как правило, со 100% селективностью приводят к образованию серосодержащих производных фуллерена общей формулы 1. В случае, когда из-за низкого качества реагента или особенностей его строения реакция протекает с меньшей селективностью, целевой продукт может быть выделен в чистом виде с выходом более 60% в результате хроматографической очистки.
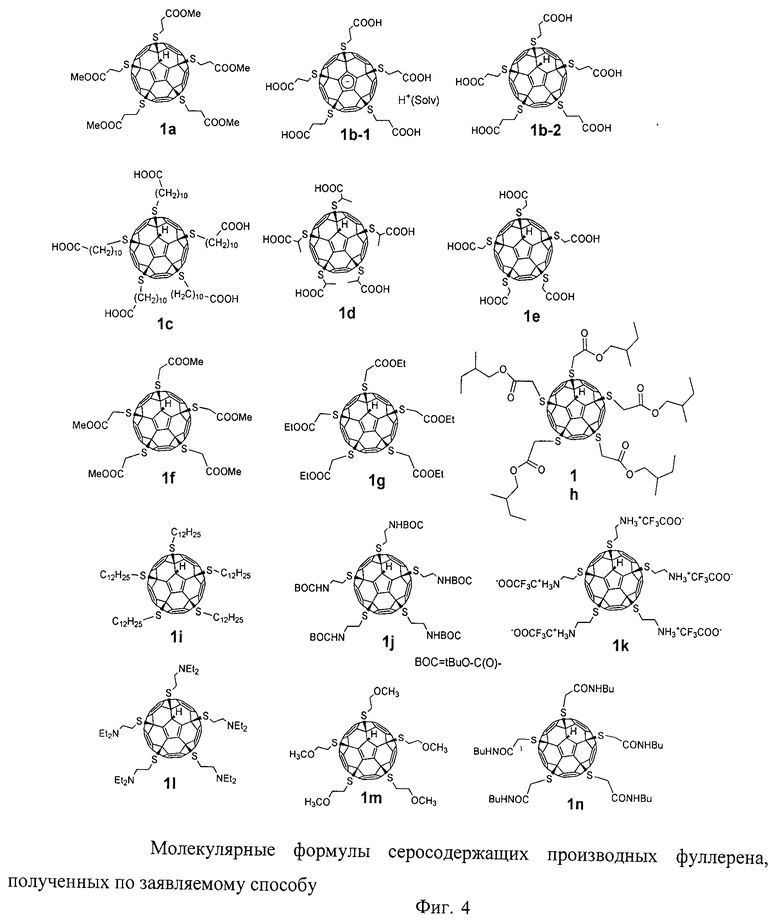
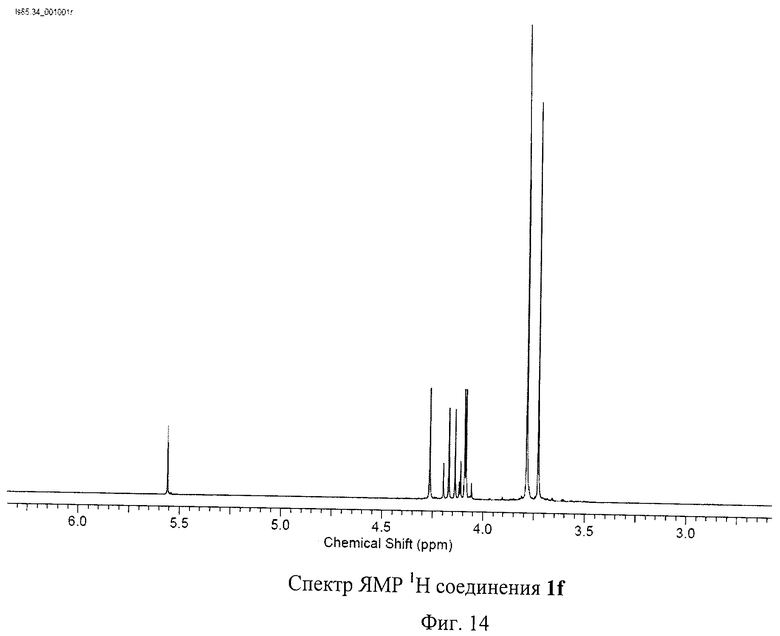
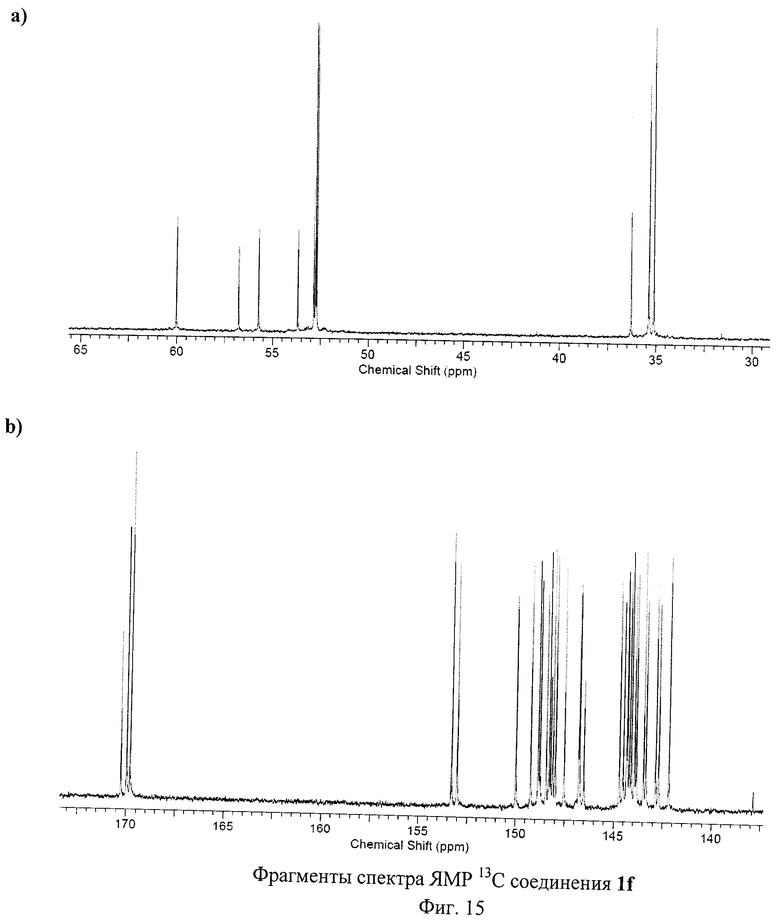
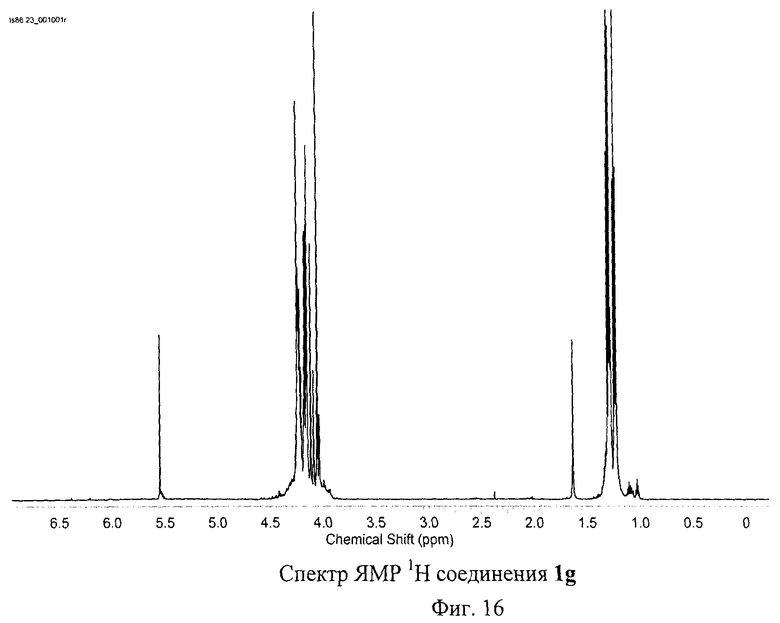
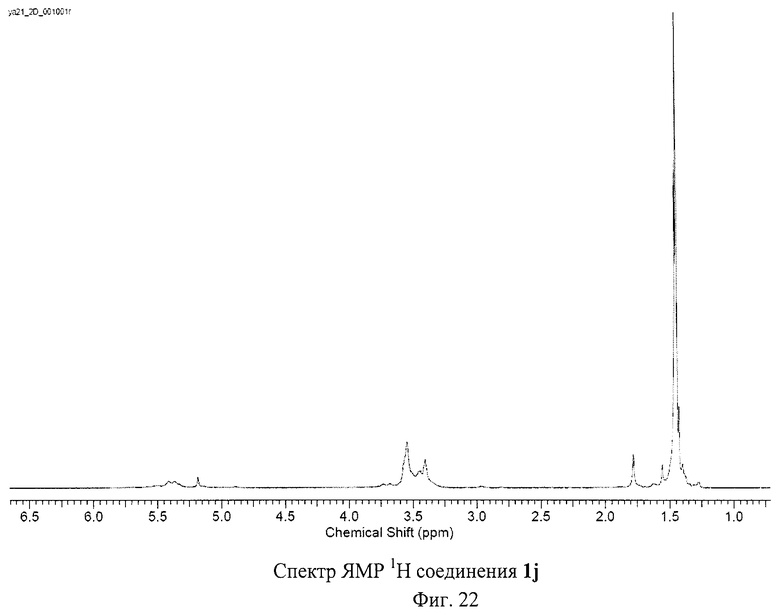
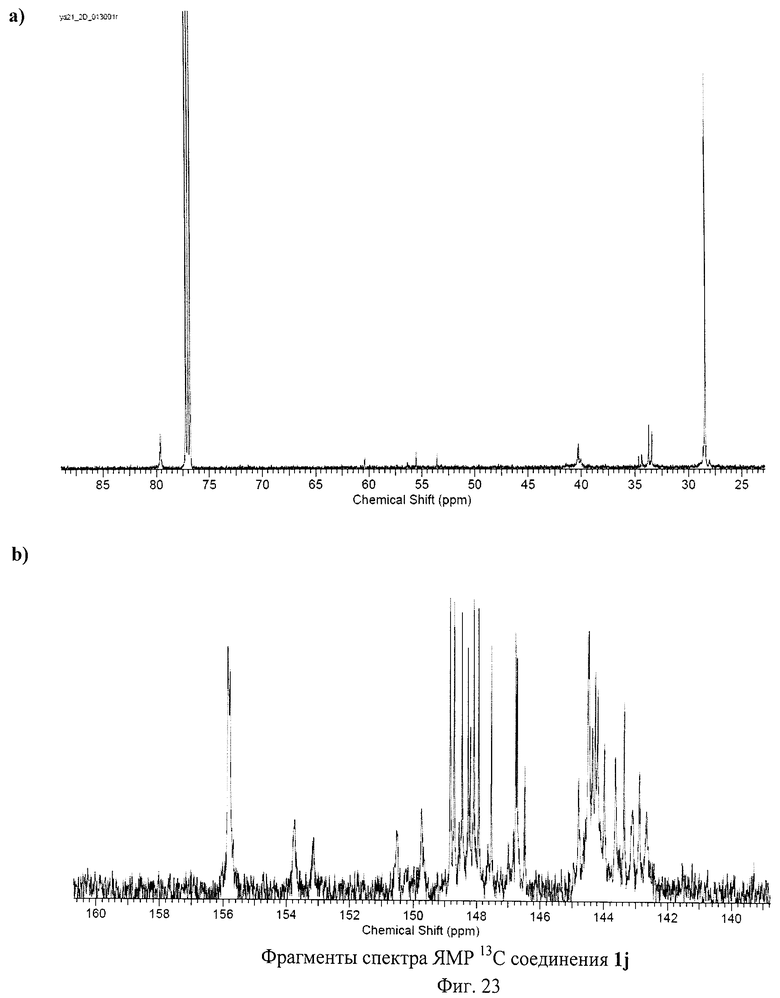
Разработанный подход позволяет получать самые разнообразные серосодержащие производные фуллеренов. Отдельные примеры синтезированных соединений представлены на Фиг.4. Реакция хлорфуллерена С60Сl6 с соответствующими эфирами тиокислот протекает в присутствии избытка основания - карбоната калия или ацетата натрия - при нагревании раствора реагентов в толуоле в течение часа. Более предпочтительно использование диизопропилэтиламина: реакция протекает при перемешивании реакционной смеси при комнатной температуре в течение 5 мин. Выделение продуктов реакции осуществляется с помощью колоночной хроматографии на силикагеле с использованием в качестве элюента смесей толуола с ацетонитрилом. Таким способом были получены соединение 1а (Пример 1, 2), которое в результате кислотного гидролиза превращается в поликарбоксильное производное 1b, а также соединения 1f-h, 1j (Примеры 7-9, 11).
В качестве реагентов успешно использовали соответствующие тиокислоты, что позволило провести одностадийный синтез поликарбоксильных производных 1b-е (Примеры 3-6), соли которых отличаются высокой растворимостью в воде (>50 мг/мл). Реакция с тиокислотами протекает в присутствии избытка основания - ацетата натрия при нагревании или третичного амина при комнатной температуре. По мере протекания реакции в осадок из реакционной смеси выпадают соли продукта, которые затем отделяют фильтрованием и растворяют в дистиллированной воде. Из водного раствора соединения 1b-е осаждают добавлением соляной кислоты. Разработанный метод синтеза позволяет легко и эффективно получать поликарбоксильные производные фуллерена в мультиграммовых количествах.
Необходимо отметить, что в зависимости от структуры соответствующей тиокислоты или ее эфира, жесткости используемого основания и условий проведения реакции, образующиеся соединения могут содержать в качестве шестого адденда, присоединенного к фуллереновому каркасу, атом водорода или просто отрицательный заряд, делокализованный в циклопентадиенильном фрагменте на фуллереновом каркасе. В последнем случае образуются фуллереновые анионы, такие как 1b-1, которые отличаются чрезвычайной устойчивостью и не протонируются в водной среде и даже при действии органических кислот (уксусная, трифторуксусная). Подобные стабильные фуллереновые анионы являются уникальными и могут найти практические приложения, в частности, в нелинейной оптике и для получения материалов с необычными магнитными свойствами [28 - P.W.Stephens, D.Cox, J.W.Lauher, L.Mihaly, J.B.Wiley, P.-M.Allemand, A.Hirsch, K.Holczer, Q.Li, J.D.Thompson, F.Wudl. Nature, 355, 331 (1992)].
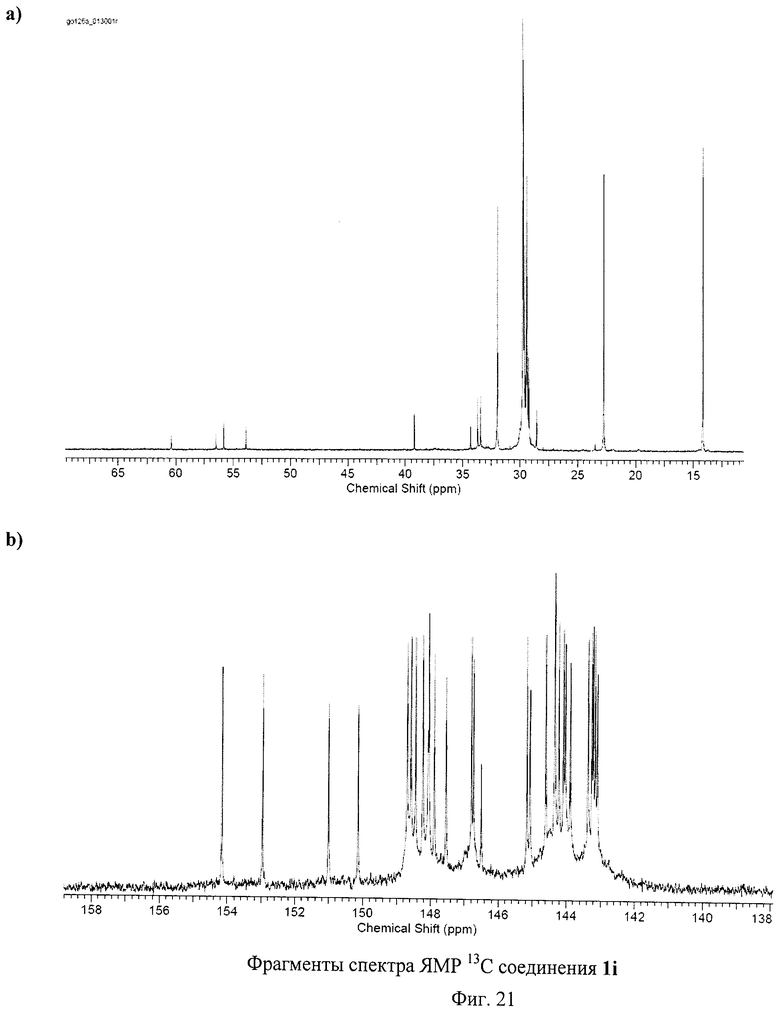
Состав и строение полученных соединений были доказаны с использованием комплекса физико-химических методов исследования: спектроскопии ЯМР на ядрах 1Н и 13С, двумерной корреляционной спектроскопии, ИК-спектроскопии, оптической спектроскопии поглощения и элементного анализа. Чистота соединений подтверждена с использованием высокоэффективной жидкостной хроматографии. Обсуждение всех полученных спектральных и аналитических данных не представляется возможным в рамках данной заявки. Поэтому приводятся данные для наиболее типичных соединений.
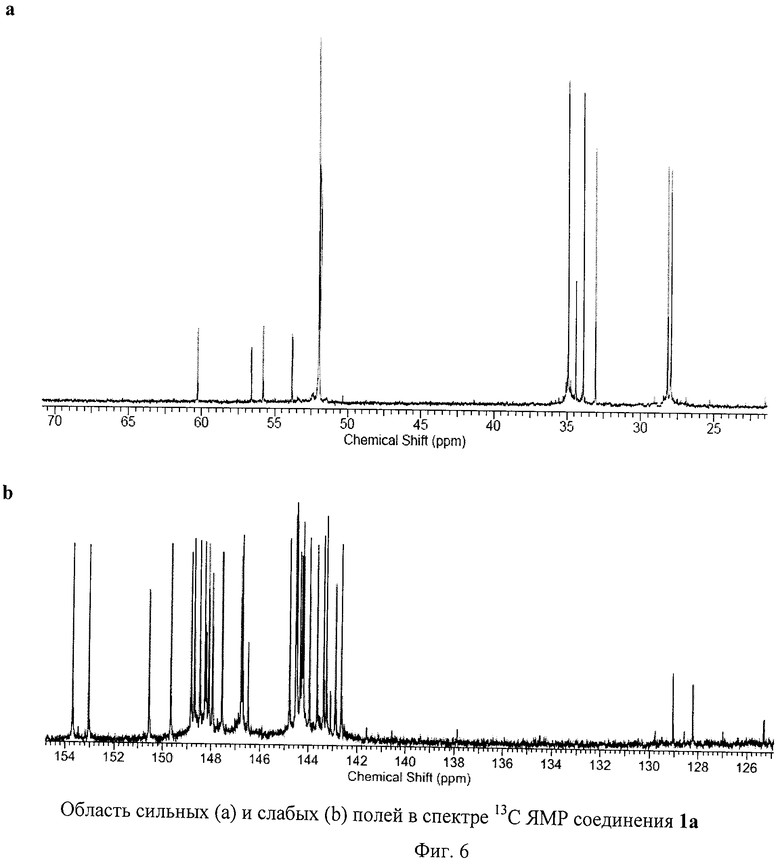
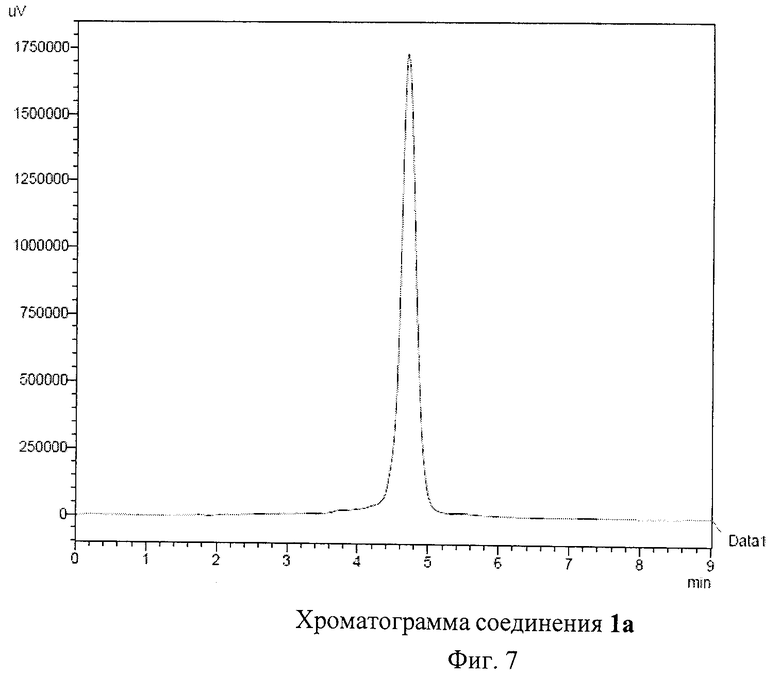
На Фиг.5 и Фиг.6 приведены ЯМР спектры соединения 1а, которые подтверждают его Cs-симметричную структуру. В спектре ЯМР 13С соединения 1а обнаружено 28 сигналов, соответствующих sр2-гибридным атомам углерода фуллеренового каркаса, 3 сигнала, соответствующих карбоксильным атомам углерода (всего 31 сигнал в области слабых полей), 4 сигнала от sр3-гибридных атомов углерода фуллеренового каркаса и 9 - от sp3-гибридных атомов аддендов (всего 13 сигналов в области сильных полей). Этот спектр полностью согласуется с молекулярной структурой соединения 1а. Спектр ЯМР 1Н соединения 1а имеет довольно сложную структуру из частичного наложения сигналов от трех типов симметрически неэквивалентных -S-СН2СН2СООМе групп. Однако наблюдаемые интегральные интенсивности сигналов и их мультиплетности в целом соответствуют предложенной структуре. Высокая чистота полученного препарата 1а подтверждается хроматограммой, приведенной на Фиг.7.
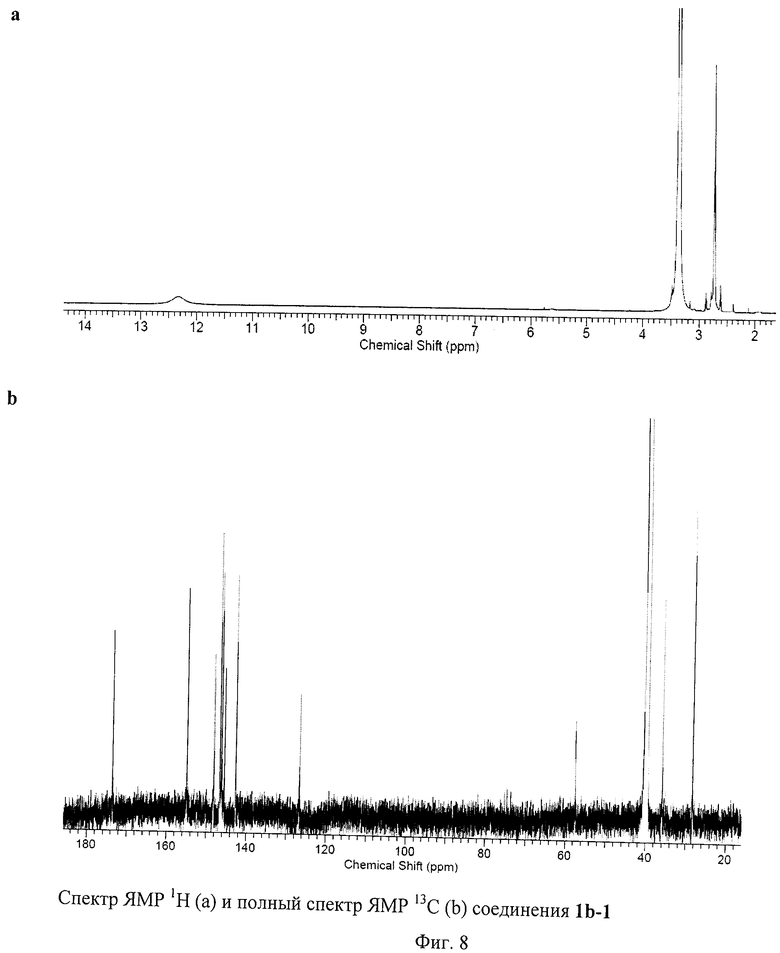
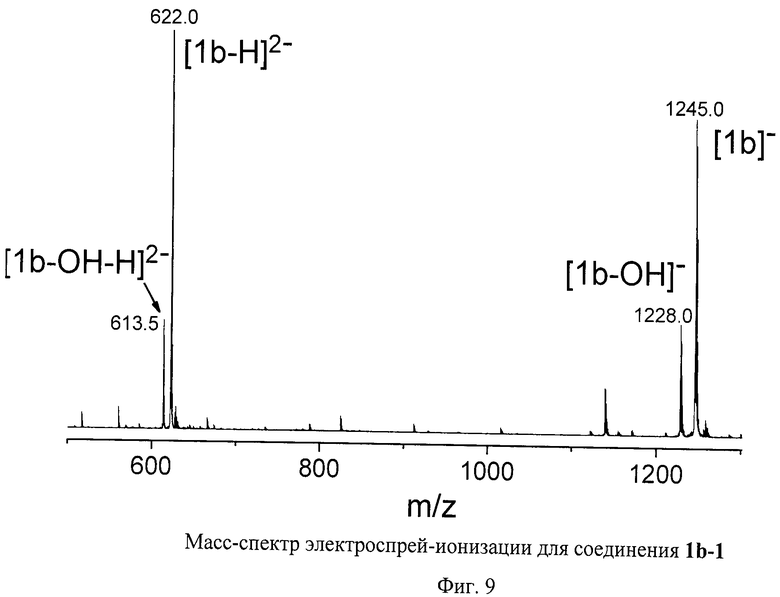
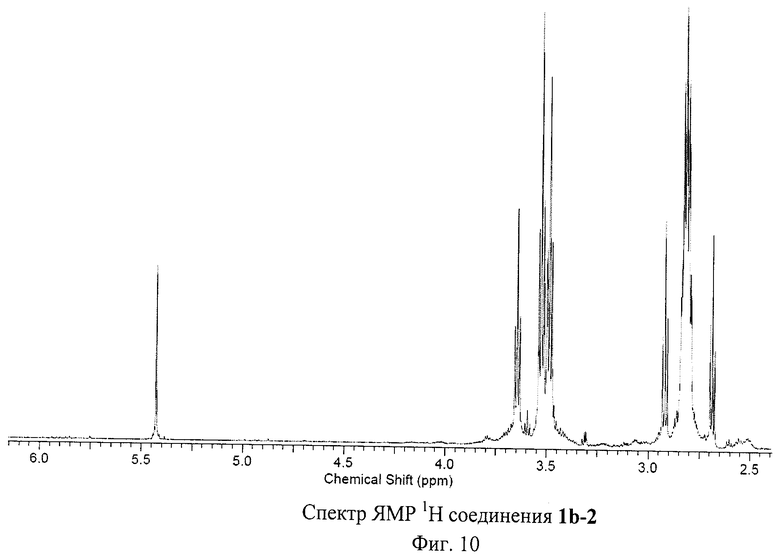
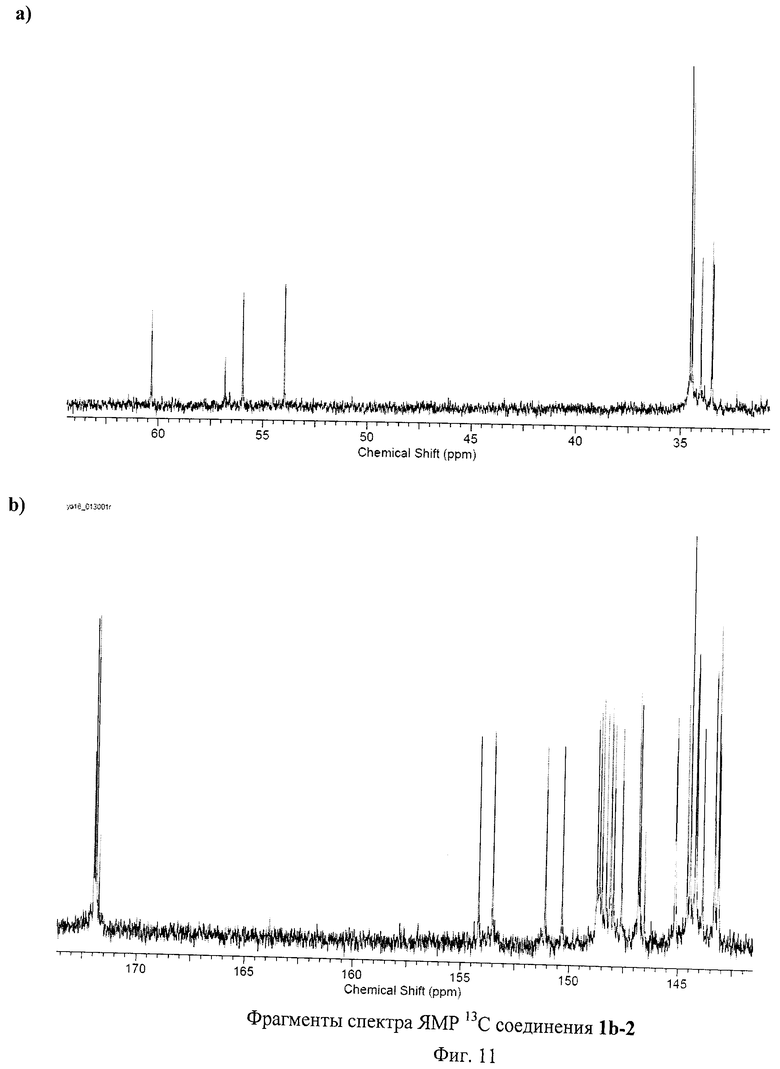
На Фиг.8 изображены ЯМР спектры соединения 1b-1. Это соединение представляет собой стабильный на воздухе фуллереновый анион, единственной структурной аналогией которого являются полученные нами соли аниона [С60(СN)5]- [29 - Р.A.Troshin, Е.A.Khakina, A.S.Peregudov, D.V.Konarev, I.V.Soulimenkov, S.M.Peregudova, and R.N.Lyubovskaya, Eur. J.Org. Chem. 2010, 3265-3268]. Спектр ЯМР 1Н соединения 1b-1 содержит лишь сигналы, принадлежащие пяти эквивалентным по симметрии остаткам 3-меркаптопропановой кислоты. Заметим, что один из сигналов при 3.37 м.д. перекрывается с сигналом воды, присутствующей в ДМСО-D6. Область слабых полей в спектре ЯМР 13С содержит пик при 173 м.д., соответствующий карбоксильной группе (-С(О)ОН), и семь сигналов, принадлежащих фуллереновому каркасу. Область сильных полей представлена двумя сигналами от sp3-гибридных атомов углерода эквивалентных по симметрии остатков 3-меркаптопропановой кислоты и одним сигналом от пяти эквивалентных по симметрии sp3-гибридных атомов углерода фуллеренового каркаса. Таким образом, молекула 1b-1 имеет уникальную для соединений фуллеренов симметрию C5v, причем ось симметрии пятого порядка проходит через циклопентадиенильный фрагмент, локализованный на фуллереновом каркасе. Анализ соединения 1b-1 методом ВЭЖХ оказался невозможным ввиду его прочного связывания с сорбентом. Масс-спектр соединения 1b-1 показал сигнал, соответствующий аниону [1b-1]- при m/z=1245, пик фрагментарного иона [1b-1-OH]- при m/z=1228, а также пики, соответствующие дианионам [1b-1-H]2- (m/z-622) и [1b-1-H-OH]2- (m/z=613.5) (Фиг.9). Таким образом, данные масс-спектрометрии полностью подтверждают состав соединения 1b-1.
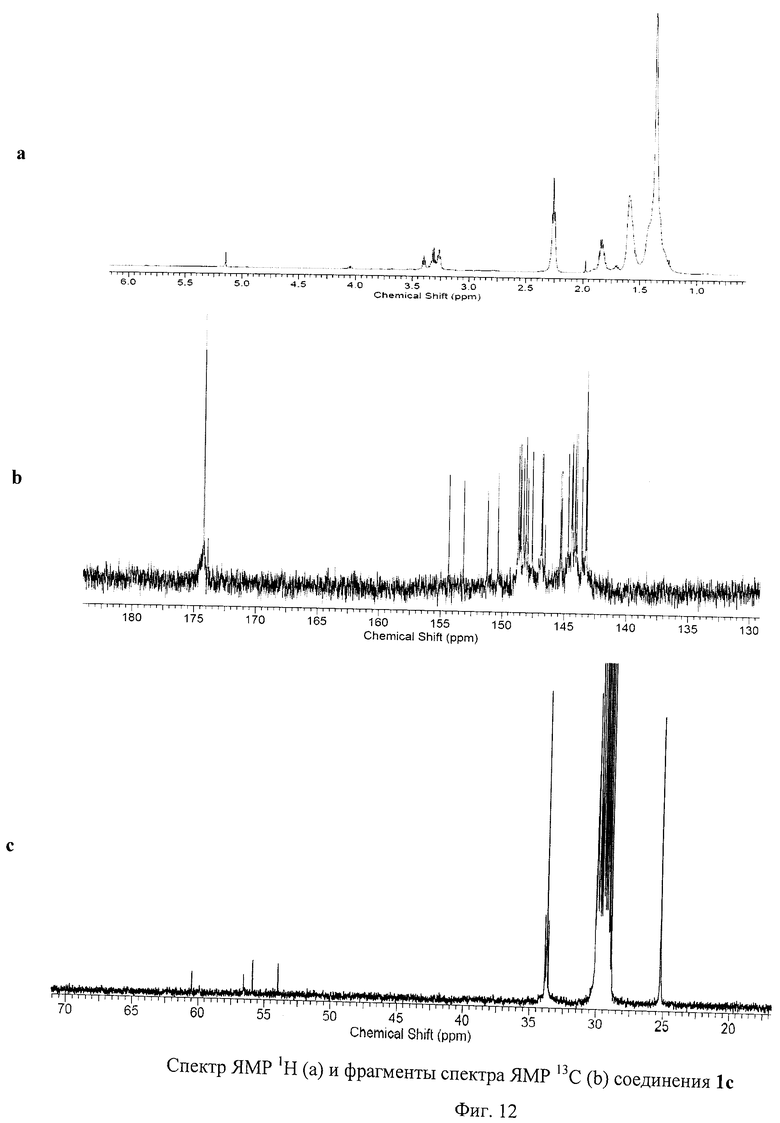
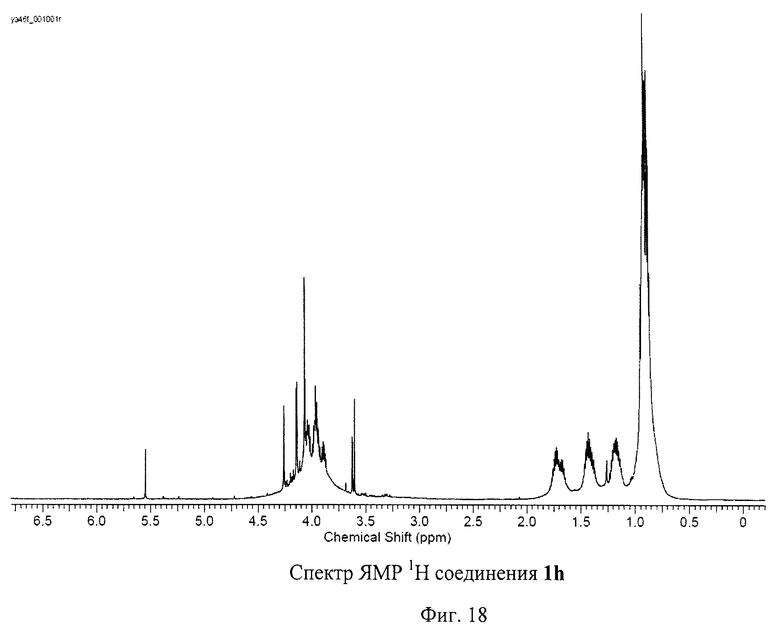
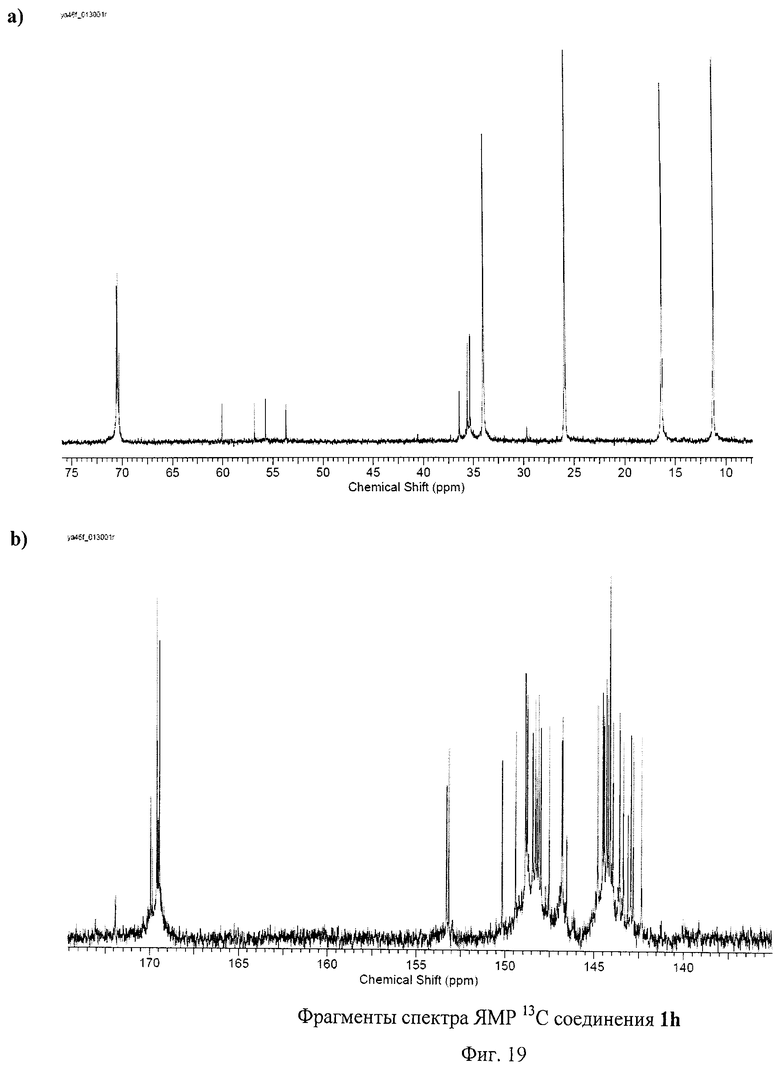
На Фиг.12 представлены спектры ЯМР 1Н и 13С соединения 1с, содержащего пять остатков 11-меркаптоундекановой кислоты. Спектр ЯМР 1Н демонстрирует сигнал атома водорода, присоединенного к фуллереновому каркасу, в виде синглета при 5.15 м.д. Наблюдается также группа сигналов при 3.31 м.д., относящаяся к метиленовым звеньям, непосредственно соседствующим с карбоксильными группами в соединении 1с. При 2.26 м.д. наблюдается мультиплет, который можно приписать метиленовым группам, соседствующим с атомами серы, присоединенными к фуллереновому каркасу. Также наблюдаются сигналы метиленовых протонов при 1.36, 1.60 и 1.84 м.д. Спектр ЯМР 13С по числу сигналов и наблюдаемым химическим сдвигам полностью соответствует молекулярной структуре соединения 1с.
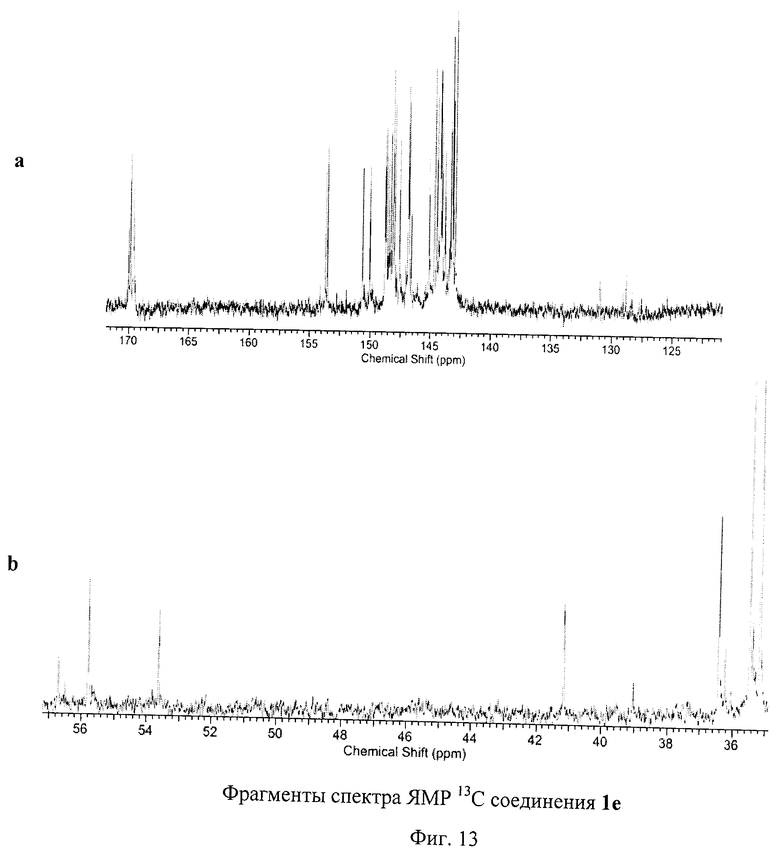
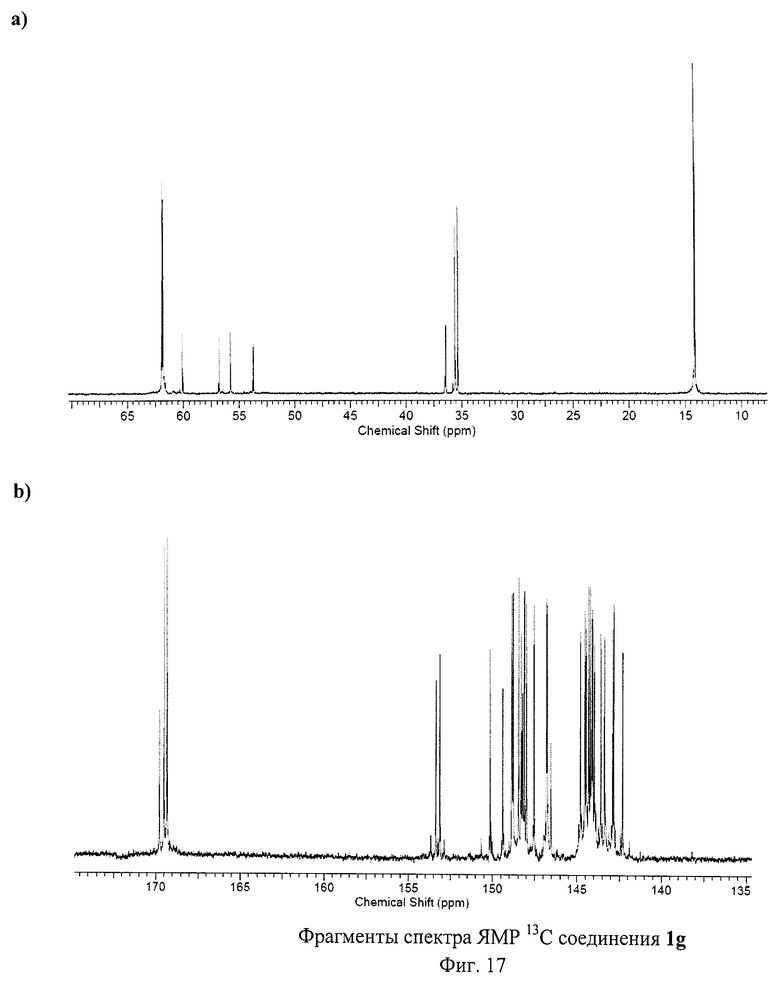
На Фиг.13 изображен спектр ЯМР 13С соединения 1е, содержащего пять остатков меркаптоуксусной кислоты. В представленном спектре имеется 28 сигналов, соответствующих sp2-гибридным атомам углерода фуллеренового каркаса, 3 сигнала, соответствующих карбоксильным атомам углерода, 4 сигнала от sp3-гибридных атомов углерода фуллеренового каркаса и 3 сигнала, принадлежащих sр3-гибридным атомам углерода аддендов. Таким образом, спектр полностью подтверждает Cs-симметричную структуру соединения 1е.
Заявляемое изобретение иллюстрируется, но никак не ограничивается, следующими примерами.
Пример 1. Синтез соединения 1а с использованием ацетата натрия в качестве основания
Хлорфуллерен С60Сl6 (500 мг, 0,5 ммоль) растворяли в атмосфере аргона в 200 мл свежеперегнанного толуола. К раствору в токе аргона прибавляли 500 мг измельченного в ступке сухого ацетата натрия и большой избыток метилового эфира 3-меркаптопропионовой кислоты (1,6 мл, 14,4 ммоль). Реакционную смесь нагревали до 50-60°С при интенсивном перемешивании в течение шести часов. Степень протекания реакции контролировали с помощью тонкослойной хроматографии на силуфоле. Выделение продуктов реакции осуществляли с помощью колоночной хроматографии на силикагеле с использованием в качестве элюентов смесей толуола с ацетонитрилом. Выход аналитически чистого (99+%) продукта составил 420 мг (64% от теории).
1Н ЯМР (600 МГц, CDCl3, δ, м.д.): 2.76 (т, 2Н), 2.86 (м, 6Н), 2.94 (т, 2Н), 3.50 (м, 6Н), 3.61 (т, 2Н), 3.73 (м, 17Н), 5.18 (с, 1Н).
13С ЯМР (150 МГц, CDCl3, δ, м.д.): 27.95 (CH2), 28.19 (СН2), 33.08 (СН2), 33.90 (СН2), 34.41 (СН2), 34.95 (СН2), 51.93 (ОСН3), 51.97 (ОСН3), 51.99 (ОСН3), 53.81 (Csp3 каркаса), 55.80 (Csp3 каркаса), 56.58 (Csp3 каркаса), 60.27 (Csp3 каркаса), 128.24, 129.05, 142.66, 142.90, 143.10, 143.66, 143.98, 144.23, 144.29, 144.36, 144.52, 144.55, 144.80, 146.50, 146.73, 146.79, 147.57, 147.97. 148.12, 148.22, 148.28, 148.48, 148.72, 148.84, 149.68, 150.57. 153.04, 153.70, 171.89 (СООСН3), 171.91 (СООСН3), 171.93 (СООСН3).
Пример 2. Синтез соединения 1а с использованием основания Хенига (диизопропилэтиламина)
Хлорфуллерен С60Сl6 (500 мг, 0,5 ммоль) растворяли на воздухе в 200 мл толуола марки «хч». К раствору прибавляли избыток метилового эфира 3-меркаптопропионовой кислоты (0,55 мл, 5 ммоль) и 6 эквивалентов (0,495 мл, 3 ммоль) основания Хенига (диизопропилэтиламина). Реакция протекала в течение 5 минут при комнатной температуре. Выделение продуктов реакции осуществляли с помощью колоночной хроматографии на силикагеле с использованием в качестве элюентов смесей толуола с этилацетатом. Выход аналитически чистого (99+%) продукта составил 560 мг (85% от теории).
Спектральные данные продукта идентичны приведенным в примере 1.
Пример 3. Синтез соединения 1b-1 с использованием ацетата натрия в качестве основания
Хлорфуллерен С60Сl6 (1500 мг, 1,6 ммоль) растворяли в атмосфере аргона в 800 мл свежеперегнанного толуола. К раствору прибавляли 5-10 г измельченного в ступке сухого ацетата натрия и большой избыток 3-меркаптопропановой кислоты (3,75 мл, 35 ммоль). Реакционную смесь нагревали до 50-60°С при интенсивном перемешивании в течение часа. Протекание реакции сопровождалось образованием красно-оранжевого осадка продукта. После окончания реакции осадок отфильтровывали, промывали ацетоном и затем смывали с фильтра дистиллированной водой. В полученный ярко-красный раствор добавляли по каплям соляную кислоту до полного осаждения поликарбоксильного производного 1b-1. Образовавшийся ярко-красный осадок отделяли центрифугированием, промывали трижды дистиллированной водой и затем переносили с ацетоном в круглодонную колбу на 250 мл и упаривали досуха. Выход продукта составил 1450 мг (72% от теории).
1Н ЯМР (600 МГц, (СD3)2SO, δ, м.д.): 2.73 (т, 10Н), 3.37 (т, 10Н), 12.32 (уш. с., 5Н)
13С ЯМР (150 МГц, (СD3)2SO, δ, м.д.): 28.55, 36.20, 57.35, 127.10, 142.45, 146.10, 146.55, 147.12, 148.32, 155.17, 173.44.
Пример 4. Синтез соединения 1b-2 с использованием основания Хенига
Хлорфуллерен С60Сl6 (1500 мг, 1,6 ммоль) растворяли на воздухе в 900 мл толуола марки «хч». К раствору прибавляли избыток 3-меркаптопропановой кислоты (1,4 мл, 16 ммоль) и 16 эквивалентов (4.2 мл, 25.6 ммоль) основания Хенига (диизопропилэтиламина). Реакция протекала в течение 5 минут при комнатной температуре. Образовавшийся осадок отделили центрифугированием, высушили на воздухе, перевели в раствор прибавлением эквивалентного количества 0.05 М раствора карбоната калия. Водный раствор соли профильтровали через бумажный фильтр и к фильтрату прибавляли избыток соляной кислоты до полного осаждения кислоты 1b-2.
Выпавший осадок 1b-2 отделили центрифугированием, растворили в ацетоне и упарили досуха на ротационном испарителе. Выход аналитически чистого (99+%) продукта составил 1895 мг (95% от теории).
1Н ЯМР (600 МГц, (CD3)2CO:CS2 (1:1), δ, м.д.): 2.69 (т, 1Н), 2.78-2.86 (м, 8Н), 2.92 (т, 1Н), 3.46-3.55 (м, 7Н), 3.59 (т, 1Н), 3.65 (т, 2Н), 5.43 (с, 1Н).
13С ЯМР (150 МГц, (СD3)2СО:СS2 (1:1), δ, м.д.): 33.49 (СН2), 33.53 (CH2), 34.04 (СН2), 34.48 (СН2), 34.57 (СН2), 53.98 (Csp3 каркаса), 55.98 (Csp3 каркаса), 56.82 (Csp3 каркаса), 60.35 (Csp3 каркаса), 143.16, 143.21, 143.37, 143.90, 144.21, 144.23, 144.27, 144.50, 144.63, 145.16, 145.19, 146.57, 146.79, 146.86, 147.64, 148.01, 148.15, 148.17, 148.34, 148.53, 148.65, 148.77, 150.35, 151.12, 153.55, 154.20, 171.91 (СООН), 171.99 (СООН), 172.02 (СООН).
Пример 5. Синтез соединения 1с.
Хлорфуллерен С60Сl6 (500 мг, 0,5 ммоль) растворяли в атмосфере аргона в 400 мл свежеперегнанного толуола. К раствору прибавляли 3-5 г измельченного в ступке сухого ацетата натрия и большой избыток 11-меркаптоундекановой кислоты (1462 мг, 7 ммоль). Реакционную смесь нагревали до 50-60°С при интенсивном перемешивании в течение часа. Протекание реакции сопровождалось образованием красно-оранжевого осадка продукта. После окончания реакции осадок отфильтровывали, промывали ацетоном и затем смывали с фильтра дистиллированной водой. В полученный ярко-красный раствор добавляли по каплям соляную кислоту до полного осаждения поликарбоксильного производного 1с. Образовавшийся ярко-красный осадок отделяли центрифугированием, промывали трижды дистиллированной водой и затем переносили с ацетоном в круглодонную колбу на 250 мл и упаривали досуха. Выход продукта составил 759 мг (84% от теории).



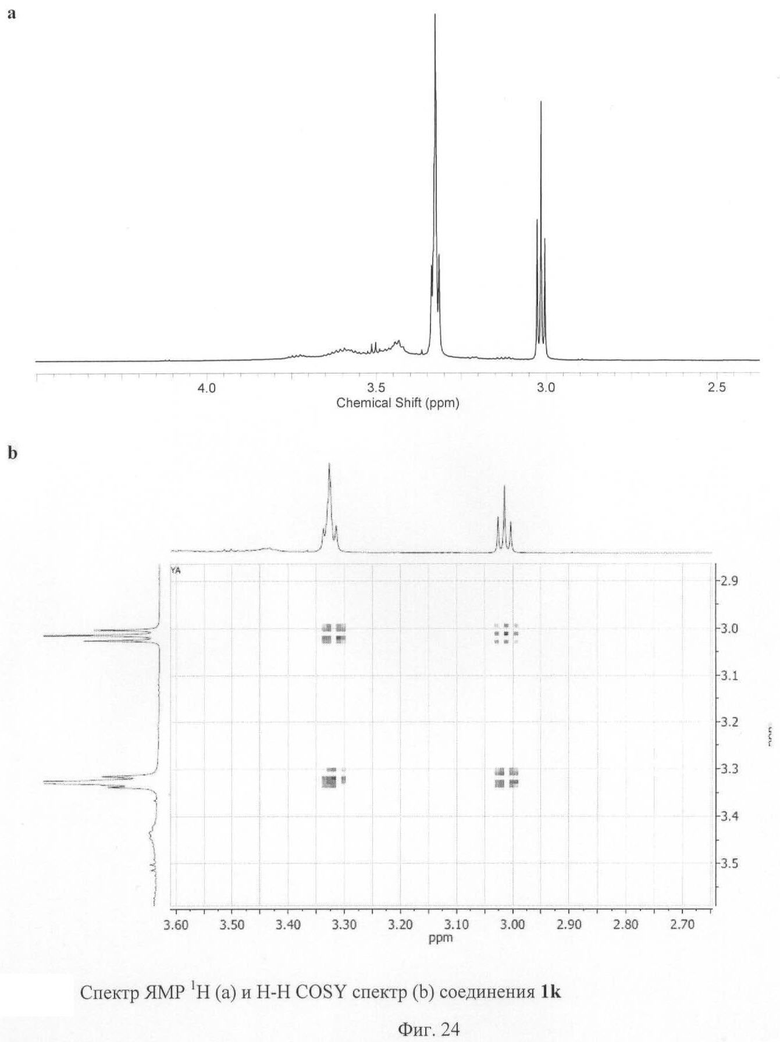
Пример 12. Синтез соединения 1k.
Соединение 1j (300 мг) растворили в 30 мл хлористого метилена. Прибавили 1 мл трифторуксусной кислоты, перемешивали 5 минут. Растворитель и избыток реагента отогнали на ротационном испарителе. Сухой остаток промыли этилацетатом и высушили на воздухе. Выход соединения 1k составил 95% от теоретического.
1Н ЯМР (600 МГц, CD3OD, δ, м. д.): 3.01 (т, 10 Н), 3.33 (м, 10 Н).
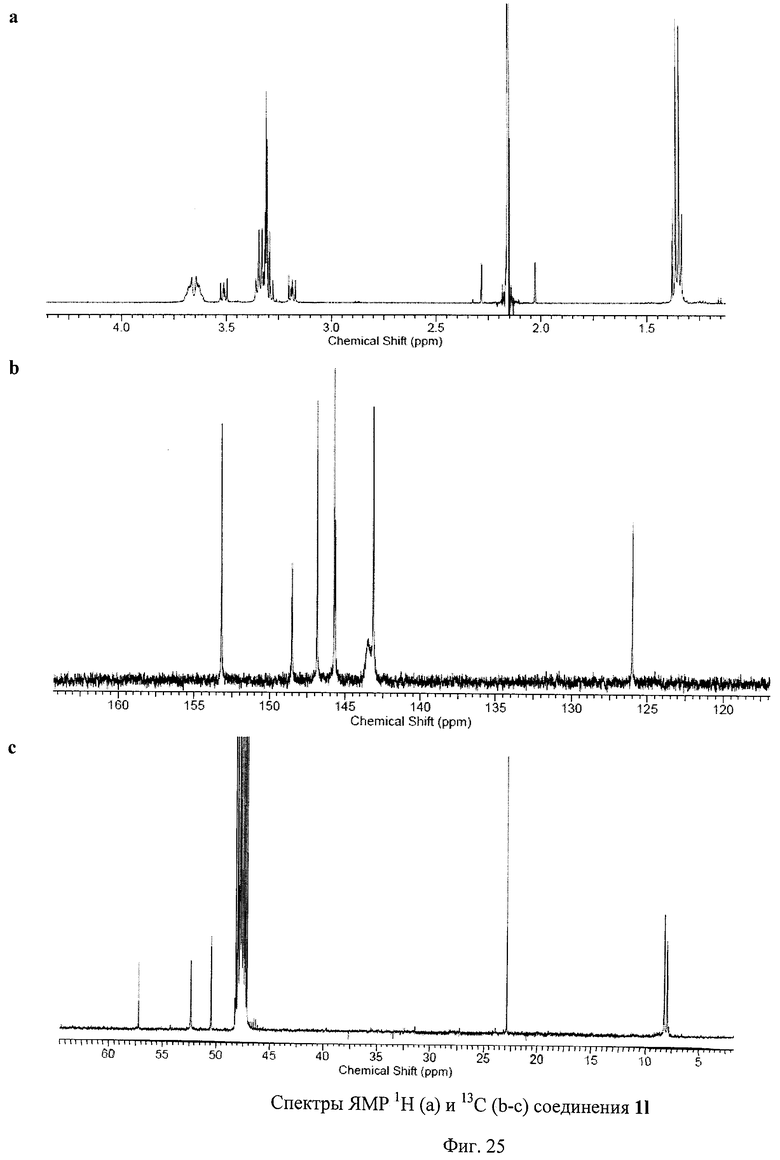
Пример 13. Синтез соединения 1l.
Синтез проводили в полной аналогии с методикой, описанной в примере 2 для соединения 1а. Выход аналитически чистого соединения 1l составил 96% от теории.
1H ЯМР (500 МГц, СD3OD, δ, м. д.): 1.37 (м, 30Н), 3.19 (м, 2Н), 3.28-3.36 (м, 26Н), 3.51 (м, 2Н), 3.60-3.73 (м, 10Н).
13С ЯМР (150 МГц, CDCl3, δ, м. д.): 8.22 (СН3), 22.86 (CH2S), 50.45 (CH2N), 52.34 (CH2N), 57.22 (sp3-C каркаса), 126, 143.12, 145.64, 145.71, 146.84, 148.52, 153.17.
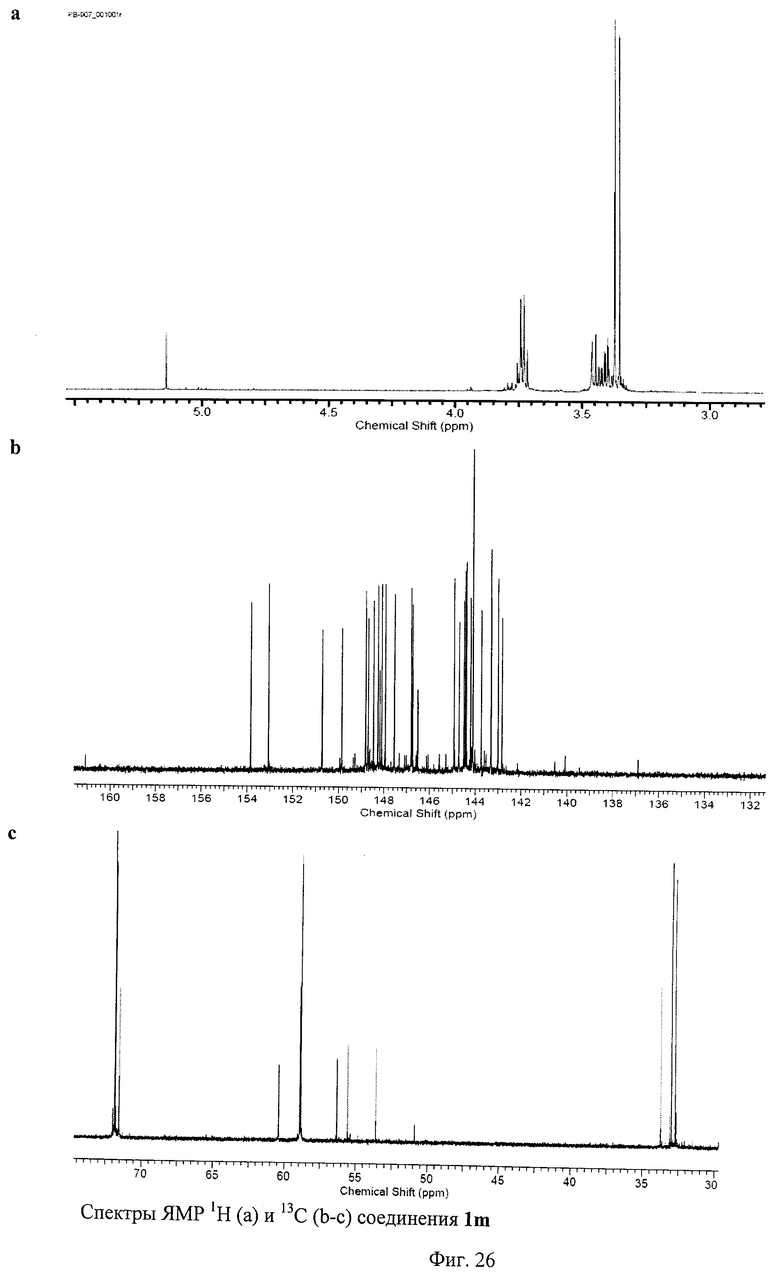
Пример 14. Синтез соединения 1m.
Синтез проводили в полной аналогии с методикой, описанной в примере 2 для соединения 1а. Выход соединения 1 m составил 46% от теории.
1Н ЯМР (500 МГц, СD3ОD, δ, м. д.): 3.35 (с, 6Н), 3.36 (с, 6Н), 3.37 (с, 3Н), 3.40-3.46 (м, 10Н), 3.73 (м, 10Н), 5.14 (с, 1Н).
13С ЯМР (150 МГц, СDСl3, δ, м. д.): 32.75, 33.01, 33.75, 53.62, 55.58, 56.35, 58.85, 58.87, 58.94, 60.42, 71.56, 71.82, 71.87, 142.83, 143.01, 143.32, 143.75, 144.11, 144.22, 144.41, 144.45, 144.51, 144.73, 144.95, 146.54, 146.77, 146.82, 147.56, 147.96, 148.11, 148.2, 148.28, 148.47, 148.7, 148.82, 149.85, 150.72, 153.07, 153.86.

Изобретение относится к серосодержащим производным фуллеренов общей формулы 1, где Х означает: - отрицательный заряд («-»), локализованный на фуллереновом каркасе, или - атом водорода (-Н), или - атом хлора (-Сl), где в общей формуле 1 фрагмент S-R1 определяется как: -остаток тиокислоты или ее сложного эфира, присоединенный к фуллереновому каркасу через атом серы, как это графически показано в формуле 1, a R1 имеет вид XCOOR; Х - линейный или разветвленный алкиленовый (СnН2n; n=1-20) радикал; R - атом водорода (-Н), линейный или разветвленный алкильный (CnH2n+1; n=1-20), алкенильный (CnH2n-1; n=1-20) или алкинильный радикал (С2Н2n-3; n=1-20); - остаток амида тиокислоты, присоединенный к фуллереновому каркасу через атом серы, как это графически показано в формуле 1, где R1 имеет вид XCONRR'; Х - линейный или разветвленный алкиленовый (СnН2n; n=1-20) радикал; R и R' - атомы водорода или линейные, или разветвленные алкильные (CnH2n+1; n=1-20) радикалы; - остаток тиола, где R1 - атом водорода или линейный, или разветвленный алкильный (СnН2n+1; n=1-20) радикал или насыщенный (СnН2n-2; n=3-8) цикл; - фрагмент общей формулы -S(CH2)nSR, присоединенный к фуллереновому каркасу через атом серы, как это графически показано в формуле 1, где R - атом водорода или линейный, или разветвленный алкильный (CnH2n+1; n=1-20), алкенильный (СnН2n-1; n=1-20) или алкинильный радикал (СnН2n-3; n=1-20), а также насыщенный (СnН2n-2; n=3-8), ненасыщенный (СnН2n-4; n=5-8, СnН2n-6; n=5-8, СnН2n-8; n=8) или ароматический цикл; - фрагмент общей формулы -S(CH2)nNRR' или -S(CH2)nN+RR'R"X-, присоединенный к фуллереновому каркасу через атом серы, как это графически показано в формуле 1, где R, R' и R" - атомы водорода или линейные, или разветвленные алкильные (CnH2n+1; n=1-20) радикалы; а также насыщенные (СnН2n-2; n=3-8) циклы; X- - любой анион. Изобретение также касается способа получения указанных соединений. Технический результат - получены новые соединения, которые могут найти применение в биомедицинских исследованиях и в фармакологии, а также в органической фотовольтаике. 2 н. и 1 з.п. ф-лы, 26 ил., 14 пр.

1. Серосодержащие производные фуллеренов общей формулы 1, а именно:
где в общей формуле 1 Х означает:
отрицательный заряд («-»), локализованный на фуллереновом каркасе, или
атом водорода (-Н), или
атом хлора (-Сl),
где в общей формуле 1 фрагмент S-R1 определяется как:
остаток тиокислоты или ее сложного эфира, присоединенный к фуллереновому каркасу через атом серы, как это графически показано в формуле 1, a R1 имеет вид XCOOR; Х - линейный или разветвленный алкиленовый (CnH2n; n=1-20) радикал; R - атом водорода (-Н), линейный или разветвленный алкильный (СnН2n+1; n=1-20), алкенильный (СnН2n-1; n=1-20) или алкинильный радикал (СnН2n-3; n=1-20);
остаток амида тиокислоты, присоединенный к фуллереновому каркасу через атом серы, как это графически показано в формуле 1, где R1 имеет вид XCONRR'; X - линейный или разветвленный алкиленовый (СnН2n; n=1-20) радикал; R и R' - атомы водорода или линейные или разветвленные алкильные (СnН2n+1; n=1-20) радикалы;
остаток тиола, где R1 - атом водорода или линейный или разветвленный алкильный (CnH2n+1; n=1-20) радикал или насыщенный (СnН2n-2; n=3-8) цикл;
фрагмент общей формулы -S(CH2)nSR, присоединенный к фуллереновому каркасу через атом серы, как это графически показано в формуле 1, где R - атом водорода или линейный или разветвленный алкильный (СnН2n+1; n=1-20), алкенильный (CnH2n-1; n=1-20) или алкинильный радикал (СnН2n-3; n=1-20), а также насыщенный (CnH2n-2; n=3-8), ненасыщенный (СnН2n-4; n=5-8, СnН2n-6; n=5-8, CnH2n-8; n=8) или ароматический цикл;
фрагмент общей формулы -S(CH2)nNRR' или -S(CH2)nN+RR'R"Х-, присоединенный к фуллереновому каркасу через атом серы, как это графически показано в формуле 1, где R, R' и R" - атомы водорода или линейные или разветвленные алкильные (СnН2n+1; n=1-20) радикалы; а также насыщенные (СnН2n-2; n=3-8) циклы; X- - любой анион,
как потенциальные материалы для органической электроники и биомедицины.
2. Способ получения серосодержащих производных фуллеренов общей формулы 1 по п.1, включающий взаимодействие хлорфуллерена С60Сl6 с нуклеофильным агентом в присутствии органического (например третичный амин) или неорганического (например СН3СООNа, K2СО3) основания, способного связывать выделяющийся в реакции НСl, отличающийся тем, что в качестве нуклеофильного агента берут соответствующие производные тиокислот, тиокислоты или тиолы.
3. Способ получения по п.2, отличающийся тем, что процесс ведут при температуре 0-150°С, преимущественно при 50-60°С.
| ЕР 0919520 А2, 02.06.1999 | |||
| Устройство для подводной разработки траншей под лежащим на грунте трубопроводом | 1973 |
|
SU546718A1 |
| A.G | |||
| AVENT et al | |||
| J.Chem.Soc., Perkin Trans 2, 2001, p.p.782-786 | |||
| KR 1020080063233 A, 03.07.2008 | |||
| JP 2005112816 A, 28.04.2005 | |||
| СПОСОБ ПОЛУЧЕНИЯ 2,5-ДИФЕНИЛ-3,4-ФУЛЛЕРО[60]ТЕТРАГИДРОТИОФЕН-1-ОНА | 2007 |
|
RU2342380C2 |
Авторы
Даты
2013-03-10—Публикация
2011-03-30—Подача