Изобретение относится к группе производных фуллеренов, обладающих полупроводниковыми свойствами n-типа (т.е. способных к эффективному электронному транспорту), что позволяет их применять при изготовлении полевых транзисторов и электронных чипов, а также любых других электронных устройств, в которых целесообразным является применение полупроводниковых материалов.
Органические полупроводники интенсивно исследуются с конца XIX века. Однако первые реальные практические приложения появились лишь в 1985-1987 гг. Тогда было показано, что на основе органических полупроводников могут быть созданы электронные устройства с планарным p-n гетеропереходом, в том числе высокоэффективные светоизлучающие диоды (ОСИДы) и солнечные батареи [1 - С.W. Tang, S.A. VanSlyke, Organic electroluminescent diodes, Appl. Phys. Lett. 1987, 51, 913; 2 - C.W. Tang, Two-layer organic photovoltaic cell. Appl. Phys. Lett. 1986, 48, 183].
Особое внимание уделяется фуллеренам и их производным как перспективным материалам n-типа. Полевые транзисторы на основе немодифицированного фуллерена C60 показали подвижности носителей зарядов около 4-6 см2. B-1.c-1 [3 - Th. В. Singh, N.S. Sariciftci, Progress in plastic electronics devices, Annu. Rev. Mater. Res. 2006, 36, 199], а на основе органических производных фуллеренов - в пределах 0.01-0.1 см2.B-1.c-1 [3 - T.D. Anthopoulos, F.B. Kooistra, Н.J. Wondergem, D. Kronholm, J.C. Hummelen, D.M. de Leeuw, Air-stable n-channel organic transistors based on a soluble C-84 fullerene derivative. Adv. Mater. 2006, 18, 1679; 4 - T.D. Anthopoulos, D.M. de Leeuw, E. Cantatore, S. Setayesh, E.J. Meijer, C. Tanase, J.C. Hummelen, P.W.M. Blom, Organic complementary-like inverters employing methanofullerene-based ambipolar field-effect transistors. Appl. Phys. Lett. 2004, 85, 4205; 5 - G. Gelinck, P. Heremans, K. Nomoto, T.D. Anthopoulos, Adv. Mater. 2010, 22, 3778]. Соотношение токов во включенном и выключенном состоянии транзисторов достигает величин 106-108, что указывает на перспективы практического использования этих устройств.
Большой прогресс достигнут в разработке фуллерен-содержащих материалов для пластиковых солнечных батарей. В 2010 году были достигнуты к.п.д. преобразования энергии солнечного света около 7-8% на основе органических производных фуллеренов и сопряженных полимеров [6 - F.G. Brunetti, R. Kumar, F. Wudl, Organic electronics from perylene to organic photovoltaics: painting a brief history with a broad brush. J. Mater. Chem., 2010, 20, 2934]. В США в 2009 году запущены первые линии для производства солнечных батарей этого типа [7 - http://www.konarka.com/index.php/technology/roll-to-roll-manufacturing-process/].
Растет интерес к органическим фотодетекторам на основе фуллерен-содержащих материалов, имеющих широкий спектр возможных применений. На основе органических фотодетекторов созданы первые цифровые камеры и двумерные сканеры, в том числе, предназначенные для целей идентификации личности [8 - Т. Someya, Y. Kato, S. Iba, Y. Noguchi, T. Sekitani, H. Kawaguchi, T. Sakurai, Integration of Organic FETs With Organic Photodiodes for a Large Area, Flexible, and Lightweight Sheet Image Scanners. IEEE Trans. Electron. Dev. 2005, 52, 2502].
В последние годы идет непрекращающийся поиск новых фуллерен-содержащих материалов с улучшенными электронными и физико-химическими свойствами. Задачей изобретения является получение органических производных фуллеренов, применение их в качестве фуллерен-содержащих материалов в электронных полупроводниковых устройствах.
В заявляемом изобретении предложен новый способ получения органических производных фуллерен-содержащих материалов.
Прототипом предлагаемого способа получения производных фуллеренов является описанный ранее способ синтеза фуллерен-содержащих материалов - соединений [60]РСВМ и [70]РСВМ [8 - Preparation and Characterization of Fulleroid and Methanofullerene Derivatives].
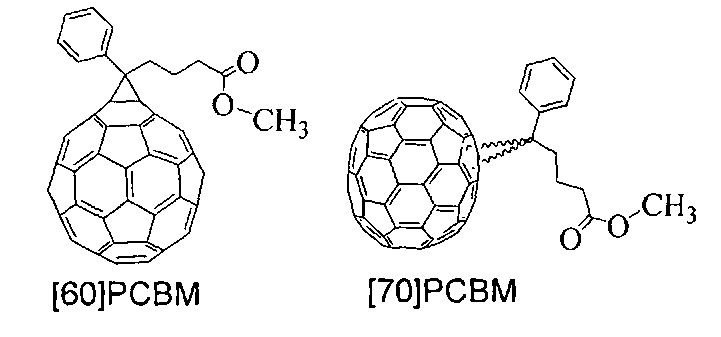
Указанный способ основан на термическом присоединении к фуллереновому каркасу тозилгидразона, полученного из метилового эфира бензоилмасляной кислоты. Синтез соединения [60]РСВМ, который ведут с использованием тозилгидразона, полученного из метилового эфира бензоилмасляной кислоты, представлен на Фиг.1. Способ не позволяет получать производные фуллеренов, содержащие в своей структуре сложноэфирную группу, непосредственно присоединенную к циклопропановому фрагменту на фуллереновой сфере.
Метиловый эфир бензоилмасляной кислоты является известным химическим соединением, отличающимся молекулярной формулой C6H5C(O)(CH2)3COOMe.
Гидразоны - это большой класс органических соединений, отличающихся присутствием в их структуре фрагмента N-N=C.
Тозилгидразонами называют гидразоны, отличающиеся наличием в их составе тозильной группы, связанной с атомом азота: TsNH-N=C, где TS - обозначает тозильную группу.
Тозильной принято называть пара-толуолсульфонильную группу п-C6H4SO2.
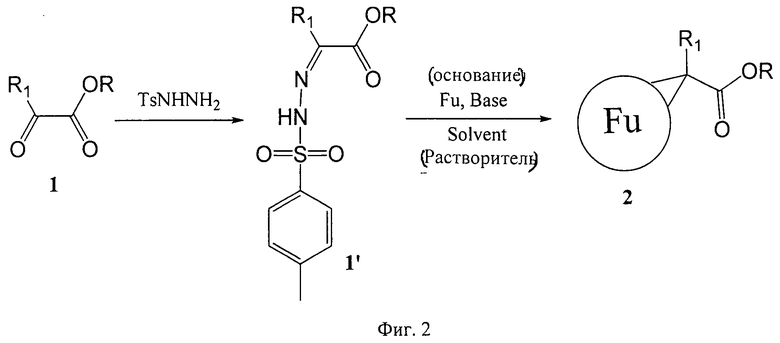
Предлагаемый способ получения производных фуллеренов отличается тем, что в качестве прекурсоров для синтеза используются доступные эфиры α-кетоуксусных кислот общей формулы R1C(O)COOR (обозначены цифрой «1» на Фиг.2), которые в реакции с тозилгидразидом (соединение состава C6H5SO2NHNH2, обозначено как TSNHNH2 на Фиг.2) образуют тозилгидразоны общей формулы R1C(=N-NH-TS)COOR (обозначены как «1'» на Фиг.2). На второй стадии синтеза тозилгидразоны общей формулы R1C(=N-NH-TS)COOR взаимодействуют с фуллереном (обозначен как «Fu» на Фиг.2) в органическом растворителе (обозначен как «Solvent» на Фиг.2) в присутствии основания (обозначено как «Base» на Фиг.2) и превращаются в циклопропановые производные фуллеренов, имеющие состав Fu=C(R1)COOR и общую структурную формулу, обозначенную как «2» на Фиг.2. Расшифровка обозначений R, R1, Fu, Base и Solvent, использованных в вышеупомянутых формулах, приведено ниже.
В общих формулах эфира α-кетоуксусной кислоты (R1C(O)COOR или «1»), гидразона эфира α-кетоуксусной кислоты (R1C(=N-NH-TS)COOR или «1'»), циклопропанового производного фуллерена (Fu=C(R1)COOR или «2») радикал R обозначает линейный или разветвленный алифатический радикал Cn, где n находится в пределах от 1 до 50;
В общих формулах эфира α-кетоуксусной кислоты (R1C(O)COOR или «1»), гидразона эфира α-кетоуксусной кислоты (R1C(=N-NH-TS)COOR или «1'»), циклопропанового производного фуллерена (Fu=C(R1)COOR или «2») радикал R1 обозначает ароматический радикал Cn, где n находится в пределах от 1 до 12;
В общей формуле циклопропанового производного фуллерена (Fu=C(R1)COOR или «2») фрагмент Fu обозначает:
- углеродный каркас фуллерена C60, образующий циклопропановые фрагменты вместе с аддендами -(R1)C(COOR2)-;
- углеродный каркас фуллерена C70, образующий циклопропановые фрагменты вместе с аддендами -(R1)C(COOR2)-;
- углеродный каркас высшего фуллерена C>70, образующий циклопропановые фрагменты вместе с аддендами -(R1)C(COOR2)-;
- смесь фуллеренов C60 и C70 (суммарное содержание 95.0-99.999% по весу) и высших фуллеренов (C>70, содержание 0.001-5.0% по весу), модифицированная путем аннелирования циклопропановых фрагментов -(R1)C(COOR2)-.
Обозначение «Solvent» на Фиг.2 подразумевает любой растворитель.
Обозначение «Base» на Фиг.2 подразумевает любое органическое или неорганическое основание.
Циклопропановые производные фуллеренов общей формулы Fu=C(R1)COOR (формула «2» на Фиг.2) обладают рядом важных преимуществ по сравнению с описанным ранее аналогом - соединением [60]PCBM (Фиг.1). В частности, присутствие в соединениях 2 сложноэфирной группы -COOR, связанной непосредственно с циклопропановым аддендом на фуллереновом каркасе, позволяет:
- получать фуллеренсодержащие материалы, способные к образованию высокоупорядоченных пленок за счет ван-дер-ваальсовых взаимодействий линейных длинноцепочечных радикалов R и/или R1;
- эффективно очищать их методами колоночной хроматографии на силикагеле или аналогичной неподвижной нормальной фазе;
- менять растворимость соединений в органических растворителях в диапазоне от 10 до 200 г/л путем варьирования состава и строения солюбилизирующих радикалов R и R1;
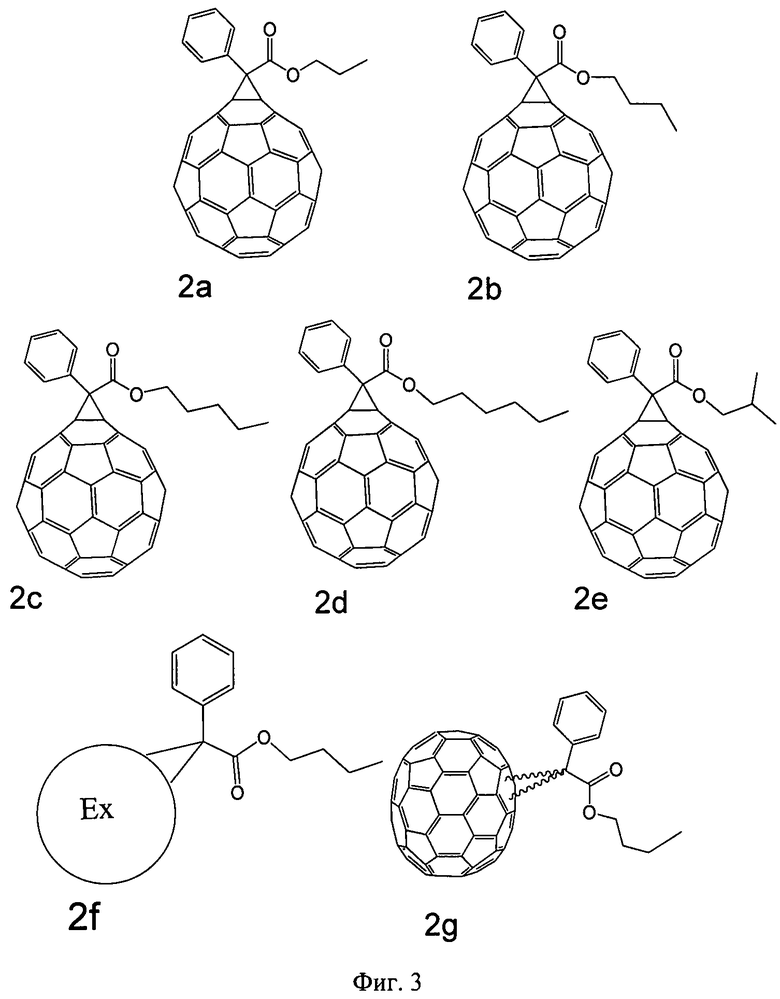
Разработанный способ синтеза органических производных фуллеренов, основанный на использовании эфиров α-кетоуксусных кислот в качестве реагентов, позволил получить серию соединений 1a-g, молекулярные формулы которых представлены на Фиг.3. Состав и строение соединений однозначно доказаны методами ЯМР на ядрах 1H и 13C, двумерной корреляционной спектроскопии и масс-спектрометрии. Спектры отдельных соединений представлены на Фиг.4-7. В спектре 1H ЯМР соединения 2b на Фиг.4 символом «*» обозначен сигнал остаточных протонов растворителя (хлороформа), а символом «**» - сигналы воды в растворителе. В спектре 13C ЯМР соединения 2b на Фиг.5 арабскими цифрами показано отнесение наблюдаемых сигналов к определенным атомам углерода в молекуле производного фуллерена. Символом «*» отмечены сигналы растворителя (ацетон-Д6). Спектр ЯМР 1H соединения 2e представлен на Фиг.6. Арабскими цифрами показано отнесение сигналов, наблюдаемых в спектре, к конкретным функциональным группам в молекуле производного фуллерена. Спектр ЯМР 13C соединения 2e представлен на Фиг.7. Арабскими цифрами показано отнесение сигналов, наблюдаемых в спектре, к конкретным типам атомов углерода в молекуле производного фуллерена.
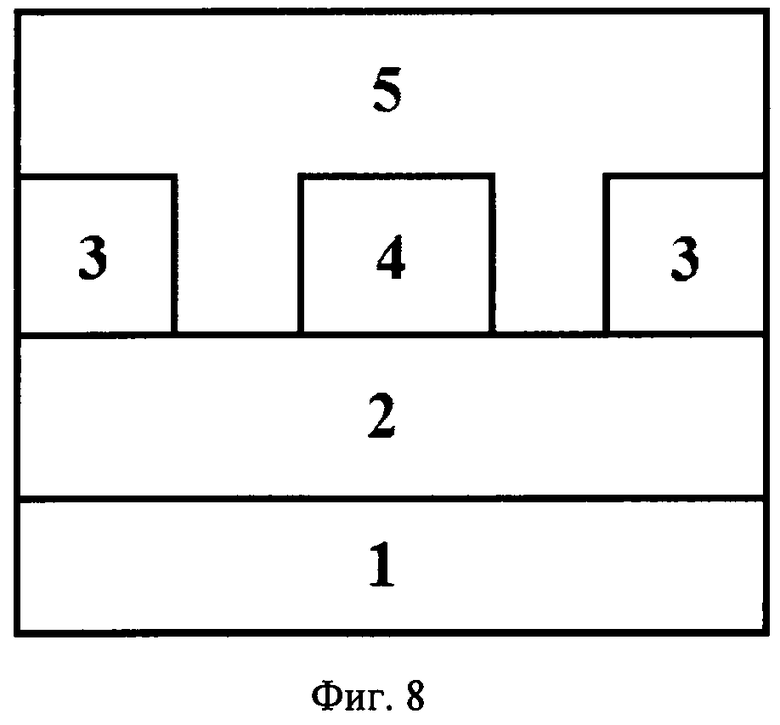
В данном изобретении предложено также применение соединений общей формулы 2 в полупроводниковой технике, полевых транзисторах, электронных схемах, фотодиодах, солнечных батареях. Прототипом указанного применения производных фуллеренов в органических тонкопленочных транзисторах является использование производного фуллерена РСВМ в аналогичных по структуре устройствах (Фиг.8) [10 - Т.D. Anthopoulos, С. Tanase, S. Setayesh, Е.J. Meijer, J.С. Hummelen, P.W.M. Blom, D.M. de Leeuw, Ambipolar organic field-effect transistors based on a solution-processed methanofullerene, Adv. Mater. 2004, 16, 2174]. Структура полевого транзистора, представленная на Фиг.8, включает нижний электрод-затвор (обозначен как «1» на Фиг.8), в качестве которого выступает допированный кремний, полупроводник затвор (обозначен как «2» на Фиг.8), роль которого играет тонкая пленка двуокиси кремния, верхние электроды сток (обозначены как «3» на Фиг.8) и исток (обозначены как «4» на Фиг.8), образованные напыленным на слой диэлектрика металлом, и полупроводником (обозначен как «5» на Фиг.8), в данном случае, органическим производным фуллерена [60]РСВМ (формула представлена на Фиг.1.
Прототипом использования производных фуллеренов в органических фотовольтаических ячейках является работа [11 - G. Yu, J. Gao, J.С. Hummelen, F. Wudl, A.J. Heeger, Polymer Photovoltaic Cells: Enhanced Efficiencies via a Network of Internal Donor-Acceptor Heterojunctions. Science, 1995, 270, 1789], в которой описывается использование [60]РСВМ в качестве материала n-типа для построения органических фотовольтаических ячеек с объемным гетеропереходом (Фиг.9).
Пример 2 иллюстрирует использование производных фуллеренов общей формулы 2 в полевых транзисторах, схема которых представлена на Фиг.10. Транзистор состоит из подложки (1), в качестве которой можно использовать самые разнообразные органические и неорганические материалы, такие как стекло, бумага, полимерная пленка, пластик, кремний, германий, металлическая фольга и др., с нанесенным поверх нее нижним электродом - затвором (2). Затвор (2) может быть сформирован из любого электропроводящего материала с подходящей работой выхода электрона (менее 5.0 эВ). На затвор наносится слой диэлектрика (3), который может быть сформирован целиком из органического (белок, сахар, поливиниловый спирт, меламин, полианилин, сшитый силоксан и др.) или неорганического (оксиды алюминия, кремния, магния и др.) материалов, а также любой их комбинации (например оксид алюминия + поливиниловый спирт или оксид кремния + монослой н-октилфосфоновой кислоты).
Поверх диэлектрика (3) наносят слой полупроводникового материала (4), роль которого в нашем случае играет циклопропановое производное фуллерена общей формулы Fu=C(R1)COOR (формула «2» на Фиг.2). Поверх слоя полупроводника наносят металлические электроды сток (5) и исток (6), сформированные из любого проводящего материала с работой выхода ниже 5 эВ.
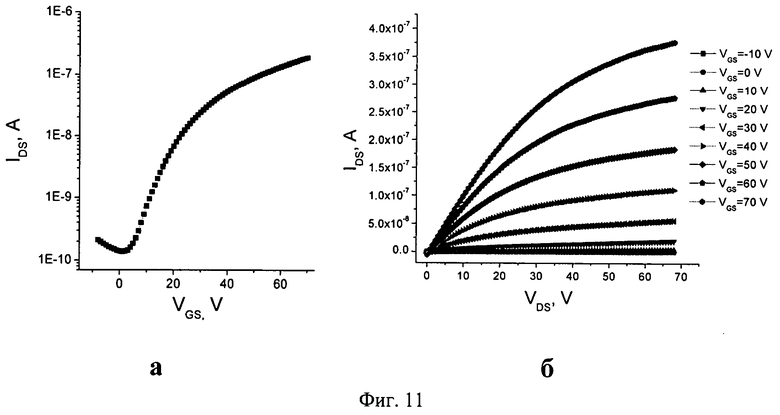
Для изготовленных на основе соединения 2b органических полевых транзисторов были измерены проходные и выходные характеристики. Изменение напряжения, приложенного к нижнему электроду устройства (затвору (2) на Фиг.10), позволяет модулировать в широких пределах ток, текущий между двумя верхними электродами (истоком (6) и стоком (5), показанными на Фиг.10). Проходные и выходные характеристики транзисторов на основе соединения 2b представлены на Фиг.11.
Пример 3 иллюстрирует использование соединений общей формулы 2 в качестве материалов для органических фотовольтаических ячеек, которые могут выполнять функцию фотодетекторов и/или солнечных батарей. Расположение слоев материалов в использованной конструкции фотовольтаической ячейки схематически показано на Фиг.12. Нижним слоем устройства является подложка (1), в качестве которой можно использовать самые разнообразные органические и неорганические материалы, такие как стекло, бумага, полимерная пленка, пластик, кремний, германий, металлическая фольга и др., с нанесенным поверх нее прозрачным электродом (2), образованным допированными оксидами металлов (оксид индия-олова ITO, оксид сурьмы-олова АТО, оксид олова, допированный фтором FTO) или тонкими металлическими слоями (серебро, золото и др.). Для обеспечения селективного сбора лишь одного типа носителей зарядов на прозрачный электрод наносится соответствующий буферный слой (3), проводящий либо дырки, либо электроны. К электрон-транспортным буферным слоям относятся оксиды титана и цинка и тонкие слои металлов с малой работой выхода электрона (Ca, Li, Sm). Дырочно-транспортные буферные слои обычно изготавливают из проводящих полимеров со значительной работой выхода электрона (PEDOT:PSS, допированный полианилин), оксидов металлов в высших степенях окисления (MoO3, WO3, NiO, V2O5) и др. На нижний буферный слой (3) наносят фотоактивный слой (4), представляющий собой смесь сопряженного полимера (в нашем случае - поли(3-пентилтиофена) Р3РТ) и циклопропанового производного фуллерена общей формулы Fu=C(R1)COOR (формула «2» на Фиг.2). Поверх фотоактивного слоя (4) наносят верхний буферный слой (5), комплементарный по своей функции буферному слою (3). Комплементарность подразумевает, что если слой (3) дырочно-проводящий, то слой (5) должен быть электрон-проводящим и наоборот. Последним функциональным слоем фотовольтаической ячейки является верхний электрод (6), который может быть сформирован из любого материала, обладающего электропроводностью не менее 500 См/см.
Вольтамперные характеристики солнечной батареи на основе соединения 2b и коммерчески доступного электронодонорного полимера поли(3-пентилтиофена) представлены на Фиг.13. Рассчитанная эффективность преобразования света для системы 2b/Р3РТ составляет 3.3%, что больше, чем для реперной системы [60]PCBM/P3PT (3.0%).
Заявляемое изобретение иллюстрируется, но не ограничивается следующими примерами.
Пример 1.
Фуллерен C60 (0.500 г, 0.69 ммоль) поместили в двугорлую колбу на 100 мл, снабженную обратным холодильником. Прибавили 70 мл 1.2-дихлорбензола, 1 ммоль гидразона соответствующего α-кетоэфира и 68 мг (1.26 ммоль) метилата натрия. После этого систему трижды вакуумировали и заполнили аргоном. Затем в токе аргона прибавили 7 мл пиридина и нагревали смесь при перемешивании на магнитной мешалке в течение 8 часов при температуре 120°C, после чего кипятили ее еще 12 часов с обратным холодильником (температура 175°C). Потом смесь охладили и упарили досуха на роторном испарителе, а остаток растворили в 50 мл хлорбензола и разбавили 600 мл петролейного эфира. Полученный раствор профильтровали и фильтрат нанесли на хроматографическую колонку. Вещество сорбировалось в верхней части колонки. Сначала колонку промыли смесью толуола и петролейного эфира в соотношении 30:170 для отделения непрореагировавшего фуллерена. Затем смесью толуола и петролейного эфира в варьируемых соотношениях от 50:150 до 70:130 элюировали целевой продукт. Полученной раствор производного фуллерена сконцентрировали в вакууме до объема 30 мл, после чего высадили вещество, добавив 90 мл метанола. Осадок отделили центрифугированием и промыли 3 раза метанолом и 2 раза диэтиловым эфиром, после чего высушили на воздухе. Выходы целевых продуктов 2a-f составляют 20-55%.
Соединение 2b. ЯМР 1H (600 МГц, CDCl3): 8.14 (д, 2H), 7.59 (м, 3H), 4.40 (т, 2H), 1.74 (м, 2H), 1.39 (м, 2.H), 0.94 (т, 3H) м. д. 13C ЯМР (CS2-ацетон-D6 10:1, 150 МГц), δ=14.18, 19.8, 31.19, 56.24, 66.47, 75.78, 125.45, 128.63, 128.77, 128.82, 129.4, 132.34, 132.59, 134.84, 137.88, 138.43, 141.04, 141.07, 142.06, 142.23, 142.29, 142.35, 142.99, 143.04, 143.06, 143.13, 143.19, 143.78, 143.98, 144.5, 144.52, 144.63, 144.72, 144.77, 144.83, 145.21, 145.25, 145.3, 145.49, 146.32, 147.68, 165.27 м.д.
Соединение 2e. ЯМР 1H (CDCl3, 600 МГц): δ=8.10 (д, 2H), 7.51 (м, 3H), 4.10 (д, 2H), 2.05 (м, 1H), 0.95 (д, 6H) м.д. ЯМР 13C (CS2-ацетон-D6, 150 МГц): δ=19.33, 21.82, 28.41, 29. сен, 29.22, 29.35, 29.47, 29.60, 29.73, 29.86, 56.21, 72.45, 75.74, 125.54, 128.41, 128.80, 129.13, 129.40, 132.35, 132.66, 137.98, 138.42, 141.04, 142.04, 142.22, 142.28, 142.33, 142.98, 143.02, 143.12, 143.19, 143.77, 143.97, 144.50, 144.62, 144.71, 144.77, 144.83, 145.20, 145.24, 145.30, 145.46, 146.31, 147.61, 165.20 м.д.
Соединение 2f. ЯМР 1H (600 МГц, CDCl3): 0.98 (т, 3H), 1.49 (м., 2H), 1.70 (м, 2H), 4.10 (т, 2H), 7.46 (т, 1H), 7.58 (т, 2H), 7.93 (уш. д., 2H) м.д.
Пример 2.
На основе фуллерен-содержащих материалов были изготовлены органические тонкопленочные полевые транзисторы, имеющие конструкцию, представленную на Фиг.10. В качестве подложки использовали стеклянные пластины толщиной 2 мм. На подложку в вакууме напыляли серебряный электрод - затвор транзистора. Поверх электрода наносили слой диэлектрика. В частности, из мезитиленового раствора наносили пленку смолы ВСВ (дивинилтетраметилдисилоксан-бис(бензоциклобутена)), которая при нагревании до 150°C полимеризуется с образованием трехмерной сшитой структуры. В качестве альтернативного органического диэлектрика использовали поливиниловый спирт, пленку которого формировали из водного раствора и затем сушили 12 часов при 60°C. Затем в инертной атмосфере наносили слой соединения фуллерена 1b путем полива из раствора в хлорбензоле. Полученные пленки сушили до удаления следов адсорбированного растворителя, после чего в вакууме напыляли серебряные электроды, формирующие канал транзистора - сток и исток.
При измерении проходной характеристики транзисторов (transfer), между электродами сток и исток прикладывалось постоянное напряжение Vds. При измерении проводилась развертка потенциала между стоком и затвором (Vgs) и регистрировался ток между истоком и стоком (Ids). Одновременно регистрировался ток утечки между истоком и затвором (Igs). Правильная работа транзистора предполагает его включение при определенном напряжении Vgs, что приводит к резкому увеличению Ids (обычно - на несколько порядков) при почти неизменном токе утечки Igs. Именно такое поведение наблюдалось для изготовленных транзисторов на основе соединения фуллерена 1b, о чем свидетельствуют результаты измерений, представленные на Фиг.11.
Пример 3
На основе фуллерен-содержащих материалов были изготовлены органические фотовольтаические ячейки, имеющие конструкцию, представленную на Фиг.12.
Подготовка подложек. В качестве подложек для изготовления фотовольтаических ячеек использовали специальные стеклянные пластины толщиной 1.1 мм, на одну сторону которых нанесен электропроводящий слой оксида индия-олова толщиной 100-200 нм. Коэффициент пропускания для таких подложек в видимом диапазоне составляет 80-87%. Для изготовления солнечных батарей подложки структурировали путем вытравливания слоя ITO с той стороны, с которой будут расположены контактные площадки верхних электродов.
Слой оксида индия-олова достаточно неравномерный по толщине. Для изготовления гомогенных тонких пленок фотоактивного композита необходимо предварительно устранить неровности подложки, для чего ее покрывали слоем дырочного проводника PEDOT-PSS. Перед нанесением PEDOT-PSS тщательно очищали стекло многократной промывкой в толуоле, ацетоне и изопропаноле под действием ультразвука. В отдельных случаях, для полного устранения загрязнений подложку обрабатывали кислородной плазмой.
Для нанесения слоя дырочного проводника использовали коммерчески доступный водный раствор PEDOT-PSS (Baytron РН, Cleveos PH). Этим раствором покрывали поверхность подложки, после чего основную часть его удаляли путем вращения подложки со скоростью 4000 об./мин. Часть препарата высыхала, образуя на подложке гомогенную пленку толщиной 50-60 нм. Подложки с пленками PEDOT-PSS сушили при температуре 150°C в течение 10 минут.
Нанесение фотоактивного слоя. Готовили рабочий раствор композита сопряженного полимера Р3РТ и соединения фуллерена. Для этого 8 мг соединения фуллерена и 12 мг Р3РТ растворяли в 1 мл хлорбензола при перемешивании в течение 48 часов. Приготовленный раствор фильтровали через мембранные фильтры (материал - PTFE) с размером пор 0.2-0.45 мкм. Это процедура позволяла полностью удалить все взвешенные частицы из раствора.
Для нанесения активного слоя, порцию раствора композита полимер/соединение фуллерена объемом 80 мкл выливали на поверхность пленки PEDOT-PSS, после чего образец вращали со скоростью 700-1000 об./мин в течение 2 минут. Толщина пленок менялась от образца к образцу в пределах 75-85 нм.
Термическая обработка фотоактивного слоя. После нанесения пленки композита Р3РТ/соединение фуллерена прогревали в течение 3 минут при температуре 155°C. В ходе прогрева происходило удаление следов растворителя, а также самоорганизация цепей полимера с образованием высокоупорядоченной кристаллической фазы, отличающейся хорошими зарядово-транспортными свойствами.
Напыление металлического электрода. На фотоактивный слой в вакууме 10-6 мм рт.ст. через специальную структурированную маску напыляли металлические электроды. Вначале наносили 10-20 нм кальция (электрон-селективный буферный слой), после чего поверх него напыляли металлическое серебро (80-90 нм). На одной подложке изготавливали 3 или 4 отдельных фотовольтаических элемента, каждый из которых имел площадь 0.5 см2.
Измерение вольтамперных характеристик. Вольтамперные характеристики измеряли с использованием стандартизованного солнечного симулятора (K.H.STEUERNAGEL Lichttechnik GmbH, SolarCellTest 575) со спектром, приближенным к AM 1.5G и источника-измерителя Kethley 2400. Световые и темновые вольтамперные кривые, полученные для солнечной батареи на основе 2b/Р3РТ, представлены на Фиг.13. Рассчитанная эффективность преобразования света для системы 2b/Р3РТ составляет 3.3%, что больше, чем для реперной системы [60]РСВМ/Р3РТ (3.0%).
Таким образом, заявляемое изобретение позволяет получать органические производные фуллеренов, которые с успехом могут быть использованы как фуллеренсодержащие материалы, способные к образованию высокоупорядоченных пленок. На основе этих материалов возможно создание широкого спектра материалов для электронных полупроводниковых устройств.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ НОРБОРНЕНЗАМЕЩЕННЫХ ЦИКЛОПРОПАНОВЫХ ПРОИЗВОДНЫХ ФУЛЛЕРЕНОВ И ПОЛИМЕРОВ НА ИХ ОСНОВЕ | 2014 |
|
RU2579148C1 |
| ПРОИЗВОДНЫЕ ФУЛЛЕРЕНОВ С ПОНИЖЕННЫМ СРОДСТВОМ К ЭЛЕКТРОНУ И ФОТОВОЛЬТАИЧЕСКАЯ ЯЧЕЙКА НА ИХ ОСНОВЕ | 2013 |
|
RU2598079C1 |
| Способ получения циклопропановых производных фуллеренов | 2016 |
|
RU2711566C2 |
| ПРОИЗВОДНЫЕ ФУЛЛЕРЕНОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФОТОВОЛЬТАИЧЕСКОЕ УСТРОЙСТВО | 2005 |
|
RU2287483C1 |
| 1',2',5'-тризамещенные фуллеропирролидины, способ их получения и применение в фотовольтаической ячейке | 2015 |
|
RU2669782C2 |
| ДВУХКОМПОНЕНТНЫЙ ЭЛЕКТРОН-СЕЛЕКТИВНЫЙ БУФЕРНЫЙ СЛОЙ И ФОТОВОЛЬТАИЧЕСКИЕ ЯЧЕЙКИ НА ЕГО ОСНОВЕ | 2012 |
|
RU2595342C2 |
| ОРГАНИЧЕСКОЕ ФОТОВОЛЬТАИЧЕСКОЕ УСТРОЙСТВО, СПОСОБ ЕГО ИЗГОТОВЛЕНИЯ И ПРИМЕНЕНИЕ ФТОРСОДЕРЖАЩИХ МОДИФИКАТОРОВ ДЛЯ УЛУЧШЕНИЯ ХАРАКТЕРИСТИК ОРГАНИЧЕСКИХ СОЛНЕЧНЫХ БАТАРЕЙ | 2012 |
|
RU2528416C2 |
| ФОТОПЕРЕКЛЮЧАЕМЫЙ И ЭЛЕКТРОПЕРЕКЛЮЧАЕМЫЙ ОРГАНИЧЕСКИЙ ПОЛЕВОЙ ТРАНЗИСТОР, СПОСОБ ЕГО ИЗГОТОВЛЕНИЯ И ЕГО ПРИМЕНЕНИЕ В КАЧЕСТВЕ УСТРОЙСТВА ПАМЯТИ | 2014 |
|
RU2580905C2 |
| ПОЛУПРОВОДНИКОВЫЕ ТОНКИЕ ПЛЕНКИ [60] ФУЛЛЕРЕНА И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2583375C2 |
| СЕРОСОДЕРЖАЩИЕ ПРОИЗВОДНЫЕ ФУЛЛЕРЕНОВ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2011 |
|
RU2477273C2 |









Изобретение относится к способу получения циклопропановых производных фуллеренов общей формулы 2 путем нагревания немодифицированного фуллерена с тозилгидразоном в присутствии растворителя и основания. При этом процесс ведут с тозилгидразоном эфира α-кетоуксусной кислоты общей формулы 1  где в общих формулах 1 и 2 радикал R обозначает линейный или разветвленный алифатический радикал Cn, где n находится в пределах от 1 до 50; радикал R1 обозначает ароматический радикал С6; Fu представляет собой фуллерен С60 или фуллерен С70, или высший фуллерен С>70, или смесь фуллеренов С60 и С70 (суммарное содержание 95.0-99.999% по весу) и высших фуллеренов (С>70, содержание 0.001-5.0% по весу). Способ позволяет получать производные фуллеренов, содержащие в своей структуре сложноэфирную группу, непосредственно присоединенную к циклопропановому фрагменту на фуллереновой сфере, используя доступные эфиры α-кетоуксусной кислоты. Изобретение также относится к применению циклопропановых производных фуллеренов общей формулы 2 в качестве полупроводниковых материалов для электронных полупроводниковых устройств, материалов для органического полевого транзистора и материалов для органической фотовольтаической ячейки. 6 н.п. ф-лы, 13 ил., 3 пр.
где в общих формулах 1 и 2 радикал R обозначает линейный или разветвленный алифатический радикал Cn, где n находится в пределах от 1 до 50; радикал R1 обозначает ароматический радикал С6; Fu представляет собой фуллерен С60 или фуллерен С70, или высший фуллерен С>70, или смесь фуллеренов С60 и С70 (суммарное содержание 95.0-99.999% по весу) и высших фуллеренов (С>70, содержание 0.001-5.0% по весу). Способ позволяет получать производные фуллеренов, содержащие в своей структуре сложноэфирную группу, непосредственно присоединенную к циклопропановому фрагменту на фуллереновой сфере, используя доступные эфиры α-кетоуксусной кислоты. Изобретение также относится к применению циклопропановых производных фуллеренов общей формулы 2 в качестве полупроводниковых материалов для электронных полупроводниковых устройств, материалов для органического полевого транзистора и материалов для органической фотовольтаической ячейки. 6 н.п. ф-лы, 13 ил., 3 пр.

1. Способ получения циклопропановых производных фуллеренов общей формулы 2

путем нагревания немодифицированного фуллерена с тозилгидразоном в присутствии растворителя и основания, отличающийся тем, что процесс ведут с тозилгидразоном эфира α-кетоуксусной кислоты общей формулы 1 
- где в общих формулах 1 и 2 радикал R обозначает линейный или разветвленный алифатический радикал Cn, где n находится в пределах от 1 до 50;
- где в общих формулах 1 и 2 радикал R1 обозначает ароматический радикал С6;
- где в общей формуле 2 Fu представляет собой фуллерен С60 или фуллерен С70, или высший фуллерен С>70, или смесь фуллеренов С60 и С70 (суммарное содержание 95.0-99.999% по весу) и высших фуллеренов (С>70, содержание 0.001-5.0% по весу).
2. Применение циклопропановых производных фуллеренов Fu=C(R1)COOR общей формулы 2 по п.1 в качестве полупроводниковых материалов для электронных полупроводниковых устройств.
3. Применение циклопропановых производных фуллеренов Fu=C(R1)COOR общей формулы 2 по п.1 в качестве материалов для органического полевого транзистора.
4. Применение циклопропановых производных фуллеренов Fu=C(R1)COOR общей формулы 2 по п.1 в качестве материалов для органической фотовольтаической ячейки.
5. Органический полевой транзистор, содержащий слои подложки, диэлектрика и полупроводникового материала, а также нижний электрод (затвор) и верхние электроды (сток и исток), отличающийся тем, что в качестве полупроводникового материала используют циклопропановые производные фуллеренов Fu=C(R1)COOR общей формулы 2 по п.1.
6. Органическая фотовольтаическая ячейка, отличающаяся тем, что в качестве компонента активного слоя используют циклопропановые производные фуллеренов Fu=C(R1)COOR общей формулы 2 по п.1.
| WO2009062456 A1, 22.05.2009 | |||
| WO2009062457 A1, 22.05.2009 | |||
| ПРОИЗВОДНЫЕ ФУЛЛЕРЕНОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФОТОВОЛЬТАИЧЕСКОЕ УСТРОЙСТВО | 2005 |
|
RU2287483C1 |
| J.C.HUMMELEN ET AL., "Preparation and characterization of fulleroid and methanofullerene derivatives", The Journal of Organic Chemistry, 1995, vol.60, pp.532-538 | |||
Авторы
Даты
2014-06-20—Публикация
2011-06-01—Подача