Изобретение относится к медицине, конкретно к способу оценки безопасности введения наночастиц меди в организм, который устанавливает критерий, позволяющий оценить безопасность введения наночастиц, и может применяться для клинико-фармакологической экспертизы препаратов на основе наночастиц.
Нанотехнологии обладают огромным потенциалом, позволяющим решить многие задачи в различных областях науки, техники и повысить качество жизни человека. Однако новые научные достижения не только способствуют развитию общества, но и ставят человечество перед новыми проблемами. Это, прежде всего, проблема воздействия наноматериалов и наночастиц на качество среды обитания человека, на животный и растительный мир, на качество сельскохозяйственной продукции и воды, а также на здоровье человека. Необходимость изучения последствий действия наночастиц и наноматериалов на живые системы и человека связана с постоянно растущим уровнем производства наноматериалов для различных нужд техники, разработкой новых лекарственных средств в наноформе, с созданием новых пищевых продуктов, парфюмерно-косметической продукции с использованием достижений нанотехнологии.
Интерес к нанообъектам связан с пониманием отличия их физико-химических и биологических свойств как от свойств массивных металлических объектов, так и свойств отдельных атомов. Проведенные нами исследования по влиянию наночастиц на биосистемы позволили выявить их уникальные свойства:
1) наночастицы металлов в 7-50 раз менее токсичны, чем металлы в ионной форме;
2) наночастицы оказывают пролонгированное действие благодаря своей способности осуществлять роль депо элементов в организме;
3) наночастицы, введенные в биотических дозах, стимулируют обменные процессы в организме;
4) наночастицы обладают многофункциональным действием [3, 5].
В настоящее время использование наночастиц металлов в составе биопрепаратов и лекарственных средств представляется перспективным. Однако перечисленные особенности влияния наночастиц на живые системы могут оказывать специфическое действие на органы и ткани, приводящее к развитию различных патологических состояний и даже гибели. Поэтому необходимо найти такие показатели изменения структурно-функционального состояния биосистем, которые позволят установить порог допустимых доз вводимых наночастиц металлов.
Современные исследования токсичности нанообъектов при введении в организм животных ограничены несколькими серьезными работами. Это исследования американских ученых, которые изучали легочную ткань при внутритрахеальной затравке наноуглеродными трубками. Такая затравка приводила к развитию воспалительного процесса в легочной ткани с последующим некрозом и развитием фиброза, что может провоцировать развитие рака легких [13].
В настоящее время токсичность наноматериалов связывают с развитием окислительного стресса и повреждением ДНК [11]. Рассматриваются и другие механизмы токсичности наноматериалов. Например, их повреждающее действие на клеточные мембраны и органеллы связано с усилением транспорта потенциально токсичных компонентов. Возможны также генотоксичность и аллергезирующее действие [6].
Однако до сих пор отсутствуют способ проведения экспертизы и критерии для оценки безопасности введения наночастиц в организм животных. Так, одни исследователи проводят изучение формирования отека мозга, оценивая нарушение проницаемости гематоэнцефалического барьера для наночастиц серебра, меди, алюминия, кремния, углерода и металлических оксидов [12], другие описывают состояние центральной нервной системы при действии наночастиц серебра, меди оксида [15], третьи изучают ответ ДОФ-аминной системы на воздействие наночастиц Mn, Ag, Cu [14], проводят сравнительные исследования токсичности наночастиц, например, меди по сравнению с микрочастицами и ионами металлов [8], изучают изменение биохимических показателей мочи, сыворотки, тканей печени и почек животных при введении наночастиц меди в различных дозах [10], изучают степень повреждения ДНК и цитотоксичность наночастиц оксидов различных металлов [9] и т.д. Поэтому разработка способа оценки безопасности наночастиц металлов при введении в организм живых систем является одной из актуальных задач современной медицины и это позволит установить порог допустимых доз вводимых наночастиц металлов.
Задачей изобретения является разработка способа оценки безопасности введения наночастиц меди в организм, который установит критерии для оценки безопасности введения в организм.
Для решения поставленной задачи предлагается способ оценки безопасности введения наночастиц меди в организм, заключающийся в определении изменения показателя экспрессии антигена каспазы-3 в миоглиоцитах сенсомоторной зоны коры головного мозга после введения наночастиц меди по сравнению с контрольной группой животных путем подсчета экспрессирующих каспазу-3 миоглиоцитов на условной единице площади идентичных сенсомоторных зон.
Нами проведен комплекс гистологических и иммуногистохимических исследований тканей экспериментальных животных при увеличении нагрузки меди в виде наночастиц на организм и, учитывая особенность ответа, обоснован выбор критерия для оценки безопасности введения наночастиц металла в организм животных.
Пример 1. Физико-химические характеристики наночастиц меди
Для исследования влияния наночастиц меди на структурно-функциональное состояние органов и тканей животных, биохимические, гистологические и иммуногистохимические показатели были синтезированы наночастицы меди методом высокотемпературной конденсации с их последующей модификацией кислородом [2, 4]. Методом просвечивающей электронной микроскопии установлено, что наночастицы меди имеют сферическую форму. Средний размер частиц составляет 103.0±2,0 нм. Кристаллической меди в ядре частиц содержится 96.0±4.5%, меди оксида - 4.0±0,4%. Толщина оксидной пленки на поверхности наночастиц меди составляет 6 нм (Таблица 1) [1].
Пример 2. Оценка состояния печени животных при увеличении нагрузки наночастиц меди на организм
Исследования проводили на белых крысах-самцах линии Vistar массой 150-180 г, находящихся на общевиварийном рационе кормления, которым внутримышечно вводили водную суспензию наночастиц меди с периодичностью 1 раз в неделю в дозе 2.0 мг/кг массы животного. Другой группе животных на протяжении 3 суток выпаивали суспензию наночастиц меди в дозе 2.0 мг/кг массы животного. Экспериментальные исследования на животных проводили в соответствии с инструкциями, рекомендуемыми Российским Регламентом, 1987 г., и «The Guide for the Care and Use of Laboratory Animals (National Academy Press, Washington, D.C., 1996)». Для приготовления водной суспензии наночастиц меди для инъекций и для выпаивания была разработана лабораторная технологическая схема, которая включает следующие этапы: приготовление точной навески нанопорошка, перенесение нанопорошка в воду, последовательное диспергирование суспензии нанопорошка на ультразвуковом диспергаторе УЗДН-2Т в режиме: трехкратное диспергирование по 1 мин с перерывом 3 мин. Отбор проб для исследования структурно-функционального состояния печени проводили через 3 ч, 1 сут, 3 сут, 7 сут после каждой инъекции и через 1 ч, 2 ч после энтерального введения животным водной суспензии наночастиц. В контрольную группу входили животные, которым внутримышечно и энтерально вводили дистиллированную воду в том же объеме, что и опытным животным.
Для исследования структурно-функционального состояния печени пробы ткани фиксировали в 10% нейтральном формалине в течение суток при комнатной температуре. После стандартной гистологической проводки материал заливали в парафин. Парафиновые срезы толщиной 5 мкм окрашивали гематоксилином Майера и эозином. Гликоген в ткани определяли перйодат-Шифф-реакцией по методу Мак-Мануса-Хочкисса-Шабадаша [7]. Для выявления экзогенных частиц меди использовали модифицированный метод окраски парафиновых срезов с бензидином [7]. Для оценки пролиферативной активности клеток печени использовали показатель экспрессии маркера Ki-67. Для выявления готовности клеток к апоптозу оценивали экспрессию каспазы-3. Иммуногистохимические исследования проводили на парафиновых срезах с использованием моноклональных антител и системы визуализации фирмы Bio Genex Super Sensytive Detection System (США) по протоколам фирмы производителя. С использованием набора Apoptag (Plus Peroxidase in situ Apoptosis Detection Kit-S 71010) идентифицировали фрагментированную ДНК в гепатоцитах, согласно протоколу фирмы производителя (Intergen, USA). Проводили подсчет иммунопозитивных клеток среди 1000 и выражали в ‰.
Статистическую обработку полученных данных проводили с использованием пакета программ "Statistica 5,5 for Windows" и программного пакета "MS Excel 2000". Достоверность различий сравниваемых показателей определяли по t-критерию Стьюдента. Достоверными считали результаты при p≤0,05.
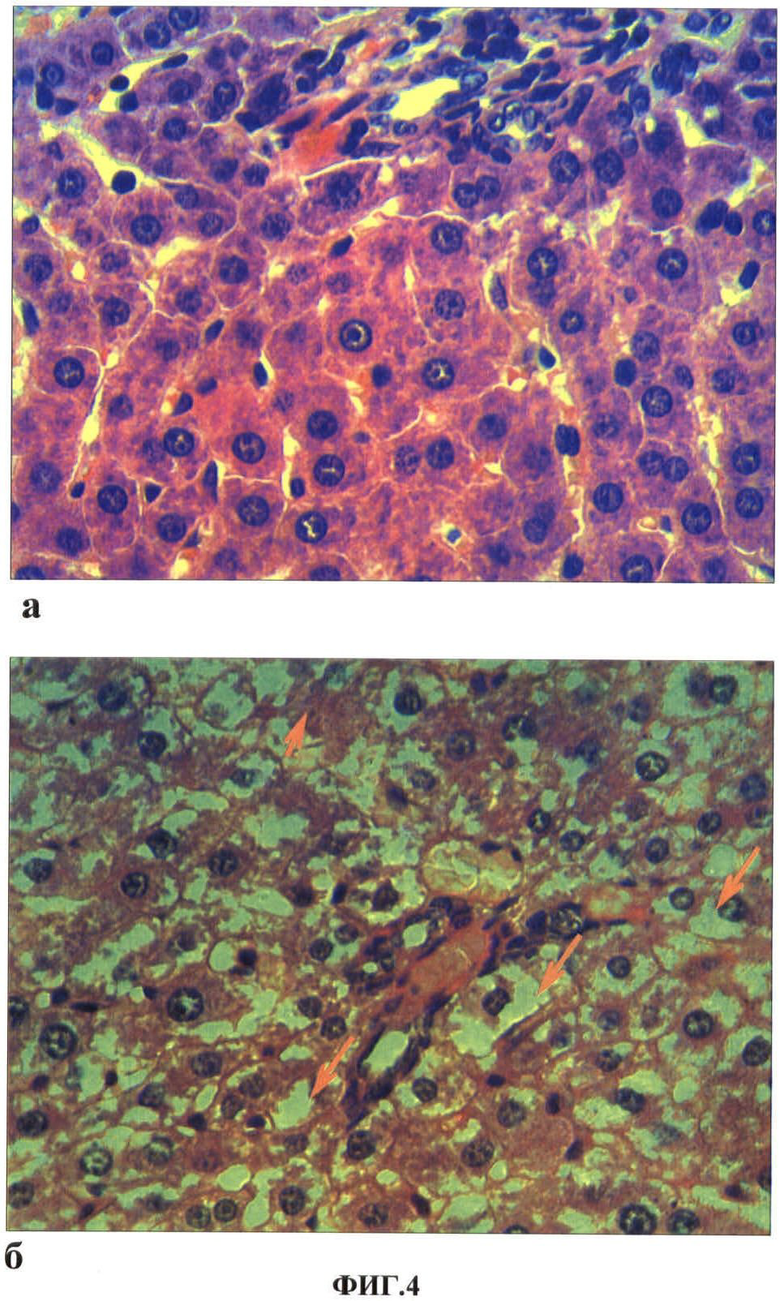
Результаты исследований представлены в таблице 2, 3 и на ФИГ. 1, 2, 3, 4. В таблице 2, 3 представлены показатели экспрессии каспазы-3 клеток печени экспериментальных животных при повторных внутримышечном и энтеральном введениях водной суспензии наночастиц меди в дозе 2.0 мг/кг массы животного соответственно. На ФИГ.1, 2, 3, 4 представлены гистологические срезы фрагментов печени крысы через 3 часа после однократного внутримышечного введения наночастиц меди в дозе 2 мг/кг массы животного, фрагментов печени контрольной (а) и опытной (б) крыс на 1 сутки после повторного внутримышечного введения наночастиц меди в дозе 2 мг/кг массы животного, фрагментов печени крысы на 1 сутки после повторного внутримышечного введения наночастиц меди в дозе 2 мг/кг массы животного, фрагментов перипортальных зон печеночных долек контрольной (а) и опытной крыс (б) через 2 часа после первого энтерального введения наночастиц меди в дозе 2 мг/кг массы животного соответственно.
Нами установлено, что через 3 часа после однократного внутримышечного введения наночастиц меди в васкулярной части перипортальных гепатоцитов и в цитоплазме клеток Купфера печени экспериментальных животных видны наночастицы меди (ФИГ.1). При этом структурных изменений в органе не выявлено. Через 3 суток после однократного внутримышечного введения наночастицы меди в клетках печени не обнаруживаются. Однако в перипортальных гепатоцитах появляются признаки гидропической дистрофии, которая не выявляется при исследовании органа через 7 суток после однократного введения металла. При повторном через неделю внутримышечном введении меди наночастицы выявляются преимущественно в васкулярной части перипортальных гепатоцитов. При этом через сутки после второй инъекции металла в васкулярной части перипортальных гепатоцитов выявляются признаки гидропической дистрофии. Среди гепатоцитов появляются также апоптозные тельца Каунсильмена (ФИГ.2). Это подтверждают иммуногистохимические исследования по выявлению готовности гепатоцитов к клеточной гибели - апоптозу (ФИГ.3). Апоптоз является тем процессом, который в паренхиме печени поддерживает структурный гомеостаз органа. В печени контрольных животных экспрессия антигена каспазы-3 обнаружена только среди центролобулярных гепатоцитов и составляет 0,7±0,03‰. Apoptag - положительные клетки также выявляются среди центролобулярных гепатоцитов и составляют 0,5±0,02‰. После повторного внутримышечного введения наночастиц меди клетки, экспрессирующие антиген каспазы-3, а также дающие положительную реакцию на фрагментированную ДНК, обнаруживаются и среди припортальных гепатоцитов. Различия показателей экспрессии маркеров готовности клеток к апоптозу достоверны по сравнению с контролем в печени животных на 3 и 7 сутки после трехкратного внутримышечного введения наночастиц. Показатели экспрессии увеличиваются в 2 раза (p<0,05) на 7 сутки после трехкратного внутримышечного введения (Таблица 2).
При энтеральном пути введения наночастиц меди через 2 часа после первого введения наблюдались структурные изменения печени с признаками гидропической дистрофии в гепатоцитах перипортальной зоны (ФИГ.4). Через 3 суток после энтерального введения наночастиц меди фиксировалась неизмененная структура органа. Сами наночастицы в гепатоцитах печени отсутствовали, но они обнаруживались в клетках Купфера. При исследовании печени через 2 часа после третьего энтерального введения наночастицы меди присутствовали в клетках Купфера и васкулярной зоне гепатоцитов. При этом признаки дистрофии в клетках отсутствовали. Готовность клеток к апоптозу после трехкратного энтерального введения недостоверно отличается от показателей экспрессии маркеров апоптоза в печени животных контрольной группы (Таблица 3).
Пример 3. Оценка состояния селезенки животных при увеличении нагрузки наночастиц меди на организм
Исследования проводили на белых крысах-самцах линии Vistar массой 150-180 г, находящихся на общевиварийном рационе кормления, которым внутримышечно вводили водную суспензию наночастиц меди с периодичностью 1 раз в неделю в дозе 2.0 мг/кг массы животного. Экспериментальные исследования на животных проводили в соответствии с инструкциями, рекомендуемыми Российским Регламентом, 1987 г., и «The Guide for the Care and Use of Laboratory Animals (National Academy Press, Washington, D.C., 1996)». Для приготовления водной суспензии наночастиц меди для инъекций и для выпаивания была разработана лабораторная технологическая схема, которая включает следующие этапы: приготовление точной навески нанопорошка, перенесение нанопорошка в воду, последовательное диспергирование суспензии нанопорошка на ультразвуковом диспергаторе УЗДН-2Т в режиме: трехкратное диспергирование по 1 мин с перерывом 3 мин. Отбор проб для исследования структурно-функционального состояния селезенки проводили через 3 ч, 1 сут, 3 сут, 7 сут после каждой инъекции водной суспензии наночастиц. В контрольную группу входили животные, которым внутримышечно вводили дистиллированную воду в том же объеме, что и опытным животным.
Для проведения морфологических и гистологических исследований селезенку фиксировали в 10% нейтральном формалине в течение суток при комнатной температуре. После стандартной гистологической проводки материал заливали в парафин. Парафиновые срезы толщиной 5 мкм окрашивали гематоксилином Майера и эозином. Для выявления экзогенной меди использовали модифицированный метод окраски парафиновых срезов с бензидином [7]. Иммуногистохимические исследования проводили на парафиновых срезах при помощи моноклональных антител (Ki 67, каспаза-3) и системы визуализации Bio Genex Super Sensytive Detection System (США). Для оценки пролиферативной активности клеток белой пульпы селезенки выявляли экспрессию маркера Ki 67. Для выявления готовности клеток к апоптозу выявляли экспрессию каспазы-3. Производили подсчет иммунопозитивных клеток на 1000 и выражали в ‰.
Статистическую обработку полученных данных проводили с использованием пакета программ "Statistica 5,5 for Windows" и программного пакета "MS Excel 2000". Достоверность различий сравниваемых показателей определяли по t-критерию Стьюдента. Достоверными считали результаты при p≤0,05.
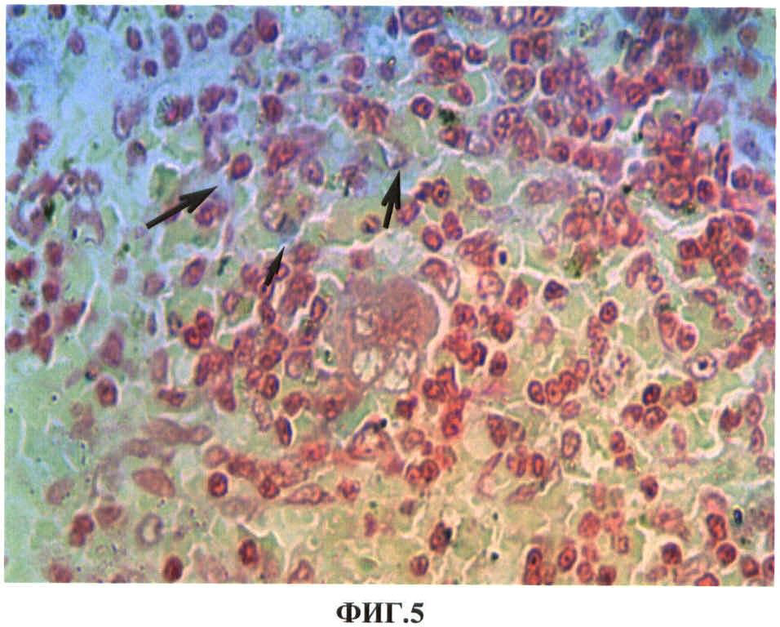
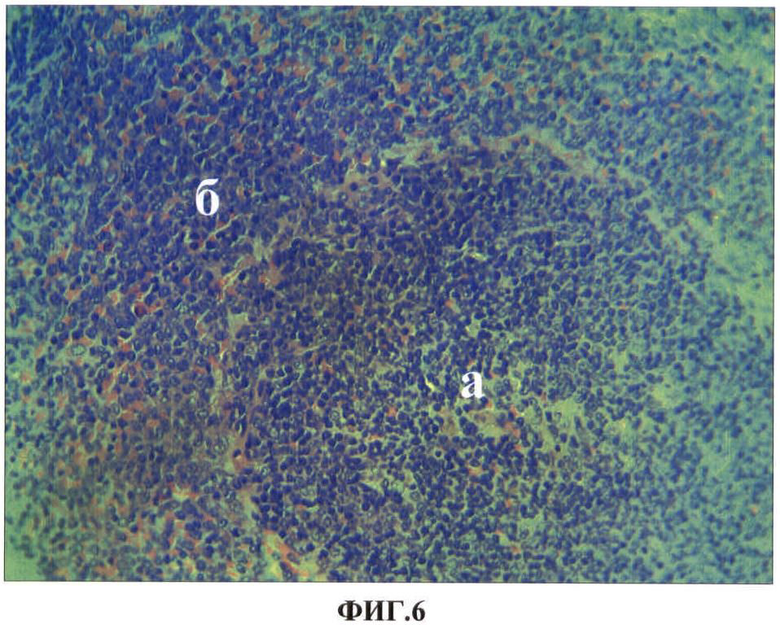
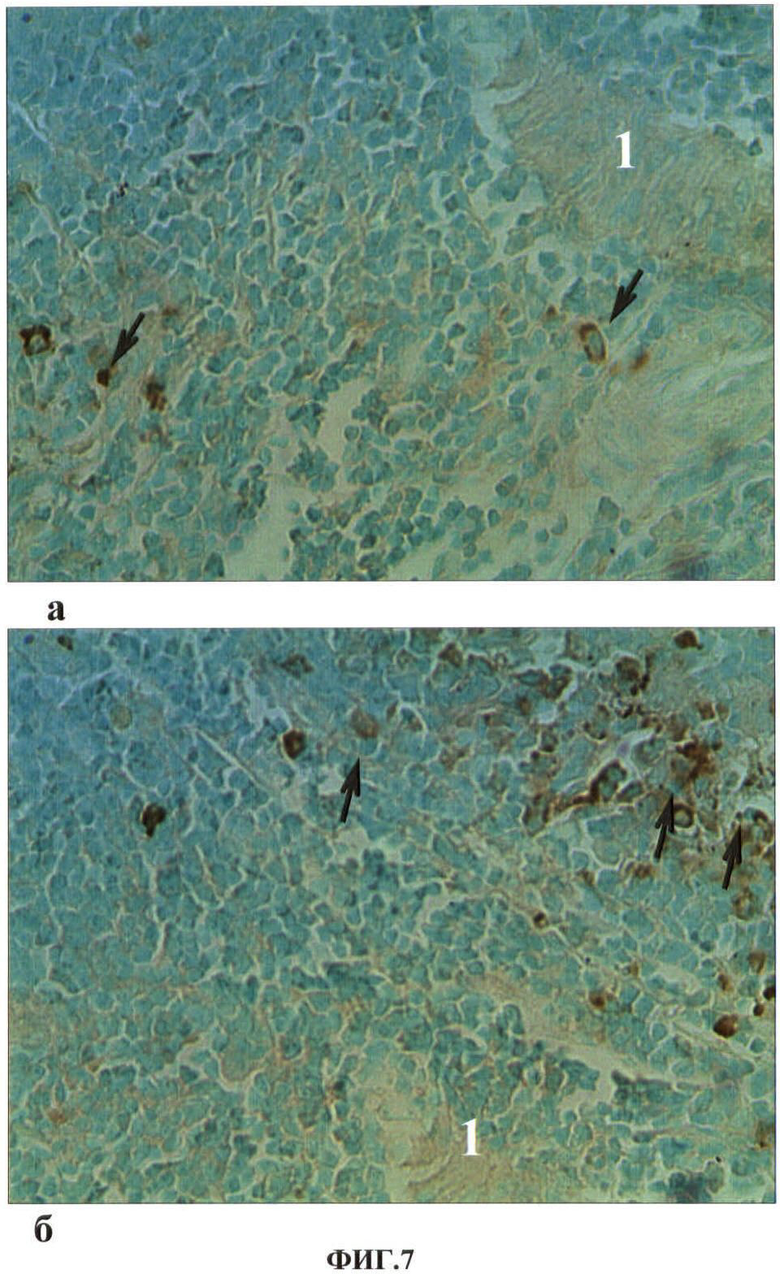
Результаты исследований представлены в таблице 4 и на ФИГ.5, 6, 7. В таблице 4 представлены показатели экспрессии каспазы-3 клеток селезенки экспериментальных животных при повторных внутримышечных введениях водной суспензии наночастиц меди в дозе 2.0 мг/кг массы животного. На ФИГ.5, 6, 7 представлены гистологические срезы фрагментов красной пульпы селезенки крысы в первые сутки после первого внутримышечного введения наночастиц меди в дозе 2 мг/кг массы животного, белой пульпы селезенки крысы на 7 сутки после повторного внутримышечного введения наночастиц меди в дозе 2 мг/кг массы животного, белой пульпы селезенки контрольной (а) и опытной (б) крыс на 7 сутки после 12 инъекции наночастиц меди в дозе 2 мг/кг массы животного соответственно.
Нами установлено, что наночастицы меди обнаруживаются в красной пульпе селезенки, преимущественно в ее макрофагах в первые сутки после внутримышечного введения металла и сохраняются в них после последующих введений (ФИГ.5). Однократное введение наночастиц меди не нарушает структурный гомеостаз селезенки, а приводит лишь к умеренному повышению функциональной активности белой пульпы, о чем свидетельствуют повышение ее относительной объемной плотности, повышение относительной объемной плотности герминативных центров, периартериальных лимфоидных муфт и повышенные показатели численности клеток на условной единице площади в этих зонах. Морфометрические показатели белой пульпы после 2 и 3 инъекций наночастиц также свидетельствует о повышении ее функциональной активности. Более значимые изменения морфометрических показателей белой пульпы наблюдаются на 7 сутки после повторного введения наночастиц меди. Увеличение лимфоидных фолликулов после второго введения наночастиц меди происходит не только за счет увеличения герминативных центров, где происходят процессы бластной трансформации и размножения лимфоцитов, но в большинстве фолликулов за счет мантийной и краевой зон, где происходят процессы дифференцировки и выхода клеток в красную пульпу (ФИГ.6).
При иммуногистохимическом исследовании пролиферативной активности клеток лимфоидных фолликулов селезенки с помощью антител Ki-67 выявлено повышение в 2 раза по сравнению с контролем экспрессии Ki-67 у животных на 7 сутки после второго введения наночастиц и понижение в 1,5 раза экспрессии этого маркера у животных на 7 сутки после 12 инъекции наночастиц меди по сравнению с контролем (p<0,05). При исследовании готовности клеток фолликулов к апоптозу выявлено снижение экспрессии каспазы-3 у животных на 7 сутки после второй инъекции наночастиц. На 7 сутки после 12 инъекции увеличивается число клеток лимфоидных фолликулов селезенки, экспрессирующих каспазу-3, что свидетельствует о повышении готовности клеток фолликулов к апоптозу (ФИГ.7, Таблица 4).
Пример 4. Оценка состояния почек животных при увеличении нагрузки наночастиц меди на организм
Исследования проводили на белых крысах-самцах линии Vistar массой 150-180 г, находящихся на общевиварийном рационе кормления, которым внутримышечно вводили водную суспензию наночастиц меди с периодичностью 1 раз в неделю в дозе 2.0 мг/кг массы животного. Другой группе животных на протяжении 3 суток выпаивали суспензию наночастиц меди в дозе 2.0 мг/кг массы животного. Экспериментальные исследования на животных проводили в соответствии с инструкциями, рекомендуемыми Российским Регламентом, 1987 г., и «The Guide for the Care and Use of Laboratory Animals (National Academy Press, Washington, D.C., 1996)». Для приготовления водной суспензии наночастиц меди для инъекций и для выпаивания была разработана лабораторная технологическая схема, которая включает следующие этапы: приготовление точной навески нанопорошка, перенесение нанопорошка в воду, последовательное диспергирование суспензии нанопорошка на ультразвуковом диспергаторе УЗДН-2Т в режиме: трехкратное диспергирование по 1 мин с перерывом 3 мин. Отбор проб для исследования структурно-функционального состояния печени проводили через 3 ч, 1 сут, 3 сут, 7 сут после каждой инъекции и через 1 ч, 2 ч после энтерального введения животным водной суспензии наночастиц. В контрольную группу входили животные, которым внутримышечно и энтерально вводили дистиллированную воду в том же объеме, что и опытным животным.
Для проведения морфологических и гистологических исследований почку фиксировали в 10% нейтральном формалине в течение суток при комнатной температуре. После стандартной гистологической проводки материал заливали в парафин. Парафиновые срезы толщиной 5 мкм окрашивали гематоксилином Майера и эозином. Для выявления экзогенной меди использовали модифицированный метод окраски парафиновых срезов с бензидином [7]. Иммуногистохимические исследования проводили на парафиновых срезах при помощи моноклональных антител (каспаза-3) и системы визуализации Bio Genex Super Sensytive Detection System (США). Для выявления готовности клеток к апоптозу выявляли экспрессию каспазы-3. Исследования проводили по протоколу фирмы производителя. Производили подсчет иммунопозитивных клеток на 1000 и выражали в ‰.
Статистическую обработку полученных данных проводили с использованием пакета программ "Statistica 5,5 for Windows" и программного пакета "MS Excel 2000". Достоверность различий сравниваемых показателей определяли по t-критерию Стьюдента. Достоверными считали результаты при p≤0,05.
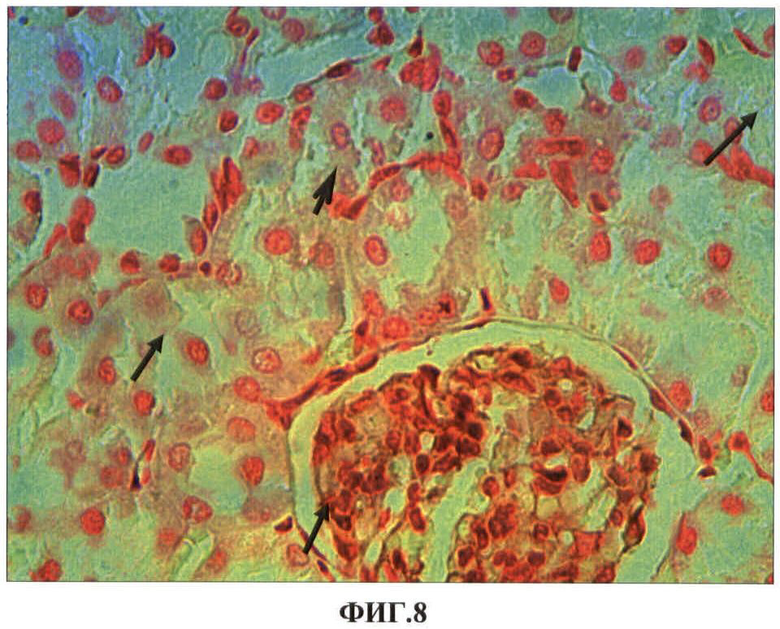
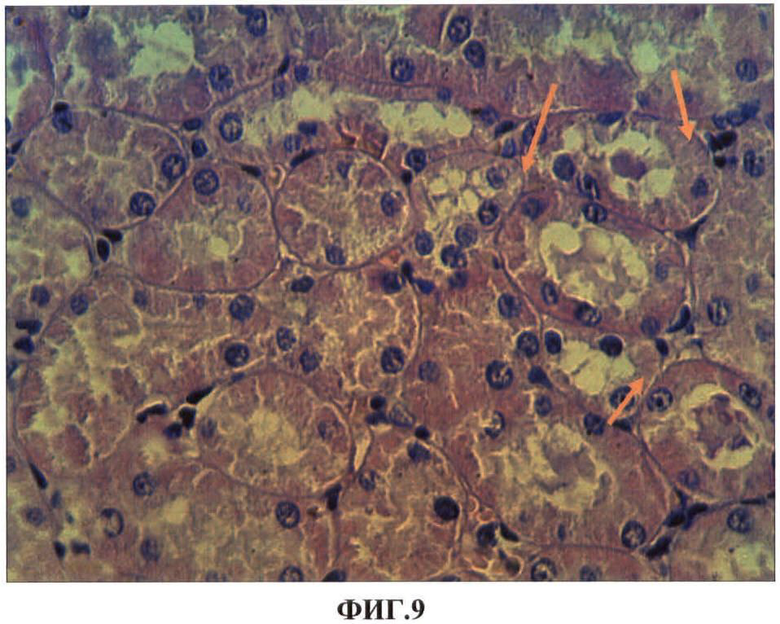
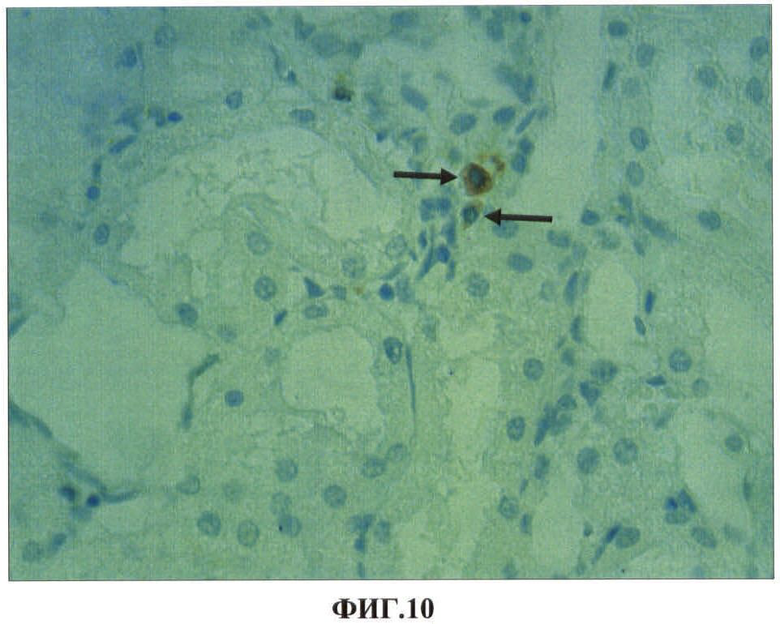
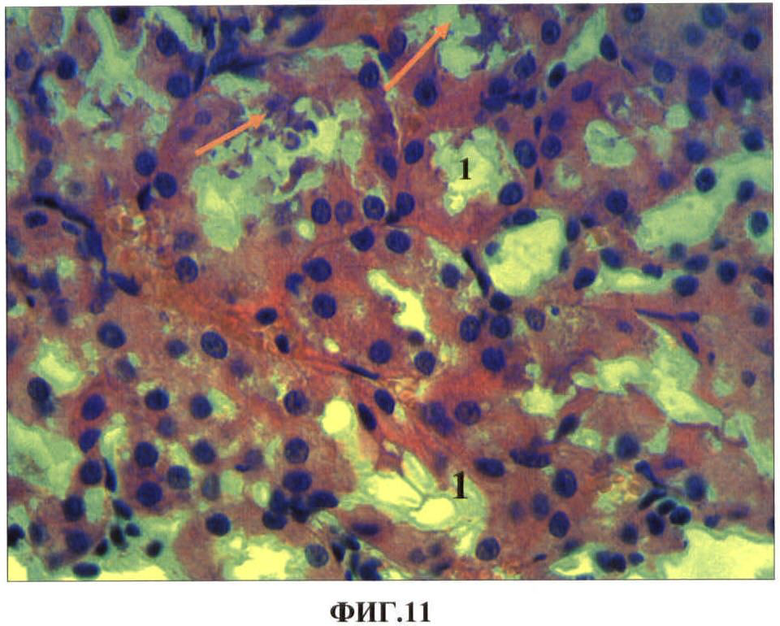
Результаты исследований представлены в таблице 5 и на ФИГ.8, 9, 10, 11. В таблице 5 представлены показатели экспрессии каспазы-3 клетками проксимальных канальцев почек при внутримышечном введении наночастиц меди в дозе 2 мг/кг массы животного. На ФИГ.8, 9, 10, 11 представлены гистологические срезы фрагментов коркового вещества почки опытной крысы через сутки после первого внутримышечного введения наночастиц меди в дозе 2 мг/кг массы животного, коркового вещества почки опытной крысы через сутки после первого внутримышечного введения наночастиц меди в дозе 2 мг/кг массы животного, коркового вещества почки опытной крысы через сутки после первого внутримышечного введения наночастиц меди в дозе 2 мг/кг массы животного, коркового вещества почки опытной крысы на 7 сутки после третьего внутримышечного введения наночастиц меди в дозе 2 мг/кг массы животного соответственно.
Нами установлено, что наночастицы меди при однократном внутримышечном введении металла обнаруживаются в почках в первые сутки после введения в клетках проксимальных канальцев (ФИГ.8). Локально в клетках отдельных канальцев обнаруживаются явления гиалиново-капельной и гидропической дистрофии (ФИГ.9). Однако эти явления не выявляются через 7 суток после введения. Клубочки почек не изменены, но в интерстициальной ткани чаще, чем в контроле, встречаются макрофаги экспрессирующие каспазу-3 (ФИГ.10). После второй и особенно после третьей внутримышечной инъекций наночастиц меди количество канальцев с явлениями белковых дистрофий увеличивается. В канальцах обнаруживаются эпителиоциты с проявлениями некроза, выявляются также локальные повреждения базальной мембраны канальцев (ФИГ.11). Достоверно увеличивается готовность клеток эпителия канальцев к апоптозу. Если в эпителии канальцев контрольной группы животных экспрессия антигена каспазы-3 составила 24,1±0,6‰, то после третьей внутримышечной инъекции наночастиц меди показатели увеличиваются в 2,5 раза (p<0,05) (Таблица 5).
При однократном энтеральном введении наночастиц, так же как при внутримышечном введении, наночастицы обнаруживаются во всех проксимальных канальцах, в отдельных из них наблюдается гиалиново-капельная и гидропическая дистрофия. После трехкратного энтерального введения, наряду с явлениями белковых дистрофий выявляется некроз отдельных эпителиоцитов в канальцах, но повреждений базальной мембраны не наблюдается, что благоприятно в плане прогноза процесса регенерации в этих канальцах. Показатель экспрессии антигена каспазы-3 в проксимальных канальцах увеличивается по сравнению с контролем в 1,6 раза (р<0,05).
Пример 5. Оценка состояния сенсомоторной зоны коры головного мозга при введении наночастиц меди на организм
Исследования проводили на белых крысах-самцах линии Vistar массой 150-180 г, находящихся на общевиварийном рационе кормления, которым однократно внутримышечно вводили водную суспензию наночастиц меди в дозе 2.0 мг/кг массы животного. Экспериментальные исследования на животных проводили в соответствии с инструкциями, рекомендуемыми Российским Регламентом, 1987 г., и «The Guide for the Care and Use of Laboratory Animals (National Academy Press, Washington, D.C., 1996)». Для приготовления водной суспензии наночастиц меди для инъекций была разработана лабораторная технологическая схема, которая включает следующие этапы: приготовление точной навески нанопорошка, перенесение нанопорошка в воду, последовательное диспергирование суспензии нанопорошка на ультразвуковом диспергаторе УЗДН-2Т в режиме: трехкратное диспергирование по 1 мин с перерывом 3 мин. Отбор проб для исследования структурно-функционального состояния сенсомоторной зоны коры головного мозга проводили через 1 сут, 3 сут, 7 сут, 14 сут после однократного внутримышечного введения животным водной суспензии наночастиц в дозе 2.0 мг/кг массы животного. В контрольную группу входили животные, которым внутримышечно вводили дистиллированную воду в том же объеме, что и опытным животным.
После фиксации ткани в нейтральном 10% формалине и стандартной гистологической проводки материал заливали в парафин. Парафиновые срезы толщиной 5 мкм окрашивали гематоксилином Майера и эозином. Для выявления экзогенной меди использовали модифицированный метод окраски парафиновых срезов с бензидином [7]. Иммуногистохимические исследования проводили на парафиновых срезах при помощи моноклональных антител и системы визуализации Bio Genex Super Sensytive Detection System (США). Для выявления готовности клеток к апоптозу выявляли экспрессию каспазы-3. Исследования проводили по протоколу фирмы производителя. Производили подсчет экспрессирующих каспазу-3 микроглиоцитов на условной единице площади идентичных сенсомоторных зон коры.
Статистическую обработку полученных данных проводили с использованием пакета программ "Statistica 5,5 for Windows" и программного пакета "MS Excel 2000". Достоверность различий сравниваемых показателей определяли по t-критерию Стьюдента. Достоверными считали результаты при p≤0,05.
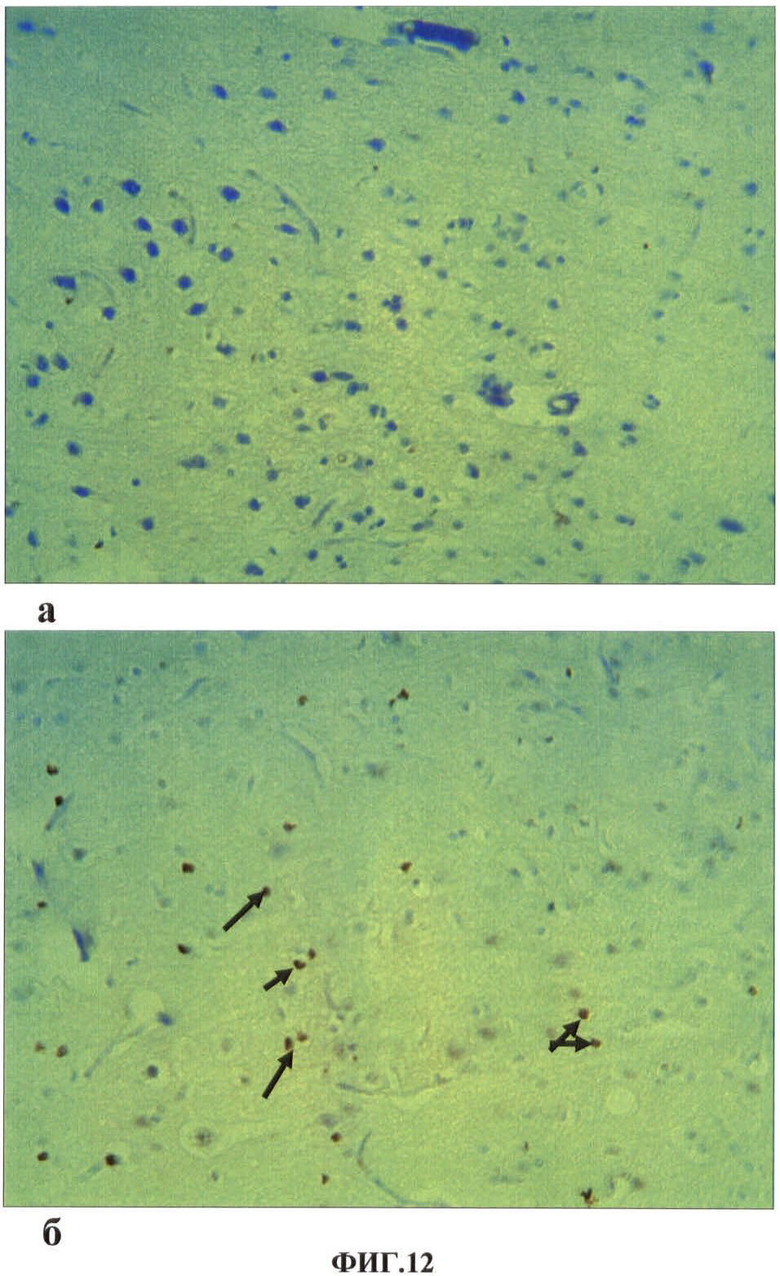
Результаты исследований представлены в таблице 6 и на ФИГ.12. В таблице 6 представлены показатели экспрессии каспазы-3 микроглиоцитами сенсомоторной зоны коры головного мозга при однократном внутримышечном введении наночастиц меди в дозе 2 мг/кг массы животного. На ФИГ.12 представлен гистологический срез фрагмента сенсомоторной зоны коры головного мозга контрольной (а) и опытной (б) крысы на 7 сутки после однократного внутримышечного введения наночастиц меди в дозе 2 мг/кг массы животного.
На светооптическом уровне в сенсомоторной зоне коры головного мозга структурных изменений у животных опытной группы после однократного внутримышечного введения наночастиц меди по сравнению с контролем не выявлено. Метод окраски с бензидином не дал положительного результата, вероятно, за счет малого количества наночастиц, поступивших в тканевые элементы нервной системы. Однако иммуногистохимическое выявление клеток, экспрессирующих каспазу-3 в сенсомоторной зоне коры головного мозга, позволило обнаружить готовность клеток к запрограммированной гибели среди микроглиоцитов. Нервных клеток, экспрессирующих каспазу-3, в разные сроки после однократного внутримышечного введения наночастиц меди (1, 3, 7, 14 сутки) не обнаружено. Среди микроглиоцитов показатель экспрессии каспазы-3 на 1 сут и 3 сут после введения ноночастиц меди недостоверно увеличен по сравнению с контролем. Самый высокий показатель экспрессии выявлен на 7 сутки после однократного внутримышечного введения наночастиц меди (ФИГ.12). У животных этой группы экспрессия каспазы-3 по сравнению с контролем увеличивается в 3 раза. К 14 суткам экспрессия каспазы-3 среди микроглиоцитов снижается и соответствует показателям контрольных животных (Таблица 6).
Наши результаты комплексных исследований, включающих гистологический и иммуногистохимический контроль тканей животных при внутримышечном и энтеральном введении наночастиц меди, позволили установить, что в исследуемых органах: печени, селезенке, почках, коре головного мозга, обнаруживаются наночастицы. В зависимости от типа ткани, суммарной дозы вводимых наночастиц и времени ответа в них наблюдаются определенные структурные изменения. В то же время для оценки безопасности необходим общий независимо от специфики органа показатель, который отражает начавшиеся в ответ на введение наночастиц структурные изменения. В качестве такого критерия нами предложен показатель готовности клеток к апоптозу, запрограммированной гибели клеток, определяемый по экспрессии антигена каспазы-3. Нами установлено, что при увеличении нагрузки наночастиц меди на организм происходит достоверное усиление экспрессии каспазы-3 в микроглиоцитах (макрофагах мозга) коры головного мозга через 7 суток после однократного внутримышечного введения наночастиц меди (доза 2 мг/кг массы животного), в клетках печени через 3, 7 суток после 3-кратного внутримышечного введения наночастиц меди (суммарная доза - 6 мг/кг массы животного), в проксимальных канальцах почек через 3 ч, 1, 3, 7 суток после 3-кратного внутримышечного введения наночастиц меди (суммарная доза - 6 мг/кг массы животного), в клетках селезенки через 3 ч, 1, 3, 7 суток после 12-кратного внутримышечного введения наночастиц меди (суммарная доза - 24 мг/кг массы животного). Полученные данные свидетельствуют о необходимости контроля в первую очередь ткани мозга через неделю после однократной инъекции наночастиц меди. И хотя изменения носят обратимый характер (в последующие 7 суток показатель апоптоза микроглиоцитов снижается до уровня контроля), можно считать дозу 2 мг/кг предельно допустимой для внутримышечного введения наночастиц меди. Правомочность выбора критерия безопасности подтверждается данными показателя апоптоза клеток печени при сравнении ответа на разные способы введения наночастиц в организм животных. Отсутствие достоверных изменений показателя апоптоза при энтеральном введении наночастиц меди свидетельствует о более безопасном (энтеральном) пути введения наночастиц меди в организм животных по сравнению с внутримышечным.
Таким образом, на основании проведенных исследований становится очевидно, что показатель готовности клеток к апоптозу отражает начавшиеся структурные нарушения в ответ на введение наночастиц меди, независимо от специфики органа. По этому показателю можно судить об органах-мишенях, допустимой дозе вводимого металла, о различиях в ответ на разные способы введения наночастиц в организм. Это дает нам основание считать показатель готовности клеток к апоптозу, оцененному по изменению экспрессии антигена каспазы-3, в качестве критерия в способе оценки безопасности введения наночастиц меди в организм живых систем.


Краткое описание фигур
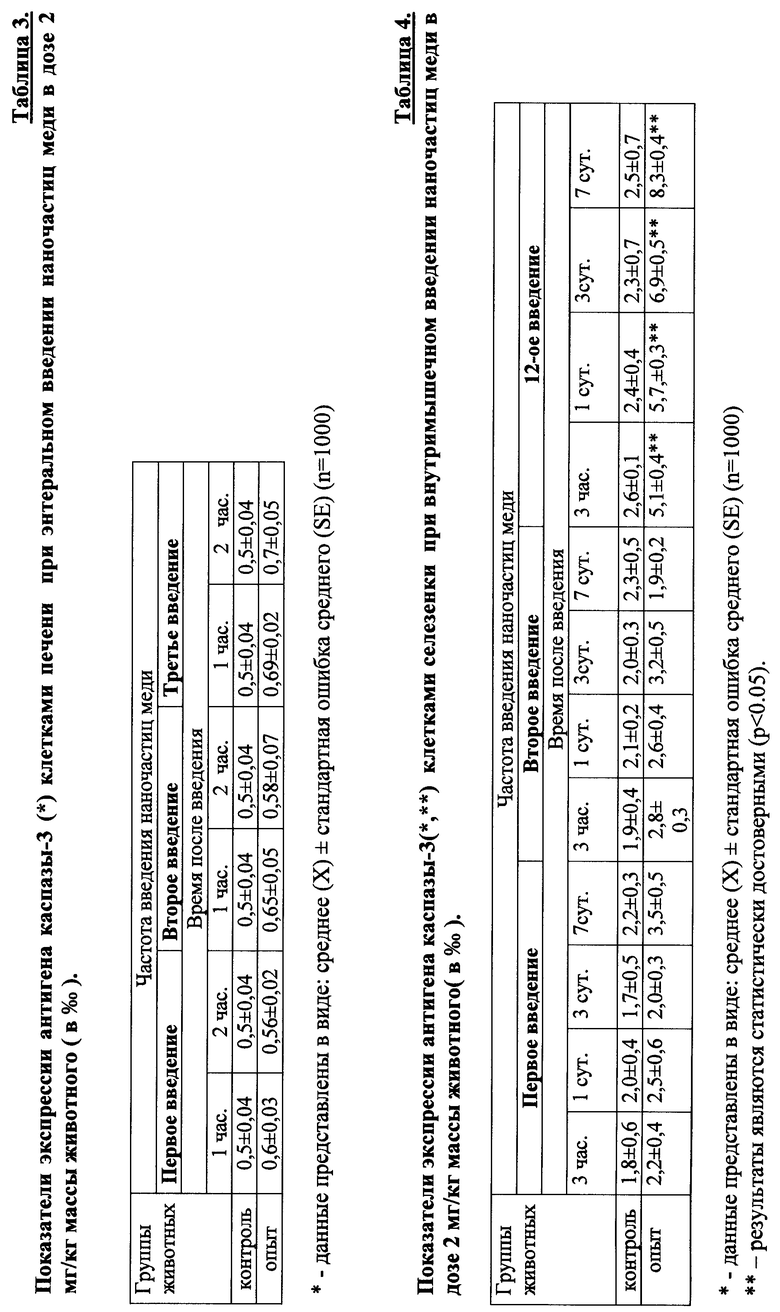
ФИГ.1. Гистологический срез фрагмента печени крысы через 3 часа после однократного внутримышечного введения наночастиц меди в дозе 2 мг/кг массы животного.
На ФИГ.1 видно, что в васкулярной части перипортальных гепатоцитов и в цитоплазме клеток Купфера печени экспериментальных животных наблюдается аморфное сине-голубое окрашивание (указано стрелкой) экзогенной меди при использовании модифицированного метода окраски с бензидином гистологических срезов фрагментов печени.
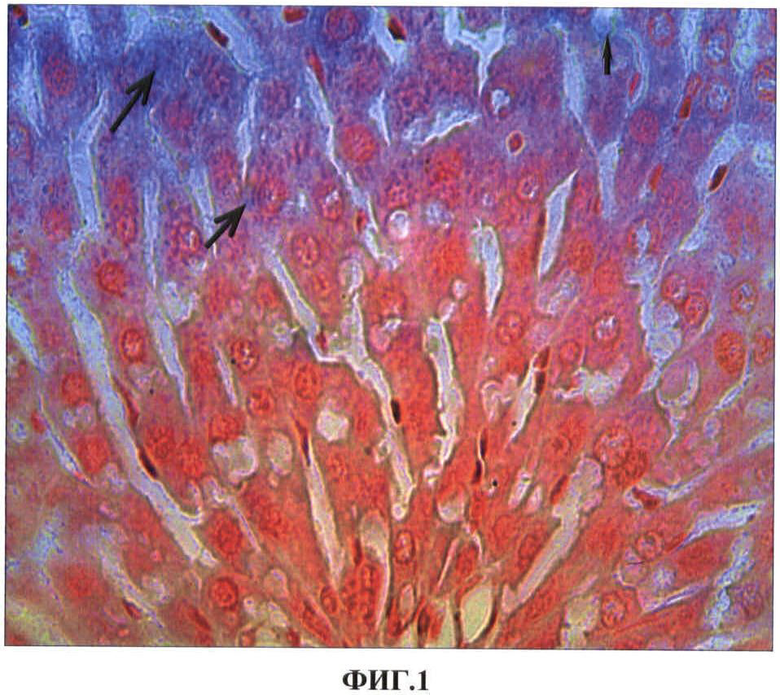
ФИГ.2. Гистологический срез фрагментов печени контрольной (а) и опытной (б) крысы на 1 сутки после повторного внутримышечного введения наночастиц меди в дозе 2 мг/кг массы животного.
На ФИГ.2 видно, что по сравнению с контролем (а) в гепатоцитах опытных крыс (б) наблюдается вакуолизация цитоплазмы (указано стрелкой) и выявляются оксифильные апоптозные тельца Каунсильмена (1).
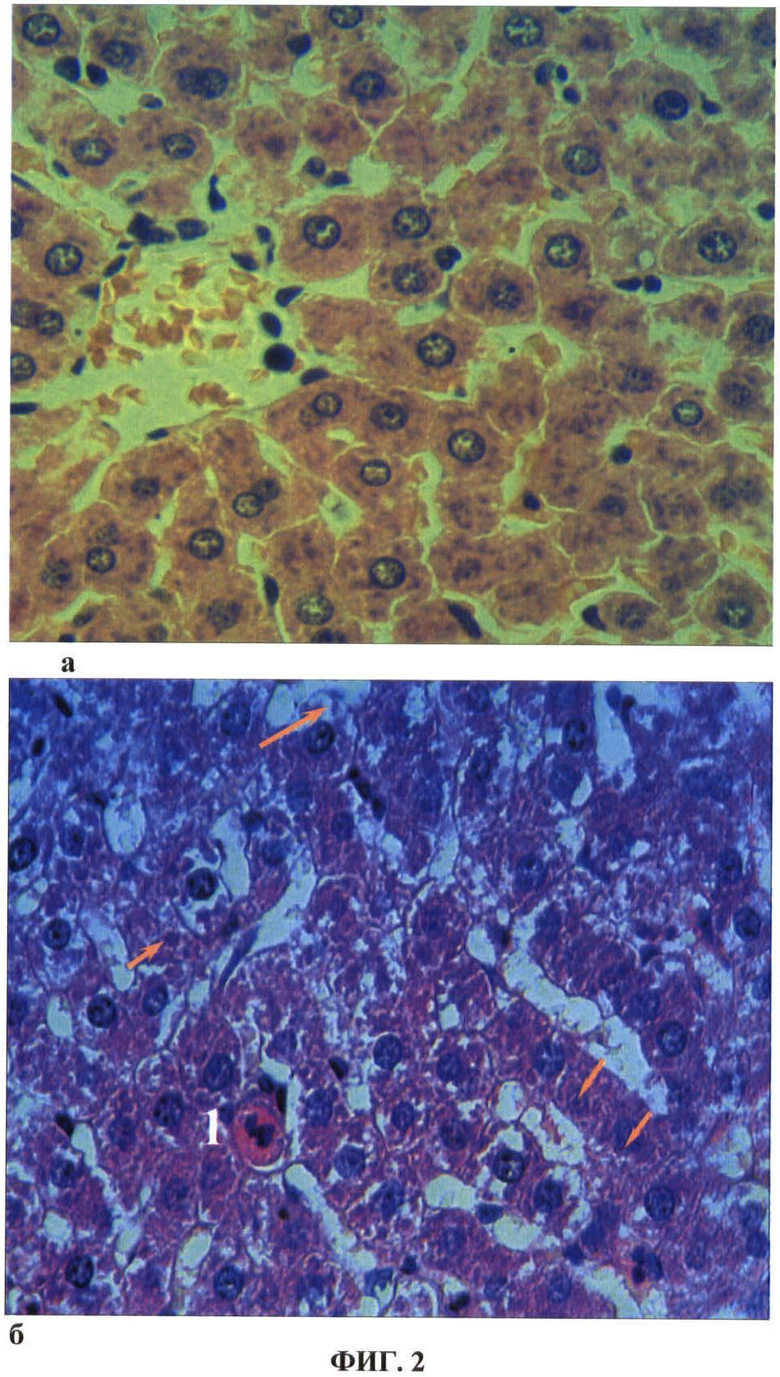
ФИГ.3. Гистологический срез фрагмента печени опытной крысы на 1 сутки после повторного внутримышечного введения наночастиц меди в дозе 2 мг/кг массы животного.
На ФИГ.3 видно, что при иммуногистохимическом выявлении готовности клеток к апоптозу в коричневый цвет окрашена цитоплазма гепатоцита (указана стрелкой), экспрессирующего каспазу-3.
ФИГ.4. Гистологические срезы фрагментов перипортальных зон печеночных долек контрольной (а) и опытной (б) крыс через 2 часа после первого энтерального введения наночастиц меди в дозе 2 мг/кг массы животного.
На ФИГ.4 видно, что по сравнению с контролем (а) в гепатоцитах перипортальных зон у опытных крыс наблюдается вакуолизация цитоплазмы, которая не обнаруживается в перивенулярной зоне. Стрелками указаны клетки с выраженными признаками гидропической дистрофии.
ФИГ.5. Гистологический срез фрагмента красной пульпы селезенки крысы в первые сутки после первого внутримышечного введения наночастиц меди в дозе 2 мг/кг массы животного.
На ФИГ.5 видно, что при использовании модифицированного метода окраски с бензидином гистологических срезов фрагментов красной пульпы селезенки преимущественно в макрофагах наблюдается аморфное сине-голубое окрашивание экзогенной меди (указано стрелками).
ФИГ.6. Гистологический срез фрагмента белой пульпы селезенки крысы на 7 сутки после повторного внутримышечного введения наночастиц меди в дозе 2 мг/кг массы животного.
На ФИГ.6. наблюдается увеличение лимфоидных фолликулов не только за счет увеличения герминативных центров (а), где происходят процессы бластной трансформации и размножения лимфоцитов, но в большинстве фолликулов за счет мантийной и краевой зон (б), где происходят процессы дифференцировки и выхода клеток в красную пульпу.
ФИГ.7. Гистологический срез фрагмента белой пульпы селезенки контрольной (а) и опытной (б) крысы на 7 сутки после 12 инъекции наночастиц меди в дозе 2 мг/кг массы животного.
На ФИГ.7. видно, что в белой пульпе селезенки опытной (б) крысы увеличивается число клеток, экспрессирующих каспазу-3 (указаны стрелками), что свидетельствует о готовности клеток к апоптозу.
1 - центральная артерия белой пульпы.
ФИГ.8. Гистологический срез фрагмента коркового вещества почки опытной крысы через сутки после первого внутримышечного введения наночастиц меди в дозе 2 мг/кг массы животного.
На ФИГ.8. видно, что в клетках проксимальных канальцев почек обнаружено разное по интенсивности аморфное сине-голубое окрашивание цитоплазмы (указано стрелками) выявляемой экзогенной меди при использовании модифицированного метода окраски с бензидином.
ФИГ.9. Гистологический срез фрагмента коркового вещества почки опытной крысы через сутки после первого внутримышечного введения наночастиц меди в дозе 2 мг/кг массы животного.
На ФИГ.9 видно, что в клетках отдельных канальцев обнаруживаются явления гиалиново-капельной и гидропической дистрофии (указано стрелками).
ФИГ.10. Гистологический срез фрагмента коркового вещества почки опытной крысы через сутки после первого внутримышечного введения наночастиц меди в дозе 2 мг/кг массы животного.
На ФИГ.10 видно, что в интерстициальной соединительной ткани чаще, чем в контроле, выявляются клетки, экспрессирующие каспазу-3 (указано стрелками).
ФИГ.11. Гистологический срез фрагмента коркового вещества почки опытной крысы на 7 сутки после третьего внутримышечного введения наночастиц меди в дозе 2 мг/кг массы животного.
На ФИГ.11 видно, что в клетках канальцев обнаруживаются явления гиалиново-капельной и гидропической дистрофии (1) и местами их некроз (указано стрелками).
ФИГ.12. Гистологический срез фрагмента сенсомоторной зоны коры контрольной (а) и опытной (б) крысы на 7 сутки после однократного внутримышечного введения наночастиц меди в дозе 2 мг/кг массы животного.
На ФИГ.12 видно, что в сенсомоторной зоне коры головного мозга опытной крысы (б) по сравнению с контролем (а) в большем количестве выявляются микроглиоциты, экспрессирующие каспазу-3 (указаны стрелками).
ЛИТЕРАТУРА



| название | год | авторы | номер документа |
|---|---|---|---|
| Способ комбинированной терапии рака печени РС-1 в эксперименте | 2020 |
|
RU2734143C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ОСТЕОАРТРОЗА | 2015 |
|
RU2587039C1 |
| Способ моделирования дисфункции эндотелия и патологии внутренних органов в эксперименте | 2019 |
|
RU2712102C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ХРОНИЧЕСКОЙ АЛКОГОЛЬНОЙ ИНТОКСИКАЦИИ У КРЫС В ЭКСПЕРИМЕНТЕ | 2020 |
|
RU2740569C1 |
| Способ оценки токсического действия биметаллического феррум-гадолиниевого нанокомпозита, инкапсулированного в природную полимерную матрицу арабиногалактана, на лабораторных животных | 2019 |
|
RU2733504C1 |
| СПОСОБ ПРОФИЛАКТИКИ ТОКСИЧЕСКОГО ДЕЙСТВИЯ КАДМИЯ У ЭКСПЕРИМЕНТАЛЬНЫХ ЖИВОТНЫХ | 2009 |
|
RU2410763C1 |
| Низкотоксичная фармацевтическая композиция с противоопухолевой активностью в отношении холангиокарциномы | 2023 |
|
RU2825942C1 |
| СПОСОБ ЛЕЧЕНИЯ СИСТЕМНЫХ ИЕРСИНИОЗНЫХ БАКТЕРИАЛЬНЫХ ИНФЕКЦИЙ В ЭКСПЕРИМЕНТЕ | 2014 |
|
RU2563174C1 |
| СПОСОБ ЛЕЧЕНИЯ ИНФЕКЦИОННОГО ПЕРИТОНИТА В ЭКСПЕРИМЕНТЕ | 2014 |
|
RU2553342C1 |
| СПОСОБ ВОССТАНОВЛЕНИЯ ПАРЕНХИМЫ ПОВРЕЖДЕННОЙ ПЕЧЕНИ КРЫС | 2009 |
|
RU2398290C1 |
Изобретение относится к медицине и описывает способ оценки безопасности введения наночастиц меди в организм, заключающийся в определении изменения показателя экспрессии антигена каспазы-3 в микроглиоцитах сенсомоторной зоны коры головного мозга после введения наночастиц меди по сравнению с контрольной группой животных путем подсчета экспрессирующих каспазу-3 микроглиоцитов на условной единице площади идентичных сенсомоторных зон. Предлагаемый способ позволяет определить допустимую дозу вводимого препарата, органы-мишени, выбрать наиболее оптимальный способ введения препарата в организм. 1 з.п. ф-лы, 5 пр., 6 табл., 12 ил.
1. Способ оценки безопасности введения наночастиц меди в организм, заключающийся в определении изменения показателя экспрессии антигена каспазы-3 в микроглиоцитах сенсомоторной зоны коры головного мозга после введения наночастиц меди по сравнению с контрольной группой животных путем подсчета экспрессирующих каспазу-3 микроглиоцитов на условной единице площади идентичных сенсомоторных зон.
2. Способ по п.1, по которому отбор проб осуществляется через 1 сут, 3 сут, 7 сут, 14 сут после введения наночастиц металлов в организм.
| СИЗОВА Е.А | |||
| и др | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Материалы III-й Международной научно-практической конференции молодых ученых | |||
| Молодежь и наука XXI Века, 23-26 ноября 2010 года | |||
| Ульяновск, т.1, с.244-248 | |||
| ПОЛЯКОВА B.C | |||
| и др | |||
| Исследование безопасности попадания наночастиц металлов в | |||
Авторы
Даты
2013-03-10—Публикация
2011-05-17—Подача