Перекрестная ссылка на родственную патентную заявку
По данной заявке испрашивается приоритет на основании 35 U.S.C. $119(e) по предварительной патентной заявке США № 60/871854, поданной 26 декабря 2006 г., которая включена в настоящее описание в качестве ссылки в полном объеме.
Описание изобретения
Область изобретения
Настоящее изобретение главным образом относится к вариантам дезинтегрина и, более конкретно, к вариантам дезинтегрина, которые являются селективными антагонистами интегрина αvβ3 и могут использоваться для лечения и профилактики интегрин αvβ3-ассоциированных заболеваний.
Уровень техники изобретения
Кость представляет собой сложную ткань, состоящую из нескольких типов клеток, которые непрерывно подвергаются процессу обновления и восстановления, называемому "ремоделирование кости". Существует два основных типа клеток, отвечающих за ремоделирование кости: остеокласты, которые осуществляют резорбцию костей, и остеобласты, обеспечивающие формирование новой кости. Известно, что ремоделирование кости регулируется некоторыми системными гормонами (например, паращитовидным гормоном, 1,25-дигидроксивитамином D3, половыми гормонами и кальцитонином) и локальными факторами (например, оксидом азота, простагландинами, факторами роста и цитокинами) [1].
Интегрины представляют собой гетеродимерные рецепторы матрикса, которые прикрепляют клетки к субстратам и передают внешние сигналы через плазматическую мембрану [5]. Интегрин αvβ3 участвует в опосредованной остеокластами резорбции кости как in vivo [6], так и in vitro [7, 8]. Данная гетеродимерная молекула распознает аминокислотный мотив Arg-Gly-Asp (RGD, SEQ ID NO:2), содержащийся в белках костного матрикса, таких как остеопонтин и костный сиалопротеин [7, 8]. Интегрин αvβ3 экспрессируется в остеокластах [9], причем его экспрессия модулируется резорбтивными стероидами и цитокинами [10]. В экспериментах по блокированию интегрин αvβ3 индентифицирован как основной рецептор функциональной адгезии остеокластов. Ингибиторы интегрина αvβ3 снижают способность остеокластов связываться и осуществлять резорбцию кости [7, 11]. Поскольку интегрин αvβ3 играет ключевую роль в функционировании остеокластов [7, 11, 12], полагают, что ингибиторы данного интегрина могут способствовать предотвращению остеопороза [11], остеолитических метастазов [13] и гиперкальцемии, индуцированной злокачественным заболеванием.
Существует много костных заболеваний, связанных с остеолизом, опосредуемым остеокластами. Остеопороз является наиболее распространенным заболеванием, которое возникает при нарушении баланса между резорбцией и формированием кости, когда разрушение костной ткани преобладает над ее созданием. Остеопороз также вызывается другими состояниями, такими как гормональный дисбаланс, гормональные заболевания или состояние после приема гормональных лекарственных средств (таких как кортикостероиды или противоэпилептические средства) [2]. При раке молочной железы, предстательной железы, легкого и щитовидной железы человека, а также при других раковых заболеваниях кость является одним из наиболее вероятных участков метастазирования [3, 4]. Остеопороз также может возникать в результате постклимактерической недостаточности эстрогенов. Вторичный остеопороз может быть связан с ревматоидным артритом. При костном метастазе наблюдается уникальная стадия резорбции кости под действием остеокластов, которая отсутствует при метастазах в других органах. Широко известно, что связанный с раком остеолиз в большинстве случаев опосредуется остеокластами, которые по-видимому находятся в активированном состоянии и могут активироваться либо косвенно, через остеобласты, либо непосредственно, под действием опухолевых продуктов [4]. Кроме того, жизненно важным осложнением остеолитических заболеваний костей является гиперкальцемия (повышенное содержание кальция в крови). Она относительно часто встречается у пациентов с обширной деструкцией костей, чаще всего при карциномах молочной железы, легкого, почки и поджелудочной железы, а также при миеломе [4].
Дезинтегрины относятся к семейству низкомолекулярных RGD-содержащих пептидов, которые специфически связываются с интегринами αIIbβ3, α5β1 и αvβ3, которые экспрессируются на тромбоцитах и других клетках, включающих клетки эндотелия сосудов и некоторые опухолевые клетки [14, 15]. Исследования дезинтегринов, обладающих высокой антитробоцитарной активностью, показали, что их также можно использовать для диагностики сердечно-сосудистых заболеваний и конструирования терапевтических средств для лечения артериального тромбоза, остеопороза и ассоциированных с ангиогенезом роста и метастазирования опухоли [15]. Обнаружено, что родостомин (Rho), дезинтегрин, полученный из яда Colloselasma rhodostoma, ингибирует агрегацию тромбоцитов in vivo и in vitro [16, 17] посредством блокады тромбоцитарного гликопротеина αIIbβ3. Кроме того, описано, что родостомин дозозависимым образом ингибирует адгезию клеток карциномы молочной железы и предстательной железы как к неминерализованному, так и к минерализованному внеклеточному костному матриксу, не влияя на жизнеспособность опухолевых клеток. Родостомин также подавляет миграцию и инвазию клеток карциномы молочной железы и предстательной железы [18]. Показано также, что родостомин ингибирует липогенез и ожирение [19]. Однако поскольку родостомин неспецифически связывается с интегринами αIIbβ3, α5β1 и αvβ3, фармацевтическое применение родостомина вызывает серьезные побочные эффекты. Например, при применении родостомина для лечения карциномы нежелательным побочным эффектом является ингибирование агрегации тромбоцитов.
Таким образом, в данной области существует потребность в преодолении упомянутых дефектов и недостатков, в особенности, связанных с получением варианта дезинтегрина, обладающего специфической селективностью по отношению к интегрину αvβ3.
Сущность изобретения
Один аспект данного изобретения относится к полипептиду, который является селективным по отношению к интегрину αvβ3. Данный полипептид проявляет уменьшенное связывание с интегрином αIIbβ3 и/или α5β1 по сравнению с дезинтегрином дикого типа. Полипептид кодируется модифицированной нуклеотидной последовательностью дезинтегрина, которая кодирует модифицированную аминокислотную последовательность, обладающую пониженной способностью связываться с интегрином αIIbβ3 и/или α5β1. Полипептид может быть пэгилированным или конъюгированным с альбумином.
Нуклеотидную последовательность дезинтегрина можно получить из змеиного яда. Дезинтегрин может быть выбран из родостомина, альболабрина, апплагина, басилицина, батроксостатина, битистатина, цереберина, церастина, кротатроксина, дуриссина, элегантина, флаворидина, флавостатина, халисина, халистатина, ярарацина, ярастатина, кистрина, лачесина, лутосина, молоссина, салмосина, саксатилина, тергеминина, триместатина, тримукрина, тримутаса, уссуристатина и виридина.
Другой аспект данного изобретения относится к полипептиду, который представляет собой вариант родостомина, где родостомин содержит аминокислотную последовательность SEQ ID NO:1.
Другой аспект данного изобретения относится к полипептиду, содержащему аминокислотную последовательность, выбранную из SEQ ID NO:30-42.
Другой аспект данного изобретения относится к полипептиду, содержащему аминокислотную последовательность SEQ ID NO:29, которая дополнительно содержит одну, две, три или четыре аминокислотные замены в положениях, соответствующих аминокислотам 48, 50, 52 или 53 SEQ ID NO:1.
Другой аспект данного изобретения относится к полипептиду, содержащему аминокислотные замены, выбранные из Ala в положении 48, Leu, Ile и His в положении 50, Asp, Met и Asn в положении 52 и Val, Leu и Met в положении 53 SEQ ID NO:1.
Другой аспект данного изобретения относится к полипептиду, который кодируется нуклеотидной последовательностью, выбранной из SEQ ID NO:43-56.
Другой аспект данного изобретения относится к полипептиду, который проявляет сродство к αIIbβ3 и/или α5β1, по меньшей мере, примерно в 5, 50 или 100 раз меньше по сравнению с родостомином. В одном варианте осуществления данного изобретения полипептид проявляет сродство к интегрину αIIbβ3 и/или α5β1, по меньшей мере, примерно в 200 раз меньше по сравнению с родостомином. В другом варианте осуществления данного изобретения полипептид проявляет сродство к интегрину αIIbβ3 и/или α5β1, по меньшей мере, примерно в 1000 или 2000 раз меньше по сравнению с родостомином. В другом варианте осуществления данного изобретения полипептид проявляет сродство к тромбоцитам, по меньшей мере, примерно в 5, 50, 100, 1000 или 2000 раз меньше по сравнению с родостомином. В следующем варианте осуществления данного изобретения полипептид обладает существенно сниженной активностью в продлении времени свертывания крови по сравнению с родостомином и/или дезинтегрином дикого типа.
Следующий аспект данного изобретения относится к физиологически приемлемой композиции, содержащей полипептид по изобретению и фармацевтически приемлемый носитель.
Другой аспект данного изобретения относится к полипептиду, содержащему аминокислотную последовательность, выбранную из SEQ ID NO:57-69.
Следующий аспект данного изобретения относится к способу применения варианта дезинтегрина для лечения и/или профилактики интегрин αvβ3-ассоциированного заболевания у млекопитающего, в том числе у человека. Данный способ включает стадию введения млекопитающему, нуждающемуся в этом, терапевтически эффективного количества варианта дезинтегрина. Используемый в данном способе полипептид может быть пэгилированным или конъюгированным с альбумином.
В одном аспекте данного изобретения дезинтегрин может быть получен из змеиного яда и может быть выбран из родостомина, альболабрина, апплагина, басилицина, батроксостатина, битистатина, цереберина, церастина, кротатроксина, дуриссина, элегантина, флаворидина, флавостатина, халисина, халистатина, ярарацина, ярастатина, кистрина, лачесина, лутосина, молоссина, салмосина, саксатилина, тергеминина, триместатина, тримукрина, тримутаса, уссуристатина и виридина.
В одном аспекте данного изобретения дезинтегрин представляет собой родостомин.
В другом аспекте данного изобретения родостомин содержит вариант родостомина, содержащий аминокислотную последовательность SEQ ID NO:1.
В другом аспекте родостомин содержит вариант мотива RGD, содержащий аминокислотную последовательность, выбранную из SEQ ID NO:30-42.
В другом аспекте родостомин содержит аминокислотную последовательность, выбранную из SEQ ID NO:57-69.
В одном аспекте данного изобретения интегрин αvβ3-ассоциированное заболевание включает, без ограничения, остеопороз, рост опухоли или рака кости и связанные с ним симптомы, ассоциированные с ангиогенезом рост и метастазирование опухоли, опухолевый метастаз в кости, индуцированную злокачественным заболеванием гиперкальциемию, ассоциированные с ангиогенезом заболевания глаз, болезнь Педжета, ревматоидный артрит и остеоартрит.
В другом аспекте настоящего изобретения полипептид по изобретению используют для лечения и/или профилактики ассоциированного с ангиогенезом заболевания глаза, которое включает, без ограничения, возрастную дегенерацию желтого пятна, диабетическую ретинопатию, заболевания, связанные с реваскуляризацией роговицы, индуцированную ишемией реваскуляризационную ретинопатию, сильную близорукость и ретинопатию недоношенных.
В следующем аспекте полипептид по изобретению используют для лечения и/или профилактики остеопороза. Остеопороз может быть связан с патологическим состоянием, выбранным из постклимактерической недостаточности эстрогенов, вторичного остеопороза, ревматоидного артрита, овариэктомии, болезни Педжета, рака кости, опухоли кости, остеоартрита, повышенного образования остеокластов и повышенной активности остеокластов. Кроме того, остеопороз включает, без ограничения, индуцированный овариэктомией или постклимактерический остеопороз или разрежение кости.
Следующий аспект настоящего изобретения относится к способу применения полипептида по изобретению для лечения и/или профилактики индуцированного овариэктомией физиологического изменения у млекопитающего, включающего человека.
Следующий аспект настоящего изобретения относится к способу применения варианта дезинтегрина для ингибирования и/или предотвращения роста опухолевых клеток в кости, а также связанных с ним симптомов у млекопитающего, в том числе человека.
Следующий аспект настоящего изобретения относится к способу получения полипептида по изобретению, который включает следующие стадии: (a) трансфицирование клетки-хозяина полинуклеотидом, кодирующим указанный полипептид; (b) выращивание указанной клетки в культуральной среде и выделение указанного полипептида. Способ по изобретению дополнительно может включать выращивание клетки-хозяина в культуральной среде, не содержащей аминокислот; и сбор супернатанта для получения указанного полипептида. Способ также может дополнительно включать добавление метанола в культуральную среду для индукции экспрессии полипептида в клетках-хозяевах. Способ может дополнительно включать стадию проведения колоночной хроматографии для получения указанного полипептида. В одном варианте осуществления способ может дополнительно включать стадию проведения ВЭЖХ для получения выделенного полипептида.
Другой аспект настоящего изобретения относится к полинуклеотиду, кодирующему полипептид, селективный по отношению к интегрину αvβ3, где полипептид может представлять собой вариант дезинтегрина, выделенный из змеиного яда.
В другом аспекте настоящего изобретения дезинтегрин выбран из родостомина, альболабрина, апплагина, басилицина, батроксостатина, битистатина, цереберина, церастина, кротатроксина, дуриссина, элегантина, флаворидина, флавостатина, халисина, халистатина, ярарацина, ярастатина, кистрина, лачесина, лутосина, молоссина, салмосина, саксатилина, тергеминина, триместатина, тримукрина, тримутаса, уссуристатина и виридина.
В другом аспекте настоящего изобретения дезинтегрин содержит родостомин.
В другом аспекте настоящего изобретения дезинтегрин содержит вариант родостомина, содержащий аминокислотную последовательность SEQ ID NO:1.
В другом аспекте настоящего изобретения полипептид содержит вариант мотива RGD, содержащий аминокислотную последовательность, выбранную из SEQ ID NO:30-42.
В другом аспекте настоящего изобретения полинуклеотид содержит последовательность, выбранную из SEQ ID NO:43-56 и 78-135.
В другом аспекте настоящего изобретения полинуклеотид может кодировать полипептиды, содержащие одну, две, три или четыре аминокислотные замены в положениях, соответствующих аминокислотам 48, 50, 52 или 53 SEQ ID NO:1.
Другой аспект настоящего изобретения относится к полинуклеотиду, который гибридизуется в жестких условиях с полинуклеотидом по изобретению.
Другой аспект настоящего изобретения относится к полипептиду, кодируемому полинуклеотидом, который гибридизуется с полинуклеотидной последовательностью по изобретению.
Эти и другие аспекты разъясняются в нижеследующем описании различных вариантов воплощения в сочетании с приведенными ниже фигурами, хотя возможно осуществление разных вариаций и модификаций без отступления от сущности и объема новых концепций, изложенных в настоящем описании.
Приложенные рисунки иллюстрируют один или несколько вариантов осуществления настоящего изобретения и, вместе с приведенным описанием, служат для разъяснения принципов настоящего изобретения.
Другие цели и преимущества настоящего изобретения частично приведены в нижеследующем описании и частично вытекают из данного описания, или они могут стать очевидны при осуществлении настоящего изобретения. Цели и преимущества настоящего изобретения можно достичь и реализовать с помощью конкретных элементов и их сочетаний, указанных в прилагающейся формуле изобретения.
Следует понимать, что и вышеизложенное общее описание, и нижеследующее подробное описание приведены только для иллюстрации и пояснения и не ограничивают настоящее изобретение, определенное в формуле изобретения.
Прилагающиеся фигуры, которые входят в объем настоящего описания и составляют его часть, иллюстрируют варианты осуществления настоящего изобретения и в сочетании с описанием служат для разъяснения принципов изобретения.
Краткое описание фигур
На фиг.1 приведен график, демонстрирующий, что RD, HSA-RD и ARLDDL оказывают меньше влияния на время кровотечения у мышей, чем родостомин.
На фиг.2А приведены фотографии губчатых костей, демонстрирующие ингибирование индуцированного овариэктомией разрежения кости у крыс, получающих белок PGP. Отрезок = 1 мм.
На фиг.2В приведены фотографии губчатых костей, окрашенных устойчивой к тартрату кислой фосфатазой (TRAP), демонстрирующие ингибирование индуцированного овариэктомией увеличения числа остеокластов у крыс, получающих белок PGP. Отрезок = 100 мм.
На фиг.3 приведен график, демонстрирующий ингибирование индуцированной овариэктомией активации остеокластов у крыс, получающих белок RD или алендронат (обработка лекарственным средством), возвращение концентрации маркера остеокластов к прежнему состоянию в период отмены лекарственного средства и снижение индуцированного овариэктомией увеличения активности остеокластов при повторном введении RD или алендроната.
На фиг.4A-4D приведены фотографии коленного сустава, окрашенного сафранином-O и гематоксилином, демонстрирующие подавление разрушения слоя хондроцитов у крыс с артритом, получающих белок RD. Стрелки показывают слой хондроцитов.
На фиг.5A-5C приведены графики, демонстрирующие ингибирование повышения уровня цитокинов в крови крыс с остеоартритом, получающих белок RD.
На фиг.6A-6C приведены графики, демонстрирующие ингибирование повышения уровня цитокинов в крови мышей с остеоартритом, получающих белок RD.
На фиг.7 приведен график, демонстрирующий ингибирование роста опухоли кости PC-3 у мышей SCID, получающих белок RD, а не алендронат.
На фиг.8 приведен график, демонстрирующий ингибирование индуцированного опухолью уменьшения массы тела у мышей SCID, получающих белок RD.
На фиг.9A приведены фотографии, демонстрирующие видимый рост сферической опухоли в проксимальной области большеберцовой кости каждой конечности после введения в большеберцовую кость клеток PC-3 (показано стрелками в средней панели) и ингибирование роста опухоли кости у мышей SCID, получающих белок RD.
На фиг.9B приведены рентгеновские снимки большеберцовых костей, демонстрирующие, что у мышей SCID, получающих белок RD, наблюдается подавление остеолитического повреждения костей, индуцированного опухолевыми клетками PC-3.
На фиг.9C графически изображены результаты, показанные на фиг.9B, демонстрирующие ингибирование индуцированного опухолью PC-3 остеолиза у мышей SCID, получающих белок RD.
На фиг.9D приведен график, демонстрирующий ингибирование индуцированного опухолью PC-3 увеличения уровня C-концевых телопептидов коллагена типа I у мышей SCID, получающих белок RD.
На фиг.9E приведен график, демонстрирующий ингибирование индуцированного опухолью PC-3 увеличения концентрации кальция в сыворотке мышей SCID, получающих белок RD или алендронат.
На фиг.10A приведен график, демонстрирующий ингибирование роста опухоли кости MDA-MB-231 у голых мышей, получающих белок RD.
На фиг.10B приведен график, демонстрирующий ингибирование индуцированного опухолью кости MDA-MB-231 увеличения уровня C-концевых телопептидов коллагена типа I у голых мышей, получающих белок RD.
На фиг.10C приведен график, демонстрирующий ингибирование индуцированной опухолью кости MDA-MB-231 гиперкальциемии у голых мышей, получающих белок RD.
На фиг.10D приведен график, демонстрирующий отсутствие изменений в числе белых кровяных клеток у голых мышей, обработанных клетками MDA-MB-231 и получающих белок RD.
На фиг.10E приведен график, демонстрирующий отсутствие изменений в числе красных кровяных клеток у голых мышей, обработанных клетками MDA-MB-231 и получающих белок RD.
На фиг.10F приведен график, демонстрирующий отсутствие изменений в числе тромбоцитов у голых мышей, обработанных клетками MDA-MB-231 и получающих белок RD.
На фиг.11A приведены фотографии, демонстрирующие уменьшение плотности кровеносных сосудов в слое MATRIGELTM у мышей C57BL/6, получающих белок RD или RD-альбумин (HSA-RD), по сравнению с необработанными контрольными мышами.
На фиг.11В приведен график, демонстрирующий снижение содержания гемоглобина в слое MATRIGELTM у мышей C57BL/6, получающих белок RD (ежедневно - RD/1день или через день - RD/2день) или RD-альбумин (HSA-RD через день), по сравнению с необработанными контрольными мышами.
На фиг.12A приведены фотографии, демонстрирующие ангиогенез у мышиной модели ретинопатии недоношенных (ROP) и уменьшение ангиогенеза у мыши ROP, получающей белок RD (ROP+RD). Стрелки показывают профили кровеносных сосудов (BVP).
На фиг.12B приведен график, демонстрирующий уменьшение BVP у мышиной модели ретинопатии недоношенных (ROP), получающей белок RD.
На фиг.13A приведен график, демонстрирующий ингибирование индуцированной овариэктомией активации остеокластов у мышей, получающих белок RD или RD-альбумин.
На фиг.13B приведен график, демонстрирующий ингибирование индуцированной овариэктомией инактивации щелочной фосфатазы (ALP) у мышей, получающих белок RD или RD-альбумин.
На фиг.13C приведен график, демонстрирующий ингибирование индуцированного овариэктомией уменьшения BMD.
На фиг.13D приведен график, демонстрирующий ингибирование индуцированного овариэктомией уменьшения BMC.
На фиг.14A-D показаны аминокислотные последовательности вариантов родостомина SEQ ID NO:1 и 57-69.
На фиг.15A-C показаны нуклеотидные последовательности SEQ ID NO:43-56 вариантов родостомина.
На фиг.16A-H показаны аминокислотные и нуклеотидные последовательности вариантов дезинтегрина SEQ ID NO:78-135.
Подробное описание настоящего изобретения
Настоящее изобретение более конкретно описывается в нижеследующих примерах, которые приведены только для иллюстрации, поскольку специалисты в данной области могут осуществить многочисленные модификации и вариации данных примеров. Разные варианты осуществления данного изобретения здесь описываются более подробно. В описании и нижеследующей формуле изобретения термины, используемые в единственном числе, включают множественное, если контекст не диктует иную трактовку. Кроме того, в описании и нижеследующей формуле изобретения термин "в" включает значения "в" и "на", если контекст не диктует иную трактовку. Некоторые термины, используемые в данном описании, более конкретно определены ниже. Все ссылки, цитирующиеся и упоминающиеся в настоящем описании, включены в данный документ в качестве ссылки во всей полноте в такой степени, как если бы каждая ссылка была отдельно включена в качестве ссылки.
Далее более подробно описываются варианты осуществления настоящего изобретения (иллюстративные воплощения), примеры которых отражены в прилагающихся фигурах.
Определения
В данном описании термины, используемые в контексте данного изобретения и в конкретном контексте применения каждого термина, обычно имеют общепринятое для данной области значение. Для дополнительного разъяснения описания настоящего изобретения ниже, или в любом другом месте, приводятся определения некоторых терминов, используемых для описания настоящего изобретения. Для некоторых терминов предлагаются синонимы. Употребление одного или нескольких синонимов не исключает применения других синонимов. Примеры, приводимые на протяжении данного описания, в том числе примеры любых упоминающихся здесь терминов, являются только иллюстративными и никаким образом не ограничивают объема и сущности настоящего изобретения или какого-либо конкретного термина. Данное изобретение не ограничивается разными вариантами осуществления, приведенными в данном описании.
Если не указано иначе, все технические и научные термины, используемые в данном документе, имеют традиционные значения, известные рядовым специалистам в области, к которой принадлежит настоящее изобретение. В случае конфликта данный документ, включающий определения, подлежит проверке.
Термины "около", "примерно" или "приблизительно" относятся к значению или интервалу, варьирующему в пределах 20 процентов, в пределах 10 процентов, в пределах 5, 4, 3, 2 или 1 процента от заданного значения или интервала. Численные значения являются приблизительными, то есть наличие терминов "около", "примерно" или "приблизительно" подразумевается, даже если специально не указано.
Термины "полинуклеотид", "нуклеотид", "нуклеиновая кислота", "молекула нуклеиновой кислоты", "последовательность нуклеиновой кислоты", "полинуклеотидная последовательность" и "нуклеотидная последовательность" используются как взаимозаменяемые для обозначения состоящих из нуклеотидов полимерных форм любой длины. К полинуклеотидам могут относиться дезоксирибонуклеотиды, рибонуклеотиды и/или их аналоги или производные. Данный термин включает варианты. Варианты могут содержать вставки, добавления, делеции или замены. Нуклеотидные последовательности описываются в направлении от 5'-конца к 3'-концу.
Термины "полипептид", "пептид" и "белок" используются как взаимозаменяемые для обозначения состоящих из аминокислот полимерных форм любой длины, которые могут содержать природные аминокислоты, кодируемые и некодируемые аминокислоты, химически или биохимически модифицированные, дериватизированные или сконструированные аминокислоты и аналоги аминокислот, и включают пептидомиметики и депсипептиды, а также полипептиды, имеющие модифицированные, циклические, бициклические, депсициклические или депсибициклические пептидные скелеты. Термин включает как одноцепочечные белки, так и мультимеры. Термин также охватывает белки, конъюгированные с меткой, такой как FITC, биотин и радиоизотопы, включающие, без ограничения, 64Cu, 67Cu, 90Y, 99mTc, 111In, 124I, 125I, 131I, 137Cs, 186Re, 211At, 212Bi, 213Bi, 223Ra, 241Am и 244Cm; ферменты, продукты которых можно детектировать (например, люцифераза, пероксидаза, щелочная фосфатаза, β-галактозидаза и т.п.); люминофоры и флуоресцентные метки, флюоресцирующие металлы, например, 152Eu или другие лантаниды, электрохемилюминесцентные соединения, хемилюминесцентные соединения, например, люминал, изолюминал или соли акридиния; специфические связывающие молекулы, например, магнитные частицы, микросферы, наносферы и т.п. Термин также включает пептиды, конъюгированные с терапевтическими средствами.
Термины также охватывают гибридные белки, включающие, но без ограничения, гибриды с глутатион-S-трансферазой (GST), гибриды с гетерологичной аминокислотной последовательностью, такой как биолюминесцентный белок, например, люциферин или экворин (зеленый флуоресцентный белок), содержащие гетерологичные и гомологичные лидерные последовательности, гибридные белки, содержащие или не содержащие N-концевые остатки метионина, пэгилированные белки и содержащие иммунные метки или his-меченные белки. Такие гибридные белки также включают гибриды с эпитопами. К таким гибридным белкам также относятся мультимеры пептидов данного изобретения, например, гомодимеры или гомомультимеры, а также гетеродимеры и гетеромультимеры. Термин также включает комплексы пептидов с аптамерами.
Термин "специфически гибридизуется" в контексте полинуклеотида относится к гибридизации в жестких условиях. Условия, которые повышают жесткость реакций гибридизации ДНК/ДНК и ДНК/РНК, широко известны и описаны в данной области. Примеры гибридизации в жестких условиях включают гибридизацию в 4× хлорид натрия/цитрат натрия (SSC), приблизительно при 65-70°C, или гибридизацию в 4× SSC плюс 50% формамид, приблизительно при 42-50°C, с последующим одним или несколькими промываниями в 1× SSC, приблизительно при 65-70°C.
Термин "лиганд" относится к молекуле, которая связывается с другой молекулой, такой как рецептор.
"Клетка-хозяин" представляет собой отдельную клетку или клеточную культуру, которая может быть или является реципиентом какого-либо рекомбинантного вектора (векторов) или полинуклеотида. Клетки-хозяева включают потомство одной клетки-хозяина, причем потомство не обязательно является полностью идентичным (по морфологии или полному комплекту ДНК) исходной родительской клетке вследствие природных, случайных или намеренных мутаций и/или изменений. Клетка-хозяин включает клетки, трансфицированные или инфицированные in vivo или in vitro рекомбинантным вектором или полинуклеотидом по изобретению. Клетку-хозяина, содержащую рекомбинантный вектор данного изобретения, можно называть "рекомбинантная клетка-хозяин".
Термин "лечение" охватывает любое введение или нанесение лекарственного средства против заболевания млекопитающего, в том числе человека, и включает подавление заболевания, прекращение его развития или облегчение заболевания, например, путем индуцирования регрессии, или возобновления или восстановления утраты, потери или дефекта функции; или путем стимуляции неэффективного процесса. Термин включает получение желательного фармакологического и/или физиологического эффекта и охватывает любое лечение патологического состояния или нарушения у млекопитающего, в том числе человека. Эффект может быть профилактическим, заключающимся в полном или частичном предотвращении нарушения или его симптома, и/или терапевтическим, выражающимся в частичном или полном излечении нарушения и/или неблагоприятной реакции, свойственной данному нарушению. Таким образом, настоящее изобретение предлагает способ как лечения, так и профилактики. Он включает (1) предотвращение появления или возобновления нарушения у субъекта, который может быть предрасположен к нарушению, но еще не имеет его симптомов, (2) подавление нарушения, например, прекращение его развития, (3) остановку или терминацию нарушения, или, по меньшей мере, связанных с ним симптомов, чтобы хозяин больше не страдал от нарушения или его симптомов, например, путем индукции регрессии нарушения или его симптомов, или путем возобновления или восстановления утраты, потери или дефекта функции; или путем стимуляции неэффективного процесса, или (4) облегчение, ослабление или улучшение нарушения или связанных с ним симптомов, где термин улучшение используется в широком смысле для обозначения, по меньшей мере, уменьшения значения параметра, такого как воспаление, боль и/или размер опухоли.
Термин "фармацевтически приемлемый носитель" относится к нетоксичным твердым, полутвердым или жидким наполнителям, разбавителям, капсулирующим веществам, вспомогательным средствам для композиции или средам для лекарства любых стандартных типов. Фармацевтически приемлемый носитель является нетоксичным для реципиентов в используемых дозах и концентрациях и совместимым с другими ингредиентами композиции.
Термин "композиция" относится к смеси, которая обычно содержит носитель, такой как фармацевтически приемлемый носитель, или наполнитель, традиционно используемый в данной области, который подходит для введения пациенту в терапевтических, диагностических или профилактических целях. Композиция может содержать клеточную культуру, в клетках или культуральной среде которой содержится полипептид или полинуклеотид. Например, композиции для перорального введения могут находиться в виде растворов, суспензий, таблеток, пилюль, капсул, композиций с замедленным высвобождением, полосканий для рта или порошков.
Термин "заболевание" относится к любым состояниям, инфекциям, нарушениям или синдромам, которые требуют медицинского вмешательства или при которых медицинское вмешательство желательно. Такое медицинское вмешательство может включать лечение, диагностику и/или профилактику.
Пептиды
Пептиды по изобретению можно экспрессировать с помощью известных в данной области способов. Для получения пептидов по изобретению можно использовать способы, в которых применяются клетки, или бесклеточные способы. Способы, проводимые с применением клеток, обычно включают введение конструкции нуклеиновой кислоты в клетку-хозяина in vitro и культивирование клетки-хозяина в условиях, обеспечивающих экспрессию, с последующим сбором пептида, либо из культуральной среды, либо из клетки-хозяина (например, после разрушения клетки-хозяина), либо и из того, и из другого. Настоящее изобретение также предлагает хорошо известные в данной области бесклеточные способы получения пептида, в которых транскрипцию/трансляцию проводят in vitro.
К подходящим клеткам-хозяевам относятся прокариотические или эукариотические клетки, включающие, например, бактериальные клетки, дрожжевые клетки, грибковые клетки, растительные клетки, клетки насекомых и клетки млекопитающих.
Как правило, гетерологичный пептид, как модифицированный, так и немодифицированный, можно экспрессировать сам по себе, как описано выше, или в виде гибридного белка, такой пептид может содержать не только сигналы секреции, но и секреторную лидерную последовательность. Секреторная лидерная последовательность по изобретению может направлять некоторые белки к эндоплазматическому ретикулуму (ER). ER разделяет мембрано-связанные белки от других белков. После локализации в ER белки могут далее направляться в аппарат Гольджи для распределения в везикулы, в том числе секреторные везикулы, плазматические мембраны, лизосомы и другие органеллы.
Пептиды могут содержать пептидные фрагменты и/или маркеры очистки. Такие фрагменты можно удалить перед конечной стадией получения пептида. Добавление к полипептидам пептидных фрагментов с целью обеспечения секреции или экскреции, улучшения стабильности, облегчения очистки, или с другой целью, является известной и рутинной в данной области процедурой. Подходящие маркеры очистки включают, например, V5, полигистидины, авидин и биотин. Конъюгирование пептидов с такими соединениями, как биотин, можно проводить с помощью хорошо известных в данной области способов (Hermanson ed. (1996) Bioconjugate Techniques; Academic Press). Пептиды также можно конъюгировать с радиоактивными изотопами, токсинами, ферментами, флуоресцентными метками, коллоидным золотом, нуклеиновыми кислотами, винорелбином и доксорубицином с помощью известных в данной области способов (Hermanson ed. (1996) Bioconjugate Techniques; Academic Press; Stefano et al. (2006)).
Партнеры по гибридизации, подходящие для применения в данном изобретении, включают, например, фетуин, человеческий сывороточный альбумин, Fc и/или один или несколько их фрагментов. Также предоставляются конъюгированные белки, такие как конъюгаты с полиэтиленгликолем.
Пептиды по изобретению также можно синтезировать химически с помощью известных в данной области способов (например, см. Hunkapiller et al., Nature, 310:105 111 (1984); Grant ed. (1992) Synthetic Peptides, A Users Guide, W. H. Freeman and Co.; патент США № 6974884)). Например, полипептид, соответствующий фрагменту полипептида, можно синтезировать с помощью пептидного синтезатора или с помощью известных в данной области способов твердофазного синтеза.
Кроме того, при желании можно вводить неклассические аминокислоты или химические аналоги аминокислот путем замены или добавления к полипептидной последовательности. Неклассические аминокислоты включают, без ограничения, такие соединения, как D-изомеры обычных аминокислот, 2,4-диаминомасляная кислота, a-аминоизомасляная кислота, 4-аминомасляная кислота, Abu, 2-аминомасляная кислота, g-Abu, e-Ahx, 6-аминогексановая кислота, Aib, 2-аминоизомасляная кислота, 3-аминопропионовая кислота, орнитин, норлейцин, норвалин, гидроксипролин, саркозин, цитруллин, гомоцитруллин, цистеиновая кислота, т-бутилглицин, т-бутилаланин, фенилглицин, циклогексилаланин, b-аланин, фтораминокислоты, сконструированные аминокислоты, такие как b-метиламинокислоты, Ca-метиламинокислоты, Na-метиламинокислоты, а также аналоги аминокислот в общем. Аминокислота может иметь D-конфигурацию (правовращающая) или L-конфигурацию (левовращающая).
Полипептиды по изобретению можно выделить из среды, в которой проводят химический синтез, и культур рекомбинантных клеток и очистить с помощью стандартных способов, которые включают, без ограничения, осаждение сульфатом аммония или этанолом, кислую экстракцию, анионо- или катионообменную хроматографию, фосфоцеллюлозную хроматографию, хроматографию, основанную на гидрофобных взаимодействиях, аффинную хроматографию, хроматографию на гидроксилаппатите и хроматографию с использованием лектина. В одном варианте осуществления для очистки используют высокоэффективную жидкостную хроматографию ("ВЭЖХ"). Если полипептид денатурирует в процессе выделения и/или очистки, для восстановления активной конформации можно использовать хорошо известные методы рефолдинга белков.
Чтобы увеличить растворимость и время полужизни в кровотоке, пептид или пептидомиметик по изобретению можно модифицировать или ковалентно присоединить к одному или нескольким гидрофильным полимерам. Небелковые гидрофильные полимеры, подходящие для присоединения к пептиду, включают, без ограничения, простые полиалкилэфиры, такие как полиэтиленгликоль и полипропиленгликоль, полимолочная кислота, полигликолевая кислота, полиоксиалкилены, поливиниловый спирт, поливинилпирролидон, целлюлозу и производные целлюлозы, декстран и производные декстрана. Обычно такие гидрофильные полимеры имеют среднюю молекулярную массу в диапазоне примерно от 500 до 100000 дальтон, примерно от 2000 до 40000 дальтон или примерно от 5000 до 20000 дальтон. Пептид можно дериватизировать такими полимерами, или присоединить к таким полимерам с помощью любого из способов, описанных в Zallipsky, S. (1995) Bioconjugate Chem., 6:150-165; Monfardini, C., et al. (1995) Bioconjugate Chem. 6:62-69; патенты США №№ 4640835, 4496689, 4301144, 4670417, 4791192, 4179337 или WO 95/34326.
В некоторых вариантах осуществления пептид по изобретению входит в состав композиции наряду с фармацевтически приемлемыми носителями, наполнителями и разбавителями, широкий ряд которых известен в данной области. Указанные фармацевтические носители, наполнители и разбавители включают перечисленные в перечне фармацевтических наполнителей Фармакопеи США. Наполнители USP и NF перечислены в Categories, pp.2404-2406, USP 24 NF 19, United States Pharmacopeial Convention Inc., Rockville, Md. (ISBN 1-889788-03-1). Фармацевтически приемлемые наполнители, такие как среды, вспомогательные средства, носители или разбавители, являются широко доступными. Широко доступны также фармацевтически приемлемые вспомогательные вещества, такие как регулирующие pH и забуферивающие средства, средства, регулирующие тоничность, стабилизаторы, увлажняющие средства и т.п.
Подходящие носители включают, без ограничения, воду, декстрозу, глицерин, физиологический раствор, этанол и их сочетания. Носитель может содержать другие вещества, такие как увлажняющие или эмульгирующие средства, pH забуферивающие средства или вспомогательные средства, которые повышают эффективность композиции. Носители, используемые для местного применения, включают жидкую нефть, изопропилпальмитат, полиэтиленгликоль, этанол (95%), раствор полиоксиэтилена монолаурата (5%) в воде или раствор лаурилсульфата натрия (5%) в воде. При необходимости можно добавить другие средства, такие как антиоксиданты, увлажнители, стабилизаторы вязкости и подобные им средства. В состав композиции также можно включить средства, способствующие проникновению через кожу, такие как Azone.
В фармацевтических лекарственных формах композиции по изобретению могут присутствовать в виде фармацевтически приемлемых солей, или их также можно использовать отдельно или в соответствующей ассоциации, а также в сочетании с другими фармацевтически активными соединениями. Указанные композиции получают в соответствии с потенциальным способом введения.
Способы лечения
Интегрин αvβ3-ассоциированное заболевание включает, без ограничения, остеопороз, опухоль или рак кости, а также связанные с ними симптомы, ассоциированные с ангиогенезом рост и метастазирование опухоли, опухолевый метастаз в кости, индуцированную злокачественным заболеванием гиперкальциемию, ассоциированные с ангиогенезом болезни глаз, болезнь Педжета, ревматоидный артрит и остеоартрит.
Пептиды по изобретению можно вводить субъекту, нуждающемуся в лечении, путем системной инъекции, такой как внутривенная инъекция; или путем введения в соответствующий участок, или нанесения на такой участок, например, путем прямой инъекции, или прямого нанесения на участок, если участок подвергается хирургической операции; или путем местного нанесения, например, если нарушение присутствует на коже.
Пептиды по изобретению можно использовать в качестве монотерапии. Альтернативно пептиды по изобретению можно использовать в сочетании со стандартными способами лечения интегрин αvβ3-ассоциированных заболеваний.
Введение средств можно осуществлять разными способами, включающими пероральное, трансбуккальное, назальное, ректальное, парентеральное, внутрибрюшинное, внутрикожное, чрескожное, подкожное, внутривенное, внутриартериальное, внутрисердечное, внутрижелудочковое, внутричерепное, внутритрахеальное, внутриоболочечное введение и др., или путем имплантации или ингаляции. Таким образом, на основе указанных композиций можно получать препараты в твердой, полутвердой, жидкой или газообразной форме, такие как таблетки, капсулы, порошки, гранулы, мази, растворы, свечи, лекарственные формы для инъекций, лекарственные формы для ингаляций и аэрозоли. Описанные ниже способы и наполнители являются только иллюстративными и ни в коей мере не ограничивающими.
Подходящими средами для лекарств являются, например, вода, физиологический раствор, декстроза, глицерин, этанол и т.п., а также их сочетания. Кроме того, при необходимости среда может содержать минорные количества вспомогательных веществ, таких как увлажняющие или эмульгирующие средства, или средства, регулирующие рН. Фактические способы получения таких лекарственных форм известны или могут стать очевидными для специалистов в данной области. Вводимые композиция или состав в любом случае содержат количество средства, необходимое для достижения желательного состояния у субъекта, подлежащего лечению.
Пептиды по изобретению можно ввести в состав препаратов для инъекций путем растворения, суспендирования или эмульгирования в водном или неводном растворителе, таком как растительные или другие подобные масла, синтетические глицериды алифатических кислот, сложные эфиры высших алифатических кислот или пропиленгликоля; при необходимости, в присутствии традиционных добавок, таких как солюбилизаторы, изотонические средства, суспендирующие средства, эмульгирующие средства, стабилизаторы и консерванты. Можно использовать и другие композиции для пероральной или парентеральной доставки, традиционно применяющиеся в данной области.
Термин "дезинтегрины" относится к семейству полипептидов, которые можно выделить из змеиного яда и которые содержат последовательность аргинин-глицин-аспарагиновая кислота (RGD). Без связи с какими-либо теориями или механизмами, полагают, что трипептид RGD связывается с высоким сродством с интегринами и блокирует взаимодействие интегринов с RGD-содержащими белками. Таким образом, дезинтегрины блокируют адгезивные свойства и действуют как ингибиторы агрегации тромбоцитов.
Аббревиатура "Rho" обозначает "родостомин", который представляет собой дезинтегрин, полученный из яда Colloselasma rhodostoma. Родостомин неспецифически связывается с интегринами αIIbβ3, α5β1 и αvβ3 и увеличивает время свертывания крови, ингибируя агрегацию тромбоцитов путем блокады тромбоцитарного гликопротеина αIIbβ3.
Термин "вариант дезинтегрина" или "вариант родостомина" относится к функционально активному белку или полипептиду, или любому его производному, который содержит аминокислотную последовательность, полученную, например, в результате модификации или мутации из дезинтегрина дикого типа, такого как родостомин. Функционально активный вариант дезинтегрина/родостомина может специфически связываться с интегрином αvβ3 и ингибировать его активность. Вариант дезинтегрина или родостомина по настоящему изобретению можно сконструировать с помощью любого способа, подходящего для целей настоящего изобретения, в одном варианте осуществления с помощью такого способа, как направленный мутагенез, в другом варианте осуществления с помощью такого способа, как полимеразная цепная реакция. Варианты могут содержать вставки, добавления, делеции или замены по сравнению с рассматриваемыми пептидами. Варианты полипептидных последовательностей включают биологически активные полиморфные варианты.
Пептиды по изобретению могут содержать природные и неприродные аминокислоты. Пептиды могут содержать D-аминокислоты, сочетание D- и L-аминокислот, а также разные "сконструированные" или "синтетические" аминокислоты (например, β-метиламинокислоты, Cα-метиламинокислоты, Nα-метиламинокислоты и др.), придающие особые свойства. Кроме того, пептиды могут быть циклическими. Пептиды могут содержать неклассические аминокислоты, позволяющие вводить конкретные конформационные мотивы. Можно использовать любые известные неклассические аминокислоты. В пептид можно вводить аналоги аминокислот и пептидомиметиков, обеспечивающие или поддерживающие специфические вторичные структуры, которые включают, без ограничения, LL-Acp (LL-3-амино-2-пропендион-6-карбоновая кислота), аналог дипептида, индуцирующий образование β-поворота; аналоги, индуцирующие образование β-складчатой структуры; аналоги, индуцирующие образование β-поворота; аналоги, идуцирующие образование α-спирали; аналоги, индуцирующие образование γ-поворота; аналоги Gly-Ala-поворота; изостера амидной связи; или тетразол и т.п.
Чтобы уменьшить чувствительность к протеазам или ограничить конформацию, в концевые участки пептида вводят остаток, не содержащий аминогруппы или карбоксильной группы. C-концевые функциональные группы включают производные, содержащие амид, амид-низший алкил, амид-ди(низший алкил), низший алкокси, гидрокси и карбокси, также низшую сложноэфирную группу, и их фармацевтически приемлемые соли.
Термин "IC50" или "половина максимальной ингибирующей концентрации" относится к концентрации Rho или его варианта, необходимой для 50% ингибирования его рецептора. IC50 является мерой количества в Rho или его варианта, необходимого для ингибирования биологического процесса на 50%, такого как аффинное взаимодействие варианта с его рецептором.
Термин "терапевтически эффективное количество" относится к количеству, которое при введении живому субъекту оказывает желательное воздействие на данного субъекта. Например, эффективное количество варианта дезинтегрина или Rho по изобретению, вводимое живому субъекту, представляет собой количество, позволяющее предотвращать и/или лечить интегрин αvβ3-опосредованное заболевание. Точное количество зависит от цели лечения и устанавливается специалистом в данной области с помощью известных методов. Как известно в данной области, соответствующий специалист с помощью рутинного экспериментирования может осуществлять корректировки в зависимости от системного или локального введения, возраста, массы тела, общего состояния здоровья, пола, диеты, времени введения, взаимодействия лекарственных средств и тяжести состояния.
Термин "антагонист рецептора" относится к связывающему лиганду рецептора, который ингибирует функционирование рецептора путем блокирования связывания агониста с рецептором, или который позволяет агонисту связываться с рецептором, но ингибирует способность агониста активировать рецептор.
Термин "значительно пониженная способность блокировать рецептор интегрина αIIbβ3 и/или α5β1" относится к, по меньшей мере, пятикратно уменьшенной способности блокировать рецептор интегрина αIIbβ3 и/или α5β1 по сравнению с родостомином дикого типа или другими дезинтегринами. Например, чтобы рассчитать уменьшение способности блокировать рецептор αIIbβ3 и/или α5β1, IC50 варианта родостомина, измеренный для ингибирования связывания интегрина αIIbβ3 и/или α5β1 с белком матрикса, таким как фибриноген, сравнивают с IC50, полученным для Rho.
Термин "вариант мотива RGD" относится к пептиду, содержащему модификацию аминокислотной последовательности, которая включает в себя последовательность RGD соответствующей последовательности дикого типа, такой как последовательность родостомина, содержащая RGD. Примеры "вариантов мотива RGD" включают 48ARGDDP53, 48PRLDMP53, 48PRIDMP53 и 48ARLDDL53.
Термин "RD" относится к варианту родостомина, содержащему вариант мотива RGD 48PRLDMP53.
Термин "PGP" относится к варианту родостомина, содержащему вариант мотива RGD 48PRGDGP53.
Термин ARLDDL относится к варианту родостомина, содержащему вариант мотива RGD 48ARLDDL53.
Термин "селективность ингибирования рецептора интегрина αvβ3 по сравнению с рецепторами αIIbβ3 и/или α5β1" относится к избирательности связывания варианта с рецептором интегрина αvβ3 по сравнению с рецепторами αIIbβ3 и/или α5β1, которую выражают как отношение IC50 для ингибирования рецепторов αIIbβ3 и/или α5β1 к IC50 для ингибирования рецептора αvβ3 под действием варианта.
Термин "существенно сниженная активность в продлении времени кровотечения" относится к статистически значимому уменьшению способности ингибировать свертывание крови, определенному в эксперименте по измерению времени кровотечения, описанному в данном документе.
Термин "пэгилированный RD" относится к пэгилированному продукту белка RD.
Термин "альбумин-RD" или "HSA-RD" относится к конъюгату человеческого альбумина с белком RD.
Общее представление об изобретении
Настоящее изобретение относится к вариантам дезинтегрина, которые являются селективными антагонистами интегрина αvβ3. Варианты дезинтегрина, такие как RD-родственные соединения, способны ингибировать дифференциацию остеокластов in vitro. В исследованиях на животных показано, что они также ингибируют резорбционную активность остеокластов и индуцированное овариэктомией увеличение образования остеокластов. Кроме того, RD ингибирует опухолевый рост клеток рака предстательной железы и молочной железы человека в кости. Индуцированная злокачественным заболеванием гиперкальциемия также эффективно блокируется RD-родственными белками. Болезнь Педжета (также известная как деформирующий остит) представляет собой хроническое заболевание костей, которое обычно приводит к увеличению и деформации костей вследствие нарушения регуляции разрушения и формирования костных тканей. Бифосфонаты утверждены для лечения болезни Педжета. Остеоартрит также связан с увеличением активности остеокластов. Поскольку производные RD обладают подобным механизмом действия, они также могут являться эффективными средствами для лечения указанных костных нарушений. Внутривенное введение RD или PGP в очень большой дозе, 30 мг/кг, не влияет на выживание мышей (n=3). Кроме того, длительное введение PGP (в.в., 0,5 мг/кг/день) в течение 6 недель не оказывает влияния на уровни креатинина, GOT и GPT в сыворотке, что позволяет предположить отсутствие побочных эффектов в почках и печени. Следовательно, RD и его производные являются потенциальными средствами-кандидатами для лечения таких заболеваний, как остеопороз, опухоль кости, индуцированная злокачественным заболеванием гиперкальциемия, болезнь Педжета, ревматоидный артрит, остеоартрит и ассоциированные с ангиогенезом заболевания глаз.
Многие виды змеиного яда содержат белки, в состав которых входит домен RGD. Такие домен RGD-содержащие белки называют дезинтегринами. Модификация последовательности, затрагивающая домен RGD, приводит к получению уникального варианта полипептида, обладающего пониженным сродством связывания по отношению к другим видам интегринов, но повышенной селективностью по отношению к интегрину αvβ3. Доказано, что варианты дезинтегрина, включающие варианты родостомина, являются потенциальными терапевтическими средствами-кандидатами для лечения, в числе прочих, таких заболеваний, как остеопороз, опухолевый рост в кости и ассоциированные с ангиогенезом заболевания глаз. Более того, варианты дезинтегрина, включающие варианты родостомина, содержащие участок мотива RGD, по меньшей мере, с одной аминокислотной заменой, могут быть полезными средствами для разработки селективных антагонистов интегрина αvβ3.
Один аспект настоящего изобретения относится к полипептиду, который обладает антагонистической активностью по отношению к рецептору интегрина αvβ3 и более низкой блокирующей активностью по отношению к рецептору интегрина αIIbβ3 и/или α5β1, чем дезинтегрин дикого типа. Полипептид кодируется модифицированной нуклеотидной последовательностью дезинтегрина, которая кодирует модифицированную аминокислотную последовательность полипептида, характеризующуюся значительно сниженной способностью блокировать рецептор интегрина αIIbβ3 и/или α5β1. Полипептид может быть пэгилированным или конъюгированным с альбумином.
Нуклеотидную последовательность дезинтегрина можно получить из змеиного яда. В соответствии с настоящим изобретением дезинтегрины включают, без ограничения, альболабрин (Cryptelytrops albolabris), апплагин (Agkistrodon piscivorus piscivorus), басилицин (Crotalus basiliscus), батроксостатин (Bothrops atrox), битистатин (Bitis arietans), цереберин (Crotalus oreganus cerberus), церастин (Crotalus cerastes cerastes), кротатроксин (Crotalus atrox), дуриссин (Crotalus durissus durissus), элегантин (Protobothrops elegans), флаворидин (Trimeresurus flavoviridis), флавостатин (Trimeresurus flavoviridis), халисин (Gloydius blomhoffi), халистатин (Gloydius halys), ярарацин (Bothrops jararaca), ярастатин (Bothrops jararaca), кистрин (Calloselasma rhodostoma), лачесин (Lachesis muta muta), лутосин (Crotalus oreganus lutosus), молоссин (Crotalus molossus molossus), салмосин (Gloydius blomhoffi brevicaudus), саксатилин (Gloydius halys), тергеминин (Sistrurus catenatus tergeminus), триместатин (Trimeresurus flavoviridis), тримукрин (Protobothrops mucrosquamatus), тримутас (Protobothrops mucrosquamatus), уссуристатин (Gloydius ussuriensis), виридин (Crotalus viridis).
Другой аспект настоящего изобретения относится к выделенному полипептиду, который представляет собой вариант родостомина, где родостомин содержит аминокислотную последовательность, описанную в SEQ ID NO:1, а вариант содержит вариант мотива RGD.
В одном варианте осуществления настоящего изобретения вариант мотива RGD может содержать аминокислотную последовательность, выбранную из SEQ ID NO:30-42.
Другой аспект настоящего изобретения относится к полипептиду, содержащему аминокислотную последовательность SEQ ID NO:29, которая дополнительно содержит одну, две, три или четыре аминокислотные замены в положениях, соответствующих аминокислотам 48, 50, 52 или 53 SEQ ID NO:1.
Другой аспект настоящего изобретения относится к полипептиду, содержащему аминокислотные замены, выбранные из Ala в положении 48, Leu, Ile и His в положении 50, Asp, Met и Asn в положении 52, и Val, Leu и Met в положении 53 SEQ ID NO:1.
Другой аспект настоящего изобретения относится к полипептиду, который кодирует нуклеотидная последовательность, выбранная из SEQ ID NO:43-56.
В качестве характерного примера, в другом варианте осуществления настоящего изобретения вариант мотива RGD может содержать, по меньшей мере, одну аминокислотную замену по остатку, соответствующему Gly50 или Met52 мотива RGD дикого типа, описанного в SEQ ID NO:29. По меньшей мере одна аминокислотная замена присутствует в остатке, соответствующем Leu50 SEQ ID NO:36-37, Ile50 SEQ ID NO:39, His50 SEQ ID NO:40, Asn52 SEQ ID NO:41 или GIy52 SEQ ID NO:42.
В другом варианте осуществления настоящего изобретения вариант мотива RGD может содержать, по меньшей мере, две аминокислотные замены по остаткам, соответствующим Pro48 и Met52, или Met52 и Pro53 мотива RGD дикого типа, описанного в SEQ ID NO:29. По меньшей мере две аминокислотные замены могут присутствовать в остатках, соответствующих Ala48 и Asp52 SEQ ID NO:30 или Asp52 и Met53 SEQ ID NO:35.
В следующем варианте осуществления настоящего изобретения вариант мотива RGD может содержать, по меньшей мере, три аминокислотные замены по остаткам, соответствующим Pro48, Met52 и Pro53 или Gly50, Met52 и Pro53 мотива RGD дикого типа, описанного в SEQ ID NO:29. По меньшей мере три аминокислотные замены могут присутствовать в остатках, соответствующих Ala48, Asp52 и Val53 SEQ ID NO:31, Ala48, Asp52 и Leu53 SEQ ID NO:32, Ala48, Asp52 и Met53 SEQ ID NO:34, Leu50, Asp52 и Leu53 SEQ ID NO:37.
В следующем варианте осуществления настоящего изобретения вариант мотива RGD может содержать, по меньшей мере, четыре аминокислотные замены по остаткам, соответствующим Pro48, Gly50, Met52 и Pro53 мотива RGD дикого типа, описанного в SEQ ID NO:29. По меньшей мере четыре аминокислотные замены могут присутствовать в остатках, соответствующих Ala48, Leu50, Asp52 и Leu53 SEQ ID NO:38.
Другой аспект настоящего изобретения относится к выделенному полипептиду, который кодируется ДНК, имеющей модифицированную нуклеотидную последовательность родостомина, выбранную из SEQ ID NO:44-56. Полипептид проявляет сродство к αIIbβ3 и/или α5β1, по меньшей мере, примерно в 5, 50 или 100 раз меньше по сравнению с родостомином. В одном варианте осуществления настоящего изобретения полипептид проявляет сродство к интегрину αIIbβ3 и/или α5β1, по меньшей мере, примерно в 200 раз меньше по сравнению с родостомином. В другом варианте осуществления настоящего изобретения полипептид проявляет сродство к интегрину αIIbβ3 и/или α5β1, по меньшей мере, примерно в 1000 или 2000 раз меньше по сравнению с родостомином. В другом варианте осуществления настоящего изобретения полипептид проявляет сродство к тромбоцитам, по меньшей мере, примерно в 5, 50, 100, 1000 или 2000 раз меньше по сравнению с родостомином. В следующем варианте осуществления настоящего изобретения полипептид проявляет существенно сниженную активность в продлении времени свертывания крови по сравнению с родостомином или дезинтегрином дикого типа.
Следующий аспект настоящего изобретения относится к физиологически приемлемой композиции, содержащей полипептид по изобретению и фармацевтически приемлемый носитель.
Следующий аспект настоящего изобретения относится к способу применения варианта дезинтегрина для лечения и/или профилактики интегрин αvβ3-ассоциированного заболевания у млекопитающего, в том числе, у человека. Способ включает стадию введения млекопитающему, нуждающемуся в этом, терапевтически эффективного количества выделенного полипептида или его фармацевтически приемлемой соли. Такой полипептид обладает антагонистической активностью по отношению к рецептору интегрина αvβ3 и значительно более низкой способностью блокировать рецептор интегрина αIIbβ3 и/или интегрина α5β1, чем дезинтегрин дикого типа, и, следовательно, может использоваться для лечения и/или профилактики интегрин αvβ3-ассоциированного заболевания у млекопитающего. Полипептид, кодируемый модифицированной нуклеотидной последовательностью дезинтегрина, имеет модифицированную аминокислотную последовательность дезинтегрина, которая обуславливает значительно пониженную способность полипептида блокировать рецептор интегрина αIIbβ3 и/или интегрина α5β1. Используемый в данном способе полипептид может быть пэгилированным или конъюгированным с альбумином.
Как описано выше, нуклеотидная последовательность дезинтегрина может быть получена из змеиного яда, а дезинтегрин может быть выбран из таких соединений, как родостомин, альболабрин, апплагин, басилицин, батроксостатин, битистатин, цереберин, церастин, кротатроксин, дуриссин, элегантин, флаворидин, флавостатин, халисин, халистатин, ярарацин, ярастатин, кистрин, лачесин, лутосин, молоссин, салмосин, саксатилин, тергеминин, триместатин, тримукрин, тримутас, уссуристатин и виридин.
В одном варианте осуществления настоящего изобретения способ включает стадию введения млекопитающему, нуждающемуся в этом, терапевтически эффективного количества выделенного полипептида или его фармацевтически приемлемой соли, где полипептид содержит аминокислотную последовательность SEQ ID NO:1, а вариант содержит вариант мотива RGD.
В другом варианте осуществления настоящего изобретения способ включает стадию введения млекопитающему, нуждающемуся в этом, терапевтически эффективного количества выделенного полипептида или его фармацевтически приемлемой соли, где полипептид представляет собой вариант родостомина, содержащий аминокислотную последовательность, описанную в SEQ ID NO:1, а вариант содержит вариант мотива RGD, имеющий аминокислотную последовательность, выбранную из SEQ ID NO:30-42.
В следующем варианте осуществления настоящего изобретения способ включает стадию введения млекопитающему, нуждающемуся в этом, терапевтически эффективного количества выделенного полипептида или его фармацевтически приемлемой соли, где полипептид содержит аминокислотную последовательность, выбранную из SEQ ID NO:57-69.
В одном варианте осуществления полипептид по изобретению используют для лечения и/или профилактики интегрин αvβ3-ассоциированного заболевания, которое включает, без ограничения, остеопороз, опухоль кости или опухолевый рост, а также связанные с ними симптомы, ассоциированные с ангиогенезом рост и метастазирование опухоли, опухолевый метастаз в кости, индуцированную злокачественным заболеванием гиперкальциемию, ассоциированные с ангиогенезом заболевания глаз, болезнь Педжета, ревматоидный артрит и остеоартрит.
В другом варианте осуществления полипептид по изобретению используют для лечения и/или профилактики ассоциированного с ангиогенезом заболевания глаз, которое включает без ограничения возрастную дегенерацию желтого пятна, диабетическую ретинопатию, заболевания, связанные с реваскуляризацией роговицы, индуцированную ишемией реваскуляризационную ретинопатию, сильную близорукость и ретинопатию недоношенных.
В следующем варианте осуществления полипептид по изобретению используют для лечения и/или профилактики остеопороза. Остеопороз может быть связан с патологическим состоянием, выбранным из постклимактерической недостаточности эстрогенов, вторичного остеопороза, ревматоидного артрита, овариэктомии, болезни Педжета, рака кости, опухоли кости, остеоартрита, повышенного образования остеокластов и повышенной активности остеокластов. Кроме того, остеопороз включает без ограничения индуцированный овариэктомией остеопороз, или разрежение кости, и постклимактерический остеопороз, или разрежение кости.
Следующий аспект данного изобретения относится к способу применения варианта дезинтегрина для лечения и/или профилактики физиологических изменений у млекопитающего, в том числе человека, индуцированных овариэктомией или постклимактерическим остеопорозом. Способ включает введение млекопитающему, нуждающемуся в этом, терапевтически эффективного количества выделенного полипептида, или его фармацевтически приемлемой соли, который обладает антагонистической активностью по отношению к рецептору интегрина αvβ3 и значительно более низкой способностью блокировать активность рецептора интегрина αIIbβ3 и/или интегрина α5β1, чем дезинтегрин дикого типа, и, следовательно, может использоваться для лечения и/или профилактики индуцированного овариэктомией физиологического изменения у млекопитающего. Полипептид, кодируемый модифицированной нуклеотидной последовательностью дезинтегрина, имеет модифицированную аминокислотную последовательность, которая обуславливает значительно пониженную способность полипептида блокировать активность рецептора интегрина αIIbβ3 и/или α5β1. Нуклеотидная последовательность дезинтегрина может быть получена из змеиного яда, и дезинтегрин может быть выбран из таких соединений, как родостомин, альболабрин, апплагин, басилицин, батроксостатин, битистатин, цереберин, церастин, кротатроксин, дуриссин, элегантин, флаворидин, флавостатин, халисин, халистатин, ярарацин, ярастатин, кистрин, лачесин, лутосин, молоссин, салмосин, саксатилин, тергеминин, триместатин, тримукрин, тримутас, уссуристатин и виридин.
Вариант полипептида, используемый для лечения и/или профилактики индуцированного овариэктомией или постклимактерического физиологического изменения у млекопитающего, может содержать вариант мотива RGD, который содержит аминокислотную последовательность, выбранную из SEQ ID NO:30-42.
В одном варианте осуществления настоящего изобретения способ включает введение млекопитающему, нуждающемуся в этом, терапевтически эффективного количества выделенного полипептида, или его фармацевтически приемлемой соли, где вариант полипептида содержит аминокислотную последовательность, выбранную из SEQ ID NO:57-69. В другом варианте осуществления вариант полипептида является пэгилированным или конъюгированным с альбумином.
Следующий аспект данного изобретения относится к способу применения варианта дезинтегрина для ингибирования и/или предотвращения роста опухолевых клеток в кости, а также связанных с ним симптомов у млекопитающего, в том числе человека. Способ включает введение млекопитающему, нуждающемуся в этом, терапевтически эффективного количества выделенного полипептида или его фармацевтически приемлемой соли, где полипептид обладает антагонистической активностью по отношению к рецептору интегрина αvβ3 и значительно более низкой способностью блокировать активность рецептора интегрина αIIbβ3 и/или интегрина α5β1, чем дезинтегрин дикого типа, и, следовательно, может использоваться для ингибирования и/или предотвращения роста опухолевых клеток в кости, а также связанных с ним симптомов у млекопитающего. Полипептид, кодируемый модифицированной нуклеотидной последовательностью дезинтегрина, имеет модифицированную аминокислотную последовательность, которая обуславливает значительно пониженную способность полипептида блокировать рецептор интегрина αIIbβ3 и/или α5β1.
Нуклеотидная последовательность дезинтегрина может быть получена из змеиного яда, и дезинтегрин может быть выбран из таких соединений, как родостомин, альболабрин, апплагин, басилицин, батроксостатин, битистатин, цереберин, церастин, кротатроксин, дуриссин, элегантин, флаворидин, флавостатин, халисин, халистатин, ярарацин, ярастатин, кистрин, лачесин, лутосин, молоссин, салмосин, саксатилин, тергеминин, триместатин, тримукрин, тримутас, уссуристатин и виридин.
Патологические симптомы, связанные с ростом опухолевых клеток в кости, включают повышенную активность остеокластов, повышенную резорбцию кости, повреждение кости, гиперкальциемию, потерю массы тела, а также любые их сочетания. Опухолевые клетки в кости включают клетки рака кости и раковые клетки, являющиеся метастазами рака предстательной железы, рака молочной железы, рака легкого, рака почки, рака яичников, рака поджелудочной железы или миеломы.
В одном варианте осуществления настоящего изобретения способ включает введение млекопитающему, нуждающемуся в этом, терапевтически эффективного количества выделенного полипептида или его фармацевтически приемлемой соли, где полипептид представляет собой вариант родостомина, родостомин содержит аминокислотную последовательность, описанную в SEQ ID NO:1, а его вариант содержит вариант мотива RGD. Вариант мотива RGD может содержать аминокислотную последовательность, выбранную из SEQ ID NO:30-42.
В другом варианте осуществления настоящего изобретения способ включает стадию введения млекопитающему, нуждающемуся в этом, терапевтически эффективного количества выделенного полипептида или его фармацевтически приемлемой соли, где полипептид содержит аминокислотную последовательность, выбранную из SEQ ID NO:57-69. Вариант полипептида может быть пэгилированным или конъюгированным с альбумином.
Следующий аспект настоящего изобретения относится к способу получения полипептида данного изобретения, который включает следующие стадии: (a) трансформация клетки-хозяина полинуклеотидом, кодирующим указанный полипептид, с получением одного или нескольких трансформантов; (b) отбор трансформанта, содержащего одну или несколько копий указанной конструкции ДНК, внедренных в трансформант; (c) выращивание трансформанта в культуральной среде, чтобы увеличить его клеточную популяцию; (d) сбор трансформированных клеток; (e) выращивание собранных трансформированных клеток в культуральной среде, не содержащей аминокислот; и (g) сбор супернатанта и получение указанного полипептида.
Вышеуказанная стадия (e) может дополнительно включать стадию добавления метанола в культуральную среду, чтобы индуцировать экспрессию полипептида в трансформированных клетках. В одном варианте осуществления стадия (g) может дополнительно включать стадию проведения колоночной хроматографии с получением указанного полипептида. В другом варианте осуществления вышеуказанный способ может дополнительно включать стадию проведения ВЭЖХ для получения очищенного, выделенного полипептида.
Вышеуказанные и другие аспекты настоящего изобретения более подробно описаны ниже.
Человеческие рекомбинантные RANKL и M-CSF получают от R&D Systems (Minneapolis, MN). Набор для ELISA C-концевых телопептидов коллагена типа I получают от Cross Laps (Herlev, Denmark). Все другие химические реагенты получают от Sigma.
Пример 1
Конструкции ДНК, кодирующие родостомин и его варианты
Родостомин клонируют и экспрессируют в векторе pGEX-2KS [20] в виде матрицы. ДНК, кодирующая Rho, состоит из кодонов, предпочтительно используемых в Pichia pastoris. ДНК Rho амплифицируют методом полимеразной цепной реакции (ПЦР) с использованием смыслового праймера 5'-GAATTCGAATTCCATCATCATCATCATCATCATGGTAAGGAATGTGACTGTTCTT-3' (Rho-Pic-1; SEQ ID NO:3), который содержит участок распознавания EcoR1 и шесть остатков гистидина для облегчения очистки. В качестве антисмыслового праймера используют 5'-CCGCGGCCGCGGTCAGTGGTATCTTGGACAGTCAGC-3' (SEQ ID NO:136) или 5'- CCGCGGCCGCGGTTAGTGGTATCTTGGACAGTCAGC-3' (Rho-Pic-2; SEQ ID NO:4), содержащий участок распознавания SacII и стоп-кодон TCA (или TTA). Продукт ПЦР очищают и затем лигируют в участки EcoR1 и SacII дрожжевого рекомбинантного вектора pPICZαA. Рекомбинантную плазмиду используют для трансформации штамма DH5α, колонии подвергают селекции на чашках с агаром, содержащих LB с низким содержанием солей (1% триптон, 0,5% дрожжевой экстракт, 0,5% NaCl, 1,5% агар при pH 7,0) и 25 мкг/мл антибиотика зеоцина.
Варианты родостомина синтезируют и амплифицируют методом полимеразной цепной реакции (ПЦР), используя стратегию перекрывающихся олигонуклеотидов и праймеры, содержащие участки рестрикции EcoR1 и SacII. Нуклеотидные последовательности разных праймеров, используемых для синтеза или подтверждения вариантов, перечислены в таблице 1. Гибридный белок RD-HSA получают с помощью подобных способов. кДНК человеческого сывороточного альбумина получают от Invitrogen, и структурный ген альбумина гибридизуют с N-концом гена Rho, используя линкерную аминокислотную последовательность GSGSGS (SEQ ID NO:137) и шесть остатков гистидина на N-конце.
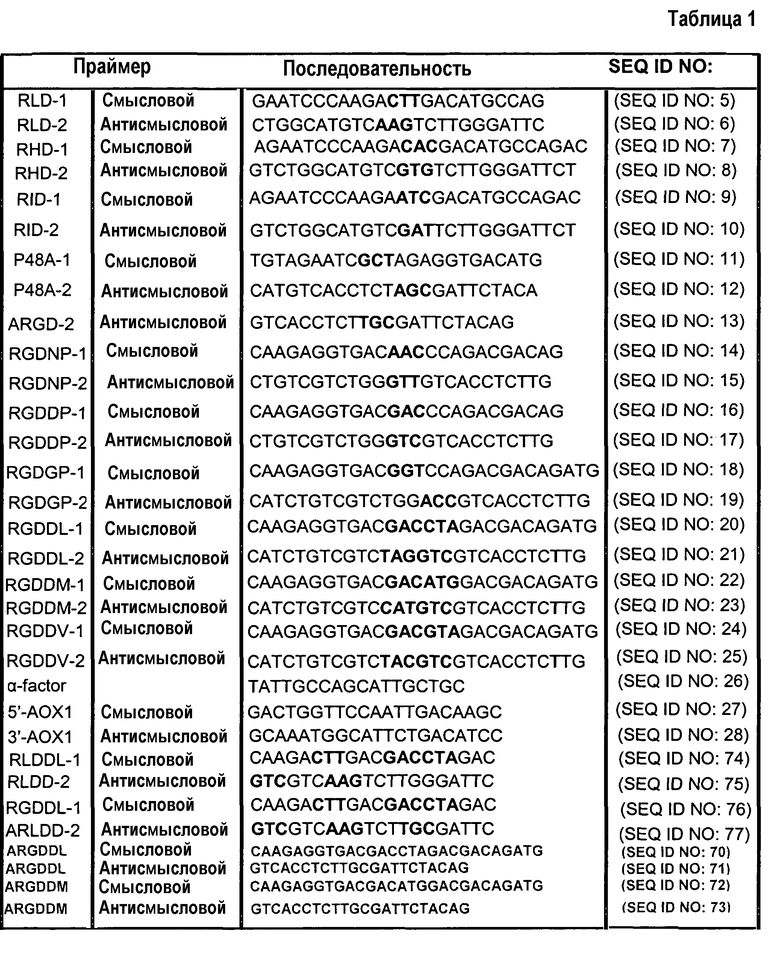
Примечание: Праймер α-фактор используют в качестве праймера для секвенирования; праймеры 5'-AOX1 и 3'-AOX1 используют для проверки присутствия вставленной ДНК.
Полимеразные цепные реакции проводят при 95°C в течение 1 мин, 55°C в течение 1 мин, затем при 72°C в течение 1 мин, и данный цикл повторяют 25 раз. Чтобы получить несколько участков мутаций, используют смесь праймеров. Продукты ПЦР разделяют на 2% агарозных гелях и визуализируют путем окрашивания бромидом этидия. Целевые продукты ПЦР очищают и затем лигируют в участки EcoR1 и SacII дрожжевого вектора переноса pPICZαA. Рекомбинантной плазмидой трансформируют штамм Escherichia coli XL1-blue, после чего проводят отбор колоний на чашках с агаром, содержащих антибиотик зеоцин. Отбирают колонии E. coli XL1-blue, выделяют плазмидную ДНК и подтверждают последовательность путем секвенирования вставки. В таблице 2 приведены ID NO последовательностей праймеров, используемых для синтеза ДНК, кодирующих родостомин и его варианты.
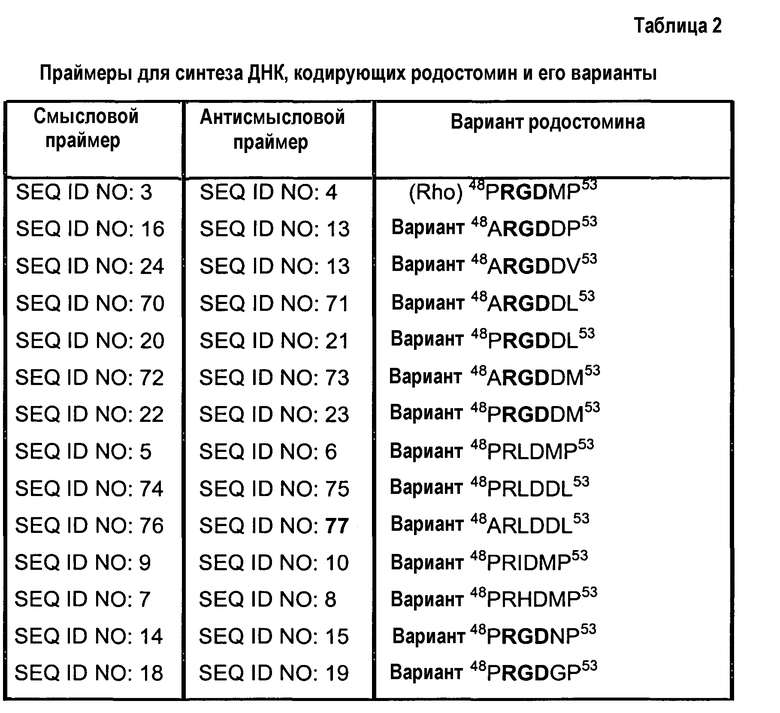
Пример 2
Экспрессия и очистка белка родостомина и его вариантов
Экспрессию белка родостомина и его вариантов в Pichia проводят в соответствии с инструкциями, прилагающимися к набору Pichia EasyCompTM, с небольшими изменениями. Коротко говоря, всего 10 мкг плазмид, содержащих ДНК, кодирующие родостомин или его варианты, очищают и расщепляют SacI, чтобы линеаризовать плазмиды. Штамм Pichia X33 трансформируют линеаризованными конструкциями методом теплового удара с использованием набора Pichia EasyCompTM от Invitrogen®. Трансформант интегрируют в локус 5' AOX1 путем единичного кроссинговера. Чтобы определить, интегрировался ли ген Rho в геном Pichia, проводят анализ интегрированных элементов Pichia методом ПЦР, и клетки лизируют литиказой (Sigma). Колонии подвергают селекции на чашках с агаром, содержащих YPD (1% дрожжевого экстракта, 2% пептона, 2% глюкозы и 2% агара) и 100 мкг/мл зеоцина. Клон с наивысшей экспрессией белка Rho выбирают из ряда клонов с несколькими копиями вставок гена Rho.
Рекомбинантный Rho и его варианты получают следующим способом: выделенные колонии выращивают в среде YPD (1% дрожжевого экстракта, 2% пептона и 2% декстрозы), содержащей 100 мкг/мл зеоцина, при 30°C. Через 48 часов клетки собирают центрифугированием и выращивают в 1 литре минимальной метанольной среды (которая содержит 1,34% дрожжевого азотистого основания, сульфат аммония при отсутствии аминокислот и 4×10-5% биотина). Чтобы индуцировать экспрессию Rho или его варианта, в течение 2 дней один раз каждые 24 часа добавляют метанол в общем количестве 1%. Супернатант собирают центрифугированием и диализируют дважды против 5 литров буфера A (5 мМ EDTA, 8M мочевина и 10 мМ Na-фосфатный буфер, pH 7,7). Конечный раствор загружают на никель-хелатообразующую колонку и элюируют градиентом, содержащим 200 мМ имидазол. Затем рекомбинантный родостомин и его варианты очищают методом ВЭЖХ (ВЭЖХ на обращенной фазе C18). Очищенный рекомбинантный Rho имеет чистоту более 95%, которую определяют с использованием трицин-SDS-PAGE.
Молекулярную массу Rho и его вариантов подтверждают методом масс-спектрометрии с электрораспылением. Аминокислотные последовательности мотивов RGD, содержащихся в Rho и его вариантах, приведены в таблице 3.
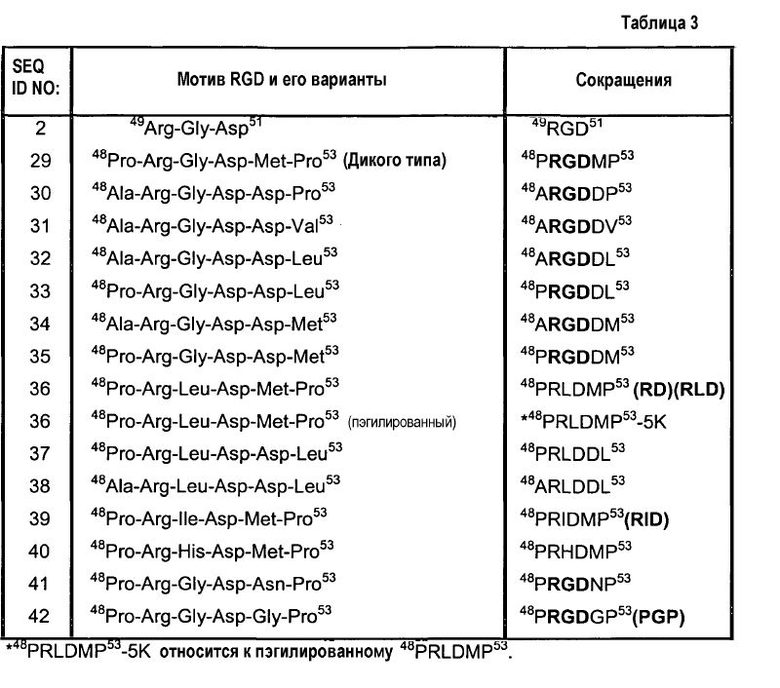
Пример 3
Влияние RD и его производных на время кровотечения
Время кровотечения измеряют следующим образом: мышей анестезируют трихлорацетальдегидом (200 мг/кг), после чего время кровотечения измеряют с помощью описанного ранее способа с небольшими изменениями [21]. Физиологический раствор или белки вводят мышам (ICR, самцы со средней массой тела 23,5±1,8 г) внутривенно через хвостовую вену. Через 5 мин после введения делают отчетливый надрез на расстоянии 0,5 мм от кончика хвоста. Затем хвост сразу погружают в заполненный физиологическим раствором стакан и при 37°C измеряют время кровотечения.
На фиг.1 показано влияние белков RD и ARLDDL на время кровотечения у мышей. Время хвостового кровотечения измеряют через 5 мин после внутривенного введения физиологического раствора, RD, ARLDDL, родостомина (0,6 мг/кг для каждой мыши) или HSA-RD (5 мг/кг). Введенный внутривенно родостомин (0,5 мг/кг) оказывает выраженный эффект, продлевая время кровотечения у мышей. Однако и RD, и ARLDDL (0,5 мг/кг), обладающие селективностью в отношении интегрина αvβ3, оказывают лишь незначительное влияние на время кровотечения у мышей по сравнению с родостомином. Результаты выражают в виде среднего значения ± S.E.M (n=6).
Пример 4
Анализ агрегации тромбоцитов
Образцы венозной крови (9 частей) от здоровых доноров, которые не получали никаких лекарственных средств в течение, по меньшей мере, двух недель, собирают в 3,8% раствор цитрата натрия (1 часть). Образцы крови центрифугируют при 150×g в течение 10 мин с получением обогащенной тромбоцитами плазмы (PRP), которую оставляют стоять в течение 5 мин, после чего собирают PRP. Плазму с низким содержанием тромбоцитов (PPP) получают из оставшейся крови путем центрифугирования при 2000×g в течение 25 мин. Определяют количество тромбоцитов в PPP с помощью гематологического анализатора и затем PPP разбавляют до 250000 тромбоцитов/мкл. Смесь 190 мкл PRP и 10 мкл либо Rho, либо буфера PBS инкубируют в течение 5 мин в агрегометре Hema Tracer 601 при 37°C. Затем добавляют десять микролитров 200 мкМ раствора дифосфата аденозина (ADP) и регистрируют происходящую в ответ на добавление агрегацию тромбоцитов по пропусканию света.
Пример 5
Анализ ингибирования клеточной адгезии
Анализ клеточной адгезии проводят по описанному ранее способу [27]. Коротко говоря, лунки 96-луночных титрационных микропланшетов Immulon-2 (Costar, Corning, USA) покрывают 100 мкл забуференного фосфатом физиологического раствора (PBS: 10 мМ фосфатный буфер, 0,15 M NaCl, pH 7,4), содержащего субстраты в концентрации 50-500 нМ, и инкубируют в течение ночи при 4°C. Используют нижеследующие субстраты в указанных концентрациях: фибриноген (Fg) 200 мкг/мл, витронектин (Vn) 50 мкг/мл и фибронектин (Fn) 25 мкг/мл. Участки неспецифического связывания белков блокируют путем инкубирования каждой лунки с 200 мкл 1% раствора денатурированного нагреванием бычьего сывороточного альбумина (BSA, Calbiochem) при комнатной температуре (25°C) в течение 1,5 ч. Денатурированный нагреванием BSA удаляют и каждую лунку промывают дважды 200 мкл PBS.
Клетки яичника китайского хомячка (CHO), экспрессирующие интегрины αvβ3 (CHO-αvβ3) и αIIbβ3 (CHO-αIIbβ3), держат в 100 мкл модифицированной по Дульбекко среде Игла (DMEM). Клетки яичника китайского хомячка (CHO), экспрессирующие интегрины αvβ3 (CHO-αvβ3) и αIIbβ3 (CHO-αIIbβ3), предоставлены Dr. Y. Takada (Scripps Research Institute). Клетки человеческого эритролейкоза K562, полученные из ATCC, культивируют в среде RPMI-1640, содержащей 5% фетальной телячьей сыворотки. Клетки CHO и K562, растущие в лог-фазе, отщепляют обработкой трипсином и используют для анализа в количестве 3×105 и 2,5×105 клеток/мл, соответственно. К культивируемым клеткам добавляют Rho и его варианты и инкубируют при 37°C и 5% CO2 в течение 15 минут. Rho и его варианты используют в качестве ингибиторов в концентрациях 0,001-500 мкМ. Затем обработанные клетки добавляют в покрытый планшет и подвергают взаимодействию при 37°C, 5% CO2 в течение 1 часа. Затем раствор для инкубации отбрасывают, и не прилипшие клетки удаляют, промывая дважды 200 мкл PBS. Количество связанных клеток определяют путем окрашивания кристаллическим фиолетовым. Коротко говоря, лунку фиксируют 100 мкл 10% формалина в течение 10 минут и сушат. Затем в лунку добавляют пятьдесят микролитров 0,05% раствора кристаллического фиолетового при комнатной температуре и инкубируют 20 минут. Каждую лунку четыре раза промывают 200 мкл дистиллированной воды и сушат. Для проявления окрашивания добавляют 150 мкл проявляющего раствора (50% спирта и 0,1% уксусной кислоты). Измеренное при 600 нм поглощение коррелирует с числом прилипших клеток. Ингибирование выражают в виде % ингибирования = 100-[OD600 (вариант родостомина - обработанный образец)/OD600 (необработанный образец)]×100.
Пример 6
Ингибирующее действие RD и его производных на интегрины αvβ3, αIIbβ3 и α5β1
IC50 RD и его производных для связывания интегрина определяют с помощью анализа клеточной адгезии, описанного выше в примере 5. Коротко говоря, белками матрикса, такими как фибронектин, витронектин или фибриноген, в фиксированной концентрации покрывают титрационные микропланшеты, как описано в примере 5, и, чтобы определить IC50, к клеткам, экспрессирующим интегрин, добавляют Rho и его варианты в разных концентрациях, варьирующих от 0,001 до 500 мкМ. Чем ниже IC50, тем выше специфичность или активность варианта.
Модификация мотива RGD, входящего в состав Rho, оказывает уникальное влияние на биологическую активность Rho: после модификации последовательности активность, с которой данный белок ингибирует связывание интегрина αIIbβ3 или α5β1 с белками матрикса, уменьшается, а селективность по отношению к интегрину αvβ3 увеличивается. В таблице 4 приведены значения IC50 для ингибирования клеточной адгезии под действием Rho и его производных.
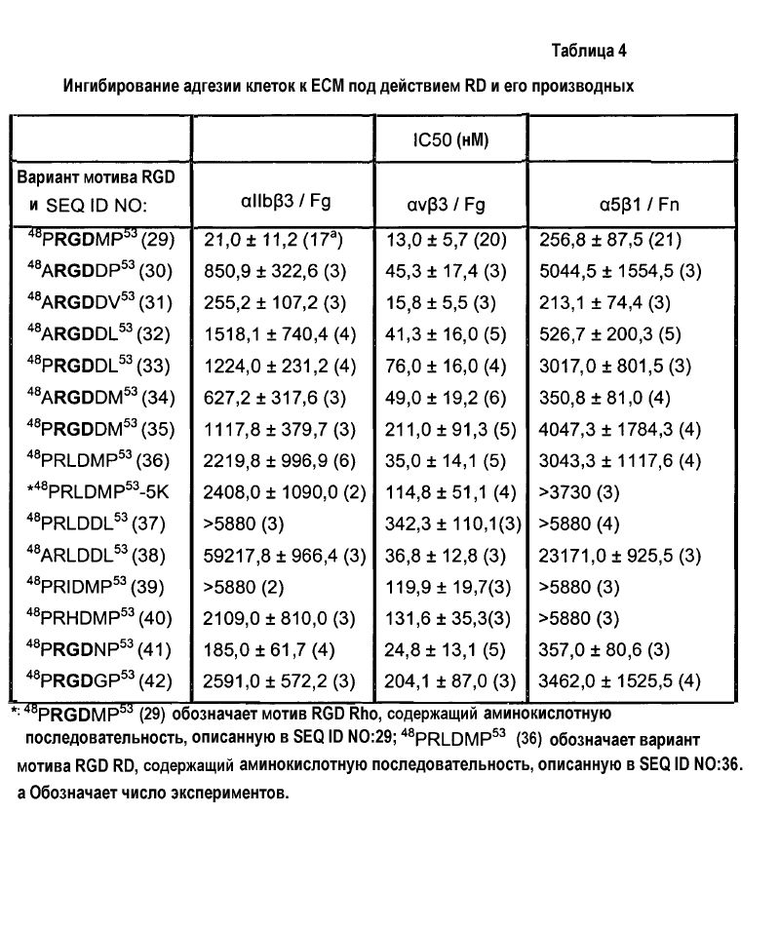
Варианты родостомина имеют гораздо более низкое сродство к αIIbβ3 и/или α5β1, чем Rho (таблица 4). Как показано в таблице 4, например, IC50 RD (т.е. PRLDMP) для ингибирования интегринов αIIbβ3 и α5β1 превышает IC50 Rho более чем в 104 и 10 раз, соответственно. Кроме того, IC50 ARLDDL для ингибирования интегринов αIIbβ3 и α5β1 превышает IC50 Rho более чем в 2000 раз. IC50 пэгилированного RD и RD, конъюгированного с человеческим альбумином, для связывания αIIbβ3 превышает IC50 Rho в 113,7 и 129,9 раз, соответственно (таблица 5). Следовательно, сродство вариантов к тромбоцитам значительно снижено по сравнению со сродством Rho (таблица 5).
Пример 7
Влияние RD и его производных на остеокластогенез
Остеокласты являются специализированными членами семейства моноцитов/макрофагов, которые дифференцируются из гематопоэтических предшественников костного мозга. После инкубации культур остеокластов в присутствии M-CSF (20 нг/мл) и sRANKL (50 нг/мл) в течение 8 дней индуцируется образование больших зрелых остеокластов с несколькими ядрами, которые характеризуются присутствием зрелых фенотипических маркеров, таких как TRAP. Способ остеокластогенеза из культуры гематопоэтических клеток костного мозга и исследование влияния RD и его производных на остеокластогенез описаны ниже.
Клетки костного мозга получают путем удаления бедренных костей из крыс SD возрастом 6~8 недель и промывания костно-мозговой полости a-MEM, содержащей 20 мМ HEPES и 10% инактивированной нагреванием FCS, 2 мМ глутамин, пенициллин (100 ед./мл) и стрептомицин (100 мкг/мл). Через 24 часа неприлипшие клетки (гематопоэтические клетки) собирают и используют в качестве предшественников остеокластов. Клетки высевают в количестве 1×106 клеток/лунку (0,5 мл) в 24-луночные планшеты в присутствии человеческого рекомбинантного растворимого RANKL (50 нг/мл) и мышиного M-CSF (20 нг/мл). Культуральную среду заменяют каждые 3 дня. Образование остеокластов подтверждают с помощью анализа с использованием устойчивой к тартрату кислой фосфатазы (TRAP) на 8 день. Коротко говоря, прилипшие клетки фиксируют 10% раствором формальдегида в забуференном фосфатом физиологическом растворе в течение 3 мин. После обработки смесью этанол/ацетон (50:50 об/об) в течение 1 мин поверхность клеток сушат на воздухе и инкубируют в течение 10 мин при комнатной температуре в ацетатном буфере (0,1 M ацетат натрия, pH 5,0), содержащем 0,01% нафтол AS-MX фосфата (Sigma) и 0,03% соли быстрого красного фиолетового LB (Sigma), в присутствии 50 мМ тартрата натрия. В каждой лунке считают остеокласто-подобные TRAP-положительные клетки путем определения числа TRAP-положительных и многоядерных клеток, содержащих более трех ядер.
Производные RD в значительной степени ингибируют дифференциацию остеокластов, причем данное ингибирование коррелирует с их ингибирующей активностью по отношению к αvβ3 (таблица 5). С другой стороны, AKGDWN (SEQ ID NO:138) и PRGEMP (SEQ ID NO:139) менее эффективно ингибируют интегрин αvβ3 и дифференциацию остеокластов (таблица 5).
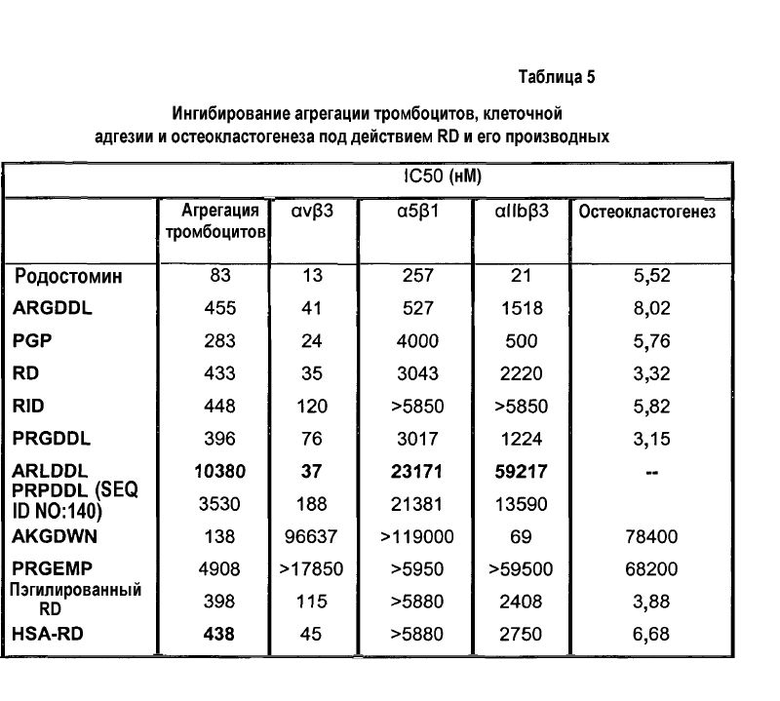
Пример 8
Остеопороз, индуцированный овариэктомией
В данном исследовании используют самок крыс Sprague-Dawley (возраст 3 месяцев, 270~290 г) или мышей ICR (возраст 4 недели, 22~28 г). Крыс или мышей подвергают двусторонней овариэктомии (OVX) под анестезией трихлоруксусным альдегидом, а контрольных мышей для сравнения подвергают ложной операции (Sham). Животных держат в контролируемых условиях при комнатной температуре (22±1°C) и 12-часовом цикле чередования света и темноты. Животные получают диету для грызунов Purina Laboratory (PMI; St. Louis, MO) (0,95% кальция) и воду в свободном доступе. Массу тела крыс регистрируют еженедельно.
Пример 9
Анализ плотности (BMP) и содержания (BMC) минералов в костной ткани
В конце эксперимента крыс или мышей умерщвляют путем декапитации. Большеберцовую кость и бедренную кость удаляют, очищают от мягких тканей и измеряют длину и массу указанных костей точным штангенциркулем (±0,05 мм), как описано Weinreb et al. [26]. BMD и BMC большеберцовой кости определяют с помощью рентгеновского абсорбциометра с двумя уровнями энергии (DEX, XR-26; Norland, Fort Atkinson, WI). Используют режим для измерения маленьких предметов. См. Chih-Hsin et al., "Enhancement of Fibronectin Fibrillogenesis and Bone Formation by Basic Fibroblast Growth Factor via Protein Kinase C-Dependent Pathway in Rat Osteoblasts", Mol. Pharmacol: 66:440-449, (2004). Коэффициент вариации 0,7% рассчитывают на основе ежедневных измерений BMD на люмбальном фантоме в течение более чем 1 года [22, 23]. Целые большеберцовую и бедренную кости сканируют и измеряют BMD и BMC с помощью абсорбциометра.
Пример 10
Гистоморфометрия кости
Большеберцовые кости фиксируют 4% раствором формальдегида, затем декальцифицируют 12% EDTA, дегидратируют возрастающими количествами раствора этанола и ацетона и погружают в парафин. Получают серийные продольные срезы (5 мм), которые окрашивают раствором гематоксилина-эозина Майера. Фотографические изображения пластинки роста и проксимальной большеберцовой кости получают с помощью микроскопа Olympus. Объем кости измеряют с помощью программного обеспечения для анализа изображений (Image-pro plus 3.0) во вторичном губчатом слое, который расположен под первичным губчатым слоем и характеризуется сетью более крупных трабекул. Чтобы определить число остеокластов, срезы окрашивают устойчивой к тартрату кислой фосфатазой (TRAP).
Пример 11
Биомеханический тест на трехточечный изгиб
Механические свойства костных тканей определяют с помощью теста на трехточечный изгиб в системе для тестирования веществ (MTS-858, MTS System Inc., Minneapolis, MN). Расстояние между двумя опорными точками составляет 20 миллиметров, а скорость деформации составляет 1 мм/мин. Кривые нагрузка/деформация вводят в компьютер и анализируют с помощью программного обеспечения Team 490 (версия 4.10, Nicolet Instrument Technologies Inc., Madison, WI). Параметры поперечных срезов, измеренные по фотографиям, используют для расчета поперечного момента инерции. Поперечный момент инерции рассчитывают исходя из допущения, что поперечные срезы имеют эллиптическую форму [24]:
 ,
,
где a обозначает ширину поперечного сечения в медиолатеральном направлении, b обозначает ширину поперечного сечения в переднезаднем направлении, а t обозначает среднее значение кортикальной толщины. Все указанные параметры получают с помощью программного обеспечения для анализа изображений Image Pro Plus 3.0 для Windows (Media Cybernetics, Silver Spring, MD). Максимальную нагрузку, критическую нагрузку и модуль упругости (модуль Юнга) рассчитывают с помощью следующих уравнений [25]:
 ,
,
где σ обозначает критическую нагрузку, c обозначает расстояние от центра массы (равно ½ b, как описано выше), F обозначает прикладываемое усилие (Н), d обозначает смещение (мм), а L обозначает расстояние между двумя опорными точками приспособления для испытания на изгиб (мм). Кроме того, измеряют энергию критической нагрузки путем компьютерной обработки соответствующих площадей под кривой нагрузка-растяжение.
Пример 12
Ингибирование OVX-индуцированного разрежения кости под действием производных RD у мышей
Чтобы исследовать влияние производных RD на разрежение кости, у самок мышей вызывают остеопороз путем овариэктомии (OVX), как описано в примере 8. У мышей OVX наблюдается снижение BMD и BMC во всем организме. Обработка производными RD (в.м., 1,5 мг/кг/через день) или алендронатом (п.о., 1,5 мг/кг/через день) в течение 2 недель приводит к подавлению снижения BMD и BMC (таблица 6). Концентрация в крови C-концевого телопептида коллагена может являться показателем остеокластной активности. Как показано в таблице 6, производные RD или алендронат также снижают индуцированный овариэктомией рост активности остеокластов (таблица 6). Оказалось, что некоторые из производных RD являются гораздо более эффективными, чем алендронат. К тому же, обработка RD (в.м., 1,5 мг/кг) раз в неделю в течение 2 недель также приводит к подавлению снижения BMD и BMC (таблица 6). Полученные результаты показывают, что RD и его производные могут подавлять остеопороз при более длинных интервалах дозирования.
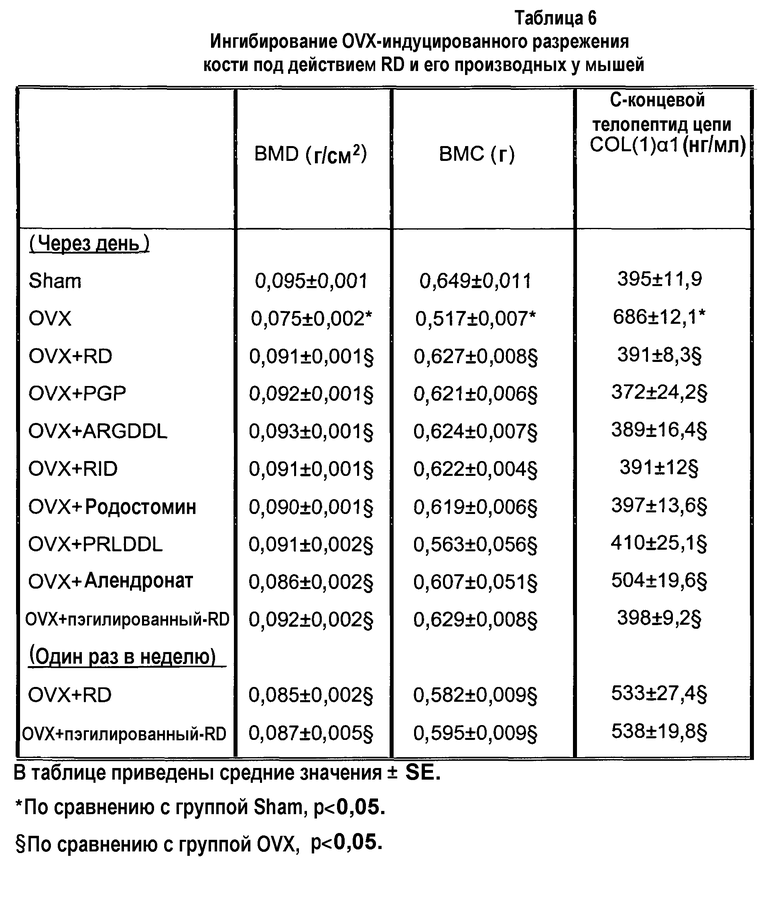
Пример 13
Ингибирование индуцированного овариэктомией разрежения кости под действием PG0, P и производных RD у крыс
PGP (производное RD) используют для более детального исследования защиты от вызванного овариэктомией (OVX) разрежения кости у крыс. Взрослых самок крыс (возрастом 3 месяца) подвергают овариэктомии, как описано в примере 8, и через 6 недель после овариэктомии измеряют объем костей, как описано в примерах 9-11. Показано, что белок PGP ингибирует как индуцированное овариэктомией уменьшение объема костей, так и увеличение числа остеокластов.
Как показано на фиг.2A, по сравнению с крысами, которые были подвергнуты ложной операции (Sham), овариэктомия (OVX) вызывает значительное разрежение губчатой кости. Однако обработка PGP (в.в., 0,3 мг/кг/день, или в.м., 1,5 мг/кг/через день) приводит к значительному ингибированию индуцированного овариэктомией разрежения губчатой кости во вторичном губчатом слое.
На фиг.2B приведены результаты окрашивания устойчивой к тартрату кислотной фосфатазой (TRAP), которые показывают, что остеокласты преимущественно локализуются вокруг губчатой кости и что PGP ингибирует OVX-индуцированное увеличение образования остеокластов.
В конце эксперимента у крыс OVX также наблюдается увеличение массы тела. Обработка PGP (в.в., 0,3 мг/кг/день, или в.м., 1,5 мг/кг/через день) приводит к значительному ингибированию OVX-индуцированного увеличения массы тела.
Через 6 недель после овариэктомии также наблюдается снижение влажной массы, BMD и BMC как в бедренной, так и в большеберцовой костях крыс (таблица 7). Обработка PGP (либо в.в., либо в.м.) приводит к подавлению снижения влажной массы как бедренной, так большеберцовой костей у крыс, перенесших OVX. Гистоморфометрия показывает, что овариэктомия вызывает разрежение губчатой кости во вторичном губчатом слое (фиг.2). Обработка PGP приводит к заметной регрессии снижения объема кости (фиг.2 и таблица 7). Кроме того, окрашивание TRAP показывает, что остеокласты преимущественно располагаются вокруг губчатой кости и что OVX приводит к увеличению числа остеокластов. Долгосрочное введение PGP противодействует OVX-индуцированному образованию остеокластов (фиг.2 и таблица 7). Уровень в сыворотке крови С-концевого телопептида коллагена отражает остеокластную активность. Обнаружено, что данное значение значительно выше в группе OVX, чем в группе Sham, тогда как обработка PGP эффективно препятствует OVX-индуцированному увеличению активности остеокластов (таблица 7).
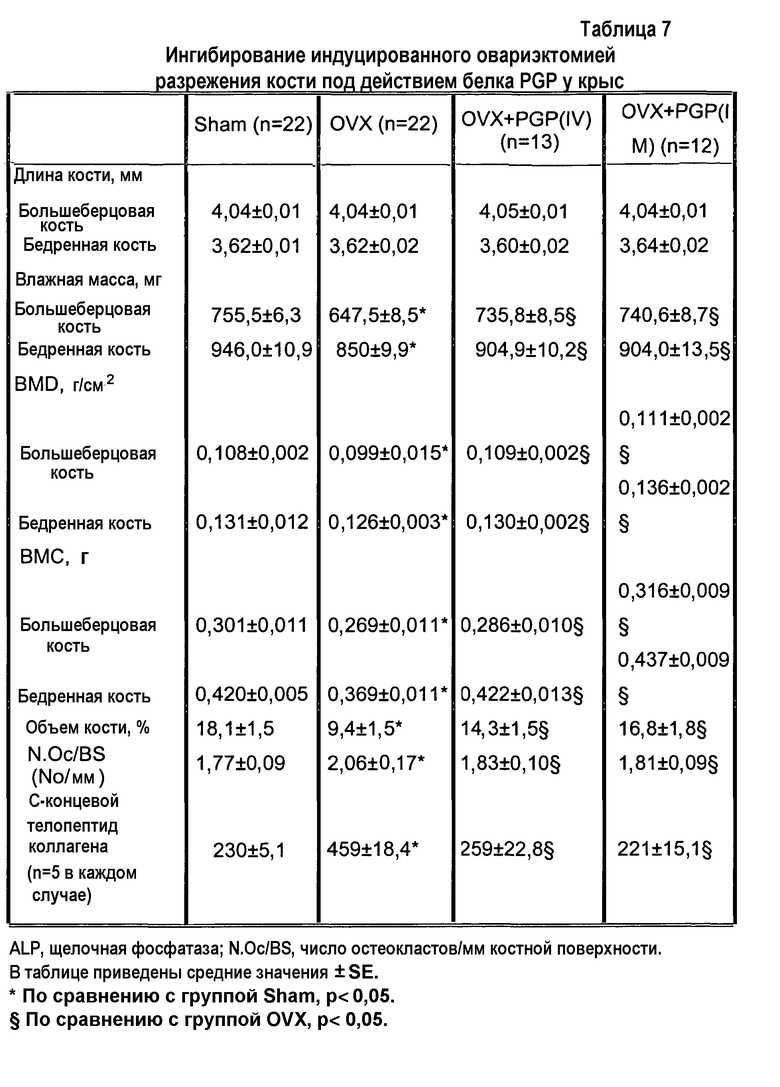
Чтобы определить механические характеристики кости, проводят тестирование бедренной кости на трехточечный изгиб. По сравнению с группой, которая была подвергнута ложной операции, у крыс OVX наблюдается снижение максимальной нагрузки, критической нагрузки, модуля Юнга и предельного напряжения. Обработка PGP обеспечивает защиту от OVX-индуцированного снижения прочности кости (таблица 8). Полученные результаты позволяют предположить, что PGP-подобные белковые лекарственные средства могут значительно ингибировать разрежение кости, вызванное овариэктомией.
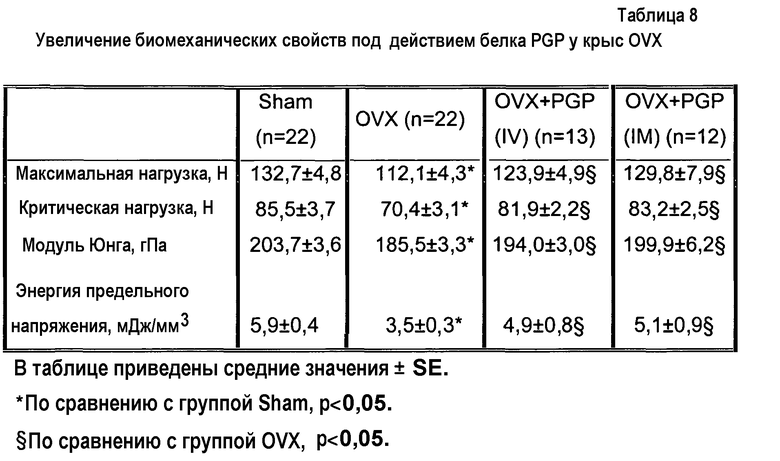
Пример 14
Постобработка белком RD приводит к ингибированию OVX-индуцированной активации остеокластов
Чтобы исследовать динамический терапевтический эффект, оказываемый производными RD на активность остеокластов in vivo, у самок крыс индуцируют остеопороз путем овариэктомии и через разные интервалы времени в крови измеряют уровень C-концевых телопептидов коллагена типа 1. По сравнению с крысами, которые были подвергнуты ложной операции (Sham), овариэктомия (OVX) вызывает значительное увеличение активности остеокластов. Измерение уровня С-концевого телопептида цепи COL(1)α1 в сыворотке показывает, что у крыс OVX наблюдается увеличение активности остеокластов. Через 28 дней после овариэктомии содержание С-концевого телопептида коллагена типа 1 увеличивается от фонового уровня 361±25,6 (n=15) до 708±50,7 нг/мл (n=15).
Через месяц после овариэктомии проводят постобработку RD или алендронатом. Постобработка RD (в.м., 1,5 мг/кг/через день) или алендронатом (п.о., 1,5 мг/кг/через день) приводит к регрессии индуцированного овариэктомией увеличения активности остеокластов, причем RD является гораздо более эффективным, чем алендронат (фиг.3). Активность остеокластов восстанавливается после отмены обработки RD или алендронатом. Восстановление активности остеокластов происходит намного быстрее в группе, получающей алендронат, чем в группе, получающей RD. Однако повторное применение RD эффективно ингибирует индуцированный овариэктомией рост активности остеокластов. Число остеокластов после обработки RD намного ниже, чем после обработки алендронатом (фиг.3). Полученные результаты показывают, что RD-родственные белки оказывают терапевтическое действие на разрежение кости, вызванное активацией остеокластов, индуцированной овариэктомией.
После повторного периода обработки лекарственными средствами крыс умерщвляют и измеряют BMD и BMC большеберцовой и бедренной костей. Как показано в таблице 9, постобработка RD приводит к эффективной регрессии разрежения кости после овариэктомии. В отношении сохранения объема кости RD является более эффективным, чем алендронат.
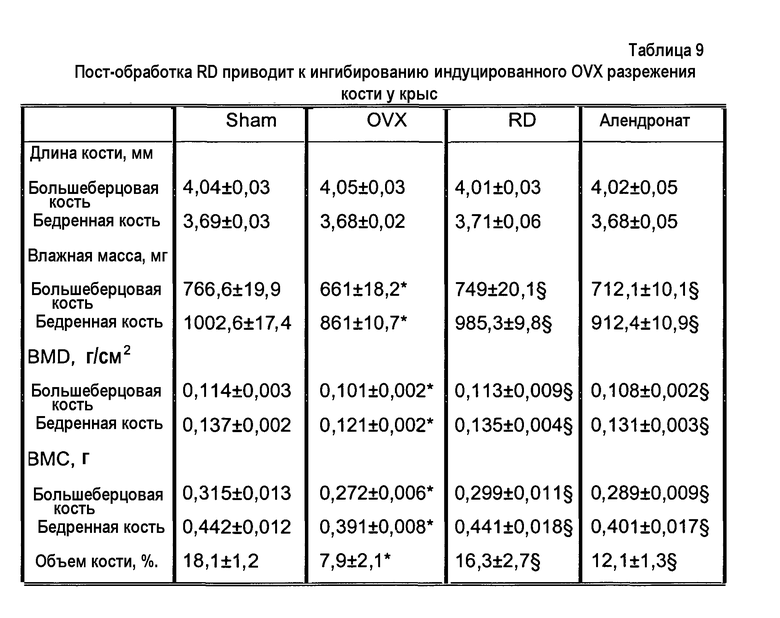
BMD представляет собой сокращенное обозначение минеральной плотности кости; BMC представляет собой сокращенное обозначение содержания минералов в кости.
В таблице приведены средние значения ± SE.
* По сравнению с группой Sham, p<0,05
§ По сравнению с группой OVX, p<0,05
RD: в.м. введение (1,5/мг/кг/через день)
Алендронат: п.о. (1,5 мг/кг/через день)
n=5 для каждой группы
Пример 15
Ингибирование повреждения хондроцитов под действием RD у животных с остеоартритом
Модель животного с остеоартритом получают путем хирургической операции только на правых коленях самцов крыс Sprague-Dawley. Хирургическая операция включает проведение переднего крестообразного лигирования и частичную медиальную менискэктомию. После операции вводят белок RD путем внутримышечной инъекции (1,5 мг/кг/через день) или местной инъекции в сустав (один раз в неделю), причем введение осуществляют до последнего дня, тогда как крыс умерщвляют через 6 недель после операции. Каждый сустав помещают в парафиновый воск, делают срезы и окрашивают 0,1% сафранином-О и гематоксилином. Как показано на фиг.4B, слой хондроцитов правого коленного сустава поврежден артритом, а RD как при внутримышечной инъекции (фиг.4D), так и при местном введении (фиг.4C) ингибирует разрушение хондроцитарного слоя.
Пример 16
Ингибирование увеличения уровня цитокинов в крови под действием RD у крыс с остеоартритом
Крыс с остеоартритом получают путем хирургической операции, как описано выше. Через шесть недель после операции получают сыворотку и измеряют уровень цитокинов в крови. Как показано на фиг.5A-5C, сывороточные уровни цитокинов, таких как c-реактивный белок, IL-1β и IL-6, повышены у крыс с остеоартритом, а введение RD эффективно подавляет индуцированное остеоартритом повышение уровня цитокинов.
Пример 17
Ингибирование увеличения уровня цитокинов в крови под действием RD у мышей с остеоартритом
Мышей с остеоартритом получают путем хирургической операции, как описано выше. Через шесть недель после операции получают сыворотку и измеряют уровень цитокинов. Как показано на фиг.6A-6C, сывороточные уровни цитокинов, таких как c-реактивный белок, IL-1β и IL-6, повышены у крыс с остеоартритом, а введение RD эффективно подавляет индуцированное остеоартритом повышение уровня цитокинов.
Пример 18
Введение клеток рака предстательной железы или молочной железы в большеберцовую кость мыши
Используют самцов мышей с тяжелым комбинированным иммунодефицитом (SCID) или самцов мышей BALB/c-nu/nu массой 20-22 г (возраст 6 недель), выведенных в изоляторе для животных (стеллажи IVC) в условиях отсутствия конкретных патогенов (SPF) при 22±2°C. Клетки аденокарциномы предстательной железы человека PC-3 или клетки рака молочной железы человека MDA-MB-231 (1×106 клеток в 15 мл стерильного PBS) вводят в костный мозг левой и правой большеберцовой кости мышей SCID или голых мышей на 1 день, соответственно. На 11 день животных случайным образом распределяют в три группы и начинают введение тестируемых соединений. RD (1,5 мг/кг) вводят путем внутримышечной (в.м.) инъекции, а алендронат (1,5 мг/кг) - путем подкожной (п.к.) инъекции один раз в день, в количестве 15 доз (5 дней вводят, 2 дня перерыв, в течение 3 недель). Массу тела и состояние роста опухоли наблюдают и регистрируют каждую неделю в течение экспериментального периода. Через месяц мышей умерщвляют и измеряют массу задних конечностей. Чтобы определить относительную массу опухоли, вычитают массу контрольной конечности. Кроме того, в конце эксперимента собирают образцы крови, в которых измеряют число красных кровяных клеток (RBC), белых кровяных клеток (WBC) и тромбоцитов, а также концентрацию C-концевых телопептидов коллагена типа I (CTX) и кальция в сыворотке.
Остеолиз костей определяют с помощью рентгенограмм, полученных с использованием устройства, генерирующего мягкие рентгеновские лучи (Young-kid Enterprise Co., Ltd., Taipei, Taiwan). Животных подвергают глубокой анестезии моногидратом трихлоруксусного альдегида, укладывают в положении лежа на животе на пленку Kodak Scientific Imaging (13×18 см) и обрабатывают рентгеновским излучением при 45 кВ в течение 5 секунд. Степень остеолиза измеряют, используя программное обеспечение для анализа изображений (Image-pro plus 3.0).
Пример 19
Ингибирование роста опухоли в кости и гиперкальциемии
Рост опухолевых клеток в кости связан с резорбтивной активностью. Анализируют влияние белка RD на опухолевый рост клеток рака предстательной железы в кости. Клетки PC-3 (1×106) локально вводят в костномозговые полости обеих большеберцовых костей мышей SCID. RD или алендронат вводят через 10 дней после имплантации опухолевых клеток. RD в дозе 1,5 мг/кг вводят внутримышечно (в.м.), а алендронат вводят в дозе 1,5 мг/кг подкожно (п.к.) один раз в день, в количестве 15 доз (5 дней вводят, 2 дня перерыв, в течение 3 недель). Чтобы оценить рост опухоли, на 33 день измеряют опухание задних конечностей. На протяжении всего экспериментального периода измеряют массу тела. Результаты показывают, что RD в дозе 1,5 мг/кг значительно подавляет индуцированное опухолевыми клетками опухание задних конечностей на 33 день (43,8±4,1%, n=21-22) (фиг.7). Однако подкожное введение алендроната в дозе 1,5 мг/кг не ингибирует опухолевый рост в конечностях (фиг.7).
На фиг.8 показано влияние RD на уменьшение массы тела в ответ на рост опухоли у мышей SCID. У необработанных контрольных мышей в конце эксперимента наблюдается уменьшение массы тела. Обработка RD позволяет предотвратить потерю массы тела, вызванную ростом опухоли. Алендронат используют в качестве положительного контроля.
На фиг.9 показано ингибирование роста опухоли и остеолитического повреждения кости под действием RD у мышей SCID. Остеолиз костей определяют с помощью рентгенограмм, полученных с использованием устройства, генерирующего мягкие рентгеновские лучи. На фиг.9A приведены фотографии, полученные через 33 дня после введения клеток PC-3 в большеберцовые кости. На проксимальной большеберцовой кости вырастает видимая сферическая опухоль. Обработка RD (в.м., 1,5 мг/кг/через день) приводит к ингибированию роста опухоли. На фиг.9B приведены рентгенограммы, полученные на 33 день, которые показывают, что в большеберцовых костях после введения раковых клеток присутствуют остеолитические повреждения и что обработка RD приводит к ингибированию остеолиза. На фиг.9C показана количественная обработка полученных результатов. На фиг.9D показано, что RD ингибирует индуцированное опухолью увеличение уровня C-концевых телопептидов коллагена (маркера остеокластной активности) по данным анализа ELISA. На фиг.9E показано, что RD и алендронат (1,5 мг/кг/через день) также ингибируют индуцированное опухолью увеличение концентрации кальция в сыворотке (т.е. гиперкальциемию). *: p<0,05 по сравнению с контролем. #: p<0,05 по сравнению с группой, получающей PC-3.
Рак молочной железы имеет большую склонность к метастазированию в костях. На фиг.10 показано ингибирование опухолевого роста под действием RD у голых мышей. Клетки рака молочной железы человека MDA-MB-231 (1×106) вводят в костномозговые полости обеих большеберцовых костей голых мышей. RD (в.м., 1 мг/кг/день) вводят через 10 дней после имплантации опухолевых клеток в течение 14 дней. Обработка RD (в.м., 1,5 мг/кг/день) в течение 2 недель приводит к ингибированию MDA-MB-231-индуцированного увеличения роста опухоли в кости (фиг.10A). Кроме того, RD также предотвращает индуцированное опухолью увеличение остеокластной активности (фиг.10B) и гиперкальциемию (фиг.10C), но не влияет на число RBC, WBC и тромбоцитов в крови (фиг.10D-10F). *: p<0,05 по сравнению с контролем. #: p<0,05 по сравнению с группой, получающей MDA-MB-231.
Пример 20
Пэгилирование белка RD
Пэгилирование продукта или его конъюгирование с альбумином может увеличить продолжительность действия и уменьшить антигенность белкового лекарственного средства. Чтобы минимизировать антигенность и увеличить продолжительность действия, белок RD пэгилируют с помощью следующего способа: белок RD (4 мг) в 20 мМ NaCNBH3 при pH 5 подвергают взаимодействию с 5 мМ PEGk5-пропиональдегидом (O-Метил-O'-[2-(6-оксокапроиламино)этил]полиэтиленгликоль 5000) (Sigma) при 4°C в течение 12 ч. Пэгилированный белок RD очищают методом ВЭЖХ на обращенной фазе C18. Конечный выход пэгилированного белка RD после очистки составляет более 60%.
Как показано в таблице 6, пэгилированный RD ингибирует дифференциацию остеокластов. Кроме того, обработка пэгилированным RD (в.м., 1,5 мг/кг, раз/неделю) в течение 2 недель приводит к ингибированию снижения BMD и BMC (таблица 6). Полученные результаты показывают, что после пэгилирования активность RD in vivo не снижается.
Пример 21
Анализ антиангиогенеза в слое MATRIGEL TM
Известно, что интегрин αvβ3 связан с ангиогенезом. Поэтому, чтобы определить, способен ли белок RD ингибировать ангиогенез, предпринимают исследования, в которых используют анализ ангиогенеза в пробке MATRIGELTM, проводимый по описанному ранее способу с минорными модификациями [32]. Коротко говоря, аликвоту (500 мкл) MATRIGELTM (Becton Dickinson Lab.), содержащую 200 нг/мл VEGF, вводят подкожно в области спины мышам C57BL/6 возрастом 6-8 недель. MATRIGELTM быстро образует пробку. RD вводят внутримышечно (3 мг/кг) ежедневно (RD/1день) или через день (RD/2день или HSA-RD), после чего животных умерщвляют. Через 8 дней пробки извлекают и фотографируют (фиг.11A). Количество новых сосудов определяют путем измерения гемоглобина в пробках, который является показателем образования кровеносных сосудов, с использованием способа Драбкина и набора реагентов Драбкина 525 (Sigma) (фиг.11B). На фиг.11A и 11B приведены результаты анализа с использованием пробок MATRIGELTM, которые показывают, что белок RD эффективно ингибирует ангиогенез. *: p<0,05 по сравнению с контрольной группой.
Пример 22
Анализ связывания радиолигандов: специфичность RD-родственных белков
Чтобы определить, действительно ли RD и его производное PGP связываются с другими рецепторами помимо интегрина αvβ3, RD и его производное PGP используют для анализа специфичности по отношению к рецепторам, лигандами которых являются белки (анализ проводят службы MDS Pharma, Taipei, Taiwan).
Как показано в таблице 10, RD и PGP не влияют на способность кальцитонина, эндотелина ETA, эндотелина ETB, инсулина, лептина, натриевого канала, трансформирующего фактора роста-β (TGF-β), фактора некроза опухолей (TNF) и фактора роста эндотелия сосудов (VEGF) связываться с их соответствующими рецепторами. Это свидетельствует о том, что RD-родственные белки обладают селективностью связывания в отношении белка-мишени αvβ3 in vivo.
Пример 23
Ингибирование ангиогенеза под действием RD у мышиной модели ретинопатии недоношенных
Животную модель ретинопатии недоношенных у мышей получают путем индуцирования гипоксией ангиогенеза, по способу, описанному Wilkinson-Berka et al. [28]. Коротко говоря, детенышей возрастом семь дней и их матерей помещают в герметично закрытые камеры, содержащие 75% O2 и воздух. Мышей оставляют в камере на пять дней (период гипероксии от P7 до P12) и затем помещают в комнатную атмосферу, где держат еще семь дней (гипоксия-индуцированный ангиогенный период, от 12 дней после родов до 19 дней после родов, или от P12 до P19). RD (2 мкг) вводят в стекловидное тело на 12 день, и на 19 день мышей умерщвляют.
Делают три среза одного из глаз каждого животного, затем срезы депарафинизируют и окрашивают гематоксилином и эозином. Профили кровеносных сосудов (BVP) считают во внутреннем слое сетчатки, причем учитывают сосуды, прилипающие к внутренней ограничивающей мембране. Подсчет проводят с помощью фотомикроскопа (Leica) при увеличении 100×.
Как показано на фиг.12A, белок RD ингибирует ангиогенез у мышиной модели ретинопатии недоношенных (ROP). На фиг.12B показано уменьшение BVP у мышиной модели ретинопатии недоношенных (ROP), получающей белок RD. Количественное определение ангиогенеза проводят путем подсчета профилей кровеносных сосудов (BVP) во внутреннем слое сетчатки и проникающих в полость стекловидного тела на трех срезах, окрашенных гематоксилином и эозином. В группе ROP, обработанной RD (2 мкг) (т.е. ROP+RD), ангиогенез уменьшается на 46% по сравнению с группой ROP, обработанной средой (ROP). (n=7 для каждой группы ROP; n=2 для группы sham.) Результаты представлены в виде среднего значения ± SE. #: p<0,01 по сравнению с группой sham. **: p<0,001 по сравнению с группой ROP.
Пример 24
Ингибирование индуцированного овариэктомией остеопороза под действием конъюгированного с альбумином RD
Влияние конъюгированного с альбумином RD на остеопороз определяют на самках мышей после овариэктомии. RD, конъюгированный с человеческим сывороточным альбумином (т.е. RD-альбумин), вводят, как показано стрелками на фиг.13A и 13B. Для сравнения на фиг.13A-13D показаны результаты, полученные с использованием RD. Сывороточные уровни c-концевого пептида коллагена типа I и щелочной фосфатазы (ALP) измеряют и используют в качестве показателей активности остеокластов и остеобластов, соответственно. Как показано на фиг.13C и 13D, каждые 2 недели также измеряют BMD и BMC. Обработка RD-альбумином (15 мг/кг/неделю) значительно уменьшает в обратимой манере активность остеокластов, но увеличивает ALP.
Пример 25
Ингибирование ревматоидного артрита под действием RD
Ревматоидный артрит представляет собой хроническое системное воспалительное нарушение неизвестной этиологии, характеризующееся инвазивной синовиальной гиперплазией, которая приводит к прогрессирующему разрушению сустава. Остеокласты, образовавшиеся из линии моноцитов/макрофагов, играют ключевую роль в разрушении субхондральной кости при ревматоидном артрите. Рентгенографические исследования показывают, что при ревматоидном артрите остеопения субхондральной кости и костная эрозия начинаются уже на ранней стадии заболевания и постепенно усиливаются [29]. Остеокласты, обеспечивающие резорбцию кости, наблюдаются в эрозийной синовиальной оболочке/поверхности контакта с костью [30]. В опубликованном недавно обзоре обсуждается роль остеокластов при ревматоидном артрите [31]. Следовательно, RD-родственные белки, которые заметно ингибируют функции остеокластов, можно использовать для лечения ревматоидного артрита.
Крысы Lewis получают внутрикожные/подкожные (п.к.) инъекции бычьего коллагена типа II (2 мг/мл в неполном адъюванте Фрейнда). После развития у крыс ревматоидного заболевания их случайным образом распределяют в несколько опытных групп. Обработку начинают на первый день после того, как клинические симптомы артрита станут отчетливо видны, например, начнет опухать голеностопный сустав. После измерения объема лапы крыс умерщвляют и собирают голеностопные и коленные суставы для анализа гистопатологических изменений.
На фиг.14A-D показаны аминокислотные последовательности Rho и его вариантов, SEQ ID NO:1 и 57-69, соответственно. На фиг.15A-C показаны нуклеотидные последовательности вариантов родостомина, SEQ ID NO:43-56. На фиг.16A-H показаны аминокислотные и нуклеотидные последовательности вариантов дезинтегрина, SEQ ID NO:78-135.
Приведенное выше описание иллюстративных воплощений данного изобретения предназначается только для иллюстрации и описания, но не для ограничения или лимитирования изобретения конкретными раскрытыми формами. С учетом вышеприведенных разъяснений могут быть осуществлены многочисленные модификации и вариации.
Другие варианты осуществления настоящего изобретения станут очевидны для специалистов в данной области после ознакомления с раскрытыми в данном документе описанием и осуществлением данного изобретения. Описание и примеры приведены только для иллюстрации, а истинные объем и сущность данного изобретения указаны в нижеследующей формуле изобретения.
Список ссылок



| название | год | авторы | номер документа |
|---|---|---|---|
| ВАРИАНТЫ ДИЗИНТЕГРИНА И ИХ ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2015 |
|
RU2685869C1 |
| ПОЛИПЕПТИДЫ, СЕЛЕКТИВНЫЕ В ОТНОШЕНИИ ИНТЕГРИНА αvβ3, КОНЪЮГИРОВАННЫЕ С ВАРИАНТОМ ЧЕЛЕВЕЧЕСКОГО СЫВОРОТОЧНОГО АЛЬБУМИНА (HSA), И ИХ ФАРМАЦЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ | 2010 |
|
RU2547592C2 |
| СПОСОБЫ И КОМПОЗИЦИИ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ИНГИБИРОВАНИЯ АНГИОГЕНЕЗА | 1997 |
|
RU2194528C2 |
| БЕЛОК, НАЦЕЛЕННЫЙ НА ИНТЕГРИН, И СПОСОБЫ ЕГО ПРИМЕНЕНИЯ | 2016 |
|
RU2806524C2 |
| СПОСОБЫ И КОМПОЗИЦИИ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ИНГИБИРОВАНИЯ αβ-ОПОСРЕДОВАННОГО АНГИОГЕНЕЗА | 1997 |
|
RU2195312C2 |
| ПОЛИПЕПТИД ДЛЯ ИНГИБИРОВАНИЯ МИГРАЦИИ И ИНВАЗИИ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ | 2019 |
|
RU2711085C1 |
| СПОСОБЫ И КОМПОЗИЦИИ, ПРИГОДНЫЕ ДЛЯ ИНГИБИРОВАНИЯ АНГИОГЕНЕЗА | 1995 |
|
RU2162712C2 |
| ПОЛИПЕПТИД ДЛЯ ИНГИБИРОВАНИЯ МИГРАЦИИ И ИНВАЗИИ ПЛОСКОКЛЕТОЧНОГО РАКА ПОЛОСТИ РТА | 2018 |
|
RU2705547C1 |
| ХИМЕРНЫЕ И ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА ПРОТИВ ИНТЕГРИНА α5β1, КОТОРЫЕ МОДУЛИРУЮТ АНГИОГЕНЕЗ | 2003 |
|
RU2346701C2 |
| АНТИТЕЛА ПРОТИВ АЛЬФА5-БЕТА 1 И ИХ ПРИМЕНЕНИЕ | 2009 |
|
RU2528736C2 |








































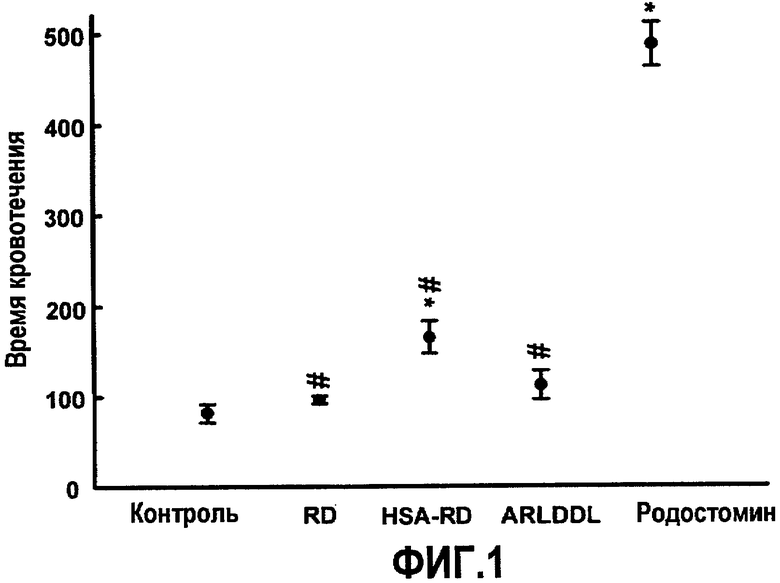
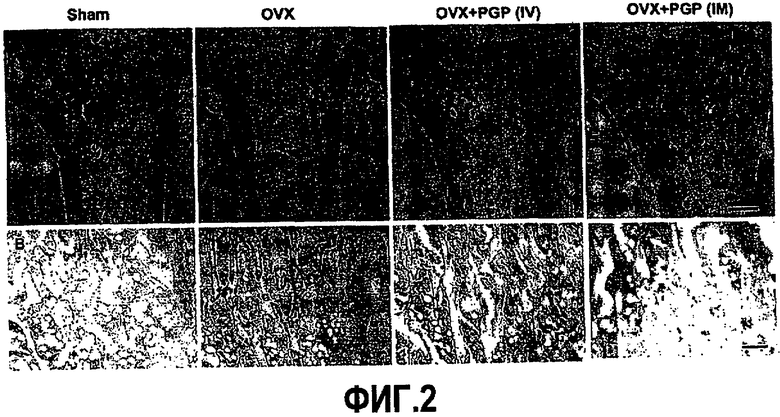
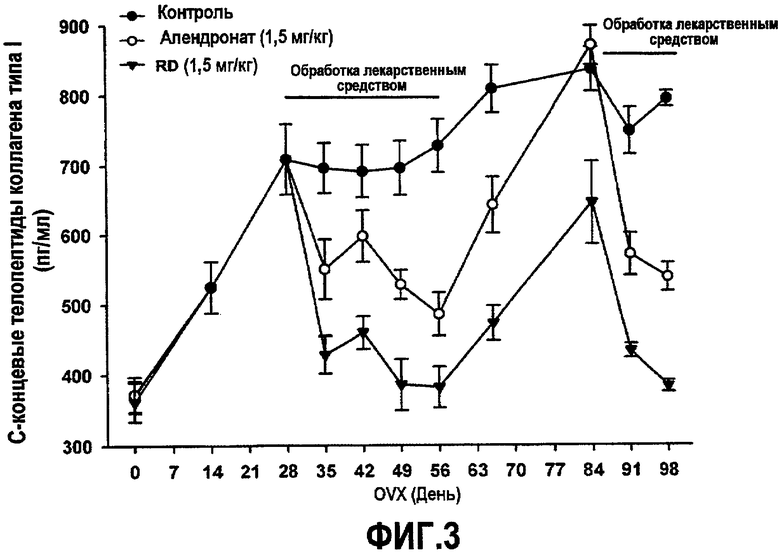
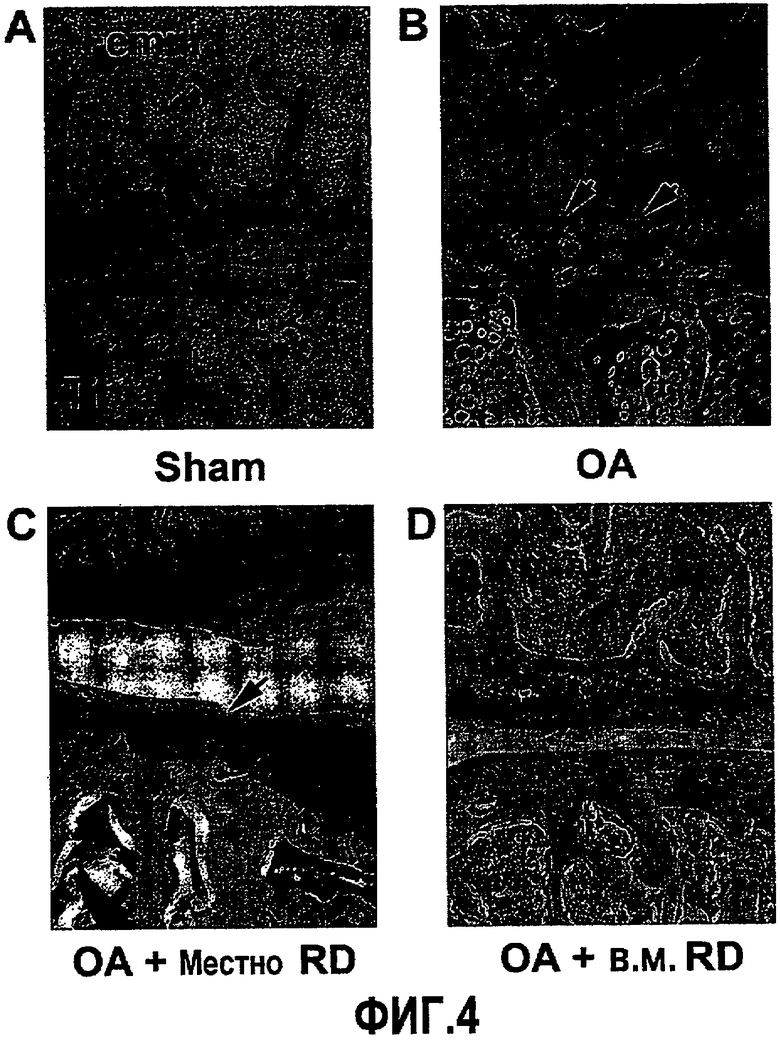
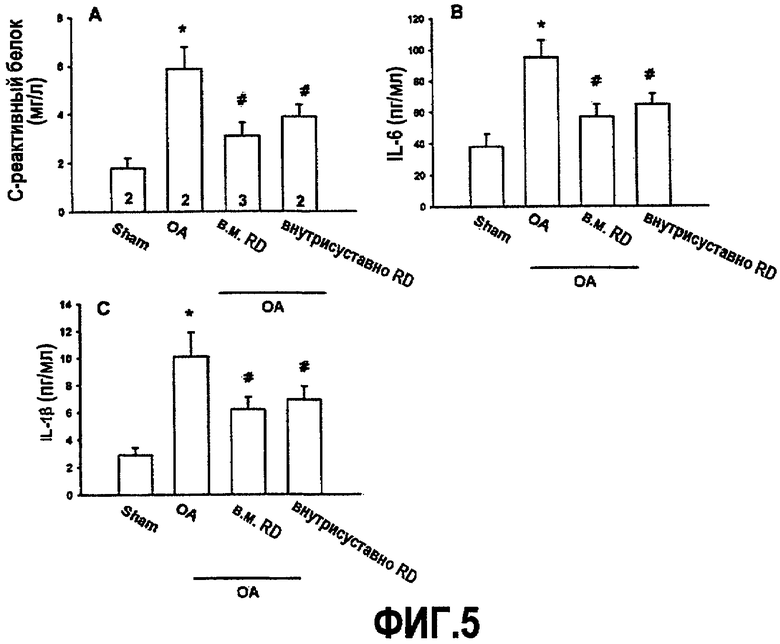
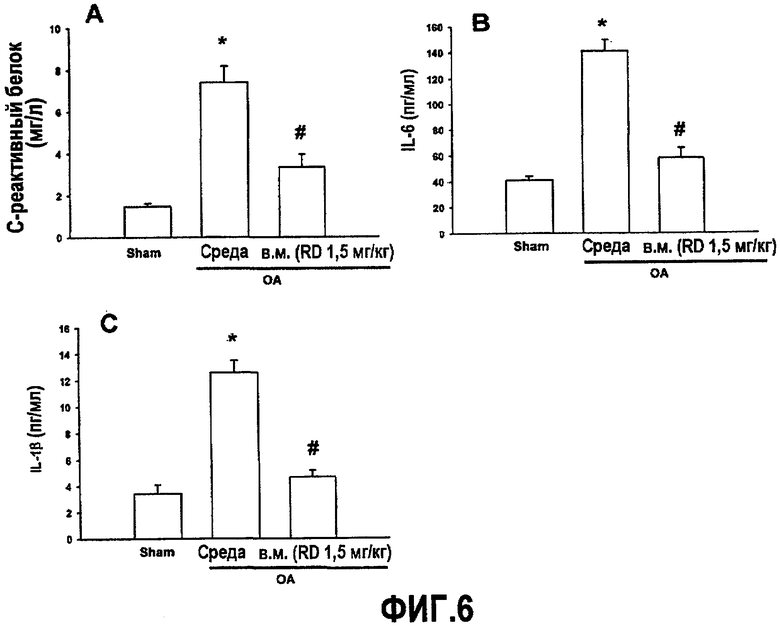
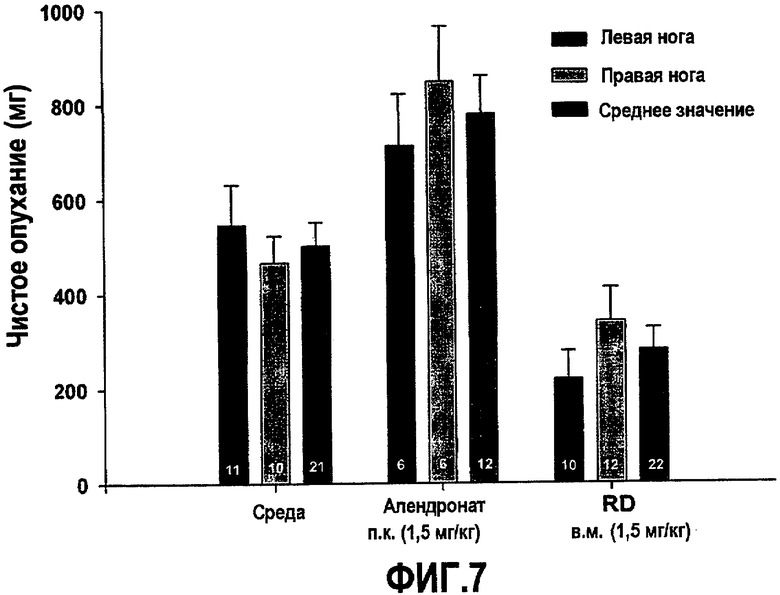
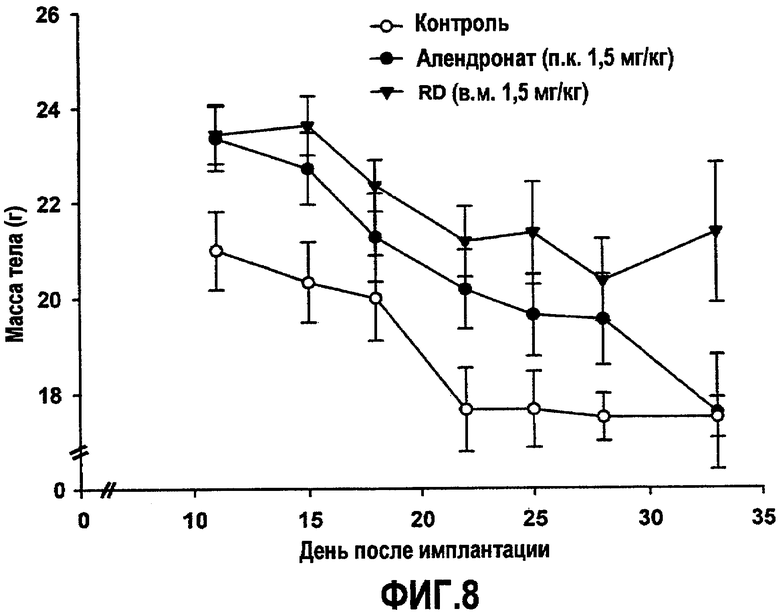
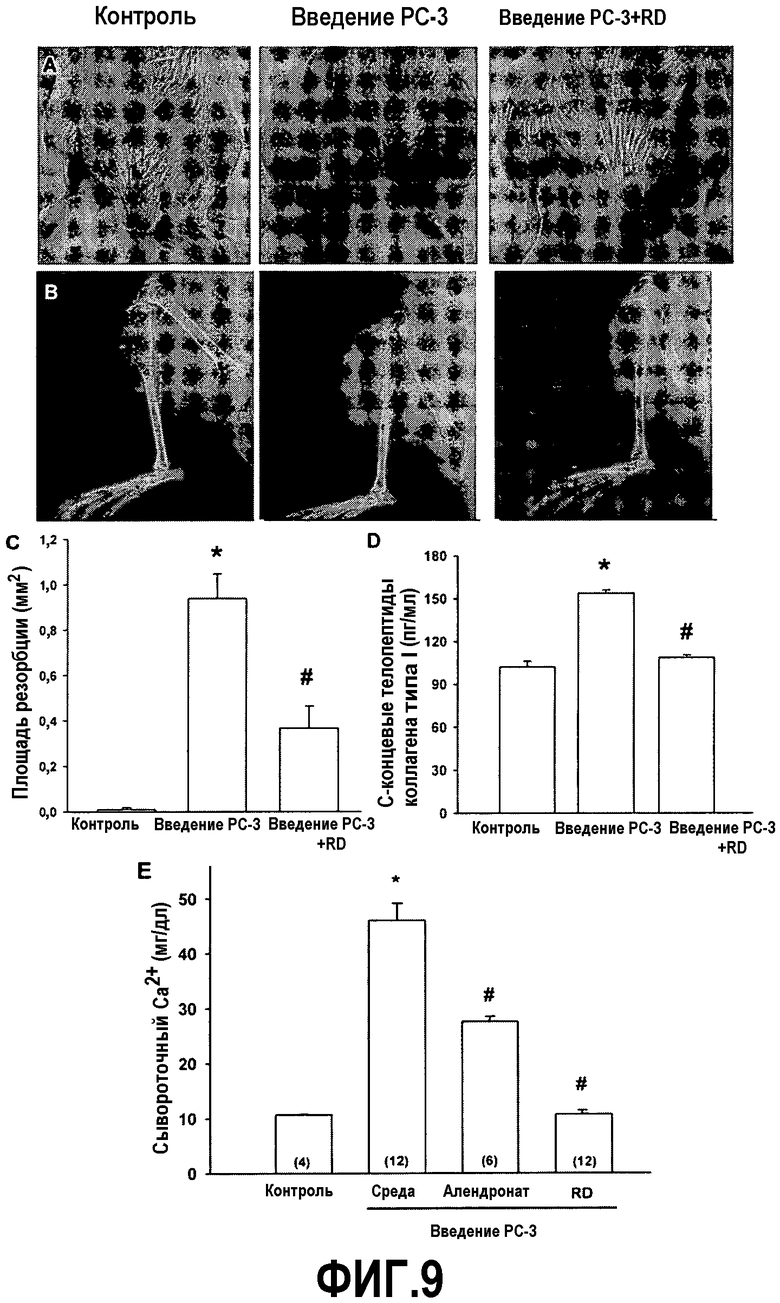
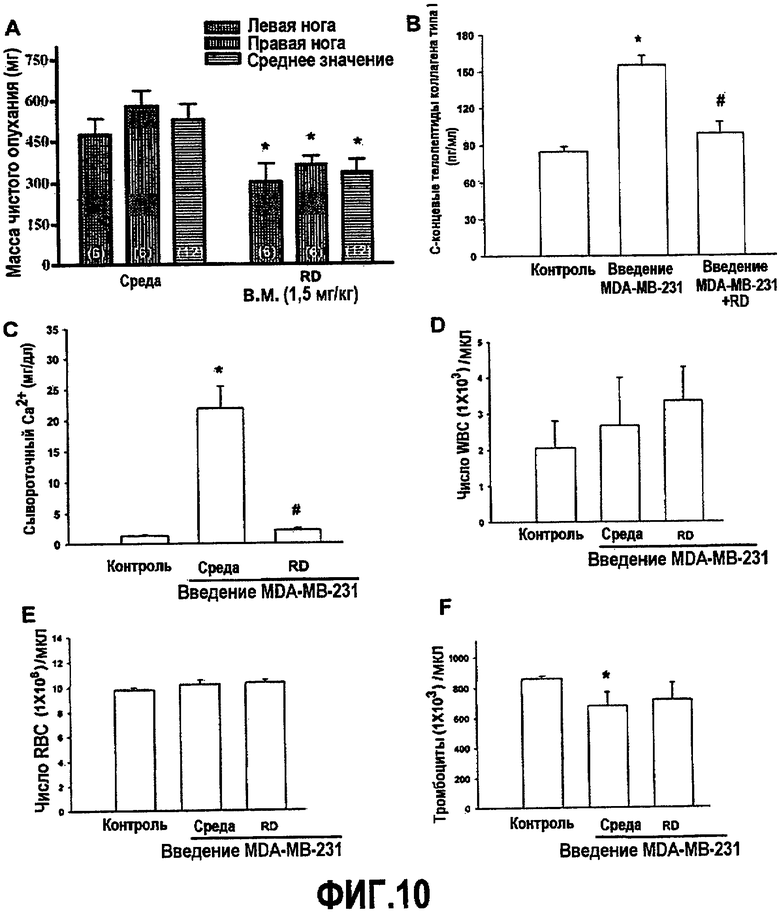
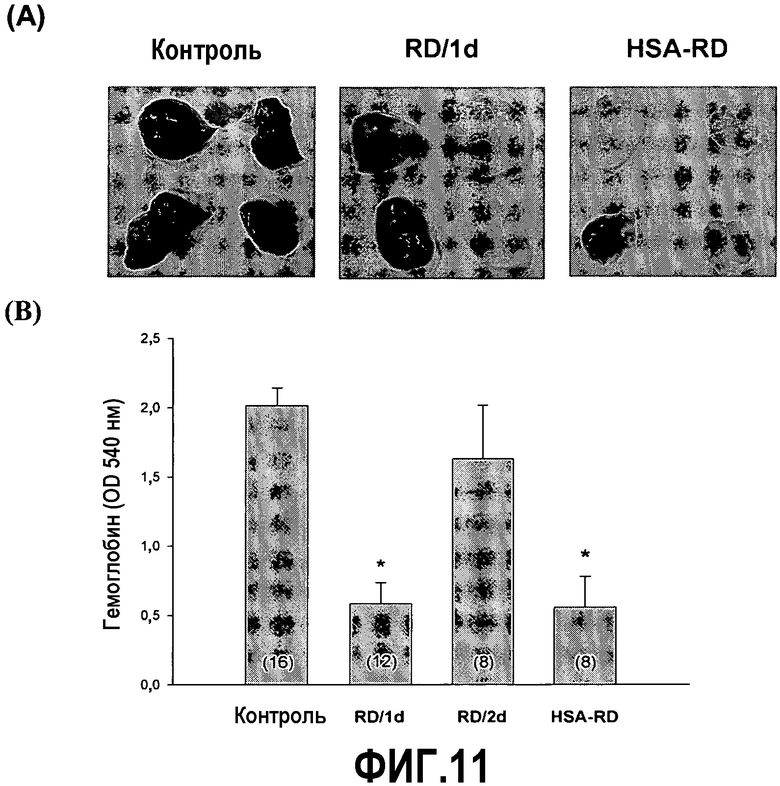
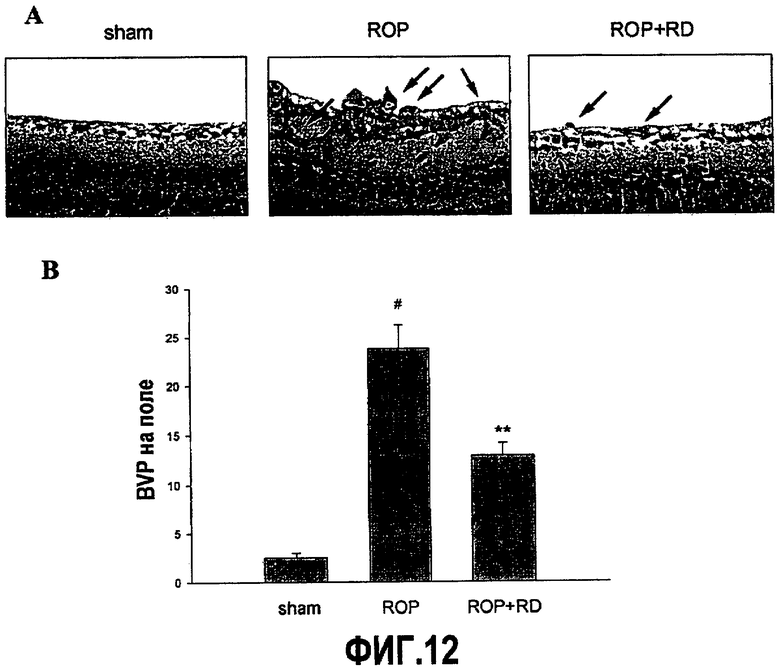
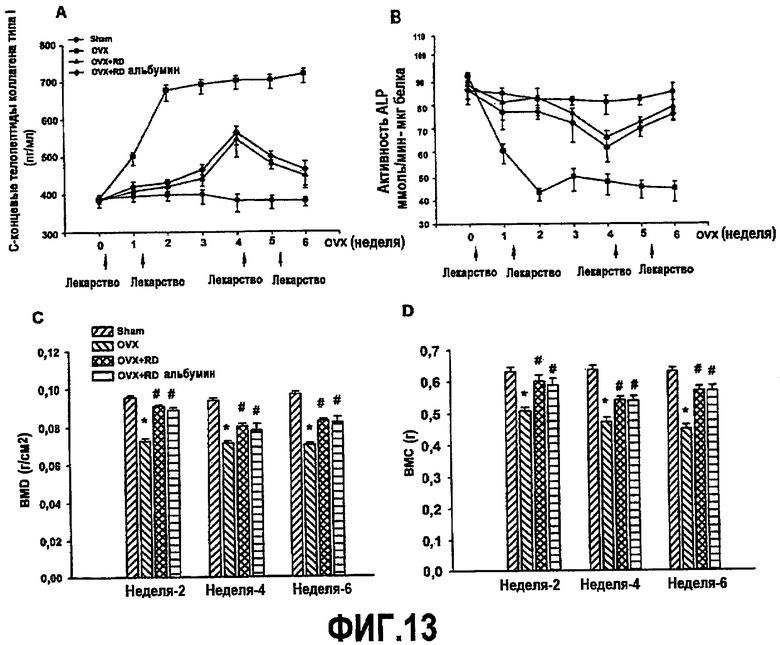














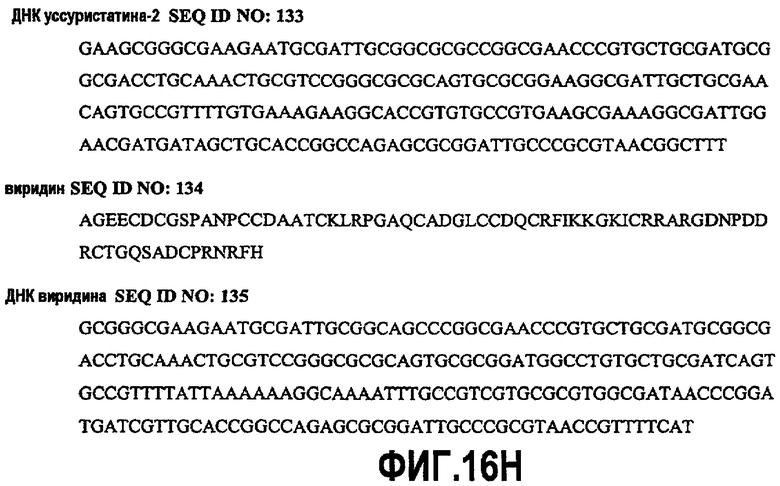
Изобретение относится к области биотехнологии и молекулярной генетики. Раскрываются варианты дезинтегрина и их применение в фармакологии. Вариант дезинтегрина включает выделенный полипептид, который обладает антагонистической активностью в отношении рецептора αvβ3 и значительно более низкой способностью блокировать рецептор интегрина aIIbβ3 и/или α5β1, чем дезинтегрин дикого типа. Полипептид кодируется модифицированной нуклеотидной последовательностью дезинтегрина, которая кодирует модифицированную аминокислотную последовательность, обладающую более низкой способностью связываться с интегрином αIIbβ3 и/или α5β1, чем дезинтегрин дикого типа. Изобретение можно использовать для лечения и/или профилактики интегрин αvβ3-ассоциированных заболеваний у млекопитающего, которые включают, без ограничения, остеопороз, рост опухоли или рака кости, ассоциированные с ангиогенезом рост и метастазирование опухоли, опухолевый метастаз в кости, индуцированную злокачественным заболеванием гиперкальциемию, ассоциированные с ангиогенезом заболевания глаз, болезнь Педжета, ревматоидный артрит и остеоартрит. 5 н. и 18 з.п. ф-лы, 16 ил., 10 табл., 25 пр.
1. Выделенный полипептид, селективный по отношению к интегрину αvβ3, где полипептид представляет собой вариант родостомина, который содержит аминокислотную последовательность, выбранную из SEQ ID NO: 57-69, или фармацевтически приемлемая соль указанного выделенного полипептида, где полипептид необязательно является конъюгированным с альбумином или пэгилированным.
2. Выделенный полипептид по п.1, где указанный выделенный полипептид содержит аминокислотную последовательность SEQ ID NO: 65.
3. Выделенный полипептид по п.1, где указанный выделенный полипептид кодируется полинуклеотидом, содержащим нуклеотидную последовательность SEQ ID NO: 52.
4. Выделенный полипептид по п.1, где указанный выделенный полипептид проявляет сродство к αIIbβ3, по меньшей мере, примерно в 50 раз меньше по сравнению с родостомином, кодируемым SEQ ID NO: 1.
5. Выделенный полипептид по п.1, где указанный выделенный полипептид проявляет сродство к α5β1, по меньшей мере, примерно в 5 раз меньше по сравнению с родостомином, кодируемым SEQ ID NO: 1.
6. Выделенный полипептид по п.1, где указанный выделенный полипептид проявляет сродство к тромбоцитам, по меньшей мере, примерно в 5, 50, 100, 1000 или 2000 раз меньше по сравнению с родостомином, кодируемым SEQ ID NO: 1.
7. Выделенный полипептид по п.1, где указанный выделенный полипептид обладает более низкой активностью в продлении времени свертывания крови по сравнению с родостомином, кодируемым SEQ ID NO: 1.
8. Выделенный полипептид по любому из пп.1-7, где указанный выделенный полипептид является конъюгированным с альбумином или пэгилированным.
9. Физиологически приемлемая композиция для лечения и/или профилактики заболевания, выбранного из группы, состоящей из индуцированного остеопорозом разрежения кости, остеопороза, остеоартрита, рака кости, ретинопатии, ревматоидного артрита и ассоциированного с ангиогенезом заболевания, содержащая выделенный полипептид по любому из пп.1-8 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
10. Способ лечения и/или профилактики заболевания, выбранного из группы, состоящей из индуцированного остеопорозом разрежения кости, остеопороза, остеоартрита, рака кости, ретинопатии, ревматоидного артрита и ассоциированного с ангиогенезом заболевания, включающий введение млекопитающему, нуждающемуся в этом, терапевтически эффективного количества выделенного полипептида по любому из пп.1-8 или его фармацевтически приемлемой соли.
11. Способ по п.10, где указанный выделенный полипептид содержит аминокислотную последовательность, выбранную из группы SEQ ID NO: 57-69.
12. Способ по п.10, где указанный выделенный полипептид содержит аминокислотную последовательность SEQ ID NO: 65.
13. Способ по п.10, где указанный выделенный полипептид кодируется полинуклеотидом, содержащим нуклеотидную последовательность SEQ ID NO: 52.
14. Способ по п.10, где указанный выделенный полипептид является конъюгированным с альбумином или пэгилированным.
15. Способ по п.10, где указанный выделенный полипептид содержит аминокислотную последовательность SEQ ID NO: 56, и где указанный выделенный полипептид является конъюгированным с альбумином или пэгилированным.
16. Способ получения выделенного полипептида по любому из пп.1-7, включающий стадии:
а. трансфекции клетки-хозяина полинуклеотидом, кодирующим указанный полипептид;
b. выращивание указанной клетки-хозяина в культуральной среде; и
с. выделение указанного полипептида.
17. Способ по п.16, где стадия (b) дополнительно включает добавление метанола к указанной культуральной среде.
18. Способ по п.16, дополнительно включающий выращивание клетки-хозяина в культуральной среде, не содержащей аминокислот.
19. Способ по п.16, где стадия (с) дополнительно включает проведение колоночной хроматографии для получения указанного полипептида.
20. Полинуклеотид, кодирующий выделенный полипептид, селективный по отношению к интегрину αvβ3, по любому из пп.1-7.
21. Полинуклеотид по п.20, где указанный выделенный полипептид содержит аминокислотную последовательность, выбранную из SEQ ID NO: 57-69.
22. Полинуклеотид по п.20, где указанный выделенный полипептид содержит аминокислотную последовательность SEQ ID NO: 65.
23. Полинуклеотид по п.20, где полинуклеотид содержит нуклеотидную последовательность SEQ ID NO: 52.
| US 5380646 A, 10.01.1995 | |||
| Веникодробильный станок | 1921 |
|
SU53A1 |
| BIOCHEMICAL JOURNAL, vol | |||
| Клапан | 1919 |
|
SU357A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| LIN ET AL: "Inhibition of adipogenesis by RGD-dependent disintegrin" | |||
| BIOCHEMICAL PHARMACOLOGY, | |||
Авторы
Даты
2013-03-20—Публикация
2007-12-21—Подача