Настоящее изобретение относится к несимметричному 3,6-дизамещенному 1,2,4,5-тетразину, содержащему в 6 положении тетразинового цикла 3,5-диметилпиразолильную группу, а в положении 3 - остаток замещенного гидразона, и способу его получения. Указанные соединения могут быть использованы в качестве противотуберкулезных агентов, в первую очередь для лечения больных туберкулезом.
Структура и способ получения соединений, заявляемых в качестве селективного противотуберкулезного агента, описаны [ЖОрХ, 2006, 42, №3, с.772-780; Heterocycles, 2003, 60 (12), PP.2653-2668}, но их активность в отношении микобактерий туберкулеза не известна и не описана.
Аналогом вышеуказанных веществ по строению является метиловый эфир 2-N-[6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразин-3-ил]-аминопропионовой кислоты формулы (I), который проявляет заметную туберкулостатическую активность в отношении штамма микобактерий H37Rv, однако для других представителей этого ряда соединений характерно обратное действие - усиление роста колоний микобактерий в их присутствии, связанное с высвобождением аминокислот [Хим. - фарм. журнал, 39, №1, 2005, с.10-12].
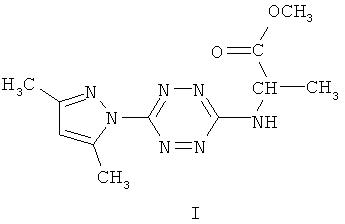
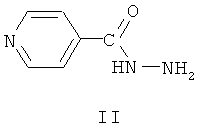
Аналог по назначению, изониазид формулы II, является селективным противотуберкулезным препаратом, однако недостатками этого препарата являются его высокая токсичность и различные побочные эффекты при применении. Изониазид вызывает аллергию, негативно влияет на функцию желудочно-кишечного тракта, имеет побочное действие на нервную систему [М.Д.Машковский. Лекарственные средства, 15-е изд., перераб., испр. и доп. - М.: РИА «Новая волна»: издатель Умеренков, 2007, с.858 и Фармакология и токсикология, 1987, 50, (4), с.87]. Отмечено широкое распространение устойчивых к изониазиду клинических штаммов микобактерий [Антибиотики и химиотерапия, 2002, 47, №6, с.28-30].
Описан способ получения заявляемых соединений путем конденсации 3-гидразино-6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразина с альдегидами или кетонами в метиловом спирте при комнатной температуре в присутствии кислоты [ЖОрХ, 2006, 42, №3, с.772-780]. Получаемый продукт отделяют фильтрованием, промывают и сушат. Выходы составляют 70-91%. Однако этот способ характеризуется длительностью процесса (3 часа), что приводит в некоторых случаях к образованию побочных продуктов.
Задача изобретения - использование известных веществ в качестве антимикобактериальных агентов с повышенной специфичностью при одновременном расширении спектра антимикобактериального действия и разработка более эффективного способа их получения.
Поставленная задача решается тем, что в качестве противотуберкулезного агента используют несимметричные 3,6-дизамещенные 1,2,4,5-тетразины формулы А, содержащие в 3 положении остаток замещенного гидразона
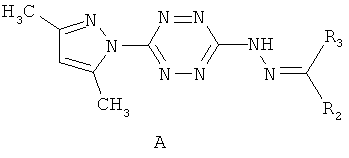
где R2=атом водорода или метил; R3=метил, 1-фенилпропен-1-ил, арил, выбранный из возможно замещенного фенила, гетерил, выбранный из фурила, пиридила, при этом замещенный фенил имеет 1-3 заместителя, выбранных из группы, включающей бром, хлор, метокси, нитро, гидрокси-группу, n=0,1,2.
Для получения замещенных 3-гидразоно-6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразинов используют новый, микроволновой способ, включающий нагревание при температуре 55-60°С эквимолярных количеств 3-гидразино-6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразина с соответствующим арил-, гетарилальдегидом, алифатическим либо ароматическим кетоном в среде ацетонитрила, и реакцию ведут под воздействием микроволнового излучения мощностью 200 Вт. Указанный способ отличается от прототипа большей селективностью процесса, что выражается в сокращении времени реакции до 15-20 минут и повышении выходов целевых продуктов до 90-95%.
В отличие от аналогов по строению и назначению указанные соединения представляют собой 3,6-дизамещенные 1,2,4,5-тетразины, содержащие гидразонные фрагменты, а также дополнительные гетероароматические остатки, наличие туберкулостатической активности у которых не было очевидным.
Особенности строения заявляемых веществ приводят к повышению специфичности антимикобактериального действия и расширению спектра действия - повышению активности указанных соединений в отношении типичных, атипичных и лекарственно устойчивых штаммов микобактерий (табл.1-3). За счет своей специфичности к микобактериям они не оказывают подавляющего действия на нормальную микрофлору организма.
Исследование антимикобактериальной активности заявляемых соединений в опытах in vitro проводят бактериологически, методом вертикальной диффузии на плотной питательной среде Ливенштейна-Йенсена или "Новая". В пробирку с засеянным тест-микробом по свободному краю на дно закапывают по 0,3 мл каждого разведения. Пробирки помещают в термостат в вертикальном положении и инкубируют при 37°С, результаты учитывают на 10-12 сутки.
Антибактериальную активность заявляемых соединений изучают методом высевания растворов препарата в лунки. В чашку Петри с простым питательным агаром вносят тест-микроб. В лунку, расположенную посредине чашки Петри, вносят по 0,02 мл препарата в необходимых концентрациях. Результаты учитывают после 24-часовой инкубации в термостате при 37°С, определением зоны задержки роста микроорганизмов по краям лунки.
Чистоту полученных соединений контролируют методом ТСХ, значения Rf определяют с использованием пластинок "Sorbfil" (Силикагель СТХ-1А,УФ) (Россия) или "Silufol-UV" (Чехословакия). Структуру полученных соединений подтверждают данными элементного анализа (C,H,N,O - анализатор фирмы Karlo Erba). ИК-спектры регистрируют на ИК - Фурье спектрометре «Spectrum One» фирмы «PerkinElmer» с помощью приставки диффузного отражения (Diffuse Reflectance Sampling Accessory (DRA). Спектры ЯМР 1Н соединений записывают в DMSO-d6 на приборе "Bruker-400" с рабочей частотой 400 мГц и ТМС в качестве внутреннего стандарта. Температуры плавления определяют на нагревательном столике «Boetius». Для микроволнового облучения исследуемых реакций используют микроволновой химический реактор ProLabo (частота 2.45 Гц, мощность излучения 200 Вт).
Примеры конкретного выполнения.
Пример 1
N-[6-(3,5-Диметилпиразол-1-ил)-1,2,4,5-тетразин-3-ил]-N'-этилиденгидразин
(Соединение формулы А, где R2=Н, R3=метил)
Раствор, содержащий 10 ммолей уксусного альдегида и 10 ммолей 3-гидразино-6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразина в 5 мл ацетонитрила подвергают микроволновому облучению в микроволновом химическом реакторе ProLabo (частота 2.45 Гц, мощность излучения 200 Вт) при 55°С в течение 15-20 минут (контроль по ТСХ). Растворитель упаривают, остаток промывают ацетонитрилом или алифатическим спиртом и сушат на воздухе.
Выход 90%. Т.пл. 120°С. Вычислено, (%): С, 46.54; Н, 5.21; N, 48.25. C9H12N8.
Найдено, (%): С, 46.63; Н, 5.20; N, 48.17. 1Н ЯМР (CDCl3), δ: 2.34 с (3Н, 3Pz-СН3); 2.58 с (3Н, 5Pz-CH3); 6.12 с (1Н, 4Pz-CH3); 2,13 д (3Н, СНСН3); 7,68 к (1Н,=СН) (5,4); 9,86 с (1H, NH).
Пример 2
N-Бензилиден-N'-[6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразин-3-ил]гидразин
(Соединение формулы А, где R2=Н, R3=фенил)
Получают аналогично примеру 17 из 1.0 ммоль 3-гидразино-6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразина и 1.0 ммоль бензальдегида при 60°С в течение 15-20 минут. Выход: 97%. Т.пл. 202-204°С. Вычислено, (%): С, 57.13; Н, 4.79; N, 38.07. С14Н14N8. Найдено, (%): С, 57.24; Н, 5.02; N, 37.86. 1Н ЯМР (СDСl3), δ: 2.71 с (3Н, 3Pz-СН3); 2.61 с (3Н, 5Pz-CH3); 6.11 с (1Н, 4Pz-CH3); 7.34-7,43 м (3Н, Наром); 7.74-7,80 м (2Н, Наром); 8,17 с (1Н, N=CH); 9,57 с (1Н, NH).
Пример 3
N-[6-(3,5-Диметилпиразол-1-ил)-s-тетразин-3-ил]-N'-(3,4-диметоксибензилиден)-гидразин
(Соединение формулы А, где R2=Н, R3=3,4-диметоксифенил)
Получают аналогично примеру 18 из 1.0 ммоль 3-гидразино-6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразина и 1.0 ммоль 3,4-диметоксибензальдегида.
Выход 91%. Т.пл. 199°С. Вычислено, (%): С, 54.23; Н, 5.12; N, 31.62. C16H18N8O2. Найдено (%): С, 54.13; Н, 5.21; N, 31.67. Спектр ЯМР 1Н (DMSO; 100 МГц; δ, м.д.): 2.25 с (3Н, 3Pz-СН3); 2.46 д (3Н, 5Pz-СН3) (J=0.6 Гц); 3.82 и 3.84 два с (6Н, 2OСН3); 6.23 с (1Н, 4Pz-CH); 7.00-7.38 м (5Н, НAr); 8.29 с (1Н, N=CH); 12.47 с (1H, NH).
Пример 4
N-(4-Метоксибензилиден)-N'-[6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразин-3-ил] гидразин
(Соединение формулы А, где R2=Н, R3=4-метоксифенил)
Получают аналогично примеру 18 из 1.0 ммоль 3-гидразино-6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразина и 1.0 ммоль 4-метоксибензальдегида.
Выход: 97%. Т.пл. 196-197°С. Вычислено, (%): С, 55.55; Н, 4.97; N, 34.55. C15H16N8O.
Найдено, (%): С, 55.68; Н, 4.99; N, 34.51. 1Н ЯМР (DMSO-d6), δ: 2.25 с (3Н, 3Pz-СН3); 2.46 с (3Н, 5Pz-CH3); 6.23 с (1Н, 4Pz-CH3); 6,98-7,09 д (2Н, Наром) (9); 7,66-7,78 д (2Н, Наром) (9); 8,31 с (1Н,=СН); 12,42 с (1Н, NH).
Пример 5
N-(4-Нитробензилиден)-N'-[6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразин-3-ил]гидразин
(Соединение формулы А, где R2=Н, R3=4-нитрофенил)
Получают аналогично примеру 17 из 1.0 ммоль 3-гидразино-6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразина и 1.0 ммоль 4-нитробензальдегида.
Выход: 94%. Т.пл. 219-220°С. Вычислено, (%): С, 49.56; Н, 3.86; N, 37.15. С14Н13N9О2.
Найдено, (%): С, 49.68; Н. 3.97; N, 37.08. 1H ЯМР (DMSO-d6), δ: 2.26 с (3Н, 3Pz-СН3); 2.49 д (3Н, 5Pz-CH3) (J 0.6 Гц); 6.25 с (1Н, 4Pz-CH3); 7,98-8,07 м (2Н, Наром.); 7,27-8,36 м (2Н, СНаром.); 8,45 с (1Н,=СН); 12,86 с (1Н, NH).
Пример 6
N-[6-(3,5-Диметилпиразол-1-ил)-1,2,4,5-тетразин-3-ил]-N'-(3,4,5-триметокси-бензилиден)-гидразин
(Соединение формулы А, где R2=Н, R3=3,4,5-триметоксифенил)
Получают аналогично примеру 18 из 1.0 ммоль 3-гидразино-6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразина и 1.0 ммоль 3,4,5-триметоксибензальдегида.
Выход 95.5%, Т.пл. 190°С. Вычислено, (%): С, 53.12; Н, 5.24; Н 29.15. C17H20N8O3.
Найдено (%): С, 52.85; Н, 5.11; N, 28.92. Спектр ЯМР 1Н (DMSO-d6, δ): 2.25 с (3Н, 3Pz-СН3); 2.47 с (3Н, 5Pz-CH3); 3.72 с (3Н, р-ОСH3); 3.86 с (6Н, 2m-ОСН3); 6.23 с (1Н, 4Pz-CH); 7.08 с (2Н, НAr); 8.28 с (1Н, CH=N); 12.60 с (1Н, NH).
Пример 7
N-[6-(3,5-Диметилпиразол-1-ил)-1,2,4,5-тетразин-3-ил]-N'-(4-гидрокси-3-метоксибензилиден)-гидразин
(Соединение формулы А, где R2=Н, R3=4-гидрокси-3-метоксифенил)
Получают аналогично примеру 18 из 1.0 ммоль 3-гидразино-6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразина и 1.0 ммоль 4-гидрокси-3-метоксибензальдегида.
Выход 93%. Т.пл. 230-231°С. Вычислено, (%): С, 52.94; Н, 4.74; N, 32.92. C15H16N8O2. Найдено, (%): С, 51.60; Н, 5.03; N, 33.60. Спектр ЯМР 1Н (DMSO; 100 МГц; δ, м.д.): 2.24 с (3Н, 3Pz-СН3); 2.45 с (3Н, 5Pz-CH3); 6.22 с (1Н, 4Pz-CH); 6.82-6.90 м (1Н, НAr); 7.10-7.20 м (1Н, НAr); 7.35 уш.с (1Н, НAr); 8.25 с (1Н, N=CH); 9.6 с (1Н, ОН); 12.3 уш.с (1H, NH).
Пример 8
N-[6-(3,5-Диметилпиразол-1-ил)-1,2,4,5-тетразин-3-ил]-N'-(3-фенилаллилиден)-гидразин
(Соединение формулы А, где R2=Н, R3=1-фенилпропен-1-ил)
Получают аналогично примеру 17 из 1.0 ммоль 3-гидразино-6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразина и 1.0 ммоль коричного альдегида.
Выход 91%. Т.пл. 193-195°С. Вычислено, (%): С, 59.99; Н, 5.03; N, 34.98. C16H16N8. Найдено, (%): С, 59.93; Н, 5.07; N, 34.95. Спектр ЯМР 1Н (DMSO-d6/CCl4; 400 МГц; δ, м.д.): 2.24 с (3Н, 3Pz-СН3); 2.45 с (3Н, 5Pz-CH3); 6.22 с (1Н, 4Pz-CH); 7.08-7.13 м (2Н, 2СН); 7.36-7.50 м (3Н, НAr); 7.62-7.69 м (2Н, НAr); 8.18 м (1Н, СН-СН-СН); 12.5 уш.с (1H, NH).
Пример 9
N-[6-(3,5-Диметилпиразол-1-ил)-1,2,4,5-тетразин-3-ил]-N'-(фуран-2-илметилиден)-гидразин
(Соединение формулы А, где R2=Н, R3=фуран-2-ил)
Получают аналогично примеру 17 из 1.0 ммоль 3-гидразино-6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразина и 1.0 ммоль фурилальдегида.
Выход 92%. Т.пл. 188-189°С. Вычислено, (%): С, 50.70; Н, 4.25; N, 39.42. C12H12N8O. Найдено, (%): С, 50.86; Н, 4.20; N, 39.34. Спектр ЯМР 1Н (DMSO; 400 МГц; δ, м.д.): 2.27 с (3Н, 3Pz-СН3); 2.50 с (3Н, 5Pz-CH3); 6.13 с (1Н, 4Pr-CH); 6.56-6.58 м (1Н, НAr); 6,87 д (1Н, НAr) (J=3.4 Гц); 6.87 д (1Н, НAr) (J=3,4 Гц); 7.73 д (1Н, НAr) (J=1.6 Гц); 8.20 с (1Н, N=CH); 12.46 c (1H, NH)
Пример 10
N-[6-(3,5-Диметилпиразол-1-ил)-1,2,4,5-тетразин-3-ил]-N'-пиридин-4-илметилиден-гидразин
(Соединение формулы А, где R2=Н, R3=пиридин-4-ил)
Получают аналогично примеру 17 из 1.0 ммоль 3-гидразино-6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразина и 1.0 ммоль 4-пиридинальдегида.
Выход 91.7%. Т.пл. 224°С. Вычислено, (%): С, 52.87; Н, 4.44; N, 42.69. С13Н13N9. Найдено, (%): С.52.13; Н, 4.57; N, 42.90. Спектр ЯМР 1Н (CDCl3; 100МГц; δ, м.д.): 2.40 с (3Н, 3Pz-СН3); 2.66 д (3Н, 5Pz-СН3) (J=0.8 Гц); 6.16 с (1Н, 4Pz-СН); 7.67 с (2Н, НAr); 8.10 с (1Н, CH=N); 8.75 д (2Н, НAr); 9.52 с (1Н, NH)
Пример 11
N-[6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразин-3-ил]-N'-пиридин-3-илметилен-гидразин
(Соединение формулы А, где R2=Н, R3=пиридин-3-ил)
Получают аналогично примеру 17 из 1.0 ммоль 3-гидразино-6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразина и 1.0 ммоль 4-пиридинальдегида.
Выход: 94.3%. Т.пл. 232°С. Вычислено, (%): С, 52.87; Н, 4.44; N, 42.69. C13H13N9.
Найдено, (%): С, 52.85; Н, 4.26; N, 42.96. 1H ЯМР (DMSO-d6/CCl4), δ): 2.28 с (3Н, 3Pz-СН3); 2.52 с (3Н, 5Pz-CH3); 6.14 с (1Н, 4Pz-CH3); 7,34-7,50 м (1Н, Н5); 8,15-8,27 и 8,51-8,59 оба м (по 1Н, Наром); 8,86д (1Н, Н6) (1,6); 8,37 с (1Н,=СН); 12,63 с (1Н, NH).
Пример 12
N-[6-(3,5-Диметилпиразол-1-ил)-1,2,4,5-тетразин-3-ил]-N'-(изопропилиден)-гидразин
(Соединение формулы А, где R2=метил, R3=метил)
Получают аналогично примеру 18 из 1.0 ммоль 3-гидразино-6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразина и 1.0 ммоль ацетона.
Выход 90%. Т.пл. 121°С. Вычислено, (%): С, 48.77; Н, 5.73; N, 45.50. C10H14N8. Найдено, (%): С, 48.71; Н, 5.69; N, 45.30. Спектр ЯМР 1Н (СDСl3; 400 МГц; δ, м.д.): 2.08 и 2.21 оба с (по 3Н, 2СН3); 2.36 с (3Н, 3Pz-СН3); 2.59 с (3Н, 5Pz-CH3); 6.12 с (1Н, 4Pz-CH); 8.62 c (1H, NH).
Пример 13
N-[6-(3,5-Диметилпиразол-1-ил)-1,2,4,5-тетразин-3-ил]-N'-(1-фенилэтилидено-гидразин
(Соединение формулы А, где R2=метил, R3=фенил)
Получают аналогично примеру 18 из 1.0 ммоль 3-гидразино-6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразина и 1.0 ммоль ацетофенона.
Выход 95.7%. Т.пл. 175-177°С. Вычислено, (%): С, 58.42; Н, 5.23; N, 36.35. C15H16N8. Найдено, (%): С, 58.61; Н, 5.34; N, 36.42. Спектр ЯМР 1H (СDСl3, δ, м.д, J/Гц): 8.97 (уш.с, 1Н, -NH-N=); 6.13 (с, 1Н, Н(4) в пиразолиле); 2.62, 2.46, 2.37 (все с, 9Н, 3СН3), 7.85-7.35 (м, 5Н, Аr).
Пример 14
N-[6-(3,5-Диметилпиразол-1-ил)-1,2,4,5-тетразин-3-ил]-N'-[1-(4-бромфенил)-этилидено] гидразин
(Соединение формулы А, где R2=метил, R3=4-бромфенил)
Получают аналогично примеру 18 из 1.0 ммоль 3-гидразино-6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразина и 1.0 ммоль 4-бромацетофенона.
Выход 96%. Т.пл. 189-191°С. Вычислено, (%): С, 46.52; Н, 3.90; N, 28.94. 79.2.
C15H15BrN8. Найдено, (%): С, 46.45; Н, 3.80; N, 28.95; Спектр ЯМР 1H (СDСl3, δ, м.д., J/Гц): 8.97 (уш.с, 1Н, -NH-N=); 6.14 (с, 1Н, Н(4) в пиразолиле); 7.76-7.54 (м, 4Н, Аr); 2.63, 2.40, 2.38 (все с, 9Н, 3СН3).
Пример 15
N-[6-(3,5-Диметилпиразол-1-ил)-1,2,4,5-тетразин-3-ил]-N'-[1-(4-метоксифенил)-этилидено] гидразин
(Соединение формулы А, где R2=метил, R3=4-метоксифенил)
Получают аналогично примеру 18 из 1.0 ммоль 3-гидразино-6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразина и 1.0 ммоль 4-метоксиацетофенона.
Выход 90%. Т.пл. 152-153°С. Вычислено, (%): С, 56.79; Н, 5.36; N, 33.12. C16H18N8O. Найдено, (%): С, 56.66; Н, 5.25; N, 32.92; Спектр ЯМР 1Н (СDСl3, δ, м.д., J/Гц): 8.98 (уш.с, 1Н, -NH-N=); 6.12 (с, 1Н, Н(4) в пиразолиле); 3.84 (с, 3Н, ОСН3); 2.61, 2.39, 2.36 (все с, 9Н, 3СН3), 7.80-7.31 (м, 4Н, Аr).
Пример 16
N-[6-(3,5-Диметилпиразол-1-ил)-1,2,4,5-тетразин-3-ил]-N'-[1-(4-хлорфенил)-этилидено] гидразин
(Соединение формулы А, где R2=метил, R3=4-хлорфенил)
Получают аналогично примеру 18 из 1.0 ммоль 3-гидразино-6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразина и 1.0 ммоль 4-хлорацетофенона.
Выход 97%. Т.пл. 182-184°С. Вычислено, (%): С, 52.55; Н, 4.41; N, 32.69. C15H15ClN8. Найдено, (%): С, 52.29; Н, 4.33; N, 32.55; Спектр ЯМР 1Н (СDСl3, δ, м.д., J/Гц): 8.96 (уш.с, 1Н, -NH-N=); 6.14 (с, 1Н, Н(4) в пиразолиле); 7.87-7.34 (м, 4Н, Аr); 2.63, 2.40, 2.38 (все с, 9Н, 3СН3).
Как видно из таблиц 1-3 заявляемые соединения отличаются высокой специфичностью в отношении микобактерий, а также высокой активностью в отношении типичных, атипичных и лекарственно устойчивых штаммов микобактерий.
Таким образом, заявляемые соединения по своим характеристикам превосходят аналоги по структуре и действию и могут быть использованы в практической медицине для лечения больных, зараженных как типичными, так и атипичными микобактериями.
| название | год | авторы | номер документа |
|---|---|---|---|
| СЕЛЕКТИВНЫЕ ПРОТИВОТУБЕРКУЛЕЗНЫЕ АГЕНТЫ, ПРЕДСТАВЛЯЮЩИЕ СОБОЙ 3-АМИНОЗАМЕЩЕННЫЕ 6-(3,5-ДИМЕТИЛПИРАЗОЛ-1-ИЛ)-1,2,4,5-ТЕТРАЗИНЫ | 2012 |
|
RU2519218C2 |
| ПРОТИВОТУБЕРКУЛЕЗНЫЕ АГЕНТЫ, ПРЕДСТАВЛЯЮЩИЕ СОБОЙ 3,7-ДИЗАМЕЩЕННЫЕ [1,2,4]ТРИАЗОЛО[1,5-b][1,2,4,5]ТЕТРАЗИНЫ | 2022 |
|
RU2802300C1 |
| 6-ЗАМЕЩЕННЫЕ 3-АЗОЛИЛИМИДАЗО[1,2-b][1,2,4,5]ТЕТРАЗИНЫ, ПРОЯВЛЯЮЩИЕ ПРОТИВООПУХОЛЕВУЮ АКТИВНОСТЬ | 2013 |
|
RU2527258C1 |
| 3-ГУАНИДИНО-6-R-ТРИАЗОЛО[4,3-b][1,2,4,5]ТЕТРАЗИНЫ, ОБЛАДАЮЩИЕ АНТИБАКТЕРИАЛЬНОЙ АКТИВНОСТЬЮ | 2018 |
|
RU2663890C1 |
| ЗАМЕЩЕННЫЕ АЗОЛО[1,2,4,5]ТЕТРАЗИНЫ - ИНГИБИТОРЫ АКТИНОБАКТЕРИАЛЬНЫХ СЕРИН-ТРЕОНИНОВЫХ ПРОТЕИНКИНАЗ | 2011 |
|
RU2462466C1 |
| 3-ГУАНИДИНОАЗОЛО[1,2,4,5]ТЕТРАЗИНЫ, ОБЛАДАЮЩИЕ АНТИГЛИКИРУЮЩЕЙ АКТИВНОСТЬЮ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2017 |
|
RU2668971C1 |
| 3-ИЗОПРОПОКСИ-6-R-ИМИДАЗО[1,2-b][1,2,4,5]ТЕТРАЗИНЫ, ОБЛАДАЮЩИЕ АНТИБАКТЕРИАЛЬНОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ NEISSERIA GONORRHOEAE | 2020 |
|
RU2767869C1 |
| 4-ИЗОПРОПИЛ-6-R-ИМИДАЗО[1,2-b][1,2,4,5]ТЕТРАЗИН-3(4H)-ОНЫ, ОБЛАДАЮЩИЕ АНТИБАКТЕРИАЛЬНОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ NEISSERIA GONORRHOEAE | 2020 |
|
RU2754554C1 |
| Способ повышения урожайности сои | 2024 |
|
RU2831609C1 |
| Четвертичные аммониевые соли на основе производных витамина В6 | 2015 |
|
RU2607522C1 |
Изобретение относится к селективному противотуберкулезному агенту, представляющему собой 3-гидразоно-6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразин общей формулы А
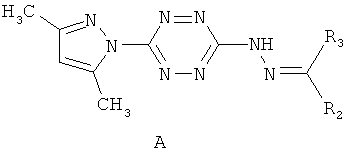
где R2=атом водорода или метил; R3=метил, арил, выбранный из возможно замещенного фенила, гетерил, выбранный из фурила, пиридила, 3-фенилаллила. Изобретение обеспечивает повышение активности и специфичность антимикобактериального действия. Изобретение также относится к способу получения 3-гидразоно-6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразина с использованием микроволнового излучения, данный способ идет с высокой скоростью и селективностью. 2 н.п. ф-лы, 3 табл., 16 пр.
1. Селективный противотуберкулезный агент, представляющий собой 3-гидразоно-6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразин общей формулы А

где R2=атом водорода или метил; R3=метил, арил, выбранный из возможно замещенного фенила, гетерил, выбранный из фурила, пиридила, 3-фенилаллила, при этом замещенный фенил имеет 1-3 заместителя, выбранных из группы, включающей бром, хлор, метокси, нитро, гидрокси-группу, n=0, 1, 2.
2. Способ получения селективного противотуберкулезного агента по п.1, включающий взаимодействие эквимолярных количеств 3-гидразино-6-(3,5-диметилпиразол-1-ил)-1,2,4,5-тетразина и арил-, гетарилальдегида, алифатического либо ароматического кетона при нагревании в среде органического растворителя, отличающийся тем, что процесс ведут под воздействием микроволнового излучения мощностью 200 Вт при температуре 55-60°С в течение 15-20 мин, а в качестве органического растворителя используют ацетонитрил.
| ЛАТОШ Н.И | |||
| и др | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Журнал органической химии, 1999, т.35, вып.9, с.1392-1400 | |||
| РУСИНОВ Г.Л | |||
| и др | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Журнал органической химии, 2006, т.42, вып.5, | |||
Авторы
Даты
2013-04-20—Публикация
2011-06-17—Подача