Настоящее изобретение относится к медицине, а именно к фотосенсибилизаторам (ФС) для фотодинамической терапии (ФДТ) злокачественных новообразований и ряда других патологических состояний.
Метод ФДТ основан на применении природных или синтетических ФС, которые обладают способностью к избирательному накоплению (тропностью) в опухолевой ткани. При облучении светом определенной длины волны ФС переходит в активированное состояние, которое инициирует образование цитотоксических агентов - синглетного кислорода и свободных радикалов, вызывающих разрушение структурных элементов опухолевой ткани.
Перспективными ФС являются производные фталоцианина. Так, препарат Фотосенс на основе сульфированного фталоцианина алюминия имеет длинноволновый максимум поглощения при λmax=675 нм с высоким коэффициентом молярной экстинкции ε (свыше 100000), высокий квантовый выход флуоресценции (патент РФ №2220722, A61K 31/409, 2004), что позволяет добиваться фотоиндуцированных некрозов на глубине до 1,0 см. Однако Фотосенс обладает недостаточно высокой селективностью накопления в опухолевых клетках, длительным сохранением в тканях, что может привести к фототоксичности кожи.
Успешное применение метода ФДТ для лечения злокачественных новообразований стимулирует поиск новых ФС с улучшенными свойствами. Наиболее перспективны для ФДТ ФС с максимумом поглощения в красном и ближнем инфракрасном диапазоне (700-800 нм), так называемом «терапевтическом окне», где собственное поглощение биологической ткани минимально, что обеспечивает возможность более глубокого проникновения излучения в ткань и, как следствие, высокую эффективность терапии (Bonnett R.J. Heterocyclic Chem. 2002. V.39. P.455-470).
Перспективными ФС для ФДТ, поглощающими в ближнем инфракрасном диапазоне спектра, являются бактериохлорины (тетрагидропорфирины). Гидрирование еще одной двойной связи в молекуле хлорина приводит к дальнейшему батохромному смещению длинноволновой полосы поглощения. Так, тукад, палладиевое производное бактериохлорина (Tookad) с максимумом поглощения при 760 нм, разрешен для лечения простаты.
Задачей предлагаемого изобретения является изыскание ФС, характеризующегося поглощением в ближнем инфракрасном диапазоне спектра, высокой тропностью к опухолевой ткани, уменьшением побочных эффектов за счет сокращения времени циркуляции в организме и обладающих высокой фотоиндуцированной активностью.
Для решения поставленной задачи синтезирован ФС, представляющий собой положительно заряженный бактериохлорин - мезо-тетра[1-(4'-бромбутил)-3-пиридил]бактериохлорина тетрабромида (3-РуВС) следующей формулы:
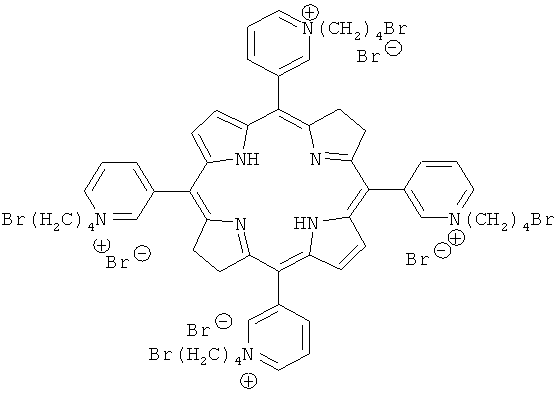
Известны ФС ряда катионных солей мезо-тетра(N-алкил-3-пиридил)бактериохлорина (US Patent 6410568, 2002). Предлагаемый ФС отличается наличием в алкильной (н-бутильной) цепи терминального атома брома. Введение атомов брома способствует увеличению вероятности интеркомбинационного перехода в триплетное состояние и тем самым увеличению выхода фотоиндуцируемого синглетного кислорода и, что более важно, позволяет провести дальнейшую кватернизацию с участием терминальных атомов брома.
3-РуВС синтезирован алкилированием мезо-тетра(3-пиридил)бактериохлорина 1,4-дибромбутаном. Исходный мезо-тетра(3-пиридил)порфирин получен конденсацией эквимолярных количеств пиррола с 3-пиридинальдегидом в кипящей уксусной кислоте в присутствии воздуха. Выделение и очистку порфирина проводили хроматографически на силикагеле хлороформом.
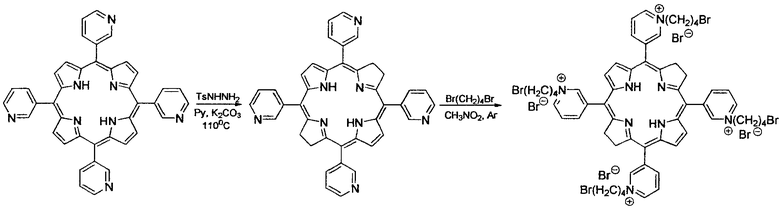
Восстановление мезо-тетра(3-пиридил)порфирина проводили диимидом, генерируемым в условиях реакции из п-толуолсульфонилгидразина в присутствии сухого поташа в сухом пиридине. Катионная водорастворимая четвертичная соль 3-РуВС получена при кипячении мезо-тетра(3-пиридил)бактериохлорина с избытком 1,4-дибромбутана в нитрометане в инертной атмосфере.
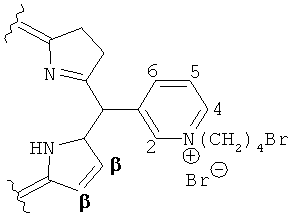
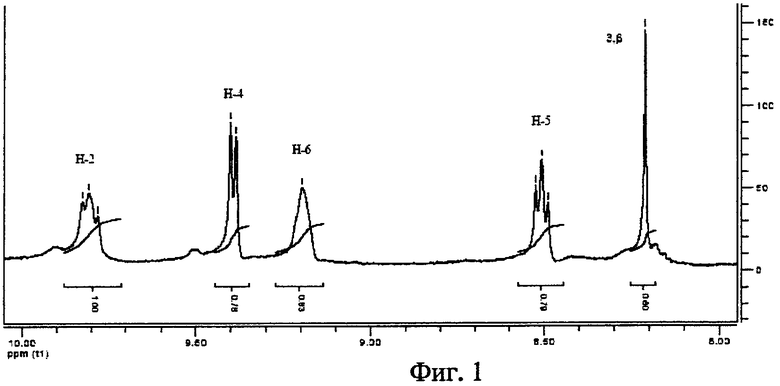
В ЭСП спектре тетракатионной соли 3-РуВС в метаноле полосы Q1 и Q2 расположены при 761 и 515 нм. На Фиг.1 приведен 1Н ЯМР спектр 3-РуВС в CD3OD в области ароматических протонов. В спектре наблюдается синглет β-пиррольных протонов при 8,21 м.д. и четыре сигнала протонов мезо-пиридиниевых колец - при 8,51 м.д. (Н-5), 9,17 м.д. (Н-6), 9,39 м.д. (Н-4) и 9,81 м.д. (Н-2).

Физико-химические и фотофизические свойства 3-РуВС
3-РуВС легко растворим в воде и водно-солевых растворах при комнатной температуре.
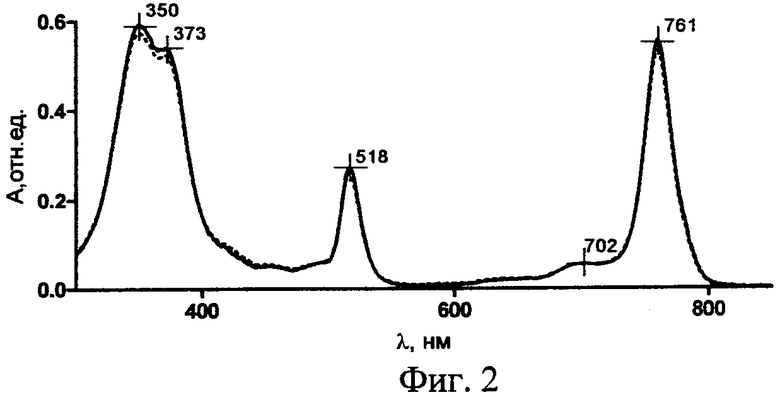
3-РуВС стабилен в водных многокомпонентных растворах в течение 6 месяцев при варьировании концентраций от 2 до 40 мкМ в темновых условиях (λmax=761 нм в спектрах поглощения λmax =751 нм в спектрах флуоресценции). На фиг.2 приведены спектры поглощения раствора 3-РуВС (5 мкМ) в 0,9% растворе NaCl сразу после растворения (сплошная линия), через месяц (штриховая линия) и через 6 месяцев (пунктирная линия) хранения при +4°C.
Фотосенсибилизатор 3-РуВС в бесклеточной среде подвержен фотовыцветанию, что сопровождается снижением интенсивности флуоресценции без изменения формы спектра.
Фотобличинг 3-РуВС наблюдали также и in vivo в процессе облучения кожи мыши, которое проводили под контролем флуоресценции. Показано снижение интенсивности флуоресценции в облученном участке до уровня фона (участок кожи без воздействия), характер спектра при этом оставался неизменным. Это происходило, по-видимому, как за счет прекращения кровотока в результате повреждения сосудов и/или образования тромбов, так и интенсивного выгорания красителя в зоне облучения и не связано с деградацией красителя в процессе облучения. После его завершения флуоресценция в облученном участке кожи начинала увеличиваться, что свидетельствовало о поступлении красителя в облученный участок из кровотока.
Фотоиндуцированная активность 3-РуВС в системе in vitro
Краситель обладал высокой фотоиндуцированной активностью в отношении опухолевых клеток человека различного эпителиального происхождения: эпидермоидной карциномы гортаноглотки (НЕр2), аденокарциномы легкого (А549) и карциномы толстой кишки (НТ29) при варьировании концентрации раствора красителя от 0,15 до 70 мкМ, времени инкубации до светового воздействия 0,5-6 часов и плотности энергии 2-10 Дж/см2. Величина ИК50, оцененная по МТТ-тесту, составляла от 0,4 до 5 мкМ.
Распределение и флуоресцентная контрастность 3-РуВС у животных с опухолями различного генеза
Оценка распределения 3-РуВС в опухолях мышей (карцинома легкого Льюис (LLC), саркома S37 (S37), меланома В16 (В16), лимфолейкоз Р388 (Р388)) и окружающей ткани, проведенная методом локальной флуоресцентной спектроскопии, показала, что фотосенсибилизатор накапливался как в опухоли, так и в окружающих тканях.
В опухолевой ткани нормированная флуоресценция (ФН) красителя достигала максимального значения через 30-60 минут после введения, а затем к 72 часам снижалась на 72%-85% от максимального значения в зависимости от гистологического типа опухоли. Наиболее высокие уровни ФН в коже и мышце наблюдались также через 30-60 минут после введения субстанции. Максимальная флуоресцентная контрастность красителя как относительно кожи, так и относительно мышцы регистрировалась через 5 секунд-30 минут после введения и составляла 2,3-3,3 усл. ед. и 1,6-2,3 усл. ед. соответственно.
Кожная фототоксичность 3-РуВС
Эффективность и безопасность фотосенсибилизатора определяется, с одной стороны, фоторазрушением опухолевой ткани, с другой стороны, фотоповреждением окружающей ткани, особенно кожи, которое происходит как во время сеанса ФДТ (характерная местная реакция кожи), так и после его завершения (общая реакция кожи при несоблюдении светового режима).
Оценка фототоксичности кожи у интактных мышей, проведенная через различные интервалы времени между введением 3-РуВС и облучением (30 минут-28 суток) показала, что фотосенсибилизатор обладает низкой кожной фототоксичностью, минимальная реакция кожи на уровне контроля зафиксирована у животных, облученных на 7-28 сутки после введения красителя. Глубокое повреждение кожи не выявлено. Наличие фоновых значений флуоресценции 3-РуВС в коже не оказывало существенного влияния на его кожную фототоксичность.
3-РуВС имеет меньшую фототоксичность кожи по сравнению с фталоцианинами [фотосенсом, фталосенсом и холосенсом (патенты РФ: 2183635, C07D 487/22, 2002 г.; 2282646, С09В 47/32, 2006 г.)].
Фотоиндуцированная противоопухолевая активность 3-РуВС у животных с опухолями различного гистогенеза
При исследовании фотоиндуцированной противоопухолевой активности 3-РуВС у животных с карциномой легкого Льюис (LLC), саркомой S37 (S37), меланомой В16 (В16), лимфолейкозом Р388 (Р388) в зависимости от дозы красителя (1,0-10,0 мг/кг), интервала между его введением и облучением (5 минут - 24 часа) и плотности энергии (50-300 Дж/см2) выявлена высокая дозозависимая противоопухолевая эффективность: ТРО составило 63,6-100%, УПЖ 26,2-48,5%, излеченность животных достигала 33,3%-100% в зависимости от опухолевой модели. Максимальный противоопухолевый эффект был получен у животных с опухолью LLC, минимальный - у мышей с меланомой В16 и лимфолейкозом Р388.
Настоящее изобретение характеризуется следующими примерами.
Пример 1
мезо-Тетра(3-пиридил)бактериохлорин. Смесь мезо-тетра(3-пиридил)порфина (0,2 г, 0,32 ммоль), п-толуолсульфонилгидразида (0,12 г, 0,65 ммоль) и сухого поташа (0,44 г, 3,2 ммоль) в 12 мл сухого пиридина нагревают при перемешивании до 108-110°C в атмосфере аргона. Перемешивание продолжают при этой же температуре в течение 12 ч, добавляя в реакционную массу через каждые 1,5 ч новую порцию п-толуолсульфонилгидразида (0,12 г, 0,65 ммоль). Далее реакционную массу охлаждают, отфильтровывают осадок, фильтрат упаривают досуха, промывают водой и сушат на воздухе. Технический продукт растворяют в хлороформе и хроматографируют на нейтральной окиси алюминия, элюируя хлороформом. Собирают первую розовую фракцию и после удаления растворителя получают 0,08 г (40%) мезо-тетра(3-пиридил)бактериохлорина. Масс-спектр (MALDI-TOF), m/z: 622,025 [М]+. ЭСП, λмакс, нм (lg ε), хлороформ: 747 (5,05), 683 (3,78), 521 (4,71), 491 (3,78), 380 (5,08), 367 (4,95), 357 (5,00).
мезо-Тетра[1-(4'-бромбутил)-3-пиридил]бактериохлорин тетрабромид. мезо-Тетра(3-пиридил)бактериохлорин (0,15 г, 0,24 ммоль) растворяют в 5 мл нитрометана и добавляют 1,5 мл 1,4-дибромбутана. Реакционную массу перемешивают при кипячении в течение 1 ч в инертной атмосфере. После охлаждения до комнатной температуры реакционную массу разбавляют 5 мл бензола и охлаждают льдом. Выпавший осадок отфильтровывают, промывают последовательно смесью нитрометан:бензол (1:1), затем бензолом и гексаном. Получают 0,24 г (66,2%) мезо-тетра[1-(4'-бромбутил)-3-пиридил]бактериохлорин тетрабромида. Электронный спектр поглощения, вода, λмакс, нм (lg ε): 763 (5,02), 702 (4,24), 518 (4,72), 374 (4,95), 351 (4,98). Электронный спектр поглощения, метанол, λмакс, нм (lg ε): 761 (5,04), 700 (3,76), 516 (4,71), 488 (3,89), 374 (4,93), 349 (4,96). Спектр 1Н ЯМР (CD3OD), δ, м.д.: 2,07-2,14 (м, 8Н, СН2), 2,38-2,45 (м, 8Н, СН2), 3,61 (т, 8Н, CH2), 4,13-4,28 (м, 8Н, β-Н), 4,94-4,98 (м, 8Н, СН2), 8,21 (с, 4Н, β-Н), 8,49-8,52 (м, 4Н, Н-5 (Ру)), 9,17 (ш, 4Н, Н-6 (Ру)), 9,39 (д, 4Н, Н-4 (Ру)), 9,78-9,83 (м, 4Н, Н-2 (Ру)).
Найдено, %: С 43,39, 43,20; Н 4,65, 4,67; N 7,31, 7,13. C56H62Br8N8×3H2O. Вычислено, %: С 43,66; Н 4,45; N 7,27.
Пример 2
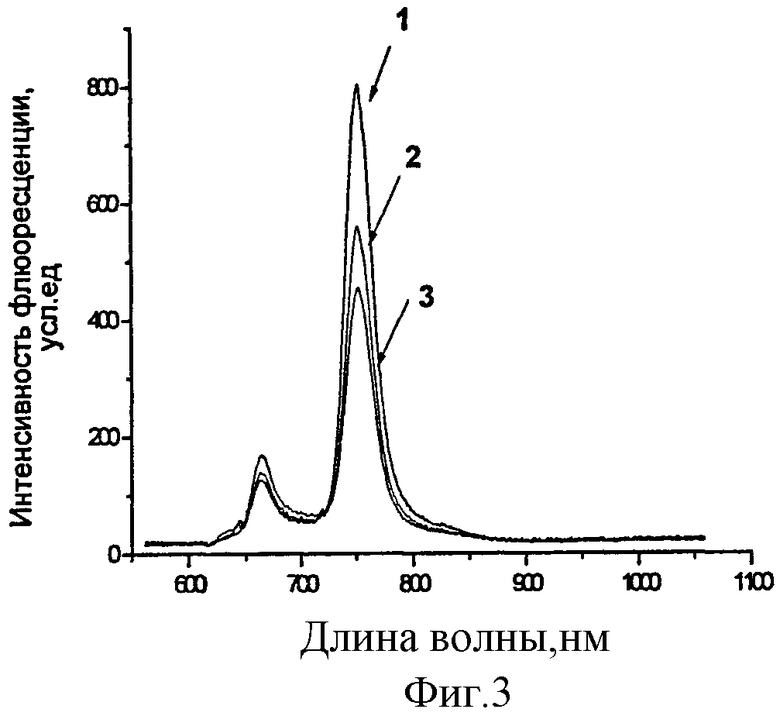
Фотовыцветание 3-РуВС в бесклеточной среде. Оценку фотовыцветания флуорохрома проводили в среде Игла, содержащей 7% ЭТС. Концентрация рабочего раствора составляла 13 мкМ. Регистрацию спектров флуоресценции проводили сразу после приготовления растворов и после светового воздействия. Световая доза составляла 5 и 10 Дж/см2, плотность мощности 16,0 мВт/см2. В качестве источника оптического излучения применяли галогеновую лампу мощностью 500 Вт с широкополосным фильтром КС-13 (λ≥640 нм) и водным фильтром толщиной 5 см. Измерения флуоресценции поводили контактным способом на лазерном спектральном анализаторе «ЛЭСА-06» (ЗАО «БИОСПЕК», Россия) в спектральном диапазоне 649-850 нм. Выявлено значительное снижение интенсивности флуоресценции в максимуме при 751 нм без изменения профиля спектра, что свидетельствовало о фотобличинге 3-РуВС в растворах при воздействии светом. На Фиг.3 приведены спектры флуоресценции 3-РуВС до воздействия светом (1), при облучении 5 Дж/см2 (2) и 10 Дж/см2 (3) в культуральной среде.
Пример 3
Фотоиндуцированная активность 3-РуВС в отношении клеток эпидермоидной карциномы гортаноглотки человека (культура клеток НЕр-2). Фотосенсибилизатор вносили в культуральную среду в концентрации от 0,4 до 15 мкМ. Время инкубации варьировали от 30 минут до 4-х часов. Облучение проводили галогеновой лампой мощностью 500 Вт с использованием широкополосного фильтра КС-13 (λ≥640 нм) и водного фильтра толщиной 5 см. Уровень ингибирования роста культуры вычисляли по формуле:
ИР(%)=[(Пк-По)/Пк]×100%
где ИР - ингибирование роста культуры, в процентах;
По и Пк - число жизнеспособных клеток, выраженное в единицах оптической плотности соответственно в опытных (с красителем) и контрольных (без красителя) пробах. Биологически значимым эффектом считали ингибирование роста культуры на 50% (ИК50).
Показано, что фотосенсибилизатор 3-РуВС обладал высокой фотоксичностью в отношении клеток культуры НЕр2. Максимальная фотоиндуцированная активность наблюдалась при 2-х часах инкубации (ИК50 составляла 0,40±0,05 мкМ), при увеличении временного интервала величина ИК50 изменялась незначительно. 3-РуВС не обладал темновой токсичностью в течение суток наблюдения (ИК50>>20 мкг/мл).
Пример 4
Распределение 3-РуВС в опухоли LLC и флуоресцентная контрастность относительно окружающей ткани. Оценку распределения 3-РуВС в опухолевой и окружающей ткани проводили у мышей с карциномой LLC в интервале от 5 секунд до 72 часов методом локальной флуоресцентной спектроскопии. Фотосенсибилизатор вводили внутривенно в эффективной (терапевтической) дозе 5,0 мг/кг. Флуоресценцию регистрировали контактным способом на лазерном спектральном анализаторе для флуоресцентной диагностики опухолей и контроля за ФДТ «ЛЭСА-06» (ЗАО «БИОСПЕК», Россия). Флуоресценцию возбуждали излучением He-Ne лазера (длина волны генерации 632.8 нм).
В опухолевой ткани LLC нормированная флуоресценция красителя достигала максимального значения через 30 минут после введения, а затем снижалась на 85% от максимального значения к 48 часам. Наиболее высокие уровни нормированной флуоресценции в коже и мышце наблюдались через 30 минут после введения субстанции. Максимальная флуоресцентная контрастность красителя как относительно кожи, так и относительно мышцы регистрировалась также через 30 минут после введения и составляла 3,3±0,7 и 2,3±0,4 усл. ед. соответственно.
Пример 5
Кожную фототоксичность 3-РуВС оценивали у интактных мышей через 30 минут (максимальное накопление красителя в коже), а также через 1, 7 и 28 суток после введения фотосенсибилизатора.
3-РуВС вводили внутривенно в одной из эффективных доз для мышей - 5,0 мг/кг. Для проведения облучения депилированного участка кожи были выбраны стандартные режимы, такие же, как и при ФДТ опухолей (плотность мощности - 100 мВт/см2, плотность энергии - 150 Дж/см2). Использовали светодиодный источник красного света, длина волны которого соответствовала максимуму поглощения красителя - 759±18 нм.
У всех животных после облучения в течение первых суток развивался отек, интенсивность которого зависела от интервала времени между введением 3-РуВС и облучением. Наиболее выраженный отек регистрировался у животных через сутки после сеанса облучения. Максимальный отек зафиксирован у мышей, облученных через 30 минут после введения красителя, при облучении через сутки размер отека резко снижался и составлял лишь 27% от максимального, через 7 и 28 суток - 10% и 4% соответственно и был соизмерим с отеком у контрольных животных (3% от максимально зафиксированного). Глубокое повреждение кожи не обнаружено.
Пример 6
Фотоиндуцированная противоопухолевая активность 3-РуВС
Исследование проведено у животных с карциномой легкого Льюис (LLC) в зависимости от дозы красителя (2,5-5,0 мг/кг). Облучение проводили светодиодным источником (759±18 нм) с плотностью мощности 100 мВт/см2 (плотность энергии 150 Дж/см2) через 30 минут после введения фотосенсибилизатора. Противоопухолевую эффективность оценивали по торможению роста опухоли (ТРО), увеличению продолжительности жизни (УПЖ) и критерию излеченности (КИ).
В течение суток после облучения у животных образовался интенсивный отек в зоне облучения, который сохранялся до 4-5 суток. После проведения облучения гибели животных отмечено не было. При использовании тетрабромидного производного бактериохлорина в дозе 2,5 мг/кг ТРО составило 70,9-100%, УПЖ не достигало биологически значимого уровня, излеченных животных не выявлено. При увеличении дозы до 3,75 мг/кг наблюдалось увеличение эффективности. ТРО составляло уже 94,4-100%, УПЖ - 48,5%, КИ - 33,3%. Для дозы 5,0 мг/кг выявлена еще более высокая эффективность: 100% торможение роста опухоли и 100% излеченность животных (в течение 120 суток наблюдения).
Таким образом, предложенный ФС обладает всеми необходимыми свойствами для его дальнейшего использования для ФДТ.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФОТОСЕНСИБИЛИЗАТОР ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2013 |
|
RU2549953C2 |
| ФОТОСЕНСИБИЛИЗАТОРЫ ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2012 |
|
RU2476218C1 |
| ПРЕПАРАТ ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ И СПОСОБ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ РАКА С ЕГО ИСПОЛЬЗОВАНИЕМ | 2012 |
|
RU2521327C1 |
| ВОДОРАСТВОРИМАЯ ЛЕКАРСТВЕННАЯ ФОРМА МЕЗО-ТЕТРА(3-ПИРИДИЛ)БАКТЕРИОХЛОРИНА ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2017 |
|
RU2663900C1 |
| ФОТОСЕНСИБИЛИЗАТОР ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2013 |
|
RU2536966C1 |
| ФОТОСЕНСИБИЛИЗАТОР ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2013 |
|
RU2548726C2 |
| АМИНОАМИДЫ В РЯДУ БАКТЕРИОХЛОРОФИЛЛА A, ОБЛАДАЮЩИЕ ФОТОДИНАМИЧЕСКОЙ АКТИВНОСТЬЮ, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2013 |
|
RU2548675C9 |
| СПОСОБ ПОДАВЛЕНИЯ РОСТА ОПУХОЛЕЙ | 2008 |
|
RU2383370C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ОПТИМАЛЬНЫХ РЕЖИМОВ ФЛУОРЕСЦЕНТНОЙ ДИАГНОСТИКИ И ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2008 |
|
RU2376044C1 |
| ФОТОСЕНСИБИЛИЗАТОРЫ ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2005 |
|
RU2282646C1 |
Описывается новый мезо-тетра[1-(4'-бромбутил)-3-пиридил]бактериохлорин тетрабромид формулы
 в качестве фотосенсибилизатора для фотодинамической терапии (ФДТ). Данное соединение обладает всеми необходимыми свойствами (низкой фототоксичностью, высокой фотоиндуцированной противоопухолевой активностью) для его дальнейшего использования для ФДТ. 6 пр., 3 ил.
в качестве фотосенсибилизатора для фотодинамической терапии (ФДТ). Данное соединение обладает всеми необходимыми свойствами (низкой фототоксичностью, высокой фотоиндуцированной противоопухолевой активностью) для его дальнейшего использования для ФДТ. 6 пр., 3 ил.
Мезо-тетра[1-(4'-бромбутил)-3-пиридил]бактериохлорин тетрабромид как фотосенсибилизатор для фотодинамической терапии

| Picard Nathalie et al | |||
| Photochemical @Photobiological Sciences | |||
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| US 6410568 B1 25.06.2002 | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| CN 101665496 A, 10.03.2010 | |||
| СПОСОБ ПОЛУЧЕНИЯ СУБСТАНЦИИ ФОТОСЕНСИБИЛИЗАТОРА ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2002 |
|
RU2220722C1 |
Авторы
Даты
2013-04-20—Публикация
2012-02-17—Подача