Настоящее изобретение относится к медицине, а именно к фотосенсибилизаторам (ФС) для фотодинамической терапии (ФДТ) злокачественных и других новообразований различного генезиса, а также флуоресцентной диагностики опухолевых клеток.
Метод ФДТ основан на применении природных или синтетических ФС, которые обладают способностью к избирательному накоплению (тропностью) в опухолевой ткани. При облучении светом определенной длины волны ФС переходят в активированное состояние, которое инициирует образование цитотоксических агентов - синглетного кислорода и свободных радикалов, вызывающих разрушение структурных элементов опухолевой ткани.
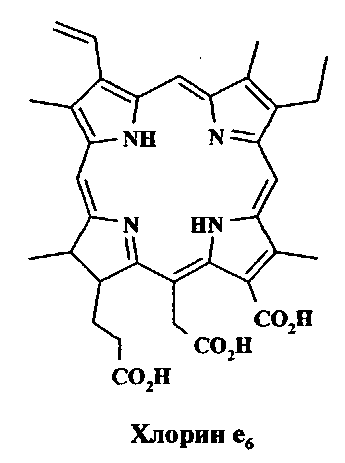
Одними из наиболее эффективных ФС являются хлорины (дигидропорфирины), имеющие в спектре поглощения интенсивную длинноволновую полосу, смещенную в красную область по сравнению с порфиринами. Все известные и официально разрешенные в РФ к применению ФС (Фотодитазин, Радахлорин и Фотолон) представляют собой водорастворимые соли хлорина е6, который является трикарбоновой кислотой, и относятся, таким образом, к анионным ФС (RU 2144538, RU 2183956, RU 2276976, RU 2276976, US 6969765, US 5330741, WO 2004/089409 A3; Чан Тхи Хай Иен, Г.В. Раменская, Н.А. Оборотова // Росс. Биотерапевт. Ж. 2009. Вып.4. С.99-104).
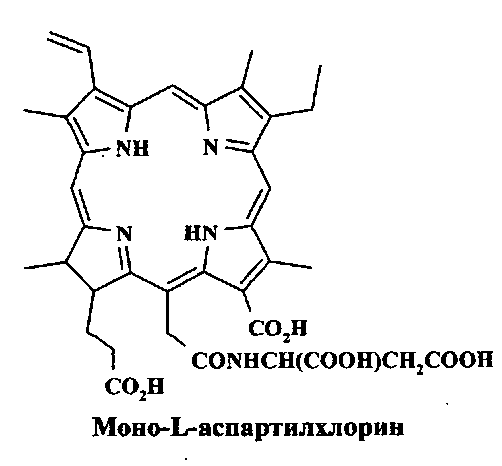
Моно-L-аспартилхлорин е6 (NPe6, Talaporfin, Laserphyrin), являющийся амидным производным хлорина е6, представляет собой тетракислоту и выпускается в виде ее натриевой соли. Он поглощает при 664 нм с молярным коэффициентом поглощения около 25000 М-1·см-1, характеризуется отсутствием кожной токсичности. Широко используются в клинической практике также синтетические хлорины - 5,10,15,20-тетракис(м-гидроксифенил)хлорин (темопорфин, m-THPC, фоскан) и полусинтетические производные бензопорфирина (бензопорфирин монокислота, кольцо А). (Н. Ali, J.E. van Lier // Chem. Rev. 1999. Vol. 99. P. 2379-2450; R. Bonnett / Chemical Aspects of Photodynamic Therapy. 2000. Gordon and Breach Sci. Publ).
5,10,15,20-Тетракис(м-гидроксифенил)хлорин (Scotia Quanta Nova) имеет максимум поглощения при 652 нм с молярным коэффициентом поглощения 22400 M-1·см-1, квантовый выход генерации 1О2 0,43). Наиболее активный из известных ФС - доза до 0,1 мг/кг, обладает низкой токсичностью (LD50>3 мг/кг) и не мутагенен. Используется в смеси ПЭГ, спирта и воды или в мицеллярном растворе поверхностно-активных веществ (ПАВ). Обладает длительной кожной токсичностью, для повышения эффективности рекомендуется использовать через 7-9 дней после введения.
Бензопорфирин монокислота, кольцо A (BPD, QuadraLogic Technologies) с максимумом поглощения при 690 нм (ε=33000 М-1·см-1), нерастворим в воде и используется в виде липосомальных композиций или масляных эмульсий для лечения рака кожи и псориаза. Под названием Визудин разрешен для лечения субретинальной неоваскулярной мембраны (СНМ).
Однако перечисленные выше ФС, как и множество других известных, обладают, как правило, теми или иными недостатками, ограничивающими их практическое применение, главным их которых является недостаточно высокая эффективность лечения. Так, ТРО при их использовании и излеченность животных не достигают 100%-ных значений.
Задачей настоящего изобретения является поиск новых ФС на базе амидопроизводных хлорина е6, превосходящих по своей эффективности ФС, применяемые в клинической практике. Для решения поставленной задачи синтезировано диамидопроизводное хлорина е6 (Chle6-диамид) следующего строения:
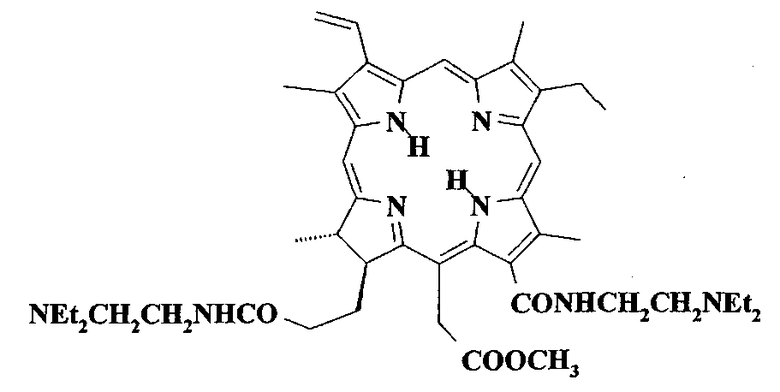
В отличие от большинства перечисленных выше анионных ФС заявляемое соединение является нейтральным и, как следствие, водонерастворимым. Поэтому для его применения в качестве ФС для ФДТ необходимо использовать средства доставки, в частности ПАВ (например, неионогенный Cremophor EL). Особенностью структуры заявляемого соединения является наличие в молекуле двух основных третичных диалкиламиногрупп, присутствие которых позволяет получать ФС катионного типа. Также можно ожидать повышения селективности накопления в опухоли, благодаря ее более высокой кислотности по сравнению с нормальной тканью.
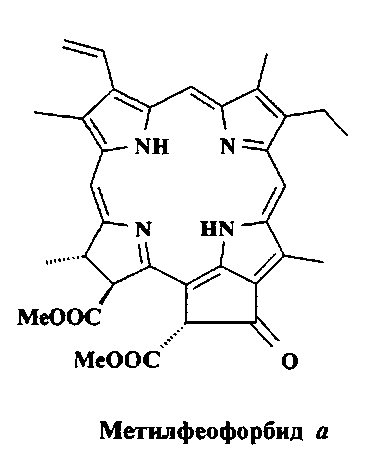
В качестве исходного соединения для получения ФС был выбран метилфеофорбид а. Известно, что метилфеофорбид а реагирует с аминами с раскрытием экзоцикла и образованием вначале 17-амидопроизводных и дальнейшим амидированием карбалкоксигрупп вплоть до 13,15,17-тризамещенных (Д.В. Белых, Л.П. Карманова, Л.В. Спирихин, А.В. Кучин // Ж. Орг. Хим. 2007. Т.43. Вып. 1. С. 120-128; Д.В. Белых, Е.А. Копылов, И.В. Груздев, А.В. Кучин // Ж. Орг. Хим. 2010. Т.46. Вып.4. С.584-592; Г.В. Пономарев, М.А. Каплан, В.И. Поспелов, И.Ю. Круглов, М.Ю. Ахлебинин. Патент РФ 2416614 (2011); 20.04. Опубл. №11, 2011). В частности, известно, что метилфеофорбид образует с этилендиамином 2-аминоэтилпроизводные.
Предлагаемое изобретение иллюстрируется следующими рисунками:
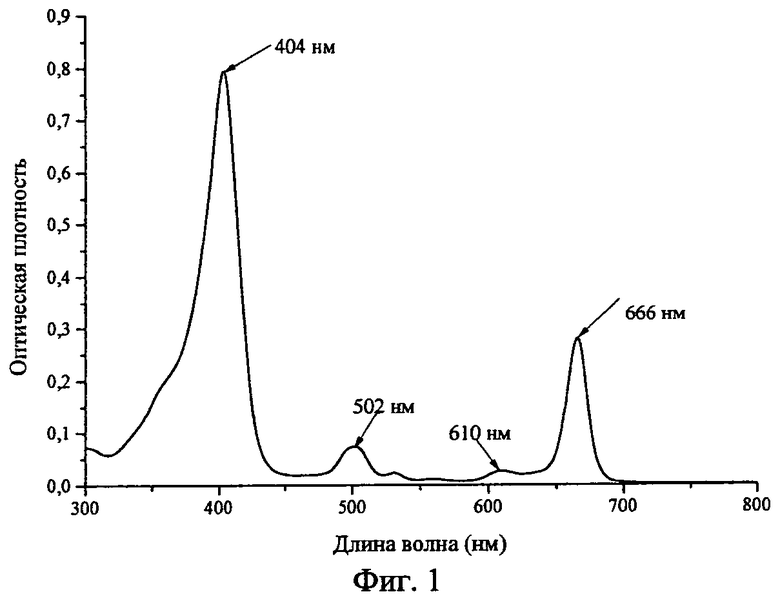
Фиг.1 - Спектр поглощения раствора 0,396 мг/мл Chle6-диамида в 4%-ом Cremophor EL (l=0,02 см).
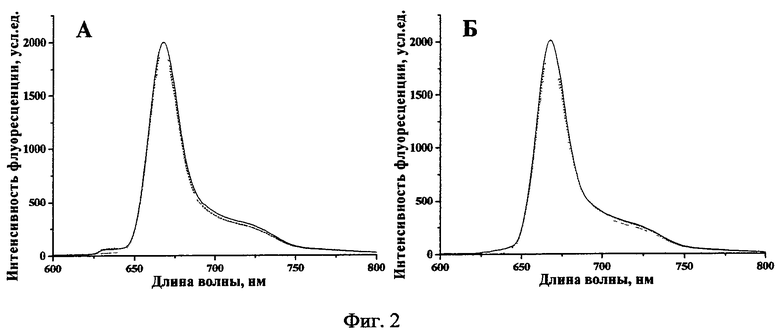
Фиг.2. - Спектры флуоресценции Chle6-диамида в 0,9% растворе NaCl (А) и содержащей 10% ЭТС среде Игла MEM (Б) при инкубации в темновых условиях (сплошная - ex tempore, пунктирная - 2 ч инкубации, точечная - 24 ч инкубации).
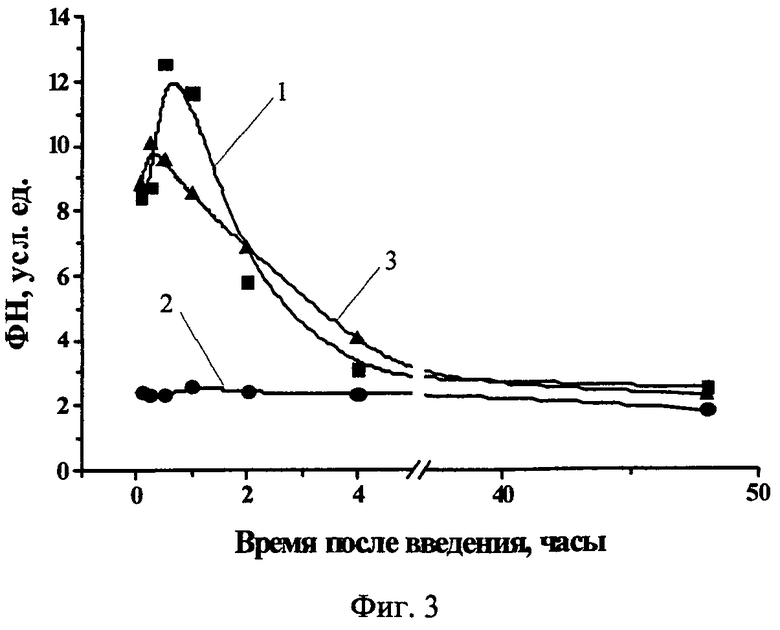
Фиг.3 - Нормированная флуоресценция Chle6-диамида в опухоли S37 и окружающих тканях в дозе 5 мг/кг (1 - опухоль, 2 - кожа, 3 - мышца).
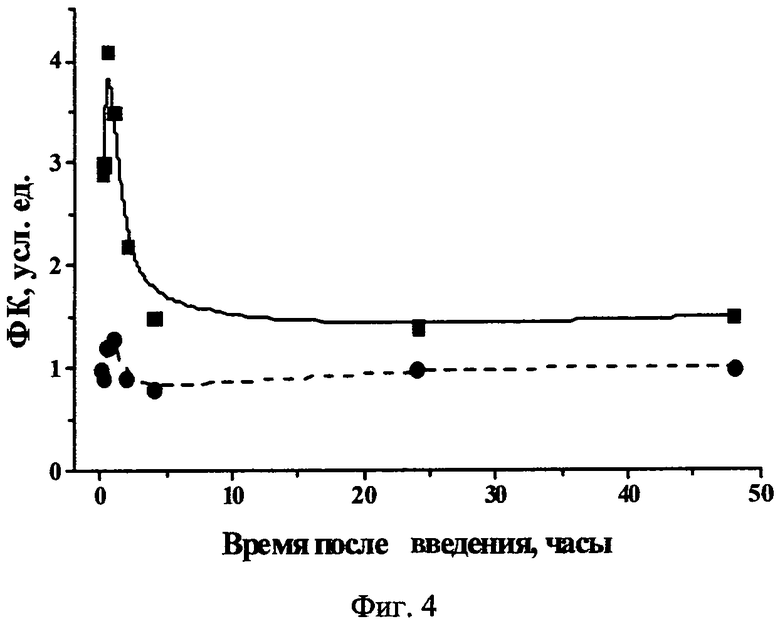
Фиг.4 - Флуоресцентная контрастность Chle6-диамида в опухоли S37 относительно окружающих здоровых тканей (сплошная - относительно нормальной кожи через 30 мин после введения, пунктирная - относительно мышцы через 30-60 мин после введения).
Фиг.5 - Фотоиндуцированная противоопухолевая активность ФС у мышей с саркомой S37 в зависимости от дозы (1-1,0 мг/кг, 2-2,5 мг/кг, 3-5,0 мг/кг).
Предлагаемое изобретение также иллюстрируется нижеприведенными примерами, но не ограничивается ими.
Пример 1. Получение 15-метилового эфира 13,17-бис(N,N-диэтиламиноэтиламида) хлорина е6 (Chle6-диамид)
Раствор 0,560 г метилфеофорбида а в 4,2 мл N,N-диэталэтилендиамина нагревали (без доступа света) при температуре от 32 до 37°C в течение 20 часов. Раствор выливали в 400 мл гексана, выпавший осадок отфильтровывали и сушили на фильтре, затем подвергали хроматографической очистке на силикагеле. После элюирования примесей хлороформом и смесью хлороформ - метанол в объемных соотношениях 30:1, используя в качестве элюента смесь хлороформ - метанол - триэтиламин в объемных соотношениях 10:1:0.15 вымывали диамидное производное, растворитель отгоняли досуха в вакууме при внешнем обогреве не выше 45°C, остаток промывали гексаном, сушили в вакууме при комнатной температуре. Получили чистый продукт в количестве 0,52 г (выход 69,3%). Соединение растворимо в хлороформе, хлористом метилене, ароматических углеводородах, ацетоне, спирте, нерастворимо в воде. ИК спектр обнаруживает интенсивную амидную полосу при 1651,3 см-1 и менее интенсивную полосу при 1734,2 см-1, принадлежащую эфирной группе. МАЛДИ масс-спектр, m/z 807,522 [М], вычислено М 807,11. Электронный спектр поглощения (хлороформ), λ max., нм (lg ε): 291 (3,94), 404 (5,17), 502 (4,13), 529 (3,57), 608 (3,66), 664 (4,66).; 290 (3,98), 403 (5,11), 501 (4,07), 531 (3,62), 609 (3,63), 663 (4,60).
Пример 2. Приготовление раствора Chle6-диамида в 4%-ном Cremophor EL
Навески Chle6-диамида (3,96 мг) и неионогенного ПАВ Cremophor EL (0,4 г) растворяли в 20 мл хлороформа. Перемешивали раствор в круглодонной колбе объемом 1 л магнитной мешалкой, нагревая до 40-45°C для интенсификации процесса растворения. Затем упаривали растворитель на роторном испарителе в вакууме при температуре водяной бани 30-40°C. Образовавшуюся пленку досушивали в вакууме, после чего гидратировали добавлением 10 мл фосфатного буферного раствора (PBS) с pH=7,34. Перемешивание осуществляли до полного растворения пленки; полученный раствор фильтровали через мембранный фильтр (Millipore, Type GS) с размером пор 0,22 мкм. Все стадии приготовления раствора проводили без доступа света.
Растворы хранили при температуре 6-10°C в защищенном от света месте. Спектр поглощения раствора 0,396 мг/мл Chle6-диамида в 4%-ном Cremophor EL приведен на Фиг.1 (регистрировали относительно 4%-го раствора Cremophor EL в кювете l=0,02 см).
Пример 3. Стабильность Chle6-диамида в динамике
Оценку стабильности ФС проводили с помощью абсорбционного и флуоресцентного методов анализа. Растворы для проведения исследований готовили ех tempore, достигая выбранной концентрации (3,1 мкМ для флуоресцентного анализа и 12 мкМ для абсорбционного анализа) путем последовательных разведений исходного раствора. Спектры поглощения регистрировали на спектрофотометре «Genesys 2» (США) в диапазоне длин волн от 600 до 900 нм. Регистрацию флуоресценции растворов проводили в динамике контактным способом на лазерном спектральном анализаторе для флуоресцентной диагностики опухолей «ЛЭСА-6» (ТОО «БиоСпек», Россия). Флуоресценцию возбуждали He-Ne лазером с длиной волны генерации 632,8 нм, спектральный диапазон измерения от 600 до 950 нм.
Раствор Chle6-диамида стабилен в течение суток инкубации в 0,9% растворе NaCl и среде Игла MEM с содержанием 10% эмбриональной телячьей сыворотки (ЭТС) в темновых условиях. В выбранном временном диапазоне не выявлено ни сдвигов Q-полосы, ни уменьшения оптической плотности и интенсивности флуоресценции, сохранялась симметрия основной полосы (Табл.1, Фиг.2).
Пример 4. Фотоиндуцированная активность Chle6-диамида в отношении клеток культуры HEp2
Исследования проводили на опухолевых клетках человека - эпидермоидной карциноме гортаноглотки (НЕр2), которые получены из Института вирусологии им. Д.И. Ивановского РАМН. Клетки культивировали при 37°C в увлажненной атмосфере, содержащей 5% CO2.
Клетки рассевали в лунки плоскодонного 96-луночного микропланшета в концентрации 65 тыс кл./мл. Тестируемый раствор красителя вносили в лунки через 24 часа после посева, варьируя концентрацию от 0,025 до 6,20 мкМ. Для оценки фототоксичности через 0,5, 2 и 4 часов инкубации с Chle6-диамидом клетки облучали галогеновой лампой через широкополосный фильтр КС-10 (λ≥640 нм). Плотность мощности составляла 36,8±1,0 мВт/см2, расчетная световая доза - 10 Дж/см2. После облучения клетки инкубировали в течение суток в стандартных условиях. Оценку выживаемости определяли визуально и колориметрическим методом с использованием МТТ-теста. Биологически значимым эффектом считали ингибирование роста клеток в культуре более чем на 50% (средняя величина по результатам трех независимых тестов).
Выявлено, что Chle6-диамид проявил максимальную фотоиндуцированную активность относительно клеток культур НЕр2 при 2-часовой инкубации, ИК50 составляла 74±3 нМ, с увеличением времени инкубации до 4 часов величина ИК50 практически не изменялась и составляла 89±4 нМ.
Таким образом, Chle6-диамид обладает высокой фотоиндуцированной активностью in vitro в отношении клеток культуры НЕр2.
Пример 5. Распределение Chle6-диамида в опухоли S37 и флуоресцентная контрастность относительно окружающей ткани
Оценку распределения Chle6-диамида в опухолевой и окружающих тканях проводили у мышей с саркомой S37 в интервале от 5 секунд до 48 часов методом (ЛФС). Раствор Chle6-диамида вводили внутривенно в дозе 5,0 мг/кг (концентрация 0,396 мг/мл в 4% CremophorEL). Флуоресценцию возбуждали излучением He-Ne лазера (λmax=632,8 нм) и регистрировали контактным способом на лазерном спектральном анализаторе для флуоресцентной диагностики опухолей и контроля за ФДТ «ЛЭСА-06».
В опухолевой ткани саркомы S37 нормированная флуоресценция (ФН) достигала максимального значения (12,5±8,5 усл. ед.) через 30 минут после введения и сохранялась на высоком уровне до одного часа, а затем к 48 часам снижалась на 80% от максимального значения. Наиболее высокий уровень ФН в коже (2,6±1,1 усл. ед.) наблюдался через 5 минут после введения ФС и сохранялся в течение 24 часов, затем к 48 часам снижалась на 31% от максимального значения. В мышце максимальная ФН (10,0±1,5 усл. ед.) регистрировалась через 15-30 минут и сохранялась на высоком уровне в течение 1 часа, а к 48 часам снижалась на 77% (Фиг.3).
Максимальная флуоресцентная контрастность Chle6-диамида относительно окружающей нормальной кожи регистрировалась через 30 минут после введения и составляла 4,1±0,7 усл. ед., а относительно мышцы - через 30-60 минут после введения и составляла 1,3±0,4 усл. ед. (Фиг.4).
Пример 6. Фотоиндуцированная противоопухолевая активность Chle6-диамида у животных с саркомой S37
Изучение фотодинамической активности композиции 0,396 мг/мл Chle6-диамида в 4% Cremophor EL проводили у животных с саркомой S37, привитой подкожно с внешней стороны правого бедра мышам F1, в зависимости от дозы Chle6-диамида на 7 сутки после инокуляции опухоли.
Chle6-диамид животным вводили однократно внутривенно в хвостовую вену в дозах 1,0, 2,5 и 5,0 мг/кг. Облучение проводили через 30 минут после введения светодиодным источником (ФГУП «ГНЦ «НИОПИК») с длиной волны 662±14 нм и плотностью мощности 100 мВт/см2 (плотность энергии 90 Дж/см2). Контрольная группа животных - без воздействия.
Эффективность ФДТ оценивали, используя общепринятые в экспериментальной онкологии критерии:
- торможение роста опухоли ТРО=[(Vк-Vоп)/Vк]·100%, где Vоп и Vк - объем опухоли в опытной и контрольной группах соответственно;
- критерий излеченности КИ=[Nи/Nо]·100%, где Nи и Nо - количество излеченных животных и общее количество животных в опытной группе соответственно.
Объем опухоли рассчитывали по формуле: V=d1·d2·d3, где d1, d2 и d3 - три взаимно перпендикулярных диаметра опухоли.
Измерение объема опухоли проводили в течение 21 суток после проведенного облучения с помощью электронного цифрового кронциркуля STORMtm 3С301 «Central». За животными наблюдали 50 суток.
В опытных группах в течение суток после облучения у животных образовывался интенсивный отек в зоне воздействия, который сохранялся до 5-10 суток. При использовании ФС в дозе 1,0 мг/кг среднее значение объема опухоли увеличивалось медленно по сравнению с объемом опухоли контрольной группы. ТРО составило 78,6-100%, КИ - 25,0%. Для дозы 2,5 мг/кг противоопухолевая эффективность значительно выше: ТРО составило 98,8 - 100%, КИ - 75,0%. При использовании дозы 5,0 мг/кг выявлена максимально высокая эффективность: 100% ТРО в течение всего срока наблюдения, 100% излеченность животных в течение 50 суток наблюдения (Фиг.5).
Таким образом, заявляемое диамидное производное хлорина е6, поглощающее в красной области спектра, селективно накапливается в опухолевой ткани (флуоресцентная контрастность относительно здоровой кожи - 4,1±0,7 усл. ед.) и обладает высокой фотоиндуцированной противоопухолевой активностью, 100% торможением роста опухоли и излеченностью животных до 100%.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФОТОСЕНСИБИЛИЗАТОР ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2013 |
|
RU2536966C1 |
| ФОТОСЕНСИБИЛИЗАТОР ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2013 |
|
RU2549953C2 |
| ПРЕПАРАТ ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ И СПОСОБ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ РАКА С ЕГО ИСПОЛЬЗОВАНИЕМ | 2012 |
|
RU2521327C1 |
| ФОТОСЕНСИБИЛИЗАТОР ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2012 |
|
RU2479585C1 |
| АМИНОАМИДЫ В РЯДУ БАКТЕРИОХЛОРОФИЛЛА A, ОБЛАДАЮЩИЕ ФОТОДИНАМИЧЕСКОЙ АКТИВНОСТЬЮ, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2013 |
|
RU2548675C9 |
| ВОДОРАСТВОРИМАЯ ЛЕКАРСТВЕННАЯ ФОРМА МЕЗО-ТЕТРА(3-ПИРИДИЛ)БАКТЕРИОХЛОРИНА ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2017 |
|
RU2663900C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ВРЕМЕНИ МАКСИМАЛЬНОЙ КОНЦЕНТРАЦИИ ФОТОСЕНСИБИЛИЗАТОРА ХЛОРИН Е6 ЛИЗИН ДИМЕГЛЮМИНОВАЯ СОЛЬ В ОПУХОЛИ | 2019 |
|
RU2713941C2 |
| ФОТОСЕНСИБИЛИЗАТОРЫ ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2005 |
|
RU2282646C1 |
| ФОТОСЕНСИБИЛИЗАТОРЫ ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2012 |
|
RU2476218C1 |
| СПОСОБ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ ПЕРЕВИВНОЙ ОПУХОЛИ КАРЦИНОМА ЭРЛИХА МЫШЕЙ С ФОТОСЕНСИБИЛИЗАТОРОМ ХЛОРИНОВОГО РЯДА | 2022 |
|
RU2788766C2 |

Настоящее изобретение касается новых эффективных фотосенсибилизаторов для фотодинамической терапии в классе амидопроизводных хлорина е6. Предложенный фотосенсибилизатор 15-метиловый эфир 13,17-бис(N,N-диэтиламиноэтиламид)хлорина е6
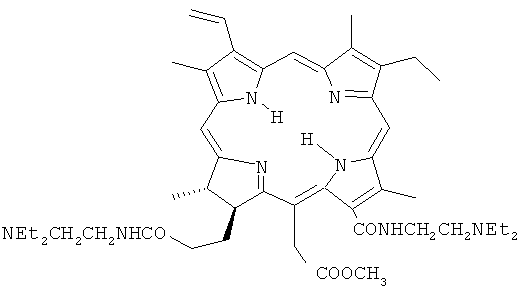
селективно накапливается в опухолевой ткани, обладает поглощением в красной области спектра и высокой фотоиндуцированной противоопухолевой активностью, 100% торможением роста опухоли и излеченностью животных до 100%. 5 ил., 1 табл., 6 пр.
15-Метиловый эфир 13,17-бис(N,N-диэтиламиноэтиламид)хлорина е6 как фотосенсибилизатор для фотодинамической терапии:
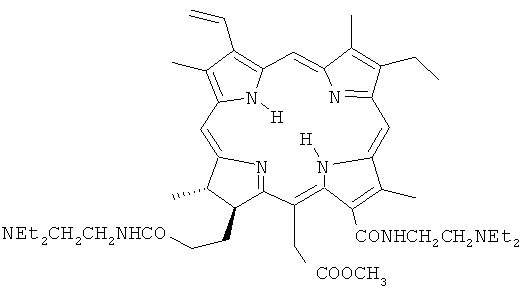
| ФОТОСЕНСИБИЛИЗАТОР И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2008 |
|
RU2367434C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ И СПОСОБ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКОГО ЗАБОЛЕВАНИЯ С ЕЕ ИСПОЛЬЗОВАНИЕМ | 2005 |
|
RU2323722C2 |
| СПОСОБ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ | 2011 |
|
RU2455039C1 |
| ФОМИНА Г | |||
| И | |||
| Автореферат «Изучение новых фотосенси-билизаторов, предназначенных для флюоресцентной диагностики и фотодинамической терапии опухолей», Москва, 2001, C.1-24  | |||
| YOSHITO TAKEUCHI | |||
Авторы
Даты
2015-04-20—Публикация
2013-12-25—Подача