Изобретение относится к области химии природных и физиологически активных веществ, а именно к области стероидных гормонов, конкретно к новым 16α,17α-циклогексанопрегненам, а именно к 6-оксимам 16α,17α- циклогексанопрегненов, содержащих оксииминогрупировку в 6-положении стероидного ядра, которые обладают цитотоксической активностью и могут найти применение в медицине для лечения злокачественных опухолей.
Известно, что выделенные в последние годы из морских организмов стероиды, так же как и синтезированные стероиды, содержащие оксиимино-группировки в различных положениях стероидного скелета, проявляют в зависимости от особенностей структуры и типа стероида широкий спектр биологического действия, включающий цитотоксическую активность [J.-G. Cuia, L. Fana, Li-L. Huanga, H.-Li Liub, A.-M. Zhoub . Synthesis and evaluation of some steroidal oximes as cytotoxic agents: Structure/activity studies (I). Steroids, 2009, 74, 62-72; J. Cuia, L. Fana, Y. Huanga, Yi Xinb, A. Zhoub. Synthesis and evaluation of some steroidal oximes as cytotoxic agents: Structure/activity studies (II). Steroids, 2009, 74, 989-95].
Синтезированные в 1959 г. авторами BABCOCK JOHN C. & ALLAN CAMPBELL J. (Steroidal 11-oximes and a process for their production , US 3064013 (A), 1962-11-13) 11-оксимы не нашли применения в медицине.
Современной терапии гормонозависимых опухолей нужны препараты, останавливающие неконтролируемую пролиферацию (рост) раковых клеток. Наряду с различными цитостатическими препаратами для этой цели широко используются прогестины и антипрогестины - модуляторы рецептора прогестерона (РП). Среди них перспективную группу представляют прегна-D′-пентараны - производные прогестерона с дополнительным карбоциклом D′ в 16α,17α-положениях стероидного скелета, обладающие прогестагенной и антипрогестагенной активностями in vivo и пригодные для перорального применения. В литературе описаны биологически активные прегна-D′6-пентараны [А.В. Камерницкий, И.С. Левина. Прегна-D'-пентараны. Прогестины и антипрогестины. Биоорган. химия, 2005, Т.31, С.115 и 227]. Но среди этих описанных стероидов неизвестны пентараны, содержащие совместно дополнительный шестичленный карбоцикл D′ в 16α,17α-положениях стероидного скелета и оксииминогруппировку в положении 6 стероидного ядра.
Задачей настоящего изобретения является создание новых стероидов, содержащих оксииминогруппировку в положении 6 стероидного ядра и шестичленное кольцо D′ в 16α,17α-положениях стероидного скелета, обладающих цитотоксической активностью.
Поставленная задача достигается новыми 6-гидроксимино-16α,17α-циклогексанопрегненами общей формулы I

где X + Y образуют вместе O или X = H, Y = OH; R = H или CH3
Предложенные соединения формулы 1 обладают цитотоксической активностью, т.е. способны ингибировать рост раковых клеток.
Предложенные соединения формулы 1 получают путем раскрытия окисного цикла в 3β-ацетокси-16α,17α-циклогексано-5α,6α-эпоксипрегнан-20-оне (2) [А.А. Ахрем, А.В. Камерницкий, И.С. Левина, Л.Е. Куликова. Синтез ∆6-6-замещенных циклогексано[1',2';16α,17α]прогестеронов. Изв. АН. Сер.хим., 444, (1978)] действием 65%-ной хлорной кислоты в тетрагидрофуране и образующийся при этом 3β-ацетокси-5α,6β-дигидрокси-16α,17α-циклогексанопрегнан-20-он (3) окисляют реактивом Джонса (CrO3-H2SO4-H2O) в ацетоне с образованием 3β-ацетокси-5α-гидрокси-16α,17α-циклогексанопрегнан-6,20-диона (4), который подвергают взаимодействию с хлористым тионилом в пиридине с последующей обработкой и гидролизу полученного при этом 3-ацетата 16α,17α-циклогексанопрегн-4-ен-6,20-диона(5) водным раствором щелочи в метаноле с образованием 3β-гидрокси-16α,17α-циклогексанопрегн-4-ен-6,20-диона (6) и последующим его взаимодействием с солянокислым гидроксиламином с образованием 6(E)-гидроксиимино-16α,17α-циклогексанопрегн-4-ен-3β-ол-20-она 1a либо с солянокислым O-метилгидроксиламином с образованием 6(E)-метоксииимино-16α,17α-циклогексанопрегн-4-ен-3β-ол-20-она 1b. После окисления последних с помощью пиридинийдихромата (PDC) в пиридине получены соответствующие 3-кетоны 6(E)-гидроксиимино-16α,17α-циклогексанопрегн-4-ен-3,20-диона 1c и 6(E)-метоксиимино-16α,17α-циклогексанопрегн-4-ен-3,20-диона 1d по приведенной ниже схеме:
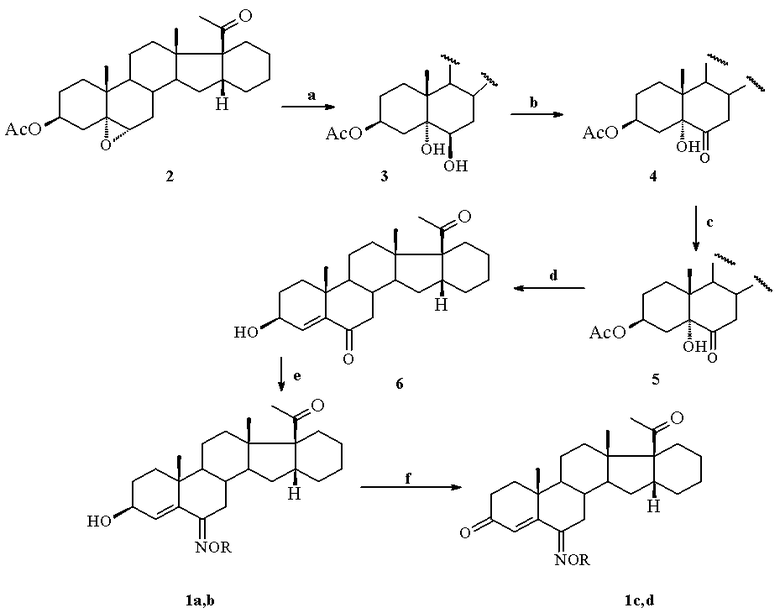
a) HClO4/THF, 20°C; b) CrO3-H2SO4-H2О/ацетон, 5 -10°C; c) SOCl2/Py, °C; d) KOH/MeOH ; e) NH2OH·HCl или NH2OMe·HCl, Py, EtOH, RT; f) PDC, Py, RT.
Структуры всех полученных соединений следуют из данных физико-химического анализа. E-Конфигурации 6-оксимам 1a - 1d были приписаны на основании характерного сигнала экваториального протона при С(7) в виде дублета с δ 3,33 м.д. (J= 14,0 и 4,0 Гц).
Изобретение иллюстрируется следующими примерами.
Пример 1. A. К раствору 5,0 г (11,7 ммоль) 3β-ацетокси-16α,17α-циклогексано-5α,6α-эпоксипрегнан-20-она (2) в 170 мл ТГФ прибавили при перемешивании 0.25 мл 65%-ной HClO4 и выдержали при 20°C 30 мин. Реакционную смесь нейтрализовали 5%-ным водным раствором NaHCO3, ТГФ удалили в вакууме и остаток растворили в 100 мл CHCl3. После обычной обработки получено 4.98 г (колич.) 3β-ацетокси-5α,6β-дигидрокси-16α,17α-циклогексанопрегнан-20-она (3). Аналитический образец имеет т.пл. 272-274 °C (из смеси ацетон-гексан). Спектр ЯМР 1H (δ, м.д.): 0,70; 1,19; 2,03; 2;14 (все с, по 3H, С(18)Ме, С(19)Ме, С(3)OAc, С(21)Ме), 2,98 (м, 1H, С(16)H), 5,16 (м, 1H, С(3)H). Масс-спектр, m/z (Iотн (%)): 446 (4) [M]+; 368 (5) [M-AcOH-H2O]+; 307 (32) [M-- AcOH -H2O- Ac]+.
B. Диол 3 (4,90 г, 11 ммоль) в 150 мл ацетона окисляли 5 мл реактива Джонса (получен из 26,72 г CrO3, 23 мл конц. H2SO4 и H2O до 100 мл) при 10°C. Реакционную смесь вылили в воду и экстрагировали CHCl3 (2×50 мл). Остаток, полученный после обычной обработки, хроматографировали. Градиентное элюирование смесью ацетон-петр.эфир (8:92→12:88) дало 3,27 г (67%) 3β-ацетокси-5α-гидрокси-16α,17α-циклогексанопрегнан-6,20-диона (4) с т.пл. 248-250 °C (из смеси ацетон-гексан). Спектр ЯМР 1H (δ, м.д.): 0,66; 0,82; 2,01; 2,14 (все с, по 3H, С(18)Ме, С(19)Ме, С(3)OAc, С(21)Ме), 2,80 (т, 1H, С(7)H, J=15 Гц))H 2.98 (м, 1H, С(16)H), 5,05 (м,1H, С(3)H). Масс-спектр, m/z (Iотн (%)): 444 (12) [M]+; 384 (9) [M-AcOH ]+; 366 (12) [M-- AcOH -H2O]+, 323 (73) [M-- AcOH -H2O- Ac]+.
C. К раствору 0,75 г (1,69 ммоль) 3β-ацетокси-5α-гидрокси-16α,17α-циклогексанопрегнан-6,20-диона (4) в 9 мл абс.Py прибавили 0,3 мл (4,1 ммоль) SOCl2 при 0°C и смесь перемешивали при этой температуре 1 ч. Затем реакционную смесь вылили в 100 мл воды и экстрагировали EtOAc (3×35 мл). Объединенные органические экстракты промыли 25 мл 10%-ной HCl и насыщенным водным раствором NaCl. Остаток после обычной обработки перекристаллизовали из MeOH. Получено 0.5 г (69%) 3β-ацетокси-16α,17α-циклогексанопрегн-4-ен-6,20-диона (5), т.пл. 184-6 °C. Спектр ЯМР 1H (δ, м.д.): 0,70; 1,02; 2,07; 2,14 (все с, по 3H, С(18)Ме, С(19)Ме, С(3)OAc, С(21)Ме), 2,98 (м, 1H, С(16)H), 5,32 (м,1H, С(3)H), 6,08 (уш.с., 1H, С(4)H).
D. Суспензию 0,48 г полученного соединения и 1 мл 1М водного раствора KOH в 25 мл MeOH перемешивали 45 мин при 20°C, после чего вылили в 100 мл лед.воды, выпавший порошок отфильтровали, промыли водой и высушили на воздухе. Получено 0,43 г 3β-гидрокси-16α,17α-циклогексанопрегн-4-ен-6,20-диона (6). Аналитический образец имеет т.пл. 199-202 °C (из смеси ацетон-гексан). Спектр ЯМР 1H (δ, м.д.): 0,70; 1,02; 2,14 (все с, по 3H, С(18)Ме, С(19)Ме, С(21)Ме), 2.52 (д.д., 1 H, С(7)He, 2J=13 Гц, 3J‹ 2 Гц) 2,98 (м, 1H, С(16)H), 4,23 (м,1H, С(3)H), 6,15 (уш.с., 1H, С(4)H). Масс-спектр, m/z (Iотн (%)): 484 (8) [M]+; 341 (9) [M-- Ac]+.
E. К раствору 0,38 г (1 ммоль) 3β-гидрокси-16α,17α-циклогексанопрегн-4-ен-6,20-диона (6) в 15 мл EtOH добавили 0,084 г NH2OH.HCl и 0,1 мл Py и реакционную смесь выдержали сутки при 20°C, после чего вылили в 100 мл лед.воды, выпавший осадок отфильтровали, промыли на фильтре водой и сушили на воздухе. Получено 0,36 г (89%) 6(E)-гидроксиимино-16α,17α-циклогексанопрегн-4-ен-3β-ол-20-она 1a с т.пл. 157-160°C (из смеси ацетон-гексан). Спектр ЯМР 1H (δ, м.д.): 0,70; 0,99; 2,12 (все с, по 3H, С(18)Ме, С(19)Ме, С(21)Ме), 3,00 (м, 1H, С(16)H), 3,33 м.д. (д.д., 1 H, С(7)H), 4,15 (м, 1H, С(3)H), 5,80 (уш.с., 1H, С(4)H). Масс-спектр, m/z (Iотн (%)): 399 (7) [M]+.
Пример 2. Аналогично примеру 1 из 0,14 г 3β-гидрокси-16α,17α-циклогексанопрегн-4-ен-6,20-диона (6) и 0,047 г MeONH2·HCl получено 0,12 г 6(E)-метоксиимино-16α,17α-циклогексанопрегн-4-ен-3β-ол-20-она 1b, т.пл. 223-225 °C(из смеси ацетон-гексан). Спектр ЯМР 1H (δ, м.д.): 0,70; 1,01; 2,12 (все с, по 3H, С(18)Ме, С(19)Ме, С(21)Ме), 3,00 (м, 1H, С(16)H), 3.38 м.д. (д.д., 1 H, С(7)H), 3,90 (с, 3 H, OMe); 4,18 (м, 1H, С(3)H), 5,85 (уш.с., 1H, С(4)H). Масс-спектр, m/z (Iотн (%)): 413 (11) [M]+.
Пример 3. К раствору 0,36 г (0,9 ммоль) стероида 1a в 5 мл Py добавили 0,37 г PDC и реакционную смесь перемешивали 1 ч при 20°C. Затем смесь разбавили 30 мл EtOAc и профильтровали. Фильтрат промыли 10%-ной HCl, 5%-ным водным раствором NaHCO3 и насыщенным водным раствором NaCl. Остаток после обычной обработки хроматографировали на колонке, элюирование смесью петр.эфир-ацетон (9:1). Получено 0,18 г 6(E)- гидроксиимино-16α,17α-циклогексанопрегн-4-ен-3,20-диона 1c с т.пл. 245-247 °C (из смеси ацетон-гексан). Спектр ЯМР 1H (δ, м.д.): 0,74; 1,15; 2,12 (все с, по 3H, С(18)Ме, С(19)Ме, С(21)Ме), 3,00 (м, 1H, С(16)H); 3,45 м.д. (д.д., 1 H, С(7)H); 6,45 (с, 1H, С(4)H); 9,68 (с, 1 H, NOH). Масс-спектр, m/z (Iотн (%)): 397 (9) [M]+.
Пример 4. Аналогично примеру 3 из 0,11 г 6(E)-метоксииимино-16α,17α-циклогексанопрегн-4-ен-3β-ол-20-она 1b получено 0,9 г 6(E)-метоксиимино-16α,17α-циклогексанопрегн-4-ен-3,20-диона 1d, т.пл. 209-211°C (из смеси ацетон-гексан). Спектр ЯМР 1H (δ, м.д.): 0,72; 1,15; 2,12 (все с, по 3H, С(18)Ме, С(19)Ме, С(21)Ме), 3,00 (м, 1H, С(16)H); 3,40 м.д. (д.д., 1 H, С(7)H); 6,20 (с, 1H, С(4)H). Масс-спектр, m/z (Iотн (%)):411(16) [M]+.
Пример 5. Цитостатическая активность заявляемых соединений 1a - 1d изучена на культуре HeLa (рак шейки матки человека). Для оценки их влияния на жизнеспособность клеток культуры HeLa использовался МТТ-тест [Nogueira D.R., Mitjans M., Infante M.R., Vinardell M.P. Com Int. J. Pharm. 2011. V. 420. № 1. Р.51-58]. Клетки инкубировали в течение 7 дней совместно с эстрадиолом в концентрации 10-8 моль/л и исследуемыми соединениями в концентрации 10-5-10-7 моль/л. В эксперименте использовалось два контроля: первый - клетки, стимулированные эстрадиолом 10-8 (эстрадиол-стимулированный контроль - ЭСК) и второй - клетки, инкубированные без эстрогенной стимуляции (К). Результаты МТТ-теста относительно первого контроля (ЭСК) представлены в таблице 1, второго контроля (К) - в таблице 2.
В качестве препарата сравнения использован синтетический прогестин медроксипрогестерона ацетат (МПА)
Таблица 1. Влияние соединений 1a - 1d на жизнеспособность клеток культуры HeLa, выраженное в процентах по отношению к эстрадиолстимулированному контролю (ЭСК).
1a
1b
1c
1d











Примечание : * - Достоверные отличия от ЭСК при р<0,05.
Жизнеспособность в ЭСК составила 100±10,5%
Цифры в колонках означают процент выживаемости раковых клеток в процентах к контролю.
Таблица 2. Влияние соединений 1a - 1d на жизнеспособность клеток культуры HeLa, выраженное в процентах по отношению к контролю (К).
1a
1b
1c
1d










Примечание : * - Достоверные отличия от Контроля при р<0,05.
Жизнеспособность в Контроле составила 100±9,5%
Из таблицы 1 следует, что все соединения в исследуемых концентрациях подавляли эстрадиолстимулированную пролиферацию раковых клеток, при этом наибольшую ингибирующую активность проявил оксим 1d.
Из таблицы 2 следует, что все соединения в исследуемых концентрациях подавляли нестимулированную (базальную) пролиферацию раковых клеток, превосходя препарат сравнения МПА в концентрациях 10-6-10-7М , однако в меньшей степени, чем эстрогенстимулированную пролиферацию. Наибольшую ингибирующую активность в концентрации 10-5М проявил оксим 1d.
Пример 6. Заявляемые соединения показали высокое сродство к рецепторам прогестерона (Р4). Методом радиолигандного анализа [Schneider М. [1982] была изучена способность исследуемых соединений вытеснять меченый тритием прогестерон (3Н-Р4*) и связываться с рецепторами прогестерона. Результаты исследования выражены в процентах по отношению к контролю- связыванию 3Н-Р4* в отсутствие исследуемых соединений. Данные представлены в таблице 3.
Таблица 3. Связывание 3Н-Р4 с рецепторами прогестерона в цитозоле матки крыс в присутствии избытка заявляемых соединений, МПА и прогестерона.
Р4*





13,6*
* - Достоверные отличия от контроля (3Н-Р4) при р<0,05
Из представленных данных видно, что все исследуемые прегна-D'-пентараны способны связываться с рецепторами прогестерона. Процент связывания 3Н-Р4* варьирует от 19,6 до 53,9% . Наименьшее связывание 3Н-Р4* наблюдалось в присутствии чистого прогестрона-19,6%, наибольшее для МПА - 53,9±13,6*%. Исследуемые прегна-D'-пентараны более эффективно вытесняют 3Н-Р4* (на 78,5-77,1%), чем препарат сравнения МПА (на 46,1%).
Заявляемое изобретение не очевидно для специалистов, работающих в области химиотерапии опухолей.
В связи с большой социально-экономической значимостью проблемы лечения злокачественного роста создание новых соединений представляет собой актуальную проблему как экспериментальной, так и клинической медицины.
Заявляемые соединения - 6-Оксимы 16α,17α-циклогексанопрегненов - пригодны для перорального применения, обладают высоким сродством к рецепторам прогестерона и показали высокую цитостатическую активность в отношении клеток рака шейки матки человека, что очень ценно и в клиническом, и в социальном, и в экономическом отношениях.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ АЦЕТАТА 16α,17α-ЦИКЛОГЕКСАНО-5α,6α-ЭПОКСИПРЕГН-3β-ОЛ-20-ОНА | 2011 |
|
RU2480477C1 |
| 4-ГЕТЕРО-16α, 17α-ЦИКЛОГЕКСАНОПРЕГНАНЫ | 2009 |
|
RU2426737C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЦЕТАТА 16α,17α-ЦИКЛОГЕКС-3',4'-ЕНОПРЕГН-5-ЕН-3β-ОЛ-20-ОНА | 2011 |
|
RU2480476C1 |
| СПОСОБ ПОЛУЧЕНИЯ 6-МЕТИЛЕНО-16α,17α-ЦИКЛОГЕКСАНОПРЕГН-4-ЕН-3,20-ДИОНА | 2014 |
|
RU2566366C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЦЕТАТА 16α,17α-ЦИКЛОГЕКСАНОПРЕГН-5-ЕН-3β-ОЛ-20-ОНА | 2012 |
|
RU2495047C1 |
| СПОСОБ ПОЛУЧЕНИЯ 6-МЕТИЛЕНО-16α,17α-ЦИКЛОГЕКСАНОПРЕГН-4-ЕН-3,20-ДИОНА | 2014 |
|
RU2566368C1 |
| СПОСОБ ПОЛУЧЕНИЯ НОВЫХ 3β-АЦЕТОКСИ-17α-ГИДРОПЕРОКСИ-16α-МЕТИЛПРЕГНАНОВ ИЗ Δ-20-КЕТОСТЕРОИДОВ И СПОСОБ ПОЛУЧЕНИЯ 3β-АЦЕТОКСИ-17α-ГИДРОКСИ-16α-МЕТИЛПРЕГНАНОВ С ИСПОЛЬЗОВАНИЕМ 3β-АЦЕТОКСИ-17α-ГИДРОПЕРОКСИ-16α-МЕТИЛПРЕГНАНОВ | 2009 |
|
RU2418805C1 |
| ПРОИЗВОДНЫЕ АНДРОСТАНА, ЗАМЕЩЕННЫЕ ПО 16-ПОЛОЖЕНИЮ ЧЕТВЕРТИЧНОЙ АММОНИЕВОЙ ГРУППОЙ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2124021C1 |
| СПОСОБ ПОЛУЧЕНИЯ 11БЕТА, 17АЛЬФА, 21-ТРИГИДРОКСИ-16АЛЬФА-МЕТИЛ-9АЛЬФА-ФТОРПРЕГНА-1,4-ДИЕН-3,20-ДИОНА (ДЕКСАМЕТАЗОНА) ИЗ ФИТОСТЕРИНА | 2013 |
|
RU2532902C1 |
| ПРОИЗВОДНЫЕ 11β-БЕНЗАЛЬДОКСИМ-ЭСТРА-4,9-ДИЕНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2137777C1 |
Изобретение относится к 6-Оксимам 16α,17α-циклогексанопрегненов общей формулы I

где X + Y образуют вместе O или X = H, Y = OH; R = H или CH3. Соединения обладают цитотоксической активностью и могут найти применение для лечения злокачественных опухолей. 2 з.п. ф-лы, 3 табл. 5 пр.
1. 6-Оксимы 16α,17α-циклогексанопрегненов общей формулы I

где X + Y образуют вместе O или X = H, Y = OH; R = H или CH3.
2. Соединения по п.1, обладающие цитотоксической активностью.
3. Соединения по п.1, способные связываться с рецепторами прогестерона.
| А | |||
| В | |||
| Камерницкий, И | |||
| С | |||
| Левина "Прегна-D'-пентараны " прогестины и антипрогестины | |||
| I | |||
| Разделение биологических функций стероидных гормонов", Биоорг | |||
| химия, 2005, том 31, N2, с | |||
| Ударно-долбежная врубовая машина | 1921 |
|
SU115A1 |
| US 20090203661 A1, 13.08.2009 | |||
| КОРРЕКТОР ПАРАНЕОПЛАСТИЧЕСКИХ ПОВРЕЖДЕНИЙ И ТОКСИЧЕСКИХ ЭФФЕКТОВ ЦИТОСТАТИЧЕСКОЙ ПОЛИХИМИОТЕРАПИИ | 2008 |
|
RU2385324C1 |
| 4-ГЕТЕРО-16α, 17α-ЦИКЛОГЕКСАНОПРЕГНАНЫ | 2009 |
|
RU2426737C1 |
Авторы
Даты
2014-12-10—Публикация
2013-07-09—Подача