Изобретение относится к иммунологическим методам анализа и может быть использовано для массового скрининга врожденного гипотиреоза у новорожденных.
Ранняя диагностика врожденных аномалий, подлежащих терапевтической коррекции при своевременном их выявлении, позволяет обеспечить полноценное физическое и психическое развитие ребенка. В основе врожденного гипотиреоза лежит полная или частичная недостаточность тиреоидных гормонов, приводящая к задержке развития и дифференцировки всех органов. Заболевание характеризуется резким снижением уровня гормона щитовидной железы тироксина (Т4) и повышением уровня тиротропного гормона (ТТГ) в крови ребенка. Диагностика основана на количественном определении концентрации данных гормонов с использованием в качестве исследуемого клинического материала - сухих пятен капиллярной крови новорожденных. Ограниченное количество тестируемого материала вызывает необходимость предложения способов одновременного количественного детектирования нескольких гормонов из одного образца. Данные способы должны быть основаны на совместимых методиках анализа разных гормонов. Проведение анализа в сухих пятнах цельной крови предъявляет дополнительные требования к точности, чувствительности и специфичности используемых методик. При этом способ детектирования должен быть адаптирован для проведения массовых обследований.
Известен способ обнаружения нескольких аналитов в образце сухой крови (Jong-Juan, at all. Simaltaneous Quadruple-Label Fluorometric Immunoassay of Thiroid-Stimulating Hormone, 17α-hidroxyprogesterone, Immunoreactive Tripsin, and Creative Kinase MM Isoenzyme in Dried Blood Spots. B: CLIN.CHEM., vol.38, №10, 1992, p.2038-2043). Способ используют для одновременного обнаружения четырех аналитов в образце сухой крови: тиротропина, 17α-ОН-прогестерона, иммунореактивного трипсина и креатин киназы ММ. Анализ осуществляют в лунках микротировального стрипа, для выявления искомых аналитов в качестве меток используют ионы лантанидов: Eu3+, Sm3+, Tb3+ и Dy3+.
Недостатком способа является сложность осуществления из-за использования большого количества операций. Кроме того, снижается точность анализа из-за перекрестного излучения эмиссии меток при определении количественного значения аналитов.
Известен многоаналитный способ диагностирования тироидных аномалий (патент США №7271009, класс НКИ 436/526). Способ предназначен для одновременного определения ТТГ, Т4, трииодтиронина (Т3), и тироидпероксидазы (ТПО) в образцах сыворотки крови. Для анализа используют смесь четырех групп микрочастиц, каждая из которых покрыта антителами к одному из гормонов и соответствующим этому гормону красителем. Для детектирования всех указанных гормонов одновременно используют совместное проведение сэндвич- и конкурентного анализов. После проведения биоспецифической реакции частицы разделяют на проточном цитометре, получая, таким образом, индивидуальные значения концентрации гормонов ТТГ, Т3, Т4 и анти-ТПО.
Недостатком способа является необходимость многократного проведения трудоемкой процедуры фильтрации и отмывки частиц размером 5-6 мкм. Кроме того, данный способ предназначен для измерения концентрации гормонов только в жидких образцах.
Известен способ детектирования гормонов ТТГ и Т4 в образцах, взятых из сухого пятна крови (Use of Microsphere Immunoassay for Simplified Multianalyte Screening of Tirotropin and Thyroxine in Dried Blood Spots from Newboms. Clinical Chemistry 49, No.2, 2003). Способ осуществляют следующим образом. Вырезают сухое пятно крови диаметром 3 мм из бланка фильтровальной бумаги и элюируют кровь элюирующим буфером, затем элюат фильтруют через микроплату с мембраной (диаметр пор - 0,45 мкм), и добавляют смесь частиц двух типов: с иммобилизованными антителами к ТТГ и с конъюгатом Т4-белок, и биотинилированных анти-Т4 антител в растворе фосфатного буфера, инкубируют определенное время. После этого добавляют биотинилированные анти-ТТГ антитела и снова инкубируют, перед окончанием инкубации добавляют флуоресцентный краситель стрептавидин-R-фикоэритрин, непосредственно перед измерениями добавляют раствор фосфатного буфера для уменьшения наложения фона. Плату считывают на считывающем устройстве Luminex100, при этом эмиссия флуоресценции, вызванная лазером, считывается компьютером для каждой частицы отдельно и конечный результат выражается как средняя интенсивность эмиссии флуоресценции определенного количества частиц. Для одновременного получения информации о концентрации ТТГ и Т4 в каждом образце требуется 60 сек.
Недостатком способа является необходимость предварительной стадии элюирования гормонов из сухого пятна крови с последующей фильтрацией элюата, что требует использования специальных фильтрующих микроплат и значительно снижает возможность проведения автоматизированного массового исследования сухих образцов цельной крови и повышает стоимость анализа.
Наиболее близким является способ многоаналитного иммуноанализа (патент России №2184970, класс МПК GOIN 33/53). Способ предназначен для многоаналитного анализа образцов сухих пятен крови и может быть использован для массового скрининга врожденных аномалий у новорожденных. Способ заключается в том, что на дне лунок микротитровальной платы иммобилизуют первые биоспецифические компоненты в виде дискретных микрообластей, помещают в лунку образец сухого пятна крови, экстрагируют определяемые аналиты из сухого пятна крови путем добавления в лунку смеси буфера и конъюгата со вторыми биоспецифическими компонентами к определяемым аналитам, при этом реакцию биоспецифического связывания с мечеными Pt-копро- или уропорфирином биоспецифическими компонентами проводят в дискретных областях первых иммобилизованных биоспецифических компонентов, а эмиссию флуоресценции детектируют путем последовательного сканирования микрообластей сфокусированным лазерным пучком. Для детектирования одного аналита иммобилизуют в лунку планшета по одной специфической микрообласти, для чего на дно наносят по 1 мкл раствора первых биоспецифических компонентов. Чтобы предотвратить разбавление образца крови и, соответственно, снижение измеряемой концентрации аналитов, реакцию биоспецифического связывания проводят в малом объеме реакционной смеси - 5 мкл, при этом смесь полностью впитывается помещаемым на микрообласть дна лунки бумажным диском с исследуемым образцом крови. Реакционный буфер не содержит добавок для высвобождения Т4 из комплексов с белками крови.
Недостатком способа является высокая вариабельность результатов, что не позволяет использовать его для проведения количественного измерения концентрации гормонов в крови. Кроме того, проведение реакции биоспецифического связывания в крайне малом объеме реакционной смеси, который поглощается пропитанным кровью бумажным диском, вызывает усиление различных неспецифических взаимодействий компонентов крови с сенсибилизированной поверхностью дна лунок планшета, и следовательно, может приводить к неточному определению концентрации исследуемых аналитов в крови.
Задачей является создание многоаналитного способа анализа образцов сухих пятен крови для проведения массового скрининга при диагностике тироидных аномалий новорожденных.
Техническим результатом, достигаемым при использовании изобретения, является снижение влияния на специфическую активность неравномерности сенсибилизируемой поверхности в сочетании с уменьшением неспецифических взаимодействий в процессе анализа гормонов, что приводит к росту стабильности, точности, чувствительности и специфичности детектирования, требуемых для применения при диагностике врожденного гипотиреоза у новорожденных.
Технический результат достигается предлагаемым изобретением.
Сущность изобретения заключается в том, что в известном способе, включающем иммобилизацию на дне лунок микротитровальной платы в виде дискретных областей первых биоспецифических компонентов к определяемым аналитам, экстрагирование определяемых аналитов из сухого пятна крови путем добавления в лунку смеси буфера и конъюгата со вторыми биоспецифическими компонентами к определяемым аналитам, проведение в дискретных областях с первыми специфическими компонентами реакции биоспецифического связывания с меченными Pt-копропорфирином вторыми биоспецифическими компонентами и детектирование эмиссии фосфоресценции метки, связанной с определяемыми аналитами, в режиме временного разрешения путем последовательного сканирования каждой микрообласти сфокусированным лазерным лучом, на поверхности дна лунок микротитровальной платы иммобилизуют первые биоспецифические компоненты к гормонам тироксину и тиротропину в виде по крайней мере трех дискретных микрообластей для каждого гормона, при этом микрообласти для выявления тироксина содержат гетерологический конъюгат трииодтиронина с белковым носителем бычьего сывороточного альбумина (БСА), а микрообласти для выявления тиротропина содержат моноклональные антитела к тиротропину, для проведения биоспецифической реакции определяемые гормоны экстрагируют в лунке микротитровальной платы из исследуемого сухого пятна крови в реакционный раствор объемом 25-50 мкл, содержащий меченные биотином моноклональные антитела к гормонам и 8-анилинонафталено-1-сульфоновую кислоту (8-АНС).
Технический результат достигается также тем, что в раствор биоспецифических компонентов для их иммобилизации добавляют глицерин до концентрации 10-15%.
Авторам не известны технические решения, имеющие такую же совокупность признаков, как совокупность признаков заявляемого изобретения. Следовательно, заявляемое техническое решение отвечает критерию новизны.
В патенте США №7271009, класс НКИ 436/526 описан способ одновременного определения нескольких гормонов в сыворотке крови. В статье "Use of Microsphere Immunoassay for Simplified Multianalyte Screening of Tirotropin and Thyroxine in Dried Blood Spots from Newborns." Clinical Chemistry 49, No.2, 2003 описан способ одновременного определения тиреотропного гормона и тироксина в одном образце сухого пятна крови. Оба способа осуществляются путем использования сэндвич- и конкурентного анализа одного образца крови, при этом для осуществления способа используют несколько групп меченых микрочастиц и метод проточной цитометрии. В патенте России №2184970 описан способ многоаналитного анализа сухих образцов крови.
По сравнению с известными техническими решениями в предлагаемом изобретении анализ проводят на дне лунки микропланшета, на которое наносят различные биоспецифические реагенты в виде по крайней мере 3 микрообластей каждого реагента, что позволяет снизить влияние неравномерности сенсибилизируемой поверхности, и тем самым значительно повысить стабильность и точность результатов одновременного детектирования нескольких гормонов в одном образце сухого пятна крови. Следовательно, предлагаемое изобретение отвечает критерию уровня техники.
Изобретение может быть использовано в здравоохранении, в частности в педиатрии и неонаталогии для скрининга, подтверждения и контроля лечения врожденного гипотиреоза у новорожденных, что имеет большое значение для своевременного выявления врожденных аномалий развития детей и проведения соответствующей коррегирующей терапии и тем самым значительного снижения инвалидности и смертности. Следовательно, предлагаемое изобретение отвечает критерию промышленной применимости.
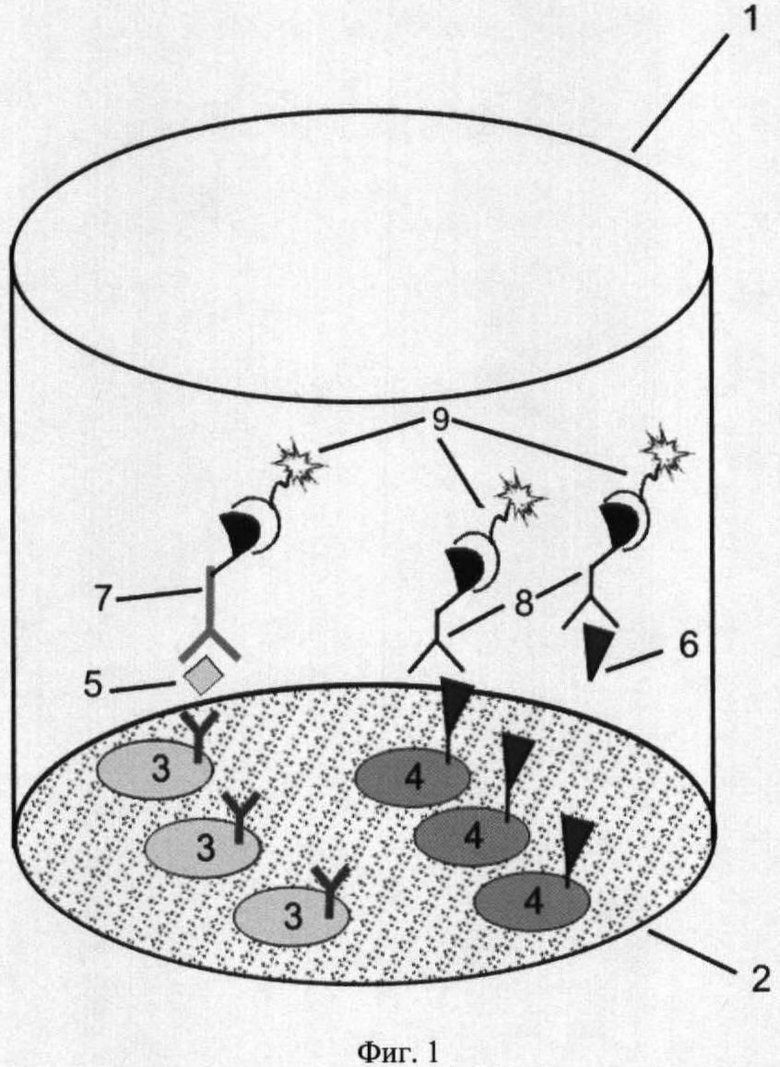
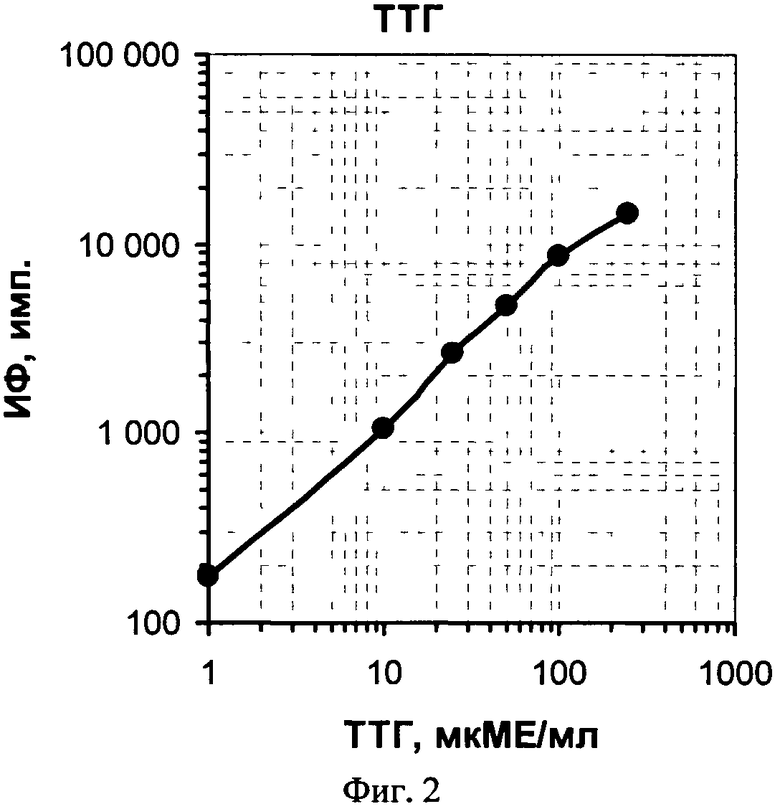
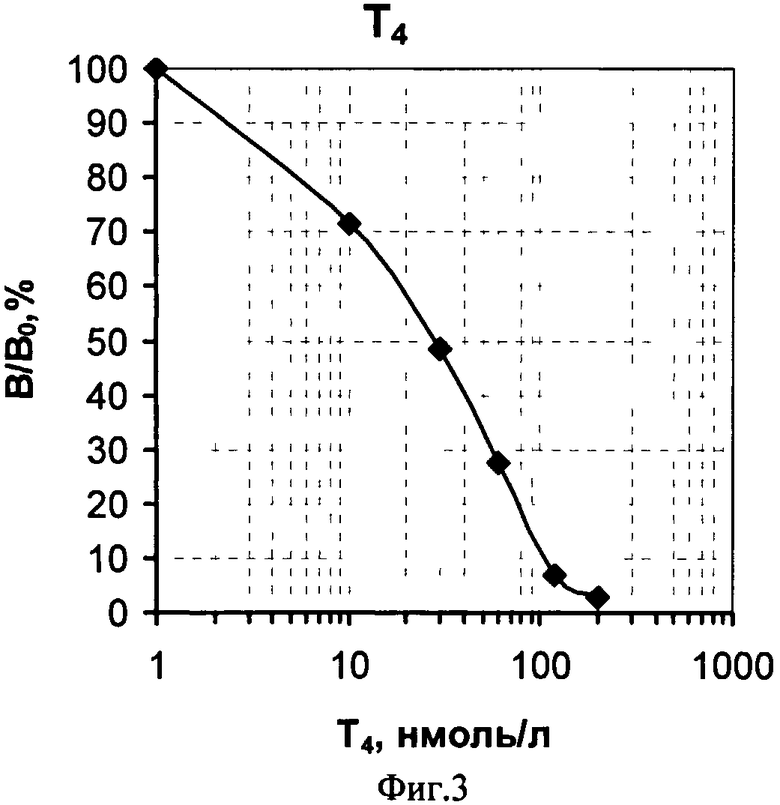
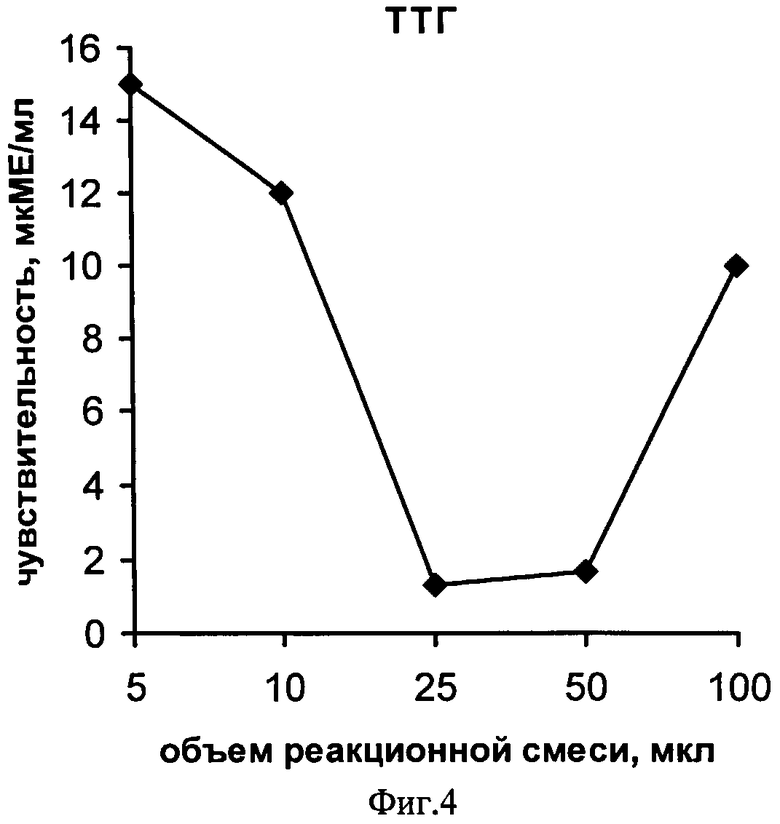
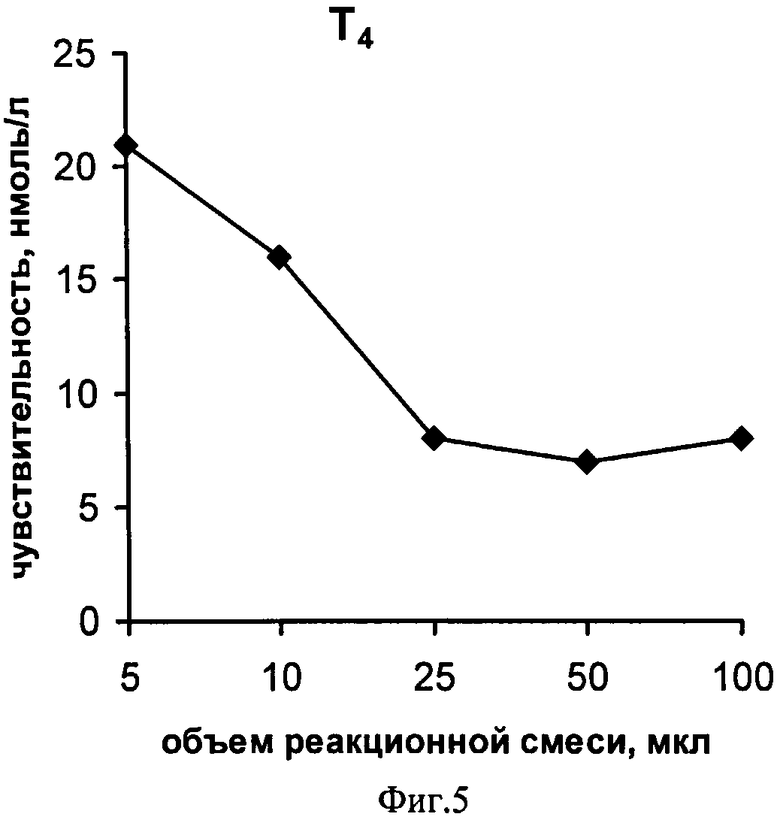
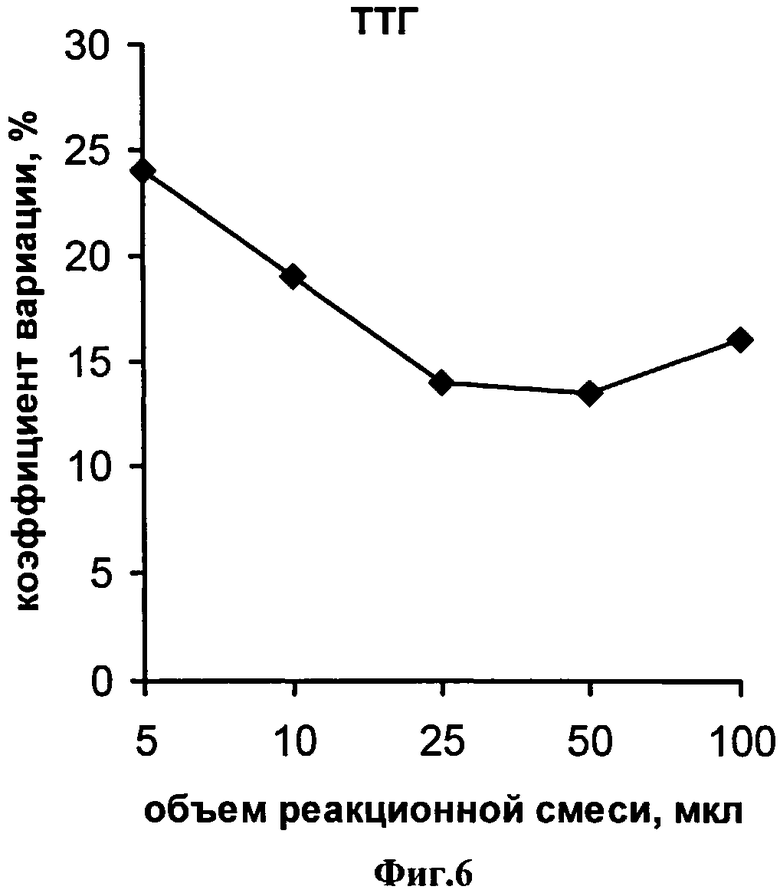
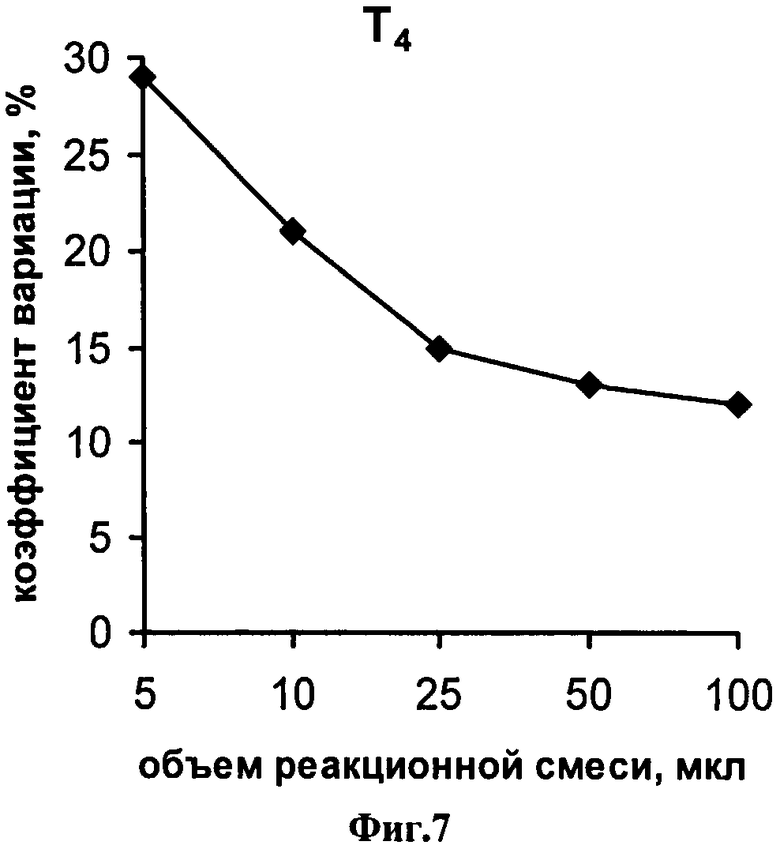
На фиг.1 представлена схема проведения одновременного определения гормонов, где 1 - лунка 96-луночного микропланшета, 2 - дно лунки; 3 - микрообласть для детектирования ТТГ; 4 - микрообласть для детектирования Т4; 5 - исследуемый ТТГ; 6 -исследуемый Т4; 7 - меченные биотином анти-ТТГ антитела; 8 - меченные биотином анти-Т4 антитела и 9 - конъюгат стрептовидин-Рт-копропорфирин; на фиг.2 представлена калибровочная кривая для определения концентрации Т4; на фиг.3 представлена калибровочная кривая для определения концентрации ТТГ; на фиг.4 показана зависимость чувствительности анализа ТТГ от объема реакционной смеси; на фиг.5 показана зависимость значений коэффициента вариации результатов анализа ТТГ от объема реакционной смеси; на фиг.6 показана зависимость чувствительности анализа Т4 от объема реакционной смеси и на фиг.7 показана зависимость значений коэффициента вариации результатов анализа ТТГ от объема реакционной смеси.
Способ осуществляется следующим образом.
Пример 1. Определение тиротропина и общего тироксина из образца сухого пятна крови
На поверхности дна лунки стрипированного плоскодонного полистиролового 96-луночного микропланшета формируют специфические дискретные микрообласти для выявления гормонов Т4 и ТТГ (фиг.1). Для детектирования каждого гормона создаются по 3-12 идентичных микрообластей диаметром 0,5 мм. Для этого на дно 2 каждой лунки планшета (Labsystems, кат. №95029140) с помощью прибора для печатания чипов наносят в строго отведенные точки микрокапли по 25 нл растворов соответствующих биоспецифических компонентов в концентрации 0,05 мг/мл. Значительное снижение объема раствора для сорбции (в 40 раз, по сравнению с прототипом) повышает чувствительность анализа и снижает расход реагентов. Для создания микрообластей 3, специфичных к ТТГ, используют моноклональные антитела к ТТГ, а для микрообластей 4, специфичных к Т4, используют гетерологичный конъюгат трииодтиронина с белком-носителем. Конъюгат трииодтиронина с БСА синтезируют карбидиимидным методом (Бекман Н.И. и др. Клин. лаб. диагностика 2002). Использование моноклональных антител к Т4, обладающих высокой аффинностью к Т4 и более низкой к Т3, однако, достаточной для проведения конкурентного анализа с применением гетерологичного конъюгата, приводит к ингибированию связывания антител на более низких концентрациях исследуемого аналита. Для снижения скорости высыхания капель и, соответственно, повышения полноты и равномерности сорбции биоспецифических компонентов в раствор для сорбции добавляют 15% глицерина (Sigma). Планшет инкубируют в течение 18 часов при 4°С, промывают и обрабатывают блокирующим раствором 15 мМ фосфатного буфера, содержащего 1% БСА, в течение 1 часа при комнатной температуре, удаляют блокирующий раствор и высушивают планшет.
Схема определения гормонов с использованием сенсибилизированных указанным образом микропланшетов представлена на фиг.1. Из исследуемого образца сухого пятна крови на фильтровальной бумаге вырезают пропитанный кровью диск диаметром 3,2 мм и помещают в лунку микропланшета, добавляют 25 мкл раствора смеси специфических меченных биотином антител к ТТГ и Т4 в концентрации 1 и 0,5 мкг/мл, соответственно, в реакционном 15 мМ трис-буфере, рН 7,75, содержащем 0,05% твин 20, 5% БСА (все реагенты SIGMA, США) и 0,15 мг/мл 8-анилинонафталено-1-сульфоновой кислоты (ICN Biomedicals, США). Планшет инкубируют при встряхивании при температуре 18-25°С в течение 20 минут и 18 часов при температуре 2-8°С и удаляют диски из лунок. Реакционный раствор содержит смесь двух меченных биотином моноклональных антител: к Т4 и к ТТГ. Элюирующийся из сухого образца крови ТТГ 5 связывается как с соответствующими антителами, иммобилизованными на микрообластях 3 дна 2 лунки, так и со вторыми мечеными биотином антителами 7 к ТТГ из реакционной смеси, а одновременно элюирующийся из того же образца Т4 6 конкурирует с Т3, иммобилизованным на соответствующих микрообластях 4, за связывание с мечеными биотином антителами к Т4 8. В реакционном растворе присутствует 8-АНС для высвобождения Т4 из комплекса с белками крови. Мечение антител биотином применяют для усиления сигнала образующихся на специфических микрообластях иммунных комплексов, которые детектируют с помощью фосфоресцирующего конъюгата стрептавидина с Pt-копропорфирином 9. Для этого в лунку планшета добавляют 25 мкл раствора конъюгата стрептавидина с Pt-копропорфирином, инкубируют в течение 15 минут при комнатной температуре, промывают и высушивают планшет.(Конъюгат синтезируют через N-гидроксисукцинимид Pt копропорфирина, полученный карбодиимидным методом (De Haas R.R. et.al., J.Histochem.&Cytochem. 1997, 45 1279-1292).)
Регистрацию сигнала осуществляют путем последовательного сканирования отдельных участков дна лунки сухого планшета лазерным лучом с длиной волны излучения 365 нм. Сканирование проводят в режиме измерения длительной люминесценции Pt-копропорфирина на длине волны 645 нм. Результаты сканирования регистрируют как число фотоимпульсов от каждой из микрообластей и рассчитывают для каждого гормона среднее значение сигнала по всем специфическим к данному гормону идентичным микрообластям в лунке планшета.
Пример 2. Построение калибровочных кривых
На дно лунок 96-луночных стрипированных плоскодонных полистироловых планшетов (Labsystems, кат. №95029140) наносят в строго отведенные точки с помощью прибора для печатания чипов ряд из трех микрокапель объемом 25 нл (диаметр 0,5 мм) раствора моноклональных антител к ТТГ в концентрации 0,05 мг/мл для создания трех микрообластей, специфичных к ТТГ, и два ряда по три капли раствора конъюгата трииодтиронина с белком носителем для создания шести микрообластей, специфичных к Т4. Растворы для сорбции содержат 15% глицерина (Sigma). Планшет инкубируют в течение 18 часов при 4°С, промывают, обрабатывают блокирующим раствором 15 мМ фосфатного буфера, содержащего 1% БСА, в течение 1 часа при комнатной температуре, удаляют блокирующий раствор и высушивают.
Двукомпонетные, содержащие ТТГ и Т4, калибровочные пробы готовят из очищенной от гормонов цельной крови доноров добавлением соответствующих количеств ТТГ и Т4 (ICN, США) и нанесением полученных растворов в виде капель по 100 мкл на специальные бланки фильтровальной бумаги (фирма Schleicher & Schuell, Германия, кат. №903) с последующим высушиванием образующих пятен крови. Калибраторы A-B-C-D-E-F содержат Т4 в концентрации: 0, 12,5, 25, 50, 100, 200 нмоль/л и ТТГ - в концентрации: 0, 10, 25, 50, 100, 250 мкМЕ/мл, соответственно.
Для проведения анализа из сухих пятен крови двукомпонентных калибровочных проб вырезают пропитанные кровью диски диаметром 3,2 мм и помещают в лунки сенсибилизированного микропланшета (по одному в каждую лунку). Анализ каждого калибратора проводят в дублях.
Далее анализ проводят, как описано в примере 1.
После окончания анализа высушенный планшет сканируют, как описано в примере 1, и для каждой лунки планшета рассчитывают средние значения интенсивности регистрируемого сигнала фосфоресценции по трем микрообластям, специфическим к ТТГ, а также среднее значение по шести областям, специфическим к Т4. При конечной оценке результатов определения каждого гормона используют средние значения данных сканирования лунок планшета, в которых был проведен повторный анализ калибровочных проб. Результирующий уровень сигнала, характеризующий ТТГ, прямо пропорционален, а уровень сигнала, характеризующий Т4, - обратно пропорционален концентрации соответствующих гормонов в исследуемом образце крови, так как одновременно в одной реакционной смеси проходит как «сэндвич»-иммуноанализ ТТГ, так и конкурентный иммуноанализ Т4. На основании полученных значений строят две калиброчные кривые зависимости интенсивности измеренного сигнала от концентрации в этих пробах ТТГ - фиг.2 и Т4 - фиг.3, соответственно. Как следует из приведенных калибровочных кривых, предложенный способ позволяет проводить одновременное количественное определение гормонов Т4 и ТТГ в высушенных образцах крови в диапазонах концентраций гормонов от 15 до 200 нмоль/л Т4 и - от 10 до 250 мкМЕ/мл ТТГ, необходимых для диагностики врожденного гипотиреоза.
Пример 3. Определение общего тироксина из образца сухого пятна крови с использованием гетерологичного конъюгата для создания специфических к тироксину микрообластей
Способ осуществляют, как описано в примере 2, при этом дно лунок одного планшета сенсибилизируют конъюгатом тироксина с белковым носителем, а второго - гетерологичным конъюгатом трииодтиронина. Результатом эксперимента является определение концентрации тироксина, при которой достигается 50% ингибирование связывания анти-тироксиновых антител со специфической микрообластью дна лунки планшета. При использовании гетерологичного конъюгата для создания специфической микрообласти получают значение - 30 нмоль/л, а при использовании гомологичного конъюгата - 70 нмоль/л. Таким образом, применение гетерологичного конъюгата значительно повышает чувствительность конкурентного иммуноанализа тироксина.
Пример 4. Определение тиротропина и тироксина из образца сухого пятна крови с использованием различного числа микрообластей
Несколько 96-луночных планшетов сенсибилизируют, как описано в примере 1, при этом варьируя количество одинаковых специфических микрообластей в лунке планшета - от одной до двенадцати для определения каждого гормона. В качестве исследуемых образцов сухих пятен крови используют образец с содержанием 12,5 нмоль/л Т4 и 10 мкМЕ/мл ТТГ, а также образец, содержащий 100 нмоль/л Т4 и 100 мкМЕ/мл ТТГ. Каждый образец анализируют в десяти повторах в каждом планшете. Процедуру анализа проводят, как описано в примере 1. Для каждого планшета (с различным числом микрообластей на дне лунки) получают среднее значение концентрации гормонов в исследуемых образцах и коэффициент вариации результатов десяти повторных определений. Как видно из результатов, приведенных в таблице 1, при использовании для определения гормонов планшетов, содержащих в лунке по одной специфической к гормону микрообласти, разброс результатов анализа достигает значений, которые не позволяют использовать данный метод для количественного определения уровня гормонов в крови. Это связано с наличием в твердой фазе дефектов и, соответственно, неравномерностью сорбирующих свойств поверхности дна полистироловых планшетов, а также высокой скоростью высыхания микрокапель сенсибилизирующих реагентов, что препятствует формированию в разных лунках планшета одинаковых микрообластей, содержащих иммобилизованные специфические реагенты в виде монослоя. Снизить влияние данных факторов позволяет увеличение числа одинаковых специфических микрообластей в лунке планшета. Как следует из результатов, приведенных в таблице 1, это приводит к значительному снижению вариабельности результатов анализа и, соответственно, повышает точность определения гормонов в крови, особенно, в случае измерения уровня Т4. Максимальное число возможных микрообластей (шестнадцать) в лунке ограничено размером дна лунки планшета, увеличение же числа за счет более тесного расположения микрообластей невозможно из-за возникновения в этом случае перекрестного свечения микрообластей, специфичных к разным гормонам.
Пример 5. Определение тиротропина и тироксина из образца сухого пятна крови в различном объеме реакционной смеси
Способ осуществляют, как описано в примере 2, для этого готовят пять сенсибилизированных планшетов. В каждом планшете анализируют в двенадцати повторах образец сухого пятна крови, не содержащий исследуемые гормоны, а также в образец с 12,5 нмоль/л Т4 и 10 мкМЕ/мл ТТГ. Определение гормонов проводят, как описано в примере 1, добавляя на стадии иммуноанализа в разные планшеты разные объемы реакционной смеси - по 5, 10, 25, 50 и 100 мкл в лунку. Рассчитанные по результатам двенадцати повторных исследований пробы с нулевым содержанием гормонов, кривые зависимости чувствительности анализа ТТГ и Т4 от объема реакционной смеси представлены на фиг.4 и 5, соответственно. Как следует из приведенных экспериментальных кривых, использование объема 5-10 мкл приводит к недостаточной чувствительности анализа обоих гормонов из-за высокого влияния неспецифических взаимодействий сенсибилизированного дна лунок планшета с компонентами цельной крови, которые экстрагируются в реакционную смесь из диска, вырезанного для анализа из исследуемого сухого пятна крови. При объеме реакционной смеси 25-50 мкл достигается чувствительность анализа ТТГ - 2 мкМЕ/мл и Т4 - 10 нмоль/л, необходимая для осуществления скрининга на врожденный гипотиреоз. Дальнейшее увеличение объема реакционной смеси приводит, как видно из фиг.4, к снижению чувствительности анализа ТТГ за счет уменьшения концентрации этого гормона в исследуемой смеси.
На фиг.6 и фиг.7 представлены зависимости значения коэффициентов вариации результатов двенадцати повторных определений гормонов, соответственно, ТТГ и Т4 от используемого объема реакционной смеси. Приведенные результаты свидетельствуют, что проведение стадии иммуноанализа гормонов в объемах менее 25 мкл приводит к столь низкой воспроизводимости результатов анализа, что делает невозможным проведение количественного определения гормонов в крови, а увеличение объема свыше 50 мкл не приводит к существенному улучшению воспроизводимости результатов при снижении чувствительности анализа ТТГ (фиг.4). Таким образом, как следует из примера, объем реакционной смеси имеет существенное значение при исследовании в качестве образцов сухих пятен крови и оптимальные значения составляют 25-50 мкл.
Пример 6. Определение тиротропина и тироксина из образца сухого пятна крови в присутствии 8-АНС
Способ осуществляют, как описано в примере 2, сенсибилизируя шесть планшетов. В качестве исследуемых образцов используют клинические образцы высушенной на бумаге крови человека с известным содержанием гормонов, причем каждый образец исследуют в четырех повторах. Стадию иммуноанализа гормонов проводят в присутствии в реакционном растворе различных концентраций 8-АНС: 0; 0,05; 0,1; 0,2; 0,4 и 0,8 г/л в разных планшетах. По построенным для каждого планшета калибровочным кривым двух гормонов определяют концентрации соответствующих гормонов в исследуемых образцах.
В результате исследования было показано, что в отсутствии в 8-АНС тироксин в клинических образцах не определился, что можно объяснить тем фактом, что количество Т4, находящегося в несвязанном с белками крови состоянии, составляет всего 0,03% от общего количества гормона. Добавление в реакционную смесь до 0,15 г/л 8-АНС, препятствующей связыванию гормона с белками крови, позволило точно измерить уровень Т4 во всех исследуемых образцах крови при незначительном снижении интенсивности регистрируемого сигнала, тогда как дальнейшее увеличение ее концентрации вызвало резкое падение фосфоресценции специфических к ТТГ микрообластей из-за отрицательного воздействия кислоты на активность биоспецифических компонентов.
Пример 7. Одновременное количественное определение гормонов тироксина и тиротропина в сухих образцах крови человека
Способ осуществляют, как описано в примере 2. В качестве исследуемых образцов используют контрольные мультианалитные (Centers for Disease Control and Prevention, US), а также клинические образцы сухих пятен крови с известным содержанием гормонов, аттестованные с помощью лантанидных моно-тестов «ТТГ-неоскрин» и «Т4-скрин» (ЗАО «Иммуноскрин», РФ). Клинические образцы получают высушиванием на специальном бланке из фильтровальной бумаги капли крови из пятки ребенка на 3-5 день рождения. Для одновременного детектирования гормонов из исследуемых пятен крови вырезают пропитанные кровью диски диаметром 3,2 мм и помещают в лунки планшета по одному в каждую лунку. Анализ каждого образца проводят в дубликатах. Далее анализ проводят, как описано в примере 2. По соответствующим калибровочным кривым определяют значения концентрации каждого гормона в исследуемых образцах. Как видно из результатов анализа, приведенных в таблице 2, полученные значения концентрации обоих гормонов в контрольных образцах соответствуют ожидаемым значениям. Результаты исследования клинических образцов крови новорожденных приведены в таблице 3 и хорошо коррелируют с результатами, полученными с помощью коммерческих монотестов. Из примера видно, что при предложенном способе детекции не наблюдается перекрестное взаимное влияние на результаты анализа присутствия в исследуемом образце двух гормонов, а также других компонентов цельной крови. Следовательно, способ позволяет проводить одновременное количественное определение концентраций тиротропина и общего тироксина в сухих образцах крови человека с необходимой чувствительностью и точностью в клинически значимом диапазоне концентраций.
Пример 8. Определение тиротропина и тироксина из образца сухого пятна крови с добавлением глицерина при создании микрообластей
96-луночный планшет сенсибилизируют, как описано в примере 1, при этом при сорбции в качестве добавки в раствор для нанесения микрокапель используют глицерин в различных концентрациях от 0 до 30%. Для каждой концентрации глицерина сенсибилизируют по десять лунок. В качестве образца для анализа используют сухое пятно крови с содержанием 0 нмоль/л Т4 и 100 мкМЕ/мл ТТГ. Процедуру анализа проводят, как описано в примере 1. В таблице 4 приведены усредненные по десяти одинаковым лункам результаты регистрации сигнала фосфоресценции специфических микрообластей, которые получены при использовании различных уровней глицерина в растворе для сорбции.
Необходимость размещения на дне лунки планшета более трех микрообластей для выявления каждого аналита приводит к уменьшению размера микрообластей, то есть к снижению объема наносимой микрокапли сенсибилизирующего раствора. Получаемая микрокапля объемом 25 нл испаряется на воздухе быстрее образования на микрообластях равномерного монослоя иммобилизованных специфических реагентов. Это может приводить как к разной специфической активности формируемых микрообластей, так и к неравномерности самой микрообласти (краевой эффект). Для снижения скорости высыхания микрокапель в данном способе предлагается использовать добавление в сенсибилизирующий раствор глицерина. Как следует из представленных в таблице 4 результатов, добавление глицерина в диапазоне концентраций от 10 до 15% позволяет усилить уровень регистрируемого сигнала за счет повышения степени и равномерности сорбции специфических компонентов на микрообластях дна лунки полистиролового планшета. Дальнейшее повышение уровня глицерина в растворе приводит к увеличению вязкости раствора, препятствующей равномерному раскапыванию микрокапель из иглы прибора для печатания чипов. Таким образом, из примера следует, что для одновременного количественного детектирования гормонов необходимо присутствие 10-15% глицерина в растворе для иммобилизации специфических компонентов в виде микрообластей на дне лунки планшета.
тей
ца
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОДНОВРЕМЕННОГО ДЕТЕКТИРОВАНИЯ НЕСКОЛЬКИХ МАРКЕРОВ ВРОЖДЕННЫХ ЗАБОЛЕВАНИЙ В СУХИХ ПЯТНАХ КРОВИ | 2013 |
|
RU2541164C2 |
| СПОСОБ МНОГОАНАЛИТНОГО ИММУНОАНАЛИЗА | 2001 |
|
RU2184970C1 |
| Способ проведения биологического микроанализа | 2019 |
|
RU2710262C1 |
| СПОСОБ МНОГОАНАЛИТНОГО ИММУНОАНАЛИЗА | 2014 |
|
RU2593787C2 |
| СПОСОБ ОДНОВРЕМЕННОГО ДЕТЕКТИРОВАНИЯ АНТИТЕЛ КЛАССА G К АНТИГЕНАМ ВОЗБУДИТЕЛЕЙ TORCH-ИНФЕКЦИЙ С ИСПОЛЬЗОВАНИЕМ ИММУНОЧИПА | 2014 |
|
RU2545792C2 |
| МИКРОТИТРОВАЛЬНАЯ ПЛАТА | 1999 |
|
RU2158179C1 |
| СПОСОБ ДЕТЕКТИРОВАНИЯ КОНЦЕНТРАЦИИ АНАЛИТА С ШИРОКИМ ДИНАМИЧЕСКИМ ДИАПАЗОНОМ | 2012 |
|
RU2519023C2 |
| СПОСОБ МНОГОАНАЛИТНОГО ИММУНОАНАЛИЗА С ИСПОЛЬЗОВАНИЕМ МИКРОЧАСТИЦ | 2008 |
|
RU2379691C1 |
| СПОСОБ ОБНАРУЖЕНИЯ И ИДЕНТИФИКАЦИИ КЛЕТОК МИКРООРГАНИЗМОВ И ВИРУСОВ | 2001 |
|
RU2197732C1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК МЫШИ MUS MUSCULUS L., ИСПОЛЬЗУЕМЫЙ ДЛЯ ПОЛУЧЕНИЯ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К ТИРОКСИНУ | 1993 |
|
RU2049816C1 |
Настоящее изобретение относится к медицине и может быть использовано для массового скрининга врожденного гипотиреоза у новорожденных и позволяет повысить точность и чувствительность анализа. Сущность способа заключается в том, что на дне лунки микротитровальной платы иммобилизуют первые специфические компоненты для каждого из определяемых гормонов по крайней мере в виде трех дискретных микрообластей, экстрагируют определяемые гормоны из сухого пятна крови путем добавления в лунку смеси буфера и конъюгата со вторыми биоспецифическими компонентами к определяемым гормонам, мечеными Pt-копропорфирином, при этом микрообласти для выявления тироксина содержат гетерологический конъюгат трииодтиронина с белковым носителем бычьего сывороточного альбумина, а микрообласти для выявления тиротропина содержат моноклональные антитела к тиротропину, наличие гормонов определяют путем детектирования фосфоресценции метки, связанной с гормонами, для проведения биоспецифической реакции определяемые гормоны экстрагируют в лунке микротитровальной платы из исследуемого сухого пятна крови в реакционный раствор объемом 25-50 мкл, содержащий меченые биотином моноклональные антитела к гормонам и 8-анилинонафталено-1-сульфоновую кислоту. 1 з.п. ф-лы, 7 ил., 4 табл., 6 пр.
1. Способ одновременного детектирования тиротропина и общего тироксина в сухих пятнах крови, включающий иммобилизацию первых биоспецифических компонентов к определяемым аналитам на дне лунок микротитровальной платы в виде дискретных областей, экстрагирование определяемых аналитов из сухого пятна крови путем добавления в лунку смеси буфера и конъюгата со вторыми биоспецифическими компонентами к определяемым аналитам, проведение в дискретных областях с первыми биоспецифическими компонентами реакции биоспецифического связывания с мечеными Pt-копропорфирином вторыми биоспецифическими компонентами и детектирование эмиссии фосфоресценции метки, связанной с определяемыми аналитами, в режиме временного разрешения путем последовательного сканирования каждой микрообласти сфокусированным лазерным пучком, отличающийся тем, что на поверхности дна лункой микротировальной платы иммобилизуют первые биоспецифические компоненты к гормонам тироксину и тиротропину в виде по крайней мере трех дискретных микрообластей для каждого гормона, при этом микрообласти для выявления тироксина содержат гетерологический конъюгат трииодтиронина с белковым носителем бычьего сывороточного альбумина, а микрообласти для выявления тиротропина содержат моноклональные антитела к тиротропину, для проведения биоспецифической реакции определяемые гормоны экстрагируют в лунке микротитровальной платы из исследуемого сухого пятна крови в реакционный раствор объемом 25-50 мкл, содержащий меченые биотином моноклональные антитела к гормонам и 8-анилинонафталено-1-сульфоновую кислоту.
2. Способ по п.1, отличающийся тем, что в раствор биоспецифических компонентов для их иммобилизации добавляют глицерин до концентрации 10-15%.
| СПОСОБ МНОГОАНАЛИТНОГО ИММУНОАНАЛИЗА | 2001 |
|
RU2184970C1 |
| СПОСОБ МНОГОАНАЛИТНОГО ИММУНОАНАЛИЗА С ИСПОЛЬЗОВАНИЕМ МИКРОЧАСТИЦ | 2008 |
|
RU2379691C1 |
| Jong-Juan, at all | |||
| Simaltaneous Quadruple-Label Fluorometric Immunoassay of Thiroid-Stimulating Hormone, 17a-hidroxyprogesterone, Immunoreactive Tripsin, and Creative Kinase MM Isoenzyme in Dried Blood Spots | |||
| B: CLIN.CHEM., vol.38, N 10, 1992, p.2038-2043 | |||
| Use of Microsphere Immunoassay for | |||
Авторы
Даты
2013-04-27—Публикация
2012-05-17—Подача