Изобретение относится к иммунологическим методам анализа и может быть использовано для массового скрининга врожденных аномалий у новорожденных, контроля иммунного и гормонального статуса, репродуктивной функции женщин и некоторых инфекционных заболеваний.
Диагностика таких заболеваний как врожденный гипотиреоз, муковисцидоз, адреногенитальная гиперплазия, фенилкетонурия и галактоземия новорожденных в первые дни и месяцы их жизни обеспечивает возможность своевременной терапевтической коррекции развития. Важное значение для снижения числа новорожденных с врожденными аномалиями имеют пренатальная диагностика для прогнозирования риска проявления синдрома Дауна, неонатальный и пренатальный скрининг на ряд инфекционных заболеваний (токсоплазмоз, вирусные гепатиты, герпесвирусные инфекции и др.). Для этих целей используют клинический материал в виде сухих пятен крови, который может очень долго (годы) сохраняться без заметного снижения активности и легко доставляться из отдаленных регионов в специализированные центры. Однако при использовании клинического материала в виде сухих пятен крови в неонатальной диагностике возникают проблемы, связанные с ограниченным количеством тестируемого материала и необходимостью выявления из одного образца сухого пятна крови нескольких аналитов.
Известен способ определения аналита в образце крови (ЕР 0460620, класс МКИ G 01 N 33/76). Способ предназначен для определения тиротропина тироксина и свободного тироксина в сухом образце крови методом флуорометрического иммуноанализа. Способ осуществляется в лунках микротировальных плат и пригоден для скрининга врожденного гипотиреоза из образцов неонатальной крови на фильтровальной бумаге. Сухое пятно крови либо растворяют в буфере и затем используют как образец, либо, что предпочтительно, сухое пятно используют непосредственно в заранее подготовленных для иммуноанализа лунках, а элюирование аналита в лунки осуществляют одновременно с проведением иммунологической реакции. В качестве конъюгата используют пероксидазу хрена с антителами против аналита, а в качестве флуорогенного субстрата 3-гидроксипропионовую кислоту. Способ удобен для осуществления анализа в микротитровальных платах, точный, быстрый, легко может быть автоматизирован.
Флуорогенные субстраты, используемые в способе, не позволяют получить достаточную чувствительность при обнаружении низких концентраций аналита в образце. Кроме того, при измерении флуоресценции на длине волны 405 нм (возбуждение 320 нм) на измеряемые сигналы большое влияние оказывает фоновая флуоресценция полимерных материалов твердой фазы (лунок планшета). Способ не пригоден для многоаналитного анализа.
Известны способ иммуноанализа и реагент для обнаружения гормонов в биологическом образце (патент США 5089423, класс НКИ 436-518). Способ предназначен для выявления в образце крови альфафетопротеина, хорионического гонадотропина человека, ферритина, тиротропина и других гормонов. В способе используют иммобилизацию иммунореактивных веществ, например, антител, на твердой фазе, реагирование комплементарных иммунореактивных веществ с веществами, иммобилизованными на твердой фазе. При этом комплементарные иммунореактивные вещества связаны с частью лиганда, образуя с ионами металлов лантанидов флуоресцентные хелатные метки. После осуществления реакции иммунологического связывания, иммунореактивные вещества, не связавшиеся с иммунореактивными веществами, иммобилизованными на твердой фазе, отмываются, а твердая фаза высушивается. Флуоресценция хелатных меток на дне лунок на комплементарно связанных иммунореактивных веществах измеряется в режиме временного разрешения в присутствии ионов металлов, стабильно связанных с хелатами. В способе исключается необходимость диссоциации меченых комплексов, образовавшихся на твердой фазе, что значительно упрощает процедуру анализа. Усиление сигнала достигается за счет того, что авидин и стрептавидин имеют множество маркерных участков на своей поверхности, что дает возможность получить эффект усиления света. Высушивание твердой фазы перед измерением флуоресценции исключает проблему поглощения или рассеяния возбуждающего потока и излучения эмиссии остаточным количеством реагентов в лунке.
Способ сложный в осуществлении из-за большого количества операций и не может быть использован для обнаружения низких концентраций аналита в образце, т. к. высокий уровень фона твердой фазы при возбуждении хелатов Еu в области 360 нм ограничивает соотношение сигнал/фон. В этом способе пороговый уровень детекции люминесценции ионов Еu не выше 10-12 M.
Наиболее близким является способ обнаружения нескольких аналитов в образце сухой крови (Jong-Juan, at all. Simaltaneous Quadruple-Label Fluorometric Immunoassay of Thyroid-Stimulating Hormone, 17α-Hydroxyprogesterone, Immunoreactive Trypsin, and Creative Kinase MM Isoenzyme in Dried Blood Spots. B: CLIN. CHEM., vol.38, 10, 1992, p. 2038-2043). Способ используют для одновременного обнаружения четырех аналитов в образце сухой крови: тиротропина (TSH), 17α-OH-прогестерона, иммунореактивного трипсина (JRT) и креатинкиназы MM (CK-MM). В способе используют иммунореагенты, меченные четырьмя различными ионами лантанидов: Eu3+, Sm3+, Tb3+ и Dy3+. Анализ осуществляется в лунках микротитровального стрипа, поверхность которого покрыта смесью моноклональных против β-TSH, JRT и CK-MM и поликлональных - против 17α-OH прогестерона. Покрытые стрипы блокируют и стабилизируют при инкубации бычьим сывороточным альбумином, высушивают и хранят при 4oС.
Иммунную реакцию осуществляют в лунках подготовленных к анализу микротитровальных стрипов в присутствии стандартного сухого пятна крови. После инкубации и отмывок связавшиеся Еu3+, Sm3+, Tb3+ и Dy3+ диссоциируют в объем лунки добавлением усиливающего раствора и встряхиванием в течение 4 минут. Интенсивность флуоресценции каждого иона измеряют последовательно на флуориметре с временным разрешением Arcus model 1230 (Wallac OY, Turku, Finland), оборудованном узкополосными интерференционными фильтрами: для Eu3+ (613 нм), Tb3+ (545 нм), Sm3+ (644 нм) и Dy3+ (573 нм) и широкополосным фильтром для создания излучения возбуждения (250-400 нм).
При использовании флуориметрической системы детектирования с временным разрешением, пространственного и временного разрешения меток и выбора их в соответствии с чувствительностью, требуемой для каждого аналита, способ позволяет производить одновременное обнаружение четырех и более аналитов в одном образце. Для достижения необходимой чувствительности в способе осуществляют перекомплексацию ионов металлов лантанидов из одного хелатного комплекса (с низкими параметрами люминесценции) в другой, обеспечивающий высокий уровень квантового выхода люминесценции. Однако, эта операция усложняет способ и не позволяет осуществлять измерение сигнала люминесценции меток непосредственно с поверхности твердой фазы. Недостатком способа является необходимость подбора меток в соответствии с требуемой чувствительностью для каждого аналита и трудности, возникающие из-за перекрестного излучения эмиссии меток, что ограничивает возможности при выборе меток, т.е. ограничивает количество определяемых аналитов в образце.
Задачей является создание многоаналитного, простого чувствительного способа анализа образцов сухих пятен крови, пригодного для массового скрининга населения.
Техническим результатом, достигаемым при использовании изобретения, является повышение чувствительности за счет улучшения отношения сигнал/фон и малый расход антител при многоаналитном анализе.
Технический результат достигается предлагаемым изобретением.
Сущность изобретения заключается в том, что в способе многоаналитного иммуноанализа, включающем иммобилизацию первых биоспецифических компонентов к определяемым аналитам на поверхности лунок микротитровальной платы, экстрагирование определяемых аналитов из сухого пятна крови добавлением в лунку смеси буфера и конъюгата со вторыми биоспецифическими компонентами к определяемым аналитам, проведение реакции биоспецифического связывания реагентов и детектирование излучения эмиссии метки, связанной с аналитом, методом флуориметрии с временным разрешением, первые биоспецифические компоненты к различным антителам иммобилизуют на дне лунок микротитровальной платы в виде дискретных микрообластей, суммарная площадь которых меньше или равна площади сухого пятна крови, смесь буфера и конъюгата со вторыми, мечеными или немечеными, биоспецифическими компонентами к определяемым аналитам наносят непосредственно на сухое пятно крови в объеме, эквивалентном его сорбционной емкости, удаляют сухое пятно крови из лунки, реакцию биоспецифического связывания с меченными Pt копро- или уропорфирином биоспецифическими компонентами проводят в дискретных микрообластях иммобилизованных первых биоспецифических компонентов, лунки отмывают, высушивают, а эмиссию фосфоресценции метки, связанной с различными определяемыми аналитами, детектируют, последовательно сканируя микрообласти сфокусированным лазерным пучком.
Сущность изобретения заключается также в том, что в качестве первых биоспецифических компонентов используют антитела к определяемым аналитам.
Сущность изобретения заключается также и в том, что в качестве первых биоспецифических компонентов используют конъюгаты белков-носителей с аналитами.
Сущность изобретения заключается также в том, что вторые биоспецифические компоненты состоят из конъюгатов с антителами к определяемым аналитам, меченными Pt копро- или уропорфирином.
Сущность изобретения заключается и в том, что вторые биоспецифические компоненты состоят из комплекса конъюгата вторых антител к определяемым аналитам с биотином и стрептавидина (или авидина), меченного Pt копро- или уропорфирином.
Сущность изобретения заключается также в том, что вторые биоспецифические компоненты состоят из вторых антител и конъюгатов антивидовых антител ко вторым антителам, меченных Pt копро- или уропорфирином.
Сущность изобретения заключается также в том, что площадь поперечного сечения сканирующего лазерного луча меньше площади микроплощадок с иммобилизованными первыми антителами.
Авторам не известны технические решения, имеющие такую же совокупность признаков, как совокупность признаков заявляемого изобретения. Следовательно, заявляемое изобретение отвечает критерию новизны.
Заявляемое изобретение отличается от прототипа новыми признаками и иным выполнением известных признаков. Используемые в качестве метчика иммунореагентов фосфоресцирующие при комнатной температуре водорастворимые Pt комплексы копро- или уропорфиринов обладают соизмеримой с ионами редкоземельных металлов (Еu, например) интенсивностью люминесценции, способны длительно люминесцировать на твердой фазе и позволяют производить считывание сигнала непосредственно из дискретных зон связывания антител с искомыми аналитами без операции их диссоциации в объем реакционного сосуда (лунки), что позволяет выявлять одновременно множество аналитов при использовании одной метки. Использование указанного объема смеси экстрагирующего раствора (буфера и конъюгата) позволяет избежать маскирующего действия форменных элементов крови на измеряемый сигнал, что в совокупности с остальными признаками дает возможность повысить концентрацию искомых аналитов в дискретных зонах и, следовательно, повысить чувствительность способа. Следовательно, предлагаемое изобретение отвечает критерию уровня техники.
Изобретение может быть использовано в здравоохранении, в частности в педиатрии и неонаталогии, для своевременного выявления врожденных аномалий развития детей с целью своевременного проведения коррегирующей терапии. Следовательно, предлагаемое изобретение отвечает критерию промышленной применимости.
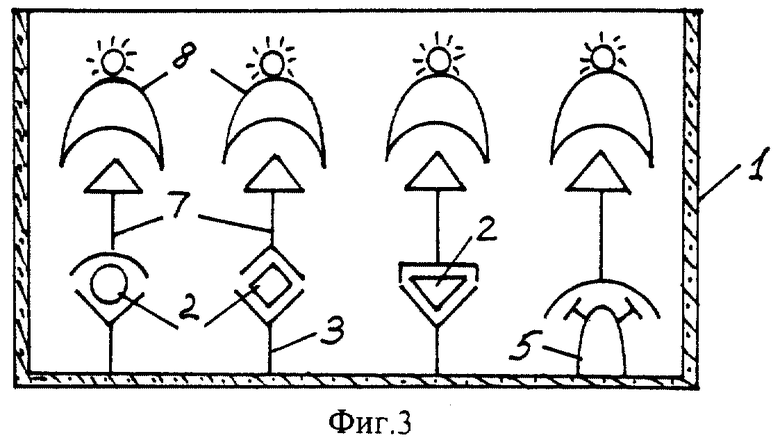
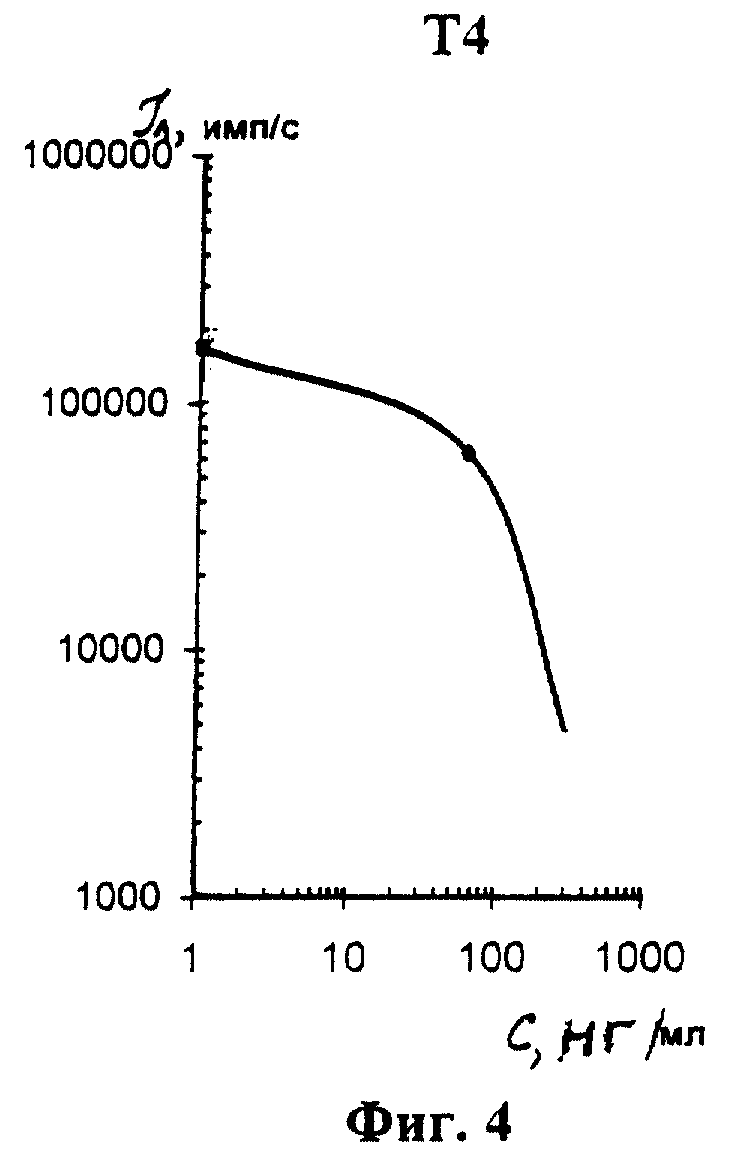
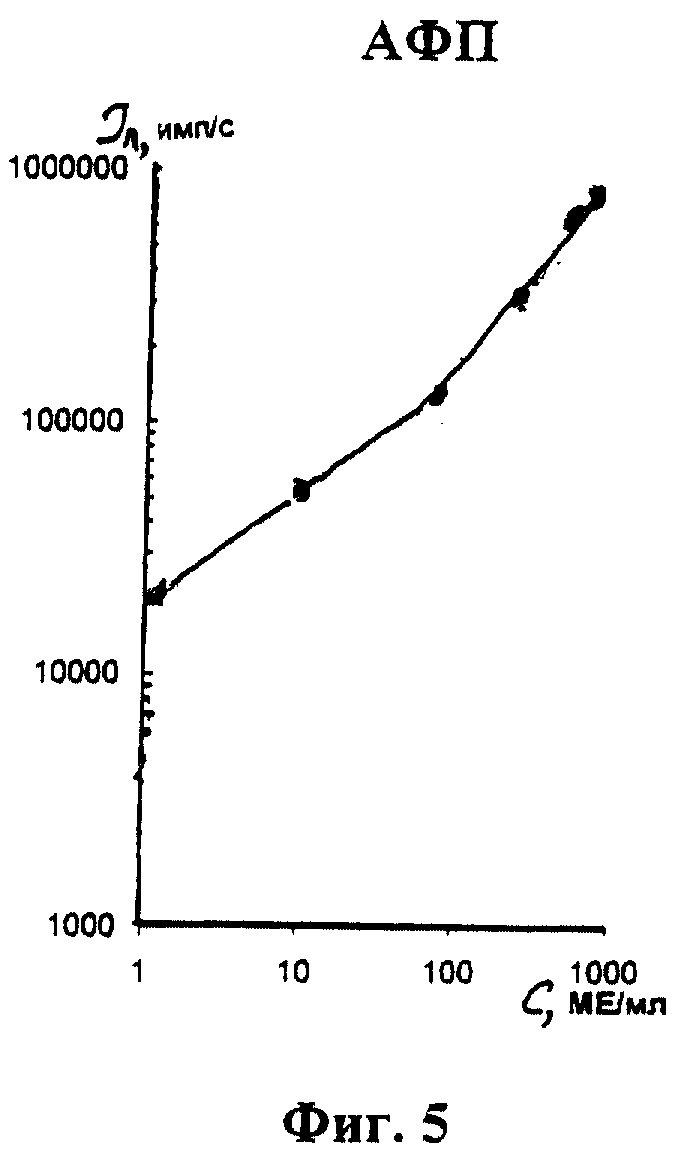
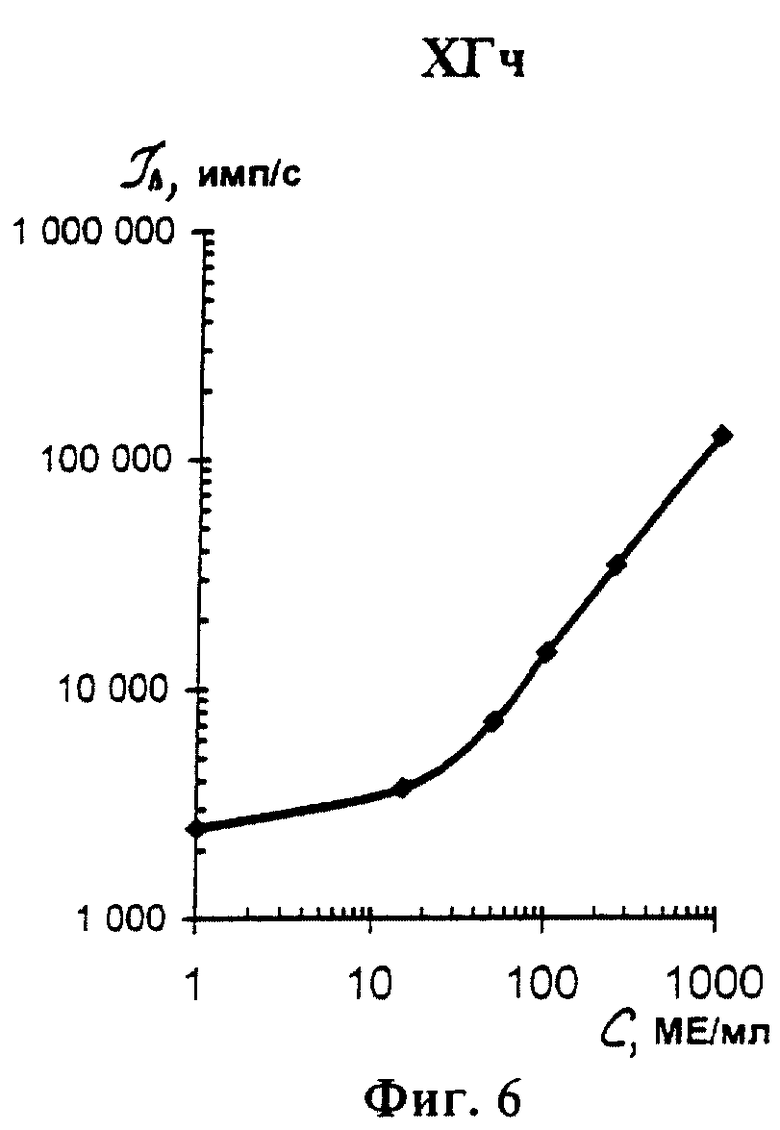
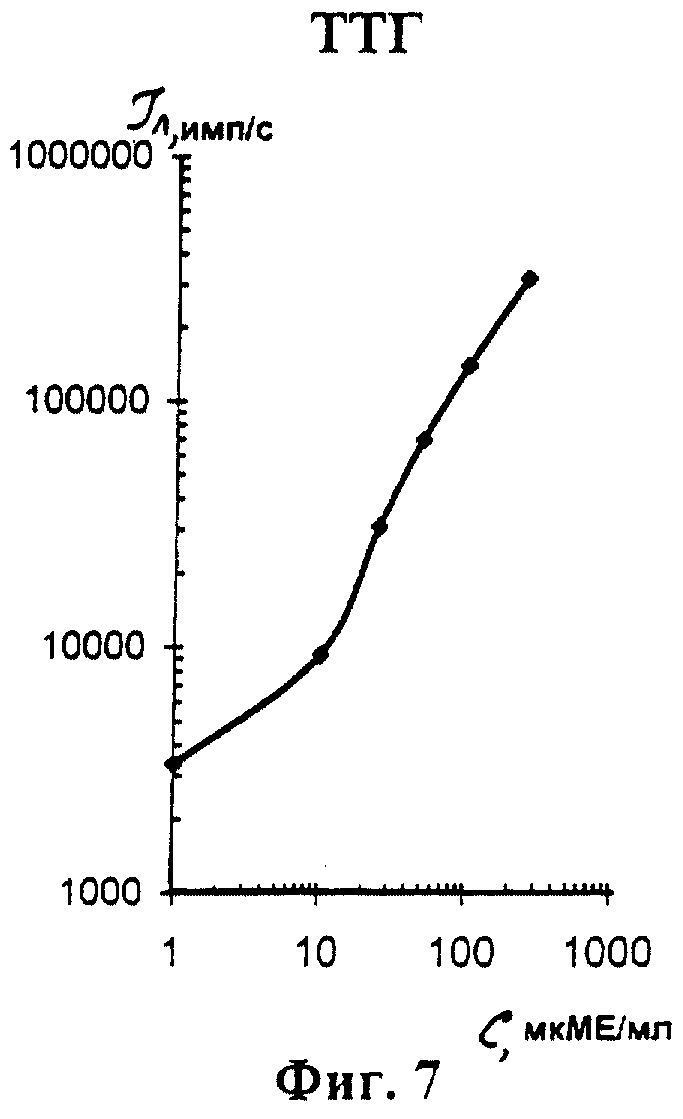
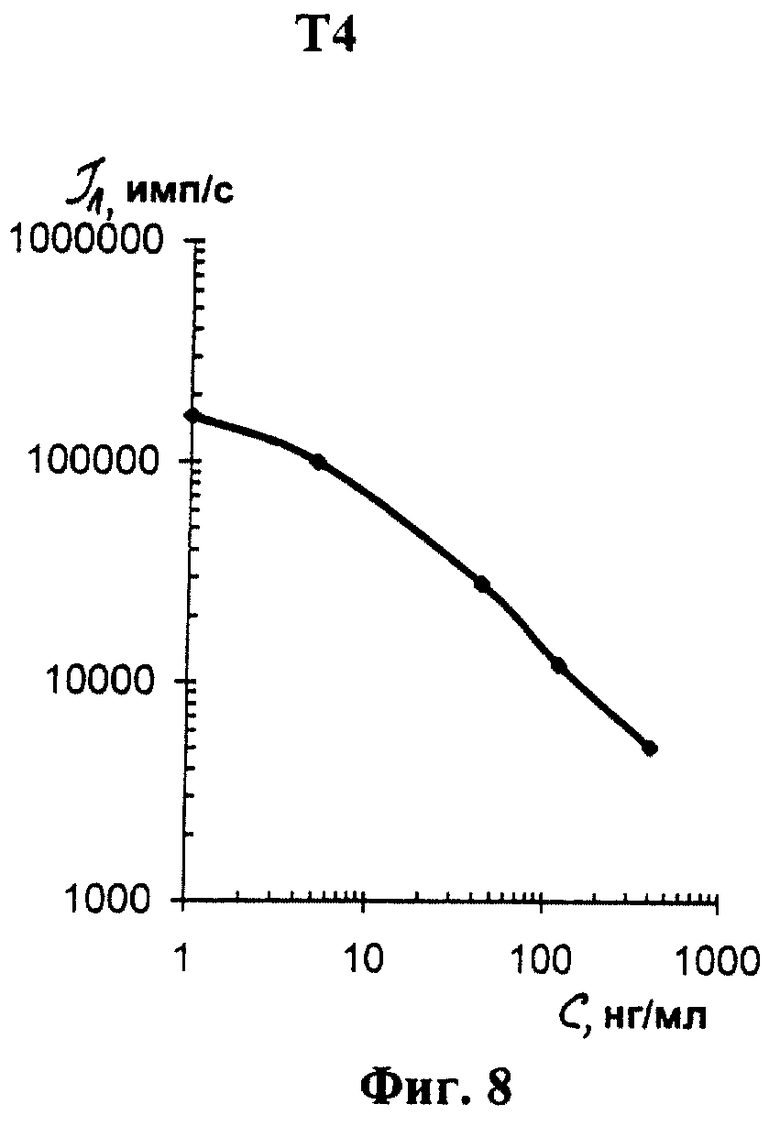
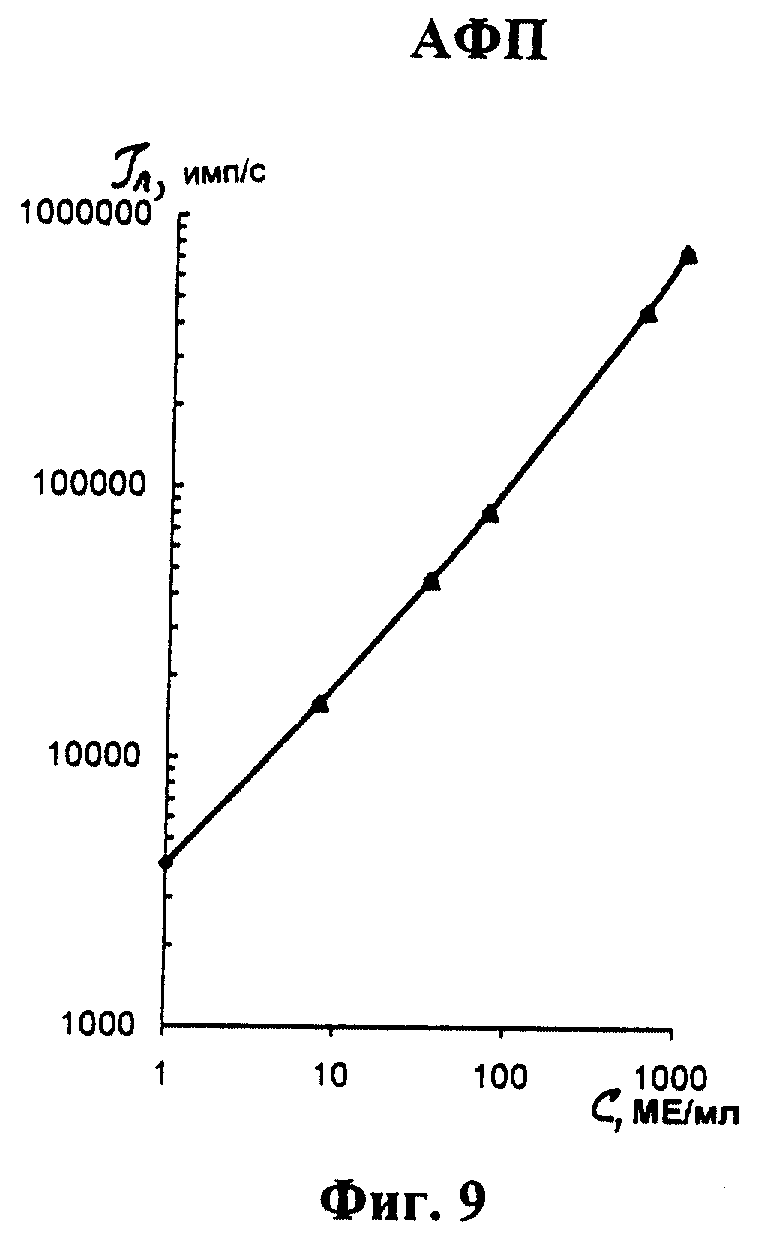
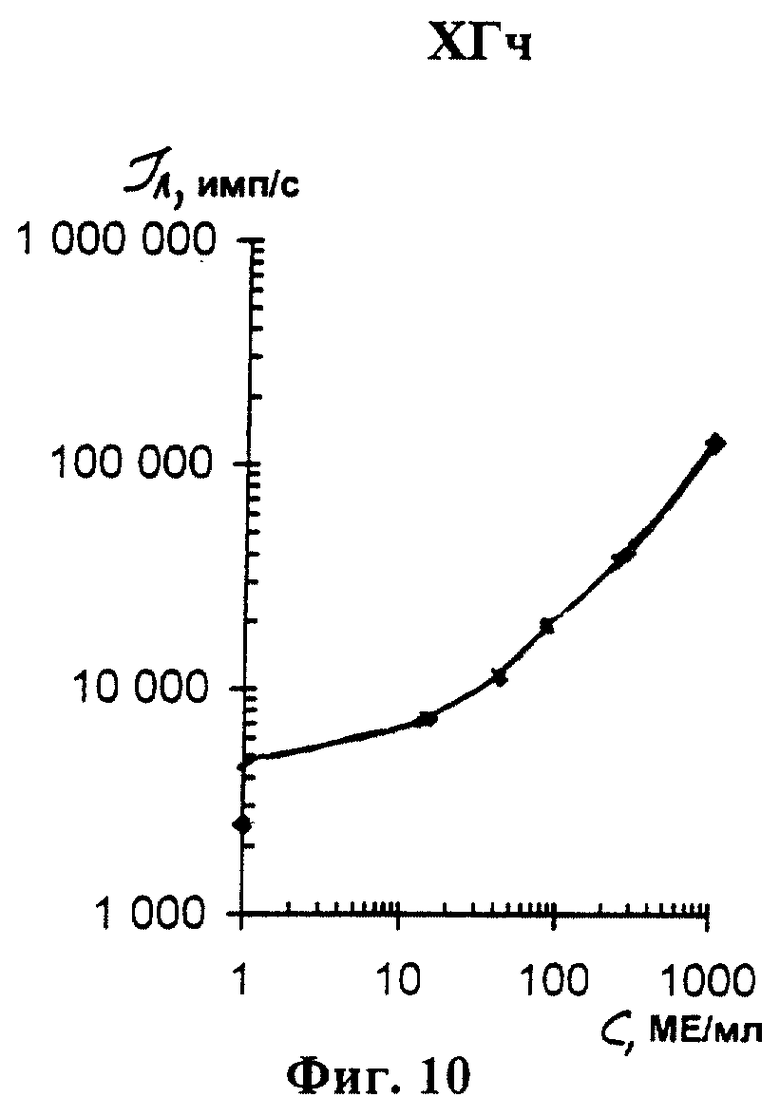
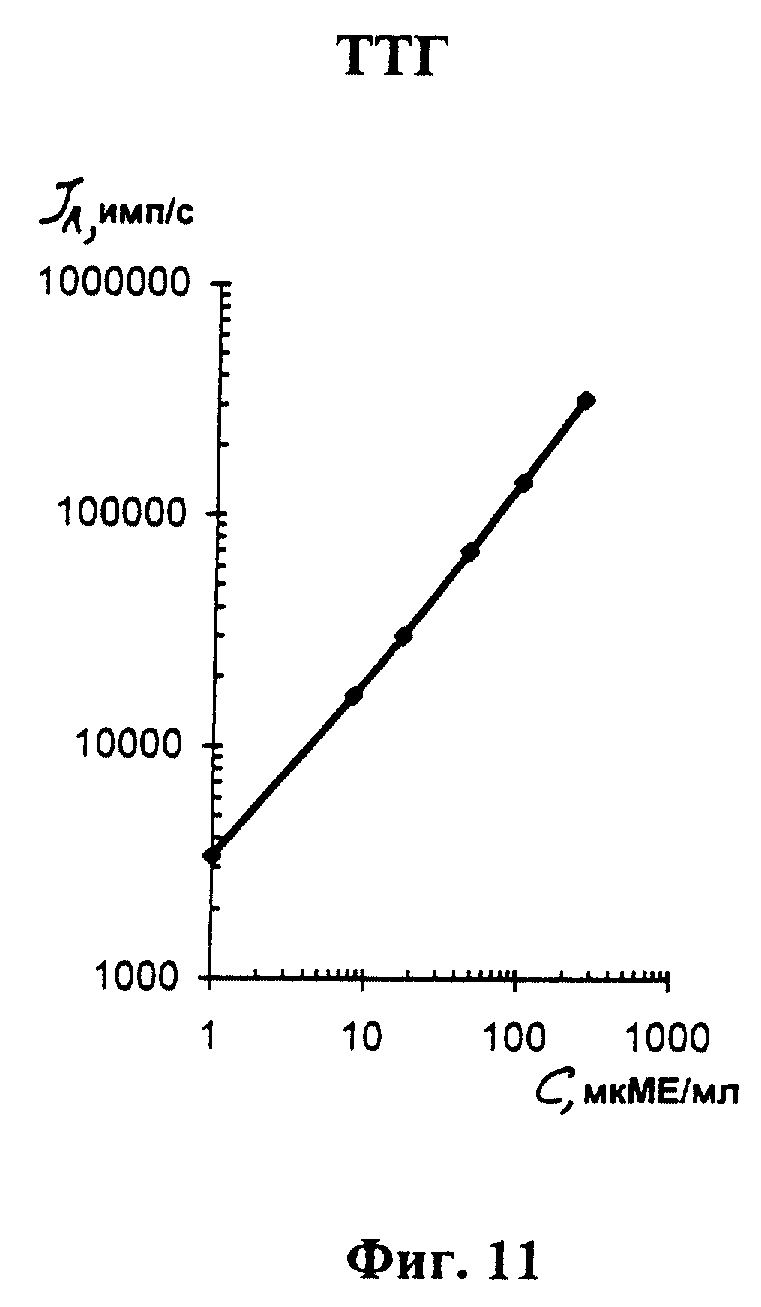
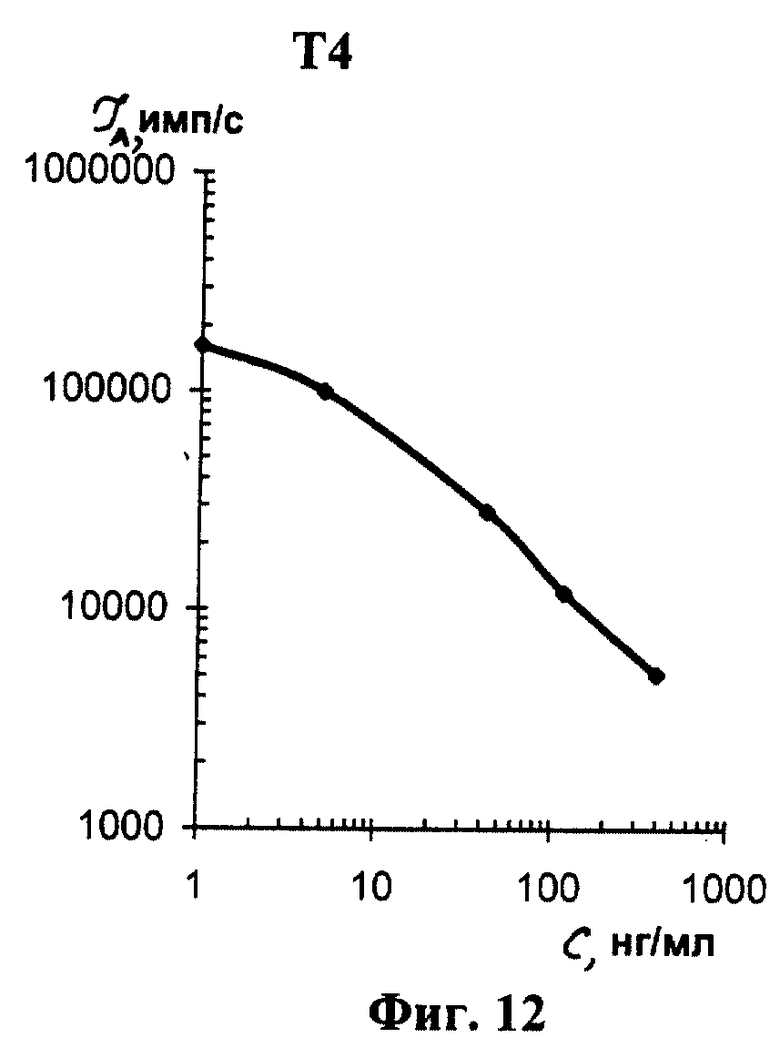
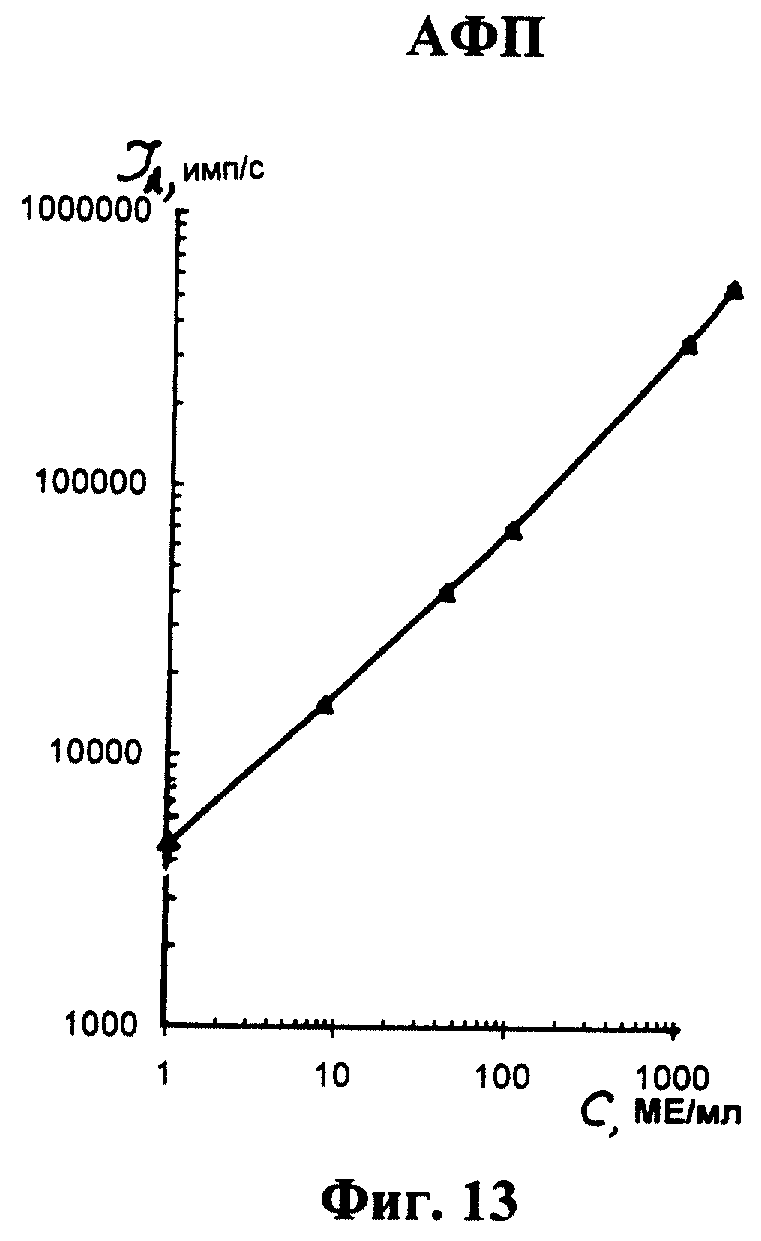
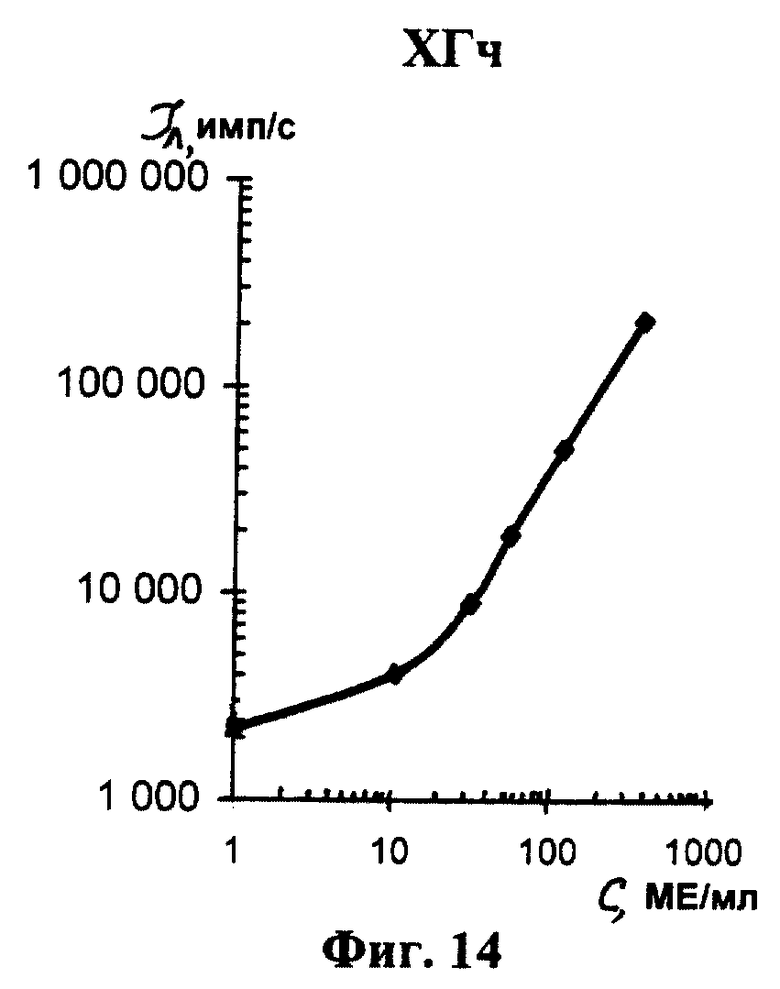
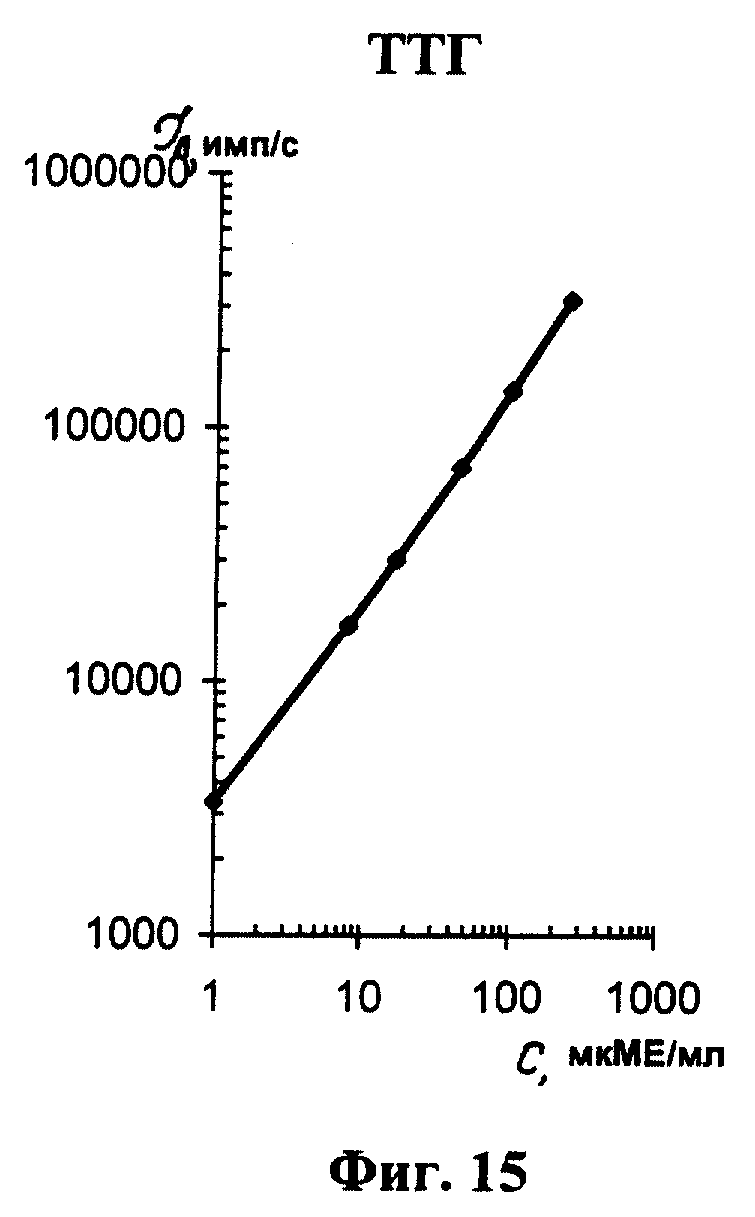
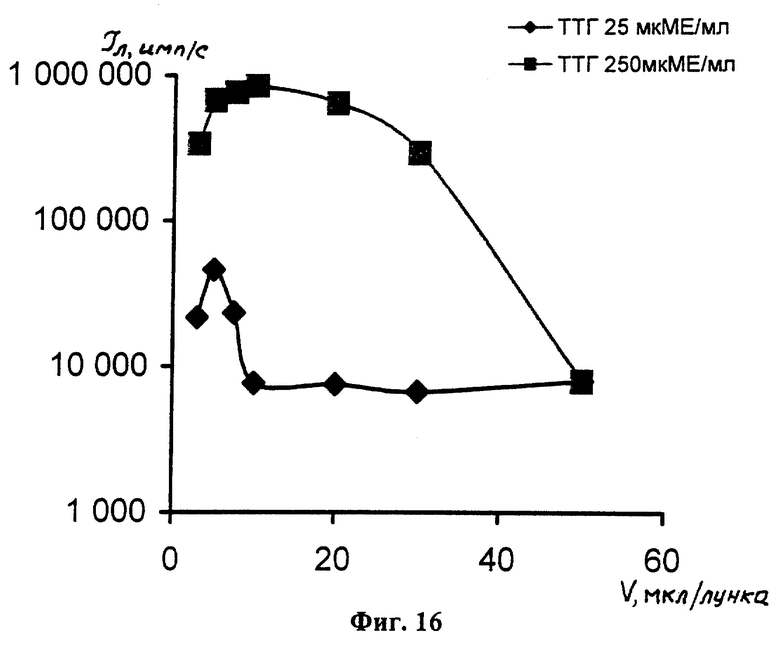
На фиг. 1 показана схема осуществления эксперимента в примерах 1, 2 (прямой метод проведения анализа); на фиг.2 показана схема осуществления эксперимента в примере 3 (непрямой метод проведения анализа); на фиг.3 показана схема осуществления эксперимента в примере 4 (метод анализа со стрептавидином-авидином); на фиг. 4-7 показаны калибровочные кривые для определения концентрации Т4 (тиропсина), АФП (альфафетопротеина), ХГч (хорионического гонадотропина человека) и ТТГ (тиротропного гормона) соответственно по примеру 1, 2; на фиг.8-11 показаны калибровочные кривые для определения концентрации Т4, АФП, ХГч и ТТГ соответственно по примеру 3; на фиг. 12-15 показаны калибровочные кривые для определения концентрации Т4, АФП, ХГч и ТТГ соответственно по примеру 4; на фиг.16 показана зависимость люминесценции метки от объема экстрагирующего буфера при различных концентрациях ТТГ: кривая 9 - концентрация ТТг 250 мкМЕ/мл; кривая 10 - концентрация ТТГ 25 мкМЕ/мл.
На фиг. 1-3 изображены: лунка микротитровальной платы 1, определяемый аналит 2, иммобилизованное на твердой фазе (дне лунки) антитело 3, конъюгаты вторых антител с Pt копропорфирином 4, конъюгат бычьего сывороточного альбумина с аналитом 6; конъюгаты вторых антител с биотином 7, конъюгат стрептавидина с Pt копропорфирином 8.
Способ осуществляется следующим образом.
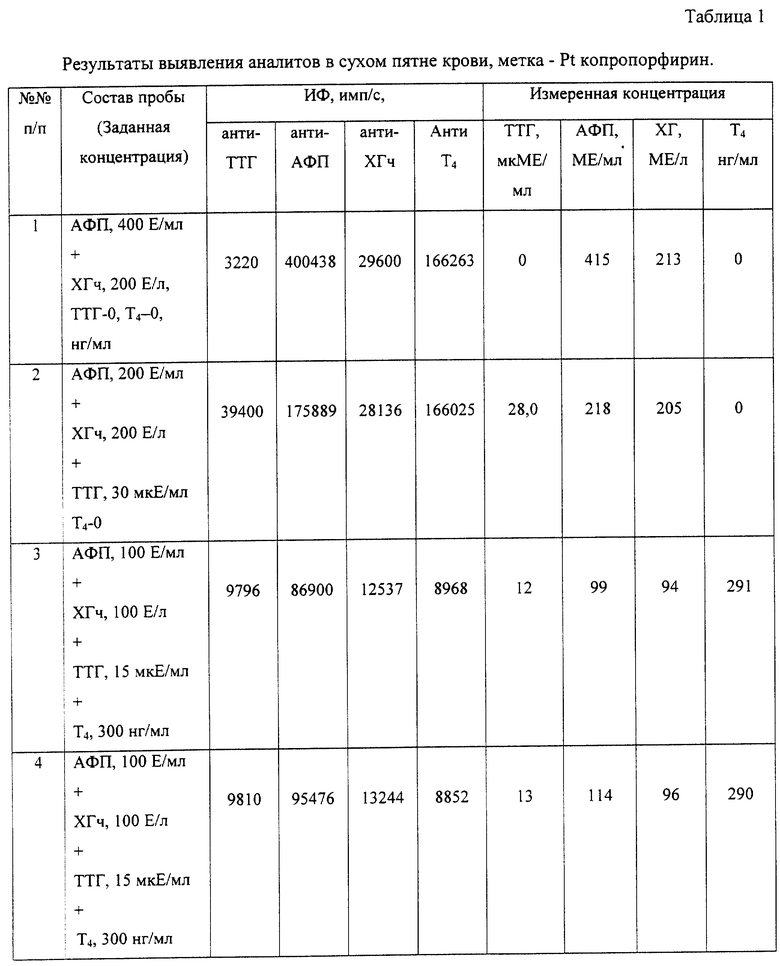
Пример 1. Обнаружение четырех аналитов из образца сухого пятна крови, материал метки - Pt копропорфирин.
Твердофазный носитель (лунки микротитровального 96-луночного микропланшета) обрабатывают первым биоспецифическим компонентом - специфическими антителами к каждому из искомых аналитов. Для этого на дно лунок с помощью микродозатора (Labsystems OY) вносят в виде дискретных зон по 1 мкл первых антител к каждому из искомых аналитов. Концентрация антител составляет 5 мкг/мл. Распределение антител в виде отдельных зон осуществляется таким образом, чтобы расстояние между зонами не превышало 1 мм и общая площадь, занимаемая сенсибилизированными антителами, не превышала площадь, занимаемую сухим пятном (от 3 до 5 мм). Антитела инкубируют в течение 2 часов при 37oС и затем удаляют избыток несвязавшихся антител 3-кратной промывкой водой. После этого, для исключения возможности неспецифического связывания, дно и стенки лунки обрабатывают блокирующим 15 мМ фосфатным буферным раствором, содержащим бычий сывороточный альбумин в концентрации 1%. Блокирование БСА осуществляют в течение 1-2 часов при комнатной температуре, затем удаляют раствор БСА, микропланшет высушивают и используют для проведения анализа.
В лунку подготовленного микропланшета вносят бумажный диск с сухим пятном крови (диаметр диска от 3 до 5 мм). На поверхность диска для экстракции аналитов наносят смесь буферного раствора в количестве 5 мкл, содержащего Твин 20 - 0,05%, тритон Х-100 - 0,1%, Трис-НСl - 15 мМ, БСА - 1%, и конъюгаты специфических антител к тиротропину, альфафетопротеину, хориогонадотропину и тироксину с Pt копропорфирином в концентрации 1мкг в мл каждый (вторые биоспецифические компоненты). Соотношение метка/белок в конъюгате 5: 1-4: 1. Конъюгаты получают обработкой Pt копропорфирина карбодиимидом и сукцинимидом для его активации с последующим внесением в реакционную смесь антител (см. 9. De Haas R.R. et al., Platinum porphyrins as phosphorescent label for time-resolved microscopy, J.Histochem.& Cytochem., 45, (1997) 1279-1292). Для получения конъюгатов используют коммерческие препараты антител с известными характеристиками (Моноклональные антитела к гормонам получены по ТУ ГНЦ ГосНИИБП на соответствующие наборы ТУ9398-334-05031637-97- ТТГ, ТУ9398-065-05031637-01- АФП, ТУ-9398-066-05031637-01 -ХГЧ, ТУ 79398-067-05031637-01 - Т4, хорионический гонадотропин фирмы Boehringer Manheim кат. номер 253065, тиротропин кат.номер 252948, АФП - DAKO Финбио, прейскурант 2000 г. кат. Х0900, моноклональные антитела: Т4 - ICN саt. 631021, TTG - DAKO Финбио, прейскурант 2000 г. кат. М3503, hCG - ICN саt. 10810, 63011, AFP - ICN саt. 692031).
Инкубируют диск в течение 2 часов. Затем диск с пятном крови удаляют с помощью Diskremove фирмы Wallac OY (Финляндия), лунки промывают трижды водным раствором, высушивают до полного удаления воды и регистрируют сигнал фосфоресценции метки с дна лунки на фосфориметре с временным разрешением (ИФИ-02, Россия) при стробоскопическом возбуждении источником света с длиной волны 532 нм и эмиссией с максимумом 645 нм. Время задержки между актами возбуждения и приемом фосфоресценции 40 мкс, время регистрации строба фосфоресценции 100 мкс. Фосфориметр обеспечивает регистрацию сигнала фосфоресценции от каждой из четырех зон (микрообластей) при детектировании четырех аналитов, при этом площадь зондирующего светового луча выбирают заведомо меньше анализируемой микрообласти с искомым аналитом, что исключает влияние сигналов соседних зон друг на друга. Экспериментальные данные по определению концентрации искомых аналитов приведены в таблице 1. Схема осуществления эксперимента показана на фиг.1.
Как видно из примера 1, расход антител, используемых для сенсибилизации твердой фазы, сокращается до 5 -10 нг, что почти в 50-100 раз меньше, чем в прототипе.
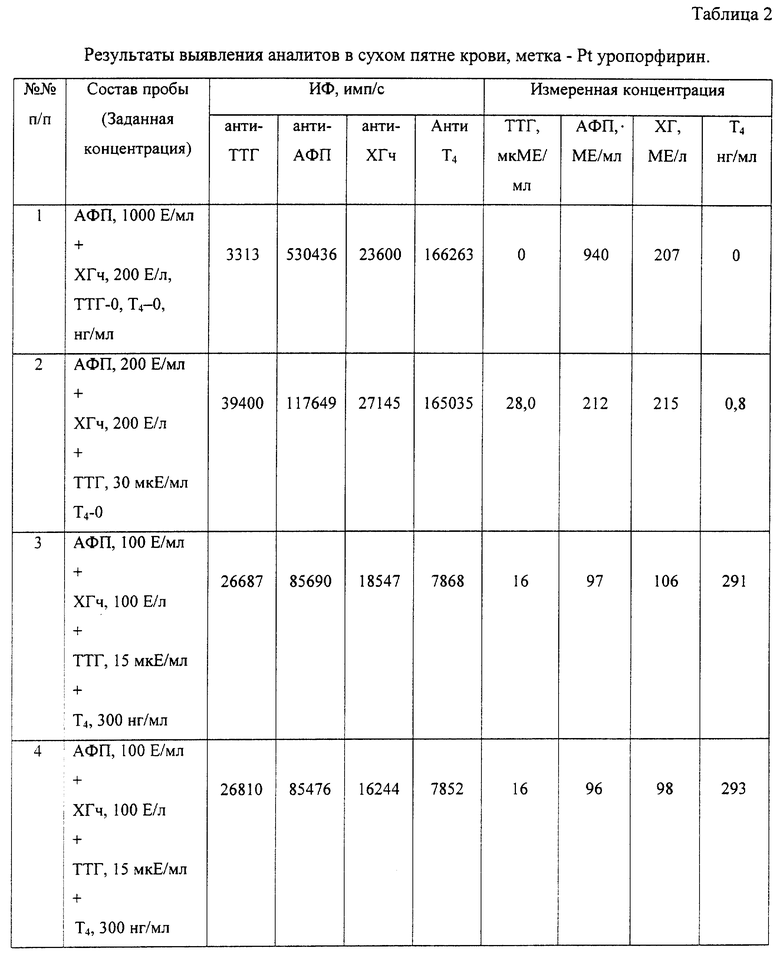
Пример 2. Обнаружение четырех аналитов из образца сухого пятна крови, материал метки - Pt уропорфирин.
Способ осуществляется так же, как в примере 1. В качестве метки для вторых антител (второго биоспецифического компонента) используют Pt уропорфирин. Нагрузка метки в конъюгатах варьирует в пределах 6:1...4:1. Экспериментальные данные определения концентрации искомых аналитов приведены в таблице 2.
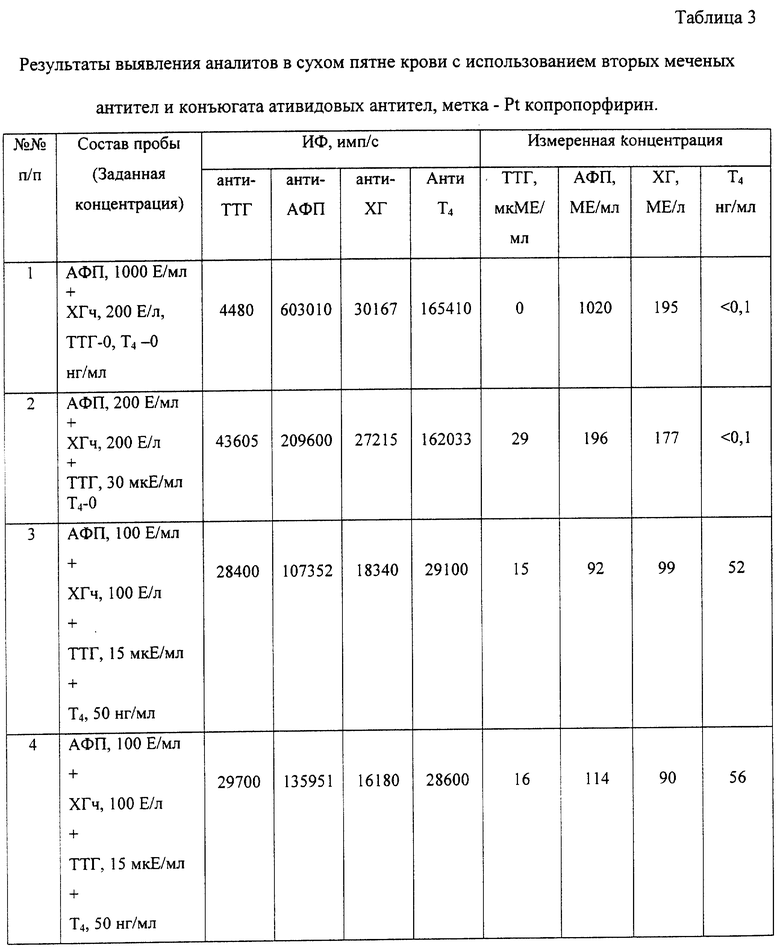
Пример 3. Обнаружение четырех аналитов из образца сухого пятна крови с использованием в качестве второго биоспецифического компонента системы вторых меченых антител и конъюгата антивидовых антител с Pt копропорфирином.
Твердофазный носитель (лунки микротитровального 96-луночного микропланшета) обрабатывают аналогично примеру 1 специфическими антителами к каждому из искомых аналитов. Для этого на дно лунок с помощью микродозатора (Labsystems OY) вносят в виде отдельных зон по 1 мкл антител к каждому из искомых аналитов. Концентрация антител составляет 5 мкг/мл. Распределение антител в виде отдельных зон осуществляется таким образом, чтобы расстояние между зонами не превышало 1 мм и общая площадь, занимаемая сенсибилизированными антителами, не превышала площадь, занимаемую сухим пятном (от 3 до 5 мм). Антитела инкубируют в течение 2 часов при 37oС и затем удаляют избыток несвязавшихся антител 3-кратной промывкой водой. После этого, для исключения возможности неспецифического связывания, дно и стенки лунки обрабатывают блокирующим 15 мМ фосфатным буферным раствором, содержащим бычий сывороточный альбумин в концентрации 1%. Блокирование БСА осуществляют в течение 1-2 часов при комнатной температуре, затем удаляют раствор БСА, микропланшет высушивают и используют для проведения анализа.
В лунку подготовленного микропланшета вносят бумажный диск с сухим пятном крови (диаметр диска от 3 до 5 мм). На поверхность диска для экстракции аналитов наносят смесь буферного раствора в количестве 5 мкл, содержащего Твин 20 - 0,05%, Твин 60 - 0,05%, тритон Х-100 - 0,1%, Трис-НСl -15 мМ, БСА - 1%, и специфические антитела (к тиротропину, альфафетопротеину, хориогонадотропину, тироксину) в концентрации 1 мкг в мл каждый. Для проведения анализа используют коммерческие препараты гормонов и кроличьи антитела к вышеперечисленным гормонам (каталог фирмы Sigma).
Инкубируют диск в течение 1 часа. Затем диск с пятном крови удаляют с помощью Diskremove фирмы Wallac OY (Финляндия), затем в лунки вносят по 20 мкл конъюгата антивидовых мышиных антител против иммуноглобулинов кролика (каталог фирмы Sigma) с Pt копропорфирином в концентрации 1 мкг в мл. Соотношение метка/белок в конъюгате 5:1-4:1. Конъюгаты получают обработкой Pt копропорфирина карбодиимидом и сукцинимидом для его активации с последующим внесением в реакционную смесь антител (см.9. De Haas R.R. et al., Platinum porphyrins as phosphorescent label for time-resolved microscopy, J.Histochem. & Cytochem., 45, (1997) 1279-1292). Для получения конъюгатов используют коммерческие препараты антител с известными характеристиками. Конъюгат инкубируют в лунке течение 30 минут и затем лунки промывают трижды водным раствором, высушивают до полного удаления воды и регистрируют сигнал фосфоресценции метки с дна лунки на фосфориметре с временным разрешением (ИФИ-02, Россия) при стробоскопическом возбуждении источником света с длиной волны 532 нм и эмиссией с максимумом 645 нм. Время задержки между актами возбуждения и приемом фосфоресценции 40 мкс, время регистрации строба фосфоресценции 100 мкс. Фосфориметр обеспечивает регистрацию сигнала фосфоресценции от каждой из 4 зон, при этом площадь зондирующего луча должна быть заведомо меньше анализируемой площадки с искомым аналитом, что исключает влияние сигнала соседней зоны с другим аналитом. Экспериментальные данные определения концентрации искомых аналитов приведены в табл. 3. Схема осуществления эксперимента показана на фиг.2.
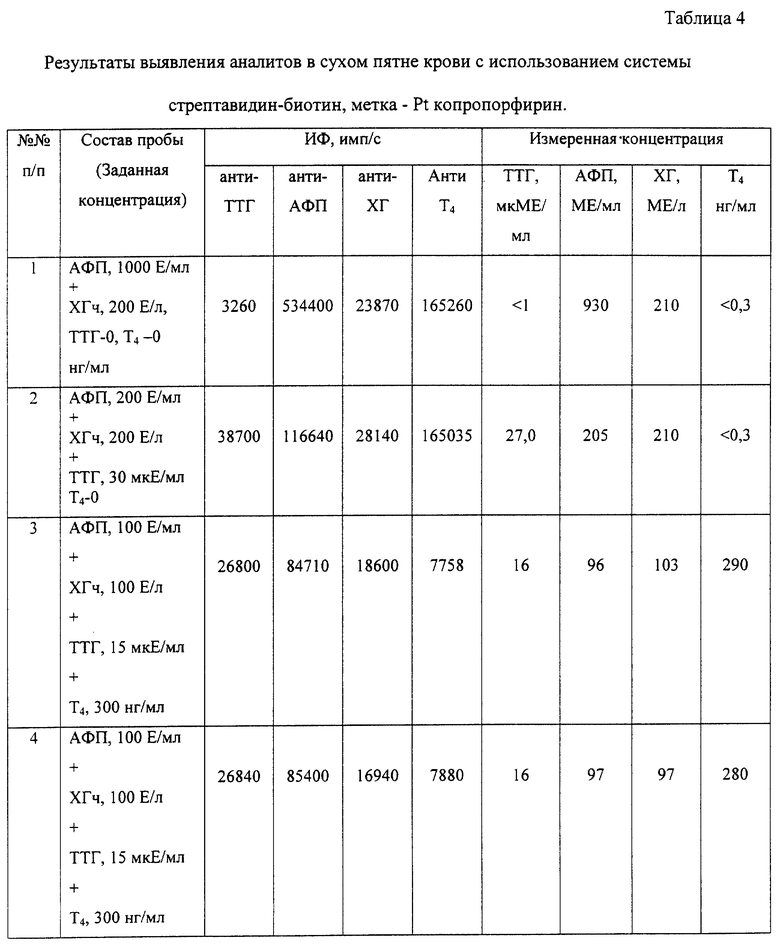
Пример 4. Обнаружение четырех аналитов из образца сухого пятна крови с использованием в качестве вторых биоспецифических компонентов комплекса вторых антител, меченных биотином, и конъюгата стрептавидина с меткой, материал метки - Pt копропорфирин.
Обработка твердофазного носителя (дна лунки 96-луночного микропланшета) специфическими антителами (первыми биоспецифическими компонентами) и обработка блокирующим буферным раствором осуществляются, как описано в примере 3. Затем в лунку подготовленного микропланшета вносят бумажный диск с сухим пятном крови. На поверхность диска для экстракции аналитов наносят смесь буферного раствора в количестве 5 мкл, содержащего Твин 20 - 0,05%, Твин 60 - 0,05%, тритон X-100 - 0,1%, Трис-НСl - 15 мМ, БСА - 1%, и конъюгаты биотинилированных мышиных моноклональных антител к искомым аналитам. Конъюгаты антител с биотином получают с помощью активированных производных биотина (биотингидроксисукцинимид ICN, cat. 62601). В качестве антител используют коммерческие антитела по ТУ ГНЦ ГосНИИБП на соответствующие наборы ТУ9398-334-05031637-97- ТТГ, ТУ9398-065-05031637-01- АФП, ТУ-9398-066-05031637-01 -ХГЧ, ТУ-79398-067-05031637-01 - Т4: Т4 - ICN са1. 631021, TTG - DAKO Финбио, прейскурант 2000 г. кат. М3503. hCG - ICN са1. 10810, 63011, AFP - ICN саt. 692031. Конъюгаты антител в смеси с буфером вносят в концентрации 1 мкг/мл. После инкубации и удаления сухого пятна крови в лунки вносят конъюгаты стрептавидина или авидина с люминесцентной меткой (второй биоспецифический компонент) в объеме 10 мкл с концентрацией 100 нг/мл. В качестве люминесцентной метки используют Pt копро- или уропорфирин. Конъюгаты получают обработкой Pt копропорфирина карбодиимидом или сукцинимидом для его активации с последующим внесением в реакционную смесь стрептавидина или авидина. De Haas R.R. et al., Platinum porphyrins as phosphorescent label for time-resolved microscopy, J.Histochem.& Cytochem., 45, (1997) 1279-1292). Нагрузка люминесцентной метки в конъюгатах со стрептавидином варьируется от 6:1 до 4:1.
Проводят инкубацию в течение 30 минут. Затем лунки промывают 3-кратно дистиллированной водой, высушивают и регистрируют сигнал длительной люминесценции. Экспериментальные данные определения концентрации искомых аналитов приведены в таблице 4. Схема осуществления эксперимента показана на фиг.3.
Использование непрямых вариантов иммунофосфоресцентного анализа с использованием вторых биоспецифических компонентов в виде комплексов (видовых специфических и антивидовых антител или системы стрептавидин -биотин) целесообразно в том случае, если получение прямых конъюгатов с первыми специфическими к искомому аналиту антителами затруднено, т.к. приводит к снижению их специфической активности или, если эти антитела имеются в очень ограниченном количестве и не могут быть использованы для получения конъюгатов.
Пример 5. Получение калибровочных кривых.
Количественную оценку содержания аналитов в исследуемом сухом пятне крови осуществляют по калибровочным кривым, построенным по экспериментальным данным, полученным при исследовании сухих образцов крови (как описано в примерах 1-4) с заданной концентрацией в них аналитов. Экспериментальные данные для построения калибровочных кривых приведены в таблице 5, калибровочные кривые на фиг. 4-7 - для определения концентрации аналитов по примеру 1; в таблице 6, калибровочные кривые на фиг.8-11 - для определения концентрации аналитов по примеру 3; в таблице 7, калибровочные кривые на фиг.12-15 - для определения концентрации аналитов по примеру 4. Данные кривые построены для случая, когда в качестве люминесцентной метки используют Pt копропорфирин; для случая, когда в качестве люминесцентной метки используют Pt уропорфирин, кривые строятся при проведении аналогичных экспериментов. Как следует из калибровочных кривых, предлагаемый способ обеспечивает повышение чувствительности анализа (снижение порогового уровня детектирования) по сравнению с известным способом.
Пример 6. Выбор оптимального объема экстрагирующего буфера.
На фиг. 16 представлены экспериментальные зависимости люминесценции исследуемого образца от объема экстрагирующего буфера при различных концентрациях гормона ТТГ в образце сухого пятна крови. Как видно из кривых 9, 10, эффективность десорбции резко снижается при увеличении объема буфера. Причем снижение эффективности десорбции тем выше, чем выше концентрация анализируемого гормона (кривая 9 на фиг.16). Это связано с тем, что при экстракции большими объемами одновременно с гормонами происходит экстракция форменных элементов крови, которые экранируют слой специфических антител и препятствуют прохождению иммунной реакции. При снижении объема буфера до 3-5 мкл в анализируемом объеме практически отсутствует свободная вода и не происходит экстракция из материала пятна форменных элементов крови. В связи с этим для многокомпонентного анализа используется буер объемом не более 5 мкл. Снижение объема буфера до 3-5 мкл, кроме того, позволяет поднять чувствительность анализа за счет того, что повышается концентрация гормона и улучшается взаимодействие с антителами твердой фазы.
Использование в качестве метки Pt копро- или уропорфирина позволяет осуществить измерения люминесцентных сигналов в более длинноволновой области спектра, чем в значительной степени уменьшается влияние на измеряемый сигнал коротковолновой флуоресценции материала твердой фазы, т.е. улучшается отношение сигнал/фон. При этом высушивание реакционного материала на твердой фазе (дне лунки) увеличивает квантовый выход метки в 30-50 раз. Ограниченный объем смеси буфера и второго биоспецифического компонента позволяет за счет градиентного распределения между сухим пятном крови и твердой фазой с иммобилизованными первыми биоспецифическими компонентами экстрагировать из сухого пятна крови только определяемые аналиты, чем исключается маскирующее действие форменных элементов крови. Совокупность этих признаков позволяет достичь чувствительности (порогового уровня), достаточной для детектирования малых количеств аналитов в микрозонах. Следовательно, способ позволяет осуществить многоаналитный анализ сухого образца крови при использовании одной метки, что упрощает способ и решает задачу детектирования количества определяемых аналитов, возникающую у прототипа из-за перекрытия спектров излучения меток.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОДНОВРЕМЕННОГО ДЕТЕКТИРОВАНИЯ НЕСКОЛЬКИХ МАРКЕРОВ ВРОЖДЕННЫХ ЗАБОЛЕВАНИЙ В СУХИХ ПЯТНАХ КРОВИ | 2013 |
|
RU2541164C2 |
| СПОСОБ ОДНОВРЕМЕННОГО ДЕТЕКТИРОВАНИЯ ТИРОТРОПИНА И ОБЩЕГО ТИРОКСИНА В СУХИХ ПЯТНАХ КРОВИ | 2012 |
|
RU2480772C1 |
| СПОСОБ МНОГОАНАЛИТНОГО ИММУНОАНАЛИЗА | 2014 |
|
RU2593787C2 |
| СПОСОБ ОБНАРУЖЕНИЯ И ИДЕНТИФИКАЦИИ КЛЕТОК МИКРООРГАНИЗМОВ И ВИРУСОВ | 2001 |
|
RU2197732C1 |
| СПОСОБ ОДНОВРЕМЕННОГО ДЕТЕКТИРОВАНИЯ АНТИТЕЛ КЛАССА G К АНТИГЕНАМ ВОЗБУДИТЕЛЕЙ TORCH-ИНФЕКЦИЙ С ИСПОЛЬЗОВАНИЕМ ИММУНОЧИПА | 2014 |
|
RU2545792C2 |
| СПОСОБ МНОГОАНАЛИТНОГО ИММУНОАНАЛИЗА С ИСПОЛЬЗОВАНИЕМ МИКРОЧАСТИЦ | 2007 |
|
RU2339953C1 |
| Способ проведения биологического микроанализа | 2019 |
|
RU2710262C1 |
| СПОСОБ МНОГОАНАЛИТНОГО ИММУНОАНАЛИЗА С ИСПОЛЬЗОВАНИЕМ МИКРОЧАСТИЦ | 2008 |
|
RU2379691C1 |
| МИКРОТИТРОВАЛЬНАЯ ПЛАТА | 1999 |
|
RU2158179C1 |
| УСТРОЙСТВО ДЛЯ БИОЛОГИЧЕСКОГО КОНТРОЛЯ ВОЗДУШНОЙ И ВОДНОЙ СРЕДЫ | 2002 |
|
RU2238542C2 |
Изобретение относится к иммунологическим методам анализа и может быть использовано для массового скрининга врожденных аномалий у новорожденных, контроля иммунного и гормонального статуса, некоторых инфекционных заболеваний и репродуктивной функции женщин. Способ заключается в том, что на дне лунок микротитровальной платы иммобилизуют первые биоспецифические компоненты к различным определяемым аналитам в виде дискретных микрообластей, суммарная площадь которых меньше или равна площади сухого пятна крови, смесь буфера и конъюгата со вторыми, мечеными или немечеными, биоспецифическими компонентами к определяемым аналитам наносят непосредственно на сухое пятно крови в объеме, эквивалентном его сорбционной емкости, удаляют сухое пятно крови из лунки, реакцию биоспецифического связывания с меченными Pt копро- или уропорфирином биоспецифическими компонентами проводят в дискретных микрообластях, лунки отмывают, высушивают, а эмиссию фосфоресценции метки детектируют, последовательно сканируя микрообласти сфокусированным лазерным лучом. Способ обеспечивает повышение чувствительности анализа. 6 з.п. ф-лы, 7 табл., 16 ил.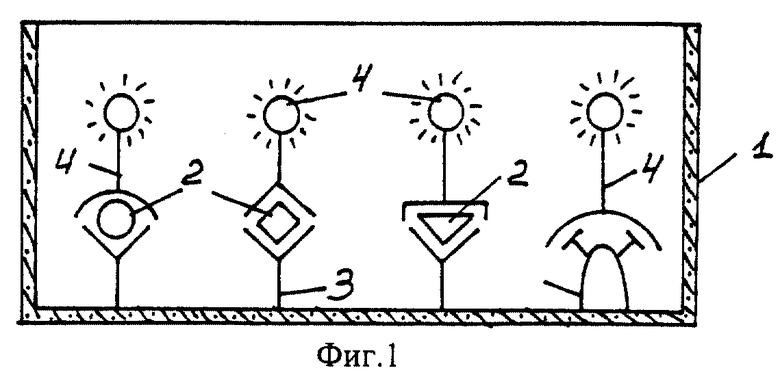
| Jong-Juan et al., CLIN | |||
| CHEM., 1992, vol.38, № 10, р.2038-2043 | |||
| Способ проведения иммуноанализа | 1988 |
|
SU1561042A1 |
| RU 2066202 С1, 10.09.1996 | |||
| RU 93051201 А, 10.01.1997. | |||
Авторы
Даты
2002-07-10—Публикация
2001-07-09—Подача