Изобретение относится к биотехнологии и может быть использовано для получения моноклональных антител (мкАТ) к тироксину.
Для правильной и своевременной диагностики заболеваний, связанных с нарушениями функции щитовидной железы, а также для контроля за эффективностью лечения необходимо составить достаточно точное представление о концентрации тироидстимулирующего гормона, тироксина (Т4) и трииодтиронина.
Большинство иммуноаналитических методов определения тироксина было разработано на поликлональных сыворотках. Как правило, не возникает особых проблем с их специфичностью. Однако многие сыворотки имеют относительно низкий титр и константу связывания, что накладывает некоторые ограничения на их пригодность для использования в иммуноанализе, в особенности когда предпринимаются попытки измерения свободного гормона.
В нескольких лабораториях были получены моноклональные антитела к тироксину, константы связывания для наиболее аффинных антител составляли 1,5 ˙ 109 до 2,6 ˙ 109 М-1 (Murray R. Burkhart F. 1990, Clin. Chem. 36, 1077; G.R. Siebert, N.C.Raleyh, J.Armstrong US Patent, 1989, 4888296).
Известно получение гибридомы, продуцирующей моноклональные антитела к тироксину, слиянием спленоцитов мышей линии BALB/c, иммунизированных конъюгированным антигеном тироксин-гамма глобулин цыпленка, с клетками мышиной миеломной линии Х63. Ag 865.3. Константа аффинности антител 2,6 ˙ 109 М-1, перекрестные реакции с тироксином 0,12% Для использования в иммуноанализе тироксина этих антител, однако оказалось недостаточно и авторы патента для получения калибровочной кривой во всем диапазоне измеряемых концентраций предлагают использовать их в смеси с другими моноклональными антителами, также заявленными в этом патенте.
Целью изобретения является получение гибридных культивируемых клеток мыши линии ВАLB/c, продуцирующих мкАТ, обладающие высокой аффинностью, хорошей специфичностью, относительной индифферентностью к различным блокирующим агентам, в особенности к 8-анилино-1-нафталенсульфокислоте, которая обычно используется в иммуноанализе тироксина. МкАТ должны быть пригодны для разработки иммунологических тест-систем для определения концентрации Т4 в биологических жидкостях.
Для получения гибридомных клеток, продуцирующих мкАТ сливали клетки мышиной миеломной линии Х63. Ag 8653 и сплентоциты мыши линии BALB/c, иммунизированной конъюгированным антигеном Т4 с гемоцианином из моллюска keyhole limpet.
Мыши иммунизировались в течение 3-4 месяцев, периодически сыворотка животных анализировалась на присутствие антител к Т4. Анализ осуществляли твердофазным иммуноферментным методом, в качестве антигена использовали конъюгированный антиген Т4 с бычим сывороточным альбумином (Т4-БСА). У животных с высоким титром антител к Т4 брали селезенки и выделяли из них клетки для слияния.
Миеломная линия Х63. Ag 865.3. стабильная миеломная линия не секретирующая иммуноглобулины, была выбрана в качестве второго партнера для слияния. Слияние клеток проводили с использованием полиэтиленгликоля. Отношение числа селезеночных клеток к числу миеломных клеток варьировали от 5:1 до 1: 1. После слияния клеток разбавлялись и культивировались в селективной среде, содержащей аминоптерин, гипоксантин и тимидин до появления растущих клонов. Супернатанты анализировали твердофазным иммуноферментным методом, в качестве антигена использовали конъюгат Т-БСА, антитела обнаруживали с помощью кроличьих антител к IgG мыши, меченных пероксидазой хрена, так что выявились только клоны, продуцирующие антитела класса G.
Дополнительный анализ синтезируемых антител производили по ингибированию Т4 и его аналогами связывания антител с сорбированным конъюгатом Т4-БСА. Положительные клоны повторно клонировали.
Наиболее важным параметром при отборе является аффинность. Из положительных клонов был выбран клон 1В7, продуцирующий антитела с Кафф 3 ˙ 109 М-1, что превышает Кафф аналога. Перекрестная реактивность этих антител по отношению к трийодтиронину составляет 1% что выше, чем перекрестные реакции аналога, но вполне достаточно для разработки любого иммуноанализа. Интервал концентраций тироксина в сыворотке в норме составляет 50-120 нг/мл, а трийодтиронина 0,8-2 нг/мл, поэтому ошибка, которая возможна в иммуноанализе при использовании этих антител, ничтожно мала и нет необходимости в получении антител с очень низкими значениями перекреста. Фирма Technicon, например, использует антитела к тироксину с перекрестом 1,7% фирма Baxter с перекрестом 3%
Антитела 1В7 относятся к подклассу IgG1.
Технологичной является та гибридома, которая стабильна и хорошо растет в асцитных опухолях. Гибридома 1В7 удовлетворяет обоим требованиям. Для получения больших количеств антител ее вводили внутрибрюшинно мышам, предварительно сенсибилизиpованных пристаном. Антитела из асцитных жидкостей выделяли ионнообменной хроматографией на DEAE-целлюлозе.
Полученные мкАт были использованы в иммуноферментном методе определения Т4. Метод основан на конкуренции тироксина из пробы и тироксина, иммобилизованного на твердой фазе, за связывание с антителами к тироксину, мечеными пероксидазой. С помощью антител 1В7 можно измерить концентрацию тироксина во всем диапазоне концентраций, в котором необходимо определять этот гормон (от 10 до 400 нг/мл), калибровочная кривая линейна во всей этой области.
Было изучено влияние 8-анилино-1-нафталенсульфокислоты (АНС) на связывание антител 1В7 с тироксином и показано, что АНС до концентрации 0,05% которая обычно используется в иммуноанализе тироксина, не влияет на результаты анализа.
Штамм получают следующим образом.
1. Иммунизация.
Мышей линии ВАLB/c, самок, иммунизировали внутрибрюшинно 100 мкг конъюгированного антигена Т4-гемоцианин, суспендированного в 100 мкл физиологического раствора и 200 мкл полного адьюванта Фрейнда. Инъекцию повторяли через 6 недель и далее через 2-4 недели с неполным адьювантом. Через 7 дней после последней иммунизации у мышей брали кровь и сыворотки анализировали на присутствие антител твердофазным иммуноферментным методом. Для завершающей иммунизации отбирали мышей, в сыворотках которых обнаруживали наибольший титр антител к тироксину. За 3 дня до гибридизации таким мышам вводили по 100 мкг антигена без адьюванта.
2. Получение конъюгированных антигенов.
2.1. Получение конъюгата тироксина с гемоцианином из моллюска фиссуреллы (KLH).
1 мг тироксина растворяли в 0,05 М NaOH и смешивали с 1 мг гемоцианина, суспендированного в 1 мл дистиллированной воды. Добавляли при интенсивном перемешивании 26 мкл 25% глутарового альдегида и инкубировали 12 ч при 4оС. Добавляли 0,1 мг NaBH в 50 мкл воды, инкубировали в течение 1 ч при комнатной температуре и перемешивании, а затем диализовали против дистиллированной воды в течение недели. По данным спектрофотометрического анализа конъюгат содержал 130 молей тироксина на молекулу белка.
2.2. Получение конъюгата тироксин-бычий сывороточный альбумин (БСА).
1 мг тироксина, растворенного в смеси 0,5 мл диметилсульфоксида и 0,5 мл воды смешивали с 1 мг бычьего сывороточного альбумина в 0,5 мл воды и добавляли к смеси при перемешивании 3 мг 1-этил-3(3-диметиламинопропил)карбодиимида гидрохлорида. Реакционную смесь инкубировали 12 ч при 4оС и диализовали против воды. Конъюгат содержал 17 молекул тироксина на молекулу белка по данным спектрофотометрии.
3. Твердофазный иммуноферментный метод обнаружения антител к тироксину.
Конъюгированный антиген тироксин-БСА растворяли в 0,05 М карбонат-бикарбонатном буфере, рН 9,6 в концентрации 1 мкг/мл и сорбировали на полистироловых 96-луночных планшетах по 100 мкл на лунку, при 4оС в течение ночи, затем твердую фазу отмывали 0,05%-ным раствором тритона Х-100 и водой. В лунки вносили по 90 мкл 0,01 М натрий-фосфатного буфера, содержащего 0,15 М NaCl, 0,05% твин-20 и 0,2% БСА (буфер А). В первую лунку вносили 10 мкл сыворотки и далее делали серию десятикратных разведений до конца ряда. После инкубации в течение 1 ч при комнатной температуре планшет промывали и вносили в каждую лунку по 90 мкл кроличьих антител против иммуноглобулинов мыши, меченых пероксидазой хрена, растворенных в буфере А. Планшет инкубировали 45 мин, отмывали и для измерения ферментной активности добавляли субстратный раствор (4 мкл 30% Н202 и 4 мг ортофенилендиамина на 100 мл 0,1 М натрий цитратного буфера рН5), по 90 мкл, через 10 мин для остановки ферментативной реакции добавляли по 45 мкл 10%-ного раствора серной кислоты и измеряли поглощение при 492 нм.
4. Гибридизация.
У иммунизированной мыши брали селезенку в стерильных условиях и готовили суспензию спленоцитов. Клетки миеломной линии РЗ-Х63. Ag 8.653. отмывали средой без сыворотки и сливали со спленоцитами в соотношении 1:1, используя 30%-ный полиэтиленгликоль 6000, 1 мл. Слившиеся клетки отмывали бессывороточной средой суспендировали в 50 мл среды RPM1 1640, содержащей 10% эмбриональной телячьей сыворотки, 2 мМ глутамина, 5-10 5 М 2-меркаптоэтанола, 1 мМ пируват натрия, 100 единиц пеницилина и стрептомицина, 4-10-7 М аминоптерина, 10-4 М гипоксантина, 1,6 ˙ 10-5 тимидина и разливали в 96-луночные планшеты, содержащие фиддерный слой мышиных перитониальных макрофагов по 50 мкл в лунку. Через неделю планшеты начинали сканировать ежедневно, супернатанты от активно растущих клонов отбирали и анализировали на присутствие антител к тироксину. Активные клоны переносили в 24-луночные планшеты, часть клеток замораживали.
5. Отбор положительных клонов.
Для отбора положительных клонов использовали твердофазный иммуноферментный метод. Конъюгированный антиген тироксин-БСА сорбировали в 96-луночных планшетах, как описано в п.3. В качестве положительных контролей использовали сыворотки мышей, содержащие антитела к тироксину (разведение 1:200), в качестве отрицательных контролей сыворотки неиммунизированных мышей и супернатанты от миеломных линий.
Первичный скрининг: В лунки планшета с антигеном Т4-белок помещали по 50 мкл буфера для анализа и добавляли по 50 мкл супернатантов. В качестве положительного контроля в одну из лунок помещали 50 мкл иммуной мышиной сыворотки в разведении 1:200, в качестве отрицательного контроля культуральную среду. Планшеты с данными растворами инкубировали 1 ч при комнатной температуре, промывали, обрабатывали 30-40 мин раствором кроличьих антител к мышиным IgG, связанных с пероксидазой хрена, и промывали водой. После этого определяли ферментативную активность как описано в разделе 3. Отбирали те клоны, которые давали сигнал, в 10 раз превышающий фоновый. Было выявлено 29 положительных клонов.
Далее была изучена способность антител, продуцируемых этими клонами, связывать свободный тироксин. Средство антител к тироксину определяли по ингибированию связывания антител с иммобилизованным антигеном в присутствии свободного тироксина.
Вторичный скрининг: 500 мкл супернатантов, которые показали высокое связывание с сорбированным антигеном, помещали в лунки планшета с антигеном. В половину лунок добавляли по 50 мкл буфера для анализа, в другую половину по 50 мкл раствора тироксина в концентрации 500 нг/мл в том же буфере. Далее анализ проводился как описано выше. Было отобрано 6 клонов, активно секретирующих антитела к тироксину. Эти клоны были проанализированы аналогичным образом на способность связывать аналог тироксина трийодтиронин. Для дальнейшей работы был выбран клон 1В7, обладающий наибольшей эффективностью и при этом наименьшей перекрестной реакцией по отношению к трийодтиронину.
6. Клонирование методом предельных разведений.
Клетки выбранного клона клонировали методом предельных разведений в 96-луночном планшете, содержащем фиддерный слой макро-фагов, из расчета 0,3 клетки на лунку. После появления клонов супернатанты тестировали на присутствие моноклональных антител. Все выросшие клоны продолжали продуцировать антитела к тироксину.
7. Производство моноклональных антител в виде асцита.
Для получения больших количеств антитироксиновых антителл гибридомные клетки вводили внутрибрюшинно мышам линии BALB/c, за 10 дней до того получившим инъекции 0,5 мл пристана, по 3х10 клеток на животное. После появления у мышей асцитных опухолей (через 5-14 дней) собирали асцитную жидкость, клетки удаляли центрифугированием, асцитную жидкость замораживали и хранили при -20оС. От каждой мыши получали по 5-10 мл асцита, содержащего от 5 до 8 мг/мл антител. Полученный штам гибридных культивируемых клеток 1В7 хранится в Специализированной коллекции перевиваемых соматических клеток позвоночных Всесоюзной коллекции клеточных культур под номером ВСКК (П) 622Д. Штамм характеризуется следующими признаками:
Культуральные свойства клона 1В7.
Клетки культивируются в монослое в концентрации 5 ˙ 10 клеток/мл, время субкультивирования составляло около 48 ч.
Криоконсервирование гибридомы осуществляется в смеси равных объемов среды RPMI 1640 и телячьей эмбриональной сыворотки, содержащей 15% диметилсульфоксида по 106 клеток в ампуле. Первые трое суток ампулы хранили при -70оС, затем переносили в жидкий азот. После разморозки клетки не теряли своих ростовых свойств.
Характеристика моноклональных антител:
Константа аффинности антител 1В7 3 ˙ 109 М-1.
Перекрестные реакции с трийодтиронином 1%
Антитела из асцитов выделялись солевым осаждением сульфатом аммония и последующей хроматографией на ДЕАЕ-целлюлозе в 0,01 М фосфатном буфере, рН 8,2 с использованием градиента NaCl от 0 до 0,5 М NaCl. Гомогенность выделенных антител проверялась с помощью электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия. Антитела, синтезируемые клоном 1В7, относятся к подклассу IgG1, что было определено твердофазным иммуноферментным методом с использованием козьих антител к подкласам мышиного IgG. Использование штамма иллюстрируется следующим примером.
П р и м е р 1. Использование полученных моноклональных антител для определения тироксина в сыворотке иммуноферментным методом.
В этом методе на твердой фазе конъюгированный антиген тироксин-белок сорбирован на твердой фазе, а измерение основано на конкуренции тироксина из пробы и иммобилизованного тироксина за связывание с антитироксиновыми антителами, мечеными ферментом пероксидазой хрена.
Конъюгированный антиген тироксин-БСА растворяли в 0,05 М натрий карбонат-бикарбонатном буфере (рН 9,6) в концентрации 1 мкг/мл и сорбировали на полистироловых 96-луночных планшетах фирмы NUNK, по 120 мкл/лунку, 3 ч при комнатной температуре и при 4 С в течение ночи, затем твердую фазу трижды отмывали 0,05% раствором тритона Х-100, планшет затем высушивали.
Очищенные ионообменной хроматографией на DEAE-целлюлозе моноклональные антитела окисляли периодатом натрия и метили пероксидазой хрена. Для этого 1 мг пероксидазы растворяли в 0,1 мл воды и добавляли 1 мг периодата натрия в 25 мкл воды. Смесь инкубировали 2 ч в темноте при комнатной температуре, пропускали через 0,5 см слой сефадекса G-25 и смешивали с 4 мг антител в 0,1 М карбонат-бикарбонатного буфера, рН 9,5. Через 3 ч добавили 0,1 мг боргидрида натрия, инкубировали 1 ч и диализовали конъюгат против воды. Затем конъюгат был осажден 75%-ным раствором сульфата аммония, отцентрифугирован и растворен в воде. После диализа против физиологического раствора конъюгат хранили в ЗФР в концентрации 10 мг/мл с добавлением 0,01% мертиолята.
Стандартные растворы тироксина в сыворотке готовили следующим образом:
Пул донорских сывороток или лошадиную сыворотку 100 мл центрифугировали при 15 т об/мин, инактивировали при 56оС, затем пропускали через колонку 1/5 см с активированным углем. Приготовленную таким образом сыворотку пропускали через аффинную колонку с моноклональными антителами 1В7 к тироксину, после чего истощенную сыворотку фильтровали через мембрану с диаметром пор 3,0 нм. Тироксин растворяли в ДМСО в концентрации 1 мг/мл и готовили из него стандартные растворы в сыворотке в концентрации 0; 12,5; 25; 50; 100; 200; 400 нг/мл. Стандартные сыворотки разливали в пробирки и лиофильно высушивали, перед использованием стандарты разводили дистиллированной водой.
Проведение анализа.
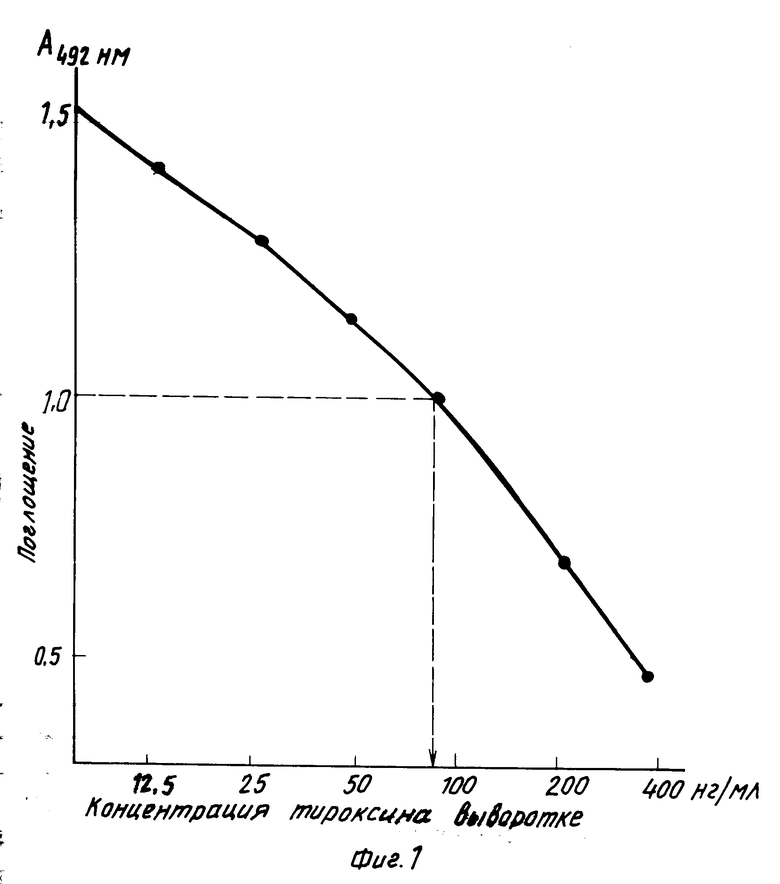
Аликвоты по 10 мкл из сывороток крови больных и стандартных растворов тироксина в донорской сыворотке, содержащих известное количество гормона, вносили в лунки планшета и добавляли по 50 мкл раствора 0,06% 8-анилино-1-нафтолсульфокислоты (АНС) в 0,05 М веронал-мединаловом буфере рН 8,6 с 0,05% твин-20 и через 2 мин 50 мкл раствора конъюгата пероксидаза-антитела в том же буфере, разведение из концентрации 10 мг/мл 1:10000. Смесь тщательно встряхивали, инкубировали 30 мин при комнатной температуре, твердую фазу отмывали и приливали в каждую лунку по 100 мкл раствора субстрата (4 мкл 30% Н202 и 4 мг ортофенилендиамина на 10 мл 0,1 М натрий-цитратного буфера, рН 5,0), инкубировали 10 мин в темноте, детекция при 492 нм. На основании значений поглощения, полученных для стандартных растворов, строилась калибровочная кривая (фиг. 1). Все измерения проводились в дубликатах.
Концентрацию тироксина в сыворотках больных определяли по калибровочной кривой. Например, поглощению 1,0 соответствует концентрация тироксина в сыворотке 90 нг/мл. Коэффициент вариабельности для параллельных измерений не превышал 8% Минимально определяемая концентрация тироксина 10 нг/мл. Как видно из приведенной калибровочной кривой, разработанный метод позволяет определять тироксин в интервале от 0 до 400 нг/мл.
Трийодтиронин до концентрации 200 нг/мл не влиял на результаты анализа.
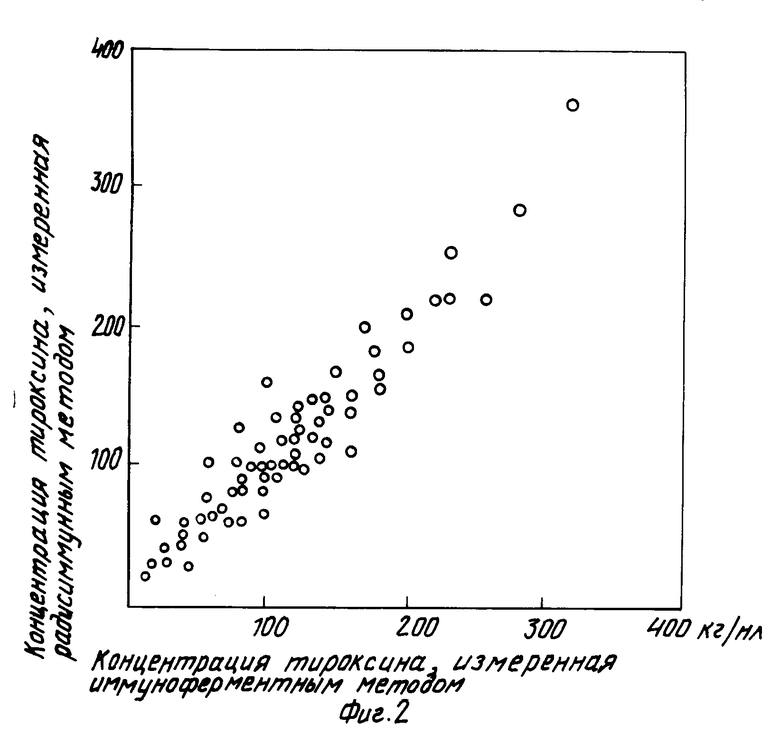
Разработанным методом была измерена концентрация тироксина в 64 сыворотках больных и доноров. Одновременно концентрация гормона измерялась радиоиммунным методом, набор производства Минского института биоорганической химии. Результаты анализа обнаружили хорошее совпадение, коэффициент корреляции между измерениями, произведенными разными методами, составлял 0,96 (фиг. 2),
Приведенные данные подтверждают, что полученные моноклональные антитела 1В7 могут успешно использоваться в иммуноанализе тироксина.
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК МЫШИ MUS MUSCULUS L., ИСПОЛЬУЕМЫЙ ДЛЯ ПОЛУЧЕНИЯ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К ДИГОКСИНУ | 1993 |
|
RU2049818C1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК МЫШИ MUS MUSCULUS L., ИСПОЛЬЗУЕМЫЙ ДЛЯ ПОЛУЧЕНИЯ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К ФЕНОБАРБИТАЛУ | 1993 |
|
RU2049817C1 |
| Штамм гибридных культивируемых клеток животных MUS. мUSсULUS L., используемый для получения моноклональных антител к теофиллину | 1989 |
|
SU1673597A1 |
| КЛОН ГИБРИДНЫХ КЛЕТОК G10B6 ЖИВОТНЫХ MUS MUSCULUS L - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К ДИФТЕРИЙНОМУ ТОКСИНУ | 2009 |
|
RU2401303C1 |
| КЛОН ГИБРИДНЫХ КЛЕТОК F3H10 ЖИВОТНЫХ MUS MUSCULUS L. - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К ДИФТЕРИЙНОМУ ТОКСИНУ | 2009 |
|
RU2407795C1 |
| СПОСОБ ИММУНОФЛУОРЕСЦЕНТНОГО ОПРЕДЕЛЕНИЯ ПРОТЕКТИВНОГО АНТИГЕНА ВОЗБУДИТЕЛЯ СИБИРСКОЙ ЯЗВЫ | 2011 |
|
RU2478970C1 |
| Штамм гибридных культивируемых клеток животных MUS MUScULUS L. - продуцент моноклональных антител к I @ Е человека | 1990 |
|
SU1752763A1 |
| ШТАММ ГИБРИДНЫХ КЛЕТОК ЖИВОТНЫХ Mus. musculus - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К ИВЕРМЕКТИНУ И МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА К ИВЕРМЕКТИНУ | 2009 |
|
RU2415930C1 |
| Штамм гибридных культивируемых клеток животных MUS мUSсULUS L, - продуцент моноклональных антител против J @ Е человека | 1991 |
|
SU1776691A1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК ЖИВОТНОГО MUS MUSCULUS L. - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К A-ДЕТЕРМИНАНТЕ ПОВЕРХНОСТНОГО АНТИГЕНА ВИРУСА ГЕПАТИТА B | 1994 |
|
RU2097425C1 |
Использование: медицинская биотехнология, создание иммунологических тест-систем для определения тироксина. Сущность изобретения: получение штамма гибридных культивируемых клеток мыши, который продуцирует моноклональные антитела (МКА) к тироксину. Штамм получают гибридизацией спленоцитов мышей линии BALBC с клетками миеломы Х63. Ag 863.3. МКА имеют константу аффинности, равную 3·109M-1 их перекрестная реактивность с трийодтиронином составляет 1 2 ил.
Штамм гибридных культивируемых клеток мыши Mus musculus L. ВСКК/П/ N 622 D, используемый для получения моноклонных антител к тироксину.
| Патент США N 4636478, кл | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Кузнечная нефтяная печь с форсункой | 1917 |
|
SU1987A1 |
Авторы
Даты
1995-12-10—Публикация
1993-04-05—Подача