Изобретение относится к биотехнологии, а именно к генетической инженерии, может быть использовано в диагностике инфекционных заболеваний птиц, в частности для диагностики инфекционной анемии цыплят (ИАЦ).
Известен способ диагностики инфекционной анемии цыплят, основанный на иммуноферментном анализе (ИФА). Степень инфицированности или иммунного ответа поголовья определяют по проценту цыплят, имеющих титры антител к вирусу инфекционной анемии цыплят (Смородинцев А.А. Вирусная анемия цыплят: известная и неизвестная/ А.А.Смородинцев, А.А.Сухинин, В.О.Виноходов //Ветеринария в птицеводстве. - СПб. - 2006. - Часть 5-6. - 4 с.).
Анализируя концентрации специфических к инфекционной анемии цыплят антител в сыворотках крови, невозможно дать однозначное заключение об эпизоотическом статусе стад птицы по инфекционной анемии цыплят. Для определения эпизоотологического статуса необходимо учитывать также эпизоотологические и экономические показатели. Наличие титров антител не свидетельствует о развитии и течении патологического процесса. Кроме того, во время инкубационного периода антител не образуется, что ограничивает возможность диагностики инфекционной анемии на раннем этапе заболевания.
Недостаток данного способа заключается также в том, что производить мониторинг можно только у птиц с длительным сроком жизни, а именно у родительского стада бройлеров, у яйценоских пород.
Также существует патоморфологический способ диагностики инфекционной анемии цыплят. Его сущность заключается в исследовании органов, в которых вирус локализуется. К таким органам относятся тимус, селезенка, костный мозг. В тимусе наблюдается сильное лимфоидное истощение, иногда присутствуют некроз или каверны в корковом и мозговом веществе. В селезенке атрофия лимфоидной ткани в совокупности с гиперплазией ретикулярных клеток. В костном мозге атрофия и аплазия вовлекают в патологический процесс все компоненты и кроветворные составляющие. Кроветворные клетки замещаются жировой тканью или клетками пролиферирующей стромы (Кэлнек Б.У. Болезни домашних и сельскохозяйственных птиц./ Б.У.Кэлнек. - М.: «АКВАРИУМ БУК». - 2003. - Стр.857-858).
Недостаток данного метода диагностики заключается в том, что в гистологических препаратах мы можем наблюдать только последствия действия вируса на ткани, в которых он локализуется, однако подобные изменения микроструктуры органов могут быть связаны и с воздействием других инфекционных агентов или с незаразными заболеваниями.
Для диагностики инфекционной анемии цыплят можно пользоваться показателями гемоглобина птицы. Но при помощи этого метода невозможно дифференцировать анемии по этиологическому фактору, так как анемия у птицы может быть связана не только с присутствием возбудителя инфекционной анемии цыплят, но и с неправильно сбалансированным рационом, кровопотерей и др. Поэтому данный способ диагностики не может являться основным в постановке диагноза.
Наиболее близким по технической сущности к заявляемому и взятый за прототип является способ полимеразной цепной реакции (Todd, D. Detection and Differentiation of Chicken Anemia Virus Isolates by Using the Polymerase Chain Reaction/ Daniel Todd, Karen A. Mawhinneg, and М. Stewart McNulty. - Veterinary Sciences Division, Department of Agriculture for Northern Ireland, Stormont, Belfast BT4 3SD. - 1991. - Accepted 9). Для проведения реакции используют олигонуклеотидные праймеры 5'-GAC TGT AAG ATG GCA AGA CGA GCT С-3' и 5'-GGC TGA AGG АТС ССТ CAT TC-3', специфичные для двухцепочечной последовательности ДНК штамма Cux-1 изолята CAV (9а) фланкирующие 675-п.н, который имеет в своем составе N-терминальный конец капсидного протеина CAV.
Однако данный способ не используется для количественного определения вируса. Кроме того, выполнение этого способа включает этап электрофореза, что повышает трудоемкость исследований и является основной причиной перекрестной контаминации образцов и ложноположительных результатов исследований.
Задача изобретения - расширение арсенала синтетических олигонуклеотидных праймеров и способов выявления вируса инфекционной анемии цыплят.
Поставленная задача решается тем, что синтезируются синтетические олигонуклеотидные праймеры для выявления геномной дезоксирибонуклеиновой кислоты (ДНК) вируса инфекционной анемии цыплят, согласно изобретению синтетические олигонуклеотидные праймеры имеют нуклеотидные последовательности: Р1-5' CGAAACGTCACTTTCGCAAC 3', Р2-5' TGGTTACTATTCCATCACCAT 3'.
Сущность изобретения заключается также в том, что в способе выявления геномной дезоксирибонуклеиновой кислоты вируса инфекционной анемии цыплят, включающем проведение полимеразной цепной реакции с синтетическими олигонуклеотидными праймерами, согласно изобретению, праймеры имеют нуклеотидные последовательности P1-5' CGAAACGTCACTTTCGCAAC 3', Р2-5' TGGTTACTATTCCATCACCAT 3', ограничивающие участок генома вируса, в состав которого входят CpG островки и вариабельные тандемные повторы (VNTR), полимеразную цепную реакцию осуществляют в режиме реального времени, в случае положительной реакции отмечают пик кривой плавления 92°С.
Для иллюстрации способа приведены примеры.
Пример 1. Получение синтетических олигонуклеотидных праймеров.
Для поиска новых олигонуклеотидных праймеров используют полный геном штамма вируса инфекционной анемии цыплят, состоящий из 2298 пар нуклеотидов, депонированный в базе GenBank (http://www.ncbi.nlm.nih.gov/GenBank/GenBankSerch.html). Полученные последовательности пары праймеров проверяют на специфичность, используя программу Primer-BLAST NCBI (http://www.ncbi.nlm.nih.gov/tools/primer-blast/primerinfo.html).
Окончательный выбор праймеров основывается на следующих критериях: высокий индекс сходства фрагмента и ДНК различных штаммов вируса ИАЦ, высокая температура отжига (CG-метод), наличие в ампликоне CpG-островков и VNTR повторов.
Химический синтез праймеров осуществляют амидофосфидным методом на автоматическом синтезаторе ASM-102U. Концентрацию синтетических олигонуклеотидных праймеров в маточном растворе определяют спектрометрическим методом.
Учитывая вышеизложенное, были выбраны синтетические олигонуклеотидные праймеры, имеющие следующую структуру
P1-5'CGAAACGTCACTTTCGCAAC 3';
P2-5'TGGTTACTATTCCATCACCAT 3'.
Пример 2. Способ выявления ДНК вируса инфекционной анемии цыплят с помощью синтетических олигонуклетоидных праймеров в полимеразной цепной реакции в режиме реального времени.
Способ осуществляют следующим образом.
Этап 1: Выделение ДНК вируса инфекционной анемии цыплят.
Выделение ДНК вируса производят традиционным способом с использованием коммерческого набора «ДНК-сорб» производства ФГУН «Центральный НИИ эпидемиологии» Роспотребнадзора. Для получения большего количества ДНК допустимо использовать набор QUAGEN DNA Kit.
Этап 2. Полимеразную цепную реакцию в режиме реального времени проводят в один этап в объеме 25 мкл.
Для постановки реакции используют пробирки 0,5 мл, равное количеству исследуемых проб. Компоненты реакции для исследования одного образца ДНК:
10х буфер рН 8,8-2,5 мкл.
dNTPs (по 0,5 каждого) - 3,0 мкл.
Смесь праймеров - 3,0 мкл.
Вода бидистиллированная автокл. - 12,0 мкл.
Taq-полимераза - 0,5 мкл.
Флюоресцентный краситель SYBR Green использовали в разведении 1:20000.
Для постановки реакции в пробирке эппендорфа (1,5 мл) готовят реакционную смесь на N образцов, в число которых входят положительный (ДНК из вакцины CAV) и отрицательный контроли.
Реакционную смесь перемешивают методом пипетирования и разносят по 20 мкл по предварительно промаркированным пробиркам для ПЦР (0,5 мл). В каждую пробирку вносят по 5 мкл исследуемой пробы. Сверху вносят каплю вазелинового масла. После этого пробирки ставят в амплификатор.
Полимеразную цепную реакцию в режиме реального времени проводят по следующему температурному режиму (Табл.1).
Этап 3. Определение размеров продуктов диагностической ПЦР в режиме реального времени.
Результаты полимеразной цепной реакции в режиме реального времени определяются по графикам, отображающим синтез ампликона в зависимости от циклов ПЦР и температурных режимов.
Результаты проверяются методом электрофореза в 6% полиакриламидном геле.
Чтобы определить размер ампликона, в каждую пробу вносят 3,0 мкл буфера для нанесения, содержащего бромфеноловый синий, и вносят в «карман» 6% полиакриламидного геля. Электрофорез проводят при силе тока 190 мА, 130 В, 20 Вт в течение 160 минут. Результаты ПЦР учитывают, визуализируя окрашенный бромистым этидием ПЦР-продукт (ампликон) в ультрафиолетовом свете. В случае положительной реакции в электрофорезе появляется фрагмент ДНК размером 268 п.н.
Пример 3. Определение специфичности ПЦР в режиме реального времени.
С целью подтверждения специфичности используемой ПЦР данную реакцию ставили с геномной ДНК различных микроорганизмов и вирусов (Табл. 2). В приведенном примере показана достаточная специфичность предложенной нами реакции.
Пример 4. Определение чувствительности ПЦР в режиме реального времени.
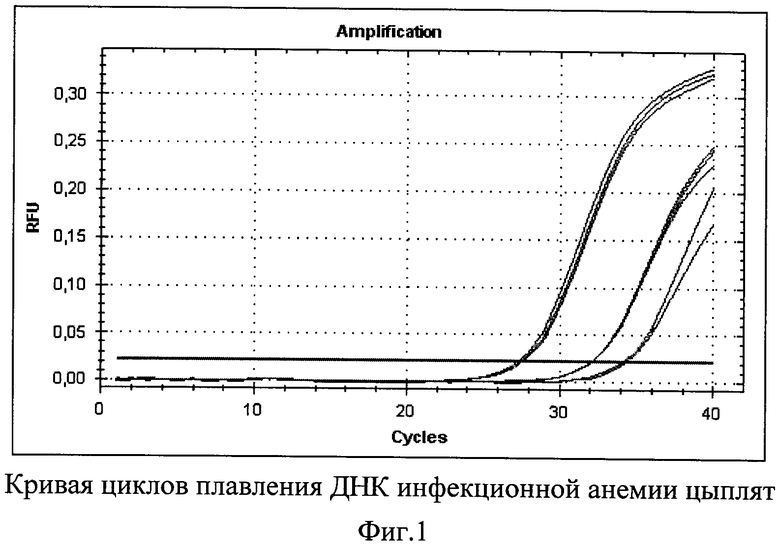
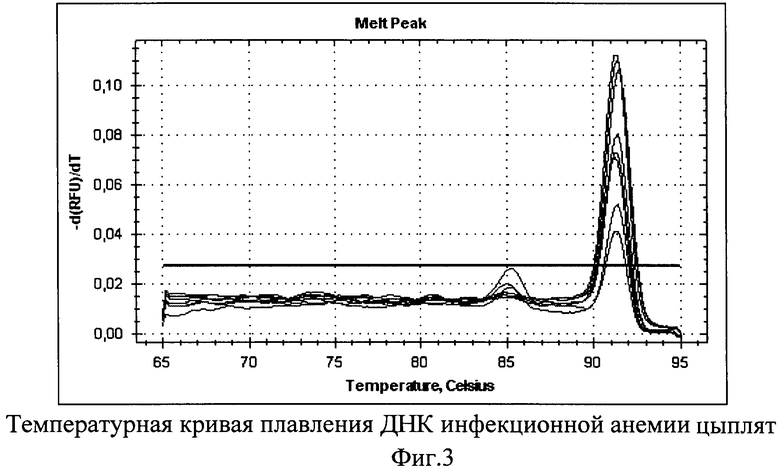
Для оценки чувствительности метода была проведена серия десятикратных разведении вируссодержащего материала. После этого с каждым разведением была поставлена ПЦР в режиме реального времени. Учет реакции проводили на основании графиков, отражающих кривую плавления (Фиг.1, Фиг.3).
При повышении температуры ДНК расплетается и светимость, соответственно, падает. В результате произведенной реакции было установлено, что накопление продукта ПЦР начинается с 24 цикла, далее происходит стадия насыщения (плато) начиная с 34 цикла (Фиг.1).
В реакциях с матрицей мы наблюдаем один пик, соответствующий плавлению специфического продукта, который приходится на 92°С (Фиг.3). Это свидетельствует о том, что в реакции образуется один продукт амплификации.
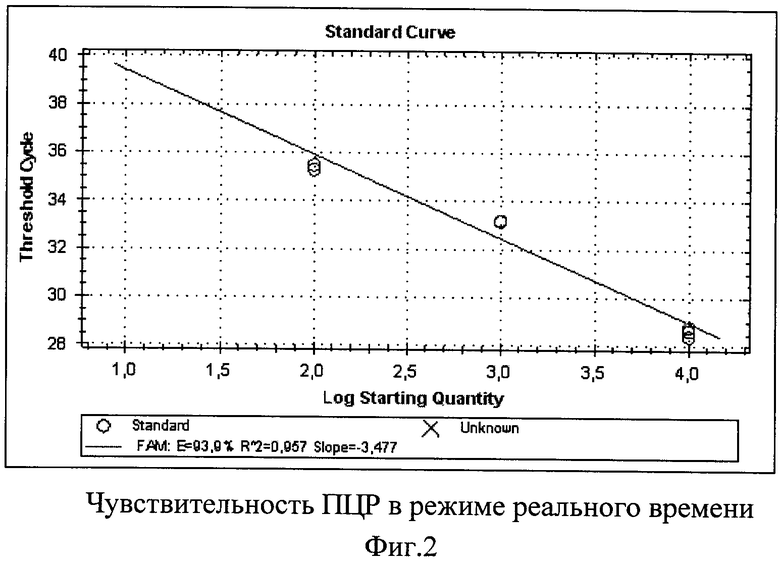
Нами было установлено, что в пробах с наибольшим содержанием специфической ДНК ампликон нарабатывается на 29 цикле. Для визуализации ампликона в пробе с меньшим количеством ДНК должно пройти около 40 циклов (Фиг.2).
Проведение ПЦР в режиме реального времени с заведомо известными концентрациями геномной ДНК вируса позволило установить, что чувствительность реакции составляет не менее 10 копий геномной ДНК вируса ИАЦ в пробе объемом 5 мкл (Табл. 3).
Пример 5. Выявление ДНК вируса инфекционной анемии цыплят в пробах биологического материала, полученного от клинически здоровых и инфицированных птиц.
Для исследования на ИАЦ используют пробы тимуса, селезенки, костного мозга от цыплят, имеющих клинические, патоморфологические признаки, а также от птиц, не имеющих признаков инфекционной анемии цыплят.
Отбор проб биоматериала производят согласно методике (Сюрин В.Н., Самуйленко А.Я., Соловьев Б.В., Фомина Н.В. Вирусные болезни животных. - М.: ВНИТИБП. - 1998. - 928 с.).
Пробы тимуса и селезенки отбирают целиком, в качестве источника костного мозга отбирают бедренную кость целиком или часть кильевой кости.
Пробы органов и тканей перед исследованием растирают в фарфоровых ступках со стерильным песком и пестиком, добавляют 3-5 мл стерильного физиологического раствора и тщательно перемешивают. Смесь переносят в пластиковые пробирки емкостью 1,5 мл, центрифугируют при 4000 об/мин в течение 5 минут. Для выделения ДНК используют 100 мкл супернатанта.
Дальнейшая работа с материалом в ПЦР проводится согласно примеру 2. В Табл. 4 приведены результаты исследования проб биоматериала в ПЦР от птицы, имеющей патологоанатомические и патогистологические изменения, характерные для инфекционной анемии цыплят с птицефабрики, неблагополучной по инфекционной анемии (№1-7), и образцы ДНК, не содержащие геном вируса инфекционной анемии цыплят(№8-10).
Таким образом, предложенный способ выявления геномной ДНК вируса инфекционной анемии цыплят в полимеразной цепной реакции может быть использован для количественного определения вируса в тканях, а также позволяет на раннем этапе заболевания и в короткие сроки диагностировать ИАЦ и эффективно предотвращать вспышки заболевания.
Изобретения относятся к биотехнологии, а именно к генетической инженерии, и представляют собой синтетические олигонуклеотидные праймеры: P1 - 5'-TGGTTACTATTCCATCACCATT-3' (сайт отжига 11-32 п.н.), Р2 - 5'-CGAAACGTCACTTTCGCAAC-3' (сайт отжига 259-278 п.н.) и способ выявления ДНК вируса инфекционной анемии цыплят с их помощью. Способ заключается в том, что праймеры фланкируют участок генома вируса, в состав которого входят CpG островки и VNTR повторы в полимеразной цепной реакции в режиме реального времени. В случае положительной реакции появляется пик кривой плавления 92°С, а при подтверждении реакции путем электрофореза в геле визуализируется фрагмент, соответствующий размеру 268 п.н. Способ диагностики позволяет определить количественное содержание вируса в тканях и может быть использован для диагностики инфекционной анемии цыплят. 2 н.п. ф-лы, 3 ил., 4 табл, 5 пр.
1. Синтетические олигонуклеотидные праймеры для выявления геномной дезоксирибонуклеиновой кислоты вируса инфекционной анемии цыплят, отличающиеся тем, что синтетические олигонуклеотидные праймеры имеют нуклеотидные последовательности: P1 - 5'-TGGTTACTATTCCATCACCATT-3' (сайт отжига 11-32 п.н.), Р2 - 5'-CGAAACGTCACTTTCGCAAC-3' (сайт отжига 259-278 п.н.).
2. Способ выявления дезоксирибонуклеиновой кислоты вируса инфекционной анемии цыплят, включающий проведение полимеразной цепной реакции с олигонуклеотидными праймерами, отличающийся тем, что праймеры имеют нуклеотидные последовательности: P1 - 5'-TGGTTACTATTCCATCACCATT-3' (сайт отжига 11-32 п.н.), Р2 - 5'-CGAAACGTCACTTTCGCAAC-3' (сайт отжига 259-278 п.н.), ограничивающие участок генома вируса, в состав которого входят CpG островки и вариабельные тандемные повторы, полимеразную цепную реакцию осуществляют в режиме реального времени, в случае появления пика кривой плавления 92°С реакцию считают положительной.
| TODD D., KAREN A.M., MCNULTY M.S | |||
| «Detection and Differentiation of Chicken Anemia Virus Isolates by Using the Polymerase Chain Reaction», J Clin | |||
| Microbiol | |||
| Пуговица для прикрепления ее к материи без пришивки | 1921 |
|
SU1992A1 |
| THAM K.M | |||
| and others | |||
| «Polymerase chain reaction amplification for direct detection of chicken anemia virus DNA in tissues and sera», Avian Dis., 1992 | |||
| SCHOT K.A | |||
| and | |||
Авторы
Даты
2013-05-10—Публикация
2011-11-07—Подача