Изобретение относится к ветеринарной вирусологии и биотехнологии, а именно к генетической инженерии, и может быть использовано для выявления атипичного пестивируса крупного рогатого скота в образцах эмбриональных сывороток и пробах биоматериала, полученных от крупного рогатого скота.
Атипичные пестивирусы - группа вирусов рода Pestivirus семейства Flaviviridae, выделенных от буйволов и крупного рогатого скота, а также из эмбриональной сыворотки, используемой для культивирования культур клеток, производства вакцин и пересадки эмбрионов. Штаммы вирусов, представленные цитопатогенным и нецитопатогенным биотипами, имеют в литературе различные названия: третий тип вируса вирусной диареи - болезни слизистых оболочек крупного рогатого скота, атипичный пестивирус (HoBi-like), пятый тип рода Pestivirus. Официальная классификация не принята.
Инфекция КРС, вызванная атипичным пестивирусом, имеет большое сходство с вирусной диареей - болезнью слизистых оболочек крупного рогатого скота (ВД-БС КРС) и проявляется в виде диареи, абортов, респираторного синдрома, персистентной инфекции.
До настоящего времени в России не разработаны способы выявления РНК атипичного пестивируса крупного рогатого скота и не проводится исследование эмбриональных сывороток, используемых для культивирования клеток и производства биопрепаратов.
За рубежом предложены следующие диагностические тесты для выявления телят, персистентно инфицированных атипичным пестивирусом: иммунофлуоресцентный анализ, метод иммуногистохимии, ОТ-ПЦР и реал-тайм ПЦР (Generation of Calves Persistently Infected with HoBi-Like Pestivirus and Comparison of Methods for Detection of These Persistent Infections / F.V. Bauermann, S.M. Falkenberg, B. Vander Ley, N. Decaro, B.W. Brodersen, A. Harmon, B. Hessman, E.F. Flores, J.F. Ridpath / Journal of Clinical Microbiology. - November 2014 Volume 52 Number 11 p. 3845-3852).
Коммерческие наборы ИФА для обнаружения антител к вирусу ВД-БС КРС дают ложноотрицательный результат при тестировании проб сыворотки крови от телят, инфицированных HoBi-подобными вирусами, т.к. вследствие различий генома вирусов не выявляют его.
Наиболее приемлемым, с точки зрения описанных недостатков и принятым за прототип, является способ, основанный на ОТ-ПЦР для выявления РНК атипичного пестивируса при помощи специфических праймеров: SF1 5' - GACTAGTGGTGGCAGTGAGC - 3' и SR1 5' -GCAGCTTCCTACCCAGATGG - 3'.
В ходе реакции со штаммами и изолятами атипичного пестивируса синтезируется фрагмент размером 753 п.н. (Liu L. Maximum likelihood and Bayesian analyses of a combined nucleotide sequence dataset for genetic characterization of a novel pestivirus, SVA/cont-08 / Lihong Liu, Hongyan Xia, Claudia Baule, Sandor Belak // Arch. Virol. - 2009. - №154. - P. 1111-1116).
К недостаткам данного способа можно отнести отсутствие данных по чувствительности, так как авторы не привели их.
Техническим результатом изобретения является разработка высокоспецифичного и чувствительного способа на основе ОТ-ПЦР, позволяющего выявлять РНК атипичного пестивируса в образцах эмбриональных сывороток и пробах биоматериала, полученных от крупного рогатого скота.
Указанный технический результат решается тем, что подобраны и синтезированы синтетические олигонуклеотидные праймеры для выявления РНК атипичного пестивируса в образцах эмбриональных сывороток и пробах биоматериала от крупного рогатого скота и согласно изобретению праймеры имеют нуклеотидные последовательности: SEQ ID NO: 1 - 5' tttgcagccgagcgtag 3', SEQ ID NO: 2 - 5' cctcctgcatactgtcacctt 3'.
Указанный технический результат решается также тем, что в способе выявления РНК атипичного пестивируса с помощью синтетических олигонуклеотидных праймеров в ОТ-ПЦР, включающем выделение РНК из образцов эмбриональных сывороток и проб биоматериала и проведение полимеразной цепной реакции, согласно изобретению используют синтетические олигонуклеотидные праймеры SEQ ID NO: 1 - 5' tttgcagccgagcgtag 3', SEQ ID NO: 2 - 5' cctcctgcatactgtcacctt 3', полимеразную цепную реакцию проводят в 1 раунд, и при получении фрагмента, соответствующего размеру 320 п.н., выявляют РНК атипичного пестивируса.
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение синтетических олигонуклеотидных праймеров
Для расчета олигонуклеотидных праймеров проводили выравнивание известных нуклеотидных последовательностей штаммов BVDV-1, BVDV-2, BVDV-3 (атипичный пестивирус), а также последовательности других близкородственных вирусов с помощью программы ClustalW (Thompson et al., 1994). Для BVDV-3 были найдены несколько видоспецифичных районов, внутри каждого из них с помощью программы Oligo v. 6.31 были подобраны олигонуклеотидные праймеры, обеспечивающие специфическую амплификацию РНК вируса.
Окончательный выбор праймеров основывается на следующих критериях: высокий индекс сходства фрагмента и РНК различных штаммов атипичного пестивируса, высокая температура отжига (GC-метод), большая длина консенсусов, отсутствие гетеродуплексов.
Химический синтез праймеров осуществляют амидофосфитным методом на автоматическом синтезаторе ASM-102U. Концентрацию синтетических олигонуклеотидных праймеров в маточном растворе определяют спектрометрическим методом.
Таким образом, были выбраны синтетические олигонуклеотидные праймеры, комплементарные позициям 9202-9218 и 9501-9521 генома штамма D32/00_'HoBi' атипичного пестивируса КРС (АВ871953.1):
SEQ ID NO: 1 - 5' tttgcagccgagcgtag 3',
SEQ ID NO: 2 - 5' cctcctgcatactgtcacctt 3'
Пример 2. Способ выявления РНК атипичного пестивируса с помощью синтетических олигонуклеотидных праймеров в ОТ-ПЦР в образцах коммерческих эмбриональных сывороток и пробах биоматериала от крупного рогатого скота
Способ осуществляется в несколько этапов.
Этап 1. Выделение РНК атипичного пестивируса КРС
Выделение РНК вируса осуществляют стандартным способом с использованием коммерческого набора «Рибо - сорб» производства ФБУН ЦНИИЭ Роспотребнадзора.
Этап 2. Проведение реакции обратной транскрипции для получения кДНК
Осуществляют стандартным способом с использованием коммерческого набора «Реверта-L» того же производителя.
В пробирку, содержащую 9,5 мкл реакционной смеси: буфер для ОТ (50 mM Tris-HCl [рН 8.3], 3 мМ MgCl2, 75 mM KCl, 10 мМ DTT), 0,1 мМ dNTP, 0,1 мкг праймера для ОТ) и 0,5 мкл ревертазы из набора «Реверта-L», добавляют 10 мкл РНК-пробы, осторожно перемешивают и помещают в термостат 37°С на 30 минут. Затем добавляют 20 мкл ДНК-буфера, тщательно перемешивают и используют для постановки ПЦР.
Этап 3. Амплификация участка кДНК атипичного пестивируса
Условия проведения амплификации оптимизировались по следующим параметрам: концентрация ионов магния в реакционной смеси; концентрация праймеров в реакционной смеси; температура отжига праймеров.
Оптимизированный состав реакционной смеси включал следующие компоненты: ПЦР-буфер (60 mM Tris-HCl [рН 8.5], 1,5 мМ MgCl2, 25 mM KCl, 10 мМ 2-меркаптэтанола, 0,1% Тритон Х-100), 0,2 мМ dNTP, по 0,1 мкг каждого праймера, 1.25 U Taq-ДНК-полимеразы, 5 мкл кДНК.
Температурный режим проведения ПЦР: 95°С - 5 мин - 1 цикл; 95°С - 45 сек, 60°С - 45 сек, 72°С - 1 мин - 40 циклов; 72°С - 5 мин - 1 цикл.
Этап 4. Определение размера продуктов ПЦР
Продукты ПЦР анализируют методом электрофореза в 2%-ном агарозном геле в стандартном трис-боратном буфере (рН 8,0) по стандартной методике. Результаты электрофореза учитывают, просматривая гель в ультрафиолетовом свете с длиной волны 254 нм на приборе «Трансиллюминатор».
Используют маркер молекулярного веса 100 п.н. Результат ПЦР считают положительным, если продукт ПЦР соответствует размеру фрагмента в 320 нуклеотидных пар.
Пример 3. Определение чувствительности и специфичности ПЦР по заявленному способу
Методом молекулярной трансформации компетентных бактериальных клеток Escherichia coli плазмидой pDrive, содержащей специфические ДНК вставки, для контроля амплификации получают положительный контрольный образец (ПКО).
Концентрацию плазмидной ДНК определяют с использованием набора реагентов Quant-iT dsDNA, HS (Invitrogen, США) и флуориметра QUBIT (Invitrogen, США). Концентрация плазмидной ДНК составляет 0,333 мкг/мкл, что в пересчете на количество копий соответствует 7,4*1010 копий/мкл.
Для определения чувствительности реакции готовят 10-кратные разведения ПКО и каждое разведение подвергают исследованию в ПЦР.
За аналитическую чувствительность принимают последнее разведение ПКО, с которым результат ПЦР-анализа интерпретировался как положительный.
Чувствительность разработанной ПЦР составила 7,4*10-1 копий/мкл.
Результаты опытов по определению чувствительности ПЦР представлены в таблице 1.

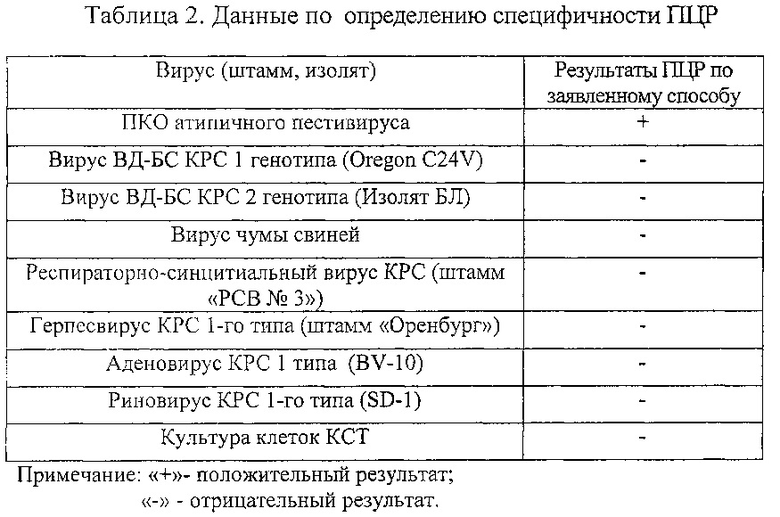
Результаты опытов по определению специфичности реакции по заявленному способу представлены в таблице 2.
Таким образом, предлагаемый способ обладает высокой чувствительностью (7,4*10-1 копий/мкл) и специфичностью при выявлении РНК атипичного пестивируса.
Пример 4. Выявление РНК атипичного пестивируса КРС в образцах эмбриональных сывороток крупного рогатого скота и пробах биологического материала, полученного от больных и инфицированных животных.
Исследованию на атипичный пестивирус подвергают образцы коммерческих эмбриональных сывороток КРС, используемых для культивирования культур клеток и производства биопрепаратов в ветеринарии, и пробы сывороток крови, лимфатических узлов, селезенки, легких от КРС с подозрениями на инфицирование пестивирусами.
Пробы сывороток крови отбирают в объеме не менее 1 мл, из органов и тканей вырезают кусочки размером 1×1×1 см3.
Образцы эмбриональных сывороток и сывороток крови от больных животных используют для выделения РНК без предварительной подготовки.
Пробы органов и тканей перед исследованием растирают в отдельных фарфоровых ступках со стерильным песком пестиком, добавляют 5-10 мл стерильного физиологического раствора и тщательно перемешивают. Смесь переносят в пластиковые пробирки емкостью 1,5 мл, центрифугируют при 10×103 об/мин в течение 5 минут. Для выделения РНК используют 100 мкл осветленной надосадочной жидкости.
Дальнейшая процедура согласно примеру 1.
Всего предлагаемым способом было исследовано 18 образцов эмбриональных сывороток, 460 проб сыворотки крови и 112 проб внутренних органов КРС.
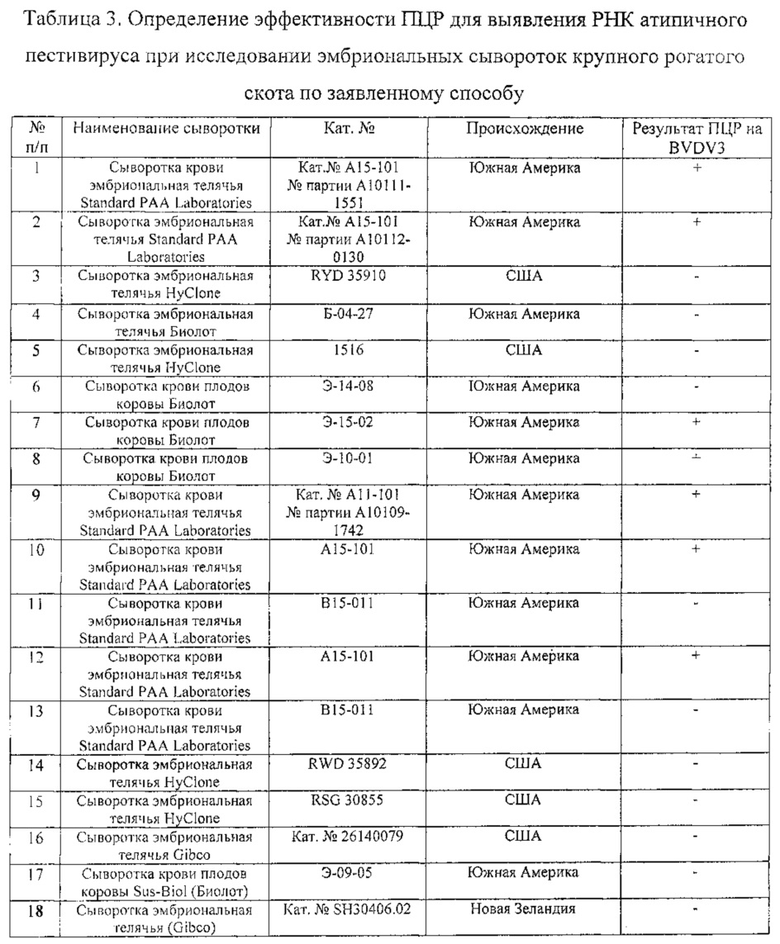
Результаты опытов по определению эффективности реакции при исследовании эмбриональных сывороток крупного рогатого скота по заявленному способу представлены в таблице 3.
По заявленному способу количество положительных проб эмбриональных сывороток составило 38,89%.
Для подтверждения специфичности полученных фрагментов РНК определяли их нуклеотидную последовательность с использованием набора BigDye 3.1 (Applied Biosystems, США) с последующей очисткой на сефадексе G-50 superfine. Секвенирование ПЦР-фрагментов проводили по обеим цепям ДНК. Расшифровку первичных данных секвенирования (хроматограмм) проводили с помощью программы Sequencher v. 4.0.5 (Gene Codes Corporation, США).
Анализ нуклеотидных последовательностей синтезируемых фрагментов проводили методами выравнивания с опубликованными последовательностями других штаммов BVDV-3 (в частности, BVDV3_D32/00 и BVDV3_Th/04_Khonkaen) с помощью программы ClustalW (Thompson et al., 1994).
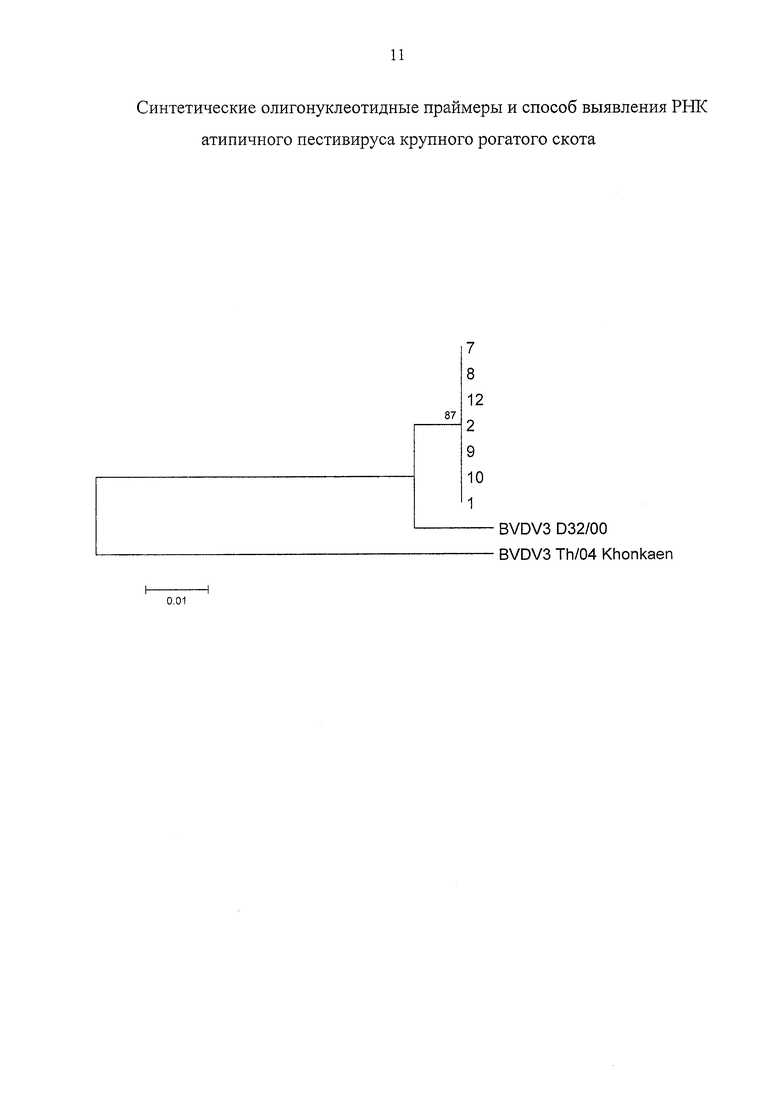
Дендрограммы были построены без укоренения методом ближайшего соседа (NJ - Neighbor Joining) при использовании 2-параметровой модели Кимуры в программе MEGA v. 4 (Tamura et al., 2007). Для оценки достоверности топологии использовался бутстрэп-тест (1000 репликаций) (Felsenstein, 1985). Результаты филогенетического анализа показали, что все семь проанализированных образцов группируются с ВД-КРС-3 штамм D32/00 (Бразильская группа).
На фигуре представлена дендрограмма: 9 штаммов ВД-КРС-3, построенная на основе нуклеотидных последовательностей с позициями 9219-9500 относительно атипичного пестивируса штамм D32/00, с использованием метода ближайшего соседа (NJ) при использовании 2-параметровой модели Кимуры в программе MEGA v. 4. В узлах ветвей показаны коэффициенты поддержки бутстрэп-теста (для 1000 псевдореплик). На каждой ветке обозначено название соответствующего штамма атипичного пестивируса.
Результаты исследования проб сыворотки крови и биоматериала от животных в ПЦР на атипичный пестивирус были отрицательны.
Таким образом, предлагаемый способ обладает высокой чувствительностью (7,4*10-1 копий/мкл), специфичностью и эффективностью при выявлении РНК атипичного пестивируса в образцах эмбриональных сывороток крупного рогатого скота.

Изобретения относятся к ветеринарной вирусологии и биотехнологии, а именно к генетической инженерии. Предложены синтетические олигонуклеотидные праймеры для выявления РНК атипичного пестивируса крупного рогатого скота и способ их применения. Предсавленные синтетические олигонуклеотидные праймеры имеют нуклеотидные последовательности: SEQ ID NO: 1 - 5' tttgcagccgagcgtag 3', SEQ ID NO: 2 - 5' cctcctgcatactgtcacctt 3'. Предложенный способ включает выделение РНК из образцов эмбриональных сывороток и биоматериала, проведение обратной транскрипции и ПЦР с синтетическими олигонуклеотидными праймерами, перенос продукта амплификации на гель и оценку проведения реакции. ПЦР проводят в 1 раунд. В случае положительной реакции синтезируется фрагмент, соответствующий размеру 320 п.н. Изобретения могут быть использованы в ветеринарии для выявления возможных контаминаций эмбриональных сывороток, используемых для культивирования культур клеток и производства биопрепаратов, атипичным пестивирусом крупного рогатого скота, а также для диагностики инфекционных заболеваний сельскохозяйственных животных, в частности инфекции, вызванной атипичным пестивирусом крупного рогатого скота. 2 н.п. ф-лы, 1 ил., 3 табл., 4 пр.
1. Синтетические олигонуклеотидные праймеры для выявления РНК атипичного пестивируса крупного рогатого скота, отличающиеся тем, что праймеры имеют нуклеотидные последовательности: SEQ ID NO: 1 - 5' tttgcagccgagcgtag 3', SEQ ID NO: 2 - 5' cctcctgcatactgtcacctt 3'.
2. Способ выявления РНК атипичного пестивируса крупного рогатого скота с помощью синтетических олигонуклеотидных праймеров в полимеразной цепной реакции, включающий выделение РНК из проб образцов эмбриональных сывороток и биоматериала от крупного рогатого скота и проведение полимеразной цепной реакции, отличающийся тем, что используют синтетические олигонуклеотидные праймеры SEQ ID NO: 1 - 5' tttgcagccgagcgtag 3', SEQ ID NO: 2 - 5' cctcctgcatactgtcacctt 3', полимеразную цепную реакцию проводят в 1 раунд, при получении фрагмента, соответствующего размеру 320 п.н., диагностируют наличие атипичного пестивируса крупного рогатого скота.
| ГЛОТОВ А.Г | |||
| и др., Атипичные пестивирусы крупного рогатого скота, Сельскохозяйственная биология, 2015, т.50 | |||
| SIMONE PELETTO et al., Detection and phylogenetic analysis of an atypical pestivirus, strain IZSPLV_To, Research in Veterinary Science, 2012, Vol.92, pp.147-150. |
Авторы
Даты
2017-01-10—Публикация
2016-05-24—Подача