Изобретение относится к исследованию биологических материалов, в частности к способам молекулярной диагностики злокачественных новообразований, и может быть использовано при исследовании образца ткани для дифференциальной диагностики лейомиосарком (ЛМС) матки и пролиферирующих (клеточных) лейомиом (пЛМ) матки.
Проблемы, возникающие при необходимости дифференциальной диагностики высокодифференцированной ЛМС и пЛМ, обусловлены тем, что применяемые в настоящее время диагностические методы (морфологические, иммуногистохимические и иные инструментальные исследования) не достаточно информативны. Указанное обстоятельство требует разработки дополнительных критериев для диагностики ЛМС матки.
Известен ряд исследований, посвященных анализу генетических изменений, характерных для ЛМС матки (Frequent loss of heterozygosity for chromosome 10 in uterine leiomyosarcoma in contrast to leiomyoma. // American Journal of Pathology. - 1999. - vol.154, №3. - pp.945-950; Specific loss of heterozygosity of chromosome 3p loci in soft tissue leiomyosarcoma. // Zhonghua Bing Li Xue Za Zhi. - 2003. - 32, pp.124-127; Leiomyosarcoma and malignant fibrous histiocytoma share similar allelic imbalance pattern at 9p. // Virchows Archiv. - 2005. - 446, pp.251-258; Array comparative genomic hybridization analysis of uterine leiomyosarcoma. // Gynecol Oncol. - 2005. - 99(3). - pp.545-51). Авторами известных исследований установлено, что для данного типа сарком характерны аллельные делеции (потеря гетерозиготности (ПГ) и микросателлитная нестабильность (МН)) локусов 3р, 9р, 10р, 10q, 17q. Однако в каждом из перечисленных исследований авторы оценивали генетические изменения в ЛМС матки только в отдельных локусах и не пытались рассмотреть совокупность этих изменений и создать на их основе диагностическую систему для дифференциальной диагностики ЛМС и пЛМ.
Заявляемое изобретение направлено на решение задачи создания достоверной диагностической тест-системы злокачественных гладкомышечных новообразований матки (ЛМС).
Использование в клинической практике заявляемого способа позволяет достичь нескольких технических (лечебных) результатов:
- возможность определения характера опухолевого заболевания путем выявления признаков генетической нестабильности и биологической агрессивности опухоли,
- возможность уточняющей диагностики лейомиосарком матки.
Указанные технические (лечебные) результаты при осуществлении изобретения достигаются за счет того, что также как в известном способе осуществляют анализ молекулярно-генетических изменений микросателлитных ДНК в образцах опухолевой ткани.
Особенность заявляемого способа заключается в том, что определяют наличие генетических изменений в совокупности следующих микросателлитов:
- D17S1161 расположенном в локусе 17q23,
- D10S1213, расположенном в локусе 10q26.13,
- D10S1146 и D10S218, расположенных в локусе 10q22.1,
- D10S24, расположенном в локусе 10р13,
- D9S942, расположенном в локусе 9р21.3,
- D9S251, расположенном в локусе 9р21,
- D3S1295, расположенном в локусе 3р14.3
в образце опухолевой и образце смежной нормальной ткани или периферической венозной крови путем проведения полимеразной цепной реакции (ПЦР) с использованием специфических праймеров. При наличии изменений в форме ПГ и/или МН по крайней мере в одном из указанных микросателлитов в образце опухолевой ткани диагностируют злокачественную природу опухоли.
Сущность изобретения заключается в следующем.
Известно, что одной из основных причин злокачественных новообразований являются генетических факторы.
К маркерам канцерогенеза относят внутригеномные перестройки микросаттелитных ДНК, происходящие в процессе нарушения процессов репарации. Микросателлитные ДНК - тандемно организованные, высокоповторяющиеся последовательности, расположенные в нетранслируемой области генома, длиной от 1 до 4 пар нуклеотидов. Опухолевый геном характеризуется генетической нестабильностью микросателлитов. Признаками нестабильности повторов являются ПГ - изменение суммарной длины микросателлитов и МН - появление новых микросателлитов. ПГ и МН являются чувствительными маркерами опухолевых клеток.
В результате проведенных исследований авторами заявляемого способа была выявлена высокая частота ПГ и/или МН следующих микросателлитных маркеров:
- D17S1161, расположенном в хромосомном районе ДНК 17q23,
- D10S1213, расположенном в хромосомном районе ДНК 10q26.13,
- D10S1146 и D10S218, расположенных в хромосомном районе ДНК 10q22.1,
- D10S24, расположенном в хромосомном районе ДНК 10р13,
- D9S942, расположенном в хромосомном районе ДНК 9р21.3,
- D9S251, расположенном в хромосомном районе ДНК 9р21,
- D3S1295, расположенном в хромосомном районе ДНК 3р14.3,
что характерно для пациенток с гистологическим диагнозом ЛМС матки. Частота составила в среднем 40%. В группе пациенток с диагнозом пЛМ матки генетические изменения не были выявлены. В результате сравнительного анализа генетических изменений между группами пациенток с диагнозом ЛМС матки и пЛМ матки было установлено, что необходимым и достаточным для дифференциальной диагностики ЛМС и пЛМ матки является определение наличия генетических изменений в совокупности следующих микросателлитов:
- D17S1161, расположенном в хромосомном районе ДНК 17q23,
- D10S1213, расположенном в хромосомном районе ДНК 10q26.13,
- D10S1146 и D10S218, расположенных в хромосомном районе ДНК 10q22.1,
- D10S24, расположенном в хромосомном районе ДНК 10р13,
- D9S942, расположенном в хромосомном районе ДНК 9р21.3,
- D9S251, расположенном в хромосомном районе ДНК 9р21,
- D3S1295, расположенном в хромосомном районе ДНК 3р14.3,
в образце опухоли при сравнении с образцом смежной нормальной ткани.
Специфичность и чувствительность данной системы составляет 96% и 95% соответственно.
Результатом исследований, произведенных авторами заявляемого изобретения, является единая диагностическая тест-система, позволяющая осуществить дифференциальную диагностику ЛМС матки и пЛМ матки.
Способ осуществляют следующим образом.
1. Клинический материал представлен:
- образцом опухолевой ткани. На гистологическом препарате должно быть представлено >70% опухолевых клеток,
- образцом смежной нормальной ткани (без патоморфологических изменений), или/и если на гистологических препаратах такового нет, образцом периферической венозной крови пациентки.
В качестве консерванта для периферической венозной крови используют 0.5 М раствор ЭДТА. При заборе крови в пробирку к 20 мкл консерванта добавляют 1,8 мл крови и тщательно перемешивают.
2. Выделение ДНК.
Выделение ДНК проводят из операционного материала, фиксированного в формалине с последующей парафинизацией, с помощью коммерческого набора «ДНК-Сорб (В/АМ)» (ИнтерЛабСервис, РФ) и/или, для особо малых количеств материала, набором «QIAamp DNA FFPE Tissue kit» (QIAGEN, Германия), в соответствии с приложенным инструкциями. Депарафинизацию материала проводят по стандартной схеме.
3. Микросателлитный анализ.
Идентификацию ПГ и/или МН проводят путем микросателлитного анализа, представляющего собой ПЦР с использованием специфических праймеров, которую осуществляют по следующей схеме:
- к 0.1 мкг геномной ДНК добавляют 0.05 мкМ каждого олигопраймера, 200 мкМ каждого дезоксинуклеотидтрифосфата, 1-2 ед. Taq-полимеразы, 5 мкл однократного буфера для ПЦР следующего состава: 50 мМ KCl, 10 мМ Трис-HCl (рН 8,4), 5 мМ MgCl2;
- добавляют 30 мкл вазелинового масла, прогревают смесь при 94°С в течение 10 мин и проводят 35 циклов по следующей программе: денатурация при 94°С - 40 с, отжиг при 56-60°С - 1 мин 30 с, элонгация при 72°С - 30 с;
- В качестве контроля ПЦР используют ДНК лейкоцитов периферической крови «здоровых» пациентов (без онкологии).
4. Продукты амплификации разделяют в 6%-ном денатурирующем полиакриламидном геле (ПААГ) и окрашивают нитратом серебра.
ПГ оценивают как ослабление или отсутствие полосы одного из аллелей на электрофореграмме относительно нормальной ткани или периферической венозной крови пациента. МН оценивают как появление дополнительной полосы на электрофореграмме относительно нормальной ткани или периферической венозной крови пациента.
Примеры выполнения:
1. Пациентка Б. Возраст: 28 лет. Клинические данные: В середине января 2011 года был удален миоматозный узел. Миоматозный узел впервые обнаружен в июле 2010 года. Консультирована в Научном центре хирургии, где был поставлен диагноз пЛМ. Рекомендован пересмотр стекол гистологических препаратов в МНИОИ им. П.А.Герцена. Нормальная ДНК была получена из периферической венозной крови.
Патологоанатомическое заключение: Формальная морфологическая картина крайне подозрительна по ЛМС, однако низкое число митозов и не специфичекая ИГХ реакция не позволяет подтвердить диагноз категорически.
Заключение ИГХ: Ki67: положительный в 5% клеток опухоли, ГМА (гладкомышечный актин) положительный в клетках опухоли. Новообразование имеет гладкомышечную природу.
Заключение молекулярно-генетического исследования: Проведено молекулярно-генетическое исследование методом микросателлитного анализа районов D17S1161, D10S218, D10S1146, D10S24, D10S1213, D9S942, D9S251, D3S1295. Обнаружена ПГ в микросателлите D10S218 и МН в микросателлите D3S1295.
Заключение: с учетом морфологической картины и данных молекулярно-генетического исследования - ЛМС G1.
2. Пациентка К. Возраст: 49 лет. Клинические данные: Консультативный материал из ЦКБ №2 им. Н.А.Семашко. В 1999 г. при введении ВМС впервые выявлена миома матки малых размеров. В течение последних 5-6 лет отмечалась длительная менструация (до 10 дней). В 2005 г. выявлена цистаденома правого яичника, полип. В 2010 г. произведена Hs+РДВ. В марте 2011 г. операция. Нормальная ДНК была получена из смежной нормальной ткани.
Патологоанатомическое заключение: Гистология ЦКБ №2 им. Н.А.Семашко: Клеточная митотически активная лейомиома.
Патологоанатомическое отделение МНИОИ им. П.А.Герцена: Эндометрий стадии пролиферации, клеточная пЛМ матки с редкими фигурами митозов. Для категорического исключения ЛМС желательно молекулярно-генетическое исследование.
Заключение молекулярно-генетического исследования: Проведено молекулярно-генетическое исследование методом микросателлитного анализа ПГ и МН, характерных для ЛМС матки в микросателлитах D17S1161, D10S218, D10S1146, D10S24, D10S1213, D9S942, D9S251, D3S1295 не обнаружено.
Заключение: с учетом морфологической картины и данных молекулярно-генетического исследования - клеточная пЛМ матки.
3. Пациентка Р. Возраст: 47 лет. Клинические данные: В 2004 г. диагностирована лейомиома матки. В 2009 г. обнаружено новообразование в легком клеточно-волокнистого строения. Материал консультативный из ГКБ 67, невозможно получить более полные клинические данные. Нормальная ДНК получена из смежной нормальной ткани.
Патологоанатомическое заключение: №1 в препаратах стенка матки с очагами аденомиоза, эндометрий с секретирующими железами, участки клеточной атипической (причудливой) лейомиомы. №2 в ткани легкого рост опухоли клеточно-волокнистого строения с мелкими железисто-подобными структурами. Для уточнения гистогенеза и потенциала новообразования в легком необходимо иммунофенотипирование. Для исключения лейомиосаркомы необходимо молекулярно-генетическое исследование.
Заключение ИГХ: Ki67 положительный в 20% клеток опухоли, десмин, ГМА (гладкомышечный актин) положительный в клетках опухоли, S100 положительная в клетках опухоли, CD34 положительная в эндотелиоцитах сосудов, CD117, NSE, кальретинин, НМВЕ1 отрицательная.
Заключение молекулярно-генетического исследования: Проведено молекулярно-генетическое исследование в материале опухоли матки и материале опухоли клеточно-волокнистого строения из легкого методом микросателлитного анализа микросателлитов D17S1161, D10S218, D10S1146, D10S24, D10S1213, D9S942, D9S251, D3S1295. Обнаружена ПГ в микросателлитах D3S1295, D9S942, D10S24, характерная для ЛМС матки. Указанные изменения обнаружены как в образце опухоли матки, так и в образце опухоли легкого.
Заключение: с учетом данных иммуногистохимического и генетического исследований, гистологической картины, опухоль матки следует расценивать как высокодифференцированную ЛМС с низкой митотической активностью, а узел, как метастаз ЛМС.
4. Пациентка С. Возраст: 32 лет. Клинические данные: Материал консультативный из Ижевска, невозможно получить более полные клинические данные. Нормальная ДНК получена из периферической венозной крови.
Патологоанатомическое заключение: Готовые стекла не удовлетворительного качества. В препаратах с парафиновых блоков - лейомиома с участками эпителиоидного клеточного строения, отека и гиалиноза. Фигуры митоза не выявляются. Необходимо проведение молекулярно-генетического исследования.
Заключение молекулярно-генетического исследования: Проведено молекулярно-генетическое исследование методом микросателлитного анализа микросателлитов D17S1161, D10S218, D10S1146, D10S24, D10S1213, D9S942, D9S251, D3S1295. Обнаружена МН в микросателлитах D9S251, D3S1295, характерная для ЛМС матки.
Заключение: результаты молекулярно-генетического исследования свидетельствуют в пользу саркоматозного характера процесса.
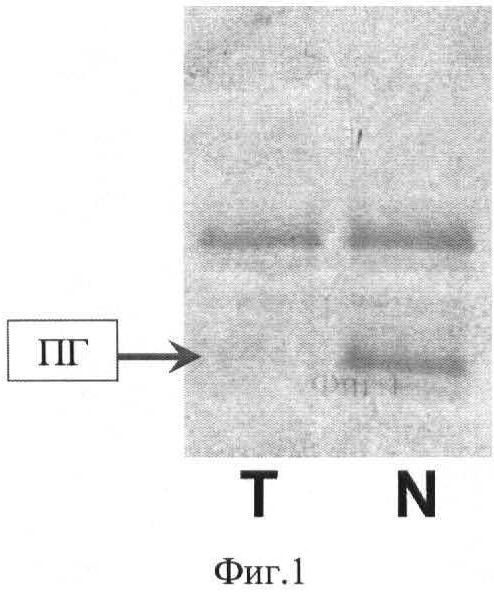
На Фиг.1 представлена электрофореграмма продуктов микросателлитного анализа микросателлита D10S218 пациентки Б.
Т - дорожка с продуктами амплификации из опухолевой ДНК. Отсутствие второй полосы - ПГ.
N - дорожка с продуктами амплификации из ДНК смежной нормальной ткани. Наличие двух полос - гетерозиготное состояние.
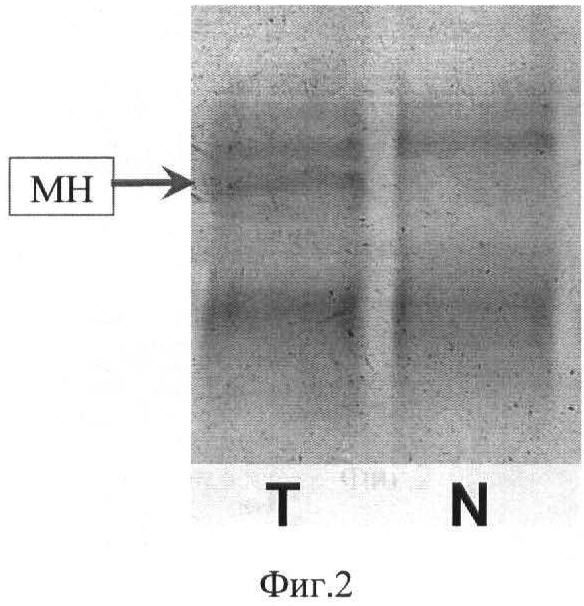
На Фиг.2 представлена электрофореграмма продуктов микросателлитного анализа микросателлита D3S1295 пациентки Б.
Т - дорожка с продуктами амплификации из опухолевой ДНК. Появление третьей дополнительной полосы - МН.
N - дорожка с продуктами амплификации из ДНК смежной нормальной ткани. Наличие двух полос - гетерозиготное состояние.
| название | год | авторы | номер документа |
|---|---|---|---|
| Тест-система и способ выявления делеций длинного плеча 6 хромосомы | 2021 |
|
RU2770892C1 |
| Тест-система и способ выявления делеций гена SESN1 | 2021 |
|
RU2772504C1 |
| Способ создания таргетной панели для исследования геномных регионов для выявления терапевтических биомаркеров ингибиторов иммунных контрольных точек (ИКТ) | 2023 |
|
RU2818360C1 |
| Способ дифференциальной и подтверждающей молекулярно-генетической диагностики врожденной аниридии и WAGR-синдрома | 2017 |
|
RU2641254C1 |
| МСН-СПЕЦИФИЧНЫЕ ПЕПТИДЫ СО СМЕЩЕННОЙ РАМКОЙ СЧИТЫВАНИЯ (ПСРС) ДЛЯ ПРЕДОТВРАЩЕНИЯ И ЛЕЧЕНИЯ РАКА | 2012 |
|
RU2644677C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ И ТЕЧЕНИЯ ХРОНИЧЕСКОГО ЛИМФОЛЕЙКОЗА | 2003 |
|
RU2248574C1 |
| ОБНАРУЖЕНИЕ МУТАЦИЙ И ПЛОИДНОСТИ В ХРОМОСОМНЫХ СЕГМЕНТАХ | 2015 |
|
RU2717641C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ПЛОЩАДИ МИОМАТОЗНЫХ УЗЛОВ ПРИ МИОМЕ МАТКИ | 2010 |
|
RU2433402C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ МНОГОУЗЛОВЫХ ПОРАЖЕНИЙ ПРИ ЛЕЙОМИОМЕ МАТКИ | 2011 |
|
RU2445625C1 |
| Тест-система для прогнозирования развития метастазов у больных раком желудка на основании определения числа копий HV2 мтДНК | 2017 |
|
RU2683571C1 |
Изобретение относится к области медицины. Предложен способ дифференциальной диагностики лейомиосарком и пролиферирующих (клеточных) лейомиом матки, включающий анализ молекулярно-генетических изменений микросателлитных ДНК в образцах опухолевой ткани. Определяют наличие генетических изменений микросателлитов D17S1161, D10S1213, D10S1146, D10S218, D10S24, D9S942, D9S251 и D3S1295 в образце опухолевой и образце смежной нормальной ткани или периферической венозной крови путем проведения полимеразной цепной реакции (ПЦР) с использованием специфических праймеров. При наличии изменений в форме потери гетерозиготности и/или микросателлитной нестабильности по крайней мере в одном из указанных микросателлитов в образце опухолевой ткани диагностируют злокачественную природу опухоли. Изобретение обеспечивает эффективный способ дифференциальной диагностики лейомиосарком и пролиферирующих (клеточных) лейомиом матки по наличию гетерозиготности и/или микросателлитной нестабильности по крайней мере в одном из указанных микросателлитов в образце опухолевой ткани. 2 ил., 4 пр.
Способ дифференциальной диагностики лейомиосарком и пролиферирующих (клеточных) лейомиом матки, включающий анализ молекулярно-генетических изменений микросателлитных ДНК в образцах опухолевой ткани, отличающийся тем, что определяют наличие генетических изменений совокупности следующих микросателлитов:
D17S1161, расположенном в локусе 17q23,
D10S1213, расположенном в локусе 10q26.13,
D10S1146 и D10S218, расположенных в локусе 10q22.1
D10S24, расположенном в локусе 10р13,
D9S942, расположенном в локусе 9р21.3,
D9S251, расположенном в локусе 9р21,
D3S1295, расположенном в локусе 3р14.3
в образце опухолевой и образце смежной нормальной ткани или периферической венозной крови путем проведения полимеразной цепной реакции (ПЦР) с использованием специфических праймеров, при наличии изменений в форме потери гетерозиготности и/или микросателлитной нестабильности по крайней мере в одном из указанных микросателлитов в образце опухолевой ткани диагностируют злокачественную природу опухоли.
| LEE J.H | |||
| et al | |||
| Different characteristics of mitochondrial microsatellite instability between uterine leiomyomas and leiomyosarcomas | |||
| Pathol | |||
| Oncol | |||
| Res | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| WATANABE K., SUZUKI Т | |||
| Uterine leiomyoma versus leiomyosarcoma: a new attempt at differential diagnosis based on their cellular characteristics. | |||
Авторы
Даты
2013-05-10—Публикация
2011-11-09—Подача