Изобретение относится к области медицины, онкологии, в частности, гематологии, и лабораторной диагностики злокачественных новообразований. Изобретение предназначено для идентификации делеций tquslSESNI, который является одним из значимых компонентов сигнальных путей в патогенезе В-клеточных неходжкинских лимфом (В-НХЛ), в частности, фолликулярной лимфомы (ФЛ), и может быть использовано в клинической медицине на этапе первичной диагностики с целью выделения групп пациентов с различным течением болезни и возможной коррекции терапии первой линии, а также в рамках фундаментальных исследований онкогенных сигнальных путей.
Выделение в патогенезе онкологического заболевания факторов, определяющих поведение опухоли и эффективность проводимого лечения, является актуальной задачей с позиций дифференциальной диагностики и возможной персонификации терапии. Молекулярное исследование генов, занимающих ключевые позиции в каскаде пролиферативных сигнальных путей, и вариантов их нарушений является оптимальным вариантом решения подобных задач, поскольку прямо отражает биологические особенности опухолевых клеток и открывает возможности разработки таргетной терапии.
Ген SESNJ кодирует белок Sestrinl, который является компонентом сигнального пути mTOR. Sestrinl представляет собой один из непосредственных эффекторов проапоптотического белка р53, осуществляющего запуск апоптотических сигналов в ответ на повреждение ДНК [1]. Активация р53 приводит к активации Sestrinl, обладающего ингибирующей активностью по отношению к комплексу mTORC1, отвечающего за поддержание пролиферативного потенциала клетки [2]. В результате происходит угнетение пролиферативной активности клетки, что сочетается с реализацией апоптотической гибели. В случае нарушения одного из звеньев этой сигнальной цепи увеличивается вероятность опухолевой трансформации и дальнейшей эволюции опухолевого клона. Делеций и мутации гена ТР53, кодирующего белок р53, известны в качестве генетических аберраций, определяющих крайнюю агрессивность опухоли и неблагоприятный прогноз лечения и выживаемости пациентов при широком спектре онкологических заболеваний [3]. Поскольку реализация функции р53 отчасти осуществляется за счет продукта гена SESN1, последний так же можно считать потенциальным супрессором опухоли и рассматривать его нарушения в качестве онкогенных событий.
Значение делеций гена SESN1 в патогенезе фолликулярной лимфомы было продемонстрировано Oricchio et al. [4]. Известно, что общая выживаемость больных ФЛ с делецией 6q значительно ниже, чем пациентов без данной генетической аномалии [5]. Ген SESN1 расположен в регионе 6q21. Исследованиями Oricchio et al. была показана высокая частота делеций области, вовлекающей ген SESN1, среди пациентов с ФЛ (в среднем в 20% случаев) [4]. Авторами также в экспериментах in vivo и на животных моделях было прямо доказано влияние потери функции Sestrinl на активацию независимой клеточной пролиферации и опухолевую трансформацию по морфологическому типу ФЛ [4].
Поскольку дефицит функциональной активности Sestrinl приводит к активации комплекса mTORC1, применение ингибиторов сигнального пути mTOR можно рассматривать в качестве потенциальной терапевтической стратегии при ФЛ, что в настоящее время реализуется в рамках клинических исследований. При этом стоит отметить, что максимальная эффективность препаратов предположительно должна быть ассоциирована с делециями SESN1.
Функция Sestrinl тесно взаимосвязана с функцией белка EZH2, продукта одноименного гена. Дикий тип транскрипционного фактора EZH2 обладает умеренной ингибирующей активностью по отношению к гену Sestrinl. Активирующие мутации EZH2, описанные у 7-27% пациентов с ФЛ [6], приводят к эпигенетической инактивации SESN1 и выпадению функции соответствующего белка. Oricchio et al. было показано, что эффективность ингибиторов EZH2, которые в настоящее время рассматриваются в качестве потенциальной терапии ФЛ, может быть достигнута только при интактном гене SESN1 [4]. Делеций SESN1 нивелируют действие EZH2 и его ингибиторов.
Приведенные зависимости свидетельствуют, что информация о статусе гена SESN1 представляется актуальной при диагностике биологических особенностей опухоли и планировании оптимального режима терапии.
Задача определения делеций гена SESN1 может быть решена при использовании следующих вариантов лабораторных методов:
1) флуоресцентная гибридизация in situ (FISH);
2) полимеразная цепная реакция (ПЦР).
Метод 1 не применим при исследовании малоклеточных образцов и образцов с низкой сохранностью генетического материала, в частности, парафиновых блоков. Создание зондов для неизвестной ранее мишени характеризуется высокой стоимостью, а само исследование отличается технической сложностью выполнения и длительностью проведения анализа.
Метод 2, заключающийся в амплификации с помощью ГЩР искомых последовательностей ДНК, характеризуется высокой чувствительностью. Он позволяет исследовать малоклеточные образцы и архивный материал (замороженные образцы опухолевых тканей и парафиновые блоки) и отличается относительной простотой выполнения и возможностью воспроизведения методики в большинстве молекулярно-генетических лабораторий.
Таким образом, данный вариант решения поставленной задачи максимально соответствует требованиям высокой чувствительности анализа, простоты технической реализации и воспроизводимости лабораторного исследования.
Идентификация делеций искомой генетической области методом ПЦР может быть реализована при анализе нуклеотидных последовательностей данной области, находящихся в гетерозиготном состоянии. В таком случае при отсутствии в конечном ПЦР-продукте, разделенном при помощи горизонтального электрофореза или капиллярного электрофореза, продукта амплификации одного из аллелей можно говорить о наличии делеций данного генетического региона. Высоким уровнем гетерозиготности и вариабельности отличаются микросателлитные последовательности ДНК. Опубликованы обширные базы данных микросателлитных локусов, которые применяются при картировании хромосом [7, 8]. Однако, известные микросателлиты расположены преимущественно в межгенных областях ДНК, и ни один из них не может быть соотнесен с геном SESN1.
Основой заявляемой диагностической системы послужили шесть микросателлитных локусов интронных областей гена SESN1, которые были выделены и впервые описаны авторами изобретения. Названия маркеров даны по типу и количеству тандемных повторов в референсной последовательности GRCh38.p13 базы данных Gene NCBI, использованной в работе.
В настоящее время аналоги предложенного способа не известны.
Заявляемое изобретение направлено на решение задачи создания простой, доступной для реализации в большинстве молекулярно-генетических лабораторий, и информативной диагностической тест-системы, направленной на выявление делеций гена SESN1 при фолликулярной лимфоме.
Поставленная задача решена разработкой тест-системы с оригинальной панелью микросателлитов интронных областей гена SESN1 и олигонуклеотидных праймеров, а также способа диагностики делеций гена SESN1 в образце опухолевой ткани при сравнении с нормальными клетками в качестве контрольного образца путем проведения анализа изменений 6 микросателлитных локусов ДНК методом ГПДР в составе 2 мультиплексных реакций с последующим фрагментным анализом ПЦР-продуктов.
Результатом исследований, произведенных авторами заявляемого изобретения, является диагностическая тест-система и способ осуществления идентификации делеций гена SESNJ, в том числе, при ФЛ. В опубликованных источниках литературы авторами не обнаружено сведений, касающихся реализованного нового решения.
Использование в практике заявляемого способа позволяет достичь прямого технического результата в виде диагностики делеций гена SESN1, роль которых была продемонстрирована в патогенезе ФЛ для определения прогностических групп заболевания и дифференциации методов терапии, а также в дальнейшей разработке значения сигнального пути Sestrinl-mTOR при В-НХЛ в рамках фундаментальных исследований.
Сущность предлагаемой группы изобретений пояснена на графических материалах.
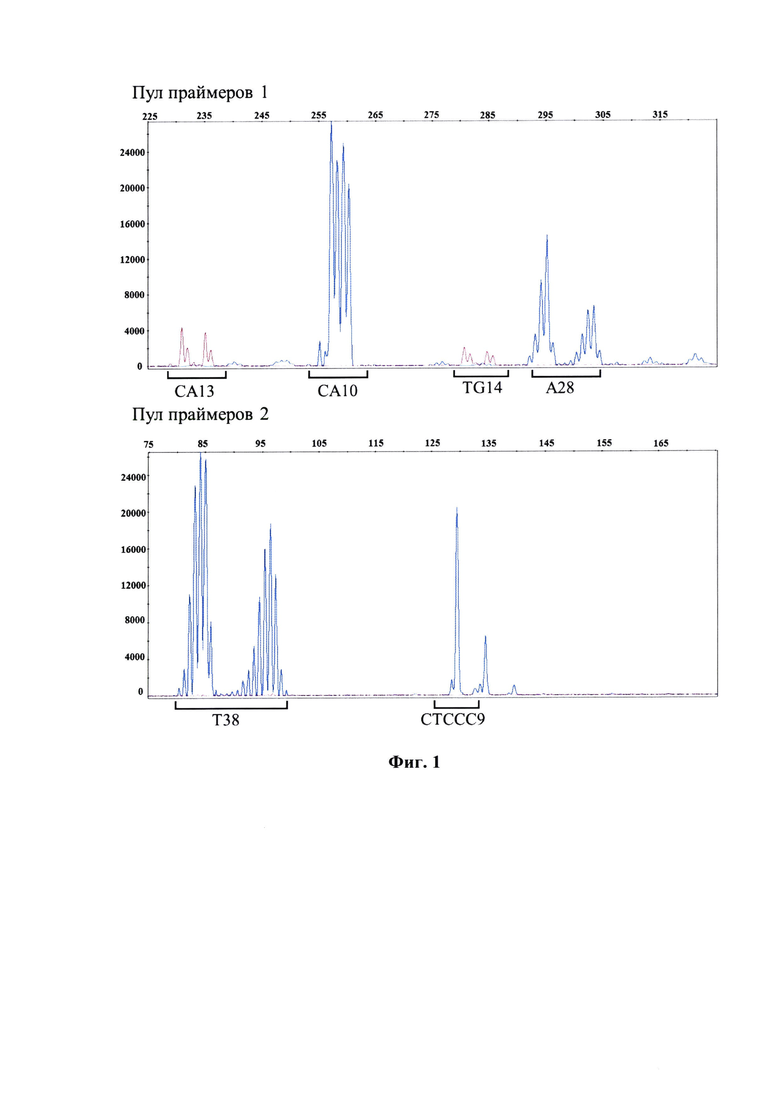
Фиг. 1 - Относится к примеру 1 и представляет результат исследования панели микросателлитных локусов у здорового донора. На графике электрофореграммы по оси X отмечена длина ПЦР-продукта, п. н. По оси Y отмечена интенсивность флуоресценции меченого ПЦР-продукта.
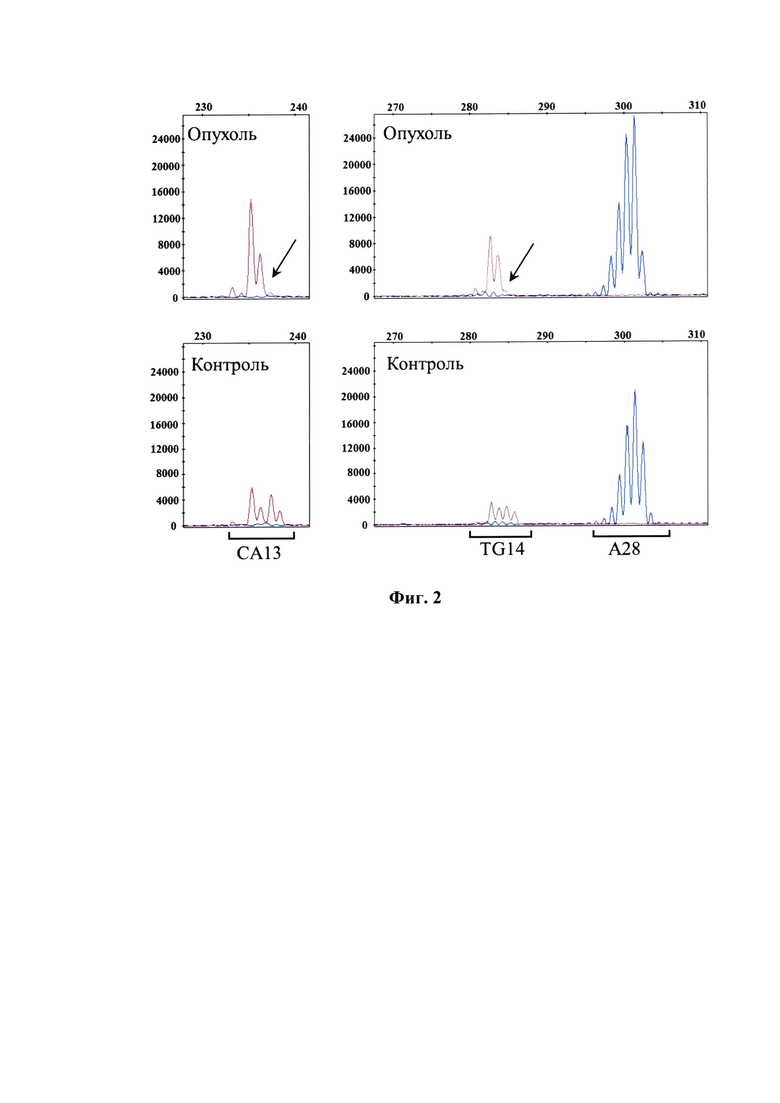
Фиг. 2 - Относится к примеру 2 и представляет результат исследования панели микросателлитных локусов у пациента С.На графике электрофореграммы по оси X отмечена длина ПЦР-продукта, п. н. По оси Y отмечена интенсивность флуоресценции меченого ПЦР-продукта. Стрелочками указаны локусы утраты одного из аллелей в опухолевом образце.
Сущность группы изобретений пояснена следующими перечнями последовательностей:
SEQ ID NO: 1 последовательность нуклеотидов ДНК Homo sapiens, прямой праймер к локусу TG14;
SEQ ID NO: 2 последовательность нуклеотидов ДНК Homo sapiens, обратный праймер к локусу TG14;
SEQ ID NO: 3 последовательность нуклеотидов ДНК Homo sapiens, прямой праймер к локусу СТССС9;
SEQ ID NO: 4 последовательность нуклеотидов ДНК Homo sapiens, обратный праймер к локусу СТССС9;
SEQ ID NO: 5 последовательность нуклеотидов ДНК Homo sapiens, прямой праймер к локусу СА10;
SEQ ID NO: 6 последовательность нуклеотидов ДНК Homo sapiens, обратный праймер к локусу СА10;
SEQ ID NO: 7 последовательность нуклеотидов ДНК Homo sapiens, прямой праймер к локусу Т38;
SEQ ID NO: 8 последовательность нуклеотидов ДНК Homo sapiens, обратный праймер к локусу Т38;
SEQ ID NO: 9 последовательность нуклеотидов ДНК Homo sapiens, прямой праймер к локусу А28;
SEQ ID NO: 10 последовательность нуклеотидов ДНК Homo sapiens, обратный праймер к локусу А28;
SEQ ID NO: 11 последовательность нуклеотидов ДНК Homo sapiens, прямой праймер к локусу СА13;
SEQ ID NO: 12 последовательность нуклеотидов ДНК Homo sapiens, обратный праймер к локусу СА13.
Нуклеотидные последовательности праймеров являются оригинальной разработкой авторов и не описаны ранее в литературе.
Сущность группы изобретения заключается в следующем.
Разработана тест-система.
Состав тест-системы:
1) пары прямого и обратного праймеров к 6 микросателлитным маркерам, объединенным в 2 мультиплексных пула соответственно 2 реакционным смесям
1 пул:
- локус TG14 (прямой праймер SEQ ID NO: l, 10 пмоль/мкл; обратный праймер SEQ ID NO: 2, меченный ROX, 10 пмоль/л);
- локус СА10 (прямой праймер SEQ ID NO: 5, 2,5 пмоль/мкл; обратный праймер SEQ ID NO: 6, меченный FAM, 2,5 пмоль/л);
- локус А28 (прямой праймер SEQ ID NO: 9, 5 пмоль/мкл; обратный праймер SEQ ID NO: 10, меченный FAM, 5 пмоль/л);
- локус СА13 (прямой праймер SEQ ID NO: 11, 5 пмоль/мкл; обратный праймер SEQ ID NO: 12, меченный ROX, 5 пмоль/л).
2 пул:
- локус СТССС9 (прямой праймер SEQ ID NO: 3,10 пмоль/мкл; обратный праймер SEQ ID NO: 4, меченный FAM, 10 пмоль/л);
- локус Т38 (прямой праймер SEQ ID NO: 7, 5 пмоль/мкл; обратный праймер SEQ ID NO: 8, меченный FAM, 5 пмоль/л).
Каждому пулу соответствует одна пробирка со смесью праймеров, которую подготавливают путем смешивания стоков синтезированных олигонуклеотидов в приведенных концентрациях, обеспечивающих наиболее благоприятные условия проведения ПЦР. Объем готовой смеси праймеров, необходимый для анализа одного образца - 1 мкл.
2) Реактивы для проведения мультиплексной ПЦР:
- 10х ПЦР-Буфер-Б (ООО "СИНТОЛ", Россия) в пробирках по 500 мкл из расчета 1 пробирка на 150 реакций;
- смесь dNTP (концентрация каждого дезоксинуклеотидтрифосфата 25 мМ) в пробирках по 500 мкл из расчета 1 пробирка на 150 реакций;
- 25 мМ раствор MgCl2 в пробирках по 500 мкл из расчета 1 пробирка на 300 реакций;
- Taq-полимераза 5 ед./мкл в пробирках по 1000 мкл из расчета 1 пробирка на 2000 реакций;
- деионизированная вода во флаконах по 50 мл из расчета 1 флакон на 3000 реакций.
Особенность заявляемого способа заключается в том, что определяют изменения совокупности 6 микросателлитных маркеров тест-системы. При реализации способа осуществляют анализ изменений микросателлитных локусов ДНК в образце опухолевой ткани при сравнении с контрольным образцом методом ПЦР на основании последующего анализа длин ПЦР-продуктов.
Амплификация исследуемых локусов производится в условиях 2 реакционных смесей соответственно 2 пулам праймеров методом мультиплексной ПЦР. Оптимальные сочетания специфичных пар праймеров к перечисленным микросателлитным локусам в 2 пулах, определенные на основании исключения вероятности взаимного отжига и образования димеров и с учетом лучшей визуализации отдельных ПЦР-продуктов, разделенных по длине и каналу флуоресценции, а также условия проведения ПЦР и соотношения концентраций реагентов являются оригинальной особенностью заявляемого изобретения.
Заявляемый способ осуществляется согласно описанной далее методике.
1. Подготовка материалов и компонентов
Исследуемый материал представлен образцом опухолевой ткани, в качестве которого допустимо использование следующих источников:
- фрагмент опухолевого биоптата (объемом не менее 0,5 мм3);
- срезы с парафиновых блоков (в количестве от 2 до 10 при толщине среза 10 мкм в зависимости от объема заключенного материала) с последующей депарафинизацией согласно стандартным методикам;
- клетки периферической крови или аспирата костного мозга при доказанном иными методами наличия лейкемизации или вовлечения в опухолевый процесс костного мозга (10 мл в пробирке с раствором ЭДТА).
Доля опухолевых клеток от общей клеточности образца должна быть не менее 10%, что определено чувствительностью молекулярного исследования.
В качестве отрицательного контроля используют внесение в состав реакционной смеси ПЦР деионизированный воды вместо матрицы ДНК.
В качестве парного нормального образца в параллельном исследовании целесообразно использовать клетки периферической крови того же пациента, а в случае лейкемизации - клетки буккального эпителия, что обеспечивает наличие контроля и достоверность анализа.
Фрагменты опухолевых биоптатов могут быть взяты в работу непосредственно после выполнения биопсии или после замораживания при температуре не выше минус 30°С без использования криоконсерванта.
2. Выделение ДНК из опухолевой ткани биоптатов и депарафинизированных срезов
Подготовку проводят по изложенной ранее методике [9]. Забор клеток аспирата костного мозга или периферической крови осуществляют в 10 мл пробирку с раствором ЭДТА. Выделение ДНК проводят по любой из стандартных методик.
ПЦР проводят в составе реакционной смеси путем смешивания следующих компонентов в 0,2 мл микропробирках:
- 3 мкл 10х буфера (ПЦР-Буфер-Б, ООО "СИНТОЛ", Россия);
3 мкл смеси dNTP (концентрация каждого дезоксинуклеотидтрифосфата 25 мМ);
- 1,5 мкл 25 мМ раствора MgCl2;
- не менее 20 нг геномной ДНК (в среднем в объеме водного раствора от 2 мкл до 5 мкл);
- 1 мкл одного из двух пулов праймеров;
- 2,5 ед. Taq-полимеразы;
- деионизированная вода до общего объема реакционной смеси 25 мкл.
3. Постановка реакции
ПЦР проводят при следующих условиях:
- первичная денатурация 95°С 10 минут;
- 35 циклов денатурации при 95°С 40 секунд, отжига при 57°С 40 секунд, элонгации при 72°С 30 секунд;
- заключительная элонгация при 72°С 5 минут.
4. Учет результатов
Продукты амплификации в разведении 1:60-100 смешивают с формамидом в соотношении 1:3 и денатурируют при 95°С в течение 3 минут, после чего проводят фрагментный анализ на основе капиллярного электрофореза на генетическом анализаторе. Авторами заявляемого изобретения был использован генетический анализатор Нанофор-05 (ООО "СИНТОЛ", Россия).
5. Интерпретация результатов
Наличие делеций гена SESN1 определяют в случае гетерозиготного наследования на основании отсутствия пиков одного из аллелей или уменьшения интенсивности его флуоресценции по отношению к пику второго аллеля соответствующего микросателлитного локуса в опухолевой ткани при сравнении с контрольным образцом. Наличие делеций гена SESN1 у пациента с ФЛ относит его к группе высокого риска и позволяет предполагать у него неблагоприятное течение заболевания.
Сущность группы изобретений пояснена примерами конкретной реализации, которые не ограничивают объем прав.
Пример 1. Технические условия заявляемого способа были разработаны с использованием образцов ДНК клеток периферической крови 4 здоровых доноров. В дополнительной группе из 28 здоровых доноров была доказана воспроизводимость разработанной диагностической тест-системы.
В таблице 1 представлены данные об аллельном разнообразии исследуемых микросателлитных локусов в донорской популяции. Несмотря на то, что уровень гетерозиготности каждого маркера невысок (3,85-53,85%), их сочетание позволяет считать исследование информативным у 89% пациентов, у которых на образце нормальной ткани подтверждено гетерозиготное наследование хотя бы одного локуса. Пентануклеотидный повтор СТССС9 можно считать консервативным, поскольку 97% доноров имеют аллель 129 п. н. в гомозиготном состоянии. По этой причине он не пригоден для исследования областей утраты генетического материала. Однако данный маркер служит внутренним контролем эффективности ПЦР-реакции, в связи с чем, он был включен в разработанную панель.
На Фиг. 1 отображены электрофореграммы, полученные при анализе ДНК одного из доноров, соответственно пулам смесей праймеров.
Пример 2. Пациент С.с диагнозом фолликулярная лимфома 3А морфологического типа. У пациента достигнута частичная ремиссия после 1 линии химиотерапии, срок наблюдения - 2 месяца. На Фиг. 2 представлены результаты исследования панели микросателлитных локусов в контрольном и опухолевом образцах пациента С, а также примеры электрофореграмм отдельных локусов. По двум микросателлитным локусам (СА13 и TG14) в опухолевой ткани отмечена утрата одного из аллелей, что свидетельствует о наличии делеций гена SESN1.
Таким образом, проведенные авторами исследования позволили разработать диагностическую тест-систему и способ выявления прогностически значимых делеций гена SESN1 при ФЛ, что реализуется путем выполнения мультиплексной ПЦР оригинальной панели 6 микросателлитных локусов с последующего фрагментным анализом ПЦР-продуктов. Результаты, получаемые при осуществлении изобретения, применимы при определении характера последующего течения опухолевого заболевания на этапе первичной диагностики для дифференциации методов терапии, а также могут быть использованы в рамках фундаментальных исследований сигнального пути Sestrinl-mTOR.
Источники информации, принятые во внимание при составлении описания к заявке на выдачу патента РФ на изобретение «Тест-система и способ выявления делеций гена SESN1»:
1. Budanov AV. Stress-responsive sestrins linkp53 with redox regulation and mammalian target of rapamycin signaling. Antioxid Redox Signal. 2011 Sep 15;15(6):1679-90. doi: 10.1089/ars.2010.3530. Epub 2011 Feb 18. PMID: 20712410; PMCID: PMC3151419.
2. Guri Y, Hall MN. mTOR Signaling Confers Resistance to Targeted Cancer Drugs. Trends Cancer. 2016 Nov;2(l l):688-697. doi: 10.1016/j.trecan.2016.10.006. Epub 2016 Nov 4. PMID: 28741507.
3. Mantovani F, Collavin L, Del Sal G. Mutant p53 as a guardian of the cancer cell. Cell Death Differ. 2019 Jan;26(2):199-212. doi: 10.1038/s41418-018-0246-9. Epub 2018 Dec 11. PMID: 30538286; PMCID: PMC6329812.
4. Oricchio E, Katanayeva N, Donaldson MC, Sungalee S, Pasion JP, Beguelin W, Battistello E, Sanghvi VR, Jiang M, Jiang Y, Teater M, Parmigiani A, Budanov AV, Chan FC, Shah SP, Kridel R, Melnick AM, Ciriello G, Wendel HG. Genetic and epigenetic inactivation of SESTRIN1 controls mTORC1 and response to EZH2 inhibition in follicular lymphoma. Sci Transl Med. 2017 Jun 28;9(396):eaak9969. doi: 10.1126/scitranslmed.aak9969. PMID: 28659443; PMCID: PMC5559734.
5. Tilly H, Rossi A, Stamatoullas A, Lenormand B, Bigorgne C, Kunlin A, Monconduit M, Bastard C. Prognostic value of chromosomal abnormalities in follicular lymphoma. Blood. 1994 Aug 15;84(4): 1043-9. PMID: 8049424.
6. Araf S, Okosun J, Koniali L, Fitzgibbon J, Heward J. Epigenetic dysregulation in follicular lymphoma. Epigenomics. 2016 Jan;8(l):77-84. doi: 10.2217/epi.l5.96. Epub 2015 Dec 23. PMID: 26698557; PMCID: PMC4864036.
7. Broman KW, Murray JC, Sheffield VC, White RL, Weber JL. Comprehensive human genetic maps: individual and sex-specific variation in recombination. Am J Hum Genet. 1998 Sep; 63(3):861-9. doi: 10.1086/302011. PMID: 9718341; PMCID: PMC1377399.
8. Gyapay G, Morissette J, Vignal A, Dib C, Fizames C, Millasseau P, Marc S, Bernardi G, Lathrop M, Weissenbach J. The 1993-94 Genethon human genetic linkage map.Nat Genet. 1994 Jun;7(2 SpecNo):246-339. doi: 10.1038/ng0694supp-246. PMID: 7545953.
9. Sidorova JV, Biderman BV, Nikulina EE, Sudarikov AB. A simple and efficient method for DNA extraction from skin and paraffin-embedded tissues applicable to T-cell clonality assays. Exp Dermatol. 2012;21(l):57-60. doi: 10.1111 /j. 1600-0625.2011.01375.x.

--->
Перечень последовательностей
<110> Федеральное государственное бюджетное учреждение
«Национальный медицинский исследовательский центр гематологии»
Министерства здравоохранения Российской Федерации (ФГБУ "НМИЦ
гематологии" Минздрава России)
Federal Governmental Budgetary Institution «National Research
Center for Hematology»
<120> ТЕСТ-СИСТЕМА И СПОСОБ ВЫЯВЛЕНИЯ ДЕЛЕЦИЙ ГЕНА SESN1
<160> 12
<210> 1
<211> 23
<212> DNA
<213> Homo sapiens
<400> 1
TCAGATTTCA AGGATTCTTC AGA
<210> 2
<211> 20
<212> DNA
<213> Homo sapiens
<400> 2
ACAAGGTGAG TAGATCGAGA
<210> 3
<211> 20
<212> DNA
<213> Homo sapiens
<400> 3
CCACTCTCGG TCTTTCCCTT
<210> 4
<211> 22
<212> DNA
<213> Homo sapiens
<400> 4
TGAAAGCCAC AGTTCATCAT CA
<210> 5
<211> 20
<212> DNA
<213> Homo sapiens
<400> 5
TGACTTATCT CTGAGCCCCA
<210> 6
<211> 21
<212> DNA
<213> Homo sapiens
<400> 6
AGGAGCTGTT CAAGACTAGG A
<210> 7
<211> 21
<212> DNA
<213> Homo sapiens
<400> 7
TCTCCATTGA ATTGCCTGTA C
<210> 8
<211> 19
<212> DNA
<213> Homo sapiens
<400> 8
CACCACACTC CAGCCTAGA
<210> 9
<211> 20
<212> DNA
<213> Homo sapiens
<400> 9
ACCATCCTGG CTATGGTGAA
<210> 10
<211> 23
<212> DNA
<213> Homo sapiens
<400> 10
CAGGGCAATG CTATACTAGT TTC
<210> 11
<211> 20
<212> DNA
<213> Homo sapiens
<400> 11
AAAAGTAGCC AAGCAAGGTG
<210> 12
<211> 21
<212> DNA
<213> Homo sapiens
<400> 12
CCTCTCCTTT TCCATTGCTG C
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Тест-система и способ выявления делеций длинного плеча 6 хромосомы | 2021 |
|
RU2770892C1 |
| Тест-система и способ выявления A, B, D мутаций гена NPM1 для количественного определения минимальной остаточной болезни | 2023 |
|
RU2830545C1 |
| Набор STR-маркеров Y-хромосомы для определения этно-территориального происхождения индивида по образцу его ДНК | 2021 |
|
RU2804433C2 |
| ПАНЕЛЬ БИОМАРКЕРОВ И СПОСОБЫ ВЫЯВЛЕНИЯ МИКРОСАТЕЛЛИТНОЙ НЕСТАБИЛЬНОСТИ ПРИ РАЗНЫХ ВИДАХ РАКА | 2019 |
|
RU2795410C2 |
| ГЕНЕТИЧЕСКИЙ ТЕСТ ДЛЯ ИДЕНТИФИКАЦИИ НОСИТЕЛЕЙ РЕЦЕССИВНОГО ГЕНА КОМПЛЕКСНЫХ ВЕРТЕБРАЛЬНЫХ МАЛЬФОРМАЦИЙ У КРУПНОГО РОГАТОГО СКОТА | 2001 |
|
RU2276690C2 |
| Способ генотипирования полиморфного локуса rs139794067 (G>T) гена MYL3 | 2025 |
|
RU2837876C1 |
| Способ генотипирования однонуклеотидного варианта rs2072668 (C>G) гена OGG1 человека методом полимеразно-цепной реакции в режиме реального времени | 2024 |
|
RU2835216C1 |
| Тест-система для определения статуса генов IDH ½ в тканях глиальных опухолей | 2023 |
|
RU2823028C1 |
| Способ генотипирования однонуклеотидного варианта rs2304277 (G>A) гена OGG1 человека методом полимеразно-цепной реакции в режиме реального времени | 2024 |
|
RU2836047C1 |
| Способ генотипирования однонуклеотидного варианта rs3219484 (C>T) гена MUTYH человека методом полимеразно-цепной реакции в режиме реального времени | 2024 |
|
RU2835215C1 |
Изобретение относится к области медицины, онкологии, в частности гематологии. Предложен пул олигонуклеотидных праймеров для специфической амплификации шести микросателлитных локусов интронов гена SESN1, который может быть использован в тест-системе для определения делеций гена SESN1 методом мультиплексной полимеразной цепной реакции (ПЦР), а также в способе выявления пациентов с неблагоприятным течением фолликулярной лимфомы по наличию значимых делеций гена SESN1 с помощью вышеупомянутой тест-системы. Наличие делеций гена SESN1 в случае гетерозиготного наследования на основании отсутствия пиков одного из аллелей или уменьшения интенсивности его флуоресценции по отношению к пику второго аллеля соответствующего микросателлитного локуса в опухолевой ткани при сравнении с контрольным образцом позволяет выявлять группу пациентов с неблагоприятным течением фолликулярной лимфомы. 3 н. и 2 з.п. ф-лы, 2 ил., 1 табл., 2 пр.
1. Пул олигонуклеотидных пар праймеров для специфической амплификации шести микросателлитных локусов интронов гена SESN1: TG14, СА10, А28, СА13, СТССС9, Т38, имеющие следующие нуклеотидные последовательности SEQ ID NO: 1- SEQ ID NO: 12:
TG14-F: 5'- TCAGATTTCAAGGATTCTTCAGA -3',
TG14-R: 5'-ROX- ACAAGGTGAGTAGATCGAGA -3',
CA10-F: 5'- CCACTCTCGGTCTTTCCCTT -3',
CA10-R: 5'-FAM- TGAAAGCCACAGTTCATCATCA -3',
A28-F: 5'- TGACTTATCTCTGAGCCCCA -3',
A28-R: 5'-FAM- AGGAGCTGTTCAAGACTAGGA -3',
CA13-F: 5'- TCTCCATTGAATTGCCTGTAC -3',
CA13-R: 5'-ROX- CACCACACTCCAGCCTAGA -3',
CTCCC9-F: 5'- ACCATCCTGGCTATGGTGAA -3',
CTCCC9-R: 5'-FAM- CAGGGCAATGCTATACTAGTTTC -3',
T38-F: 5'- AAAAGTAGCCAAGCAAGGTG -3',
T38-R: 5'-FAM- CCTCTCCTTTTCCATTGCTGC -3'.
2. Тест-система для определения делеций гена SESN1 методом мультиплексной полимеразной цепной реакции (ПЦР), состоящая из пула олигонуклеотидных пар праймеров по п. 1, локализованных в интронах гена SESN1, разделенного на 2 пула-смеси праймеров, исключающих вероятность взаимного отжига и образования димеров и с учетом лучшей визуализации отдельных ПЦР-продуктов:
1 пул - TG14 - 10 пмоль/мкл, СА10 - 2,5 пмоль/мкл, А28 - 5 пмоль/мкл, СА13 - 5 пмоль/мкл,
2 пул - СТССС9 - 10 пмоль/мкл, Т38 - 5 пмоль/мкл;
реактивов для проведения ПЦР: 10х ПЦР-Буфер-Б, смесь dNTP по 25 мМ, 25 мМ раствор MgCl2, Taq-полимераза, деионизированная вода.
3. Способ выявления пациентов с неблагоприятным течением фолликулярной лимфомы по наличию значимых делеций гена SESN1 с помощью тест-системы по п. 2, включающий следующие этапы: сбор и подготовка парных образцов опухоли и контрольной ткани; выделение ДНК; проведение мультиплексной ПЦР с помощью тест-системы по п. 2 для каждого образца при следующих условиях:
первичная денатурация 95°С 10 минут,
35 циклов денатурации при 95°С 40 секунд, отжига при 57°С 40 секунд,
элонгации при 72°С 30 секунд,
заключительная элонгация при 72°С 5 минут;
продукты амплификации в разведении 1:60-100 смешивают с формамидом в соотношении 1:3 и денатурируют при 95°С в течение 3 минут; фрагментный анализ на основе капиллярного электрофореза на генетическом анализаторе; интерпретация полученных данных: наличие делеций гена SESN1 в случае гетерозиготного наследования на основании отсутствия пиков одного из аллелей или уменьшения интенсивности его флуоресценции по отношению к пику второго аллеля соответствующего микросателлитного локуса в опухолевой ткани при сравнении с контрольным образцом выявляет группу пациентов с неблагоприятным течением фолликулярной лимфомы.
4. Способ по п. 3, отличающийся тем, что в качестве образца опухолевой ткани допустимо использование фрагментов опухолевого биоптата, срезов с парафиновых блоков с последующей депарафинизацией, а также клеток периферической крови или аспирата костного мозга в случае вовлечения их в опухолевый процесс.
5. Способ по п. 3, отличающийся тем, что в качестве парного нормального образца используют клетки периферической крови того же пациента, а в случае лейкемизации - клетки буккального эпителия.
| ORICCHIO E | |||
| et al., Genetic and epigenetic inactivation of SESTRIN1 controls mTORC1 and response to EZH2 inhibition in follicular lymphoma, Sci Transl Med, 2017, Vol | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| Станок для сборки автомобильных и других двигателей | 1927 |
|
SU9969A1 |
| BURKHARDT B | |||
| et al., Loss of heterozygosity on chromosome 6q14-q24 is associated with poor outcome in children and adolescents with T-cell lymphoblastic | |||
Авторы
Даты
2022-05-23—Публикация
2021-07-22—Подача