Область изобретения
Настоящее изобретение относится к способам иммунной или гематологической стимуляции, ингибирования образования или роста опухоли и лечения или предупреждения злокачественной опухоли, симптомов злокачественной опухоли или симптомов, связанных с лечением злокачественных опухоли посредством введения молочного жира или аналога молочного жира, необязательно, по меньшей мере с одним дополнительным лекарственным средством, таким как противоопухолевое средство, предпочтительно выбранное из лактоферрина (включая железосодержащий лактоферрин). Способы и лечебное применение по изобретению можно осуществлять, применяя диетические (в виде пищевых продуктов или пищевых добавок), нутрицевтические или фармацевтические композиции. Также предоставлены композиции, пригодные в способах по изобретению.
Предпосылки изобретения
Молоко является богатой биологической жидкостью, которая обеспечивает питание во время быстрого роста и развития в младенческом возрасте. Поэтому, кроме субстратов, необходимых для развития младенца, оно содержит много регуляторов роста.
Польза для здоровья от употребления молока относительно риска развития злокачественной опухоли является предметом исследования и широкой дискуссии. Сообщалось, что потребление молочных продуктов с высоким содержанием жира (Larsson, et al., 2005) или молока с низким содержанием жира (Ma, et al., 2001 and Goodman, et al., 2002) может снизить риск некоторых злокачественных опухолей, включая рак ободочной и прямой кишки и рак яичников. С другой стороны, в других исследованиях описано, что высокое потребление молока с низким содержанием жира повышает риск некоторых злокачественных опухолей (Larsson, et al., 2006). В обзоре литературы сообщается, что доказательства связи потребления молочных продуктов с риском рака яичников ограничены и противоречивы (Schulz, et al., 2004). Со сниженным риском рака молочной железы (Shin, et al., 2002 and Bradlow and Sepkovic, 2002) связывали как цельное молоко, так и молоко с низким содержанием жира, тогда как в других исследованиях они были описаны как факторы риска (Knekt, et al., 1996 и Gaard, et al., 1995). Молоко с низким содержанием жира способствует развитию индуцированных канцерогенами опухолей молочных желез у крыс (Qin, et al., 2004), а также молоко с низким содержанием жира было ассоциировано с повышенным риском рака предстательной железы (Tseng, et al., 2005 and Veierod, et al, 1997). В одном большом проспективном исследовании опубликовано, что употребление молока взрослым человеком имеет тенденцию к отрицательной связи с частотой возникновения рака молочной железы (Hjartaker, et al., 2001), тогда как в недавних обзорах сделано заключение, что между повышенным или сниженным риском злокачественной опухоли и высоким потреблением молочных продуктов как с низким, так и с высоким содержанием жира закономерности нет (Moorman and Terry, 2004 and Parodi, 2005). В заключение необходимо отметить, что эпидемиологические данные относительно рисков развития злокачественной опухоли и преимуществ употребления молока являются противоречивыми.
Молочный жир содержит ряд компонентов, включая конъюгированную линолевую кислоту (CLA), сфингомиелин, масляную кислоту, вакценовую кислоту, жирные кислоты с разветвленной цепью, липиды простых эфиров, β-каротин и витамины A и D, которые исследовали для оценки их противоопухолевого потенциала (рассмотрено в Parodi, 1999 and Parodi, 1997). Например, по опубликованным данным цис-9, транс-11 (c9, t11) изомер CLA и его предшественник вакценовая кислота ингибируют рост опухолевых клеточных линий (Miller, et al., 2003 and O'Shea, et al., 2000). По опубликованным данным диета с CLA, увеличивая апоптоз, снижает частоту возникновения опухолей толстого кишечника у крыс, которым вводили 1,2-диметилгидразин (Kim and Park, 2003). В других исследованиях описано, что диета с CLA ингибирует инициацию канцерогенеза кожи у мышей, индуцированного 7,12-диметил-бенз[а]антраценом (DMBA) (Ha, et al., 1987) и неоплазию кардиального отдела желудка у мышей, индуцированную бензо[а]пиреном (Chen, et al., 2003). Описывали, что кормление вакценовой кислотой и c9, t11 CLA в виде жира масла ингибировало развитие карцином молочных желез у крыс (Corl, et al., 2003, Banni, et al., 2001). Было опубликовано, что CLA ингибирует ангиогенез, что может вносить вклад в ее эффективность в качестве хемопревентивного средства (Masso-Welch, et al., 2002).
В отличие от этого в других исследованиях описано, что диета с CLA индивидуально или в комбинации с изолятом белка сои не ингибирует рост и развитие опухолевых клеток предстательной железы у крыс in vivo (Cohen, et al., 2003) и развитие аберрантных очагов крипт в толстом кишечнике самцов крыс линии Sprague-Dawley, индуцированное азоксиметаном (Ealey, et al., 2001). Кроме того, опубликовано, что масса гепатом крыс была значимо выше у крыс, которых содержали на диете с CLA (Yamasaki, et al., 2001). В эпидемиологических исследованиях опубликовано, что возникновение рака молочной железы не было связано с потреблением групп пищевых продуктов, содержащих CLA (Voorrips, et al., 2002). Как и в случае с эпидемиологическими исследованиями потребления молочного жира людьми, результаты различных исследований CLA и противоопухолевой активности являются противоречивыми.
Ранее опубликовано, что опухоли не очень чувствительны к химиотерапии во всех случаях. Например, эффективность химиотерапии для субъектов со злокачественными опухолями зависит от вида злокачественной опухоли, типа и доз лекарственных средств, используемых для лечения, механизмов, посредством которых работают лекарственные средства и схем лечения.
В данной области известно, что злокачественные опухоли отличаются по своей чувствительности к химиотерапии от обычно и часто чувствительных (например, лимфомы, острый лимфобластный лейкоз (ALL), хронический лимфоцитарный лейкоз (CLL), болезнь Ходжкина, средней и высокой степени злокачественности неходжкинская лимфома, например диффузная крупноклеточная лимфома, лимфома Беркита, лимфобластная лимфома, хориокарцинома, эмбриональные опухоли, миеломатоз, овсяно-клеточная карцинома бронхов, тестикулярная карцинома, саркома Юинга, опухоль Вильма, рак кожи), где можно достичь полного клинического выздоровления, до более устойчивых (рак мочевого пузыря, рак пищевода, немелкоклеточный рак легких, печеночноклеточная карцинома, карцинома почек, карцинома поджелудочной железы, рак головы и шеи, карцинома шейки матки, карцинома печени, карциномы легких, которые не являются овсяно-клеточными). Ранее описано, что опухоли EL-4, составляющие более 0,3 см в диаметре, становятся полностью нечувствительными к иммунотерапии и антиангиогенному лечению (Kanwar, et al, 1999 и Sun, et al., 2001) и химиотерапии (Kanwar et al. - WO 2006/054908).
Кроме того, лечение злокачественной опухоли посредством лучевой терапии, или хирургической операции, или химиотерапии, или другими способами часто вызывает или обостряет ассоциированные с ней симптомы или заболевания. Например, субъекты со злокачественными опухолями, проходящие лечение, часто кахектичны, так как химиотерапия может вызывать воспаление слизистой оболочки тонкого кишечника, ассоциированное с апоптозом клеток в криптах, которое предшествует атрофии кишечных ворсинок (Keefe, et al., 2000).
Таким образом желательно разработать усовершенствованный способ ингибирования образования или роста опухоли или снижения симптомов или тяжести заболеваний, ассоциированных со злокачественной опухолью, или лечения злокачественной опухоли с применением молочного жира, необязательно с одним или несколькими дополнительными лекарственными средствами, или, по меньшей мере, предоставить людям подходящий выбор.
Сущность изобретения
Таким образом, один из аспектов изобретения относится к способу ингибирования образования опухоли, ингибированию роста опухоли, ингибированию метастазирования опухоли или лечению или предупреждению злокачественной опухоли у субъекта, где способ включает раздельное, одновременное или последовательное введение нуждающемуся в этом субъекту эффективного количества молочного жира или аналога молочного жира и одного или нескольких лекарственных средств, таких как одно или несколько противоопухолевых средств, где предпочтительно одно или несколько противоопухолевых средств выбраны из противоопухолевых пищевых факторов, химиотерапевтических средств, иммунотерапевтических средств, гематопоэтических средств, противокахектических средств или противомукозитных средств, более предпочтительно одно или несколько лекарственных средств представляют собой лактоферрин (Lf).
Другой аспект изобретения относится к способу стимулирования иммунной системы субъекта, где способ включает введение нуждающемуся в этом субъекту эффективного количества молочного жира или аналога молочного жира. В одном из вариантов осуществления способ стимулирования иммунной системы включает раздельное, одновременное или последовательное введение субъекту молочного жира и одного или нескольких противоопухолевых средств, где предпочтительно одно или несколько противоопухолевых средств выбраны из противоопухолевых пищевых факторов, химиотерапевтических средств, иммунотерапевтических средств, гематопоэтических средств, противокахектических средств или противомукозитных средств, где одно или несколько лекарственных средств более предпочтительно представляют собой лактоферрин.
В одном из вариантов осуществления введение повышает продукцию цитокинов Th1 и Th2 в опухоли субъекта. В одном из вариантов осуществления введение повышает продукцию цитокинов Th1 и Th2 в кишечнике субъекта. В одном из вариантов осуществления введение повышает уровень цитокинов Th1 и Th2 в системе кровообращения субъекта. В одном из вариантов осуществления введение повышает у субъекта противоопухолевый иммунный ответ.
Другой аспект изобретения относится к способу индукции апоптоза у субъекта, где способ включает введение эффективного количества молочного жира или аналога молочного жира нуждающемуся в этом субъекту. В одном из вариантов осуществления способ стимуляции апоптоза у нуждающегося в этом субъекта включает раздельное, одновременное или последовательное введение субъекту молочного жира и по меньшей мере одного противоопухолевого средства, где по меньшей мере одно противоопухолевое средство предпочтительно выбрано из противоопухолевых пищевых факторов, химиотерапевтических средств, иммунотерапевтических средств, гематопоэтических средств, противокахектических средств или противомукозитных средств, где более предпочтительно по меньшей мере одно дополнительное лекарственное средство представляет собой лактоферрин. В одном из вариантов осуществления апоптоз представляет собой апоптоз клеток опухоли.
Другой аспект изобретения относится к способу ингибирования ангиогенеза у субъекта, где способ включает введение эффективного количества молочного жира или аналога молочного жира нуждающемуся в этом субъекту. В одном из вариантов осуществления способ ингибирования ангиогенеза у нуждающегося в этом субъекта включает раздельное, одновременное или последовательное введение субъекту молочного жира и по меньшей мере одного противоопухолевого средства, где предпочтительно по меньшей мере одно противоопухолевое средство выбрано из противоопухолевых пищевых факторов, химиотерапевтических средств, иммунотерапевтических средств, гематопоэтических средств, противокахектических средств или противомукозитных средств, где более предпочтительно по меньшей мере одно дополнительное лекарственное средство представляет собой лактоферрин. В одном из вариантов осуществления ангиогенез представляет собой ангиогенез опухоли.
Другой аспект изобретения относится к способу лечения или предупреждения анемии, вызываемой низкими уровнями гемоглобина или эритроцитов, кахексии, мукозита или лейкопении или поддержания или улучшения одного или нескольких из количеств лейкоцитов, эритроцитов и миелоидных клеток у субъекта, где способ включает введение эффективного количества молочного жира или аналога молочного жира нуждающемуся в этом субъекту.
Другой аспект изобретения относится к способу поддержания или увеличения у субъекта одного или нескольких из количества лейкоцитов, количества эритроцитов или количества миелоидных клеток, где способ включает введение субъекту молочного жира или аналога молочного жира предпочтительно с введением субъекту раздельно, одновременно или последовательно по меньшей мере одного противоопухолевого средства, где предпочтительно по меньшей мере одно противоопухолевое средство выбрано из противоопухолевых пищевых факторов, химиотерапевтических средств, иммунотерапевтических средств, гематопоэтических средств, противокахектических средств или противомукозитных средств, где более предпочтительно по меньшей мере одно дополнительное лекарственное средство представляет собой лактоферрин.
Другой аспект изобретения относится к способу лечения или предупреждения у субъекта анемии, где способ включает введение субъекту молочного жира или аналога молочного жира предпочтительно с введением субъекту раздельно, одновременно или последовательно по меньшей мере одного противоопухолевого средства, где предпочтительно по меньшей мере одно противоопухолевое средство выбрано из противоопухолевых пищевых факторов, химиотерапевтических средств, иммунотерапевтических средств, гематопоэтических средств, противокахектических средств или противомукозитных средств, где более предпочтительно по меньшей мере, одно дополнительное лекарственное средство представляет собой лактоферрин.
Другой аспект изобретения относится к способу лечения или предупреждения кахексии у субъекта, где способ включает введение субъекту молочного жира или аналога молочного жира предпочтительно с введением субъекту раздельно, одновременно или последовательно по меньшей мере одного противоопухолевого средства, где предпочтительно по меньшей мере одно противоопухолевое средство выбрано из противоопухолевых пищевых факторов, химиотерапевтических средств, иммунотерапевтических средств, гематопоэтических средств, противокахектических средств или противомукозитных средств, где более предпочтительно по меньшей мере одно дополнительное лекарственное средство представляет собой лактоферрин.
Другой аспект изобретения относится к способу лечения или предупреждения у субъекта мукозита, где способ включает введение субъекту молочного жира или аналога молочного жира предпочтительно с введением субъекту раздельно, одновременно или последовательно по меньшей мере одного противоопухолевого средства, где предпочтительно по меньшей мере одно противоопухолевое средство выбрано из противоопухолевых пищевых факторов, химиотерапевтических средств, иммунотерапевтических средств, гематопоэтических средств, противокахектических средств или противомукозитных средств, где более предпочтительно по меньшей мере одно дополнительное лекарственное средство представляет собой лактоферрин.
Другой аспект изобретения относится к способу ингибирования образования опухоли, ингибирования роста опухоли, ингибирования метастазирования опухоли или лечению или предупреждению злокачественной опухоли у субъекта, где способ включает введение субъекту фракции молочного жира, такой как фосфолипидная фракция, фракция твердого молочного жира, фракция мягкого молочного жира, сфинголипидная фракция, фракция оболочки глобул молочного жира, фосфолипидная фракция, или комплексная липидная фракция, или комбинация любых двух или более из них, необязательно, по меньшей мере с одним дополнительным лекарственным средством, где предпочтительно по меньшей мере одно дополнительное лекарственное средство выбрано из противоопухолевых пищевых факторов, химиотерапевтических средств, иммунотерапевтических средств, гематопоэтических средств, противокахектических средств или противомукозитных средств, где более предпочтительно по меньшей мере одно дополнительное лекарственное средство представляет собой лактоферрин (Lf).
Другой аспект изобретения относится к способу увеличения отвечаемости субъекта на лечение злокачественной опухоли, где способ включает введение субъекту молочного жира или аналога молочного жира предпочтительно с введением субъекту раздельно, одновременно или последовательно по меньшей мере одного противоопухолевого средства, где по меньшей мере одно противоопухолевое средство предпочтительно выбрано из противоопухолевых пищевых факторов, химиотерапевтических средств, иммунотерапевтических средств, гематопоэтических средств, противокахектических средств или противомукозитных средств, где более предпочтительно по меньшей мере одно дополнительное лекарственное средство представляет собой лактоферрин.
Другой аспект изобретения относится к способу увеличения чувствительности опухоли субъекта к лечению злокачественной опухоли, где способ включает введение субъекту молочного жира или аналога молочного жира предпочтительно с введением субъекту раздельно, одновременно или последовательно по меньшей мере одного противоопухолевого средства, где предпочтительно по меньшей мере одно противоопухолевое средство выбрано из противоопухолевых пищевых факторов, химиотерапевтических средств, иммунотерапевтических средств, гематопоэтических средств, противокахектических средств или противомукозитных средств, где более предпочтительно по меньшей мере одно дополнительное лекарственное средство представляет собой лактоферрин.
Другой аспект изобретения относится к способу ускорения восстановления субъекта, проходившего лечение злокачественной опухоли, где способ включает введение субъекту молочного жира или аналога молочного жира предпочтительно с введением субъекту раздельно, одновременно или последовательно по меньшей мере одного противоопухолевого средства, где предпочтительно по меньшей мере одно противоопухолевое средство выбрано из противоопухолевых пищевых факторов, иммунотерапевтических средств, гематопоэтических средств, противокахектических средств или противомукозитных средств, где более предпочтительно по меньшей мере одно дополнительное лекарственное средство представляет собой лактоферрин.
Другой аспект изобретения относится к применению молочного жира в производстве композиции для цели, как описано в настоящем документе, где предпочтительно композиция включает по меньшей мере одно дополнительное лекарственное средство или введена раздельно, одновременно или последовательно по меньшей мере с одним дополнительным лекарственным средством, где предпочтительно по меньшей мере одно дополнительное лекарственное средство является противоопухолевым средством, где противоопухолевое средство предпочтительно выбрано из противоопухолевых пищевых факторов, химиотерапевтических средств, иммунотерапевтических средств, гематопоэтических средств, противокахектических средств или противомукозитных средств, где более предпочтительно по меньшей мере одно дополнительное лекарственное средство представляет собой лактоферрин.
Другой аспект изобретения относится к применению молочного жира, необязательно по меньшей мере с одним дополнительным лекарственным средством, в производстве композиции для цели, как описано в настоящем документе.
Другой аспект изобретения относится к применению молочного жира и по меньшей мере одного дополнительного лекарственного средства в производстве композиции для цели, как описано в настоящем документе, где композицию составляют так, чтобы обеспечить раздельное, одновременное или последовательное введение молочного жира и по меньшей мере одного дополнительного лекарственного средства.
Другой аспект изобретения относится к применению молочного жира и по меньшей мере одного дополнительного лекарственного средства в производстве композиции для цели, как описано в настоящем документе, где молочный жир вводят раздельно, одновременно или последовательно с дополнительным лекарственным средством.
Другой аспект изобретения относится к применению молочного жира и по меньшей мере одного дополнительного лекарственного средства в производстве композиции для цели, как описано в настоящем документе, где молочный жир составляют для раздельного, одновременного или последовательного введения с дополнительным лекарственным средством.
Другой аспект изобретения относится к композиции, которая включает, преимущественно содержит или состоит из молочного жира и одного или нескольких, двух или более или трех или более дополнительных лекарственных средств.
Другой аспект изобретения относится к продукту, который включает, преимущественно содержит или состоит из молочного жира и одного или нескольких, двух или более или трех или более дополнительных лекарственных средств, в виде комбинированного препарата для одновременного, раздельного или последовательного применения для цели, как описано в настоящем документе.
Следующие варианты осуществления могут относиться к любым указанным выше аспектам.
В предпочтительных вариантах осуществления по меньшей мере одно лекарственное средство является противоопухолевым средством. В предпочтительных вариантах осуществления противоопухолевое средство представляет собой лактоферрин.
В одном из вариантов осуществления лактоферрин выбран из группы, включающей полипептид лактоферрина, функциональный вариант лактоферрина, функциональный фрагмент лактоферрина, содержащий ион металла лактоферрин, функциональный вариант содержащего ион металла лактоферрина и функциональный фрагмент содержащего ион металла лактоферрина или смесь любых двух или более из них. В одном из вариантов осуществления лактоферрин представляет собой аполактоферрин. В другом варианте осуществления лактоферрин представляет собой природный насыщенный железом лактоферрин. В другом варианте осуществления лактоферрин представляет собой по существу полностью насыщенный железом лактоферрин.
Цели, описанные в настоящем документе, включают цель, выбранную из ингибирования образования опухоли, ингибирования роста опухоли, ингибирования метастазирования опухоли или лечения или предупреждения злокачественной опухоли у нуждающегося в этом субъекта, стимулирования иммунной системы у нуждающегося в этом субъекта, повышения продукции цитокинов Th1 и Th2 в опухоли у нуждающегося в этом субъекта, повышения продукции цитокинов Th1 и Th2 в кишечнике у нуждающегося в этом субъекта, повышения уровня продукции цитокинов Th1 и Th2 в системе кровообращения у нуждающегося в этом субъекта, повышения противоопухолевого иммунного ответа у нуждающегося в этом субъекта, стимуляции апоптоза у нуждающегося в этом субъекта, стимуляции апоптоза клеток опухоли у нуждающегося в этом субъекта, ингибирования ангиогенеза у нуждающегося в этом субъекта, ингибирования ангиогенеза в опухоли у нуждающегося в этом субъекта, поддержания или улучшения одного или нескольких из количеств лейкоцитов, эритроцитов или миелоидных клеток у нуждающегося в этом субъекта, лечения или предупреждения анемии у нуждающегося в этом субъекта, лечения или предупреждения кахексии у нуждающегося в этом субъекта, лечения или предупреждения мукозита у нуждающегося в этом субъекта, повышения отвечаемости субъекта на лечение злокачественной опухоли, повышения чувствительности опухоли субъекта к лечению злокачественной опухоли и ускорения восстановления субъекта, проходившего лечение злокачественной опухоли.
В одном из вариантов осуществления по меньшей мере одно лекарственное средство или противоопухолевое средство выбрано из группы, содержащей противоопухолевые пищевые факторы, химиотерапевтические средства, иммунотерапевтические средства, гематопоэтические средства, противокахектические средства или противомукозитные средства.
В одном из вариантов осуществления противоопухолевый пищевой фактор выбран из витамина D и аналогов витамина D (включая в качестве неограничивающих примеров, т.е. которые рассмотрены ниже), белка сои, одного или нескольких компонентов соевых бобов (включая те, которые рассматриваются ниже), полифенолов, ликопина, пшеничных отрубей, флаваноидов, инозитола, ресвератрола, прополиса, экстракта грибов, антоцианов, миндаля, женьшеня, гидролизата казеина и их комбинаций.
В одном из вариантов осуществления противоопухолевой пищевой фактор выбран из группы, включающей противоопухолевые пищевые продукты и противоопухолевые пищевые компоненты. Предпочтительно вводят один или несколько, два или более или три или более противоопухолевых пищевых факторов.
В одном из вариантов осуществления противоопухолевые пищевые продукты могут представлять собой функциональные пищевые продукты или их производные, которые обладают противораковыми свойствами, включая те, которые описаны в настоящем документе.
В одном из вариантов осуществления противоопухолевый пищевой компонент можно выбрать из тех, которые описаны в настоящем документе.
В одном из вариантов осуществления способ по изобретению включает введение композиции, преимущественно содержащей или состоящей из молочного жира и по меньшей мере одного дополнительного лекарственного средства, где по меньшей мере одно дополнительное лекарственное средство предпочтительно выбрано из лактоферрина, функционального варианта лактоферрина, функционального фрагмента лактоферрина, содержащего ион металла лактоферрина, функционального варианта лактоферрина, содержащего ион металла, функционального фрагмента лактоферрина, содержащего ион металла или их смеси. Предпочтительно, композиция преимущественно содержит или состоит из одного или нескольких, двух или более или трех или более противоопухолевых пищевых факторов.
В одном из вариантов осуществления применения изобретения композиция получена для ингибирования образования опухоли у субъекта, ингибирования роста опухоли у субъекта, ингибирования метастазирования опухоли у субъекта, лечения или предупреждения злокачественной опухоли у субъекта, стимулирования иммунной системы у субъекта, повышения продукции цитокинов Th1 и Th2 в опухоли субъекта, повышения продукции цитокинов Th1 и Th2 в кишечнике субъекта, повышения уровня продукции цитокинов Th1 и Th2 в системе кровообращения субъекта, повышения противоопухолевого иммунного ответа у субъекта, стимуляции апоптоза у субъекта, стимуляции апоптоза опухолевых клеток у субъекта, ингибирования ангиогенеза у субъекта, ингибирования ангиогенеза в опухоли у субъекта, поддержания или улучшения одного или нескольких из количеств лейкоцитов, эритроцитов или миелоидных клеток у субъекта, лечения или предупреждения анемии у нуждающегося в этом субъекта, лечения или предупреждения кахексии у нуждающегося в этом субъекта, лечения или предупреждения мукозита у нуждающегося в этом субъекта, лечения или предупреждения лейкопении у нуждающегося в этом субъекта, усиления ответной реакции субъекта на лечение злокачественной опухоли, повышение отвечаемости субъекта на лечение злокачественной опухоли или ускорение восстановления субъекта, проходящего лечение злокачественной опухоли.
В одном из вариантов осуществления введение представляет собой пероральное, местное или парентеральное введение.
В одном из вариантов осуществления субъект страдает от злокачественной опухоли или восприимчив к злокачественной опухоли; прошел лечение, но у него произошел рецидив или он восприимчив к рецидиву; имеет опухоль, устойчивую к лечению химиотерапевтическим, радиотерапевтическим, антиангиогенным или иммунотерапевтическим средством; или он ранее перенес хирургическое вмешательство, хирургическое вмешательство с неблагоприятным исходом или проходил безуспешное лечение химиотерапевтическим, радиотерапевтическим, анти-ангиогенным или иммунотерапевтическим средством.
В одном из вариантов осуществления молочный жир выбран из липидов молока, фракций липидов молока, гидролизатов липидов молока и гидролизатов фракции липидов молока. Предпочтительные молочные жиры представляют собой жиры молока, особенно жиры коровьего молока.
В других вариантах осуществления молочный жир представляет собой жир молока любого млекопитающего, включая в качестве неограничивающих примеров жир молока овцы, козы, свиньи, мыши, азиатского буйвола, верблюда, яка, лошади, осла, ламы или человека.
В одном из вариантов осуществления лактоферрин представляет собой лактоферрин любого млекопитающего, включая в качестве неограничивающих примеров лактоферрин овцы, козы, свиньи, мыши, азиатского буйвола, верблюда, яка, лошади, осла, ламы или человека. Предпочтительно лактоферрин представляет собой бычий лактоферрин.
В одном из вариантов осуществления лактоферрин представляет собой аполактоферрин. В одном из вариантов осуществления лактоферрин, функциональный вариант лактоферрина или функциональный фрагмент лактоферрина не содержит ионов металла. В одном из вариантов осуществления лактоферрин или функциональный вариант или его функциональный фрагмент насыщен ионом металла по меньшей мере приблизительно на 5, 10 или 20% в стехиометрическом соотношении.
В одном из вариантов осуществления ион металла представляет собой ион металла, выбранный из группы, включающей алюминий, висмут, медь, хром, кобальт, золото, железо, марганец, осмий, платину, рутений и ионы цинка или любую комбинацию любых двух или более из них или других ионов, которые будут специфично взаимодействовать с центром связывания ионов металла в лактоферрине. Предпочтительно ион металла представляет собой ион железа.
В одном из вариантов осуществления лактоферрин, функциональный вариант лактоферрина или функциональный фрагмент лактоферрина участвуют в неспецифическом связывании ионов. Ионы, которые могут неспецифически связываться с лактоферрином, функциональным вариантом лактоферрина или функциональным фрагментом лактоферрина, предпочтительно выбраны из алюминия, кальция, висмута, меди, хрома, кобальта, золота, железа, марганца, осмия, платины, рутения, селена и ионов цинка или любых комбинаций любых двух или более из них. Ион может представлять собой любой ион или смесь ионов, которые неспецифически связываются с лактоферрином, функциональным вариантом лактоферрина или функциональным фрагментом лактоферрина, предпочтительно ионом кальция и селена.
В одном из вариантов осуществления содержащий ион металла лактоферрин или содержащий ион металла функциональный вариант или его функциональный фрагмент насыщен ионом металла по меньшей мере, приблизительно на 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 99,5 или 100% в стехиометрическом соотношении.
В одном из вариантов осуществления содержащий ион металла лактоферрин или содержащий ион металла функциональный вариант или его функциональный фрагмент насыщен ионом металла по меньшей мере приблизительно на 105, 110, 115, 120, 125, 130, 135, 140, 145, 150, 155, 160, 165, 170, 175, 180, 185, 190, 195 или 200% в стехиометрическом соотношении.
В одном из вариантов осуществления композиция, пригодная в настоящем документе, включает приблизительно от 2 грамм до приблизительно 210 грамм молочного жира или аналога молочного жира и приблизительно от 0,1 грамма до приблизительно 210 грамм одного или нескольких противоопухолевых средств. В одном из вариантов осуществления композиция включает приблизительно 2, 4, 6, 8, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 105, 110, 115, 120, 125, 130, 135, 140, 145, 150, 155, 160, 165, 170, 175, 180, 185, 190, 195, 200, 205 или 210 грамм молочного жира или аналога молочного жира и пригодные диапазоны можно выбрать между любыми этими значениями. В одном из вариантов осуществления композиция включает приблизительно 2, 4, 6, 8, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 105, 110, 115, 120, 125, 130, 135, 140, 145, 150, 155, 160, 165, 170, 175, 180, 185, 190, 195, 200, 205 или 210 грамм одного или нескольких противоопухолевых средств, и подходящие диапазоны можно выбрать между любыми этими значениями. Предпочтительно одно или несколько противоопухолевых средств выбраны из группы, включающей лактоферрин, аполактоферрин, полипептид лактоферрина, функциональный вариант лактоферрина, функциональный фрагмент лактоферрина, содержащий ион металла лактоферрин, природный насыщенный железом лактоферрин, по существу полностью насыщенный железом лактоферрин, функциональный вариант содержащего ион металла лактоферрина, функциональный фрагмент содержащего ион металла лактоферрина или их смесь. В различных вариантах осуществления композиция включает
(a) от приблизительно 2 граммов до приблизительно 210 граммов молочного жира или аналога молочного жира и от приблизительно 0,7 грамма до приблизительно 70 граммов одного или нескольких противоопухолевых средств;
(b) от приблизительно 35 граммов до приблизительно 210 граммов молочного жира или аналога молочного жира и от приблизительно 0,35 граммов до приблизительно 210 граммов одного или нескольких противоопухолевых средств;
(c) от приблизительно 10 граммов до приблизительно 200 граммов молочного жира или аналога молочного жира и от приблизительно 2,5 грамма до приблизительно 70 граммов одного или нескольких противоопухолевых средств;
(d) от приблизительно 10 граммов до приблизительно 200 граммов молочного жира или аналога молочного жира и от приблизительно 0,25 грамма до приблизительно 5 граммов одного или нескольких противоопухолевых средств;
(e) от приблизительно 15 граммов до приблизительно 30 граммов молочного жира или аналога молочного жира и от приблизительно 1 грамма до приблизительно 6 граммов одного или нескольких противоопухолевых средств; или
(f) от приблизительно 3 граммов до приблизительно 8 граммов молочного жира или аналога молочного жира и от приблизительно 0,1 грамма до приблизительно 1 грамма одного или нескольких противоопухолевых средств.
В одном из вариантов осуществления способ включает введение совместно с молочным жиром и смеси содержащего ион металла лактоферрина и по меньшей мере одного содержащего ион металла функционального варианта или его функционального фрагмента.
В одном из вариантов осуществления молочный жир и дополнительное лекарственное средство, предпочтительно лактоферрин, обеспечивают синергичное лечебное действие, которое является большим, чем индивидуальное действие каждого, или большим, чем сумма действий каждого из них индивидуально. Например, существует большее действие на ингибирование образования или роста опухоли, регрессию опухоли, цитолитические эффекты, иммунную активацию, образование цитокинов Th1 и Th2, поддержание или улучшение количеств лейкоцитов, эритроцитов или миелоидных клеток, лечение или предупреждение анемии, кахексии, мукозита или ответную реакцию субъекта или опухоли на способ лечения. В одном из вариантов осуществления лактоферрин и противоопухолевые пищевые факторы, в соответствующих случаях, обеспечивают снижение или увеличения дозы или длительности введения при проведении одновременной или последовательной терапии злокачественной опухоли.
В одном из вариантов осуществления способ по изобретению дополнительно включает раздельное, одновременное или последовательное проведение по меньшей мере одного способа лечения злокачественной опухоли.
В одном из вариантов осуществления лечение злокачественной опухоли представляет собой противоопухолевое средство или противоопухолевую терапию.
В одном из вариантов осуществления молочный жир, необязательно, по меньшей мере с одним дополнительным лекарственным средством и по меньшей мере с одним противоопухолевым средством или противоопухолевой терапией вводят раздельно, одновременно или последовательно.
В одном из вариантов осуществления противоопухолевая терапия в качестве неограничивающих примеров выбрана из таких способов лечения, как хирургическое вмешательство, химиотерапевтические способы лечения, способы лучевой терапии, способы гормональной терапии, способы биологического лечения/иммунотерапии, способы клеточной терапии, способы антиангиогенной терапии, способы цитотоксической терапии, вакцины, вакцины на основе нуклеиновых кислот (например, нуклеиновых кислот, экспрессирующих антиген злокачественной опухоли, такие как ДНК вакцины, включая вакцины p185), способы лечения на основе вирусов (например, аденоассоциированного вируса, лентивируса), способы генотерапии, способы терапии на основе низкомолекулярного ингибитора, способы терапии на основе нуклеотидов (например, РНКи, антисмысловые нуклеотиды, рибозимы и т.д.), способы лечения на основе антител, кислородо- и озонотерапия, способы лечения эмболизацией и/или химиоэмболизацией. В одном из вариантов осуществления противоопухолевое средство включает один или несколько ингибиторов ангиогенеза.
В одном из вариантов осуществления противоопухолевое средство представляет собой химиотерапевтическое средство или иммунотерапевтическое средство. В одном из вариантов осуществления по меньшей мере одно противоопухолевое средство представляет собой химиотерапевтическое средство. Предпочтительно химиотерапевтическое средство выбрано из дезинтеграторов тубулина, интеркаляторов ДНК и их смеси. В одном из вариантов осуществления дезинтеграторы тубулина, включают в качестве неограничивающих примеров дезинтеграторы тубулина, перечисленные в опубликованной международной патентной заявке WO 2006/054908, которая включена в настоящей документ в качестве ссылки. В одном из вариантов осуществления интеркаляторы ДНК включают в качестве неограничивающих примеров интеркаляторы ДНК, перечисленные в опубликованной международной патентной заявке WO 2006/054908, которая включена в настоящей документ в качестве ссылки. В одном из вариантов осуществления химиотерапевтическое средство представляет собой паклитаксел, доксорубицин, эпирубицин, фторурацил, циклофосфамид или метотрексат.
В одном из вариантов осуществления противоопухолевое средство представляет собой иммунотерапевтическое средство. Предпочтительно иммунотерапевтическое средство представляет собой экспрессирующую плазмиду, кодирующую костимулятор Т-клеток B7-1, костимулятор T-клеток или функционально родственную молекулу, например растворимую химерную молекулу B7-Ig. В одном из вариантов осуществления противоопухолевое средство включает терапию иммунными клетками. Предпочтительно лечение представляет собой терапию дендритными клетками.
В одном из вариантов осуществления химиотерапевтическое средство представляет собой паклитаксел, доксорубицин, эпирубицин, фторурацил, циклофосфамид или метотрексат.
В одном из вариантов осуществления противоопухолевое средство представляет собой иммунотерапевтическое средство. Предпочтительно иммунотерапевтическое средство представляет собой экспрессионную плазмиду, кодирующую костимулятор Т-клеток B7-1, костимулятор Т-клеток или функционально родственную молекулу, например растворимую химерную молекулу B7-Ig.
В одном из вариантов осуществления противоопухолевое средство включает терапию иммунными клетками. Предпочтительно лечение представляет собой терапию дендритными клетками.
В одном из вариантов осуществления противоопухолевое средство включает один или несколько ингибиторов ангиогенеза.
В одном из вариантов осуществления по меньшей мере одно противоопухолевое средство вводят перорально или парентерально, предпочтительно посредством внутривенного, интраперитонеального введения или введения внутрь опухоли.
В одном из вариантов осуществления молочный жир, необязательно, по меньшей мере с одним дополнительным лекарственным средством вводят ежедневно в течение по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 недель перед введением противоопухолевого средства или проведением противоопухолевого лечения.
В одном из вариантов осуществления молочный жир, необязательно, по меньшей мере с одним дополнительным лекарственным средством вводят в течение по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или 21 суток, или в течение по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7 или 8 недель, или в течение по меньшей мере приблизительно 1, 2, 3, 4, 5 или 6 месяцев перед введением противоопухолевого средства или проведением противоопухолевого лечения.
В одном из вариантов осуществления молочный жир, необязательно, по меньшей мере с одним дополнительным лекарственным средством вводят в течение по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или 21 суток, или в течение по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7 или 8 недель, или в течение по меньшей мере приблизительно 1, 2, 3, 4, 5 или 6 месяцев после введения противоопухолевого средства или началом противоопухолевой терапии.
В одном из вариантов осуществления молочный жир, необязательно, по меньшей мере с одним дополнительным лекарственным средством вводят по меньшей мере однократно, включая непрерывное пероральное введение в течение суток или парентеральное введение посредством капельницы или комбинацией путей введения с лечением злокачественной опухоли или без него.
В одном из вариантов осуществления опухоль или злокачественная опухоль представляет собой солидную опухоль, лейкоз, лимфому, множественную миелому, гематопоэтические опухоли лимфоцитарного происхождения, гематопоэтические опухоли миелоидного происхождения, карциному толстого кишечника, рак молочной железы, меланому, злокачественную опухоль кожи или рак легких.
В одном из вариантов осуществления опухоль или злокачественная опухоль представляет собой лейкоз, в качестве неограничивающих примеров такой, как острый лейкоз, острый лимфоцитарный лейкоз, острый гранулоцитарный лейкоз, острый миелоцитарный лейкоз, такой как миелобластный, промиелоцитарный, миеломоноцитарный, моноцитарный, эритролейкоз и миелодиспластический синдром, хронический лейкоз, такой как, но не ограничен им, хронический миелоцитарный лейкоз, хронический гранулоцитарный лейкоз, хронический лимфоцитарный лейкоз и волосатоклеточный лейкоз.
В одном из вариантов осуществления опухоль или злокачественная опухоль представляет собой лимфому, в качестве неограничивающих примеров такую, как болезнь Ходжкина и неходжкинскую лимфому.
В одном из вариантов осуществления опухоль или злокачественная опухоль включает гематопоэтическую опухоль миелоидного происхождения, такую как, но не ограничена ею, острый и хронический миелогенный лейкоз, вялотекущая множественная миелома, несекреторная миелома и остеосклеротическая миелома.
В одном из вариантов осуществления опухоль или злокачественная опухоль включает гематопоэтическую опухоль лимфоцитарного происхождения, включая лейкоз, острый и хронический лимфоцитарный лейкоз, острый и хронический лимфобластный лейкоз, B-клеточную лимфому, T-клеточную лимфому, лимфому Беркита.
В одном из вариантов осуществления опухоль или злокачественная опухоль включает гематопоэтическую опухоль B-лимфоидной линии дифференцировки.
В одном из вариантов осуществления опухоль или злокачественная опухоль включает гематопоэтическую опухоль T-лимфоидной линии дифференцировки.
В одном из вариантов осуществления опухоль представляет собой массивную опухоль. В одном из вариантов осуществления опухоль или злокачественная опухоль включает
(a) опухоль с размером по меньшей мере приблизительно 0,3, 0,4 или 0,5 см в диаметре, или
(b) опухоль, которая является невосприимчивой к лечению одним, по меньшей мере одним иммунотерапевтическим, антиангиогенным или химиотерапевтическим средством.
В одном из вариантов осуществления поддерживают или улучшают одно или несколько из количества лейкоцитов, эритроцитов или миелоидных клеток у субъекта.
В одном из вариантов осуществления опухоль уменьшают в размере или в значительной степени ликвидируют.
В одном из вариантов осуществления, когда вводимый лактоферрин вводят в лекарственной форме, содержащей усвояемый белок, предпочтительно казеин или другой белок, такой как другие пригодные к употреблению в пищу белки.
В одном из вариантов осуществления композиция представляет собой пищевой продукт, напиток, пищевую добавку, жидкую пищевую добавку, диетическую добавку, питательный продукт, лечебные пищевые продукты, нутрицевтические, лекарственные или фармацевтические. Предпочтительно композицию составляют для перорального или местного введения. Предпочтительно композицию составляют для перорального или парентерального введения. В одном из вариантов осуществления композиция включает молочный жир и фракцию молочного белка.
В одном из вариантов осуществления композиция включает молочную композицию, выбранную из свежего или цельного рекомбинированного молока, рекомбинированного или свежего обезжиренного молока, восстановленного цельного или обезжиренного сухого молока, концентрата обезжиренного молока, сухого обезжиренного молока, ультраконцентрата обезжиренного молока, концентрированного молока, пахты, ультраконцентрата молока после ультрафильтрации, молочного белкового концентрата (MPC), изолята молочного белка (MPI), молочного белкового концентрата, обедненного кальцием (MPC), молока с пониженным содержанием жира, молочного белкового концентрата с пониженным содержанием жира (MPC), молозива, фракции молозива, белкового концентрата молозива (CPC), сыворотки молозива, иммуноглобулиновой фракции из молозива, сыворотки, изолята белков сыворотки (WPI), белкового концентрата сыворотки (WPC), сладкой сыворотки, сыворотки, полученной с применением молочной кислоты, сыворотки, полученной с применением неорганических кислот, или восстановленной сухой молочной сыворотки.
В одном из вариантов осуществления молочный жир составляют для совместного введения по меньшей мере с одним дополнительным лекарственным средством. В одном из вариантов осуществления молочный жир составляют для последовательного введения по меньшей мере с одним дополнительным фактором.
В одном из вариантов осуществления, где композиция по изобретению или композиция, примененная в способе по изобретению, включает лактоферрин, композиция обеспечивает популяцию полипептидов лактоферрина или функциональных вариантов или его фрагментов, где по меньшей мере приблизительно 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 99,5 или 100% доступных центров связывания ионов металлов в популяции связаны с ионом металла, предпочтительно с ионом железа.
В одном из вариантов осуществления, где композиция по изобретению или композиция, примененная в способе по изобретению, включает лактоферрин, композиция обеспечивает популяцию полипептидов лактоферрина или функциональных вариантов или его фрагментов, где приблизительно 100% доступных в популяции центров связывания ионов металлов связаны с ионом металла, предпочтительно с ионом железа, и дополнительно ионы металлов связаны с молекулами лактоферрина в неспецифических центрах связывания, таким образом, лактоферрин по меньшей мере приблизительно на 105, 110, 115, 120, 125, 130, 135, 140, 145, 150, 155, 160, 165, 170, 175, 180, 185, 190, 195 или 200% насыщен ионами металла в стехиометрическом соотношении.
В одном из вариантов осуществления молочный жир или аналог молочного жира включает
(a) от приблизительно 23% (масс./масс.) и приблизительно 32% (масс./масс.) пальмитиновой кислоты;
(b) от приблизительно 15% (масс./масс.) и приблизительно 22% (масс./масс.) олеиновой кислоты;
(c) от приблизительно 10% (масс./масс.) и приблизительно 15% (масс./масс.) стеариновой кислоты;
(d) от приблизительно 9% (масс./масс.) и приблизительно 12% (масс./масс.) миристиновой кислоты;
(e) от приблизительно 3% (масс./масс.) и приблизительно 5% (масс./масс.) масляной кислоты;
(f) любые две из a), b), c), d) или e) выше;
(g) любые три из a), b), c), d) или e) выше;
(h) любые четыре из a), b), c), d) или e) выше; или
(i) каждую из a), b), c), d) и e) выше.
Следует понимать, что указание на ряд чисел, описанных в настоящем документе (например, от 1 до 10), также включает указание на все рациональные числа внутри этого ряда (например, 1, 1,1, 2, 3, 3,9, 4, 5, 6, 6,5, 7, 8, 9 и 10), а также любой диапазон рациональных чисел в пределах этого диапазона (например, от 2 до 8, от 1,5 до 5,5 и от 3,1 до 4,7) и таким образом явно описаны все поддиапазоны всех диапазонов, явно описанных в настоящем документе. Они представляют собой только примеры того, что конкретно указано, и все перечисленные возможные комбинации числовых значений между наименьшим значением и наибольшим значением следует рассматривать как явно указанные в этой заявке сходным образом.
В этом описании, где сделано указание на описания патентов, другие внешние документы или другие источники информации, как правило, это сделано в целях предоставления контекста для обсуждения признаков изобретения. Если специально не указано иначе, указание на такие внешние документы не должны трактоваться как признание, что такие документы или другие источники информации, в любой юрисдикции, являются известным уровнем техники или образуют часть общего известного уровня техники в данной области.
Также можно в широком смысле сказать, что изобретение состоит из частей, элементов и характеристик, указанных или обозначенных в описании заявки, индивидуально или в совокупности, в любой или всех комбинациях из двух или более указанных частей, элементов или характеристик, и где в настоящем документе указаны конкретные числа, которые имеют известные эквиваленты в данной области, к которой относится изобретение, такие известные эквиваленты считают включенными в настоящий документ, как если бы их указали индивидуально.
Краткое описание чертежей
На фиг.1 представлен график, на котором показано, что молочный жир ингибирует рост лимфомы и ингибирует опухолеобразование. Мышей содержали на контрольной диете AIN93G или на той же диете, в которой долю жира заменяли как на молочный жир, так и на обогащенный молочный жир. После двух недель диеты в бока мышей вводили клетки линии EL-4 в количестве 2×105. Размер опухоли, измеренный посредством нахождения двух перпендикулярных диаметров (в сантиметрах), контролировали до 91 суток или до достижения опухолью размера 1 см в диаметре. Каждая точка означает средний размер опухоли с доверительным интервалом 95%, указанным как для 6 мышей, так и для обозначенного числа мышей.
На фиг.2 представлен график, на котором показано, что молочный жир усиливает иммуногенную терапию с B7-1, направленную на ликвидацию опухоли. Мышей содержали на контрольной диете AIN93G или на той же диете, в которой долю жира заменяли как на молочный жир, так и на обогащенный молочный жир. После двух недель такой диеты в бока мышей вводили 2×105 клеток EL-4. Контролировали размер опухоли, измеренный посредством нахождения двух перпендикулярных диаметров (в сантиметрах). При достижении опухолями ~0,4 см в диаметре в опухоли вводили комплексы ДНК-липосома, содержащие 60 мкг экспрессирующей плазмиды B7-1. Момент введения плазмиды показан стрелкой. Размер опухоли, измеренный посредством нахождения двух перпендикулярных диаметров (в сантиметрах), контролировали до 91 суток или до достижения опухолью размера 1 см в диаметре. Каждая точка означает средний размер опухоли с доверительным интервалом 95%, указанным как для 6 мышей, так и для обозначенного числа мышей.
На фиг.3 представлены 4 графика, на которых показано, что молочный жир действует синергично с насыщенным железом лактоферрином (Lf+) в полном предупреждении опухолеобразования. (A) Эффекты на опухолеобразование. Мышей содержали на контрольной диете AIN93G или на той же диете, где доли жира и белка заменяли как на Lf+, молочный жир, так и на комбинацию Lf+ и молочного жира. Сутки 0 относится к суткам, когда мышей помещали на соответствующую диету. После двух недель диеты в бока мышей вводили 2×105 клеток EL-4. Размер опухоли, найденный посредством измерения двух перпендикулярных диаметров (в сантиметрах), контролировали до 56 суток. Каждая точка означает средний размер опухоли с доверительным интервалом 95%, указанным как для 6 мышей, так и для обозначенного числа мышей. (B) Эффекты на противоопухолевую цитолитическую активность. Спленоциты выделяли из мышей в (A) на 56 сутки и анализировали их цитолитическую активность против клеток мишеней EL-4. Процент цитотоксичности отложен против различных соотношений клеток эффектора и мишени (E:T соотношения). Каждая точка означает средний процент цитотоксичности, рассчитанный от 6 мышей или указанного числа мышей. Планки погрешностей указывают доверительный интервал 95%. (C) Эффекты на апоптоз опухолевых клеток. Срезы получали из опухолей в (A) на 56 сутки и окрашивали способом опосредованного концевой дезоксинуклеотидилтрансферазой концевого мечения разрывов дезоксиуридинтрифосфатом-дигоксигенином (TUNEL) и также посредством способа флуоресценции с аннексином V (annexin-V-fluos). Число апоптотических клеток определяли посредством способа TUNEL или флуоресценции с аннексином V (annexin-V-fluos), анализировали 10 случайно выбранных областей окрашенных опухолевых срезов, визуализированных через увеличение ×40. Апоптотический индекс (A/I) представляет собой число клеток в апоптозе (положительных в TUNEL или флуоресценции с аннексином) × (100/общее число клеток). Планки погрешностей указывают доверительный интервал 95%. (D) Эффекты на ангиогенез опухоли. Срезы получали от мышей в (A) на 56 сутки и окрашивали как mAb MEC13,3 против CD31, так и против CD105 для визуализации кровеносных сосудов или альтернативно, за одну минуту до сбора тканей в хвостовую вену вводили DiO7 для того, чтобы визуализировать поток крови. Окрашенные кровеносные сосуды считали у шести мышей в шести вслепую выбранных случайных областях.
На фиг.4 представлены шесть графиков, на которых показано, что сухая смесь альфа-липидов (Phospholac 600TM) и сфингомиелин ингибируют рост опухолей. Мышей содержали на контрольной диете AIN93G или на той же диете, где доли жира и белка заменяли как на Lf+ (B), Phospholac 600TM (C), сфингомиелин (D), так и на комбинацию Lf+ и Phospholac 600TM (E) или на комбинацию Lf+ и сфингомиелина (F). Размер опухоли, найденный посредством измерения двух перпендикулярных диаметров (в сантиметрах), отложен против времени для каждой мыши индивидуально. Шкала времени, отложенная на оси абсцисс, является нелинейной.
На фиг.5 представлен график, на котором показано, что молочный жир сдерживает рост опухолей первичного рака молочной железы. Мышей линии Balb/c содержали на диете с молочным жиром или соответствующей контрольной диете. Опухоли формировали двумя неделями позднее посредством подкожного введения 2×104 опухолевых клеток 4T1 в правый бок мышей. Паклитаксел вводили i.p., когда опухоли достигали размера 0,5 см в диаметре. Вели наблюдения за ростом опухоли у мышей и каждые трое суток измеряли размер опухоли. *Значимое различие (P<0,05) по сравнению с мышами, которых содержали на контрольной диете. #Значимое различие (P<0,05) по сравнению с мышами, которых содержали на контрольной диете и которым вводили паклитаксел.
На фиг.6 представлен график, на котором показано, что молочный жир сдерживает рост опухолей при раке молочной железы, которые метастазируют в легкие, и усиливает действие паклитаксела. Мышей на фиг.5 умертвили на 35 сутки и отделили легкие. Подсчитали число метастазов опухолей как на поверхности легких мышей, которых содержали на контрольной диете, у мышей на контрольной диете и с введением паклитаксела, на диете с молочным жиром, так и на диете с молочным жиром и с введением паклитаксела и выразили средним числом ±SEM. *Значимое различие (P<0,05) по сравнению с мышами, которых содержали на контрольной диете. #Значимое различие (P<0,05) по сравнению с мышами, которых содержали на контрольной диете и с введением паклитаксела.
На фиг.7 представлен график, на котором показано, что молочный жир сдерживает рост опухолей рака молочной железы, которые метастазируют в печень, и усиливает эффекты паклитаксела. Мышей, на фиг.5, умертвили на 35 сутки и отделили печень, сделали срезы печени и окрасили гематоксилин/эозином. Подсчитывали число опухолевых метастазов внутри печени мышей, которых содержали на контрольной диете, которых содержали на контрольной диете и с введением паклитаксела, так и на диете с молочным жиром или диете с молочный жиром и с введением паклитаксела и выразили средней величиной ±SEM. *Значимое различие (P<0,05) по сравнению с мышами, которых содержали на контрольной диете. #Значимое различие (P<0,05) по сравнению с мышами, которых содержали на контрольной диете и с введением паклитаксела.
На фиг.8 представлены два графика, на которых показано, что молочный жир ингибирует ангиогенез опухоли. Опухоли 4Т1 мышей на фиг.5 иссекали, делали срезы и окрашивали с mAb против CD31, чтобы идентифицировать сосудистые эндотелиальные клетки. В случайных областях, выбранных вслепую, подсчитывали кровеносные сосуды, окрашенные mAb против CD31 для определения средней плотности сосудов (A) или среднего расстояния до ближайшего кровеносного сосуда, меченого mAb к CD31, из точки расположения (B). Планки погрешностей представляют ±SEM. *Значимое различие (P<0,05) по сравнению с мышами, которых содержали на контрольной диете. #Значимое различие (P<0,05) по сравнению с мышами, которых содержали на контрольной диете и с введением паклитаксела.
На фиг.9 представлены два графика, на которых показано, что молочный жир защищает от повреждений кишечника, вызванных химиотерапией. Мышей, описанных на фиг.5, умерщвляли на 35 сутки и вырезали тощую кишку, делали срезы и окрашивали гематоксилин/эозином. (A) Средняя длина (±SEM) ворсинок тощей кишки. (B) Средняя активность(±SEM) γ-GGT. *Значимое различие (P<0,05) по сравнению с мышами, которых содержали на контрольной диете. #Значимое различие (P<0,05) по сравнению с мышами, которых содержали на контрольной диете и с введением паклитаксела.
Фиг.10 представляет собой графики, на которых показано, что молочный жир предотвращает апоптоз клеток кишечника, вызванный химиотерапией. Тощую кишку, как на фиг.9, окрашивали посредством способа TUNEL. Подсчитывали апоптотические тельца в 10 случайно выбранных криптах и выражали как число апоптотических телец на крипту (среднее ±SEM). *Значимое различие (P<0,05) по сравнению с мышами, которых содержали на контрольной диете. # Значимое различие (P<0,05) по сравнению с мышами, которых содержали на контрольной диете и с введением паклитаксела.
На фиг.11 представлено три графика, на которых показано, что молочный жир ингибирует потерю массы тела вследствие химиотерапии, как описано в примере 14. (A) Молочный жир в диете незначимо увеличивает массу тела у здоровых мышей. Мышей в течение 4 недель перед химиотерапией содержали на контрольной диете AIN93G или схожей диете, где долю жира замещали как 70%, 25%, так и 5% молочного жира. В конце 4 недельного периода регистрировали среднюю массу тела мышей (соответствующую фигурам, предоставленным вверху над чертой). (B, C) Молочный жир в диете предотвращал потерю массы тела вследствие химиотерапии и ускорял увеличение массы. После 4 недель питания, указанного выше, мышам, описанным в (A), вводили 300 мг/кг циклофосфамида. Регистрировали процент изменения массы тела 4 (B) и 12 (C) сутками позднее и сравнивали с начальной массой тела. ***P<0,001 и **P<0,01 в сравнении с контрольной диетой.
На фиг.12 представлен график, на котором показано, что молочный жир в большой дозе ингибирует потерю вследствие химиотерапии периферических WBC, как описано в примере 15. Количество периферических WBC регистрировали для мышей с фиг.11 в сутки введения циклофосфамида и 4, 8 и 12 сутками позднее.
На фиг.13 представлены два графика, на которых показано, что молочный жир ингибирует потерю клеточного содержимого селезенки вследствие химиотерапии и ускоряет восстановление клеточного содержимого селезенки, как описано в примере 15. (A) Молочный жир предотвращает потерю клеточного содержимого селезенки. Молочный жир не оказывает эффекта на клеточное содержимое селезенки в случае кормления мышей в течение 4 недель перед химиотерапией. Значимое ингибирование потери клеточного содержимого селезенки достигалось на 4 сутки после химиотерапии посредством всех диет с молочным жиром, на 8 сутки посредством диет с 70% и 25% молочного жира и на 12 сутки посредством диет с 70% молочного жира в сравнении с контрольной диетой. (B) Молочный жир стимулирует образование селезеночных колониеобразующих единиц. Значимой стимуляции образования селезеночных колониеобразующих единиц достигали на 8 сутки после химиотерапии посредством всех трех диет с молочным жиром в сравнении с контрольной диетой, хотя на 12 сутки ситуация изменилась на обратную, так как образованные посредством питания с молочным жиром клетки-предшественники больше не требовались. *Значимая разница (P<0,05) против мышей, которых содержали на контрольной диете.
На фиг.14 представлены три графика, на которых показано, что диета с молочным жиром уменьшает проявления анемии, как описано в примере 16. Для мышей на фиг.11 регистрировали количество RBC, уровень HCT и уровни гемоглобина в сердечных образцах в день введения циклофосфамида и 4, 8 и 12 сутками позже. (A) диета с молочным жиром повышает количество RBC, но результаты не являются значимыми. (B) Диеты с молочным жиром повышают уровень HCT (RBC объем). Две повышенные дозы молочного жира значимо повышали уровни HCT на 8 и 12 сутки. (C) Диета с молочным жиром повышает уровни гемоглобина. Две повышенные дозы молочного жира значимо повышали уровни гемоглобина на 12 сутки, и диета с 25% молочного жира также повышала уровни гемоглобина на 8 сутки.
На фиг.15 представлен график, на котором показано, что диета с молочным жиром предотвращает повреждение тонкого кишечника, как описано в примере 17. Для мышей на фиг.11 регистрировали длины ворсинок тонкого кишечника в сутки введения циклофосфамида и 4, 8 и 12 сутками позже.
На фиг.16 представлен график, на котором показано восстановление ворсинок кишечника после поражения тонкого кишечника, опосредованного циклофосфамидом. Мышей содержали на одной из четырех диет (контрольная диета и диеты с замещением на 0,025% Lf+, молочный жир и комбинацию последних) и регистрировали длины ворсинок тощей кишки в сутки введения циклофосфамида и 4, 8 и 12 сутками позднее. На 8 сутки средняя длина ворсинок в случае комбинации молочного жира и 0,025% Lf+ была значимо больше, чем в случае только молочного жира или только 0,025% Lf+, обеспечивая доказательство синергичного эффекта.
На фиг.17 представлен график, на котором показано, что после химиотерапии циклофосфамидом у мышей, которых содержали на диете, содержащей молочный жир, 0,025% Lf+ или комбинацию последних, количество WBC восстановилось быстрее, чем у мышей, которых содержали на контрольной диете. Регистрировали количества WBC в образцах сердечной крови у мышей на фиг.16 в сутки введения циклофосфамида и 4, 8 и 12 сутками позже. Повышение количества WBC между 4 сутками и 8 сутками в случае комбинации молочного жира и 0,025% Lf+ было значимо больше, чем в случае только молочного жира или только 0,025% Lf+, обеспечивая тем самым доказательство синергичного эффекта.
На фиг.18 представлен график, на котором показано, что после химиотерапии циклофосфамидом у мышей, которых содержали на диете, содержащей молочный жир, 0,25% Lf+ или комбинацию последних, количества RBC восстановились быстрее, чем у мышей, которых содержали на контрольной диете. В образцах сердечной крови у мышей на фиг.16 регистрировали количества RBC в сутки введения циклофосфамида и 4, 8 и 12 сутками позже. На 12 сутки количество RBC для комбинации молочный жир и 0,25% Lf+ было значимо выше, чем только для молочного жира или только 0,25% Lf+, что обеспечивало доказательство синергичного эффекта.
На фиг.19 представлен график, на котором показано, что после химиотерапии циклофосфамидом у мышей, которых содержали на диете, включающей молочный жир, 0,25% Lf+ или комбинацию последних, HCT восстанавливается быстрее, чем у мышей, которых содержали на контрольной диете. HCT (RBC объем) в образцах сердечной крови у мышей на фиг.16 регистрировали в сутки введения циклофосфамида и 4, 8 и 12 сутками позже. На 12 сутки HCT для комбинации молочного жира и 0,25% Lf+ было значимо выше, чем только для молочного жира или только 0,25% Lf+, обеспечивая тем самым доказательства синергичного эффекта.
На фиг.20 представлен график, на котором показано, что после химиотерапии циклофосфамидом у мышей, которых содержали на диете, включающей молочный жир, 0,25% Lf+ или комбинацию последних, гемоглобин восстанавливается быстрее, чем у мышей, которых содержали на контрольной диете. Уровень гемоглобина регистрировали в образцах сердечной крови у мышей на фиг.16 в день введения циклофосфамида и 4, 8 и 12 сутками позже. На 12 сутки гемоглобин для комбинации молочного жира и 0,25% Lf+ был выше, чем только для молочного жира или только 0,25% Lf+. Сравнение только с 0,25% Lf+ было значимым.
На фиг.21 представлен график, на котором показано, что молочный жир увеличивает массу тела после химиотерапии циклофосфамидом у мышей, которых содержали на диете, включающей молочный жир с Lf+ или без Lf+. Регистрировали массу тел у мышей на фиг.16 в сутки введения циклофосфамида и 4, 8 и 12 сутками позже. Когда данные всех суток объединили, масса любых мышей, которых содержали на рационе, обогащенном молочным жиром, была значимо выше, чем у групп, которых не содержали на рационе, обогащенном молочным жиром.
Подробное описание изобретения
1. Определения
Термины "безводный молочный жир" и "AMF" используют в настоящем документе взаимозаменяемо и относят к фракции молочного жира, полученной обращением фаз сливок или из растопленного масла. Молочный жир может представлять собой любой молочный жир млекопитающих, включая в качестве неограничивающих примеров молочный жир коровы, овцы, козы, свиньи, мыши, азиатского буйвола, верблюда, яка, лошади, осла, ламы или человека, с молочным жиром коровы, являющимся предпочтительным источником. Общеупотребительные способы получения AMF раскрыты в Bylund (Ed., 1995), включенной в настоящий документ в полном объеме. Предпочтительный AMF представляет собой, как правило, приблизительно 60%, приблизительно 70%, приблизительно 80%, приблизительно 90%, приблизительно 95%, больше чем приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98%, приблизительно 99%, приблизительно 99,5% или 100% жир, более предпочтительно AMF с приблизительно 99% жира, 99,5% жира или больше. AMF дополнительно неоднократно фракционируют в "твердую" (H) и "мягкую" (S) фракции, последнюю дополнительно можно фракционировать в "мягкую твердую" (SH) и "мягкую мягкую" (SS) фракции, последнюю можно снова дополнительно фракционировать в «мягкую мягкую твердую» (SSH) и «мягкую мягкую мягкую» (SSS) фракции. Как будет понятно, каждая фракция отличается по композиции жирной кислоты. Неограничивающие иллюстративные композиции жирных кислот для AMF и фракции производных показаны ниже в таблицах от 1 до 5.
Иллюстративная композиция AMF
Иллюстративная композиция фракции H
Иллюстративная композиция SH фракции
Иллюстративная композиция фракции SSH
Иллюстративная композиция фракции SSS
Термины "противоопухолевый фактор пищевого продукта", "противоопухолевый пищевой продукт" и "противоопухолевый компонент пищевого продукта" относятся к пищевым продуктам и компонентам пищевого продукта, которые способны к ингибированию опухолевого образования или роста и предпочтительно способны усиливать способность молочного жира и/или лактоферрина ингибировать образование и рост опухоли.
Термин "противоопухолевые факторы" относится по меньшей мере к факторам, вызывающим апоптоз, и может включать противоопухолевые цитолитические антитела и уничтожающие опухолевые клетки цитокины, такие как TNF-α.
Термин "противоопухолевый иммунный ответ" относится к способности молочного жира или лактоферрина стимулировать образование антигенспецифичной цитолитической активности (активности иммунных клеток, особенно цитотоксических T-лимфоцитов) и/или активности NK клеток, улучшать клеточный иммунный ответ на антигены (через активность по меньшей мере цитотоксических T-лимфоцитов), улучшать иммунную защиту (посредством по меньшей мере восстановления активности цитотоксических T-лимфоцитов и/или NK клеток и повышения продукции цитокинов), восстанавливать иммунную защиту (посредством по меньшей мере восстановления или стимулирования активности цитотоксических T-лимфоцитов и/или активности NK клеток и повышения продукции цитокинов), образование провоспалительных и иммуннорегуляторных медиаторов (цитокинов Th1 и Th2) и/или образования противоопухолевых цитолитических антител и уничтожающих опухолевые клетки цитокинов, таких как TNF-α.
Термин "противокахектическое средство" и его грамматический вариант противокахектичное средство обозначает средство, способное обращать, замедлять или прекращать кахексию или обладающее активностью к облегчению одного или нескольких симптомов кахексии, включая прогрессирующую потерю массы тела (включая потерю веса вследствие липолиза и потерю веса вследствие миолиза), анемию, отек и анорексию у субъекта. Противокахектические средства включают ингибиторы циклооксигеназ (например, индометацин), кортикостероиды и глюкокортикоиды, такие как преднизолон, метилпреднизолон и дексаметазон, прогестагенные средства, такие как мегестрола ацетат, медроксипрогестерон ацетат, каннабиноиды, такие как тетрагидроканнабинолы и дронабинол, антагонисты серотонина, такие как ципрогептадин, средства, влияющие на перистальтику кишечника, такие как метоклопрамид и цизаприд, стероидные анаболические средства, такие как нандролона деканоат и флуоксиместерон, ингибиторы фосфоенолпируват-карбоксикиназы, такие как гидразина сульфат, аналоги метилксантина, такие как пентоксифиллин и лизофиллин, талидомид, цитокины и антицитокины, такие как антитело Anti-IL-6, IL-12, аминокислоты с разветвленной цепью, средства, улучшающие метаболизм липидов, такие как эйкозапентаеновая кислота, ингибиторы синтеза простагландина, такие как индометацин и ибупрофен, гормоны, такие как мелатонин, агонисты β2-адренорецептора, такие как кленбутерол, метоклопрамиды, гормон роста, IGF-1 и антитела к факторам TNF-альфа, LIF, IL-6 и онкостатину M, вызывающие кахексию.
Термин "противомукозитное средство" обозначает средство, способное приводить к улучшению состояния при повреждении кишечника, такому как альтерация или к обращению, замедлению или прекращению мукозита или обладающее способностью к облегчению симптомов мукозита.
Термин "включающий", как используют в этом описании, обозначает "содержащий по меньшей мере частично". При толковании утверждений в этом описании, которые включают этот термин, в каждом утверждении должны быть представлены все характерные признаки, которые начинаются с этого термина, но могут быть также представлены другие характерные признаки. Родственные термины, такие как "включать" и "включенный", также должны быть истолкованы таким же образом.
"Эффективное количество" представляет собой количество, необходимое для обеспечения терапевтического эффекта. Соответствие дозировок для животных и людей (из расчета миллиграмм на квадратный метр поверхности тела) описано у Freireich, et al. (1966). Площадь поверхности тела можно приблизительно определить из роста и веса субъекта. См., например, Scientific Tables, Geigy Pharmaceuticals, Ardley, New York, 1970, 537. Эффективные дозы также изменяют в соответствии с решением специалистов в данной области в зависимости от способа введения, используемого эксципиента и т.п.
Термины "усилить иммунную систему" и "стимулировать иммунную систему" (и различные грамматические времена этих терминов) относятся к способности молочного жира стимулировать образование антигенспецифичной цитолитической активности (активности иммунных клеток, особенно цитотоксических T-лимфоцитов) и/или активности NK клеток, улучшать клеточный иммунный ответ к антигенам (посредством активности по меньшей мере цитотоксических T-лимфоцитов), улучшать иммунную защиту (посредством по меньшей мере восстановления активности цитотоксических T-лимфоцитов и/или NK клеток и усиления продукции цитокинов), восстанавливать иммунную защиту (посредством по меньшей мере восстановления или стимулирования активности цитотоксических T-лимфоцитов и/или активности NK клеток и повышения продукции цитокинов) или образовывать провоспалительные и иммунорегуляторные медиаторы (цитокины Th1 и Th2).
Термин "функциональный фрагмент лактоферрина" предназначен для обозначения встречающейся в природе или невстречающейся в природе части полипептида лактоферрина, которая имеет активность, исследованную согласно примерам ниже, и включает функциональные фрагменты, содержащие ион металла. Пригодные фрагменты лактоферрина включают укороченные полипептиды лактоферрина, гидролизаты лактоферрина, связывающего ионы металла, фрагменты, которые включают центр связывания иона металла N-доли, фрагменты, которые включают центр связывания иона металла C-доли, и фрагменты, связывающие ионы металла, образованные (посредством искусственных или природных процессов) и выявленные известными способами, которые обсуждаются ниже. В опубликованных международных патентных заявках WO 2006/054908 и WO2007/043900 сообщают о получении и использовании фрагментов лактоферрина и они включены в настоящий документ в качестве ссылки.
Термин "функциональный вариант лактоферрина" предназначен для обозначения варианта полипептида лактоферрина, который имеет активность, исследованную согласно примерам ниже, и включает функциональные варианты, содержащие ион металла.
Термин "гликозилированный", использованный в отношении полипептида лактоферрина, функционального варианта или функционального фрагмента предназначен для обозначения того, что лактоферрин является полностью или частично гликозилированным гликозильными группами, встречающимися в природе или невстречающимися в природе у человека или быка. Гликозилированные и негликозилированные формы лактоферрина известны (см. Pierce, et al. (1991); Metz-Boutigue, et al. (1984); van Veen, et al. (2004)).
Термин "гематопоэтическое средство" обозначает средство, способное к регулированию и предпочтительно стимулированию гемопоэза и/или лимфопоэза и включает средства, которые улучшают качество крови как посредством повышения числа клеток крови, таких как эритроциты, лимфоциты или миелоидные клетки, так и посредством повышения уровня гемоглобина. Предпочтительные гематопоэтические средства являются пригодными в лечении анемии. Иллюстративные гематопоэтические средства включают гематопоэтические, лимфопоэтические и миелоидные факторы роста и рекомбинантные эквиваленты, такие как эритропоэтин, включая эпоэтин альфа, тромбопоэтин, IL-1-12, IL-20, фактор, стимулирующий образование колоний гранулоцитов/макрофагов (GM-CSF), включая сарграмостим (LEUKINE), фактор, стимулирующий образование колоний моноцитов/макрофагов (M-CSF или CSF-1), фактор, стимулирующий образование колоний макрофагов (M-CSF), фактор, стимулирующий образование колоний гранулоцитов (G-CSF), включая филграстим (NEUPOGEN), фактор стволовой клетки (SCF), лиганд FTL-3 (FL), железо и соли железа, такие как сульфат железа, фумарат железа, глюконат железа и т.д., эдетат железа, декстран железа, натрий железоглюконатный комплекс (FERRLECIT), пиридоксин, рибофлавин, витамины, включая B12 и фолиевую кислоту. См. также Goodman & Gilman's Pharmacological Basis of Therapeutics, 10th Edition, Harman JG и Limbird LE eds., McGraw-Hill, New York, Chapter 54. Hematopoietic Agents: Growth Factors, Minerals, and Vitamins, pp.1487-1517.
Термин "повышение ответной реакции субъекта" предназначен для обозначения того, что у субъекта наблюдается большее снижение в скорости роста опухоли, в размере опухоли или в клинических симптомах заболевания, чем у субъекта, не подвергаемого способу по изобретению. В одном из вариантов осуществления подвергаемый лечению субъект также имеет пользу от одного или нескольких восстановленных витаминных статусов, сниженного времени химиотерапии, сниженной дозы химиотерапии, повышенной иммунной сопротивляемости, повышения здоровья, обусловленного питанием, уменьшенной кахексии, уменьшенного мукозита, уменьшенной анемии, уменьшенной гематологической супрессии или увеличенного гемопоэза.
Термин "повышение чувствительности опухоли" предназначен для обозначения того, что у опухоли наблюдают большее снижение скорости опухолевого роста, размера опухоли или она уничтожена, в то же время у опухоли, не подвергаемой воздействию способа по изобретению, не будут наблюдаться эти эффекты.
Термин "иммунотерапевтическое средство" предназначен для обозначения средства, которое стимулирует противоопухолевую иммунологическую активность, также обозначаемую в настоящем документе как противоопухолевый иммунитет и противоопухолевый иммунный ответ(ы). Средства, которые стимулируют противоопухолевую иммунологическую активность, представляют собой предпочтительно те, которые прямо или опосредованно стимулируют T-клетки и/или NK клетки к уничтожению клеток опухоли. Иллюстративным анализом для определения того, стимулирует ли выбранное средство противоопухолевую иммунологическую активность in vitro, является анализ CTL, описанный ниже.
Термин "ингибирование образования опухоли" предназначен для обозначения того, что опухоли не формируются или что опухоли формируются, но не определяются или не растут, или что опухоли формируются, но остаются небольшими, доброкачественными и не становятся злокачественными опухолями или не метастазируют, или что опухоли растут более медленно. Образование опухоли можно контролировать посредством изображений, полученных с CT и опухолевых маркеров, где доступно.
Термин "ингибирование роста опухоли" предназначен для обозначения того, что опухоли не формируются у субъекта, подвергающегося лечению по изобретению, или что одна или несколько опухолей, которые могут присутствовать у субъекта, подвергающегося лечению по изобретению, не растут в размере или не становятся злокачественными опухолями или не метастазируют, или что одна или несколько опухолей, присутствующих у субъекта, подвергающегося лечению по изобретению, уменьшаются в размере (предпочтительно, по меньшей мере приблизительно на 20, 30, 40, 50, 60, 70, 80, 90 или 100% по объему), или что одна или несколько опухолей, присутствующих у субъекта, подвергающегося лечению по изобретению, уничтожены. Размер опухоли можно контролировать посредством изображений, полученных с CT и опухолевых маркеров, где доступно.
Термины "лактоферрин, содержащий железо" и "лактоферрин, насыщенный железом", как применяют в настоящем документе, предназначен для именования популяции полипептидов лактоферрина, предоставляющих популяцию железосвязывающих центров, где по меньшей мере приблизительно 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 99,5, 99,9 или 100% представленных в популяции центров, связывающих ионы металла, имеют связанный ион железа.
Термин "полипептид лактоферрина" относится к негликозилированной или гликозилированной аминокислотной последовательности лактоферрина дикого типа или гомологичным последовательностям лактоферрина других видов, таких как описанные ниже. Полипептид лактоферрина имеет два центра связывания ионов металла и таким образом может связывать ионы металла в стехиометрическом соотношении 2 иона металла на молекулу лактоферрина. Один центр связывания ионов металла присутствует в N-концевой доле (N-доля) лактоферрина, а другой центр расположен в C-концевой доле (C-доля) (Moore et al, 1997). Проверенные последовательности лактотрансферринов (предшественников лактоферрина) быка и человека, лактоферринов и пептидов такового можно найти в базе данных Swiss-Prot (http://au.expasy.org/cgi-bin/sprot-search-ful). Указанные полипептиды лактоферрина включают предшественник лактотрансферрин быка с регистрационным номером P24627, бычий лактоферрин, предшественник лактотрансферрин человека с регистрационным номером P02788 и лактоферрин человека. В опубликованных международных патентных заявках WO 2006/054908 и WO 2007/043900 сообщают о получении и использовании полипептидов лактоферрина и его аминокислотной последовательности, и каждая заявка включена в настоящий документ в качестве ссылки. Полипептиды лактоферрина могут связывать ионы металлов, как правило, ионы железа, на "природных" уровнях. Например, в природе бычий лактоферрин насыщен железом от приблизительно 10% до 20% (предпочтительно 15%). В рамках изобретения пригоден аполактоферрин и лактоферрин по меньшей мере с 1% насыщения ионом металла.
Термин "массивная опухоль" предназначен для обозначения опухоли, которая не поддается лечению одним, по меньшей мере одним иммунотерапевтическим, анти-ангиогенным или химиотерапевтическим средством, предпочтительно не поддающейся лечению по меньшей мере одним, по меньшей мере одним иммунотерапевтическим или химиотерапевтическим средством. В одном из вариантов осуществления массивная опухоль является опухолью, которая представляет собой по меньшей мере приблизительно 0,3, 0,4, 0,5, 0,6, 0,7 или 0,8 см в диаметре. В одном из вариантов осуществления массивная опухоль является опухолью, которая представляет собой от приблизительно 0,3 до приблизительно 0,8, от приблизительно 0,4 до приблизительно 0,8, от приблизительно 0,5 до приблизительно 0,8, от приблизительно 0,6 до приблизительно 0,8 или от приблизительно 0,7 до приблизительно 0,8 см в диаметре. В одном из вариантов осуществления массивная опухоль является опухолью, которая не поддается лечению иммунотерапией или антиангиогенной терапией или химиотерапией.
Термин "связывающий ионы металла" предназначен для обозначения связывания иона металла в центре связывания железа полипептида лактоферрина или в центре связывания железа фрагмента полипептида лактоферрина, который все еще способен к формированию центра связывания железа.
Термины "содержащий ион металла лактоферрин" и "насыщенный ионом металла лактоферрин" предназначен для именования популяции полипептидов лактоферрина, которые предоставляют популяцию центров связывания ионов металлов, где по меньшей мере приблизительно 25% центров связывания ионов металлов, присутствующих в популяции, имеют связанный ион металла. Следует понимать, что популяция может содержать полипептиды различных видов; например, одни молекулы, которые не связывают ни один ион, и другие, где каждая связывает один или два иона. В случае если использованы различные ионы металлов, одни молекулы могут связать ион металла, выбранный из, например, группы, включающей алюминий, висмут, медь, хром, кобальт, золото, железо, марганец, осмий, платина, рутений, ионы цинка, или другие ионы, которые могут определенным образом устанавливать правильное соотношение в центре связывания иона металла в лактоферрине, и другие молекулы, которые могут связывать различные ионы. В некоторых случаях популяция может включать полипептиды, вовлеченные в неспецифическое связывание ионов, где один или несколько ионов, предпочтительно ионы металлов, неспецифически связаны с полипептидом, т.е. связаны не в центре связывания ионов металла. Неограничивающие примеры ионов, которые можно неспецифически связать с полипептидами лактоферрина, представляют собой кальций и селен.
Термины "содержащий ион металла фрагмент лактоферрина" и "насыщенный ионом металла фрагмент лактоферрина" в равной степени предназначены для именования популяции фрагментов полипептида лактоферрина, которые предоставляют центры связывания ионов металлов, где по меньшей мере приблизительно 25% представленных в популяции центров связывания ионов металлов имеют связанный ион металла.
По настоящему изобретению можно применять смесь полипептидов лактоферрина и фрагментов лактоферрина. В таком варианте осуществления популяция центров связывания ионов металла составлена из двух центров для каждого полипептида лактоферрина и одного или двух центров для каждого фрагмента лактоферрина в зависимости от природы фрагментов.
Степень насыщения можно определить посредством спектрофотометрического анализа (Brock & Arzabe, 1976; Bates et al, 1967; Bates et al, 1973). Следует понимать, что может происходить обмен ионами металлов между полипептидами лактоферрина. В одном из вариантов осуществления лактоферрин, насыщенный железом, можно получить посредством способа Law et al. (1977). В другом варианте осуществления лактоферрин, насыщенный железом, можно получить способом Kawakami et al. (1993). Лактоферрин, насыщенный ионами металлов, можно получить посредством связывания ионов металлов с местами связывания ионов металлов в лактоферрине, включая центры связывания иона металла, такие как центры связывания Fe и другие центры неспецифического связывания в молекуле лактоферрина или фрагменте лактоферрина.
В одном из вариантов осуществления по меньшей мере приблизительно 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 99,5, 99,9 или 100% центров связывания ионов металлов, присутствующие в популяции молекул лактоферрина, имеют связанный ион металла, и пригодный диапазон можно выбрать между любыми упомянутыми выше значениями (например, от приблизительно 25 до приблизительно 100%, от приблизительно 30 до приблизительно 100%, от приблизительно 35 до приблизительно 100%, от приблизительно 40 до приблизительно 100%, от приблизительно 45 до приблизительно 100%, от приблизительно 50 до приблизительно 100%, от приблизительно 55 до приблизительно 100%, от приблизительно 60 до приблизительно 100%, от приблизительно 65 до приблизительно 100%, от приблизительно 70 до приблизительно 100%, от приблизительно 75 до приблизительно 100%, от приблизительно 80 до приблизительно 100%, от приблизительно 85 до приблизительно 100%, от приблизительно 90 до приблизительно 100%, от приблизительно 95 до приблизительно 100% и от приблизительно 99 до приблизительно 100%). В одном из вариантов осуществления содержащий ион металла лактоферрин представляет собой сверхнасыщенный лактоферрин.
Термин "содержащий ион металла функциональный фрагмент лактоферрина" предназначен для обозначения встречающейся в природе или не встречающейся в природе части полипептида лактоферрина, которая имеет один или два центра связывания с ионами металлов и которая имеет активность, определенную в условиях согласно примерам ниже. Пригодные фрагменты лактоферрина включают укороченный полипептид лактоферрина, гидролизаты лактоферрина, связывающего ионы металлов, фрагменты, которые содержат центр связывания иона металла N-доли, фрагменты, которые содержат центр связывания иона металла C-доли и фрагменты, связывающие ионы металлов, образованные посредством искусственных или природных способов и определенные посредством известных способов, как обсуждается ниже.
Термин "молочный жир" включает липиды и липидную фракцию и гидролизаты липидной фракции млекопитающих. Предпочтительными молочными жирами являются жиры молока, особенно молочные жиры молока коровы. Предпочтительный молочный жир имеет в составе пальмитиновую кислоту, олеиновую кислоту, стеариновую кислоту или миристиновую кислоту, одну или несколько, которая присутствует как наиболее многочисленная жирная кислота(ы), предпочтительно пальмитиновая, олеиновая, стеариновая и миристиновая кислоты присутствуют как наиболее многочисленные жирные кислоты. В особенно предпочтительных вариантах осуществления молочный жир имеет в составе a) по существу то же процентное содержание по массе пальмитиновой кислоты, равно как и у обычного молочного жира коровьего молока (от приблизительно 23% (масс./масс.) и приблизительно 32% (масс./масс.), как правило, приблизительно 28% (масс./масс.) - см. таблицу 1,2, PF Fox и PLH McSweeney eds, Advanced Dairy Chemistry Volume 2 - Lipids, 3rd Ed, Springer NY, NY (2006) ISBN-10:0-387-26364-0); b) по существу то же процентное содержание по массе олеиновой кислоты, равно как и у обычного молочного жира коровьего молока (от приблизительно 15% (масс./масс.) и приблизительно 22% (масс./масс.), как правило, приблизительно 17% (масс./масс.) - см. Fox and McSweeny ibid); c) по существу то же процентное содержание по массе стеариновой кислоты, равно как и у нормального молочного жира коровьего молока (от приблизительно 10% (масс./масс.) и приблизительно 15%(масс./масс.), как правило, приблизительно 12% (масс./масс.) - см. Fox и McSweeny ibid); d) по существу то же процентное содержание по массе миристиновой кислоты, равно как и у обычного молочного жира коровьего молока (от приблизительно 9% (масс./масс.) и приблизительно 12% (масс./масс.), как правило, приблизительно 11% (масс./масс.) - см. Fox и McSweeny ibid); e) по существу то же процентное содержание по массе масляной кислоты, равно как и у обычного молочного жира коровьего молока (от приблизительно 3% (масс./масс.) и приблизительно 5% (масс./масс.), как правило, приблизительно 4% (масс./масс.) - см. Fox и McSweeny ibid); f) любые два из a), b), c), d) или e) выше; g) любые три из a), b), c), d) или e) выше; h) любые четыре из a), b), c), d) или e) выше; i) каждый из a), b), c), d) и e) выше. Предпочтителен безводный молочный жир (AMF), особенно AMF с композицией, имеющей по существу то же процентное содержание по массе пальмитиновой, олеиновой и стеариновой кислоты, что и у обычного молочного жира коровьего молока, более предпочтительно по существу та же композиция жирной кислоты, что и у обычного молочного жира коровьего молока (см. Fox и McSweeny ibid).
Термин "аналог молочного жира" включает любую комбинацию растительных жиров, животных жиров или жиров из продуктов моря, которую смешивают для предоставления пальмитиновой кислоты, олеиновой кислоты, стеариновой кислоты или миристиновой кислоты, одной или нескольких присутствующих как наиболее многочисленная жирная кислота(ы), предпочтительно пальмитиновая, олеиновая, стеариновая и миристиновая кислоты представлены как наиболее многочисленные жирные кислоты, таким образом, аналог молочного жира имеет в составе a) по существу то же процентное содержание по массе пальмитиновой кислоты, равно как и у обычного молочного жира коровьего молока (от приблизительно 23% (масс./масс.) и приблизительно 32% (масс./масс.), как правило, приблизительно 28% ( масс./масс.) - см. Fox и McSweeny ibid); b) в значительной степени то же процентное содержание по массе олеиновой кислоты, равно как и у обычного молочного жира коровьего молока (от приблизительно 15% (масс./масс.) и приблизительно 22% (масс./масс.), как правило, приблизительно 17% (масс./масс.) - см. Fox и McSweeny ibid); c) в значительной степени то же процентное содержание по массе стеариновой кислоты, равно как и у обычного молочного жира коровьего молока (от приблизительно 10% (масс./масс.) и приблизительно 15% (масс./масс.), как правило, приблизительно 12% (масс./масс.) - см. Fox и McSweeny ibid); d) в значительной степени то же процентное содержание по массе миристиновой кислоты, равно как и у обычного молочного жира коровьего молока (от приблизительно 9% (масс./масс.) и приблизительно 12% (масс./масс.), как правило, приблизительно 11% (масс./масс.) - см. Fox и McSweeny ibid); e) в значительной степени то же процентное содержание по массе масляной кислоты, равно как и у обычного молочного жира коровьего молока (от приблизительно 3% (масс./масс.) и приблизительно 5% (масс./масс.), как правило, приблизительно 4% (масс./масс.) - см. Fox и McSweeny ibid); f) любые два из a), b), c), d) или e) выше; g) любые три из a), b), c), d) или e) выше; h) любые четыре из a), b), c), d) или e) выше; i) каждый из a), b), c), d) и e) выше. Подходящие жиры могут включать пищевые или кулинарные масла, включая пальмовое, оливковое, соевых бобов, канолы, кукурузы, подсолнечное, сафлоры, арахиса, семян винограда, кунжута, ореховое, миндаля, кешью, фундука, макадамии, пекана, фисташковое и грецкого ореха и других пищевых масел, включая асаи, амаранта, абрикоса, аргании колючей, артишока, авокадо, бабассу, бегенового ореха, семян черной смородины, семян бурачника, масло шореа, бутылочной тыквы, тыквы буйвола, рожкового дерева (альгароба), манаки, семян кориандра, энотеры, рыжика посевного, конопли, семян хлопкового дерева, ляллеманции, семян пенника лугового, горчичное, семян бамии (семян гибискуса), семян периллы, пекуи, кедровое, семян мака, сливовое, семян тыквы, квиноя, нута абиссинского, рисовое, чайных (камелии), росторопши, семян арбуза и ростков пшеницы, масло из продуктов моря, включая жиры моллюсков и ракообразных, рыбу, анчоусов, рыб Байкала, копченую рыбу, рыбу каха, карпа, угря, тихоокеанскую корюшку, сельдь, макруронуса, тенуалозу, щуку, рыбу катла, копченого лосося, макрель, хоплостета, карася, пильчарда, нототению, лосося, сардин, акулу, шпрот, форель, тунца, снетка и меч-рыбу и комбинацию любых двух или более из них.
Термин "пероральное введение" включает пероральное, буккальное, энтеральное и внутрижелудочное введение.
Термин "парентеральное введение" включает в качестве неограничивающих примеров местное (включающее введение на любую кожную, эпидермальную или слизистую поверхность), подкожное, внутривенное, интраперитонеальное, внутримышечное и внутриопухолевое введение (включающее любое непосредственное введение в опухоль).
Термин "фармацевтически приемлемый носитель" предназначен для обозначения носителя, включая в качестве неограничивающих примеров эксципиент, разбавитель или вспомогательное средство, которое можно вводить субъекту как компонент композиции по изобретению. При введении в дозах, достаточных для введения эффективного количества молочного жира, производного молочного жира или его компонента, включая, например, cis-9, trans-11 CLA и TVA или при введении полипептида лактоферрина или функционального варианта или его функционального фрагмента, предпочтительные носители не снижают активность композиции и не токсичны. Препараты можно вводить перорально, в нос или парентерально.
Термин "субъект" предназначен для обозначения животного, предпочтительно млекопитающего, более предпочтительным млекопитающим является домашнее животное или человек. Предпочтительные домашние животные включают кошек, собак и лошадей.
Термин "сверхнасыщенный лактоферрин" относится к популяции полипептидов лактоферрина или функциональных фрагментов, предоставляющих популяцию центров связывания ионов металлов, где ионы металлов доступны в количестве, достаточном для насыщения 100% центров связывания, и присутствуют дополнительные ионы металлов и связаны неспецифическими местами связывания в полипептиде лактоферрина или фрагменте лактоферрина. Другими словами, предоставлен стехиометрический избыток ионов металлов. В композиции по изобретению, включающей сверхнасыщенный лактоферрин, представлены, предпочтительно, несвободные ионы металлов, хотя может происходить обмен ионом металла между центрами связывания, между неспецифическими местами связывания и между центрами связывания и неспецифическими центрами связывания. Предпочтительно, сверхнасыщенный лактоферрин не формирует нерастворимые агрегаты. В одном из вариантов осуществления сверхнасыщенный лактоферрин представляет собой по меньшей мере на 105, 110, 115, 120, 125, 130, 135, 140, 145, 150, 155, 160, 165, 170, 175, 180, 185, 190, 195 или 200% насыщенный ионами металла, предпочтительно насыщенный железом. Пригодные диапазоны насыщения включают от приблизительно 25 до приблизительно 200%, от приблизительно 30 до приблизительно 200%, от приблизительно 35 до приблизительно 200%, от приблизительно 40 до приблизительно 200%, от приблизительно 45 до приблизительно 200%, от приблизительно 50 до приблизительно 200%, от приблизительно 55 до приблизительно 200%, от приблизительно 60 до приблизительно 200%, от приблизительно 65 до приблизительно 200%, от приблизительно 70 до приблизительно 200%, от приблизительно 75 до приблизительно 200%, от приблизительно 80 до приблизительно 200%, от приблизительно 85 до приблизительно 200%, от приблизительно 90 до приблизительно 200%, от приблизительно 95 до приблизительно 200% и от приблизительно 100 до приблизительно 200% насыщения ионом металла.
Термины "лечить" и его производные должны быть объяснены в их самом широком возможном смысле. Термин не должен употребляться для обозначения того, что субъект вылечен до полного восстановления. Таким образом, термин "лечить" широко включает сохранение развития заболевания субъекта или симптомов заболевания в значительной степени на постоянном уровне, увеличение скорости восстановления субъекта, улучшение состояния и/или предотвращение начала проявления симптомов или усиления тяжести конкретного состояния или продлевание качества жизни субъекта. Термин "лечение" также широко включает поддержку хорошего здоровья у подверженных заболеванию личностей и формирование защитных сил для предотвращения заболевания.
Термин "вариант" относится к встречающемуся в природе (аллельный вариант, например) или не встречающемуся в природе (искусственно созданный мутант, например) полипептиду лактоферрина или фрагменту лактоферрина, которые отличаются от основной аминокислотной последовательности полипептида лактоферрина дикого типа данных видов (такие как перечисленные ниже) или его фрагмента присоединением, удалением или заменой одной или нескольких аминокислот.
Как правило, вариант последовательности полипептида обладает общей качественной биологической активностью, которая определяется, согласно примерам ниже. Дополнительно, эти варианты полипептидной последовательности могут иметь идентичность последовательности по меньшей мере приблизительно 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%. Также включенными в значение термина "вариант" являются гомологи полипептида лактоферрина. Гомолог представляет собой, как правило, полипептид различных видов, но имеющий по существу ту же биологическую функцию или активность, как соответствующий полипептид, описываемый в настоящем документе.
Предпочтительный вариант полипептидов предпочтительно имеет по меньшей мере приблизительно 70, 75, 80, 85, 90, 95 или 99% идентичности, предпочтительно по меньшей мере приблизительно 90, 95 или 99% идентичности с последовательностью лактоферрина, описываемой в настоящем документе, включая те последовательности, которые описаны в опубликованной международной патентной заявке WO 2006/054908 и WO 2007/043900, которые включены в настоящий документ в качестве ссылки. Вариант фрагментов предпочтительно имеет по меньшей мере приблизительно 70, 75, 80, 85, 90, 95 или 99% идентичности, предпочтительно по меньшей мере приблизительно 90, 95 или 99% идентичности с фрагментом, описываемым в настоящем документе, включая последовательности, описанные в опубликованной международной патентной заявке WO 2006/054908 и WO 2007/043900. Идентичность можно определить путем сравнения подходящей аминокислотной последовательности c последовательностью, описываемой в настоящем документе, такой как полипептид лактоферрина или его фрагмент, используя набор программ BLAST (версия 2,2,12; 28 August 2005), который общедоступен в NCBI (ftp://ftp.ncbi.nih.gov/blast/).
Консервативные замены одной или нескольких аминокислот в последовательности полипептида лактоферрина, без значимого изменения его биологической активности, также пригодны. Специалистам в данной области известны способы создания замен аминокислот, не проявляющихся фенотипически (см. например, Bowie et al., (1990)).
Термин "витамин D" относится к одному или нескольким соединениям витамина D, выбранным из группы, включающей витамин D1 [люмистерин], витамин D2 [кальциферол или эргокальциферол], витамин D3 [холекальциферол], витамин D4 [22-дигидроэргокальциферол] и витамин D5 [ситокальциферол] и любую смесь любых двух или более из них. Термин "аналог витамина D" относится к любому соединению, которое будет связывать и активировать рецептор витамина D (VDR). VDR представляет собой внутриклеточный рецептор, активируемый лигандом, который действует как фактор транскрипции и связывает в промоторной/энхансерной областях генов чувствительные элементы к витамину D (VDREs), включая в качестве неограничивающих примеров гены, которые оказывают антипролиферативные эффекты на клетки опухоли посредством блокирования фазы G0/G1 клеточного цикла, подавляет факторы, стимулирующие рост, такие как IGF-1, активирует отрицательные регуляторы роста, такие как трансформирующий фактор роста бета, чем обуславливает апоптоз опухоли, ингибирование ангиогенеза опухоли и ингибирование метастазирования. Анализы для определения связывания VDR известны; например, иммуноанализы, которые измеряют уровень экспрессии генов, регулируемых витамином D. Таким образом, подходящие аналоги витамина D, для использования по настоящему изобретению, можно быстро определить без излишнего экспериментирования.
2. Молочные липиды и фракции липидов
Молочные липиды всесторонне обсуждены Fox и McSweeney (2006) и, таким образом, включены в качестве ссылки. Фракция молочных липидов обсуждена в Dairy Processing Handbook, 1995 и в Illingworth, 2002 и Rombaut et al., 2006 и все включены, таким образом, в качестве ссылки.
Примеры пригодных фракций молочных липидов по изобретению включают сливки, масло, безводный молочный жир (AMF) (как правило, полученный посредством обращения фазы сливок или масла), пахту, плазму масла, твердые фракции молочного жира, мягкие фракции молочного жира, сфингомиелиновые фракции, фракции оболочки глобул молочного жира, фосфолипидные фракции и комплексные липидные фракции и их сочетания и их гидролизаты.
Многоступенчатое фракционирование молочного жира можно выполнить посредством дифференциальной кристаллизации. Фракции молочного жира нагревают до установленной температуры и кристаллизуют или разделяют на твердые ("стеарин") и жидкие ("олеин") фракции. Многоступенчатое фракционирование обозначает рефракционирование в последующей стадии продукта фракционирования предыдущей стадии.
Другие способы фракционирования включают обращение фаз, переэтерификацию, глицеролиз, фракционирование растворителем, сверхкритическое фракционирование, фракционирование, близкое к сверхкритическому, дистилляцию, фракционирование центрифугированием, кристаллизацию суспензии, сухую кристаллизацию, фракционирование с модификатором (например, мылами или эмульгаторами) и комбинации этих способов.
Липиды, присутствующие в композициях по изобретению, могут быть полностью или частично модифицированными, включающими, например, гликозилированные, сиалированные, этерифицированные, фосфорилированные или гидролизованные природным способом, химическим, ферментативным или любыми другими известными в данной области способами.
Липидные гидролизаты можно получать, используя известные способы, включая в качестве неограничивающих примеров гидролиз в кислой среде, гидролиз в щелочной среде, гидролиз ферментативный, с использованием, например, липазы, как описано в Fox и McSweeney ((2006), Chapter 15 by HC Deeth и CH Fitz-Gerald) и микробиологическую ферментацию. Способ щелочного гидролиза включает добавление 1% KOH (в этаноле) и нагревание в течение 10 минут. Продукты гидролиза можно нейтрализовать уксусной кислотой или соляной кислотой.
Вещества оболочки глобул молочного жира можно выделить согласно способу ацидификации Kanno & Dong-Hyun, 1990 и дополнительно фракционировать на комплекс фракций липидов и липопротеинов посредством добавления метанола, как описано Kanno et al., 1975. Фракцию фосфолипидов можно выделить посредством экстракции смеси липидов ацетоном, согласно способу Purthi et al, 1970. Липидный остаток можно дополнительно обогатить липидным комплексом посредством избирательной экстракции простых липидов пентаном.
В одном из вариантов осуществления молочный жир включает одну или несколько жирных кислот, выбранных из масляной кислоты (C4:0), капроновой кислоты (C6:0), каприловой кислоты (C8:0), каприновой кислоты (C10:0), лауриновой кислоты (C12:0), миристиновой кислоты (C14:0), пальмитиновой кислоты (C16:0), пальмитолеиновой кислоты (C16:1), стеариновой кислоты (C18:0), олеиновой кислоты (C18:1 cis-9; cis-9-октадеценовая кислота), элаидиновой кислоты (C18:1 trans-9; trans-9-октадеценовая кислота), вакценовой кислоты (C18:1 trans-11; trans-11-октадеценовая кислота), cis-вакценовой кислоты (C18:1 cis-11; cis-11-октадеценовая кислота), арахиновой кислоты (C20:0) и бегеновой кислоты (C22:0), необязательно замещенную одной или несколькими группами, выбранными из гидроксильной, метильной, этильной и пропильной групп и солей, сложных эфиров и их амидов и их сочетания. Необязательный заместитель(и) может присутствовать в любой позиции по всей длине углеродной цепи. Предпочтительный молочный жир включает жирные кислоты, такие как масляная кислота, капроновая кислота, каприловая кислота, каприновая кислота, лауриновая кислота, миристиновая кислота, пальмитиновая кислота, пальмитолеиновая кислота, стеариновая кислота, олеиновая кислота и элаидиновая кислота, соли, сложные эфиры и их амиды и их сочетания. Эти жирные кислоты являются главными компонентами коровьего молочного жира.
В одном из вариантов осуществления композиция включает, содержит в основном или состоит из по меньшей мере приблизительно 0,1, 0,2, 0,5, 1, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 99, 99,5, 99,8 или 99,9% по массе свежего, рекомбинированного или порошкового цельного молока или производного молока, предпочтительно молочного жира и пригодные диапазоны можно выбрать между любыми упомянутыми выше значениями (например, от приблизительно 0,1 до приблизительно 50%, от приблизительно 0,2 до приблизительно 50%, от приблизительно 0,5 до приблизительно 50%, от приблизительно 1 до приблизительно 50%, от приблизительно 5 до приблизительно 50%, от приблизительно 10 до приблизительно 50%, от приблизительно 15 до приблизительно 50%, от приблизительно 20 до приблизительно 50%, от приблизительно 25 до приблизительно 50%, от приблизительно 30 до приблизительно 50%, от приблизительно 35 до приблизительно 50%, от приблизительно 40 до приблизительно 50%, от приблизительно 45 до приблизительно 50%, от приблизительно 0,1 до приблизительно 60%, от приблизительно 0,2 до приблизительно 60%, от приблизительно 0,5 до приблизительно 60%, от приблизительно 1 до приблизительно 60%, от приблизительно 5 до приблизительно 60%, от приблизительно 10 до приблизительно 60%, от приблизительно 15 до приблизительно 60%, от приблизительно 20 до приблизительно 60%, от приблизительно 25 до приблизительно 60%, от приблизительно 30 до приблизительно 60%, от приблизительно 35 до приблизительно 60%, от приблизительно 40 до приблизительно 60%, от приблизительно 45 до приблизительно 60%, от приблизительно 0,1 до приблизительно 70%, от приблизительно 0,2 до приблизительно 70%, от приблизительно 0,5 до приблизительно 70%, от приблизительно 1 до приблизительно 70%, от приблизительно 5 до приблизительно 70%, от приблизительно 10 до приблизительно 70%, от приблизительно 15 до приблизительно 70%, от приблизительно 20 до приблизительно 70%, от приблизительно 25 до приблизительно 70%, от приблизительно 30 до приблизительно 70%, от приблизительно 35 до приблизительно 70%, от приблизительно 40 до приблизительно 70%, от приблизительно 45 до приблизительно 70%, от приблизительно 0,1 до приблизительно 80%, от приблизительно 0,2 до приблизительно 80%, от приблизительно 0,5 до приблизительно 80%, от приблизительно 1 до приблизительно 80%, от приблизительно 5 до приблизительно 80%, от приблизительно 10 до приблизительно 80%, от приблизительно 15 до приблизительно 80%, от приблизительно 20 до приблизительно 80%, от приблизительно 25 до приблизительно 80%, от приблизительно 30 до приблизительно 80%, от приблизительно 35 до приблизительно 80%, от приблизительно 40 до приблизительно 80%, от приблизительно 45 до приблизительно 80%, от приблизительно 0,1 до приблизительно 90%, от приблизительно 0,2 до приблизительно 90%, от приблизительно 0,5 до приблизительно 90%, от приблизительно 1 до приблизительно 90%, от приблизительно 5 до приблизительно 90%, от приблизительно 10 до приблизительно 90%, от приблизительно 15 до приблизительно 90%, от приблизительно 20 до приблизительно 90%, от приблизительно 25 до приблизительно 90%, от приблизительно 30 до приблизительно 90%, от приблизительно 35 до приблизительно 90%, от приблизительно 40 до приблизительно 90%, от приблизительно 45 до приблизительно 90%, от приблизительно 0,1 до приблизительно 99%, от приблизительно 0,2 до приблизительно 99%, от приблизительно 0,5 до приблизительно 99%, от приблизительно 1 до приблизительно 99%, от приблизительно 5 до приблизительно 99%, от приблизительно 10 до приблизительно 99%, от приблизительно 15 до приблизительно 99%, от приблизительно 20 до приблизительно 99%, от приблизительно 25 до приблизительно 99%, от приблизительно 30 до приблизительно 99%, от приблизительно 35 до приблизительно 99%, от приблизительно 40 до приблизительно 99% и от приблизительно 45 до приблизительно 99%).
В одном из вариантов осуществления композиция включает по меньшей мере приблизительно 0,001, 0,01, 0,05, 0,1, 0,15, 0,2, 0,3, 0,4, 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18 или 19 грамм свежего, рекомбинированного или порошкового цельного молока или производного молока, предпочтительно молочного жира, формулы (I) или (II) и пригодные диапазоны можно выбрать между любыми упомянутыми выше значениями (например, от приблизительно 0,01 до приблизительно 1 грамма, от приблизительно 0,01 до приблизительно 10 граммов, от приблизительно 0,01 до приблизительно 19 граммов, от приблизительно 0,1 до приблизительно 1 грамма, от приблизительно 0,1 до приблизительно 10 граммов, от приблизительно 0,1 до приблизительно 19 граммов, от приблизительно 1 до приблизительно 5 граммов, от приблизительно 1 до приблизительно 10 граммов, от приблизительно 1 до приблизительно 19 граммов, от приблизительно 5 до приблизительно 10 граммов и от приблизительно 5 до приблизительно 19 граммов).
В одном из вариантов осуществления композиция включает, содержит в основном или содержит приблизительно 0,1, 0,2, 0,5, 1, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 99, 99,5, 99,8 или 99,9% по массе полипептид лактоферрина, функциональный вариант лактоферрина, функциональный фрагмент лактоферрина, содержащий ион металла лактоферрин, функциональный вариант содержащего ион металла лактоферрина или функциональный фрагмент содержащего ион металла лактоферрина или смесь любых двух или более из них и пригодные диапазоны можно выбрать между любыми упомянутыми выше значениями (например, от приблизительно 0,1 до приблизительно 50%, от приблизительно 0,2 до приблизительно 50%, от приблизительно 0,5 до приблизительно 50%, от приблизительно 1 до приблизительно 50%, от приблизительно 5 до приблизительно 50%, от приблизительно 10 до приблизительно 50%, от приблизительно 15 до приблизительно 50%, от приблизительно 20 до приблизительно 50%, от приблизительно 25 до приблизительно 50%, от приблизительно 30 до приблизительно 50%, от приблизительно 35 до приблизительно 50%, от приблизительно 40 до приблизительно 50%, от приблизительно 45 до приблизительно 50%, от приблизительно 0,1 до приблизительно 60%, от приблизительно 0,2 до приблизительно 60%, от приблизительно 0,5 до приблизительно 60%, от приблизительно 1 до приблизительно 60%, от приблизительно 5 до приблизительно 60%, от приблизительно 10 до приблизительно 60%, от приблизительно 15 до приблизительно 60%, от приблизительно 20 до приблизительно 60%, от приблизительно 25 до приблизительно 60%, от приблизительно 30 до приблизительно 60%, от приблизительно 35 до приблизительно 60%, от приблизительно 40 до приблизительно 60%, от приблизительно 45 до приблизительно 60%, от приблизительно 0,1 до приблизительно 70%, от приблизительно 0,2 до приблизительно 70%, от приблизительно 0,5 до приблизительно 70%, от приблизительно 1 до приблизительно 70%, от приблизительно 5 до приблизительно 70%, от приблизительно 10 до приблизительно 70%, от приблизительно 15 до приблизительно 70%, от приблизительно 20 до приблизительно 70%, от приблизительно 25 до приблизительно 70%, от приблизительно 30 до приблизительно 70%, от приблизительно 35 до приблизительно 70%, от приблизительно 40 до приблизительно 70%, от приблизительно 45 до приблизительно 70%, от приблизительно 0,1 до приблизительно 80%, от приблизительно 0,2 до приблизительно 80%, от приблизительно 0,5 до приблизительно 80%, от приблизительно 1 до приблизительно 80%, от приблизительно 5 до приблизительно 80%, от приблизительно 10 до приблизительно 80%, от приблизительно 15 до приблизительно 80%, от приблизительно 20 до приблизительно 80%, от приблизительно 25 до приблизительно 80%, от приблизительно 30 до приблизительно 80%, от приблизительно 35 до приблизительно 80%, от приблизительно 40 до приблизительно 80%, от приблизительно 45 до приблизительно 80%, от приблизительно 0,1 до приблизительно 90%, от приблизительно 0,2 до приблизительно 90%, от приблизительно 0,5 до приблизительно 90%, от приблизительно 1 до приблизительно 90%, от приблизительно 5 до приблизительно 90%, от приблизительно 10 до приблизительно 90%, от приблизительно 15 до приблизительно 90%, от приблизительно 20 до приблизительно 90%, от приблизительно 25 до приблизительно 90%, от приблизительно 30 до приблизительно 90%, от приблизительно 35 до приблизительно 90%, от приблизительно 40 до приблизительно 90%, от приблизительно 45 до приблизительно 90%, от приблизительно 0,1 до приблизительно 99%, от приблизительно 0,2 до приблизительно 99%, от приблизительно 0,5 до приблизительно 99%, от приблизительно 1 до приблизительно 99%, от приблизительно 5 до приблизительно 99%, от приблизительно 10 до приблизительно 99%, от приблизительно 15 до приблизительно 99%, от приблизительно 20 до приблизительно 99%, от приблизительно 25 до приблизительно 99%, от приблизительно 30 до приблизительно 99%, от приблизительно 35 до приблизительно 99%, от приблизительно 40 до приблизительно 99% и от приблизительно 45 до приблизительно 99%).
3. Композиции, пригодные по изобретению
Композицию, пригодную в рамках изобретения, можно составлять как пищевой продукт, напиток, добавку к пищевому продукту, добавку к напитку, диетическую добавку, питательный продукт, лечебный пищевой продукт, нутрицевтический, лечебный или фармацевтический. Подходящие составы может получить специалист в данной области с учетом этой области и идеей этого описания.
В одном из вариантов осуществления настоящее изобретение относится к использованию молочного жира или аналога молочного жира, необязательно по меньшей мере с одним противоопухолевым средством, предпочтительно лактоферрином, в производстве пищевого продукта, напитка, добавки к пищевому продукту, добавки к напитку, диетической добавки, питательного продукта, лечебного пищевого продукта, нутрицевтического, лечебного или фармацевтического. Предпочтительно композицию составляют для перорального или местного введения. Предпочтительно композицию составляют для перорального или парентерального введения. Предпочтительно композиция служит для ингибирования роста опухоли, ингибирования опухолевого метастазирования, стимуляции апоптоза, стимуляции апоптоза клеток опухоли, лечения или предупреждения злокачественной опухоли, повышения ответной реакции субъекта или чувствительности опухоли к лечению, сохранения или улучшения у субъекта одного или нескольких показателей количества лейкоцитов, эритроцитов или миелоидных клеток, повышения у субъекта продукции цитокинов Th1 и Th2 в кишечнике или опухоли, лечения или предупреждения анемии, кахексии, мукозита у нуждающегося в этом субъекта или других применений, как описано выше. Предпочтительными являются молочный жир или аналог молочного жира и по меньшей мере одно дополнительное лекарственное средство, такое как одно или несколько противоопухолевых средств, такое как лактоферрин, который описан в настоящем документе. Предпочтительно противоопухолевым фактором является один, описываемый в настоящем документе.
В одном из вариантов осуществления композиция находится в форме таблетки, каплеты, пилюли, твердой или мягкой капсулы или таблетки для рассасывания.
В одном из вариантов осуществления композиция находится в форме крахмальной капсулы, расфасованного порошка, гранул, суспензии, эликсира, жидкого раствора, напитка или в любой другой форме, которую можно добавлять к пищевому продукту или напитку, включая, например, воду или фруктовый сок. В одном из вариантов осуществления композиция представляет собой продукт для энтерального питания, твердый продукт для энтерального питания или жидкий продукт для энтерального питания.
В одном из вариантов осуществления композиция дополнительно включает один или несколько составляющих (таких, как антиоксиданты), которые предотвращают или снижают деградацию композиции в течение хранения или после введения.
В одном из вариантов осуществления композиции, пригодные в рамках изобретения, включают любые продуктовые потребительские товары, которые могут содержать жиры, жирные кислоты или липиды. Когда композиция содержит белковый фактор, такой как лактоферрин, как по меньшей мере одно дополнительное лекарственное средство, продуктовые потребительские товары могут содержать белок. Примеры подходящих продуктовых потребительских товаров включают хлебобулочные изделия, муку, жидкости, кондитерские изделия, восстановленные продукты из фруктов, снеки, мюсли, спреды, подливки, соусы, молочные продукты, включая мороженое, йогурты и сыры, напитки, включая напитки на основе молока и немолочные напитки (такие, как молочные напитки, включающие молочные коктейли и питьевые йогурты), молочные порошки, спортивные пищевые добавки, включающие спортивные пищевые добавки на основе молока и немолочные, добавки к пищевому продукту, такие как белковые сыпучие добавки и продукты, представляющие собой диетические пищевые добавки, включая диетические пищевые добавки в виде таблеток. В этом варианте осуществления композиция, пригодная в настоящем документе, может также являться детской смесью, в виде порошка или жидкости. В сходном виде можно предоставить подходящие нутрицевтические композиции, пригодные в рамках изобретения.
Композиции, пригодные в рамках изобретения, могут дополнительно включать другие факторы, такие как кальций, цинк, магний, селен, витамин C, витамин D, витамин E, витамин K2, комплекс углеводов, пищевые или кулинарные масла, включая пальмовое, оливковое, соевых бобов, канолы, кукурузы, подсолнечное, сафлоры, арахиса, семян винограда, кунжута, ореховое, миндаля, кешью, фундука, макадамии, пекана, фисташковое и грецкого ореха и других пищевых масел, включая асаи, амаранта, абрикоса, аргании колючей, артишока, авокадо, бабассу, бегенового ореха, семян черной смородины, семян бурачника, масло шореа, бутылочной тыквы, тыквы буйвола, рожкового дерева (альгароба), манаки, семян кориандра, энотеры, рыжика посевного, конопли, семян хлопкового дерева, ляллеманции, семян пенника лугового, горчичное, семян бамии (семян гибискуса), семян периллы, пекуи, кедровое, семян мака, сливовое, семян тыквы, квиноя, нута абиссинского, рисовое, чайных (камелии), расторопши, семян арбуза или ростков пшеницы, или их сочетание.
Композиции, пригодные в рамках изобретения, можно составлять, предоставляя возможность для введения субъекту посредством любого выбранного способа введения, включая в качестве неограничивающих примеров пероральное или парентеральное (включающее местное, подкожное, внутримышечное и внутривенное) введение.
В основном, для перорального введения, диетическую (пищевой продукт, добавки к пищевому продукту или пищевые добавки, например), нутрицевтическую или фармацевтическую композицию, пригодную в настоящем документе, может составлять специалист в данной области, согласно известным способам формулирования.
Таким образом, фармацевтическую композицию, пригодную по изобретению, можно составлять с подходящим фармацевтически приемлемым носителем (включая эксципиенты, разбавители, вспомогательные средства и их сочетания), выбранным с учетом предполагаемого способа введения и норм в фармацевтической области. См., например, Remington's Pharmaceutical Sciences, 16th edition, Osol, A. Ed., Mack Publishing Co., 1980.
Следует понимать, что, несмотря на то что предпочтительным способом введения является пероральный, любой способ введения может подходить для любой композиции по изобретению, включая введение многократным способом введения, включающим различные способы введения для различных средств. Таким образом, также предполагается ингаляция (ингаляция в нос или рот) и вагинальное и ректальное введение любой композиции изобретения. Также предполагается интрамедуллярное, эпидуральное, внутрисуставное и внутриплевральное введение любой композиции по изобретению. Также предполагается ведение молочного жира или аналога молочного жира, необязательно по меньшей мере с одним дополнительным фактором, одним способом введения, сопровождаемым раздельным, одновременным или последовательным введением другого средства вторым способом введения; например, пероральное введение молочного жира сопровождается местным введением по меньшей мере одного дополнительного лекарственного средства.
Лекарственную форму, пригодную в рамках изобретения, можно вводить перорально в виде порошка, жидкости, таблетки или капсулы. При необходимости, подходящая лекарственная форма может содержать дополнительное средство, включая эмульсификатор, антиоксидант, ароматизирующие или красящие средства, или иметь растворяющееся в кишечнике покрытие. Подходящие растворяющиеся в кишечнике покрытия известны. Растворяющиеся в кишечнике покрытия окружают активные ингредиенты и предотвращают высвобождение активных ингредиентов в желудке, но обеспечивают высвобождение после прохождения лекарственной формы через желудок. Лекарственные формы, пригодные в рамках изобретения, можно применять для немедленного, задержанного, модифицированного, замедленного, пульсированного или контролируемого высвобождения активных компонентов. При необходимости, подходящие препараты могут содержать дополнительные средства, включая эмульсификатор, антиоксидант, ароматизирующие или красящие средства.
Капсулы могут содержать любые стандартные фармацевтически приемлемые вещества, такие как желатин или целлюлоза. Таблетки можно составлять в соответствии с общепринятыми способами, посредством прессования смеси активных ингредиентов с твердым носителем и лубрикантом. Примеры твердого носителя включают крахмал и сахар, бентонит. Активные ингредиенты также можно вводить в форме таблетки или капсулы с твердой оболочкой, содержащей связующее вещество, например лактозу или маннит, традиционный наполнитель и средство для таблетирования. Фармацевтические композиции можно также вводить парентеральным способом. Примеры лекарственных форм для парентерального введения включают растворы активного средства в воде, в изотоническом растворе или в 5% глюкозе или в другом хорошо известном фармацевтически приемлемом эксципиенте. Циклодекстрины или другие растворяющие средства, хорошо известные осведомленным в данной области, можно использовать как фармацевтические эксципиенты для доставки лекарственного средства.
Лекарственные формы для инъекций можно составлять в виде жидких растворов или суспензий. Перед инъекцией можно также получить раствор или суспензию подходящих твердых форм в жидкости. Лекарственную форму можно также получить в виде эмульсии. Молочный жир или аналог молочного жира и по меньшей мере один дополнительный фактор, если присутствует, можно смешать с носителями, такими как, например, вода, физиологический раствор, декстроза, глицерин, этанол или подобные и их сочетания.
Можно получить препараты с замедленным высвобождением, включающие молочный жир, необязательно по меньшей мере с одним дополнительным фактором. Подходящие примеры препарата с замедленным высвобождением включают полупроницаемые матрицы твердых гидрофобных полимеров, содержащие молочный жир, и по меньшей мере одно дополнительное лекарственное средство, если присутствует, такое как лактоферрин или его функциональный вариант или функциональный фрагмент. Матрица может представлять собой профилированные изделия, например пластыри или микрокапсулы. Примеры матриц с замедленным высвобождением включают полиэфиры, гидрогели (например, поли(2-гидроксиэтил-метакрилат) или поли(этенол)), полилактиды (см. US 3773919), сополимеры L-глутаминовой кислоты и этил-L-глутамата, неразлагающийся этилен-винилацетат и разлагающиеся сополимеры молочной кислоты-гликолевой кислоты, такие как LUPRON DEPOT™ (микросферы для инъекций, содержащие сополимер молочной кислоты-гликолевой кислоты и лейпролида ацетата).
Составы для местного введения, включающие молочный жир или аналог молочного жира и по меньшей мере, одно, если присутствует, дополнительное лекарственное средство, можно получать в виде лосьонов, кремов, мазей, паст или бальзамов, используя для подобного применения известные носители.
Настоящее изобретение также относится к парентеральной дозированной лекарственной форме, включающей молочный жир, необязательно по меньшей мере с одним дополнительным лекарственным средством, и по меньшей мере с одним противоопухолевым средством. Предпочтительным является по меньшей мере одно противоопухолевое средство, выбранное из паклитаксела, доксорубицина, эпирубицина, фторурацила, циклофосфамида, метотрексата, экспрессирующей плазмиды, кодирующей костимулятор Т-клеток B7-1, и терапия дендритными клетками. Альтернативно средство выбирают из любых, описываемых в настоящем документе. Предпочтительными являются молочный жир или аналог молочного жира, как описано выше.
Эффективность композиции, пригодной по изобретению, можно оценивать и in vitro, и in vivo. См., например, примеры ниже. В кратком изложении, в одном из вариантов осуществления композицию можно проверить на ее способность, например, ингибировать образование или рост опухоли in vitro. Композицией можно кормить или ее можно ввести животному (например, мыши) и затем оценить эффекты на размер или морфологию опухоли в in vivo исследованиях. Исходя из результатов, можно определить подходящий диапазон доз и способ введения.
Композиции, пригодные в рамках изобретения, можно использовать индивидуально или в комбинации с одним или несколькими другими терапевтическими средствами. Лекарственное средство может представлять собой пищевой продукт, напиток, добавку к пищевому продукту, добавку к напитку, компонент пищевого продукта, компонент напитка, диетическую пищевую добавку, питательный продукт, лечебный пищевой продукт, нутрицевтическое, лечебное или фармацевтическое. Предпочтительным является лекарственное средство, эффективное для ослабления одного или нескольких симптомов состояния, ассоциированного со злокачественной опухолью или ассоциированного с анемией, гематологической супрессией, мукозитом или кахексией, или ассоциированного с состоянием, обусловленного анемией (включая макроцитарную и микроцитарную анемию), гематологической супрессией, мукозитом или кахексией. Предпочтительное терапевтическое средство включает противоопухолевые пищевые факторы, иммунотерапевтические средства, гематопоэтические средства, противокахектические средства и средства против мукозита и особенно предпочтительным лекарственным средством является лактоферрин.
В одном из вариантов осуществления молочный жир или аналог молочного жира необязательно по меньшей мере с одним дополнительным лекарственным средством составляют для введения раздельно, одновременно или последовательно по меньшей мере с одним противоопухолевым средством или противоопухолевым лечением, описываемым в настоящем документе.
В одном из вариантов осуществления молочный жир или аналог молочного жира необязательно по меньшей мере с одним дополнительным лекарственным средством составляют для совместного введения по меньшей мере с одним противоопухолевым средством или противоопухолевым лечением, описываемым в настоящем документе.
В одном из вариантов осуществления молочный жир или аналог молочного жира необязательно по меньшей мере с одним дополнительным лекарственным средством составляют для последовательного введения по меньшей мере с одним противоопухолевым средством или противоопухолевым лечением, описываемым в настоящем документе.
В одном из вариантов осуществления молочный жир или аналог молочного жира включен или введен как адъювант противоопухолевого средства или противоопухолевого лечения, в котором молочный жир или аналог молочного жира повышает или усиливает действие эффектов противоопухолевых средств или противоопухолевого лечения. По меньшей мере одно дополнительное лекарственное средство можно вводить раздельно.
При использовании в комбинации c другим лекарственным средством композицию, пригодную в рамках изобретения, и другое лекарственное средство можно вводить одновременно или последовательно. Одновременное введение включает введение одной лекарственной формы, которая содержит все компоненты, или введение практически в одно и то же время разных лекарственных форм. Последовательное введение включает введение по различным схемам, предпочтительно так, чтобы имелись перекрывающиеся участки схемы в периоды, в течение которых предусмотрено введение композиции, пригодной в настоящем документе, и другого лекарственного средства.
Подходящие средства, с которыми могут быть введены совместно композиции по изобретению, включают химиотерапевтические средства, иммунотерапевтические средства, противокахектические средства, средства против мукозита, гематопоэтические средства и другие подходящие средства, известные в данной области. Предпочтительно подобные средства вводят парентерально, предпочтительно посредством внутривенного, подкожного, внутримышечного, интраперитонеального, интрамедуллярного, эпидурального, внутрикожного, трансдермального (местно), трансмукозального, внутрисуставного и внутриплеврального, а также перорального, ингаляционного, вагинального и ректального введения.
Дополнительно предполагается, что композицию в соответствии с изобретением можно составлять с дополнительными активными ингредиентами, которые могут быть полезны субъекту в раздельных случаях. Например, можно использовать терапевтические средства, у которых та же мишень или для различных аспектов патологического процесса.
Подходящие средства, с которыми можно совместно вводить композиции, пригодные в настоящем документе, включают антагонистов интегринового рецептора альфа v бета 3, антиэстрогены или SERMs (селективные модуляторы рецептора эстрогена) (включая в качестве неограничивающих примеров тамоксифен, ралоксифен, лазофоксифен, торемифен, азорксифен, кломифен, дролоксифен, идоксифен, левормелоксифен, зукломифен, энкломифен, нафоксидин и их соли), противорезорбтивные средства, бисфосфонаты (включая в качестве неограничивающих примеров алендронат, клодронат, этидронат, ибандронат, инкадронат, минодронат, неридронат, олпадронат, памидронат, пиридронат, ризедронат, тилудронат, золедронат и их фармацевтически приемлемые соли), антагонисты кальциевого рецептора, кальциевые пищевые добавки, ингибиторы катепсина K, средства двойного действия (DABAs) (включая в качестве неограничивающих примеров стронция ранелат), эстроген и производные эстрогена (включая в качестве неограничивающих примеров 17 бета-эстрадиол, эстрон, конъюгированный эстроген, конский эстроген и 17 бета-этинилэстрадиол), флавоноиды, фолиевую кислоту, остеоанаболические средства, остеопротогерин, прогестин и производные прогестина (включая в качестве неограничивающих примеров норэтиндрон и медроксипрогестерона ацетат), ингибиторы вакуолярных АТФаз, антагонистов VEGF, тиазолидиндионы, кальцитонин, ингибиторы протеинкиназы, паратиреоидный гормон (PTH), аналоги PTH, рекомбинантный паратиреоидный гормон, усиливающие секрецию гормона роста, гормон, высвобождающий гормон роста, инсулиноподобный фактор роста, морфогенетический белок кости (BMP), ингибиторы антагонизма BMP, производные простогландина, факторы роста фибробластов, витамин B6, витамин D, производные витамина D (включая в качестве неограничивающих примеров 1,25-дигидроксихолекальциферол), витамин K, производные витамина K, изофлавоны сои, кальциевые соли, фториды, статины (включая в качестве неограничивающих примеров ловастатин, симвастатин, правастатин, флувастатин, аторвастатин, церивастатин, розувастатин и питавастатин) и их сочетания и другие подходящие средства, известные в данной области.
В одном из вариантов осуществления композиция, пригодная в рамках изобретения, включает или введена одновременно или последовательно с другими компонентами молока, такими как белок сыворотки молока, фракции белка сыворотки молока (включая кислые или щелочные фракции белка сыворотки молока или их комбинацию), гликомакропептид, лактоферрин, витамин D или кальций или их сочетания. Пригодные композиции, содержащие компоненты молока, включают такие композиции, как пищевой продукт, напиток, добавка к пищевому продукту, добавка к напитку, диетическая пищевая добавка, питательный продукт, лечебный пищевой продукт или нутрицевтический. Для этих компонентов можно также применять обогащенные молочные фракции.
Следует понимать, что дополнительные терапевтические средства, перечисленные выше (как на основе пищевых продуктов, так и фармацевтических средств), можно также применять в способе по изобретению, где их вводят раздельно, одновременно или последовательно с композицией, пригодной в рамках изобретения.
Как будет понятно, доза введенной композиции, период введения и общий режим введения могут отличаться у субъектов в зависимости от таких показателей, как тяжесть симптомов у субъекта, вида заболевания, подлежащего лечению, выбранного способа введения и возраста, пола и/или основного заболевания субъекта. Однако, в качестве общего примера, изобретатели рассмотрели введение композиции, пригодной в рамках изобретения, которую вводили в количестве от приблизительно 1 мг до приблизительно 1000 мг на кг массы тела в сутки, предпочтительно от приблизительно 50 до приблизительно 500 мг на кг в сутки. В одном из вариантов осуществления изобретатели рассмотрели введение фармацевтической композиции, пригодной в рамках изобретения, от приблизительно 0,05 мг до приблизительно 250 мг на кг массы тела.
Следует понимать, что введение может включать одну дозу в сутки или введение ряда отдельных доз, по необходимости. Следует понимать, что специалист в данной области будет способен, без излишнего экспериментирования, исходя из данной области и этого описания, определить эффективную схему введения доз для данного состояния (включая суточную дозу и расписание введения).
Настоящее изобретение также относится к диетической, нутрицевтической или пероральной фармацевтической композиции, включающей, содержащей в основном или содержащей молочный жир или аналог молочного жира в сочетании с лактоферрином, казеином, или другим защитным белком. Предпочтительно композиция содержит в основном от приблизительно 0,1 до 99% масс. молочного жира или аналога молочного жира и от приблизительно 0,1 до 99% масс. лактоферрина, казеина или другого защитного белка. Более предпочтительна композиция, содержащая в основном от приблизительно 0,5 до 10% масс. молочного жира и от приблизительно 10 до 99% масс. лактоферрина, казеина или другого защитного белка. Наиболее предпочтительная композиция содержит в основном приблизительно 1% масс. молочного жира и приблизительно 20% масс. лактоферрина, казеина или другого защитного белка. Предпочтительными являются молочный жир или аналог молочного жира, как описано выше.
В одном из вариантов осуществления композиция по изобретению является молочной фракцией, предпочтительно фракцией молочного жира. В одном из вариантов осуществления молочная фракция включает по меньшей мере приблизительно 1, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 99% по массе молочного жира и пригодные диапазоны можно выбрать из любых этих значений (например, от приблизительно 1 до приблизительно 99% по массе, от приблизительно 5 до приблизительно 99% по массе, от приблизительно 10 до приблизительно 99% по массе, от приблизительно 15 до приблизительно 99% по массе, от приблизительно 20 до приблизительно 99% по массе, от приблизительно 25 до приблизительно 99% по массе, от приблизительно 30 до приблизительно 99% по массе, от приблизительно 35 до приблизительно 99% по массе, от приблизительно 40 до приблизительно 99% по массе, от приблизительно 45 до приблизительно 99% по массе, от приблизительно 50 до приблизительно 99% по массе, от приблизительно 55 до приблизительно 99% по массе, от приблизительно 60 до приблизительно 99% по массе, от приблизительно 65 до приблизительно 99% по массе, от приблизительно 70 до приблизительно 99% по массе, от приблизительно 75 до приблизительно 99% по массе, от приблизительно 80 до приблизительно 99% по массе, от приблизительно 85 до приблизительно 99% по массе, от приблизительно 90 до приблизительно 99% по массе, или от приблизительно 95 до приблизительно 99% по массе). Предпочтительно, композиция включает по меньшей мере одно дополнительное лекарственное средство, композиция может дополнительно содержать фракцию молочного белка.
В одном из вариантов осуществления молочный жир введен в виде фракции молочного жира. Предпочтительные фракции молочного жира включают сливки, масло, безводный молочный жир (AMF) (как правило, полученный посредством обращения фаз сливок или масла), пахту, плазму масла, твердые фракции молочного жира, мягкие фракции молочного жира, фракции сфингомиелина, фракции оболочки шариков молочного жира, фосфолипидные фракции и комплексные липидные фракции, и их комбинации и их гидролизаты и фракции гидролизатов и комбинации гидролизованных и/или негидролизованных фракций.
Предпочтительные фосфолипидные фракции можно получить разделением безводного молочного жира (такого, как имеющийся в наличии у Fonterra Co-operative Group Limited, New Zealand) посредством тонкослойной хроматографии и/или жидкостной хроматографии. Используя подобные способы разделения, можно получать желаемые фосфолипидные фракции. Например, фракции, включающие все три пика сфингомиелина, включающие фосфатидилхолин и фосфатидилинозитол в равных количествах, небольшое количество фосфатидилсерина и первый из трех пиков сфингомиелина или включающие большое количество фосфатидилэтаноламина и церамидов и лизофосфолипида, получены в рабочем порядке посредством жидкостной хроматографии. Гидролизованные формы этих фракций можно получить, например, при добавлении 1% KOH (в этаноле) и перемешивании и нагревании в течение 10 минут при pH 9,5-10,0. Предпочтительно, как правило, гидролизованные образцы нейтрализуют перед дальнейшим использованием, например, уксусной кислотой или соляной кислотой до pH 7,0 и продувают досуха в нагретом кожухе в атмосфере азота.
Доступные в продаже фосфолипидные фракции также пригодны для использования по настоящему изобретению. Предпочтительными являются фракция фосфолипидов Phospholipid Concentrate PC600™ и фракция Ganglioside G600™ (обе доступны у Fonterra Co-operative Group Limited, New Zealand), как в негидролизованной форме, так и в гидролизованной форме. И в этом случае эти фракции можно гидролизовать по способу, указанному выше.
В одном из вариантов осуществления композиция включает, содержит в основном или состоит из приблизительно 0,1, 0,5, 1, 5, 10, 15, 20, 25, 30, 35, 40, 45 или 50% по массе свежего, рекомбинированного или порошкообразного цельного молока или производного молока, предпочтительно молочного жира и пригодные диапазоны можно выбрать из любых этих значений (например, от приблизительно 0,1 до приблизительно 50%, от приблизительно 0,2 до приблизительно 50%, от приблизительно 0,5 до приблизительно 50%, от приблизительно 1 до приблизительно 50%, от приблизительно 5 до приблизительно 50%, от приблизительно 10 до приблизительно 50%, от приблизительно 15 до приблизительно 50%, от приблизительно 20 до приблизительно 50%, от приблизительно 25 до приблизительно 50%, от приблизительно 30 до приблизительно 50%, от приблизительно 35 до приблизительно 50%, от приблизительно 40 до приблизительно 50% и от приблизительно 45 до приблизительно 50%). Предпочтительным является производное молока, выбранное из рекомбинированного, порошкообразного или свежего молока, восстановленного цельного порошкового молока, концентрата молока, ретентата молока, концентрированного молока, ретентата молока, подвергшегося ультрафильтрации, молочного белкового концентрата (MPC), изолята молочного белка (MPI), молочного белкового концентрата, обедненного кальцием (MPC), казеина, казеината, молочного жира, сливок, масла, безводного молочного жира (AMF), пахты, плазмы масла, твердых фракций молочного жира, мягких фракций молочного жира, фракции сфингомиелина, фракций оболочки шариков молочного жира, фосфолипидной фракции, комплекса липидных фракций, молозива, фракции молозива, концентрата белков молозива (CPC), сыворотки молозива, фракции иммуноглобулинов из молозива, сыворотки, изолята белка сыворотки (WPI), концентрата белка сыворотки (WPC), сладкой сыворотки, сыворотки, полученной с применением молочной кислоты, сыворотки, полученной с применением неорганических кислот или восстановленной порошковой сыворотки, композиция, полученная из любой фракции переработанного молока или молозива, композиция, полученная из ретентата или пермеата, полученных посредством ультрафильтрации или микрофильтрации любой фракции переработанного молока или молозива, или композиция, полученная из фракции, не связавшейся с хроматографическим сорбентом (проскок), или адсорбированной фракции, полученных посредством хроматографического разделения любой переработанной фракции молока или молозива (включая в качестве неограничивающих примеров ионообменную и гель-проникающую хроматографию), и их комбинация и их гидролизаты и фракции гидролизатов и комбинации гидролизованных и/или негидролизованных фракций.
В одном из вариантов осуществления способ по изобретению включает введение смеси молочного жира или аналога молочного жира и лактоферрина или по меньшей мере одного функционального варианта или функционального фрагмента лактоферрина, как описано ниже. Таким образом, в одном из вариантов осуществления композиция включает смесь молочного жира или аналога молочного жира и лактоферрина или по меньшей мере одного функционального варианта или функционального фрагмента лактоферрина. В альтернативном варианте осуществления композиция включает смесь молочного жира или аналога молочного жира и по меньшей мере один функциональный фрагмент лактоферрина.
Композиции по изобретению, включающие лактоферрин или по меньшей мере один функциональный вариант или его функциональный фрагмент, также можно вводить посредством парентеральных путей введения, включая в качестве неограничивающих примеров подкожное, внутривенное, интраперитонеальное, внутримышечное и внутриопухолевое введение. Предпочтительно, лактоферрин введен парентерально, посредством инъекции. Молочный жир или аналог молочного жира можно вводить раздельно и предпочтительным является пероральное введение. Специалисты в данной области способны получить подходящие препараты для парентерального введения без излишнего экспериментирования.
В одном из вариантов осуществления суточный диапазон доз для взрослого человека массой 70 кг (посредством любого пути введения) представляет собой от приблизительно 0,001 до 250 г молочного жира в сутки, предпочтительно от 0,001 до 100 г, 0,1 до 30 г, 0,1 до 40 г, 0,1 до 50 г, 0,1 до 60 г, 0,1 до 70 г, 0,1 до 80 г, 0,1 до 100 г, 0,1 до 110 г, 0,1 до 120 г, 0,1 до 130 г, 0,1 до 140 г, 0,1 до 150 г, 0,1 до 160 г, 0,1 до 170 г, 0,1 до 180 г, 0,1 до 190 г, 0,1 до 200 г, 0,1 до 210 г, 0,1 до 220 г, 0,1 до 230 г, 0,1 до 240 г или 0,1 до 250 г в сутки, предпочтительно от 10 мг до 1,5 г/кг/сутки, предпочтительно от 50 мг до 500 мг/кг/сутки. Наиболее высокая доза является предпочтительной при кратковременном лечении и предупреждении и наименьшая доза при длительном лечении и предупреждении.
4. Полипептиды лактоферрина
Бычий лактоферрин (bLf) представляет собой одноцепочечный гликопротеин, связывающий железо, с массой 78 кДа, который присутствует в молоке коровы. Это природный белок с защитным действием, обыкновенно секретируемый для поддержания нормальной микрофлоры, присутствует в большинстве секретируемых жидкостях, включая молоко, молозиво, слезы, носовой секрет, слюну, желчь, сок поджелудочной железы, слизь кишечника и секрет половых органов. Бычий лактоферрин секретируют нейтрофилы, и он представлен на высоком уровне в очагах бактериальной инфекции. Это многофункциональный белок, который может контролировать всасывание железа в кишечнике, обеспечивать рост клеток в кишечнике, защищать от инфекции микробами, контролировать миелопоэз, контролировать системный иммунный ответ и предотвращать развитие злокачественной опухоли (рассмотрено в Ward, et al., 2002; Brock, J H, 2002; Weinburg, E D, 2001; Conneely, O M, 2001; Tomita, et al., 2002 и Tsuda, et al., 2002).
В дополнение к пригодным полипептидам лактоферрина и фрагментам, перечисленным выше, примеры аминокислотной последовательности и последовательности мРНК лактоферрина, которые опубликованы и пригодны в способах по изобретению, включают в качестве неограничивающих примеров аминокислотную (регистрационный номер NP_002334) и мРНК (регистрационный номер NM_002343) последовательности лактоферрина человека; аминокислотную (регистрационные номера NP_851341 и CAA38572) и мРНК (регистрационные номера X54801 и NM_180998) последовательности бычьего лактоферрина; аминокислотную (регистрационные номера JC2323, CAA55517 и AAA97958) и мРНК (регистрационный номер U53857) последовательности козьего лактоферрина; аминокислотную (регистрационный номер CAA09407) и мРНК (регистрационный номер AJ010930) последовательности лактоферрина лошади; аминокислотную (регистрационные номера NP_999527, AAL40161 и AAP70487) и мРНК (регистрационный номер NM_214362) последовательности лактоферрина свиньи; аминокислотную (регистрационный номер NP_032548) и мРНК (регистрационный номер NM_008522) последовательности лактоферрина мышей; аминокислотную (регистрационный номер CAA06441) и мРНК (регистрационный номер AJ005203) последовательности лактоферрина азиатского буйвола; и аминокислотную (регистрационный номер CAB53387) и мРНК (регистрационный номер AJ131674) последовательности лактоферрина верблюда. По изобретению эти последовательности можно использовать в диком типе или в форме варианта. Кодируемые этими последовательностями полипептиды можно выделить из природного источника, получить в виде рекомбинантных белков или получить посредством органического синтеза, используя известные способы.
Способы получения пригодных полипептидов и вариантов известны в данной области и обсуждаются ниже. Пригодные рекомбинантные полипептиды лактоферрина и фрагменты и способы их получения опубликованы в описаниях патентов США US 5571691, US 5571697, US 5571896, US 5766939, US 5849881, US 5849885, US 5861491, US 5919913, US 5955316, US 6066469, US 6080599, US 6100054, US 6111081, US 6228614, US 6277817, US 6333311, US 6455687, US 6569831, US 6635447, US 2005-0064546 и US 2005-0114911.
Пригодные варианты также включают варианты бычьего лактоферрина bLf-a и bLf-b (Tsuji, et al. (1989); Yoshida, et al. (1991)). Дополнительные пригодные варианты включают гликозилированные и негликозилированные формы лактоферрина (Pierce, et al. (1991); Metz-Boutigue, et al. (1984); van Veen, et al. (2004)) и гликозилирование мутантов (с вариантом центров гликозилирования или вариантом гликозидных остатков боковых цепей).
Пригодные фрагменты включают фрагменты N-доли и C-доли (Baker, et al., 2002) и любые другие полипептиды лактоферрина, которые сохраняют центр связывания лактоферрина, такие как укороченные полипептиды лактоферрина. Другие фрагменты лактоферрина описаны в опубликованной международной патентной заявке WO2007/043900, которая включена в настоящий документ в качестве ссылки.
Пригодные укороченные полипептиды лактоферрина включают полипептиды, укороченные от приблизительно 1 до приблизительно 300 аминокислот, предпочтительно приблизительно на 1, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 105, 110, 115, 120, 125, 130, 135, 140, 145, 150, 155, 160, 165, 170, 175, 180, 185, 190, 195, 200, 205, 210, 215, 220, 225, 230, 235, 240, 245, 250, 255, 260, 265, 270, 275, 280, 285, 290, 295 или 300 аминокислот или более, и включают полипептиды, укороченные с N-конца, с C-конца или и с N- конца и C-конца, при условии сохранения в укороченном полипептиде по меньшей мере одного из центров связывания ионов металлов N-доли или C-доли. Сообщают, что лигандами ионов металлов в N-доле являются остатки аминокислот Asp 60, Tyr 92, Tyr 192 и His 253 бычьего лактоферрина (без сигнальной последовательности). Сообщают, что лигандами ионов металлов в C-доле являются остатки аминокислот Asp 395, Tyr 433, Tyr 526 и His 595 бычьего лактоферрина (без сигнальной последовательности) (Karthikeyan, et al., 1999).
Подходящие варианты или фрагменты лактоферрина для использования по настоящему изобретению можно получить способами, включая в качестве неограничивающих примеров, способы внесения изменений в белки дикого типа (см. Sambrook, et al. (1989) и в другом месте обсуждения таких способов), такие как, но не ограничивающиеся этими, сайт-специфический мутагенез лактоферрина дикого типа и экспрессия полученных полинуклеотидов; способы для получения экспрессирующих фрагментов полинуклеотида, такие как ПЦР с использованием группы случайных или подобранных праймеров; способы полного или частичного протеолиза или гидролиз дикого типа лактоферрина или варианта полипептидов лактоферрина; и способы химического синтеза полипептидов. Варианты или фрагменты лактоферрина можно получать посредством экспрессии с рекомбинантных молекул ДНК или РНК из лактоферрина или из его вариантов или фрагментов. Последовательности нуклеиновых кислот, кодирующих варианты или фрагменты лактоферрина, можно вставить в подходящий вектор для экспрессии в клетках, включая эукариотические клетки, такие как Aspergillus, но не ограниченные ими, или бактериальные клетки, такие как E. coli, но не ограниченные ими. Варианты или фрагменты лактоферрина можно получать, используя известные способы ПЦР, включая в качестве неограничивающих примеров допускающую ошибки ПЦР и перестановки в ДНК. Допускающая ошибки ПЦР представляет собой способ проведения ПЦР в условиях, при которых копирование ДНК полимеразой представлено с низкой точностью, так что имеет место высокий показатель точечных мутаций вдоль полноразмерного продукта ПЦР (Leung, et al. (1989); Cadwell, et al. (1992)). Перестановка ДНК относится к направленной гомологичной рекомбинации in vitro между молекулами ДНК с различной, но высокогомологичной последовательностью ДНК на основе гомологии последовательности, вызванной случайной фрагментацией молекулы ДНК, с последующей фиксацией кроссинговера посредством достройки праймера в реакции ПЦР (Stemmer (1994)). Подходящие для применения в подобных способах последовательности нуклеиновой кислоты лактоферрина включают перечисленные выше или могут быть получены известными способами, включая, например, ПЦР с обратной транскрипцией (ОТ-ПЦР) на РНК, выделенных из тканей. Подходящие праймеры для ОТ-ПЦР можно рассчитать, основываясь на мРНК последовательности, перечисленные выше. В продаже доступны наборы для ОТ-ПЦР (например, наборы Cells-to-cDNA™ у Ambion, USA).
Варианты или фрагменты лактоферрина можно также получить известными синтетическими способами (см. Kimmerlin, et al., 2005, например).
Варианты, связывающие ионы металлов или фрагменты лактоферрина, можно получить посредством известных способов выделения полипептидов, связывающих металлы, включая в качестве неограничивающих примеров металлоаффинную хроматографию, например. Подходящие варианты или фрагменты лактоферрина могут быть связаны со свободными или иммобилизованными ионами металлов, такими как Fe, и очищены подходящим способом. Например, подходящие варианты или фрагменты могут взаимодействовать при нейтральной pH с ионами металлов, иммобилизованных посредством образования хелатных связей с матрицей для хроматографии, включающей лиганды, иминодиуксусную кислоту или трис(карбоксиметил)этилендиамин. Связанные варианты или фрагменты можно элюировать из несущей матрицы и собрать, уменьшая pH и ионную силу примененного буферного раствора. Варианты, связывающие ионы металлов или фрагменты, можно получать по способам, описанным выше и ниже и описанным в примерах ниже.
Функциональные варианты, фрагменты и гидролизаты лактоферрина можно получить, выбирая варианты, фрагменты и гидролизаты лактоферрина и оценивая их эффективность в способах по настоящему изобретению, применяя методологию, изложенную в примерах, описанных ниже.
В одном из вариантов осуществления лактоферрин представляет собой любой лактоферрин млекопитающих, включая в качестве неограничивающих примеров овцу, козу, свинью, мышь, азиатского буйвола, верблюда, яка, лошадь, осла, ламу, бычий или человеческий лактоферрин. Предпочтительным лактоферрином является лактоферрин быка.
В другом варианте осуществления лактоферрин представляет собой любой рекомбинантный лактоферрин млекопитающего, включая в качестве неограничивающих примеров рекомбинантный лактоферрин овцы, козы, свиньи, мыши, азиатского буйвола, верблюда, яка, лошади, осла, ламы, быка или человека. Предпочтительный лактоферрин представляет собой рекомбинантный бычий лактоферрин. Рекомбинантный лактоферрин можно получить посредством экспрессии в бесклеточных системах экспрессии или в трансгенных животных, растениях, грибах или бактериях или других пригодных видах.
В еще одном варианте осуществления лактоферрин выделен из молока, предпочтительно овцы, козы, свиньи, мыши, азиатского буйвола, верблюда, яка, лошади, осла, ламы, коровы или молока человека. Предпочтительным является лактоферрин, выделенный из молока посредством катионообменной хроматографии с последующими ультрафильтрацией и диафильтрацией.
5. Выделение лактоферрина из молока
Следующим представлен иллюстративный способ выделения лактоферрина из молока коровы. Свежее обезжиренное молоко (7 л, pH 6,5) пропущено через 300 мл колонку с сорбентом S Sepharose Fast Flow, уравновешенную водой, которая очищена системой milli Q, со скоростью потока 5 мл/мин и при 4°C. Несвязанный белок промыт водой 2,5 объема слоя и связанный белок элюирован ступенчато, каждым из 0,1 M, 0,35 M и 1,0 M хлорида натрия, приблизительно 2,5 объема слоя. Лактоферрин, элюирующийся в виде неяркой розовой полосы в 1 M хлориде натрия, собран в виде одной фракции и диализован против воды milli Q с последующей лиофилизацией. Лиофилизированный порошок растворен в 25 мМ натрий-фосфатном буфере, pH 6,5, и подвергнут повторной хроматографии на S Sepharose Fast Flow в градиенте хлорида натрия до 1 M в буфере, указанном выше, и со скоростью потока 3 мл/мин. Фракции, содержащие лактоферрин надлежащей чистоты, которую определили электрофорезом в геле и ВЭЖХ с обращенной фазой, объединены, диализованы и лиофилизованы. Последнюю стадию очищения лактоферрина завершили посредством гель-фильтрации на Sephacryl 300 в 80 мМ дикалия фосфата, pH 8,6, содержащего 0,15 M хлорида калия. Выбранные фракции объединены, диализованы против воды milli Q и лиофилизованы. Степень чистоты при таком способе получения формы лактоферрина, насыщенной железом, составляет больше чем 95%, на что указывает ВЭЖХ анализ и спектральное отношение (280 нм/465 нм), равное ~19 или меньше.
Другие иллюстративные способы выделения пригодных фракций молока, включающих лактоферрин, представлены в патенте US № 5932259 to Kato et al. и патенте US № 5976597 to Takada et al.
6. Насыщенный ионами металлов или ненасыщенный лактоферрин
Насыщения железом достигают посредством добавления 5 мМ нитрилотриацетата железа в молярном избытке 2:1 (Foley и Bates (1987)) к 1% раствору очищенного лактоферрина в 50 мМ Tris, pH 7,8, содержащем 10 мМ бикарбоната натрия. Избыточный нитрилотриацетат железа удаляют посредством диализа против 100 объемов воды milli Q (обновляемой дважды) в общей сложности в течение 20 часов при 4°C. Насыщенный железом (холо-) лактоферрин можно затем лиофилизовать. Различные степени насыщения железом можно получить посредством предоставления меньшего количества доноров ионов металлов, как описано в примерах ниже. Другой способ получения лактоферрина, содержащего ионы металла, опубликован в опубликованной международной патентной заявке WO 2006/132553, которая включена, таким образом, в качестве ссылки. Способ сохранения или улучшения качества композиции лактоферрина с ионами металла при хранении опубликован в опубликованной международной патентной заявке WO 2006/096073, которая включена, таким образом, в качестве ссылки.
Ненасыщенный железом (апо) лактоферрин получают посредством диализа 1% раствора высокоочищенного образца лактоферрина в воде против 30 объемов 0,1 M лимонной кислоты, pH 2,3, содержащей 500 мг/л двунатриевой ЭДТА, в течение 30 ч при 4°C (Masson и Heremans (1966)). Цитрат и ЭДТА затем удаляют посредством диализа против 30 объемов воды milli Q (обновляли один раз) и результирующий бесцветный раствор можно лиофилизовать.
Полипептид лактоферрина может содержать ион железа (как и встречающийся в природе полипептид лактоферрина) или ион другого металла (например, ион меди, ион хрома, ион кобальта, ион марганца или ион цинка). Например, лактоферрин, полученный из молока коровы, можно лишить железа и затем наполнить другим типом иона металла. Например, по тому же способу насыщения железом, описанным выше, можно выполнить насыщение медью. Для насыщения лактоферрина другими ионами металлов можно использовать способ Ainscough, et al. (1979).
В одном из вариантов осуществления ион металла выбран из группы, включающей алюминий, висмут, медь, хром, кобальт, золото, железо, марганец, осмий, платину, рутений, цинк или другие ионы, которые могут определенным образом устанавливать правильные соотношения в центре связывания ионов металла лактоферрина. Предпочтительным ионом металла является ион железа.
В составе композиции для использования по изобретению полипептид лактоферрина или фрагмент лактоферрина, связывающего ионы металла, могут быть одного вида или разных видов. Например, каждые полипептиды или фрагменты могут содержать разное число ионов металлов или разные виды ионов металлов; или длины полипептидов могут варьировать, например, некоторые являются полноразмерными полипептидами, а некоторые представляют собой фрагменты, и каждые фрагменты могут представлять раздельный участок полноразмерного полипептида. Такой состав можно получать из природного источника или при смешивании разных видов полипептидов лактоферрина. Например, смесь полипептидов лактоферрина разных длин можно получить посредством протеиназного расщепления (полного или частичного) полноразмерных полипептидов лактоферрина. Степень расщепления можно регулировать согласно способам, хорошо известным в данной области, например, варьируя количество протеиназы или время инкубации, и способами, описанными ниже. При полном расщеплении получают смесь разнообразных фрагментов полноразмерных полипептидов лактоферрина; при частичном расщеплении получают смесь полноразмерных полипептидов лактоферрина и различных фрагментов.
7. Получение фрагментов лактоферрина или гидролизатов лактоферрина
Пригодные фрагменты лактоферрина описаны в опубликованных международных патентных заявках WO 2006/054908 и WO 2007/043900, каждая из которых включена в настоящий документ в полном объеме. Гидролизаты, содержащие подходящие функциональные фрагменты, можно получить, подбирая подходящие ферменты с известной специфичностью расщепления, такие как трипсин или химотрипсин, и регулированием/ограничением протеолиза посредством pH, температуры, временем инкубации и соотношения фермента к субстрату. Обработку подобных выделенных пептидов можно сделать, используя специфичные эндопептидазы. Как, например, бычий лактоферрицин можно получить посредством расщепления бычьего лактоферрина пепсином при pH 2,0 в течение 45 мин при 37°C (Facon & Skura, 1996) или при pH 2,5, 37°C в течение 4 ч, используя фермент в виде 3% (масс./масс. субстрата) (Tomita et al., 1994). Пептид можно затем получить в чистом виде посредством ВЭЖХ с обращенной фазой (Tomita et al., 1994) или хроматографией на основе гидрофобных взаимодействий (Tomita et al., 2002).
Альтернативно, пептиды лактоферрина можно получить посредством общепринятой синтетической химии Fmoc, как описывается для калиоцина-1 человека (NH2-FFSASCVPGADKGQFPNLCRLCAGTGENKCA-COOH) и производного пептида лактоферрицина (NH2-TKCFQWQRNMRKVRGPPVSCIKR-COOH) у Viejo-Diaz et al., (2003); и бычьего пептида лактоферрицина (NH2-RRWQWRMKKLG-COOH), как описано в Nguyen et al., (2005); и лактоферрампина (NH2-WKLLSKAQEKFGKNKSR-COOH) и более коротких фрагментов, как описано в van der Kraan et al., (2004).
В основном, для оценки степени гидролиза посредством сравнения молекулярных масс гидролизата и контроля можно использовать ДСН-ПААГ (SDS-PAGE). Эксклюзионную хроматографию можно использовать для разделения в гидролизате различных фракций и для оценки профиля молекулярно-массового распределения.
В предпочтительном гидролитическом способе бычий лактоферрин растворяли до 20 мг/мл в 50 мМ Tris pH 8,0, 5 мМ CaCl2. Добавляли трипсин (Sigma T8642, обработанный TPCK, Type XII из бычьей поджелудочной железы, 11700 ед./мг белка) в фермент-субстратном соотношении 1:50 масс./масс. и смесь инкубировали при 25°C в течение 3 ч. Реакцию останавливали добавлением PMSF до конечной концентрации 1 мМ и следили за степенью расщепления посредством ДСН-ПААГ. Расщепленный трипсином образец (4 мл) подвергали гель-фильтрации на Sephacryl S300 (Amersham GE) (колонка 90 см × 2,6 см) в 50 мМ Tris, 0,15 М NaCl с pH 8,0. Подходящие фракции, содержащие большее количество фрагментов бычьего лактоферрина (Legrand et al., 1984), подвергали затем катионообменной хроматографии на S Sepharose fast Flow (Amersham GE) (колонка 15 см × 1,6 см), используя натрий-фосфатный буфер с pH 6,5 и градиент соли до 1 М NaCl. Заключительного разделения C доли и N+C долей достигали посредством дополнительной гель-фильтрации на Sephacryl S300, как описано выше, но с использованием 10% об./об. уксусной кислоты в качестве элюента (Mata et al., 1994). Идентичность диализованных (против воды milli-Q) и лиофилизованных фрагментов подтверждали посредством ДСН-ПААГ и секвенированием N-конца способом Edman.
В другом способе трипсиновое расщепление, такое как выше, разделяли посредством ВЭЖХ с обращенной фазой на колонке Vydac C18, также как у Superti et al., (2001), и собирали фрагменты с большой массой, соответствующие фрагментам C-доли и фрагментам N-доли. Идентичность подтверждали посредством MALDI MS.
В одном из вариантов осуществления гидролизаты, пригодные в настоящем документе, содержали один или несколько функциональных фрагментов.
8. Противоопухолевые пищевые факторы
Противоопухолевые компоненты пищевых продуктов рассмотрены в Park, et al., 2002 и Kris-Etherton, 2002.
В одном из вариантов осуществления противоопухолевый фактор пищевого продукта выбран из витамина D (включая витамин D1 [люмистерин], витамин D2 [кальциферол или эргокальциферол], витамин D3 [холекальциферол], витамин D4 [22-дигидроэргокальциферол] и витамин D5 [ситокальциферол] и витамин D5 [7-дегидроситостерол]), аналогов витамина D (включая в качестве неограничивающих примеров упоминаемые ниже), соевого белка, одного или нескольких компонентов соевых бобов (включая те, которые выбраны из группы, включающей, но не ограничивающейся омега-3 жирными кислотами из сои, изофлавонами сои (например, генистеин и/или даидзеин) и пептидами лунасина (такими, как описаны в патентах США US 6107287 и US 6544956, которые включены в настоящий документ в качестве ссылки, и те, которые имеют регистрационные номера AAE49016, AAE49017, AAP62458 и AAP62459)), полифенолов (из зеленого или черного чая, например), ликопина (или томатного сока, например), пшеничных отрубей, флавоноидов (или яблочного сока, например), инозитолов, ресвератролов (или виноградного сока, например), прополиса, вытяжки из грибов, антоцианинов (или ягодного сока, например), миндаля, женьшеня, гидролизата казеина и их комбинации.
Примеры соединений витамина D, пригодных в рамках изобретения, включают в качестве неограничивающих примеров кальцитриол (1-альфа,25-дигидрокси[1,25(OH)2D3]; 1,25-дигидроксихолекальциферол), 1,25-дигидроксиэргокальциферол, кальцифедиол (25-гидроксихолекальциферол), 25-гидроксиэргокальциферол, эргокальциферол (и его предшественник эргостерол), холекальциферол (и его предшественник 7-дегидрохолестерол), доксеркальциферол, дигидротахистерол, паракальцитол, сеокальцитол [EB 1089; 1(S),3(R)-дигидрокси-20(R)-(5'-этил-5'-гидроксигепта-1'(E),3'(E)-диен-1'-ил)-9,10-секопрегна-5(Z),7(E),10(19)-триен)], а также производные аналогов, гомологов, предшественников и их метаболитов.
В одном из вариантов осуществления противоопухолевый фактор пищевых продуктов выбран из группы, включающей противоопухолевые пищевые продукты и противоопухолевые компоненты пищевых продуктов.
В одном из вариантов осуществления функциональные пищевые продукты или их производные, которые обладают свойствами, направленными против злокачественных опухолей, могут быть противоопухолевыми пищевыми продуктами, включая фрукты, овощи, бобовые, орехи, семечки, зерна, пряности, травы, грибы, пробиотики, яблоки, абрикосы, фасоль (например, зеленая фасоль, черная фасоль), нут, ягоды (например, черника, малина), овощи из семейства крестоцветных (например, брокколи, брюссельская капуста, капуста, цветная капуста, браунколь, капуста листовая, кольраби, китайская капуста, редька, горчица и турнепс), морковь, сыр, продукты из кукурузы, клюква, баклажан, льняное семя, овощи семейства луковых [например, чеснок, лук, весенний лук (лук-перо), шнит-лук, порей, шалот], имбирь (включая компоненты имбиря гингерол, парадол и бета-элемен), женьшень, грейпфрут, виноград, виноградный сок, зеленый или черный чай, хрен, киви, батат, порей, лимоны, лайм, фрукт нони, лук, апельсины, арахис, перцы, продукты из ржи, лосось, продукты из соевого молока, соевые орехи, соевые бобы, тыква, мандарины, томаты, продукты из пшеничных отрубей, рис, папайю, азимину, персики, хурму, клубнику, листья таро, зеленые бананы, манго, кресс водяной, ямс, миндаль и их комбинации.
В одном из вариантов осуществления противоопухолевый компонент пищевых продуктов можно выбрать из группы, включающей белок сои, один или несколько компонентов соевых бобов (включая те, которые выбраны из группы, включающей но не ограничивающейся омега-3 жирными кислотами из сои, изофлавонами сои (например, генистеин и/или даидзеин) и пептидами лунасина (таких, как описаны в патентах США US 6107287 и US 6544956, которые включены в настоящий документ в качестве ссылки, и те, которые имеют регистрационные номера AAE49016, AAE49017, AAP62458 и AAP62459)), хрящ акулы, вытяжку из чеснока, пищевую добавку с селеном, вытяжку из чая (например, полифенолы/катехины/эпигалокатехин галлат зеленого или черного чая), куркуминоиды, кофеин, карнозную кислоту, капсаицин, сесквитерпен лактоны (например, партенолида, костунолида, йомогина), котиленин A, гумулон, аргинин, глутамин, ретиноиды из зеленых овощных листьев, порошок какао, ликопин, глюкозинолат из овощей семейства крестоцветных, органические соединения серы (аллицин, диаллил сульфид, диаллил дисульфид, аллил меркаптан), N-ацетил цистеин, соединений лука, каротиноидов (включая в качестве неограничивающих примеров (β-каротин), кумарины, пищевые волокна, дитиолтионы, флавоноиды (например, мирицетин, кверцетин, рутин), индолы, инозитол, инозитол гексафосфат, изофлавоны сои (например, генистеин, даидзеин), изотиоцианаты, монотерпены (например, лимонен, перилловая кислота, метол, карвеол), пшеничные отруби, дитерпеновые сложные эфиры, полифенолы, рибофлавин-5'-фосфат, коричный альдегид, ванилин, оксикумарин, фенолы (например, коричная кислота), полифенолы, растительные стеролы (например, ситостанол, стигмастерол, кампестерол), ацилгликозилстеролы, фитостероиды, ингибиторы протеаз, сапонины, изопреноиды, терпеноиды, токотриенолы, ретиноиды, эллаговая кислота, полиамины, ресвератрол, гидроксикоричные кислоты [например, (E)-феруловая кислота и (E)-п-кумаровая кислота], хлорофиллин, прополис и некоторые его компоненты (например, кофеиновая кислота, фениловые сложные эфиры, артеллипин С), красное вино, таниновая кислота, вытяжки из грибов, антоцианы (например, цианидины), грибы (β-глюканы) (например, лентинан), вытяжки из листьев шпината, смесь природных антиоксидантов из листьев шпината, сок нони, витамины A, B6, C и E, вытяжка из кассии сиамской, вытяжка из свеклы обыкновенной, вытяжки из лимонного сорго и бамбукового сорго, карнозная кислота, капсаицин, сесквитерпен лактоны (например, партенолид, костунолид, йомогин), котиленином A, гумулоном и омега-3 жирные кислоты (включая эйкозапентаеновую кислоту (EPA) и докозагексаеновую кислоту (DHA)) и их комбинации.
В одном из вариантов осуществления противоопухолевый компонент пищевых продуктов выбран из группы, включающей витамин D, витамин B6, таурин, аргинин, глутамин, α-лактальбумин, сыворотку молозива, полные или частичные гидролизаты казеина, пептид(ы) казеина, известные как иммуностимуляторные (например, иммуноказокинины, казеинофосфопептиды, казоморфины, казокинин), пептиды молозива, молозиво, кальций и фосфат кальция, фолат, протеины молока, богатые цистеином, лактопероксидазу, HAMLET (комплекс α-лактальбумина и олеиновой кислоты), фрагменты плазминогена, просапосин, сапосины, каталазу, лактопероксидазу, белок, связывающий жирные кислоты, рибонуклеазу, ингибитор бета-глюкуронидазы, РАЗВ.CA1, РАЗВ.CA2, CD36, интерферон, фактор некроза опухоли, интерлейкин 2 (IL-2), кининоген и фрагменты, кининостатин, цистатин, фетуин, дефензины нейтрофилов, интерлейкин 12 (IL-12), хитиназоподобные белки, дистрогликаны, простазин, SPARC-подобные белки и тромбоспондин или их сочетание.
Белок сои
Сою уже продвигали как средство, которое способствует сохранению здорового сердца и здоровых костей, предотвращает развитие злокачественной опухоли и облегчает симптомы менопаузы (Kerwin, 2004). Противораковые эффекты сои связаны с соевым белком, который представляет собой белок с более низким содержанием серосодержащих аминокислот, чем у белков животных, и, как было показано, ингибирует развитие опухолей у животных, вызванное действием канцерогена. Другие компоненты сои с противораковым действием включают ингибиторов протеаз, изофлавоны, такие как генистеин, которые могут иметь противораковые или предраковые эффекты и сапонины.
Витамин D и лиганды рецептора витамина D
Широко описаны противораковые свойства витамина D (Harris, et al., 2004). Кроме того, полагают, что витамин D снижает риск развития не только злокачественной опухоли, но и многих распространенных и тяжелых заболеваний, включая диабет 1 типа, рассеянный склероз, сердечно-сосудистое заболевание и остеопороз (Holick, 2004). Молочные продукты являются основным пищевым источником витамина D в странах, таких как Новая Зеландия, где молоко и другие молочные продукты обогащены витамином D. Витамин D3 представляет собой 25-гидроксилированный в печени и преобразованный в почках и периферических органах в активную гормональную форму 1-альфа,25-дигидрокси [1,25(OH)2D3] (кальцитриол), который влияет на множество процессов, связанных c ростом и развитием клетки. Он оказывает антипролиферативные эффекты на клетки опухоли посредством блокирования фазы G0/G1 клеточного цикла, что приводит к подавлению факторов, стимулирующих рост, таких как IGF-1, и активирует регуляторы роста с ингибирующим действием, такие как трансформирующий фактор роста бета. Он обуславливает апоптоз опухоли и является ингибитором ангиогенеза и метастазирования опухоли (Nakagawa, et al., 2005). Введение активного метаболита 1,25(OH)2D3 в дозах, необходимых для ингибирования роста опухоли, связано с токсичностью, вызванной гиперкалиемией. Как было описано, синтетические структурные аналоги 1,25(OH)2D3, которые не вызывают гиперкалиемию, ингибируют рост опухоли и приводят к регрессии опухолей в моделях на животных (Colston, et al., 2003; Nolan, et al., 1998; van Weelden, et al., 1998). Противораковая активность лигандов рецептора витамина D (VDR) была показана на моделях карциномы мочевого пузыря, молочных желез, толстого кишечника, эндометрия, почек, легких, поджелудочной железы, предстательной железы, саркомы мягких тканей и кости, нейробластомы, глиомы, меланомы, плоскоклеточной карциномы (SCC) и других (Beer, et al., 2004).
В I фазе клинических исследований показали, что введение дозы периодически, раз в неделю, позволяет существенно увеличить дозу и получить потенциальный терапевтический пик концентрации кальцитриола (Beer, et al., 2001). Во II фазе исследований описали уровни, способствующие противоопухолевой активности для комбинации высокой дозы 1α,25-дигидрокси витамина D и доцетаксела, вводили по еженедельной схеме субъектам с андроген-независимым раком предстательной железы (Beer, et al., 2003).
В ряде исследований показали, что суточное потребление 10,000 МЕ является безопасным для человека (в отсутствие солнца). В большинстве случаев токсичность витамина D, как описано, проявляется после приема внутрь в сутки больше чем 50,000 МЕ в течение нескольких лет. Некоторые приводят доводы, что витамин D не является очень токсичным (Saul, 2003).
Соединения, которые действуют как лиганды рецептора витамина D (VDR) и которые могут быть пригодными в рамках изобретения, как правило, разделены на три класса: (1) "дельтаноиды", которые имеют секостероидную каркасную структуру, (2) "псевдо-секостероиды", которые имеют A-кольцо витамина D, но одно C или D кольцо разомкнуто, и (3) "не-секостероиды", которые по своей структуре являются отличными от секостероидов. Для обзора пригодных аналогов витамина D см. Guyton, et al., 2003; Guyton, et al., 2001; Peleg, et al., 2003; и Yee, et al., 2005.
Пригодные аналоги витамина D описаны в международной заявке PCT/NZ2007/000389 (и цитируемые в ней ссылки), включенной в настоящий документ в полном объеме.
Оценку этих аналогов в способе по изобретению можно выполнить посредством следующих протоколов, описанных в примерах ниже.
9. Иммунная стимуляция
Авторы настоящего изобретения нашли, что молочный жир, необязательно по меньшей мере с одним дополнительным лекарственным средством, способен стимулировать и усиливать иммунную систему. В частности, как показано в примерах ниже, молочный жир, необязательно по меньшей мере с одним дополнительным фактором, способен стимулировать образование антигенспецифичной цитолитической активности (активности иммунных клеток, особенно цитотоксических T-лимфоцитов) и/или активность NK клеток, улучшать клеточный иммунный ответ на антигены (через активность по меньшей мере цитотоксических T-лимфоцитов), улучшать иммунную защиту (посредством по меньшей мере восстановления активности цитотоксических T-лимфоцитов и/или NK клеток и повышения продукции цитокинов), восстанавливать иммунную защиту (посредством по меньшей мере восстановления или стимулирования активности цитотоксических T-лимфоцитов и/или активности NK клеток и повышения продукции цитокинов) и производства провоспалительных и иммунорегуляторных медиаторов (цитокины Th1 и Th2). Полагают, что любой функциональный вариант молочного жира, включая фракции молочного жира и т.п., в комбинации или не в комбинации по меньшей мере с одним дополнительным лекарственным средством, будет показывать активность, аналогичную молочному жиру. Аналогично, полагают, что когда лактоферрин подлежит введению, любой функциональный вариант или функциональный фрагмент лактоферрина будет показывать активность, аналогичную лактоферрину.
Как показано в примерах ниже, молочный жир эффективен для увеличения образования антигенспецифичной цитолитической активности и/или активности NK клеток, усиления клеточного иммунного ответа на антигены, усиления иммунной защиты и восстановления иммунной защиты.
Таким образом, настоящее изобретение относится к способу стимулирования иммунной системы субъекта, включающему введение молочного жира или аналога молочного жира субъекту, необязательно по меньшей мере с одним дополнительным лекарственным средством, таким как один или несколько противоопухолевых средств. Настоящее изобретение также относится к способам повышения продукции цитокинов Th1 и Th2 в опухоли субъекта, повышения продукции цитокинов Th1 и Th2 в кишечнике субъекта, повышения уровня цитокинов Th1 и Th2 в системе кровообращения субъекта и повышения противоопухолевого иммунного ответа у субъекта.
В одном из вариантов осуществления этих способов по изобретению субъект проходит или будет проходить лечение от злокачественной опухоли, как описано выше.
В одном из вариантов осуществления субъект прошел лечение, но у него произошел рецидив или восприимчив к рецидиву. В одном из вариантов осуществления субъект имеет опухоль, невосприимчивую к терапии химиотерапевтическим, антиангиогенным или иммунотерапевтическим средством. В одном из вариантов осуществления субъект ранее проходил безуспешное лечение химиотерапевтическим, антиангиогенным или иммунотерапевтическим средством.
В одном из вариантов осуществления цитокин Th1 выбран из IL-18, TNF-α и IFN-γ. В одном из вариантов осуществления цитокин Th2 выбран из IL-4, IL-5, IL-6 и IL-10. В одном из вариантов осуществления уровень Th1 или Th2 цитокинов увеличен по меньшей мере приблизительно на 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750 или 800%.
При необходимости, эти способы можно комбинировать со способами лечения, применяя любое одно или несколько противоопухолевых средств (включая химиотерапевтические средства или иммунотерапевтические средства) или противоопухолевые способы лечения, описанные ниже.
10. Предупреждение злокачественной опухоли
Авторы настоящего изобретения обнаружили, что молочный жир и индивидуально, и в комбинации по меньшей мере с одним дополнительным лекарственным средством может ингибировать образование опухоли и ингибировать рост опухоли и ингибировать метастазирование опухоли. Молочный жир, индивидуально или в комбинации с лактоферрином и особенно с лактоферрином, содержащим ион металла, высвобождает или стимулирует высвобождение противоопухолевых факторов, таких как T-клетки и/или NK клетки (природные киллеры), и факторов, вызывающих апоптоз, внутрь системы кровоснабжения, стимулирует противоопухолевую иммунологическую активность и проявляет иммуностимулирующую активность, антиангиогенную активность и прямую опухолевую цитотоксичность и способен вызывать апоптоз опухолевых клеток, как показано в примерах ниже. Полагают, что любой функциональный вариант молочного жира, или фракции молочного жира, или аналога молочного жира будет показывать активность, аналогичную молочному жиру.
Настоящее изобретение полезно для предупреждения злокачественной опухоли, особенно для предотвращения рецидива (роста опухоли) после хирургического вмешательства, который часто возникает из-за роста и пролиферации вторичных опухолей, предотвращения распространения опухоли после ее диагностирования и подготовки субъекта для введения противоопухолевого средства или противоопухолевого лечения.
Твердые опухоли должны сформировать новые кровеносные сосуды, прежде чем будут способны расти за пределы определенного размера. Таким образом, ингибирование ангиогенеза, особенно ангиогенеза опухоли (образование кровеносных сосудов для кровоснабжения опухолей), имеет очевидные области применения при лечении злокачественных опухолей (Dass, 2004). Как показано в примерах ниже, перорально вводимый молочный жир, как индивидуально, так и в комбинации с лактоферрином и особенно с лактоферрином, содержащим ион металла, способен достоверно снижать число сосудов и достоверно уменьшать кровоток в опухолях.
Ингибирование ангиогенеза также находит применения в других заболеваниях, включая в качестве неограничивающих примеров сердечно-сосудистые заболевания (атеросклероз и рестеноз, например), хроническое воспаление (ревматоидный артрит, остеоартрит и болезнь Крона, например), диабет (диабетическая ретинопатия), псориаз, эндометриоз, дегенерацию желтого пятна и ожирение. Таким образом, молочный жир или аналог молочного жира, предпочтительно в комбинации, более предпочтительно по меньшей мере с одним дополнительным лекарственным средством, лактоферрин или функциональный вариант или его функциональный фрагмент и особенно содержащий ион металла лактоферрин, имеют применение за рамками лечения и предупреждения злокачественных опухолей.
Аналогично, перорально вводимый молочный жир или аналог молочного жира, как индивидуально, так и в комбинации по меньшей мере с одним дополнительным лекарственным средством, таким как лактоферрин и особенно содержащим ион металла лактоферрин, способен вызывать апоптоз опухолевых клеток, как показано в примерах ниже. Примеры также показывают, что апоптотические факторы обнаружены в сыворотке крови мышей, которых содержали на лактоферрине, содержащем ион металла.
Таким образом, настоящее изобретение также относится к способам ингибирования образования опухоли у субъекта, стимуляции апоптоза у субъекта, стимуляции апоптоза опухолевых клеток у субъекта и ингибирования опухолевого ангиогенеза у субъекта, включающим введение субъекту лактоферрина или функционального варианта, содержащего ионы металла или его функционального фрагмента.
Настоящее изобретение также относится к способу сохранения или повышения уровня противоопухолевых факторов в системе кровоснабжения.
В одном из вариантов осуществления субъект подвержен образованию злокачественной опухоли. В одном из вариантов осуществления субъект имеет опухоль, невосприимчивую к лечению химиотерапевтическим, антиангиогенным или иммунотерапевтическим средством. В одном из вариантов осуществления субъект ранее проходил безуспешное лечение химиотерапевтическим, антиангиогенным или иммунотерапевтическим средством.
При необходимости, эти способы можно комбинировать со способами лечения, применяя любое одно или несколько противоопухолевых средств (включая химиотерапевтические средства или иммунотерапевтические средства) или противоопухолевые способы лечения, описанные ниже.
11. Лечение и предупреждение злокачественных опухолей способами комбинированного лечения
Авторы настоящего изобретения обнаружили, что молочный жир способен ингибировать рост опухоли и ингибирует опухолевое метастазирование. Молочный жир действует синергично с иммунотерапией (включая ту, которая опосредована переносом гена B7-1 внутрь опухоли), с химиотерапией (включая паклитаксел, доксорубицин, эпирубицин или фторурацил) или терапией дендритными клетками для ликвидации опухолей в значительной степени. Молочный жир способен действовать синергично с химиотерапией (включая паклитаксел, доксорубицин, эпирубицин, фторурацил, циклофосфамид или метотрексат), чтобы ингибировать рост и метастазирование опухоли. Полагают, что любой функциональный вариант молочного жира, включая фракции молочного жира и т.п. или аналог молочного жира, в комбинации или не в комбинации по меньшей мере с одним дополнительным лекарственным средством, будет показывать активность, аналогичную молочному жиру. Аналогично, полагают, что когда лактоферрин подлежит введению, любой функциональный вариант или функциональный фрагмент лактоферрина будет показывать активность, аналогичную лактоферрину. Молочный жир индивидуально или в комбинации с другими способами лечения был способен подавлять развитие опухолей линии 4T1 при раке молочной железы, которые распространяются в легкие и печень, и, таким образом, способен ингибировать опухолевое метастазирование.
Как описано выше, было найдено, что молочный жир высвобождает внутрь или стимулирует в системе кровоснабжения противоопухолевые факторы, такие как T-клетки и/или NK клетки (природные киллеры), и факторы, вызывающие апоптоз, проявляет иммуностимулирующую активность, антиангиогенную активность и прямую опухолевую цитотоксичность и способен вызывать апоптоз опухолевых клеток, как показано в примерах ниже.
В одном из вариантов осуществления химиотерапевтическое средство представляет собой паклитаксел, доксорубицин, эпирубицин, фторурацил, циклофосфамид или метотрексат.
В дополнение к способам, описанным выше, настоящее изобретение относится к способам ингибирования опухолевого роста или ингибирования опухолевого метастазирования у субъекта и способам лечения или предупреждения злокачественных опухолей у субъекта, где способ включает:
(a) введение молочного жира, необязательно по меньшей мере с одним дополнительным лекарственным средством, и
(b) раздельное, одновременное или последовательное введение по меньшей мере одного противоопухолевого средства или противоопухолевого лечения.
В одном из вариантов осуществления субъект страдает от злокачественной опухоли или восприимчив к развитию злокачественной опухоли. В одном из вариантов осуществления пациент имеет опухоль, невосприимчивую к терапии химиотерапевтическим, антиангиогенным или иммунотерапевтическим средством. В одном из вариантов осуществления пациент ранее проходил безуспешное лечение химиотерапевтическим, антиангиогенным или иммунотерапевтическим средством.
В одном из вариантов осуществления по меньшей мере одно противоопухолевое средство введено перорально или парентерально, хотя предпочтительный способ введения зависит от выбранного противоопухолевого средства. Предпочтительно по меньшей мере одно противоопухолевое средство введено перорально или посредством внутривенной, интраперитонеальной или внутриопухолевой инъекции. Паклитаксел, доксорубицин, эпирубицин, фторурацил, циклофосфамид и метотрексат предпочтительно введены посредством внутривенной или интраперитонеальной инъекции. Экспрессирующая плазмида, кодирующая B7-1, предпочтительно введена посредством внутриопухолевой инъекции. Альтернативно, от субъекта можно получить опухолевые клетки, трансфицировать экспрессирующей B7-1 плазмидой ex vivo, затем трансфицированные клетки ввести субъекту. Альтернативно, растворимый слитный белок B7-Ig можно ввести парентерально. Терапия дендритными клетками предпочтительно введена посредством внутривенной, интраперитонеальной или внутриопухолевой инъекции.
В одном из вариантов осуществления молочный жир или аналог молочного жира вводят перорально или парентерально.
В одном из вариантов осуществления молочный жир или аналог молочного жира, необязательно по меньшей мере с одним дополнительным лекарственным средством, вводят ежедневно в течение по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 недель перед введением противоопухолевого средства или противоопухолевого лечения.
В одном из вариантов осуществления молочный жир или аналог молочного жира, необязательно по меньшей мере с одним дополнительным лекарственным средством, введен в течение по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или 21 суток, или в течение по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7 или 8 недель, или в течение по меньшей мере приблизительно 1, 2, 3, 4, 5 или 6 месяцев перед введением противоопухолевого средства или противоопухолевого лечения.
В одном из вариантов осуществления молочный жир или аналог молочного жира, необязательно по меньшей мере с одним дополнительным лекарственным средством, введен в течение по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или 21 суток, или в течение по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7 или 8 недель, или в течение по меньшей мере приблизительно 1, 2, 3, 4, 5 или 6 месяцев после начала введения противоопухолевого средства или противоопухолевого лечения.
Предпочтительно молочный жир или аналог молочного жира, необязательно по меньшей мере с одним дополнительным лекарственным средством, введен по меньшей мере однажды в сутки, включая постоянное пероральное введение в течение суток, парентеральное введение посредством капельницы или посредством комбинирования способов введения (перорального и парентерального, например).
В одном из вариантов осуществления способа изобретения опухоль представляет собой большую опухоль, как описано выше.
В одном из вариантов осуществления способа изобретения один или несколько показателей количества лейкоцитов, эритроцитов или миелоидных клеток у субъекта сохранены или улучшены.
В одном из вариантов осуществления молочный жир или аналог молочного жира и по меньшей мере одно дополнительное лекарственное средство, если введено, введены в лекарственной форме, включающей усвояемый жир, более предпочтительно усвояемый жир и усвояемый белок, предпочтительно лактоферрин, казеин или другой белок, такой как другие белки, пригодные для употребления в пищу.
В одном из вариантов осуществления молочный жир или аналог молочного жира и по меньшей мере одно дополнительное лекарственное средство обеспечивают синергичный лечебный эффект, который является большим, чем индивидуальные эффекты каждого, предпочтительно большим, чем сумма эффектов каждого индивидуально. Например, существует предпочтительно больший эффект на ингибирование образования или роста опухоли, регрессии опухоли, цитолитические эффекты, иммунную активацию, производство цитокинов Th1 и Th2, сохранение или улучшение количеств лейкоцитов, эритроцитов или миелоидных клеток, лечение или предупреждение анемии, кахексии, мукозита или ответную реакцию субъекта или опухоли на способ лечения.
Эти способы можно комбинировать со способами лечения, применяя любое одно или несколько противоопухолевых средств (включая химиотерапевтические средства, иммунотерапевтические средства, противокахектические средства, средства против мукозита или гематопоэтические средства) или противоопухолевые способы лечения, описанные ниже.
В одном из вариантов осуществления противоопухолевое лечение выбрано из способов лечения, но не ограничено ими, таких как хирургическое вмешательство, химиотерапевтические способы лечения, способы лучевой терапии, способы гормональной терапии, способы биологического лечения/иммунотерапии, способы антиангиогенной терапии, способы цитотоксической терапии, вакцины, вакцины на основе нуклеиновых кислот (например, нуклеиновых кислот, экспрессирующих антиген злокачественной опухоли, таких как ДНК вакцины, включая вакцины p185), способы лечения на основе вирусов (например аденоассоциированного вируса, лентивируса), способы генотерапии, способы терапии на основе низкомолекулярного ингибитора, способы терапии на основе нуклеотидов (например, РНКи, антисмысловые нуклеотиды, рибозимы и т.д.), способы лечения на основе антител, кислородо- и озонотерапия, способы лечения эмболизацией и/или химиоэмболизацией.
В одном из вариантов осуществления противоопухолевое лечение или противоопухолевое средство выбирают из химиотерапевтических средств, включая в качестве неограничивающих примеров перечисленные в опубликованной международной патентной заявке WO 2006/054908, в полном объеме включенной в настоящий документ в качестве ссылки.
В одном из предпочтительных вариантов осуществления химиотерапевтическое средство выбирают из паклитаксела, доксорубицина, эпирубицина, фторурацила, циклофосфамида и метотрексата.
В одном из вариантов осуществления противоопухолевое средство является иммунотерапевтическим средством. Иммунотерапевтическое средство представляет собой предпочтительно экспрессирующую плазмиду, кодирующую костимулятор Т-клеток B7-1, костимулятор T-клеток или функционально родственную молекулу, например химерную молекулу B7-Ig.
В одном из вариантов осуществления противоопухолевое средство или лечение включает терапию дендритными клетками.
В одном из вариантов осуществления лучевая терапия включает лучевую терапию наружным облучением (включающую терапию гамма-излучением и рентгеновскими лучами) и внутреннюю лучевую терапию с использованием радиоактивных изотопов. По изобретению радиоактивные изотопы также можно использовать в качестве противоопухолевых средств.
Авторы изобретения показали в примерах ниже, что перорально вводимый молочный жир, или индивидуально, или в комбинации по меньшей мере с одним дополнительным лекарственным средством, таким как лактоферрин и особенно лактоферрин, содержащий ион металла, способен повышать ответную реакцию субъекта и повышать чувствительность опухоли к противоопухолевым средствам. Когда лактоферрин вводят в комбинации с молочным жиром, полагают, что любой функциональный вариант, функциональный фрагмент, функциональный вариант, содержащий ионы металла, или функциональный фрагмент лактоферрина, содержащий ионы металла, будет показывать активность, аналогичную лактоферрину, содержащему ион металла в комбинации с молочным жиром.
Таким образом, настоящее изобретение также относится к способу повышения ответной реакции субъекта на лечение, такому как противораковая терапия, выбранная из группы, включающей хирургическое вмешательство, способы химиотерапии, способы лучевой терапии, способы гормональной терапии (например, тамоксифеном, ингибиторами ароматазы), способы биологического лечения/иммунотерапии, способы антиангиогенной терапии, способы цитотоксической терапии, вакцинам, вакцинам на основе нуклеиновых кислот (например, нуклеиновых кислот, экспрессирующих антиген злокачественной опухоли, таких как ДНК вакцины, включая вакцины p185), способы лечения на основе вирусов (например, аденоассоциированного вируса, лентивируса), способы генотерапии, способы терапии на основе низкомолекулярного ингибитора, способы терапии на основе нуклеотидов (например, РНКи, антисмысловые нуклеотиды, рибозимы и т.д.), способы лечения на основе антител, кислородо- и озонотерапия, способы лечения эмболизацией и/или химиоэмболизацией и их комбинация, где способ включает наряду с лечением раздельное, одновременное или последовательное введение молочного жира или аналога молочного жира, необязательно по меньшей мере с одним дополнительным лекарственным средством, предпочтительно лактоферрином, нуждающемуся в этом субъекту.
Настоящее изобретение также относится к способу повышения чувствительности опухоли субъекта к лечению злокачественной опухоли, включающему пероральное или парентеральное введение молочного жира или аналога молочного жира, необязательно по меньшей мере с одним дополнительным лекарственным средством, предпочтительно лактоферрином, нуждающемуся в этом субъекту раздельно, одновременно или последовательно с введением противоопухолевого лечения. Предпочтительно молочный жир или аналог молочного жира представляет собой описанный выше. Предпочтительно по меньшей мере одно дополнительное лекарственное средство представляет собой описанное выше. Предпочтительно лактоферрин представляет собой описанный выше. Предпочтительно лечение представляет собой одно из описанных выше.
В равной степени настоящее изобретение также относится к способу ускорения восстановления субъекта, прошедшего лечение злокачественной опухоли, включающему введение молочного жира или аналога молочного жира, необязательно по меньшей мере с одним дополнительным лекарственным средством, предпочтительно лактоферрином, нуждающемуся в этом субъекту раздельно, одновременно или последовательно с введением лечения. В этом варианте осуществления изобретения субъект восстанавливается от последствий злокачественной опухоли или лечения злокачественной опухоли более быстро, чем субъект, не проходивший лечение по изобретению. Состояние субъекта предпочтительно позволяет снизить дозу или время проводимого лечения злокачественной опухоли.
Эти способы можно комбинировать со способами лечения, применяя любое одно или несколько противоопухолевых средств (включая химиотерапевтические средства или иммунотерапевтические средства) или противоопухолевые способы лечения, описанные выше.
В одном из вариантов осуществления молочный жир или аналог молочного жира, необязательно по меньшей мере с одним дополнительным лекарственным средством, введены ежедневно в течение по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 недель перед введением противоопухолевого средства или противоопухолевого лечения. В одном из вариантов осуществления молочный жир или аналог молочного жира, необязательно по меньшей мере с одним дополнительным лекарственным средством введены в течение по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или 21 суток или в течение по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7 или 8 недель или в течение по меньшей мере приблизительно 1, 2, 3, 4, 5 или 6 месяцев перед введением противоопухолевого средства или противоопухолевого лечения. В одном из вариантов осуществления молочный жир или аналог молочного жира, необязательно по меньшей мере с одним дополнительным лекарственным средством введены в течение по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или 21 суток или в течение по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7 или 8 недель или в течение по меньшей мере приблизительно 1, 2, 3, 4, 5 или 6 месяцев после начала введения противоопухолевого средства или противоопухолевого лечения.
13. Виды опухолей
В одном из вариантов осуществления опухоль, клетки опухоли или злокачественная опухоль представляют собой лейкоз, карциному толстого кишечника, рак молочной железы, меланому, рак кожи или легких. Виды опухолей, которые имеют отношение к настоящему изобретению, перечислены в опубликованной международной патентной заявке WO 2006/054908, которая включена в настоящий документ в качестве ссылки.
В одном из вариантов осуществления опухоль, клетки опухоли или злокачественная опухоль представляют собой лейкоз, такой как, но не ограничены им, острый лейкоз, острый лимфоцитарный лейкоз, острый гранулоцитарный лейкоз, острый миелоцитарный лейкоз, такой как миелобластный, промиелоцитарный, миеломоноцитарный, моноцитарный, эритролейкоз и миелодиспластический синдром, хронический лейкоз, такой как, но не ограничен им, хронический миелоцитарный лейкоз, хронический гранулоцитарный лейкоз, хронический лимфоцитарный лейкоз и волосатоклеточный лейкоз.
В одном из вариантов осуществления опухоль, клетки опухоли или злокачественная опухоль представляют собой лимфому, такую как, но не ограничены ею, болезнь Ходжкина и болезнь неходжкина. В одном из вариантов осуществления опухоль является, клетки опухоли происходят из или злокачественная опухоль включает гематопоэтическую опухоль миелоидного ряда, такую как, но не ограничена ею, острый и хронический миелогенный лейкоз, вялотекущая множественная миелома, несекреторная миелома и остеосклеротическая миелома. В одном из вариантов осуществления опухоль является, клетки опухоли происходят из лимфоидного ряда или злокачественная опухоль включает гематопоэтическую опухоль лимфоидного ряда, включая лейкоз, острый и хронический лимфоцитарный лейкоз, острый и хронический лимфобластный лейкоз, B-клеточную лимфому, T-клеточную лимфому, лимфому Беркита. В одном из вариантов осуществления опухоль является, клетки опухоли происходят из или злокачественная опухоль включает гематопоэтическую опухоль B-клеточного лимфоцитарного ряда. В одном из вариантов осуществления опухоль является, клетки опухоль происходят из или злокачественная опухоль включает гематопоэтическую опухоль T-клеточного лимфоцитарного ряда.
Дополнительные злокачественные опухоли и родственные заболевания, которые можно лечить или предупреждать посредством способов и композиций по настоящему изобретению, включают в качестве неограничивающих примеров следующие: лейкозы; лимфомы; множественная миеломы; макроглобулинемия Вальденстрема; моноклональная гаммопатия неопределенного значения; доброкачественная моноклональная гаммопатия; болезнь тяжелых цепей; саркомы костей и соединительной ткани; опухоли головного мозга; рак молочной железы; злокачественная опухоль надпочечников; рак щитовидной железы; злокачественная опухоль поджелудочной железы; злокачественные опухоли гипофиза; злокачественные опухоли глаз; злокачественные опухоли влагалища; злокачественная опухоль женских наружных половых органов; злокачественные опухоли шейки матки; злокачественные опухоли матки; злокачественные опухоли яичников; злокачественные опухоли пищевода; злокачественные опухоли желудка; злокачественные опухоли толстого кишечника; злокачественные опухоли прямой кишки; злокачественные опухоли печени; злокачественные опухоли желчного пузыря; холангиокарциномы; злокачественные опухоли легких; тестикулярные злокачественные опухоли; злокачественные опухоли предстательной железы; почечные злокачественные опухоли; злокачественные опухоли ротовой полости; базалиомы; злокачественной опухоли слюнных желез; злокачественные опухоли глотки; злокачественные опухоли кожи; злокачественные опухоли почек; опухоль Вильмса и злокачественные опухоли мочевого пузыря. Для обзора такого рода нарушений см. Fishman at al., 1985, Medicine, 2d Ed., J.B. Lippincott Co., Philadelphia и Murphy at al., 1997, Informed Decisions: The Complete Book of Cancer Diagnosis, Treatment, и Recovery, Viking Penguin, Penguin Books U.S.A., Inc, United States of America.
Дополнительные злокачественные опухоли или другие патологические пролиферативные заболевания, которые могут быть вылечены или предупреждены по изобретению, включают в качестве неограничивающих примеров следующие: карциному, включая карциному печени, селезенки, сердца, легких, тонкого кишечника, толстого кишечника, прямой кишки, почек, мозга, мочевого пузыря, молочных желез, ободочной кишки, почек, печени, легких, яичников, поджелудочной железы, желудка, шейки матки, щитовидной железы и кожи; включая плоскоклеточную карциному; гемопоэтические опухоли лимфоцитарного ряда, включая лейкоз, острый лимфоцитарный лейкоз, острый лимфобластный лейкоз, B-клеточная лимфома, T-клеточная лимфома, лимфому Беркита; гематопоэтические опухоли миелоидного ряда, включая острые и хронические миелогенные лейкозы и промиелоцитарный лейкоз; опухоли мезенхимального происхождения, включая фибросаркому и рабдомиосаркому; другие опухоли, включая меланому, семиному, тератокарциному, нейробластому и глиому; опухоли центральной и периферической нервной системы, включающие астроцитому, нейробластому, глиому и шванному; опухоли мезенхимального происхождения, включающие фибросаркому, рабдомиосаркому и остеосаркому; и другие опухоли, включая меланому, пигментную ксеродерму, кератоакантому, семиному, фолликулярный рак щитовидной железы и тератокарциному.
В специфичных вариантах осуществления, злокачественные или диспролиферативные изменения (такие как метаплазии и дисплазии) или гиперпролиферативные нарушения лечат или предотвращают в яичниках, мочевом пузыре, молочных железах, ободочной кишке, печени, легких, коже, поджелудочной железе или матке. В других специфичных вариантах осуществления, лечат или предотвращают саркому, меланому или лейкоз.
14. Лечение или предупреждение злокачественных опухолей кожи
В дополнительном варианте осуществления изобретения представлен способ лечения или предупреждения злокачественной опухоли кожи, включающий стадию введения молочного жира или аналога молочного жира, необязательно по меньшей мере с одним дополнительным лекарственным средством, предпочтительно лактоферрином, в или на кожу и/или в область опухоли.
В предпочтительном варианте осуществления из-за воздействия солнечной радиации кожа предрасположена к злокачественной опухоли кожи.
В предпочтительном варианте осуществления злокачественная опухоль является базальноклеточной карциномой, плоскоклеточной карциномой или меланомой.
Предпочтительно, молочный жир или аналог молочного жира вводят местно как индивидуально, так и в комбинации со стандартной схемой лечения злокачественной опухоли. Введение в область опухоли включает введение в окрестностях или рядом с границами опухоли или непосредственно в зону опухоли. Предполагается, что молочный жир ингибирует канцерогенез, стимулирует местный противоопухолевый иммунитет в тканях, ингибирует опухолевый ангиогенез и/или является средством, прямо уничтожающим опухолевые клетки (способен ингибировать рост опухоли). В кратком изложении, молочный жир, необязательно по меньшей мере с одним дополнительным лекарственным средством в подходящем носителе в концентрациях 0,1%, 1%, 5% или 10% нанесен дважды в сутки на кожу в зону риска или на участок кожи, пораженный злокачественной опухолью. Прогрессирование размера опухоли контролируют посредством изображений, полученных с CT и опухолевых маркеров, где доступно.
О дозах и схемах лечения можно узнать посредством проведения преклинических исследований на подходящей модели злокачественной опухоли кожи у животных. Участок кожи у мышей бреют и обрабатывают местно с применением канцерогена (например, 7,12-диметил-бенз[а]антраценом (DMBA)), затем возможно последующее облучение UV-B (Bestak, et al., 1996). Лактоферрин можно наносить в течение двух суток после нанесения канцерогена или как только образуется участок поражения злокачественной опухолью, предпочтительно в присутствии вещества, способствующего проникновению в кожу (такого как 70% лаурета сульфата и 30% фенилпиперазина), которое способно увеличивать кожную проницаемость. Лактоферрин наносят дважды в сутки или иначе, при необходимости, на кожу или участок поражения злокачественными опухолями и контролируют рост опухоли за период от недель до месяцев.
При необходимости, эти способы можно комбинировать со способами лечения, применяя любой один или несколько противоопухолевых средств (включая химиотерапевтические средства или иммунотерапевтические средства) или противоопухолевые способы лечения, описанные выше.
15. Анемия
Как показано в примерах ниже, пероральное введение молочного жира является эффективным для снижения гематологической супрессии у субъекта и при лечении или предупреждении анемии у субъекта.
Анемия относится к недостаточности эритроцитов (RBCs) и/или гемоглобина. В результате этого снижается способность крови к переносу кислорода к тканям, что приводит к гипоксии. Таким образом, различные стадии анемии могут приводить к широкому диапазону клинических последствий.
Используя морфологический подход, анемию можно классифицировать по размеру эритроцитов. Размер отражен в среднем объеме эритроцита (MCV), который измеряют, как правило, в фемтолитрах (fl). Если клетки являются меньшими по размеру, чем в норме (до 80 fl), то анемию называют микроцитарной; если клетки являются нормальными по размеру (80-100 fl), то нормоцитарной; и если клетки являются большими по размеру, чем в норме (более 100 fl), то анемию классифицируют как макроцитарную.
Микроцитарная анемия является, прежде всего, результатом нарушений в синтезе гемоглобина или недостаточного синтеза гемоглобина и может быть вызвана несколькими причинами, включая дефекты при синтезе гема, дефицит железа, анемией при хронических нарушениях, дефекты при синтезе глобина, альфа- и бетаталассемии, HbE синдром, HbC синдром и другие заболевания, связанные с наличием нестабильной формы гемоглобина, дефекты сидеробластов, включая наследственную сидеробластную анемию, приобретенную сидеробластную анемию, включая от токсичного действия свинца и обратимую сидеробластную анемию. Железодифицитная анемия представляет собой самый широко распространенный вид анемии, и она обусловлена многими причинами. При рассматривании под микроскопом часто выявляют гипохромные (бледнее, чем обычные) и микроцитарные (меньше, чем обычные) RBCs. Железодифицитная анемия представляет собой состояние, обычно вызванное недостаточным потреблением железа с пищей или недостаточным всасыванием железа. Железодифицитная анемия может также быть вызвана кровотечением из поврежденных участков желудочно-кишечного тракта. Как микроцитарные анемии обычно классифицируют гемоглобинопатии, такие как серповидноклеточное заболевание и талассемии.
Нормоцитарная анемия представляет собой состояние, при котором общий уровень Hb снижен, но размер эритроцитов (MCV) остается нормальным. Причины возникновения включают острую потерю крови, анемию при хроническом заболевании, апластическую анемию (нарушение костномозгового кроветворения) и гемолитическую анемию. Гемолитическая анемия вызвана раздельной совокупностью симптомов с рядом возможных причин (также характеризуется желтухой и повышенным уровнем LDH). Заболевание может представлять собой аутоиммунное, иммунное, наследственное или быть результатом механического вмешательства (например, хирургического вмешательства на сердце). Несмотря на то что чаще нормоцитарная, она может происходить в результате разрушения клеток микроцитарной анемией или по причине преждевременного высвобождения незрелых эритроцитов из костного мозга макроцитарной анемией.
Макроцитарную анемию можно в дальнейшем подразделять на "мегалобластную анемию" или "немегалобластную макроцитарную анемию". Причиной мегалобластной анемии является, прежде всего, нарушение синтеза ДНК с сохраненным синтезом РНК, что приводит к ограниченному клеточному делению клеток-предшественников. Мегалобластные анемии часто представлены с гиперсегментацией нейтрофилов (6-10 долей). Мегалобластная анемия является наиболее общим случаем макроцитарной анемии. Мегалобластная анемия возникает, в основном, из-за дефицита как витамина B12 так и фолиевой кислоты (или обоих), который в свою очередь обычно происходит или из-за недостаточного приема внутрь или недостаточного всасывания. Дефицит фолатов в норме не приводит к неврологическим симптомам, в отличие от дефицита B12. Пернициозная анемия представляет собой аутоиммунное состояние, направленное против париетальных клеток желудка. Париетальные клетки продуцируют внутренний фактор, необходимый для всасывания витамина B12 из пищевого продукта. Таким образом, разрушение париетальных клеток обуславливает отсутствие внутреннего фактора, что приводит к низкому всасыванию витамина B12. Мегалобластная анемия может являться также результатом воздействия метотрексата, зидовудина и других лекарственных средств, которые ингибируют репликацию ДНК. Немегалобластные макроцитарные анемии имеют другие причины (т.е. имеет место ненарушенный синтез ДНК), которые проявляются, например, при алкоголизме.
Существуют различные специфичные анемии, включая анемию недоношенных, которая возникает у недоношенных детей в течение от 2 до 6 недель после рождения и происходит в результате сниженной реакции эритропоэтина на уменьшающиеся уровни гематокрита; анемия Фанкони, наследственные нарушения или дефекты, характеризующие апластическую анемию и различные другие нарушения; наследственный сфероцитоз, наследственное нарушение, которое приводит к дефектам в мембране эритроцитов (RBC), что приводит к депонированию и разрушению эритроцитов в селезенке. Это приводит к снижению числа циркулирующих RBCs и, таким образом, к анемии; серповидноклеточная анемия, наследственное нарушение, которое происходит вследствие наличия мутантного гена гемоглобина S; аутоиммунная гемолитическая анемия с тепловыми агглютининами, анемия, вызванная аутоиммунной атакой против эритроцитов, главным образом, посредством IgG; и гемолитическая анемия, связанная с холодовыми агглютининами, главным образом, опосредованная IgM.
Таким образом, настоящее изобретение относится к способу лечения или предупреждения анемии у субъекта, включающему введение субъекту молочного жира или аналога молочного жира необязательно по меньшей мере с одним дополнительным лекарственным средством. Настоящее изобретение также относится к способам снижения или ингибирования гематологической супрессии у субъекта.
Снижение или ингибирование гематологической супрессии имеет применение не только у субъектов, проходящих лечение, или у тех кто прошел противораковое лечение, но и при других нарушениях, включая в качестве неограничивающих примеров анемии, описанные выше. Таким образом, молочный жир или аналог молочного жира предпочтительно в комбинации по меньшей мере с одним дополнительным лекарственным средством, более предпочтительно лактоферрином или функциональным вариантом или его функциональным фрагментом и особенно лактоферрином, содержащим ион металла, имеют применение вне области лечения и предупреждения злокачественных опухолей.
16. Кахексия
Как показано в примерах ниже, пероральное введение молочного жира является эффективным для улучшения состояния субъекта и для лечения или предупреждения кахексии у субъекта.
При кахексии существуют один или несколько признаков, это потеря массы, атрофия мышц, утомляемость, слабость и отсутствие аппетита (значительная потеря аппетита) у кого-либо кто не стремится к интенсивной потере массы. Это состояние обычно ассоциировано с основным заболеванием, таким как злокачественная опухоль, некоторые инфекционные заболевания (например, туберкулез, СПИД) и некоторые аутоиммунные нарушения. Кахексия физически ослабляет субъектов до состояния неподвижности, обусловленного потерей аппетита, астенией и анемией и обычно ответная реакция на стандартное лечения является слабой.
Субъекты со злокачественной опухолью с кахексией, возникшей вследствие как сниженной физической активности, присоединившейся инфекции, так и токсичного действия химиотерапии и лучевой терапии на пищеварительный тракт, как правило, проходят симптоматическое лечение для сохранения качества питания и качества жизни. Подобная регуляция включает применение полосканий для рта при стоматитах, частое потребление пищи малыми порциями, противорвотные средства, антибиотики, переливание компонентов крови и пероральные и парентеральные питательные добавки. Пищевые добавки могут быть эффективны для обеспечения дополнительными калориями, белками, жирами, витаминами и микроэлементами. В специфичных случаях, таких как синдром мальабсорбции на фоне карциномы поджелудочной железы, использован экзогенный экстракт поджелудочной железы для улучшения всасывания жира и белка (Perez MM, et al. Оценка потери массы, потребления пищи, обмена жиров, мальабсорбции и лечение недостаточности поджелудочной железы при раке поджелудочной железы. Cancer 1983; 52:346-52).
Различные фармакологические средства вводили при попытках обратить, задержать или приостановить прогрессирующую кахексию у субъектов со злокачественной опухолью. Они включают кортикостероиды, такие как преднизолон, метилпреднизолон и дексаметазон, прогестагенные средства, такие как мегестрола ацетат, медроксипрогестерон ацетат, каннабиноиды, такие как дронабинол, антагонисты серотонина, такие как ципрогептадин, средства, влияющие на перистальтику кишечника, такие как метоклопрамид и цизаприд, стероидные анаболические средства, такие как нандролона деканоат и флуоксиместерон, ингибиторы фосфоенолпируват-карбоксикиназы, такие как гидразина сульфат, аналоги метилксантина, такие как пентоксифиллин и лизофиллин, талидомид, цитокины и антицитокины, такие как антитело Anti-IL-6, IL-12, аминокислоты с разветвленной цепью, эйкозапентаеновая кислота, ингибиторы синтеза простагландина, такие как индометацин и ибупрофен, гормоны, такие как мелатонин и агонисты β2-адренорецептора, такие как кленбутерол.
Таким образом, настоящее изобретение относится к способу лечения или предупреждения кахексии у субъекта, включающему введение субъекту молочного жира или аналога молочного жира, необязательно, по меньшей мере с одним дополнительным лекарственным средством. Настоящее изобретение также относится к способам улучшения состояния субъекта при кахексии.
Лечение или предупреждение кахексии имеет применение не только у субъектов, проходящих лечение, или у тех кто прошел противораковое лечение, но и при других нарушениях, ассоциированных с потерей массы или утомляемостью, включая в качестве неограничивающих примеров нарушения, описанные выше. Таким образом, молочный жир или аналог молочного жира предпочтительно в комбинации по меньшей мере с одним дополнительным лекарственным средством, более предпочтительно лактоферрином или функциональным вариантом или его функциональным фрагментом и особенно содержащим ион металла лактоферрином имеют применения вне лечения и предупреждения злокачественных опухолей.
17. Мукозит
Как показано в примерах ниже, пероральное введение молочного жира эффективно для улучшения состояния при повреждениях пищеварительного тракта, таких как изъязвления и при лечении или предупреждении мукозита.
Мукозит представляет собой состояние, которое характеризуется повреждениями эпителия полости рта, и глотки, и желудочно-кишечного тракта (GI), приводящее в результате к воспалению и изъязвлению этих слизистых оболочек. В ротовой полости и пищеводе мукозит характеризуется образованием болезненных язв. Еще дальше по пищеварительному тракту, мукозит вызывает диарею, которая часто является тяжелой и изнуряющей. Мукозит обычно является результатом лучевой и/или химиотерапии, возникающим, в той или иной степени, приблизительно у 40% субъектов, которые получали химиотерапию против злокачественной опухоли. Вследствие относительно высокой скорости обновления по сравнению с клетками в других органах, эпителиальные клетки являются более чувствительными к цитотоксическим эффектам лучевой терапии и химиотерапии. В большинстве случаев, эпителиальные клетки слизистых оболочек имеют более быстрое обновление, чем подлежащая лечению злокачественная опухоль, и являются уязвимыми к повреждению цитотоксическими средствами и облучению. Диагностику и контролирование мукозита успешно выполняют посредством опроса субъекта (такого как опросный лист по боли), осмотра ротовой полости и эндоскопии. Рекомендованы также некоторые тесты, подлежащие определению для диагностики, включающие дыхательный тест на сахарозу, цитруллин и тест на трансглутаминазу.
Лечение мукозита является, в основном, поддерживающим. В настоящее время основой лечения является гигиена полости рта, достигаемая, как правило, посредством частого полоскания рта. Для смазывания ротовой полости можно использовать водорастворимые гели. Для снятия боли и повышенной чувствительности, которые ассоциированы с мукозитом, существуют различные местные паллиативные средства. Промывание ротовой полости солевым раствором может смягчить боль и очистить от частиц пищевого продукта для того, чтобы избежать инфицирования. Лекарственные средства включают хлоргексидина глюконат, лидокаин (Ксилокаин), диклонин HCl (Диклон) и бензокаин в составе Орабейз (Orabase). Дополнительно, дифенгидрамин HCl (Бенадрил), который обладает местным анестезирующим действием, можно смешать в равных объемах или с Каопектатом (Kaopectate) или с гидроксидом магния с образованием суспензии. Бензидамин гидрохлорид (HCl) представляет собой нестероидный препарат для полоскания с противовоспалительными, болеутоляющими и анестезирующими свойствами. Рядом исследователей было описано применение сукральфата, широко применяемого при лечении язвенной болезни желудка, в виде полосканий при лечении мукозита, вызванного лучевой терапией и химиотерапией.
Было описано, что бактерицидные средства, такие как хлоргексидина глюконат, полимиксин E, тобрамицин и амфотерицин, имеют некоторую клиническую значимость. Было описано, что противовоспалительные средства, такие как бетаметазон и индометацин, потенциально значимы в предупреждении или при снижении тяжести течения мукозита, вызванного облучением. Было описано применение палифермина (KEPIVANCE), человеческого фактора роста кератиноцитов (KGF), для усиления пролиферации, дифференцировки и миграции эпителиальных клеток. Другие описанные способы лечения основаны на применении цитокинов и других модуляторов воспаления (таких как IL-1, IL-11, TGF-бета3), пищевой добавки с аминокислотой (например, с глутамином), витаминов, колониестимулирующих факторов, таких как колониестимулирующий фактор гранулоцитов и макрофагов (GM-CSF), лечения холодом и лечения лазером.
Таким образом, настоящее изобретение относится к способу лечения или предупреждения мукозита у субъекта, включающему введение субъекту молочного жира или аналога молочного жира, необязательно, по меньшей мере с одним дополнительным лекарственным средством. Настоящее изобретение также относится к способам улучшения состояния субъекта при мукозите.
Лечение или предупреждение мукозита и уменьшение повреждений или улучшения состояния при повреждениях желудочно-кишечного тракта имеет применение не только у субъектов, проходящих лечение, или у тех кто прошел противораковое лечение, но и при других нарушениях, ассоциированных с повреждением эпителия пищеварительного тракта, включая в качестве неограничивающих примеров нарушения, описанные выше. Таким образом, молочный жир или аналог молочного жира предпочтительно в комбинации по меньшей мере с одним дополнительным лекарственным средством, более предпочтительно лактоферрином или функциональным вариантом или его функциональным фрагментом и особенно содержащим ион металла лактоферрином имеет применение вне лечения и предупреждения злокачественных опухолей.
18. Лейкоцитопения
Как показано в примерах ниже, пероральное введение молочного жира является эффективным для снижения гематологической супрессии у субъекта и в лечении и предупреждении лейкопении у субъекта.
Лейкоцитопения (также известная как лейкопения и включающая состояния, иногда обозначаемые как лимфопения или лимфоцитопения) относится к снижению количества лейкоцитов (WBCs) у субъекта. Это приводит к пониженной способности организма к сопротивлению инфекциям, что приводит к большей уязвимости организма. Разную степень лейкопении можно, таким образом, приравнивать к широкому диапазону клинических последствий.
В среднем, взрослый человек имеет WBC в количестве, равном 4500-10000 клеток/кубический миллиметр (варьирует в зависимости от пола и субъекта). Лейкопению определяют, как правило, когда имеющееся количество WBC меньше чем 4000 клеток/кубический миллиметр (снова варьирует от пола и субъекта). Двумя основными формами лейкоцитопении являются нейтропения и гранулоцитопения.
Нейтропения представляет собой основной вид лейкоцитопении и характеризуется снижением количества нейтрофилов. Помимо злокачественной опухоли, много синдромов ассоциированно с нейтропенией, большая часть которых является наследственными по природе. Нейтропения Костманна, синдром Швахмана, агаммаглобулинемия, дисгаммаглобулинемия, миелокатексис, синдром хрящево-волосяной гипоплазии и врожденный дискератоз представляют собой лишь немногие примеры нарушений, ассоциированных с нейтропенией. Нейтропению также ассоциируют с дефицитами питательных веществ, таким как недостаток витамина B12, фолиевой кислоты или недостаток меди.
Гранулоцитопению иногда используют взаимозаменяемо с нейтропенией, но более точно гранулоцитопения представляет собой падение количества эозинофилов и базофилов, а также нейтрофилов.
Лейкоцитопения может также возникать, когда субъекты подвергаются химиотерапии или лучевой терапии. Она является широко распространенным побочным эффектом и субъектам обычно дается время для восстановления и образования большего количества WBCs перед продолжением терапии. В основном, лейкопению обычно лечат стероидами или витаминами, чтобы стимулировать костный мозг на образование большего количества WBCs.
Таким образом, настоящее изобретение относится к способу лечения или предупреждения лейкопении у субъекта, включающему введение субъекту молочного жира или аналога молочного жира необязательно по меньшей мере с одним дополнительным лекарственным средством. Настоящее изобретение также относится к способу снижения или ингибирования гематологической супрессии у субъекта.
Снижение или ингибирование гематологической супрессии имеет применение не только у субъектов, проходящих лечение, или у тех, кто прошел противораковое лечение, но и при других нарушениях, включая в качестве неограничивающих примеров лейкоцитопении, указанные выше. Таким образом, молочный жир или аналог молочного жира предпочтительно в комбинации по меньшей мере с одним дополнительным лекарственным средством, более предпочтительно лактоферрином или функциональным вариантом или его функциональным фрагментом и особенно содержащим ион металла лактоферрином имеет применения вне лечения и предупреждения злокачественных опухолей.
Различные аспекты по изобретению теперь будут проиллюстрированы в способах, но неограничиваются ими, посредством ссылки к следующим примерам.
ПРИМЕРЫ
Мыши и реагенты
Работали с самками мышей линии C57BL/6 и мышами линии Balb/c в возрасте от шести до девяти недель (University of Auckland, New Zealand), причем в каждую группу по питанию включали 5 или 6 мышей, если не указано иначе. Мышей содержали в комнате с кондиционируемым воздухом с регулируемой влажностью, температурой и 12 ч циклом чередования света и темноты. Мышиную T-клеточную лимфому тимуса EL-4 из C57BL/6 и клеточную линию рака молочных желез 4T1 из BALB/c (H-2b) приобретали у American Type Culture Collection (Rockville, MD, USA). Клетки EL-4 культивировали при 37°C в среде DMEM (Gibco BRL, Grand Island, NY, USA), тогда как клетки 4T1 поддерживались в виде монослойной культуры при 37°C в среде RPMI 1640 (Gibco BRL, Grand Island, NY, USA). В среду дополнительно добавляли 10% эмбриональную сыворотку теленка, 50 Ед/мл пенициллина/стрептомицина, 2 мМ L-глутамина и 1 мМ пирувата. Паклитаксел приобретали у Bristol-Meyers Squibb, WA, USA. Все эксперименты проводили по протоколу, одобренному Animal Ethics Committee, University of Auckland.
Получение молочного жира
Молочный жир, обогащенный сопряженной линолевой и вакценовой кислотами, получали посредством докорма свободными жирными кислотами коров на пастбище, согласно способу Harfoot et al. 58. Нормальный безводный молочный жир получали от Fonterra Co-operative Group Limited, NZ. Композиции молочного жира и обогащенного молочного жира, использованные в лечебных диетах, обобщены в таблицах 6a и 6b. Данные в таблицах 6a и 6b получали, применяя FAMES, расширенный FAMES, CLA и анализы молочного жира, известные в данной области.
Содержание молочного жира в диетах
Содержание молочного жира в диетах
Получение лактоферрина
Бычий лактоферрин получали из обезжиренного молока (Fonterra Co-Operative Group Limited, New Zealand), используя способ Norris et al. (Norris, GE et al., 1989). Ионообменную смолу SP Big Beads нагружали обезжиренным молоком и промывали водой. Элюцию с колонки проводили 0-0,5 M раствором NaCl и элюат не использовали. Затем элюцию с колонки провели 0,5-1,0 M NaCl и собрали элюат. Собранный элюат подвергали UF/DF, применяя мембрану 30кДа для снижения количества солей и компонентов с низкой молекулярной массой. Фильтрацию продолжали до тех пор, пока ретентат не стал представлять собой от 90 до 93% бычьего лактоферрина. Полученный экстракт лактоферрина имел природные уровни насыщения железом, приблизительно 15%, и обозначен как bLf в последующих примерах. Экстракт бычьего лактоферрина, насыщенного железом (100% насыщенный), получали из природного bLf способом Law et al., (Law и Reiter, 1977), обозначен как Lf+ в последующих примерах.
Диеты
Экспериментальные пищевые рационы получали посредством Crop & Food Research, Palmerston North, New Zealand, используя как основу порошкообразный состав AIN93G. В диете AIN93G, не содержащей лактоферрин, как источник белка использовали казеин и соевое масло как источник липидов. В экспериментальных пищевых рационах казеин заменяли природным bLf или Lf+, полученными как описано выше, общее содержание белка в диете, таким образом, было неизменным. Диета включала 28 г bLf, насыщенного железом, или 28 г экстракта природного bLf на 2,4 кг пищи. Соевое масло заменяли в экспериментальных пищевых рационах или обогащенным молочным жиром, или нормальным безводным молочным жиром, полученным, как описано выше, таким образом, общее содержание жира в рационе было неизменным. Свежей пищей обеспечивали два раза в неделю, и мыши имели свободный доступ к пищевым продуктам и воде на всем протяжении исследования. Фосфолипидную фракцию из Фосфолипидного концентрата Phospholac 600™ (PC600™) приобретали у Fonterra Co-operative Group Limited, New Zealand.
Экспериментальные модели опухоли и способы лечения
Опухоли прививали посредством s.c. инъекции клеток EL-4 в количестве 2×105 или 4T1 в количестве 2×104 в левый бок мышей, и рост опухоли оценивали посредством нахождения двух перпендикулярных диаметров. Когда опухоли достигали размера более чем 1,0 см в диаметре, животных умерщвляли в соответствии с Animal Ethics Approval (University of Auckland). Во все эксперименты включали 5 или 6 мышей на группу лечения, если не указано иначе. Паклитаксел (30 мг, растворенный в 5 мл Cremophor® EL и дегидратированного спирта) разводили 0,9% NaCl и вводили i.p. из расчета 30 мг/кг. В случае метастатической модели рака молочных желез линии 4T1 в конце экспериментов после умерщвления мышей извлекали и взвешивали органы, включая легкие, печень и селезенку. Подсчитывали число метастазов на поверхности легких. Печень фиксировали в 4% параформальдегиде и делали поперечные срезы толщиной 10 мкм на 5 различных уровнях, чтобы охватить всю печень. Срезы окрашивали гематоксилином и эозином. Подсчитывали количество метастатических узлов, содержащих более 6 злокачественных клеток, и брали среднее значение для представления числа метастазов. Кровь собирали посредством сердечной пункции во время аутопсии и подсчитывали на гемоцитометре количество клеток крови.
Количественное определение производства противоопухолевых цитотоксических T-лимфоцитов (CTLs)
Спленоциты собирали в определенные дни после инъекции опухолевых клеток. Инкубировали при 37°C с клетками-мишенями EL-4 в градиентном соотношении E:T в 96-луночной круглодонной плашке. После 4 часовой инкубации отбирали 50 мкл надосадочной жидкости и измеряли лизис клеток, используя Cyto Tox 96 Assay Kit (Promega, Madison, WI, USA). Включали контрольные измерения фонового неспецифического лизиса клетки мишени и эффекторной клетки. После вычитания фона, подсчитывали процент клеточного лизиса, используя формулу: 100 × (экспериментальный спонтанный эффектор - спонтанная мишень/максимальная мишень - спонтанная мишень).
Количественное определение апоптоза
Опухоли вырезали и немедленно замораживали в сухом льду и хранили при -70°C для дальнейшего выявления апоптотических клеток в опухолях in situ. Замороженные серии срезов толщиной 6 мкм фиксировали в растворе параформальдегида (4% в PBS, pH 7,4) и нарушали проницаемость клеточных мембран раствором, содержащим 0,1% Triton X-100 и 0,1% цитрат натрия. Срезы инкубировали с 20 мкл реагента TUNEL (коммерчески доступный набор для определения апоптоза in situ от Boehringer Mannheim, Germany) в течение 60 мин при 37°C и исследовали посредством флуоресцентной микроскопии. Соседние срезы контрастно окрашивали гематоксилином для подсчета общего числа клеток или числа апоптотических клеток в десяти областях, выбранных случайным образом (увеличение x40). Апоптотический индекс (AI) считали как количество апоптотических клеток × 100/общее количество ядросодержащих клеток. Для определения апоптотических клеток in vitro, количество апоптотических и некротических опухолевых клеток измеряли посредством окрашивания способом флуоресценции с аннексином V, TUNEL и трипановым синим. Для измерения апоптоза в пищеварительном тракте, срезы тонкого кишечника окрашивали посредством способа TUNEL, используя DeadEndTM Fluorometric TUNEL System (Promega, Madison, WI, USA). Подсчитывали число апоптотических клеток в 10 криптах, выбранных случайным образом, и данные представляли как число апоптотических телец на крипту.
Оценка васкуляризации
Для определения васкуляризации опухоли, замороженные опухолевые срезы толщиной 10 мкм фиксировали в ацетоне, промывали с PBS, блокировали 2% BSA в течение 2 ч и икубировали в течение ночи с антителом MEC13,3 против CD31 или mAb против CD105. Срезы затем инкубировали в течение 30 мин с вторичными антителами, используя набор VECTASTAIN Universal Quick kit (Vector Laboratories, Burlingame, CA, USA); и обрабатывали с Sigma FAST DAB (3,3'-диаминобензидин тетрагидрохлорид) и таблетками, усиливающими CoCl2 (Sigma) и контрастно окрашивали гематоксилином. Окрашенные кровеносные сосуды подсчитывали под x40 увеличением в пяти или шести областях (0,155 мм2), выбранных вслепую случайным образом, и подсчитывали среднее значение из трех максимальных значений. Для наблюдения за потоком крови в кровеносных сосудах в хвостовую вену вводили DiO7 в концентрации 1,0 мг/кг (Molecular Probes, Eugene, OR) за одну минуту до сбора тканей, как описывали ранее (Ding et al., 2001). Для оценки васкуляризации также использовали способ концентрических окружностей.
Оценка кахексии
Мышей взвешивали в начале и в конце эксперимента. После мышей умерщвляли, опухоли вырезали и взвешивали. Для определения объема жировой ткани и мышечной слабости иссекали эпидидимальную жировую ткань и левую икроножную мышцу. Убойную массу подсчитывали как разницу в массе между общей массой и массой опухоли.
Количественная оценка повреждения пищеварительного тракта
Тощую кишку мышей фиксировали в 4% параформальдегиде, погружали в парафин, делали срезы толщиной 4 мкм и срезы окрашивали гематоксилином-эозином. В каждом образце выбирали случайным образом 20 хорошо сохраненных ворсинок и измеряли их длину посредством микроскопии, используя объективный микрометр.
Регистрировали активность γ-глутамилтранспептидазы (γ-GGT) в тощей кишке, как раздельного показателя повреждения кишечника, как описывали ранее (Ziotnik et al., 2005). Часть тощей кишки (приблизительно 5 см) отделяли и промывали 10 мл PBS и разрезали на две части по 2 см2, которые помещали в 1,0 мл 1,0% Triton X-100, 0,15 M NaCl, 100 мМ Tris, pH 8,0 (буфер Tris). Добавляли двадцать микролитров раствора, содержащего 0,3 мл 100 мМ глицил-глицина, pH 8,0, 0,08 мл буфера Tris, 0,5 мл 5 мМ γ-глутамил-п-нитроанилида, до конечного объема 0,9 мл. Части пищеварительного тракта инкубировали в течение 10 мин на водяной бане, с перемешиванием, при 37°C и регистрировали активность γ-GGT при 405 нм. Результаты выражали в виде единиц активности γ-GGT на см тощей кишки, где одна единица определена как активность γ-GGT, которая высвобождает 1,0 моль п-нитроанилина за 1 ч.
Статистический анализ
Результаты представляли как среднее значение ±SEM или с доверительным интервалом ±95% и статистическую значимость оценивали, используя тест Стьюдента (примеры от 1 до 17), или дисперсионный анализ, или анализ ковариаций с последующим способом множественного сравнения Tukey's, или 1-сторонний тест Даннетта (примеры от 18 до 21). Значение P<0,05 показывает статистическую значимость, тогда как P<0,001 показывает, что результаты являются высоко значимыми.
Пример 1
Бычий лактоферрин с чистотой более чем 90% приобретали у Fonterra Co-operative Group. Для получения апо-Lf, приблизительно 80 мг/мл раствора Lf в воде milliQ (pH~5,7), доводили до pH 2,08 осторожным добавлением 6 M HCl. Раствор перемешивали в RT в течение 1 ч, затем диализовали в течение ночи при 4°C против 10 объемов 0,1 M лимонной кислоты, используя диализные трубки SpectraPor с номинально отсекаемой молекулярной массой 3,5 кДа (Spectrum Companies, Ranco Dominguez, CA, USA). Диализный раствор меняли дважды в течение 24 ч периода и раствор Lf лиофилизировали до белого полукристаллического порошка. Для получения лактоферрина, насыщенного Fe на 50%, 8% раствор лактоферрина в 0,1 M бикарбонате натрия доводили до pH 8,2 осторожным добавлением 6 M NaOH. Надлежащий объем 50 мМ нитрилотриацетата железа (Fe-NTA) (Bates et al., 1967; Brock & Arzabe, 1976) добавляли для получения ~50% насыщения лактоферрина (учитывая чистоту Lf и его природное насыщение Fe ~12%). После перемешивания в течение 1 ч в RT, раствор (pH 8,01) диализовали в течение ночи при 4°C против 10 объемов воды milli-Q, используя диализные трубки SpectraPor, как описано выше. Диализные раствор меняли дважды в течение 24 ч периода и раствор Lf лиофилизировали до лососево-красного полукристаллического порошка. Лактоферрин с ~100% насыщением Fe получали в основном так же, как для вещества, насыщенного Fe на 50%, за исключением корректировки соответствующего количества Fe-NTA и последующего добавления Fe-NTA, передоведения pH до 8,0 осторожным добавлением 6 M NaOH. Конечный продукт представлял собой темный лососево-красный полукристаллический порошок. Уровни насыщения Fe конечных продуктов проверяли посредством спектрофотометрического титрования (Bates et al., 1967; Brock & Arzabe, 1976). Апо-лактоферрин был насыщен Fe приблизительно на 5%.
Пример 2
В примере показано, что молочный жир подавляет рост опухолей EL-4, тогда как молочный жир, обогащенный сопряженной линолевой и вакценовой кислотами, является неэффективным.
Группу из шести мышей линии C57BL/6 содержали на контрольной диете AIN-93 или той же диете с замещением 120 г или на молочный жир, или на обогащенный молочный жир на 2,4 кг пищи, обеспечивая ~71% жирового компонента диеты. Через две недели после начала такой диеты мышам прививали подкожно 2×105 опухолевых клеток EL-4. Размер опухоли, измеренный посредством нахождения двух перпендикулярных диаметров (в сантиметрах) контролировали до 91 суток или до достижения опухолью размера 1 см в диаметре. Каждая точка означает средний размер опухоли с доверительным интервалом 95%, указанным как для 6 мышей, так и для обозначенного числа мышей.
Обогащенный молочный жир замедлял рост опухолей на 25% на 49 сутки, по сравнению с контрольной диетой, но эффект был незначимым (фиг.1). В отличие от этого, обозначенный молочный жир полностью предотвращал развитие опухолей у 2 из 6 мышей. Рост опухолей у других 4 мышей, которых содержали на диете с молочным жиром, был схожим с ростом опухолей у мышей, которых кормили обогащенным молочным жиром.
Пример 3
В примере показано, что молочный жир действует синергично с иммунотерапией в уничтожении опухолей EL-4.
Опухоли прививали в группе из пяти мышей, которых кормили как обогащенным молочным жиром, молочным жиром, так и содержали на контрольной диете, как описано выше в примере 2. Контролировали размер опухоли, измеренный посредством нахождения двух перпендикулярных диаметров (в сантиметрах). При достижении опухолями ~0,4 см в диаметре, в опухоли вводили комплексы ДНК-липосомы, содержащие 60 мкг экспрессирующей плазмиды B7-1. Момент введения плазмиды показан стрелкой. Размер опухоли, измеренный посредством нахождения двух перпендикулярных диаметров (в сантиметрах), контролировали до 91 суток или до достижения опухолью размера 1 см в диаметре. Опухоли этого конкретного размера частично сохраняют чувствительность к иммуногенному лечению B7-1, о чем свидетельствует тот факт, что контрольные опухоли у четырех мышей медленно уменьшались в течение одной недели, но затем возобновили рост. Однако опухоль у одной мыши уменьшалась и полностью исчезла в течение 4 недельного периода после инъекции плазмиды B7-1 (фиг.2).
Опухоли у мышей, которых кормили молочным жиром, уменьшались более быстро, чем у контрольных мышей, поскольку им требовалось 2 недели для исчезновения после инъекции плазмиды B7-1. В отличие от этого опухоли у мышей, которых кормили обогащенным молочным жиром, были устойчивы к иммуногенному лечению B7-1 и росли со скоростью, близкой к росту опухолей у мышей, которых содержали на контрольной диете. Таким образом, молочный жир усиливает действие иммунотерапии против злокачественной опухоли, тогда как обогащенный молочный жир является менее эффективным.
Пример 4
В примере показано, что молочный жир действует синергично с лактоферрином, насыщенным железом, чтобы полностью ингибировать образование опухолей.
В предыдущих исследованиях заявители показали, что Lf, насыщенный железом (Lf+), способен ингибировать рост опухоли (WO/2006/054908). В этих экспериментах исследовали эффект от совместного введения молочного жира и Lf+. Мы пытались определить, может ли молочный жир действовать синергично с Lf+ в борьбе с лимфомой.
Группу из шести мышей содержали на контрольной диете AIN-93G, диетах, содержащих или 28 г Lf+, или 120 г молочного жира (AMF) на 2,4 кг пищи, или диете, содержащей комбинацию и Lf, и молочного жира. Сутки 0 относятся к суткам начала помещения мышей на соответствующую диету. После двух недель диеты в бока мыши вводили 2×105 клеток EL-4. Размер опухоли, найденный посредством измерения двух перпендикулярных диаметров (в сантиметрах), контролировали до 56 суток. Каждая точка означает средний размер опухоли с доверительным интервалом 95%, указанным как для 6 мышей, так и для обозначенного числа мышей.
Появление опухолей задержалось на одну неделю у 5 из 6 мышей, которых кормили Lf+, и у всех 6 мышей, которых содержали на диете с молочным жиром (фиг.3A). У одной из 6 мышей, которых содержали на диете с Lf+, произошло полное отторжение опухоли. В отличие от этого полное отторжение привитой опухоли произошло у всех шести мышей, которых содержали на диете, содержащей комбинацию Lf+ и молочного жира, что указывает на то, что молочный жир действует синергично с Lf+ в уничтожении лимфом.
Пример 5
В примере показано, что молочный жир увеличивает способность Lf+ повышать противоопухолевую цитотоксичность лейкоцитов и опухолевый апоптоз.
Спленоциты выделяли на 56 сутки из мышей, описанных в примере 4, и анализировали их цитолитическую активность против клеток мишеней EL-4. Противоопухолевая цитолитическая активность спленоцитов, полученных из мышей, которых кормили или Lf+, или молочным жиром, была достоверно повышена на 66% (P<0,001) и 61% (P<0,01) соответственно по сравнению с мышами, которых содержали на контрольной диете (фиг.3B). Противоопухолевая цитолитическая активность была, кроме того, повышена на 86% (P<0,001) по сравнению с контролями у мышей, которых кормили комбинацией Lf+ и молочного жира.
Срезы получали из опухолей мышей, описанных в примере 4, на 56 сутки и окрашивали способом опосредованного концевой дезоксинуклеотидилтрансефразой концевого мечения разрывов дезоксиуридинтрифосфатом-дигоксигенином (TUNEL) и также посредством способа флуоресценции с аннексином V (annexin-V-fluos). Число апоптотических клеток определяли посредством способа TUNEL или флуоресценции с аннексином V (annexin-V-fluos), анализировали 10 случайно выбранных областей окрашенных опухолевых срезов, визуализированных через увеличение x40. Апоптотический индекс (A/I) представляет собой число клеток в апоптозе (положительных в TUNEL или флуоресценции с аннексином)×(100/общее число клеток). Молочный жир и Lf+ стимулировали опухолевый апоптоз на 73% и 68% соответственно по сравнению с контрольной диетой (фиг.3C). В соответствии со своей повышенной противоопухолевой цитолитической активностью комбинация молочного жира и Lf+ повышала опухолевый апоптоз на 84%.
Пример 6
В этом примере показано, что молочный жир ингибирует опухолевый ангиогенез.
Эффекты Lf+ и молочного жира на опухолевый кровоток и образование кровеносных сосудов анализировали посредством окрашивания опухолевых срезов, полученных, как описано в примере 5, с mAbs против CD31 и против CD 105 и посредством перфузии DiO7 соответственно. От мышей, подвергнутых обработке, как описано в примере 4, на 56 сутки получали опухолевые срезы и окрашивали или с mAb MEC13,3 против CD31, или mAb против CD 105 для визуализации кровеносных сосудов, или альтернативно за одну минуту до сбора тканей, в хвостовую вену вводили DiO7 для того, чтобы визуализировать поток крови. Окрашенные кровеносные сосуды считали у шести мышей в шести вслепую выбранных случайных областях.
Как показано на фиг.3D, число CD31 + сосудов в опухолях мышей, которых кормили Lf+, молочным жиром или комбинацией молочного жира и Lf+, было достоверно снижено на 84% (P<0,001), 72% (P<0,001) и 84% (P<0,01) соответственно, и кровоток был снижен на 84% (P<0,001), 68% (P<0,001) и 84% (P<0,001) соответственно по сравнению с мышами, которых содержали на контрольной диете. Похожие результаты получали при окрашивании CD105+ сосудов и перфузии DiO7 как дополнительных маркеров образования сосудов опухоли. Данные результаты показывают, что молочный жир ингибирует ангиогенез.
Пример 7
В примере показано, что порошок альфа липидов (Phospholac 600™), сфингомиелин и 9, 11 изомеры CLA ингибируют рост опухолей, но не действуют синергично с Lf+ для эффективного уничтожения опухолей.
Группу из пяти мышей линии C57BL/6 содержали на контрольной диете AIN-93 (фиг.4A) или на той же диете с замещением на 28 г Lf+ (фиг.4B), на 120 г phospholac 600™ (фиг.4C) или на 1,2 г сфингомиелина (фиг.4D) (обеспечивая ~71 и 0,71% жирового компонента диеты соответственно) на 2,4 кг пищи. Через две недели после назначения диеты мышам прививали подкожно опухолевые клетки EL-4. Размер опухоли опять измеряли посредством нахождения двух перпендикулярных диаметров (в сантиметрах).
Lf+ задержал рост опухоли, у двух опухолей рост задерживался на две недели и у одной по меньшей мере на одну неделю. Phospholac 600™ полностью ингибировал опухолеобразование у одной мыши и задерживал образование опухоли у других мышей в течение 24 суток, при этом не оказывал заметного влияния на рост опухолей у остальных трех мышей по сравнению с мышами, которых содержали на контрольной диете. Сфингомиелин являлся таким же эффективным, как и Lf+, поскольку задерживал опухолевый рост на ~1 неделю у двух мышей и на ~2 недели у двух других мышей, при этом не оказывал заметного влияния на рост опухолей у остальных мышей. Дополнительную группу из пяти мышей кормили комбинациями Lf+ (28 г на 2,4 кг питания) и или Phospholac 600™ (120 г на 2,4 кг пищи) (фиг.4E), или сфингомиелина (1,2 г на 2,4 кг пищи) (фиг.4F). Lf+ в комбинации с Phospholac 600™ не привел к полному уничтожению опухоли (как видно из настоящего документа для комбинация Lf+ и молочного жира). Скорее, суммарный эффект был похож на эффект, наблюдаемый при монотерапии Phospholac 600™.
Комбинация Lf+ и сфингомиелина была менее эффективной, чем соответствующие виды монотерапий, такой, что опухолевый рост был такой же, как у контрольных мышей, что позволяет предположить, что два биологически активных средства могут противодействовать друг другу (фиг.4F).
Включение в диету мышей c-9, t-11 изомеров CLA из расчета 5 г на 2,4 кг питания, обеспечивающих 3% жирового компонента диеты, только слабо ингибировало рост опухолей 4T1 и не показало синергичного действия с Lf+.
Пример 8
В примере показано, что молочный жир задерживает рост опухолей рака молочной железы линии 4T1 как индивидуально, так и в комбинации с химиотерапией.
Группу из 6 мышей линии Balb/c содержали на контрольной диете AIN-93 или той же диете с замещением на 5% молочный жир, обеспечивающим ~71% жирового компонента диеты. Через две недели после помещения на диету мышам прививали подкожно 2×104 опухолевых клеток 4Т1. У мышей контролировали рост опухоли, и размер опухоли измеряли каждые трое суток.
По сравнению с мышами, которых содержали на контрольной диете, опухоли у мышей, которых содержали на диете с молочным жиром, прощупывались тремя сутками позже и на 35-е сутки после прививания, когда мышей умертвили, образованные опухоли были меньше в среднем на 21% (P<0,05) (фиг.5). Химиотерапевтическое лекарственное средство паклитаксел вводили интраперитонеально (30 мг/кг масса тела), как только опухоли достигали ~0,5 см в диаметре, что приводило к снижению размера опухолей (на 35 сутки) на 31% (P<0,05) у мышей, которых содержали на контрольной диете. На 35 сутки, в результате лечения паклитакселом, у мышей, которых кормили молочным жиром, размеры опухолей были снижены на 35% (P<0,05) и 49% (P<0,01) по сравнению с мышами, которых содержали на контрольной диете с лечением паклитакселом и мышами, которых содержали на контрольной диете без лечения соответственно.
Пример 9
В примере показано, что молочный жир подавляет разрастание опухолей линии 4T1 рака молочной железы, которые диссеминируют в легкие и печень.
Подавление метастазов в легких: клеточная линия 4T1 рака молочной железы обладает высокой способностью к метастазированию и диссеминирует в легкие и печень. Легкие мышей в примере 8 (сутки 35) были проверены на наличие опухолей и микрометастазов. Среднее число опухолей на поверхности легких мышей, которых содержали на контрольной диете без лечения, мышей, которых содержали на контрольной диете с лечением паклитакселом, мышей, которых кормили молочным жиром без лечения, и мышей, которых кормили молочным жиром с лечением паклитакселом, составляло 32, 18, 22 и 10 соответственно (фиг.6).
По сравнению с мышами, которых содержали на контрольной диете без лечения, лечение паклитакселом и кормление молочным жиром в высоких дозах достоверно снижало (P<0,01) число опухолей на поверхности легких на 44% и 31% соответственно.
Диета с молочным жиром в комбинации с лечением паклитакселом приводила к еще большему уменьшению числа опухолей, на 63% (P<0,001) и 44% (P<0,05), по сравнению с мышами, которых содержали на контрольной диете без лечения паклитакселом, и мышами, которых содержали на контрольной диете с лечением паклитакселом соответственно. Соответственно, масса легких мышей, которых содержали на контрольной диете с лечением паклитакселом, мышей, которых кормили молочным жиром без лечения, и мышей, которых кормили молочным жиром с лечением паклитакселом, была достоверно снижена на 30, 22 и 40% по сравнению с мышами, которых содержали на контрольной диете без лечения (таблица 7).
Масса тела, опухоли, органа и ткани и количество клеток крови1
Подавление метастазов в печени: аналогичным образом проверили на наличие опухолей и микрометастазов печень у мышей выше. Печень вырезали, делали срезы и окрашивали с гематоксилин/эозином и подсчитывали число метастатических узелков внутри печени. Среднее число метастазов у мышей, которых содержали на контрольной диете без лечения, у мышей, которых содержали на контрольной диете с лечением паклитакселом, у мышей, которых кормили молочным жиром без лечения, и у мышей, которых кормили молочным жиром с лечением паклитакселом было 108, 59, 74 и 36 соответственно (фиг.7). Таким образом, лечение паклитакселом и кормление молочным жиром в высоких дозах достоверно (P<0,01) уменьшало число опухолей в печени на 45% и 32% соответственно по сравнению с мышами, которых содержали на контрольной диете без лечения.
Диета с молочным жиром в комбинации с лечением паклитакселом приводила к еще большему уменьшению числа опухолей на 67% (P<0,001) и 39% (P<0,05) по сравнению с мышами, которых содержали на контрольной диете без лечения, и мышами, которых содержали на контрольной диете с лечением паклитакселом, соответственно.
Пример 10
В примере показано, что молочный жир ингибирует ангиогенез опухоли.
Для того чтобы оценить опухолевый ангиогенез, приведенные выше первичные опухоли 4T1 (пример 8; 35 сутки) вырезали у мышей, которых содержали на контрольной диете без лечения, у мышей, которых содержали на контрольной диете с лечением паклитакселом, у мышей, которых кормили молочным жиром без лечения, и у мышей, которых содержали на диете с молочным жиром с лечением паклитакселом, делали срезы и окрашивали с антителом против CD31 для выявления сосудистых эндотелиальных клеток. Кровеносные сосуды, окрашенные с mAb против CD31, подсчитывали в случайных областях, выбранных вслепую для регистрации средней плотности сосудов (8A), или среднего расстояния до ближайшего кровеносного сосуда, меченого mAb к CD31, из точки расположения (8B).
При лечении паклитакселом и кормлении молочным жиром в высоких дозах достоверно (P<0,05) уменьшалась плотность микрососудов (CD31+ сосуды) на 37% и 31% соответственно по сравнению с мышами, которых содержали на контрольной диете без лечения (фиг.8A). Соответственно, при лечении паклитакселом и кормлении молочным жиром в высоких дозах достоверно (P<0,05) повышалось среднее расстояние до ближайших CD31+ сосудов на 71 и 59% соответственно (фиг.8B).
Диета с молочным жиром в комбинации с лечением паклитакселом приводила к еще большему снижению плотности микрососудов на 52% (P<0,001) и 22% (P<0,05) по сравнению с мышами, которых содержали на контрольной диете без лечения, и мышами, которых содержали на контрольной диете с лечением паклитакселом, соответственно. Соответственно, диета с молочным жиром в комбинации с лечением паклитакселом приводила к еще большему увеличению среднего расстояния до ближайших CD31+ сосудов на 125% (P<0,001) и 31% (P<0,05) по сравнению с мышами, которых содержали на контрольной диете без лечения, и мышами, которых содержали на контрольной диете с лечением паклитакселом, соответственно.
Пример 11
Кахексия является серьезной проблемой для субъектов со злокачественной опухолью, поскольку ослабляет физическое состояние и снижает ответную реакцию субъектов на лечение. Улучшенное питание является одним из способов борьбы с кахексией. В этом эксперименте исследовали, улучшит ли кормление молочным жиром состояние мышей при кахексии на модели рака молочных желез, использованной заявителем, и приведет ли длительное кормление высокими дозами молочного жира, который содержит насыщенные жирные кислоты (например, стеарат), к гиперхолистеринемии, которая была бы неблагоприятной для некоторых органов, таких как печень и селезенка. В этом примере показано, что диета с молочным жиром в высоких дозах не проявляет очевидного токсичного действия на органы и ослабляет кахексию, вызванную прогрессирующей злокачественной опухолью.
Отсутствие токсичного действия на органы. В селезенке и печени мышей, которых кормили повышенными дозами молочного жира, не наблюдали очевидных признаков токсичного воздействия, и не было значимого изменения массы органов (P>0,05) по сравнению с мышами, которых содержали на контрольной диете (таблица 7).
Уменьшение симптомов кахексии. Модель 4T1 метастатического рака молочной железы представляет идеальную модель кахексии при злокачественной опухоли. Прививание опухолей приводило к значимому снижению убойной массы тела на 12% (P<0,05), что отражало потери в массе икроножной мышцы и эпидидимальной жировой ткани на 40% (P<0,05) и 83% (P<0,01) соответственно по сравнению с мышами, не имеющими опухолей, которых содержали на той же контрольной диете (таблица 7). Уменьшенные проявления кахексии наблюдали у мышей, которых содержали на диете с молочным жиром, о чем свидетельствует достоверно увеличенная убойная масса тела (P<0,05) на (9,2 и 17,6%) и масса икроножной мышцы на (33,4 и 27,6%) и эпидидимальной жировой ткани на (107 и 141%) у мышей, которых кормили молочным жиром без лечения, и у мышей, которых кормили молочным жиром с лечением паклитакселом, по сравнению с теми мышами, которых содержали на контрольной диете без лечения, и мышами, которых содержали на контрольной диете с лечением паклитакселом, соответственно. Увеличение массы икроножной мышцы и эпидидимальной жировой ткани не ограничивалось мышами-опухоленосителями, поскольку кормление молочным жиром здоровых мышей, не имеющих опухоль, увеличивало массу двух последних тканей на 8,2 и 12% (P<0,05) соответственно по сравнению с теми здоровыми мышами, не имеющими опухоль, которых содержали на контрольной диете.
Пример 12
Одним из наиболее тяжелых побочных эффектов злокачественной опухоли и лечения злокачественных опухолей, такого как химиотерапия, является гематологическая супрессия, которая может приводить к иммунологической недостаточности, а та в свою очередь может являться причиной тяжелых инфекций и даже смерти. В этом примере показано, что диета с молочным жиром уменьшает гематологическую супрессию, вызванную злокачественной опухолью и химиотерапией.
Нарушение гемопоэза обнаруживали у мышей с кахексией из примера 11, приведенного выше, поскольку количество эритроцитов (RBC) и лейкоцитов (WBC) было достоверно сниженным на 23 и 29% (P<0,05) соответственно по сравнению с теми здоровыми мышами, не имеющими опухоль, которых содержали на той же контрольной диете (таблица 7). Химиотерапия паклитакселом приводила к дальнейшему снижению количества RBC и WBC на 49 и 44% и соответствующему снижению массы селезенки на 8,5% по сравнению с мышами-опухоленосителями, которых содержали на контрольной диете.
В отличие от этого, количество RBC и WBC у мышей, которых кормили молочным жиром с лечением паклитакселом, снижалось только на 11% и 7% и масса селезенки на 3% соответственно по сравнению с теми здоровыми мышами, не имеющими опухоль, которых содержали на контрольной диете (таблица 7). Количество WBC у мышей-опухоленосителей, которых кормили молочным жиром без лечения, снизилось только на 5%, тогда как количество RBC незначительно повысилось на 9% (P<0,05) и масса селезенки полностью восстановилась. Достоверно повышалось количества RBC и WBC у мышей, которых кормили молочным жиром с лечением паклитакселом, на 56 и 57% (P<0,01) соответственно и на 11% масса селезенки (P<0,05) по сравнению с теми мышами, которых содержали на контрольной диете с лечением паклитакселом (таблица 7). Количество RBC и WBC у мышей-опухоленосителей, которых кормили молочным жиром без лечения, повышалось на 34 и 27% (P<0,05) по сравнению с теми мышами-опухоленосителями, которых содержали на контрольной диете без лечения.
Таким образом, диета с молочным жиром ослабляет гематологическую супрессию посредством повышения или восстановления числа эритроцитов и лейкоцитов, которое уменьшено вследствие злокачественной опухоли и вследствие химиотерапии.
Пример 13
Цитотоксические лекарственные средства повреждают ворсинки кишечника, что приводит к тому, что они становятся сглаженными, и, таким образом, изменяются всасывающие свойства пищеварительного тракта (Melichar et al., 2005). В этом примере показано, что диета с молочным жиром улучшает состояние при повреждении кишечника, вызванное химиотерапией.
Чтобы определить защищал ли молочный жир пищеварительный тракт от повреждений, обусловленных паклитакселом, группу из 6 мышей линии Balb/c содержали на контрольной диете AIN-93 или на той же диете с замещением на 5% молочный жир, обеспечивающим ~71% жирового компонента диеты. Спустя две недели каждой мыши сделали интраперитонеальную инъекцию паклитаксела (30 мг/кг масса тела). Еще через одну неделю мышей умерщвляли и отделяли тощую кишку. Погруженные в парафин срезы тощей кишки мышей, которых содержали на контрольной диете, диете с молочным жиром, контрольной диете плюс паклитаксел и диете с молочным жиром плюс паклитаксел, окрашивали с гематоксилином и эозином.
Как ожидалось, здоровые мыши, которых без лечения содержали на контрольной диете и диете с молочным жиром, имели неповрежденные ворсинки кишечника. В отличие от этого, срезы, полученные от мышей, которых лечили паклитакселом, показали, что тощая кишка этих мышей содержит поврежденные и сглаженные ворсинки. Ворсинки у мышей, которых кормили молочным жиром с лечением паклитакселом, были большей частью неповрежденными, что позволяет предположить, что диета с молочным жиром оказывает защитное действие на слизистую оболочку кишечника.
Для того чтобы определить степень повреждения кишечника, измеряли среднюю длину ворсинок. По сравнению с ворсинками контрольных мышей, паклитаксел достоверно снижал среднюю длину ворсинок на 61% (P<0,01) (фиг.9A). Диета с молочным жиром защищала кишечник от повреждений, вызванных паклитакселом, поскольку средняя длина ворсинок у мышей, которых кормили молочным жиром с лечением паклитакселом, снижалась на 29% (P<0,05) по сравнению с контрольными мышами. Ворсинки мышей, которых содержали на диете с молочным жиром с лечением паклитакселом, были достоверно длиннее (40%, P<0,05), чем ворсинки мышей, которых содержали на контрольной диете с лечением паклитакселом.
Активность γ-глутамилтранспептидазы (γ-GGT) тощей кишки, показателя состояния щеточной каемки эпителия тонкого кишечника (Tate и Meister, 1981 и Ferraris, et al., 1992), регистрировали как отдельный параметр повреждения кишечника. Лечение паклитакселом заметно снижало уровень γ-GGT в слизистой оболочке тощей кишки на 56% (P<0,01) по сравнению с контрольными мышами без лечения (фиг.9B), тогда как активность γ-GGT у мышей, которых содержали на диете с молочным жиром с лечением паклитакселом, снижалась только на 29% (P<0,05). Активность γ-GGT тощей кишки достоверно увеличивалась у мышей, которых содержали на диете с молочным жиром с лечением паклитакселом (78%, P<0,05) по сравнению с теми мышами, которых содержали на контрольной диете с лечением паклитакселом.
Мукозит тонкого кишечника, вызванный химиотерапией, ассоциирован с клеточным апоптозом в криптах, который предшествует атрофии ворсинок (Keefe, et al., 2000). Очень немного апоптотических клеток было в криптах у мышей, которых без лечения содержали на контрольной диете и на диете с молочным жиром. В отличие от этого, срезы кишечника мышей, которых содержали на контрольной диете и лечили паклитакселом, содержали большое число клеток в апоптозе. Диета с молочным жиром заметно уменьшала число апоптотических телец. Апоптотические клетки подсчитывали в 10 случайно выбранных криптах и выражали в виде апоптотических телец на крипту (фиг.10). Лечение паклитакселом достоверно повышало число апоптотических телец в 6 раз по сравнению с мышами без лечения. Диета с молочным жиром достоверно снижала число апоптотических телец у мышей с лечением паклитакселом на 39% (P<0,05) по сравнению с контрольной диетой.
Обсуждение примеров 1-13
В описанных выше экспериментах показано, что перорально вводимый нормальный безводный молочный жир обладает противоопухолевой активностью. Введение молочного жира усиливало действие иммунотерапии на верифицированную лимфому и увеличивало действие химиотерапевтического лечения на верифицированные опухоли при раке молочной железы.
Молочный жир в комбинации с Lf+ полностью ингибировал опухолеобразование у всех субъектов, имеющих лимфому, обуславливая повышенную противоопухолевую цитолитическую активность, опухолевый апоптоз, и сокращал количество кровеносных сосудов опухоли.
Введение молочного жира в комбинации с химиотерапевтическим лечением замедляло рост опухолей при раке молочной железы, кроме того, молочный жир, или индивидуально или в комбинации с химиотерапевтическим лечением, при раке молочной железы достоверно подавлял метастазирование опухолей в легкие и печень и разрастание в этих органах.
Противоопухолевую активность также наблюдали при введении фракций молочного жира. Так, и Phospholac 600™, и сфингомиелин приводили к задержке опухолеобразования.
Кроме того, введение молочного жира снижает гематологическую супрессию, кахексию и повреждение кишечника, возникающие вследствие опухолей при раке молочной железы и/или химиотерапии.
Пример 14
В примере показано, что молочный жир достоверно ингибирует потерю массы вследствие химиотерапии и может способствовать увеличению массы.
Диеты
Экспериментальные пищевые рационы получали посредством Crop & Food Research, Palmerston North, New Zealand, используя в качестве контрольного пищевого рациона порошкообразный препарат AIN93G. В диете AIN93G в качестве источника белка использовали казеин, а в качестве источника липидов использовали соевое масло. Соевое масло заменяли в экспериментальных пищевых рационах на безводный молочный жир (AMF) так, что общее содержание липидов питания оставалось неизмененным. Диеты включали или 100, 35,7 или 7,1 г AMF на 2 кг питания, обеспечивая 70, 25 и 5% общего содержания липидов в диете (140 г липидов/2 кг). Свежей пищей обеспечивали два раза в неделю и мыши имели свободный доступ к пище и воде на всем протяжении исследования.
Экспериментальная модель для анализа побочных эффектов химиотерапии
Циклофосфамид вводили в соответствии с Animal Ethics Approval (University of Auckland). Все эксперименты включали 6 мышей на лечебную группу, если не указано иначе. Циклофосфамид разводили в PBS, вводили i.p. в количестве 300 мг/кг. Во время аутопсии собирали кровь посредством кардиальной пункции.
Группу из шести мышей линии C57BL/6 содержали на диете AIN93G или той же диете с замещением или 5%, 25%, или 70% молочным жиром и после 4 недель кормления, в сутки 0 интраперитонеально вводили циклофосфамид (300 мг/кг массы тела). Мышей умерщвляли через 4, 8 и 12 суток и анализировали ткани на наличие побочных эффектов лечения лекарственным средством, как описано ниже.
Как показано на фиг.11A, в сутки 0 не было значительного различия в массе тел мышей (т.е. через 4 недели содержания на четырех различных диетах перед началом химиотерапии). В отличие от этого, а именно через 4 суток химиотерапии, мыши, которых содержали на контрольной диете, потеряли 7% массы тела (фиг.11B). В случае двух повышенных доз молочного жира степень потери массы достоверно уменьшалась на 54% на 4 сутки (P<0,001) и 39% (P=0,0017) соответственно по сравнению с контрольной диетой. В случае пониженной дозы молочного жира потеря массы недостоверно снижалась на 19% (P=0,068) по сравнению с контролем. У мышей на контрольной диете наблюдали небольшое увеличение в прибавке массы тела через 12 суток химиотерапии, тогда как, в отличие от этого, масса тел мышей, которых кормили наименьшей дозой молочного жира, восстановилась почти до нормы (P<0,001), а мыши на диете с двумя повышенными дозами молочного жира фактически прибавили в массе (фиг.11C).
Пример 15
В примере показано, что молочный жир облегчает восстановление лейкоцитов, циркулирующих в крови, и лейкоцитов селезенки (WBC) после химиотерапии, стимулирует развитие колониеобразующих единиц в селезенке и обеспечивает восстановление селезенки.
Содержание на различных диетах с молочным жиром в течение 4 недель перед началом химиотерапии не повлияло значимо на количество периферических WBC. Циклофосфамид существенно снижал количество периферических WBC у мышей в примере 14 на 4 сутки, более чем на 90%, независимо от диеты (фиг.12). У всех четырех групп мышей количество WBC начало восстанавливаться на 8 сутки. На 12 сутки достоверно увеличивался уровень восстановления количества WBC в группе мышей, которых кормили самой высокой дозой молочного жира (P=0,0028). Количество WBC у таких мышей вернулось к нормальному значению. В отличие от этого, более низкие дозы молочного жира не способствовали значимо восстановлению числа WBC.
Содержание на различных диетах с молочным жиром в течение 4 недель перед началом химиотерапии не повлияло значимо на объем клеточного содержимого селезенки (фиг.13A). Циклофосфамид существенно снижал объем клеточного содержимого селезенки на 4 сутки у мышей, которых содержали на контрольной диете. По сравнению с контрольной диетой, на 4 сутки диеты с 70%, 25% и 5% молочным жиром ослабляли потерю селезенкой клеточного содержимого на 52%, 41% и 25% соответственно. На 8 сутки, диеты с 70% и 25% молочным жиром ослабляли потерю селезенкой клеточного содержимого на 32% и 27% соответственно, при этом на 12 сутки только диета с 70% молочным жиром оказала влияние на объем клеточного содержимого селезенки (фиг.13A).
Восстановление количества клеток внутри селезенки начиналось с образования колониеобразующих единиц в селезенке на 4 сутки после начала химиотерапии. На 8 сутки каждая из диет с 70%, 25% и 5% молочным жиром достоверно стимулировала образование колониеобразующих единиц в селезенке на 207%, 130% и 85% соответственно (фиг.13B). На 12 сутки объем клеточного содержимого селезенки у мышей, которых содержали на диете с 70% и 25% молочным жиром, почти восстановился до нормального значения, таким образом не удивительно, что при содержании на диете с молочным жиром число колониеобразующих единиц достоверно снижалось, тогда как селезенки мышей, которых содержали на контрольной диете, все еще подвергались восстановлению (фиг.13B).
Пример 16
В примере показано, что молочный жир увеличивает размер и содержание гемоглобина в эритроцитах (RBC) после химиотерапии.
Циклофосфамид, независимо от питания, на 8 сутки снижал количество периферических RBC у мышей из примера 14 (фиг.14A). Потеря количества RBC, которая была меньше чем уровень снижения количества WBC в примере 15, составляла от 17% до 22% на 4 сутки. Число RBC продолжало снижаться до 8 суток и на 12 сутки полностью не восстановилось. Диета с молочным жиром не повлияла значимо на снижение количества RBC, опосредованное циклофосфамидом. Несмотря на то что при повышенных дозах молочного жира наблюдалось повышение восстановления числа RBC, результаты были незначимыми.
Неожиданно оказалось, что каждая из двух повышенных доз молочного жира предотвращала уменьшение и/или способствовала восстановлению уровня гематокрита (HCT) (фиг.14B). Гематокрит представляет собой процент цельной крови, которая содержит эритроциты, и представляет собой способ измерения как числа RBC, так и размера RBC. Учитывая, что диеты с молочным жиром не повлияли значимо на число RBC, можно предположить, что повышение уровней HCT является результатом повышения среднего объема RBC. Диета с 70% молочным жиром достоверно (P=0,023) задерживала понижение уровня HCT на 8 сутки (снижение 18% по сравнению с 31% снижением при контрольной диете) и повышала уровень HCT почти до нормальных уровней на 12 сутки (P<0,001). Диета с 25% молочным жиром достоверно способствовала восстановлению уровней HCT на 8 (P=0,017) и 12 сутки (P=0,006), когда на 8 сутки наблюдалось 18% снижение по сравнению с 31% снижением при контрольной диете и на 12 сутки наблюдалось 9% снижение по сравнению с 24% снижением для контрольной диеты. Результаты в случае самой низкой дозы молочного жира не достигли значимого значения.
Ключевым вопросом являлся вопрос о том, отразится ли увеличение уровня HCT также на увеличении общего уровня гемоглобина. Диета с 70% молочным жиром уменьшала снижение уровня гемоглобина на 8 сутки, когда наблюдалось 22% снижение по сравнению с 31% снижением при контрольной диете, но разница не достигла значимого значения (фиг.14C). Однако на 12 сутки такая диета достоверно повышала уровень гемоглобина на 8% (P=0,0048) по сравнению с мышами, которых содержали на контрольной диете. Диета с 25% молочного жира достоверно способствовала восстановлению уровня гемоглобина на 8 (P=0,030) и 12 сутки (P=0,015), когда на 8 сутки наблюдалось 20% снижение по сравнению с 31% снижением при контрольной диете и на 12 сутки наблюдалось 12% снижение по сравнению с 26% снижением при контрольной диете. Результаты в случае самой низкой дозы молочного жира не достигли значимого значения.
Таким образом, результаты показывают, что хотя употребление молочного жира не влияет достоверно на число RBC, оно увеличивает размер RBC и содержание гемоглобина в RBC и может, таким образом, иметь возможное положительное влияние при анемии. Данные результаты имеют важное значение для лечения железодефицитной анемии, например, микроцитарной анемии, которая характеризуется патологически малым размером RBC.
Пример 17
Как описано выше, мукозит возникает, когда химиотерапия злокачественной опухоли разрушает быстро делящиеся эпителиальные клетки, выстилающие желудочно-кишечный тракт, оставляя слизистую оболочку тканей открытой для изъязвления и инфекции. В примере показано, что молочный жир уменьшает повреждение кишечника вследствие химиотерапии.
Чтобы определить, защищал ли молочный жир желудочно-кишечный тракт от повреждений, вызванных действием циклофосфамида, тощую кишку мышей в примере 14 делили на срезы, погружали в парафин и окрашивали гематоксилином и эозином.
Кормление в течение 4 недель перед химиотерапией различными диетами с молочным жиром не оказало явного эффекта на ворсинки тощей кишки (фиг.15). Срезы кишечника мышей, которым делали одну инъекцию циклофосфамида, показали, что тощая кишка мышей содержала разрушенные и сглаженные ворсинки. Для оценки повреждений, вызванных химиотерапией, использовали среднюю длину ворсинок. Циклофосфамид достоверно уменьшал среднюю длину ворсинок на 65% (P<0,001) по сравнению со здоровыми контрольными мышами (фиг.15). Диеты с 70%, 25% и 5% молочным жиром защищали от повреждения кишечника, вызванного циклофосфамидом, поскольку средняя длина ворсинок у мышей, которых содержали на диете с молочным жиром с лечением циклофосфамидом, на 4 сутки снижалась на 36% (P<0,01), 41% (P<0,01) и на 52% (P<0,001) соответственно и на 8 сутки на 21% (P<0,05), 24% (P<0,01) и 31% (P<0,01) соответственно по сравнению с мышами, которых содержали на контрольной диете. Ворсинки после химиотерапии у мышей, которых содержали на диетах с 70% и 25% молочным жиром с лечением циклофосфамидом, были достоверно длиннее на 4 сутки (71% и 58% соответственно для обоих диет P<0,01) и на 8 сутки (44% и 36% соответственно для обоих диет P<0,05), чем у мышей, которых содержали на контрольной диете с лечением циклофосфамидом. На 12 сутки кишечник мышей, которых содержали на контрольной диете начал восстанавливаться, и только самая высокая доза молочного жира показывала сохранение достоверного эффекта.
Результаты позволяют предположить, что диеты с молочным жиром оказывают защитное действие на слизистую оболочку кишечника, особенно в течение первых нескольких суток после начала химиотерапии, когда побочные эффекты от лечения являются наиболее явными. Не желая ограничиваться любой теорией, предполагают, что защита кишечника посредством питания с молочным жиром по меньшей мере частично приводит к уменьшенной потере массы вследствие химиотерапии и к повышенному увеличению массы, наблюдаемой у мышей, которых кормили такими видами питания. Диета с молочным жиром, по-видимому, помогает сохранить аппетит и всасывающие свойства желудочно-кишечного тракта. Увеличение массы происходило не только вследствие повышенной калорийности молочного жира, поскольку диеты уравновешены по энергоемкости и мыши, которых кормили молочным жиром, не прибавляли в массе в течение четырехнедельного периода кормления перед химиотерапией.
Обсуждение примеров 14-17
В примерах 1-13, описанных выше, исследовано влияние молочного жира на побочные эффекты от химиотерапии у мышей-опухоленосителей. В примерах 14-17 исследовалось непосредственное действие молочного жира на побочные эффекты, опосредованные химиотерапией циклофосфамидом, у других контрольных здоровых мышей. Циклофосфамид представляет собой лекарственное средство, которое сильно ингибирует метаболизм и деление клетки, таким образом, в качестве побочного эффекта циклофосфамид ингибирует рост и деление клеток иммунной и кровеносной систем, приводя к миелосупрессии и анемии. В исследованиях сообщают, что анемия, вызванная химиотерапией, включая анемию от легкой до умеренной, имеет отрицательное влияние на качество жизни субъектов со злокачественной опухолью (Groopman JE, Itri LM. Chemotherapy-induced anemia in adults: incidence and treatment. J Natl Cancer Inst. 1999 Oct 6; 91 (19):1616-34). Химиотерапия может также снижать качество жизни субъектов со злокачественной опухолью, обуславливая потерю массы в результате плохого аппетита, мукозита, тошноты, повреждения кишечника и дегидратации.
Результаты, полученные в настоящем документе, показывают, что молочный жир является эффективным в предупреждении или уменьшении побочных эффектов химиотерапии.
Пример 18
В примере показано, что молочный жир действует синергично с Lf+ для снижения многочисленных побочных эффектов химиотерапии у субъекта, включающих гематологическую супрессию, анемию и повреждение желудочно-кишечного тракта.
Диеты
Экспериментальные пищевые рационы получали от Crop & Food Research, Palmerston North, New Zealand, используя как основу порошкообразный состав AIN93G. В диете AIN93G использовали казеин как источник белка и соевое масло как источник липидов. Соевое масло в экспериментальных пищевых рационах заменяли безводным молочным жиром (AMF) так что общее содержание липидов в диете не изменялось. Казеин в экспериментальных пищевых рационах заменяли Lf+, так что общее содержание белка в диете не изменялось. Диеты с замещением на AMF содержали 35 г AMF на 2 кг питания, обеспечивая 25% от общего содержания липидов питания (140 г липидов/2 кг). Диеты с замещением на Lf+ содержали или 0,1, 1, или 10 г Lf+ на 2 кг питания, обеспечивая 0,025, 0,25 и 2,5% от общего содержания белка питания (400 г белка/2 кг). Некоторые диеты содержали комбинацию из 35 г AMF на 2 кг питания и одного из перечисленных выше количеств Lf+. Свежим питанием обеспечивали два раза в неделю и мыши имели свободный доступ к пище и воде на всем протяжении исследования.
Экспериментальная модель для анализа побочных эффектов химиотерапии
Циклофосфамид вводили в соответствии с Animal Ethics Approval (University of Auckland). Во все эксперименты включали 24 мыши на группу лечения. Циклофосфамид, растворенный в PBS, вводили i.p. из расчета 300 мг/кг. Для сбора крови мышей подвергали глубокой анестезии и обескровливали посредством сердечной пункции.
Группу из 24 мышей линии C57BL/6, содержащую равное число самок и самцов мышей, содержали на диете AIN93G или той же диете с замещением на молочный жир, Lf+ или комбинацию молочного жира и Lf+ и после 4 недель кормления в сутки 0 вводили интраперитонеально циклофосфамид (300 мг/кг масса тела). Мышей умерщвляли группами по шесть мышей в сутки 0, и 4, 8 и 12 сутками позже, и анализировали кровь и ткань кишечника для изучения побочных эффектов лечения лекарственным средством, как описано ниже.
Среднюю длину ворсинок анализировали на 8 сутки, применяя двухфакторный дисперсионный анализ (ANOVA) для оценки эффектов замещения молочным жиром (0 vs. 25%), замещения Lf+ (0 vs. 0,025%) и их взаимодействия. Раздельные группы сравнивали, применяя способ множественного сравнения Tukey's.
Молочный жир действует синергично с Lf+, чтобы ингибировать повреждения кишечника, вызванное химиотерапией. Содержание на различных диетах с молочным жиром в течение 4 недель перед химиотерапией не имело явного влияния на длину ворсинок тощей кишки (фиг.16). Среднюю длину ворсинок использовали как оценку повреждений, вызванных химиотерапией. Циклофосфамид достоверно снижал среднюю длину ворсинок во всех группах на 4 сутки (фиг.16). 25% молочный жир способствовал восстановлению кишечника от повреждений, вызванных циклофосфамидом. На 8 сутки средняя длина ворсинок в группе с молочным жиром была достоверно больше (P<0,001), чем в контрольной группе.
Комбинация молочного жира и Lf+ привела к достоверно большей длине ворсинок по сравнению только с молочным жиром и только с Lf+ (P<0,01).
Пример 19
В примере показано, что молочный жир действует синергично с Lf+, чтобы способствовать восстановлению циркулирующих лейкоцитов (WBC) после химиотерапии.
Для того чтобы оценить эффекты обогащения молочным жиром (0 vs. 25%), обогащения Lf+ (0 vs. 0,025%) и их комбинации анализировали разницу в количестве WBC между 4 сутками и 8 сутками, используя двухфакторный ковариационный анализ (ANCOVA). Массу тела во время химиотерапии включали как независимую переменную. Комбинацию молочного жира и Lf+ сравнивали только с молочным жиром или только с Lf+, используя односторонний критерий Даннетта.
Количество WBC в образцах из сердечной пункции регистрировали в сутки начала химиотерапии и через 4, 8 и 12 суток, как описано в примере 18. Содержание на диете с молочным жиром и диете с 0,025% Lf+ в течение 4 недель перед химиотерапией не имело значимого эффекта на количество периферических WBC (фиг.17). Циклофосфамид значительно снижал количество периферических WBC на 4 сутки у всех мышей в примере 19. Количество WBC начало восстанавливаться на 8 сутки у всех групп мышей. Таким образом, сравнивали число WBC в случае самых низких значений (4 сутки) с 8 сутками, когда число WBC уже значительно восстановилось. По сравнению с диетой с 0,025% Lf+ (P=0,049) и диетой с молочным жиром (P=0,012) увеличение количества WBC было достоверно больше у мышей, которых кормили 0,025% Lf+ и молочным жиром в комбинации.
Пример 20
В примере показано, что молочный жир действует синергично с Lf+, чтобы увеличить число и размер эритроцитов (RBC) после химиотерапии, с тенденцией к увеличению содержания гемоглобина.
Для того чтобы оценить эффекты обогащения молочным жиром (0 vs. 25%), обогащения Lf+ (0 vs. 0,025%) и их комбинации, анализировали количество RBC, HCT и уровни гемоглобина, используя двухфакторный анализ (ANCOVA). Массу тела во время химиотерапии включали как независимую переменную. Комбинацию молочного жира и Lf+ сравнивали только с молочным жиром или только с Lf+, используя односторонний критерий Даннетта.
Количество RBC, HCT и уровень гемоглобина в образцах кардиальной пункции регистрировали в сутки начала химиотерапии и через 4, 8 и 12 суток, как описано в примере 18.
Циклофосфамид снижал количество RBC на 4 и 8 сутки у мышей в примере 20, независимо от диеты (фиг.18). Число RBC продолжало сокращаться до 8 суток и затем начинало восстанавливаться, но не достигло полного восстановления на 12 сутки. Молочный жир показывал уменьшение падения на 4 и 8 сутки и действовал синергично с 0,25% Lf, что способствовало восстановлению числа RBC на 12 сутки. Количество RBC на 12 сутки было достоверно больше у мышей, которых кормили 0,25% Lf+ и молочным жиром в комбинации по сравнению с диетой с 0,25% Lf+ (P=0,018) и диетой с молочным жиром (P=0,024).
Циклофосфамид снижал HCT на 4 и 8 сутки у мышей в примере 20 независимо от диеты (фиг.19). HCT продолжало снижаться до 8 суток и затем начинало восстанавливаться, но не достигло полного восстановления на 12 сутки. Молочный жир показывал снижение падения на 4 и 8 сутки и действовал синергично с 0,25% Lf, что способствовало восстановлению уровней HCT на 12 сутки. Уровни HCT на 12 сутки были достоверно больше у мышей, которых кормили 0,25% Lf+ и молочным жиром в комбинации по сравнению с диетой с 0,25% Lf+ (P=0,046) и диетой с молочным жиром P=(0,047).
Циклофосфамид снижал уровни гемоглобина на 4 и 8 сутки у мышей в примере 20 независимо от диеты (фиг.20). Гемоглобин продолжал снижаться до 8 суток и затем начинал восстанавливаться, но не достигал полного восстановления на 12 сутки. Молочный жир показывал снижение падения на 4 и 8 сутки и действовал синергично с 0,25% Lf, что способствовало восстановлению уровня гемоглобина на 12 сутки. Уровень гемоглобина на 12 сутки был достоверно выше у мышей, которых кормили 0,25% Lf+ и молочным жиром в комбинации по сравнению с диетой с 0,25% Lf+ (P=0,038). И был выше, но не так достоверно, по сравнению с диетой с молочным жиром (P=0,094).
Таким образом, результаты показывают, что употребление молочного жира в комбинации с 0,25% Lf+ достоверно увеличивает число и размер RBC, и существует тенденция к увеличению общего содержания гемоглобина. Результаты имеют важное значение при лечении анемии, включая анемию, обусловленную химиотерапией.
Пример 21
В примере показано, что молочный жир достоверно уменьшает анорексию и кахексию, которые обусловлены химиотерапией. Диеты, содержащие комбинацию молочного жира и Lf+, также уменьшают анорексию и кахексию, которые обусловлены химиотерапией.
Массу тела регистрировали в сутки начала химиотерапии и через 4, 8 и 12 суток, как описано в примере 18. Молочный жир достоверно (P=0,004) увеличивал массу тел мышей независимо от пола, обогащения Lf+ и суток, т.е. вследствие потери любых значимых взаимодействий, объединяли для анализа животных обоих полов, все сутки и все группы кормления с Lf (фиг.21). Эффекты молочного жира были специфичны для химиотерапии, поскольку ни диета с молочным жиром, ни другие диеты не имели какого-либо достоверного эффекта на массу тел мышей перед химиотерапией.
Промышленное применение
Способы, медицинское применение и композиции по настоящему изобретению имеют пользу при ингибировании роста опухоли, сохранении или улучшении одного или нескольких параметров, таких как количество лейкоцитов, эритроцитов или миелоидных клеток, при стимулировании иммунной системы и при лечении или предупреждении злокачественной опухоли. Способы и лечебное применение можно реализовать посредством применения диетических (в качестве пищевых продуктов или пищевых добавок к пищевому продукту), нутрицевтических или фармацевтических композиций.
Специалисты в данной области поймут, что описание, приведенное выше, предоставлено только как способ иллюстрации и что изобретение не ограничено ими.
Ссылки
Ainscough, E.W, Brodie A.M.; Plowman J.E. The chromium, manganese, cobalt and copper complexes of human lactoferrin. Inorganica Chimica Acta 1979, 33 (2) 149-53.
Andrade L.N, de Lima T.M, Curi R, Castrucci A.M. Toxicity of fatty acids on murine and human melanoma cell lines. Toxicol In Vitro. 2005; 19:553-60.
Baker E.N, Baker H.M, Kidd R.D., Lactoferrin and transferrin: functional variations on a common structural framework. Biochem Cell Biol. 2002; 80(1):27-34.
Banni S, Angioni E, Murru E, Carta G, Melis M.P, Bauman D, Dong Y, Ip C. Vaccenic acid feeding increases tissue levels of conjugated linoleic acid and suppresses development of premalignant lesions in rat mammary gland. Nutr Cancer. 2001; 41:91-7.
Bates G.W. and Schlabach M.R. (1973). The reaction of Ferric salts with Transferrin. J Biol. Chem 248, 3228-3232.
Bates G.W, Billups C, Saltman P, (1967). The kinetics and mechanism of iron exchange between chelates and transferrin. 1. The complexes of citrate and nitrilotriacetic acid. J. Biol. Chem. 242, 2810-2815.
Beer T.M, Eilers K.M, Garzotto M, Egorin M.J, Lowe B.A, Henner W.D. Weekly high-dose calcitriol and docetaxel in metastatic androgen independent prostate cancer. J Clin. Oncol. 2003; 21:123-8.
Beer T.M, Munar M, Henner W.D. A Phase I trial of pulse calcitriol in patients with refractory malignancies: pulse dosing permits substantial dose escalation. Cancer. 2001; 91:2431-9.
Beer T.M, Myrthue A. Calcitriol in cancer treatment: from the lab to the clinic. Mol. Cancer Ther. 2004; 3:373-81.
Belobrajdic D.P, McIntosh G.H. Dietary butyrate inhibits NMU-induced mammary cancer in rats. Nutr Cancer. 2000; 36:217-23.
Bestak R, Halliday G.M. Sunscreens protect from UV-promoted squamous cell carcinoma in mice chronically irradiated with doses of UV radiation insufficient to cause edema. Photochem Photobiol. 64:188-93, 1996.
Bougnoux P, Chajes V, Lanson M, Hacene K, Body G, Couet C, Le Floch O. Prognostic significance of tumor phosphatidylcholine stearic acid level in breast carcinoma. Breast Cancer Res Treat. 1992; 20:185-94.
Bowie J.U, Reidhaar-Olson J.F, Lim W.A, Sauer R.T. Deciphering the message in protein sequences: tolerance to amino acid substitutions. Science. (1990) 247(4948):1306-10.
Bradlow H.L, Sepkovic D.W. Diet and breast cancer. Ann N.Y Acad Sci. 2002; 963:247-67.
Brock J.H, Arzabe F.R (1976), Cleavage of diferric bovine transferrin into two monoferric fragments. FEBS Lett 69, 63-66.
Brock J.H. The physiology of lactoferrin. Biochem Cell Biol. 2002; 80:1-6.
Buckman D.K, Chapkin R.S, Erickson K.L. Modulation of mouse mammary tumor growth and linoleate enhanced metastasis by oleate. J Nutr. 1990; 120:148-57.
Bylund, G. (Ed.) Dairy processing handbook. 1995 Tetra Pak Processing Systems AB, S-221 86 Lund, Sweden.
Cadwell, R.C. and G.F. Joyce. Randomization of genes by PCR mutagenesis. PCR Methods Appl. 1992; 2:28-33.
Calonghi N, Pagnotta E, Parolin C, Tognoli C, Boga C, Masotti L. 9-Hydroxystearic acid interferes with EGF signalling in a human colon adenocarcinoma. Biochem Biophys Res Commun. 2006; 342:585-8.
Chen B.Q, Xue Y.B, Liu J.R, Yang Y.M, Zheng Y.M, Wang X.L, Liu R.H. Inhibition of conjugated linoleic acid on mouse forestomach neoplasia induced by benzo (a) pyrene and chemopreventive mechanisms. World J Gastroenterol. 2003; 9:44-9.
Cohen L.A, Zhao Z, Pittman B, Scimeca J. Effect of soy protein isolate and conjugated linoleic acid on the growth of Dunning R-3327-AT-1 rat prostate tumours. Prostate. 2003; 54:169-80.
Colomer R, Menendez J.A. Mediterranean diet, olive oil and cancer. Clin. Transl Oncol. 2006; 8:15-21.
Colston K.W, Pirianov G, Bramm E, Hamberg K.J, Binderup L. Effects of Seocalcitol (EB1089) on nitrosomethyl urea-induced rat mammary tumors. Breast Cancer Res Treat. 2003; 80:303-11.
Conneely O.M. Antiinflammatory activities of lactoferrin. J Am College Nutr 2001; 20:389S-395S.
Corl B.A, Barbano D.M, Bauman D.E, Ip С cis-9, trans-11 CLA derived endogenously from trans-11 18:1 reduces cancer risk in rats. J Nutr. 2003; 133:2893-900.
Dass C.R. Tumour angiogenesis, vascular biology and enhanced drug delivery. J Drug Target. 2004 Jun; 12(5):245-55.
Ding I, Sun J.Z, Fenton В et al. Intratumoral administration of endostatin plasmid inhibits vascular growth and perfusion in MCa-4 murine mammary carcinomas. Cancer Res. 2001; 61:526-531.
Ealey K.N, el-Sohemy A, Archer M.C. Conjugated linoleic acid does not inhibit development of aberrant crypt foci in colons of male Sprague-Dawley rats. Nutr Cancer. 2001; 41:104-6.
Facon M.J, Skura B.J. Antibacterial activity of lactoferricin, lysozyme and EDTA against Salmonella enteritidis. Int. Dairy J. 1996, 6 (3) 303-13.
Fermor B.F, Masters J.R, Wood C.B, Miller J, Apostolov K, Habib N.A. Fatty acid composition of normal and malignant cells and cytotoxicity of stearic, oleic and sterculic acids in vitro. Eur J Cancer. 1992; 28A: 1143-7.
Ferraris R.P, Villenas S.A, Diamond J. Regulation of brush-border enzyme activities and enterocyte migration rates in mouse small intestine. Am J Physiol. 1992; 262: G1047-G1059.
Foley A.A, Bates G.W. The purification of lactoferrin from human whey to batch extraction Analytica Biochemistry 1987, 162 (1) 296-300.
Freireich E.J, Gehan E.A, Rail D.P, Schmidt L.H, Skipper H.E., Quantitative comparison of toxicity of anticancer agents in mouse, rat, hamster, dog, monkey, and man. Cancer Chemother Rep. (1966) 50(4):219-44.
Gaard M, Tretli S, Loken E.B. Dietary fat and the risk of breast cancer: a prospective study of 25, 892 Norwegian women. Int J Cancer. 1995; 63:13-7.
Galdiero F, Carratelli C.R, Nuzzo I, Bentivoglio C, De Martino L, Gorga F, Folgore A, Galdiero M. Beneficial effects of myristic, stearic or oleic acid as part of liposomes on experimental infection and antitumor effect in a murine model. Life Sci. 1994; 55:499-509.
Goldbohm R.A. Intake of conjugated linoleic acid, fat, and other fatty acids in Goodman M.T, Wu A.H, Tung K.H, McDuffie K, Kolonel L.N, Nomura A.M, Terada K, Wilkens L.R, Murphy S, Hankin J.H. Association of dairy products, lactose, and calcium with the risk of ovarian cancer. Am J Epidemiol. 2002; 156:148-57.
Gulaia N.M, Smirnov I.M, Shmal'ko IuP, Mel'nik A.A, Mel'nik S.N. Effect of N-palmitoyl- and N-stearoylethanolamines on lipid peroxidation in mouse tissues in metastatic Lewis carcinoma. Ukr Biokhim Zh. 1993; 65:96-101.
Guyton K.Z, Kensler T.W, Posner G.H. Cancer chemoprevention using natural vitamin D and synthetic analogs. Annu Rev. Pharmacol. Toxicol. 2001; 41:421-42.
Guyton K.Z, Kensler T.W, Posner G.H. Vitamin D and vitamin D analogs as cancer chemopreventive agents. Nutr Rev. 2003; 61:227-38.
Ha Y.L, Grimm N.K, Pariza M.W. Anticarcinogens from fried ground beef: heat-altered derivatives of linoleic acid. Carcinogenesis. 1987; 8:1881-7.
Harada H, Yamashita U, Kurihara H, Fukushi E, Kawabata J, Kamei Y. Antitumor activity of palmitic acid found as a selective cytotoxic substance in a marine red alga. Anticancer Res. 2002; 22:2587-90.
Harfoot C.G. and Hazlewood G.P. "Lipid metabolism in the rumen" in P.N. Hobson (Ed.) "The Rumen Microbial Ecosystem" at pages 285 to 322, Elsevier Applied Science Publishers, London (1988).
Harris D.M, Go V.L.'Vitamin D and colon carcinogenesis. J Nutr. 2004; 134:3463S-3471S.
Hjartaker A, Laake. P, Lund E. Childhood and adult milk consumption and risk of premenopausal breast cancer in a cohort of 48,844 women - the Norwegian women and cancer study. Int J Cancer. 2001; 93:888-93.
Holick M.F. Vitamin D: importance in the prevention of cancers, type 1 diabetes, heart disease, and osteoporosis. Am J Clin. Nutr. 2004; 79:362-71.
Hooper C.W, Robscheit F.S, Whipple G.H. Am J Physiol. Blood regeneration following simple anemia: III. Influence of bread and milk, crackermeal, rice and potato, casein and gliadin in varying amounts and combinations. 1920; 53, 206-35.
Inaba K, Inaba M, Romani N, Aya H, Deguchi M, Ikehara S, Muramatsu S, Steinman R.M. Generation of large numbers of dendritic cells from mouse bone marrow cultures supplemented with granulocyte/macrophage colony-stimulating factor. J Exp Med. 1992; 176:1693-1702.
Jung K.С, Park C.H, Hwang Y.H, Rhee H.S, Lee J.H, Kim H.K, Yang C.H. Fatty acids, inhibitors for the DNA binding of c-Myc/Max dimer, suppress proliferation and induce apoptosis of differentiated HL-60 human leukemia cell. Leukemia. 2006; 20:122-7.
Kanwar J, Berg R, Lehnert K, and Krissansen G.W. Taking lessons from dendritic cells: Multiple xenogeneic ligands for leukocyte integrins have the potential to stimulate anti-tumour immunity. Gene Therapy 1999; 6:1835-44.
Kanwar J.R, Kanwar R, Pandey S, Ching L-M, and Krissansen G.W. Vascular attack by 5,6-dimethylxanthenone-4-acetic acid combined with B7.1-mediated immunotherapy overcomes immune-resistance and leads to the eradication of large tumors. Cancer Res 2000; 61:1948-56.
Kanwar J.R, Shen W.P, Kanwar R.K, Berg R.W, Krissansen G.W. Effects of survivin antagonists on growth of established tumors and B7-1 immunogene therapy. J Natl. Cancer Inst. 2001; 93:1541-52.
Karthikeyan S, Sujata Sharma, Ashwani K. Sharma, M. Paramasivam, Savita Yadav, A. Srinivasan and Tej P. Singh, Structural variability and functional convergence in lactoferrins, Current Science (1999) 77(2):241.
Kawakami H et al. Effect of lactoferrin on iron solubility under neutral conditions. BiosScience Biotech Biochem. 1993; 57(8) 1376-1377.
Keefe D.M.K, Brealey J, Goland G.J, Cummins A.G. Chemotherapy for cancer causes apoptosis that precedes hypoplasia in crypts of the small intestine in humans. Gut 2000; 47:632-637.
Kerwin S.M. Soy saponins and the anticancer effects of soybeans and soy-based foods. Curr Med Chem. Anti-Cane Agents. 2004; 4:263-72.
Kim K.H, Park H.S. Dietary supplementation of conjugated linoleic acid reduces colon tumour incidence in DMH-treated rats by increasing apoptosis with modulation of biomarkers. Nutrition. 2003; 19:772-7.
Kimmerlin T, Seebach D. 100 years of peptide synthesis: ligation methods for peptide and protein synthesis with applications to beta-peptide assemblies. J Pept Res. 2005 Feb; 65(2):229-60.
Kimura Y. Carp oil or oleic acid, but not linoleic acid or linolenic acid, inhibits tumor growth and metastasis in Lewis lung carcinoma-bearing mice. J Nutr. 2002; 132:2069-75.
Knekt P, Jarvinen R, Seppanen R, Pukkala E, Aromaa A. Intake of dairy products and the risk of breast cancer. Br J Cancer. 1996; 73:687-91.
Kris-Etherton P. Bioactive compounds in foods: Their role in prevention of cardiovascular disease and cancer. Americal Journal of Medicine 113: 71S-88S, 2002.
Kristiansen E, Madsen C, Meyer O, Roswall K, Thorup I. Effects of high-fat diet on incidence of spontaneous tumors in Wistar rats. Nutr Cancer. 1993; 19:99-110.
Larsson S.C, Bergkvist L, Wolk A. High-fat dairy food and conjugated linoleic acid intakes in relation to colorectal cancer incidence in the Swedish Mammography Cohort. Am J Clin. Nutr. 2005; 82:894-900.
Larsson S.C, Orsini N, Wolk A. Milk, milk products and lactose intake and ovarian cancer risk: a meta-analysis of epidemiological studies. Int J Cancer. 2006; 118:431-41.
Law, B.A. and Reiter, В., The isolation and bacteriostatic properties of lactoferrin from bovine milk whey. J. Dairy Res. (1977) 44:595-599.
Legrand D, Mazurier J, Metz-Boutigue M-H, Jolles J, Jolles P, Montreuil J & Spik G (1984). Characterization and localization of an iron-binding 18-kDa glycopeptide isolated from the N-terminal half of human lactotransferrin. Biochimica et Biophysica acta 787, 90-96.
Leung, D.W., Chen,. E.Y., Goeddel, D.V. A Method for Random Mutagenesis of a Defined DNA. Segment Using a Modified Polymerase Chain Reaction. Technique 1989; 1:11-15.
Ma J, Giovannucci E, Pollak M, Chan J.M, Gaziano J.M, Willett W, Stampfer M.J. Milk intake, circulating levels of insulin-like growth factor-I, and risk of colorectal cancer in men. J Natl Cancer Inst. 2001; 93:1330-6.
Masson P.L, Heremans J.F. Studies on lactoferrin, the iron-binding protein of secretions. Protides of the Biological Fluids 1966, 14, 115-24.
Masso-Welch P.A, Zangani D, Ip C, Vaughan M.M, Shoemaker S, Ramirez R.A, Ip M.M. Inhibition of angiogenesis by the cancer chemopreventive agent conjugated linoleic acid. Cancer Res. 2002; 62:4383-9.
Mata L, Castillo H, Sanchez L, Puyol P, Calvo M. Effect of trypsin on bovine lactoferrin and interaction between the fragments under different conditions. J Dairy Res. (1994) 61(3):427-32.
Matsubara K, Saito A, Tanaka A, Nakajima N, Akagi R, Mori M, Mizushina Y. Catechin conjugated with fatty acid inhibits DNA polymerase and angiogenesis. DNA Cell Biol. 2006; 25:95-103.
Melichar B, Dvorak J, Hyspler R, Zadak Z. Intestinal permeability in the assessment of intestinal toxicity of cytotoxic agents. Chemotherapy. 2005; 51:336-8.
Menendez J.A, Vellon L, Colomer R, Lupu R. Oleic acid, the main monounsaturated fatty acid of olive oil, suppresses Her-2/neu (erbB-2) expression and synergistically enhances the growth inhibitory effects of trastuzumab (Herceptin) in breast cancer cells with Her-2/neu oncogene amplification. Ann Oncol. 2005; 16:359-71.
Metz-Boutigue M.H, Jolles J, Mazurier J, Schoentgen F, Legrand D, Spik G, Montreuil J, Jolles P. Human lactotransferrin: amino acid sequence and structural comparisons with other transferrins. Eur J Biochem. 1984; 145(3):659-76.
Miller A, Stanton C, Murphy J, Devery R. Conjugated linoleic acid (CLA)-enriched milk fat inhibits growth and modulates CLA-responsive biomarkers in MCF-7 and SW480 human cancer cell lines. Br J Nutr. 2003; 90:877-85.
Moore S.A, Anderson B.F, Groom C.R, Haridas M, Baker E.N. Three-dimensional structure of diferric bovine lactoferrin at 2.8 A resolution. J Mol. Biol. 1997 Nov 28; 274(2):222-36.
Moorman P.G, Terry P.D. Consumption of dairy products and the risk of breast cancer: a review of the literature. Am J Clin. Nutr. 2004; 80:5-14.
Nakagawa K, Sasaki Y, Kato S, Kubodera N, Okano T. 22-Oxa-lalpha,25-dihydroxyvitamin D3 inhibits metastasis and angiogenesis in lung cancer. Carcinogenesis. 2005; 26:1044-54.
Nelson R.L, Samelson S.L. Inability of the mutagen-blocking agent oleic acid to protect against colon carcinogenesis in the rat. Mutat Res. 1984; 140(2-3):155-7.
Nguyen L.T, Schibli D.J, Vogel J. Structural studies and model membrane interactions of two peptides derived from bovine lactoferricin. Journal of Peptide Science 2005, 11 (7) 379-89.
Nolan E, Donepudi M, Van Weelden K, Flanagan L, Welsh J.E. Dissociation of vitamin D3 and anti-estrogen mediated growth regulation in MCF-7 breast cancer cells. Mol Cell Biochem. 1998; 188:13-20.
Norris G.E, Baker H.M, Baker E.N. Preliminary crystallographic studies on human apo-lactoferrin in its native and deglycosylated forms. J Mol Biol. 1989; 209(2):329-31.
O'Shea M, Devery R, Lawless F, Murphy J, Stanton С Milk fat conjugated linoleic acid (CLA) inhibits growth of human mammary MCF-7 cancer cells. Anticancer Res. 2000; 20:3591-601.
Park E.J and Pezzuto J.M. Botanicals in cancer prevention. Cancer and Metastasis Reviews 21:231-255, 2002.
Parodi P.W. Conjugated linoleic acid and other anticarcinogenic agents of bovine milk fat. J Dairy Sci. 1999; 82:1339-49.
Parodi P.W. Cows' milk fat components as potential anticarcinogenic agents. J Nutr. 1997; 127:1055-60.
Parodi P.W. Dairy product consumption and the risk of breast cancer. J Am Coll Nutr. 2005; 24(6 Suppl): 556S-68S.
Peleg S, Posner G.H. Vitamin D analogs as modulators of vitamin D receptor action. Curr Top Med Chem. 2003; 3:1555-72.
Pierce A, Colavizza D, Benaissa M, Maes P, Tartar A, Montreuil J, Spik G. Molecular cloning and sequence analysis of bovine lactotransferrin. Eur J Biochem. 1991; 196(1):177-84.
Qin L.Q, Xu J.Y, Wang P.Y, Ganmaa D, Li J, Wang J, Kaneko T, Hoshi K, Shirai T, Sato A. Low-fat milk promotes the development of 7,12 dimethylbenz(A)anthracene (DMBA)-induced mammary tumours in rats. Int J Cancer. 2004; 110:491-6.
Sambrook, J.; Fritsch, E.F.; Maniatis, T. (1989). Molecular Cloning: A Laboratory Manual. Cold Spring Harbour Lab Press, Cold Spring Harbour, New York.
Saul A.W. Vitamin D: Deficiency, diversity and dosage. J Orthomolecular Med. 2003; 18:194-204.
Schulz M, Lahmann P.H, Riboli E, Boeing H. Dietary determinants of epithelial ovarian cancer: a review of the epidemiologic literature. Nutr Cancer. 2004; 50:120-40.
Shin M.H, Holmes M.D, Hankinson S., Wu K, Colditz G.A, Willett W.C. Intake of dairy products, calcium, and vitamin d and risk of breast cancer. J Natl Cancer Inst. 2002; 94:1301-11.
Siegel I, Liu T.L, Yaghoubzadeh E, Keskey T.S, Gleicher N. Cytotoxic effects of free fatty acids on ascites tumor cells. J Natl Cancer Inst. 1987; 78:271-7.
Steinman R.M, Turley S, Mellman I, Inaba K. The induction of tolerance by dendritic cells that have captured apoptotic cells. J Exp Med. 2000 7; 191:411-416.
Stemmer W.P. DNA shuffling by random fragmentation and reassembly: in vitro recombination for molecular evolution. Proc Natl Acad Sci USA 1994; 91:10747-10751.
Sun, X., Kanwar, J.R., Leung, E., Lehnert, K., Wang, D., and Krissansen, G.W. Gene transfer of antisense hypoxia inducible factor-la enhances the therapeutic efficacy of cancer immunotherapy. Gene Therapy 8: 638-645, 2001.
Superti F, Siciliano R, Rega B, Giansanti F, Valenti P, Antonini G (2001) Involvement of bovine lactoferrin metal saturation, sialic acid and protein fragments in the inhibition of rotavirus infection. Biochim Biophya Acta 1528 (2-3) 107-15.
Suzuki I, Iigo M, Ishikawa C, Kuhara T, Asamoto M, Kunimoto T, Moore M.A, Yazawa K, Araki E, Tsuda H. Inhibitory effects of oleic and docosahexaenoic acids on lung metastasis by colon-carcinoma-26 cells are associated with reduced matrix metalloproteinase-2 and -9 activities. Int J Cancer. 1997; 73:607-12.
Tate S.S, Meister A. Gamma-glutamyl transpeptidase: catalytic, structural and functional aspects. Mol Cell Biochem. 1981; 39:357-368.
Tomita M, Bellamy W, Takase M, Yamauchi K, Wakabayashi H, Kawasi K. Potent antibacterial peptides generated by pepsin digestion of bovine lactoferrin. J. Dairy Science 1991, 74 (12) 4137-4.
Tomita M, Takase M, Bellamy W, Shimamura S. A review: the active peptide of lactoferrin. Acta Paediatr. Jpn. 1994, 36, 585-91.
Tomita M, Takase, M, Wakabayashi H & Bellamy W (1994) Antimicrobial Peptides of Lactoferrin in Lactoferrin Structure and Function, pp.209-218. Eds T.W. Hutchens, S.V. Rumball, В Lonnerdal, Plenum Press, New York.
Tomita M, Wakabayashi H, Yamauchi K, Teraguchi S, Hayasawa H; Bovine lactoferrin and lactoferricin derived from milk: production and applications. Biochemistry and Cell Biology 2002, 80(1)109-12.
Tseng M, Breslow R.A, Graubard B.I, Ziegler R.G. Dairy, calcium, and vitamin D intakes and prostate cancer risk in the National Health and Nutrition Examination Epidemiologic Follow-up Study cohort. Am J Clin. Nutr. 2005; 81:1147-54.
Tsuda H, Sekine К, Fujita К, Iigo M. Cancer prevention by bovine lactoferrin and underlying mechanisms-a review of experimental and clinical studies. Biochem Cell Biol 2002; 131-36.
Tsuji S, Hirata Y, Matsuoka K. Two apparent molecular forms of bovine lactoferrin. J Dairy Sci. 1989; 72(5):1130-6.
van der Kraan MIA, Groenink J, Nazmi K, Veerman ECI,. Bolscher JGM, Nieuw Amerongen AV. Lactoferrampin: a novel antimicrobial peptide in the N1-domain of bovine lactoferrin. Peptides 2004, 25(2) 177-83.
Van Duuren B.L, Goldscbmidt B.M. Co-carcinogenic and tumor-promoting agents in tobacco carcinogenesis. J Natl Cancer Inst. 1976; 56:1237-42.
van Veen H.A, Geerts M.E, van Berkel P.H, Nuijens J.H. The role of N-linked glycosylation in the protection of human and bovine lactoferrin against tryptic proteolysis. Eur. J. Biochem. (2004). 271(4):678-684.
van Weelden K, Flanagan L, Binderup L, Tenniswood M, Welsh J.E. Apoptotic regression of MCF-7 xenografts in nude mice treated with the vitamin D analog EB1089. Endocrinology 1998; 139:2102-10.
Veierod M.B, Laake P, Thelle D.S. Dietary fat intake and risk of prostate cancer: a prospective study of 25,708 Norwegian men. Int J Cancer. 1997 27;73(5):634-8.
Viejo-Diaz M, Andres M.T, Perez-Gil J, Sanchez M, Fierro J F. Potassium Efflux Induced by a New Lactoferrin-Derived Peptide Mimicking the Effect of Native Human Lactoferrin on the Bacterial Cytoplasmic Membrane. Biochemistry (Moscow) 2003, 68 (2) 217-27.
Voorrips L.E, Brants H.A, Kardinaal A.F, Hiddink G.J, van den Brandt P.A, relation to postmenopausal breast cancer: the Netherlands Cohort Study on Diet and Cancer. Am J Clin. Nutr. 2002; 76:873-82.
Ward P.P, Uribe-Luna S, Conneely O.M. Lactoferrin and host defense. Biochem Cell Biol. 2002; 80:95-102.
Watkins S.M, Carter L.C, Mak J, Tsau J, Yamamoto S, German J.B. Butyric acid and tributyrin induce apoptosis in human hepatic tumour cells. J Dairy Res. 1999; 66:559-67.
Weinberg E.D. Human lactoferrin: a novel therapeutic with broad spectrum potential. Pharm Pharmacol. 2001; 53:1303-10.
Whipple G.H. and Robscheit F.S. Blood regeneration in severe anemia. Am J Physiol. 1926; 79:280-88.
Yamaki T, Yano T, Satoh H, Endo T, Matsuyama C, Kumagai H, Miyahara M, Sakurai H, Pokorny J, Shin S.J, Hagiwara K. High oleic acid oil suppresses lung tumorigenesis in mice through the modulation of extracellular signal-regulated kinase cascade. Lipids. 2002; 37:783-8.
Yamasaki M, Ikeda A, Hirao A, Tanaka Y, Miyazaki Y, Rikimaru T, Shimada M, Sugimachi K, Tachibana H, Yamada K. Effect of dietary conjugated linoleic acid on the in vivo growth of rat hepatoma dRLh-84. Nutr Cancer. 2001; 40:140-8.
Yee Y.K, Chintalacharuvu S.R, Lu J, Nagpal S. Vitamin D receptor modulators for inflammation and cancer. Mini Rev Med Chem. 2005; 5:761-78.
Yoshida, S. and Xiuyn, Ye. Isolation of Lactoperoxidase and Lactoferrins from Bovine Milk Acid Whey by Carboxymethyl Cation Exchange Chromatography. J Dairy Sci. 1991; 74:1439-1444.
Ziotnik Y, Patya M, Vanichkin A, Novogrodsky A. Tyrphostins reduce chemotherapy-induced intestinal injury in mice: assessment by a biochemical assay. Br J Cancer. 2005; 92:294-297.
Zusman I, Gurevich P, Madar Z, Nyska A, Korol D, Timar B, Zuckerman A. Tumor-promoting and tumor-protective effects of high-fat diets on chemically induced mammary cancer in rats. Anticancer Res. 1997; 17(1A):349-56.
| название | год | авторы | номер документа |
|---|---|---|---|
| ДИАГНОСТИКА И ЛЕЧЕНИЕ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ, ЯИЧНИКОВ И ДРУГИХ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ | 2009 |
|
RU2556129C2 |
| СПОСОБ ТЕРАПИИ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ | 2011 |
|
RU2577993C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ДЛЯ ЛЕЧЕНИЯ ОПУХОЛЕЙ | 2009 |
|
RU2531758C2 |
| УЛУЧШЕННЫЕ СПОСОБЫ ЛЕЧЕНИЯ ОПУХОЛЕЙ | 2007 |
|
RU2481853C2 |
| СПЕЦИФИЧЕСКАЯ СОЧЕТАННАЯ ТЕРАПИЯ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ ЦИТОСТАТИКОМ И ЕГО МОДИФИКАТОРОМ | 2015 |
|
RU2571551C1 |
| ПРЕПАРАТ И КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ | 2017 |
|
RU2777595C2 |
| ПРИМЕНЕНИЕ ПАРАЗИТОВ И ВНЕКЛЕТОЧНЫХ ВЕЗИКУЛ, ПОЛУЧЕННЫХ ИЗ ПАРАЗИТОВ, ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ | 2020 |
|
RU2814990C2 |
| СПОСОБ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ | 2020 |
|
RU2816126C2 |
| КОМБИНАЦИЯ АНТИ-PD-L1 АНТИТЕЛА И ИНГИБИТОРА ДНК-ПК ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ | 2018 |
|
RU2765997C2 |
| ЛЕЧЕНИЕ РАКА КОМБИНАЦИЕЙ ЛУЧЕВОЙ ТЕРАПИИ, НАНОЧАСТИЦ ОКСИДА ЦЕРИЯ И ХИМИОТЕРАПЕВТИЧЕСКОГО СРЕДСТВА | 2015 |
|
RU2704811C2 |
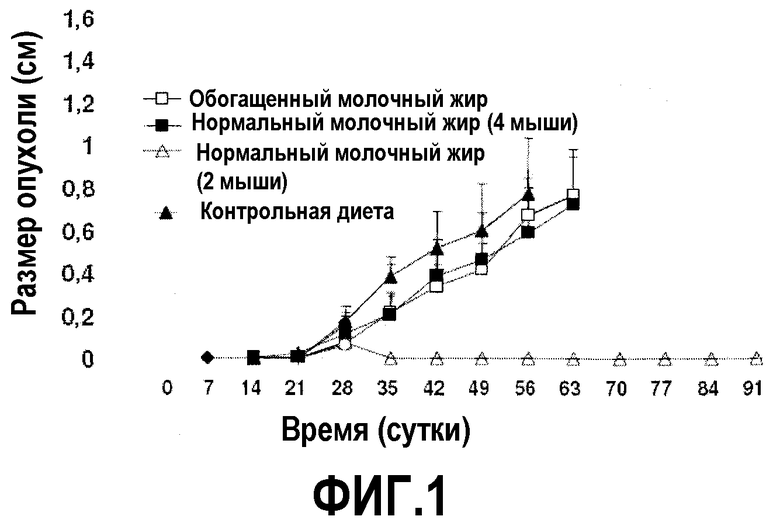
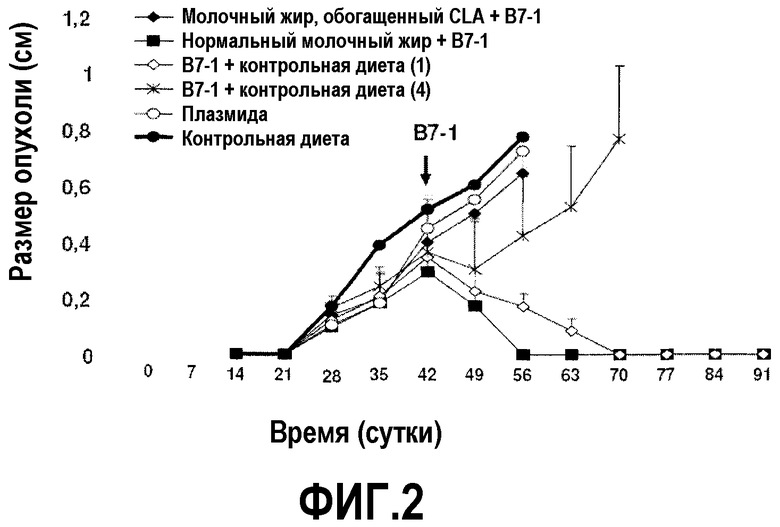
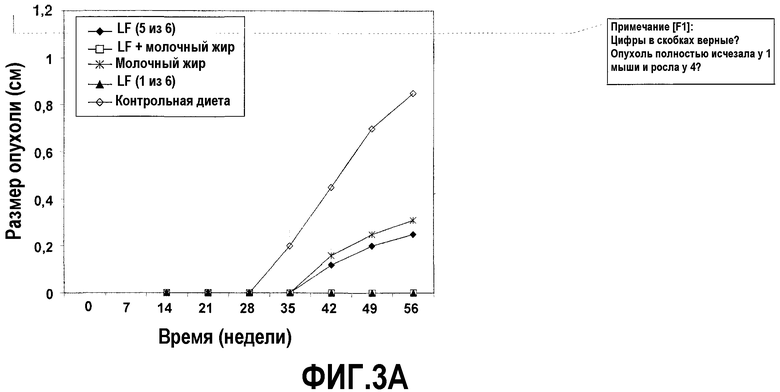
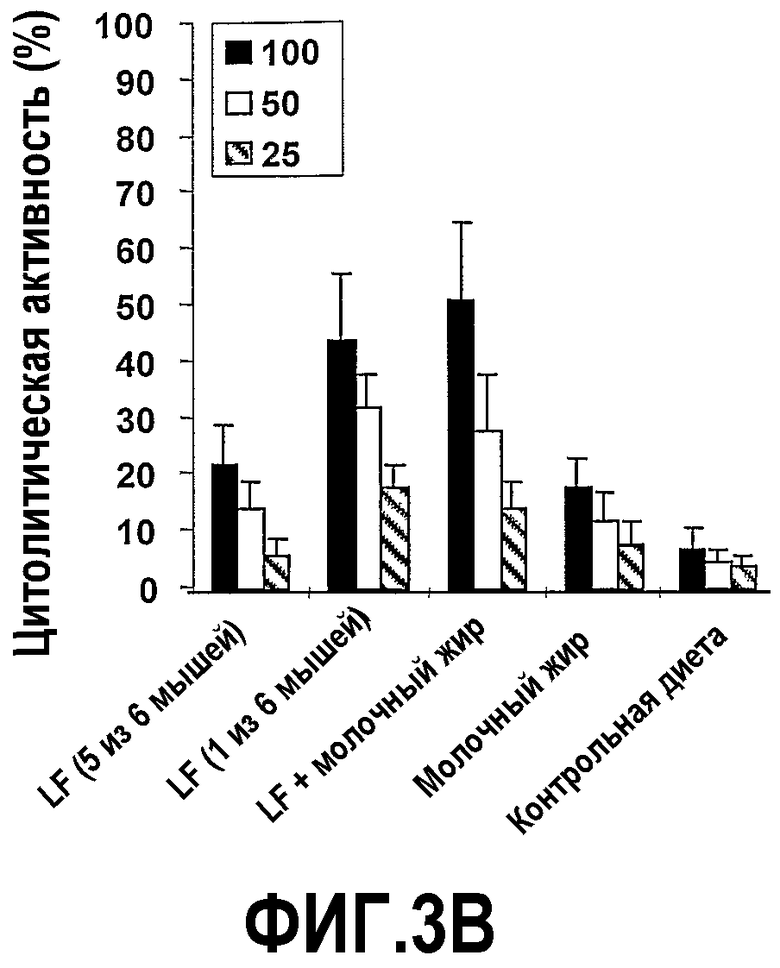
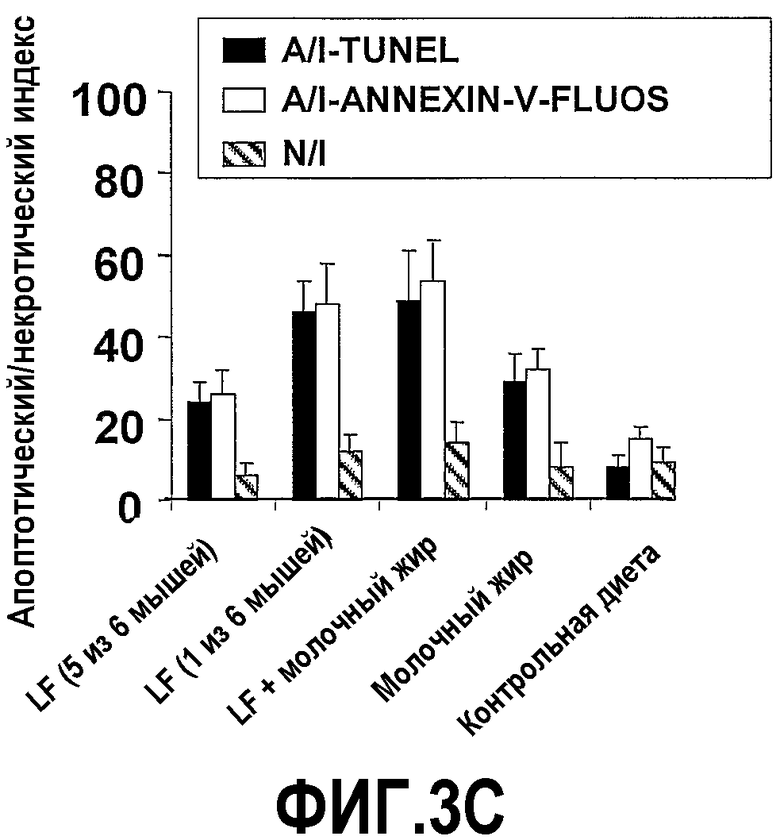
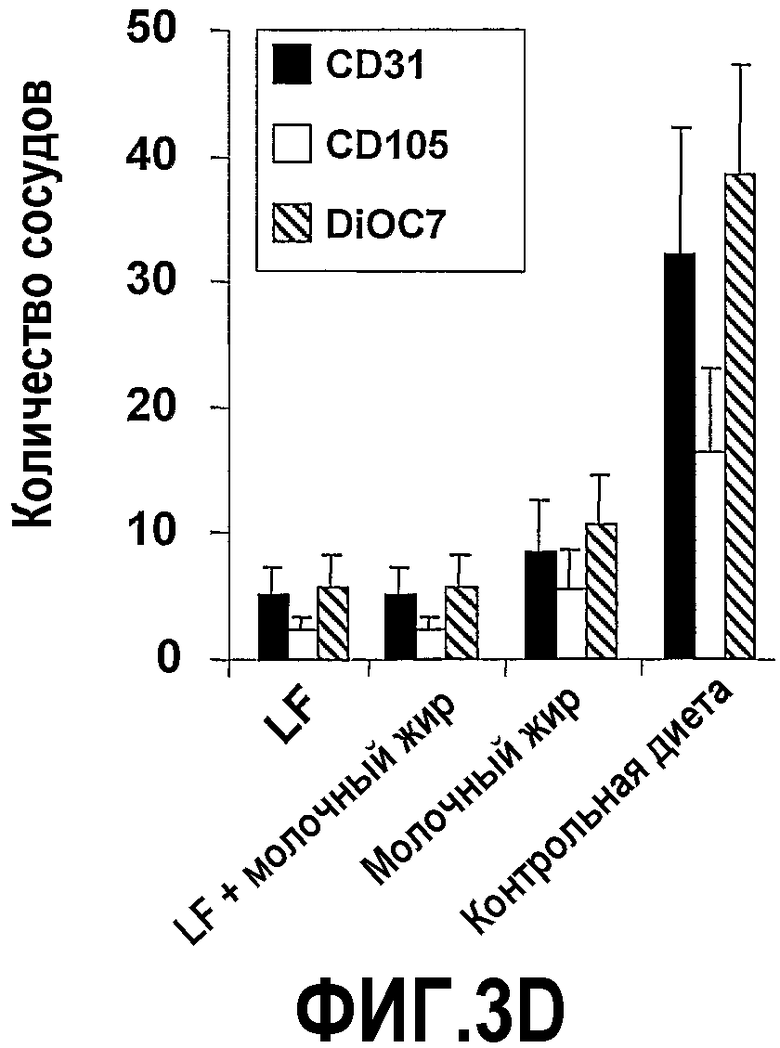
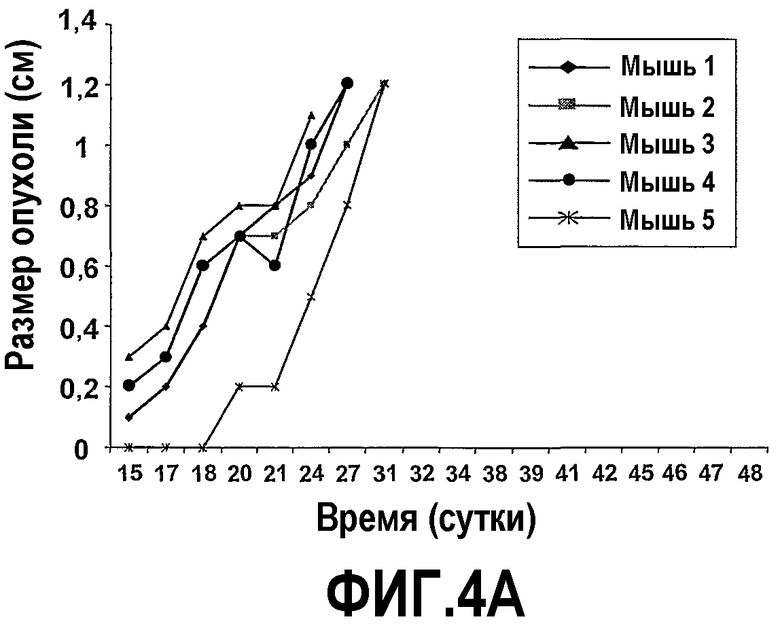
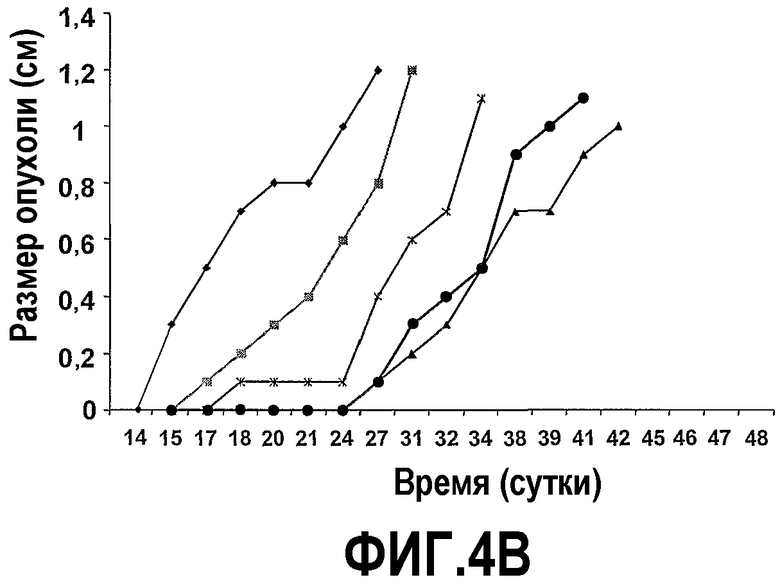
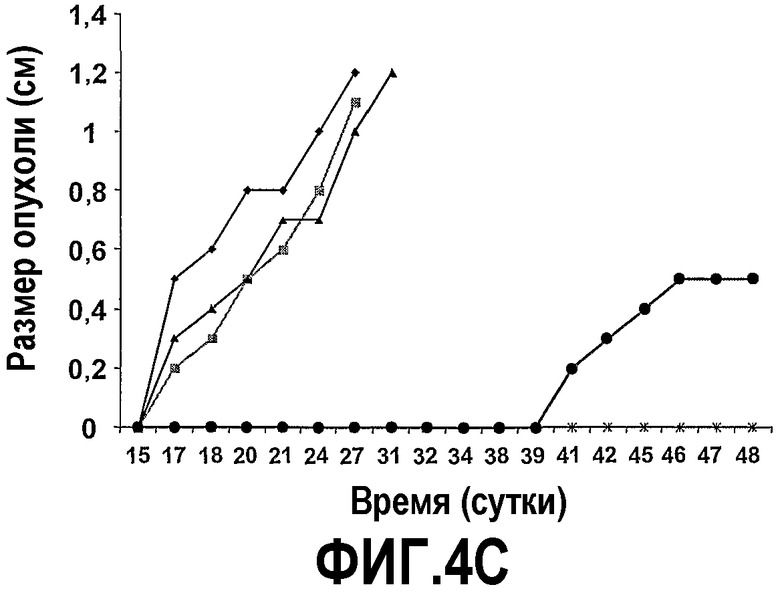
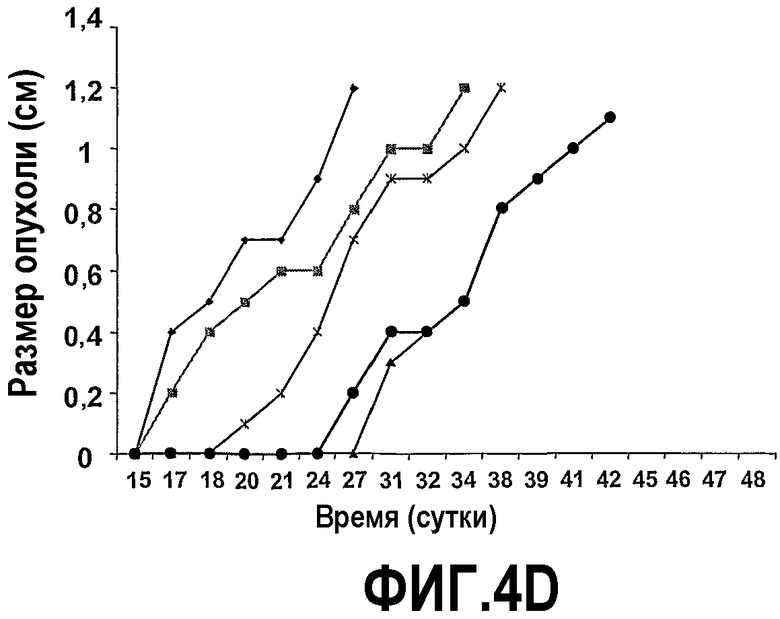
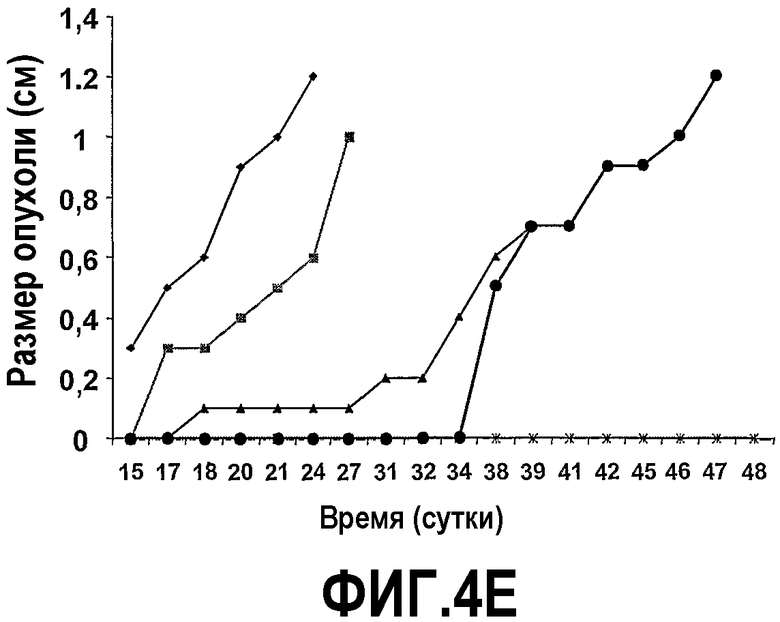
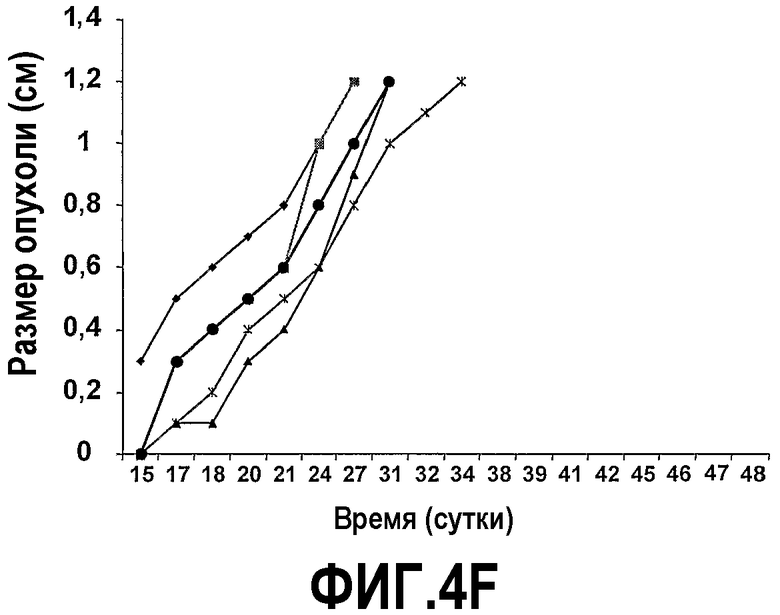
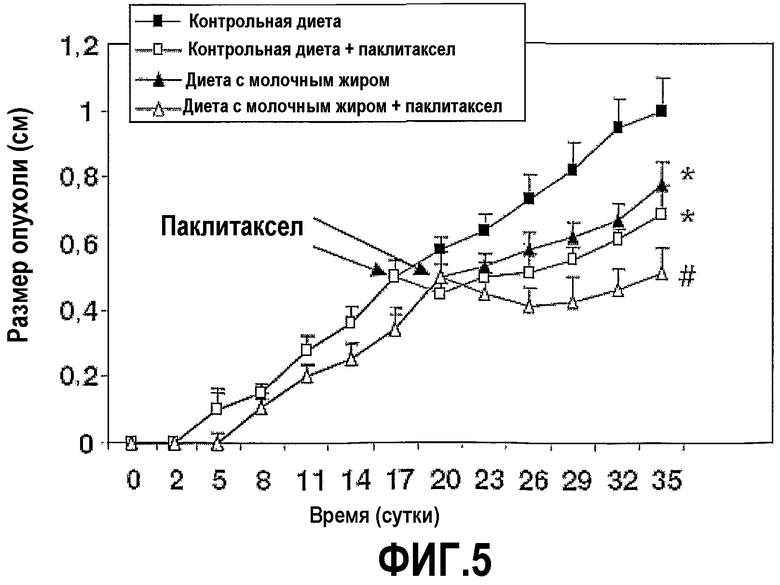
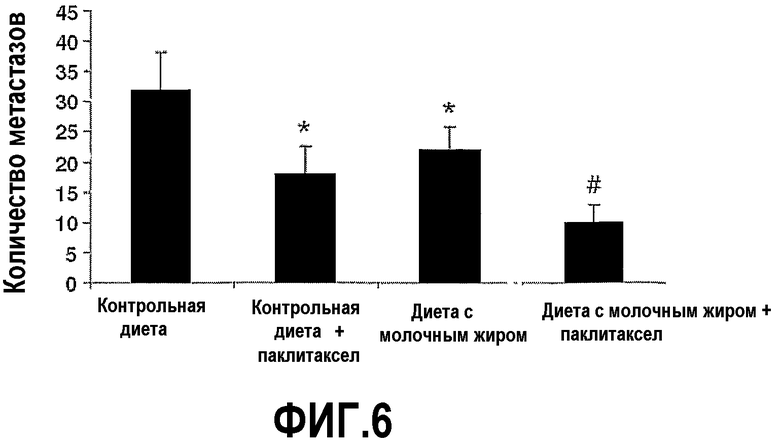
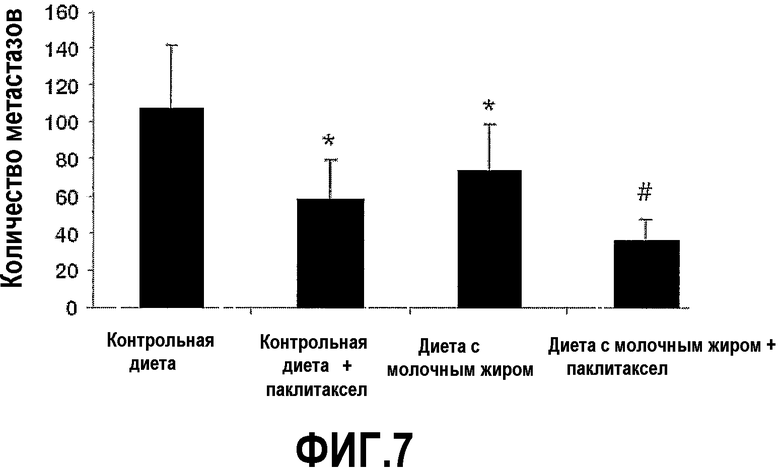
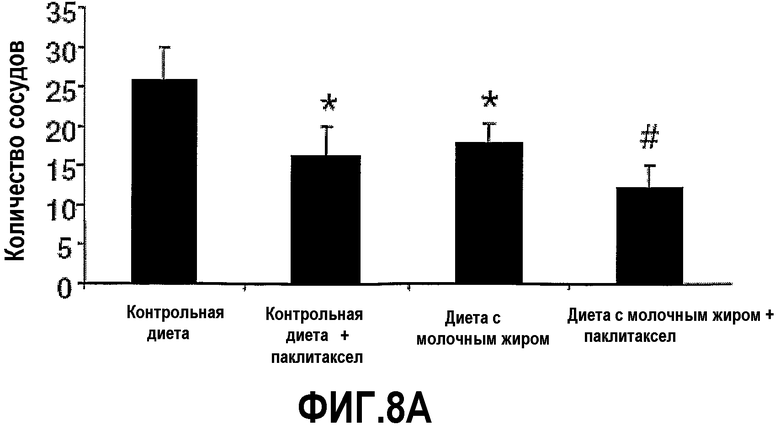
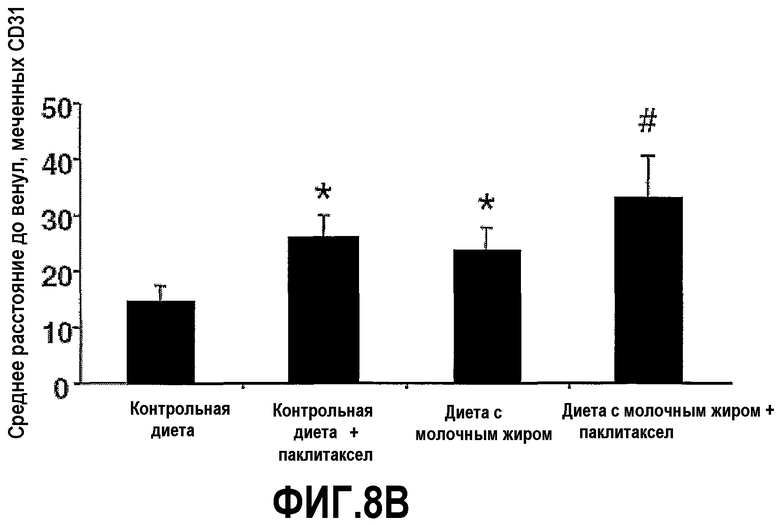
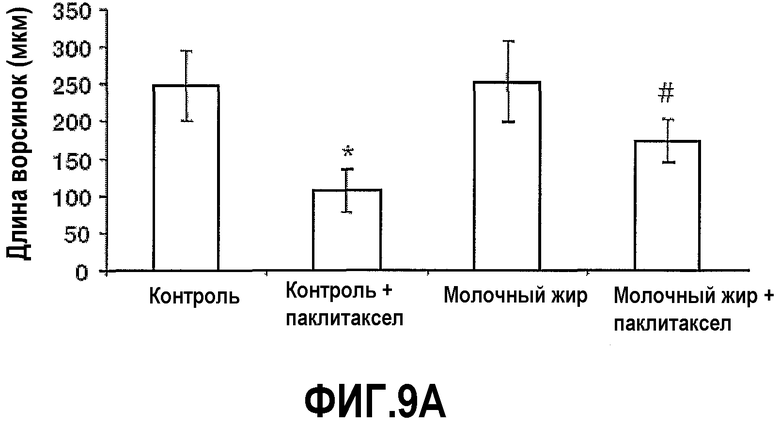
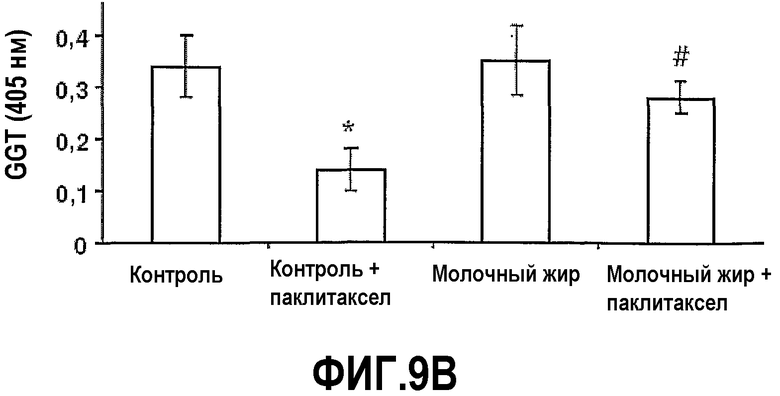
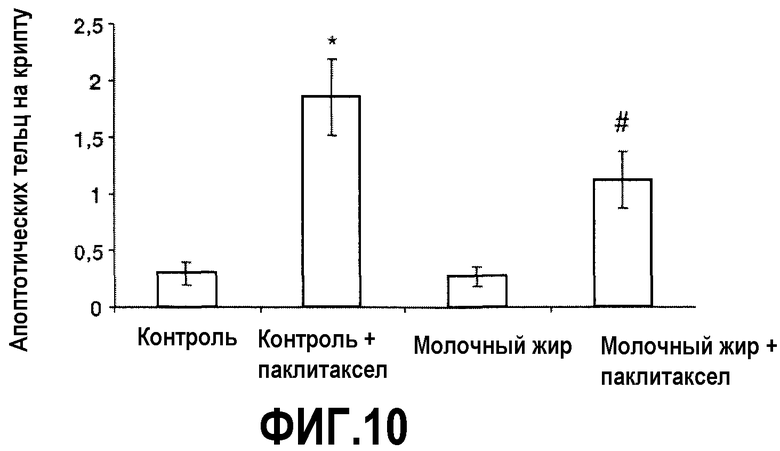
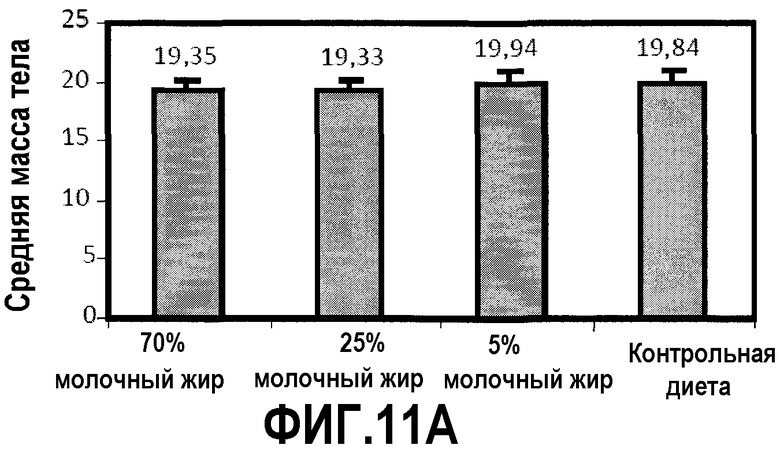
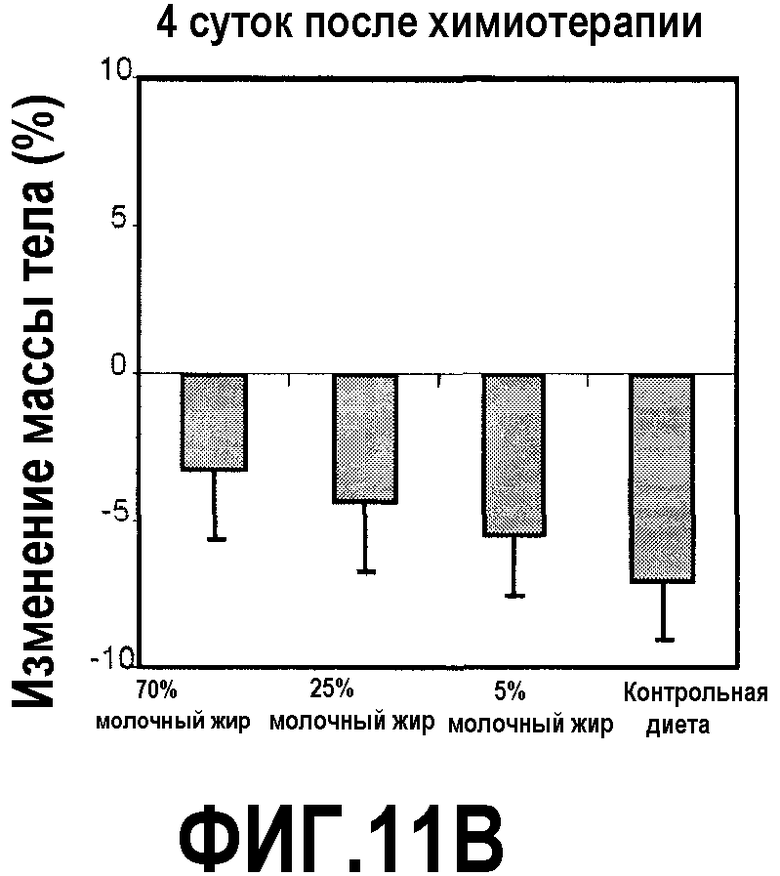
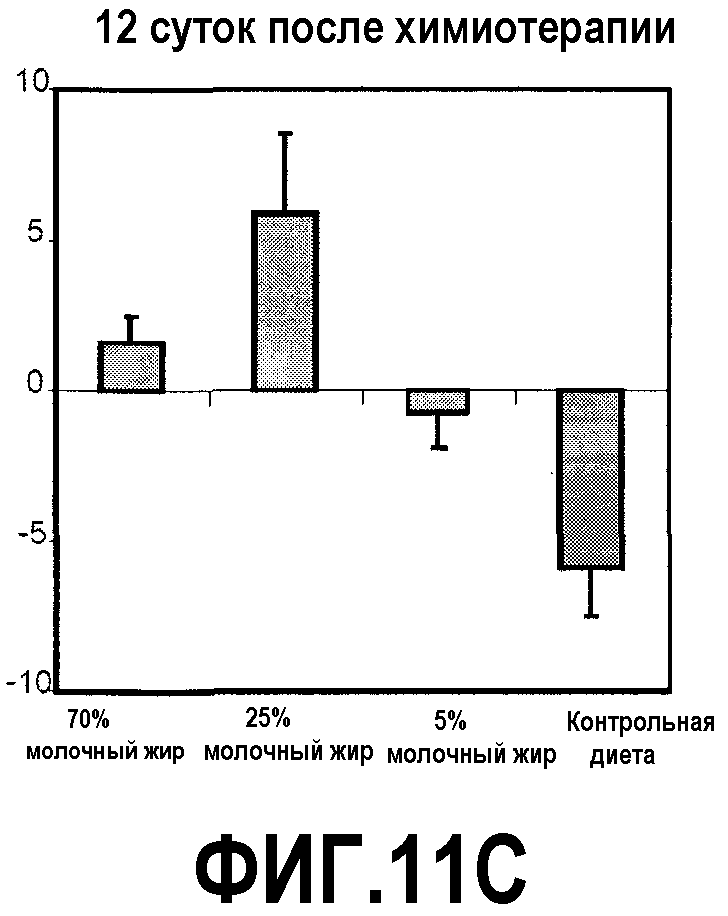
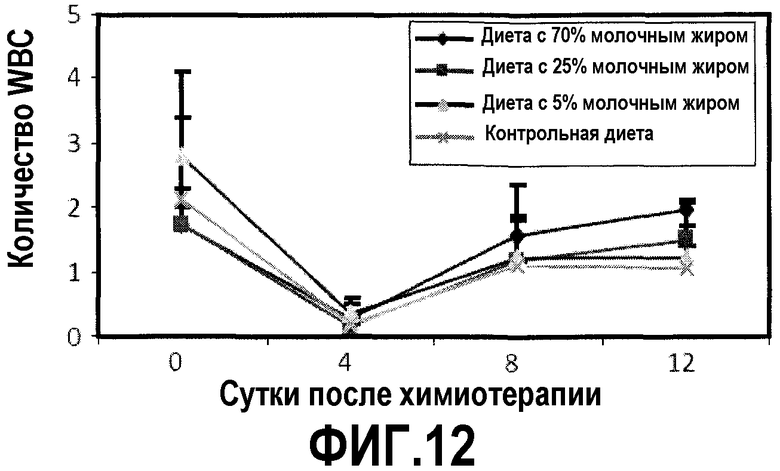
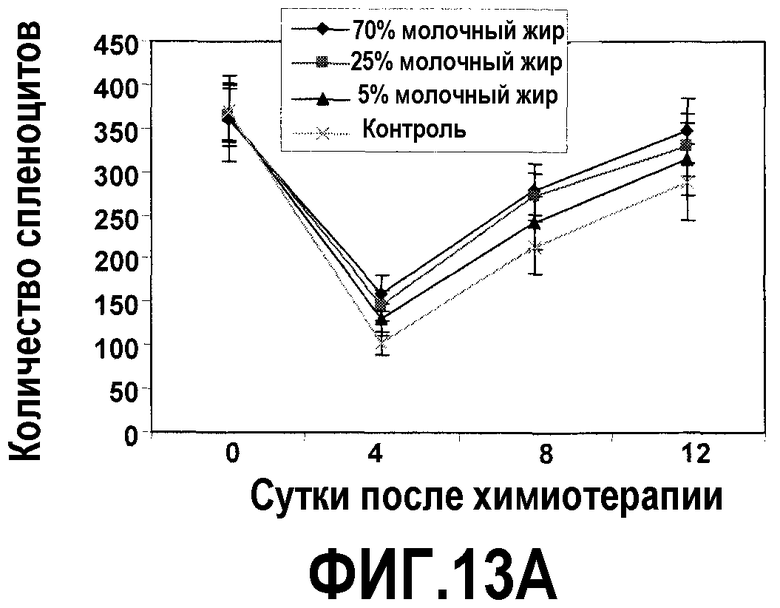
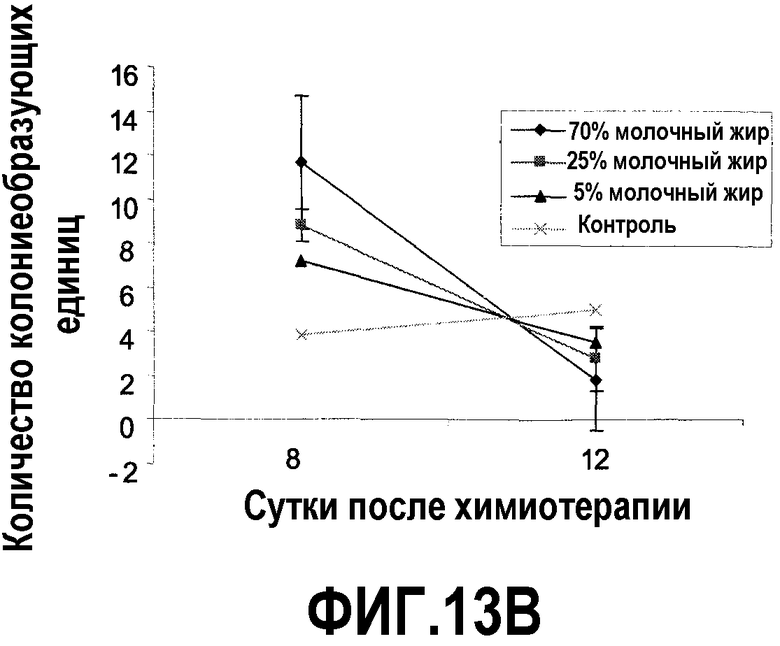
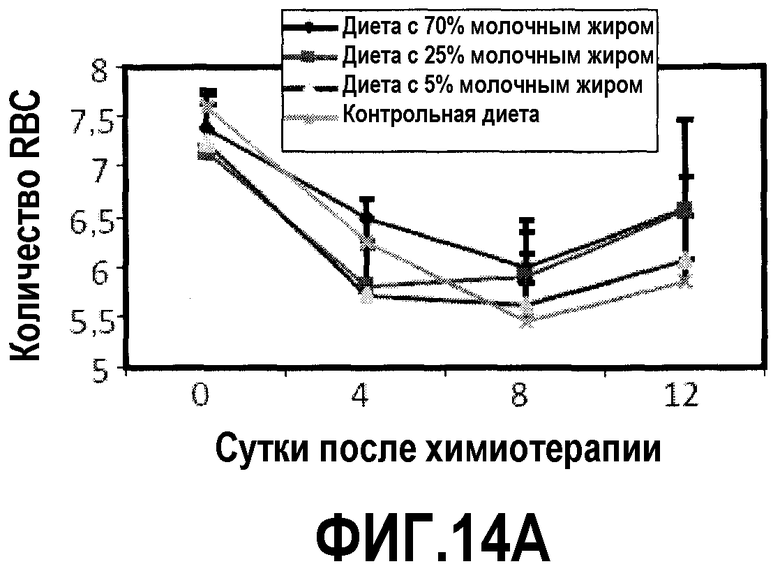
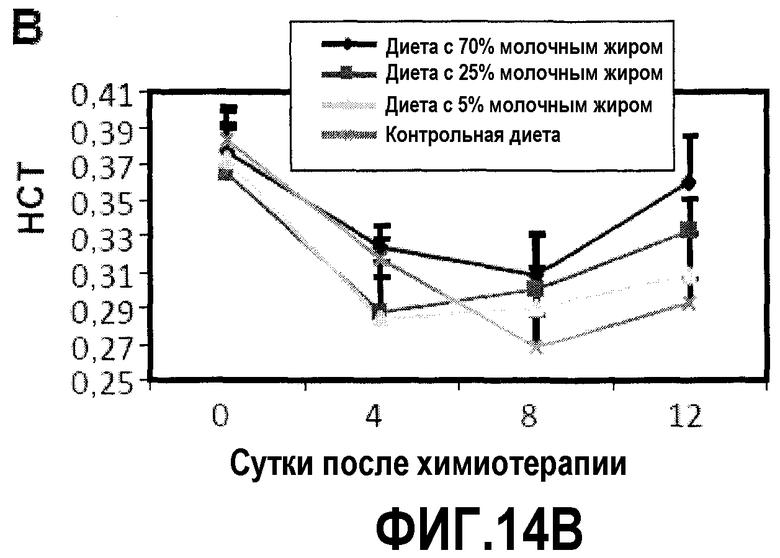
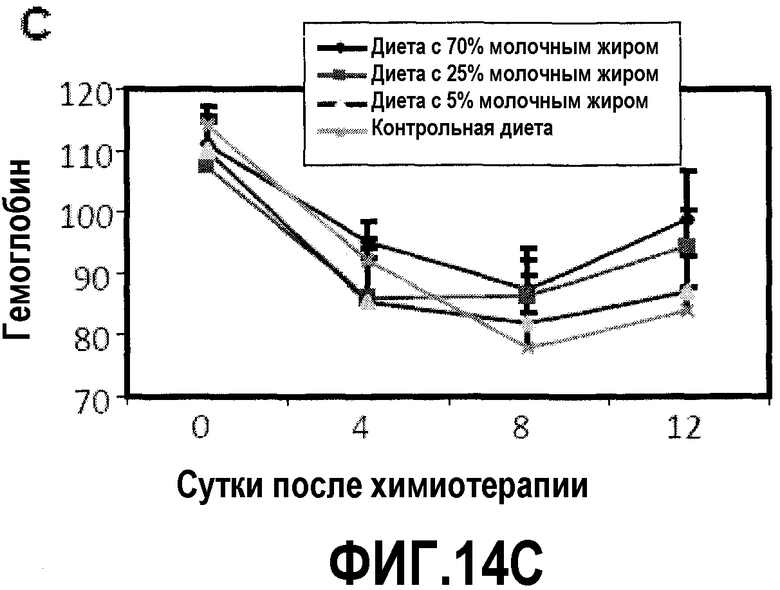
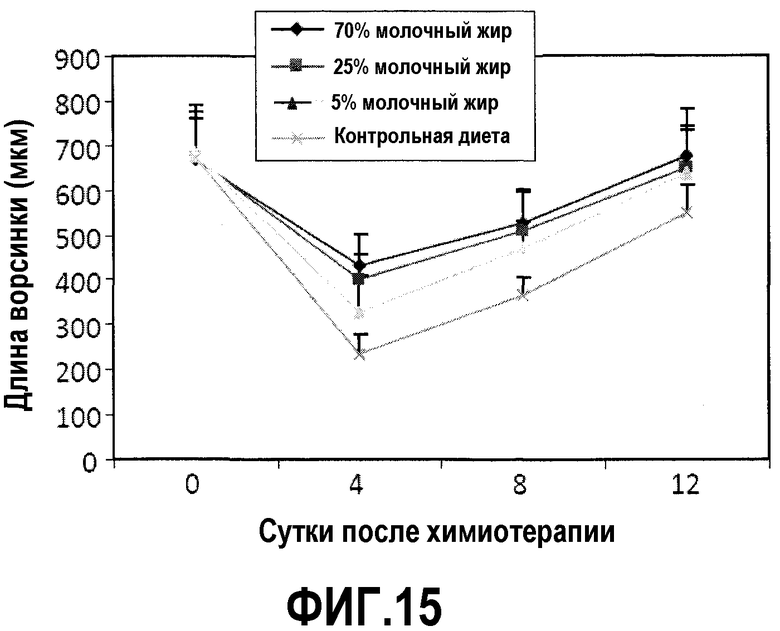
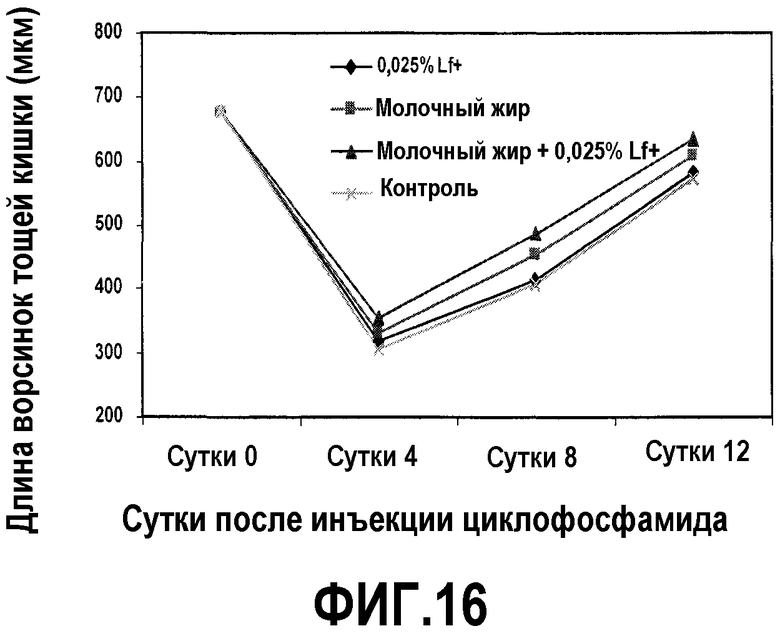
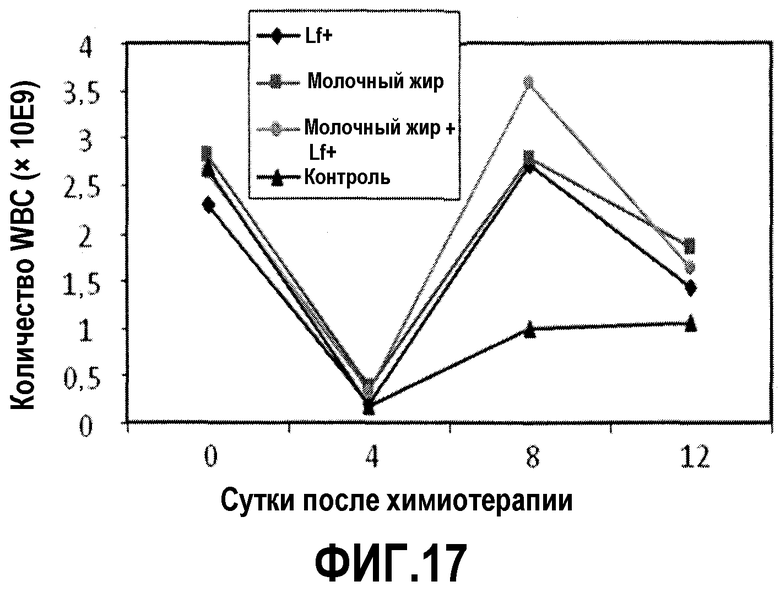
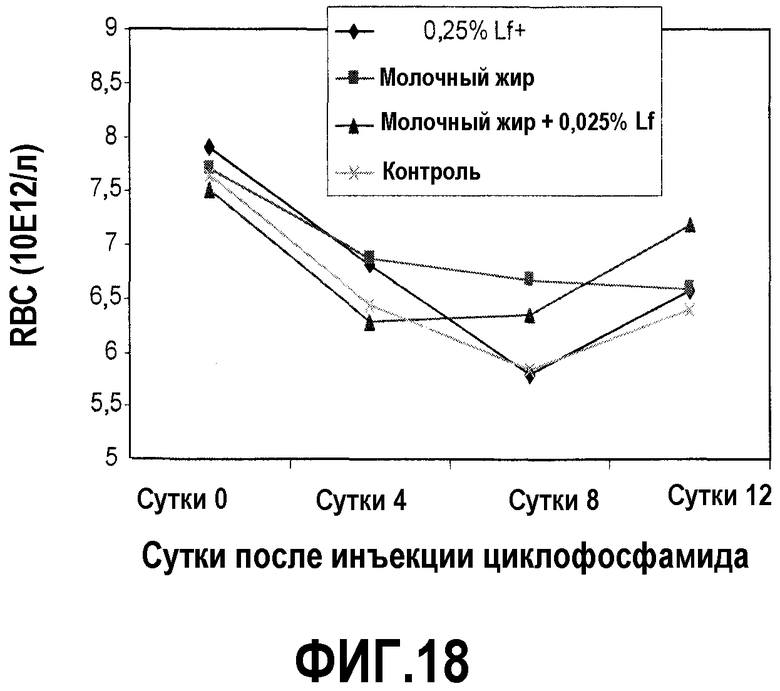
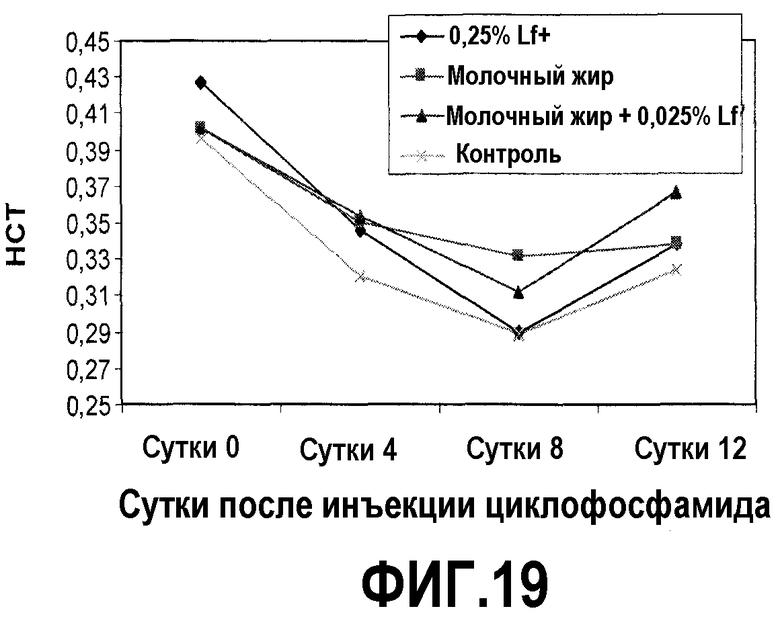
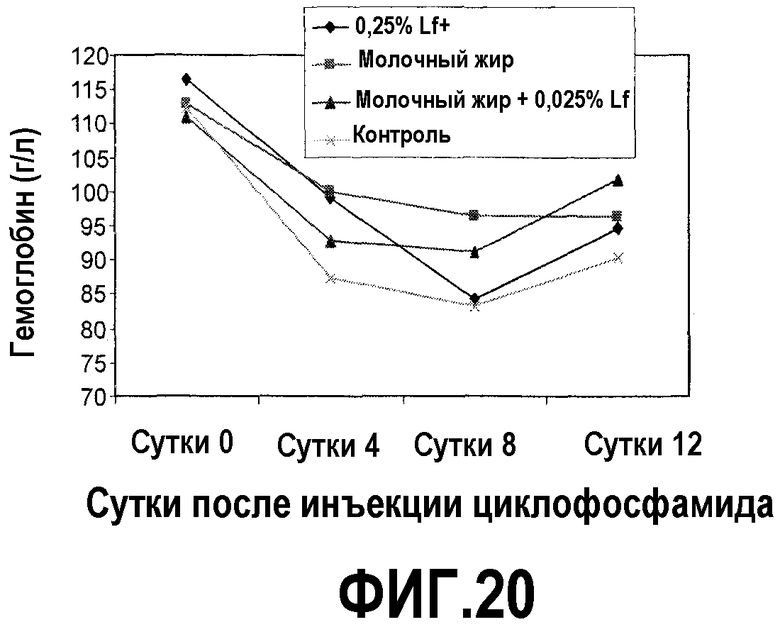
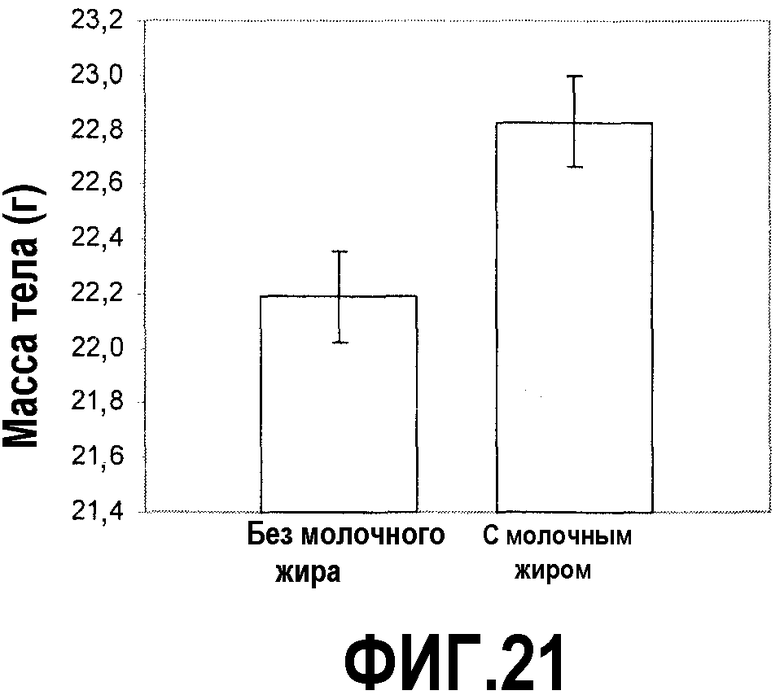
Группа изобретений относится к введению молочного жира или аналога молочного жира, необязательно по меньшей мере с одним дополнительным терапевтическим фактором, предпочтительно с лактоферрином или лактоферрином, содержащим ион металла, предпочтительно лактоферрином, содержащим железо, предпочтительно бычьим лактоферрином, предпочтительно бычьим лактоферрином, содержащим железо, или его функциональным вариантом, содержащим ионы металла, или функциональным фрагментом, для того чтобы ингибировать образование или рост опухоли, поддерживать или улучшать один или несколько параметров, таких как количество лейкоцитов, количество эритроцитов или количество миелоидных клеток, уменьшать проявления кахексии, мукозита и анемии, стимулировать иммунную систему и лечить или предотвращать злокачественную опухоль и симптомы злокачественной опухоли, и побочные эффекты лечения злокачественной опухоли. Способы и лечебное применение по изобретению можно реализовать посредством применения диетической (в виде пищевых продуктов или пищевых добавок), нутрицевтической или фармацевтической композиции. Также предоставлены композиции, пригодные в способах по изобретению. Группа изобретений обеспечивает повышение эффективности лечения или предупреждение злокачественной опухоли и ее симптомов. 6 н. и 33 з.п. ф-лы, 36 ил., 7 табл., 21 пр.
1. Способ лечения или предупреждения мукозита, анемии, обусловленной низким уровнем гемоглобина или эритроцитов, кахексии, лейкопении, или поддержания, или улучшения одного или более параметров, таких как количество лейкоцитов, эритроцитов и миелоидных клеток у субъекта, включающий введение эффективного количества молочного жира или аналога молочного жира нуждающемуся в этом субъекту.
2. Способ по п.1, дополнительно включающий раздельное, одновременное или последовательное введение субъекту одного или более противоопухолевых средств.
3. Способ по п.1 или 2, где одно или более противоопухолевых средств выбрано из группы, включающей лактоферрин, апо-лактоферрин, полипептид лактоферрина, функциональный вариант лактоферрина, функциональный фрагмент лактоферрина, лактоферрин, содержащий ион металла, природный насыщенный железом лактоферрин, лактоферрин, по существу полностью насыщенный железом, функциональный вариант лактоферрина, содержащий ион металла, функциональный фрагмент лактоферрина, содержащий ион металла или комбинацию двух или более из них, противоопухолевые факторы пищевых продуктов, включающие витамин D (включая витамин D1 [люмистерин], витамин D2 [кальциферол или эргокальциферол], витамин D3 [холекальциферол], витамин D4 [22-дигидроэргокальциферол] и витамин D5 [ситокальциферол] и витамин D5 [7-дегидроситостерол]), аналоги витамина D, соевый белок, один или более компонентов соевых бобов, одну или более омега-3 жирных кислот из сои, один или более изофлавонов из сои, генистеин, даидзеин, один или более пептидов лунасина, один или более полифенолов, ликопин, пшеничные отруби, флаваноиды, инозит, ресвератрол, прополис, экстракт из грибов, антоцианы, миндальные орехи, женьшень, гидролизат казеина и комбинации двух или более из них, химиотерапевтические средства, иммунотерапевтические средства, гематопоетические средства, противокахетические средства или противомукозитные средства и комбинации двух или более из них.
4. Способ по п.1 или 2, где молочный жир выбран из группы, включающей липиды молока, фракции липидов молока, гидролизаты липидов молока, фракции гидролизатов липидов молока, жир коровьего молока, сливки, масло, безводный молочный жир, пахту, сыворотку масла, твердые фракции молочного жира, мягкие фракции молочного жира, фракции сфингомиелина, фракции оболочек шариков молочного жира, фосфолипидные фракции и комплекс липидных фракций, и их комбинации, и их гидролизаты, и фракции гидролизатов, и комбинации гидролизатов и/или негидролизованные фракции.
5. Способ по п.1 или 2, где молочный жир или аналог молочного жира представляет собой безводный молочный жир или сливки или, где молочный жир или аналог молочного жира включает:
(a) от 23% (масс./масс.) до 32% (масс./масс.) пальмитиновой кислоты;
(b) от 15% (масс./масс.) до 22% (масс./масс.) олеиновой кислоты;
(c) от 10% (масс./масс.) до 15% (масс./масс.) стеариновой кислоты;
(d) от 9% (масс./масс.) до 12% (масс./масс.) миристиновой кислоты;
(e) от 3% (масс./масс.) до 5% (масс./масс.) масляной кислоты;
(f) любые две из а), b), с), d) или е);
(g) любые три из а), b), с), d) или е);
(h) любые четыре из а), b), с), d) или е); или
(i) каждую из а), b), с), d) и е).
6. Применение молочного жира или аналога молочного жира для лечения мукозита, анемии, опосредованной низким уровнем гемоглобина или эритроцитов, кахексии, мукозита или лейкопении, или поддержания, или улучшения одного или более показателей из количества лейкоцитов, количества эритроцитов и количества миелоидных клеток у субъекта.
7. Применение по п.6, где молочный жир или аналог молочного жира сформулированы для раздельного, одновременного или последовательного введения с одним или более противоопухолевых средств.
8. Применение по п.6, где молочный жир или аналог молочного жира присутствуют в композиции, дополнительно включающей одно или более противоопухолевых средств.
9. Применение по любому из пп.7 или 8, где одно или более противоопухолевых лекарственных средств выбрано из группы, включающей лактоферрин, апо-лактоферрин, полипептид лактоферрина, функциональный вариант лактоферрина, функциональный фрагмент лактоферрина, лактоферрин, содержащий ион металла, природный насыщенный железом лактоферрин, лактоферрин, по существу полностью насыщенный железом, функциональный вариант лактоферрина, содержащий ион металла, функциональный фрагмент лактоферрина, содержащий ион металла или комбинацию двух или более их них, противоопухолевые факторы пищевых продуктов, включающие витамин D (включая витамин D1 [люмистерин], витамин D2 [кальциферол или эргокальциферол], витамин D3 [холекальциферол], витамин D4 [22-дигидроэргокальциферол] и витамин D5 [ситокальциферол] и витамин D5 [7-дегидроситостерол]), аналоги витамина D, соевый белок, один или более компонентов соевых бобов, одну или более омега-3 жирных кислот из сои, один или более изофлавонов из сои, генистеин, даидзеин, один или более пептидов лунасина, один или более полифенолов, ликопин, пшеничные отруби, флаваноиды, инозит, ресвератрол, прополис, экстракт из грибов, антоцианы, миндальные орехи, женьшень, гидролизат казеина и комбинации двух или более из них, химиотерапевтические средства, иммунотерапевтические средства, гематопоетические средства, противокахетические средства или противомукозитные средства и комбинации двух или более из них.
10. Применение по любому из пп.6-8, где молочный жир выбран из группы, включающей липиды молока, фракции липидов молока, гидролизаты липидов молока, фракции гидролизатов липидов молока, жир коровьего молока, сливки, масло, безводный молочный жир, пахту, сыворотку масла, твердые фракции молочного жира, мягкие фракции молочного жира, фракции сфингомиелина, фракции оболочек шариков молочного жира, фосфолипидные фракции и комплекс липидных фракций, и их комбинации, и их гидролизаты, и фракции гидролизатов, и комбинации гидролизатов и/или негидролизованные фракции.
11. Применение по любому из пп.6-8, где молочный жир или аналог молочного жира представляет собой безводный молочный жир или сливки или, где молочный жир или аналог молочного жира включает:
(a) от 23% (масс./масс.) до 32% (масс./масс.) пальмитиновой кислоты;
(b) от 15% (масс./масс.) до 22% (масс./масс.) олеиновой кислоты;
(c) от 10% (масс./масс.) до 15% (масс./масс.) стеариновой кислоты;
(d) от 9% (масс./масс.) до 12% (масс./масс.) миристиновой кислоты;
(e) от 3% (масс./масс.) до 5% (масс./масс.) масляной кислоты;
(f) любые две из а), b), с), d) или е);
(g) любые три из а), b), с), d) или е);
(h) любые четыре из а), b), с), d) или е); или
(i) каждую из а), b), с), d) и е).
12. Композиция для лечения мукозита или пригодная для введения субъекту с риском развития, страдающего или подлежащего лечению от мукозита, включающая от 2 г до 210 г молочного жира или аналога молочного жира и от 0,7 г до 210 г одного или нескольких противоопухолевых средств.
13. Композиция по п.12, включающая от 2 г до 210 г молочного жира или аналога молочного жира и от 0,7 г до 70 г одного или нескольких противоопухолевых средств.
14. Композиция по п.12, включающая от 35 г до 210 г молочного жира или аналога молочного жира и от 0,7 г до 210 г одного или нескольких противоопухолевых средств.
15. Композиция по п.12, включающая от 10 г до 200 г молочного жира или аналога молочного жира и от 2,5 г до 70 г одного или нескольких противоопухолевых средств.
16. Композиция по п.12, включающая от 10 г до 200 г молочного жира или аналога молочного жира и от 0,7 г до 5 г одного или нескольких противоопухолевых средств.
17. Композиция по п.12, включающая от 15 г до 30 г молочного жира или аналога молочного жира и от 1,0 г до 6,0 г одного или нескольких противоопухолевых средств.
18. Композиция по п.12, включающая от 3 г до 8 г молочного жира или аналога молочного жира от 0,1 г до 1,0 г одного или нескольких противоопухолевых средств.
19. Композиция по любому из пп.12-18, которая представляет собой съедобный потребительский продукт или входит в состав съедобного потребительского продукта, выбранного из группы, включающей кондитерский продукт, десерт, жидкость, напиток, брикетированный пищевой концентрат, мюсли, спред, подливку, соус, мороженое, йогурт, сыр, молочный коктейль, йогуртовый коктейль, молочный порошок, детское питание или питание для подрастающих или энтеральную жидкость.
20. Композиция по любому из пп.12-18, где одно или более противоопухолевых лекарственных средств выбрано из группы, включающей лактоферрин, апо-лактоферрин, полипептид лактоферрина, функциональный вариант лактоферрина, функциональный фрагмент лактоферрина, лактоферрин, содержащий ион металла, природный насыщенный железом лактоферрин, лактоферрин, по существу полностью насыщенный железом, функциональный вариант лактоферрина, содержащий ион металла, функциональный фрагмент лактоферрина, содержащий ион металла или комбинацию двух или более их них, противоопухолевые факторы пищевых продуктов, включающие витамин D (включая витамин D1 [люмистерин], витамин D2 [кальциферол или эргокальциферол], витамин D3 [холекальциферол], витамин D4 [22-дигидроэргокальциферол] и витамин D5 [ситокальциферол] и витамин D5 [7-дегидроситостерол]), аналоги витамина D, соевый белок, один или более компонентов соевых бобов, одну или более омега-3 жирных кислот из сои, один или более изофлавонов из сои, генистеин, даидзеин, один или более пептидов лунасина, один или более полифенолов, ликопин, пшеничные отруби, флаваноиды, инозит, ресвератрол, прополис, экстракт из грибов, антоцианы, миндальные орехи, женьшень, гидролизат казеина и комбинации двух или более из них, химиотерапевтические средства, иммунотерапевтические средства, гематопоетические средства, противокахетические средства или противомукозитные средства и комбинации двух или более из них.
21. Композиция по любому из пп.12-18, где молочный жир выбран из группы, включающей липиды молока, фракции липидов молока, гидролизаты липидов молока, фракции гидролизатов липидов молока, жир коровьего молока, сливки, масло, безводный молочный жир, пахту, сыворотку масла, твердые фракции молочного жкра, мягкие фракции молочного жира, фракции сфингомиелина, фракции оболочек шариков молочного жира, фосфолипидные фракции и комплекс липидных фракций, и их комбинации, и их гидролизаты, и фракции гидролизатов, и комбинации гидролизатов и/или негидролизованные фракции.
22. Композиция по любому из пп.12-18, где молочный жир или аналог молочного жира представляет собой безводный молочный жир или сливки или, где молочный жир или аналог молочного жира включает:
(а) от 23% (масс./масс.) до 32% (масс./масс.) пальмитиновой кислоты;
(b) от 15% (масс./масс.) до 22% (масс./масс.) олеиновой кислоты;
(c) от 10% (масс./масс.) до 15% (масс./масс.) стеариновой кислоты;
(d) от 9% (масс./масс.) до 12% (масс./масс.) миристиновой кислоты;
(e) от 3% (масс./масс.) до 5% (масс./масс.) масляной кислоты;
(f) любые две из а), b), с), d) или е);
(g) любые три из а), b), с), d) или е);
(h) любые четыре из а), b), с), d) или е); или
(i) каждую из а), b), с), d) и е).
23. Композиция для лечения мукозита или пригодная для введения субъекту с риском развития, страдающего или подлежащего лечению от мукозита, включающая от 2 г до 210 г молочного жира или аналога молочного жира и от 0,1 г до 210 г одного или нескольких противоопухолевых средств.
24. Композиция по п.23, включающая от 0,1 г до 50 г молочного жира или аналога молочного жира и от 1,0 мг до 1,0 г одного или нескольких противоопухолевых средств.
25. Композиция по п.23, включающая от 0,1 г до 50 г молочного жира или аналога молочного жира йот 1,0 мг до 1,0 мг одного или нескольких противоопухолевых средств.
26. Композиция по п.23, включающая от 2,0 г до 210 г молочного жира или аналога молочного жира и от 0,7 мг до 70,0 г одного или нескольких противоопухолевых средств.
27. Композиция по п.23, включающая от 35 г до 210 г молочного жира или аналога молочного жира и от 0,35 г до 210 г одного или нескольких противоопухолевых средств.
28. Композиция по п.23, включающая от 10 г до 200 г молочного жира или аналога молочного жира и от 2,5 г до 70,0 г одного или нескольких противоопухолевых средств.
29. Композиция по п.23, включающая от 10 г до 200 г молочного жира или аналога молочного жира и от 0,25 г до 5,0 г одного или нескольких противоопухолевых средств.
30. Композиция по п.23, включающая от 15 г до 30 г молочного жира или аналога молочного жира и от 1,0 г до 6,0 г одного или нескольких противоопухолевых средств.
31. Композиция по п.23, включающая от 3,0 г до 8,0 г молочного жира или аналога молочного жира и от 0,1 г до 1,0 г одного или нескольких противоопухолевых средств.
32. Композиция по любому из пп.23-31, которая представляет собой съедобный потребительский продукт или входит в состав съедобного потребительского продукта, выбранного из группы, включающей кондитерский продукт, десерт, жидкость, напиток, брикетированный пищевой концентрат, мюсли, спред, подливку, соус, мороженое, йогурт, сыр, молочный коктейль, йогуртовый коктейль, молочный порошок, детское питание или питание для подрастающих или энтеральную жидкость.
33. Композиция по любому из пп.23-31, где одно или более противоопухолевых лекарственных средств выбрано из группы, включающей лактоферрин, апо-лактоферрин, полипептид лактоферрина, функциональный вариант лактоферрина, функциональный фрагмент лактоферрина, лактоферрин, содержащий ион металла, природный насыщенный железом лактоферрин, лактоферрин, по существу полностью насыщенный железом, функциональный вариант лактоферрина, содержащий ион металла, функциональный фрагмент лактоферрина, содержащий ион металла или комбинацию двух или более их них, противоопухолевые факторы пищевых продуктов, включающие витамин D (включая витамин D1 [люмистерин], витамин D2 [кальциферол или эргокальциферол], витамин D3 [холекальциферол], витамин D4 [22-дигидроэргокальциферол] и витамин D5 [ситокальциферол] и витамин D5 [7-дегидроситостерол]), аналоги витамина D, соевый белок, один или более компонентов соевых бобов, одну или более омега-3 жирных кислот из сои, один или более изофлавонов из сои, генистеин, даидзеин, один или более пептидов лунасина, один или более полифенолов, ликопин, пшеничные отруби, флаваноиды, инозит, ресвератрол, прополис, экстракт из грибов, антоцианы, миндальные орехи, женьшень, гидролизат казеина и комбинации двух или более из них, химиотерапевтические средства, иммунотерапевтические средства, гематопоетические средства, противокахетические средства или противомукозитные средства и комбинации двух или более из них.
34. Композиция по любому из пп.23-31, где молочный жир выбран из группы, включающей липиды молока, фракции липидов молока, гидролизаты липидов молока, фракции гидролизатов липидов молока, жир коровьего молока, сливки, масло, безводный молочный жир, пахту, сыворотку масла, твердые фракции молочного жира, мягкие фракции молочного жира, фракции сфингомиелина, фракции оболочек шариков молочного жира, фосфолипидные фракции и комплекс липидных фракций, и их комбинации, и их гидролизаты, и фракции гидролизатов, и комбинации гидролизатов и/или негидролизованные фракции.
35. Композиция по любому из пп.23-31, где молочный жир или аналог молочного жира включает:
(a) от 23% (масс./масс.) до 32% (масс./масс.) пальмитиновой кислоты;
(b) от 15% (масс./масс.) до 22% (масс./масс.) олеиновой кислоты;
(c) от 10% (масс./масс.) до 15% (масс./масс.) стеариновой кислоты;
(d) от 9% (масс./масс.) до 12% (масс./масс.) миристиновой кислоты;
(e) от 3% (масс./масс.) до 5% (масс./масс.) масляной кислоты;
(f) любые две из а), b), с), d) или е);
(g) любые три из а), b), с), d) или е);
(h) любые четыре из а), g), с), d) или е); или
(i) каждую из а), b), с), d) и е).
36. Продукт для лечения мукозита или пригодный для введения субъекту с риском развития, страдающего или подлежащего лечению от мукозита, включающий молочный жир или аналог молочного жира и одно или несколько дополнительных противоопухолевых средств, в виде комбинированного препарата для одновременного, раздельного или последовательного применения.
37. Продукт по п.36, где противоопухолевое средство пригодно для парентерального введения.
38. Продукт по п.36 или 37, где одно или более противоопухолевых средств выбрано из группы, включающей лактоферрин, апо-лактоферрин, полипептид лактоферрина, функциональный вариант лактоферрина, функциональный фрагмент лактоферрина, лактоферрин, содержащий ион металла, природный насыщенный железом лактоферрин, лактоферрин по существу полностью насыщенный железом, функциональный вариант лактоферрина, содержащий ион металла, функциональный фрагмент лактоферрина, содержащий ион металла или комбинацию двух или более их них, противоопухолевые факторы пищевых продуктов, включающие витамин D (включая витамин D1 [люмистерин], витамин D2 [кальциферол или эргокальциферол], витамин D3 [холекальциферол], витамин D4 [22-дигидроэргокальциферол] и витамин D5 [ситокальциферол] и витамин D5 [7-дегидроситостерол]), аналоги витамина D, соевый белок, один или более компонентов соевых бобов, одну или более омега-3 жирных кислот из сои, один или более изофлавонов из сои, генистеин, даидзеин, один или более пептидов лунасина, один или более полифенолов, ликопин, пшеничные отруби, флаваноиды, инозит, ресвератрол, прополис, экстракт из грибов, антоцианы, миндальные орехи, женьшень, гидролизат казеина и комбинации двух или более из них, химиотерапевтические средства, иммунотерапевтические средства, гематопоетические средства, противокахетические средства или противомукозитные средства и комбинации двух или более из них.
39. Продукт по п.36 или 37, где молочный жир выбран из группы, включающей липиды молока, фракции липидов молока, гидролизаты липидов молока, фракции гидролизатов липидов молока, жир коровьего молока, сливки, масло, безводный молочный жир, пахту, сыворотку масла, твердые фракции молочного жира, мягкие фракции молочного жира, фракции сфингомиелина, фракции оболочек шариков молочного жира, фосфолипидные фракции и комплекс липидных фракций, и их комбинации, и их гидролизаты, и фракции гидролизатов, и комбинации гидролизатов и/или негидролизованные фракции.
40. Продукт по п.36 или 37, где молочный жир или аналог молочного жира включает:
(a) от 23% (масс./масс.) до 32% (масс./масс.) пальмитиновой кислоты;
(b) от 15% (масс./масс.) до 22% (масс./масс.) олеиновой кислоты;
(c) от 10% (масс./масс.) до 15% (масс./масс.) стеариновой кислоты;
(d) от 9% (масс./масс.) до 12% (масс./масс.) миристиновой кислоты;
(e) от 3% (масс./масс.) до 5% (масс./масс.) масляной кислоты;
(f) любые две из а), b), с), d) или е);
(g) любые три из а), b), с), d) или е);
(h) любые четыре из а), g), с), d) или е); или
(i) каждую из а), b), с), d) и е).
41. Применение молочного жира или аналога молочного жира для изготовления лекарственного средства для введения субъекту с риском развития, страдающего или подлежащего лечению мукозита, анемии, вызванной низким гемоглобином или уровнем эритроцитов, кахексии, лейкопении, или поддержания или улучшения одного или более показаний, выбранных из количества лейкоцитов, количества эритроцитов и количества миелоидных клеток у субъекта.
| Способ запрессовки не выдержавших гидравлической пробы отливок | 1923 |
|
SU51A1 |
Авторы
Даты
2013-06-10—Публикация
2008-05-14—Подача