Область техники настоящего изобретения
Настоящее изобретение относится к области молекулярной иммунологии, биотехнологии, молекулярной диагностики и медицины. Получен бактериальный продуцент нового полипептида, являющегося рекомбинантным производным антиген-узнающего домена особого антитела верблюда (без легких цепей), способный узнавать консервативный участок рецептор-связывающего домена поверхностного белка (шипа, Spike) пандемического коронавируса SARS-CoV-2. Такой полипептид может быть использован для разработки комбинированных новых препаратов в качестве модуля мишень-специфического связывания, задержки/блокирования коронавируса в верхних дыхательных путях человека.
Уровень техники
Сегодня серьезную глобальную угрозу для здоровья людей представляет продолжающаяся пандемия COVID-19, вызванная коронавирусом тяжелого острого респираторного синдрома 2 (SARS-CoV-2), которая привела к гибели в мире уже более 6,6 миллионов человек (Johns Hopkins University, https://coronavirus.jhu.edu/). В последние два года с помощью разных технологий были разработаны и разрешены к применению несколько вакцин против COVID-19, а также получено большое число вирус-нейтрализующих антител к SARS-CoV-2. Однако эти инструменты профилактики и потенциального лечения сталкиваются с существенными проблемами из-за появления новых мутантных вариантов вируса, как более контагиозных, так и ускользающих от иммунной нейтрализации, что, очевидно, постоянно требует обновления вакцин и разработки новых терапевтических антител. Большинство антител, которые нейтрализуют вирусы, такие как SARS-CoV-2, связываются с доступными белковыми эпитопами на поверхности вирусной частицы и предотвращают взаимодействие вируса с клеточным рецептором, что необходимо для проникновения вируса в клетку. В случае SARS-CoV-2 основной мишенью нейтрализующих антител является основной поверхностный белок, гликопротеин Spike (шип), или S-белок (1300 а.о.). S-белок образует гомотример на поверхности вириона. Во время сборки вируса этот белок расщепляется на N-концевую область (S1) и С-концевую область (S2), которая непосредственно участвует в слиянии с клеточной мембраной клетки хозяина. В С-концевой части области S1 был идентифицирован рецептор-связывающий домен (RBD, 319-541 а.о. или, в минимальном варианте, 333-527 а.о.), который в открытой конформации S-белка взаимодействует с входным для вируса SARS-CoV-2 рецептором на поверхности клетки-хозяина ангиотензинпревращающим ферментом 2 (АСЕ2), который запускает перестройку S-белка, что приводит к слиянию мембран и проникновению вируса в клетку. RBD состоит из двух субдоменов ядра с центральным р-слоем и внешнего субдомена или мотива связывания с рецептором (RBM, остатки с 438 по 506), который соединен с двумя соседними β-тяжами сердечника; RBM становится самым удаленным от мембраны участком S в его открытой конформации, связывающей рецептор. RBD (и особенно RBM) является основным антигенным участком S-белка и основной мишенью вирус-нейтрализующих антител. [Hoffmann et al. SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell. 2020. 181(2):271-80.e8. doi: 10.1016/j.cell.2020.02.052; Walls et al. Structure, Function, and Antigenicity of the SARS-CoV-2 Spike Glycoprotein. Cell. 2020. 181(2):281-92.e6. doi: 10.1016/j.cell.2020.02.058; Zhou et al. CryoEM Structures of SARS-CoV-2 Spike Without and With ACE2 Reveal a pH Dependent Switch to Mediate Endosomal Positioning of Receptor-Binding Domains. Cell Host Microbe. 2020. 28(6):867-79.e5. doi: 10.1016/j.chom. 2020.11.004]. С начала пандемии циркулирующие сегодня штаммы SARS-CoV-2 приобрели мутации по сравнению с исходным штаммом Wuhan (WA1). В частности, вариант В.1.617.2 (дельта) и родственный ему В.1.617.1 (каппа) были первоначально идентифицированы в Индии и несут замены RBD L452R-T478K или L452R-E484Q соответственно, которые, вероятно, ответственны за их улучшенные характеристики контагиозности. Совсем недавно вариант В.1.1.529 (омикрон), идентифицированный в Южной Африке, содержит крайнюю эволюцию RBD с пятнадцатью заменами (например, G339D, S371L, S373P, S375F, K417N, N440K, G446S, S477N, T478K, Е484А Q493K, G496S, Q498R, N501Y, Y505H) [Mannar et al. SARS-CoV-2 Omicron Variant: Antibody Evasion and Cryo-EM Structure of Spike Protein-ACE2 Complex. Science. 2022. 375(6582):eabn7760. doi: 10.1126/science.abn7760]. Мутации RBD, обнаруженные в этих вариантах, представляют угрозу для эффективности современных вакцин и терапевтических антител человека, могут создавать дополнительное давление для вирусной эволюции и отбора новых вариантов, которые избегают нейтрализации иммунной системой человека. Таким образом, создание вирус-нейтрализующих антител широкого действия против различных штаммов (сегодняшних и будущих) коронавируса SARS-CoV-2 является крайне сложной задачей.
Использование ингаляционных препаратов на основе антител - другой очень актуальный и перспективный метод для мишень-специфического воздействия и противодействия респираторным инфекциям воздушных дыхательных путей [Parray et al. Inhalation monoclonal antibody therapy: a new way to treat and manage respiratory infections. Appl Microbiol Biotechnol 2021. 105 (16-17): 6315-6332. doi: 10.1007/s00253-021-11488-4]. Ингаляция - многообещающая неинвазивная стратегия доставки антител для лечения респираторных заболеваний, потому что этот путь обеспечивает более высокие концентрации антител в дыхательных путях, преодолевая ограничения и неопределенности в количестве препарата в нужном месте при системном введении антител через кровоток. Назальный путь доставки лекарств - один из широко исследованных способов введения, назальные спреи для ряда лекарств были признаны успешными и разрешены для широкого использования. Респираторные вирусы, поражающие человека, попадают в организм через дыхательные пути в виде аэрозолей, образующихся при кашле или чихании от других инфицированных людей. Большие аэрозольные частицы обычно задерживаются в носовых раковинах и пазухах, где они могут вызвать инфекции верхних дыхательных путей. Более мелкие частицы могут проникать в нижние дыхательные пути и вызывать более опасные инфекции в альвеолярных областях. Большинство вирусов, инфицирующих верхние дыхательные пути, вызывает острую инфекцию и заражают людей сезонно (например, респираторно-синцитиальный вирус (RSV), риновирус, парагрипп, грипп А, аденовирус, метапневмовирус человека, бокавирус человека и коронавирус). Эпителиальные клетки слизистой оболочки - входные ворота для большинства респираторных вирусных инфекций. Вирус не сможет инициировать инфекцию, если его прикрепление к клетке блокировать в месте проникновения. Антивирусные препараты на основе антител доказали свою эффективность в противодействии такому прикреплению вируса и развитию инфекции, примеры чего приведены, например, в недавно опубликованной обзорной статье [Parray et al. Inhalation monoclonal antibody therapy: a new way to treat and manage respiratory infections. Appl Microbiol Biotechnol. 2021. 105 (16-17): 6315-6332. doi: 10.1007/s00253-021-11488-4].
Было показано, что частицы вируса гриппа могут задерживаться в слизи дыхательных путей человека вне зависимости от связывания гемагглютинина с остатками сиаловых кислот на муцинах [Wang et al. Influenza-binding antibodies immobilise influenza viruses in fresh human airway mucus. Eur Respir J. 2017. 49. No. 1601709. doi: 10.1183/13993003.01709-2016]. Скорее всего, наблюдаемая задержка происходила за счет присутствия антител, связывающих как вирус гриппа, так и компоненты муцинового геля. Связь антител с муциновым гелем, по-видимому, обеспечивается посредством множественных низкоаффинных взаимодействий Fc-муцин. Важно отметить, что подобные адгезивные взаимодействия между антителами, связывающимися с патогенами, и компонентами слизи дыхательных путей могут обеспечивать универсальную стратегию комбинированной борьбы с патогенами в дыхательных путях. Местная доставка антител, связывающих возбудителей респираторных инфекций, потенциально может снизить вероятность заболевания, а также снизить вирусную нагрузку на эпителий дыхательных путей.
Перспективным представляется использование в качестве вирус-нейтрализующих антител IgA- и IgM-классов иммуноглобулинов. Структура и особенности гликозилирования IgA антител позволяют им связываться с муцинами эпителия воздушных путей, что ведет к продлению их жизни в составе слизи. Высокая авидность пентамера IgM позволяет достигать более высокой эффективности защиты от вирусной инфекции при использовании в верхних дыхательных путях. IgM и IgA1 также можно распылять и они достигают тканей дыхательных путей при вдыхании. Показано, что благодаря эффекту авидности поливалентные антитела проявляют повышенную нейтрализующую активность в отношении вируса SARS-CoV-2. Пентамер IgM по своей природе декавалентен из-за повторяющихся антигенсвязывающих вариабельных фрагментов. Эти уникальные особенности делают интраназальную доставку нейтрализующих моноклональных IgM антител очень перспективными для профилактики и лечения COVID-19 [Ku et al. Nasal delivery of an IgM offers broad protection from SARS-CoV-2 variants. Nature. 2021. 595: 718-723. https://doi.org/10.1038/s41586-021-03673-2].
Одним из самых многообещающих и привлекающих все большее внимание форматов моноклональных антител, в том числе для разработки новых средств борьбы с респираторными инфекциями, в последние годы является формат однодоменных антител. Однодоменными антителами (нанотелами или наноантителами) называют рекомбинантные производные однодоменных антиген-связывающих фрагментов (VHH) особых антител (HCAb, Heavy-Chain only antibodies), состоящих из димера укороченной тяжелой цепи при полном отсутствии легких цепей, которые присутствуют в норме в крови представителей семейства Camelidae и у некоторых видов хрящевых рыб в дополнение к классическим типам иммуноглобулинов [Hamers-Casterman et al. Naturally occurring antibodies devoid of light chains. Nature.1993. 363: 446-448. https://doi.org/10.1038/363446a0; Flajnik and Kasahara. Origin and evolution of the adaptive immune system: genetic events and selective pressures. Nat. Rev. Genet. 2010. 11: 47-59. doi: 10.1038/nrg2703]. Основными особенностями наноантител являются: небольшие размеры (12-15 кДа, 4 нм × 2,5 нм), высокие растворимость, стабильность, специфичность и аффинность, тепловая и химическая стойкость, а также простота осуществления их всевозможных модификаций методами генной инженерии и возможность использования чрезвычайно эффективного метода фагового дисплея для селекции оптимальных вариантов нанотел. Наноантитела способны формировать необычные паратопы и узнавать необычные для классических антител уникальные нативные эпитопы антигенов (преимущественно конформационные эпитопы, небольшие углубления, активные центры ферментов), что может приводить к особо высокой специфичности узнавания заданных мишеней in vivo. Каркасные участки «верблюжьих» нанотел (VHH), имеют высокую гомологию (заметно выше, чем в случае VH мыши) с каркасными участками вариабельных VH доменов иммуноглобулинов человека (подкласса IgG3). Производство нанотел в бактериях или любых иных системах экспрессии является очень рентабельным, а нанотела могут быть легко используемы в качестве строительных блоков для многодоменных конструкций [Harmsen and Haard. Properties, production, and applications of camelid single-domain antibody fragments. Appl. Microbiol. Biotechnol. 2007. 77: 13-22. doi: 10.1007/s00253-007-1142-2; Muyldermans. Nanobodies: natural single-domain antibodies. Annu. Rev. Biochem. 2013. 82: 775-797. doi: 10.1146/annurev-biochem-063011-092449].
Разработаны эффективные методы генно-инженерной модификации исходно отбираемых кодирующих ДНК-последовательностей нанотел и собственно нанотел с целью их адаптации для конкретного использования. Получено большое количество разнообразных комбинированных препаратов, в которых нанотело участвует в качестве антиген-связывающего модуля, тогда как остальная часть конструкции может иметь другую функцию (например, эффекторную функцию в результате присоединения константного участка антитела Fc организма хозяина) или другую специфичность связывания (присоединенное нанотело с другой специфичностью). Создаваемые на основе нанотел более сложные производные молекулы, мультивалентные, биспецифичные и иные конструкции, могут приобретать заметно более высокие специфичность и эффективность связывания, существенно более высокую биологическую активность, а также могут позволить получить новые биологические инструменты/материалы с улучшенными свойствами, например, для борьбы с вирусными или иными инфекциями [Stone Е., Hirama Т., Tanha J., Tong-Sevinc Н., Li S., MacKenzie C.R., Zhang J. (2007) The assembly of single domain antibodies into bispecific decavalent molecules. J. Immunol Methods. 318, 88-94. doi: 10.1016/j.jim.2006.10.006; Hultberg A., Temperton N.J., Rosseels V., Koenders M., Gonzalez-Pajuelo M., Schepens В., Ibañez L..I, Vanlandschoot P., Schillemans J., Saunders M., Weiss R.A., Saelens X., Melero J.A., Verrips. СТ., Van Gucht S., de Haard H.J. (2011) Llama-derived single domain antibodies to build multivalent, superpotent and broadened neutralizing anti-viral molecules. PLoS One 6, el7665. doi: 10.1371/journal.pone.0017665; Tillib S., Ivanova T.I., Vasilev L.A., Rutovskaya M.V., Saakyan S.A., Gribova I.Y., Tutykhina I.L., Sedova E.S., Lysenko A.A., Shmarov M.M., Logunov D.Y., Naroditsky B.S., Gintsburg A.L. (2013) Formatted single-domain antibodies can protect mice against infection with influenza virus (H5N2). Antiviral Research 97, 245-254. doi: 10.1016/j.antiviral.2012.12.014; Huet H.A., Growney J.D., Johnson J.A., Li J., Bilic S., Ostrom L., Zafari M., Kowal C., Yang G., Royo A. et al.: Multivalent nanobodies targeting death receptor 5 elicit superior tumor cell killing through efficient caspase induction. mAbs 2014, 6:1560-1570. doi: 10.4161/19420862.2014.975099; Burmistrova D.A., Tillib S.V., Shcheblyakov DV, Dolzhikova IV, Shcherbinin DN, Zubkova OV, Ivanova TI, Tukhvatulin AI, Shmarov MM, Logunov DY, Naroditsky BS, Gintsburg AL.(2016) Genetic Passive Immunization with Adenoviral Vector Expressing Chimeric Nanobody-Fc Molecules as Therapy for Genital Infection Caused by Mycoplasma hominis. PLoS one 11, e0150958. doi: 10.1371/journal.pone.0150958].
Уже получены перспективные терапевтические препраты на основе наноантител. Так, путем иммунизации лам противогриппозной вакциной и рекомбинантными гемагглютининами Н7 и Н2, приготовления библиотеки последовательностей наноантител на основе мРНК лимфоцитов крови иммунизированного животного и последующей селекции методом фагового дисплея клонов однодоменных антител с перекрестной реакцией на различные варианты гемагглютинина были получены несколько однодоменных антител, специфически связывающих особенно консервативные участки гемагглютинина из разных подтипов вирусов гриппа. На основе четырех отобранных нанотел были созданы многодоменные конструкции, содержащие четыре различных нанотела. Такие конструкции были встроены в вектор на основе аденоассоциированного вируса. Показано на мышиной модели, что экспрессирующиеся многодоменные антитела, нацеленные сразу на несколько консервативных эпитопов, с высокой эффективностью предотвращают заражение вирусами гриппа А и В [Laursen et al. Universal protection against influenza infection by a multidomain antibody to influenza hemagglutinin. Science. 2018. 362 (6414): 598-602. doi: 10.1126/science.aaq0620]. Эта же стратегия может быть использована для предотвращения заражения и другими вирусами/патогенами с высокой вариабельностью. Важно отметить, что подобного препарата не удалось пока получить с помощью классических моноклональных антител.
В другой недавней работе [Guttler et al. Neutralization of SARS-CoV-2 by highly potent, hyper-thermostable, and mutationtolerant nanobodies. The EMBO Journal. 2021. 40. el07985. doi: 10.15252/embj.2021107985], авторы, используя иммунные библиотеки альпаки против рецептор-связывающего домена (RBD) белка SARS-CoV-2 Spike, выделили 45 антител к VHH, блокирующих инфекцию. Среди них были и нанотела, выдерживающие нагрев до 95°С.Наиболее эффективное антитело к VHH нейтрализует SARS-CoV-2 в концентрации 17-50 пМ (0.2-0.7 мкг на литр), связывает Spike-белок в открытом и закрытом состояниях. Получаемые лучшие тримеризованные VHH нейтрализуют даже в концентрации 40 нг на литр. Авторы сконструировали тандемы нанотел и идентифицировали мономеры нанотел, которые выдерживают мутации иммунного ускользания K417N / Т, E484K, N501Y и L452R, обнаруженные в линиях коронавируса Alpha, Beta, Gamma, Epsilon, Iota и Delta / Kappa. Авторы также обнаружили VHH, которые обеспечивают естественное сворачивание RBD в цитозоле Е. coli, где его сворачивание обычно не выполняется. Такие «способствующие сворачиванию» нанотела могут позволить упростить производство вакцин и их адаптацию к вирусным ускользающим мутациям.
Другая большая группа авторов [Schoof et al. An ultrapotent synthetic nanobody neutralizes SARS-CoV-2 by stabilizing inactive Spike. Science. 2020. 370 (6523): 1473-1479. doi: 10.1126/science.abe3255] получила однодоменные антитела, которые сильно нарушают взаимодействие между SARS-CoV-2 Spike и рецептора клетки-хозяина АСЕ2. Путем скрининга дрожжевой библиотеки синтетических последовательностей нанотел, экспрессируемых на поверхности клеток, авторы идентифицировали панель нанотел, которые связываются с несколькими эпитопами на Spike и блокируют его взаимодействие с АСЕ2. Нанотело Nb6 связывает Spike в полностью неактивной конформации с его рецептор-связывающими доменами (RBD), заблокированными в состоянии, неспособном связывать АСЕ2. Созревание аффинности и использование структурированного дизайна поливалентности позволили получить трехвалентное нанотело, mNb6-tri, с фемтомолярной аффинностью к SARS-CoV-2 Spike и пикомолярной нейтрализующей активностьдю против инфекции SARS-CoV-2. mNb6-tri сохраняет стабильность и функцию после аэрозолизации, лиофилизации и термической обработки. Эти свойства могут обеспечить опосредованную аэрозолем доставку этого мощного нейтрализатора непосредственно в эпителий дыхательных путей, обещая дать широкое применение, удобное для пациента профилактическое и/или терапевтическое средство на ранней стадии инфекции, чтобы остановить самую страшную пандемию за столетие.
Сегодня наиболее популярным подходом борьбы с вирусной инфекцией (на примере коронавируса SARS-CoV-2) является использование вакцин. Альтернативной стратегией борьбы с респираторными инфекциями может быть использование аэрозолей на основе антител с целью предотвратить инфекцию до того, как вирус начнет распространяться внутри организма. Для этого требуются антитела, не обязательно нейтрализующие, но которые могут надежно связать вирусную частицу и задержать в слизи дыхательных путей. Агрегация или агглютинация антителами может позволить более эффективно улавливать вирус в слизи и затем удалять с помощью «мукоцилиарного эскалатора», что значительно расширяет потенциал методов защиты на основе антител [Parray et al. Inhalation monoclonal antibody therapy: a new way to treat and manage respiratory infections. Appl Microbiol Biotechnol. 2021. 105 (16-17): 6315-6332. doi: 10.1007/s00253-021-11488-4].
В патенте WO 2021/224606 Al (WO 2021/224606 A1 «Single domain antibodies binding to SARS-CoV-2 Spike Protein.» Дата публикации - 11.11.2021) описывается получение однодоменных антител (нанотел) против S-белка коронавируса SARS-CoV-2. Авторы получили несколько производных одного варианта нанотела, исходно отобранного из «наивной» библиотеки VHH-кДНК ламы. Среди полученных с помощью аффинного созревания (эволюции in vitro) производных нанотел были как вирус-нейтрализующие нанотела, так и нанотела для детекции и диагностики коронавируса. Основными недостатками данного патента являются нижеследующие. Авторы использовали для отбора нанотел только один вариант RBD S-белка, а именно вариант исходного изолята Wuhan-Hul (Genbank MN 908947). Во время работ по этому патенту еще не была столь очевидна, как сегодня, высокая вариабельность новых мутантных производных изолятов SARS-CoV-2, ярким примером чего является omicron. Авторы не проводили иммунизацию ламы, а использовали «нативную» (не иммунную) библиотеку VHH-клонов, кодирующих случайный спектр нанотел. Не удивительно, что исходно удалось отобрать лишь один вариант нанотела с невыразительной аффинностью. Далее авторы сумели из этого варианта с помощью мутагенеза (в первую очередь, гипервариабельного CDR3 участка) и последующего отбора получить более эффективные производные. Однако все эти производные должны узнавать практически один и тот же или очень близкий по структуре эпитоп RBD S-белка. Получены «вирус-нейтрализующие» варианты нанотел, блокирующие по данным авторов связывание RBD S-белка с АСЕ2. Однако, узнаваемый эпитоп находится как раз в зоне наиболее сильного мутагенеза у в случае последующих вариантов SARS-CoV-2, таких как omicron. Авторы патента совсем не задаются целью получить нанотела к наиболее эволюционно консервативным эпитопам RBD S-белка SARS-CoV-2. Сегодня эти нанотела вряд ли будут также узнавать и блокировать новые варианты коронавируса, и их можно всерьез рассматривать лишь как возможную часть коктейля из многих нанотел/антител, полученных разными авторами.
Из анализа уровня техники можно сделать вывод, что в настоящее время существует необходимость разработки новых подходов для борьбы с большим разнообразием возникающих новых мутантных вариантов коронавируса SARS-CoV-2.
Таким подходом может быть, например, коктейль биспецифических антител, содержащих модули связывания консервативных эпитопов S-белка коронавируса и модулей связывания мажорных компонентов секрета верхних дыхательных путей человека.
Раскрытие сущности изобретения
Целью изобретения была разработка способа получения новых однодоменных антител (нанотел), связывающих высоко консервативные поверхностные антигенные эпитопы вируса (в данном случае коронавируса SARS-CoV-2). Способ основан на последовательном выполнении следующих экспериментальных этапов.
На первом этапе проводят наработку антигенного материала, рекомбинантного белка, соответствующего рецептор-связывающему домену (RBD) основного поверхностного белка коронавируса SARS-CoV-2, Spike (шип), или S-белка. RBD удобно расположен на наиболее выдвинутой (от поверхности вируса наружу) части S-белка, содержит как весьма вариабельные участки (они обычно как раз соответствует локализации участков узнавания вирус-нейтрализующих антител с узкой специфичностью), так и консервативные участки, и он является удобной мишенью для таргетирования антителами. В принципе, на этом этапе оптимальным было бы получение целого вируса (и затем инактивированного для цели проведения иммунизации), в котором консервативные эпитопы RBD имеют нативную структуру. Однако это требует особых и малодоступных условий работы с опасными инфекциями.
На втором этапе полученный препарат рекомбинантного RBD-белка используют в качестве антигена при иммунизации верблюда с целью индукции образования и роста титра высокоаффинных антител против RBD в результате иммунизации представителя семейства Верблюдовых (в данном случае, двугорбого верблюда Camelus bactrianus) рекомбинантным RBD-белком с адъювантом. Затем проводят клонирование кДНК-последовательностей всего репертуара антиген-узнающих доменов особых неканонических верблюжьих антител (представляющих собой гомодимер укороченных тяжелых цепей при отсутствии легких цепей), синтезирующихся в виде мРНК в лимфоцитах иммунизированного животного, в фагмидном векторе (использующимся в последующей процедуре фагового дисплея), получение специфически обогащенной библиотеки последовательностей, кодирующих нанотела.
Следующий, третий этап, заключается в проведении многоэтапной селекция методом фагового дисплея клонов нанотел, связывающихся с консервативными участками RBD S-белка разных уже известных и актуальных на текущий момент мутантных вариантов коронавируса. Целью отбора являются клоны нанотел, способных эффективно связывать наиболее широкий спектр разных RBD. Отобранные клонированные последовательности, кодирующие нанотела, адаптируют для более эффективной наработки наработки в бактериальной системе экспрессии и последующей эффективной очистки.
Наконец, на четвертом этапе проводят наработку и очистку адаптированного нанотела, а затем тестируют его функциональную активность. Первоначальное тестирование проводят с помощью иммуноферментного анализа, в котором проверяют эффективность связывания полученными нанотелами консервативного эпитопа RBD S-белка для разных актуальных мутантных вариантов коронавируса SARS-CoV-2.
Краткое описание фигур
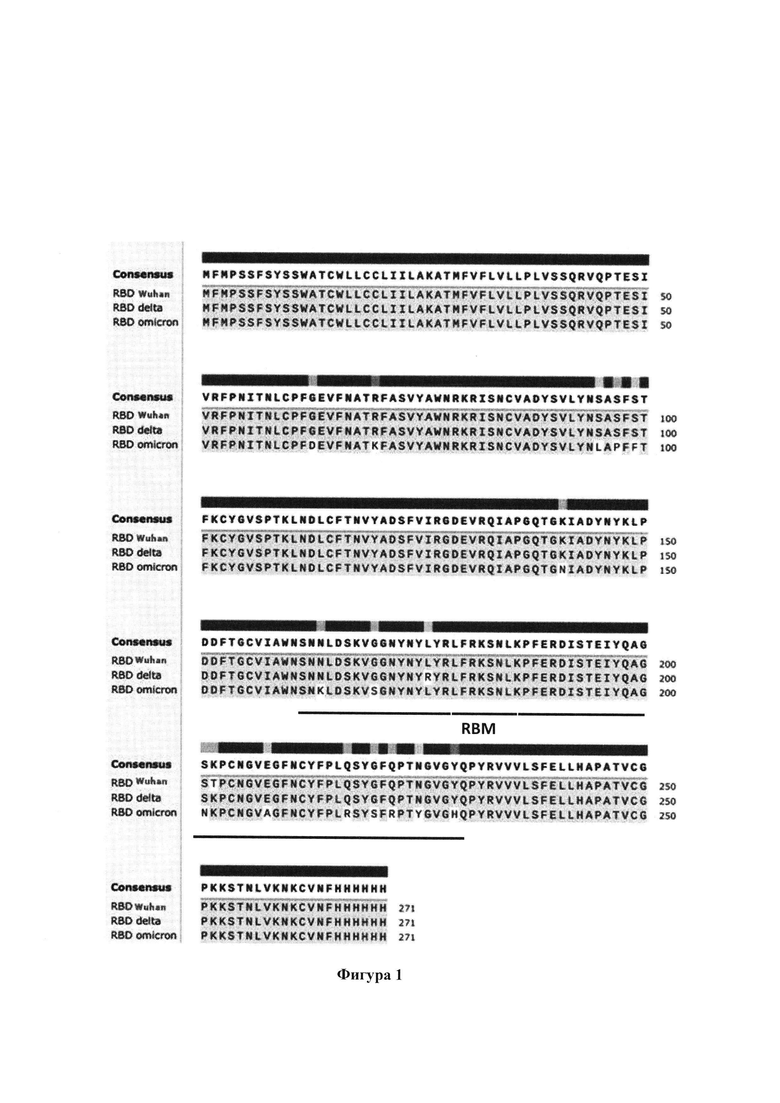
Фигура 1. Схема выравненных аминокислотных последовательностей RBD трех штаммов (мутантных вариантов) S-белка коронавируса SARS-CoV-2 (исходный - RBD Wuhan, RBD delta и наиболее мутированный вариант - RBD omicron). Указаны (без фонового желтого цвета) мутировавшие аминокислотные остатки. Жирной линией обозначено положение рецептор-связывающего мотива (RBM), который непосредственно взаимодействует с АСЕ2 рецептором.
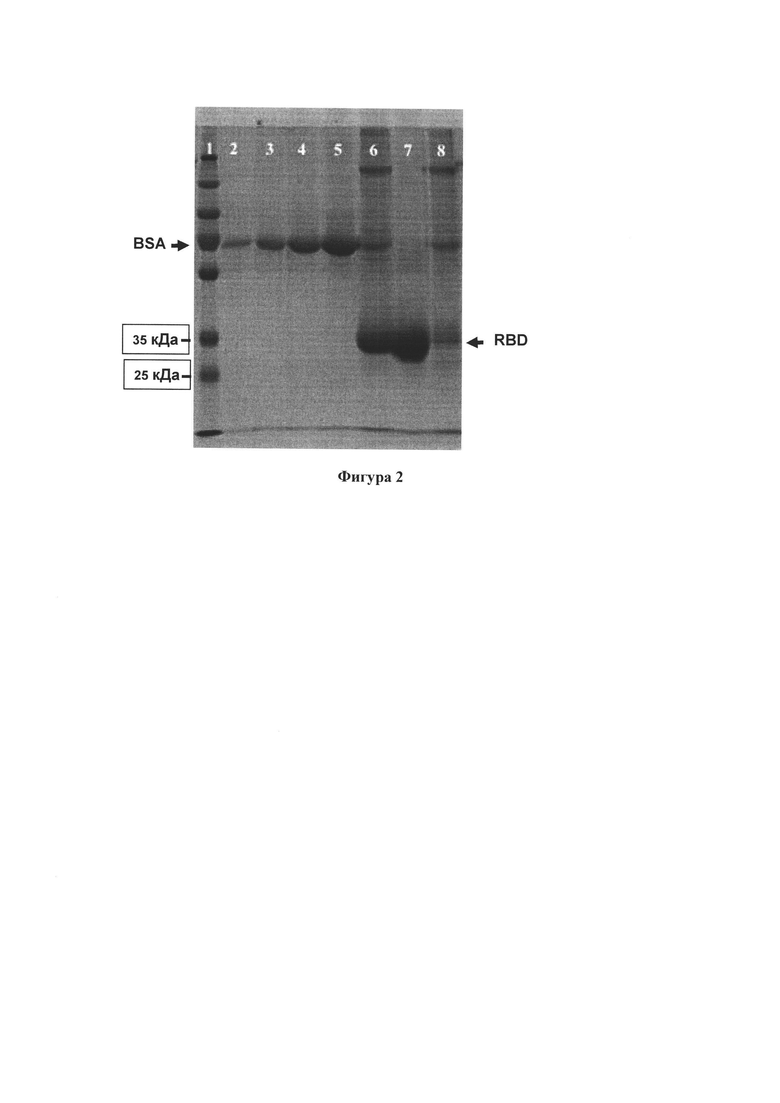
Фигура 2. Электорофореграмма SDS-полиакриламидного геля с наработанными (с помощью клонированной кодирующей последовательности) и затем очищенными рекомбинантными RBD трех штаммов (6 - RBD delta, 7 - RBD Wuhan, 8 - RBD omicron). Слева - дорожка с маркерными белками (Thermo Scientific PageRuler Plus Prestained Protein Ladder, размер - от 10 до 250 кДа). Для определения количества наработанного белка в дорожках 2-5 нанесены разные количества маркерного белка BSA (1 - 0.25 мкг, 2 - 0.5 мкг, 1 - мкг, 2 - мкг).
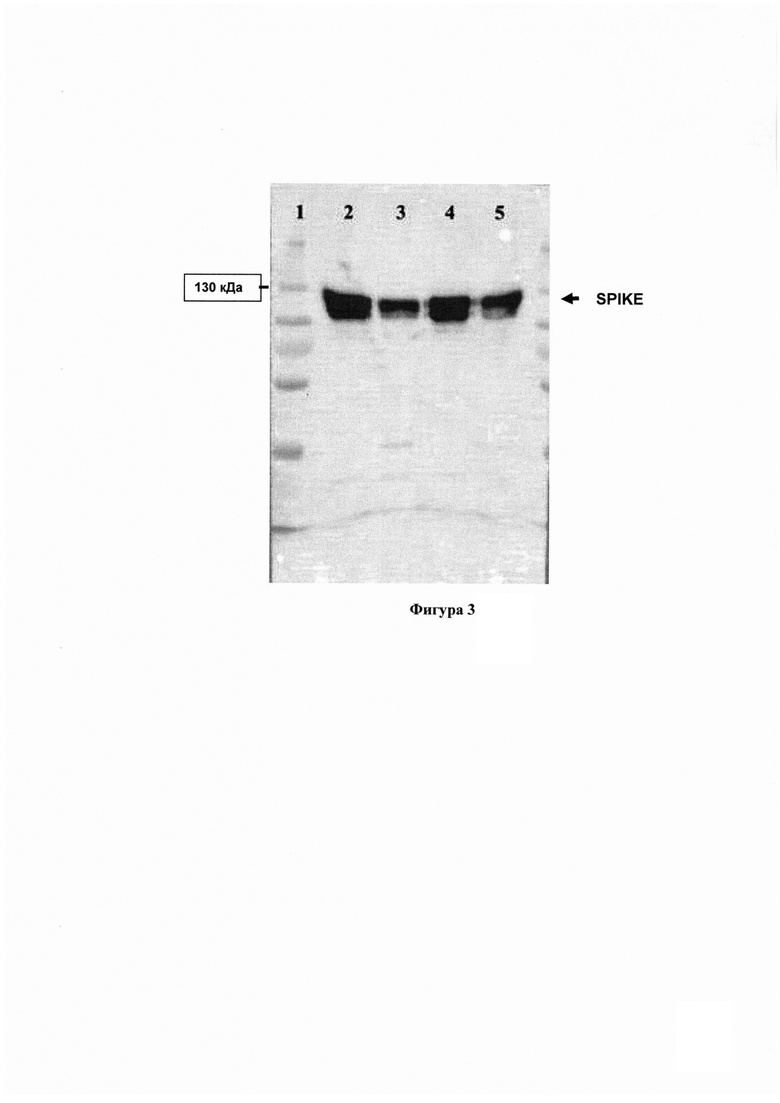
Фигура 3. Электорофореграмма SDS-полиакриламидного геля с наработанным (с помощью клонированной кодирующей последовательности) и затем очищенным рекомбинантным S-белком (Spike) SARS-CoV-2 (Wuhan). Слева - дорожка с маркерными белками (Thermo Scientific PageRuler Plus Prestained Protein Ladder, размер - от 10 до 250 кДа). Белок выявляли в четырех фракциях (2 - тотальная фракция, 3 - цитоплазматическая фракция, 4 - мембранная фракция, 5 - осадок).
Фигура 4. Аминокислотная последовательность нанотела aRBDcel. В указанной последовательности выделены соответственно (слева направо, от N- к С-концу) гипервариабельные участки CDR1, CDR2 и CDR3, которые являются определяющими для специфического узнавания нанотелом aRBDcel консервативного эпитопа RBD S-белка коронавируса SARS-CoV-2.
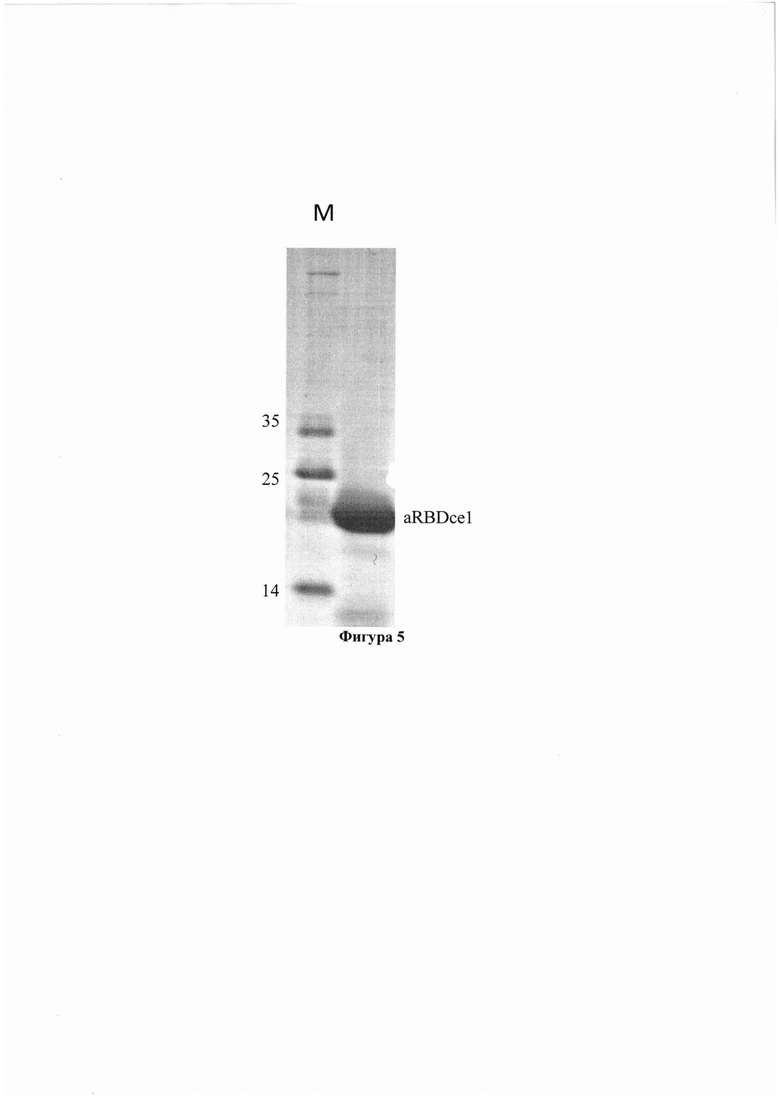
Фигура 5. Электорофореграмма SDS-полиакриламидного геля с наработанным (с помощью отобранной клонированной кодирующей последовательности) и затем очищенным нанотелом aRBDcel. М - дорожка с маркерными белками известного размера (в кДа).
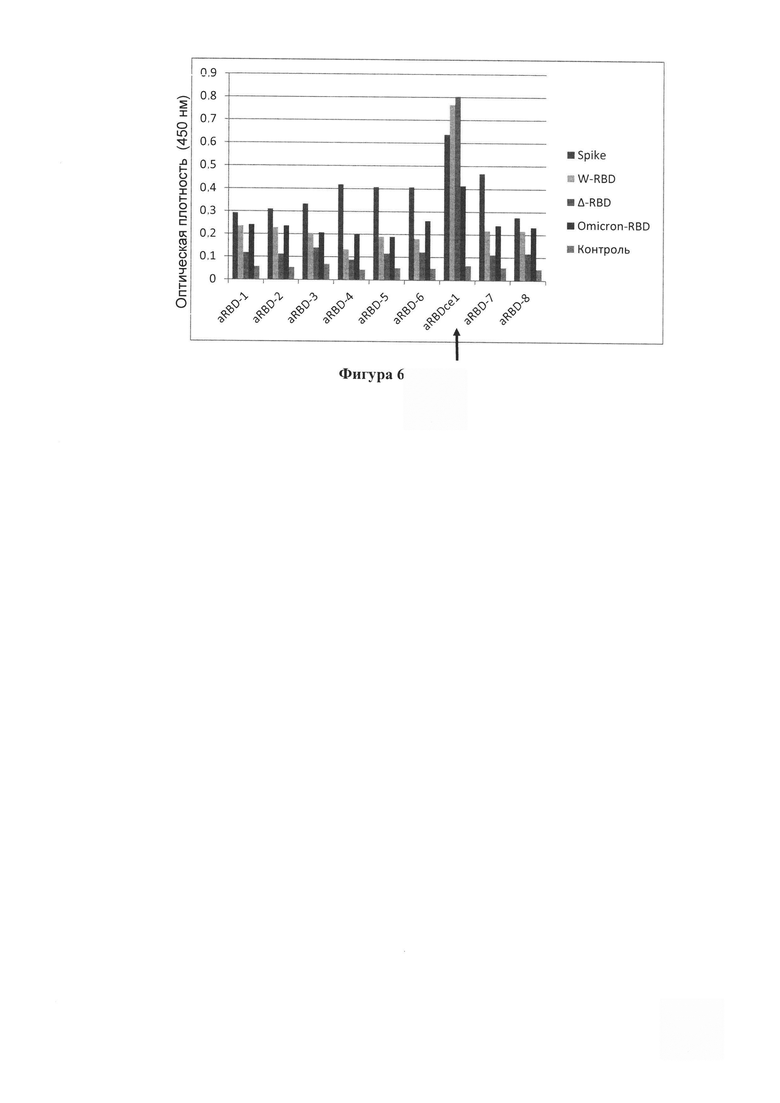
Фигура 6. Результат иммуноферментного анализа, из которого следует, что нанотело aRBDcel (в концентрации 1 мкг/мл) высокоэффективно и лучше других параллельно отобранных вариантов нанотел связывается с иммобилизованными в лунках планшета рекомбинантными белками Spike, RBD wuhan (W-RBD), RBD delta (A-RBD) и Omicron RBD, но практически не связывается с белками в контрольной лункой. В качестве контроля использовали белок бычьего сывороточного альбумина (BSA). Интенсивность сигнала отражает эффективность связывания нанотел.
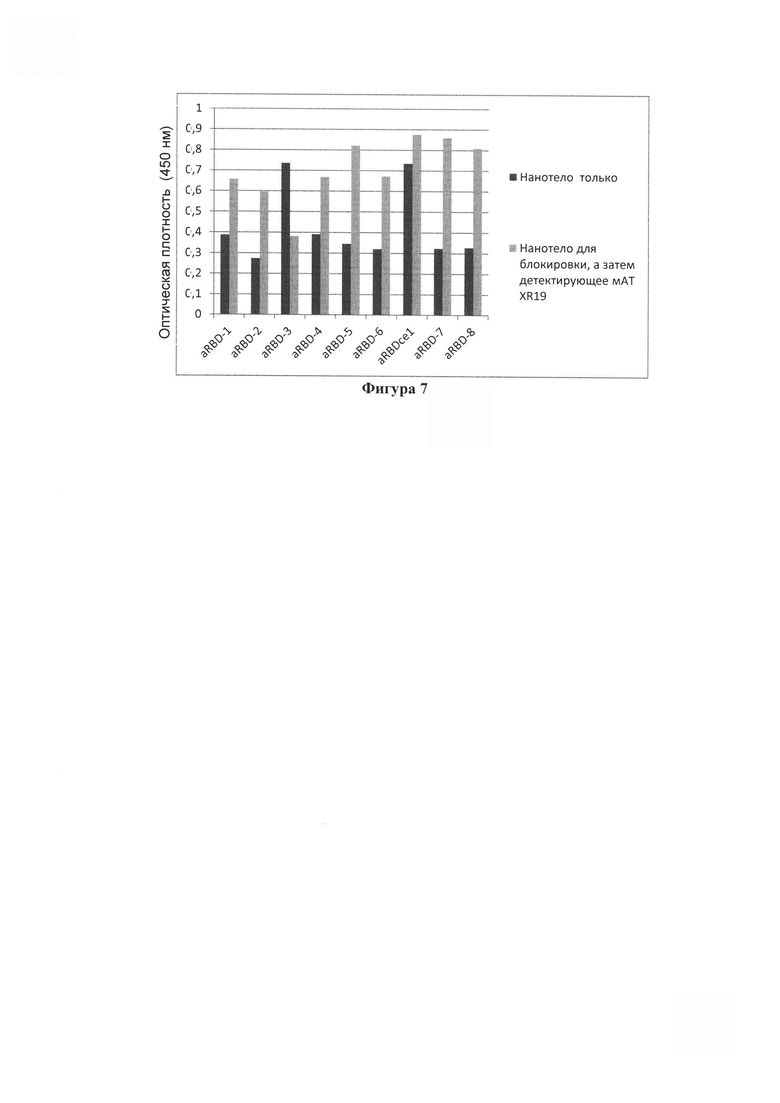
Фигура 7. Результат иммуноферментного анализа, из которого следует, что нанотело aRBDcel совсем не конкурирует с одним из коммерчески доступных вирус-нейтрализующих моноклональных антител XR19 (Хема, Россия) за связывание с иммобилизованым в лунке RBD wuhan.
Осуществление изобретения
Получение нанотел к консервативному эпитопу наиболее доступного на поверхности SARS-CoV-2 белкового домена RBD S-белка. можно рассматривать как важный этап создания комбинированных ингаляционных препаратов, способных задерживать вирусы в верхних дыхательных путях. В этом контексте получаемое нанотело будет вирус-связывающим модулем комбинированной (биспецифической) конструкции, тогда как другой модуль («якорный») может быть представлен, например, нанотелом к мажорному антигену секрета верхних дыхательных путей человека.
Способ получения нанотел, связывающих высоко консервативные поверхностные антигенные эпитопы вируса (в данном случае коронавируса SARS-CoV-2), включает следующие принципиальные этапы.
1) Наработка антигенного материала, рекомбинантного белка, соответствующего рецептор-связывающему домену (RBD) основного поверхностного белка коронавируса SARS-CoV-2 (Spike (шип), или S-белок). S-белок присутствует на поверхности коронавируса в форме гомотримеров и образует выступы-шипы в оболочке вируса, напоминающие корону. Рецептор-связывающий домен (RBD) удобно расположен на наиболее выдвинутой (от поверхности вируса наружу) части S-белка, и он является удобной мишенью для таргетирования антителами. Рекомбинантный RBD белок используют в качестве антигена при иммунизации верблюда.
2) Индукция образования и роста титра высокоаффинных антител против RBD в результате иммунизации представителя семейства Верблюдовых (в данном случае, двугорбого верблюда Camelus bactrianus) рекомбинантным RBD-белком с адъювантом.
3) Клонирование кДНК-последовательностей всего репертуара антиген-узнающих доменов особых неканонических верблюжьих антител (представляющих собой гомодимер укороченных тяжелых цепей при отсутствии легких цепей), синтезирующихся в виде мРНК в лимфоцитах иммунизированного животного, в фагмидном векторе (использующимся в последующей процедуре фагового дисплея), получение специфически обогащенной библиотеки последовательностей, кодирующих нанотела.
4) Многоэтапная селекция методом фагового дисплея (функционального отбора фаговых частиц, несущих на поверхности экспрессируемое нанотело, а внутри - ДНК, кодурующую это нанотело) клонов нанотел, связывающихся с консервативными участками RBD S-белка разных уже известных и актуальных на текущий момент мутантных вариантов коронавируса. Для селекции используются последовательно разные проклонированные рекомбинантные белки, имеющие аминокислотную последовательность соответствующих разных RBD S-белков актуальных вариантов сегодняшнего пандемического коронавируса. Целью отбора являются клоны нанотел, способных эффективно связывать наиболее широкий спектр разных RBD.
5) Проведение переклонирования генно-инженерных модификаций кодирующих последовательностей отобранных нанотел с целью их эффективной наработки в бактериальной системе экспрессии и последующей эффективной очистки (в качестве штамма-продуцента действующего вещества используются бактерии E.coli).
6) Наработка и выделение адаптированного (для эффективной наработки и очистки) отобранного нанотела. Проверка его функциональной активности (связывание консервативного эпитопа RBD S-белка для разных актуальных мутантных вариантов коронавируса SARS-CoV-2) методом иммуноанализа.
Несмотря на то, что, главным образом, в иллюстративных целях авторами настоящего изобретения делается акцент на продукции антител с использованием бактерии E.coli, среднему специалисту в данной области техники будет очевидно, что под объем настоящего изобретения подпадают и другие варианты систем реализации настоящего изобретения, прямо не заявленные в настоящем документе. Например, в качестве эукариотического продуцента могут быть использованы дрожжевые культуры или любые другие системы, очевидные в данной области техники.
Авторы настоящего изобретения исходят из того, что, как известно среднему специалисту в данной области техники, первичные, исходно получаемые последовательности нанотел могут быть затем адаптированы или «форматированы» различным образом для последующего практического использования. Так, нанотела могут быть исходными модулями (блоками) более сложных многомодульных препаратов. Возможно объединение в одном мультивалентном производном двух, трех и более моновалентных первичных нанотел. Эти объединяемые в одну конструкцию нанотела могут связываться как с одним и тем же эпитопом антигена-мишени, так и с его разными эпитопами, или даже с различными антигенами-мишенями. Возможно также комбинированное объединение в одну конструкцию однодоменных нанотел и других молекул с получением многофункциональных препаратов; мультимеризация с помощью введения дополнительных аминокислотных последовательностей, взаимодействующих белковых доменов, таких как лейциновые зипперы или последовательностей небольших белков, образующих стабильные комплексы. Для модулирования свойств препарата нанотела, например, увеличения времени жизни или совершенствования способа очистки, в состав конечного соединения могут быть введены дополнительные аминокислотные последовательности. Среднему специалисту в данной области техники будет очевидно, что такие модификации и прочие варианты нанотел, лежащих в основе настоящего изобретения, подпадают под объем настоящего изобретения, поскольку являются структурными и функциональными вариантами нанотел. Таким образом, авторы настоящего изобретения понимают под термином "нанотела" как первичные, исходно получаемые, "минимальные" аминокислотные последовательности нанотел, так и их модификации, полученные в результате упомянутых адаптаций или «форматирования» и их варианты. Термин «вариант нанотела» для целей настоящего изобретения означает полипептид, который содержит изменения в аминокислотной последовательности, а именно делеции, вставки, добавления или замены аминокислот, при условии, что при этом сохраняется необходимый уровень активности белка, например, как минимум 10% от активности исходного нанотела. Ряд изменений в варианте белка зависит от положения или от типа аминокислотного остатка в трехмерной структуре белка. Количество изменений может составлять, например, от 1 до 30, более предпочтительно, от 1 до 15, и наиболее предпочтительно, от 1 до 5 изменений в последовательности исходного однодоменного наноантитела. Эти изменения могут иметь место в областях полипептида, которые не являются критичными для его функции. Это становится возможным благодаря тому, что некоторые аминокислоты обладают высокой гомологией друг с другом, и поэтому третичная структура или активность белка не нарушаются при таком изменении. Поэтому в качестве варианта белка может выступать белок, который характеризуется гомологией не менее 70%, предпочтительно, не менее 80%, более предпочтительно, не менее 90%, и наиболее предпочтительно, не менее 95% по отношению к аминокислотной последовательности исходного при условии сохранения активности полипептида. Гомология между аминокислотными последовательностями может быть установлена с использованием хорошо известных методов, например с помощью выравнивания последовательностей в компьютерной программе BLAST 2.0, которая вычисляет три параметра: счет, идентичность и сходство.
Замена, деления, вставка, добавление или замена одного или нескольких аминокислотных остатков будут представлять собой консервативную мутацию или консервативные мутации при условии, что активность нанотела при этом сохраняется. Примером консервативной мутации(ий) является консервативная замена(ы). "Консервативная аминокислотная замена" представляет собой замену, при которой аминокислотный остаток заменяется аминокислотным остатком, имеющим сходную боковую цепь. В данной области техники определены семейства аминокислот, имеющих сходные боковые цепи. Эти семейства включают в себя аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислыми боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Поскольку гипервариабельные районы нанотел определяют их специфическое взаимодействие с антигеном, то именно гомологичные замены аминокислот в этих участках могут приводить к получению несколько различающихся по последовательности нанотел, которые обладают идентичными или близкими свойствами. Таким образом, среднему специалисту в данной области техники будет очевидно, что под объем настоящего изобретения подпадают не только указанные в приложении последовательности нанотел, но и те, которые могут быть получены путем замен аминокислот в гипервариабельных участках (указанных в перечне последовательностей как CDR1, CDR2 и CDR3, определяющих комплементарность антител участков) на другие, но очень близкие по свойствам, аминокислоты (консервативных замен).
Фрагменты ДНК, которые кодируют по существу тот же функциональный полипептид, могут быть получены, например, путем модификации нуклеотидной последовательности фрагмента ДНК, кодирующего исходное нанотело, например, посредством метода сайт-направленного мутагенеза, так, что один или несколько аминокислотных остатков в определенном сайте будут делетированы, заменены, вставлены или добавлены. Фрагменты ДНК, модифицированные как описано выше, могут быть получены с помощью традиционных методов обработки с целью получения мутации.
Фрагменты ДНК, которые кодируют по существу тот же функциональный полипептид исходного нанотела, могут быть получены путем экспрессии фрагментов ДНК, имеющих мутацию, описанную выше, и установления активности экспрессируемого продукта.
Замена, делеция, вставка или добавление нуклеотидов, описанных выше, также включают мутации, которые имеют место в природе и, например, обусловлены изменчивостью.
Нанотела, согласно настоящему изобретению, могут кодироваться большим множеством молекул нуклеиновых кислот, что является результатом хорошо известного в данной области техники явления вырожденности генетического кода. Суть феномена состоит в том, что любая аминокислота (за исключением триптофана и метионина), входящая в состав природных пептидов, может кодироваться более, чем одним триплетным нуклеотидным кодоном. Любая из этих вырожденных кодирующих молекул нуклеиновых кислот может входить в состав кассет, экспрессирующих нанотела, заявленные в соответствии с настоящим изобретением и подпадающих под объем настоящего изобретения.
Далее изобретение будет проиллюстрировано примерами, которые предназначены для обеспечения лучшего понимания сущности заявленного изобретения, но не должны рассматриваться как ограничивающие данное изобретение.
Пример 1. Наработка рекомбинантных белков, соответствующих рецептор-связывающим доменам (RBD) S-белка трех актуальных штаммов SARS-CoV-2, а также полноразмерного S-белка (Wuhan).
На Фигуре 1 приведена схема выравненных аминокислотных последовательностей RBD трех штаммов (мутантных вариантов) S-белка коронавируса SARS-CoV-2 (исходный - RBD Wuhan, RBD delta и наиболее мутированный вариант - RBD omicron). Именно эти RBD наработаны и использованы в данной работе.
Наработку RBD вирусного штамма SARS-CoV-2 (Wuhan) проводят с помощью плазмиды, предоставленной Ф. Крамером ("данный материал был получен в рамках HHSN272201400008C и доступен через сайт BEI Resources, NIAID, NIH, https://www.beiresources.org/Catalog/BEIPlasmidVectors/NR-52309.aspx; Vector pCAGGS Containing the SARS-Related Coronavirus 2, Wuhan-Hu-1 Spike Glycoprotein Receptor Binding Domain (RBD), NR-52309.") по прилагаемому на сайте протоколу.
Указанный вектор для рецептор-связывающего домена (RBD) гена шиповидного (S) гликопротеина из коронавируса SARS-CoV-2, Wuhan-Hu-1 (GenBank: MN908947) получают путем слияния сигнальной последовательности N-концевой сигнальной последовательности S-белка и RBD (аминокислоты с 319 по 541) с С-концевой гексагистидиновой меткой. Последовательность оптимизируют по кодонам для экспрессии у млекопитающих и субклонируют в вектор экспрессии pCAGGS у млекопитающих под промотором AG. NR-52309 содержит ген бета-лактамазы, bla, для обеспечения селекции трансформантов через устойчивость к ампициллину в Escherichia coli (Е. coli). Полученный размер плазмиды составляет примерно 5490 пар оснований. Полная последовательность плазмиды представлена на веб-странице BEI Resources.
Экспрессию и отчистку RBD проводят в соответствии с протоколом группы Краммера, опубликованным в [Stadlbauer et al. SARS-CoV-2 Seroconversion in Humans: A Detailed Protocol for a Serological Assay, Antigen Production, and Test Setup. Curr Protoc Microbiol. 2020. 57(1):e100. doi: 10.1002/cpmc.100]. Кратко, клетки HEK293T трансфицируют плазмидой, кодирующей RDB, с помощью кальций-фосфатного метода, на третий день собирают супернатант. Супернатант откручивают от клеток при 4000xg в течение 20 минут и фильтруют через фильтр 0.22 нm. Ni-NTA смолу, перед использованием промывают раствором PBS, количество смолы для отчистки RBD берут из расчета 6 мл смолы на 200 мл культуральной среды. После промывки PBS, смолу осаждают при 2000xg в течение 10 минут, PBS отбирают и смолу ресуспендируют со средой, содержащей белок, инкубируют на шейкере при комнатной температуре в течение 2 часов. Стеклянную хроматографическую колонку заполняют смесью смолы и культуральной среды, после чего дважды промывают промывочным раствором следующего состава: NaH2PO4 57 mM, NaCl 300 mM, Имидазол 20 mM). RBD элюируют с помощью следующего буфера: NaH2PO4 57 mM, NaCl 300 mM, Имидазол 235 mM. Белок диализуют с помощью диализного мешка с диаметром пор 14 kDa в PBS в течение 16 часов при +4°С, после чего проводят электрофорез в SDS-полиакриламидном геле с последующим окрашиванием белков Кумасси R-250 (Фигура 2 (7 дорожка)). Концентрацию белка определяют с помощью Pierce ВСА Protein Assay Kit (Thermofisher, USA) и калибровочной кривой для различных концентраций BSA (Фигура 2 (дорожки 2-5)).
С целью получения RBD штамма SARS-COV2 delta вносят следующие смысловые замены в исходную плазмиду для экспрессии RBD короновируса SARS-COV2 в эукариотических клетках HEK293T, (предоставленную Ф. Крамером, описание выше). Мутации, соответствующие заменам аминокислот L176R, T202K, проводят с помощью метода безлигазного клонирования с использованием олигонуклеотидов SEQ ID NO: 1-6.
Полученную в результате клонирования последовательность проверяют методом секвинирования по Сенгеру с помощью олигонуклеотида SEQ ID NO: 5.
Безлигазное клонирование проводят в соответствии со стандартным протоколом: после амплификации соответствующих фрагментов с помощью полимеразы PhusionTM high-fidelity DNA polymerase (Thermofisher, США), амплифицированные фрагментвы подвергают электрофорезу в 1% агарозном геле, фрагменты нужного размера выделяют с помощью набора Cleanup Standart (Евроген, Россия). Амплифицированный вектор и вставку инкубируют в течение 3 минут при 37°С с Т4 полимеразой, после чего Т4 полимеразу инактивируют при 75°С в течение 15 минут, выдерживают в течение 1 минуты во льду, затем полученную смесь используют для проведения трансформации компетентных клеток ТОР10. Экспрессию и отчистку RBD проводят, как описано выше, согласно протоколу Stadlbauer et al. 2020.
Для синтеза последовательности, кодирующей RBD штамма SARS-CoV2 omicron, в исходную плазмиду, кодирующую RBD штамма SARS-CoV2, вносят нуклеотидные замены, соответствующие мутациям: G63D, R70K, S95L, S97P, S99F, K141N, N164K, G170S, S201N, T202K, Е208А, Q217R, G220S, Q222R, N225Y, Y229H. Для этого используют методы безлигазного клонирования и сайт-специфического мутагенеза. Безлигазное клонирование, экспрессию и отчистку RBD omicron проводят, как описано выше для RBD delta. Наработанные белки анализируют и количественно оценивают с помощью электрофореза (Фигура 2).
Для внесения замен методом безлигазного клонирования использовали последовательности SEQ ID NO: 7-22.
Полученную последовательность проверяли методом секвинирования по Сенгеру с помощью последовательностей SEQ ID NO: 23 и SEQ ID NO: 24.
Экспрессию и отчистку полноразмерного белка Spike SARS-CoV2 проводят в соответствии с протоколом, опубликованным группой Краммера [Stadlbauer et al. SARS-CoV-2 Seroconversion in Humans: A Detailed Protocol for a Serological Assay, Antigen Production, and Test Setup.Curr Protoc Microbiol. 2020. 57(1): e100. doi: 10.1002/cpmc.100], с тем отличием, что экспрессируют Spike, вместо RBD. Наработку и очистку проводят так же, как описано выше для RBD. На Фигуре 3 представлена электорофореграмма SDS-полиакриламидного геля с наработанным (с помощью клонированной кодирующей последовательности) и затем очищенным рекомбинантным S-белком (Spike) SARS-CoV-2 (Wuhan). Белок выявляют в разных фракциях (2 - тотальная фракция, 3 - цитоплазматическая фракция, 4 - мембранная фракция, 5 - осадок). Впоследствии объединяют весь очищенный белок в один препарат, который используют в качестве антигена для ИФА.
Пример 2. Проведение иммунизации и получение библиотеки кДНК-последовательностей, кодирующих нанотела.
Двугорбого верблюда Camelus bactrianus последовательно иммунизируют 5 раз (через 4 недели после первой инъекции, а затем каждый последующий этап инъекций проводят через 10-14 дней) путем подкожного введения антигенного материала, смешанного с равным объемом полного (при первой инъекции) или неполного (при остальных инъекциях) классического адъюванта Фрейнда (Difco, США), представляющего собой эмульсию из воды, минеральных масел, эмульгаторов и, в случае полного адьеванта, также кусочков убитых туберкулезных бактерий В качестве антигенного материала для иммунизации используют 0,5 мг смеси рекомбинаннтных белков, соответствующих RBD Wuhan и RBD delta. Взятие крови (150 мл) проводят через 5 дней после последней инъекции. Для предотвращения свертывания взятой крови добавляют 50 мл стандартного фосфатно-солевого раствора (PBS), содержащего гепарин (100 ед./мл) и ЭДТА (3 мМ). Кровь разводят в 2 раза раствором PBS, содержащим 1 мМ ЭДТА, 35 мл разбавленного раствора крови наслаивают на ступеньку объемом 15 мл специальной среды (Histopaque-1077, Sigma) с плотностью 1,077 г/мл, проводят центрифугирование в течение 20 мин при 800xg. Мононуклеарные клетки (лимфоциты и моноциты) отбирают из интерфазной зоны плазма/Histopaque, после чего их промывают раствором PBS, содержащим 1 мМ ЭДТА.
Суммарную РНК из В-лимфоцитов выделяют с помощью реагента TRIzol (Invitrogen). Затем, на колонке с олиго(dT)-целлюлозой из тотальной РНК очищают поли(А)-содержащую РНК. Концентрацию РНК определяют с помощью биофотометра (Eppendorf) и проверяют качество выделенной РНК с помощью электрофореза в 1,5%-ном агарозном геле с формальдегидом. Реакцию обратной транскрипции проводят с использованием обратной транскриптазы Maxima (Thermo Scientific, США и праймера олиго(dT) 15 в качестве затравки.
Продукты обратной транскрипции используют в качестве матрицы в двухступенчатой полимеразной цепной реакции и полученные продукты амплификации клонируют по сайтам NcoI(PstI) и NotI в фагмидный вектор, как описано ранее [Тиллиб и др. Фингерпринтный анализ селекции наноантител методом фагового дисплея с использованием двух вариантов фагов-помощников. Acta Naturae. 2010; 2 (3): 100-108/]. Последующие процедуры селекции, базирующиеся на методе фагового дисплея, в котором в качестве фага-помощника используют бактериофаг M13KO7 (New England Biolabs, США), проводят аналогично методам, в указанной выше статье.
Пример 3. Проведение многоэтапной селекции для отбора клонов нанотел, связывающихся с консервативными участками RBD S-белка трех известных и актуальных на текущий момент мутантных вариантов коронавируса.
Последующие процедуры селекции, базирующиеся на методе фагового дисплея, в котором в качестве фага-помощника используют бактериофаг M13KO7 (New England Biolabs, США) и проводят аналогично методам в статье [Тиллиб и др. Фингерпринтный анализ селекции наноантител методом фагового дисплея с использованием двух вариантов фагов-помощников. Acta Naturae. 2010; 2 (3): 100-108]. Для селекции последовательно используют лунки иммунологического планшета с высокой сорбцией (Nunc Maxisorp) с иммобилизованными в PBS рекомбинантными белками (RBD Wuhan, RBD delta и RBD omicron). Для блокировки используют 1% БСА (Sigma-Aldrich, США) в PBS или казеиновый блокирующий буфер (Sigma-Aldrich, США). Процедуру селекции и последующей амплификации отбираемых фаговых частиц (содержащих ген однодоменного наноантитела внутри и экспрессирующееся однодоменное нанотело - в составе поверхностного фагового белка pIII) повторяют, как правило, последовательно три раза, параллельно используя разную последовательность инкубации с каждым из трех вариантов иммобилизованных антигенов. Если первые два варианта RBD используют для иммунизации, и к ним не составляет труда отобрать нанотела, то в случае штамма omicron RBD, содержащего большое число мутаций, оказалось непросто отобрать нанотело, эффективно связывающее RBD omicron.
Последовательности клонов отобранных нанотел группируют согласно схожести их фингерпринтов, получаемых при электрофоретическом разделении продуктов гидролиза амплифицированных последовательностей однодоменных наноантител параллельно тремя частощепящими рестрикционными эндонуклеазами (HinfI, MspI, RsaI). Для оценки специфической активности отобранных нанотел, представителей каждой из групп, проводят микроиндукцию синтеза нанотел в периплазме бактерий и выделяют периплазматический экстракт, в котором содержатся нарабатываемые нанотела. Эти периплазматичесие экстракты с нанотелами, содержащими на С-конце НА)-тэг (антигенная детерминанта, фрагмент из 9 аминокислот YPYDVPDYA), используют в иммуноферментном анализе (ИФА) для выявления наиблолее перспективных вариантов нанотел. В качестве вторичных антител к НА-тагу использовуют конъюгированные с пероксидазой хрена анти-НА-моноклональные антитела (CHGT-45P-Z, ICL, Inc., США). Активность пероксидазы хрена определяют, используя Ultra TMB-ELISA (Thermo Scientific, USA) и измеряют поглощение при длине волны 650 нм, а затем, после добавления 2М серной кислоты, при 450 нм. В результате проделанных селекций и ИФА нам удалось отобрать одно наиболее перспективное однодоменное антитело (нанотело), названное aRBDcel (anti-RBD conserved epitope), удовлетворившее основные требования, которые были нами исходно поставлены и представлено аминокислотной последовательностью SEQ ID NO: 25, которая кодируется нуклеотидной последовательностью кДНК SEQ ID NO: 26. В последовательности SEQ ID NO: 25 указаны соответственно (слева направо, от N- к С-концу) гипервариабельные участки CDR1, CDR2 и CDR3, которые являются определяющими для специфического узнавания нанотелом aRBDcel консервативного эпитопа RBD S-белка коронавируса (Фигура 4).
Пример 4. Форматирование и продукция полученных анти-RBD нанотел.
Отобранные клонированные последовательности, кодирующие нанотела, адаптируют для более эффективной наработки в бактериальной системе экспрессии и последующей эффективной очистки нанотела, как описано ранее [Tillib et al. Formatted single-domain antibodies can protect mice against infection with influenza virus (H5N2). Antiviral Res. 2013.. 97: 245-254 doi: 10.1016/j.antiviral.2012.12.014; Tillib et al. Single-domain antibody-based ligands for immunoaffinity separation of recombinant human lactoferrin from the goat lactoferrin of transgenic goat milk. J. Chromatogr. B: Anal. Technol. Biomed. Life Sci. 2014. 949-950: 48-57 doi: 10.1016/j.jchromb.2013.12.034]. Получаемые нанотела содержат на С-конце длинную линкерную последовательность (из 28 аминокислот длинного варианта шарнирного участка неканонического верблюжьего антитела), после которой идут два пептидных фрагмента: гемагглютинин (НА)-тэг), позволяющий детектировать нанотело с помощью коммерческих антител к этому пептиду, и последовательность из шести остатков гистидина (His)6-тэг, позволяющая эффективно очищать содержащий ее белокссылки в полном формате с помощью металл-хелатной аффинной хроматографии на Ni-NTA-агарозе. Используемый линкерный линейный участок содержит четыре удобно расположенных и хорошо доступных аминокислотных остатка лизина. По этим остаткам очень удобно проводить химические реакции пришивки других молекул, в том числе удобно иммобилизовать наноантитело на BrCN-Сефарозе. Качество получаемых очищенных нанотел оценивают с помощью хроматографического, электрофоретического и иммуноферментного анализа, как описано ранее [Tillib et al. Formatted single-domain antibodies can protect mice against infection with influenza virus (H5N2). Antiviral Res. 2013.. 97: 245-254 doi: 10.1016/j.antivira1.2012.12.014; Tillib et al. Single-domain antibody-based ligands for immunoaffinity separation of recombinant human lactoferrin from the goat lactoferrin of transgenic goat milk. J. Chromatogr. B: Anal. Technol. Biomed. Life Sci. 2014. 949-950: 48-57 doi: 10.1016/j.jchromb.2013.12.034]. На Фигуре 5. представлена электорофореграмма SDS-полиакриламидного 14% геля, из которой видно, что отобранная с помощью клонирования кодирующая последовательность SEQ ID NO: 26 позволяет нарабатывать нанотело aRBDcel.
Пример 5. Тестирование полученных адаптированных нанотел.
Выделенные адаптированные нанотела тестируют на их функциональную активность. Первоначальное тестирование проводят с помощью ИФА, в котором проверяют эффективность связывания полученными нанотелами консервативного эпитопа RBD S-белка для разных актуальных мутантных вариантов коронавируса SARS-CoV-2. На Фигуре 6 представлен результат иммуноферментного анализа, из которого следует, что нанотело aRBDcel (в концентрации 1 мкг/мл) высокоэффективно и лучше других параллельно отобранных вариантов нанотел связывается с иммобилизованными в лунках планшета рекомбинантными белками Spike, RBD wuhan (W-RBD), RBD delta (Δ-RBD) и Omicron RBD, но практически не связывается с иммобилизованным белком бычьего сывороточного альбумина (BSA) в контрольной лункой.. Интенсивность сигнала отражает эффективность связывания нанотел. По нашим сравнительным оценкам с другими ранее нами полученными и охарактеризованными нанотелами к другим мишеням, из полученных результатов можно предполагать высокую аффинность связывания нанотела aRBDcel с RBD (в нижнем наномолярном диапазоне). aRBDcel - пока единственное нами отобранное нанотело, эффективно связывающее все используемые варианты RBD, в том числе RBD omicron и полноразмерный S-белок. На Фигуре 7 показан результат ИФА, в котором иммобилизованный RBD (wuhan) вначале связывают-блокируют повышенными концентрациями индивидуальных вариантов отобранных нанотел (20 мкг/мл), затем промывают лунки и добавляют коммерческое вирус-нейтрализющее моноклональное мышиное антитело XR19 (Хема, Россия). Затем после промывки добавляют кроличье антимышиное антитело, коньюгированное с пероксидазой и проводят определение связавшейся пероксидазы, как описано выше. Можно видеть, что нанотело aRBDcel совсем не конкурирует за связывание с этим «вирус-нейтрализующим» (по данным фирмы-производителя) антителом. Из полученных результатов можно с высокой вероятностью предполагать, что нам удалось выполнить поставленную задачу и получить однодоменное антитело, с высокой эффективностью связывающее консервативный поверхностный (легко доступный) эпитоп RBD S-белка коронавируса SARS-CoV-2.
| название | год | авторы | номер документа |
|---|---|---|---|
| Однодоменное антитело ламы Н5 и его производное H5-Fc, специфически связывающие RBD-домен S-белка вируса SARS-CoV-2, обладающие вируснейтрализующей активностью | 2022 |
|
RU2793967C1 |
| Плазмидная генетическая конструкция pET21a_SKP, обеспечивающая экспрессию в прокариотической системе E.coli рекомбинантного белка SKP, и рекомбинантный белок SKP, обладающий широконейтрализующими свойствами однодоменного наноантитела против SARS-CoV-2 | 2024 |
|
RU2839376C1 |
| Моноклональное антитело iC1 и его антигенсвязывающий фрагмент, селективно связывающие рецептор-связывающий домен Spike-белка вируса SARS-CoV-2, обладающие вируснейтрализующей активностью | 2023 |
|
RU2817696C1 |
| Интегративный плазмидный вектор pVEAL3-RBDdel, обеспечивающий синтез и секрецию рекомбинантного белка рецепторсвязывающего домена RBDdelta коронавируса SARS-CoV-2 в клетках млекопитающих, рекомбинантный штамм клеточной линии CHO-K1- RBDdelta и рекомбинантный белок RBDdelta SARS-CoV-2, продуцируемый штаммом клеточной линии | 2023 |
|
RU2816175C1 |
| Моноклональное антитело iC2 и его антигенсвязывающий фрагмент, селективно связывающие рецептор-связывающий домен Spike-белка вируса SARS-CoV-2, обладающие вируснейтрализующей активностью | 2023 |
|
RU2817697C1 |
| Однодоменные наноантитела против шиповидного белка вируса SARS-CoV-2 | 2021 |
|
RU2794141C2 |
| Широко нейтрализующее антитело против SARS-CoV-2 | 2022 |
|
RU2810476C1 |
| БИСПЕЦИФИЧЕСКОЕ МОНОКЛОНАЛЬНОЕ АНТИТЕЛО ПРОТИВ SARS-COV-2 | 2022 |
|
RU2791749C1 |
| Тяжелоцепочечные моноклональные антитела, специфически связывающиеся с S белком вируса SARS-CoV-2, и способ их применения для терапии заболеваний, вызываемых различными вариантами вируса SARS-CoV-2 | 2024 |
|
RU2836313C1 |
| Средство и способ терапии и экстренной профилактики заболеваний, вызываемых вирусом SARS-CoV-2 на основе рекомбинантного антитела и гуманизированного моноклонального антитела | 2021 |
|
RU2769223C1 |

Настоящее изобретение относится к области молекулярной иммунологии, биотехнологии, молекулярной диагностики и медицины. Получен бактериальный продуцент нового полипептида, являющегося рекомбинантным производным антиген-узнающего домена особого антитела верблюда, не имеющего легких цепей. Получаемый полипептид (нанотело) обладает свойством эффективно узнавать и связывать консервативный участок рецептор-связывающего домена поверхностного белка (шипа, Spike) пандемического коронавируса SARS-CoV-2. Такой полипептид, являющийся однодоменным антителом, помимо традиционного использования в иммуноанализе и диагностике может быть использован для разработки комбинированных новых препаратов в качестве модуля мишень-специфического связывания, задержки/блокирования коронавируса в верхних дыхательных путях человека. 2 н. и 1 з.п. ф-лы, 7 ил., 5 пр.
1. Однодоменное антитело, обозначаемое также как нанотело, специфически связывающее консервативный эпитоп рецептор-связывающего домена RBD S-белка коронавируса SARS-CoV-2 человека и имеющее аминокислотную последовательность SEQ ID NO: 25.
2. Способ связывания и детекции консервативного эпитопа RBD S-белка коронавируса SARS-CoV-2 человека, включающий приведение в контакт указанного RBD как отдельного рекомбинантного белка, так и в составе S-белка, с нанотелом по п. 1 и детектирование связывания нанотела по п. 1 с RBD.
3. Способ по п. 2, отличающийся тем, что связывание консервативного эпитопа RBD S-белка осуществляют комбинированным препаратом, в котором нанотело по п. 1 участвует в качестве коронавирус-связывающего модуля.
| Однодоменное антитело и его модификации, специфически связывающиеся с RBD S белка вируса SARS-CoV-2, и способ их применения для терапии и экстренной профилактики заболеваний, вызываемых вирусом SARS-CoV-2 | 2021 |
|
RU2763001C1 |
| Экспрессионный вектор на основе аденоассоциированного вируса и способ его применения для экстренной профилактики и профилактики заболеваний, вызываемых вирусом SARS-CoV-2 (варианты) | 2022 |
|
RU2777404C1 |
| CN 111825762 A, 27.10.2020 | |||
| WO 2021233834 A1, 25.11.2021. | |||
Авторы
Даты
2023-12-07—Публикация
2022-12-08—Подача