Использование: в гальваническом производстве для восстановления работоспособности электролитов хромирования на основе соединений шестивалентного хрома.
Изобретение относится к способу очистки электролита хромирования на основе хромового ангидрида и серной кислоты от вредной примеси - катионов трехвалентного железа.
Предлагаемый способ позволяет очищать сильно загрязненные электролиты хромирования, содержащие от 5-10 г/л и более катионов трехвалентного железа, при этом продлевается срок службы электролита хромирования и предотвращается залповый сброс электролита на очистные сооружения.
Целью изобретения является разработка способа очистки электролита хромирования от катионов трехвалентного железа, не требующего использования ионообменных смол, ионообменных мембран и не использующих химических реагентов, после которых образуются трудно утилизируемые отходы.
В качестве объекта применения изобретения взят электролит хромирования, загрязненный примесью катионов трехвалентного железа.
Сущность изобретения: известен способ очистки стандартного электролита хромирования от примесей катионов железа и меди с помощью фосфата кальция [1, 2]. Недостаток такого способа - образование большого количества трудно утилизируемого осадка сульфата кальция (90-150 кг сульфата кальция на 1 м3 регенерируемого электролита).
Для осаждения катионов трехвалентного железа непосредственно из электролита хромирования необходимо, чтобы кислотная форма аниона-осадителя представляла собой сильную кислоту, а произведение растворимости, ПР, образующихся при этом соединений трехвалентного железа было наименьшим.
Йодноватая кислота, HIO3, удовлетворяет предъявленным выше требованиям: K1=1,6×10-1 [3], растворимость йодата трехвалентного железа Fe(IO3)3 в воде равна 3,6 г/л (0,0062 М) (при t=20°C) [4].
При растворении в воде йодноватая кислота диссоциирует с образованием йодат-анионов, IO3 -, согласно уравнению реакции:
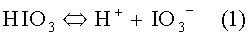
При добавлении в электролит хромирования йодноватой кислоты происходит осаждение катионов трехвалентного железа йодат-анионами согласно уравнению:

Для осаждения примеси катионов трехвалентного железа из электролита хромирования на основе соединений шестивалентного хрома в виде йодата трехвалентного железа необходимо использовать йодноватую кислоту или пятиокись йода.
При использовании солей щелочных металлов йодноватой кислоты в электролит совместно с йодат-анионами вводятся катионы щелочных металлов (натрия или калия), удалить которые трудно.
Применение солей щелочноземельных металлов (кальция или бария) йодноватой кислоты приводит к образованию дополнительных отходов - сульфата кальция или бария.
При извлечении катионов трехвалентного железа из электролита хромирования с помощью твердой йодноватой кислоты или ее водных растворов остаточная концентрация катионов примеси в электролите хромирования (после отделения осадка малорастворимого йодата трехвалентного железа и пересчета концентрации катионов трехвалентного железа и хромового ангидрида в фильтрате на концентрацию хромового ангидрида, соответствующую электролиту хромирования, содержащему 250 г/л CrO3) проходит через минимум.
Это связано с тем, что в концентратах электролита хромирования и в электролите хромирования образуются относительно сильные полихромовые кислоты, константа диссоциации которых становится сопоставимой с константой диссоциации йодноватой кислоты. В этом случае реакция осаждения примеси катионов начинает протекать в обратную сторону.
При использовании для удаления примеси катионов раствора йодноватой кислоты, особенно, разбавленного раствора, происходит разбавление электролита хромирования и, соответственно, деполимеризация полихромовых кислот с образованием менее сильных полихромовых кислот и снижение общей концентрации (активности) катионов водорода. В этом случае процесс осаждения примеси катионов происходит полнее и остаточная концентрация примеси катионов (с учетом последующего пересчета концентрации компонентов в очищенном фильтрате до концентрации, соответствующей концентрации хромового ангидрида в электролите хромирования, равной 250 г/л CrO3) будет меньше.
Дальнейшее значительное увеличение степени разбавления электролита хромирования при удалении примеси катионов при использовании раствора йодноватой кислоты приведет к ухудшению степени очистки, т.е. к увеличению остаточной концентрации примеси катионов (с учетом последующего пересчета концентрации компонентов в очищенном фильтрате до концентрации, соответствующей концентрации хромового ангидрида в электролите хромирования, равной 250 г/л CrO3). Это связано с заметной растворимостью йодата трехвалентного железа.
Значительное разбавление электролита хромирования для удаления примеси катионов трехвалентного железа нежелательно, так как в этом случае потребуется большой расход электроэнергии для последующего концентрирования очищенного фильтрата до концентрации по хромовому ангидриду, соответствующей электролиту хромирования, содержащему 250 г/л CrO3.
Для экономии количества йодноватой кислоты, используемой за один раз для удаления катионов трехвалентного железа из электролита хромирования, содержащего 250 г/л CrO3, йодноватую кислоту можно взять в недостатке против стехиометрического количества, указанного согласно уравнению (2). В этом случае необходимо регенерировать йодноватую кислоту из осадка йодата трехвалентного железа и использовать ее повторно для дальнейшей очистки этой же порции электролита хромирования.
Для увеличения степени очистки (снижения остаточной концентрации примеси катионов трехвалентного железа) можно сместить равновесие реакции (2) в сторону образования йодата трехвалентного железа, для чего взять йодноватую кислоту в избытке против стехиометрического количества, указанного в уравнении (2).
Предлагаемое мольное соотношение Fe3+:HIO3=1:(0,3÷6). Рекомендуемый вариант - использование стехиометрического количества йодноватой кислоты, согласно уравнению (2), т.е. мольное соотношение Fe3+:HIO3=1:3.
Вместо йодноватой кислоты можно использовать ангидрид йодноватой кислоты - пятиокись йода, I2O5. При растворении в воде I2O5 образуется йодноватая кислота, HIO3:

Йодноватая кислота (другое название йодатная кислота [3]), HIO3, и пятиокись йода, I2O5, очень хорошо растворимы в воде. Растворимость HIO3 составляет 236,7 (при 0°С) и 360,8 (при 80°С) г/100 г Н2О. Растворимость I2O5 составляет 187 (при 12°С) г/100 г Н2О [3].
Оба указанных вещества могут быть использованы как в твердом виде, так и в виде водных растворов различных концентраций (от 1,0 г/л до насыщенного раствора, приготовленного при температуре от 0 до 100°С) для удаления катионов трехвалентного железа из электролита хромирования на основе соединений Cr(VI).
При удалении примеси катионов трехвалентного железа из электролита хромирования на основе соединений шестивалентного хрома с помощью растворов йодноватой кислоты рекомендуется осуществить следующий температурный цикл при периодическом перемешивании электролита: выдержка обрабатываемого электролита при повышенной (60-100°С) температуре (от 1 часа до 3 дней, желательно сутки), далее выдержка при комнатной температуре (от 1 часа до 3 дней, желательно сутки), далее желательна выдержка при пониженной температуре (-5÷5°С) (от 1 часа до 3 дней, рекомендуется сутки). Количество полных температурных циклов должно быть от 1 до 10.
Нагревание снижает пересыщение раствора по малорастворимому йодату трехвалентного железа, однако снижает и вязкость электролита, что способствует росту крупных кристаллов, которые легко можно отделить декантацией или фильтрованием.
Нагревание электролита с осадком малорастворимого йодата трехвалентного железа вызывает "старение" осадка, образование крупных кристаллов и снижение его ПР, и, соответственно, растворимости.
Охлаждение электролита с осадком, после длительного прогрева до комнатной или ниже температуры, приводит к росту пересыщения, что необходимо для образования зародышей кристаллов и роста имеющихся маленьких кристаллов. Увеличение вязкости раствора, препятствующей росту кристаллов, в этом случае будет небольшим, так как к этому моменту большая часть йодата трехвалентного железа уже выпадет в осадок.
Периодическая многочасовая тепловая обработка электролита с выдержкой при комнатной или ниже (-5°С) температуре способствует быстрому достижению равновесия при распределении йодата трехвалентного железа между жидкой фазой (обрабатываемый электролит) и твердой фазой (осадок малорастворимого йодата трехвалентного железа).
Как было сказано выше, твердая йодноватая кислота, твердая пятиокись йода или их водные растворы в широком диапазоне концентраций могут быть использованы для очистки от примеси катионов трехвалентного железа как концентратов электролита хромирования на основе соединений шестивалентного хрома, так и разбавленных электролитов хромирования на основе соединений шестивалентного хрома.
Диапазон рекомендуемого разбавления (или концентрирования) относительно исходного электролита хромирования, содержащего 250 г/л CrO3, после введения твердой йодноватой кислоты, твердой пятиокиси йода или их водных растворов, составляет от 0,25 (концентрирование в 4 раза, 1000 г/л CrO3) до 5 раз (разбавление в 5 раз, 50 г/л CrO3).
Пример 1
В плотно закрывающиеся колбы с одинаковыми пробами электролита хромирования, состава, в г/л: CrO3 251,6+H2SO4 2,48+Fe3+ 19,1 добавлялось стехиометрическое (согласно уравнению (2)) количество концентрированного водного раствора йодноватой кислоты (полученного путем растворения соответствующего (согласно уравнению (3)) стехиометрического количества пятиокиси йода в минимальном количестве воды) и далее добавляется вода, так что суммарный объем полученных растворов увеличился в: 1,15; 2; 3,4 и 5 раз по сравнению с исходным объемом проб электролита. После этого полученные пробы растворов в колбах были герметично закрыты пробкой, перемешаны и выдержаны на водяной бане в общей сложности сутки при температуре 60-80°С. Периодически содержимое колб перемешивалось, охлаждалось до комнатной температуре, а также до температуры -5°С, после чего снова нагревалось на водяной бане. После завершения нагревания пробы выдерживались сутки при комнатной температуре. Для анализа отбиралась осветленная проба раствора над осадком, и она дополнительно профильтровывалась через стеклянный фильтр с мелкими порами. Анализ фильтратов на Fe3+ показал, что в пробах содержится Fe3+, в г/л, соответственно: 3,16; 1,30; 0,744; 0,545 и 0,502. Пересчет концентрации Fe3+ на концентрацию, соответствующую стандартному электролиту хромирования (250 г/л CrO3), дает следующие значения концентрации
Fe3+, в г/л, соответственно: 3,61; 2,58; 2,22; 2,17 и 2,49.
Пример 2
Две одинаковые пробы электролита хромирования, состава, в г/л: CrO3 251,6+H2SO4 2,48+Fe3+ 19,1 упариваются в 3 и в 2 раза соответственно. После охлаждения до комнатной температуры к обеим пробам добавляется стехиометрическое (согласно уравнению (2)) количество концентрированного водного раствора йодноватой кислоты (полученного путем растворения соответствующего (согласно уравнению (3)) стехиометрического количества пятиокиси йода в минимальном количестве воды) и далее добавляется вода, так что суммарный объем полученных проб изменился, соответственно, в 0,5 и 1 раз по сравнению с исходным объемом пробы электролита. После этого полученные пробы растворов в колбах были герметично закрыты и выдержаны на водяной бане в общей сложности сутки при температуре 60-80°С. Периодически содержимое колб перемешивалось, охлаждалось до комнатной температуре, а также до температуры -5°С, после чего снова нагревалось на водяной бане. После завершения нагревания пробы выдерживались сутки при комнатной температуре. Отбиралась осветленная проба раствора над осадком и дополнительно профильтровывалась через фильтр из пористого стекла. Анализ фильтратов на Fe3+ показал, что в пробах содержится Fe3+ в г/л, соответственно: 8,93; и 3,91. Пересчет концентрации Fe3+ на концентрацию, соответствующую стандартному электролиту хромирования (250 г/л CrO3), дает следующие значения концентрации Fe3+, в г/л, соответственно: 4,44 и 3,89.
После отделения осадка йодата трехвалентного железа электролит хромирования содержит остаточное количество йодноватой кислоты, которая удаляется электрохимической проработкой электролита (электролизом) или добавлением соответствующего количества гидроксида бария.
Для регенерации йодноватой кислоты осадок йодата трехвалентного железа, Fe(IO3)3, нагревают, пары йода конденсируют на холодной поверхности в виде кристаллов:

Твердый йод смешивают с крепкой азотной кислотой и нагревают [5]:
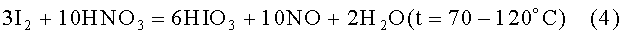
После обесцвечивания раствора жидкость полностью испаряют, а получившиеся кристаллы йодноватой кислоты нагревают до 240°С, при этом следы азотной кислоты, вредной для электролита хромирования, полностью удаляются, и образуется пятиокись йода, которая удобна для хранения, взвешивания и быстрого приготовления растворов йодноватой кислоты в широком диапазоне концентраций.
Источники информации
1. Добрыднев С. В., Ларьков А. П. Способ регенерации сульфатного электролита хромирования. Патент №2175691. Заявлено 23.01.2001, опубликовано 10.11.2001.
2. Добрыднев С. В., Ларьков А. П. Способ регенерации сульфатного электролита хромирования. Патент №2197568. Заявлено 24.07.2001, опубликовано 27.01.2003.
3. Краткий справочник по химии. Под редакцией академика АН УССР А.Т.Пилипенко. Киев, Наукова думка, 1987, с.829.
4. http://www.ponics.ru/2009/03/solutable (дата просмотра 01.02.2012).
5. Руководство по неорганическому синтезу. Под ред. Брауэра Г. Т.2, М. 1985, с.361-362.
Изобретение относится к гальваническому производству, а именно к способу восстановления работоспособности электролита хромирования на основе соединений шестивалентного хрома, загрязненного вредной примесью - катионами трехвалентного железа. Способ включает удаление катионов трехвалентного железа путем добавления твердой йодноватой кислоты или твердого ангидрида йодноватой кислоты или их водных растворов с концентрацией от 1,0 г/л до насыщения, полученных при температуре от 0°С до 100°С, при этом процесс проводят при мольном соотношении Fe3+: HIO=1:(0,3÷6) с осаждением йодата трехвалентного железа. Технический результат: продление срока службы электролита и предотвращение залпового сброса электролита на очистные сооружения. 3 з.п. ф-лы, 2 пр.
1. Способ очистки электролита хромирования на основе соединений шестивалентного хрома от примеси катионов трехвалентного железа, отличающийся тем, что удаляют катионы трехвалентного железа путем добавления твердой йодноватой кислоты или твердого ангидрида йодноватой кислоты или их водных растворов с концентрацией от 1,0 г/л до насыщения, полученных при температуре от 0°С до 100°С, при этом процесс проводят при мольном соотношении Fe3+:HIO3=1:(0,3÷6) с осаждением йодата трехвалентного железа.
2. Способ по п.1, отличающийся тем, что процесс осаждения йодата трехвалентного железа проводят при периодическом перемешивании электролита при следующем температурном цикле: выдержка обрабатываемого электролита при повышенной температуре 60-100°С от 1 ч до 3 дней, далее выдержка при комнатной температуре от 1 ч до 3 дней, далее выдержка при пониженной температуре - 5÷5°С от 1 ч до 3 дней.
3. Способ по п.2, отличающийся тем, что количество температурных циклов составляет от 1 до 10.
4. Способ по п.1, отличающийся тем, что диапазон разбавления относительно исходного электролита хромирования, содержащего 250 г/л CrO3, после введения твердой йодноватой кислоты, твердого ангидрида йодноватой кислоты или их водных растворов составляет от 0,25 до 5 раз.
| СПОСОБ ОЧИСТКИ ЭЛЕКТРОЛИТА ХРОМИРОВАНИЯ ОТ ПРИМЕСЕЙ КАТИОНОВ ЖЕЛЕЗА И МЕДИ (ВАРИАНТЫ) | 2009 |
|
RU2433212C2 |
| СПОСОБ РЕГЕНЕРАЦИИ СУЛЬФАТНОГО ЭЛЕКТРОЛИТА ХРОМИРОВАНИЯ | 2001 |
|
RU2197568C1 |
| Способ регенерации отработанных электролитов хромирования | 1990 |
|
SU1801990A1 |
| WO 9727349 A1, 31.07.1997 | |||
| US 6207033 B1, 27.03.2001. | |||
Авторы
Даты
2013-06-10—Публикация
2012-02-27—Подача