Настоящее изобретение касается трансдермальной терапевтической системы для обезболивающего лечения с заметно повышенным усвоением действующего вещества, содержащей, по меньшей мере, одну всасываемую карбоновую кислоту, которая определяет растворимость бупренорфина в матричном слое.
Активное вещество бупренорфин [17-(циклопропилметил)-α-(1,1-диметилэтил)-4,5-эпокси-18,19-дигидро-3-гидрокси-6-метокси-α-метил-6,14-этеноморфинан-7-метанол] представляет собой частично синтетический опиат, преимуществом которого является его более высокая эффективность по сравнению с другими соединениями этого класса веществ. Это означает, что обезболивание при раке - или у онкологических больных с неблагоприятным диагнозом в финальной стадии - может быть достигнуто с помощью суточных доз около 1 мг. При этом бупренорфин, по сравнению с синтетическим опиатом фентанилом и его аналогами, отличается тем, что его наркотический потенциал менее значителен, чем у этих соединений. Недостатком бупренорфина является то обстоятельство, что из-за своего высокого молекулярного веса, а именно 467,64 дальтон, - он только с трудом может всасываться трансдермально.
Несмотря на это в продаже уже имеются трансдермальные системы, содержащие бупренорфин (например, Transtec® или Norspan®). В немецком патенте DE 3939376 С1 описан их принцип действия. Активное вещество растворяют в полиакрилатной матрице с образованием гомогенного раствора, причем агентом, усиливающим проникающую способность и содействующим растворимости, служит карбоновая кислота.
Системы, в которых активное вещество присутствует в виде гомогенного раствора, обычно отличаются низкой степенью усвоения действующего вещества. Причиной является то, что выделение действующего вещества, определяющее термодинамическую активность, уменьшается в процессе аппликации с понижением содержания действующего вещества. Равномерного выделения действующего вещества в продолжение всего процесса аппликации можно достичь только с помощью относительно высокого, по сравнению с выделяющимся количеством, содержанием действующего вещества. Данные, относящиеся, например, к продаваемому в Европе продукту Transtec® 35, позволяют заключить, что усвоение действующего вещества на протяжении всего времени применения составляет только 17%. Поскольку бупренорфин является дорогим препаратом, его повышенная усвояемость была бы существенным преимуществом с точки зрения высокой стоимости. Кроме того, возможность более низкого содержания в системе бупренорфина, относящегося к наркотическим средствам, и вытекающая из этого возможность более низкого остаточного содержания его в использованных системах после применения, крайне желательны с точки зрения безопасности.
Задача настоящего изобретения поэтому состояла в том, чтобы для всегда с трудом всасывающегося трансдермально бупренорфина разработать ТТС, которая делает доступным его трансдермальное применение с заметно повышенным усвоением активного вещества.
Эта задача удивительным образом решается согласно изобретению с помощью трансдермальной терапевтической системы для введения бупренорфина в кожу, причем ТТС включает непроницаемый для активного вещества внешний слой, по меньшей мере, один самоклеящийся матричный слой, содержащий активное вещество бупренорфин и, по меньшей мере, одну карбоновую кислоту, и при необходимости защитный слой, удаляемый перед употреблением. Матричный слой синтезирован на основе полисилоксанов или полиизобутилена. Бупренорфин растворяют в карбоновой кислоте или кислотах, и этот раствор в виде капель диспергируют в матричном слое. Это тем более удивительно, поскольку бупренорфин из-за своих известных физико-химических свойств, в частности плохой растворимости, сравнительно высокой точки плавления 216°С и уже упомянутого высокого молекулярного веса, склонен легко кристаллизоваться. По этой причине используют растворитель, содержащий, по меньшей мере, одну кислотную группу, чтобы предотвратить кристаллизацию бупренорфина при хранении лекарственной формы. Как сам бупренорфин, так и карбоновые кислоты чрезвычайно плохо растворимы в полисилоксанах или полиизобутилене. Благодаря этому возможно растворять бупренорфин в карбоновой кислоте и этот раствор в виде капель диспергировать в матричном слое, изготовленном на основе полисилоксанов, предпочтительно устойчивых к аминам диметилполисилоксанов, особенно предпочтительно - смеси устойчивого и неустойчивого к аминам диметилполисилоксанов, в которой содержание последнего составляет не более 40 мас.%, предпочтительно от 2 до 20 мас.%; можно также использовать матричный слой на основе полиизобутилена. Важно при этом, чтобы смесь бупренорфина и карбоновой кислоты или кислот присутствовала в виде жидкости.
Удивительным образом используемые карбоновые кислоты малорастворимы в органических растворителях клеевого состава. Поэтому жидкую смесь бупренорфина и карбоновой кислоты диспергируют в растворе клея, причем дисперсия сохраняется после удаления растворителя. Растворимость бупренорфина в таком матричном слое практически зависит только от количества карбоновой кислоты или кислот. Количество диспергированного раствора может составлять до 40 мас.%, причем предпочтительно - не превышать 20 мас.%. Размер самих капель преимущественно не должен превышать 50 мкм. Кроме того, предпочтительный размер зависит от толщины матричного слоя.
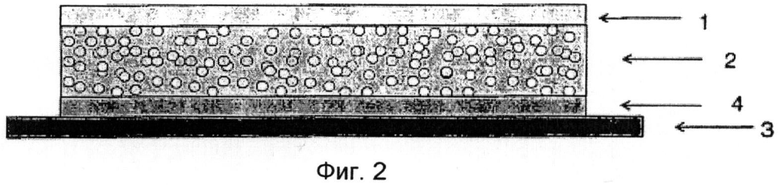
Фиг.1 показывает схематическое изображение такой однослойной самоклеящейся системы. На фиг.2 представлена система, содержащая контактирующий с кожей слой, фиг.3 показывает многослойную систему с наружным пластырем. Обозначения на чертежах:
1) внешний слой,
2) матричный слой на основе полисилоксанов с диспергированными капельками раствора бупренорфин-карбоновая кислота,
3) удаляемый перед употреблением защитный слой,
4) контактирующий с кожей слой на основе полиакрилатного клеевого материала,
5) самоклеящийся слой без бупренорфина,
6) внешний слой (например, телесного цвета).
Поскольку карбоновые кислоты также могут всасываться через кожу, то в процессе аппликации уменьшается их количество в системе и тем самым - также и насыщающая растворимость бупренорфина. Благодаря этому компенсируется уменьшение термодинамической активности бупренорфина, обусловленное его выделением. Выбор карбоновой кислоты определяется по всасыванию ее через кожу, которое, если сравнивать с бупренорфином, происходит точно так же быстро, предпочтительно еще быстрее. Предпочтительно применяют карбоновые кислоты, жидкие при температуре кожи. Карбоновую кислоту или кислоты выбирают из группы, состоящей из масляной, левулиновой, линолевой и линоленовой кислот. При надлежащем исполнении удается во время аппликации достигнуть состояния перенасыщения. В перенасыщенных системах термодинамическая активность действующего вещества и тем самым - также скорость проникновения на единицу поверхности увеличивается в соответствии с коэффициентом перенасыщения. Благодаря этому можно выгодным образом минимизировать выделяющую поверхность, а также поверхность всей системы. Во время хранения как бупренорфин, так и кислоты остаются в полимерной матрице, так что в течение этого времени система является максимально насыщенной, а выделение активного вещества в виде кристаллов исключено.
Другой аспект изобретения касается такого эффекта, что повышение термодинамической активности в таких системах при слишком быстром выделении кислоты может привести к тому, что скорость проникновения после аппликации повышается слишком сильно. Вследствие этого ТТС из-за слишком быстрого выделения активного вещества преждевременно истощается. Теперь было обнаружено, что такой эффект предотвращают добавлением дополнительного слоя на основе полиакрилатов. Предпочтительно этот слой находится между полимерным матричным слоем, содержащим активное вещество, и кожей или между матричным и внешним слоями. Предпочтительно этот дополнительный слой исполняют как самоклеящийся слой, контактирующий с кожей.
Растворимость бупренорфина в полиакрилатах заметно выше, чем в полисилоксанах или полиизобутилене, и в зависимости от конкретного состава достигает примерно 10 мас.%. Поскольку благодаря этому вся система имеет повышенную растворимость насыщения для бупренорфина, степень перенасыщения, обусловленная выделением кислоты, понижается из-за перераспределения бупренорфина из матричного в полиакрилатный слой. Вследствие этого выделение активного вещества происходит более равномерно, и предупреждается преждевременное истощение ресурсов системы. Оказалось, что в предпочтительной форме исполнения при содержании бупренорфина в матричном слое в количестве примерно 0,4 мг и использовании в качестве карбоновой кислоты - левулиновой, на см2 контактирующего с кожей слоя с плотностью покрытия 15-30 г/м2 является достаточно для достижения желательного эффекта.
В отношении мономеров, применяемых для получения полиакрилатного клеящего материала, существенных ограничений не имеется. Правда, из теоретических соображений предпочтительными являются клеи, не содержащие свободных карбоксильных групп, так как они не могут иммобилизовать основание бупренорфин за счет солеобразования.
Фиг.2 показывает схематическое изображение такой системы; ее получение описано в примере 1. Толщину матричного и контактирующего с кожей слоев следует соответственно оптимизировать в зависимости от избранной концентрации активного вещества в матричном слое или количества его на единицу поверхности. Количество или концентрация кислоты в матричном слое зависит от ее растворяющей способности по отношению к бупренорфину. В случае предпочтительного применения левулиновой кислоты бупренорфин и кислоту используют в равном массовом соотношении. Удобными оказались выбранные концентрации обоих веществ от 7 до 9 мас.%, однако может быть выбрано и другое значение, если при выборе плотности покрытия учитывать, соответственно, отсутствие воздействия на производительность ТТС.
Трансдермальные терапевтические системы согласно Примеру 1 в фармакокинетических испытаниях на людях сравнивали с уже имеющимися в продаже ТТС в качестве контрольных. Оказалось, что система согласно Примеру 1 размером 17 см2, с содержанием бупренорфина 6,3 мг соответствует контрольной системе размером 25 см2, с содержанием бупренорфина 20 мг. Принимая во внимание заявленное выделение из ТТС контрольного препарата в количестве 35 мг/час, таким образом для контрольной системы получается использование активного вещества на 17%, а для системы согласно Примеру 1 - 53%. Это ясно показывает, что с помощью трансдермальных систем согласно Примеру 1 была достигнута цель существенно улучшенного усвоения активного вещества. Таким образом, с помощью ТТС согласно изобретению с бупренорфином в качестве активного вещества можно достигнуть на живом объекте усвоения его, по меньшей мере, на 30%, предпочтительно, по меньшей мере, на 40%, особенно предпочтительно - по меньшей мере, на 50%. К тому же выявляется преимущество, что из-за повышенной скорости проникновения эти системы можно использовать с площадью поверхности примерно на 30% меньше, чем у контрольной системы.
Особое преимущество состоит в том, что благодаря повышению использования активного вещества можно далее снижать содержание в системе бупренорфина, который относится к наркотическим средствам, и тем самым минимизировать остаточное содержание бупренорфина в применяемой системе после использования.
Трансдермальные терапевтические системы согласно изобретению можно изготавливать с различной спецификой выделения и с различной степенью дозирования. Как уже описано выше, можно, например, с помощью соответствующих изменений толщины матричного слоя, содержащего активное вещество, и/или контактирующего с кожей слоя, или изменением концентрации активного вещества в матрице, повлиять на специфику выделения активного вещества. Благодаря этому степень дозирования ТТС согласно изобретению можно подбирать таким образом, что для достижения различной дозировки, при одинаковых составах композиции и толщине матричного слоя и контактного с кожей слоя, варьируется площадь поверхности матрицы, содержащей активное вещество. Преимущественно таким образом можно получать трансдермальные терапевтические системы, проявляющие свойства, сравнимые с теми, которые имеют уже находящиеся на рынке трансдермальные терапевтические системы.
Благодаря изготовлению ТТС с различной величиной дозы возможно индивидуально устанавливать для пациента необходимое ему количество активного вещества. Кроме того, возможно так наладить дозирование активного вещества пациенту, чтобы он мог с помощью соответствующей схемы дозирования принципиально известным способом определять необходимое ему количество активного вещества. При этом, например, поступающее к пациенту количество активного вещества увеличивается путем последовательного использования трансдермальных терапевтических систем с различной степенью дозирования. Благодаря последовательному повышению дозы активного вещества можно снизить известные побочные действия бупренорфина, которые могут проявиться при его применении. Примеры последовательного подбора дозирования активного вещества пациенту с помощью соответствующей схемы дозирования описаны, например, в международной заявке на патент WO 2006/030030 A2 и европейской заявке на патент EP 1572167. Тем самым настоящее изобретение включает также системы, например, комплекты, которые содержат несколько ТТС согласно изобретению с различной степенью дозирования.
Трансдермальные терапевтические системы согласно изобретению могут быть исполнены таким образом, чтобы они давали возможность разделения ТТС на различные части (сегменты). Благодаря такой делимости делается возможным также лучший подбор ТТС по индивидуальным требованиям пациента в отношении активного вещества или применение ТТС для исполнения соответствующей схемы дозирования. При этом в разделяемой системе существует множество участков полимерной матрицы, которые разделены в пространстве областями, не содержащими активного вещества. Тогда разделение ТТС может происходить вдоль этих областей, например, разрезанием, таким образом, что один или несколько сегментов полимерной матрицы отделяют от остальной ТТС. Примеры создания делимых вариантов ТТС описаны, например, в международных заявках на патент WO 2003/079962 A2 и WO 02/41878 A2.
Трансдермальные терапевтические системы согласно изобретению можно использовать или подбирать для различной продолжительности применения. ТТС согласно изобретению можно, например, накладывать, по меньшей мере, на 12 или 24 часа, соответственно. Преимущественно, однако, отдельные ТТС согласно изобретению можно применять также на протяжении времени аппликации, по меньшей мере, 72, 84 или 96 час, соответственно. Возможны, однако, и более продолжительные аппликации, например, 120, 144 или 168 час.
Нижеследующие примеры подробнее поясняют изобретение, не ограничивая, однако, его объема.
Пример 1
A. В емкости из нержавеющей стали суспендируют 3,65 кг бупренорфина в 3,65 кг левулиновой кислоты и 2,6 кг этанола. При перемешивании добавляют 60,6 кг полисилоксанового клеевого материала в виде раствора в н-гептане с содержанием твердого вещества 74 мас.%, а также 9,72 кг гептана. Смесь перемешивают до полного растворения бупренорфин-основания и получают 80,22 кг клеевого раствора, содержащего 4,55% бупренорфина, при содержании твердого вещества 64,8% (клеевой раствор 1).
B. Для слоя, контактирующего с кожей, используется полиакрилатный клеевой материал, приготовленный из 2-этилгексилакрилата, винил-ацетата и 2-гидроксиэтилакрилата. К 31,87 кг раствора этого клея с содержанием твердого вещества 51 мас.% прибавляют 6,5 кг этил-ацетата и 1,91 кг масляной кислоты, индивидуально или в смеси с другими карбоновыми кислотами, и после гомогенизации получают около 40 кг раствора полиакрилата, не содержащего активного агента (клеевой раствор 2).
C. С помощью известных в технике средств пленку, подготовленную для адгезии с выбранным клеем, покрывают клеевым раствором 1, содержащим бупренорфин. Толщину покрытия выбирают таким образом, чтобы после удаления растворителя плотность покрытия матричного слоя составлял 55 г/м2. Концентрации бупренорфина и левулиновой кислоты в этом слое составляют от 7 до 9 мас.%. На "высушенный" матричный слой затем наносят внешний слой будущей системы. Клеевой раствор 2 также наносят на подготовленную для адгезии пленку (будущую защитную пленку, удаляемую перед употреблением системы) и удаляют органические растворители. Толщина покрытия полученного слоя, контактирующего с кожей, после удаления растворителей составляет около 20 г/м2. С полученного вначале матричного слоя теперь удаляют липкую пленку и наклеивают его на слой, контактный с кожей. Из полученного в результате целостного многослойного материала можно теперь штамповать отдельные системы.
В специальных формах исполнения ТТС, как описано выше, можно снабжать внешним пластырем по всей поверхности, предпочтительно с закругленными углами, включающим самоклеящийся матричный слой, не содержащий активного вещества, с его внешним слоем, предпочтительно телесного цвета. Это удобно в том случае, если сам контактный с кожей слой из-за своих физических свойств недостаточно хорошо прилипает к коже и/или если матричный слой, содержащий бупренорфин, во избежание отлипания имеет четкие углы (например, квадратные или прямоугольные формы).
Примеры 2-5
Получение производят аналогично Примеру 1, только величины концентрации и толщины матричного слоя варьируются согласно Таблице 1.
Пример 6
В качестве Примера 6 использовали товарный продукт Transtec® Grünenthal GmbH.
С этими ТТС проводили опыты в лабораторных условиях с помощью известных в технике диффузионных ячеек системы Франца, используя эпидермис полнослойной кожи человека. Для этого из многослойных материалов штамповали образцы (кусочки) площадью 2,54 см2 и проводили сравнительные испытания с образцами товарного продукта Transtec®. Последний имеется в продаже в трех различных дозировках, которые, однако, пропорциональны площади. Концентрации бупренорфина измеряли в акцепторной среде ячейки Франца (Табл.2). Дополнительно ТТС анализировали на содержание бупренорфина и левулиновой кислоты после эксперимента. Результаты анализа Примера 1 и других Примеров представлены в виде таблиц и графиков.
Если сравнить между собой совокупные степени выделения (Flux-Raten) из Таблицы 2, то оказывается, что все скорости проницаемости ТТС согласно изобретению имеют тот же порядок величины, что и продажный препарат Transtec®. Если ячейки Франца не служат заменой клинических испытаний, а используются для установления отличий между различными рецептурами ТТС, то и результаты, представленные в Таблице 2, можно оценить таким образом, что в лабораторных условиях ТТС согласно Примеру 1 выделяют столько же бупренорфина, что и Transtec®. Как уже описано выше, ТТС согласно Примеру 1 в фармакокинетических испытаниях на людях сравнивали с уже имеющимися в продаже ТТС в качестве контрольных и обнаружили для контрольной системы усвоение активного вещества на 17%, а для системы согласно Примеру 1 - на 53%.
После испытаний на проницаемость каждый Пример ТТС согласно изобретению исследовали на остаточное содержание левулиновой кислоты. Остаточные количества и рассчитанные из них выделенные относительные количества левулиновой кислоты приведены в Таблице 3.
Таблица 3 ясно показывает, что ТТС во время применения, в соответствии с теоретическими основами изобретения, обедняется (работает в режиме обеднения) левулиновой кислотой и тем самым обусловливает поразительно высокую степень использования активного вещества - бупренорфина.


.Настоящее изобретение относится к медицине, а именно к терапии, и касается трансдермальной терапевтической системы для введения активного вещества бупренорфина. Трансдермальная терапевтическая система включает внешний слой, непроницаемый для активного вещества, матричный слой на основе полисилоксанов или полиизобутилена, содержащий активное вещество бупренорфин и, по меньшей мере, одну карбоновую кислоту, и удаляемый перед употреблением защитный слой. Изобретение обеспечивает более полное и равномерное усвоение активного вещества за счет того, что бупренорфин, растворенный в карбоновой кислоте, в виде капель диспергирован в матричном слое, и матричный слой находится в диффузионном взаимодействии с самоклеящимся слоем, контактирующим с кожей. 9 з.п. ф-лы, 3 табл., 3 ил., 6 пр.
1. Трансдермальная терапевтическая система для введения бупренорфина в кожу, включающая внешний слой, непроницаемый для активного вещества, по меньшей мере, один самоклеящийся матричный слой, содержащий активное вещество бупренорфин и, по меньшей мере, одну карбоновую кислоту, и удаляемый перед употреблением защитный слой, отличающаяся тем, что матричный слой создан на основе полисилоксанов или полиизобутилена, бупренорфин растворен в карбоновой кислоте или карбоновых кислотах, и этот раствор в виде капель диспергирован в матричном слое, и матричный слой находится в диффузионном взаимодействии с самоклеящимся слоем на основе полиакрилатов, контактирующим с кожей.
2. Трансдермальная терапевтическая система по п.1, отличающаяся тем, что полисилоксаном является устойчивый к аминам диметилполисилоксан.
3. Трансдермальная терапевтическая система по п.1, отличающаяся тем, что полисилоксан представляет собой смесь устойчивого и не устойчивого к аминам диметилполисилоксана, причем содержание последнего составляет до 40 мас.%.
4. Трансдермальная терапевтическая система по п.1, отличающаяся тем, что карбоновая кислота диффундирует в кожу быстрее, чем активное вещество бупренорфин.
5. Трансдермальная терапевтическая система по п.1, отличающаяся тем, что количество диспергированного раствора составляет до 40 мас.%, предпочтительно до 20 мас.%.
6. Трансдермальная терапевтическая система по п.1, отличающаяся тем, что карбоновая кислота при температуре кожи представляет собой жидкость.
7. Трансдермальная терапевтическая система по п.6, отличающаяся тем, что карбоновой кислотой является левулиновая кислота.
8. Трансдермальная терапевтическая система по п.7, отличающаяся тем, что бупренорфин и левулиновая кислота присутствуют в равном весовом соотношении.
9. Трансдермальная терапевтическая система по п.1, отличающаяся тем, что полиакрилатный клеящий материал не содержит свободных карбоксильных групп.
10. Трансдермальная терапевтическая система по одному из пп.1-9, отличающаяся тем, что усвоение активного вещества в условиях in vivo достигает, по меньшей мере, 30%, предпочтительно, по меньшей мере, 40%, особенно предпочтительно, по меньшей мере, 50%.
| ТРАНСДЕРМАЛЬНАЯ ТЕРАПЕВТИЧЕСКАЯ СИСТЕМА (ТТС), СОДЕРЖАЩАЯ ТОЛТЕРОДИН | 2000 |
|
RU2251413C2 |
| RU 2005132834 A, 20.05.2006 | |||
| US 20010002259 A1, 31.05.2001 | |||
| WO 9836728 A, 27.08.1998 | |||
| WO 2004014336 A, 19.02.2004 | |||
| Трансдермальные терапевтические системы | |||
| Журнал «Качественная клиническая практика, 2001, №1, [найдено 17.11.2011], найдено из Интeрнет: http://medi.ru/doc/991011.ht. | |||
Авторы
Даты
2013-06-20—Публикация
2007-11-07—Подача