ОБЛАСТЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
[0001] Настоящее изобретение относится к трансдермальной терапевтической системе (ТТС) для трансдермального введения азенапина в системную циркуляцию, процессам производства, способу лечения и их применению.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
[0002] Активный агент азенапин (3aRS,12bRS)-рел-5-хлор-2,3,3а,12b-тетрагидро-2-метил-1Н-дибенз[2,3:6,7]оксепино[4,5-с]пиррол) представляет собой атипичное антипсихотическое средство, принадлежащее к группе дибензооксепинопиррола, тетрациклическая структура которого не связана со структурой других антипсихотических средств, таких как оланзапин, кветиапин или клозапин (трициклическая структура), рисперидон, зипразидон или арипипразол (бициклическая структура). Азенапин является антагонистом рецепторов дофамина D2 и серотонина 5-НТ2А с высокой аффинностью к последним, и был разработан компаниями Schering-Plough/Organon для лечения шизофрении и острой мании, связанных с биполярным расстройством.
[0003] В настоящее время азенапин коммерчески доступен в форме сублингвальных таблеток, которые применяют в дозировке 2,5 мг, 5 мг или 10 мг два раза в сутки (2 р/сут), под торговой маркой Сикрест (Swissmedic) и Сафрис (Schermg-Plough).
[0004] Сублингвальный путь введения позволяет избежать пресистемного метаболизма перорального введения, чтобы увеличить биодоступность, которая составляет 35% при сублингвальном приеме и <2% при приеме внутрь. Однако сублингвальное применение связано с горьким или неприятным вкусом, а также с онемением языка/слизистой оболочки полости рта, вызванными местным анестезирующим действием, тошнотой и головными болями. Кроме того, сразу после сублингвального применения нельзя есть, пить и курить в течение 10 мин. Эти неудобства могут привести к снижению соблюдения пациентом режима приема и неправильному введению, например, снижению дозы, пропуску дозы, нерегулярному приему лекарственного средства или полному отказу от назначенного приема азенапина. Кроме того, сублингвальное применение трудно контролировать у пациентов психиатрических лечебниц, и оно может не подходить для детей, пожилых людей и других пациентов с затрудненным глотанием или для тех, кто не может принимать лекарства самостоятельно.
[0005] При применении азенапина наблюдаются побочные эффекты, часто встречающиеся при применении нейролептиков. Очень часто регистрируются сонливость и беспокойство (наблюдаются у ≥10% пациентов). Другие частые побочные эффекты (наблюдаемые у от ≥1% до <10% пациентов) включают увеличение массы тела и повышение аппетита, расстройства нервной системы; такие как дистония, акатизия, дискинезия, паркинсонизм, седативный эффект, головокружение, дисгевзия; желудочно-кишечные расстройства, такие как гипестезия полости рта, тошнота, повышенное слюноотделение; повышение уровня аланинаминотрансферазы (АЛТ), ригидность мышц и повышенная утомляемость (усталость).
[0006] Азенапин метаболизируется в печени, главным образом через CYP1A2 и UGT1A4 (глюкуронидация). Клиническая значимость основных метаболитов у человека - N-десметилазенапина и азенапина N+ глюкуронида остается спорной. По крайней мере, кажется, что метаболиты не будут вносить существенный вклад в терапевтический эффект. Таким образом, обычно желательно уменьшение количества этих метаболитов.
[0007] После сублингвального применения азенапин быстро всасывается, причем пиковые концентрации в плазме крови достигаются в течение 0,5 - 1,5 часа, и при этом (в терапевтических дозах) он проявляет двухкомпартментную модель фармакокинетики с быстрой фазой начального распределения и периодом полувыведения, составляющим несколько часов, за которым следует более длительный конечный период распределения с периодом полувыведения, составляющим около 1 дня или дольше. Таким образом, концентрация в плазме крови демонстрирует определенную степень колебания с пиками через приблизительно 1 час после введения препарата, за которыми следует снижение концентрации, приводящее к минимальному уровню непосредственно перед следующей дозой, даже в равновесном состоянии. Относительно быстрое снижение концентрации также неизбежно приводит к назначению многократных доз в сутки (в настоящее время два раза в сутки), что связано с плохим соблюдением пациентом режима приема, особенно при хронических состояниях.
[0008] Такого колебания можно избежать или, по меньшей мере, снизить путем транс дермального введения азенапина, которое в некоторой степени предотвращает снижение концентрации в плазме между двумя введениями препарата, обеспечивая пролонгированное высвобождение активного вещества. Трансдермальная доставка азенапина изучалась, но оказалось, что пассивная Трансдермальная доставка азенапина и, в частности, постоянное высвобождение в течение длительного периода времени, является сложной задачей. При пассивном транспорте активных агентов из трансдермальной терапевтической системы (ТТС) через кожу используется движущая сила, основанная на градиенте концентрации между концентрацией активного агента в трансдермальной системе и на внешней поверхности кожи и его концентрацией в кровотоке. Такой пассивный транспорт является преимуществом с точки зрения сложности ТТС и удобства введения по сравнению с ТТС, в которых используется активный транспорт, такой как ионофорез или микропорация. На сегодняшний день коммерчески доступные ТТС азенапина отсутствуют.
[0009] Авторы изобретения ранее разработали трансдермальную терапевтическую систему для трансдермального введения азенапина, в которой устранили вышеупомянутые недостатки существующих методов введения азенапина. В частности, была разработана ТТС, которая способна обеспечить скорость проникновения, достаточную для достижения терапевтически эффективной дозы, надлежащей для непрерывного введения азенапина в течение периодов введения до 7 дней, например 3,5 дня, производство которой является легким и рентабельным.
[0010] Однако, с точки зрения стабильности изготовленных ТТС, в частности, в отношении содержания активного вещества и разложения активного вещества как на исходном уровне, так и при хранении, ранее разработанный состав все еще нуждается в улучшении. Таким образом, существует потребность в улучшенных составах ТТС азенапина, которые обеспечивают лучшую стабильность без ухудшения благоприятных скоростей проникновения через кожу.
ЦЕЛИ И СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0011] Целью настоящего изобретения является обеспечение ТТС, преодолевающей вышеупомянутые недостатки текущего введения азенапина.
[0012] Таким образом, целью настоящего изобретения является обеспечение ТТС, в частности ТТС матричного типа, с улучшенной стабильностью, для трансдермального введения азенапина, которая в то же время обеспечивает скорость проникновения, достаточную для достижения терапевтически эффективной дозы, в частности, при непрерывном введении, что обеспечивает терапевтически эффективные количества азенапина на срок до 7 дней в течение периода применения на коже пациента до 7 дней (например, 3, 5 дня).
[0013] Целью настоящего изобретения является обеспечение ТТС, в частности ТТС матричного типа с улучшенной стабильностью для трансдермального введения азенапина, где колебания концентрации азенапина в плазме крови по сравнению с сублингвальным применением снижаются, в частности, в равновесном состоянии.
[0014] Другой целью настоящего изобретения является обеспечение ТТС, в частности ТТС матричного типа с улучшенной стабильностью для трансдермального введения азенапина, которая соответствует потребностям удобного применения с учетом размера и толщины и/или производство которой является легким и рентабельным.
[0015] Эти и другие цели достигаются с помощью настоящего изобретения, которое согласно одному аспекту относится к трансдермальной терапевтической системе для трансдермального введения азенапина, включающей в себя структуру самоклеящегося слоя, содержащего терапевтически эффективное количество азенапина, при этом указанная структура самоклеящегося слоя содержит:
A) защитный слой;
B) азенапин-содержащий матричный слой, состоящий из композиции матричного слоя, которая содержит:
1. азенапин; и
2. полимер, выбранный из акриловых полимеров
3. дополнительный полимер; и
4. α-токоферол в количестве от 0,01 до 2% композиции матричного слоя и аскорбилпальмитат в количестве, составляющем по меньшей мере 0,01% композиции матричного слоя, в качестве стабилизаторов.
[0016] Согласно определенным вариантам осуществления изобретения трансдермальная терапевтическая система по изобретению предназначена для использования в способе лечения, предпочтительно для использования в способе лечения психоза и более предпочтительно для использования в способе лечения одного или более состояний, выбранных из шизофрении, биполярного расстройства, посттравматического стрессового расстройства, большого депрессивного расстройства, психоза на фоне деменции, тревожного возбуждения и маниакального расстройства, в частности, во время применения в течение длительного периода времени.
[0017] Таким образом, согласно определенным вариантам осуществления изобретения трансдермальная терапевтическая система по изобретению предназначена для использования в способе лечения шизофрении и/или биполярного расстройства в течение периода применения, составляющего от приблизительно 24 часов до приблизительно 168 часов или от 1 до 7 дней и, в частности, для использования в способе лечения шизофрении и/или биполярного расстройства в течение периода применения, составляющего приблизительно 24 часа или 1 день, приблизительно 48 часов или 2 дня или приблизительно 84 часа или 3,5 дня.
[0018] Согласно другим вариантам осуществления настоящее изобретение относится к способу лечения и, в частности, к способу лечения психоза и, более предпочтительно, к способу лечения одного или более состояний, выбранных из шизофрении, биполярного расстройства, посттравматического стрессового расстройства, большого депрессивного расстройства, психоза на фоне деменции, тревожного возбуждения и маниакального расстройства, включающему применение трансдермальной терапевтической системы по изобретению на коже пациента в течение длительного периода времени.
[0019] Таким образом, согласно некоторым другим вариантам осуществления изобретение относится к способу лечения шизофрении и/или биполярного расстройства, включающему применение трансдермальной терапевтической системы по изобретению на коже пациента от приблизительно 24 часов до приблизительно 168 часов или от 1 до 7 дней, или в течение приблизительно 24 часов, 48 часов или 84 часов, или 1 дня, 2 дней или 3,5 дня.
[0020] Такие способы применения требуют замены ТТС один раз в день, один раз в два дня, два раза в неделю или один раз в неделю примерно в одно и то же время суток.
[0021] Согласно еще одному конкретному аспекту изобретение относится к процессу производства матричного слоя для применения в трансдермальной терапевтической системе, включающему следующие стадии:
1) объединение в растворителе по меньшей мере таких компонентов, как азенапин, акриловый полимер, дополнительный полимер, α-токоферол и аскорбилпальмитат с получением композиции для покрытия;
2) нанесение композиции для покрытия на защитный слой, или удаляемую защитную подложку, или любую промежуточную подложку; и
3) высушивание нанесенной композиции для покрытия с получением матричного слоя.
[0022] Согласно определенным вариантам осуществления изобретение также относится к трансдермальной терапевтической системе для трансдермального введения азенапина, имеющей структуру самоклеящегося слоя, который содержит:
A) защитный слой;
B) азенапин-содержащий матричный слой, состоящий из композиции матричного слоя, которая содержит:
1. азенапин, включенный в форме свободного основания;
2. сополимер на основе винилацетата, 2-этилгексилакрилата, 2-гидроксиэтилакрилата и глицидилметакрилата или сополимер на основе винилацетата, 2-этилгексилакрилата и 2-гидроксиэтилакрилата;
3. триглицериды со средней длиной цепи в количестве от 5 до 12% композиции матричного слоя;
4. растворимый поливинилпирролидон в количестве от 5 до 15% композиции матричного слоя; и
5. α-токоферол в количестве от 0,025 до 0,1% композиции матричного слоя, аскорбилпальмитат в количестве от 0,15 до 0,5% композиции матричного слоя и метабисульфит натрия в количестве от 0,05 до 0,15% композиции матричного слоя, в качестве стабилизаторов.
[0023] В контексте настоящего изобретения термин «трансдермальная терапевтическая система» (ТТС) относится к системе, с помощью которой активный агент (азенапин) вводится в системную циркуляцию посредством трансдермальной доставки, а также относится ко всему отдельному дозирующему устройству, которое применяется на коже пациента и содержит терапевтически эффективное количество азенапина в структуре самоклеящегося слоя и, необязательно, дополнительное адгезивное покрытие поверх азенапин-содержащей структуры самоклеящегося слоя. Структура самоклеящегося слоя может размещаться на удаляемой защитной подложке (отделяемом защитном слое), таким образом ТТС может дополнительно содержать удаляемую защитную подложку. В контексте настоящего изобретения термин «ТТС» относится, в частности, к системе, обеспечивающей пассивную трансдермальную доставку, исключающую активный транспорт, как в способах, включающих ионофорез или микропорацию.
[0024] В контексте настоящего изобретения термин «азенапин-содержащая структура самоклеящегося слоя» или «структура самоклеящегося слоя, содержащая терапевтически эффективное количество азенапина» относится к структуре, содержащей активный агент, которая при применении обеспечивает некоторую площадь высвобождения азенапина. Адгезивное покрытие увеличивает общий размер ТТС, но не увеличивает площадь высвобождения. Азенапин-содержащая структура самоклеящегося слоя содержит защитный слой и по меньшей мере один азенапин-содержащий слой.
[0025] В контексте настоящего изобретения термин «терапевтически эффективное количество» относится к количеству активного агента в ТТС, достаточному для обеспечения, при применении у пациента ТТС, уровней азенапина в крови в аналогичном диапазоне (например, от приблизительно 10% до приблизительно 1000% по результатам измерения AUC) по сравнению с уровнями в крови, полученными в равновесном состоянии при введении азенапина в дозе 5 мг сублингвально два раза в сутки в течение заранее определенного длительного периода времени (например, 1, 3, 5 и 7 дней). ТТС обычно содержит больше активного вещества в системе, чем фактически поступает в кожу и системную циркуляцию. Это избыточное количество активного агента обычно необходимо для обеспечения достаточной движущей силы для пассивного транспорта из ТТС в системную циркуляцию.
[0026] В контексте настоящего изобретения термины «активное вещество», «активный агент» и т.п., а также термин «азенапин» относятся к азенапину в любой фармацевтически приемлемой химической и морфологической форме и физическом состоянии. Эти формы включают, без ограничений, азенапин в форме свободного основания, протонированный или частично протонированный азенапин, соли азенапина и, в частности, кислотно-аддитивные соли, образованные добавлением неорганической или органической кислоты, такие как гидрохлорид азенапина или малеат азенапина, гидраты, комплексы и т.д., а также азенапин в форме частиц, которые могут быть микронизированными, кристаллическими и/или аморфными, и любые смеси вышеупомянутых форм. Если азенапин содержится в среде, такой как растворитель, он может быть растворен или диспергирован, или частично растворен, а частично диспергирован.
[0027] Когда упоминается, что при производстве ТТС азенапин используется в конкретной форме, это не исключает взаимодействия между этой формой азенапина и другими ингредиентами азенапин-содержащей структуры самоклеящегося слоя, например, образования солей или комплексообразования в готовой ТТС. Это означает, что даже если азенапин включен в форме свободного основания, он может присутствовать в готовой ТТС в протонированной или частично протонированной форме или в форме кислотно-аддитивной соли, или, если он включен в форме соли, ее части могут присутствовать в готовой ТТС в виде свободного основания. В частности, если не указано иное, количество азенапина в структуре самоклеящегося слоя относится к количеству азенапина, включенному в ТТС во время производства ТТС, и рассчитывается на основе азенапина в форме свободного основания. Например, если во время производства в ТТС включено а) 0,1 ммоль (равно 28,6 мг) основания азенапина или b) 0,1 ммоль (равно 40,2 мг) малеата азенапина, то количество азенапина в структуре самоклеящегося слоя находится в пределах значения изобретения и в обоих случаях составляет 0,1 ммоль или 28,6 мг.
[0028] Исходный материал азенапина, включенный в ТТС во время производства ТТС, может быть в форме частиц. Азенапин может, например, присутствовать в структуре самоклеящегося слоя в форме частиц и/или в растворенном виде.
[0029] В контексте настоящего изобретения термин «частицы» относится к твердому материалу в виде частиц, содержащему отдельные частицы, размеры которых незначительны по сравнению с материалом. В частности, частицы являются твердыми, включая пластичные/деформируемые твердые тела, включая аморфные и кристаллические материалы.
[0030] В контексте настоящего изобретения термин «диспергирование» относится к стадии или комбинации стадий, на которых исходный материал (например, азенапин) не растворяется полностью. Диспергирование в контексте изобретения включает растворение части исходного материала (например, частиц азенапина) в зависимости от растворимости исходного материала (например, растворимости азенапина в композиции для покрытия).
[0031] Существует два основных типа ТТС с использованием пассивной доставки активного агента, то есть ТТС матричного типа и ТТС резервуарного типа. В ТТС матричного типа активный агент включен в матрицу, в то время как в ТТС резервуарного типа активный агент включен в жидкий или полужидкий резервуар. Высвобождение активного агента в ТТС матричного типа в основном контролируется матрицей, включающей сам активный агент. В отличие от этого, в ТТС резервуарного типа необходима мембрана, регулирующая скорость и контролирующая высвобождение активного агента. ТТС матричного типа обладают преимуществом, заключающимся в том, что по сравнению с ТТС резервуарного типа в них обычно не требуются мембраны, регулирующие скорость, и при этом не может происходить выброс дозы препарата из-за разрыва мембраны. Таким образом, трансдермальные терапевтические системы (ТТС) матричного типа менее сложны в производстве и просты и удобны при использовании пациентами.
[0032] В контексте настоящего изобретения «ТТС матричного типа» относится к системе или структуре, в которой активное вещество гомогенно растворено и/или диспергировано в полимерном носителе, то есть к матрице, которая вместе с активным агентом и, необязательно, оставшимися ингредиентами образует матричный слой. В такой системе матричный слой контролирует высвобождение активного агента из ТТС. ТТС матричного типа может также содержать мембрану, регулирующую скорость.
[0033] ТТС с мембраной, регулирующей скорость, и резервуаром, содержащим жидкий или полужидкий активный агент, в котором высвобождение активного агента из ТТС контролируется мембраной, регулирующей скорость, называются «ТТС резервуарного типа». В контексте настоящего изобретения следует понимать, что ТТС резервуарного типа отличается от матричного типа. В частности, в контексте настоящего изобретения системы микрорезервуаров (двухфазные системы, имеющие внутреннюю фазу с активным веществом во внешней матричной фазе), которые в данной области техники рассматриваются как смесь ТТС матричного типа и ТТС резервуарного типа, относятся к матричному типу. ТТС матричного типа может, в частности, представлять собой ТТС типа «лекарственное средство в адгезиве», относящуюся к системе, в которой активное вещество гомогенно растворено и/или диспергировано в чувствительной к давлению адгезивной матрице.
[0034] В контексте настоящего изобретения термин «матричный слой» относится к любому слою, содержащему активное вещество, гомогенно растворенное и/или диспергированное в полимерном носителе. Обычно матричный слой присутствует в ТТС матричного типа в виде слоя, содержащего активный агент. ТТС резервуарного типа может содержать, помимо резервуарного слоя и мембраны, регулирующей скорость, дополнительный адгезивный слой, который служит слоем контакта с кожей. В такой ТТС резервуарного типа дополнительный адгезивный слой часто изготавливают как слой, не содержащий активного агента. Однако из-за градиента концентрации активный агент с течением времени будет мигрировать из резервуара в дополнительный адгезивный слой до тех пор, пока не будет достигнуто равновесие. Следовательно, после некоторого времени уравновешивания в такой ТТС резервуарного типа дополнительный адгезивный слой будет содержать активный агент и в смысле настоящего изобретения должен рассматриваться как матричный слой.
[0035] Матричный слой - это последний затвердевший слой, например полученный после нанесения покрытия и высушивания композиции для покрытия, содержащей растворитель. Матричный слой также может быть изготовлен путем наслаивания двух или более таких затвердевших слоев (например, высушенных слоев) с одинаковым составом для обеспечения желаемой массы на единицу площади. Матричный слой может быть самоклеящимся (в форме чувствительной к давлению адгезивной матрицы), или для обеспечения достаточной липкости ТТС он может содержать дополнительный слой контакта с кожей, выполненный из чувствительного к давлению адгезива. В частности, матричный слой представляет собой чувствительную к давлению адгезивную матрицу.
[0036] В контексте настоящего изобретения термин «чувствительный к давлению адгезив» относится к материалу, который, в частности, прилипает при прижимании пальцами, является постоянно липким, проявляет сильное удерживающее усилие и должен удаляться с гладких поверхностей, не оставляя следов. Чувствительный к давлению адгезивный слой при контакте с кожей является «самоклеящимся», то есть обеспечивает адгезию к коже так, что обычно не требуется никакого дополнительного средства для фиксации на коже. Структура «самоклеящегося» слоя включает чувствительный к давлению адгезивный слой для контакта с кожей, который может быть выполнен в форме чувствительной к давлению адгезивной матрицы или в форме дополнительного слоя, то есть чувствительного к давлению адгезивного слоя контакта с кожей. Для улучшения адгезии все еще можно использовать адгезивное покрытие.
[0037] В контексте настоящего изобретения термин «слой контакта с кожей» относится к включенному в ТТС слою, который во время применения находится в прямом контакте с кожей пациента. Когда ТТС содержит слой контакта с кожей, другие слои не контактируют с кожей и не обязательно обладают самоклеящимися свойствами. Как указано выше, слой контакта с кожей со временем может абсорбировать части активного агента, и тогда его можно рассматривать как матричный слой. Площадь высвобождения обеспечивается площадью матричного слоя. Слой контакта с кожей может использоваться для улучшения прикрепления. Размеры дополнительного слоя контакта с кожей и матричного слоя обычно совпадают и соответствуют площади высвобождения.
[0038] В контексте настоящего изобретения термин «масса на единицу площади» относится к сухой массе слоя, например матричного слоя, выраженной в г/м2. Допустимые отклонения значений массы на единицу площади вследствие производственной изменчивости составляют ±10%, предпочтительно ±7,5%.
[0039] Если не указано иное, «%» относится к массовому %.
[0040] В контексте настоящего изобретения термин «полимер» относится к любому веществу, состоящему из так называемых повторяющихся звеньев, полученных путем полимеризации одного или более мономеров, и включает гомополимеры, которые состоят из мономера одного типа, и сополимеры, состоящие из двух или более типов мономеров. Полимеры могут иметь любую структуру, например, представлять собой линейные полимеры, звездообразный полимер, гребенчатые полимеры, щеточные полимеры с любым расположением мономеров в случае сополимеров, например чередующиеся, статистические, блок-сополимеры или привитые полимеры. Минимальная молекулярная масса варьируется в зависимости от типа полимера и известна специалисту в данной области. Например, полимеры могут иметь молекулярную массу выше 2000, предпочтительно выше 5000 и более предпочтительно выше 10 000 дальтон. Соответственно, соединения с молекулярной массой ниже 2000, предпочтительно ниже 5000 или более предпочтительно ниже 10000 дальтон обычно называют олигомерами.
[0041] В контексте данного изобретения термин «функциональные группы» относится к группам гидрокси- и карбоновых кислот.
[0042] В контексте настоящего изобретения термин «сшивающий агент» относится к веществу, которое способно сшивать функциональные группы, содержащиеся в полимере.
[0043] В контексте настоящего изобретения термин «адгезивное покрытие» относится к структуре самоклеящегося слоя, которая не содержит активный агент и имеет большую площадь, чем структура, содержащая активный агент, и при этом обеспечивает дополнительную площадь, прилегающую к коже, но такая площадь не содержит активного агента. Тем самым он улучшает общие адгезионные свойства ТТС. Адгезивное покрытие содержит защитный слой и адгезивный слой.
[0044] В контексте настоящего изобретения термин «защитный слой» относится к слою, который поддерживает, например, азенапин-содержащий слой или образует защитную подложку для адгезивного покрытия. По меньшей мере один защитный слой в ТТС и обычно защитный слой азенапин-содержащего слоя является окклюзионным, то есть по существу непроницаемым для содержащегося в слое активного агента в течение периода хранения и введения и, таким образом, предотвращает потерю активного агента или перекрестное загрязнение в соответствие нормативным требованиям.
[0045] ТТС по настоящему изобретению можно охарактеризовать некоторыми параметрами, измеренными в испытании проникновения через кожу in vitro.
[0046] Испытание проникновения через кожу in vitro проводят в диффузионной ячейке Франца, с кожей человека или животного, и предпочтительно с полученной с использованием дерматома расщепленной до толщины 800 мкм кожей человека с интактным эпидермисом, а также с фосфатным буфером рН 5,5 или 7,4 в качестве рецепторной среды (32°С с 0,1% раствором азида натрия в физиологическом растворе) с добавлением или без добавления не более 40 об. % органического растворителя, например этанола, ацетонитрила, изопропанола, дипропиленгликоля, ПЭГ 400 так, что рецепторная среда может, например, содержать 60 об. % фосфатного буфера с рН 5,5, 30 об. % дипропиленгликоля и 10 об. % ацетонитрила.
[0047] Если не указано иное in vitro испытание проникновения через кожу выполняют с полученной с использованием дерматома расщепленной до толщины 800 мкм кожей человека с интактным эпидермисом и фосфатным буфером рН 5,5 в качестве рецепторной среды (32°С с 0,1% раствором азида натрия в физиологическом растворе). Количество активного вещества, проникающего в рецепторную среду, определяется через регулярные интервалы с использованием валидированного метода ВЭЖХ с УФ-фотометрическим детектором путем отбора объема пробы. При отборе объема пробы рецепторная среда полностью или частично заменяется свежей средой, и измеренное количество проникающего активного вещества относится к количеству, проникшему между двумя последними точками отбора образцов, а не к общему проникшему количеству.
[0048] Таким образом, в контексте настоящего изобретения параметр «проникающее количество» представлен в мкг/см2 и относится к количеству активного вещества, проникшего в образец за определенное истекшее время в интервале отбора проб. Например, в испытании проникновения через кожу in vitro, описанном выше, в котором количество проникшего в рецепторную среду активного вещества измеряли, например в часы 0, 2, 4, 8, 12 и 24, можно, например, указать «проникающее количество» активного вещества для интервала отбора проб от часа 8 до часа 12 и соответствующее измерению в час 12.
[0049] Проникающее количество также может быть представлено как «совокупное проникающее количество», соответствующее совокупному количеству проникшего активного вещества в определенный момент времени. Например, в испытании проникновения через кожу in vitro, описанном выше, в котором количество проникшего в рецепторную среду активного вещества измеряли, например в часы 0, 2, 4, 8, 12 и 24, «совокупное проникающее количество» активного вещества в час 12 соответствует сумме проникающих количеств с часа 0 до часа 2, с часа 2 до часа 4, с часа 4 до часа 8 и с часа 8 до часа 12.
[0050] В контексте настоящего изобретения параметр «скорость проникновения через кожу» для определенного интервала отбора проб за определенное истекшее время указывается в мкг/(см2⋅ч) и рассчитывается как проникающее количество в указанном интервале отбора проб, измеренное в испытании проникновения через кожу in vitro, как описано выше, в мкг/см2, деленное на продолжительность указанного интервала отбора проб в часах. Например, скорость проникновения через кожу в испытании проникновения через кожу in vitro, описанном выше, где количество проникшего активного вещества в рецепторную среду измеряли в часы 0, 2, 4, 8, 12 и 24, «скорость проникновения через кожу» в час 12 рассчитывают как проникающее количество в интервале отбора проб от часа 8 до часа 12, разделенное на 4 часа.
[0051] «Совокупную скорость проникновения через кожу» можно рассчитать из соответствующего совокупного проникающего количества путем деления совокупного проникающего количества на истекшее время. Например, в испытании проникновения через кожу in vitro, описанном выше, в котором количество проникшего в рецепторную среду активного вещества измеряли, например в часы 0, 2, 4, 8, 12 и 24, «совокупную скорость проникновения через кожу» в час 12 рассчитывают как совокупное проникающее количество до часа 12 (см. выше), разделенное на 12 часов.
[0052] В контексте настоящего изобретения описанные выше параметры «проникающее количество» и «скорость проникновения через кожу» (а также «совокупное проникающее количество» и «совокупная скорость проникновения через кожу») относятся к средним значениям, рассчитанным по результатам 3 экспериментальных испытаний проникновения через кожу in vitro.
[0053] ТТС по настоящему изобретению можно охарактеризовать некоторыми параметрами; измеренными в клиническом исследовании in vivo.
[0054] В контексте настоящего изобретения параметр «средняя скорость высвобождения» относится к средней скорости высвобождения, выраженной в мкг/ч, в мг/ч, в мкг/24 ч, в мг/24 ч, в мкг/сут или в мг/сут в течение периода применения (например, от 1 до 7 дней), за который активный агент высвобождается через кожу человека в системную циркуляцию, и основан на значении AUC, полученном за указанный период применения в клиническом исследовании. Средняя скорость высвобождения - это параметр, используемый для определения дозы или эффективности ТТС. Поскольку, например, в отличие от внутривенного или перорального введения и (как также описано выше) ТТС обычно содержит больше активного вещества в системе, чем фактически поступает в кожу и системную циркуляцию, количество активного вещества, содержащегося в ТТС, не является значимым показателем дозы. Вот почему для ТТС доза или сила дозы обычно характеризуется средней скоростью высвобождения, которая более точно описывает количество активного вещества, доставленного субъекту с течением времени.
[0055] В контексте настоящего изобретения термин «длительный период времени» относится к периоду, составляющему по меньшей мере или приблизительно 24 часа, по меньшей мере или приблизительно 48 часов, по меньшей мере или приблизительно 84 часа, по меньшей мере или приблизительно 168 часов, по меньшей мере или приблизительно 1 день, по меньшей мере или приблизительно 3,5 дня или по меньшей мере или приблизительно 7 дней, или к периоду от приблизительно 24 часов до приблизительно 168 часов или от 1 до 7 дней, или приблизительно от 24 часов до приблизительно 84 часов, или от 1 до 3,5 дня.
[0056] Для непрерывного лечения лекарственным средством частоту введения лекарственного средства предпочтительно сохраняют достаточно высокой, чтобы поддерживать терапевтически эффективную концентрацию в плазме крови. Другими словами, интервал между двумя введениями лекарственной формы, также называемый интервалом введения, необходимо подбирать соответствующим образом. В контексте настоящего изобретения термин «интервал введения» относится к периоду времени между двумя последовательными введениями ТТС, то есть к интервалу между двумя последовательными моментами времени применения ТТС на коже пациента. После накладывания ТТС обычно сохраняется на коже пациента в течение всего интервала введения и удаляется только в конце интервала введения, когда на кожу накладывают новую ТТС. Например, если интервал введения составляет 168 часов или 7 дней, ТТС накладывают на кожу пациента и не снимают в течение 168 часов или 7 дней. Через 168 часов или 7 дней ТТС снимают с кожи и накладывают новую ТТС. Таким образом, при интервале введения 168 часов или 7 дней, возможен режим замены ТТС один раз в неделю примерно в одно и то же время суток.
[0057] В контексте настоящего изобретения термин «комнатная температура» относится к неизмененной температуре, обнаруживаемой в помещении в лаборатории, где проводятся эксперименты, и обычно находится в пределах 15 до 35°С, предпочтительно от приблизительно 18 до 25°С.
[0058] В контексте настоящего изобретения термин «пациент» относится к субъекту, у которого проявилось клиническое проявление конкретного симптома или симптомов, предполагающих необходимость лечения, которого лечат превентивно или профилактически от патологического состояния, или у которого диагностировали состояние, подлежащее лечению.
[0059] В контексте настоящего изобретения термин «фармакокинетические параметры» относится к параметрам, описывающим кривую плазмы крови, например Cmax, Ct и AUCt1-t2, полученным в клиническом исследовании, например при однократном, многократном или устойчивом введении активного агента с помощью ТТС, например ТТС азенапина здоровым людям, участвующим в исследовании. Фармакокинетические параметры отдельных субъектов суммируются с использованием арифметических и геометрических средних значений, например среднего значения Cmax, среднего значения AUCt и среднего значения AUCINF, а также с использованием дополнительных статистических показателей, таких как соответствующие стандартные отклонения и стандартные ошибки, минимальное значение, максимальное значение и среднее значение при ранжировании списка значений (медиана). В контексте настоящего изобретения фармакокинетические параметры, например Cmax, Ct и AUCt1-t2 относятся к средним арифметическим или геометрическим значениям и предпочтительно относятся к средним геометрическим значениям. Нельзя исключить, что абсолютные средние значения, полученные для определенного ТТС в клиническом исследовании, могут в определенной степени варьироваться в разных исследованиях. Для возможности сравнения абсолютных средних значений между исследованиями в будущем в качестве внутреннего стандарта может быть использован эталонный состав, например любого препарата по изобретению. Сравнение AUC для каждой единицы площади высвобождения соответствующего эталонного продукта в более раннем и последующем исследовании можно использовать для получения поправочного коэффициента, учитывающего различия между исследованиями.
[0060] Клинические исследования по настоящему изобретению относятся к исследованиям, проведенным в полном соответствии с рекомендациями Международной конференции по гармонизации клинических испытаний (ICH) и всеми применимыми местными требованиями надлежащей клинической практики (НКП) и нормативными требованиями.
[0061] В контексте настоящего изобретения термин «здоровый человек, участвующий в исследовании» относится к участникам мужского и женского пола с массой тела от 55 кг до 100 кг и индексом массы тела (ИМТ) от 18 до 29 и нормальными физиологическими параметрами, такими как артериальное давление и т.п. Здоровые люди, участвующие в исследовании, для целей настоящего изобретения отбираются в соответствии с критериями включения и не включения, которые основаны на рекомендациях ICH.
[0062] В контексте настоящего изобретения термин «выборка субъектов» относится к по меньшей мере десяти здоровым людям, участвующим в исследовании.
[0063] В контексте настоящего изобретения термин «геометрическое среднее значение» относится к среднему значению логарифмически преобразованных данных, которые были преобразованы обратно в исходный масштаб.
[0064] В контексте настоящего изобретения термин «арифметическое среднее значение» относится к сумме значений из всех наблюдений, разделенной на общее количество наблюдений.
[0065] В контексте настоящего изобретения параметр «AUC» соответствует площади под кривой зависимости концентрации в плазме от времени. Значение AUC пропорционально общему количеству активного агента, абсорбированного в кровоток и, следовательно, является показателем биодоступности.
[0066] В контексте настоящего изобретения параметр «AUCt1-t2» указывают в (нг/мл)⋅ч, и он относится к площади под кривой зависимости концентрации в плазме от времени от часа t1 до t2 и рассчитывается методом линейных трапеций.
[0067] В контексте настоящего изобретения параметр «Cmax» указывают в (нг/мл), и он относится к максимальной наблюдаемой концентрации активного агента в плазме крови.
[0068] В контексте настоящего изобретения параметр «Ct» указывают в (нг/мл), и он относится к концентрации активного агента в плазме крови, наблюдаемой в час t.
[0069] В контексте настоящего изобретения параметр «tmax» указывают в ч, и он относится к моменту времени, в которое достигается показатель Cmax. Другими словами, tmax - это момент времени максимальной наблюдаемой концентрации в плазме.
[0070] В контексте настоящего изобретения параметр «tlag» указывают в ч, и он относится к задержке между временем введения (в случае ТТС ко времени, когда ТТС впервые накладывают на кожу, т.е. t = 0) и временем появления измеримой концентрации в плазме крови. Показатель tlag можно рассчитать приблизительно как среднее арифметическое значение первого момента времени, когда получена измеряемая (т.е. ненулевая) концентрация активного агента в плазме крови или когда она представлена медианным значением.
[0071] В контексте настоящего изобретения термин «средняя концентрация в плазме крови» указывают в (нг/мл), и он представляет собой среднее значение отдельных концентраций активного агента, например азенапина, в плазме в каждый момент времени.
[0072] В контексте настоящего изобретения термин «композиция для покрытия» относится к композиции, содержащей все компоненты матричного слоя в растворителе, которую можно нанести на защитный слой или удаляемую защитную подложку с получением после высушивания матричного слоя.
[0073] В контексте настоящего изобретения термин «растворять» относится к процессу получения раствора, который является прозрачным и не содержит никаких частиц, видимых невооруженным глазом.
[0074] В контексте настоящего изобретения термин «растворитель» относится к любому жидкому веществу, которое предпочтительно представляет собой летучую органическую жидкость, такую как метанол, этанол, изопропанол, ацетон, этилацетат, метиленхлорид, гексан, н-гептан, гептаны, толуол и их смеси.
[0075] В контексте настоящего изобретения, если не указано иное, термин «приблизительно» относится к количеству, которое составляет ±10% от раскрытого количества. В некоторых вариантах осуществления термин «приблизительно» относится к количеству, которое составляет ±5% от раскрытого количества. В некоторых вариантах осуществления термин «приблизительно» относится к количеству, которое составляет ±2% от раскрытого количества.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0076] На Фиг. 1a показана скорость проникновения азенапина через кожу из ТТС, полученной в соответствии со справочными примерами 1a-1c, для периода от 0 до 72 часов.
[0077] На Фиг. 1b показано использование азенапина из ТТС, полученной в соответствии со справочными примерами 1а-1с через 72 часа.
[0078] На Фиг. 2а изображена сумма всех родственных веществ (т.е. возможных продуктов разложения), обнаруженных в испытании на стабильность при хранении при 25°С и относительной влажности (OB) 60% в течение периода от 0 до 12 месяцев для ТТС, полученной в соответствии с примером 2а и справочными примерами 2с и 2d.
[0079] На Фиг. 2b изображена сумма всех родственных веществ (т.е. возможных продуктов разложения), обнаруженных в испытании на стабильность при хранении при 40°С и OB 75% в течение периода от 0 до 6 месяцев для ТТС, полученной в соответствии с примером 2а и справочными примерами 2с и 2d.
[0080] На Фиг. 3а изображена сумма всех родственных веществ (т.е. возможных продуктов разложения), обнаруженных в испытании на стабильность при хранении при 25°С и OB 60% в течение периода от 0 до 3 месяцев для ТТС, полученной в соответствии с примером За, и в течение периода от 0 до 2 месяцев для ТТС, полученной в соответствии со справочными примерами 3b и 3 с.
[0081] На Фиг. 3b изображена сумма всех родственных веществ (т.е. возможных продуктов разложения), обнаруженных в испытании на стабильность при хранении при 40°С и OB 75% в течение периода от 0 до 3 месяцев для ТТС, полученной в соответствии с примером 3а, и в течение периода от 0 до 2 месяцев для ТТС, полученной в соответствии со справочными примерами 3b и 3 с.
[0082] На Фиг. 3 с изображена сумма всех родственных веществ (т.е. возможных продуктов разложения), обнаруженных в испытании на стабильность при хранении при 5°С через 4,5 месяца для ТТС, полученной в соответствии с примером 2а, через 4 месяца для ТТС, полученной в соответствии с примером 2b, и через 2 месяца для ТТС, полученной в соответствии с примерами 3d и 3е.
[0083] На Фиг. 4а показана скорость проникновения азенапина через кожу из ТТС, полученной в соответствии с примерами 4а и 4b, а также в соответствии со справочным примером 1 с для периода от 0 до 72 часов.
[0084] На Фиг. 4b показано использование азенапина из ТТС, полученной в соответствии с примерами 4а и 4b, а также в соответствии со справочным примером 1 с через 72 часа.
[0085] На Фиг. 5а изображена сумма всех родственных веществ (т.е. возможных продуктов разложения), обнаруженных в испытании на стабильность при хранении при 40 °С и OB 75% через 2,5 месяца для ТТС, полученной в соответствии со справочными примерами 5а, 5b и 5с.
[0086] На Фиг. 5b изображена сумма всех родственных веществ (т.е. возможных продуктов разложения), обнаруженных в испытании на стабильность при хранении при 25°С и OB 60% через 12 месяцев для ТТС, полученной в соответствии со справочными примерами 5а и 5с.
[0087] На Фиг. 6а изображена сумма всех родственных веществ (т.е. возможных продуктов разложения), обнаруженных в испытании на стабильность при хранении при 40°С и OB 75% через 2,5 месяца для ТТС, полученной в соответствии со справочными примерами 6а, 6b, 6с и 6d.
[0088] На Фиг. 6b изображена сумма всех родственных веществ (т.е. возможных продуктов разложения), обнаруженных в испытании на стабильность при хранении при 25°С и OB 60% через 12 месяцев для ТТС, полученной в соответствии со справочными примерами 6а, 6с и 6d.
[0089] На Фиг. 7а изображена сумма всех родственных веществ (т.е. возможных продуктов разложения), обнаруженных в испытании на стабильность при хранении при 40°С и OB 75% через 2,5 месяца для ТТС, полученной в соответствии со справочными примерами 7а, 7b, 7с и 7d.
[0090] На Фиг. 7b изображена сумма всех родственных веществ (т.е. возможных продуктов разложения), обнаруженных в анализе композиций для покрытий (до нанесения), полученных в соответствии со справочными примерами 6а, 7а, 7b, 7с и 7d.
[0091] На Фиг. 8а изображена сумма всех родственных веществ (т.е. возможных продуктов разложения), обнаруженных в испытании на стабильность при хранении при 40°С и OB 75% через 2,5 месяца для ТТС, полученной в соответствии с примерами 8а, 8b, 8 с, 8d и 8е.
[0092] На Фиг. 8b изображена сумма всех родственных веществ (т.е. возможных продуктов разложения), обнаруженных в испытании на стабильность при хранении при 25°С и OB 60% через 12 месяцев для ТТС, полученной в соответствии с примерами 8а, 8b, 8 с, 8d и 8е.
[0093] На Фиг. 9а изображена сумма всех родственных веществ (т.е. возможных продуктов разложения), обнаруженных в испытании на стабильность при хранении при 25°С и OB 60% в течение периода от 0 до 12 месяцев для ТТС, полученной в соответствии со справочным примером 2d и примерами 9а, 9b и 9 с.
[0094] На Фиг. 9b изображена сумма всех родственных веществ (т.е. возможных продуктов разложения), обнаруженных в испытании на стабильность при хранении при 30°С и OB 75% в течение периода от 0 до 12 месяцев для ТТС, полученной в соответствии с примерами 9а, 9b и 9с.
[0095] На Фиг. 9 с изображена сумма всех родственных веществ (т.е. возможных продуктов разложения), обнаруженных в испытании на стабильность при хранении при 40°С и OB 75% в течение периода от 0 до 6 месяцев для ТТС, полученной в соответствии со справочным примером 2d и примерами 9а, 9b и 9с.
[0096] На Фиг. 9d изображена сумма всех родственных веществ (т.е. возможных продуктов разложения), обнаруженных в испытании на стабильность при хранении при 25°С и OB 60% в течение периода от 0 до 12 месяцев для ТТС, полученной в соответствии со справочным примером 2d и примерами 9а, 9d и 9е.
[0097] На Фиг. 9е изображена сумма всех родственных веществ (т.е. возможных продуктов разложения), обнаруженных в испытании на стабильность при хранении при 30°С и OB 75% в течение периода от 0 до 12 месяцев для ТТС, полученной в соответствии с примерами 9а, 9d и 9е.
[0098] На Фиг. 9f изображена сумма всех родственных веществ (т.е. возможных продуктов разложения), обнаруженных в испытании на стабильность при хранении при 40°С и OB 75% в течение периода от 0 до 6 месяцев для ТТС, полученной в соответствии со справочным примером 2d и примерами 9а, 9d и 9е.
[0099] На Фиг. 10а изображена сумма всех родственных веществ (т.е. возможных продуктов разложения), обнаруженных в испытании на стабильность при хранении при 25°С и OB В 60% в течение периода от 0 до 12 месяцев для ТТС, полученной в соответствии со справочным примером 2d и примерами 9а и 10а, и в течение периода от 0 до 6 месяцев для ТТС, полученной в соответствии с примером 10b.
[0100] На Фиг. 10b изображена сумма всех родственных веществ (т.е. возможных продуктов разложения), обнаруженных в испытании на стабильность при хранении при 30°С и OB 75% в течение периода от 0 до 12 месяцев для ТТС, полученной в соответствии с примерами 9а и 10а, ив течение периода от 0 до 6 месяцев для ТТС, полученной в соответствии с примером 10b.
[0101] На Фиг. 10с изображена сумма всех родственных веществ (т.е. возможных продуктов разложения), обнаруженных в испытании на стабильность при хранении при 40°С и OB 75% в течение периода от 0 до 6 месяцев для ТТС, полученной в соответствии со справочным примером 2d и примерами 9а, 10а и 10b.
[0102] На Фиг. 11а изображена сумма всех родственных веществ (т.е. возможных продуктов разложения), обнаруженных в испытании на стабильность при хранении при 40°С и OB 75% на исходном уровне и через 1 месяц для ТТС, полученной в соответствии с примером На и справочными примерами 11 с и 11d.
[0103] На Фиг. 11b показано количество основания азенапина, обнаруженного в испытании на стабильность при хранении при 40°С и OB 75% на исходном уровне и через 1 месяц для ТТС, полученной в соответствии с примером 11а и справочными примерами 11c и 11d.
[0104] На Фиг. 11 с показана скорость проникновения азенапина через кожу из ТТС, полученной в соответствии с примером 11а и справочными примерами 11с и 11d для периода от 0 до 96 часов.
[0105] На Фиг. 11d показано использование азенапина из ТТС, полученной в соответствии с примером 11a и справочными примерами 11с и 11d через 72 часа.
[0106] На Фиг. 11e-11g показаны изображения ТТС, полученных в соответствии с примером 11a (Фиг. 11е), справочным примером 11с (Фиг. 11f) и справочным примером 11d (Фиг. 11g).
[0107] На Фиг. 12а изображена сумма всех родственных веществ (т.е. возможных продуктов разложения), обнаруженных в испытании на стабильность при хранении при 25°С и OB 60% в течение периода от 0 до 9 месяцев для ТТС, полученной в соответствии со справочным примером 2d, и в течение периода от 0 до 6 месяцев для примеров 12а, 12b и 12с.
[0108] На Фиг. 12b изображена сумма всех родственных веществ (т.е. возможных продуктов разложения), обнаруженных в испытании на стабильность при хранении при 30°С и OB В 75% в течение периода от 0 до 6 месяцев для примеров 12а, 12b и 12 с.
[0109] На Фиг. 12с изображена сумма всех родственных веществ (т.е. возможных продуктов разложения), обнаруженных в испытании на стабильность при хранении при 40°С и OB 75% в течение периода от 0 до 6 месяцев для справочного примера 2d и примеров 12а, 12b и 12с.
[0110] На Фиг. 12d показано количество основания азенапина, обнаруженного в испытании на стабильность при хранении при 25°С и 60% OB на исходном уровне и через 3 месяца для ТТС, полученной в соответствии со справочным примером 2d и примерами 9а, 12а, 12b и 12с, через 6 месяцев для ТТС, полученной в соответствии с примерами 9а, 12а, 12b и 12с, и через 9 месяцев для ТТС, полученной в соответствии со справочным примером 2d и примером 9а.
[0111] На Фиг. 12е показано количество основания азенапина, обнаруженного в испытании на стабильность при хранении при 30°С и 75% OB на исходном уровне, через 3 месяца и 6 месяцев для ТТС, полученной в соответствии с примерами 9а, 12а, 12b и 12с.
[0112] На Фиг. 12f показано количество основания азенапина, обнаруженного в испытании на стабильность при хранении при 40°С и 75% OB на исходном уровне, через 3 месяца и 6 месяцев для ТТС, полученной в соответствии со справочным примером 2d и примерами 9а, 12а, 12b и 12с.
[0113] На Фиг. 13а показана концентрация азенапина в плазме крови (арифметические средние значения со стандартным отклонением в виде планок погрешностей), полученная в клиническом исследовании in vivo для ТТС, полученной в соответствии со справочными примерами 2 с и 2d для периода от 0 до 168 часов.
[0114] На Фиг. 13b показана концентрация азенапина в плазме крови (арифметические средние значения со стандартным отклонением в виде планок погрешностей), определенная в клиническом исследовании in vivo для ТТС, полученной в соответствии со справочными примерами 2с и 2d для периода от 0 до 84 часов.
[0115] На Фиг. 13с показана концентрация азенапина-глюкуронида в плазме крови (геометрические средние значения со средним геометрическим, умноженным на / разделенным на геометрическое стандартное отклонение в виде планок погрешностей), определенная в клиническом исследовании in vivo для ТТС, полученной в соответствии со справочными примерами 2с и 2d для периода от 0 до 168 часов.
[0116] На Фиг. 13d показана концентрация азенапина-глюкуронида в плазме крови (геометрические средние значения со средним геометрическим, умноженным на / разделенным на геометрическое стандартное отклонение в виде планок погрешностей), определенная в клиническом исследовании in vivo для ТТС, полученной в соответствии со справочными примерами 2с и 2d для периода от 0 до 96 часов.
[0117] На Фиг. 13е показана концентрация N-десметил-азенапина в плазме крови (геометрические средние значения со средним геометрическим, умноженным на / разделенным на геометрическое стандартное отклонение в виде планок погрешностей), определенная в клиническом исследовании in vivo для ТТС, полученной в соответствии со справочными примерами 2 с и 2d для периода от 0 до 108 часов.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ СТРУКТУРА ТТС
[0118] Настоящее изобретение относится к трансдермальной терапевтической системе для трансдермального применения азенапина, содержащей структуру самоклеящегося слоя, которая содержит азенапин.
[0119] Структура самоклеящегося слоя включает в себя терапевтически эффективные количества азенапина и содержит А) защитный слой и В) азенапин-содержащий матричный слой, состоящий из композиции матричного слоя, содержащей: 1. азенапин, 2. полимер, 3. дополнительный полимер и 4. α-токоферол и аскорбилпальмитат в качестве стабилизаторов.
[0120] Таким образом, трансдермальная терапевтическая система для трансдермального введения азенапина включает в себя структуру самоклеящегося слоя, содержащую терапевтически эффективное количество азенапина, при этом указанная структура самоклеящегося слоя содержит:
A) защитный слой;
B) азенапин-содержащий матричный слой, состоящий из композиции матричного слоя, которая содержит:
1. азенапин;
2. полимер, выбранный из акриловых полимеров;
3. дополнительный полимер; и
4. α-токоферол в количестве от 0,01 до 2% композиции матричного слоя и аскорбилпальмитат в количестве, составляющем по меньшей мере 0,01% композиции матричного слоя, в качестве стабилизаторов.
[0121] Защитный слой является, в частности, по существу непроницаемым для азенапина.
[0122] ТТС по настоящему изобретению может представлять собой ТТС матричного типа или ТТС резервуарного типа, и предпочтительно представляет собой ТТС матричного типа.
[0123] В такой ТТС матричного типа в азенапин-содержащий матричный слой включен азенапин, предпочтительно терапевтически эффективное количество азенапина. Структура самоклеящегося слоя в такой ТТС матричного типа может включать в себя один или более дополнительных слоев, таких как слой контакта с кожей. В такой дополнительный слой может быть включен или может не быть включен активный агент. Как указано выше, слой контакта с кожей после уравновешивания может содержать азенапин, даже если он изготовлен как слой, не содержащий активного агента, и затем он может также рассматриваться как (дополнительный) матричный слой. Дополнительный слой и азенапин-содержащий матричный слой могут содержать одинаковый полимер или разные полимеры. Любой из азенапин-содержащего матричного слоя и дополнительного(-ых) слоя (слоев) могут непосредственно контактировать друг с другом или могут быть разделены мембраной, такой как мембрана, регулирующая скорость. Если азенапин-содержащий слой получают наслаиванием двух азенапин-содержащих матричных слоев, которые имеют по существу одинаковый состав, полученный двойной слой следует рассматривать как один матричный слой.
[0124] В некоторых вариантах осуществления структура самоклеящегося слоя содержит дополнительный резервуарный слой, расположенный между защитным слоем и матричным слоем, и дополнительную регулирующую скорость мембрану, расположенную между дополнительным резервуарным слоем и матричным слоем.
[0125] В конкретных вариантах осуществления структура самоклеящегося слоя по изобретению содержит дополнительный слой контакта с кожей. Дополнительный слой контакта с кожей является самоклеящимся и обеспечивает адгезию между структурой самоклеящегося слоя и кожей пациента во время применения.
[0126] В таких вариантах осуществления структура самоклеящегося слоя может содержать или может не содержать мембрану, расположенную между матричным слоем и дополнительным слоем контакта с кожей, причем мембрана предпочтительно представляет собой мембрану, регулирующую скорость.
[0127] В другом варианте осуществления структура самоклеящегося слоя по изобретению не содержит дополнительный слой контакта с кожей. Достаточная адгезия между структурой самоклеящегося слоя и кожей пациента во время применения затем обеспечивается другими способами, например, азенапин-содержащим матричным слоем и/или адгезивным слоем.
[0128] Таким образом, согласно определенным вариантам осуществления изобретения ТТС может дополнительно содержать адгезивное покрытие или не содержит адгезивного покрытия, и предпочтительно не содержит адгезивного покрытия. Это адгезивное покрытие, в частности, по размеру больше, чем структура азенапин-содержащего самоклеящегося слоя, и прикрепляется к нему для улучшения адгезионных свойств всей трансдермальной терапевтической системы. Указанное адгезивное покрытие также содержит защитный слой. Площадь указанного адгезивного покрытия увеличивает общий размер ТТС, но не увеличивает площадь высвобождения. Адгезивное покрытие содержит самоклеящийся полимер или смесь самоклеящихся полимеров, выбранных из группы, состоящей из акриловых полимеров, полиизобутиленов, сополимеров стирола, изопрена и стирола, полисилоксанов и их смесей, которые могут быть идентичными или отличаться от любого полимера или полимерной смеси, входящих в состав структуры самоклеящегося слоя, содержащего активный агент.
[0129] Структура самоклеящегося слоя по изобретению обычно расположена на отделяемом защитном слое (удаляемой защитной подложке), с которого ее снимают непосредственно перед нанесением на поверхность кожи пациента. Таким образом, ТТС может дополнительно содержать удаляемую защитную подложку. Защищенную таким образом ТТС обычно хранят в герметичном пакетике. Упаковка может быть с функцией защиты от детей и/или легкой в обращении для пожилых людей.
МАТРИЧНЫЙ СЛОЙ И КОМПОЗИЦИЯ МАТРИЧНОГО СЛОЯ
[0130] Как более подробно описано выше, ТТС по настоящему изобретению содержит структуру самоклеящегося слоя, который включает в себя азенапин-содержащий матричный слой, состоящий из композиции матричного слоя.
[0131] Композиция матричного слоя содержит:
1. азенапин;
2. полимер, выбранный из акриловых полимеров;
3. дополнительный полимер; и
4. α-токоферол в количестве от 0,01 до 2% композиции матричного слоя и аскорбилпальмитат в количестве, составляющем по меньшей мере 0,01% композиции матричного слоя, в качестве стабилизаторов.
[0132] В конкретном варианте осуществления изобретения композиция матричного слоя содержит азенапин и полимер, выбранный из акриловых полимеров, при этом трансдермальная терапевтическая система имеет площадь высвобождения от 5 до 100 см2.
[0133] В некоторых вариантах осуществления изобретения площадь высвобождения находится в диапазоне от 5 до 100 см2, предпочтительно от 5 до 80 см2 и более предпочтительно от 10 до 50 см2 или от 50 до 80 см2, от 10 до 40 см2, или от 10 до 30 см2, или от 55 до 65 см2, т.е. трансдермальная терапевтическая система имеет площадь высвобождения от 5 до 100 см2, предпочтительно от 5 до 80 см2 и более предпочтительно от 10 до 50 см2 или от 50 до 80 см2, от 10 до 40 см2, или от 10 до 30 см2, или от 55 до 65 см2.
[0134] В некоторых вариантах осуществления изобретения масса матричного слоя на единицу площади находится в диапазоне 90-230 г/м2, предпочтительно 110-210 г/м2 и наиболее предпочтительно 120-170 г/м2.
[0135] Не желая ограничиваться какой-либо теорией, считается, что хорошее проникновение через кожу in vitro достигается, среди прочего, за счет количества азенапина, содержащегося в ТТС, которым можно управлять в двух направлениях, регулируя концентрацию и/или массу на единицу площади азенапин-содержащих слоев, таких как матричный слой.
[0136] Таким образом, в некоторых вариантах осуществления изобретения трансдермальная терапевтическая система содержит по меньшей мере 0,70 мг/см2, предпочтительно по меньшей мере 0,80 мг/см2, более предпочтительно по меньшей мере 0,82 мг/см2 и наиболее предпочтительно по меньшей мере 0,83 мг/см2 азенапина на единицу площади высвобождения. В некоторых дополнительных вариантах осуществления изобретения трансдермальная терапевтическая система содержит по меньшей мере 0,90 мг/см2, по меньшей мере 1,00 мг/см2, по меньшей мере 1,2 мг/см2, по меньшей мере 1,5 мг/см2 или по меньшей мере 2,0 мг/см2 азенапина на единицу площади высвобождения.
[0137] В частности, трансдермальная терапевтическая система содержит от 0,70 мг/см2 до 4,0 мг/см2, предпочтительно от 0,80 мг/см2 до 3,0 мг/см2, более предпочтительно от 0,82 мг/см2 до 2,0 мг/см2 и наиболее предпочтительно от 0,83 мг/см2 до 1,7 мг/см2 азенапина.
[0138] В некоторых вариантах осуществления изобретения композиция матричного слоя представляет собой чувствительную к давлению адгезивную композицию. Композиция матричного слоя может содержать второй полимер или может содержать два или более дополнительных полимеров.
[0139] Согласно определенным вариантам осуществления изобретения общее содержание полимеров в композиции матричного слоя находится в диапазоне 60-95%, предпочтительно 70-90% и более предпочтительно 75-85% композиции матричного слоя. В любом случае матричный слой включает в себя достаточное количество полимера для обеспечения достаточной когезии.
[0140] В соответствии с некоторыми вариантами осуществления количество азенапина, содержащееся в ТТС, в частности, в матричном слое ТТС, находится в диапазоне 5-100 мг, предпочтительно 10-80 мг и наиболее предпочтительно 15-60 мг.
[0141] В некоторых вариантах осуществления трансдермальная терапевтическая система имеет площадь высвобождения 5-100 см2, и количество азенапина, содержащегося в ТТС, находится в диапазоне 5-100 мг.
[0142] В некоторых вариантах осуществления изобретения азенапин-содержащий матричный слой не содержит изопропилпальмитат в количестве 10% композиции матричного слоя, предпочтительно не содержит изопропилпальмитат в количестве 5-15% композиции матричного слоя и наиболее предпочтительно не содержит изопропилпальмитата.
[0143] В некоторых вариантах осуществления изобретения азенапин-содержащий матричный слой не содержит изопропилмиристат в количестве 5% композиции матричного слоя, предпочтительно не содержит изопропилмиристат в количестве 1-10% композиции матричного слоя и наиболее предпочтительно не содержит изопропилмиристата.
[0144] В некоторых вариантах осуществления изобретения азенапин-содержащий матричный слой не содержит этилцеллюлозу в количестве 10-20% композиции матричного слоя и предпочтительно не содержит этилцеллюлозу.
[0145] В некоторых вариантах осуществления изобретения азенапин-содержащий матричный слой не содержит хлористый водород.
[0146] В некоторых вариантах осуществления изобретения азенапин-содержащий матричный слой не содержит ацетат натрия или диацетат натрия. В еще одном варианте осуществления азенапин-содержащий слой не содержит щелочную соль дикарбоновой кислоты. В еще одном варианте осуществления азенапин-содержащий слой не содержит щелочную соль малеиновой кислоты.
[0147] В некоторых вариантах осуществления изобретения композиция матричного слоя не содержит никаких полисилоксанов и полиизобутиленов в количестве более 50% композиции матричного слоя.
[0148] В некоторых вариантах осуществления азенапин-содержащий матричный слой может быть получен путем высушивания нанесенной композиции для покрытия, при этом в композицию для покрытия не включена хлористоводородная кислота.
[0149] В некоторых вариантах осуществления изобретения азенапин-содержащий матричный слой не содержит толуол.
[0150] В некоторых вариантах осуществления изобретения, азенапин-содержащий матричный слой может быть получен путем высушивания нанесенной композиции для покрытия, не содержащей толуол.
АЗЕНАПИН
[0151] Согласно изобретению, структура самоклеящегося слоя содержит азенапин в терапевтически эффективном количестве, и при этом структура самоклеящегося слоя содержит азенапин-содержащий матричный слой, состоящий из композиции матричного слоя, содержащей азенапин.
[0152] Хотя в соответствии с настоящим изобретением активный агент может присутствовать в ТТС в протонированной форме или в форме свободного основания, форма свободного основания является предпочтительной.
[0153] Таким образом, в некоторых вариантах осуществления в композицию матричного слоя включен азенапин в форме свободного основания.
[0154] В некоторых вариантах осуществления композиция матричного слоя может быть получена путем включения азенапина в форме свободного основания.
[0155] В частности, по меньшей мере 90 моль %, предпочтительно по меньшей мере 95 моль %, более предпочтительно по меньшей мере 98 моль % и наиболее предпочтительно по меньшей мере 99 моль % азенапина в матричном слое присутствует в форме свободного основания.
[0156] Азенапин в матричном слое может быть полностью растворен, или композиция матричного слоя может содержать частицы азенапина, предпочтительно состоящие из свободного основания азенапина.
[0157] Как указано выше, количество азенапина в ТТС, как полагают, важно для хорошего высвобождения активного вещества и может, например, регулироваться концентрацией азенапина. Таким образом, в некоторых вариантах осуществления количество азенапина в композиции матричного слоя находится в диапазоне 2 - 20%, предпочтительно 3 - 15% и более предпочтительно 4 - 12% композиции матричного слоя.
[0158] В некоторых вариантах осуществления азенапин имеет чистоту по меньшей мере 95%, предпочтительно по меньшей мере 98% и более предпочтительно по меньшей мере 99%, как определено с помощью количественной ВЭЖХ. Количественная ВЭЖХ может быть проведена с помощью обращенно-фазовой ВЭЖХ с УФ-детектированием. В частности, при изократическом выполнении ВЭЖХ можно использовать следующие условия:

Кроме того, при выполнении ВЭЖХ с применением градиента можно использовать следующие условия:

ПОЛИМЕР
[0159] Как описано выше, ТТС по настоящему изобретению содержит структуру самоклеящегося слоя, который включает в себя азенапин-содержащий матричный слой, состоящий из композиции матричного слоя, причем композиция матричного слоя содержит полимер.
[0160] Этот полимер обеспечивает достаточную когезию матричного слоя. Согласно определенным вариантам осуществления полимер может также обеспечивать достаточную адгезию. В таких вариантах осуществления полимер выбран из чувствительных к давлению адгезивных полимеров.
[0161] В предпочтительном варианте осуществления полимер выбран из чувствительных к давлению адгезивных полимеров.
[0162] Полимеры, которые подходят в качестве полимера по изобретению, представляют собой акриловые полимеры.
[0163] Доступны соответствующие коммерческие продукты, например, под торговой маркой Duro-Tak™(подробную информацию см. ниже).
[0164] Акриловые полимеры содержат или не содержат функциональные группы.
[0165] Доступны соответствующие коммерческие продукты, например, под торговыми марками Duro-Tak™ 387-2287 (акр иловый сополимер, содержащий гидроксильные группы), Duro-Tak™ 87-4287 (акриловый сополимер, содержащий гидроксильные группы), Duro-Tak™ 387-2516 (акриловый сополимер, содержащий гидроксильные группы), Duro-Tak™ 387-2051 (акриловый сополимер, содержащий группы карбоновых кислот), Duro-Tak™ 387-2353 (акриловый сополимер, содержащий группы карбоновых кислот), Duro-Tak™ 387-4098 (акриловый сополимер, не содержащий функциональных групп) и Duro-Tak™ 387-9301 (акриловый сополимер, не содержащий функциональных групп).
[0166] В некоторых вариантах осуществления полимер выбран из акриловых полимеров, содержащих функциональные группы, причем функциональные группы выбраны из гидроксильных групп, групп карбоновых кислот, групп нейтрализованных карбоновых кислот и их смесей. Предпочтительно, функциональные группы ограничиваются гидроксильными группами.
[0167] В некоторых вариантах осуществления полимер выбран из акриловых полимеров, которые не содержат групп карбоновых кислот или групп нейтрализованных карбоновых кислот, или тех и других групп, и предпочтительно полимер выбран из акриловых полимеров, которые не содержат кислотных групп.
[0168] В других предпочтительных вариантах осуществления полимер выбран из акриловых полимеров, содержащих гидроксильные группы и не содержащих группы карбоновых кислот, и более предпочтительно, полимер представляет собой сополимер на основе винилацетата, 2-этилгексилакрилата, 2-гидроксиэтилакрилата и глицидилметакрилата или сополимер на основе винилацетата, 2-этилгексилакрилата и 2-гидроксиэтилакрилата.
[0169] Такой сополимер на основе винилацетата, 2-этилгексилакрилата, 2-гидроксиэтилакрилата и глицидилметакрилата коммерчески доступен под торговой маркой Duro-Tak™ 387-2287 (предоставляется в виде раствора в этилацетате без сшивающего агента) и Duro-Tak™ 387-2516 (предоставляется в виде раствора в этилацетате, этаноле, гептане и метаноле с титановым сшивающим агентом). Сополимер на основе винилацетата, 2-этилгексилакрилата и 2-гидроксиэтилакрилата (предоставляется в виде раствора в этилацетате без сшивающего агента) коммерчески доступен под торговой маркой Duro-Tak™ 387-4287. Таким образом, в зависимости от типа используемого коммерчески доступного акрилового полимера и в зависимости от того, добавлен ли сшивающий агент к композиции для покрытия, полимер в окончательном матричном слое является сшитым (и предпочтительно сшитым алюминиевым и/или титановым сшивающим агентом) или не сшитым сшивающим агентом.
[0170] В некоторых других вариантах осуществления полимер выбран из акриловых полимеров, не содержащих гидроксильных групп и групп карбоновых кислот, и предпочтительно полимер выбран из акриловых полимеров, не содержащих функциональных групп.
[0171] В других предпочтительных вариантах осуществления полимер представляет собой сополимер на основе метилакрилата, 2-этилгексилакрилата и трет-октилакриламида, который коммерчески доступен под торговой маркой Duro-Tak™ 387-9301 (предоставляется в виде раствора в этилацетате).
[0172] В других предпочтительных вариантах осуществления полимер представляет собой сополимер на основе 2-этилгексилакрилата и винилацетата, который коммерчески доступен под торговой маркой Duro-Tak™ 387-4098 (предоставляется в виде раствора в этилацетате).
[0173] В некоторых предпочтительных вариантах осуществления количество полимера находится в диапазоне 50-90%, предпочтительно 60-85% и более предпочтительно 65-80% композиции матричного слоя.
ДОПОЛНИТЕЛЬНЫЙ ПОЛИМЕР
[0174] Как описано выше, в ТТС по настоящему изобретению композиция матричного слоя содержит дополнительный полимер.
[0175] Особый интерес представляют полимеры с повышенной способностью поглощать воду, поскольку повышенное поглощение воды и/или влаги способствует поддержанию/улучшению адгезионных свойств матричного слоя.
[0176] Таким образом, в некоторых вариантах осуществления композиция матричного слоя содержит дополнительный полимер, выбранный из полимеров, которые обеспечивают улучшенное поглощение воды и/или влаги матричным слоем. Такие полимеры хорошо известны в данной области. Из них особенно подходящими и предпочтительными являются полив инилпирролидоны и, в частности, растворимые поливинилпирролидоны.
[0177] Термин «растворимый поливинилпирролидон» относится к полив инилпирролидону, также известному как повидон, который растворим на более 10% по меньшей мере в этаноле, предпочтительно также в воде, диэтиленгликоле, метаноле, н-пропаноле, 2-пропаноле, н-бутаноле, хлороформе, метиленхлориде, 2-пирролидоне, макроголе 400, 1,2-пропиленгликоле, 1,4-бутандиоле, глицерине, триэтаноламине, пропионовой кислоте и уксусной кислоте. Примеры коммерчески доступных поливинилпирролидонов включают Kollidon® 12 PF, Kollidon® 17 PF, Kollidon® 25, Kollidon® 30 и Kollidon® 90 F, поставляемые компанией BASF, или повидон K90F. Различные марки Kollidon® определяются по K-значению, отражающему среднюю молекулярную массу марок поливинилпирролидона. Kollidon® 12 PF характеризуется диапазоном K-значений от 10,2 до 13,8, что соответствует номинальному K-значению 12. Kollidon® 17 PF характеризуется диапазоном K-значений от 15,3 до 18,4, что соответствует номинальному K-значению 17. Kollidon® 25 характеризуется диапазоном K-значений от 22,5 до 27,0, что соответствует номинальному K-значению 25, Kollidon® 30 характеризуется диапазоном K-значений от 27,0 до 32,4, что соответствует номинальному K-значению 30. Kollidon® 90F характеризуется диапазоном K-значений от 81,0 до 97,2, что соответствует номинальному K-значению 90. Предпочтительными марками Kollidon® являются Kollidon® 12 PF, Kollidon® 30 и Kollidon® 90F. Для всех марок и типов поливинилпирролидона предпочтительно, чтобы количество пероксидов находилось в определенных пределах, в частности, чтобы количество пероксида было равно 500 м. д. или менее, более предпочтительно, чтобы было равно 150 м. д. или менее, и наиболее предпочтительно, чтобы было равно 100 м. д. или менее.
[0178] В контексте настоящего изобретения термин «K-значение» относится к значению, рассчитанному на основе относительной вязкости поливинилпирролидона в воде в соответствии со статьями «Повидон» Европейской фармакопеи (Евр. Фарм.) и Фарм. США.
[0179] Таким образом, в некоторых вариантах осуществления композиция матричного слоя содержит дополнительный полимер, причем дополнительный полимер представляет собой поливинилпирролидон, имеющий K-значение в диапазоне, выбранном из группы диапазонов, состоящей из
9-15 и предпочтительно 10,2-13,8,
15-20 и предпочтительно 15,3-18,4,
20-27 и предпочтительно 22,5-27,0,
27-35 и предпочтительно 27,0-32,4, и
75-110 и предпочтительно 81,0-97,2,
или любых их смесей, и более предпочтительно представляет собой поливинилпирролидон, имеющий K-значение в диапазоне 27,0-32,4 или 81,0-97,2, и любую их смесь, и наиболее предпочтительно представляет собой поливинилпирролидон, имеющий K-значение в диапазоне 27,0-32,4.
[0180] Дополнительный полимер, например поливинилпирролидоны, предпочтительно растворимые поливинилпирролидоны, могут присутствовать, например в количестве 0-20% композиции матричного слоя, предпочтительно 5-15% композиции матричного слоя и более предпочтительно в количестве приблизительно 10% композиции матричного слоя.
[0181] Композиция матричного слоя может, например, содержать один из вышеупомянутых полимеров в качестве дополнительного(-ых) полимера(-ов). Также могут быть добавлены другие дополнительные полимеры и добавки для повышения когезии и/или адгезии.
[0182] Другие полимеры, в частности, уменьшают текучесть на холоде и, таким образом, также подходят в качестве дополнительного полимера. Полимерная матрица может проявлять текучесть на холоде, поскольку, несмотря на очень высокую вязкость, такие полимерные композиции часто демонстрируют способность к очень медленной текучести. Таким образом, во время хранения матрица может до определенной степени растекаться по краям защитного слоя. Это - проблема со стабильностью при хранении, и ей можно препятствовать добавлением определенных полимеров. Для уменьшения текучести на холоде может, например, использоваться основной акрилатный полимер (например, Eudragit E100, который представляет собой сополимер на основе диметиламиноэтилметакрилата, бутилметакрилата и метилметакрилата). Таким образом, в некоторых вариантах осуществления композиция матричного слоя содержит дополнительно основной полимер, в частности, аминофункциональный акрилат, например Eudragit E100.
[0183] В соответствии с некоторыми вариантами осуществления общее содержание полимеров в композиции матричного слоя находится в диапазоне 60-95%, предпочтительно 70-90% и более предпочтительно 75-85% композиции матричного слоя.
СТАБИЛИЗАТОРЫ
[0184] Как описано выше, ТТС по настоящему изобретению содержит структуру самоклеящегося слоя, который включает в себя азенапин-содержащий матричный слой, состоящий из композиции матричного слоя, причем композиция матричного слоя содержит α-токоферол и аскорбилпальмитат.
[0185] α-Токоферол и аскорбилпальмитат включены в качестве стабилизаторов. Авторы изобретения неожиданно обнаружили, что стабильность составов по изобретению с точки зрения содержания и разложения азенапина улучшается при использовании синергетической комбинации α-токоферола и аскорбилпальмитата, в частности, в определенных конкретных количествах.
[0186] Таким образом, композиция матричного слоя содержит в качестве стабилизаторов α-токоферол в количестве от 0,01 до 2% композиции матричного слоя и аскорбилпальмитат в количестве, составляющем по меньшей мере 0,01% композиции матричного слоя.
[0187] Кроме того, изобретатели обнаружили, что благоприятное влияние на стабильность можно дополнительно улучшить добавлением метабисульфита натрия. Таким образом, предпочтительно, композиция матричного слоя дополнительно содержит в качестве стабилизатора метабисульфит натрия в количестве 0-0,5%, предпочтительно 0,01-0,2%, и более предпочтительно 0,05-0,15% композиции матричного слоя. Особенно предпочтительно, композиция матричного слоя дополнительно содержит в качестве стабилизатора метабисульфит натрия в количестве приблизительно 0,1% композиции матричного слоя. В случаях, когда настоящая заявка ссылается на метабисульфит натрия, любой другой сульфит или дисульфит считается включенным в качестве альтернативного варианта осуществления.
[0188] Что касается количества α-токоферола и аскорбилпальмитата, определенные диапазоны оказывают особенно благоприятное влияние на стабильность.
[0189] Таким образом, композиция матричного слоя предпочтительно содержит α-токоферол в количестве, составляющем по меньшей мере 0,025% композиции матричного слоя и/или в количестве до 1,5% или 0,75%, предпочтительно до 0,5%, и более предпочтительно до 0,1% композиции матричного слоя и наиболее предпочтительно в количестве приблизительно 0,05% композиции матричного слоя.
[0190] Композиция матричного слоя может дополнительно содержать аскорбилпальмитат в количестве, составляющем по меньшей мере 0,02% композиции матричного слоя, предпочтительно по меньшей мере 0,08% композиции матричного слоя, и более предпочтительно по меньшей мере 0,15% композиции матричного слоя, и/или в количестве до 2,0 или 1,0%, предпочтительно до 0,6% композиции матричного слоя, и более предпочтительно в количестве от 0,2 до 0,4% композиции матричного слоя.
[0191] В некоторых вариантах осуществления композиция матричного слоя может содержать один или более дополнительных стабилизаторов, выбранных из аскорбиновой кислоты и ее сложноэфирных производных, бутилированного гидрокситолуола, производных сложных эфиров токоферола, таких как токоферилацетат и токофериллинолеат, карбоновых кислот и, в частности, разветвленных или линейных алкилмоно-, ди- или трикарбоновых кислот, предпочтительно разветвленной или линейной С4-С16-монокарбоновой кислоты и более предпочтительно изононановой кислоты или гептановой кислоты, а наиболее предпочтительно 3,5,5-триметилгексановой кислоты, а также любой их комбинации.
[0192] ТТС по настоящему изобретению преимущественно демонстрируют улучшенную стабильность с точки зрения содержания и разложения азенапина.
[0193] Таким образом, в некоторых вариантах осуществления матричный слой изначально (т.е. вскоре после изготовления, например в пределах одной недели) содержит количество азенапина, составляющее по меньшей мере 95%, предпочтительно по меньшей мере 96%, более предпочтительно по меньшей мере 97% и еще более предпочтительно по меньшей мере 98% теоретического количества азенапина, включенного в матричный слой. Теоретическое количество азенапина рассчитывают из количества азенапина, используемого в композиции для покрытия, и (фактической) массы на единицу площади нанесенного и высушенного матричного слоя тестируемой ТТС.
[0194] Матричный слой может также изначально содержать общее количество продуктов разложения азенапина, составляющее менее 0,7%, предпочтительно менее 0,5%, более предпочтительно менее 0,3% и еще более предпочтительно менее 0,2%.
[0195] В некоторых других вариантах осуществления ТТС по настоящему изобретению стабильны при хранении, то есть они могут поддерживать изначальные значения содержания азенапина или содержать низкие количества продуктов разложения, как показано ниже.
[0196] В одном из таких вариантов осуществления после хранения при температуре 25°С и относительной влажности 60% в течение по меньшей мере 2 месяцев, предпочтительно по меньшей мере 3 месяцев, матричный слой содержит количество азенапина, составляющее по меньшей мере 90%, предпочтительно по меньшей мере 92%, более предпочтительно по меньшей мере 94% и еще более предпочтительно по меньшей мере 95% теоретического количества азенапина, включенного в матричный слой.
[0197] После хранения при температуре 25°С и относительной влажности 60% в течение по меньшей мере 2 месяцев, предпочтительно по меньшей мере 3 месяцев, матричный слой может также содержать общее количество продуктов разложения азенапина, составляющее менее 1,0%, предпочтительно менее 0,7%, более предпочтительно менее 0,5% и еще более предпочтительно менее 0,4%.
[0198] В другом из таких вариантов осуществления после хранения при температуре 40°С и относительной влажности 75% в течение по меньшей мере 2 месяцев, предпочтительно по меньшей мере 3 месяцев, матричный слой содержит количество азенапина, составляющее по меньшей мере 88%, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 91% и еще более предпочтительно по меньшей мере 92% теоретического количества азенапина, включенного в матричный слой.
[0199] После хранения при температуре 40°С и относительной влажности 75% в течение по меньшей мере 2 месяцев, предпочтительно по меньшей мере 3 месяцев, матричный слой может также содержать общее количество продуктов разложения азенапина, составляющее менее 3,0%, предпочтительно менее 2,0%, более предпочтительно менее 1,5% и еще более предпочтительно менее 0,7%.
[0200] Для определения содержания азенапина и общего количества продуктов разложения азенапина, образец ТТС экстрагируется подходящим растворителем для экстракции, а количество основания азенапина, а также различных возможных продуктов разложения определяется методом количественной ВЭЖХ с УФ-фотометрическим детектором. Количество азенапина определяется на основании стандарта азенапина. Общее количество продуктов разложения азенапина (выраженное в %), представляет собой сумму площадей пиков всех продуктов разложения, каждая из которых умножена на коэффициент ответа, равный 0,33 для тетрадегидроазенапина и 1 для всех других веществ, разделенную на площадь пика азенапина тестируемого образца и умноженную на 100%.
ДОПОЛНИТЕЛЬНЫЕ ДОБАВКИ
[0201] Композиция матричного слоя ТТС по изобретению может содержать дополнительные вспомогательные вещества или добавки, выбранные из группы, состоящей из дополнительных полимеров (см. выше), сшивающих агентов, солюбилизаторов, наполнителей, веществ, придающих клейкость, пластификаторов, стабилизаторов, смягчителей, веществ для ухода за кожей, усилителей проницаемости, то есть веществ, которые влияют на барьерные свойства рогового слоя в смысле увеличения проницаемости активного агента, регуляторов рН и консервантов. Особенно предпочтительными добавками являются вещества, придающие клейкость, и стабилизаторы. Такие добавки могут присутствовать в азенапин-содержащем слое в количестве от 0,001% до 15% композиции матричного слоя для каждой добавки. В определенном варианте осуществления общее количество всех добавок составляет от 0,001% до 25% композиции матричного слоя. В дальнейшем при указании диапазона количества конкретной добавки такой диапазон относится к количеству, приходящемуся на отдельную добавку.
[0202] Следует отметить, что в фармацевтических составах компоненты состава классифицируются в соответствии с их физико-химическими и физиологическими свойствами и в соответствии с их функцией. Это, в частности, означает, что вещество или соединение, попадающее в одну категорию, не исключается из другой категории компонентов состава. Например, определенный полимер может быть ингибитором кристаллизации, но также и веществом, придающим клейкость. Некоторые вещества могут, например, быть типичным смягчителем, но в то же время действовать как усилитель проницаемости. Квалифицированный специалист может определить на основании своих общих знаний, к какой категории или категориям компонентов состава принадлежит определенное вещество или соединение. Далее представлены подробности о вспомогательных веществах и добавках, которые, однако, не следует понимать как исключительные. Другие вещества, не перечисленные в явном виде в настоящем описании, также могут использоваться в соответствии с настоящим изобретением, и при этом в контексте настоящего изобретения вещества и/или соединения, явно перечисленные для одной категории компонентов состава, не исключены из использования в качестве другого компонента состава.
[0203] Сшивающий агент может быть выбран из группы, состоящей из алюминиевых и титановых сшивающих агентов, таких как ацетилацетонат алюминия, ацетилацетонат титана или полибутилтитанат, и предпочтительно представляет собой титановый сшивающий агент. Количество сшивающего агента может составлять 0,005-1%, и предпочтительно 0,01-0,1% композиции матричного слоя. Композиция матричного слоя может также содержать полимер, который является самосшивающимся, т.е. содержит сшивающую функциональную группу, такую как глицидильные группы, которая реагирует при нагревании. В соответствии с дополнительным конкретным вариантом осуществления композиция матричного слоя содержит сшивающий агент, как указано выше, и самосшивающийся полимер.
[0204] В одном варианте осуществления композиция матричного слоя дополнительно содержит солюбилизатор. Солюбилизатор предпочтительно улучшает растворимость азенапина в азенапин-содержащем слое. Предпочтительные солюбилизаторы включают, например, сложные эфиры глицерина, полиглицерина, пропиленгликоля и полиоксиэтилена и жирных кислот со средней и/или длинной цепью, такие как монолинолеат глицерина, глицериды со средней длиной цепи и триглицериды со средней длиной цепи, неионные солюбилизаторы, полученные реакцией касторового масла с этиленоксидом и любые их смеси, которые могут дополнительно содержать жирные кислоты или жирные спирты; целлюлозу и метилцеллюлозу и их производные, такие как гидроксипропилцеллюлоза и сукцинат ацетата гипромеллозы; различные цикло декстрины и их производные; неионные триблок-сополимеры, имеющие центральную гидрофобную цепь полиоксипропилена, фланкированную двумя гидрофильными цепями полиоксиэтилена, известные как полоксамеры; привитой сополимер на основе полиэтиленгликоля, поливинилацетата и поливинилкапролактама, также сокращенно PVAc-PVCap-ПЭГ и известный как Soluplus®; очищенные марки касторового масла природного происхождения, полиэтиленгликоля 400, моноолеата полиоксиэтиленсорбитана (такого как полисорбат 80) или пропиленгликолей; моноэтиловый простой эфир диэтиленгликоля; а также любой из нижеупомянутых растворимых поливинилпирролидонов, но также нерастворимые/сшитые поливинилпирролидоны, также известные как кросповидоны, такие как Kollidon® CL, Kollidon® CL-M и Kollidon® CL-SF, и сополимеры поливинилпирролидона и поливинилацетата, также известные как коповидоны, такие как Kollidon® VA64.
[0205] Однако упомянутые ниже усилители проницаемости также могут действовать как солюбилизаторы. Кроме того, ингибиторы кристаллизации также могут действовать как солюбилизаторы.
[0206] Наполнители, такие как силикагели, диоксид титана и оксид цинка, могут быть использованы в сочетании с полимером с целью влияния желаемым образом на определенные физические параметры, такие как когезия и прочность связи.
[0207] В случае, если требуется, чтобы матричный слой обладал самоклеящимися свойствами, и при этом выбран один или более полимеров, которые не обеспечивают достаточные самоклеящиеся свойства, добавляют вещество, придающее клейкость. Вещество, придающее клейкость может быть выбрано из триглицеридов, полиэтиленгликолей, дипропиленгликоля, смол, сложных эфиров смол, терпенов и их производных, этиленвинилацетатных адгезивов, диметилполисилоксанов и полибутенов и их смесей. В некоторых вариантах осуществления композиция матричного слоя содержит вещество, придающее клейкость, в количестве от 5 до 15% композиции матричного слоя.
[0208] В некоторых вариантах осуществления композиция матричного слоя содержит триглицериды со средней длиной цепи. Такие триглицериды со средней длиной цепи включены в качестве вещества, придающего клейкость, и обеспечивают улучшенную адгезию матричного слоя к коже. В некоторых вариантах осуществления к композициям азенапин-содержащего матричного слоя, включающего в себя акр иловые полимеры, можно добавлять достаточное количество триглицеридов со средней длиной цепи без ухудшения характеристик проникновения через кожу.
[0209] В таких вариантах осуществления композиция матричного слоя может содержать триглицериды со средней длиной цепи в количестве 0,1-14% композиции матричного слоя, предпочтительно 1-13% композиции матричного слоя, более предпочтительно 3-12% композиции матричного слоя, еще более предпочтительно 5-12% композиции матричного слоя и наиболее предпочтительно в количестве приблизительно 10% композиции матричного слоя. С точки зрения адгезии предпочтительны высокие количества триглицеридов со средней длиной цепи, но при слишком высоких концентрациях когезионные свойства могут стать недостаточными.
[0210] Триглицериды со средней длиной цепи представляют собой сложные эфиры, полученные из глицерина и трех жирных кислот со средней длиной цепи. Свойства триглицеридов зависят от композиции жирных кислот, то есть композиции всех фрагментов жирных кислот, присутствующих в триглицеридах со средней длиной цепи (что означает, что композиция жирных кислот, содержащая 3 молекулы триглицеридов каждой из одной октаноидной кислоты, одной декановой кислоты и одной додекановой кислоты является такой же, как композиции жирных кислот смеси первого триглицерида только на основе октановой кислоты, второго триглицерида только на основе декановой кислоты и третьего триглицерида только на основе додекановой кислоты).
[0211] В некоторых вариантах осуществления композиция жирных кислот триглицеридов со средней длиной цепи состоит из одного или более из следующих компонентов:
(i) капроновая кислота,
(ii) октановая кислота,
(iii) декановая кислота,
(iv) додекановая кислота и
(v) тетрадекановая кислота.
[0212] В некоторых предпочтительных вариантах осуществления композиция жирных кислот триглицеридов со средней длиной цепи состоит из:
(i) 0-5% капроновой кислоты,
(ii) 40,0-90,0% октановой кислоты,
(iii) 10,0-55,0% декановой кислоты,
(iv) 0-5% додекановой кислоты и
(v) 0-2% тетрадекановой кислоты.
[0213] Предпочтительно композиция жирных кислот триглицеридов со средней длиной цепи состоит из:
(i) 0-2% капроновой кислоты,
(ii) 50,0-80,0% октановой кислоты,
(iii) 20,0-5,0% декановой кислоты,
(iv) 0-2% додекановой кислоты и
(v) 0-1% тетрадекановой кислоты.
[0214] В некоторых приведенных выше вариантах осуществления композиция жирных кислот триглицеридов со средней длиной цепи состоит из:
(i) 0-2% капроновой кислоты,
(ii) 50,0-65,0% октановой кислоты,
(iii) 30,0-5,0% декановой кислоты,
(iv) 0-2% додекановой кислоты и
(v) 0-1% тетрадекановой кислоты.
[0215] В некоторых других из приведенных выше вариантов осуществления композиция жирных кислот триглицеридов со средней длиной цепи состоит из:
(i) 0-2% капроновой кислоты,
(ii) 65,0-80,0% октановой кислоты,
(iii) 20,0-35,0% декановой кислоты,
(iv) 0-2% додекановой кислоты и
(v) 0-1% тетрадекановой кислоты.
[0216] Триглицериды со средней длиной цепи могут также иметь определенные кислотные числа, перекисные числа и/или гидроксильные числа.
[0217] Например, в некоторых вариантах осуществления кислотное число триглицеридов со средней длиной цепи составляет 0,5 мг KOH/г или менее, предпочтительно 0,2 мг KOH/г или менее и наиболее предпочтительно 0,1 мг KOH/г или менее.
[0218] В некоторых других вариантах осуществления перекисное число триглицеридов со средней длиной цепи составляет 5,0 мэкв активного О/кг или менее, предпочтительно 2,0 мэкв активного О/кг или менее и наиболее предпочтительно 1,0 мэкв активного О/кг или менее.
[0219] В других вариантах осуществления гидроксильное число триглицеридов со средней длиной цепи составляет 10 мг KOH/г или менее, предпочтительно 8,0 мг KOH/г или менее и наиболее предпочтительно 5,0 мг KOH/г или менее.
[0220] В одном варианте осуществления композиция матричного слоя дополнительно содержит смягчитель/пластификатор. Примеры смягчителей/пластификаторов включают линейные или разветвленные, насыщенные или ненасыщенные спирты, содержащие от 6 до 20 атомов углерода, Триглицериды и полиэтиленгликоли.
[0221] В некоторых вариантах осуществления композиция матричного слоя содержит усилитель проницаемости, выбранный из моноэтилового простого эфира диэтиленгликоля, диизопропиладипата, изопропилмиристата, изопропилпальмитата, лауриллактата,
диметилпропиленмочевины и смеси простых моноэфиров пропиленгликоля и сложных диэфиров жирных кислот. Такая смесь простых моноэфиров пропиленгликоля и сложных диэфиров жирных кислот коммерчески доступна, например, под торговой маркой Capryol, которая представляет собой монокаприлат пропиленгликоля (тип II), смесь моноэфиров пропиленгликоля и сложных диэфиров жирных кислот с соотношением моноэфиров > 90% и сложных диэфиров < 10%, причем жирные кислоты в основном состоят из каприловой кислоты.
[0222] В некоторых других вариантах осуществления композиция матричного слоя не содержит усилителя проницаемости, выбранного из олеиновых кислот, олеиновых спиртов и их смесей, и, в частности, композиция матричного слоя вообще не содержит усилителя проницаемости. В другом варианте осуществления композиция матричного слоя не содержит ацетат натрия или диацетат натрия. В еще одном варианте осуществления азенапин-содержащий слой не содержит щелочную соль дикарбоновой кислоты. В еще одном варианте осуществления композиция матричного слоя не содержит щелочную соль малеиновой кислоты.
[0223] Композиция матричного слоя по изобретению может содержать регулятор рН. Предпочтительно, регулятор рН выбирают из производных амина, производных неорганических щелочей, полимеров с основной и кислотной функциональностью соответственно.
ХАРАКТЕРИСТИКИ ВЫСВОБОЖДЕНИЯ
[0224] ТТС по изобретению предназначены для трансдермального введения азенапина в системную циркуляцию в течение заранее определенного длительного периода времени.
[0225] В одном аспекте ТТС по изобретению обеспечивает среднюю скорость высвобождения 0,5-20 мг/сут, 0,5-20 мг/24 ч, 500-20000 мкг/сут, 500-20 000 мкг/24 ч, 0,021-0,833 мг/ч или 21-833 мкг/ч, предпочтительно 1,0-15 мг/сут, 1,0-15 мг/24 ч, 1000-15 000 мкг/сут, 1000-15000 мкг/24 ч, 0,042-0,625 мг/ч или 42-625 мкг/ч, и более предпочтительно 2,0-10 мг/сут, 2,0-10 мг/24 ч, 2000-10 000 мкг/сут, 2000-10 000 мкг/24 ч, 0,083-0,417 мг/ч или 83-417 мкг/ч в течение по меньшей мере 24 часов применения, предпочтительно в течение по меньшей мере 48 часов применения, более предпочтительно в течение по меньшей мере 72 часов применения и наиболее предпочтительно в течение по меньшей мере 84 часов применения.
[0226] В соответствии с некоторыми вариантами осуществления ТТС по изобретению по результатам измерения с помощью диффузионной ячейки Франца с полученной с использованием дерматома кожей человека обеспечивает совокупную скорость проникновения азенапина через кожу в час 48 или в час 72 от 1 мкг/(см2⋅ч) до 20 мкг/(см2⋅ч), предпочтительно от 2 мкг/(см2⋅ч) до 15 мкг/(см2⋅ч) и более предпочтительно от 4 мкг/(см2⋅ч) до 12 мкг/(см2⋅ч).
[0227] В конкретных вариантах осуществления изобретения ТТС по изобретению, описанная выше, по результатам измерения с помощью диффузионной ячейки Франца с полученной с использованием дерматома кожей человека обеспечивает скорость проникновения через кожу азенапина
от 0 мкг/(см2⋅ч) до 10 мкг/(см2⋅ч) в первые 8 часов,
от 2 мкг/(см2⋅ч) до 20 мкг/(см2⋅ч) от часа 8 до часа 24,
от 3 мкг/(см2⋅ч) до 20 мкг/(см2⋅ч) от часа 24 до часа 32,
от 3 мкг/(см2⋅ч) до 20 мкг/(см2⋅ч) от часа 32 до часа 48,
от 2 мкг/(см2⋅ч) до 15 мкг/(см2⋅ч) от часа 48 до часа 72.
[0228] В некоторых вариантах осуществления транс дермальная терапевтическая система по изобретению по результатам измерения с помощью диффузионной ячейки Франца с полученной с использованием дерматома кожей человека обеспечивает совокупное проникающее количество азенапина от 0,05 мг/см2 до 1,0 мг/см2, предпочтительно от 0,1 мг/см2 до 0,7 мг/см2 за период времени 48 часов.
[0229] В некоторых вариантах осуществления транс дермальная терапевтическая система по изобретению по результатам измерения с помощью диффузионной ячейки Франца с полученной с использованием дерматома кожей человека обеспечивает совокупное проникающее количество азенапина от 0,1 мг/см2 до 2,0 мг/см2, предпочтительно от 0,2 мг/см2 до 1,0 мг/см2 за период времени 72 часа.
СПОСОБ ЛЕЧЕНИЯ / МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ
[0230] В соответствии с конкретным аспектом настоящего изобретения ТТС по изобретению предназначена для использования в способе лечения и, в частности, в способе лечения пациента-человека.
[0231] В некоторых вариантах осуществления ТТС по изобретению предназначена предпочтительно для использования в способе лечения психоза, и более предпочтительно для использования в способе лечения одного или более состояний, выбранных из шизофрении, биполярного расстройства, посттравматического стрессового расстройства, большого депрессивного расстройства, психоза на фоне деменции, тревожного возбуждения и маниакального расстройства, в частности, для использования в способе лечения шизофрении и/или биполярного расстройства у пациента-человека и, в частности, для использования в способе лечения острых маниакальных или смешанных эпизодов биполярного расстройства у пациента-человека.
[0232] В некоторых вариантах осуществления ТТС по изобретению предназначена для использования в способе лечения острых маниакальных или смешанных эпизодов биполярного расстройства у взрослых пациентов или детей в возрасте от 10 до 17 лет. В некоторых вариантах осуществления ТТС по изобретению предназначена для использования в качестве дополнительного лечения к применению препаратов лития или вальпроата в способе лечения биполярного расстройства у пациента-человека, в частности, у взрослого человека. В некоторых вариантах осуществления ТТС по изобретению предназначена для использования в качестве поддерживающей монотерапии в способе лечения биполярного расстройства у пациента-человека, в частности, у взрослого человека.
[0233] ТТС может быть дополнительно предназначена для использования в способе лечения с интервалом введения, составляющим по меньшей мере 24 часа или 1 день, по меньшей мере 48 часов или 2 дня, или по меньшей мере 72 часа или 3 дня, и/или с интервалом введения до 168 часов или 7 дней, до 120 часов или 5 дней, до 96 часов или 4 дней. Интервал введения может, в частности, составлять 24 часа или 1 день, 48 часов или 2 дня или 84 часа или 3,5 дня.
[0234] Соответственно, изобретение также относится к ТТС для использования в способе лечения и, в частности, для использования в способе лечения шизофрении и/или биполярного расстройства и, в частности, острых маниакальных или смешанных эпизодов биполярного расстройства, с режимом замены ТТС один раз в день (интервал введения 24 часа или 1 день), с режимом замены ТТС два раза в неделю (интервал введения 84 часа или 3,5 дня) или с режимом замены ТТС один раз в неделю (интервал введения 168 часов или 7 дней) примерно в одно и то же время суток.
[0235] ТТС по изобретению дополнительно предпочтительна для использования в способе лечения пациента, в котором трансдермальная терапевтическая система обеспечивает уменьшение по меньшей мере одного связанного с применением азенапина побочного эффекта по сравнению с эквивалентной дозой азенапина для сублингвального применения.
[0236] Выражение «по сравнению с эквивалентной дозой азенапина для сублингвального применения» следует понимать как сравнение частоты и интенсивности побочных эффектов в клиническом исследовании при использовании дозы трансдермального и сублингвального азенапина, которая по существу приводит к одинаковой экспозиции азенапина в плазме крови.
[0237] В другом варианте осуществления ТТС по изобретению может также быть предназначена для применения в способе уменьшения у пациента по меньшей мере одного связанного с применением азенапина побочного эффекта по сравнению с эквивалентной дозой азенапина для сублингвального применения.
[0238] В таком способе лечения пациента или в таком способе уменьшения по меньшей мере одного связанного с применением азенапина побочного эффекта, но также во всех транс дермальных терапевтических системах для использования в способе лечения, к транс дермальным терапевтическим системам для использования в способе уменьшения по меньшей мере одного связанного с применением азенапина побочного эффекта, а также к способам лечения и способам уменьшения по меньшей мере одного связанного с применением азенапина побочного эффекта, в целом дополнительно может применяться следующее:
[0239] (i) По меньшей мере один связанный с применением азенапина побочный эффект представляет собой, в частности, утомляемость, сонливость, головокружение, гипестезию полости рта или любую их комбинацию.
[0240] (ii) Поскольку эти побочные эффекты уменьшаются, в одном варианте осуществления способы по изобретению и трансдермальные терапевтические системы для использования в способах, в частности, подходят для пациента-человека, уже страдающего от такого состояния, то есть страдающего от усталости, сонливости, головокружения или любой их комбинации.
[0241] (iii) Кроме того, частота возникновения по меньшей мере одного связанного с применением азенапина побочного эффекта по сравнению с эквивалентной дозой азенапина для сублингвального применения может быть уменьшена по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 70% или по меньшей мере приблизительно на 80%, и/или может быть уменьшена интенсивность по меньшей мере одного связанного с применением азенапина побочного эффекта по сравнению с эквивалентной дозой азенапина для сублингвального применения. Интенсивность побочного эффекта можно определить, например, по классификации побочных эффектов по шкале, показывающей на «легкую», «умеренную» или «тяжелую» интенсивность, а уменьшение интенсивности можно оценить количественно, сравнивая среднюю интенсивность.
[0242] (iv) В таких вариантах осуществления по меньшей мере одним связанным с применением азенапина побочным эффектом может быть усталость, и частота возникновения усталости по сравнению с эквивалентной дозой азенапина для сублингвального применения может быть уменьшена по меньшей мере приблизительно на 30%, или по меньшей мере приблизительно на 40%, и/или может быть уменьшена интенсивность усталости по сравнению с эквивалентной дозой азенапина для сублингвального применения.
[0243] (v) Альтернативно, по меньшей мере одним связанным с применением азенапина побочным эффектом может быть головокружение, и частота возникновения головокружения по сравнению с эквивалентной дозой азенапина для сублингвального применения может быть уменьшена по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 70% или по меньшей мере приблизительно на 80%.
[0244] Что касается типа побочных эффектов, следует отметить, что усталость и сонливость, хотя и указывают на клинически разные состояния, имеют общие и/или сходные симптомы, и поэтому их может быть трудно различить, в частности, если не наблюдать за ними в течение длительного времени.
[0245] В соответствии с другим конкретным аспектом настоящее изобретение также относится к способу лечения и, в частности, к способу лечения пациента-человека.
[0246] В частности, изобретение относится к способу лечения психоза и, в частности, к способу лечения одного или более состояний, выбранных из шизофрении, биполярного расстройства, посттравматического стрессового расстройства, большого депрессивного расстройства, психоза на фоне деменции, тревожного возбуждения и маниакального расстройства, и предпочтительно к способу лечения шизофрении и/или биполярного расстройства у пациента-человека и, в частности, острых маниакальных или смешанных эпизодов биполярного расстройства, включающему применение трансдермальной терапевтической системы по изобретению на коже пациента-человека.
[0247] В некоторых вариантах осуществления изобретение также относится к способу лечения острых маниакальных или смешанных эпизодов биполярного расстройства у взрослых пациентов или детей в возрасте от 10 до 17 лет. В некоторых вариантах осуществления изобретение также относится к способу лечения биполярного расстройства у пациента-человека, в частности, у взрослого человека, как дополнительное лечение к применению препаратов лития или вальпроата. В некоторых вариантах осуществления изобретение также относится к поддерживающей монотерапии в способе лечения биполярного расстройства у пациента-человека, в частности, у взрослого человека.
[0248] Изобретение также относится к способу лечения посредством применения трансдермальной терапевтической системы по изобретению на коже пациента-человека в течение по меньшей мере 24 часов или 1 дня, по меньшей мере 48 часов или 2 дней или по меньшей мере 72 часов или 3 дней, и/или до 168 часов или 7 дней, до 120 часов или 5 дней, или до 96 часов или 4 дней. Трансдермальную терапевтическую систему по изобретению можно, в частности, применять на коже пациента-человека в течение 24 часов или 1 дня, 48 часов или 2 дней или 84 часов или 3,5 дня.
[0249] Соответственно изобретение также относится к способу лечения с режимом замены ТТС один раз в день (интервал введения 24 часа или 1 день), с режимом замены ТТС два раза в неделю (интервал введения 84 часа или 3,5 дня) или с режимом замены ТТС один раз в неделю (интервал введения 168 часов или 7 дней) примерно в одно и то же время суток. [0250] В таком способе, как описано ранее, трансдермальная терапевтическая система может обеспечить уменьшение по меньшей мере одного связанного с применением азенапина побочного эффекта по сравнению с эквивалентной дозой азенапина для сублингвального применения.
[0251] В другом варианте осуществления настоящее изобретение также относится к способу уменьшения у пациента по меньшей мере одного связанного с применением азенапина побочного эффекта по сравнению с эквивалентной дозой азенапина для сублингвального применения, причем способ включает применение трансдермальной терапевтической системы по изобретению.
[0252] Изобретение также относится к способу уменьшения по меньшей мере одного связанного с применением азенапина побочного эффекта у пациента, проходящего терапию азенапином для сублингвального применения, при этом указанный способ включает
a) отмену терапии азенапином для сублингвального применения; и
b) применение трансдермальной терапевтической системы по изобретению на коже пациента, причем трансдермальная терапевтическая система обеспечивает уменьшение по меньшей мере одного связанного с применением азенапина побочного эффекта по сравнению с эквивалентной дозой азенапина для сублингвального применения.
[0253] В таком способе трансдермальная терапевтическая система может доставлять количество азенапина, эквивалентное количеству азенапина, которое исходно обеспечивалось терапией азенапином для сублингвального применения.
[0254] Относительно постоянная концентрация азенапина в плазме крови может быть описана несколькими фармакокинетическими параметрами, полученными в клиническом исследовании in vivo с участием людей.
[0255] Таким образом, в некоторых вариантах осуществления трансдермальная терапевтическая система по настоящему изобретению:
обеспечивает транс дермальную доставку со средней скоростью высвобождения 0,5-20 мг/сут, 0,5-20 мг/24 ч, 500-20 000 мкг/сут, 500-20 000 мкг/24 ч, 0,021-0,833 мг/ч или 21-833 мкг/ч, предпочтительно 1,0-15 мг/сут, 1,0-15 мг/24 ч, 1000-15 000 мкг/сут, 1000-15000 мкг/24 ч, 0,042-0,625 мг/ч или 42-625 мкг/ч, более предпочтительно 2,0-10 мг/сут, 2,0-10 мг/24 ч, 2000-10 000 мкг/сут, 2000-10 000 мкг/24 ч, 0,083-0,417 мг/ч или 83-417 мкг/ч в течение по меньшей мере 48 часов или 2 дней применения, или обеспечивает транс дермальную доставку со средней скоростью высвобождения 0,5-20 мг/сут, 0,5-20 мг/24 ч, 500-20 000 мкг/сут, 500-20000 мкг/24 ч, 0,021 0,833 мг/ч или 21-833 мкг/ч, предпочтительно 1,0-15 мг/сут, 1,0-15 мг/24 ч, 1000-15 000 мкг/сут, 1000-15 000 мкг/24 ч, 0,042-0,625 мг/ч или 42-625 мкг/ч, более предпочтительно 2,0-10 мг/сут, 2,0-10 мг/24 ч, 2000-10 000 мкг/сут, 2000-10 000 мкг/24 ч, 0,083-0,417 мг/ч или 83-417 мкг/ч в течение по меньшей мере 72 часов или 3 дней применения, или обеспечивает трансдермальную доставку со средней скоростью высвобождения 0,5-20 мг/сут, 0,5-20 мг/24 ч, 500-20000 мкг/сут, 500-20000 мкг/24 ч, 0,021-0,833 мг/ч или 21-833 мкг/ч, предпочтительно 1,0-15 мг/сут, 1,0-15 мг/24 ч, 1000-15 000 мкг/сут, 1000-15000 мкг/24 ч, 0,042-0,625 мг/ч или 42-625 мкг/ч, более предпочтительно 2,0-10 мг/сут, 2,0-10 мг/24 ч, 2000-10 000 мкг/сут, 2000-10 000 мкг/24 ч, 0,083-0,417 мг/ч или 83-417 мкг/ч в течение по меньшей мере 84 часов или 3,5 дня применения.
[0256] Кроме того, в некоторых вариантах осуществления трансдермальная терапевтическая система по настоящему изобретению:
обеспечивает трансдермальную доставку с показателем AUC0-48 от 20 до 300 (нг/мл)⋅ч или от более 300 до 450 (нг/мл)⋅ч и предпочтительно от 30 до 200 (нг/мл)⋅ч, или обеспечивает трансдермальную доставку с показателем AUC0-72 от 30 до 400 (нг/мл)⋅ч или от более 400 до 600 (нг/мл)⋅ч и предпочтительно от 50 до 300 (нг/мл)⋅ч, или обеспечивает трансдермальную доставку с показателем AUC0-84 от 35 до 450 (нг/мл)⋅ч или от более 450 до 700 (нг/мл)⋅ч и предпочтительно от 60 до 350 (нг/мл)⋅ч.
[0257] И кроме того, в некоторых вариантах осуществления трансдермальная терапевтическая система по настоящему изобретению:
обеспечивает трансдермальную доставку с соотношением показателей Cmax и С48 менее 2,0, предпочтительно менее 1,5 и более предпочтительно менее 1,3, или обеспечивает трансдермальную доставку с соотношением показателей Cmax и С72 менее 3,0, предпочтительно менее 2,5 и более предпочтительно менее 2,0, или
обеспечивает транс дермальную доставку с соотношением показателей Cmax и C84 менее 3,5, предпочтительно менее 3,0, более предпочтительно менее 2,5 и наиболее предпочтительно менее 2,0.
[0258] И кроме того, в некоторых вариантах осуществления трансдермальная терапевтическая система по настоящему изобретению:
обеспечивает транс дермальную доставку с показателем Cmax от 0,5 до 10 нг/мл и предпочтительно от 1 до 8 нг/мл.
[0259] В таких вариантах осуществления, как описано ранее, ТТС может быть предназначена для использования в способе лечения пациента-человека, при этом трансдермальная терапевтическая система обеспечивает уменьшение по меньшей мере одного связанного с применением азенапина побочного эффекта по сравнению с эквивалентной дозой азенапина для сублингвального применения.
ПРОЦЕСС ПРОИЗВОДСТВА
[0260] Изобретение дополнительно относится к процессу производства матричного слоя для применения в трансдермальной терапевтической системе и соответствующей структуре матричного слоя и соответствующей ТТС.
[0261] Согласно изобретению, процесс производства матричного слоя для применения в трансдермальной терапевтической системе включает следующие стадии:
1) объединение в растворителе по меньшей мере таких компонентов, как азенапин, акриловый полимер, дополнительный полимер, α-токоферол и аскорбилпальмитат с получением композиции для покрытия;
2) нанесение композиции для покрытия на защитный слой, или удаляемую защитную подложку, или любую промежуточную подложку; и
3) высушивание нанесенной композиции для покрытия с получением матричного слоя.
[0262] В некоторых вариантах осуществления на стадии 1) в растворителе объединяют по меньшей мере компоненты азенапин, акриловый полимер, дополнительный полимер, α-токоферол, аскорбилпальмитат и метабисульфит натрия с получением композиции для покрытия.
[0263] В этом процессе производства, предпочтительно на стадии 1) растворяют азенапин с получением композиции для покрытия.
[0264] В вышеописанном процессе растворитель предпочтительно выбирают из спиртовых растворителей, в частности метанола, этанола, изопропанола и их смесей, и из неспиртовых растворителей, в частности этилацетата, гексана, н-гептана, гептанов, петролейного эфира, толуола и их смесей, и более предпочтительно выбирают из этанола и этилацетата.
[0265] В некоторых вариантах осуществления полимер в описанном выше процессе представляет собой акриловый полимер и предпочтительно сополимер на основе винилацетата, 2-этилгексилакрилата, 2-гидроксиэтилакрилата и глицидилметакрилата или сополимер на основе винилацетата, 2-этилгексилакрилата и 2-гидроксиэтилакрилата, который предоставляется в виде раствора и предпочтительно в виде раствора в этилацетате, н-гептане, гептанах, метаноле, этаноле или любой их смеси с содержанием твердых веществ от 30 до 60 мас. %.
[0266] В некоторых предпочтительных вариантах осуществления полимер представляет собой акриловый полимер, и при этом полимер является сшитым. Как подробно описано выше, коммерчески доступные акриловые полимеры могут быть предоставлены в виде раствора со сшивающим агентом или без него. Кроме того, дополнительный сшивающий агент (то есть сшивающий агент, который не поставляется с полимером) может быть добавлен на стадии 1) процесса производства.
[0267] Таким образом, в некоторых вариантах осуществления на стадии 1) для получения композиции для покрытия используют дополнительный сшивающий агент, причем сшивающий агент предпочтительно представляет собой алюминиевый или титановый сшивающий агент. В альтернативных вариантах осуществления на стадии 1) для получения композиции для покрытия не используют дополнительный сшивающий агент.
[0268] Если на стадии 1) используется раствор полимера со сшивающим агентом и/или используется дополнительный сшивающий агент, полимер становится сшитым. В альтернативных вариантах осуществления полимер представляет собой акриловый полимер, и при этом полимер не является сшитым.
[0269] На стадии 3) высушивание предпочтительно выполняют в одном или более циклах при комнатной температуре и/или при температуре 65-100°С, более предпочтительно 70-90°С.
ПРИМЕРЫ
[0270] Настоящее изобретение теперь будет более полно описано со ссылкой на прилагаемые примеры. Однако следует понимать, что нижеследующее описание является только иллюстративным и никоим образом не должно восприниматься как ограничивающее настоящее изобретения. Численные значения, представленные в примерах в отношении количества ингредиентов в композиции или массы на единицу площади, могут незначительно отличаться из-за вариабельности производственного процесса.
СПРАВОЧНЫЕ ПРИМЕРЫ 1А-С
Композиция для покрытия
[0271] Составы азенапин-содержащих композиций для покрытия для справочных примеров 1а-1с обобщены в таблице 1.1 ниже. Составы основаны на массовых процентах, что также указано в таблице 1.1.
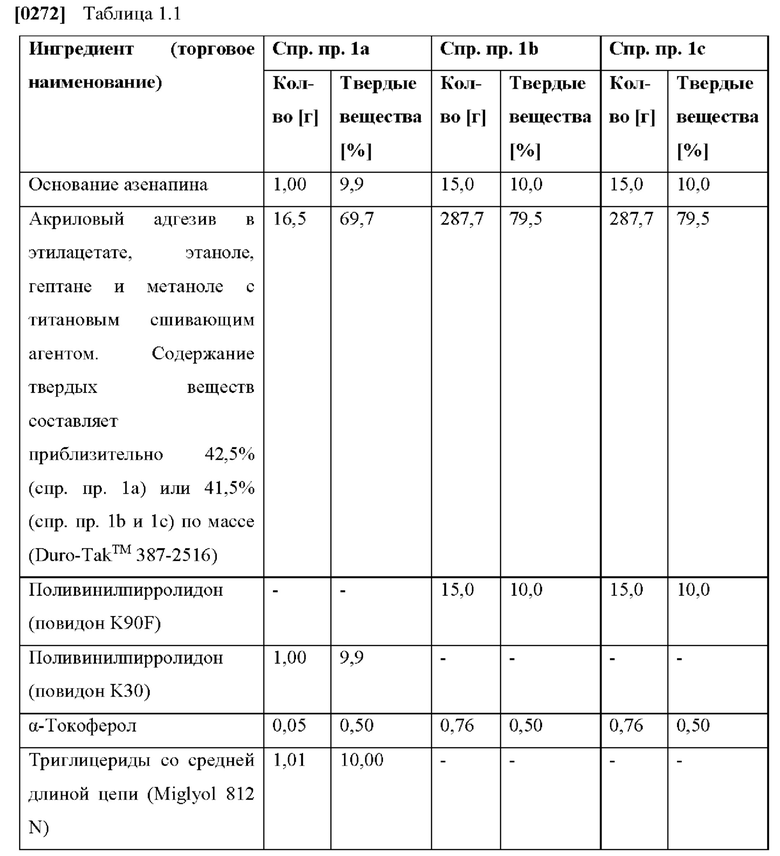
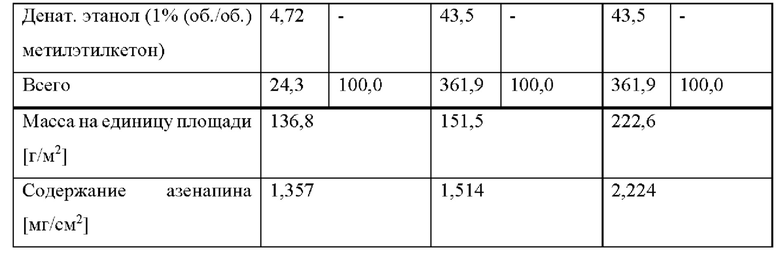
Изготовление композиции для покрытия
[0273] Для справочного примера 1а в сосуд из нержавеющей стали загружали α-токоферол. Добавляли триглицериды со средней длиной цепи, чувствительный к давлению акриловый адгезив Duro-Tak™ 387-2516 и поливинилпирролидон, после чего смесь перемешивали до получения прозрачного раствора (около 40 мин). Медленно добавляли азенапин и растворяли при перемешивании до получения прозрачного раствора.
[0274] Для справочных примеров 1b и 1с в мерный стакан загружали α-токоферол, азенапин и этанол. Добавляли чувствительный к давлению акриловый адгезив Duro-Tak™ 387-2516, после чего смесь перемешивали до получения прозрачного раствора (около 10 мин). При перемешивании медленно добавляли поливинилпирролидон и растворяли при перемешивании до получения прозрачного раствора.
Нанесение композиции для покрытия по справочным примерам 1а и 1b
[0275] Полученную азенапин-содержащую композицию для покрытия наносили на пленку из полиэтилентерефталата (силиконизированная с одной стороны, толщиной 75 мкм, которая может служить в качестве удаляемой защитной подложки) и сушили в течение прибл. 10 мин при комнатной температуре и 20 мин при 80°С. Толщина покрытия обеспечивала массу на единицу площади 136,8 г/м2 (спр. пр. 1а) и 151,5 (спр. пр. 1b) соответственно. На высушенную пленку наслаивали защитный слой из полиэтилентерефталата (толщиной 23 мкм) с получением азенапин-содержащей структуры самоклеящегося слоя.
Нанесение композиции для покрытия, справочный пример 1с
[0276] Полученную азенапин-содержащую композицию для покрытия наносили на пленку из полиэтилентерефталата (силиконизированная, толщиной 100 мкм, которая может служить в качестве удаляемой защитной подложки) и сушили в течение прибл. 10 мин при комнатной температуре и 20 мин при 80°С. Толщина покрытия обеспечивала массу на единицу площади матричного слоя 111,3 г/м2. На первую часть высушенной пленки наслаивали защитный слой из полиэтилентерефталата (толщиной 23 мкм). Затем удаляли эту полиэтилентерефталатную пленку (силиконизированную, толщиной 100 мм, которая может служить в качестве удаляемой защитной подложки) с этой первой части и наслаивали адгезивный участок первой части на адгезивный участок второй немодифицированной части высушенной пленки (содержащей удаляемую защитную подложку, но не защитный слой). В результате этого получали азенапин-содержащую структуру самоклеящегося слоя с массой на единицу площади матричного слоя 222,6 г/м2, с защитным слоем и удаляемой защитной подложкой.
Изготовление ТТС (относится ко всем примерам)
[0277] Затем штампом высекали отдельные системы (ТТС) из азенапин-содержащей структуры самоклеящегося слоя. В конкретных вариантах осуществления ТТС, как описано выше, может быть снабжена дополнительным самоклеящимся слоем с большей площадью поверхности, предпочтительно с закругленными углами, содержащим чувствительный к давлению адгезивный матричный слой, не содержащий активный агент. Преимуществом является то, когда на основании только своих физических свойств ТТС недостаточно прилипает к коже и/или когда азенапин-содержащий матричный слой во избежание излишних потерь имеет ярко выраженные углы (квадратной или прямоугольные формы) Затем ТТС высекают штампом и запечатывают в пакеты из первичного упаковочного материала, как это принято в данной области техники, то есть в защитной атмосфере с продувкой газообразным азотом.
Измерение скорости проникновения через кожу
[0278] Проникающее количество и соответствующие значения скорости проникновения через кожу ТТС, изготовленной в соответствии с примером 1а, а также справочными примерами 1b и 1с, определяли с помощью экспериментов in vitro, проводимых в диффузионной ячейке Франца на 7,0 мл в соответствии с рекомендациями ОЭСР (принятыми 13 апреля 2004 г). Использовали расслоенную кожу человека, полученную после косметической хирургической операции (женский живот, дата рождения пациентки 1955 г.). Для подготовки кожи толщиной 800 мкм с неповрежденным эпидермисом для всех ТТС использовали дерматом. Из ТТС высекали штампом элементы с площадью поверхности 1,151 см2. Измеряли количество азенапина, проникающее в рецепторную среду ячеек Франца (фосфатный буферный раствор рН 5,5 с 0,1% раствором азида натрия в физиологическом растворе в качестве антибактериального агента) при температуре 32±1°С, и рассчитывали соответствующую скорость проникновения через кожу. Результаты представлены в таблице 1.2 и на Фиг. 1а.
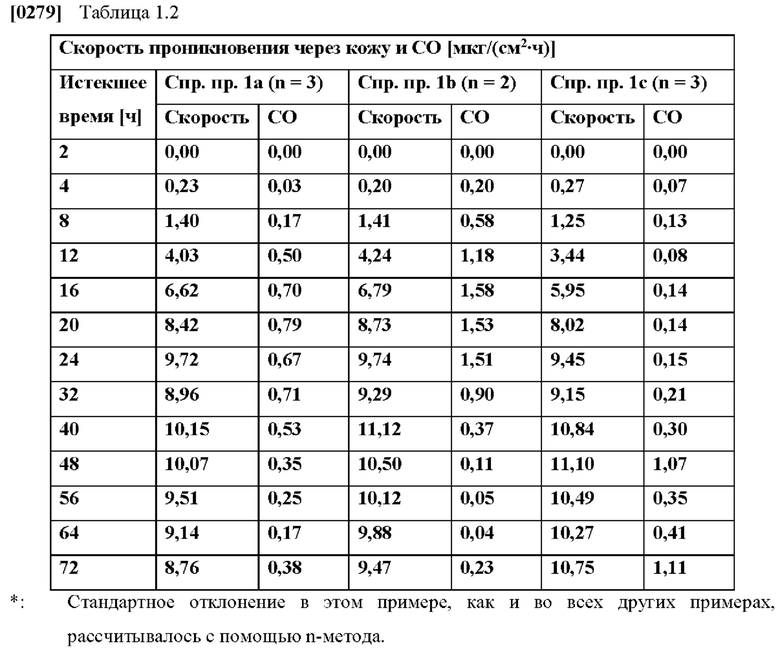
Использование азенапина
[0280] Использование азенапина через 72 часа рассчитывали на основании совокупного проникающего количества через 72 часа и изначального содержания азенапина. Результаты представлены в таблице 1.3 и на Фиг. 1b.

[0282] Эксперименты in vitro демонстрируют хорошую скорость проникновения через кожу и использование азенапина из ранее разработанных эталонных составов (спр. пр. 1b и 1с). Спр. примеры 1b и 1с соответствуют по составу спр. примеру 2d (за исключением более высокой массы на единицу площади), с применением которого было успешно проведено клиническое исследование in vivo (см. ниже).
ПРИМЕРЫ 2А, 2В И СПРАВОЧНЫЕ ПРИМЕРЫ 2С, 2D
Композиция для покрытия
[0283] Составы азенапин-содержащих композиций для покрытия для примеров 2а и 2b, а также для справочных примеров 2b и 2d обобщены в таблице 2.1 ниже. Составы основаны на массовых процентах, что также указано в таблице 2.1.
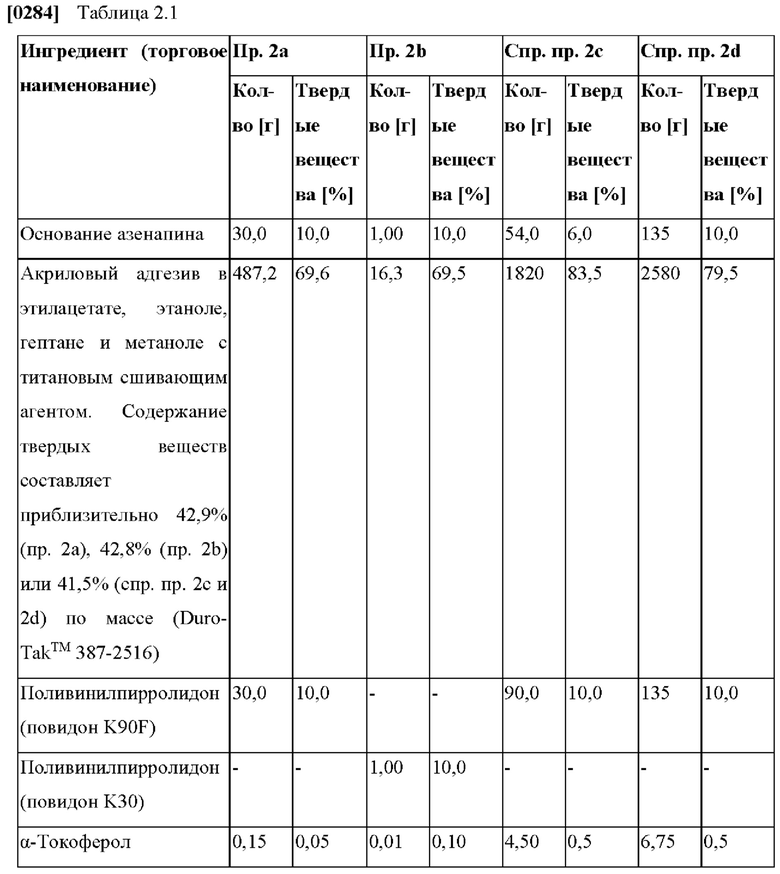
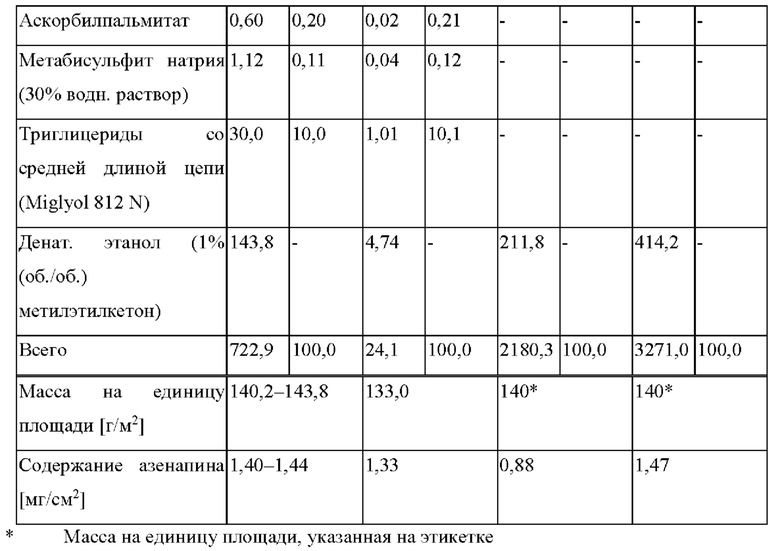
Изготовление композиции для покрытия
[0285] Для примера 2а в мерный стакан загружали α-токоферол. Добавляли аскорбилпальмитат, триглицериды со средней длиной цепи и раствор метабисульфита натрия. Добавляли чувствительный к давлению акриловый адгезив Duro-Tak™ 387-2516, после чего смесь перемешивали до получения прозрачного раствора. При перемешивании медленно добавляли поливинилпирролидон и растворяли при перемешивании до получения прозрачного раствора. Добавляли приблизительно 100 г этанола и перемешивали полученный раствор. Азенапин переносили в мерный стакан и перемешивали смесь. Добавляли остаток этанола и перемешивали раствор.
[0286] Для примера 2b в мерный стакан загружали азенапин. К азенапину добавляли в следующем порядке: α-токоферол, аскорбилпальмитат, триглицериды со средней длиной цепи, раствор метабисульфита натрия, чувствительный к давлению акриловый адгезив Duro-Tak™ 387-2516, поливинилпирролидон и этанол. Полученную смесь перемешивали. [0287] Для справочных примеров 2с и 2d в сосуд из нержавеющей стали загружали α-токоферол. Добавляли чувствительный к давлению акриловый адгезив Duro-Tak™ 387-2516, после чего смесь перемешивали до получения прозрачного раствора. При перемешивании медленно добавляли поливинилпирролидон и растворяли при перемешивании до получения прозрачного раствора. Азенапин суспендировали в этаноле и переносили в сосуд из нержавеющей стали. После добавления азенапина смесь перемешивали до получения прозрачного раствора слегка желтого цвета.
Нанесение композиции для покрытия, примеры 2а и 2b
[0288] Информацию о процессе нанесения покрытия см. в справочном примере 1а и справочном примере 1b. В примере 2b толщина покрытия обеспечивала массу на единицу площади 133,0. Для примера 2а получали различные пленки с массой на единицу площади от 140,2 до 143,8 г/м2. На высушенную пленку наслаивали защитный слой из полиэтилентерефталата (толщиной 23 мкм) с получением азенапин-содержащей структуры самоклеящегося слоя.
Нанесение композиции для покрытия по справочным примерам 2с и 2d
[0289] Полученную азенапин-содержащую композицию для покрытия наносили на пленку из полиэтилентерефталата (силиконизированная с одной стороны, толщиной 75 мкм, которая может служить в качестве удаляемой защитной подложки) и сушили в течение прибл. 15 мин при 80°С. Толщина покрытия обеспечивала массу на единицу площади приблизительно 140 г/м2 в соответствии с требованиями, указанными на этикетке (далее в тексте ссылка на значение, указанное на этикетке, подразумевает, что фактическое значение находится в пределах допуска ± 7,5% от указанного на этикетке значения). На высушенную пленку наслаивали защитный слой из полиэтилентерефталата (толщиной 23 мкм) с получением азенапин-содержащей структуры самоклеящегося слоя. Количество остаточных растворителей соответствовало требованиям руководства ICH Q3C (R3), т.е.: метанол ≤3000 м.д., этанол ≤5000 м.д., этилацетат ≤5000 м.д. и н-гептан ≤5000 м.д.
Изготовление ТТС
[0290] Для примеров 2а и 2b см. пример 1. Для справочных примеров 2с и 2d штампом высекали отдельные системы (ТТС) размером 10 см2 (спр. пр. 2с) и 15 см2 (спр. пр. 2d) из азенапин-содержащей структуры самоклеящегося слоя.
Измерения стабильности
[0291] Испытание стабильности при длительном хранении было проведено для примера 2а и для справочных примеров 2с и 2d в различных условиях испытаний, то есть при хранении при температуре 25°С и относительной влажности (OB) 60% и при температуре 40°С и OB 75%. Все измерения стабильности, описанные в данном документе (т.е. касающиеся всех примеров и справочных примеров), были проведены в соответствии с рекомендациями ICH по стабильности Q1A (R2). В разные моменты времени из ТТС брали образцы, экстрагировали подходящим растворителем для экстракции, и определяли количество основания азенапина, а также различных возможных продуктов разложения с помощью специфического метода количественной ВЭЖХ с УФ-фотометрическим детектором на основании содержания азенапина, рассчитанного исходя из (фактической) массы на единицу площади испытываемой ТТС. Количество других родственных примесей указано во всем описании в соответствии с рекомендациями ICH по стабильности Q1A (R2). Результаты представлены в таблицах 2.2-2.7. График суммарного содержания всех родственных примесей (то есть возможных продуктов разложения) показан на Фиг. 2а и 2b.
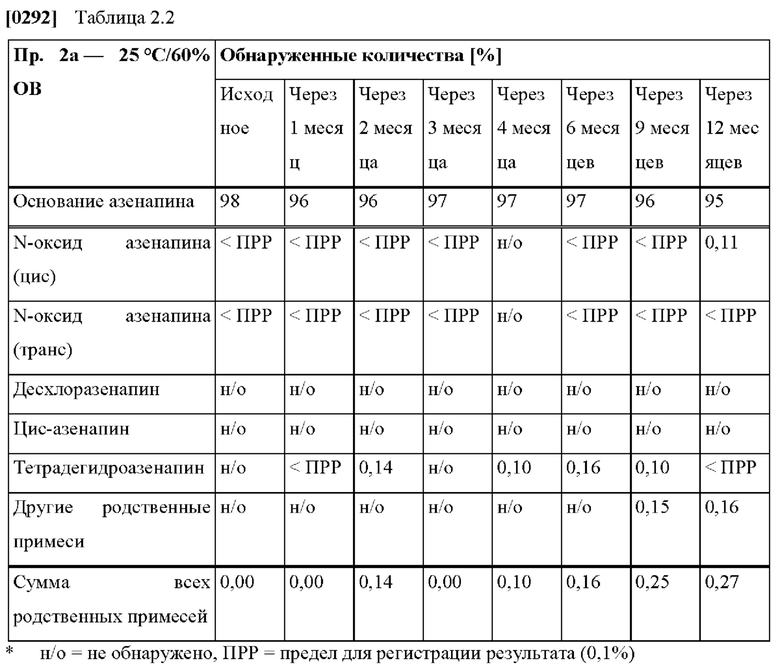

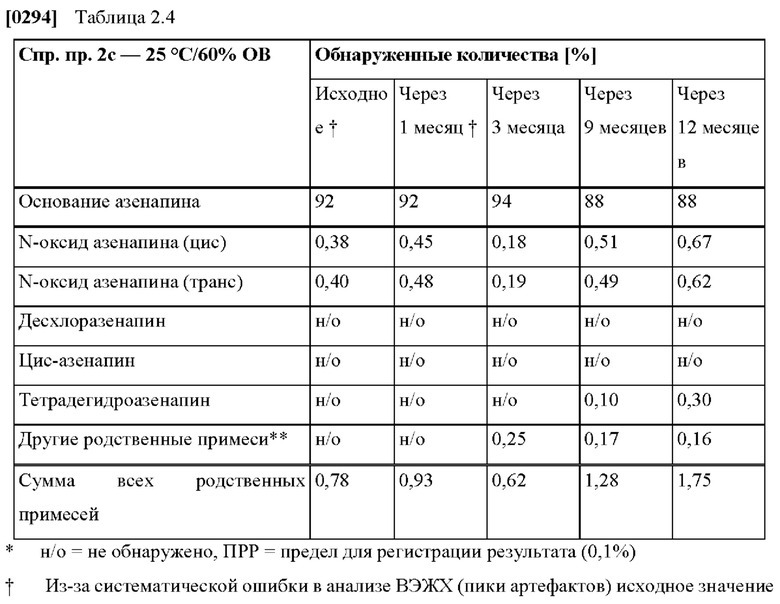
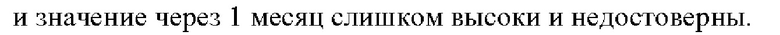
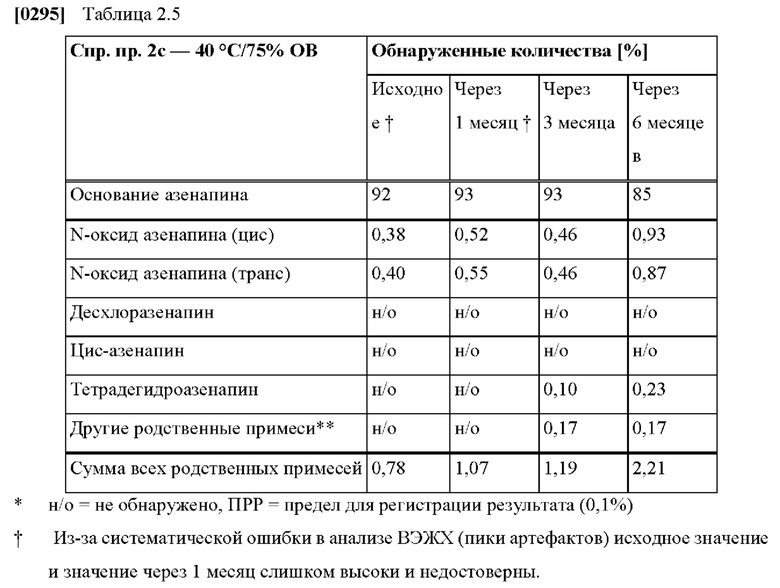
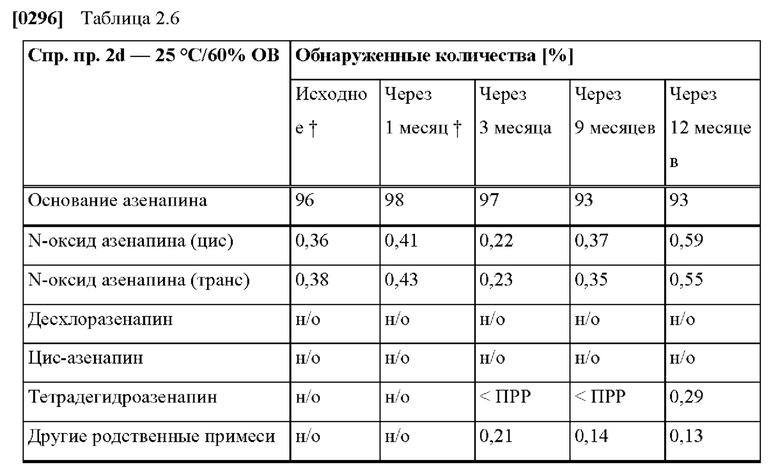

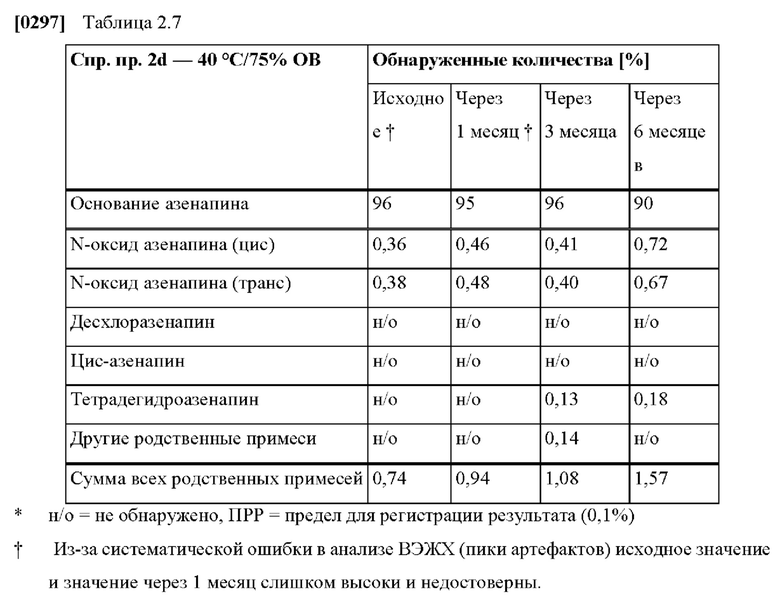
[0298] Данные по стабильности показывают, что в некоторых вариантах осуществления изобретения исходная стабильность, а также стабильность при хранении были существенно улучшены по сравнению с ранее разработанными эталонными составами (спр. пр. 2с и 2d), как с точки зрения количества основания азенапина (в частности, относительно количества основания азенапина, оставшегося после хранения), так и суммы всех родственных примесей (т.е. возможных продуктов разложения).
ПРИМЕРЫ 3А-Е
Композиция для покрытия
[0299] Составы азенапин-содержащих композиций для покрытия для примеров 3а-е обобщены в таблице 3.1 ниже. Составы основаны на массовых процентах, что также указано в таблице 3.1.
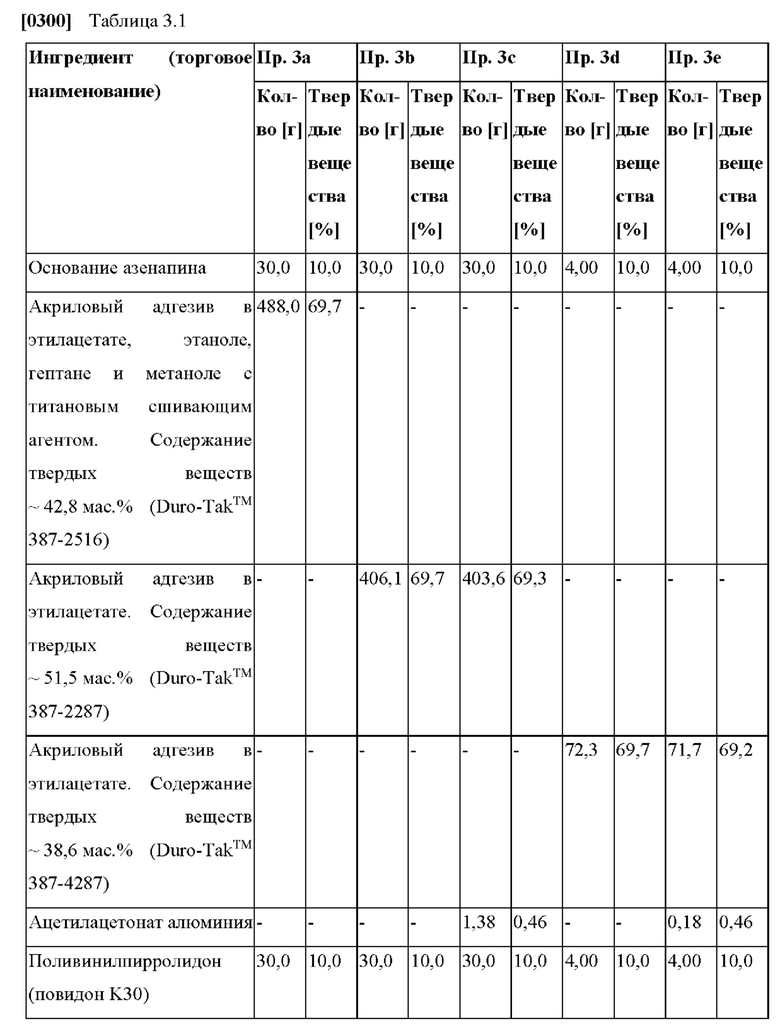
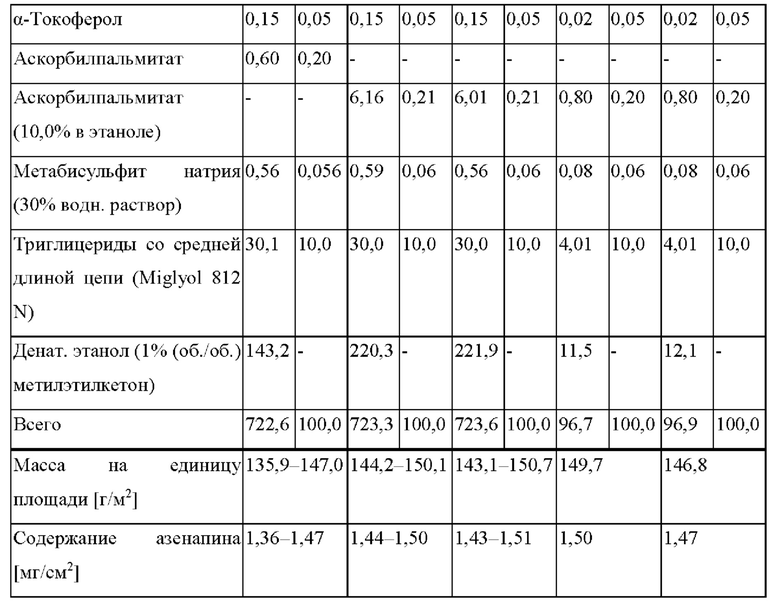
Изготовление композиции для покрытия
[0301] Композицию для покрытия по примеру 3а получали так, как описано в примере 2а.
[0302] Для примеров 3b и 3с в мерный стакан загружалиα-токоферол. Добавляли в указанном порядке триглицериды со средней длиной цепи, раствор метабисульфита натрия и чувствительный к давлению акриловый адгезив Duro-Tak™ 387-2287, после чего перемешивали смесь. При перемешивании по каплям добавляли раствор аскорбилпальмитата, после чего при перемешивании добавляли поливинилпирролидон, и для примера 3с добавляли ацетилацетонат алюминия. Несколькими порциями в смесь с этанолом переносили азенапин и перемешивали полученную смесь.
[0303] Для примеров 3d и 3е в мерный стакан загружали α-токоферол. Добавляли в указанном порядке триглицериды со средней длиной цепи, раствор метабисульфита натрия, чувствительный к давлению акриловый адгезив Duro-Tak™ 387-4287, раствор аскорбилпальмитата и поливинилпирролидон, после чего перемешивали смесь. Добавляли азенапин и перемешивали смесь. При перемешивании добавляли этанол (пр. 3d) или растворяли в этаноле ацетилацетонат алюминия и добавляли при перемешивании (пр. 3е).
Нанесение композиции для покрытия
[0304] Информацию о процессе нанесения покрытия см. в справочном примере 1а и справочном примере 1b. Толщина покрытия обеспечивала массу на единицу площади матричного слоя 149,7 г/м2 (пример 3d) и 146,8 г/м2 (пример 3е) соответственно. Для примеров 3а, 3b и 3с изготавливали разные пленки с массой на единицу площади от 135,9 до 147,0 г/м2, от 144,2 до 150,1 г/м2 и от 143,1 до 150,7 г/м2 соответственно. На высушенную пленку наслаивали защитный слой из полиэтилентерефталата (толщиной 23 мкм) с получением азенапин-содержащей структуры самоклеящегося слоя.
Изготовление ТТС
[0305] См. пример 1.
Измерения стабильности
[0306] Испытание стабильности при длительном хранении было проведено для примеров 3а, 3с в различных условиях испытаний, то есть при хранении при температуре 25°С и относительной влажности (OB) 60% и при температуре 40°С и OB 75%. В разные моменты времени из ТТС брали образцы, экстрагировали подходящим растворителем для экстракции, и определяли количество основания азенапина, а также различных возможных продуктов разложения с помощью специфического метода количественной ВЭЖХ с УФ-фотометрическим детектором на основании содержания азенапина, рассчитанного исходя из (фактической) массы на единицу площади испытываемой ТТС. Результаты представлены в таблицах 3.2-3.7. График суммарного содержания всех родственных примесей (то есть возможных продуктов разложения) показан на Фиг. 3а и 3b.
[0307] Дополнительно таким же образом определяли количество основания азенапина, а также различных возможных продуктов распада для ТТС по примерам 2а, 2b, 3d и 3е при хранении при 5°С (упакованных в атмосфере N2, как описано выше) в течение 4,5, 4, 2 и 2 месяца соответственно. Результаты представлены в таблице 3.8 и на Фиг. 3с.
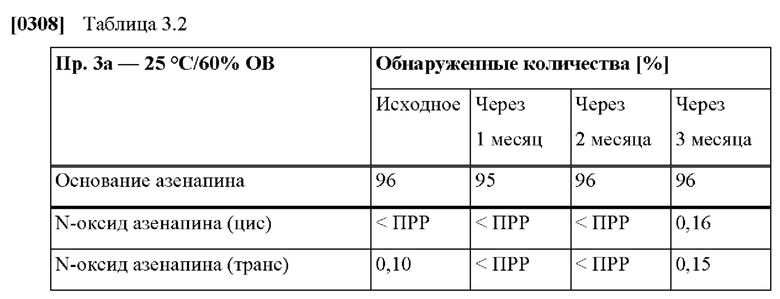
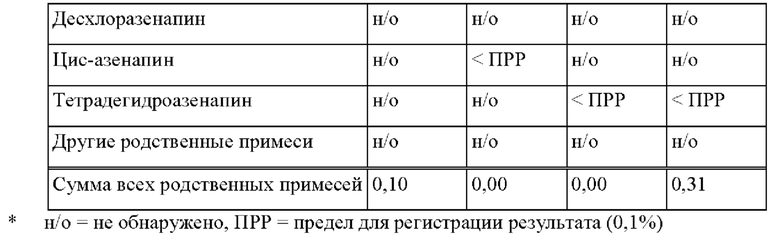
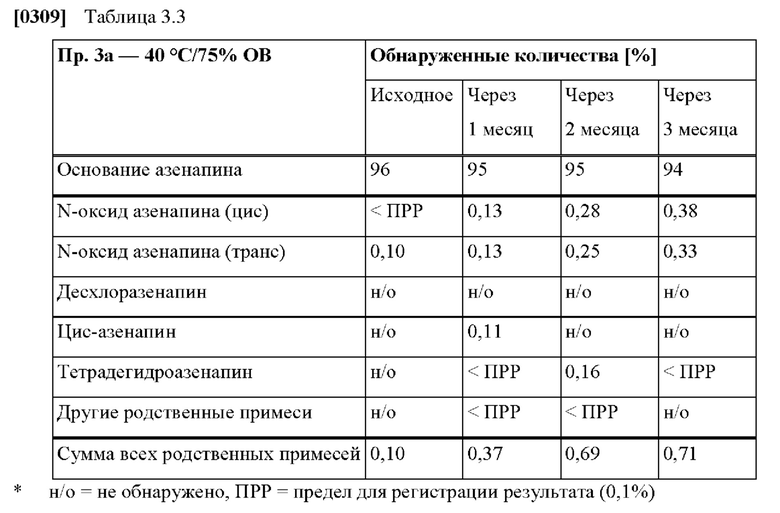
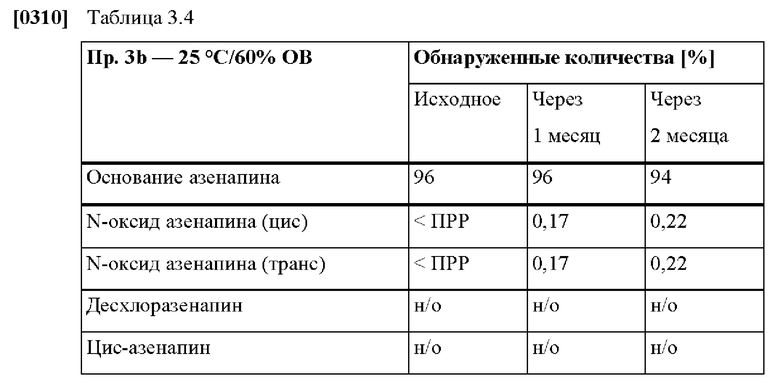

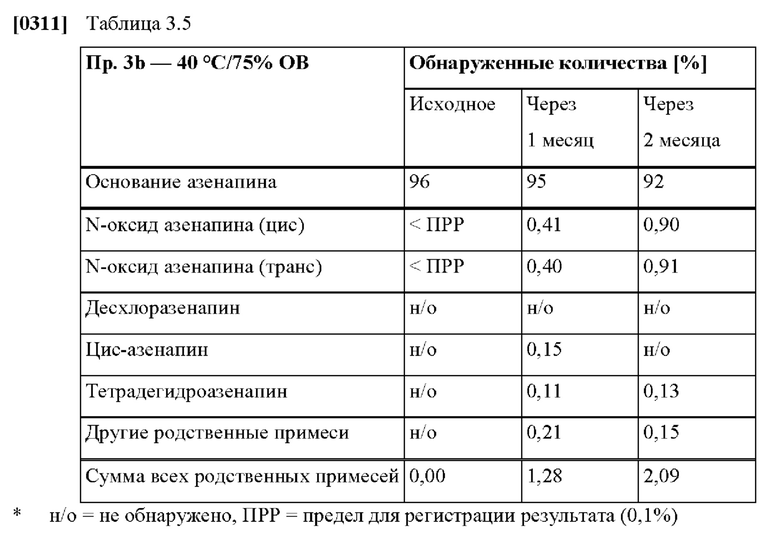
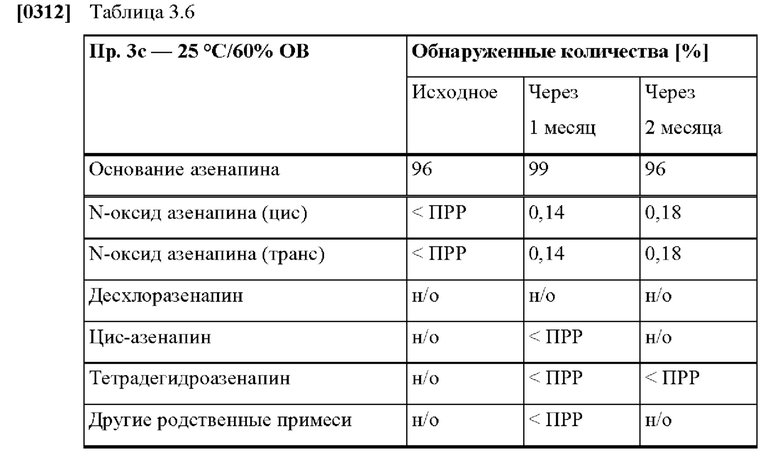

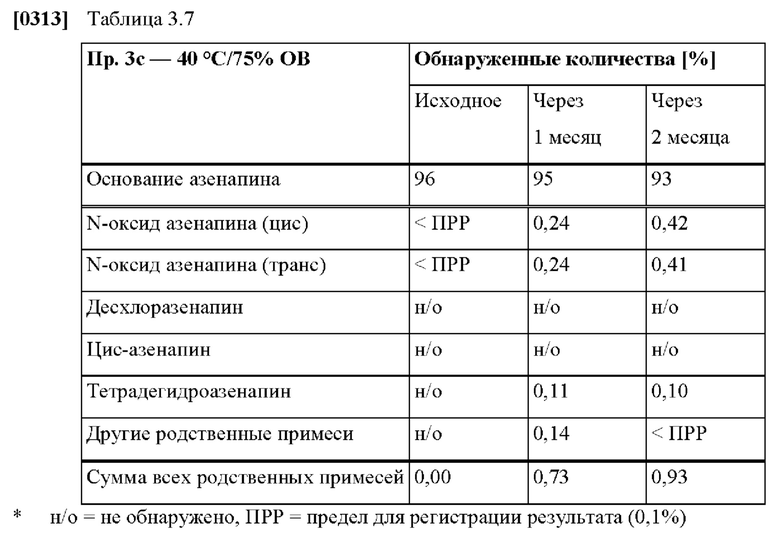
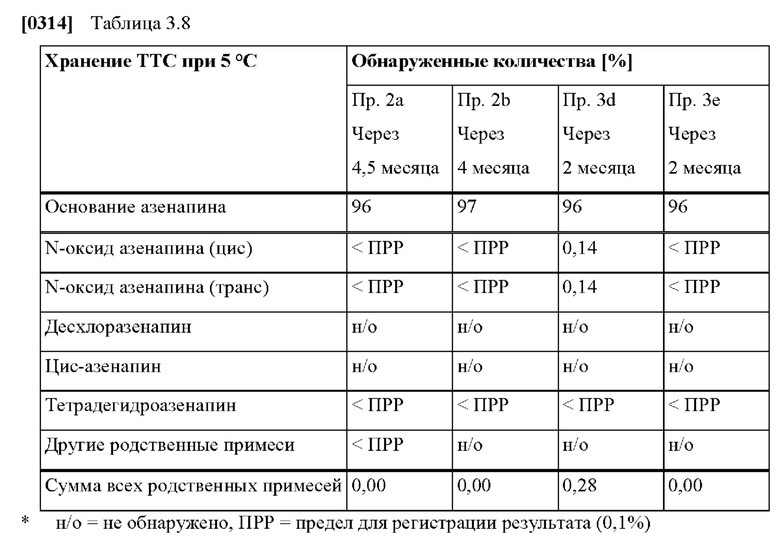
[0315] Результаты испытания стабильности демонстрируют, что в некоторых вариантах осуществления изобретения ТТС обеспечивают отличную изначальную стабильность, а также стабильность при хранении.
ПРИМЕРЫ 4А И В
Композиция для покрытия
[0316] Составы азенапин-содержащих композиций для покрытия для примеров 4а и 4b обобщены в таблице 4.1 ниже. Составы основаны на массовых процентах, что также указано в таблице 4.1.
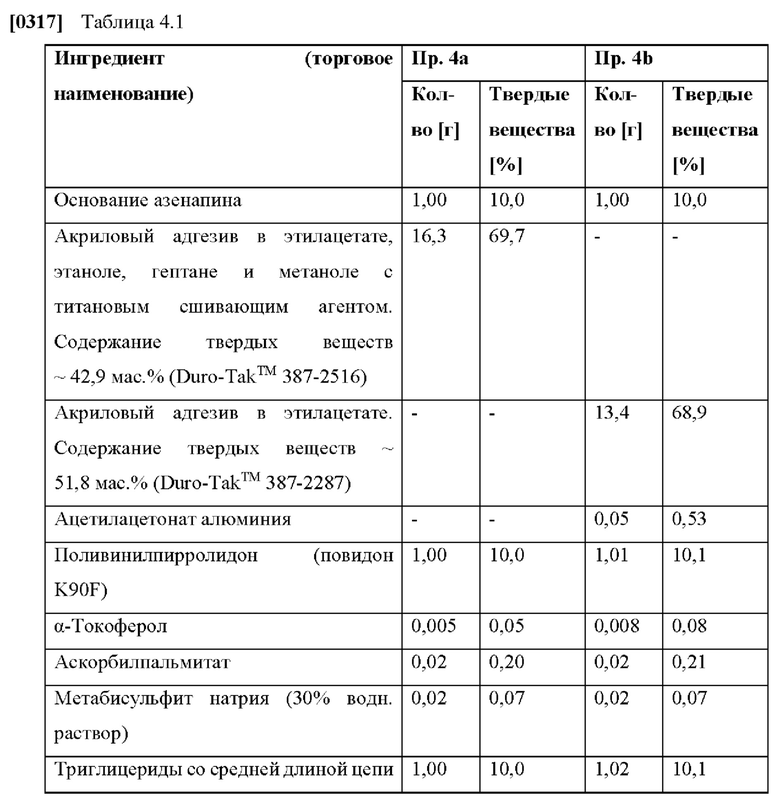
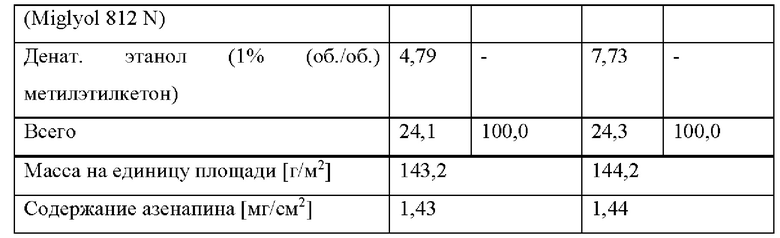
Изготовление композиции для покрытия
[0318] Композицию для покрытия по примеру 4а получали так, как описано в примере 2b.
[0319] Для примера 4b в мерный стакан загружали азенапин. К азенапину добавляли в следующем порядке: α-токоферол, аскорбилпальмитат, триглицериды со средней длиной цепи, раствор метабисульфита натрия, чувствительный к давлению акриловый адгезив Duro-Tak™ 387-2287 и поливинилпирролидон, и перемешивали полученную смесь. Растворяли ацетилацетонат алюминия в этаноле и при перемешивании добавляли в смесь.
Нанесение композиции для покрытия
[0320] Информацию о процессе нанесения покрытия см. в справочном примере 1а и справочном примере 1b. Толщина покрытия обеспечивала массу на единицу площади матричного слоя 143,2 г/м2 (пример 4а) и 144,2 г/м2 (пример 4b) соответственно. На высушенную пленку наслаивали защитный слой из полиэтилентерефталата (толщиной 23 мкм) с получением азенапин-содержащей структуры самоклеящегося слоя.
Изготовление ТТС
[0321] См. пример 1.
Измерение скорости проникновения через кожу
[0322] Проникающее количество и соответствующие значения скорости проникновения через кожу ТТС, изготовленной в соответствии с примерами 4а и 4b, а также справочным примером 1с, определяли с помощью экспериментов in vitro, проводимых в диффузионной ячейке Франца на 7,0 мл в соответствии с рекомендациями ОЭСР (принятыми 13 апреля 2004 г). Использовали расслоенную кожу человека, полученную после косметической хирургической операции (женский живот, дата рождения пациентки 1982 г.). Для подготовки кожи толщиной 800 мкм с неповрежденным эпидермисом для всех ТТС использовали дерматом. Из ТТС высекали штампом элементы с площадью поверхности 1,188 см2. Измеряли количество азенапина, проникающее в рецепторную среду ячеек Франца (фосфатный буферный раствор рН 5,5 с 0,1% раствором азида натрия в физиологическом растворе в качестве антибактериального агента) при температуре 32±1°С, и рассчитывали соответствующую скорость проникновения через кожу. Результаты представлены в таблице 4.2 и на Фиг. 4а.
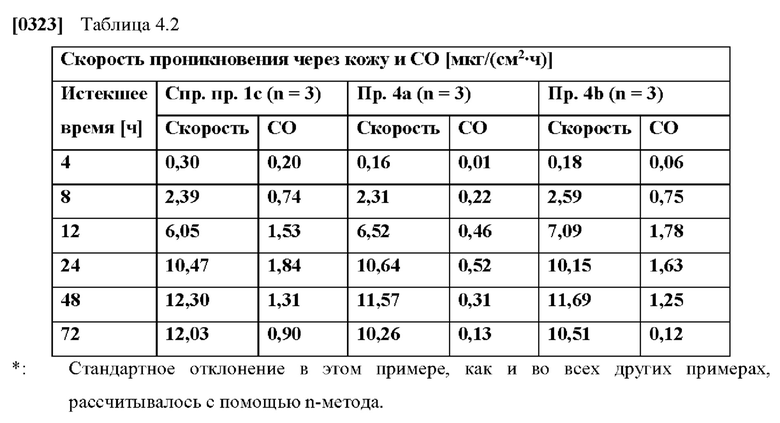
Использование азенапина
[0324] Использование азенапина через 72 часа рассчитывали на основании совокупного проникающего количества через 72 часа и изначального содержания азенапина. Результаты представлены в таблице 4.3 и на Фиг. 4b.

[0326] Эксперименты in vitro демонстрируют, что хорошая скорость проникновения через кожу и использование азенапина из ранее разработанного эталонного состава (спр. пр. 1с), могут неожиданно сохраняться для составов из некоторых вариантов осуществления настоящего изобретения, содержащих значительное количество триглицеридов со средней длиной цепи в качестве вещества, придающего клейкость, а также конкретную комбинацию стабилизаторов. Справочный пример 1 с соответствует составу справочного примера 2d (за исключением более высокой массы на единицу площади), с применением которого было успешно проведено клиническое исследование in vivo (см. ниже).
СПРАВОЧНЫЕ ПРИМЕРЫ 5А-С
Композиция для покрытия
[0327] Составы азенапин-содержащих композиций для покрытия для справочных примеров 5а, 5b и 5с обобщены в таблице 5.1 ниже. Составы основаны на массовых процентах, что также указано в таблице 5.1.
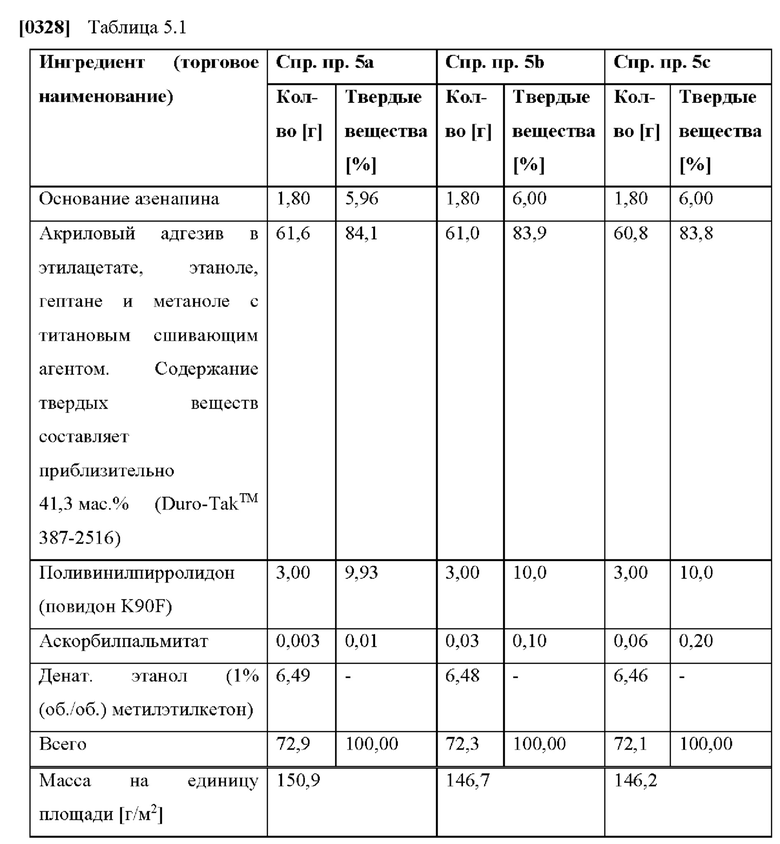

Изготовление композиции для покрытия
[0329] В мерный стакан загружали аскорбилпальмитат. Добавляли чувствительный к давлению акриловый адгезив Duro-Tak™ 387-2516, смесь перемешивали, и при перемешивании добавляли поливинилпирролидон. Последовательно добавляли азенапин и этанол, и смесь перемешивали до получения прозрачного раствора.
Нанесение композиции для покрытия
[0330] Информацию о процессе нанесения покрытия см. в справочном примере 1а и справочном примере 1b. Толщина покрытия обеспечивала массу на единицу площади матричного слоя 150,9 г/м2 (справочный пример 5а), 146,7 г/м2 (справочный пример 5b) и 146,2 г/м2 (справочный пример 5с) соответственно. На высушенную пленку наслаивали защитный слой из полиэтилентерефталата (толщиной 23 мкм) с получением азенапин-содержащей структуры самоклеящегося слоя.
Изготовление ТТС
[0331] См. пример 1.
Измерения стабильности
[0332] Исследовали стабильность ТТС из справочных примеров 5а-5с, хранившихся при 40°С и OB 75% в течение 2,5 месяца, а также ТТС из справочных примеров 5а и 5с, хранившихся при 25°С и OB 60% в течение 12 месяцев. Из ТТС брали образцы, экстрагировали подходящим растворителем для экстракции, и определяли количество основания азенапина, а также различных возможных продуктов разложения с помощью специфического метода количественной ВЭЖХ с УФ-фотометрическим детектором на основании содержания азенапина, рассчитанного исходя из (фактической) массы на единицу площади испытываемой ТТС. Результаты представлены в таблицах 5.2 и 5.3, а также на Фиг. 5а и 5b.
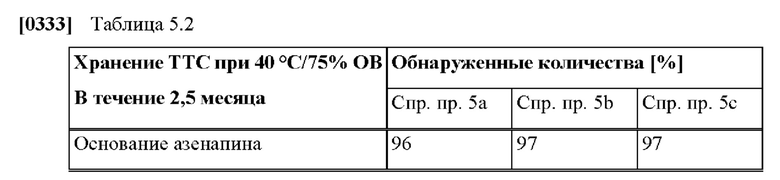
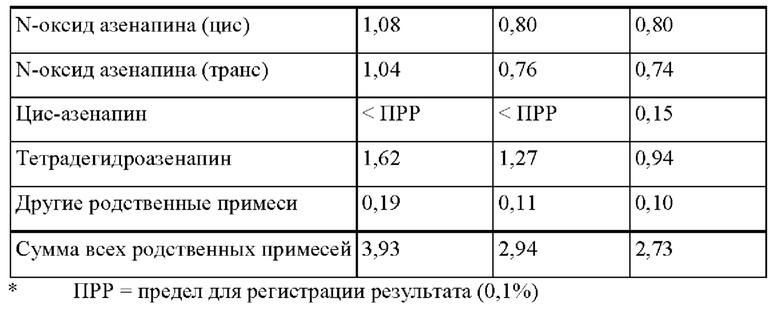
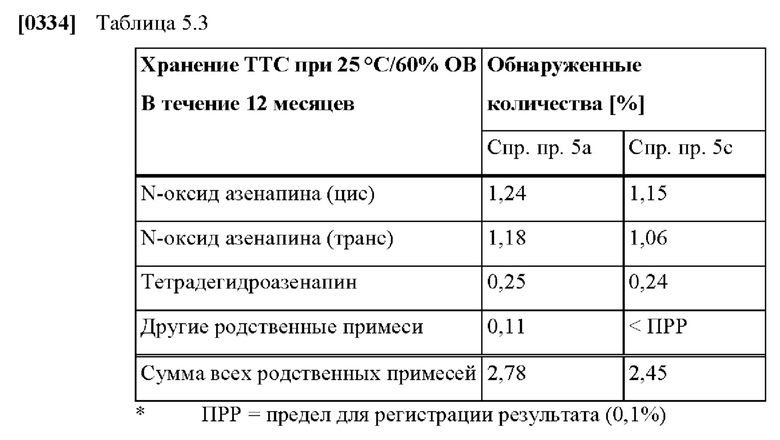
[0335] Данные по стабильности для справочных примеров 5а-с показывают, что присутствие и некоторые более высокие количества аскорбилпальмитата оказывают положительное влияние на исходную стабильность, а также стабильность при хранении составов азенапина, содержащих матричный слой на основе акрилового адгезива, и включающих в себя дополнительный полимер (поливинилпирролидон).
СПРАВОЧНЫЕ ПРИМЕРЫ 6A-D
Композиция для покрытия
[0336] Составы азенапин-содержащих композиций для покрытия для справочных примеров 6а, 6b, 6с и 6d обобщены в таблице 6.1 ниже. Составы основаны на массовых процентах, что также указано в таблице 6.1.
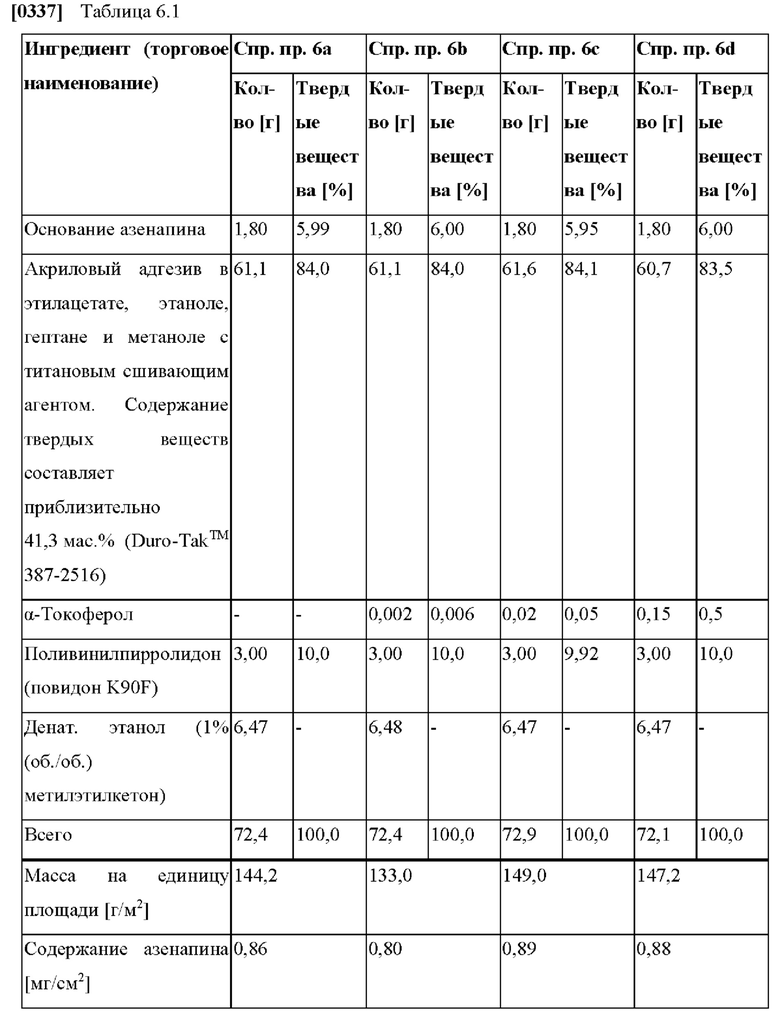
Изготовление композиции для покрытия
[0338] Для справочного примера 6а в мерный стакан загружали чувствительный к давлению акриловый адгезив Duro-Tak™ 387-2516. При перемешивании добавляли поливинилпирролидон. Последовательно добавляли азенапин и этанол, и смесь перемешивали.
[0339] Для справочных примеров 6b-6d в мерный стакан загружали α-токоферол. Добавляли чувствительный к давлению акриловый адгезив Duro-Tak™ 387-2516, смесь перемешивали, и при перемешивании добавляли поливинилпирролидон. Последовательно добавляли азенапин и этанол, и смесь перемешивали до получения прозрачного раствора.
Нанесение композиции для покрытия
[0340] Информацию о процессе нанесения покрытия см. в справочном примере 1а и справочном примере 1b. Толщина покрытия обеспечивала массу на единицу площади матричного слоя 144,2 г/м2 (справочный пример 6а), 133,0 г/м2 (справочный пример 6b), 149,0 г/м2 (справочный пример 6с) и 147,2 г/м2 (справочный пример 6d) соответственно. На высушенную пленку наслаивали защитный слой из полиэтилентерефталата (толщиной 23 мкм) с получением азенапин-содержащей структуры самоклеящегося слоя.
Изготовление ТТС
[0341] См. пример 1.
Измерения стабильности
[0342] Исследовали стабильность ТТС из справочных примеров 6a-6d, хранившихся при 40°С и OB 75% в течение 2,5 месяца, а также ТТС из справочных примеров 6а, 6с и 6d, хранившихся при 25°С и OB 60% в течение 12 месяцев. Из ТТС брали образцы, экстрагировали подходящим растворителем для экстракции, и определяли количество основания азенапина, а также различных возможных продуктов разложения с помощью специфического метода количественной ВЭЖХ с УФ-фотометрическим детектором на основании содержания азенапина, рассчитанного исходя из (фактической) массы на единицу площади испытываемой ТТС. Результаты представлены в таблицах 6.2 и 6.3, а также на Фиг. 6а и 6b.
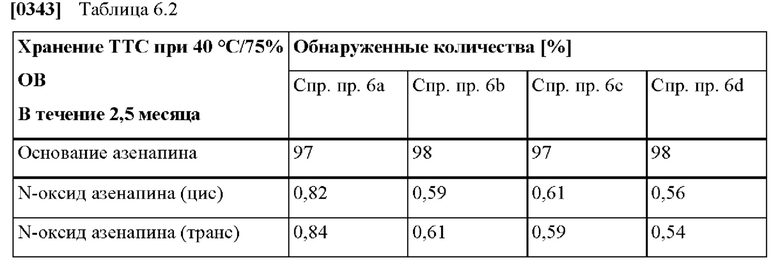
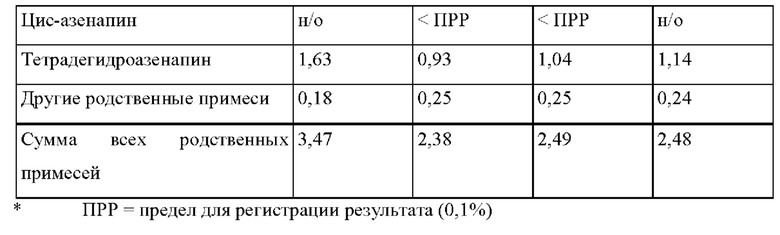
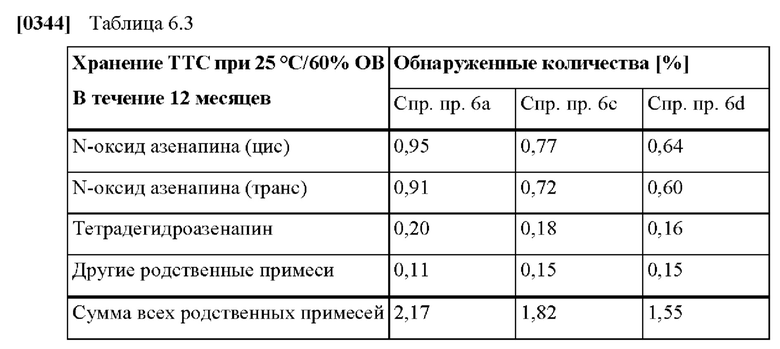
[0345] Данные по стабильности для справочных примеров 6a-d показывают, что присутствие и некоторые более высокие количества α-токоферола оказывают положительное влияние на исходную стабильность, а также стабильность при хранении составов азенапина, содержащих матричный слой на основе акрилового адгезива, и включающих в себя дополнительный полимер (поливинилпирролидон).
СПРАВОЧНЫЕ ПРИМЕРЫ 7A-D
Композиция для покрытия
[0346] Составы азенапин-содержащих композиций для покрытия для справочных примеров 7а, 7b, 7с и 7d обобщены в таблице 7.1 ниже. Составы основаны на массовых процентах, что также указано в таблице 7.1.
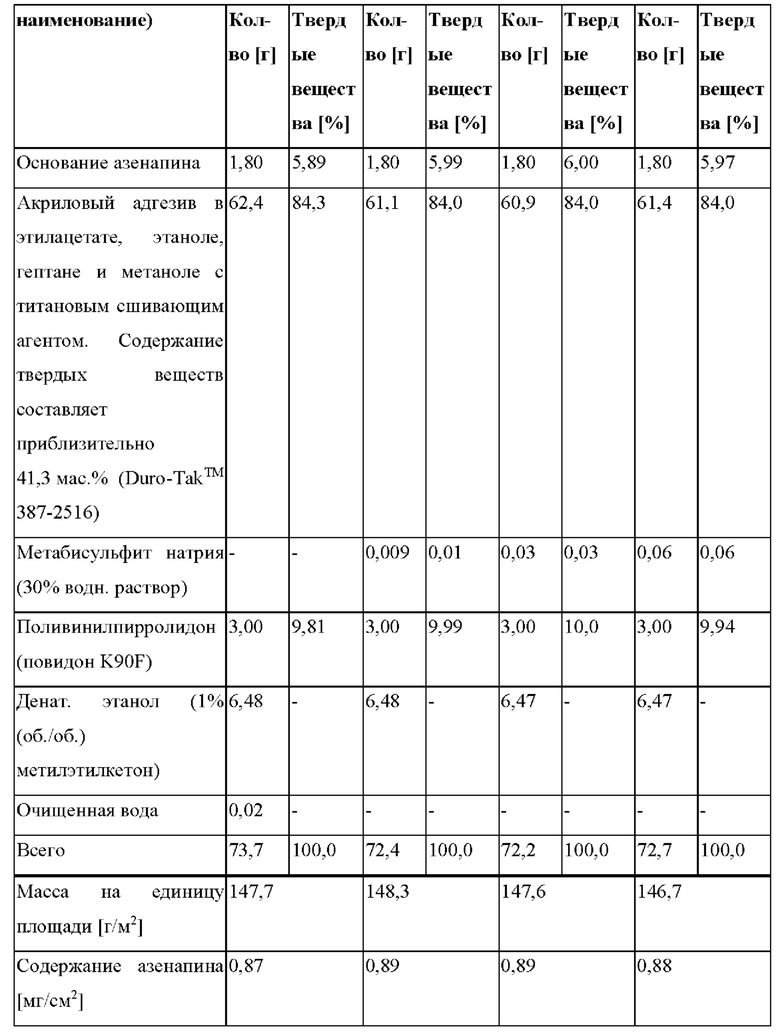
Изготовление композиции для покрытия
[0348] Для справочного примера 7а в мерный стакан загружали очищенную воду и добавляли чувствительный к давлению акриловый адгезив Duro-Tak™ 387-2516. К этой смеси при перемешивании добавляли поливинилпирролидон. Последовательно добавляли азенапин и этанол, и смесь перемешивали.
[0349] Для справочных примеров 7b-7d в мерный стакан загружали раствор метабисульфита натрия и добавляли чувствительный к давлению акриловый адгезив Duro-Tak™ 387-2516. При перемешивании добавляли поливинилпирролидон. Последовательно добавляли азенапин и этанол, и смесь перемешивали до получения прозрачного раствора.
Нанесение композиции для покрытия
[0350] Информацию о процессе нанесения покрытия см. в справочном примере 1а и справочном примере 1b. Толщина покрытия обеспечивала массу на единицу площади матричного слоя 147,7 г/м2 (справочный пример 7а), 148,3 г/м2 (справочный пример 7b), 147,6 г/м2 (справочный пример 7с) и 146,7 г/м2 (справочный пример 7d) соответственно. На высушенную пленку наслаивали защитный слой из полиэтилентерефталата (толщиной 23 мкм) с получением азенапин-содержащей структуры самоклеящегося слоя.
Изготовление ТТС
[0351] См. пример 1.
Измерения стабильности
[0352] Исследовали стабильность ТТС из справочных примеров 7a-7d, хранившихся при 40°С и OB 75% в течение 2,5 месяца. Из ТТС брали образцы, экстрагировали подходящим растворителем для экстракции, и определяли количество основания азенапина, а также различных возможных продуктов разложения с помощью специфического метода количественной ВЭЖХ с УФ-фотометрическим детектором на основании содержания азенапина, рассчитанного исходя из (фактической) массы на единицу площади испытываемой ТТС. Результаты представлены в таблице 7.2 и на Фиг. 7а.
[0353] Дополнительно определяли количество основания азенапина, а также различных возможных продуктов разложения композиций для покрытия по справочным примерам 6а и 7a-7d с помощью специфического метода количественной ВЭЖХ с УФ-фотометрическим детектором через несколько дней после приготовления композиций для покрытия. Результаты представлены в таблице 7.3 и на Фиг. 7b.

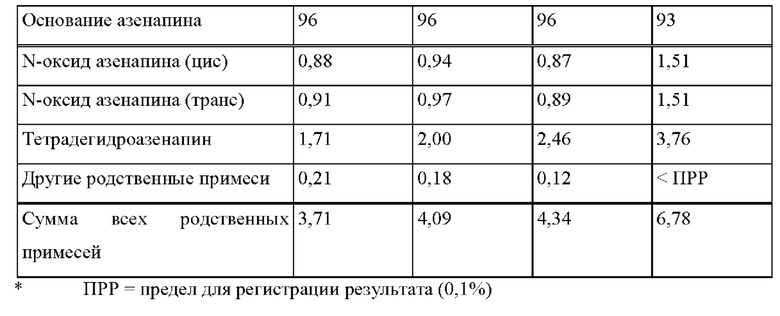
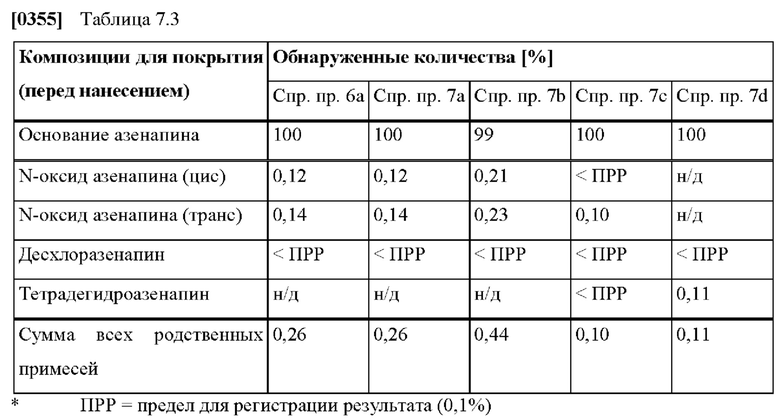
[0356] Данные по стабильности для справочных примеров 7a-d показывают, что присутствие и некоторые более высокие количества метабисульфита натрия оказывают положительное влияние на исходную стабильность составов азенапина, содержащих матричный слой на основе акрилового адгезива, и включающих в себя дополнительный полимер (поливинилпирролидон).
ПРИМЕРЫ 8А-Е
Композиция для покрытия
[0357] Составы азенапин-содержащих композиций для покрытия для примеров 8а-8е обобщены в таблице 8.1 ниже. Составы основаны на массовых процентах, что также указано в таблице 8.1.
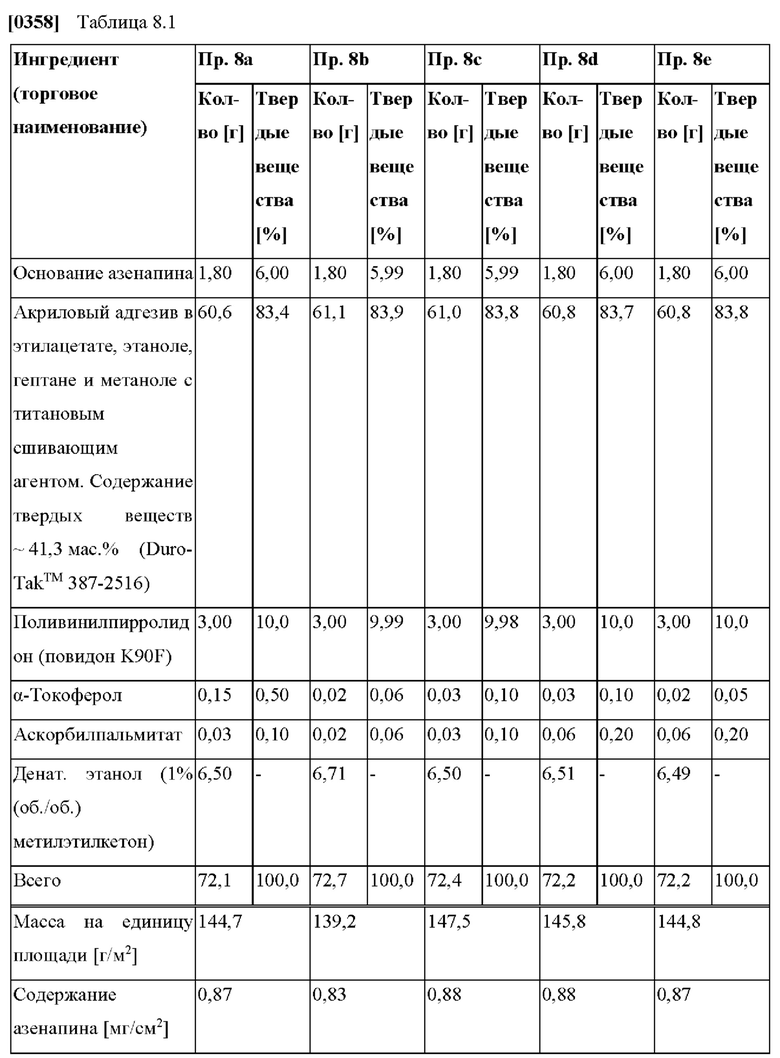
Изготовление композиции для покрытия
[0359] Для примеров 8а-8е в мерный стакан загружали α-токоферол и аскорбилпальмитат, добавляли чувствительный к давлению акриловый адгезив Duro-Tak™ 387-2516 и перемешивали полученную смесь. При перемешивании добавляли поливинилпирролидон. Последовательно добавляли азенапин и этанол, и смесь перемешивали до получения прозрачного раствора.
Нанесение композиции для покрытия
[0360] Информацию о процессе нанесения покрытия см. в справочном примере 1а и справочном примере 1b. Толщина покрытия обеспечивала массу на единицу площади матричного слоя 144,7 г/м2 (пример 8а), 139,2 г/м2 (пример 8b), 147,5 г/м2 (пример 8с), 145,8 г/м2 (пример 8d) и 144,8 г/м2 (пример 8е) соответственно. На высушенную пленку наслаивали защитный слой из полиэтилентерефталата (толщиной 23 мкм) с получением азенапин-содержащей структуры самоклеящегося слоя.
Изготовление ТТС
[0361] См. пример 1.
Измерения стабильности
[0362] Исследовали стабильность ТТС из примеров 8а-8е, хранившихся при 40°С и OB 75% в течение 2,5 месяца, а также при 25°С и OB 60% в течение 12 месяцев. Из ТТС брали образцы, экстрагировали подходящим растворителем для экстракции, и определяли количество основания азенапина, а также различных возможных продуктов разложения с помощью специфического метода количественной ВЭЖХ с УФ-фотометрическим детектором на основании содержания азенапина, рассчитанного исходя из (фактической) массы на единицу площади испытываемой ТТС. Результаты представлены в таблицах 8.2 и 8.3, а также на Фиг. 8а и 8b.
[0363]
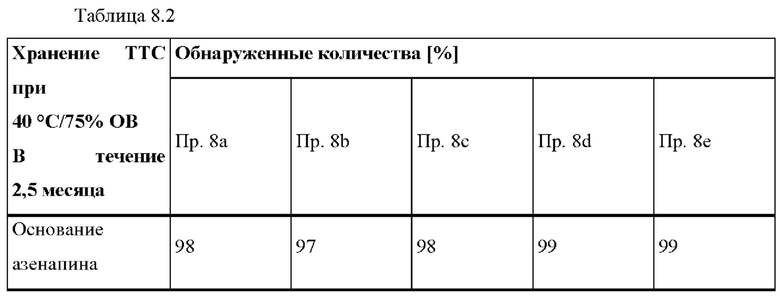
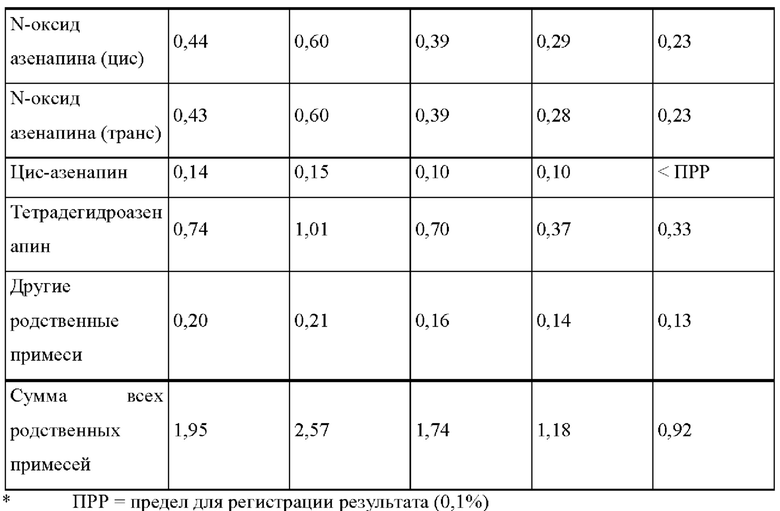
[0364]
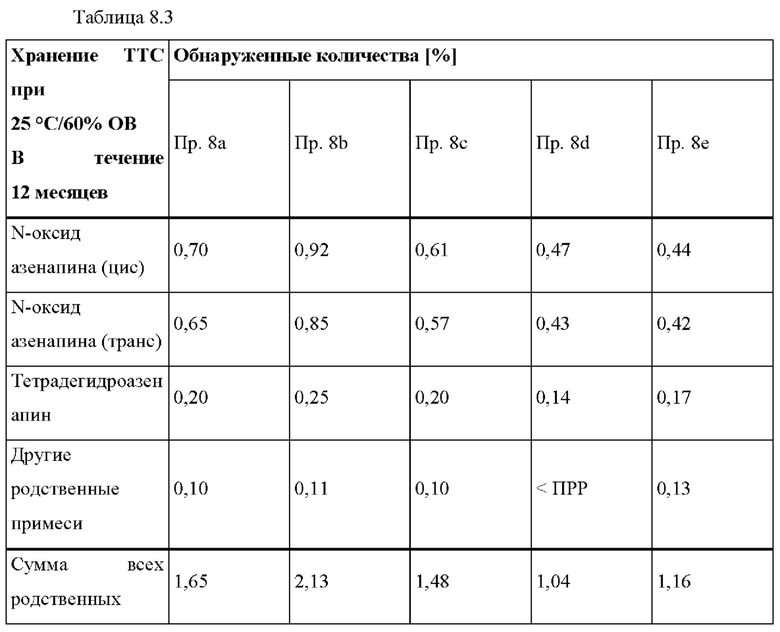
[0365] Данные по стабильности для примеров 8а-е показывают, что положительное влияние α-токоферола и аскорбилпальмитата на исходную стабильность, а также стабильность при хранении составов азенапина, содержащих матричный слой на основе акрилового адгезива и включающих в себя дополнительный полимер (поливинилпирролидон), обладает синергическим действием для определенных количеств α-токоферола и аскорбилпальмитата.
ПРИМЕРЫ 9А-Е
Композиция для покрытия
[0366] Составы азенапин-содержащих композиций для покрытия для примеров 9а-9е обобщены в таблице 9.1 ниже. Составы основаны на массовых процентах, что также указано в таблице 9.1.
[0367]
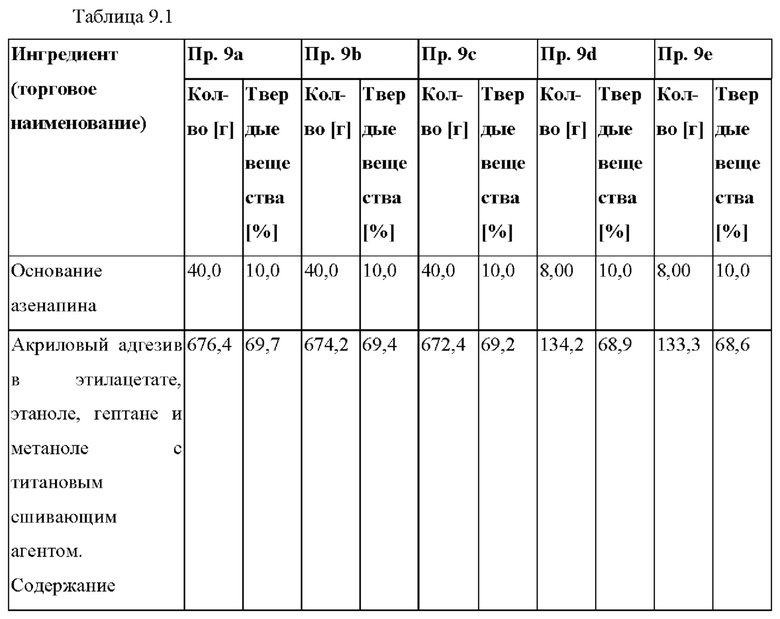
Изготовление композиции для покрытия
[0368] В сосуд из нержавеющей стали (примеры 9а-9с) или мерный стакан (примеры 9d и 9е) загружали часть этанола, при перемешивании добавляли по каплям раствор метабисульфита натрия, и смесь перемешивали по меньшей мере 10 мин. При перемешивании добавляли по каплям α-токоферол и раствор аскорбилпальмитата, и полученную смесь перемешивали в течение по меньшей мере 20 мин. После добавления при перемешивании триглицеридов со средней длиной цепи, в мерный стакан навешивали полив инилпирролидон и при перемешивании добавляли к смеси. В случае примера 9е добавляли изононановую кислоту, перемешивали смесь в течение по меньшей мере 10 мин, после чего добавляли поливинилпирролидон. В реакционную смесь добавляли навеску чувствительного к давлению акрилового адгезива Duro-Tak™ 387-2516, полученную смесь перемешивали, давали отстояться, после чего навешивали в мерный стакан азенапин и добавляли в смесь вместе с оставшейся частью этанола. Смесь перемешивали до получения прозрачного раствора.
Нанесение композиции для покрытия
[0369] Информацию о процессе нанесения покрытия см. в справочном примере 1а и справочном примере 1b. Толщина покрытия обеспечивала массу на единицу площади матричного слоя 136,6 г/м2 (пример 9d) и 135,1 г/м2 (пример 9е) соответственно. Для примера 9а получали различные пленки с массой на единицу площади от 140,2 до 148,7 г/м2. Для примера 9b получали различные пленки с массой на единицу площади от 140,5 до 145,6 г/м2. Для примера 9с получали различные пленки с массой на единицу площади от 137,0 до 148,9 г/м2. На высушенную пленку наслаивали защитный слой из полиэтилентерефталата (толщиной 23 мкм) с получением азенапин-содержащей структуры самоклеящегося слоя.
Изготовление ТТС
[0370] См. пример 1.
Измерения стабильности
[0371] Испытание стабильности при длительном хранении было проведено для примеров 9а-9е в различных условиях испытаний, то есть при хранении при температуре 25°С и относительной влажности (OB) 60%, при температуре 30°С и OB 75% и при 40°С и OB 75%. В разные моменты времени из ТТС брали образцы, экстрагировали подходящим растворителем для экстракции, и определяли количество основания азенапина, а также различных возможных продуктов разложения с помощью специфического метода количественной ВЭЖХ с УФ-фотометрическим детектором на основании содержания азенапина, рассчитанного исходя из (фактической) массы на единицу площади испытываемой ТТС. Результаты представлены в таблицах 9.2-9.16. На Фиг. 9а-9f представлен график суммы всех родственных примесей (т.е. возможных продуктов разложения) в сравнении со справочным примером 2d (при хранении при 25°С и OB 60%, а также при 40°С и OB 75%).
[0372]
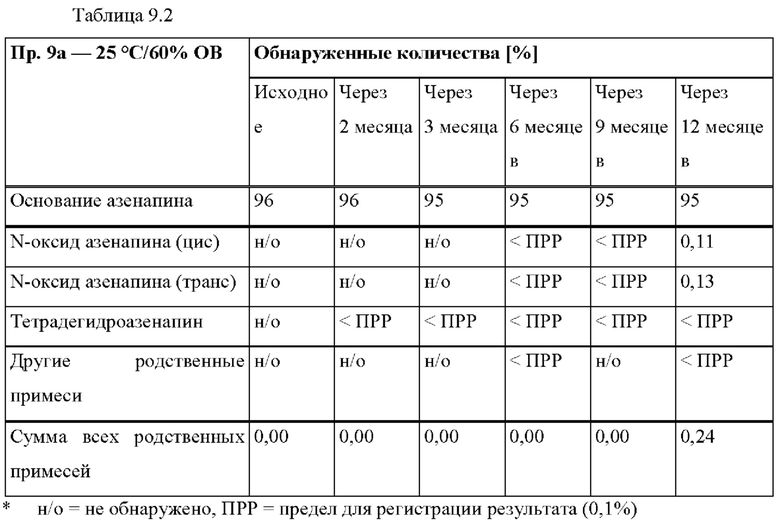
[0373]
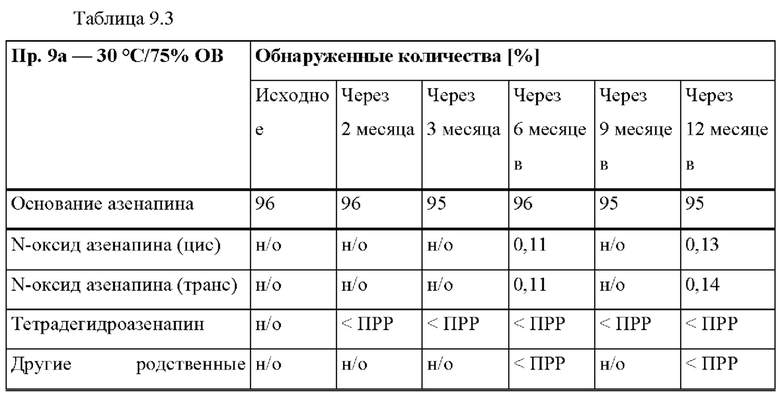
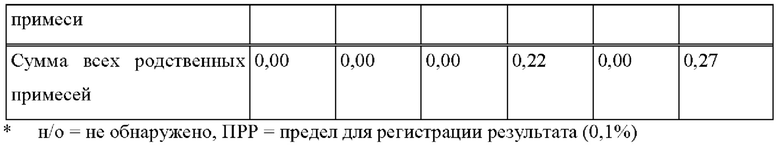
[0374]
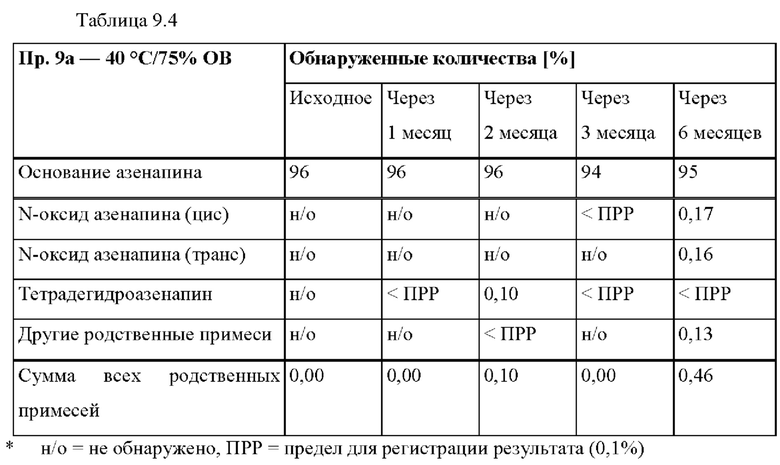
[0375]
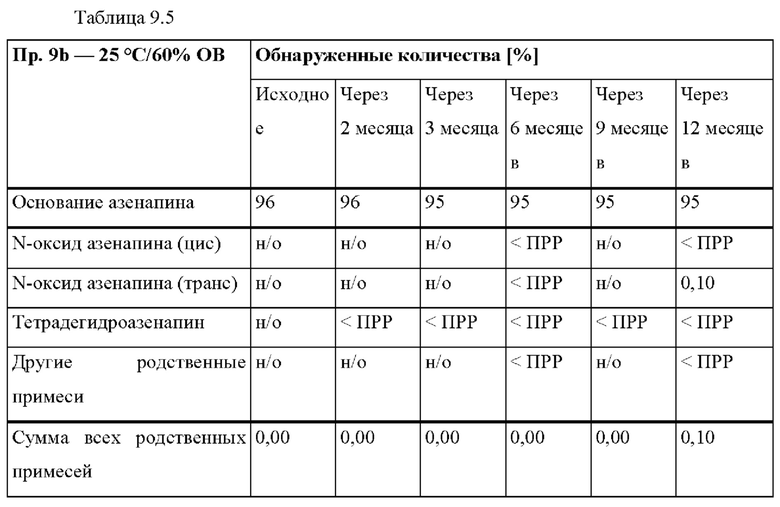
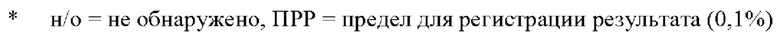
[0376]
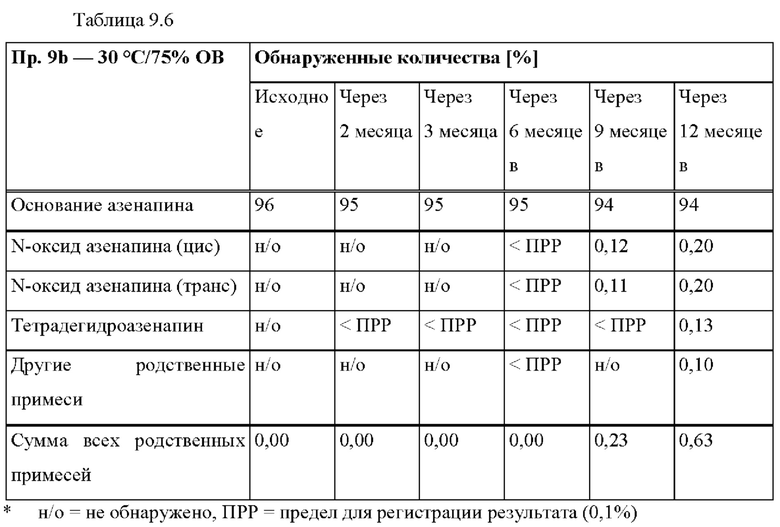
[0377]
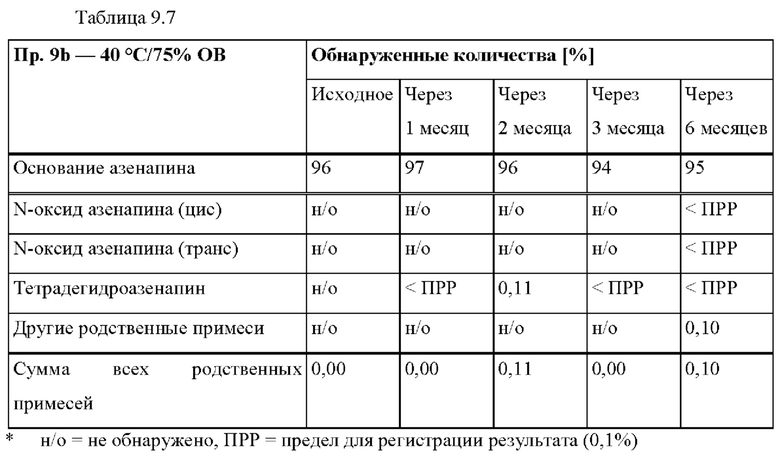
[0378]
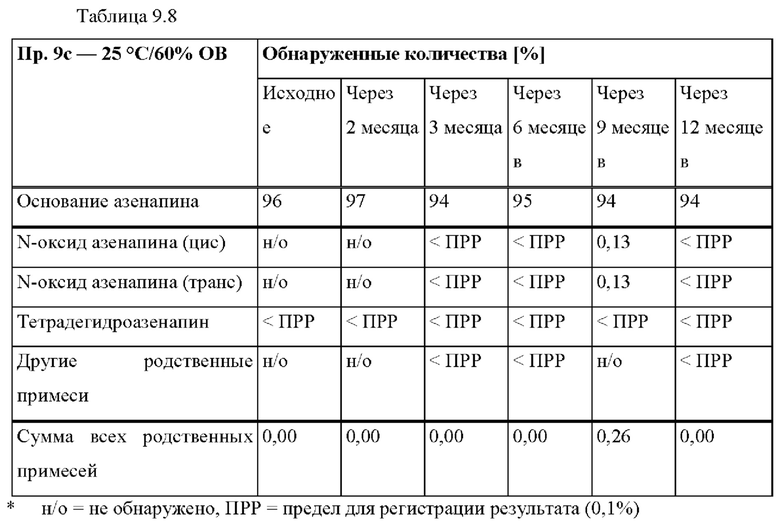
[0379]
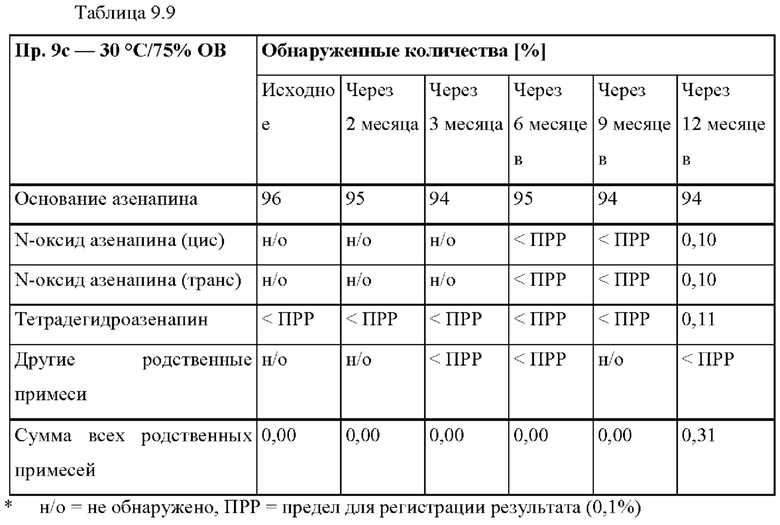
[0380]

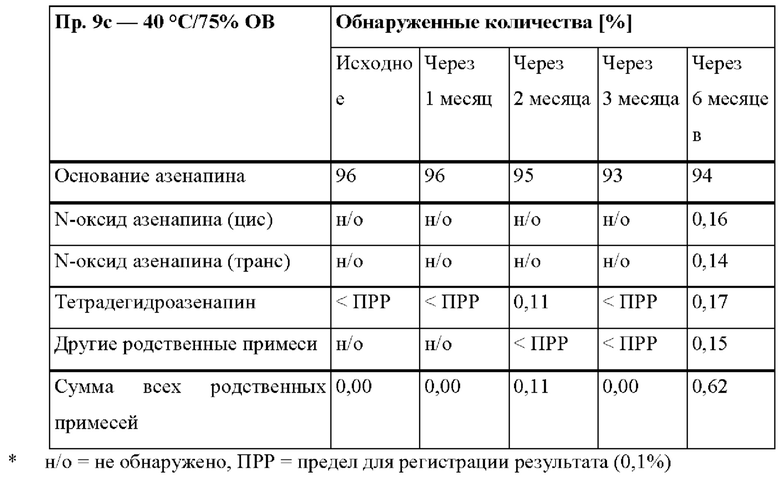
[0381]
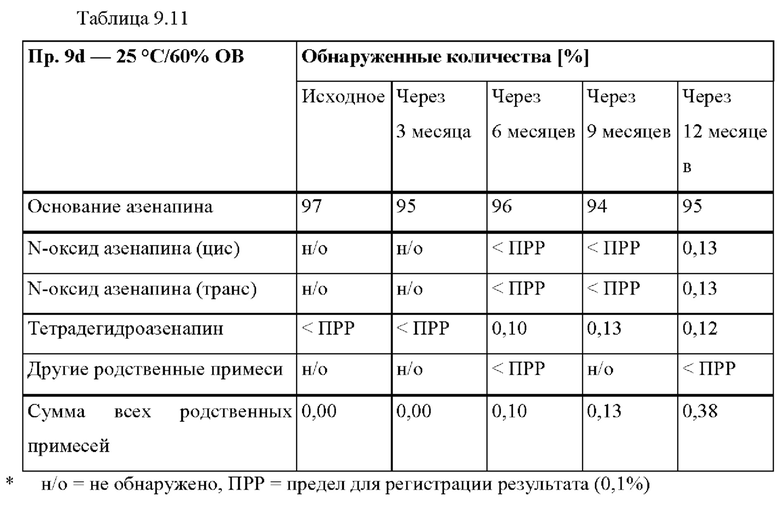
[0382]

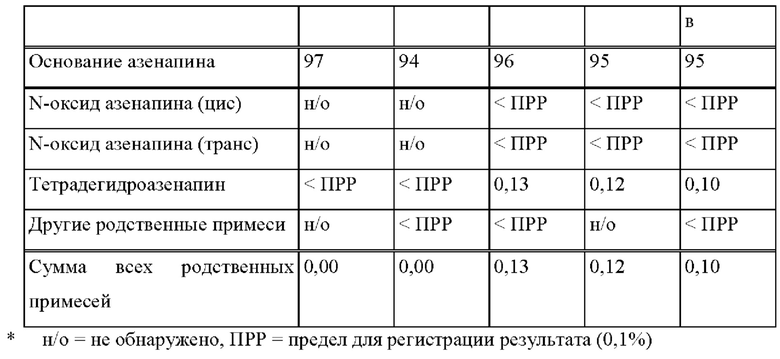
[0383]
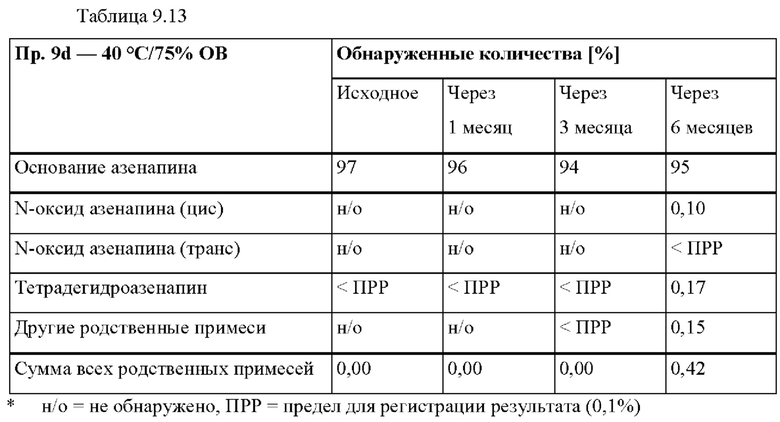
[0384]
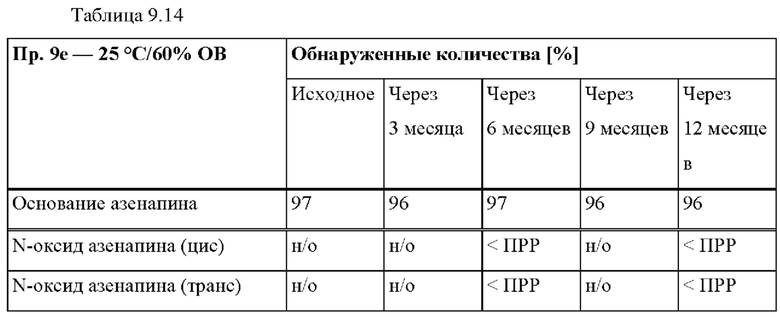
[0385]
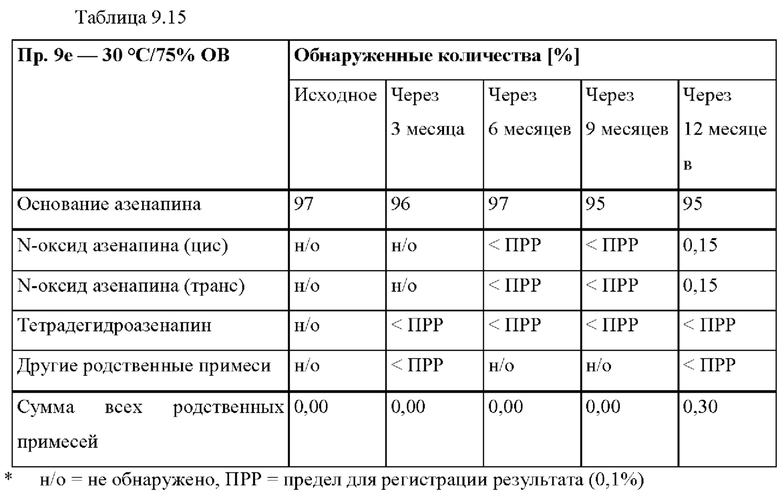
[0386]
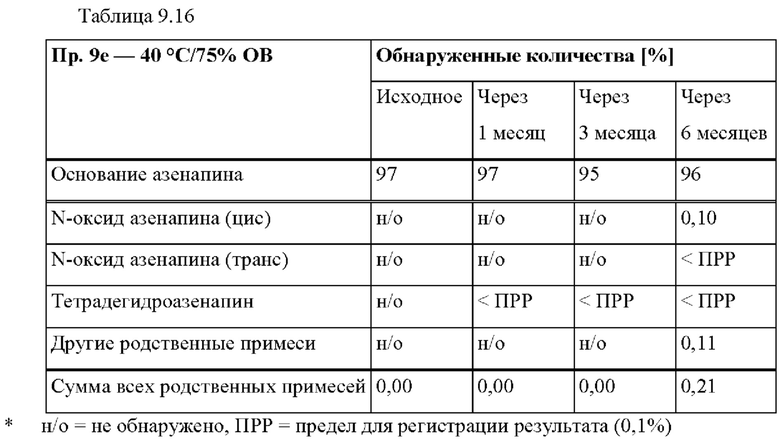
[0387] Данные по стабильности показывают, что в некоторых вариантах осуществления изобретения исходная стабильность, а также стабильность при хранении были существенно улучшены по сравнению с ранее разработанными эталонными составами (например, спр. пр. 2d), как с точки зрения количества основания азенапина (в частности, относительно количества основания азенапина, оставшегося после хранения), так и суммы всех родственных примесей (т.е. возможных продуктов разложения).
ПРИМЕРЫ 10А И В
Композиция для покрытия
[0388] Составы азенапин-содержащих композиций для покрытия для примеров 10а и 10b обобщены в таблице 10.1 ниже. Составы основаны на массовых процентах, что также указано в таблице 10.1.
[0389]
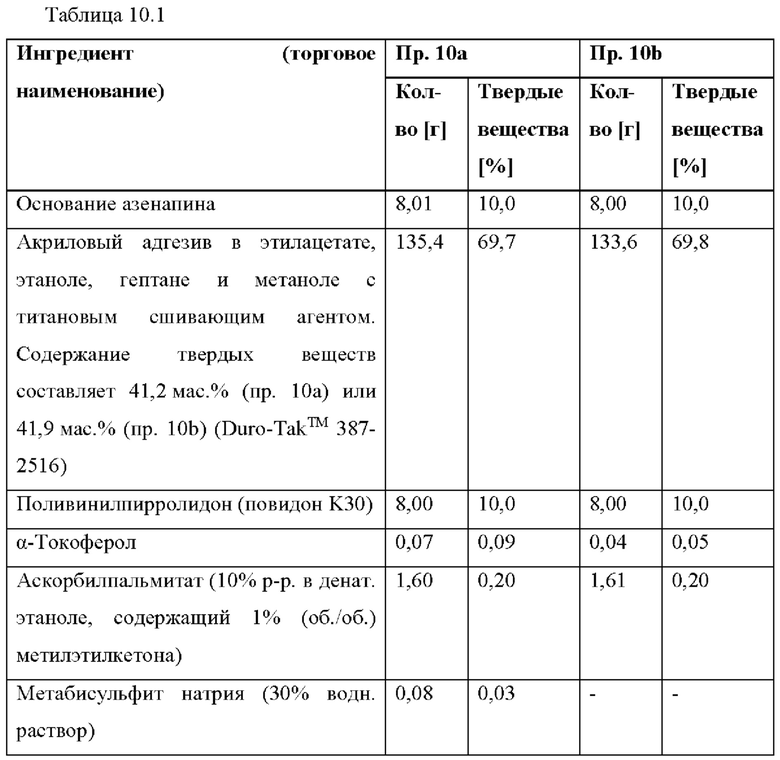
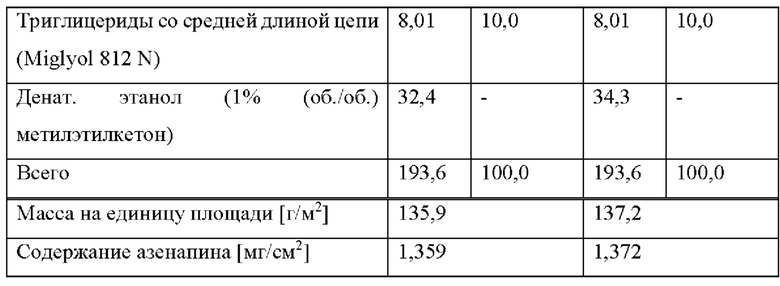
Изготовление композиции для покрытия
[0390] Для примера 10а в мерный стакан загружали часть этанола, при перемешивании добавляли по каплям раствор метабисульфита натрия, и смесь перемешивали по меньшей мере 10 мин, после чего по каплям при перемешивании добавляли α-токоферол. Для примера 10b в мерный стакан загружали α-токоферол и часть этанола. К этой смеси, содержащей α-токоферол (пример 10b) и метабисульфит натрия (пример 10а), в этаноле при перемешивании добавляли по каплям раствор аскорбилпальмитата, и перемешивали полученную смесь в течение по меньшей мере 20 мин. После добавления при перемешивании триглицеридов со средней длиной цепи, в мерный стакан навешивали поливинилпирролидон и при перемешивании добавляли к смеси. В реакционную смесь добавляли навеску чувствительного к давлению акр илового адгезива Duro-Tak™ 387-2516, полученную смесь перемешивали, давали отстояться, после чего навешивали в мерный стакан азенапин и добавляли в смесь вместе с оставшейся частью этанола. Смесь перемешивали до получения прозрачного раствора.
Нанесение композиции для покрытия
[0391] Информацию о процессе нанесения покрытия см. в справочном примере 1а и справочном примере 1b. Толщина покрытия обеспечивала массу на единицу площади матричного слоя 135,9 г/м2 (пример 10а) и 137,2 г/м2 (пример 11b) соответственно. На высушенную пленку наслаивали защитный слой из полиэтилентерефталата (толщиной 23 мкм) с получением азенапин-содержащей структуры самоклеящегося слоя.
Изготовление ТТС
[0392] См. пример 1.
Измерения стабильности
[0393] Испытание стабильности при длительном хранении было проведено для примеров 10а и 10b в различных условиях испытаний, то есть при хранении при температуре 25°С и относительной влажности (OB) 60%, при температуре 30°С и OB 75% и при 40°С и OB 75%. В разные моменты времени из ТТС брали образцы, экстрагировали подходящим растворителем для экстракции, и определяли количество основания азенапина, а также различных возможных продуктов разложения с помощью специфического метода количественной ВЭЖХ с УФ-фотометрическим детектором на основании содержания азенапина, рассчитанного исходя из (фактической) массы на единицу площади испытываемой ТТС. Результаты представлены в таблицах 10.2-10.7. На Фиг. 10а-10с представлен график суммы всех родственных примесей (т.е. возможных продуктов разложения) в сравнении с примером 9а и со справочным примером 2d (при хранении при 25°С и OB 60%, а также при 40°С и OB 75%).
[0394]
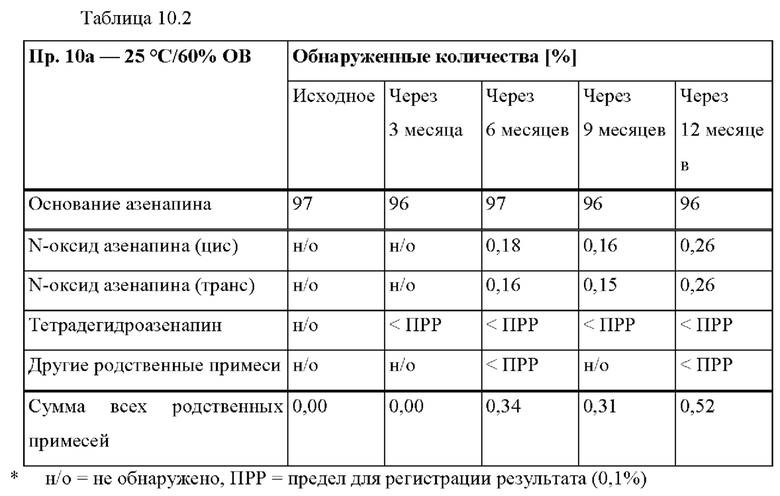
[0395]
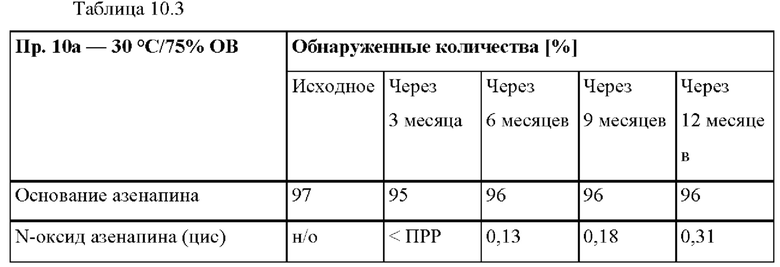
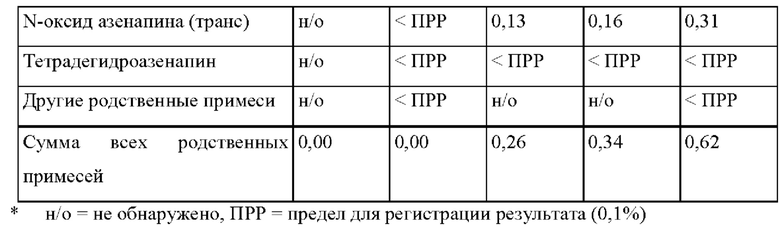
[0396]
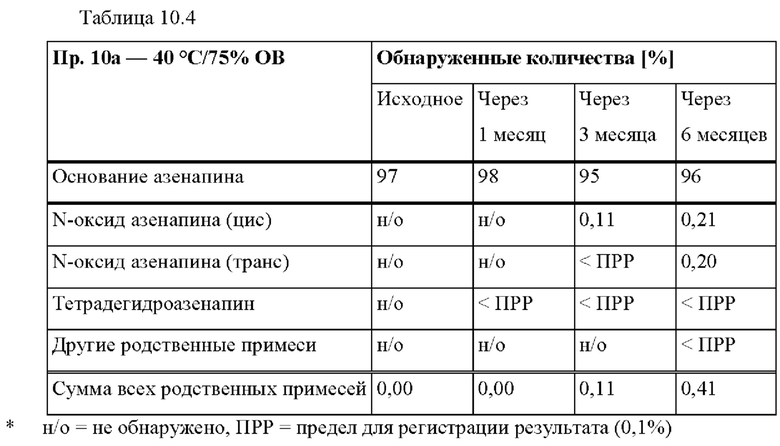
[0397]
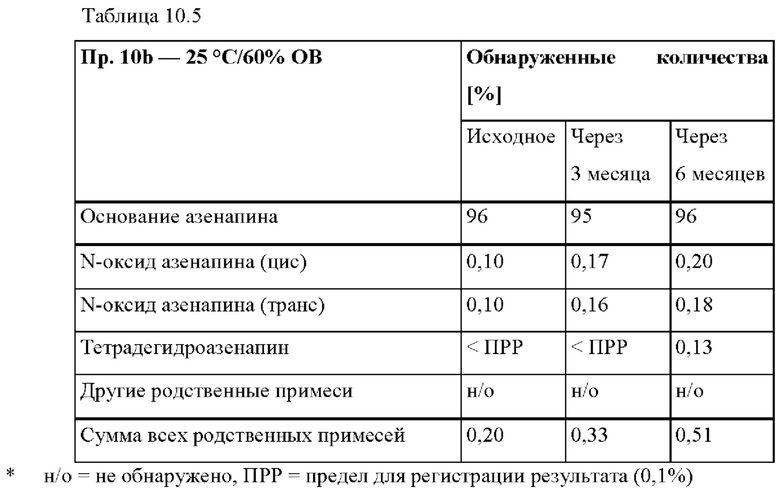
[0398]
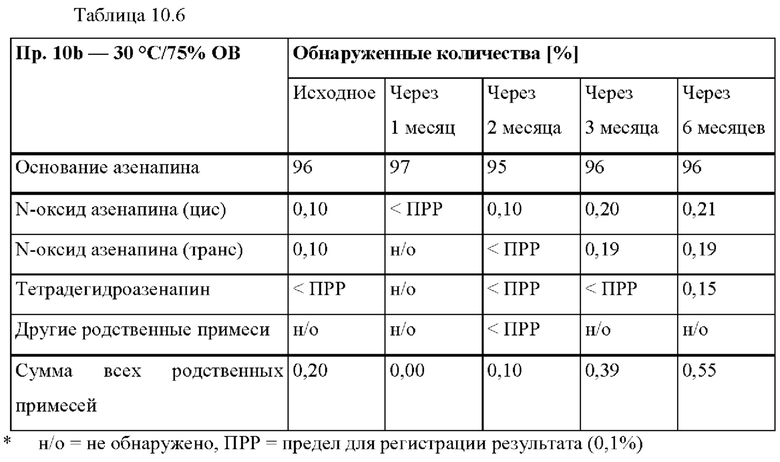
[0399]
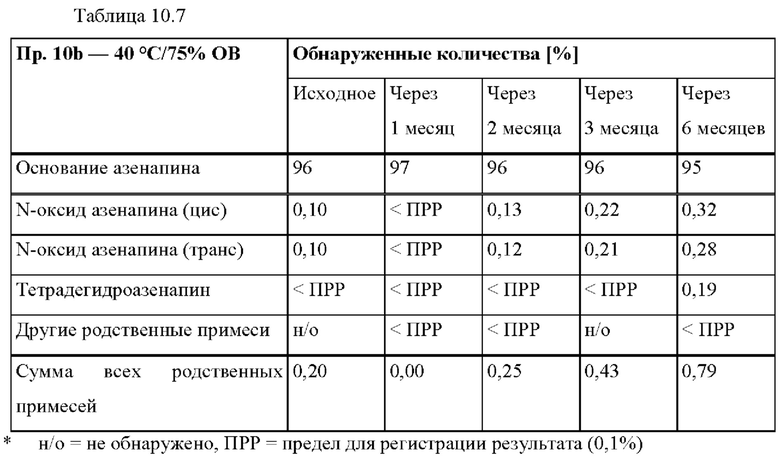
[0400] Данные по стабильности показывают, что улучшенная стабильность, а также стабильность при хранении могут быть достигнуты за счет комбинации α-токоферола и аскорбилпальмитата, и что добавление определенного количества метабисульфита натрия положительно влияет на общую стабильность при хранении.
ПРИМЕР 11А И СПРАВОЧНЫЕ ПРИМЕРЫ 11В, 11С И 11D
Композиция для покрытия
[0401] Составы азенапин-содержащих композиций для покрытия для примеров 11а, а также для справочных примеров 11b, 11c и 11d обобщены в таблице 11.1 ниже. Составы основаны на массовых процентах, что также указано в таблице 11.1.
[0402]
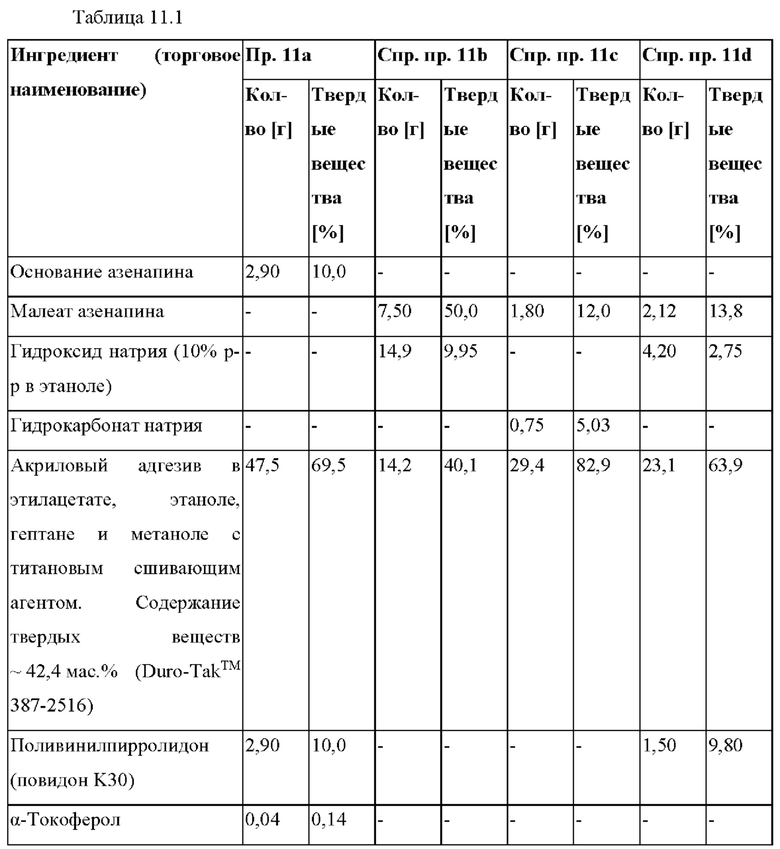
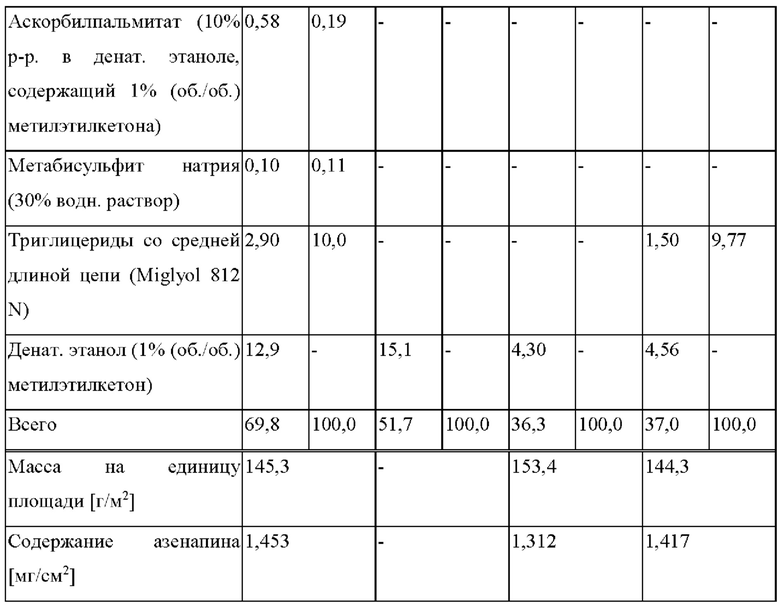
Изготовление композиции для покрытия
[0403] Композицию для покрытия по примеру 11а получали так, как описано в примерах 9d и 10а.
[0404] Для справочного примера 11b в мерный стакан загружали малеат азенапина, добавляли раствор гидроксида натрия и перемешивали смесь. По мере затвердевания смеси добавляли этанол и дополнительно перемешивали смесь. В реакционную смесь добавляли навеску чувствительного к давлению акрилового адгезива Duro-Tak™ 387-2516, после чего смесь перемешивали, давали отстояться и перемешивали снова. Полученная смесь была неоднородной, поэтому нанесение покрытия на композицию было невозможным.
[0405] Для справочного примера 11с в мерный стакан загружали малеат азенапина и добавляли этанол. В реакционную смесь добавляли навеску чувствительного к давлению акрилового адгезива Duro-Tak™ 387-2516, после чего смесь перемешивали, давали отстояться и снова перемешивали до получения прозрачного раствора, включающего нерастворенные частицы.
[0406] Для справочного примера 11d в мерный стакан загружали малеат азенапина и гидрокарбонат натрия. В реакционную смесь добавляли этанол и навеску чувствительного к давлению акрилового адгезива Duro-Tak™ 387-2516, после чего смесь перемешивали. В мерный стакан навешивали поливинилпирролидон и при перемешивании добавляли к смеси. Раствор гидроксида натрия и триглицериды со средней длиной цепи добавляли по каплям и последовательно в указанном порядке. Получали белый однородный раствор.
Нанесение композиции для покрытия, пример 11а и справочные примеры 11с и 11d
[0407] Информацию о процессе нанесения покрытия см. в справочном примере 1а и справочном примере 1b. Толщина покрытия обеспечивала массу на единицу площади матричного слоя 145,3 г/м2 (пример 11а), 153,4 г/м2 (справочный пример 11с) и 144,3 г/м2 (справочный пример 11d), соответственно. На высушенную пленку наслаивали защитный слой из полиэтилентерефталата (толщиной 23 мкм) с получением азенапин-содержащей структуры самоклеящегося слоя. Как описано выше, для справочного примера 11b нанесение покрытия было невозможным. Матричный слой с нанесенным покрытием по справочному примеру 11с был явно неоднородным, вероятно, из-за нерастворенных частиц гидрокарбоната натрия, и адгезия оказалась недостаточной. Матричный слой с нанесенным покрытием по примеру 11а продемонстрировал отличную адгезию, в то время как матричный слой с нанесенным покрытием по справочному примеру 11d продемонстрировал лишь умеренную адгезию.
Изготовление ТТС
[0408] См. пример 1. На Фиг. 11e-11g показаны изображения ТТС, полученных в соответствии с примером 11а, справочным примером 11с и справочным примером 11d соответственно. На этих фигурах можно увидеть, что поверхность ТТС в примерах 11а и справочном примере 11d является гладкой, в то время как поверхность ТТС в справочном примере 11b является шероховатой, что свидетельствует о неоднородном матричном слое.
Измерения стабильности
[0409] Исследовали исходную стабильность ТТС из примера 11а, а также из справочных примеров 11c и 11d, и после хранения в течение 1 месяца при 40°С и OB 75%. Из ТТС брали образцы сразу после изготовления ТТС и спустя 1 месяц хранения, экстрагировали подходящим растворителем для экстракции, и определяли количество основания азенапина, а также различных возможных продуктов разложения с помощью специфического метода количественной ВЭЖХ с УФ-фотометрическим детектором на основании содержания азенапина, рассчитанного исходя из (фактической) массы на единицу площади испытываемой ТТС. Результаты представлены в таблицах 11.2 и 11.3, а также на Фиг. 11а и 11b.
[0410]
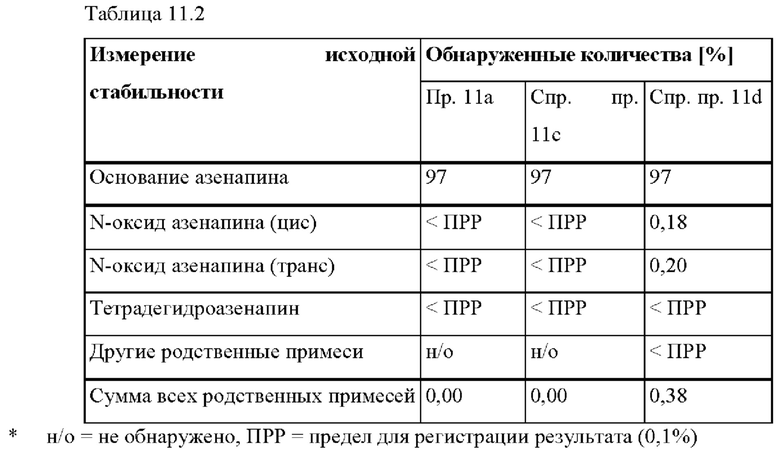
[0411]
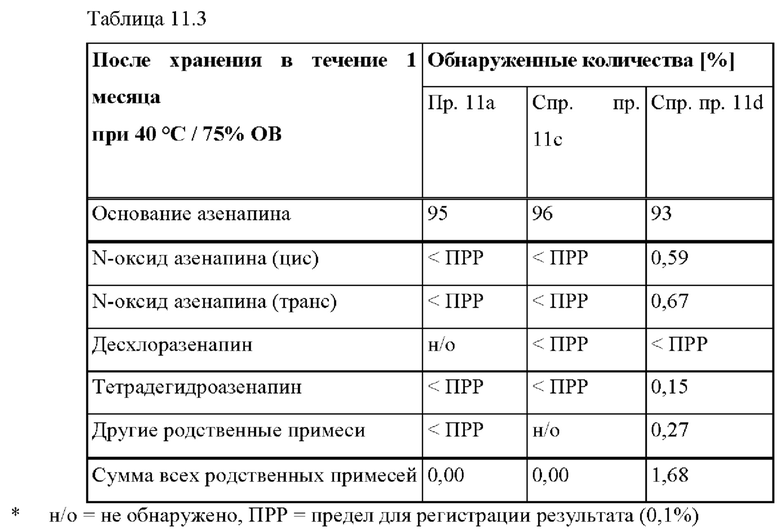
[0412] Эти данные демонстрируют, что состав по настоящему изобретению способен стабилизировать свободное основание азенапина с помощью комбинации α-токоферола и аскорбилпальмитата, и что стабильность, полученная таким образом, даже выше, чем у составов, в которых получают свободное основание азенапина in situ из более стабильной соли малеата азенапина путем депротонирования гидроксидом натрия (спр. пр. 11d).
[0413] Считается, что получение in situ формы свободного основания активного агента имеет недостатки из-за пониженной проницаемости солевой формы, поэтому характеристики проникновения через кожу препаратов на основе малеата азенапина in vitro могут быть ниже, предположительно в зависимости от времени реакции депротонирования (см. измерение скорости проникновения через кожу ниже).
[0414] Кроме того, как демонстрируют справочные примеры 11b и 11с, использование депротонирующих агентов, таких как бикарбонат натрия или гидроксид натрия, также приводит к проблемам составления рецептуры композиций для покрытий (см. Фиг. 11с) или даже к невозможности их составления с невозможностью получения ТТС (спр. пр. 11b).
Измерение скорости проникновения через кожу
[0415] Проникающее количество и соответствующие значения скорости проникновения через кожу ТТС, изготовленной в соответствии с примером 11а, а также справочными примерами 11с и 11d, определяли с помощью экспериментов in vitro, проводимых в диффузионной ячейке Франца на 7,0 мл в соответствии с рекомендациями ОЭСР (принятыми 13 апреля 2004 г). Использовали расслоенную кожу человека, полученную после косметической хирургической операции (живот, дата рождения пациента 1964 г.). Для подготовки кожи толщиной 800 мкм с неповрежденным эпидермисом для всех ТТС использовали дерматом. Из ТТС высекали штампом элементы с площадью поверхности 1,157 см2. Измеряли количество азенапина, проникающее в рецепторную среду ячеек Франца (фосфатный буферный раствор рН 5,5 с 0,1% раствором азида натрия в физиологическом растворе в качестве антибактериального агента) при температуре 32±1°С, и рассчитывали соответствующую скорость проникновения через кожу. Результаты представлены в таблице 11.4 и на Фиг. 11с.
[0416]
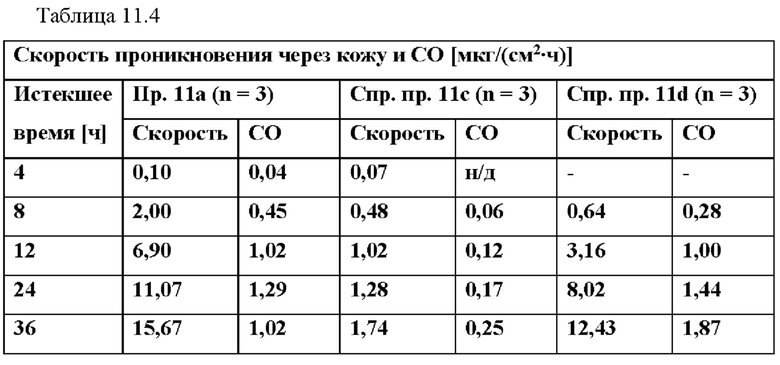
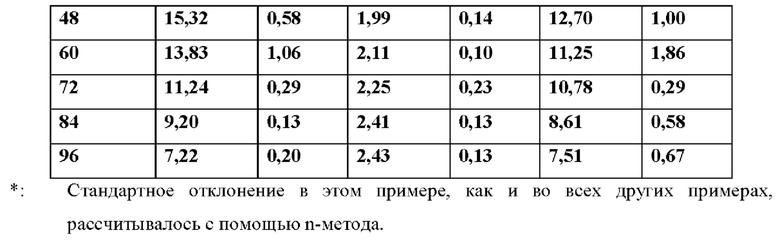
Использование азенапина
[0417] Использование азенапина через 72 часа рассчитывали на основании совокупного проникающего количества через 72 часа и изначального содержания азенапина. Результаты представлены в таблице 11.5 и на Фиг. 11d.
[0418]

[0419] Эксперименты in vitro демонстрируют, что хорошая скорость проникновения через кожу и использование азенапина из ранее разработанных эталонных составов (спр. пр. 1b и 1с) могут неожиданно сохраняться для примера 11а, который представляет собой состав в соответствии с настоящим изобретением и обеспечивает улучшенную стабильность (см. выше и Фиг. 11а и 11b). В то время как справочный пример 11d смог обеспечить немного более низкую, но все же приемлемую скорость проникновения через кожу, стабильность справочного примера 11d была неприемлемой (см. выше). С другой стороны, справочный пример 11с не обеспечивает приемлемой скорости проникновения через кожу (см. Фиг. 11с), и при этом использование азенапина также является очень низким (таблица 11.5 выше и Фиг. 11d).
[0420] Составы по настоящему изобретению способны обеспечивать улучшенную стабильность как в отношении разложения азенапина, так и содержания азенапина, при сохранении отличной скорости проникновения через кожу.
ПРИМЕРЫ 12А-С
Композиция для покрытия
[0421] Составы азенапин-содержащих композиций для покрытия для примеров 12а-12с обобщены в таблице 12.1 ниже. Составы основаны на массовых процентах, что также указано в таблице 12.1.
[0422]
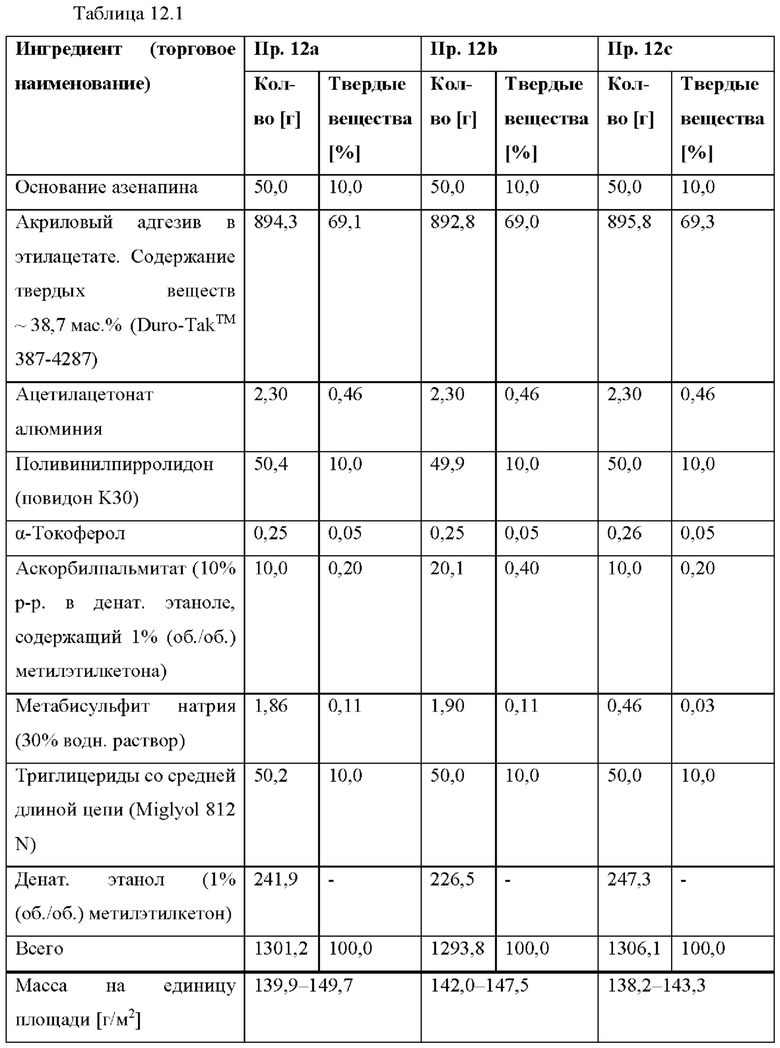

Изготовление композиции для покрытия
[0423] В сосуд из нержавеющей стали загружали часть этанола, при перемешивании добавляли по каплям раствор метабисульфита натрия, и смесь перемешивали по меньшей мере 10 мин. При перемешивании добавляли по каплям α-токоферол и раствор аскорбилпальмитата, и полученную смесь перемешивали в течение по меньшей мере 20 мин. После добавления при перемешивании триглицеридов со средней длиной цепи, в мерный стакан навешивали поливинилпирролидон и при перемешивании добавляли к смеси. В реакционную смесь добавляли навеску чувствительного к давлению акрилового адгезива Duro-Tak™ 387-4287, полученную смесь перемешивали, давали отстояться, после чего навешивали в мерный стакан каждый из ацетилацетоната алюминия и азенапина и добавляли в смесь вместе с оставшейся частью этанола. Смесь перемешивали до получения однородного раствора.
Нанесение композиции для покрытия
[0424] Информацию о процессе нанесения покрытия см. в справочном примере 1а и справочном примере 1b. Изготавливали разные пленки с массой на единицу площади от 139,9 до 149,7 г/м2 (пр. 12а), от 142,0 до 147,5 г/м2 (пр. 12b) и от 138,2 до 143,3 г/м2. На высушенную пленку наслаивали защитный слой из полиэтилентерефталата (толщиной 23 мкм) с получением азенапин-содержащей структуры самоклеящегося слоя.
Изготовление ТТС
[0425] См. пример 1.
Измерения стабильности
[0426] Испытание стабильности при длительном хранении было проведено для примеров 12а-12с в различных условиях испытаний, то есть при хранении при температуре 25°С и относительной влажности (OB) 60%, при температуре 30°С и OB 75% и при 40°С и OB 75%. В разные моменты времени из ТТС брали образцы, экстрагировали подходящим растворителем для экстракции, и определяли количество основания азенапина, а также различных возможных продуктов разложения с помощью специфического метода количественной ВЭЖХ с УФ-фотометрическим детектором на основании содержания азенапина, рассчитанного исходя из (фактической) массы на единицу площади испытываемой ТТС. Результаты представлены в таблицах 12.2-12.10 и на Фиг. 12а-12f, где на Фиг. 12а-12с изображена сумма возможных продуктов разложения, обнаруженных в сравнении со справочным примером 2d (для хранения при 25°С и OB 60%, а также при 40°С и OB 75%), а на Фиг. 12d-12f показано количество основания азенапина в сравнении с примером 9а и в сравнении со справочным примером 2d (при наличии данных).
[0427]
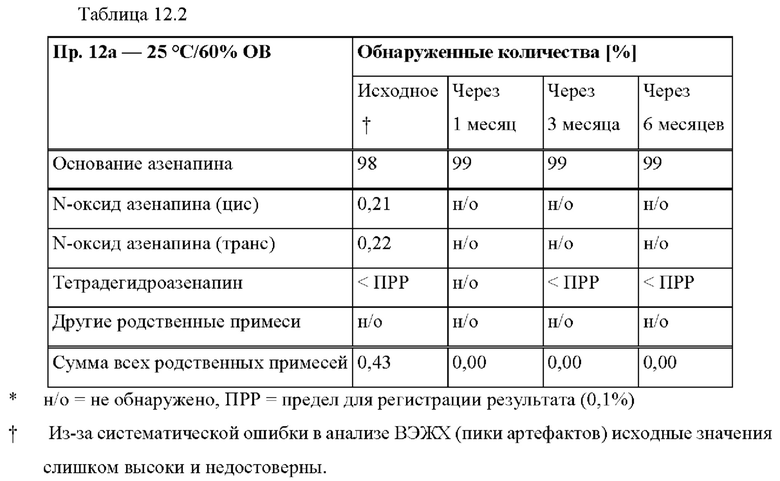
[0428]
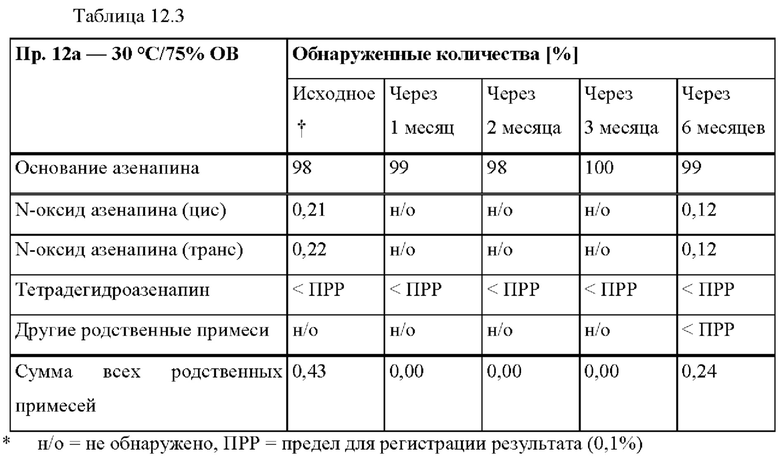
[0429]
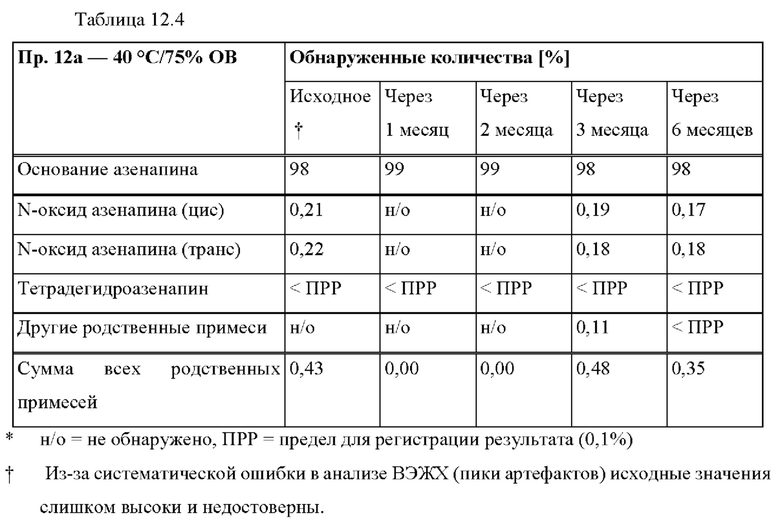
[0430]
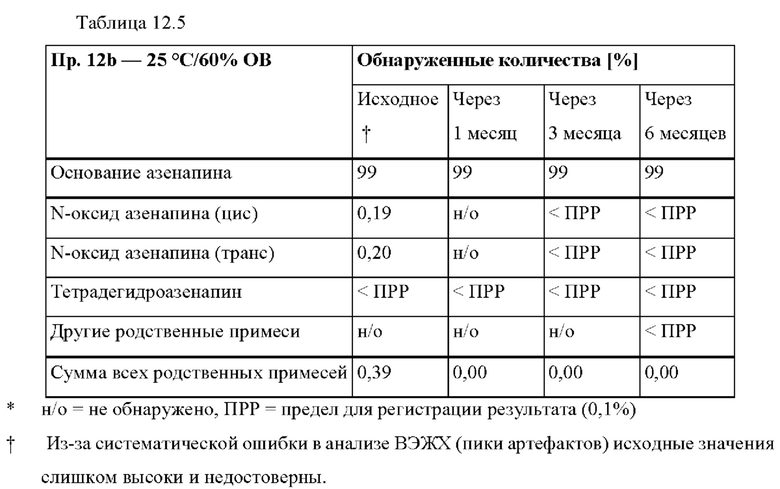

[0431]
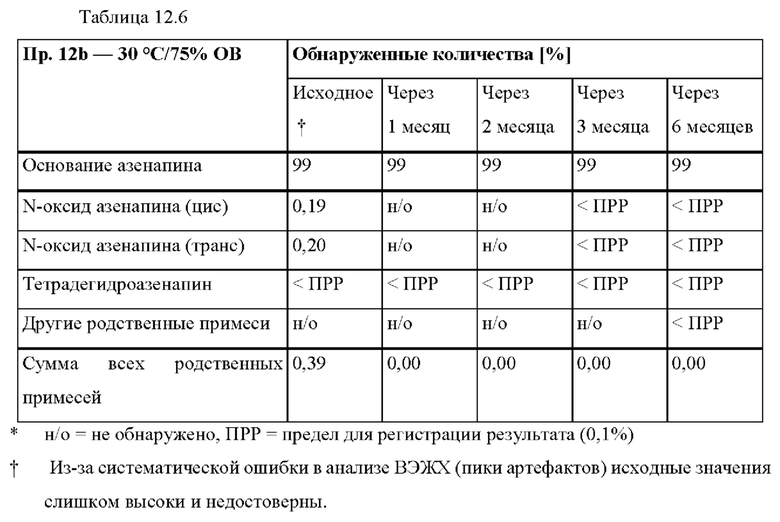
[0432]
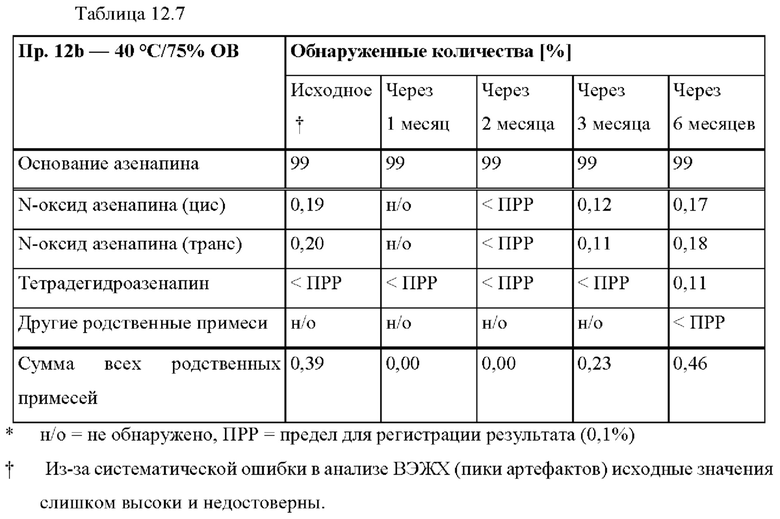
[0433]

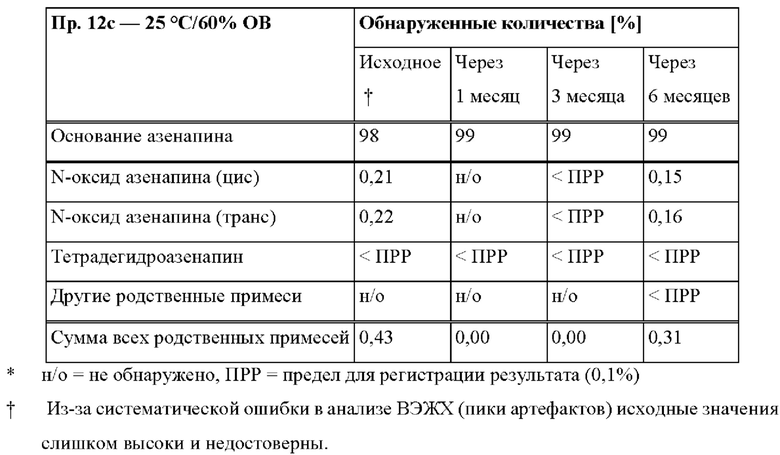
[0434]
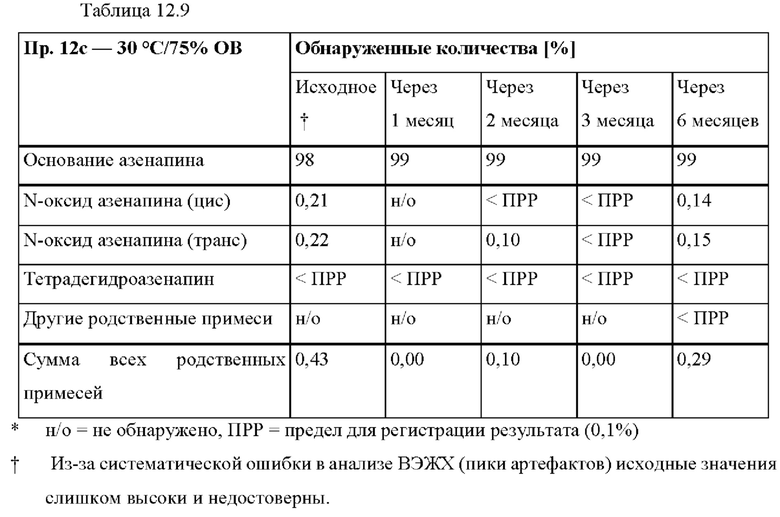
[0435]

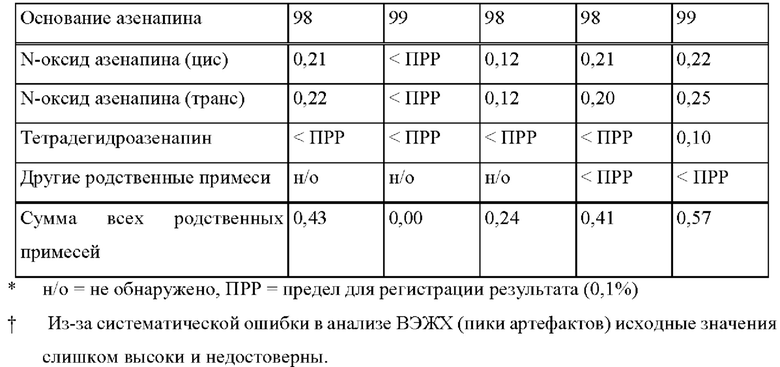
[0436] Данные по стабильности примеров 12а-с показывают, что использование определенных акриловых полимеров приводит к превосходной исходной стабильности, а также стабильности при хранении составов азенапина, в частности, с точки зрения количества основания азенапина, остающегося после хранения.
КЛИНИЧЕСКОЕ ИССЛЕДОВАНИЕ IN VIVO
Клиническое исследование in vivo
[0437] Было проведено клиническое исследование in vivo для изучения относительной биодоступности азенапина после трансдермального применения ТТС из справочных примеров 2с и 2d по сравнению с сублингвальным введением. Исследование было проведено в соответствии с этическими принципами, изложенными в Хельсинкской декларации.
Дизайн исследования
[0438] Это было одноцентровое открытое исследование фазы I с дизайном, предусматривающим 3 варианта лечения, 3 периода лечения, фиксированную последовательность лечения у 16 здоровых добровольцев мужского и женского пола, в котором сравнивали относительную биодоступность азенапина в плазме после трансдермального введения однократной дозы препарата с помощью ТТС, изготовленной по справочным примерам 2с и 2d и после приема продаваемых в настоящее время сублингвальных таблеток (Сикрест®, 5 мг).
[0439] Для каждого субъекта исследование включало:
• Период амбулаторного скрининга, во время которого получали информированное согласие и оценивали соответствие субъектов критериям участия. В зависимости от результатов скрининга субъектов включали в исследование.
• Период лечения и наблюдения, состоящий из 3 последовательных периодов лечения (каждый по несколько дней).
• Амбулаторный визит последующего наблюдения после окончания последнего лечения.
[0440] Что касается 3 последовательных периодов лечения: в первый день периода 1 субъекты получали сублингвальные таблетки 5 мг азенапина 2 р/сут (= два раза в сутки) (препарат сравнения), во время периода 2 - однократную дозу ТТС, изготовленной по справочному примеру 2с (3 ТТС по 10 см2 каждая) и во время периода 3 - однократную дозу ТТС, изготовленной по справочному примеру 2d (1 ТТС 15 см2).
Выбор популяции исследования
[0441] В фазу лечения включали только субъектов, соответствующие всем критериям включения и ни одному из критериев невключения. Критерии оценивали в ходе скрининга, а повторную проверку проводили в день 1 периода 1.
Критерии включения
[0442] Чтобы иметь право на участие в периоде лечения, субъекты должны были соответствовать всем следующим критериям.
1. Субъекты, способные понимать инструкции и следовать им во время исследования.
2. Предоставить подписанную форму информированного согласия.
3. Принадлежать к европеоидной расе.
4. Быть в возрасте от ≥18 до ≤55 лет.
5. Не курить.
6. Иметь в целом хорошее физическое здоровье, подтвержденное медицинским и хирургическим анамнезом, физическим осмотром, электрокардиограммой (ЭКГ) в 12 отведениях, показателями жизненно важных функций и результатами клинических лабораторных исследований.
7. Иметь массу в пределах нормы согласно принятым значениям индекса массы тела (ИМТ) от 18,0 до 29,4 кг/м2.
8. Иметь нормальное артериальное давление (систолическое артериальное давление (САД) ≥90 и ≤139 мм рт.ст.; диастолическое артериальное давление ≥55 и ≤89 мм рт.ст.), измеренное после 5-минутного отдыха в положении лежа на спине.
9. Иметь частоту пульса ≥50 и ≤99 уд/мин после 5-минутного отдыха в положении лежа на спине.
10. Не иметь на ЭКГ клинически значимых отклонений от нормы.
11. Не иметь повышенной температуры тела или инфекционного заболевания в пределах как минимум 7 дней до первого введения.
Критерии невключения:
[0443] Чтобы убедиться, что субъекты здоровы и находятся в сопоставимом состоянии, были применены следующие критерии невключения.
Ограничения, связанные с образом жизни
1. Чрезмерное потребление ксантина (более 5 чашек кофе или эквивалента в день).
2. Потребление алкоголя в количестве, превышающем умеренное (>35 г этанола в день регулярно или >245 г в неделю регулярно).
3. Наличие в анамнезе любого из злоупотребления алкоголем или наркотиками.
4. Вегетарианство.
5. Положительный результат скрининга на наркотики.
6. Положительный результат дыхательного алкотеста.
7. Употребление ксантинсодержащих продуктов или напитков, а также грейпфрутового сока или севильских апельсинов в пределах 48 часов до первого применения препарата.
8. Употребление жаренной и приготовленной на гриле пищи, брокколи или брюссельской капусты в пределах 72 часов до первого применения препарата.
Предыдущее медикаментозное лечение
9. Применение любых лекарственных препаратов (безрецептурных или отпускаемых по рецепту), за исключением гормональных контрацептивов, в пределах 4 недель до первого введения препарата (или по меньшей мере в течение периода, превышающего в 10 раз соответствующий период полувыведения, в зависимости от того, что длиться дольше).
Медицинский и хирургический анамнез
10. Наличие любого физического заболевания, острого или хронического, в активной стадии.
11. Наличие в анамнезе гиперчувствительности к лекарственным препаратам, бронхиальной астмы, крапивницы или другого тяжелого аллергического диатеза, а также текущей сенной лихорадки.
12. Наличие в анамнезе гиперчувствительности к любому компоненту исследуемых лекарственных форм.
13. Наличие в анамнезе хронического гастрита или язвенной болезни.
14. Наличие в анамнезе хронических или рецидивирующих метаболических, почечных, печеночных, легочных, желудочно-кишечных, неврологических (особенно эпилептических припадков), эндокринологических (особенно сахарный диабет), иммунологических, психических или сердечно-сосудистых заболеваний, миопатий, кожных заболеваний и склонности к кровотечениям.
15. Синдром Жильбера.
16. Любые жалобы со стороны желудочно-кишечного тракта в пределах 7 дней до первого введения препарата.
17. Наличие любых шрамов, родинок, татуировки, раздражения кожи или чрезмерного роста волос на участке применения ТТС.
18. Любые суицидальные мысли типа 2-5 по шкале C-SSRS (шкала оценки выраженности суицидальных тенденций Колумбийского университета) за последние 12 месяцев (т.е. активные суицидальные мысли, активные суицидальные мысли с наличием метода, активные суицидальные мысли с намерениями, но без конкретного плана или активные суицидальная мысль с планом и намерением).
Лабораторные исследования
19. Отклонение от нормы лабораторных показателей, имеющих клиническое значение (например, дающих возможность предполагать наличие неизвестного заболевания и требующих дальнейшей клинической оценки со стороны исследователя), особенно уровней аспартатаминотрансферазы (ACT), аланинаминотрансферазы (АЛТ), гамма-глутамилтранспептидазы (ГГТ).
20. Положительный результат анализа на антитела к вирусу иммунодефицита человека (ВИЧ)/антиген р24.
21. Положительный результат анализа на поверхностный антиген вируса гепатита В (HBsAg).
22. Положительный результат анализа на антитела к вирусу гепатита С (антитела к ВГС).
Другое
23. Сдача (донорство) крови в пределах 30 дней до подписания информированного согласия на участие в этом исследовании.
24. Участие в фазе лечения клинического исследования в течение 30 дней или блокировка в периоде наблюдения предыдущего клинического исследования до подписания информированного согласия на участие в этом исследовании.
25. Женщины детородного возраста, не использующие высокоэффективный метод контрацепции. Под высокоэффективными методами контрацепции понимают такие методы, которые при последовательном и правильном использовании приводят к низкому проценту неэффективности, т.е. менее 1% в год (например, сочетание внутриматочной спирали и презерватива). Считается, что субъекты женского пола способны к рождению детей, если они не стерилизованы хирургически путем гистерэктомии, двусторонней перевязки маточных труб или не пребывают в периоде в постменопаузе в течение по меньшей мере 2 лет.
26. Беременные или кормящие женщины.
Виды лечения, используемые во время исследования
[0444] Виды лечения, используемые во время исследования, кратко изложены в таблице 13.1 ниже, а их характеристики подробно описаны ниже.
[0445]
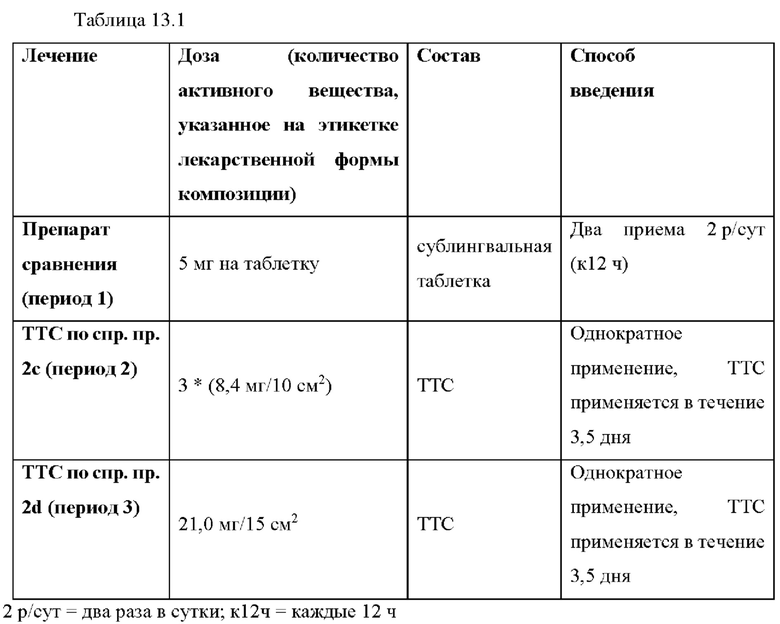
[0446] Препарат сравнения, вводимый в период 1, содержит активный ингредиент малеат азенапина и продается под торговым названием Сикрест®, сублингвальные таблетки, 5 мг, производства компании N.V. Organon, г. Осс, Нидерланды. Номер централизованной аптеки (PZN): 07728207.
Применение сублингвальных таблеток (препарат сравнения)
[0447] Сублингвальные таблетки вводили утром и вечером только в первый день с 12-часовым перерывом между двумя введениями в соответствии с инструкциями по введению, приведенными в краткой характеристике лекарственного препарата. Субъектов инструктировали положить таблетки под язык по меньшей мере на 10 минут, чтобы дать сублингвальной таблетке раствориться, и не разжевывать и не глотать сублингвальные таблетки.
Применение ТТС
[0448] ТТС накладывали на интактную кожу верхней части грудной клетки или верхней части спины. Волосы в области наложения при необходимости подстригали ножницами (не сбривали). Перед применением ТТС субъектов просили проверить, чтобы на коже не было детергентов, масел и жира. ТТС помещали в желаемое положение и прижимали в течение не менее 30 секунд пальцами или ладонью для фиксации ТТС на поверхности кожи. В случае необходимости и во избежание дальнейшего отклеивания ТТС дополнительно фиксировали поверх адгезивным покрытием, не содержащим активного агента. Необязательное адгезивное покрытие помещали поверх ТТС таким образом, чтобы каждая сторона была в равной степени покрыта адгезивным покрытием. Затем для фиксации ТТС ее снова прижимали не менее 30 секунд пальцами или ладонью. ТТС удаляли через 3,5 дня (84 часа, период 2 и период 3). После удаления использованные ТТС (включая адгезивное покрытие, если применимо) обрабатывали и хранили в атмосфере азота в холодильнике до дальнейшего анализа.
График дозирования препарата для каждого субъекта
[0449] В первый день периода 1 завтрак не подавали; перед утренним введением субъекты воздерживались от приема пищи в течение ночи. Стандартный обед давали через 4 часа, а ужин примерно через 10 часов после утреннего приема препарата. Не разрешался прием жидкости за 1 час до и через 1 час после утреннего и вечернего приема. Поскольку еда не взаимодействует с ТТС, субъекты получали стандартизированную еду и напитки в дни участия в периоде 2 и 3 исследования в обычное время. В дни участия в исследовании субъектам разрешалось употреблять только еду или напитки, предоставленные в исследовательском центре.
Ограничения и меры предосторожности
[0450] Во время исследования субъектов проинструктировали воздерживаться от всех видов деятельности, которые могут повысить температуру тела, например, от физических нагрузок, сауны, пребывания в помещениях с высокой температурой. Во время ношения ТТС субъектам не разрешалось выполнять какие-либо действия, которые могут повлиять на адгезию ТТС, например, любые действия, которые могут усилить потоотделение. Были введены дополнительные ограничения на потребление пищи и напитков, например в соответствии с критериями невключения.
Взятие образцов и определение концентраций в плазме крови
[0451] Образцы крови для определения концентрации азенапина и его метаболитов в плазме крови брали в определенные моменты времени после введения.
[0452] Для определения концентрации азенапина, N-десметилазенапина и азенапина глюуронида в плазме крови использовали утвержденный стандартизованный в лаборатории метод жидкостной хроматографии с тандемной масс-спектрометрией, который выполняли в лаборатории, сертифицированной в соответствии с требованиями НЛП (Надлежащая лабораторная практика). Концентрации азенапина глюкуронида в плазме были определены только у 8 субъектов, что не оказало влияния на достоверность результатов или интерпретацию результатов исследования. Нижние пределы количественного определения (НПКО) составляли 0,1 нг/мл для азенапина и N-десметилазенапина в плазме и 0,25 нг/мл для азенапина глюкуронида.
Нежелательные явления (НЯ)
[0453] Нежелательные явления были установлены исследователем с использованием ненаводящих вопросов, отмеченных как спонтанные сообщения субъектов медицинскому персоналу или наблюдаемые во время любых измерений во все дни исследования после введения лекарственной формы и оцененные врачом-исследователем.
[0454] Кроме того, отслеживался риск суицида. Все положительные отчеты во время исследования были зарегистрированы как нежелательные явления. Суицидальное мышление типа 1-3 регистрировали как несерьезное НЯ. Суицидальное мышление типа 4 и 5 и все суицидальное поведение во время исследования регистрировали как серьезное нежелательное явление (СНЯ) и подавали информацию о них в отчетности.
[0455] Для НЯ указывали связь с лечением и момент времени, после которого оно возникло, то есть любое НЯ, возникшее до первого введения, считается исходной жалобой / НЯ до лечения и не включается в приведенный ниже анализ.
Результаты и анализы
[0456] Все 16 субъектов завершили период 1 (прием препарата сравнения) исследования. После периода 1 (прием препарата сравнения) и до начала периода 2 (применение препарата по спр. пр. 2с) 1 субъект выбыл. Другой субъект выбыл в ходе периода 3 (применение препарата по спр. пр. 2d), но мог быть оценен в анализе нежелательных явлений. Лабораторные показатели безопасности, показатели жизненно важных функций и параметры ЭКГ не показали значимых с медицинской точки зрения изменений. Результаты исследования представлены в таблицах 13.2-13.9 и на Фиг. 13а-13е.
Арифметическое среднее значение концентрации азенапина в плазме крови
[0457] Арифметические средние значения концентрации азенапина в плазме крови на основании результатов, полученных у 16 субъектов для периода 1 и у 15 и 14 субъектов, завершивших участие в периодах 2 и 3 соответственно, вместе с показателями стандартного отклонения представлены в таблице 13.2 и на Фиг. 13а и 13b. Значения AUC рассчитывали на основе концентраций в плазме крови. Показатель tlag рассчитывали приблизительно как среднее арифметическое значение первого момента времени, когда получена измеряемая (т.е. ненулевая) концентрация азенапина в плазме крови, и результаты также представлены в таблице 13.2.
[0458]
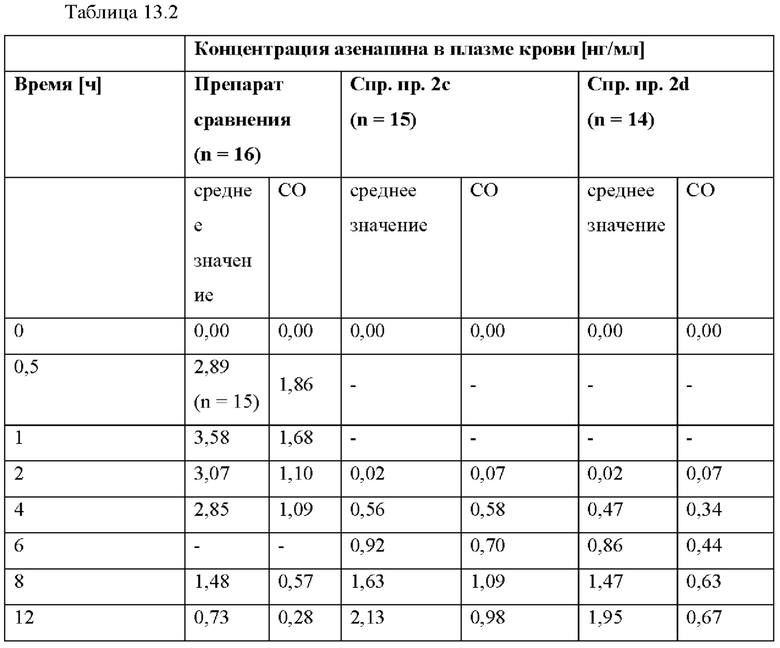
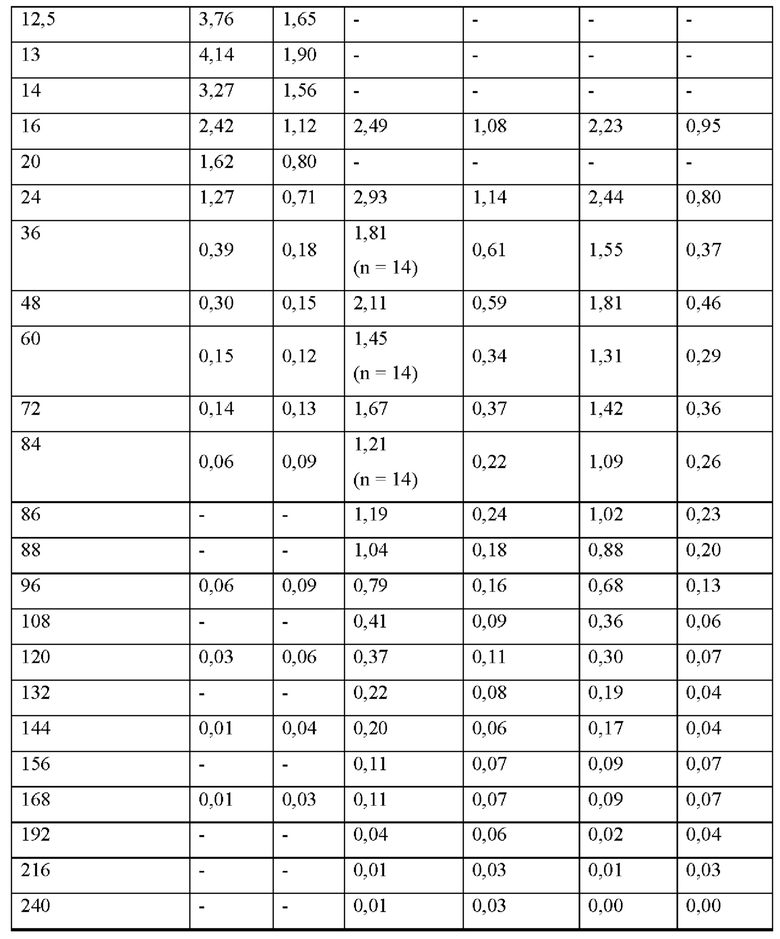
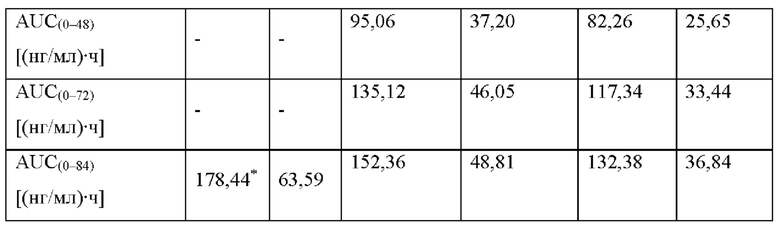
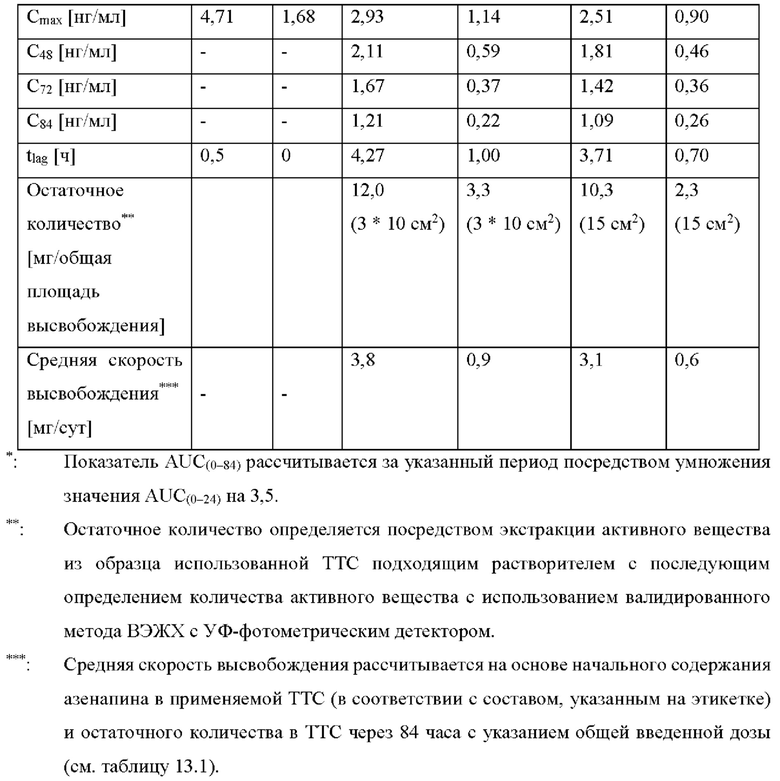
Фармакокинетический анализ азенапина и метаболитов
[0459] На основании данных о концентрации азенапина и метаболитов в плазме в зависимости от времени были рассчитаны фармакокинетические параметры в плазме с использованием некомпартментных процедур, и результаты представлены в таблицах 13.3-13.5, где Ccp. представляет собой среднюю концентрацию; наблюдаемую в течение соответствующего интервала применения препарата (12 часов для периода 1. / препарата сравнения и 84 часа для периодов 2 и 3 / справочные примеры 2с и 2d), и где tlag представляет время первой поддающейся количественной оценке концентрации после введения. Для значений Ccp. и tlag препарата сравнения учитывали только первый интервал применения препарата (0-12 часов). Кроме того, профиль концентрации в плазме крови метаболитов азенапина глюкуронида и N-десметилазенапина был изображен как средние геометрические значения с указанием среднего геометрического значения, умноженного на геометрическое стандартное отклонение и разделенное на него, представленного на Фиг. 13с, 13d и 13е в виде планок погрешностей.
[0460] Биометрическая оценка проводилась с использованием программного обеспечения SAS версии 9.3 системы SAS для Windows. Фармакокинетические расчеты проводились с использованием программного обеспечения Phoenix WinNonlin версии 6.4. Фармакокинетические расчеты основывались на данных всех субъектов, завершивших не менее 2 периодов лечения, т.е. имеющих поддающиеся оценке данные по азенапину и N-десметилазенапину для препарата сравнения и, по меньшей мере, для одного препарата из справочных примеров 2а или 2b. Таким образом, количество субъектов составляло n=15 для периодов 1 и 2 (препарат сравнения и справочный пример 2 с) и n=14 для периода 3 (справочный пример 2d). Для азенапина глюкуронида количество субъектов составляло n=8 для всех периодов. Значения ниже НПКО были исключены из всех расчетов для описательной статистики. Описательную статистику концентраций рассчитывали, если по меньшей мере 1/2 измерений отдельных точек данных были равны или превышали НПКО.
[0461] Расчет фармакокинетических характеристик был основан на фактическом времени взятия крови [ч] (относительно соответствующего времени введения препарата - приемлемые отклонения от запланированного времени взятия крови находились в пределах 3,5%) с округлением до 2 десятичных знаков, и отрицательное время перед применением препарата устанавливали как ноль.
[0462] В моменты времени в промежутке времени между нулевым моментом времени и первой поддающейся количественной оценке концентрацией ниже НПКО считали как нулевые. Концентрации ниже НПКО между двумя поддающимися количественному определению концентрациями считали как половину значения НПКО. Конечные концентрации ниже НПКО в расчетах не использовали.
[0463] Показатели описательной статистики фармакокинетических параметров рассчитывали отдельно для каждого из периодов 1, 2 и 3. Для tmax были составлены таблицы частот по варианту лечения на основе номинального времени tmax.
[0464] Для каждого из препарата сравнения и препаратов справочных примеров 2с и 2d, сравнивали Фармакокинетические параметры азенапина и метаболитов с помощью исследовательской модели дисперсионного анализа (ANOVA). Арифметические и геометрические средние значения, используемые для расчета точечных оценочных функций, таких как различия или соотношения между вариантами лечения, были получены из ANOVA как средние значения, рассчитанные по методу наименьших квадратов (LSMEANS) или как LSMEANS с экспоненциальным преобразованием соответственно. Включение 90%-ного доверительного интервала предполагает значение α=0,05 для ошибки I рода. Не проводили α-коррекцию.
[0465] Основываясь на фундаментальных фармакокинетических отношениях, для всех параметров, связанных с концентрацией применялась мультипликативная модель. Это означает, что указанные характеристики были скорее логарифмическими, чем нормально распределенными. Следовательно, анализ ANOVA выполняли после логарифмического преобразования. Иллюстративные результаты представлены в таблицах 13.6 и 13.7.
[0466] Профиль концентрации азенапина в плазме показывает, что терапевтические концентрации могут поддерживаться в течение всего периода ношения ТТС без значительных колебаний. По сравнению с сублингвальным введением максимальные концентрации после трансдермального применения были ниже и достигались позже. Образование основных метаболитов, N-десметилазенапина и азенапина глюкуронида заметно снижалось по сравнению с сублингвальным введением.
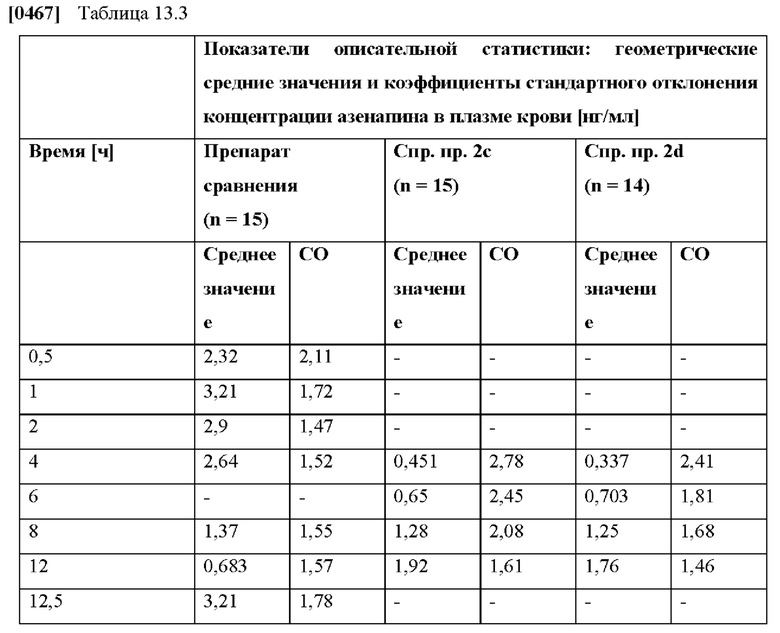
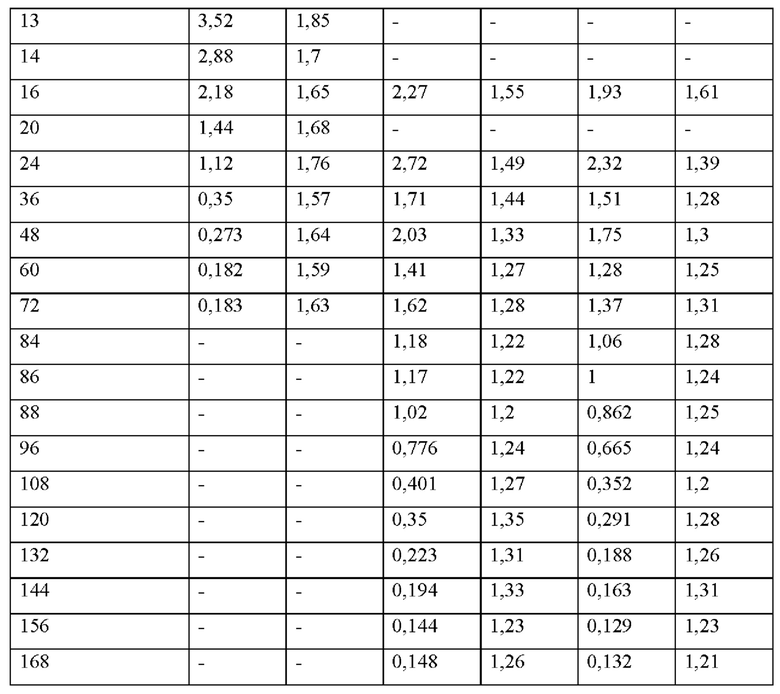
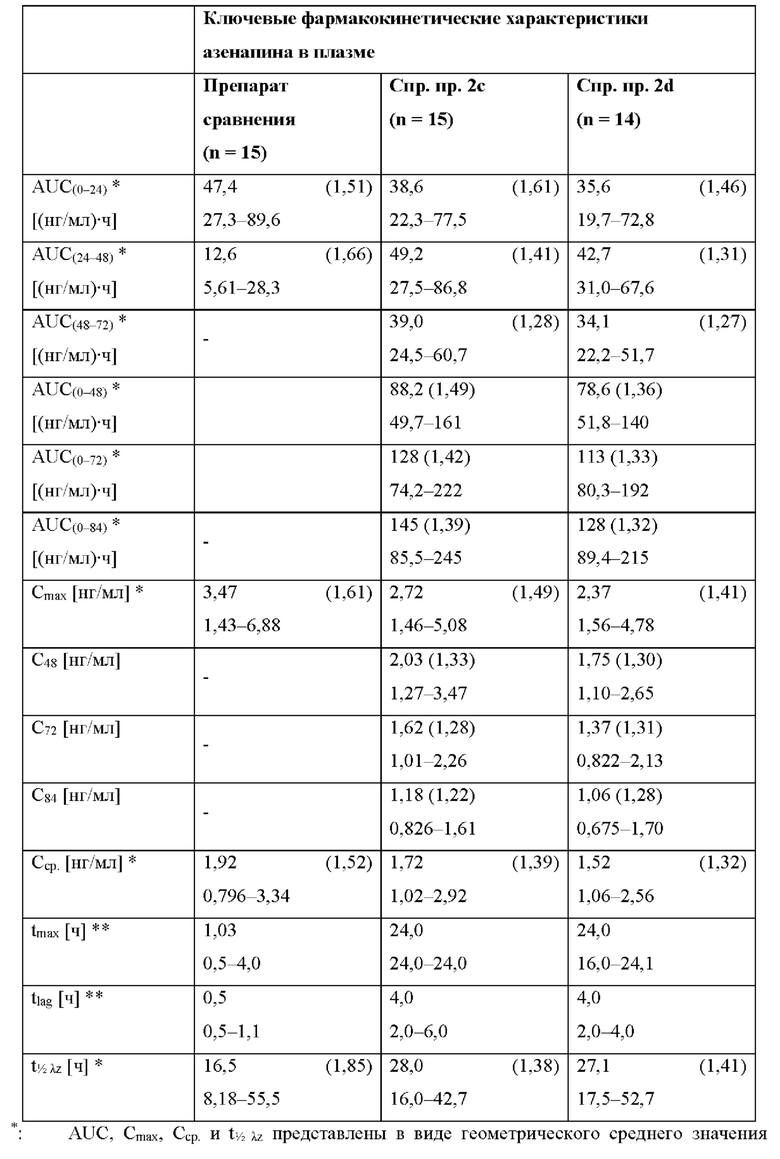

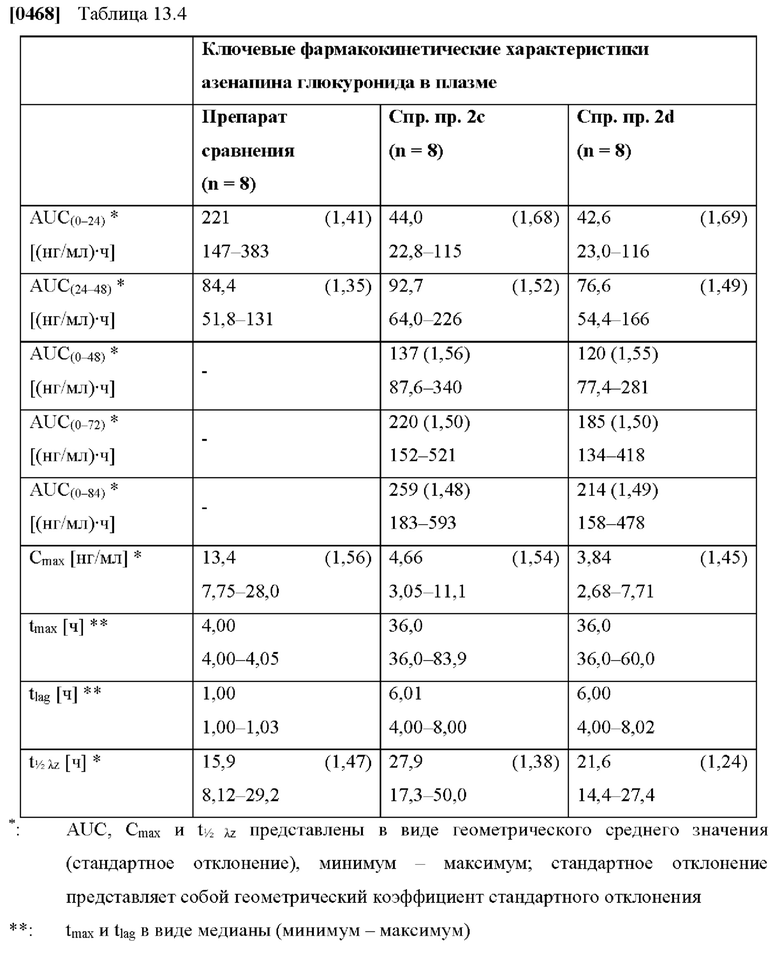
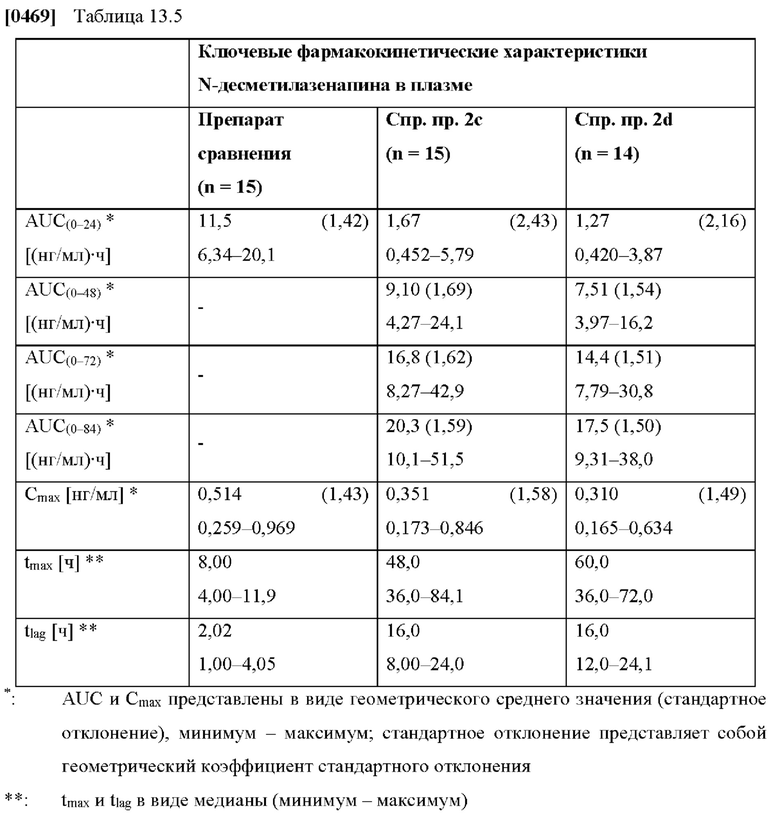
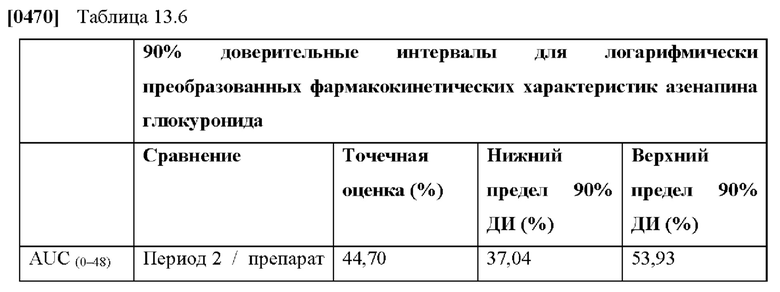
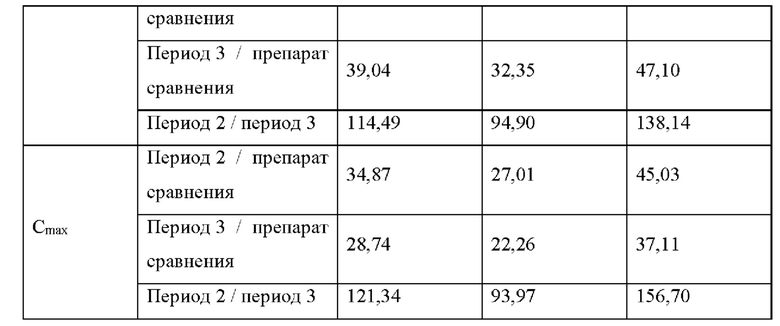
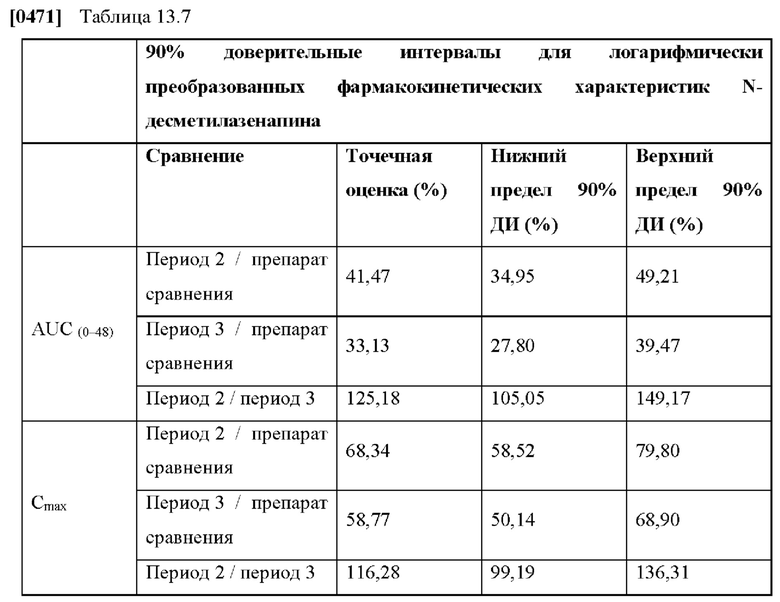
Нежелательные явления (НЯ)
[0472] В таблицах 13.8 и 13.9 отражено количество нежелательных явлений, зарегистрированных в различных категориях.
[0473] Хотя продолжительность лечения таблеткой для сублингвального применения (препарат сравнения) составляла всего 12 ч (т.е. 2 приема) по сравнению с 3,5 днями применения ТТС (справочные примеры 2с и 2d), общие системные побочные эффекты лечения азенапином, такие как усталость и головокружение наблюдались реже после применения ТТС и, в случае усталости, они были только легкой интенсивности. В сравнении с сублингвальным применением препарата (препарат сравнения), при трансдермальном введении частота и интенсивность усталости была значительно ниже, а головокружение возникало реже.
[0474] Симптомы дискомфорта в ротовой полости, такие как гипестезия и сухость во рту, которые наблюдались после применения препарата сравнения, не регистрировались при применении ТТС (справочные примеры 2с и 2d).
[0475] Местная переносимость в месте нанесения была хорошей, изредка наблюдались лишь легкие реакции (пять НЯ), которые исчезли без вмешательства.
[0476] Дисменорея, о которой сообщалось в ходе периода 3, которая была умеренной по интенсивности, не была связана с применением ТТС по справочному примеру 2d.
[0477] Не было зарегистрировано СНЯ, и ни у одного из субъектов на возникало суицидальное мышление.
[0478] В целом трансдермальное применение азенапина было безопасным и хорошо переносимым. НЯ наблюдаемые после введения любого из ТТС (периоды 2 и 3), были в основном легкими и преходящими, разрешались без вмешательства, а частота НЯ была ниже по сравнению с периодом 1 применения препарата сравнения.
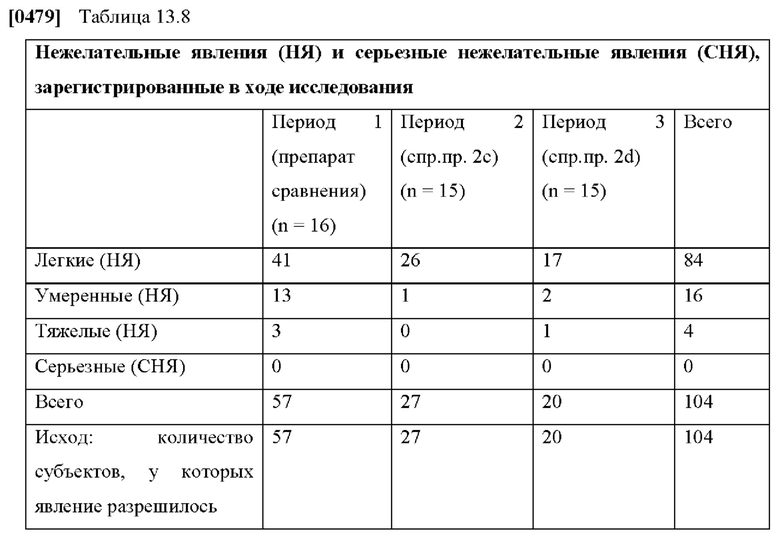
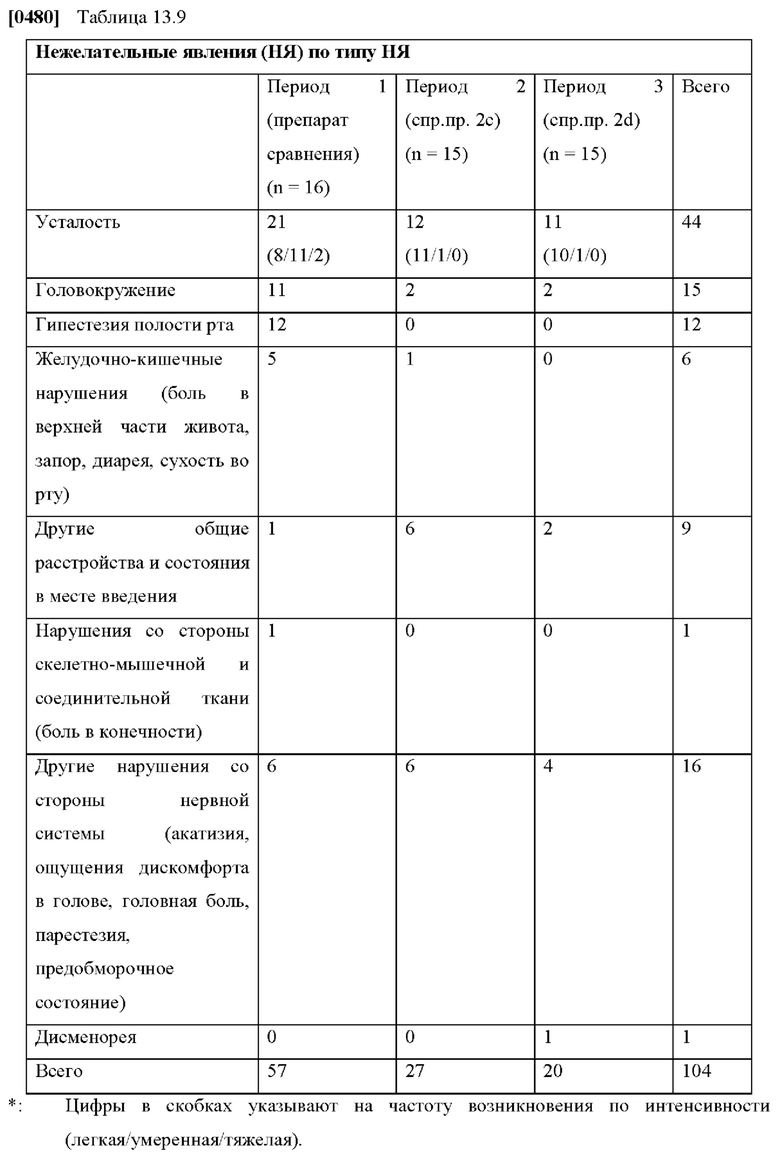
Изобретение относится, в частности, к следующим дополнительным пунктам:
1. Трансдермальная терапевтическая система для трансдермального введения азенапина, включающая в себя структуру самоклеящегося слоя, содержащую терапевтически эффективное количество азенапина, при этом указанная структура самоклеящегося слоя содержит:
A) защитный слой;
B) азенапин-содержащий матричный слой, состоящий из композиции матричного слоя, которая содержит:
1. азенапин;
2. полимер, выбранный из акриловых полимеров;
3. дополнительный полимер; и
4. α-токоферол в количестве от 0,01 до 2% композиции матричного слоя и аскорбилпальмитат в количестве, составляющем по меньшей мере 0,01% композиции матричного слоя, в качестве стабилизаторов.
2. Трансдермальная терапевтическая система по п. 1,
отличающаяся тем, что композиция матричного слоя дополнительно содержит в качестве стабилизатора метабисульфит натрия в количестве 0-0,5%, предпочтительно 0,01-0,2%, и более предпочтительно 0,05-0,15% композиции матричного слоя.
3. Трансдермальная терапевтическая система по п. 2,
отличающаяся тем, что, композиция матричного слоя дополнительно содержит в качестве стабилизатора метабисульфит натрия в количестве приблизительно 0,1% композиции матричного слоя.
4. Трансдермальная терапевтическая система по любому из пп. 1-3,
отличающаяся тем, что композиция матричного слоя содержит α-токоферол в количестве, составляющем по меньшей мере 0,025% композиции матричного слоя, и/или отличающаяся тем, что композиция матричного слоя содержит α-токоферол в количестве до 1,5% или 0,75%, предпочтительно до 0,5% и более предпочтительно до 0,1% композиции матричного слоя.
5. Трансдермальная терапевтическая система по п. 4, отличающаяся тем, что композиция матричного слоя содержит α-токоферол в количестве приблизительно 0,05% композиции матричного слоя.
6. Трансдермальная терапевтическая система по любому из пп. 1-5,
отличающаяся тем, что композиция матричного слоя содержит аскорбилпальмитат в количестве, составляющем по меньшей мере 0,02%, предпочтительно по меньшей мере 0,08% и более предпочтительно по меньшей мере 0,15% композиции матричного слоя, и/или отличающаяся тем, что композиция матричного слоя содержит аскорбилпальмитат в количестве до 2,0 или 1,0% и предпочтительно до 0,6% композиции матричного слоя.
7. Трансдермальная терапевтическая система по п. 6,
отличающаяся тем, что композиция матричного слоя содержит аскорбилпальмитат в количестве от 0,2% до 0,4% композиции матричного слоя.
8. Трансдермальная терапевтическая система по любому из пп. 1-7,
отличающаяся тем, что дополнительный полимер выбран из полимеров, которые обеспечивают улучшенное поглощение воды и/или влаги матричным слоем, и более предпочтительно из поливинилпирролидонов и наиболее предпочтительно из растворимых поливинилпирролидонов.
9. Трансдермальная терапевтическая система по п. 8,
отличающаяся тем, что дополнительный полимер представляет собой поливинилпирролидон, имеющий K-значение в диапазоне, выбранном из группы диапазонов, состоящей из
9-15 и предпочтительно 10,2-13,8,
15 20 и предпочтительно 15,3 18,4,
20-27 и предпочтительно 22,5-27,0,
27-35 и предпочтительно 27,0-32,4, и
75 110 и предпочтительно 81,0 97,2,
или любых их смесей, и предпочтительно представляет собой поливинилпирролидон, имеющий K-значение в диапазоне 27,0-32,4 или 81,0-97,2, или любые их смеси, и более предпочтительно представляет собой поливинилпирролидон, имеющий K-значение в диапазоне 27,0-32,4.
10. Трансдермальная терапевтическая система по п. 8 или 9,
отличающаяся тем, что композиция матричного слоя содержит дополнительный полимер, выбранный из поливинилпирролидонов, и предпочтительно из растворимых поливинилпирролидонов, в количестве от 0 до 20% композиции матричного слоя, предпочтительно от 5 до 15% композиции матричного слоя и более предпочтительно в количестве приблизительно 10% композиции матричного слоя.
11. Трансдермальная терапевтическая система по любому из пп. 1-10,
отличающаяся тем, что Трансдермальная терапевтическая система содержит по меньшей мере 0,70 мг/см2, предпочтительно по меньшей мере 0,80 мг/см2, более предпочтительно по меньшей мере 0,82 мг/см2 и наиболее предпочтительно по меньшей мере 0,83 мг/см2 азенапина.
12. Трансдермальная терапевтическая система по любому из пп. 1-11,
отличающаяся тем, что Трансдермальная терапевтическая система содержит от 0,70 мг/см2 до 4,0 мг/см2, предпочтительно от 0,80 мг/см2 до 3,0 мг/см2, более предпочтительно от 0,82 мг/см2 до 2,0 мг/см2 и наиболее предпочтительно от 0,83 мг/см2 до 1,7 мг/см2 азенапина.
13. Трансдермальная терапевтическая система по любому из пп. 1-12,
отличающаяся тем, что масса матричного слоя на единицу площади находится в диапазоне 90-230 г/м2, предпочтительно 110-210 г/м2 и наиболее предпочтительно 120-170 г/м2.
14. Трансдермальная терапевтическая система по любому из пп. 1-13,
отличающаяся тем, что Трансдермальная терапевтическая система обеспечивает трансдермальную доставку со средней скоростью высвобождения от 0,5 до 20 мг/сут в течение по меньшей мере 48 часов, предпочтительно в течение 72 часов и более предпочтительно в течение 84 часов применения.
15. Трансдермальная терапевтическая система по п. 14,
отличающаяся тем, что Трансдермальная терапевтическая система обеспечивает трансдермальную доставку со средней скоростью высвобождения от 0,5 до 20 мг/сут, предпочтительно от 1,0 до 15 мг/сут, более предпочтительно от 2,0 до 10 мг/сут в течение по меньшей мере 48 часов применения, или
отличающаяся тем, что трансдермальная терапевтическая система обеспечивает трансдермальную доставку со средней скоростью высвобождения от 0,5 до 20 мг/сут, предпочтительно от 1,0 до 15 мг/сут, более предпочтительно от 2,0 до 10 мг/сут в течение по меньшей мере 72 часов применения, или
отличающаяся тем, что трансдермальная терапевтическая система обеспечивает трансдермальную доставку со средней скоростью высвобождения от 0,5 до 20 мг/сут, предпочтительно от 1,0 до 15 мг/сут, более предпочтительно от 2,0 до 10 мг/сут в течение по меньшей мере 84 часов применения.
16. Трансдермальная терапевтическая система по любому из пп. 1-15, отличающаяся тем, что Трансдермальная терапевтическая система обеспечивает трансдермальную доставку с показателем AUC0-48 от 20 до 300 (нг/мл)⋅ч или от более 300 до 450 (нг/мл)⋅ч и предпочтительно обеспечивает трансдермальную доставку с показателем AUC0-48 от 30 до 200 (нг/мл)⋅ч.
17. Трансдермальная терапевтическая система по любому из пп. 1-16, отличающаяся тем, что Трансдермальная терапевтическая система обеспечивает трансдермальную доставку с показателем AUC0-72 от 30 до 400 (нг/мл)⋅ч или от более 400 до 600 (нг/мл)⋅ч и предпочтительно обеспечивает трансдермальную доставку с показателем AUC0-72 от 50 до 300 (нг/мл)⋅ч.
18. Трансдермальная терапевтическая система по любому из пп. 1-17, отличающаяся тем, что Трансдермальная терапевтическая система обеспечивает трансдермальную доставку с показателем AUC0-84 от 35 до 450 (нг/мл)⋅ч или от более 450 до 700 (нг/мл)⋅ч и предпочтительно обеспечивает трансдермальную доставку с показателем AUC0-84 от 60 до 350 (нг/мл)⋅ч.
19. Трансдермальная терапевтическая система по любому из пп. 1-18, отличающаяся тем, что Трансдермальная терапевтическая система обеспечивает трансдермальную доставку с соотношением показателей Cmax и С48 менее 2,0, предпочтительно менее 1,5 и более предпочтительно менее 1,3.
20. Трансдермальная терапевтическая система по любому из пп. 1-19,
отличающаяся тем, что Трансдермальная терапевтическая система обеспечивает трансдермальную доставку с соотношением показателей Cmax и С72 менее 3,0, предпочтительно менее 2,5 и более предпочтительно менее 2,0.
21. Трансдермальная терапевтическая система по любому из пп. 1-20,
отличающаяся тем, что Трансдермальная терапевтическая система обеспечивает трансдермальную доставку с соотношением показателей Cmax и C84 менее 3,5, предпочтительно менее 3,0, более предпочтительно менее 2,5 и наиболее предпочтительно менее 2,0.
22. Трансдермальная терапевтическая система по любому из пп. 1-21,
отличающаяся тем, что азенапин-содержащий матричный слой не содержит изопропилпальмитат в количестве 10% композиции матричного слоя, предпочтительно не содержит изопропилпальмитат в количестве 5-15% композиции матричного слоя и наиболее предпочтительно не содержит изопропилпальмитата.
23. Трансдермальная терапевтическая система по любому из пп. 1-22,
отличающаяся тем, что композиция матричного слоя не содержит никаких полисилоксанов и полиизобутиленов в количестве более 50% композиции матричного слоя.
24. Трансдермальная терапевтическая система по любому из пп. 1-23,
отличающаяся тем, что Трансдермальная терапевтическая система имеет площадь высвобождения от 5 до 100 см2.
25. Трансдермальная терапевтическая система по любому из пп. 1-24,
отличающаяся тем, что азенапин-содержащий матричный слой не содержит изопропилмиристат в количестве 5% композиции матричного слоя, предпочтительно не содержит изопропилмиристат в количестве 110% композиции матричного слоя и наиболее предпочтительно не содержит изопропилмиристата.
26. Трансдермальная терапевтическая система по любому из пп. 1-25,
отличающаяся тем, что азенапин-содержащий матричный слой не содержит этилцеллюлозу в количестве 10-20% композиции матричного слоя и предпочтительно не содержит этилцеллюлозу.
27. Трансдермальная терапевтическая система по любому из пп. 1-26,
отличающаяся тем, что азенапин-содержащий матричный слой не содержит хлористый водород.
28. Трансдермальная терапевтическая система по любому из пп. 1-27,
отличающаяся тем, что азенапин-содержащий матричный слой не содержит толуол.
29. Трансдермальная терапевтическая система по любому из пп. 1-28,
отличающаяся тем, что азенапин-содержащий матричный слой может быть получен путем высушивания нанесенной композиции для покрытия, при этом в композицию для покрытия не включена хлористоводородная кислота.
30. Трансдермальная терапевтическая система по любому из пп. 1-29,
отличающаяся тем, что азенапин-содержащий матричный слой может быть получен путем высушивания нанесенной композиции для покрытия, не содержащей толуол.
31. Трансдермальная терапевтическая система по любому из пп. 1-30,
отличающаяся тем, что в композицию матричного слоя включен азенапин в форме свободного основания.
32. Трансдермальная терапевтическая система по любому из пп. 1-31,
отличающаяся тем, что композиция матричного слоя может быть получена путем включения азенапина в форме свободного основания.
33. Трансдермальная терапевтическая система по любому из пп. 1-32,
отличающаяся тем, что по меньшей мере 90 моль%, предпочтительно по меньшей мере 95 моль%, более предпочтительно по меньшей мере 98 моль% и наиболее предпочтительно по меньшей мере 99 моль% азенапина в матричном слое присутствует в форме свободного основания.
34. Трансдермальная терапевтическая система по любому из пп. 1-33,
отличающаяся тем, что азенапин в матричном слое полностью растворен.
35. Трансдермальная терапевтическая система по любому из пп. 1-34,
отличающаяся тем, что композиция матричного слоя содержит частицы азенапина, предпочтительно состоящие из свободного основания азенапина.
36. Трансдермальная терапевтическая система по любому из пп. 1-35,
отличающаяся тем, что количество азенапина в композиции матричного слоя находится в диапазоне 2-20%, предпочтительно 3-15% и более предпочтительно 4-12% композиции матричного слоя.
37. Трансдермальная терапевтическая система по любому из пп. 1-36,
отличающаяся тем, что азенапин имеет чистоту по меньшей мере 95%, предпочтительно по меньшей мере 98% и более предпочтительно по меньшей мере 99%, как определено с помощью количественной ВЭЖХ.
38. Трансдермальная терапевтическая система по любому из пп. 1-37,
отличающаяся тем, что композиция матричного слоя представляет собой чувствительную к давлению адгезивную композицию.
39. Трансдермальная терапевтическая система по любому из пп. 1-38,
отличающаяся тем, что полимер выбран из чувствительных к давлению адгезивных полимеров.
40. Трансдермальная терапевтическая система по любому из пп. 1-39,
отличающаяся тем, что полимер выбран из акриловых полимеров, содержащих функциональные группы.
41. Трансдермальная терапевтическая система по п. 40,
отличающаяся тем, что функциональные группы выбраны из гидроксильных групп, групп карбоновых кислот, групп нейтрализованных карбоновых кислот и их смесей.
42. Трансдермальная терапевтическая система по п. 41,
отличающаяся тем, что функциональные группы ограничиваются гидроксильными группами.
43. Трансдермальная терапевтическая система по любому из пп. 1-42,
отличающаяся тем, что полимер выбран из акриловых полимеров, которые не содержат групп карбоновых кислот или групп нейтрализованных карбоновых кислот, или тех и других групп.
44. Трансдермальная терапевтическая система по любому из пп. 1-43,
отличающаяся тем, что полимер выбран из акриловых полимеров, которые не содержат кислотных групп.
45. Трансдермальная терапевтическая система по любому из пп. 1-44,
отличающаяся тем, что полимер выбран из акриловых полимеров, содержащих гидроксильные группы и не содержащих группы карбоновых кислот.
46. Трансдермальная терапевтическая система по п. 45,
отличающаяся тем, что полимер представляет собой сополимер на основе винилацетата, 2-этилгексилакрилата, 2-гидроксиэтилакрилата и глицидилметакрилата или сополимер на основе винилацетата, 2-этилгексилакрилата и 2-гидроксиэтилакрилата.
47. Трансдермальная терапевтическая система по любому из пп. 39-46,
отличающаяся тем, что полимер является сшитым сшивающим агентом и предпочтительно сшитым алюминиевым или титановым сшивающим агентом.
48. Трансдермальная терапевтическая система по любому из пп. 39-46,
отличающаяся тем, что полимер не является сшитым сшивающим агентом.
49. Трансдермальная терапевтическая система по любому из пп. 1-48,
отличающаяся тем, что полимер выбран из акриловых полимеров, не содержащих гидроксильные группы и не содержащих группы карбоновых кислот.
50. Трансдермальная терапевтическая система по п. 49,
отличающаяся тем, что полимер выбран из акриловых полимеров, не содержащих функциональные группы.
51. Трансдермальная терапевтическая система по п. 50,
отличающаяся тем, что полимер представляет собой сополимер на основе метилакрилата, 2-этилгексилакрилата и трет-октилакриламида или сополимер на основе 2-этилгексилакрилата и винилацетата.
52. Трансдермальная терапевтическая система по любому из пп. 1-51,
отличающаяся тем, что количество полимера находится в диапазоне 50-90%, предпочтительно 60 85% и более предпочтительно 65 80% композиции матричного слоя.
53. Трансдермальная терапевтическая система по любому из пп. 1-52,
отличающаяся тем, что общее содержание полимеров в композиции матричного слоя находится в диапазоне 60-95%, предпочтительно 70-90% и более предпочтительно 75-85% композиции матричного слоя.
54. Трансдермальная терапевтическая система по любому из пп. 1-53,
отличающаяся тем, что Трансдермальная терапевтическая система имеет площадь высвобождения от 5 до 100 см2, предпочтительно от 5 до 80 см2 и более предпочтительно от 10 до 50 см2, или от 50 до 80 см2, от 10 до 40 см2, или от 10 до 30 см2, или от 55 до 65 см2.
55. Трансдермальная терапевтическая система по любому из пп. 1-54,
отличающаяся тем, что количество азенапина, содержащееся в трансдермальной терапевтической системе, находится в диапазоне 5-100 мг, предпочтительно 10-80 мг и наиболее предпочтительно 15-60 мг.
56. Трансдермальная терапевтическая система по любому из пп. 1-55,
отличающаяся тем, что Трансдермальная терапевтическая система имеет площадь высвобождения 5-100 см2, и количество азенапина, содержащегося в трансдермальной терапевтической системе, находится в диапазоне 5-100 мг.
57. Трансдермальная терапевтическая система по любому из пп. 1-56,
отличающаяся тем, что композиция матричного слоя содержит дополнительные вспомогательные вещества или добавки, выбранные из группы, состоящей из дополнительных полимеров, сшивающих агентов, солюбилизаторов, наполнителей, веществ, придающих клейкость, пластификаторов, стабилизаторов, смягчителей, веществ для ухода за кожей, усилителей проницаемости, регуляторов рН и консервантов.
58. Трансдермальная терапевтическая система по п. 57,
отличающаяся тем, что вещество, придающее клейкость выбрано из полиэтиленгликолей, дипропиленгликоля, смол, сложных эфиров смол, терпенов и их производных, этиленвинилацетатных адгезивов, диметилполисилоксанов и полибутенов и их смесей.
59. Трансдермальная терапевтическая система по п. 58,
отличающаяся тем, что в качестве вещества, придающего клейкость, композиция матричного слоя содержит триглицериды со средней длиной цепи.
60. Трансдермальная терапевтическая система по п. 59,
отличающаяся тем, что композиция матричного слоя в качестве вещества, придающего клейкость, содержит триглицериды со средней длиной цепи в количестве от 0,1 до 14% композиции матричного слоя, предпочтительно от 1 до 13% композиции матричного слоя, более предпочтительно от 3 до 12% композиции матричного слоя и наиболее предпочтительно от 5 до 12% композиции матричного слоя.
61. Трансдермальная терапевтическая система по п. 60,
отличающаяся тем, что композиция матричного слоя в качестве вещества, придающего клейкость, содержит триглицериды со средней длиной цепи в количестве, составляющем приблизительно 10% композиции матричного слоя.
62. Трансдермальная терапевтическая система по любому из пп. 59-61,
отличающаяся тем, что композиция жирных кислот триглицеридов со средней длиной цепи состоит из одного или более из следующих компонентов:
(i) капроновая кислота,
(ii) октановая кислота,
(iii) декановая кислота,
(iv) додекановая кислота и
(v) тетрадекановая кислота.
63. Трансдермальная терапевтическая система по любому из пп. 59-62,
отличающаяся тем, что композиция жирных кислот триглицеридов со средней длиной цепи
состоит из:
(i) 0-5% капроновой кислоты,
(ii) 40,0-90,0% октановой кислоты,
(iii) 10,0-55,0% декановой кислоты,
(iv) 0-5% додекановой кислоты и
(v) 0-2% тетрадекановой кислоты.
64. Трансдермальная терапевтическая система по любому из пп. 59-63,
отличающаяся тем, что композиция жирных кислот триглицеридов со средней длиной цепи
состоит из:
(i) 02% капроновой кислоты,
(ii) 50,0-80,0% октановой кислоты,
(iii) 20,0-45,0% декановой кислоты,
(iv) 0-2% додекановой кислоты и
(v) 0-1% тетрадекановой кислоты.
65. Трансдермальная терапевтическая система по любому из пп. 59-64,
отличающаяся тем, что композиция жирных кислот триглицеридов со средней длиной цепи
состоит из:
(i) 0-2% капроновой кислоты,
(ii) 50,0-65,0% октановой кислоты,
(iii) 30,0-45,0% декановой кислоты,
(iv) 0-2% додекановой кислоты и
(v) 0-1% тетрадекановой кислоты.
66. Трансдермальная терапевтическая система по любому из пп. 59-64,
отличающаяся тем, что композиция жирных кислот триглицеридов со средней длиной цепи
состоит из:
(i) 0-2% капроновой кислоты,
(ii) 65,0-80,0% октановой кислоты,
(iii) 20,0-35,0% декановой кислоты,
(iv) 0-2% додекановой кислоты и
(v) 0-1% тетрадекановой кислоты.
67. Трансдермальная терапевтическая система по любому из пп. 59-66,
отличающаяся тем, что кислотное число триглицеридов со средней длиной цепи составляет 0,5 мг KOH/г или менее, предпочтительно 0,2 мг KOH/г или менее и наиболее предпочтительно 0,1 мг KOH/г или менее.
68. Трансдермальная терапевтическая система по любому из пп. 59-67,
отличающаяся тем, что перекисное число триглицеридов со средней длиной цепи составляет 5,0 мэкв активного О/кг или менее, предпочтительно 2,0 мэкв активного О/кг или менее и наиболее предпочтительно 1,0 мэкв активного О/кг или менее.
69. Трансдермальная терапевтическая система по любому из пп. 59-68,
отличающаяся тем, что гидроксильное число триглицеридов со средней длиной цепи составляет 10 мг KOH/г или менее, предпочтительно 8,0 мг KOH/г или менее и наиболее предпочтительно 5,0 мг KOH/г или менее.
70. Трансдермальная терапевтическая система по п. 57,
отличающаяся тем, что стабилизатор выбран из метабисульфита натрия, аскорбиновой кислоты и ее сложноэфирных производных, бутилированного гидрокситолуола, производных сложных эфиров токоферола, таких как токоферилацетат и токофериллинолеат, а также любых их комбинаций.
71. Трансдермальная терапевтическая система по п. 57,
отличающаяся тем, что усилитель проницаемости выбран из моноэтилового простого эфира диэтиленгликоля, диизопропиладипата, изопропилмиристата, изопропилпальмитата, лауриллактата, диметилпропиленмочевины и смеси простых моноэфиров пропиленгликоля и сложных диэфиров жирных кислот.
72. Трансдермальная терапевтическая система по любому из пп. 1-71,
отличающаяся тем, что композиция матричного слоя не содержит усилителя проницаемости, выбранного из олеиновых кислот, триглицеридов, олеиновых спиртов и их смесей.
73. Трансдермальная терапевтическая система по любому из пп. 1-72,
отличающаяся тем, что композиция матричного слоя не содержит усилителя проницаемости.
74. Трансдермальная терапевтическая система по любому из пп. 1-73,
которая по результатам измерения с помощью диффузионной ячейки Франца с полученной с использованием дерматома кожей человека обеспечивает совокупную скорость проникновения азенапина через кожу в час 48 или в час 72 от 1 мкг/(см2⋅ч) до 20 мкг/(см2⋅ч), предпочтительно от 2 мкг/(см2⋅ч) до 15 мкг/(см2⋅ч) и более предпочтительно от 4 мкг/(см2⋅ч) до 12 мкг/(см2⋅ч).
75. Трансдермальная терапевтическая система по любому из пп. 1-74,
которая по результатам измерения с помощью диффузионной ячейки Франца с полученной с использованием дерматома кожей человека обеспечивает скорость проникновения через кожу азенапина
от 0 мкг/(см2⋅ч) до 10 мкг/(см2⋅ч) в первые 8 часов,
от 2 мкг/(см2⋅ч) до 20 мкг/(см2⋅ч) от часа 8 до часа 24,
от 3 мкг/(см2⋅ч) до 20 мкг/(см2⋅ч) от часа 24 до часа 32,
от 3 мкг/(см2⋅ч) до 20 мкг/(см2⋅ч) от часа 32 до часа 48,
от 2 мкг/(см2⋅ч) до 15 мкг/(см2⋅ч) от часа 48 до часа 72.
76. Трансдермальная терапевтическая система по любому из пп. 1-75,
которая по результатам измерения с помощью диффузионной ячейки Франца с полученной с использованием дерматома кожей человека обеспечивает совокупное проникающее количество азенапина от 0,05 мг/см2 до 1,0 мг/см2, предпочтительно от 0,1 мг/см2 до 0,7 мг/см2 за период времени 48 часов.
77. Трансдермальная терапевтическая система по любому из пп. 1-76,
которая по результатам измерения с помощью диффузионной ячейки Франца с полученной с использованием дерматома кожей человека обеспечивает совокупное проникающее количество азенапина от 0,1 мг/см2 до 2,0 мг/см2, предпочтительно от 0,2 мг/см2 до 1,0 мг/см2 за период времени 72 часа.
78. Трансдермальная терапевтическая система по любому из пп. 1-77,
отличающаяся тем, что матричный слой изначально содержит количество азенапина, составляющее по меньшей мере 95%, предпочтительно по меньшей мере 96%, более предпочтительно по меньшей мере 97% и еще более предпочтительно по меньшей мере 98% теоретического количества азенапина, включенного в матричный слой.
79. Трансдермальная терапевтическая система по любому из пп. 1-78,
отличающаяся тем, что после хранения при температуре 25°С и относительной влажности 60% в течение по меньшей мере 2 месяцев, предпочтительно по меньшей мере 3 месяцев, матричный слой содержит количество азенапина, составляющее по меньшей мере 90%, предпочтительно по меньшей мере 92%, более предпочтительно по меньшей мере 94% и еще более предпочтительно по меньшей мере 95% теоретического количества азенапина, включенного в матричный слой.
80. Трансдермальная терапевтическая система по любому из пп. 1-79,
отличающаяся тем, что после хранения при температуре 40°С и относительной влажности 75% в течение по меньшей мере 2 месяцев, предпочтительно по меньшей мере 3 месяцев, матричный слой содержит количество азенапина, составляющее по меньшей мере 88%, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 91% и еще более предпочтительно по меньшей мере 92% теоретического количества азенапина, включенного в матричный слой.
81. Трансдермальная терапевтическая система по любому из пп. 1-80,
отличающаяся тем, что матричный слой изначально содержит общее количество продуктов разложения азенапина, составляющее менее 0,7%, предпочтительно менее 0,5%, более предпочтительно менее 0,3% и еще более предпочтительно менее 0,2%.
82. Трансдермальная терапевтическая система по любому из пп. 1-81,
отличающаяся тем, что после хранения при температуре 25°С и относительной влажности 60% в течение по меньшей мере 2 месяцев, предпочтительно по меньшей мере 3 месяцев, матричный слой содержит общее количество продуктов разложения азенапина, составляющее менее 1,0%, предпочтительно менее 0,7%, более предпочтительно менее 0,5% и еще более предпочтительно менее 0,4%.
83. Трансдермальная терапевтическая система по любому из пп. 1-79,
отличающаяся тем, что после хранения при температуре 40°С и относительной влажности 75% в течение по меньшей мере 2 месяцев, предпочтительно по меньшей мере 3 месяцев, матричный слой содержит общее количество продуктов разложения азенапина, составляющее менее 3,0%, предпочтительно менее 2,0%, более предпочтительно менее 1,5% и еще более предпочтительно менее 0,7%.
84. Трансдермальная терапевтическая система по любому из пп. 1-83,
дополнительно содержащая удаляемую защитную подложку.
85. Трансдермальная терапевтическая система по любому из пп. 1-84,
дополнительно содержащая адгезивное покрытие или не содержащая адгезивного покрытия и предпочтительно не содержащая адгезивного покрытия.
86. Трансдермальная терапевтическая система по любому из пп. 1-85,
отличающаяся тем, что защитный слой является по существу непроницаемым для азенапина.
87. Трансдермальная терапевтическая система по любому из пп. 1-86,
отличающаяся тем, что структура самоклеящегося слоя не содержит дополнительный слой контакта с кожей.
88. Трансдермальная терапевтическая система по любому из пп. 1-87,
отличающаяся тем, что структура самоклеящегося слоя содержит дополнительный слой контакта с кожей.
89. Трансдермальная терапевтическая система по п. 88,
отличающаяся тем, что структура самоклеящегося слоя содержит мембрану, расположенную между матричным слоем и дополнительным слоем контакта с кожей, причем мембрана предпочтительно представляет собой мембрану, регулирующую скорость.
90. Трансдермальная терапевтическая система по любому из пп. 1-89,
отличающаяся тем, что структура самоклеящегося слоя содержит дополнительный резервуарный слой, расположенный между защитным слоем и матричным слоем, и дополнительную мембрану, регулирующую скорость, расположенную между дополнительным резервуарным слоем и матричным слоем.
91. Трансдермальная терапевтическая система по любому из пп. 1-90,
отличающаяся тем, что Трансдермальная терапевтическая система представляет собой ТТС матричного типа.
92. Трансдермальная терапевтическая система по любому из пп. 1-91, для использования в способе лечения, предпочтительно для использования в способе лечения психоза и более предпочтительно для использования в способе лечения одного или более состояний, выбранных из шизофрении, биполярного расстройства, посттравматического стрессового расстройства, большого депрессивного расстройства, психоза на фоне деменции, тревожного возбуждения и маниакального расстройства.
93. Трансдермальная терапевтическая система по п. 92,
для использования в способе лечения шизофрении и/или биполярного расстройства.
94. Трансдермальная терапевтическая система по п. 92,
для использования в способе лечения биполярное расстройство, в частности, острых маниакальных или смешанных эпизодов биполярного расстройства.
95. Трансдермальная терапевтическая система по любому из пп. 92-94,
для использования в способе лечения с интервалом введения по меньшей мере 24 часа или 1 день, по меньшей мере 48 часов или 2 дня или по меньшей мере 72 часа или 3 дня.
96. Трансдермальная терапевтическая система по любому из пп. 92-95,
для использования в способе лечения с интервалом введения до 168 часов или 7 дней, до 120 часов или 5 дней или до 96 часов или 4 дней.
97. Трансдермальная терапевтическая система по п. 95,
для использования в способе лечения с интервалом введения 24 часа или 1 день.
98. Трансдермальная терапевтическая система по п. 95,
для использования в способе лечения с интервалом введения 48 часов или 2 дня.
99. Трансдермальная терапевтическая система по п. 95,
для использования в способе лечения с интервалом введения 84 часа или 3,5 дня.
100. Трансдермальная терапевтическая система по любому из пп. 92-99, для использования в способе лечения пациента,
отличающаяся тем, что Трансдермальная терапевтическая система обеспечивает уменьшение по меньшей мере одного связанного с применением азенапина побочного эффекта по сравнению с эквивалентной дозой азенапина для сублингвального применения.
101. Трансдермальная терапевтическая система по п. 94 для использования в способе лечения пациента, отличающаяся тем, что
пациент является человеком, страдающим от усталости, сонливости, головокружения или любой их комбинации, или
по меньшей мере одним связанным с применением азенапина побочным эффектом является утомляемость, сонливость, головокружение, гипестезия полости рта или любая их комбинация, или
частота возникновения по меньшей мере одного связанного с применением азенапина побочного эффекта по сравнению с эквивалентной дозой азенапина для сублингвального применения уменьшается по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 70% или по меньшей мере приблизительно на 80%, и/или уменьшается интенсивность по меньшей мере одного связанного с применением азенапина побочного эффекта по сравнению с эквивалентной дозой азенапина для сублингвального применения, или
по меньшей мере одним связанным с применением азенапина побочным эффектом является усталость, и частота возникновения усталости по сравнению с эквивалентной дозой азенапина для сублингвального применения уменьшается по меньшей мере приблизительно на 30%, или по меньшей мере приблизительно на 40%, и/или уменьшается интенсивность усталости по сравнению с эквивалентной дозой азенапина для сублингвального применения, или
по меньшей мере одним связанным с применением азенапина побочным эффектом является головокружение, и частота возникновения головокружения по сравнению с эквивалентной дозой азенапина для сублингвального применения уменьшается по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 70% или по меньшей мере приблизительно на 80%.
102. Трансдермальная терапевтическая система по любому из пп. 1-101,
для применения в способе уменьшения у пациента по меньшей мере одного связанного с применением азенапина побочного эффекта по сравнению с эквивалентной дозой азенапина для сублингвального применения.
103. Трансдермальная терапевтическая система по п. 102 для применения в способе уменьшения у пациента по меньшей мере одного связанного с применением азенапина побочного эффекта по сравнению с эквивалентной дозой азенапина для сублингвального применения, отличающаяся тем, что:
пациент является человеком, страдающим от усталости, сонливости, головокружения или любой их комбинации, или
по меньшей мере одним связанным с применением азенапина побочным эффектом является утомляемость, сонливость, головокружение, гипестезия полости рта или любая их комбинация, или
частота возникновения по меньшей мере одного связанного с применением азенапина побочного эффекта по сравнению с эквивалентной дозой азенапина для сублингвального применения уменьшается по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 70% или по меньшей мере приблизительно на 80%, и/или уменьшается интенсивность по меньшей мере одного связанного с применением азенапина побочного эффекта по сравнению с эквивалентной дозой азенапина для сублингвального применения, или
по меньшей мере одним связанным с применением азенапина побочным эффектом является усталость, и частота возникновения усталости по сравнению с эквивалентной дозой азенапина для сублингвального применения уменьшается по меньшей мере приблизительно на 30%, или по меньшей мере приблизительно на 40%, и/или уменьшается интенсивность усталости по сравнению с эквивалентной дозой азенапина для сублингвального применения, или
по меньшей мере одним связанным с применением азенапина побочным эффектом является головокружение, и частота возникновения головокружения по сравнению с эквивалентной дозой азенапина для сублингвального применения уменьшается по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 70% или по меньшей мере приблизительно на 80%.
104. Способ лечения и, в частности, способ лечения психоза, и более предпочтительно, способ лечения одного или более состояний, выбранных из шизофрении, биполярного расстройства, посттравматического стрессового расстройства, большого депрессивного расстройства, психоза на фоне деменции, тревожного возбуждения и маниакального расстройства,
включающий применение трансдермальной терапевтической системы по любому из пп. 1-91 на коже пациента.
105. Способ лечения шизофрении и/или биполярного расстройства,
включающий применение трансдермальной терапевтической системы по любому из пп. 1-91 на коже пациента.
106. Способ лечения биполярного расстройства и, в частности, острых маниакальных или смешанных эпизодов биполярного расстройства,
включающий применение трансдермальной терапевтической системы по любому из пп. 1-91 на коже пациента.
107. Способ лечения по любому из пп. 104-106, включающий применение трансдермальной терапевтической системы по любому из пп. 1-91 на коже пациента в течение по меньшей мере 24 часов или 1 дня, по меньшей мере 48 часов или 2 дней или по меньшей мере 72 часов или 3 дней.
108. Способ лечения по любому из пп. 104-106,
включающий применение трансдермальной терапевтической системы по любому из пп. 1-91 на коже пациента в течение периода до 168 часов или 7 дней, до 120 часов или 5 дней или до 96 часов или 4 дней.
109. Способ лечения по любому из пп. 104-106,
включающий применение трансдермальной терапевтической системы по любому из пп. 1-91 на коже пациента в течение 24 часов или 1 дня.
110. Способ лечения по любому из пп. 104-106,
включающий применение трансдермальной терапевтической системы по любому из пп. 1-91 на коже пациента в течение 48 часов или 2 дней.
111. Способ лечения по любому из пп. 104-106,
включающий применение трансдермальной терапевтической системы по любому из пп. 1-91 на коже пациента в течение 84 часов или 3,5 дней.
112. Способ лечения по любому из пп. 104-111,
отличающийся тем, что транс дермальная терапевтическая система обеспечивает уменьшение по меньшей мере одного связанного с применением азенапина побочного эффекта по сравнению с эквивалентной дозой азенапина для сублингвального применения.
113. Способ лечения по п. 112,
отличающийся тем, что пациент является человеком, страдающим от усталости, сонливости, головокружения или любой их комбинации.
114. Способ лечения по п. 112 или 113,
отличающийся тем, что по меньшей мере одним связанным с применением азенапина побочным эффектом является утомляемость, сонливость, головокружение, гипестезия полости рта или любая их комбинация.
115. Способ лечения по любому из пп. 112-114,
отличающийся тем, что частота возникновения по меньшей мере одного связанного с применением азенапина побочного эффекта по сравнению с эквивалентной дозой азенапина для сублингвального применения уменьшается по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 70% или по меньшей мере приблизительно на 80%, и/или отличающийся тем, что уменьшается интенсивность по меньшей мере одного связанного с применением азенапина побочного эффекта по сравнению с эквивалентной дозой азенапина для сублингвального применения.
116. Способ лечения по п. 115, отличающийся тем, что
по меньшей мере одним связанным с применением азенапина побочным эффектом является усталость, и частота возникновения усталости по сравнению с эквивалентной дозой азенапина для сублингвального применения уменьшается по меньшей мере приблизительно на 30%, или по меньшей мере приблизительно на 40%, и/или уменьшается интенсивность усталости по сравнению с эквивалентной дозой азенапина для сублингвального применения, или
по меньшей мере одним связанным с применением азенапина побочным эффектом является головокружение, и частота возникновения головокружения по сравнению с эквивалентной дозой азенапина для сублингвального применения уменьшается по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 70% или по меньшей мере приблизительно на 80%.
117. Способ уменьшения у пациента по меньшей мере одного связанного с применением азенапина побочного эффекта по сравнению с эквивалентной дозой азенапина для сублингвального применения, причем способ включает применение трансдермальной терапевтической системы по любому из пп. 191.
118. Способно п. 117,
отличающийся тем, что пациент является человеком, страдающим от усталости, сонливости, головокружения или любой их комбинации.
119. Способ по п. 117 или 118,
отличающийся тем, что по меньшей мере одним связанным с применением азенапина побочным эффектом является утомляемость, сонливость, головокружение, гипестезия полости рта или любая их комбинация.
120. Способ по любому из пп 117-119
отличающийся тем, что частота возникновения по меньшей мере одного связанного с применением азенапина побочного эффекта по сравнению с эквивалентной дозой азенапина для сублингвального применения уменьшается по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 70% или по меньшей мере приблизительно на 80%, и/или отличающийся тем, что уменьшается интенсивность по меньшей мере одного связанного с применением азенапина побочного эффекта по сравнению с эквивалентной дозой азенапина для сублингвального применения.
121. Способ по п. 120, отличающийся тем, что
по меньшей мере одним связанным с применением азенапина побочным эффектом является усталость, и частота возникновения усталости по сравнению с эквивалентной дозой азенапина для сублингвального применения уменьшается по меньшей мере приблизительно на 30%, или по меньшей мере приблизительно на 40%, и/или уменьшается интенсивность усталости по сравнению с эквивалентной дозой азенапина для сублингвального применения, или
по меньшей мере одним связанным с применением азенапина побочным эффектом является головокружение, и частота возникновения головокружения по сравнению с эквивалентной дозой азенапина для сублингвального применения уменьшается по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 70% или по меньшей мере приблизительно на 80%.
122. Способ уменьшения по меньшей мере одного связанного с применением азенапина побочного эффекта у пациента, проходящего терапию азенапином для сублингвального применения, при этом указанный способ включает:
a) отмену терапии азенапином для сублингвального применения; и
b) применение трансдермальной терапевтической системы по любому из пп. 1-91 на коже пациента, причем транс дермальная терапевтическая система обеспечивает уменьшение по меньшей мере одного связанного с применением азенапина побочного эффекта по сравнению с эквивалентной дозой азенапина для сублингвального применения.
123. Способ по п. 122, отличающийся тем, что трансдермальная терапевтическая система доставляет количество азенапина, эквивалентное количеству азенапина, которое исходно обеспечивалось терапией азенапином для сублингвального применения.
124. Процесс производства матричного слоя для применения в трансдермальной терапевтической системе по любому из пп. 1-103, включающий следующие стадии:
1) объединение в растворителе по меньшей мере таких компонентов, как азенапин, акриловый полимер, дополнительный полимер, α-токоферол и аскорбилпальмитат с получением композиции для покрытия;
2) нанесение композиции для покрытия на защитный слой, или удаляемую защитную подложку, или любую промежуточную подложку; и
3) высушивание нанесенной композиции для покрытия с получением матричного слоя.
125. Процесс по п. 124,
отличающийся тем, что на стадии 1) в растворителе объединяют по меньшей мере компоненты азенапин, акриловый полимер, дополнительный полимер, α-токоферол, аскорбилпальмитат и метабисульфит натрия с получением композиции для покрытия.
126. Процесс по п. 124 или 125,
отличающийся тем, что на стадии 1) растворяют азенапин с получением композиции для покрытия.
127. Процесс по любому из пп. 124-126,
отличающийся тем, что растворитель предпочтительно выбирают из спиртовых растворителей, в частности метанола, этанола, изопропанола и их смесей, и из неспиртовых растворителей, в частности этилацетата, гексана, н-гептана, гептанов, петролейного эфира, толуола и их смесей, и более предпочтительно, выбирают из этанола и этилацетата.
128. Процесс по любому из пп. 124-127,
отличающийся тем, что полимер представляет собой акриловый полимер и предпочтительно сополимер на основе винилацетата,
2-этилгексилакрилата, 2-гидроксиэтилакрилата и глицидилметакрилата или сополимер на основе винилацетата, 2-этилгексилакрилата и 2-гидроксиэтилакрилата, который предоставляется в виде раствора и предпочтительно в виде раствора в этилацетате, н-гептане, гептанах, метаноле, этаноле или любых их смесей с содержанием твердых веществ от 30 до 60 мас. %.
129. Процесс по любому из пп. 124 128,
отличающийся тем, что полимер представляет собой акриловый полимер и при этом полимер является сшитым.
130. Процесс по п. 123,
отличающийся тем, что на стадии 1) для получения композиции для покрытия не используют дополнительный сшивающий агент.
131. Процесс по любому из пп. 124-128,
отличающийся тем, что полимер представляет собой акриловый полимер и при этом полимер не является сшитым.
132. Процесс по п. 131,
отличающийся тем, что на стадии 1) для получения композиции для покрытия используют дополнительный сшивающий агент,
При этом сшивающий агент предпочтительно представляет собой алюминиевый или титановый сшивающий агент.
133. Процесс по любому из пп. 124-132, отличающийся тем, что высушивание выполняют в одном или более циклах при комнатной температуре и/или при температуре 65-100°С, более предпочтительно 70-90°С.
134. Трансдермальная терапевтическая система для трансдермального введения азенапина, включающая в себя структуру самоклеящегося слоя, содержащую:
A) защитный слой;
B) азенапин-содержащий матричный слой, состоящий из композиции матричного слоя, которая содержит:
1. азенапин, включенный в форме свободного основания;
2. сополимер на основе винилацетата, 2-этилгексилакрилата, 2-гидроксиэтилакрилата и глицидилметакрилата или сополимер на основе винилацетата, 2-этилгексилакрилата и 2-гидроксиэтилакрилата;
3. триглицериды со средней длиной цепи в количестве от 5 до 12% композиции матричного слоя;
4. растворимый поливинилпирролидон в количестве от 5 до 15% композиции матричного слоя; и
5. α-токоферол в количестве от 0,025 до 0,1% композиции матричного слоя, аскорбилпальмитат в количестве от 0,15 до 0,5% композиции матричного слоя и метабисульфит натрия в количестве от 0,05 до 0,15% композиции матричного слоя, в качестве стабилизаторов.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТРАНСДЕРМАЛЬНАЯ ТЕРАПЕВТИЧЕСКАЯ СИСТЕМА, СОДЕРЖАЩАЯ АЗЕНАПИН И ПОЛИСИЛОКСАН ИЛИ ПОЛИИЗОБУТИЛЕН | 2017 |
|
RU2764443C2 |
| ТРАНСДЕРМАЛЬНАЯ ТЕРАПЕВТИЧЕСКАЯ СИСТЕМА, СОДЕРЖАЩАЯ ЛАВАНДОВОЕ МАСЛО | 2015 |
|
RU2695785C2 |
| ТРАНСДЕРМАЛЬНАЯ ТЕРАПЕВТИЧЕСКАЯ СИСТЕМА ДЛЯ ВВЕДЕНИЯ АКТИВНОГО ВЕЩЕСТВА БУПРЕНОРФИНА | 2007 |
|
RU2484822C2 |
| ТРАНСДЕРМАЛЬНАЯ ТЕРАПЕВТИЧЕСКАЯ СИСТЕМА (ТТС), СОДЕРЖАЩАЯ ТОЛТЕРОДИН | 2000 |
|
RU2251413C2 |
| ТРАНСДЕРМАЛЬНОЕ ВВЕДЕНИЕ МЕМАНТИНА | 2011 |
|
RU2578971C2 |
| ТРАНСДЕРМАЛЬНАЯ ТЕРАПЕВТИЧЕСКАЯ СИСТЕМА ДЛЯ ТРАНСДЕРМАЛЬНОГО ВВЕДЕНИЯ ГУАНФАЦИНА, СОДЕРЖАЩАЯ СИЛИКОНОВЫЙ ПОЛИМЕР | 2018 |
|
RU2792822C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ТРАНСДЕРМАЛЬНОЙ ТЕРАПЕВТИЧЕСКОЙ СИСТЕМЫ, СОДЕРЖАЩАЯ АЛПРАЗОЛАМ | 2018 |
|
RU2694232C1 |
| ТРАНСДЕРМАЛЬНАЯ ТЕРАПЕВТИЧЕСКАЯ СИСТЕМА ДЛЯ ТРАНСДЕРМАЛЬНОГО ВВЕДЕНИЯ ГУАНФАЦИНА, СОДЕРЖАЩАЯ ПО МЕНЬШЕЙ МЕРЕ ОДНО ВСПОМОГАТЕЛЬНОЕ ВЕЩЕСТВО | 2018 |
|
RU2812734C2 |
| ОБЛАДАЮЩАЯ ВЫСОКОЙ ГИБКОСТЬЮ ТРАНСДЕРМАЛЬНАЯ ТЕРАПЕВТИЧЕСКАЯ СИСТЕМА С НИКОТИНОМ В КАЧЕСТВЕ АКТИВНОГО ВЕЩЕСТВА | 2002 |
|
RU2302856C2 |
| ВЫСОКОЧИСТЫЕ СЛОЖНЫЕ 3,3-ДИФЕНИЛПРОПИЛАМИНОМОНОЭФИРЫ | 2004 |
|
RU2394019C2 |
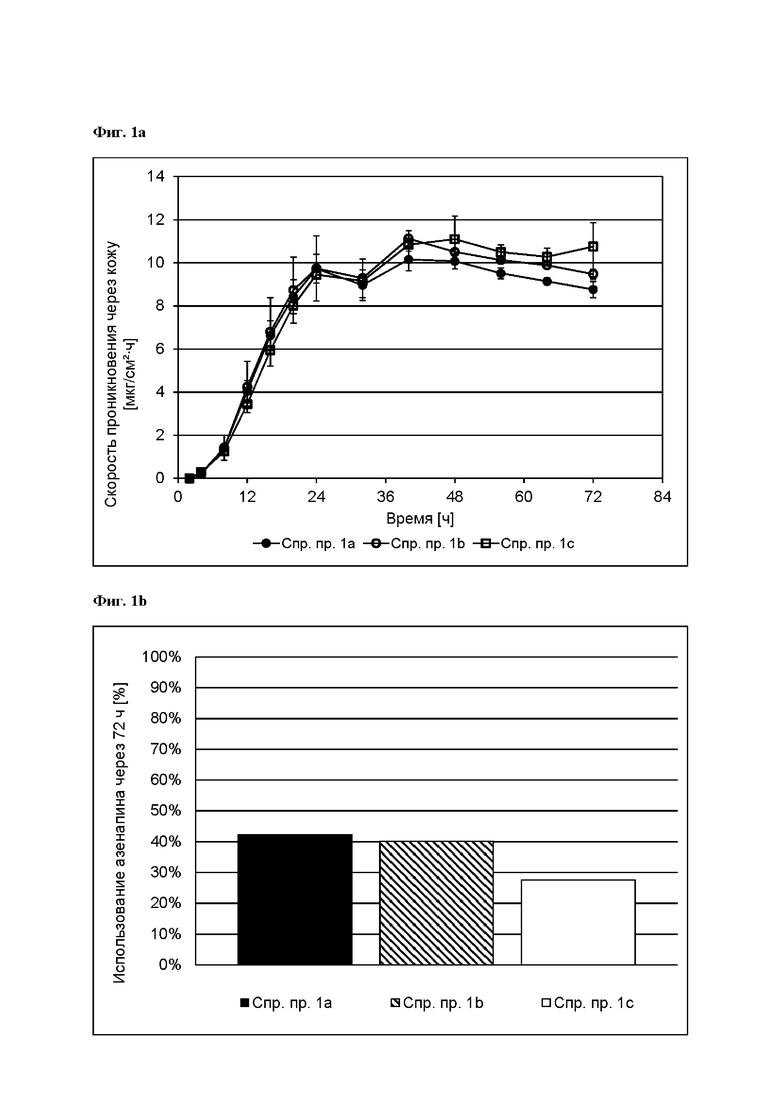
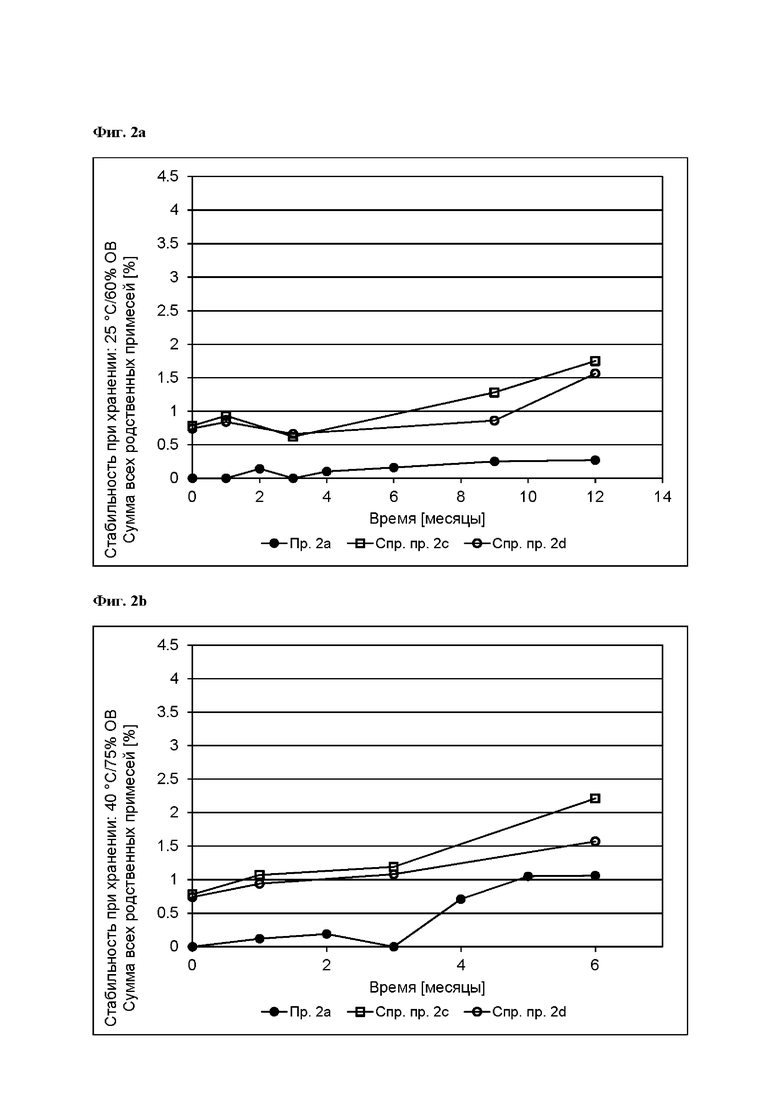
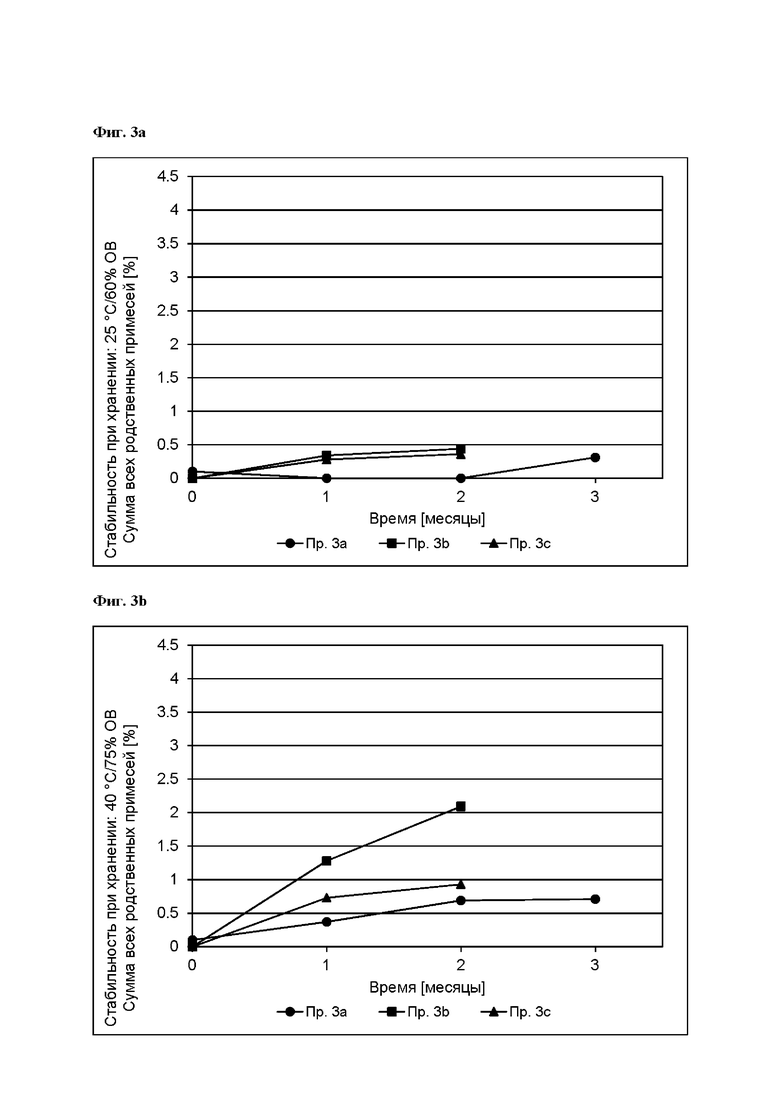

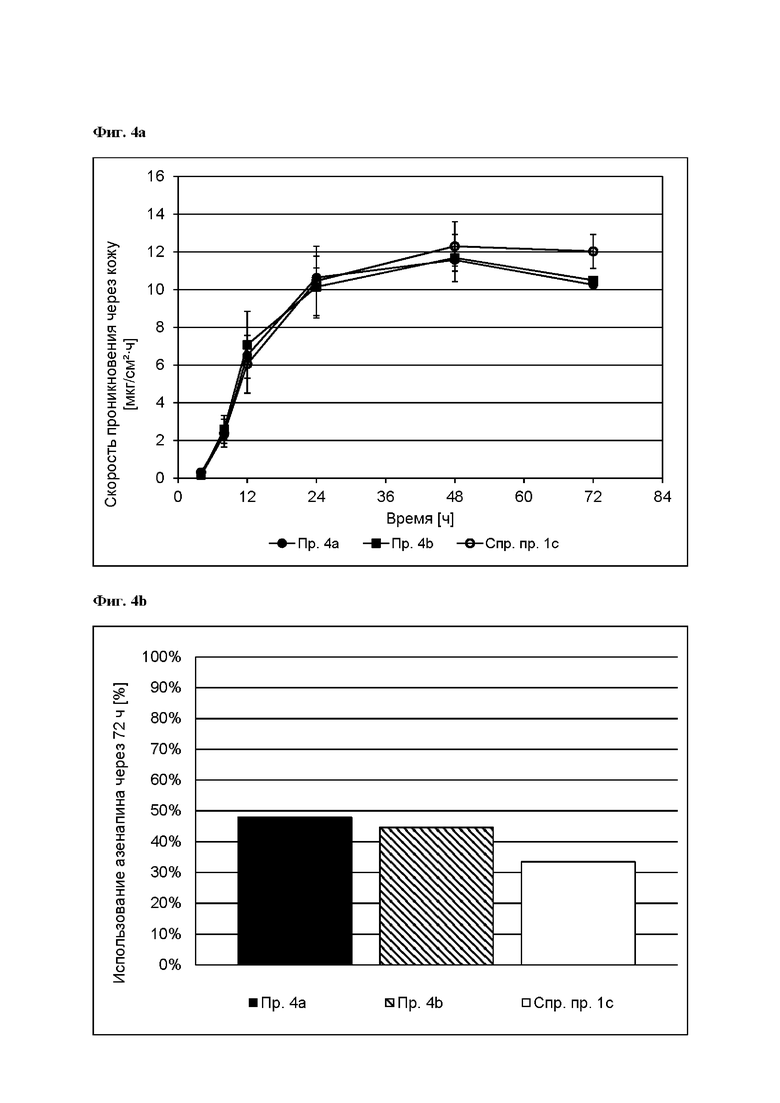
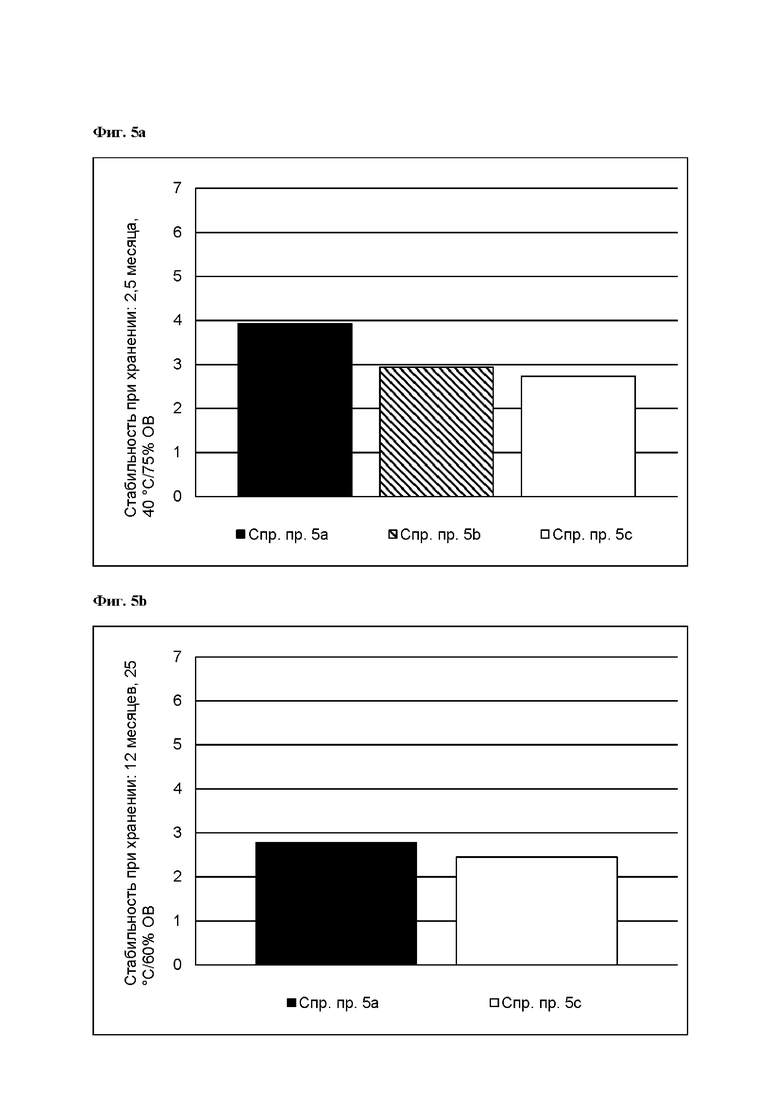
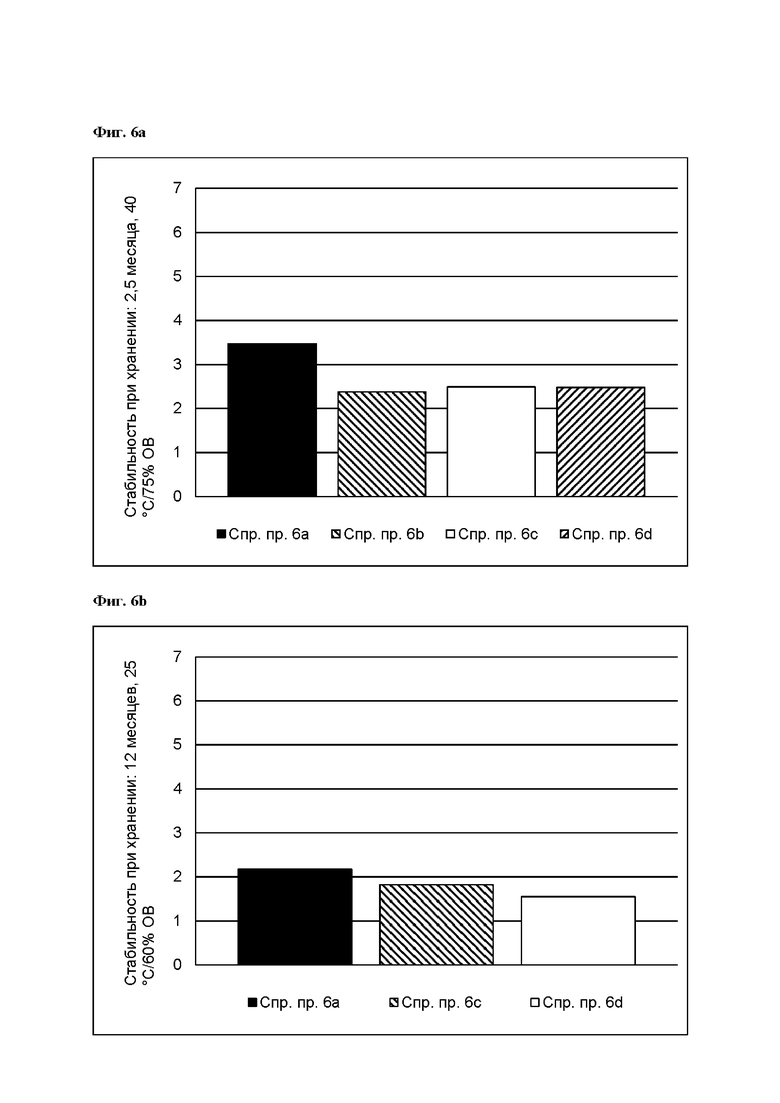
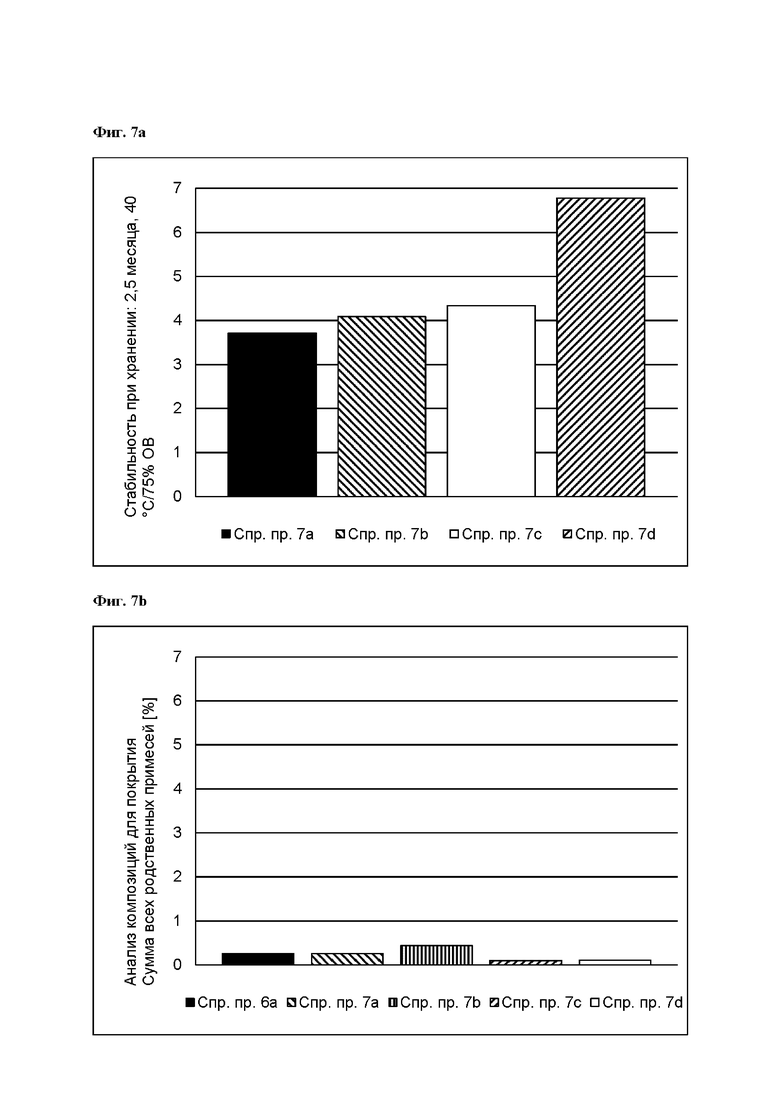
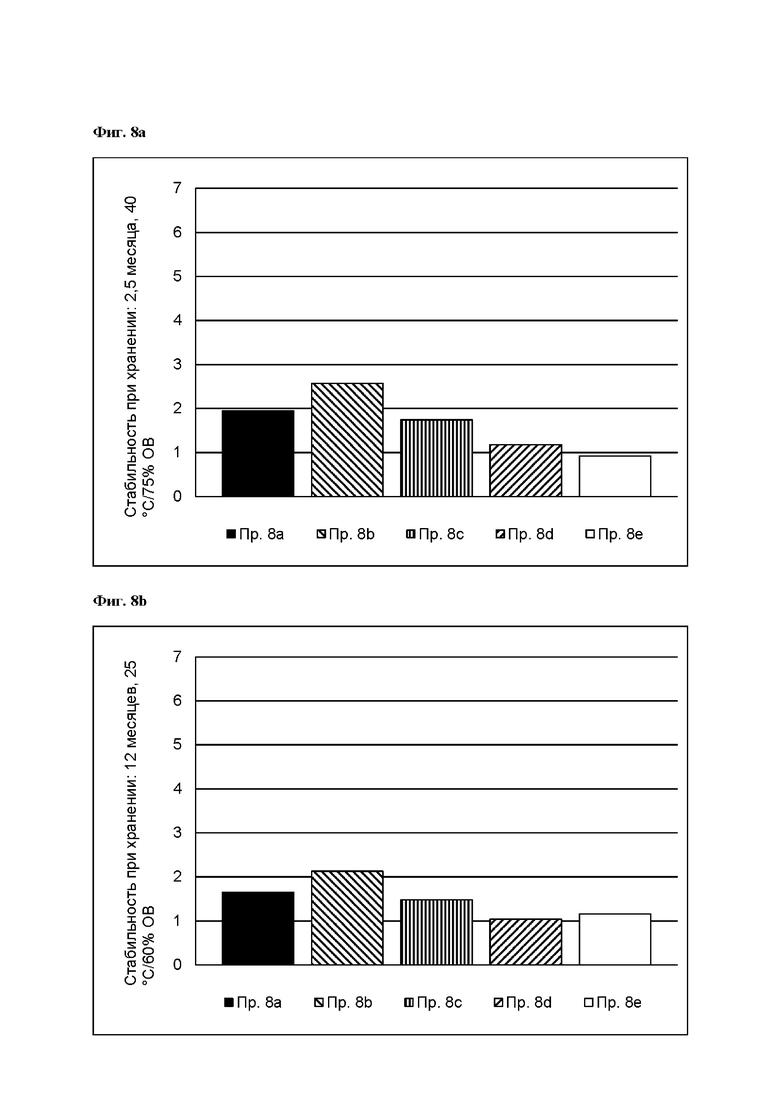
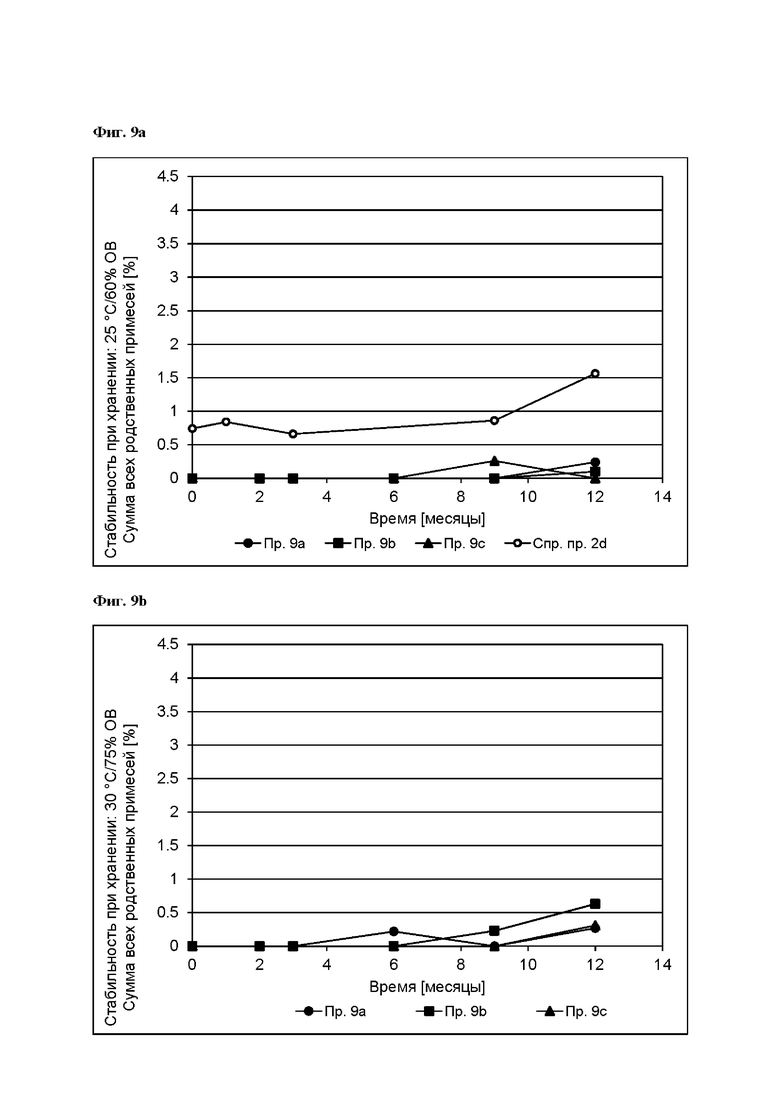
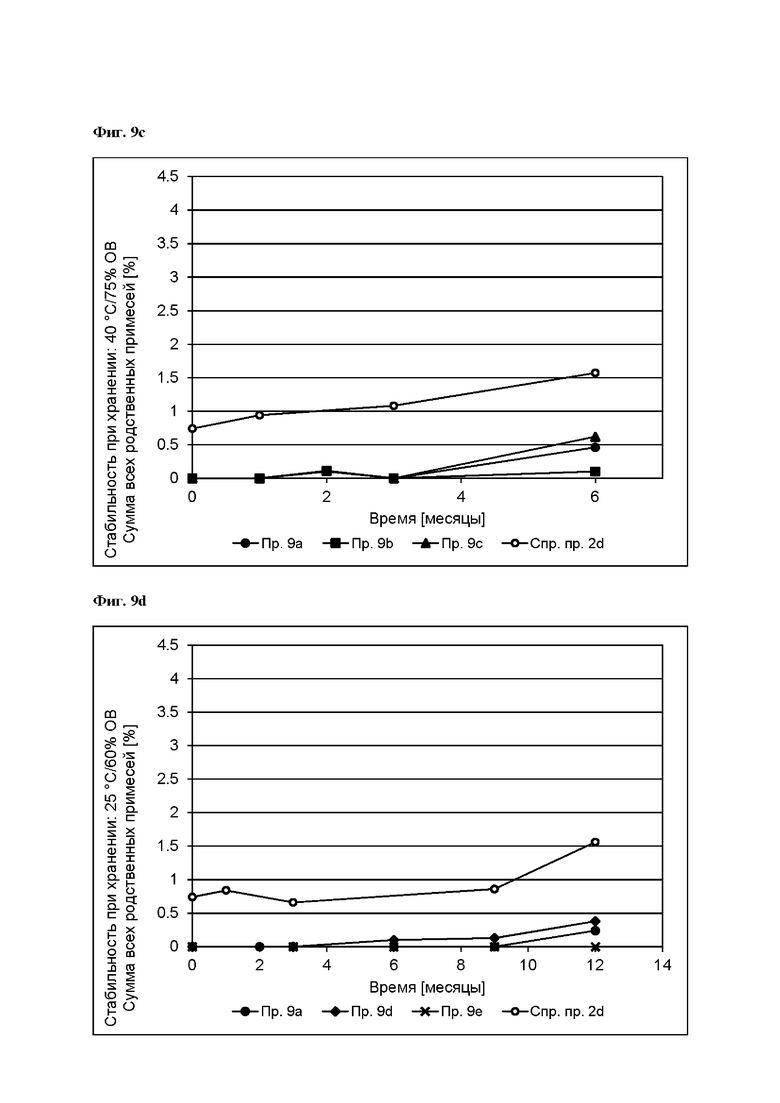
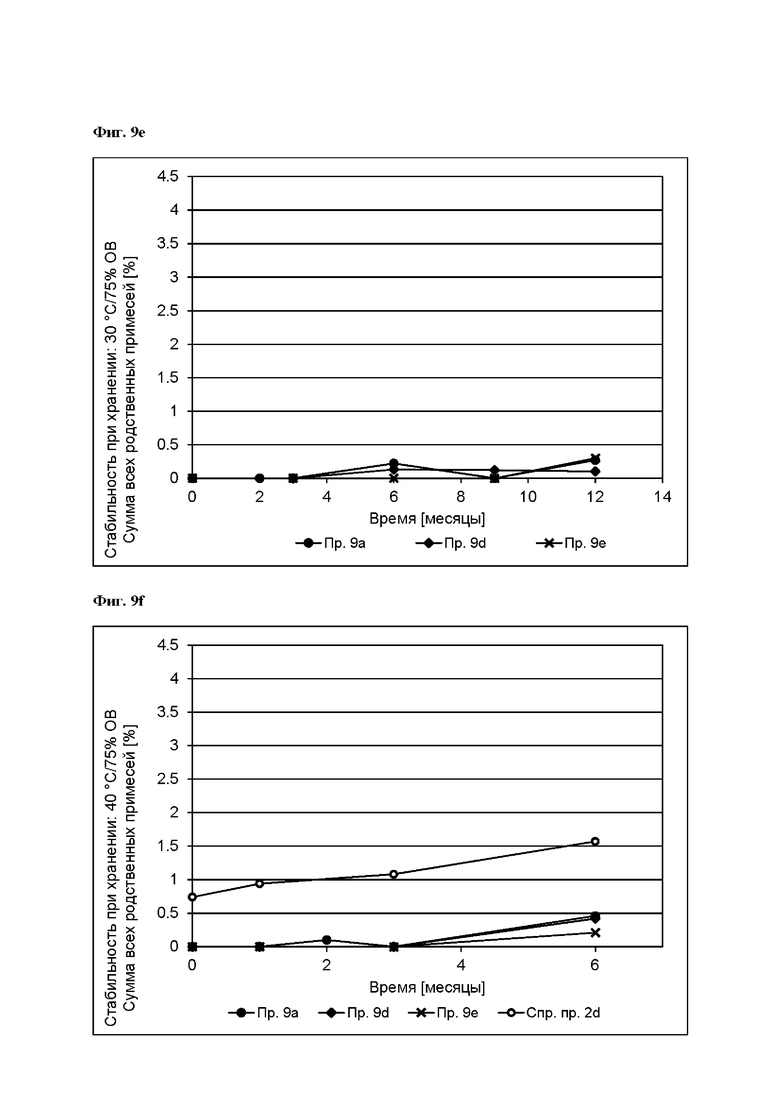
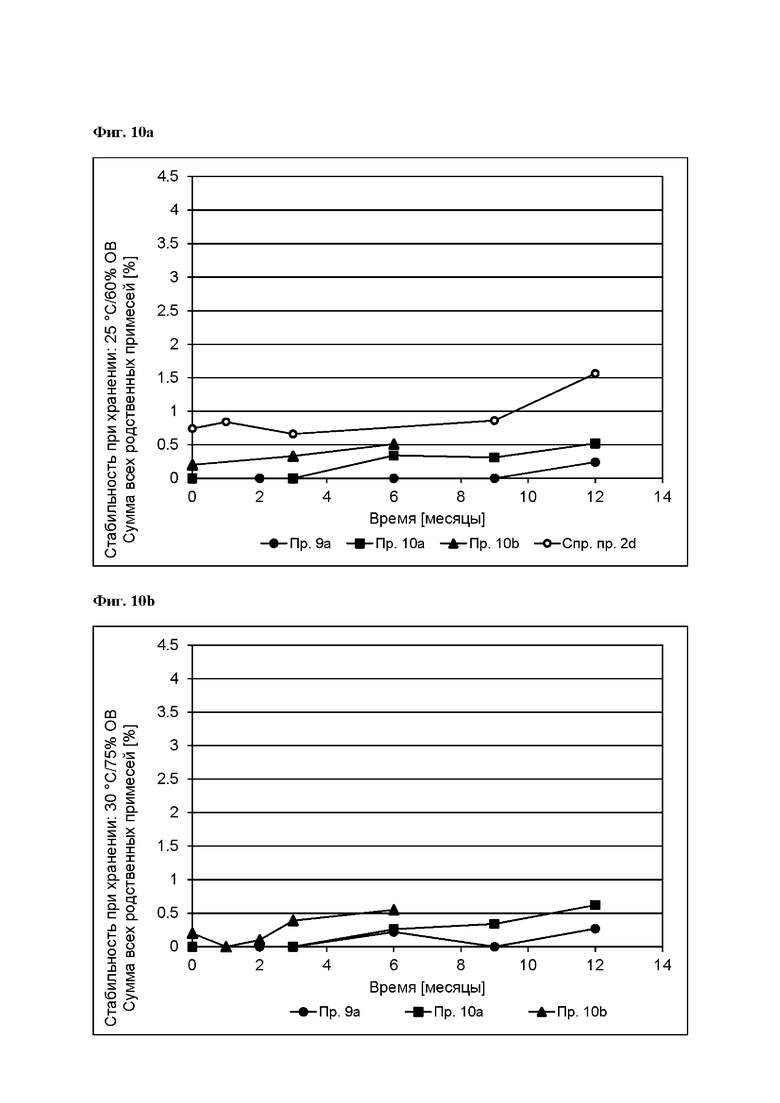
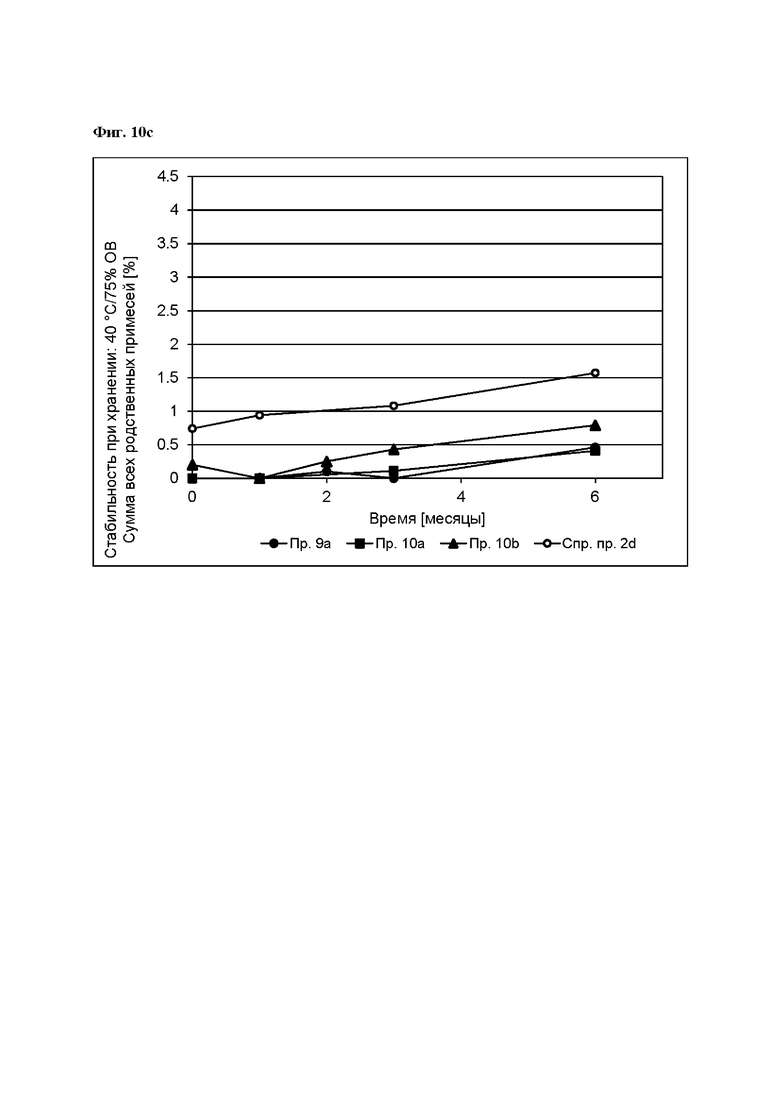
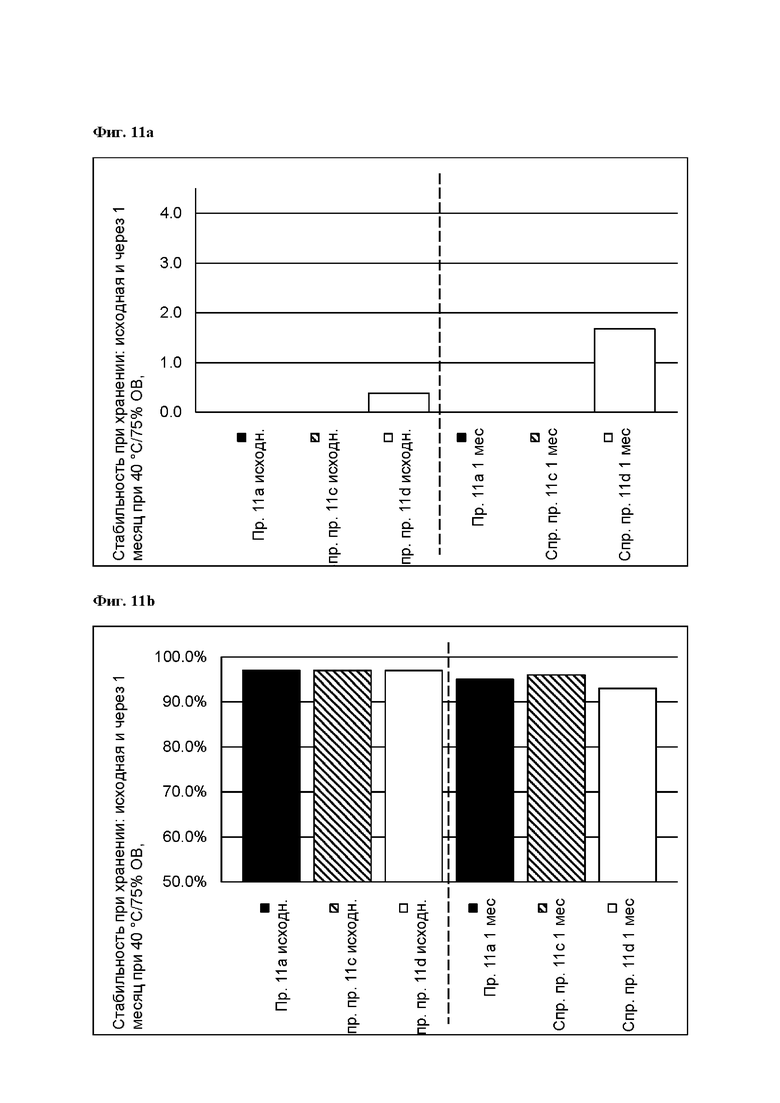
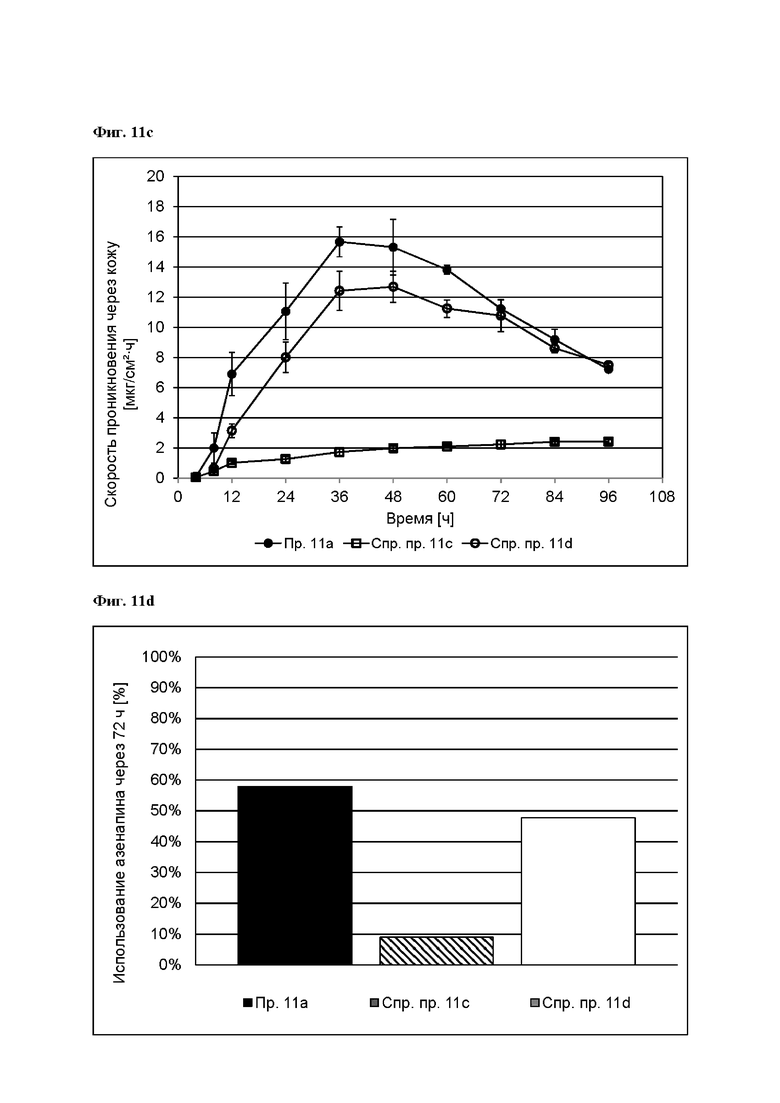

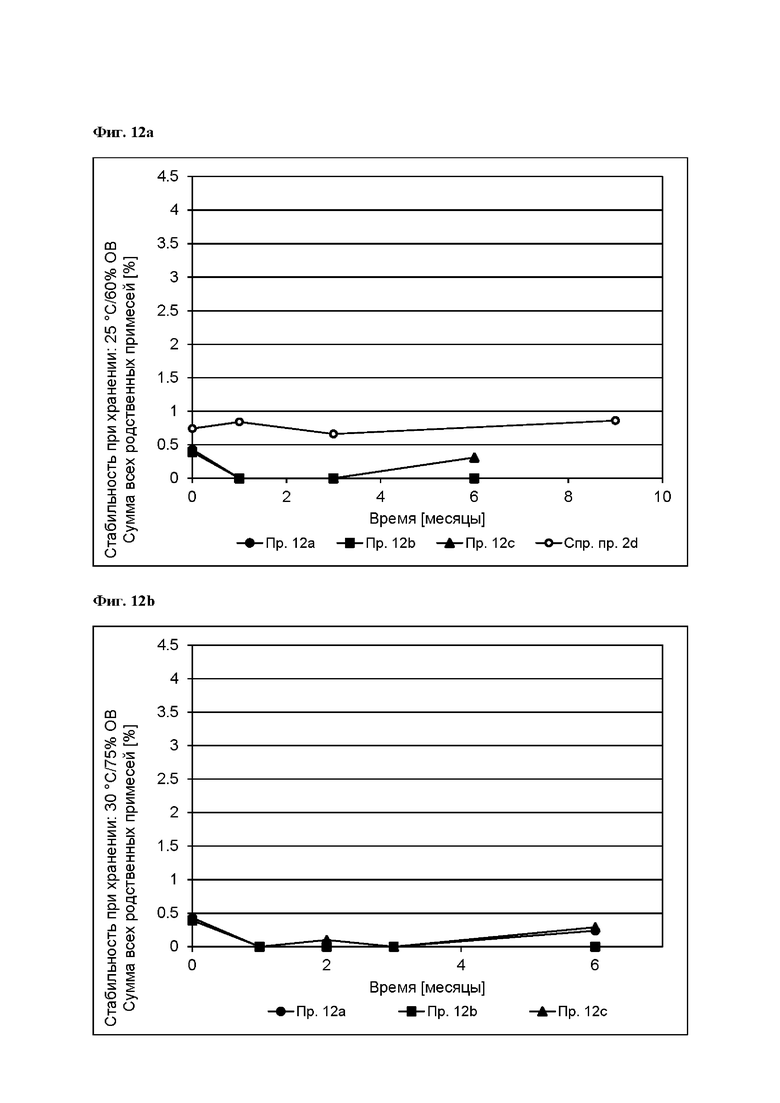
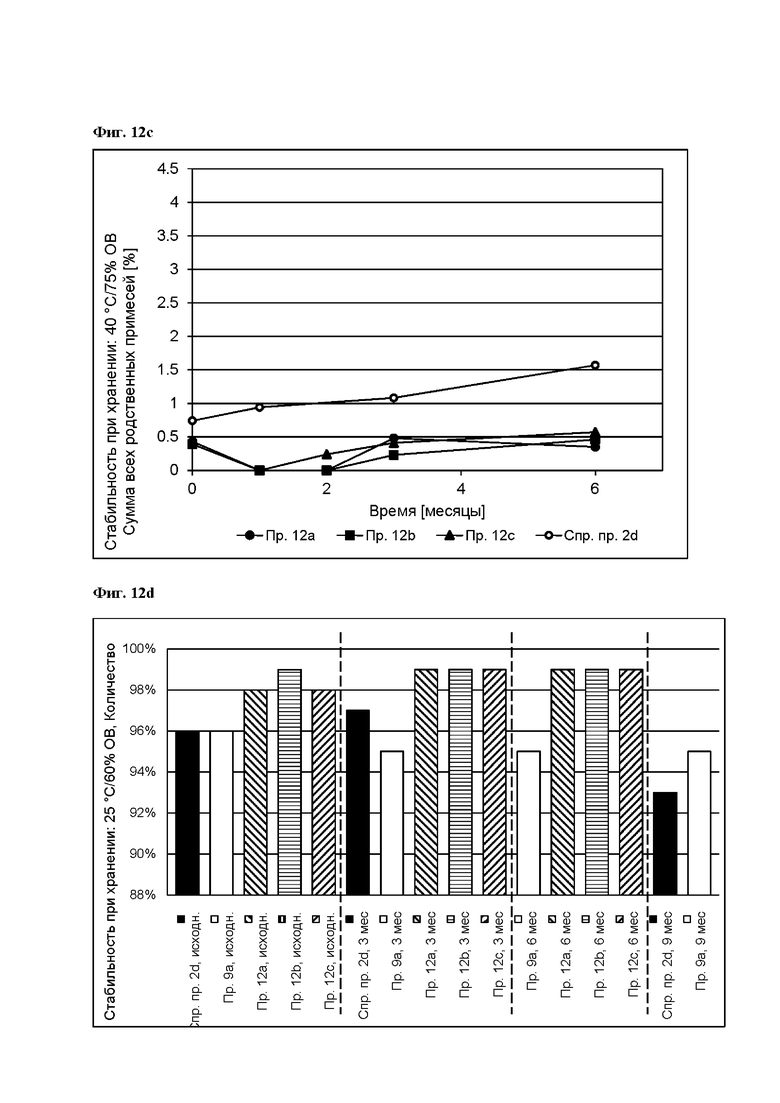
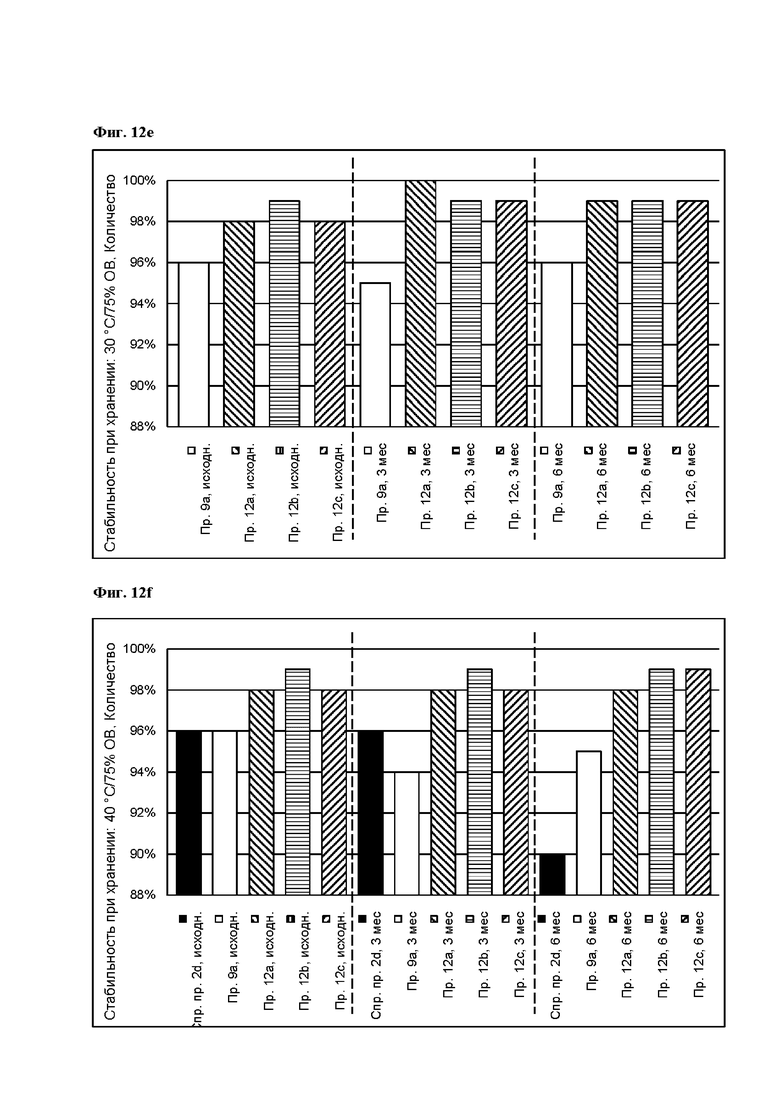
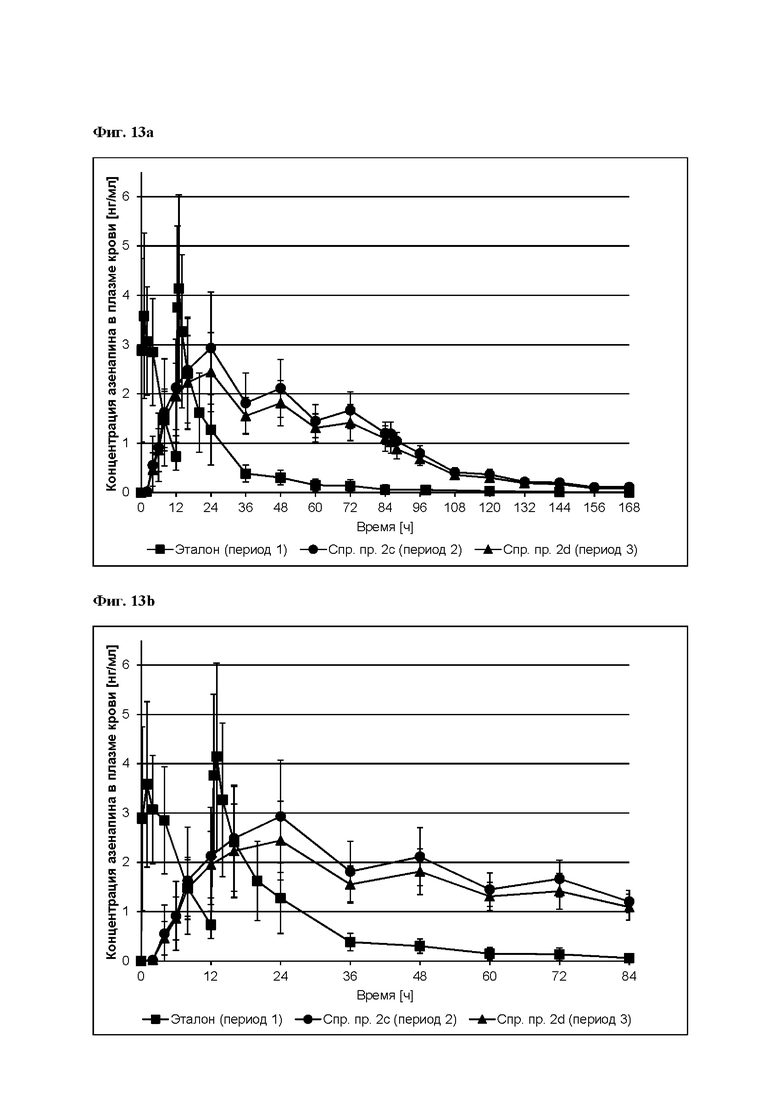
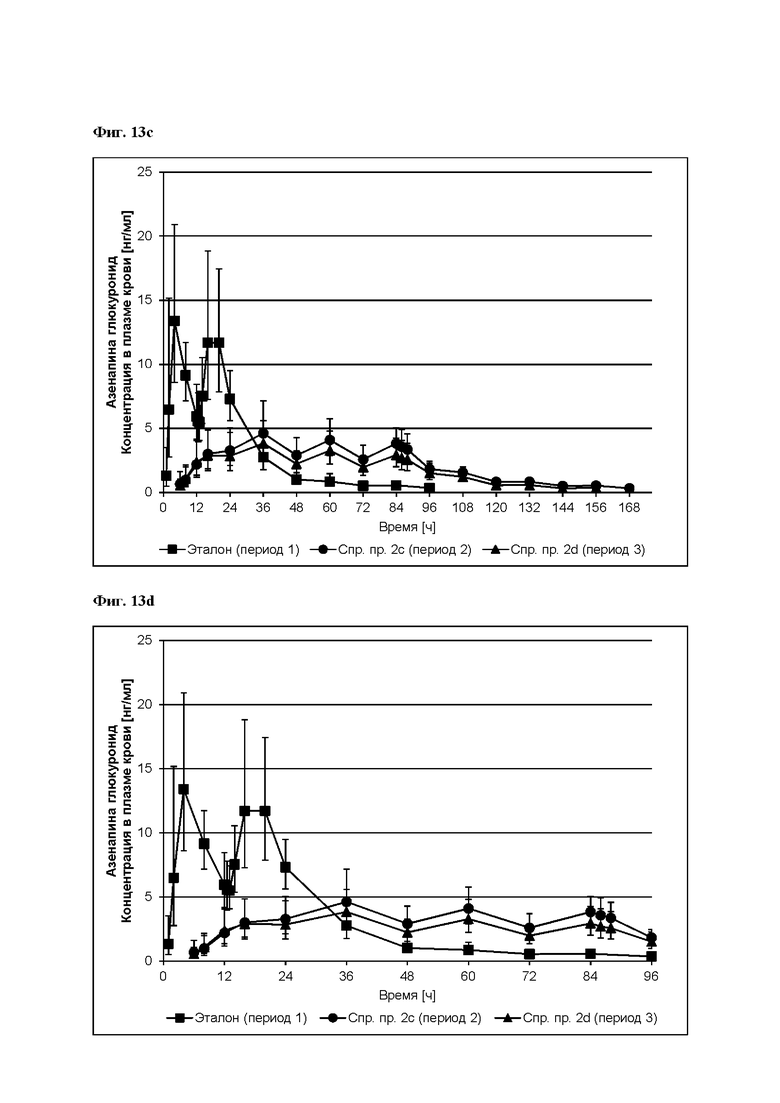
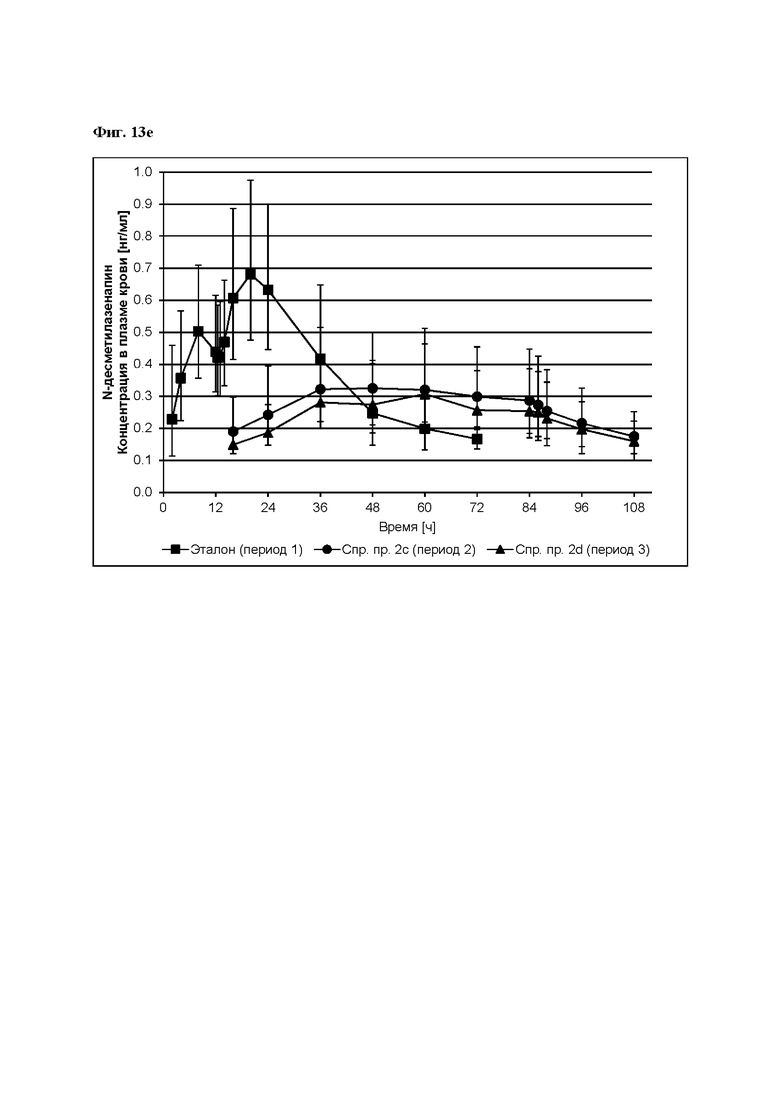
Группа изобретений относится к области медицины, а именно к трансдермальной терапевтической системе для трансдермального введения азенапина, включающей в себя структуру самоклеящегося слоя, содержащую терапевтически эффективное количество азенапина, при этом указанная структура самоклеящегося слоя содержит: A) подложку; B) азенапинсодержащий матричный слой, состоящий из композиции матричного слоя, которая содержит: 1) азенапин, включенный в форме свободного основания; 2) полимер, выбранный из акриловых полимеров, причем полимер представляет собой сополимер на основе винилацетата, 2-этилгексилакрилата, 2-гидроксиэтилакрилата и глицидилметакрилата или сополимер на основе винилацетата, 2-этилгексилакрилата и 2-гидроксиэтилакрилата; 3) дополнительный полимер, выбранный из поливинилпирролидонов; и 4) α-токоферол в количестве от 0,01 до 2 масс. % композиции матричного слоя и аскорбилпальмитат в количестве, составляющем по меньшей мере 0,01 масс. % композиции матричного слоя, в качестве стабилизаторов, также относится к способу лечения одного или более состояний, выбранных из шизофрении, биполярного расстройства, посттравматического стрессового расстройства, большого депрессивного расстройства, психоза на фоне деменции, тревожного возбуждения и маниакального расстройства, включающему применение трансдермальной терапевтической системы на коже пациента и также относится к способу производства матричного слоя для применения в трансдермальной терапевтической системе, включающему следующие стадии: 1) объединение в растворителе по меньшей мере таких компонентов, как азенапин, включенный в форме свободного основания, сополимер на основе винилацетата, 2-этилгексилакрилата, 2-гидроксиэтилакрилата и глицидилметакрилата или сополимер на основе винилацетата, 2-этилгексилакрилата и 2-гидроксиэтилакрилата, дополнительный полимер, выбранный из поливинилпирролидонов, α-токоферол и аскорбилпальмитат с получением композиции для покрытия; 2) нанесение композиции для покрытия на подложку, или высвобождающую подложку, или любую промежуточную подложку; и 3) высушивание нанесенной композиции для покрытия с получением матричного слоя. Группа изобретений обеспечивает трансдермальную терапевтическую систему азенапина с улучшенной стабильностью и в то же время обеспечивает скорость проникновения, которая достаточна для достижения терапевтически эффективной дозы. 3 н. и 17 з.п. ф-лы, 80 табл., 44 ил.
1. Трансдермальная терапевтическая система для трансдермального введения азенапина, включающая в себя структуру самоклеящегося слоя, содержащую терапевтически эффективное количество азенапина, при этом указанная структура самоклеящегося слоя содержит:
A) подложку;
B) азенапинсодержащий матричный слой, состоящий из композиции матричного слоя, которая содержит:
1) азенапин, включенный в форме свободного основания;
2) полимер, выбранный из акриловых полимеров, причем полимер представляет собой сополимер на основе винилацетата, 2-этилгексилакрилата, 2-гидроксиэтилакрилата и глицидилметакрилата или сополимер на основе винилацетата, 2-этилгексилакрилата и 2-гидроксиэтилакрилата;
3) дополнительный полимер, выбранный из поливинилпирролидонов; и
4) α-токоферол в количестве от 0,01 до 2 масс. % композиции матричного слоя и аскорбилпальмитат в количестве, составляющем по меньшей мере 0,01 масс. % композиции матричного слоя, в качестве стабилизаторов.
2. Трансдермальная терапевтическая система по п. 1, отличающаяся тем, что композиция матричного слоя дополнительно содержит в качестве стабилизатора метабисульфит натрия в количестве 0–0,5 масс. % композиции матричного слоя.
3. Трансдермальная терапевтическая система по любому из пп. 1 и 2, отличающаяся тем, что композиция матричного слоя содержит α-токоферол в количестве, составляющем по меньшей мере 0,025 масс. % композиции матричного слоя, и/или композиция матричного слоя содержит α-токоферол в количестве до 1,5 масс. % или 0,75 масс. % композиции матричного слоя.
4. Трансдермальная терапевтическая система по любому из пп. 1–3, отличающаяся тем, что композиция матричного слоя содержит аскорбилпальмитат в количестве, составляющем по меньшей мере 0,02 масс. % композиции матричного слоя, и/или композиция матричного слоя содержит аскорбилпальмитат в количестве до 2,0 или 1,0 масс. % композиции матричного слоя.
5. Трансдермальная терапевтическая система по любому из пп. 1–4, отличающаяся тем, что дополнительный полимер выбран из растворимых поливинилпирролидонов и/или дополнительный полимер представляет собой поливинилпирролидон, имеющий K-значение в диапазоне, выбранном из группы диапазонов, состоящей из
9–15,
15–20,
20–27,
27–35, и
75–110, или любых их смесей.
6. Трансдермальная терапевтическая система по п. 5, отличающаяся тем, что композиция матричного слоя содержит дополнительный полимер, выбранный из поливинилпирролидонов в количестве от 0 до 20 масс. % композиции матричного слоя.
7. Трансдермальная терапевтическая система по любому из пп. 1–6, отличающаяся тем, что трансдермальная терапевтическая система содержит по меньшей мере 0,70 мг/см2, предпочтительно по меньшей мере 0,80 мг/см2 азенапина.
8. Трансдермальная терапевтическая система по любому из пп. 1–7, отличающаяся тем, что по меньшей мере 90 моль-процентов азенапина в матричном слое присутствует в форме свободного основания.
9. Трансдермальная терапевтическая система по любому из пп. 1–8, отличающаяся тем, что количество азенапина в композиции матричного слоя находится в диапазоне 2–20 масс. % композиции матричного слоя.
10. Трансдермальная терапевтическая система по любому из пп. 1–9, отличающаяся тем, что полимер выбран из чувствительных к давлению адгезивных полимеров.
11. Трансдермальная терапевтическая система по п. 10, отличающаяся тем, что полимер является сшитым сшивающим агентом.
12. Трансдермальная терапевтическая система по любому из пп. 1–11, отличающаяся тем, что количество полимера находится в диапазоне 50–90 масс. % композиции матричного слоя.
13. Трансдермальная терапевтическая система по любому из пп. 1–12, отличающаяся тем, что композиция матричного слоя содержит вещество, придающее клейкость, выбранное из полиэтиленгликолей, дипропиленгликоля, смол, сложных эфиров смол, терпенов и их производных, этиленвинилацетатных адгезивов, диметилполисилоксанов и полибутенов и их смесей.
14. Трансдермальная терапевтическая система по п. 13, причем в качестве вещества, придающего клейкость, композиция матричного слоя содержит триглицериды со средней длиной цепи.
15. Трансдермальная терапевтическая система по п. 14, отличающаяся тем, что композиция матричного слоя в качестве вещества, придающего клейкость, содержит триглицериды со средней длиной цепи в количестве 0,1–14 масс. % композиции матричного слоя.
16. Трансдермальная терапевтическая система по любому из пп. 1–15, отличающаяся тем, что матричный слой изначально содержит количество азенапина, составляющее по меньшей мере 95 масс. % теоретического количества азенапина, включенного в матричный слой.
17. Трансдермальная терапевтическая система по любому из пп. 1–16, отличающаяся тем, что матричный слой изначально содержит общее количество продуктов разложения азенапина, составляющее менее 0,7 масс. %.
18. Трансдермальная терапевтическая система по любому из пп. 1–17 для применения в способе лечения одного или более состояний, выбранных из шизофрении, биполярного расстройства, посттравматического стрессового расстройства, большого депрессивного расстройства, психоза на фоне деменции, тревожного возбуждения и маниакального расстройства.
19. Способ лечения одного или более состояний, выбранных из шизофрении, биполярного расстройства, посттравматического стрессового расстройства, большого депрессивного расстройства, психоза на фоне деменции, тревожного возбуждения и маниакального расстройства, включающий применение трансдермальной терапевтической системы по любому из пп. 1–17 на коже пациента.
20. Способ производства матричного слоя для применения в трансдермальной терапевтической системе по любому из пп. 1–17, включающий следующие стадии:
1) объединение в растворителе по меньшей мере таких компонентов, как азенапин, включенный в форме свободного основания, сополимер на основе винилацетата, 2-этилгексилакрилата, 2-гидроксиэтилакрилата и глицидилметакрилата или сополимер на основе винилацетата, 2-этилгексилакрилата и 2-гидроксиэтилакрилата, дополнительный полимер, выбранный из поливинилпирролидонов, α-токоферол и аскорбилпальмитат, с получением композиции для покрытия;
2) нанесение композиции для покрытия на подложку, или высвобождающую подложку, или любую промежуточную подложку; и
3) высушивание нанесенной композиции для покрытия с получением матричного слоя.
| EP 2878298 A1, 03.06.2015 | |||
| WO 2014079573 A1, 30.05.2014 | |||
| WO 2010127674 A1, 11.11.2010 | |||
| WO 2017018321 A1, 02.02.2017. |
Авторы
Даты
2023-06-14—Публикация
2019-06-19—Подача