Уровень техники
Настоящее изобретение относится к новым N-(6-пиперазин-1-илпиридин-3-ил)бензолсульфонамидным соединениям, в частности к соединениям формулы I, описанным в настоящем документе. Соединения обладают полезными терапевтическими свойствами и пригодны, в частности, для лечения заболеваний, которые восприимчивы к модуляции дофаминового рецептора D3.
Нейроны получают свою информацию посредством, среди прочего, рецептора, сопряженного с G-белком. Большое число веществ проявляет свое воздействие посредством этих рецепторов. Одним из них является дофамин. Существуют подтвержденные данные относительно присутствия дофамина и его физиологического назначения в качестве нейромедиатора. Расстройства в дофаминергической системе передачи приводят к заболеваниям центральной нервной системы, которые включают, например, шизофрению, депрессию и болезнь Паркинсона. Эти заболевания и другие лечат с помощью лекарственных средств, которые взаимодействуют с дофаминовыми рецепторами.
Вплоть до 1990 было четко определено фармакологически два подтипа дофаминового рецептора, названных рецепторами D1 и D2. Позднее третий подтип был найден, а именно рецептор D3, который, по-видимому, опосредует некоторые эффекты нейролептических и антипаркинсонических лекарственных средств (J. C. Schwartz et al., "The Dopamine D3 Receptor as a Target for Antipsychotics" in Novel Antipsychotic Drugs, H. Y. Meltzer, ed., Raven Press, New York 1992, pages 135-144; M. Dooley et al., Drugs and Aging 1998, 12:495-514; J.N. Joyce, Pharmacology and Therapeutics 2001, 90:231-59, "The Dopamine D3 Receptor as a Therapeutic Target for Antipsychotic and Antiparkinsonian Drugs"). После этого дофаминовые рецепторы были разделены на два семейства. С одной стороны, существует группа D2, состоящая из рецепторов D2, D3 и D4, и, с другой стороны, группа D1, состоящая из рецепторов D1 и D5.
В то время как рецепторы D1 и D2 широко распределены, рецепторы D3, по-видимому, экспрессируются региоселективно. Таким образом, эти рецепторы предпочтительно следует искать в лимбической системе и проекционных областях мезолимбической дофаминовой системы, особенно в прилежащем ядре, но также в других областях, таких как миндалевидная железа. Благодаря этой относительно региоселективной экспрессии рецепторы D3 рассматривают в качестве цели, обладающей несколькими побочными эффектами, и допускают, что, в то время когда селективный лиганд D3 обладал бы свойствами известных нейролептических лекарственных средств, он бы не имел их побочные неврологические эффекты, опосредованные дофаминовым рецептором D2 (P. Sokoloff et al., Arzneim. Forsch./Drug Res. 42(1):224 (1992), "Localization and Function of the D3 Dopamine Receptor"; P. Sokoloff et al., Nature, 347:146 (1990), "Molecular Cloning and Characterization of a Novel Dopamine Receptor (D3) as a Target for Neuroleptics").
N-(6-Пиперазин-1-илпиридин-3-ил)бензолсульфонамидные соединения, обладающие аффиностью к дофаминовому рецептору D3, были описаны ранее на различных событиях, как, например, в WO2004/089905. Эти соединения обладают высокими аффиностями в отношении дофаминового рецептора D3 и, следовательно, были предложены в качестве пригодных для лечения заболеваний центральной нервной системы. К сожалению, их селективность в отношении рецептора D3 не всегда является удовлетворительной. Более того, некоторые из этих соединений имеют неудовлетворительный профиль DMPK (DMPK: метаболическая стабильность и/или фармакокинетика) и/или могут проявлять сердечно-сосудистые взаимодействия. Следовательно, существует постоянная потребность в обеспечении новыми соединениями, которые обладают улучшенной селективностью в отношении рецепторов D3 или улучшенным фармакологическим профилем, таким как профиль DMPK, и/или могут проявлять меньшие сердечно-сосудистые взаимодействия.
Сущность изобретения
Сейчас было найдено, что определенные N-(6-пиперазин-1-илпиридин-3-ил)бензолсульфонамидные соединения проявляют (с удивительной и неожиданной степенью) весьма селективное связывание с дофаминовым рецептором D3, а также удовлетворительный профиль DMPK, в частности относительно метаболической стабильности, и/или удовлетворительный сердечно-сосудистый профиль, т.е. соединения проявляют меньшие сердечно-сосудистые взаимодействия. Такими соединениями являются соединения, имеющие общую формулу I, их физиологически устойчивые соли и их N-оксиды:
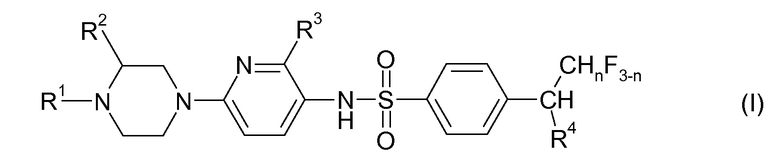
где
R1 выбран из группы, состоящей из водорода, линейного C1-C3 алкила и фторированного линейного C1-C3 алкила;
R2 представляет собой водород или метил;
R3 выбран из группы, состоящей из водорода, галогена, C1-C2-алкила, фторированного C1-C2-алкила, C1-C2-алкокси и фторированного C1-C2-алкокси,
R4 представляет собой C1-C2-алкил или фторированный C1-C2-алкил; и
n представляет собой 0, 1 или 2.
Следовательно, настоящее изобретение относится к N-(6-пиперазин-1-илпиридин-3-ил)бензолсульфонамидным соединениям общей формулы I, а также к их физиологически устойчивым солям и к N-оксидам соединений I и их физиологически устойчивым солям.
Настоящее изобретение также относится к фармацевтической композиции, которая включает, по меньшей мере, одно N-(6-пиперазин-1-илпиридин-3-ил)бензолсульфонамидное соединение формулы I и/или, по меньшей мере, одну физиологически устойчивую соль I и/или его N-окид, где приемлемо совместно с физиологически приемлемыми носителями и/или вспомогательными веществами.
Настоящее изобретение также относится к способу лечения расстройств, которые восприимчивы к влиянию антагонистов дофаминового рецептора D3 или агонистов дофамина D3, включающему введение эффективного количества, по меньшей мере, одного N-(6-пиперазин-1-илпиридин-3-ил)бензолсульфонамидного соединения формулы I, и/или, по меньшей мере, одной физиологически устойчивой кислотно-аддитивной соли I, и/или его N-оксида нуждающемуся в этом субъекту.
Подробное описание настоящего изобретения
Заболевания, которые восприимчивы к воздействию антагонистов дофаминового рецептора D3 или агонистов, включают расстройства и заболевания центральной нервной системы, в частности эмоциональные потрясения, нервные потрясения, стрессовые потрясения и соматоформные нарушения и психозы, и особенно шизофрению, депрессию, биполярное расстройство, наркотическую зависимость и токсикоманию (также называемую наркоманией), слабоумие, большое депрессивное расстройство, беспокойство, аутизм, дефицитарное расстройство внимания с (или без) повышенной активностью и расстройством личности. Кроме того, D3-опосредованные заболевания могут включать нарушения функции почки, в частности нарушения функции почки, которые вызваны диабетом, таким как сахарный диабет, также называемый диабетической нефропатией (смотри WO 00/67847).
В соответствии с изобретением одно или более соединений общей формулы I, имеющие значения, упомянутые вначале, могут быть использованы для лечения вышеупомянутых показаний. В случае если соединения формулы I обладают одним или более центрами ассиметрии, также возможно использовать энантиомерные смеси, в частности рацемические, диастереомерные смеси и таутомерные смеси; предпочтительными, однако, являются соответствующие по существу чистые энантиомеры, диастереомеры и таутомеры.
Подобным образом возможно использовать физиологически устойчивые соли соединений формулы I, особенно кислотно-аддитивные соли с физиологически устойчивыми кислотами. Примерами подходящих физиологически устойчивых органических и неорганических кислот являются хлороводородная кислота, бромоводородная кислота, фосфорная кислота, азотная кислота, серная кислота, органические сульфоновые кислоты, имеющие от 1 до 12 атомов углерода, например C1-C4-алкилсульфоновые кислоты, такие как метансульфоновая кислота, циклоалифатические сульфоновые кислоты, такие как S-(+)-10-камфорсульфоновые кислоты, и ароматические сульфоновые кислоты, такие как бензолсульфоновая кислота и толуолсульфоновая кислота, ди- и трикарбоновые кислоты и гидроксикарбоновые кислоты, имеющие от 2 до 10 атомов углерода, такие как щавелевая кислота, малоновая кислота, малеиновая кислота, фумаровая кислота, муциновая кислота, молочная кислота, винная кислота, лимонная кислота, гликолиевая кислота и адипиновая кислота, а также цис- и транс-коричная кислота, фуранкарбоновая кислота и бензойная кислота. Другие используемые кислоты описаны в Fortschritte der Arzneimittelforschung [Advances in Drug Research], Volume 10, pages 224 ff., Birkhauser Verlag, Basel and Stuttgart, 1966. Физиологически устойчивые соли соединений формулы I могут присутствовать в виде моно-, бис-, трис- и тетракис-солей, то есть они могут содержать 1, 2, 3 или 4 вышеупомянутых молекул кислоты на молекулу формулы I. Молекулы кислоты могут находиться в своей кислотной форме или в виде аниона.
Используемый в настоящем описании C1-C3 алкил представляет собой разветвленную или с неразветвленной цепью алкильную группу, содержащую 1, 2 или 3 атома углерода. Примерами таких групп являются метильная, этильная, н-пропильная и изопропильная.
Используемый в настоящем описании фторированный C1-C3 алкил представляет собой разветвленную или с неразветвленной цепью алкильную группу, содержащую 1, 2 или 3 атома углерода, где, по меньшей мере, один, например 1, 2, 3, 4 или 5, атом водорода или все атомы водорода заменены атомами фтора. Примерами таких групп являются фторметильная, дифторметильная, трифторметильная, 2-фторэтильная, 2,2-дифторэтильная, 2,2,2-трифторэтильная, 1,1,2,2-тетрафторэтильная, 3,3,3-трифторпропильная, 1-метил-2-фторэтильная, 1-метил-2,2-дифторэтильная, 1-метил-2,2,2-трифторэтильная и 1,1,1,3,3,3-гексафторпропан-2-ильная.
Используемый в настоящем описании C1-C2 алкокси представляет собой алкильную группу с неразветвленной цепью, содержащую 1 или 2 атома углерода, которая присоединена к остальной молекуле через атом кислорода. Примерами таких групп являются метокси и этокси.
Используемый в настоящем описании фторированный C1-C2 алкокси представляет собой алкоксигруппу в качестве, как определено выше, где, по меньшей мере, один, например 1, 2, 3, 4 или 5 атомов водорода, заменен атомами фтора. Примерами таких групп являются фторметокси, дифторметокси, трифторметокси, 2-фторэтокси, 2,2-дифторэтокси, 2,2,2-трифторэтокси и 1,1,2,2-тетрафторэтокси.
Первый предпочтительный вариант осуществления настоящего изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где R1 представляет собой водород.
Другой предпочтительный вариант осуществления настоящего изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где R1 представляет собой этил или н-пропил.
Дополнительный предпочтительный вариант осуществления настоящего изобретения относится к соединениям формулы I, где R2 представляет собой метил. В соединениях, где R2 представляет собой метил, атом углерода, который несет R2, создает хиральный центр. Таким образом, конкретный вариант осуществления настоящего изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где R2 представляет собой метил и где атом углерода, который несет R2, имеет S-конфигурацию. Другой конкретный вариант осуществления настоящего изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где R2 представляет собой метил и где атом углерода, который несет R2, имеет R-конфигурацию.
Подобным образом предпочтительными являются смеси соединений, где атом углерода, который несет R2, имеет S-конфигурацию или R-конфигурацию соответственно. Эти смеси могут содержать равные количества или неравные количества соединения I, которое имеет R-конфигурацию относительно группы CH-R2, и соединения, которое имеет S-конфигурацию относительно CH-R2.
Предпочтительные смеси содержат S-изомер в избытке или являются энантиомерно чистыми относительно CH-R2.
Термин "энантиомерно чистый" означает, что смесь содержит соответствующее соединение в энантиомерном избытке, по меньшей мере 80%, в частности, по меньшей мере, 90% (ee).
Дополнительный предпочтительный вариант осуществления настоящего изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где R2 представляет собой водород.
Предпочтение отдано соединениям формулы I, их фармакологически устойчивым солям и их N-оксидам, где R3 выбран из группы, состоящей из водорода, фтора, хлора, метила, фторированного C1-алкила, такого как трифторметил, метокси и фторированного C1-алкокси, такого как дифторметокси и трифторметокси. В частности, R3 выбирают из водорода, метила или метокси. Особенно предпочтительный вариант осуществления настоящего изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где R3 представляет собой метил. Дополнительный особенно предпочтительный вариант осуществления настоящего изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где R3 представляет собой метокси.
Предпочтение отдано соединениям формулы I, их фармакологически устойчивым солям и их N-оксидам, где n представляет собой 1.
Особенно предпочтение отдано соединениям формулы I, их фармакологически устойчивым солям и их N-оксидам, где n представляет собой 2.
Предпочтение отдано соединениям формулы I, их фармакологически устойчивым солям и их N-оксидам, где R4 представляет собой C1-C2-алкил, в частности метил. В соединениях по настоящему изобретению атом углерода, который несет R4, создает хиральный центр. Таким образом, конкретный вариант осуществления настоящего изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где R4 представляет собой C1-C2-алкил, в частности метил, и где атом углерода, который несет R4, имеет S-конфигурацию. Другой конкретный вариант осуществления настоящего изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где R4 представляет собой C1-C2-алкил, в частности метил, и где атом углерода, который несет R4, имеет R-конфигурацию.
Подобным образом предпочтительными являются смеси соединений, где атом углерода, который несет R4, имеет S-конфигурацию или R-конфигурацию соответственно. Эти смеси могут содержать равные количества или неравные количества соединения I, которое имеет R-конфигурацию относительно группы CH-R2, и соединения, которое имеет S-конфигурацию относительно CH-R4. Предпочтительные смеси содержат один S-изомер в избытке или являются энантиомерно чистыми относительно CH-R4.
Термин "энантиомерно чистый" означает, что смесь содержит соответствующее соединение в энантиомерном избытке, по меньшей мере, 80%, в частности, по меньшей мере, 90% (ee).
Особенно предпочтительный вариант осуществления Ia изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где
R1 представляет собой водород;
R2 представляет собой метил;
R3 выбран из группы, состоящей из фтора, хлора, метила, фторированного C1-алкила, такого как трифторметил, метокси и фторированного C1-алкокси, такого как дифторметокси и трифторметокси, и где R3 представляет собой, в частности, метил;
R4 представляет собой C1-C2-алкил, в частности метил; и
где переменная n представляет собой 1.
Дополнительный особенно предпочтительный вариант осуществления Ib изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где
R1 представляет собой водород;
R2 представляет собой метил;
R3 выбран из группы, состоящей из фтора, хлора, метила, фторированного C1-алкила, такого как трифторметил, метокси и фторированного C1-алкокси, такого как дифторметокси и трифторметокси, и где R3 представляет собой, в частности, метил;
R4 представляет собой C1-C2-алкил, в частности метил; и
где переменная n представляет собой 2.
Дополнительный особенно предпочтительный вариант осуществления Ic изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где
R1 представляет собой водород;
R2 представляет собой метил;
R3 выбран из группы, состоящей из фтора, хлора, метила, фторированного C1-алкила, такого как трифторметил, метокси и фторированного C1-алкокси, такого как дифторметокси и трифторметокси, и где R3 представляет собой, в частности, метил;
R4 представляет собой C1-C2-алкил, в частности метил; и
где переменная n представляет собой 0.
Соединения вариантов осуществления Ia, Ib и Ic имеют два хиральных центра и таким образом могут существовать в четырех разных стереоизомерных формах, а именно в форме
1. RR-соединения, где оба атома: атом углерода, несущий радикал R4, и атом углерода, несущий радикал R2, имеют R-конфигурацию,
2. SS-соединения, где оба атома: атом углерода, несущий радикал R4, и атом углерода, несущий радикал R2, имеют S-конфигурацию,
3. RS-соединения, где атом углерода, несущий радикал R4, имеет R-конфигурацию, в то время как атом углерода, несущий радикал R2, имеет S-конфигурацию, и
4. SR-соединения, где атом углерода, несущий радикал R4, имеет S-конфигурацию, в то время как атом углерода, несущий радикал R2, имеет R-конфигурацию.
Соединения вариантов осуществления Ia, Ib и Ic могут присутствовать в виде диастереомерных смесей, где RR-, SS-, RS- и SR-соединения могут присутствовать в равных или неравных количествах, как энантиомерные (рацемические или нерацемические) смеси, т.е. в виде смеси RR-соединения с SS-соединением или в виде смеси RS-соединения с SR-соединением, а также в форме чистых диастереомеров. Термин "чистый диастереомер" означает, что соответствующий диастереомер состоит из, по меньшей мере, на 80% и особенно, по меньшей мере, на 90% соответствующего соединения I, т.е. другие диастереомеры присутствуют в количествах, меньших чем 20%, в частности меньших чем 10%, из расчета на общее количество соединения I.
Примеры соединений варианта осуществления Ia включают 4-(2,2-Дифтор-1-метилэтил)-N-[2-метил-6-(3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид и их фармакологически устойчивые соли. Это соединение может присутствовать в виде чистых стереоизомеров, а именно:
4-((R)-2,2-Дифтор-1-метилэтил)-N-[2-метил-6-((R)-3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид,
4-((S)-2,2-Дифтор-1-метилэтил)-N-[2-метил-6-((S)-3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид,
4-((R)-2,2-Дифтор-1-метилэтил)-N-[2-метил-6-((S)-3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид, или
4-((S)-2,2-Дифтор-1-метилэтил)-N-[2-метил-6-((R)-3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид,
или в качестве диастереомерных смесей RR-, SS-, RS- и SR-соединения или в виде энантиомерной (рацемической или нерацемической) смеси RR-соединения с SS-соединением или в качестве смеси RS-соединения с SR-соединением.
Примеры соединений варианта осуществления Ib включают 4-(2-Фтор-1-метилэтил)-N-[2-метил-6-(3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид и их фармакологически устойчивые соли. Это соединение может присутствовать в виде чистых стереоизомеров, а именно:
4-((R)-2-фтор-1-метилэтил)-N-[2-метил-6-((R)-3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид,
4-((S)-2-Фтор-1-метилэтил)-N-[2-метил-6-((S)-3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид,
4-((R)-2-Фтор-1-метилэтил)-N-[2-метил-6-((S)-3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид, или
4-((S)-2-Фтор-1-метилэтил)-N-[2-метил-6-((R)-3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид,
или в виде диастереомерных смесей RR-, SS-, RS- и SR-соединения или в виде энантиомерной (рацемической или нерацемической) смеси RR-соединения с SS-соединением или в качестве смеси RS-соединения с SR-соединением.
Примеры соединений варианта осуществления Ic включают 4-(2,2,2-Трифтор-1-метилэтил)-N-[2-метил-6-(3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид и их фармакологически устойчивые соли. Это соединение может присутствовать в виде чистых стереоизомеров, а именно:
4-((R)-2,2,2-Трифтор-1-метилэтил)-N-[2-метил-6-((R)-3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид,
4-((S)-2,2,2-Трифтор-1-метилэтил)-N-[2-метил-6-((S)-3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид,
4-((R)-2,2,2-Трифтор-1-метилэтил)-N-[2-метил-6-((S)-3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид, или
4-((S)-2,2,2-Трифтор-1-метилэтил)-N-[2-метил-6-((R)-3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид,
или в виде диастереомерных смесей RR-, SS-, RS- и SR-соединения или в виде энантиомерной (рацемической или нерацемической) смеси RR-соединения с SS-соединением или в виде смеси RS-соединения с SR-соединением.
Дополнительный особенно предпочтительный вариант осуществления Id изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где
R1 представляет собой водород;
R2 представляет собой водород;
R3 выбран из группы, состоящей из фтора, хлора, метила, фторированного C1-алкила, такого как трифторметил, метокси и фторированного C1-алкокси, такого как дифторметокси и трифторметокси, и где R3 представляет собой, в частности, метил;
R4 представляет собой C1-C2-алкил, в частности метил; и
где переменная n представляет собой 1.
Дополнительный особенно предпочтительный вариант осуществления Ie изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где
R1 представляет собой водород;
R2 представляет собой водород;
R3 выбран из группы, состоящей из фтора, хлора, метила, фторированного C1-алкила, такого как трифторметил, метокси и фторированного C1-алкокси, такого как дифторметокси и трифторметокси, и где R3 представляет собой, в частности, метил;
R4 представляет собой C1-C2-алкил, в частности метил; и
где переменная n представляет собой 2.
Дополнительный особенно предпочтительный вариант осуществления If изобретение относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где
R1 представляет собой водород;
R2 представляет собой водород;
R3 выбран из группы, состоящей из фтора, хлора, метила, фторированного C1-алкила, такого как трифторметил, метокси и фторированного C1-алкокси, такого как дифторметокси и трифторметокси, и где R3 представляет собой, в частности, метил;
R4 представляет собой C1-C2-алкил, в частности метил; и
где переменная n представляет собой 0.
Соединения вариантов осуществления Id, Ie и If могут присутствовать в виде рацемических или нерацемических смесей R-энантиомера с S-энантиомером, а также в форме чистого энантиомера. Термин "чистый энантиомер" означает, что соответствующий энантиомер состоит, по меньшей мере, на 80% и особенно, по меньшей мере, на 90% соответствующего соединения I, т.е. другой энантиомер присутствует в количествах, меньших чем 20%, в частности меньших чем 10%, из расчета на общее количество соединения I.
Примеры соединений варианта осуществления Id включают 4-(2,2-Дифтор-1-метилэтил)-N-[2-метил-6-пиперазин-1-илпиридин-3-ил]-бензолсульфонамид и их фармакологически устойчивые соли. Это соединение может присутствовать в виде чистых энантиомеров, а именно:
4-((R)-2,2-Дифтор-1-метилэтил)-N-[2-метил-6-пиперазин-1-илпиридин-3-ил]-бензолсульфонамид,
4-((S)-2,2-Дифтор-1-метилэтил)-N-[2-метил-6-пиперазин-1-илпиридин-3-ил]-бензолсульфонамид,
или в виде смеси R- и S-энантиомера.
Примеры соединений варианта осуществления Id дополнительно включают 4-(2,2-дифтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид и их фармакологически устойчивые соли. Это соединение может присутствовать в виде чистых энантиомеров, а именно:
4-((R)2,2-Дифтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид,
4-((S)2,2-Дифтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид,
или в виде смеси R- и S-энантиомера.
Примеры соединений варианта осуществления Ie включают 4-(2-фтор-1-метилэтил)-N-[2-метил-6-пиперазин-1-илпиридин-3-ил]-бензолсульфонамид и их фармакологически устойчивые соли. Это соединение может присутствовать в виде чистых энантиомеров, а именно:
4-((R)-2-Фтор-1-метилэтил)-N-[2-метил-6-пиперазин-1-илпиридин-3-ил]-бензолсульфонамид,
4-((S)-2-Фтор-1-метилэтил)-N-[2-метил-6-пиперазин-1-илпиридин-3-ил]-бензолсульфонамид,
или в виде смеси R- и S-энантиомера.
Примеры соединений варианта осуществления Ie дополнительно включают 4-(2-Фтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид-бензолсульфонамид и их фармакологически устойчивые соли. Это соединение может присутствовать в виде чистых энантиомеров, а именно:
4-((R)-2-Фтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид,
4-((S)-2-Фтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид,
или в виде смеси R- и S-энантиомера.
Примеры соединений варианта осуществления If включают 4-(2,2,2-трифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид и их фармакологически устойчивые соли. Это соединение может присутствовать в виде чистых энантиомеров, а именно:
4-((R)-2,2,2-Трифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид,
4-((S)-2,2,2-Трифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид или в виде смеси R- и S-энантиомера.
Примеры соединений варианта осуществления If дополнительно включают N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-4-(2,2,2-трифтор-1-метилэтил)-бензолсульфонамид и их фармакологически устойчивые соли. Это соединение может присутствовать в виде чистых энантиомеров, а именно:
N-(2-Метокси-6-пиперазин-1-илпиридин-3-ил)-4-((R)-2,2,2-трифтор-1-метилэтил)-бензолсульфонамид,
N-(2-Метокси-6-пиперазин-1-илпиридин-3-ил)-4-((S)-2,2,2-трифтор-1-метилэтил)-бензолсульфонамид.
Соединения I по изобретению получают по аналогии со способами, известными из литературы. Важный подход к соединениям по изобретению предлагается реакцией 2-(пиперазин-1-ил)-5-аминопиридинового соединения II с производным бензолсульфоновой кислоты III, как показано на схеме 1.
Схема 1:
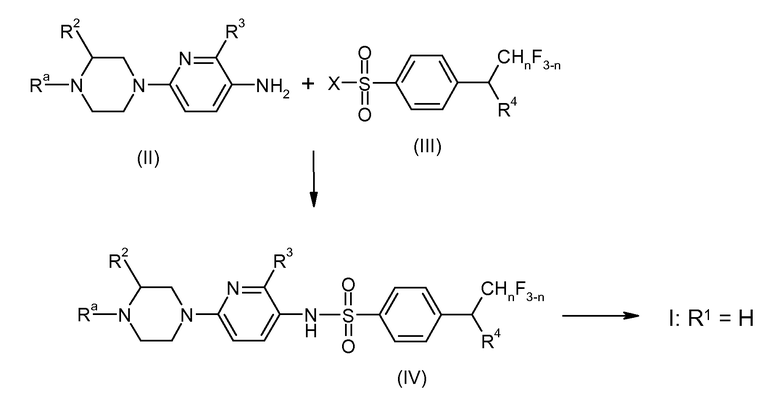
На схеме 1 n, R2, R3 и R4 имеют ранее указанные значения. Ra представляет собой защитную группу азота или выбрана из линейного C1-C3 алкила и фторированного линейного C1-C3 алкила. Подходящие N-защитные группы описаны, например, в PJ. Kocienski "Protecting Groups", 2nd ed., Georg Thieme Verlag, Stuttgart 2000, pp 186-237 и в указанной в настоящем документе литературе. Предпочтительными примерами N-защитных групп являются, например оксикарбонильные группы, такие как C1-C6-алкоксикарбонильная, например, метоксикарбонильная, этоксикарбонильная и Boc (третбутоксикарбонильная) и другие оксикарбонильные группы, такие как бензилоксикарбонильная (Cbz), аллилоксикарбонильная, 9-флуоренилметоксикарбонильная (Fmoc) и 2-триметилсилилэтоксикарбонильная (Teoc) или 2-пропенильная (аллил). X представляет собой нуклеофильно замещаемую уходящую группу, в частности атом галогена и, особенно, хлора или брома.
Соединения формулы IV, где Ra представляет собой защитную группу азота, в частности C1-C6-алкоксикарбонильную группу, такую как метоксикарбонильную, этоксикарбонильную и Boc (третбутоксикарбонильная), являются новыми и таким образом также образуют часть настоящего изобретения.
Соединения формулы IV, где Ra представляет собой линейный C1-C3 алкил или фторированный линейный C1-C3 алкил, относятся к соединениям I, где R1 представляет собой линейный C1-C3 алкил или фторированный линейный C1-C3 алкил.
Реакция, указанная на схеме 1, проходит при условиях реакции, которые общеприняты для получения арилсульфонамидных соединений или арилсульфоновых сложных эфиров соответственно и которые описаны, например, в J. March, Advanced Organic Chemistry, 3rd edition, John Wiley & Sons, New York, 1985, p 444 и указанной в настоящем документе литературе, European J. Org. Chem. 2002 (13), pp. 2094-2108, Tetrahedron 2001, 57 (27) pp. 5885-5895, Bioorganic and Medicinal Chemistry Letters, 2000, 10(8), pp. 835-838 and Synthesis 2000 (1 ), pp. 103-108.
Реакцию обычно проводят в инертном растворителе, например в простом эфире, таком как диэтиловый эфир, диизопропиловый эфир, метил-трет-бутиловый эфир или тетрагидрофуран, галогеноуглеводороде, таком как дихлорметан, алифатическом или циклоалифатическом углеводороде, таком как пентан, гексан или циклогексан, или ароматическом углеводороде, таком как толуол, ксилен, кумол и подобные, или в смеси вышеупомянутых растворителей.
Реакцию соединения II с соединением III обычно проводят в присутствии вспомогательного основания. Подходящими основаниями являются неорганические основания, такие как карбонат натрия или карбонат калия или гидрокарбонат натрия или гидрокарбонат калия, и органические основания, например триалкиламины, такие как триэтиламин, или пиридиновые соединения, такие как пиридин, диметилпиридин и подобные. Последние из упомянутых соединений можно в то же время использовать в качестве растворителей. Вспомогательные основания обычно применяют, по меньшей мере, в эквимолярных количествах из расчета на соединение амина II.
Реакция соединения II с соединением III приводит к соединению IV, с которого в случае, если Ra представляет собой N-защитную группу, снимают защитную группу с получением соединения общей формулы I, где R1 представляет собой водород. Снятие защитной группы соединения IV может быть достигнуто стандартными способами, например, с помощью способов, описанных в PJ. Kocienski "Protecting Groups", 2nd ed., Georg Thieme Verlag, Stuttgart 2000, pp 186-237, и в указанной в настоящем документе литературе. Общепринятые способы могут быть затем использованы для реакции этих соединений с алкилирующим агентом R1'-Z, в котором R1' представляет собой C1-C3-алкил или фторированный C1-C3-алкил, и Z представляет собой нуклеофильно замещаемую уходящую группу (например, галоген, такой как хлор, бром или йод), с получением соединения I, в котором R1 представляет собой C1-C3-алкил или фторированный C1-C3-алкил. Условия реакции, необходимые для этого, раскрыты, например, в WO 02/83652, Tetrahedron 2000, 56(38) pp. 7553-7560 и Synlett. 2000 (4), pp. 475-480.
Соединения общей формулы II сами по себе известны или могут быть получены способом, показанным на схеме 2.
Схема 2:
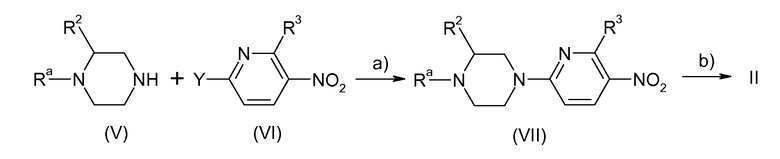
На схеме 2 Ra, R2, и R3 имеют ранее указанные значения. Y представляет собой нуклеофильно замещаемую уходящую группу, в частности атом галогена, например хлор или бром, или алкилсульфонильную группу, например метилсульфонил.
Реакция, показанная на стадии a) схемы 2, проходит при условиях реакции, которые являются общепринятыми для нуклеофильного замещения на ароматический радикал и которые описаны, например, в Tetrahedron 1999, 55(33), pp. 10243-10252, J. Med. Chem. 1997, 40(22), pp. 3679-3686 и Synthetic Communications, 1993, 23(5), pp. 591-599. По необходимости, может быть выгодным преобразовать кольцевой атом азота в пиридиновом кольце в его N-оксид (смотри, например, Angew. Chem. Int. Ed. Engl., 2002 41(11), pp. 1937-1940, J. Med. Chem. 1985, 28(2), pp. 248-252 и Tetrahedron Lett. 2002 43(17) pp. 3121-3123). В связи с последующим восстановлением нитрогруппы в VII (стадия b) N-оксидная группа также восстанавливается. Для этого восстановление проводят, например, в присутствии солей индия.
Если Y в соединении VI представляет собой бром, сопряжение на стадии a) схемы 2 может также быть достигнуто при катализе на палладии в присутствии вспомогательного основания, например карбоната щелочного металла, такого как карбонат цезия. Особенно подходящими палладиевыми катализаторами в этой связи являются соединения палладия (0) или соединения палладия, которые способны образовать соединение палладия (0) при условиях реакции, например дихлорид палладия, тетракис(трифенилфосфин)палладий(0), трис(дибензилиденацетон)дипалладий(0), преимущественно в комбинации с фосфиновыми лигандами, например, триарилфосфины, такие как трифенилфосфин, триалкилфосфины, такие как трибутилфосфин, и циклоалкилфосфины, такие как трициклогексилфосфин, и, особенно, используя фосфиновые хелатные лиганды, такие как 2,2'-бис(дифенилфосфино)-1,1'-бинафтил. Условия, которые являются необходимыми для реакций этой природы, описаны, например, в Tetrahedron Lett. 2001, 42(22), p. 3681 и Tetrahedron Lett. 2002, 43(12), pp. 2171-2173.
На стадии b) нитрогруппу в соединении VII восстанавливают до NH2 группы с получением соединения II. Условия реакции, которые являются необходимыми для стадии b), относятся к общепринятым условиям для восстановления ароматических нитрогрупп, которые широко были описаны в литературе (смотри, например, J. March, Advanced Organic Chemistry, 3rd ed., J. Wiley & Sons, New-York, 1985, p. 1183 и литературу, указанную в этой ссылке). Восстановление может быть достигнуто, например, с помощью взаимодействия нитросоединения VII с помощью металла, такого как железо, цинк или олово, при кислотных условиях реакции, т.е. используя образующийся водород или используя сложный гидрид, такой как литийалюмогидрид или боргидрид натрия, предпочтительно в присутствии соединений переходного металла никеля или кобальта, таких как NiCl2(P(фенил)3)2 или CoCl2,(смотри Ono et al. Chem. Ind. (London), 1983 p.480), или используя NaBH2S3 (смотри Lalancette et al. Can. J. Chem. 49, 1971, p. 2990), делая возможным проведение этих восстановлений в зависимости от конкретного реагента в веществе или в растворителе или разбавителе. С другой стороны, восстановление VII до II может быть проведено с помощью водорода в присутствии катализатора переходного металла, например, используя водород в присутствии катализаторов, основанных на платине, палладие, никеле, рутении или родии. Катализаторы могут содержать переходный металл в элементарной форме или в форме сложного соединения, соли или оксида переходного металла, делая возможным, для цели изменения активности, использование общепринятых со-лигандов, например органических фосфиновых соединений, таких как трифенилфосфин, трициклогексилфосфин или три-н-бутилфосфины или фосфиты. Катализатор обычно применяют в количествах от 0,001 до 1 моль на моль соединения VII, рассчитанные на металл катализатора. В предпочтительном варианте восстановление осуществляют, используя хлорид олова (II) по аналогии со способами, описанными в Bioorganic and Medicinal Chemistry Letters, 2002, 12(15), pp. 1917-1919 и J. Med. Chem. 2002, 45(21), pp. 4679-4688. Реакцию VII с хлоридом олова (II) предпочтительно проводят в инертном органическом растворителе, предпочтительно спирте, таком как метанол, этанол, изопропанол или бутанол.
N-оксиды соединения формулы I могут быть получены с помощью обработки соединения формулы I окисляющим агентом, в частности неорганическим или органическим пероксидом или гидропероксидом, таким как пероксид водорода, или перкарбоновыми кислотами, такими как надуксусная кислота, надбензойная кислота или м-хлорпербензойная кислота.
Если не указано другого, вышеописанные реакции в основном проводят в растворителе при температурах между комнатной температурой и температурой кипения используемого растворителя. С другой стороны, энергия активации, которая необходима для реакции, может быть введена в реакционную смесь, используя микроволны, некоторые из которых, оказывается, имеют значение, в частности в случае, если реакции катализируются с помощью переходных металлов (относительно реакций, использующих микроволны, смотри Tetrahedron 2001, 57, p. 9199 ff. p. 9225 ff., а также, в общем случае, "Microwaves in Organic Synthesis", Andre Loupy (Ed.), Wiley-VCH 2002).
Примерами растворителей, которые могут быть использованы, являются простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, метил-трет-бутиловый эфир или тетрагидрофуран, апротонные полярные растворители, такие как диметилформамид, диметилсульфоксид, диметоксиэтан и ацетонитрил, ароматические углеводороды, такие как толуол и ксилен, кетоны, такие как ацетон или метилэтилкетон, галогенуглеводороды, такие как дихлорметан, трихлорметан и дихлорэтан, сложные эфиры, такие как этилацетат и метилбутират, карбоновые кислоты, такие как уксусная кислота или пропионовая кислота, и спирты, такие как метанол, этанол, н-пропанол, изопропанол и бутанол.
Если необходимо, возможно присутствие основания, чтобы нейтрализовать протоны, которые высвобождаются в реакциях. Подходящие основания включают неорганические основания, такие как карбонат натрия, карбонат калия, гидрокарбонат натрия или гидрокарбонат калия, алкоксиды, такие как метоксид натрия или этоксид натрия, гидриды щелочных металлов, такие как гидрид натрия, органометаллические соединения, такие как бутиллитиевые соединения или алкилмагниевые соединения, и органические азотные основания, такие как триэтиламин или пиридин. Последние из упомянутых соединений можно в то же время использовать в качестве растворителей.
Сырой продукт выделяют общепринятым способом, как, например, с помощью фильтрования, дистилляции растворителя или экстракцией из реакционной смеси и т.д. Полученные соединения могут быть очищены общепринятым способом, как, например, с помощью перекристаллизации из растворителя, посредством хроматографии или посредством превращения в кислотно-аддитивную соль.
Кислотно-аддитивные соли получают общепринятым способом с помощью смешивания свободного основания с соответствующей кислотой, где приемлемо в растворе в органическом растворителе, как, например, низшем спирте, таком как метанол, этанол, н-пропанол или изопропанол, простом эфире, таком как метил-трет-бутиловый эфир или диизопропиловый эфир, кетоне, таком как ацетон или метилэтилкетон, или сложном эфире, таком как этилацетат. Например, свободное основание формулы I и подходящие количества соответствующей кислоты, такие как от 1 до 4 молей на моль формулы I, растворимы в подходящем растворителе, предпочтительно в низшем спирте, таком как метанол, этанол, н-пропанол или изопропанол. Нагрев может быть применен для растворения твердых веществ, если необходимо. Растворители, где кислотно-аддитивная соль I нерастворима (антирастворители), могут быть добавлены для осаждения соли. Подходящие антирастворители включают C1-C4-алкил-сложные эфиры C1-C4-алифатические кислоты, такие как этилацетат, алифатические и циклоалифатические углеводороды, такие как гексан, циклогексан, гептан, и т.д., ди-C1-C4-алкил-сложные эфиры, такие как метил-трет-бутиловый эфир или диизопропиловый эфир. Часть или весь антирастворитель может быть добавлен к горячему раствору соли, и таким образом полученный раствор охлаждают; остаток антирастворителя затем добавляют до тех пор, пока концентрация соли в маточном растворе не будет низкой, как приблизительно 10 мг/л или ниже.
Соединения по изобретению формулы I являются поразительно весьма селективными лигандами дофаминового рецептора D3. Благодаря своей низкой аффиности по отношению к другим рецепторам, таким как D1 рецепторы, D4 рецепторы, α1-адренорецептор и/или α2-адренорецептор, мускариновые рецепторы, гистаминовые рецепторы, опиатные рецепторы и, в особенности, дофаминовые рецепторы D2, можно ожидать, что соединения вызовут меньше побочных эффектов, чем классические нейролептики, которые являются антагонистами рецептора D2.
Высокая афинность соединений по изобретению в отношении рецептора D3 выражается в очень низких значениях Ki in-vitro в, как правило, меньше чем 60 нМ (нмоль/л), предпочтительно меньше чем 30 нМ и, в частности, меньше чем 20 нМ. Замещение [125I]иодосульпридом может, например, быть использовано в изучениях связывания рецептора для определения аффиности связывания для рецептора D3ов.
Селективность соединений по изобретению в отношении D2 рецептора относительно рецептора D3, выраженная как Ki(D2)/Ki(D3), равна, как правило, по меньшей мере, 20, предпочтительно, по меньшей мере, 40. Замещение [3H]SCH23390, [125I]иодосульпридом или [125I]спипероном может быть использовано, например, при проведении исследований связывания рецептора на D1, D2 и D4 рецепторах.
Благодаря своему профилю связывания настоящие соединения могут быть использованы для лечения заболеваний или расстройств, которые восприимчивы к лигандам дофамина D3, то есть можно ожидать, что они должны быть эффективными для лечения тех медицинских расстройств или заболеваний, в которых проявление воздействия (модулирование) на дофаминовые рецепторы D3 приводит к улучшению клинической картины или лечимого заболевания. Примерами этих заболеваний являются расстройства или заболевания центральной нервной системы.
Под расстройствами или заболеваниями центральной нервной системы понимаются расстройства, которые действуют на спинной мозг и, в частности, мозг. В пределах значения изобретения термин "расстройства" означает нарушения и/или аномалии, которые, как правило, рассматривают как патологические состояния или функции и которые могут обнаруживать себя в виде особых знаков, симптомов и/или дисфункций. В то время как лечение по изобретению может быть направлено на индивидуальное расстройство, то есть аномалии или патологические состояния, также возможно для некоторых аномалий, которые могут являться причиной болезни друг для друга, объединение в модели болезни или синдромы, которые могут быть вылечены в соответствии с изобретением.
Расстройствами, которые могут быть вылечены в соответствии с изобретением, являются, в частности, психиатрические и неврологические нарушения. Эти нарушения включают, в частности, органические нарушения, включая симптоматические нарушения, такие как психозы острого экзогенного типа, реакции или сопутствующие психозы органической или экзогенной причины, как, например, в связи с метаболическими нарушениями, инфекциями и патологиями эндокринной системы; экзогенные психозы, такие как шизофрения и шизотипные и иллюзорные нарушения; эмоциональные потрясения, такие как депрессии, большое депрессивное расстройство, мания и/или маниакально-депрессивные состояния; смешенные формы вышеописанных нарушений; невропатические и соматоформные нарушения и также нарушения в связи со стрессом; диссоциированные нарушения, такие как потеря сознания, помрачение сознания, раздвоение сознания и личностные нарушения; аутизм; нарушения внимания и режима бодрствования/сна, такие как поведенческие нарушения и эмоциональные нарушения, чье появление относится к детству и юности, как, например, повышенная активность у детей, умственные нарушения, такие как нарушения внимания (расстройства, связанные с дефицитом внимания с (или без) повышенной активностью), нарушения памяти и когнитивные нарушения, такие как нарушение обучения и памяти (нарушенная когнитивная функция), слабоумие, наркомания и нарушения сна, такие как синдром усталых ног; нарушение развития; состояния беспокойства; бредовое состояние; сексуальные нарушения, такие как импотенция у мужчин; нарушения питания, такие как анорексия или булемия; зависимость; биполярное расстройство и другие точно неустановленные психиатрические нарушения.
Расстройства, которые могут быть вылечены в соответствии с изобретением, также включают болезнь Паркинсона и эпилепсию и, в частности, эмоциональные потрясения, связанные с ней.
Также лечению поддаются заболевания, вызывающие зависимость (наркотическую зависимость и токсикоманию), то есть психические расстройства и поведенческие нарушения, которые вызваны злоупотреблением психотропных веществ, таких как фармацевтические препараты или наркотики, и также другие зависимые поведения, такие как игорная зависимость и/или расстройства контроля над побуждениями, не отнесенные к другим категориям. Примеры веществ, вызывающих зависимость, включают опиоиды, такие как морфин, героин и кодеин; кокаин; никотин; спирт; вещества, которые взаимодействуют с комплексом ГАМК - канал-переносчик для ионов хлора; седативные средства, снотворные средства и транквилизаторы, как, например, бензодиазепины; ЛСД; каннабиноиды; психомоторные стимуляторы, такие как 3,4-метилендиокси-N-метиламфетамин (экстази); амфетамин и амфетаминподобные вещества, такие как метилфенидат; и другие стимуляторы, включая кофеин. Вещества, вызывающие зависимость, которые особенно принимают во внимание, представляют собой опиоиды, кокаин, амфетамин или амфетаминподобные вещества, никотин и спирт.
Относительно лечения заболеваний, связанных с зависимостью, особое предпочтение отдано тем соединениям по изобретению формулы I, которые сами по себе не обладают каким-либо психотропным воздействием. Это также можно наблюдать в исследовании, используя крыс, которые, после введения им соединений, которые могут быть использованы в соответствии с изобретением, уменьшили самостоятельное потребление психотропных веществ, например кокаина.
В соответствии с другим аспектом настоящего изобретения соединения по изобретению являются пригодными для лечения расстройств, чьи причины можно, по меньшей мере частично, отнести к аномальной активности дофаминовых рецепторов D3.
В соответствии с другим аспектом настоящего изобретения лечение направлено, в частности, на те расстройства, которые могут находиться под влиянием, в смысле рационального медицинского лечения, связывания предпочтительно экзогенно вводимых партнеров (лигандов), связывающихся с дофаминовыми рецепторами D3.
Заболевания, которые могут быть вылечены с помощью соединений по изобретению, часто характеризуют с помощью прогрессивного развития, то есть вышеописанные состояния меняются с течением времени; как правило, тяжесть возрастает, и условия могут, вероятно, накладываться друг на друга, или другие условия могут появляться в дополнение к уже существующим.
Соединения по изобретению могут быть использованы для лечения большого числа явлений, симптомов и/или дисфункций, которые связаны с расстройствами центральной нервной системы и, в частности, с вышеупомянутыми состояниями. Эти явления, симптомы и/или дисфункции включают, например, нарушенные отношения к реальности, отсутствие адекватной самооценки и способности принять общепринятые общественные нормы или требования, поставленные жизнью, изменения темперамента, изменения в самоуправлении, такие как голод, сон, жажда и т.д., и в настроении, нарушения в способности наблюдать и объединять, изменения в личности, в частности эмоциональная неустойчивость, галлюцинации, нарушения эго, встревоженность, раздвоение чувств, аутизм, деперсонализация и ложное восприятие, иллюзорные идеи, бубнеж, отсутствие совместного рефлекторного движения, ходьба короткими шагами, изогнутое положение туловища и конечностей, тремор, отсутствие мимики, монотонная речь, депрессии, апатия, стесненная непосредственность и решительность, скудная ассоциативная способность, беспокойство, нервное возбуждение, заикание, общественные фобии, панические нарушения, синдромы отмены в связи с зависимостью, экспансивные синдромы, состояния возбуждения и помрачения сознания, подавленное настроение, дискинетические синдромы и тиковые расстройства, такие как хорея Гентингтона и Синдром Жиля де ла Туретта, синдромы головокружения, такие как периферическое позиционное, ротационное и осциллирующее головокружение, меланхолия, истерический невроз, ипохондрия и подобные.
В пределах значения изобретения лечение также включает профилактическое лечение (профилактику), в частности, в виде повторной профилактики или периодической профилактики, а также лечение острых или хронических явлений, симптомов и/или дисфункций. Лечение может быть сориентировано симптоматически, как, например, для подавления симптомов. Оно может иметь эффект в течение короткого периода, быть сориентировано в течение среднего срока или может представлять собой лечение в течение длительного периода, как, например, в рамках поддерживающей терапии.
Следовательно, соединения по изобретению предпочтительно пригодны для лечения заболеваний центральной нервной системы, в частности для лечения аффективных расстройств; нервных потрясений, стрессовых потрясений и соматоформных нарушений и психозов, и, в частности, для лечения шизофрении и биполярного расстройства.
Благодаря своей высокой селективности в отношении рецептора D3 соединения I по изобретению являются также пригодными для лечения нарушений функции почки, в частности нарушений функции почки, которые вызваны диабетом (смотри WO 00/67847) и, особенно, диабетической нефропатией.
Кроме того, соединения по настоящему изобретению могут обладать другими фармакологическими и/или токсикологическими свойствами, которые делают их особенно пригодными для разработки в качестве фармацевтических препаратов. В качестве примера, ожидается, что соединения формулы I, обладающие низкой аффиностью в отношении HERG рецептора, имеют пониженную вероятность стимулирования QT-пролонгации (рассматривают в качестве одного показателя риска, вызывающего аритмию сердца) (для обсуждения QT-пролонгации смотри, например, A. Cavalli et al., J. Med. Chem. 2002, 45:3844-3853 и указанную в настоящем документе литературу; анализ HERG доступен платно у GENION Forschungsgesellschaft GmbH, Hamburg, Germany).
В рамках лечения применение в соответствии с изобретением описанных соединений включает способ. В этом способе эффективное количество одного или более соединений, как правило, составленное в соответствии с фармацевтической и ветеринарной практикой, вводят индивидууму, которого необходимо лечить, предпочтительно млекопитающему, в частности человеку, продуктивному животному или домашнему животному. Показано ли такое лечение и в какой форме оно должно иметь место, зависит от индивидуального случая и представляет собой предмет медицинского обследования (диагноз), который принимает во внимание явления, симптомы и/или дисфункции, которые присутствуют, риски развития конкретных явлений, симптомов и/или дисфункций и другие факторы.
Как правило, лечение осуществляют посредством однократного или повторяющегося ежедневно введения, где приемлемо совместно или при чередовании с другими активными соединениями или препаратами, содержащими активное соединение, таким образом, чтобы ежедневную дозу предпочтительно от приблизительно 0,01 до 1000 мг/кг, более предпочтительно от 0,1 до 1000 мг/кг веса тела, в случае перорального введения, или от приблизительно 0,01 до 100 мг/кг, более предпочтительно от 0,1 до 100 мг/кг веса тела, в случае парентерального введения, вводили индивидууму, которого необходимо лечить.
Изобретение также относится к получению фармацевтических композиций для лечения индивидуума, предпочтительно млекопитающего и, в частности, человека, сельскохозяйственного животного или домашнего животного. Таким образом, соединения обычно вводят в форме фармацевтических композиций, которые включают фармацевтически приемлемый эксципиент совместно с, по меньшей мере, одним соединением по изобретению и, где приемлемо, другими активными соединениями. Эти композиции можно, например, вводить перорально, ректально, вагинально, трансдермально, подкожно, внутривенно, внутримышечно или через нос.
Примерами подходящих фармацевтических составов являются твердые медицинские формы, такие как порошки, гранулы, таблетки (в частности, таблетки, покрытые пленочной оболочкой), таблетки для рассасывания, саше, капсулы для приема лекарств, таблетки, покрытые сахаром, капсулы, такие как твердые желатиновые капсулы и мягкие желатиновые капсулы; суппозитории или вагинальные медицинские формы; полутвердые медицинские формы, такие как мази, кремы, гидрогели, пасты или гипс; и также жидкие медицинские формы, такие как растворы, эмульсии (в частности, эмульсии масло-в-воде), суспензии, такие как лосьоны, препараты для введения и препараты для инфузии, капли в нос и капли для ушей. Имплантированные спусковые устройства также могут быть использованы для введения ингибиторов по изобретению. Кроме того, также возможно использовать липосомы или микросферы.
При получении композиций соединения по изобретению обычно смешивают или разбавляют эксципиентом. Эксципиенты могут представлять собой твердые, полутвердые или жидкие материалы, которые используют в качестве средств для переноса носителей или среды для активного соединения.
Подходящие эксципиенты перечислены в медицинских монографиях специалистов. Кроме того, составы могут включать фармацевтически приемлемые носители или общепринятые вспомогательные вещества, такие как вещества, способствующие скольжению; смачивающие агенты; эмульгирующие и суспендирующие агенты; консерванты; антиоксиданты; антираздражители; хелатирующие агенты; покрывающие вспомогательные вещества; стабилизаторы эмульсии; пленкообразователи; гелеобразователи; агенты, маскирующие запах; улучшители вкуса; смолу; гидроколлоиды; растворители; солюбилизаторы; нейтрализующие агенты; ускорители диффузии; пигменты; соединения четвертичного аммония; повторно обезжиривающие и пережиривающие агенты; сырые материалы для мазей, кремов или масел; силиконовые производные; распределяющиеся вспомогательные вещества; стабилизаторы; стерилизующие средства; суппозиторные основания; вспомогательные вещества для таблетки, такие как связующие вещества, наполнители, вещества, способствующие скольжению, разрыхлители или покрытия; пропелленты; осушивающие вещества; замутнители; загустители; воски; пластификаторы и белые минеральные масла. Состав в этой связи основан на знании специалиста, как описано, например, в Fiedler, H. P., Lexikon der Hilfsstoffe fur Pharmazie, Kosmetik und angrenzende Gebiete [Encyclopedia of auxiliary substances for pharmacy, cosmetics and related fields], 4th edition, Aulendorf: ECV-Editio-Kantor-Verlag, 1996.
Следующие примеры служат для объяснения изобретения без его ограничения.
Соединения характеризовали или через протонный ЯМР в d6-диметилсульфоксиде или d-хлороформе на ЯМР приборе (Bruker AVANCE) при 400 MHz или 500 MHz, или с помощью масс-спектрометрии, в основном записанной через ВЭЖХ-МС в быстром градиенте на C18-материале (режим электрораспылительной ионизации (ESI)), или по температуре плавления.
Спектральные свойства магнитного ядерного резонанса (ЯМР) относятся к химическим сдвигам (δ), выраженным в миллионных долях (м.д.). Относительная площадь сдвигов в 1H ЯМР спектре соответствует числу атомов водорода для конкретного функционального типа в молекуле. Природа сдвига, что касается мультиплетности, указана как синглет (с), уширенный синглет (уш.с), дублет (д), уширенный дублет (уш.д), триплет (т), уширенный триплет (уш.т), квартет (кв), квинтет (квин) и мультиплет (м).
Примеры получения:
I. Получение промежуточного соединения IV
Пример получения 1: третбутиловый эфир (R)-4-{5-[4-((S)-2-фтор-1-метилэтил)-бензолсульфонил-амино]-6-метилпиридин-2-ил}-2-метилпиперазин-1-карбоновой кислоты
1.1 (R)-2-Метил-4-(6-метил-5-нитропиридин-2-ил)-пиперазин
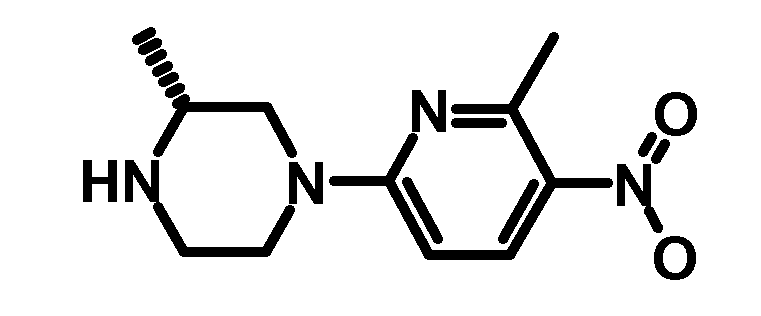
0,72 г (R)-2-метилпиперазина (4,17 ммоль) растворяли в 10 мл N,N-диметилформамида. Добавляли 1,165 г карбоната калия (8,43 ммоль) и 0,44 г 6-хлор-2-метил-3-нитропиридина, и смесь перемешивали в течение 16 ч при комнатной температуре. Растворитель упаривали при пониженном давлении, и остаток разделяли между водой и диэтиловым эфиром. Водный слой экстрагировали с помощью диэтилового эфира, и объединенные органические фазы промывали водой, сушили над сульфатом натрия, фильтровали, и фильтрат упаривали досуха с получением 0,85 г указанного в заголовке соединения.
ESI-МС: 237,1 [M+Н]+
1.2 Третбутиловый эфир (R)-2-метил-4-(6-метил-5-нитропиридин-2-ил)-пиперазин-1-карбоновой кислоты
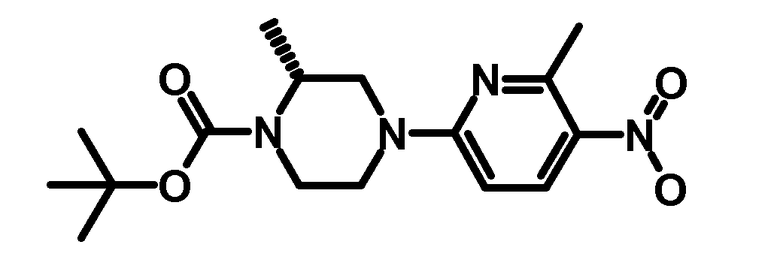
0,85 г (R)-2-метил-4-(6-метил-5-нитропиридин-2-ил)-пиперазина (3,6 ммоль) растворяли в 12 мл тетрагидрофурана. Добавляли раствор 0,775 г дитретбутилдикарбоната (0,355 ммоль) в 3 мл тетрагидрофурана и 1,5 мл триэтиламина. Смесь перемешивали в течение 3 ч при комнатной температуре, растворитель упаривали, и остаток повторно растворяли в диэтиловом эфире, и раствор промывали дважды с помощью разбавленного водного раствора хлорида аммония. Органическую фазу сушили над сульфатом натрия, фильтровали, и фильтрат упаривали досуха с получением 1,2 г указанного в заголовке продукта.
ESI-МС: 337,1 [M+Н]+
1.3 третбутиловый эфир (R)-2-метил-4-(6-метил-5-аминопиридин-2-ил)-пиперазин-1-карбоновой кислоты
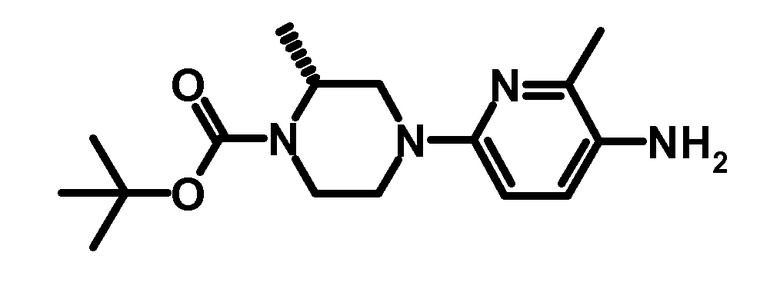
1,2 г третбутилового эфира (R)-2-метил-4-(6-метил-5-нитропиридин-2-ил)-пиперазин-1-карбоновой кислоты (3,57 ммоль) растворяли в 20 мл этилацетата. Добавляли 10% Pd на углероде и 3 мл уксусной кислоты, и смесь гидрировали в течение 4 ч при 50ºC до завершения. Катализатор отфильтровывали, и фильтрат упаривали досуха. Остаток обрабатывали водой, и pH доводили до pH 8-9 с помощью 1 N водного раствора гидроксида натрия.
Водную фазу экстрагировали дважды с помощью дихлорметана, органические экстракты сушили над сульфатом натрия, фильтровали, и фильтрат упаривали досуха. Сырой продукт очищали с помощью хроматографии на силикагеле, используя прибор ISCO CompanionTM (дихлорметан-этилацетат 0-50%) с получением 0,88 г указанного в заголовке продукта.
ESI-МС: 307,2 [M+Н]+
1.4 третбутиловый эфир (R)-4-{5-[4-((S)-2-фтор-1-метилэтил)-бензолсульфониламино]-6-метилпиридин-2-ил}-2-метилпиперазин-1-карбоновой кислоты
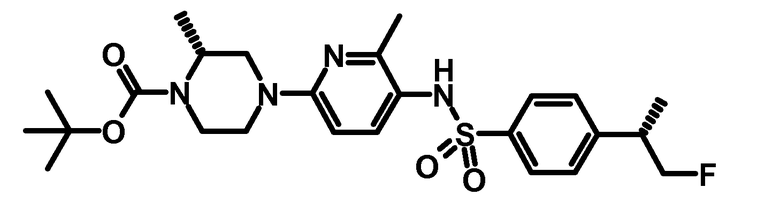
0,105 г третбутилового эфира (R)-2-метил-4-(6-метил-5-аминопиридин-2-ил)-пиперазин-1-карбоновой кислоты (0,34 ммоль) и 0,085 г ((S)-2-фтор-1-метилэтил)-бензолсульфонилхлорида (0,36 ммоль) растворяли в 5 мл пиридина, и раствор перемешивали в течение 1 ч при комнатной температуре. Растворитель упаривали при пониженном давлении, остаток обрабатывали с помощью диэтилового эфира. Органические фазы впоследствии промывали дважды с помощью разбавленного водного хлорида аммония и водой. Органическую фазу сушили над сульфатом натрия, фильтровали, и растворитель упаривали при пониженном давлении. Сырой продукт очищали с помощью хроматографии на силикагеле, используя хроматографическую систему ISCO Companion (циклогексан-этилацетат 15-40%) с получением 0,162 г продукта.
ESI-МС: 507,2 [M+Н]+
Пример получения 2: третбутиловый эфир (S)-4-{5-[4-((S)-2-фтор-1-метилэтил)-бензолсульфониламино]-6-метилпиридин-2-ил}-2-метилпиперазин-1-карбоновой кислоты
2.1 (S)-2-Метил-4-(6-метил-5-нитропиридин-2-ил)-пиперазин
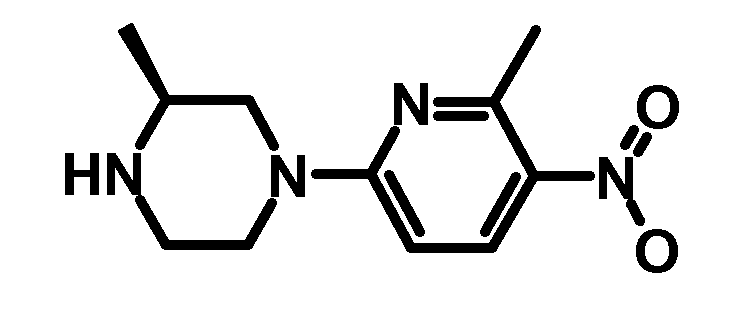
0,72 г (S)-2-метил-4-(6-метил-5-нитропиридин-2-ил)-пиперазин получали, как описано в примере получения 1,1 для синтеза (R)-2-метил-4-(6-метил-5-нитропиридин-2-ил)-пиперазина.
ESI-МС: 237,1 [M+Н]+
1H-ЯМР (CDCl3, 400 Гц): δ [м.д.] 8,2 (д, 1Н), 6,45 (д, 1Н), 4,3-4,45 (м, 2H), 3,1 (м, 1Н), 3,0 (м, 1Н), 2,7-2,95 (м, 2H), 2,75 (с, 3H), 2,65 (м, 1Н), 1,15 (с, 3H).
2.2 Третбутиловый эфир (S)-2-метил-4-(6-метил-5-нитропиридин-2-ил)-пиперазин-1-карбоновой кислоты

1,13 г третбутилового эфира (S)-2-метил-4-(6-метил-5-нитропиридин-2-ил)-пиперазин-1-карбоновой кислоты получали, как описано в примере получения 1,2 для синтеза третбутилового эфира (R)-2-метил-4-(6-метил-5-нитропиридин-2-ил)-пиперазин-1-карбоновой кислоты.
ESI-МС: 337,2 [M+Н]+
2.3 третбутиловый эфир (S)-2-метил-4-(6-метил-5-аминопиридин-2-ил)-пиперазин-1-карбоновой кислоты третбутиловый эфир
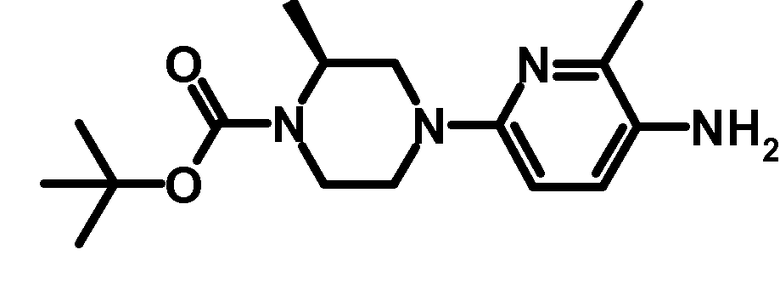
1,13 г третбутилового эфира (S)-2-метил-4-(6-метил-5-нитропиридин-2-ил)-пиперазин-1-карбоновой кислоты (3,36 ммоль) растворяли в 65 мл метанола и 5 мл этилацетата, и раствор подвергали гидрированию в H-cubeTM (Thalos Ltd.) при 40ºC (скорость потока 1 мл/мин). Растворители удаляли при пониженном давлении, и остаток очищали с помощью хроматографии на силикагеле, используя прибор ISCO CompanionTM (дихлорметан-этилацетат 0-45%) с получением 0,58 г указанного в заголовке продукта.
ESI-МС: 307,2 [M+Н]+
2.4 Третбутиловый эфир (S)-4-{5-[4-((S)-2-фтор-1-метилэтил)-бензолсульфониламино]-6-метилпиридин-2-ил}-2-метилпиперазин-1-карбоновой кислоты
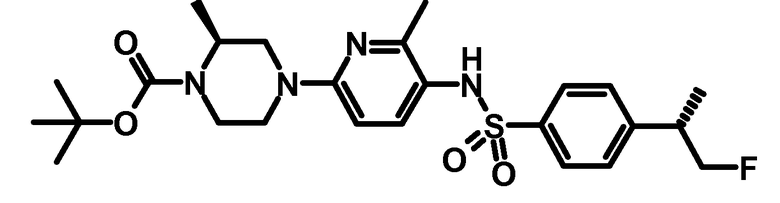
0,105 г третбутилового эфира (S)-2-метил-4-(6-метил-5-аминопиридин-2-ил)-пиперазин-1-карбоновой кислоты (0,34 ммоль) и 0,085 г ((S)-2-фтор-1-метилэтил)-бензолсульфонилхлорида (0,36 ммоль) растворяли в 5 мл пиридина, и раствор перемешивали в течение 1 ч при комнатной температуре. Растворитель упаривали при пониженном давлении, остаток обрабатывали с помощью диэтилового эфира. Органические фазы впоследствии промывали дважды с помощью разбавленного водного хлорида аммония и водой. Органическую фазу сушили над сульфатом натрия, фильтровали, и растворитель упаривали при пониженном давлении. Сырой продукт очищали с помощью хроматографии на силикагеле, используя хроматографическую систему ISCO Companion (циклогексан-этилацетат 15-40%) с получением 0,162 г продукта.
ESI-МС: 507,2 [M+Н]+
Пример получения 3: третбутиловый эфир (S)-4-{5-[4-((R)-2-фтор-1-метилэтил)-бензолсульфониламино]-6-метилпиридин-2-ил}-2-метилпиперазин-1-карбоновой кислоты
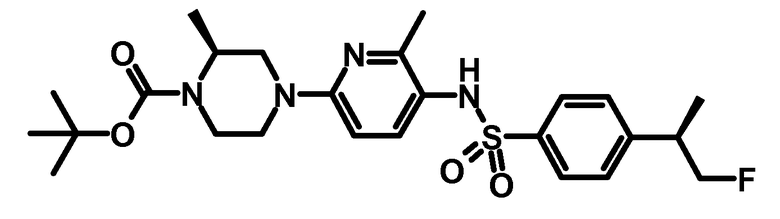
Соединение получали, как описано для синтеза третбутилового эфира (S)-4-{5-[4-((S)-2-фтор-1-метилэтил)-бензолсульфониламино]-6-метилпиридин-2-ил}-2-метилпиперазин-1-карбоновой кислоты в примере получения 2,4 с получением 0,194 г продукта.
ESI-МС: 507,2 [M+Н]+
Пример получения 4: третбутиловый эфир 4-{5-[4-((S)-2-фтор-1-метилэтил)-бензолсульфониламино]-6-метилпиридин-2-ил}-пиперазин-1-карбоновой кислоты
4.1 третбутиловый эфир 4-(6-метил-5-аминопиридин-2-ил)-пиперазин-1-карбоновой кислоты
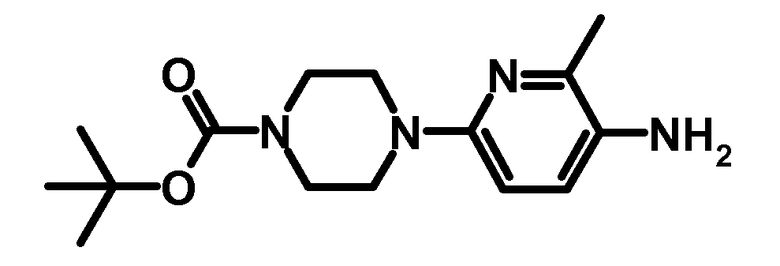
Указанное в заголовке соединение получали по аналогии со способами, описанными в примерах получения с 1.1 по 1.3
4.2 третбутиловый эфир 4-{5-[4-((S)-2-фтор-1-метилэтил)-бензолсульфониламино]-6-метилпиридин-2-ил}-пиперазин-1-карбоновой кислоты
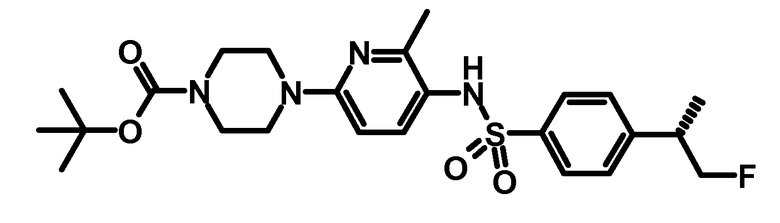
Соединение получали, как описано для синтеза третбутилового эфира (S)-4-{5-[4-((S)-2-фтор-1-метилэтил)-бензолсульфониламино]-6-метилпиридин-2-ил}-2-метилпиперазин-1-карбоновой кислоты в примере получения 2.4.
ESI-МС: 493,2 [M+Н]+
Пример получения 5: третбутиловый эфир 4-{5-[4-((R)-2-фтор-1-метилэтил)-бензолсульфониламино]-6-метилпиридин-2-ил}-пиперазин-1-карбоновой кислоты
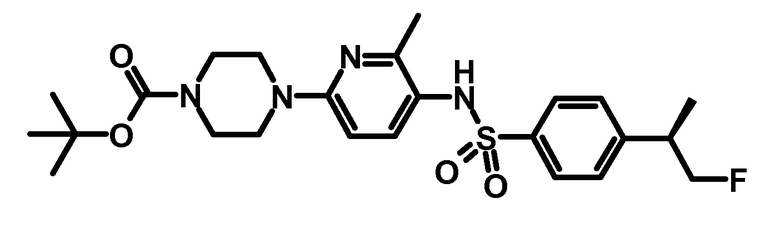
Соединение получали, как описано для синтеза третбутилового эфира (S)-4-{5-[4-((S)-2-фтор-1-метилэтил)-бензолсульфониламино]-6-метилпиридин-2-ил}-2-метилпиперазин-1-карбоновой кислоты в примере получения 2.4.
ESI-МС: 493,2 [M+Н]+
Пример получения 6: третбутиловый эфир (R)-4-{5-[4-((R)-2-фтор-1-метилэтил)-бензолсульфониламино]-6-метилпиридин-2-ил}-2-метилпиперазин-1-карбоновой кислоты.
Соединение получали, как описано для синтеза третбутилового эфира (S)-4-{5-[4-((S)-2-фтор-1-метилэтил)-бензолсульфониламино]-6-метилпиридин-2-ил}-2-метилпиперазин-1-карбоновой кислоты в примере получения 2,4.
ESI-МС: 507,2 [M+Н]+
Пример получения 7: третбутиловый эфир 4-{5-[4-(2,2-дифтор-1-метилэтил)-бензолсульфониламино]-6-метилпиридин-2-ил}-пиперазин-1-карбоновой кислоты 450 мг, выход 86%.
II. Получение соединений I
Пример 1: 4-((S)-2-Фтор-1-метилэтил)-N-[2-метил-6-((S)-3-метилпиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид
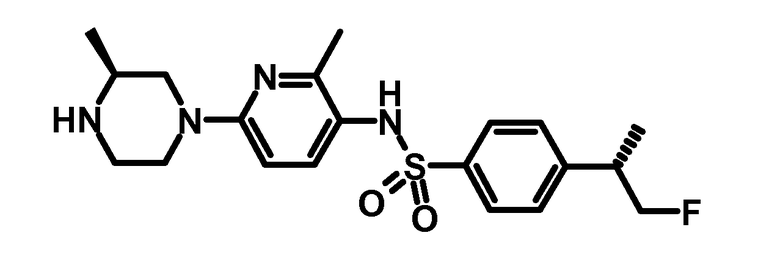
0,162 г третбутилового эфира (S)-4-{5-[4-((S)-2-фтор-1-метилэтил)-бензолсульфониламино]-6-метилпиридин-2-ил}-2-метилпиперазин-1-карбоновой кислоты (0,32 ммоль) растворяли в 5 мл дихлорметана. К раствору добавляли 1,5 мл 6 N хлороводородной кислоты в изопропаноле. Смесь перемешивали в течение 16 ч при комнатной температуре, и растворитель упаривали. Остаток разбавляли водой, и раствор доводили до pH 8-9 с помощью насыщенного водного бикарбоната натрия. Смесь экстрагировали три раза с помощью диэтилового эфира. Объединенные органические слои промывали водой, сушили над сульфатом натрия, фильтровали, и растворитель упаривали при пониженном давлении. Сырой продукт обрабатывали с помощью 0,3 мл ацетонитрила (содержащего 0,1% трифторуксусной кислоты) и 0,3 мл ацетонитрил/вода (содержащего 0,1% трифторуксусной кислоты). Образовавшийся осадок собирали, промывали с помощью ацетонитрил/вода 1:1 и сушили с получением 0,025 г указанного в заголовке продукта.
ESI-МС: 407,2 [M+Н]+
1H-ЯМР (CDCl3, 400 Гц): δ [м.д.] 7,7 (д, 2H), 7,4 (д, 2H), 7,3 d, 1Н), 6,4 (д, 1Н), 4,55 (м, 1Н), 4,4, м, 1Н), 4,1 (т, 2H), 3,15 (м, 1Н), 3,1 (м, 1Н), 2,7-2,95 (несколько м, 3H), 2,4 (т, 1Н), 2,0 (с, 3H), 1,3 (д, 3H), 1,1 (д, 3H).
Пример 2: 4-((R)-2-Фтор-1-метилэтил)-N-[2-метил-6-((S)-3-метилпиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид
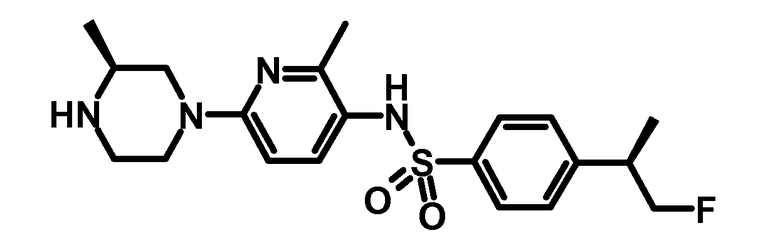
0,194 г третбутилового эфира (S)-4-{5-[4-((R)-2-фтор-1-метилэтил)-бензолсульфониламино]-6-метилпиридин-2-ил}-2-метилпиперазин-1-карбоновой кислоты (0,38 ммоль) растворяли в 5 мл дихлорметана. К раствору добавляли 1,5 мл 6N хлороводородной кислоты в изопропаноле. Смесь перемешивали в течение 16 ч при комнатной температуре, и растворитель упаривали. Остаток разбавляли водой, и раствор доводили до pH 8-9 с помощью насыщенного водного бикарбоната натрия. Смесь экстрагировали три раза с помощью диэтилового эфира. Объединенные органические слои промывали водой, сушили над сульфатом натрия, фильтровали, и растворитель упаривали при пониженном давлении с получением 0,128 г указанного в заголовке продукта.
ESI-МС: 407,2 [M+Н]+
1H-ЯМР (CDCl3, 400 Гц): δ [м.д.] 7,7 (д, 2H), 7,4 (д, 2H), 7,3 д, 1Н), 6,4 (д, 1Н), 4,55 (м, 1Н), 4,4, м, 1Н), 4,1 (т, 2H), 3,15 (м, 1Н), 3,1 (м, 1Н), 2,7-2,95 (несколько м, 3H), 2,4 (т, 1Н), 2,0 (с, 3H), 1,3 (д, 3H), 1,1 (д, 3H).
Если не указано другого, соединения следующих примеров с 3 по 18 получали с помощью по аналогии со способами, раскрытыми в примерах 1 и 2.
Пример 3: 4-((R)-2-Фтор-1-метилэтил)-N-[2-метил-6-((R)-3-метилпиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид
Пример 4: 4-((S)-2-Фтор-1-метилэтил)-N-[2-метил-6-((R)-3-метилпиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид
Пример 5: 4-((R)-2-Фтор-1-метилэтил)-N-[2-метил-6-пиперазин-1-илпиридин-3-ил]-бензолсульфонамид
100 мг, выход 99%. ESI-МС: 393,1 [M+Н]+
1H-ЯМР (ДМСО-d6, 400 Гц): δ [м.д.] 1,24 (д, 3H), 1,98 (с, 3H), 3,16 (м, 4H), 3,23 (м, 1Н), 3,67 (м, 4H), 4,48 (д, 1Н), 4,60 (д, 1Н), 6,66 (д, 1Н), 7,12 (д, 1Н), 7,50 (д, 2H), 7,60 (д, 2H), 9,00 (уш. с, 1Н), 9,43 (с, 1Н).
Пример 6: 4-((S)-2-Фтор-1-метилэтил)-N-[2-метил-6-пиперазин-1-илпиридин-3-ил]-бензолсульфонамид
460 мг, выход 99%. ESI-МС: 393,1 [M+Н]+
1H-ЯМР (ДМСО-d6, 400 Гц): δ [м.д.] 1,24 (д, 3H), 1,98 (с, 3H), 3,16 (м, 4H), 3,23 (м, 1Н), 3,67 (м, 4H), 4,48 (д, 1Н), 4,60 (д, 1Н), 6,66 (д, 1Н), 7,12 (д, 1Н), 7,50 (д, 2H), 7,60 (д,2H), 9,00 (уш. с, 1Н), 9,43 (с, 1Н).
Пример 7 (сравнительный): N-(5-Бром-2-метил-6-пиперазин-1-илпиридин-3-ил)-4-((S)-2-фтор-1-метилэтил)-бензолсульфонамид
Третбутиловый эфир 4-{5-[4-((S)-2-фтор-1-метилэтил)-бензолсульфониламино]-6-метилпиридин-2-ил}-пиперазин-1-карбоновой кислоты (370 мг, 0,754 ммоль) разбавляли в ацетонитриле (3 мл) и добавляли N-бромсукцинимид (201 мг, 1,13 ммоль). Полученный раствор нагревали при 80ºC при микроволновом излучении в течение 35 минут. Охлажденный раствор затем разделяли между раствором NaHCO3 и дихлорметаном. Органический слой отделяли, сушили (MgSO4), фильтровали и очищали с помощью колоночной хроматографии с получением желаемого продукта. Желтое твердое вещество. Количество 135 мг. Выход 38%.
Характеризовали в виде соли HCl:
ESI-МС: 473,1, 471,1 [M+Н]+
1H-ЯМР (CDCl3, 400 Гц): δ [м.д.] 1,24 (д, 3H), 2,02 (с, 3H), 3,18 (м, 4H), 3,25 (м, 1Н), 3,40 (м, 4H), 4,52 (дд, 2H), 7,39 (с, 1Н), 7,54 (д, 2H), 7,67 (д, 2H), 9,15 (уш. с, 2H), 9,85 (с, 1Н).
Пример 8: 4-(2,2-Дифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид
420 мг, выход 99%. ESI-МС: 41 1,1 [M+Н]+
1H-ЯМР (CD3OD, 400 Гц): δ [м.д.] 1,38 (д, 3H), 2,00 (с, 3H), 3,28 (м, 5H), 3,79 (м, 4H), 5,97 (тд, 1Н), 6,63 (д, 1Н), 7,22 (д, 1Н), 7,50 (д, 2H), 7,64 (д, 2H).
Пример 9: 4-((S)-2,2-Дифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид
181 мг, выход 99%. ESI-МС: 411,1 [M+Н]+
1H-ЯМР (CD3OD, 400 Гц): δ [м.д.] 1,38 (д, 3H), 2,00 (с, 3H), 3,28 (м, 5H), 3,79 (м, 4H), 5,97 (тд, 1Н), 6,63 (д, 1Н), 7,22 (д, 1Н), 7,50 (д, 2H), 7,64 (д, 2H).
Пример 10: 4-((R)-2,2-Дифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид
230 мг, выход 99%. ESI-МС: 41 1,1 [M+Н]+
1H-ЯМР (CD3OD, 400 Гц): δ [м.д.] 1,38 (д, 3H), 2,00 (с, 3H), 3,28 (м, 5H), 3,79 (м, 4H), 5,97 (тд, 1Н), 6,63 (д, 1Н), 7,22 (д, 1Н), 7,50 (д, 2H), 7,64 (д, 2H).
Пример 11: 4-(2,2,2-Трифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид
Характеризовали в виде соли HCl: ESI-МС: 430,1 [M+Н]+
1H-ЯМР (ДМСО-d6, 400 Гц): δ [м.д.] 1,45 (д, 3H), 1,90 (с, 3H), 3,14 (м, 4H), 3,67 (м, 4H), 4,98 (м, 1Н), 6,68 (д, 1Н), 7,12 (д, 1Н), 7,63 (д, 4H), 8,93 (с, 2H), 9,55 (с, 1Н).
Пример 12: 4-((R)-2,2,2-Трифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид
420 мг, выход 99%. Характеризовали в виде соли HCl:
ESI-МС: 430,1 [M+Н]+
1H-ЯМР (ДМСО-d6, 400 Гц): δ [м.д.] 1,45 (д, 3H), 1,90 (с, 3H), 3,14 (м, 4H), 3,67 (м, 4H), 4,98 (м, 1Н), 6,68 (д, 1Н), 7,12 (д, 1Н), 7,63 (д, 4H), 8,93 (с, 2H), 9,55 (с, 1Н).
Пример 13: 4-((S)-2,2,2-Трифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид
62 мг, выход 47%. Характеризовали в виде соли HCl:
ESI-МС: 430,1 [M+Н]+
1H-ЯМР (ДМСО-d6, 400 Гц): δ [м.д.] 1,45 (д, 3H), 1,90 (с, 3H), 3,14 (м, 4H), 3,67 (м, 4H), 4,98 (м, 1Н), 6,68 (д, 1Н), 7,12 (д, 1Н), 7,63 (д, 4H), 8,93 (с, 2H), 9,55 (с, 1Н).
Пример 14: 4-((R)-2-Фтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид
160 мг, выход 80%. Характеризовали в виде соли HCl:
ESI-МС: 409,1 [M+Н]+
1H-ЯМР (ДМСО-d6, 400 Гц): δ [м.д.] 1,23 (д, 3H), 3,12 (м, 4H), 3,18 (м, 1Н), 3,35 (с, 3H), 3,67 (м, 4H), 4,52 (дд, 2H), 6,37 (д, 1Н), 7,34 (д, 1Н), 7,45 (д, 2H), 7,59 (д, 2H), 9,28 (м, 3H).
Пример 15: 4-((S)-2-Фтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид
24 мг, выход 18%. Характеризовали в виде соли HCl:
ESI-МС: 409,1 [M+Н]+
1H-ЯМР (ДМСО-d6, 400 Гц): δ [м.д.] 1,23 (д, 3H), 3,12 (м, 4H), 3,18 (м, 1Н), 3,35 (с, 3H), 3,67 (м, 4H), 4,52 (дд, 2H), 6,37 (д, 1Н), 7,34 (д, 1Н), 7,45 (д, 2H), 7,59 (д, 2H), 9,28 (м, 3H).
Пример 16: 4-(2,2-Дифтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид
57 мг, выход 28%. Характеризовали в виде соли HCl:
ESI-МС: 427,1 [M+Н]+
1H-ЯМР (CD3OD, 400 Гц): δ [м.д.] 1,38 (д, 3H), 3,28 (м, 4H), 3,42 (с, 3H), 3,48 (м, 1Н), 3,74 (м, 4H), 5,97 (дт, 1Н), 6,39 (д, 1Н), 7,43 (д, 2H), 7,60 (д, 1Н), 7,65 (д, 2H).
Пример 17: N-(2-Метокси-6-пиперазин-1-илпиридин-3-ил)-4-(2,2,2-трифтор-1-метилэтил)-бензолсульфонамид
42 мг, выход 31%.
ESI-МС: 445,1 [M+Н]+
1H-ЯМР (CDCl3, 400 Гц): δ [м.д.] 1,48 (д, 3H), 3,10 (м, 4H), 3,38 (с, 3H), 3,43 (м, 1Н), 3,59 (м, 4H), 5,20 (уш. с, 2H), 6,17 (д, 1Н), 7,37 (д, 2H), 7,63 (м, 3H).
Пример 18: N-(2-Метокси-6-пиперазин-1-илпиридин-3-ил)-4-((S)-2,2,2-трифтор-1-метилэтил)-бензолсульфонамид
45 мг, выход 62%.
ESI-МС: 445,1 [M+Н]+
1H-ЯМР (CDCl3, 400 Гц): δ [м.д.] 1,48 (д, 3H), 3,10 (м, 4H), 3,38 (с, 3H), 3,43 (м, 1Н), 3,59 (м, 4H), 5,20 (уш. с, 2H), 6,17 (д, 1Н), 7,37 (д, 2H), 7,63 (м, 3H).
III. Примеры форм введения, полученные обработкой растительного и животного сырья
A) Таблетки
Таблетки следующих композиций прессовали на таблеточном прессе общепринятым способом:
40 мг вещества из примера 1
120 мг кукурузного крахмала
13,5 мг желатина
45 мг лактозы
2,25 мг Aerosil® (химически чистая кремниевая кислота в ультрамикроскопической тонкой дисперсии)
6,75 мг картофельный крахмал (в виде 6% пасты)
B) Таблетки, покрытые сахаром
20 мг вещества из примера 1
60 мг основной композиции
70 мг сахарообразующей композиции
Основная композиция состоит из 9 частей кукурузного крахмала, 3 частей лактозы и 1 части сополимера винилпирролидон/винилацетат 60:40. Сахарообразующая композиция состоит из 5 частей тростникового сахара, 2 частей кукурузного крахмала, 2 частей карбоната кальция и 1 части талька. Таблетки, покрытые сахаром, которые получали этим способом, впоследствии предоставляют с покрытием, устойчивым к желудочному соку.
IV. Биологические исследования
Изучения связывания рецептора:
Вещество, которое необходимо исследовать, растворяли или в метанол/Chremophor® (BASF-AG), или в диметилсульфоксиде и затем разбавляли водой до желаемой концентрации.
a) Дофаминовый рецептор D3:
Анализируемая смесь (0,250 мл) состояла из мембран, происходящих из ~106 HEK-293 клеток, обладающих стабильно экспрессирующимися человеческими дофаминовыми рецепторами D3, 0,1 нМ [125I]-иодосульприда и инкубационного буфера (полное связывание) или, кроме того, исследоваемого вещества (кривая ингибирования) или 1 μM спиперона (неспецифическое связывание). Каждую анализируемую смесь использовали трижды.
Инкубационный буфер содержал 50 мМ трис, 120 мМ NaCl, 5 мМ KCl, 2 мМ CaCl2, 2 мМ MgCl2 и 0,1% бычьего сывороточного альбумина, 10 μM хинолона и 0,1% аскорбиновой кислоты (получали свежую ежедневно). Буфер доводили до pH 7,4 с помощью HCl.
b) Дофаминовый рецептор D2L:
Анализируемая смесь (1 мл) состояла из мембран, происходящих из ~106 HEK-293 клеток, обладающих стабильно экспрессирующимися человеческими дофаминовыми рецепторами D2L (длинная изоформа), и 0,01 нМ [125I]иодоспиперона и инкубационного буфера (полное связывание) или, кроме того, исследуемого вещества (кривая ингибирования) или 1 μM галогенперидола (неспецифическое связывание). Каждую анализируемую смесь использовали трижды.
Инкубационный буфер содержал 50 мМ трис, 120 мМ NaCl, 5 мМ KCl, 2 мМ CaCl2, 2 мМ MgCl2 и 0,1% бычьего сывороточного альбумина. Буфер доводили до pH 7,4 с помощью HCl.
c) Измерение и анализ:
После инкубирования при 25ºC в течение 60 минут анализируемые смеси фильтровали через Whatman GF/B стекловолокнистый фильтр под вакуумом, используя устройство для сбора клеток. Фильтры переносили на сцинтилляционные виалы, используя систему для переноса фильтров. После добавления 4 мл Ultima Gold® (Packard) образцы встряхивали в течение часа и затем высчитывали радиоактивность в бета-счетчике (Packard, Tricarb 2000 или 2200CA). Значения cpm (число импульсов в минуту) переводили в dpm (число распадов в минуту), используя стандартный порядок гашения и программу, принадлежащую прибору.
Кривые ингибирования анализировали посредством циклического анализа криволинейной регрессии, используя Статистическую Анализирующую Систему (SAS), которая аналогична программе «Ligand», описанной Munson и Rodbard.
В этих исследованиях соединения по изобретению проявляют очень хорошие аффиности в отношении рецептора D3 (<100 нМ, часто <50 нМ, в частности <10 нМ) и селективность связывания с рецептором D3.
Результаты исследований на связывание представлены в Таблице 1.
+++<10 нМ, ++<100 нМ, +<1000 нМ
| название | год | авторы | номер документа |
|---|---|---|---|
| АРИЛСУЛЬФОНИЛМЕТИЛЬНЫЕ ИЛИ АРИЛСУЛЬФОНАМИДНЫЕ ПРОИЗВОДНЫЕ АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ РАССТРОЙСТВ, ВОСПРИИМЧИВЫХ К ЛЕЧЕНИЮ ЛИГАНДАМИ ДОФАМИНОВЫХ D РЕЦЕПТОРОВ, С ИХ ПОМОЩЬЮ | 2005 |
|
RU2442781C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ АРИЛСУЛЬФОНЫ, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ РАССТРОЙСТВ, КОТОРЫЕ ОТВЕЧАЮТ НА МОДУЛИРОВАНИЕ 5HT РЕЦЕПТОРОВ | 2007 |
|
RU2451012C2 |
| СОЕДИНЕНИЯ N-ФЕНИЛ(ПИПЕРАЗИНИЛ ИЛИ ГОМОПИПЕРАЗИНИЛ)БЕНЗОЛСУЛЬФОНАМИДА ИЛИ БЕНЗОЛСУЛЬФОНИЛФЕНИЛ(ПИПЕРАЗИНА ИЛИ ГОМОПИПЕРАЗИНА), ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, КОТОРЫЕ РЕАГИРУЮТ НА МОДУЛИРОВАНИЕ РЕЦЕПТОРА 5-НТ СЕРОТОНИНА | 2010 |
|
RU2535200C2 |
| ИНГИБИТОРЫ КАТЕПСИН-ЦИСТЕИНПРОТЕАЗЫ | 2003 |
|
RU2312861C2 |
| ПРОИЗВОДНЫЕ ГЕТЕРОАРЕНКАРБОКСАМИДА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И ПРИМЕНЕНИЕ | 2003 |
|
RU2320656C2 |
| ПРОИЗВОДНЫЕ АМИНОКИСЛОТ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ИХ ПРИМЕНЕНИЕ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2005 |
|
RU2379281C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ПОЛОЖИТЕЛЬНЫХ МОДУЛЯТОРОВ МЕТАБОТРОПНОГО ГЛУТАМАТНОГО РЕЦЕПТОРА 2 (РЕЦЕПТОРА MGLU2) | 2008 |
|
RU2479577C2 |
| ЗАМЕЩЕННЫЕ АРИЛАМИНЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ 5-HT-РЕЦЕПТОРА | 2006 |
|
RU2440996C2 |
| ПРОИЗВОДНЫЕ ЗАМЕЩЕННОГО ТРИАЗОЛДИАМИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2001 |
|
RU2274639C2 |
| НОВОЕ ПРОИЗВОДНОЕ ОКТАГИДРОТИЕНОХИНОЛИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ПРОИЗВОДНОЕ, И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2573399C2 |
Изобретение относится к соединениям формулы I
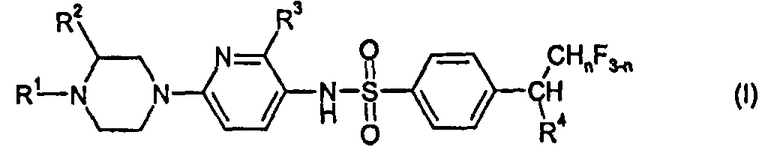 где R1 выбран из группы, состоящей из водорода и линейного C1-С3 алкила; R2 представляет собой водород или метил; R3 выбран из группы, состоящей из водорода, C1-C2-алкила и C1-С2-алкокси, R4 представляет собой С1-С2-алкил; n представляет собой 0, 1 или 2; и физиологически устойчивые соли этих соединений. Изобретение также относится к фармацевтической композиции, включающей, по меньшей мере, одно соединение формулы (I) и обладающей активностью и селективностью в отношении дофаминового рецептора D3, к применению соединений формулы I для лечения заболеваний, которые восприимчивы к влиянию антагонистов дофаминового рецептора D3, и далее к способу лечения заболеваний, которые восприимчивы к влиянию антагонистов дофаминового рецептора D3 или агонистов дофамина D3, включающему введение эффективного количества, по меньшей мере, одного соединения или физиологически устойчивой кислотно-аддитивной соли формулы I нуждающемуся в этом субъекту. Технический результат: получены и описаны новые соединения, которые могут найти свое применение в лечении заболеваний нервной системы. 7 н. и 20 з.п. ф-лы, 18 пр., 1 табл.
где R1 выбран из группы, состоящей из водорода и линейного C1-С3 алкила; R2 представляет собой водород или метил; R3 выбран из группы, состоящей из водорода, C1-C2-алкила и C1-С2-алкокси, R4 представляет собой С1-С2-алкил; n представляет собой 0, 1 или 2; и физиологически устойчивые соли этих соединений. Изобретение также относится к фармацевтической композиции, включающей, по меньшей мере, одно соединение формулы (I) и обладающей активностью и селективностью в отношении дофаминового рецептора D3, к применению соединений формулы I для лечения заболеваний, которые восприимчивы к влиянию антагонистов дофаминового рецептора D3, и далее к способу лечения заболеваний, которые восприимчивы к влиянию антагонистов дофаминового рецептора D3 или агонистов дофамина D3, включающему введение эффективного количества, по меньшей мере, одного соединения или физиологически устойчивой кислотно-аддитивной соли формулы I нуждающемуся в этом субъекту. Технический результат: получены и описаны новые соединения, которые могут найти свое применение в лечении заболеваний нервной системы. 7 н. и 20 з.п. ф-лы, 18 пр., 1 табл.
1. N-(6-пиперазин-1-илпиридин-3-ил)бензолсульфонамидные соединения формулы I

где R1 выбран из группы, состоящей из водорода и линейного C1-С3 алкила;
R2 представляет собой водород или метил;
R3 выбран из группы, состоящей из водорода, C1-C2-алкила и С1-С2-алкокси,
R4 представляет собой С1-С2-алкил;
n представляет собой 0, 1 или 2;
и физиологически устойчивые соли этих соединений.
2. Соединение по п.1, где R1 представляет собой водород.
3. Соединение по п.1 или 2, где R2 представляет собой метил.
4. Соединение по п.3, где атом углерода, который несет R2, имеет S-конфигурацию.
5. Соединение по п.3, где атом углерода, который несет R2, имеет R-конфигурацию.
6. Соединение по п.1 или 2, где R2 представляет собой водород.
7. Соединение по любому из пп.1, 2, 4 или 5, где R3 представляет собой метил.
8. Соединение по любому из пп.1, 2, 4 или 5, где R4 представляет собой метил.
9. Соединение по п.8, где атом углерода, который несет R4, имеет S-конфигурацию.
10. Соединение по п.8, где атом углерода, который несет R4, имеет R-конфигурацию.
11. Соединение по любому из пп.1, 2, 4, 5, 9 или 10, где n представляет собой 1.
12. Соединение по любому из пп.1, 2, 4, 5, 9 или 10, где n представляет собой 2.
13. Соединения по п.1, выбранные из группы, состоящей из:
4-(2-фтор-1-метилэтил)-N-[2-метил-6-(3-метилпиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамида,
4-((R)-2-фтор-1-метилэтил)-N-[2-метил-6-((R)-3-метилпиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамида,
4-((S)-2-фтор-1-метилэтил)-N-[2-метил-6-((S)-3-метилпиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамида,
4-((R)-2-фтор-1-метилэтил)-N-[2-метил-6-((S)-3-метилпиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамида,
4-((S)-2-фтор-1-метилэтил)-N-[2-метил-6-((R)-3-метилпиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамида,
4-(2-фтор-1-метилэтил)-N-[2-метил-6-пиперазин-1-илпиридин-3-ил]-бензолсульфонамида,
4-((R)-2-фтор-1-метилэтил)-N-[2-метил-6-пиперазин-1-илпиридин-3-ил]-бензолсульфонамида,
4-((S)-2-фтор-1-метилэтил)-N-[2-метил-6-пиперазин-1-илпиридин-3-ил]-бензолсульфонамида,
и физиологически устойчивые соли этих соединений.
14. Соединения по п.1, выбранные из группы, состоящей из:
4-(2,2-дифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамида,
4-((S)-2,2-дифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамида,
4-((R)-2,2-дифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамида,
и физиологически устойчивые соли этих соединений.
15. Соединения по п.1, выбранные из группы, состоящей из:
4-(2,2,2-трифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамида,
4-((R)-2,2,2-трифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамида,
4-((S)-2,2,2-трифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамида,
и физиологически устойчивые соли этих соединений.
16. Соединения по п.1, выбранные из группы, состоящей из:
4-(2-фтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамида,
4-((R)-2-фтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсуль фонамида,
4-((S)-2-фтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамида,
4-(2,2-дифтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамида,
4-((S)-2,2-дифтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамида,
4-((R)-2,2-дифтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамида,
N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-4-(2,2,2-трифтор-1-метилэтил)-бензолсульфонамида,
N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-4-((S)-2,2,2-трифтор-1-метилэтил)-бензолсульфонамида,
N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-4-((R)-2,2,2-трифтор-1-метилэтил)-бензолсульфонамида,
и физиологически устойчивые соли этих соединений.
17. Фармацевтическая композиция, включающая, по меньшей мере, одно соединение, обладающее активностью и селективностью в отношении дофаминового рецептора D3, по любому из пп.1, 2, 4, 5, 9, 10, 13, 14, 15 или 16, необязательно совместно с, по меньшей мере, одним физиологически приемлемым носителем или вспомогательным веществом.
18. Соединение по любому из пп.1, 2, 4, 5, 9, 10, 13, 14, 15 или 16 для применения в качестве лекарственного средства для лечения медицинского заболевания, поддающегося лечению с помощью лиганда дофаминового рецептора D3.
19. Применение соединения по любому из пп.1, 2, 4, 5, 9, 10, 13, 14, 15 или 16 для лечения медицинского заболевания, поддающегося лечению с помощью лиганда дофаминового рецептора D3.
20. Применение соединения по любому из пп.1, 2, 4, 5, 9, 10, 13, 14, 15 или 16 для получения лекарственного средства для лечения медицинского заболевания, поддающегося лечению с помощью лиганда дофаминового рецептора D3.
21. Способ лечения медицинских заболеваний, поддающихся лечению с помощью лиганда дофаминового рецептора D3, включающий введение эффективного количества, по меньшей мере, одного соединения по любому из пп.1, 2, 4, 5, 9, 10, 13, 14, 15 или 16 нуждающемуся в этом субъекту.
22. Способ лечения заболевания центральной нервной системы, включающий введение эффективного количества, по меньшей мере, одного соединения по любому из пп.1, 2, 4, 5, 9, 10, 13, 14, 15 или 16 нуждающемуся в этом субъекту.
23. Способ по п.22, где медицинское заболевание представляет собой шизофрению.
24. Способ по п.22, где медицинское заболевание представляет собой наркотическую зависимость.
25. Способ по п.21, где медицинское заболевание представляет собой диабетическую нефропатию.
26. Способ по п.22, где медицинское заболевание представляет собой биполярное расстройство.
27. Соединение формулы IV
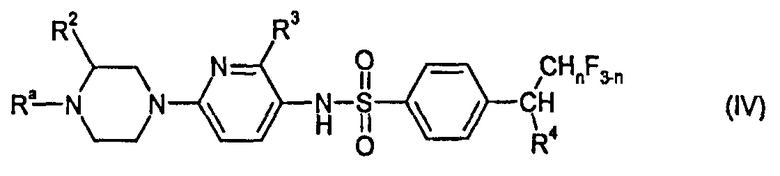
где Ra представляет собой N-защитную группу, и где n, R2, R3 и R4 являются такими, как определено в любом из пп.1, 2, 4, 5, 9 или 10.
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| RU 2004102389 A, 2005.07.10. | |||
Авторы
Даты
2013-06-20—Публикация
2008-10-30—Подача