Область техники, к которой относится изобретение
Настоящее изобретение относится к новым арилсульфонилметильным или арилсульфонамидным производным ароматических соединений. Соединения обладают ценными фармацевтическими свойствами и пригодны, в частности, для лечения заболеваний, реагирующих на модулирование дофаминовых рецепторов D3.
Уровень техники
Помимо прочих способов, нейроны получают информацию с помощью рецепторов, сопряженных с G-белком. Действие множества соединений обусловлено именно этими рецепторами. Одним из таких соединений является дофамин. Известно, что дофамин присутствует в нейронах, а также известна его физиологическая роль как нейропередатчика. Нарушения в работе дофаминергической передающей системы приводят к заболеваниям центральной нервной системы, включая, например, шизофрению, депрессию или болезнь Паркинсона. Эти и другие заболевания можно лечить соединениями, взаимодействующими с дофаминовыми рецепторами.
До 1990 года были известны два подтипа дофаминовых рецепторов, четко охарактеризованных фармакологически. Это рецепторы D1 и D2. Недавно нашли третий подтип, D3 рецептор, который, видимо, опосредует действие некоторых антипсихотиков и препаратов для лечения паркинсонизма (J.C.Schwartz et al., The Dopamine D3 Рецептор as a Target for Antipsychotics, in Novel Antipsychotic Drugs, H.Y. Meltzer, Ed. Raven Press, New York 1992, pages 135-144; M. Dooley et al., Drugs and Aging 1998, 12, 495-514, J.N.Joyce, Pharmacology и Therapeutics 2001, 90, pp.231-59 "The Dopamine D3 Рецептор as a Therapeutic Target for Antipsychotic и Antiparkinsonian Drugs").
С этого момента дофаминовые рецепторы разделяют на два семейства. С одной стороны, существует группа D2, состоящая из D2, D3 и D4 рецепторов, и, с другой стороны, группа D1, включающая D1 и D5 рецепторы. В то время как D1 и D2 рецепторы распространены в организме повсеместно, D3 рецепторы, вероятно, экспрессируются региоселективно. Так, эти рецепторы предпочтительно встречаются в лимбической системе и в областях проекции мезолимбической дофаминовой системы, особенно в области nucleus accumbens, но также и в других областях, таких как миндалевидное тело (amygdala). Из-за такой относительно региоселективной экспрессии считается, что D3 рецепторы являются фармацевтической мишенью, характеризующейся небольшим количеством побочных эффектов, а также предполагается, что, хотя селективные лиганды D3 рецепторов должны проявлять свойства известных антипсихотиков, но они не обладают неврологическими побочными эффектами, опосредуемыми рецепторами D2. (Р. Sokoloff et al., Localization и Function of the D3 Dopamine Receptor, Arzneim. Forsch. / Drug Res. 42(1), 224 (1992); P. Sokoloff et al. Molecular Cloning и Characterization of a Novel Dopamine Рецептор (D3) as a Target for Neuroleptics, Nature, 347, 146 (1990)).
В патенте WO 97/45403, помимо прочего, описаны 6-аминотетралиновые соединения, обладающие сродством к дофаминовому D3 рецептору. Некоторые из этих соединений обладают определенной селективностью по отношению к D3 рецептору по сравнению с их сродством к D2 рецептору. На этом основании предположили, что такие соединения подходят для лечения заболеваний центральной нервной системы. К сожалению, их сродство и селективность по отношению к D3 рецепторам является всего лишь умеренным, или их фармакологический профиль неудовлетворителен. Это означает, что существует потребность в новых соединениях, обладающих как высоким сродством, так и улучшенной селективностью. Такие вещества должны обладать хорошим фармакологическим профилем, например высоким отношением содержания в мозге к содержанию в плазме, высокой биодоступностью, хорошей метаболической стабильностью или уменьшенным ингибированием митохондриального дыхания.
Раскрытие изобретения
Целью настоящего изобретения является получение соединений, действующих как высокоселективные лиганды дофаминового D3 рецептора. Для достижения этой цели были получены арилсульфонилметильные и арилсульфонамидные производные ароматических соединений, соответствующие формуле 1
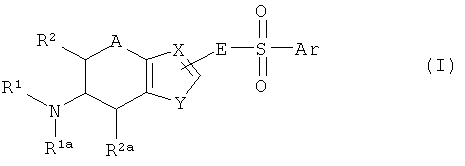
где
Ar представляет собой фенил или ароматический 5- или 6-членный связанный через атом углерода гетероароматический радикал, где Ar может в качестве заместителя включать один радикал R3 и где Ar может дополнительно включать один или два радикала Rb;
Ra выбран из группы, включающей С1-С6-алкил, С2-С6-алкенил, фторированный С2-С6-алкенил, С3-С6-циклоалкил, С1-С6-алкокси, фторированный С1-С6-алкил, фторированный С3-С6-циклоалкил, фторированный С1-С6-алкокси, С1-С6-гидроксиалкил, С1-С6-алкокси-С1-С4-алкил, С1-С6-гидроксиалкокси, С1-С6-алкокси-С1-C4-алкокси, СООН, NR4R5, CH2NR4R5, ONR4R5, NHC(O)NR4R5, C(O)NR4R5, SO2NR4R5, С1-С6-алкилкарбонил, фторированный C1-C6-алкилкарбонил, С1-С6-алкилкарбониламино, фторированный С1-С6-алкилкарбониламино, С1-С6-алкилкарбонилокси, фторированный С1-С6-алкилкарбонилокси, С1-С6-алкоксикарбонил, С1-С6-алкилтио, фторированный С1-С6-алкилтио, С1-С6-алкилсульфинил, С1-С6-алкилсульфонил, фторированный С1-С6-алкилсульфинил, фторированный С1-С6-алкилсульфонил, фенилсульфонил, фенил, фенокси, бензилокси, а также 3-7-членный гетероциклический радикал, где пять последних упомянутых радикалов могут содержать в качестве заместителей 1, 2, 3 или 4 радикала, выбранных из группы, включающей галоген, циано, ОН, оксо, CN, а также радикалы Ra;
Rb независимо друг от друга выбраны из группы, включающей галоген, циано, нитро, ОН, метил, метокси, фторметил, дифторметил, трифторметил, фторметокси, дифторметокси и трифторметокси,
радикал Ra и один радикал Rb, если они присутствуют и связаны с двумя соседними атомами углерода фенила, могут образовывать 5- или 6-членный гетеро- или карбоцикл, конденсированный с фенильным циклом и незамещенный или содержащий 1, 2 или 3 заместителя, выбранных из группы, включающей галоген, NO2, NH2, ОН, CN, C1-C6-алкил, С3-С6-циклоалкил, C1-C6-алкокси, фторированный C1-C6-алкил, фторированный С3-С6-циклоалкил, фторированный С1-С6-алкокси, С1-С6-гидроксиалкил, С1-С4-алкокси-С2-С4-алкил, C1-C6-гидроксиалкокси, С1-С4-алкокси-С2-С4-алкокси, С1-С6-алкилкарбонил, С1-С6-алкиламино, ди-С1-С6-алкиламино, С1-С6-алкиламинокарбонил, ди-С1-С6-алкиламинокарбонил, фторированный С1-С6-алкилкарбонил, С1-С6-алкилкарбониламино, фторированный С1-С6-алкилкарбониламино, C1-C6-алкилкарбонилокси, фторированный C1-C6-алкилкарбонилокси, C1-C6-алкоксикарбонил, C1-C6-алкилтио, фторированный С1-С6-алкилтио, С1-С6-алкилсульфинил, C1-C6-алкилсульфонил, фторированный С1-С6-алкилсульфинил и фторированный C1-C6-алкилсульфонил;
причем, если Ar представляет собой фенил, R2a - водород, R2b - водород и А-CH2, то Ar содержит один радикал Ra, отличающийся от следующих: метил, метокси, трифторметил и трифторметокси, и необязательно содержит один или два радикала Rb;
Х соответствует N или СН;
Y соответствует О, S, -СН=N-, -СН=СН- или -N=CH-;
А соответствует СН2, О или S;
Е представляет собой CR6R7 или NR3;
R1 представляет собой С1-С4-алкил, С3-С4-циклоалкил, С3-С4-циклоалкилметил, С3-С4-алкенил, фторированный С1-С4-алкил, фторированный С3-С4-циклоалкил, фторированный С3-С4-циклоалкилметил, фторированный С3-С4-алкенил, формил или С1-С3-алкилкарбонил;
R1a представляет собой Н, С2-С4-алкил, С3-С4-циклоалкил, С3-С4-алкенил, фторированный С1-С4-алкил, фторированный С3-С4-циклоалкил, или R13 и R2 вместе образуют (СН2)n, где n соответствует 2 или 3, или R1a и R2a вместе образуют (СН2)n, где n соответствует 2 или 3;
R2 и R2a независимо друг от друга выбраны из группы, включающей Н, СН3, CH2F, CHF2 или CF3;
R3 представляет собой Н или С1-С4-алкил;
R4, R5 независимо друг от друга выбраны из группы, включающей Н, С1-С2-алкил, С1-С2-алкокси и фторированный С1-С2-алкил; и
R6, R7 независимо друг от друга выбраны из группы, включающей Н, С1-С2-алкил и фторированный С1-С2-алкил, в особенности водород;
а также их физиологически переносимые соли присоединения кислот.
Таким образом, настоящее изобретение относится к бициклическим ароматическим соединениям общей формулы I и к их физиологически переносимым солям присоединения кислот.
Кроме того, настоящее изобретение относится к фармацевтической композиции, включающей по меньшей мере одно ароматическое соединение формулы I и/или по меньшей мере одну физиологически переносимую соль присоединения кислот соединений формулы I, а также при необходимости физиологически приемлемые носители и/или вспомогательные вещества.
Настоящее изобретение относится также к способу лечения заболеваний, на которые можно воздействовать, влияя на дофаминовые антагонисты D3 рецептора или дофаминовые агонисты D3, причем названный способ включает введение эффективного количества по меньшей мере одного ароматического соединения формулы 1 и/или по меньшей мере одной соли присоединения кислот соединений формулы 1 пациенту, нуждающемуся в таком лечении.
Осуществление изобретения
К числу заболеваний, реагирующих на агонисты и антагонисты дофаминовых D3 рецепторов, относятся, в особенности, заболевания и расстройства центральной нервной системы, такие как аффективные расстройства, невротические расстройства, стресс и соматические расстройства и психозы, в особенности шизофрения и депрессия, а также нарушения функционирования почек, например, вызванные сахарным диабетом (см. патент WO 00/67847).
В соответствии с настоящим изобретением по меньшей мере одно соединение общей формулы I, описанное в начале данной заявки, применяется для лечения упомянутых выше показаний. Соединения формулы I данного состава могут существовать в различных пространственных формах, например, они могут содержать один или более центров асимметрии, полиненасыщенные или двойные связи. Могут они существовать также в виде различных таутомеров. Это означает возможность использования для лечения энантиомерных смесей, в особенности рацематов, диастереомерных и таутомерных смесей. Однако, предпочтительно, чтобы соединения существовали в виде чистых энантиомеров, диастереомеров и таутомеров соединения формулы 1 и/или в виде их солей.
Возможно также использовать физиологически переносимые соли соединений формулы I, в особенности соли присоединения физиологически переносимых кислот. Примерами подходящих физиологически переносимых органических и неорганических кислот являются хлороводородная, бромоводородная, фосфорная, серная кислоты, С1-С4-алкилсульфоновые кислоты, такие как метансульфоновая кислота, ароматические сульфоновые кислоты, такие как бензолсульфоновая кислота и толуолсульфоновая кислота, щавелевая кислота, малеиновая кислота, фумаровая кислота, молочная кислота, винная кислота, адипиновая кислота и бензойная кислота. Другие подходящие кислоты описаны в работе Fortschritte der Arzneimittelforschung [Advances in drug research], Volume 10, pages 224 ff., Birkhauser Verlag, Basel и Stuttgart, 1966.
Органические заместители, упомянутые в приведенных выше определениях - подобно термину "галоген" - представляют собой собирательные понятия, обозначающие целые списки конкретных представителей соответствующих групп. Префикс Cn-Cm в каждом случае означает возможное количество атомов углерода у представителей группы.
Термин "галоген" всегда означает фтор, бром, хлор или иод, в особенности фтор или хлор.
Термин С1-С4алкил (используемый самостоятельно или в составе других определений, таких как С1-С4гидроксиалкил, С1-С6алкокси-С1-С4-алкил, С1-С4алкилкарбонил, С1-С4алкилкарбониламино, С1-С4алкилкарбонилокси, С1-С4алкилтио, С1-С4алкилсульфинил, С1-С4алкилсульфонил и т.д.), представляет собой прямую или разветвленную алкильную группу, содержащую от 1 до 4 атомов углерода. Примерами алкильных групп являются метил, этил, н-пропил, изо-пропил, н-бутил, 2-бутил, изо-бутил или трет-бутил.
Термин С1-С6алкил (используемый самостоятельно или в составе других определений, таких как С1-С6гидроксиалкил.С1-С6алкокси-С1-С4-алкил, C1-С6алкилкарбонил, C1-С6алкилкарбониламино, C1-С6алкилкарбонилокси, C1-С6алкилтио, C1-С6алкилсульфинил, С1-С6алкилсульфонил и т.д.), представляет собой прямую или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода. Примерами таких групп являются упомянутые выше С1-С4алкилы, а также пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, 2,2-диметилпропил, 1-этилпропил, гексил, 1,1-диметилпропил, 1,2-диметилпропил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 2,2-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-этилбутил, 2-этилбутил, 1,1,2-триметилпропил, 1,2,2-триметилпропил, 1-этил-1-метилпропил и 1-этил-2-метилпропил;
Фторированный C1-С6алкил (термин может использоваться самостоятельно или в составе других определений, таких как фторированный C1-С6алкилкарбонил, фторированный C1-С6алкилкарбониламино, фторированный C1-С6алкилкарбонилокси, фторированный C1-С6алкилтио, фторированный С1-С6алкилсульфинил, фторированный C1-С6алкилсульфонил и т.д.), представляет собой прямую или разветвленную алкильную группу, содержащую от 1 до 6, в особенности от 1 до 4, атомов углерода, наиболее предпочтительно, от 1 до 3 атомов углерода, где по меньшей мере один атом водорода (например, 1, 2, 3, 4 или все атомы водорода) замещен на атом фтора. Например, к данной категории относятся дифторметил, трифторметил, (R)-1-фторэтил, (S)-1-фторэтил, 2-фторэтил, 1,1-дифторэтил, 2,2-дифторэтил, 2,2,2-трифторэтил, (R)-1-фторпропил, (S)-1-фторпропил, 2-фторпропил, 3-фторпропил, 1,1-дифторпропил, 2,2-дифторпропил, 3,3-дифторпропил, 3,3,3-трифторпропил, (R)-2-фтор-1-метилэтил, (S)-2-фтор-1-метилэтил, (R)-2,2-дифтор-1-метилэтил, (S)-2,2-дифтор-1-метилэтил, (R)-1,2-дифтор-1-метилэтил, (S)-1,2-дифтор-1-метилэтил, (R)-2,2,2-трифтор-1-метилэтил, (S)-2,2,2-трифтор-1-метилэтил, 2-фтор-1-(фторметил)этил, 1-(дифторметил)-2,2-дифторэтил, (R)-1-фторбутил, (S)-1-фторбутил, 2-фторбутил, 3-фторбутил, 4-фторбутил, 1,1-дифторбутил, 2,2-дифторбутил, 3,3-дифторбутил, 4,4-дифторбутил, 4,4,4-трифторбутил, и т.д.;
Разветвленный С3-С6 алкил представляет собой алкил, содержащий от 3 до 6 атомов углерода, у которого по меньшей мере один атом углерода является вторичным или третичным. Примерами являются трет-бутил, 2-бутил, изобутил, 2-пентил, 2-гексил, 3-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил1-метил-1-этилпропил.
C1-С6алкокси (термин может использоваться самостоятельно или в составе других определений, таких как C1-С6алкоксикарбонил, C1-С6алкокси-С1-С4алкил, С1-С6алкокси-С1-С4алкокси и С1-С6гидроксиалкокси) представляет собой прямую или разветвленную алкильную группу, содержащую от 1 до 6, в особенности от 1 до 4, атомов углерода, связанных с остальной частью молекулы через атом кислорода. Примерами таких групп являются метокси, этокси, н-пропокси, изопропокси, н-бутокси, 2-бутокси, изо-бутокси, трет-бутокси пентилокси, 1-метилбутокси, 2-метилбутокси, 3-метилбутокси, 2,2-диметилпропокси, 1-этилпропокси, гексилокси, 1,1-диметилпропокси, 1,2-диметилпропокси, 1-метилпентилокси, 2-метилпентилокси, 3-метилпентилокси, 4-метилпентилокси, 1,1-диметилбутилокси, 1,2-диметилбутилокси, 1,3-диметилбутилокси, 2,2-диметилбутилокси, 2,3-диметилбутилокси, 3,3-диметилбутилокси, 1-этилбутилокси, 2-этилбутилокси, 1,1,2-триметилпропокси, 1,2,2-триметилпропокси, 1-этил-1-метилпропокси и 1-этил-2-метилпропокси группы.
Фторированный C1-С6алкокси (используемый самостоятельно или в составе других определений, таких как фторированный C1-С6алкоксикарбонил) представляет собой прямую или разветвленную алкокси группу, содержащую от 1 до 6, в особенности от 1 до 4, атомов углерода, где по меньшей мере один атом водорода (например, 1, 2, 3, 4 или все атомы водорода) замещен на атом фтора. Например, к данной категории относятся такие группы, как фторметокси, дифторметокси, трифторметокси, (R)-1-фторэтокси, (S)-1-фторэтокси, 2-фторэтокси, 1,1-дифторэтокси, 2,2-дифторэтокси, 2,2,2-трифторэтокси, (R)-1-фторпропокси, (S)-1-фторпропокси, 2-фторпропокси, 3-фторпропокси, 1,1-дифторпропокси, 2,2-дифторпропокси, 3,3-дифторпропокси, 3,3,3-трифторпропокси, (R)-2-фтор-1-метилэтокси, (S)-2-фтор-1-метилэтокси, (R)-2,2-дифтор-1-метилэтокси, (S)-2,2-дифтор-1-метилэтокси, (R)-1,2-дифтор-1-метилэтокси, (S)-1,2-дифтор-1-метилэтокси, (R)-2,2,2-трифтор-1-метилэтокси, (S)-2,2,2-трифтор-1-метилэтокси, 2-фтор-1-(фторметил)этокси, 1-(дифторметил)-2,2-дифторэтокси, (R)-1-фторбутокси, (S)-1-фторбутокси, 2-фторбутокси, 3-фторбутокси, 4-фторбутокси, 1,1-дифторбутокси, 2,2-дифторбутокси, 3,3-дифторбутокси, 4,4-дифторбутокси, 4,4,4-трифторбутокси, и т.д.;
C3-С6циклоалкил представляет собой циклоалифатический радикал, содержащий от 3 до 6 атомов углерода, такой как циклопропил, циклобутил и циклопентил. Циклоалкильный радикал может быть незамещенным или содержать 1, 2, 3 или 4 С1-С4алкильных радикалов в качестве заместителей (предпочтительно это метильный радикал). Предпочтительно, чтобы один алкильный радикал был расположен в 1-положении циклоалкила, как, например, в 1-метилциклопропиле или 1-метилциклобутиле.
Фторированный С3-С6циклоалкил представляет собой циклоалифатический радикал, содержащий от 3 до 6 атомов углерода, такой как циклопропил, циклобутил и циклопентил, где по меньшей мере один атом водорода (например, 1, 2, 3, 4 или все атомы водорода) заменен на атом фтора. Например, к данной категории относятся такие группы, как 1-фторциклопропил, 2-фторциклопропил, 2,2-дифторциклопропил, 1,2-дифторциклопропил, 2,3-дифторциклопропил, пентафторциклопропил, 1-фторциклобутил, 2-фторциклобутил, 3-фторциклобутил, 2,2-дифторциклобутил, 3,3-дифторциклобутил, 1,2-дифторциклобутил, 1,3-дифторциклобутил, 2,3-дифторциклобутил, 2,4-дифторциклобутил или 1,2,2-трифторциклобутил.
С2-С6-алкенил представляет собой ненасыщенный углеводородный радикал с одной двойной связью, содержащий 2, 3, 4, 5 или 6 атомов углерода, например винил, аллил (2-пропен-1-ил), 1-пропен-1-ил, 2-пропен-2-ил, металлил (2-метилпроп-2-ен-1-ил) и подобные им. В особенности, к этой категории относятся аллил, 1-метилпроп-2-ен-1-ил, 2-бутен-1-ил, 3-бутен-1-ил, металлил, 2-пентен-1-ил, 3-пентен-1-ил, 4-пентен-1-ил, 1-метилбут-2-ен-1-ил или 2-этилпроп-2-ен-1-ил.
Фторированный С2-С6-алкенил представляет собой ненасыщенный углеводородный радикал с одной двойной связью, содержащий 2, 3, 4, 5 или 6 атомов углерода, где по меньшей мере один атом водорода (например, 1, 2, 3, 4 или все атомы водорода) заменен на атом фтора. Например, к данной категории относятся такие группы, как 1-фторвинил, 2-фторвинил, 2,2-фторвинил, 3,3,3-фторпропенил, 1,1-дифтор-2-пропенил 1-фтор-2-пропенил и подобные им.
C1-С6гидроксиалкил представляет собой алкильный радикал, содержащий от 1 до 6 атомов углерода, как описано выше, где по меньшей мере один атом водорода замещен на гидрокси группу. Примеры таких групп включают гидроксиметил, 2-гидроксиэтил, 1-гидроксиэтил, 3-гидроксипропил, 2-гидроксипропил, 1-метил-1-гидроксиэтил и подобные им.
C1-С6гидроксиалкокси представляет собой алкоксильный радикал, содержащий от 1 до 6, предпочтительно от 2 до 4 атомов углерода, как описано выше, где по меньшей мере один атом водорода замещен на гидрокси группу. Примеры таких групп включают 2-гидроксиэтил, 3-гидроксипропил, 2-гидроксипропил, 1-метил-2-гидроксиэтил и подобные им.
C1-С6алкокси-С1-С4-алкил представляет собой алкильный радикал, содержащий от 1 до 4 атомов углерода, как описано выше, и по меньшей мере один атом водорода замещен на C1-С6алкокси группу. Примеры таких групп включают метоксиметил, 2-метоксиэтил, 1-метоксиэтил, 3-метоксипропил, 2-метоксипропил, 1-метил-1-метоксиэтил, этоксиметил, 2-этоксиэтил, 1-этоксиэтил, 3-этоксипропил, 2-этоксипропил, 1-метил-1-этоксиэтил и подобные им.
С1-С6алкокси-С1-С4-алкокси представляет собой алкоксильный радикал, содержащий от 1 до 4 атомов углерода, как описано выше, и по меньшей мере один атом водорода замещен на C1-С6алкокси-группу. Примеры таких групп включают метоксиметокси, 2-метоксиэтокси, 1-метоксиэтокси, 3-метоксипропокси, 2-метоксипропокси, 1-метил-1-метоксиэтокси, этоксиметокси, 2-этоксиэтокси, 1-этоксиэтокси, 3-этоксипропокси, 2-этоксипропокси, 1-метил-1-этоксиэтокси и подобные им.
C1-С6алкилкарбонил представляет собой радикал вида R-C(O)-, где R соответствует алкильному радикалу, содержащему от 1 до 6 атомов углерода, как описано выше. Примеры включают ацетил, пропионил, н-бутилил, 2-метилпропионил, пивалил и подобные им.
C1-С6алкилкарбониламино представляет собой радикал вида R-C(O)-NH-, где R соответствует алкильному радикалу, содержащему от 1 до 6 атомов углерода, как описано выше. Примеры включают ацетамидо, пропионамидо, н-бутирамидо, 2-метилпропионамидо, 2,2-диметилпропионамидо и подобные им.
C1-С6алкилкарбонилокси представляет собой радикал вида R-C(O)-O-, где R соответствует алкильному радикалу, содержащему от 1 до 6 атомов углерода, как описано выше. Примеры включают ацетилокси, пропионилокси, н-бутирилокси, 2-метилпропионилокси, 2,2-диметилпропионилокси и подобные им.
С1-С6алкилтио представляет собой радикал вида R-S-, где R соответствует алкильному радикалу, содержащему от 1 до 6 атомов углерода, как описано выше. Примеры включают метилтио, этилтио, пропилтио, бутилтио, пентилтио, 1-метилбутилтио, 2-метилбутилтио, 3-метилбутилтио, 2,2-диметилпропилтио, 1-этилпропилтио, гексилтио, 1,1-диметилпропилтио, 1,2-диметилпропилтио, 1-метилпентилтио, 2-метилпентилтио, 3-метилпентилтио, 4-метилпентилтио, 1,1-диметилбутилтио, 1,2-диметилбутилтио, 1,3-диметилбутилтио, 2,2-диметилбутилтио, 2,3-диметилбутилтио, 3,3-диметилбутилтио, 1-этилбутилтио, 2-этилбутилтио, 1,1,2-триметилпропилтио, 1,2,2-триметилпропилтио, 1-этил-1-метилпропил и 1-этил-2-метилпропил;
C1-С6алкилсульфинил представляет собой радикал вида R-S(O)-, где R соответствует алкильному радикалу, содержащему от 1 до 6 атомов углерода, как описано выше. Примеры включают метилсульфинил, этилсульфинил, пропилсульфинил, бутилсульфинил, пентилсульфинил, 1-метилбутилсульфинил, 2-метилбутилсульфинил, 3-метилбутилсульфинил, 2,2-диметилпропилсульфинил, 1-этилпропилсульфинил, гексилсульфинил, 1,1-диметилпропилсульфинил, 1,2-диметилпропилсульфинил, 1-метилпентилсульфинил, 2-метилпентилсульфинил, 3-метилпентилсульфинил, 4-метилпентилсульфинил, 1,1-диметилбутилсульфинил, 1,2-диметилбутилсульфинил, 1,3-диметилбутилсульфинил, 2,2-диметилбутилсульфинил, 2,3-диметилбутилсульфинил, 3,3-диметилбутилсульфинил, 1-этилбутилсульфинил, 2-этилбутилсульфинил, 1,1,2-триметилпропилсульфинил, 1,2,2-триметилпропилсульфинил, 1-этил-1-метилпропил и 1-этил-2-метилпропил;
С1-С6алкилсульфонил представляет собой радикал вида R-S(O)2-, где R соответствует алкильному радикалу, содержащему от 1 до 6 атомов углерода, как описано выше. Примеры включают метилсульфонил, этилсульфонил, пропилсульфонил, бутилсульфонил, пентилсульфонил, 1-метилбутилсульфонил, 2-метилбутилсульфонил, 3-метилбутилсульфонил, 2,2-диметилпропилсульфонил, 1-этилпропилсульфонил, гексилсульфонил, 1,1-диметилпропилсульфонил, 1,2-диметилпропилсульфонил, 1-метилпентилсульфонил, 2-метилпентилсульфонил, 3-метилпентилсульфонил, 4-метилпентилсульфонил, 1,1-диметилбутилсульфонил, 1,2-диметилбутилсульфонил, 1,3-диметилбутилсульфонил, 2,2-диметилбутилсульфонил, 2,3-диметилбутилсульфонил, 3,3-диметилбутилсульфонил, 1-этилбутилсульфонил, 2-этилбутилсульфонил, 1,1,2-триметилпропилсульфонил, 1,2,2-триметилпропилсульфонил, 1-этил-1-метилпропил и 1-этил-2-метилпропил;
Фторированный C1-С6алкилкарбонил представляет собой радикал вида R-C(O)-, где R соответствует фторированному алкильному радикалу, содержащему от 1 до 6 атомов углерода, как описано выше. Примеры включают фторацетил, дифторацетил, трифторацетил, (R)-1-фторэтилкарбонил, (S)-1-фторэтилкарбонил, 2-фторэтилкарбонил, 1,1-дифторэтилкарбонил, 2,2-дифторэтилкарбонил, 2,2,2-трифторэтилкарбонил, (R)-1-фторпропилкарбонил, (S)-1-фторпропилкарбонил, 2-фторпропилкарбонил, 3-фторпропилкарбонил, 1,1-дифторпропилкарбонил, 2,2-дифторпропилкарбонил, 3,3-дифторпропилкарбонил, 3,3,3-трифторпропилкарбонил, (R)-2-фтор-1-метилэтилкарбонил, (S)-2-фтор-1-метилэтилкарбонил, (R)-2,2-дифтор-1-метилэтилкарбонил, (S)-2,2-дифтор-1-метилэтилкарбонил, (R)-1,2-дифтор-1-метилэтилкарбонил, (S)-1,2-дифтор-1-метилэтилкарбонил, (R)-2,2,2-трифтор-1-метилэтилкарбонил, (S)-2,2,2-трифтор-1-метилэтилкарбонил, 2-фтор-1-(фторметил)этилкарбонил, 1-(дифторметил)-2,2-дифторэтилкарбонил, (R)-1-фторбутилкарбонил, (S)-1-фторбутилкарбонил, 2-фторбутилкарбонил, 3-фторбутилкарбонил, 4-фторбутилкарбонил, 1,1-дифторбутилкарбонил, 2,2-дифторбутилкарбонил, 3,3-дифторбутилкарбонил, 4,4-дифторбутилкарбонил, 4,4,4-трифторбутилкарбонил, и т.д.;
Фторированный С1-С6алкилкарбониламино представляет собой радикал вида R-C(O)-NH-, где R соответствует фторированному алкильному радикалу, содержащему от 1 до 6 атомов углерода, как описано выше. Примеры включают фторацетамидо, дифторацетамидо, трифторацетамидо, (R)-1-фторэтилкарбониламино, (S)-1-фторэтилкарбониламино, 2-фторэтилкарбониламино, 1,1-дифторэтилкарбониламино, 2,2-дифторэтилкарбониламино, 2,2,2-трифторэтилкарбониламино, (R)-1-фторпропилкарбониламино, (S)-1-фторпропилкарбониламино, 2-фторпропилкарбониламино, 3-фторпропилкарбониламино, 1,1-дифторпропилкарбониламино, 2,2-дифторпропилкарбониламино, 3,3-дифторпропилкарбониламино, 3,3,3-трифторпропилкарбониламино, (R)-2-фтор-1-метилэтилкарбониламино, (S)-2-фтор-1-метилэтилкарбониламино, (R)-2,2-дифтор-1-метилэтилкарбониламино, (S)-2,2-дифтор-1-метилэтилкарбониламино, (R)-1,2-дифтор-1-метилэтилкарбониламино, (S)-1,2-дифтор-1-метилэтилкарбониламино, (R)-2,2,2-трифтор-1-метилэтилкарбониламино, (S)-2,2,2-трифтор-1-метилэтилкарбониламино, 2-фтор-1-(фторметил)этилкарбониламино, 1-(дифторметил)-2,2-дифторэтилкарбониламино, (R)-1-фторбутилкарбониламино, (S)-1-фторбутилкарбониламино, 2-фторбутилкарбониламино, 3-фторбутилкарбониламино, 4-фторбутилкарбониламино, 1,1-дифторбутилкарбониламино, 2,2-дифторбутилкарбониламино, 3,3-дифторбутилкарбониламино, 4,4-дифторбутилкарбониламино, 4,4,4-трифторбутилкарбониламино, и т.д.;
Фторированный C1-С6 алкилкарбонилокси представляет собой радикал вида R-C(O)-O-, где R соответствует фторированному алкильному радикалу, содержащему от 1 до 6 атомов углерода, как описано выше, включая фторацетил, дифторацетил, трифторацетил, (R)-1-фторэтилкарбонилокси, (S)-1-фторэтилкарбонилокси, 2-фторэтилкарбонилокси, 1,1-дифторэтилкарбонилокси, 2,2-дифторэтилкарбонилокси, 2,2,2-трифторэтилкарбонилокси, (R)-1-фторпропилкарбонилокси, (S)-1-фторпропилкарбонилокси, 2-фторпропилкарбонилокси, 3-фторпропилкарбонилокси, 1,1-дифторпропилкарбонилокси, 2,2-дифторпропилкарбонилокси, 3,3-дифторпропилкарбонилокси, 3,3,3-трифторпропилкарбонилокси, (R)-2-фтор-1-метилэтилкарбонилокси, (S)-2-фтор-1-метилэтилкарбонилокси, (R)-2,2-дифтор-1-метилэтилкарбонилокси, (S)-2,2-дифтор-1-метилэтилкарбонилокси, (R)-1,2-дифтор-1-метилэтилкарбонилокси, (S)-1,2-дифтор-1-метилэтилкарбонилокси, (R)-2,2,2-трифтор-1-метилэтилкарбонилокси, (S)-2,2,2-трифтор-1-метилэтилкарбонилокси, 2-фтор-1-(фторметил)этилкарбонилокси, 1-(дифторметил)-2,2-дифторэтилкарбонилокси, (R)-1-фторбутилкарбонилокси, (S)-1-фторбутилкарбонилокси, 2-фторбутилкарбонилокси, 3-фторбутилкарбонилокси, 4-фторбутилкарбонилокси, 1,1-дифторбутилкарбонилокси, 2,2-дифторбутилкарбонилокси, 3,3-дифторбутилкарбонилокси, 4,4-дифторбутилкарбонилокси, 4,4,4-трифторбутилкарбонилокси, и т.д.;
Фторированный С1-С6алкилтио представляет собой радикал вида R-S-, где R соответствует фторированному алкильному радикалу, содержащему от 1 до 6 атомов углерода, как описано выше. Примеры включают: фторметилтио, дифторметилтио, трифторметилтио, (R)-1-фторэтилтио, (S)-1-фторэтилтио, 2-фторэтилтио, 1,1-дифторэтилтио, 2,2-дифторэтилтио, 2,2,2-трифторэтилтио, (R)-1-фторпропилтио, (S)-1-фторпропилтио, 2-фторпропилтио, 3-фторпропилтио, 1,1-дифторпропилтио, 2,2-дифторпропилтио, 3,3-дифторпропилтио, 3,3,3-трифторпропилтио, (R)-2-фтор-1-метилэтилтио, (S)-2-фтор-1-метилэтилтио, (R)-2,2-дифтор-1-метилэтилтио, (S)-2,2-дифтор-1-метилэтилтио, (R)-1,2-дифтор-1-метилэтилтио, (S)-1,2-дифтор-1-метилэтилтио, (R)-2,2,2-трифтор-1-метилэтилтио, (S)-2,2,2-трифтор-1-метилэтилтио, 2-фтор-1-(фторметил)этилтио, 1-(дифторметил)-2,2-дифторэтилтио, (R)-1-фторбутилтио, (S)-1-фторбутилтио, 2-фторбутилтио, 3-фторбутилтио, 4-фторбутилтио, 1,1-дифторбутилтио, 2,2-дифторбутилтио, 3,3-дифторбутилтио, 4,4-дифторбутилтио, 4,4,4-трифторбутилтио, и т.д.;
Фторированный С1-С6алкилсульфинил представляет собой радикал вида R-S(O)-, где R соответствует фторированному алкильному радикалу, содержащему от 1 до 6 атомов углерода, как описано выше. Примеры включают фторметилсульфинил, дифторметилсульфинил, трифторметилсульфинил, (R)-1-фторэтилсульфинил, (S)-1-фторэтилсульфинил, 2-фторэтилсульфинил, 1,1-дифторэтилсульфинил, 2,2-дифторэтилсульфинил, 2,2,2-трифторэтилсульфинил, (R)-1-фторпропилсульфинил, (S)-1-фторпропилсульфинил, 2-фторпропилсульфинил, 3-фторпропилсульфинил, 1,1-дифторпропилсульфинил, 2,2-дифторпропилсульфинил, 3,3-дифторпропилсульфинил, 3,3,3-трифторпропилсульфинил, (R)-2-фтор-1-метилэтилсульфинил, (S)-2-фтор-1-метилэтилсульфинил, (В)-2,2-дифтор-1-метилэтилсульфинил, (S)-2,2-дифтор-1-метилэтилсульфинил, (R)-1,2-дифтор-1-метилэтилсульфинил, (S)-1,2-дифтор-1-метилэтилсульфинил, (R)-2,2,2-трифтор-1-метилэтилсульфинил, (S)-2,2,2-трифтор-1-метилэтилсульфинил, 2-фтор-1-(фторметил)этилсульфинил, 1-(дифторметил)-2,2-дифторэтилсульфинил, (R)-1-фторбутилсульфинил, (S)-1-фторбутилсульфинил, 2-фторбутилсульфинил, 3-фторбутилсульфинил, 4-фторбутилсульфинил, 1,1-дифторбутилсульфинил, 2,2-дифторбутилсульфинил, 3,3-дифторбутилсульфинил, 4,4-дифторбутилсульфинил, 4,4,4-трифторбутилсульфинил, и т.д.;
Фторированный С1-С6алкилсульфонил представляет собой радикал вида R-S(O)2-, где R соответствует фторированному алкильному радикалу, содержащему от 1 до 6 атомов углерода, как описано выше. Примеры включают фторметилсульфонил, дифторметилсульфонил, трифторметилсульфонил, (R)-1-фторэтилсульфонил, (S)-1-фторэтилсульфонил, 2-фторэтилсульфонил, 1,1-дифторэтилсульфонил, 2,2-дифторэтилсульфонил, 2,2,2-трифторэтилсульфонил, (R)-1-фторпропилсульфонил, (S)-1-фторпропилсульфонил, 2-фторпропилсульфонил, 3-фторпропилсульфонил, 1,1-дифторпропилсульфонил, 2,2-дифторпропилсульфонил, 3,3-дифторпропилсульфонил, 3,3,3-трифторпропилсульфонил, (R)-2-фтор-1-метилэтилсульфонил, (S)-2-фтор-1-метилэтилсульфонил, (R)-2,2-дифтор-1-метилэтилсульфонил, (S)-2,2-дифтор-1-метилэтилсульфонил, (R)-1,2-дифтор-1-метилэтилсульфонил, (S)-1,2-дифтор-1-метилэтилсульфонил, (R)-2,2,2-трифтор-1-метилэтилсульфонил, (S)-2,2,2-трифтор-1-метилэтилсульфонил, 2-фтор-1-(фторметил)этилсульфонил, 1-(дифторметил)-2,2-дифторэтилсульфонил, (R)-1-фторбутилсульфонил, (S)-1-фторбутилсульфонил, 2-фторбутилсульфонил, 3-фторбутилсульфонил, 4-фторбутилсульфонил, 1,1-дифторбутилсульфонил, 2,2-дифторбутилсульфонил, 3,3-дифторбутилсульфонил, 4,4-дифторбутилсульфонил, 4,4,4-трифторбутилсульфонил, и т.д.
К группе 3-7-членных гетероциклических радикалов относятся насыщенные гетероциклические радикалы, обычно содержащие 3, 4, 5, 6 или 7 атомов, формирующих цикл (члены цикла), ненасыщенные неароматические гетероциклические радикалы, обычно содержащие 5, 6 или 7 атомов, формирующих цикл, и гетероароматические радикалы, обычно содержащие 5, 6 или 7 атомов, формирующих цикл. Гетероциклические радикалы могут быть связаны через атом углерода (С-связанные) или через атом азота (N-связанные). Предпочтительные гетероциклические радикалы содержат в составе цикла один атом азота и необязательно 1, 2 или 3 других гетероатома, независимо друг от друга выбранные из числа О, S или N. Аналогично, предпочтительные гетероциклические радикалы содержат в составе цикла один гетероатом, выбранный из числа О, S или N, а также необязательно 1, 2 или 3 дополнительных атома азота.
Примеры 3-7-членных насыщенных гетероциклических радикалов включают 1- или 2-азиридинил, 1-, 2- или 3-азетидинил, 1-, 2- или 3-пирролидинил, 1-, 2-, 3- или 4-пиперидинил, 1-, 2- или 3-морфолинил, 1-, 2- или 3-тиоморфолинил, 1-, 2- или 3-пиперазинил, 1-, 2- или 4-оксазолидинил, 1-, 3- или 4-изоксазолидинил, 2-оксиранил, 2- или 3-оксетанил, 2- или 3-оксоланил, 2-, 3- или 4-оксанил, 1,3-диоксолан-2- или 4-ил и подобные им. Циклы могут быть незамещенными, а могут содержать 1, 2 или 3 упомянутых ранее радикалов Ra и/или Rb.
Ненасыщенные неароматические гетероциклические радикалы представляют собой гетероциклические радикалы, в общем случае, содержащие 5, 6 или 7 атомов, образующих цикл, а также одну или две двойные связи, не образующие ароматическую р-электронную систему. Примеры включают 2,3-дигидропирролил, 3,4-дигидропирролил, 2,3-дигидрофуранил, 3,4-дигидрофуранил, 2,3-дигидротиофенил, 3,4-дигидротиофенил, 1,2-дигидропиридинил, 2,3-дигидропиридинил, 3,4-дигидропиридинил, 1,2,3,4-тетрагидропиридинил, 2,3,4,5-тетрагидропиридинил, и подобные им.
5- или 6-членные гетероароматические радикалы представляют собой гетероароматические циклические радикалы, где циклический радикал содержит 5 или 6 образующих цикл атомов (члены цикла) и где, в общем случае, 1, 2, 3 или 4 атома-члена цикла выбраны из числа О, S и N, а остальные атомы-члены цикла являются атомами углерода. Гетероароматические радикалы могут быть связаны через атом углерода (С-связанные) или через атом азота (N-связанные). Предпочтительные гетероароматические радикалы содержат в составе цикла один атом азота и необязательно 1, 2 или 3 других гетероатома, независимо друг от друга выбранных из числа О, S или N. Аналогично, предпочтительные гетероароматические радикалы содержат в составе цикла один гетероатом, выбранный из числа О, S или N, а также необязательно 1, 2 или 3 дополнительных атома азота. Примеры 5-или 6-членных гетероароматических радикалов включают 2-, 3-, или 4-пиридил, 2-, 4- или 5-пиримидинил, пиразинил, 3- или 4-пиридазинил, 2- или 3-тиепил, 2- или 3-фурил, 1-, 2-или 3-пирролил, 1-, 2- или 4-имидазолил, 1-, 3- или 4-пиразолил, 1- или 3-[1,2,4]-триазолил, 1- или 4-[1,2,3]-триазолил, 1-, 2- или 5-тетразолил, 2-, 3- или 5-оксазолил, 3-, 4- или 5-изоксазолил, 2-, 3- или 5-тиазолил, 3-, 4- или 5-изотиазолил, 4- или 5-[1,2,3]-оксадиазолил, [1,2,5]-оксадиазолил (=фуразанил), 3- или 5-[1,2,4]-оксадизолил, [1,3,4]-оксадизолил, 4- или 5-[1,2,3]-тиадиазолил, [1,2,5]-тиадиазолил, 3- или 5-[1,2,4]-тиадизолил или [1,3,4]-тиадиазолил. Радикалы могут быть незамещенными, а могут содержать 1, 2 или 3 упомянутых ранее радикалов Ra и/или Rb.
Для квалифицированного специалиста будет понятным, что радикал -E-SO2-Ar связан с одним из таких атомов углерода ароматической части бициклической группы формулы I, с которыми был связан атом водорода, таким образом замещая указанный атом водорода. Предпочтительно, чтобы радикал -E-SO2-Ar не был связан с атомом углерода, расположенным рядом с атомом углерода, входящим в состав мостика. Кроме того, квалифицированный специалист поймет, что, если Y соответствует -СН=N-, то с "мостиковым" атомом углерода связан другой атом углерода, а если Y соответствует -N=CH-, то с "мостиковым" атомом углерода связан атом азота.
Предпочтительно, чтобы Ar представлял собой фенил или ароматический 5- или 6-членный связанный через атом углерода гетероароматический радикал, содержащий в составе цикла один атом азота и 0, 1, 2 или 3 других гетероатома, независимо друг от друга выбранных из числа О, S и N, причем они могут быть незамещенными, а могут содержать 1, 2 или 3 упомянутых ранее радикалов Ra и/или Rb. Среди таких гетероароматических радикалов предпочтительны такие, которые содержат 1, 2 или 3 атома азота в составе цикла, и не содержат других гетероатомов, или которые содержат 1 или 2 атома азота и один атом, выбранный из числа О и S. Однако предпочтительны также радикалы тиенил и фурил. Особенно предпочтительными радикалами Ar являются следующие: 2- или 3-тиенил, 2-, 3- или 4-пиридил, 2-, 4- или 5-пиримидинил, 2-, 3- или 5-тиазолил, 1,2,4-триазол-3-ил, 1,2,3-триазол-4-ил, 1,3,4-тиадиазол-2-ил, в особенности 2-тиенил, 2-пиримидинил, 5-пиримидинил, 2-пиридинил, и особо следует выделить фенил, который может быть незамещенным, а может содержать 1, 2 или 3 упомянутых ранее радикалов Ra и/или Rb.
Предпочтительно, если ароматический радикал Ar содержит один радикал Ra и необязательно один или два описанных ранее радикала Rb, причем особо предпочтительно, если последний выбран из числа следующих: метил, фторированный метил, галоген (особо предпочтительно, если галоген представляет собой фтор или хлор).
Предпочтительно, если ранее упомянутый пятичленный гетероароматический радикал Ar содержит один радикал Ra в положении 3 (относительно положения радикала SO2) и необязательно один или два радикала Rb. Особенно предпочтительно, если радикалы Rb выбраны из числа галогенов, в особенности фтора или хлора.
Предпочтительно, если ранее упомянутый фенил и шестичленный гетероароматический радикал Ar содержит один радикал Ra в положении 4 (относительно положения радикала SO2) и необязательно один или два радикала Rb. Особенно предпочтительно, если радикалы Rb выбраны из числа галогенов, в особенности фтора или хлора.
В соответствии с особенно предпочтительным аспектом изобретения Ar представляет собой фенил, содержащий радикал Ra в положении 4 фенильного цикла и необязательно один или два радикала Rb. Особенно предпочтительно, если радикалы Rb выбраны из числа галогенов, в особенности фтора или хлора.
В соответствии с еще одним предпочтительным аспектом изобретения Ar представляет собой 2-пиримидинил, содержащий радикал Ra в положении 5 пиримидинового цикла и необязательно один или два радикала Rb. Особенно предпочтительно, если радикалы Rb выбраны из числа галогенов, в особенности фтора или хлора.
В соответствии с еще одним предпочтительным аспектом изобретения Ar представляет собой 5-пиримидинил, содержащий радикал Ra в положении 2 пиримидинового цикла и необязательно один или два радикала Rb. Особенно предпочтительно, если радикалы Rb выбраны из числа галогенов, в особенности фтора или хлора.
В соответствии с еще одним предпочтительным аспектом изобретения Ar представляет собой 2-тиенил, содержащий радикал Ra в положении 3 тиофенового цикла и необязательно один или два радикала Rb. Особенно предпочтительно, если радикалы Rb выбраны из числа галогенов, в особенности фтора или хлора.
Предпочтительно, если Ar содержит в качестве заместителя один радикал Ra, отличающийся от СН3, ОСН3, CF3, OCF3, NH2, SO2NH2, ацетамидо, С2-С6-алкокси и ацетила.
В соответствии с предпочтительным аспектом Ar содержит в качестве заместителя один радикал Ra, выбранный из группы, включающей С2-С6-алкил, С3-С6-циклоалкил, С2-С6-алкокси, фторированный С2-С6-алкил, фторированный С3-С6-циклоалкил, фторированный С2-С6-алкокси, NR4R5, 1-азиридинил, азетидин-1-ил, пирролидин-1-ил или пиперидин-1-ил, где последние четыре упомянутых радикала могут быть фторированы, фенильную группу и ароматический 5- или 5-членный С-связанный гетероароматический радикал, содержащий в составе цикла один атом азота, а также 0, 1, 2 или 3 других гетероатома, независимо выбранных из числа О, S и N, где последние два упомянутых радикала могут в качестве заместителей содержать 1, 2, 3 или 4 радикала, выбранных из числа галогенов и радикалов Ra, и где Ar может в качестве заместителей содержать один или два радикала Rb, независимо друг от друга выбранных из группы, включающей галоген, циано, метил, фторметил, дифторметил, трифторметил, дифторметокси и трифторметокси. В данном аспекте R4 и R5 независимо друг от друга предпочтительно выбраны из группы, включающей Н, С1-С2-алкил и фторированный С1-С2-алкил. Предпочтительно, если один из радикалов R4 или R5 - это не водород. Кроме того, один из радикалов R4 или R5 может представлять собой С1-С2-алкокси.
В соответствии с особенно предпочтительным аспектом радикал Ar содержит в качестве заместителя один радикал Ra, строение которого представлено формулой Ra'
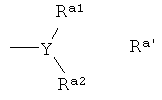
где
Y представляет собой N, СН или CF,
Ra1 и Ra2 независимо друг от друга выбраны из группы, включающей С1-С2-алкил, С1-С2-алкокси, фторированный С1-С2-алкил, причем, если Y соответствует СН или CF, то один из радикалов Ra1 или Ra2 может также представлять собой водород или фтор, или
Ra1 и Ra2 вместе образуют радикал (СН2)m, где 1 или 2 атома водорода могут быть замещены на фтор, гидрокси, оксо, С1-С2-алкил или С1-С2-алкокси, где одна группа CH2 может быть заменена на О, S, S=O, SO2 или N-Rc, причем Rc соответствует водороду или С1-С2-алкилу, и где m соответствует 2, 3, 4, 5 или 6;
В частности,
Ra1 и Ra2 независимо друг от друга выбраны из группы, включающей С1-С2-алкил, в частности метил, фторированный С1-С2-алкил, в частности фторметил, дифторметил или трифторметил; если Y представляет собой СН или CF, то один из радикалов Ra1 или Ra2 может также представлять собой водород или фтор, или
Ra1 и Ra2 формируют радикал (CH2)m, где 1 или 2 атома водорода могут быть замещены фтором и где m соответствует 2, 3 или 4, в частности, СН2-СН2, CHF-CH2CF2-CH2, CH2-CH2-CH2, CHF-CH2-CH2, CF2-CH2-CH2, CH2-CHF-CH2, CH2-CF2-CH2.
Если Ra1 и Ra2 отличаются друг от друга, то радикал упомянутой выше формулы Ra' может находиться в (R)- или в (S)-конфигурации, в зависимости от заместителя Y.
Примерами предпочтительных радикалов формулы Ra' являются изопропил, (R)-1-фторэтил, (S)-1-фторэтил, 2-фторэтил, 1,1-дифторэтил, 2,2-дифторэтил, 2,2,2-трифторэтил, (R)-1-фторпропил, (S)-1-фторпропил, 2-фторпропил, 3-фторпропил, 1,1-дифторпропил, 2,2-дифторпропил, 3,3-дифторпропил, 3,3,3-трифторпропил, (R)-2-фтор-1-метилэтил, (S)-2-фтор-1-метилэтил, (R)-2,2-дифтор-1-метилэтил, (S)-2,2-дифтор-1-метилэтил, (R)-1,2-дифтор-1-метилэтил, (S)-1,2-дифтор-1-метилэтил, (R)-2,2,2-трифтор-1-метилэтил, (S)-2,2,2-трифтор-1-метилэтил, 2-фтор-1-(фторметил)этил, 1-(дифторметил)-2,2-дифторэтил, 1-фтор-1-метилэтил циклопропил, циклобутил, 1-фторциклопропил, (R)- и (S)-2,2-дифторциклопропил, (R)- и (S)-2-фторциклопропил.
Предпочтительны также радикалы формулы Ra', где одна из групп Ra1 или Ra2 представляет собой С1-С2-алкокси, а другая группа выбрана из числа следующих заместителей: Н, С1-С2-алкил, в частности метил, фторированный С1-С2-алкил, в частности фторметил, дифторметил или трифторметил. Примеры включают н-метокси-н-метиламино, н-метоксиамино и н-этоксиамино.
К числу предпочтительных радикалов вида Ra' относятся также такие, у которых Y представляет собой азот, a Ra1 и Ra2 формируют радикал (СН2)m, где 1 или 2 атома водорода могут быть замещены на фтор, метил, трифторметил, метокси или оксо и где m принимает значения 2, 3, 4 или 5. Примеры включают азетидин-1-ил, 2-метилазетидин-1-ил, (S)-2-метилазетидин-1-ил, (R)-2-метилазетидин-1-ил, 3-фторазетидин-1-ил, 3-метоксиазетидин-1-ил, 3-гидроксиазетидин-1-ил, пирролидин-1-ил, (S)-2-фторпирролидин-1-ил, (R)-2-фторпирролидин-1-ил, 3-фторпирролидин-1-ил, (S)-3-фторпирролидин-1-ил, (R)-3-фторпирролидин-1-ил, 2,2-дифторпирролидин-1-ил, 3,3-дифторпирролидин-1-ил, 2-метилпирролидин-1-ил, (S)-2-метилпирролидин-1-ил, (R)-2-метилпирролидин-1-ил, 3-метилпирролидин-1-ил, (S)-3-метилпирролидин-1-ил, (R)-3-метилпирролидин-1-ил, 2,2-диметилпирролидин-1-ил, 3,3-диметилпирролидин-1-ил, 2-трифторметилпирролидин-1-ил, (S)-2-трифторметилпирролидин-1-ил, (R)-2-трифторметилпирролидин-1-ил, 3-трифторметилпирролидин-1-ил, (S)-3-трифторметилпирролидин-1-ил, (R)-3-трифторметилпирролидин-1-ил, 2-оксопирролидин-1-ил, пиперидин-1-ил, 2-метилпиперидин-1-ил, (S)-2-метилпиперидин-1-ил и (R)-2-метилпиперидин-1-ил.
Аналогично, предпочтительными являются структуры Ra', у которых Ra1 и Ra2 формируют радикал (CH2)m, где 1 или 2 атома водорода могут быть замещены на фтор, гидрокси, оксо, С1-С2-алкил или С1-С2-алкокси, где одна из групп CH2 заменена на О, S, S=O, SO2 или N-Rc, причем Rc представляет собой водород или С1-С2-алкил, и m может принимать значения 2, 3, 4, 5 или 6. Примеры предпочтительных радикалов формулы Ra' также включают 4-морфолинил, 4-тиоморфолинил, 4-(1,1-диоксо)тиоморфолинил, пиперазин-1-ил, 4-метилпиперазин-1-ил, 2-оксо-оксазолидин-3-ил, пирролидин-2-ил, (S)-пирролидин-2-ил, (R)-пирролидин-2-ил, пирролидин-3-ил, (S)-пирролидин-3-ил, (R)-пирролидин-3-ил, 2-фторпирролидин-1-ил, 1-метилпирролидин-2-ил, (S)-1-метилпирролидин-2-ил, (R)-1-метилпирролидин-2-ил, 1-метилпирролидин-3-ил, (S)-1-метилпирролидин-3-ил и (R)-1-метилпирролидин-3-ил.
Среди радикалов вида Ra' предпочтительны те, у которых имеется 1, 2, 3 или 4, в особенности 1, 2 или 3 атома фтора.
В соответствии с другим предпочтительным аспектом Ar содержит один заместитель вида Ra, выбранный из группы, включающей 5- или 6-членные гетероароматические радикалы, в состав которых входит один гетероатом из числа О, S и N, и которые могут дополнительно содержать один, два или три атома азота, причем 5- или 6-членные гетероароматические радикалы могут содержать 1, 2 или 3 заместителя, выбранные из группы, включающей: галоген, NO2, NH2, ОН, CN, C1-C6-алкил, С3-С6-циклоалкил, C1-C6-алкокси, фторированный С1-С6-алкил, фторированный С3-С6-циклоалкил, фторированный С1-С6-алкокси, С1-С6-гидроксиалкил, С1-С4-алкокси-С2-С4-алкил, C1-C6-гидроксиалкокси, С1-С4-алкокси-С2-С4-алкокси, C1-C6-алкилкарбонил, С1-С6-алкиламино, ди-С1-С6-алкиламино, C1-C6-алкиламинокарбонил, ди-С1-С6-алкиламинокарбонил, фторированный C1-C6-алкилкарбонил, С1-С6-алкилкарбониламино, фторированный C1-C6-алкилкарбониламино, С1-С6-алкилкарбонилокси, фторированный С1-С6-алкилкарбонилокси, C1-C6-алкоксикарбонил, С1-С6-алкилтио, фторированный C1-C6-алкилтио, С1-С6-алкилсульфинил, С1-С6-алкилсульфонил, фторированный С1-С6-алкилсульфинил и фторированный С1-С6-алкилсульфонил. Среди этих радикалов Ra особо предпочтительны выбранные из следующей группы: 2-, 3-, или 4-пиридил, 2-, 4- или 5-пиримидинил, пиразинил, 3- или 4-пиридазинил, 2- или 3-тиенил, 2- или 3-фурил, 1-, 2- или 3-пирролил, 1-, 2- или 4-имидазолил, 1-, 3- или 4-пиразолил, 1- или 3-[1,2,4]-триазолил, 1- или 4-[1,2,3]-триазолил, 1-, 2- или 5-тетразолил, 2-, 3- или 5-оксазолил, 3-, 4- или 5-изоксазолил, 2-, 3- или 5-тиазолил, 3-, 4- или 5-изотиазолил, 4- или 5-[1,2,3]-оксадиазолил, [1,2,5]-оксадиазолил (=фуразинил), 3- или 5-[1,2,4]-оксадизолил, [1,3,4]-оксадизолил, 4- или 5-[1,2,3]-тиадиазолил, [1,2,5]-тиадиазолил, 3- или 5-[1,2,4]-тиадизолил или [1,3,4]-тиадиазолил, в частности 2- или 3-фуранил, 2- или 3-тиенил, 1-, 2- или 3-пирролил, пиразолил, имидазолил, оксазолил, изоксазолил, 1,3,4-тиадиазолил, 1,2,4-триазолил, 1,2,3-триазолил и тетразолил, где гетероароматический радикал может быть незамещенным или содержать от 1 до 3 описанных выше заместителей. Предпочтительные заместители гетероароматического Ra выбраны из группы, включающей галоген, С1-C4-алкил, С1-С4-алкокси, фторированный С1-С4-алкил и фторированный С1-С4-алкокси.
В соответствии с еще одним предпочтительным аспектом Ar содержит один заместитель вида Ra, выбранный из группы, включающей CHF2, CH2F, OCHF2 и OCH2F, причем предпочтителен OCHF2. В этом аспекте Ar может содержать также один или два радикала Rb, независимо друг от друга выбранные из числа следующих: галоген, циано, метил, фторметил, дифторметил, трифторметил, дифторметокси и трифторметокси. Предпочтительно, чтобы Ar не содержал дополнительно радикалов Rb. В этом аспекте предпочтительно также, чтобы Ar представлял собой фенил с одним радикалом Ra, выбранным из группы, включающей CHF2, CHF2, OCHF2 и OCH2F, причем предпочтителен OCHF2. В этом отношении предпочтительно, чтобы Ar представлял собой фенил с радикалом Ra в четвертом положении по отношению к группе SO2.
В соответствии с еще одним аспектом изобретения Ar содержит один заместитель вида Ra, выбранный из группы, включающей С2-С6-алкенил, фторированный С2-С6-алкенил, C1-C6-гидроксиалкил, С1-С6-алкокси-С1-С4-алкил, С1-С6-гидроксиалкокси, С1-С6-алкокси-С1-C4-алкокси, СООН, CH2NR4R5, ONR4R5, NHC(O)NR4R5, C(O)NR4R5, SO2NR4R5, С1-С6-алкилкарбонил, фторированный С2-С6-алкилкарбонил, C1-C6-алкилкарбониламино, фторированный С1-С6-алкилкарбониламино, C1-C6-алкилкарбонилокси, фторированный С1-С6-алкилкарбонилокси, C1-C6-алкоксикарбонил, С1-С6-алкилтио, фторированный C1-C6-алкилтио, C1-C6-алкилсульфинил, C1-C6-алкилсульфонил, фторированный C1-C6-алкилсульфинил, фторированный C1-C6-алкилсульфонил, фенилсульфонил, фенокси, бензилокси и 5- или 6-членный связанный через атом азота гетероароматический радикал, причем последние четыре упомянутых радикала могут содержать 1, 2, 3 или 4 заместителя, выбранные из следующей группы: галоген, NO2, NH2, ОН, CN, C1-C6-алкил, С3-С6-циклоалкил, C1-C6-алкокси, фторированный C1-C6-алкил, фторированный С3-С6-циклоалкил, фторированный С1-С6-алкокси, C1-C6-гидроксиалкил, С1-С4-алкокси-С2-C4-алкил, С1-С6-гидроксиалкокси, С1-С4-алкокси-С2-С4-алкокси, С1-С6-алкилкарбонил, C1-C6-алкиламино, ди-С1-С6-алкиламино, С1-С6-алкиламинокарбонил, ди-С1-С6-алкиламино-карбонил, фторированный C1-C6-алкилкарбонил, C1-C6-алкилкарбониламино, фторированный С1-С6-алкилкарбониламино, C1-C6-алкилкарбонилокси, фторированный С1-С6-алкилкарбонилокси, C1-C6-алкоксикарбонил, C1-C6-алкилтио, фторированный C1-C6-алкилтио, C1-C6-алкилсульфинил, С1-С6-алкилсульфонил, фторированный С1-С6-алкилсульфинил и фторированный C1-C6-алкилсульфонил.
В соответствии с еще одним аспектом изобретения Ar представляет собой фенил, содержащий один заместитель Ra и по меньшей мере один радикал Rb, где Ra и один радикал Rb связаны с двумя соседними атомами углерода фенила и формируют 5- или 6-членный гетеро- или карбоцикл, сопряженный с фенилом и незамещенный или содержащий 1, 2 или 3 заместителя, описанных выше. Примеры фенила, конденсированного с насыщенным или ненасыщенным 5- или 6-членным гетеро- или карбоциклом, включают инденил, инданил, нафтил, тетралин, бензофуранил, 2,3-дигидробензофуранил, бензотиенил, индолил, индазолил, бензимидазолил, бензоксатиазолил, бензоксадиазолил, бензотиадиазолил, бензоксазинил, дигидробензоксазинил, хинолинил, изохинолинил, тетрагидроизохинолинил, хроменил, хроманил и подобные им. Структуры могут быть незамещенными, а могут содержать 1, 2 или 3 упомянутых ранее радикала. Предпочтительными заместителями для насыщенного или ненасыщенного 5- или 6-членного гетеро- или карбоцикла, сопряженного с фенилом, являются следующие: галоген, С1-С4-алкил, С1-С4-алкокси, фторированный С1-С4-алкил и фторированный С1-С4-алкокси.
Предпочтительно, чтобы радикал R1 был выбран из группы, включающей С2-С4-алкил, С3-С4-циклоалкил, С3-С4-циклоалкилметил, С3-С4-алкенил, фторированный С1-С4-алкил, фторированный С3-С4-циклоалкил, фторированный С3-С4-циклоалкилметил, фторированный С3-С4-алкенил, формил или С1-С3-алкилкарбонил, в частности С2-С4-алкил, С3-С4-циклоалкил, С3-С4-алкенил, фторированный С1-С4-алкил, фторированный С3-С4-циклоалкил, наиболее предпочтительно н-пропил, фторированный неразветвленный C2-С3-алкил или 1-пропен-3-ил, в частности н-пропил или 1-пропен-3-ил.
Предпочтительно, чтобы группа Е представляла собой N-R3, где R3 описан выше. В частности, R3 соответствует Н или метилу, наиболее предпочтителен Н.
Один предпочтительный аспект изобретения направлен на соединения, где R1a представляет собой водород и R2 и R2a описаны выше. В частности, R2 и/или R2a также представляют собой водород. Если R2 и R2a отличаются от водорода, то R2 (или R2a) и NR1R1a могут быть расположены в цис- или транс-положении относительно друг друга.
Еще один предпочтительный аспект изобретения направлен на соединения, где R1a и R2 или R1a и R2a вместе формируют группу (СН2)n, где n был описан выше, и, в частности, равен 2 или 3. Таким способом формируется конденсированный цикл, который может быть цис- или транс-конденсирован.
Еще один предпочтительный аспект изобретения направлен на соединения, где R1a представляет собой С2-C4-алкил, С3-С4-циклоалкил, С3-С4-алкенил, фторированный С1-C4-алкил, фторированный С3-С4-циклоалкил, в частности н-пропил, фторированный неразветвленный С2-С3-алкил или 1-пропен-3-ил, более предпочтительно пропил или 1-пропен-3-ил. В этом аспекте группы R2 и R2a были определены ранее. В частности, R2 и/или R2a также представляют собой водород. Если R2 и R2a отличаются от водорода, то R2 (или R2a) и NR1R1a могут быть расположены в цис- или транс-положении относительно друг друга. Атом углерода бициклического ядра, содержащего радикал NR1R1a, может быть в (R)- или (S)-конфигурации.
Один аспект изобретения направлен на соединения формулы I, где Х соответствует СН. В этом аспекте Y предпочтительно соответствует -СН=N-, -СН=СН- или -N=CH- и, в частности, -СН=СН-. В частности, этот аспект направлен на соединения общих формул Ia, Ib и Ic:
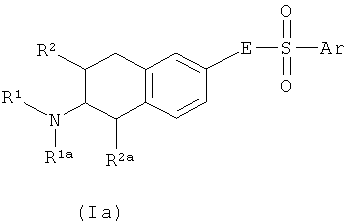
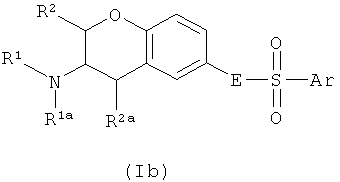
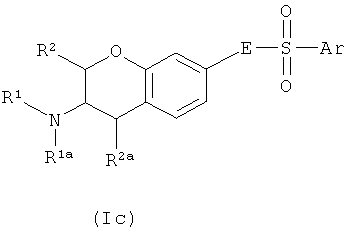
где R1, R1a, R2, R2a, R3, E и Ar описаны выше, и на их физиологически переносимые соли присоединения кислот. Предпочтения, определенные ранее для групп R1, R1a, R2, R2a, R3, Е и Ar, естественным образом применимы к формулам Ia, Ib и Ic.
Предпочтительными аспектами соединений Ia, Ib и Ic являются такие, у которых R2 и R2a представляют собой водород. Эти соединения будут также называться соединениями Iaa, Iba и Ica.
В соответствии с еще одним предпочтительным аспектом соединения Ia, R2a представляет собой водород, a R1a вместе с R2 составляют 1,3-пропандиил. Такие соединения называются соединениями Iab.
В соответствии с еще одним предпочтительным аспектом соединения Ia, R2 представляет собой водород, a R1a вместе с R2a составляют 1,3-пропандиил. Такие соединения называются соединениями Iac.
Наиболее предпочтительны соединения Iaa и их физиологически переносимые соли присоединения кислот. В формуле Iaa арил - это предпочтительно фенил с радикалом Ra в четвертом положении фенильного цикла. Среди них более предпочтительны соединения Iaa, у которых Ra соответствует радикалу Ra', как описано выше. Аналогично, предпочтительны соединения Iaa, у которых Ar соответствует фенилу с радикалом Ra в четвертом положении, причем радикал Ra выбран из группы, включающей CHF2, CH2F, OCHF2 и OCH2F, предпочтителен OCHF2. В соединениях Iaa R1 - это предпочтительно С2-С4-алкил, C3-C4-циклоалкил, С3-С4-циклоалкилметил, С3-С4-алкенил, фторированный С1-С4-алкил, фторированный С3-С4-циклоалкил, фторированный С3-С4-циклоалкилметил, фторированный С3-С4-алкенил, формил или С1-С3-алкилкарбонил, в частности С2-С4-алкил, С3-С4-циклоалкил, С3-С4-алкенил, фторированный С1-С4-алкил, фторированный С3-С4-циклоалкил, более предпочтительно н-пропил, фторированный неразветвленный С2-С3-алкил или 1-пропен-3-ил, в частности н-пропил или 1-пропен-3-ил. Чрезвычайно предпочтительным примером соединения Iaa является такое соединение, у которого R1 представляет собой н-пропил и Ar - 4-дифторметоксифенил. Таким образом, чрезвычайно предпочтительный аспект изобретения направлен на соединения формулы 1аа, у которых R1 представляет собой н-пропил, а Ar - 4-дифторметоксифенил, и их физиологически переносимые соли присоединения кислот, включая чистые S- и R-стереоизомеры и смеси S- и R-стереоизомеров указанных соединений.
В соединениях Ia, Ib и Ic и, аналогично, в соединениях Iaa, Iba и Ica атом углерода, с которым связан радикал R1R1aN, может находиться в S- или R-конфигурациях. Изобретение включает чистые S- и R-стереоизомеры и их смеси.
Примеры предпочтительных соединений Iaa, Iab, Iac, Iba и Ica приводятся в таблицах А-1, А-2, А-3, А-4 и А-5.
Таблица А-1: Соединения формулы Iaa, включая чистые S-изомеры, чистые R-изомеры и рацемические смеси, где R1a представляет собой Н, а Ar и R1 определены в одной строке таблицы А.
Таблица А-2: Соединения формулы Iba, включая чистые S-изомеры, чистые R-изомеры и рацемические смеси, где R1a представляет собой Н, а Ar и R1 определены в одной строке таблицы А.
Таблица А-3: Соединения формулы Ica, включая чистые S-изомеры, чистые R-изомеры и рацемические смеси, где R1a представляет собой Н, а Ar и R1 определены в одной строке таблицы А.
Таблица А-4: Соединения формулы Iab, где Ar и R1 определены в одной строке таблицы А, где R2 и NR1R2 находятся в транс-положении относительно друг друга, включая чистые S/R-изомеры, чистые R/S-изомеры и рацемические смеси.
Таблица А-5: Соединения формулы Iab, где Ar и R1 определены в одной строке таблицы А, где R2a и NR1R2 находятся в транс-положении относительно друг друга, включая чистые S/R-изомеры, чистые R/S-изомеры и рацемические смеси.
Еще один аспект настоящего изобретения направлен на соединения формулы I, где Х представляет собой N. В этом аспекте Y предпочтительно соответствует S, -СН=N- или -СН=СН- и, в частности, S или -СН=N-. В частности, данный аспект направлен на соединения общих формул Id и Ie,
где R1, R1a, R2, R2a, R3, Е и Ar описаны выше. Предпочтения, определенные ранее для групп R1, R1a, R2, R2a, R3, Е и Ar, естественным
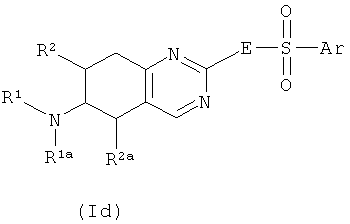

образом применимы к формулам Id и Ie. Предпочтительными аспектами соединений Id и Ie являются такие, у которых R2 и R2a представляют собой водород. Эти соединения будут также называться соединениями Ida и Iea.
Примеры предпочтительных соединений Ida и Iea приводятся в следующих далее таблицах А-6 и А-7.
Таблица А-6: Соединения формулы Ida, где Ar и R1 определены в одной строке таблицы А, включая чистые S-изомеры, чистые R-изомеры и рацемические смеси.
Таблица А-7: Соединения формулы Iea, где Ar и R1 определены в одной строке таблицы А, включая чистые S-изомеры, чистые R-изомеры и рацемические смеси.
Соединения формулы I, где Е представляет собой NH, a R1a - водород, можно приготовить способами, аналогичными тем, которые хорошо известны в соответствующей области, например, описаны в международных патентных заявках, процитированных во вводной части. Предпочтительный способ получения таких соединений изложен в схеме 1:
Схема 1
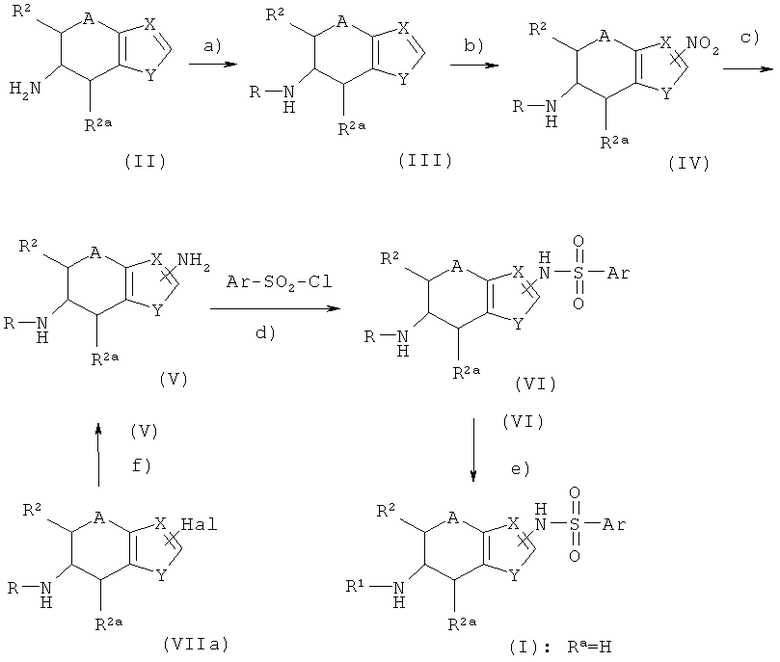
В схеме 1 заместители R1, R2, R2a, А, X, Y и Ar описаны выше. Hal представляет собой галоген, в частности бром или иод. R - С1-С3-алкилкарбонил, фторированный С1-С3-алкилкарбонил, или может представлять собой амино-защитную группу PG, такую как трет-бутоксикарбонил. Подходящие защитные группы рассматриваются, например, в работе Р. Kocienski, Protecting Groups, Thieme-Verlag, Stuttgart 2000, Chapter 6.
На этапе а) схемы 1 аминогруппа соединения формулы II реагирует с необязательно фторированным С2-C4-ацилгалогенидом в присутствии основания с получением соединения формулы III, где R представляет собой необязательно фторированный С1-С3-алкилкарбонил. Ацилирование выполняют стандартными методами, рассматриваемыми в книге J. March, Advanced Organic Chemistry, 3rd ed. J. Wiley & Sons, New York 1985, p.370 и 373 (ацилирование) и р.1099f., а также в литературе, цитируемой в этом издании (см. также Synth. Commun. 1986, 16, p.267). Подобно этому, аминогруппу можно защитить стандартными методами с использованием обычной амино-защитной группы PG, например, по реакции II с пивалоилангидридом в присутствии третичного амина, такого как триэтиламин (условия реакции см. в литературе, процитированной в работре Р.Kocienski, Protecting Groups, loc. cit).
Протекающая на этапе b) схемы 2 реакция осуществляется в условиях, распространенных при нитровании ароматических радикалов и описанных, например, в работе J. March, Advanced Organic Chemistry, 3rd ed., John Wiley & Sons, New York 1985, pp. 468-470, а также в литературе, цитируемой в этом издании.
На этапе с) нитрогруппа формулы IV восстанавливается в NH2 группу формулы V. На том же этапе NH2 группу можно преобразовать в -NR3'H группу, где R3' не может быть водородом, определенным для R3. Условия реакции на этапе с) соответствуют типовым условиям для восстановления ароматических нитрогрупп, широко представленным в литературе (см., например, J. March, Advanced Organic Chemistry, 3rd ed., J. Wiley & Sons, New-York, 1985, p.1183, а также литературу, цитируемую в этом издании). Например, для осуществления восстановления нитросоединение IV реагирует с такими металлами, как железо, цинк или олово, в кислых условиях, то есть с использованием водорода в момент выделения или комплексных гидридов, таких как алюмогидрид лития или боргидрид натрия, предпочтительно в присутствии соединений никеля или кобальта, таких как NiCl2(Р(фенил)3)2, или CoCl2, (см. Ono et al. Chem. Ind. (London), 1983 р.480), или с использованием NaBH2S3 (см. Lalancette et al. Can. J. Chem. 49, 1971, p.2990). В таких условиях возможно осуществить указанное восстановление, непосредственно или в присутствии растворителя или разбавителя. Альтернативно, можно восстановить IV в V водородом в присутствии основанного на переходных металлах катализатора, например, в присутствии платиновых, палладиевых, никелевых, рутениевых или родиевых катализаторов. Катализаторы могут содержать переходный металл в элементной форме или в форме комплексного соединения, соли или оксида переходного металла. Для модификации его активности можно использовать распространенные солиганды, например фосфорорганические соединения, такие как трифенилфосфин, трициклогексилфосфин или три-N-бутилфосфины или фосфиты. Катализатор обычно вводят в концентрации от 0,001 до 1 моль на моль соединения IV, в пересчете на используемый для катализа металл. В предпочтительном варианте на восстановление влияют хлоридом олова (II), по аналогии с методами, описанными в работах Bioorganic and Medicinal Chemistry Letters, 2002, 12(15), pp.1917-1919 и J. Med. Chem. 2002, 45(21), pp.4679-4688. Реакция между соединением IV и хлоридом олова (II) предпочтительно выполняется в инертном органическом растворителе, предпочтительно в спирте, таком как метанол, этанол, изопропанол или бутанол.
Полученное таким способом соединение V реагирует с арилхлорсульфонилхлоридом Cl-SO2-Ar предпочтительно в присутствии основания, по стандартной описанной в литературе схеме с получением соединения VI. Изображенная на этапе d) схемы 1 реакция протекает в условиях, типовых для получения арилсульфонамидных соединений или арилсульфоновых эфиров соответственно и описанных, например, в работах J. March, Advanced Organic Chemistry, 3rd edition, John Wiley & Sons, New York, 1985 p. 444, а также в литературе, цитируемой в этом издании, European Journal of Medicinal Chemistry (1977), 12(1), 81-66, European J. Org. Chem. 2002 (13), pp.2094-2108, Tetrahedron 2001, 57 (27) pp.5885-5895, Bioorganic и Medicinal Chemistry Letters, 2000, 10(8), pp.835-838 и Synthesis 2000 (1), pp.103-108. Обычно, реакция протекает в инертном растворителе, например в эфире, таком как диэтиловый эфир, диизопропиловый эфир, метил-трет-бутиловый эфир или тетрагидрофуран, галогенированный углеводород, такой как дихлорметан, алифатический или циклоалифатический углеводород, такой как пентан, гексан или циклогексан, или ароматический углеводород, такой как толуол, ксилен, кумен и подобные им, или смесь упомянутых растворителей. Обычно, реакция V с Cl-SO2-Ar выполняется в присутствии вспомогательного основания. Подходят неорганические основания, такие как карбонат натрия или калия, гидрокарбонат натрия или калия, а также органические основания, например триалкиламины, такие как триэтиламин, соединения пиридина, такие как пиридин, литидин и подобные им. Последние из названных соединений могут одновременно служить и растворителями. Обычно, вспомогательные основания используются, по меньшей мере, в эквимолярных количествах, соответствующих количеству аминосоединения V.
Аминосоединение формулы V можно приготовить также из соответствующего бромпроизводного VIIa путем его взаимодействия с солью щелочного металла и бис(триалкилсилил)амина, такого как бис(триметилсилил)амид лития, в присутствии палладиевого катализатора с последующим гидролизом. Примерами подходящих палладиевых катализаторов являются трис(дибензилиденацетон)дипалладий(0), возможно, в присутствии тризамещенного фосфина, например триарилфосфина, такого как трифенилфосфин или тритолилфосфин, три(цикло)алкилфосфина, такого как трис-N-бутилфосфин, трис(трет-бутил)фосфин или трис(циклогексилфосфин), или PdCl2(dppf). Реакция VIIa с бис(триалкилсилил)амидом щелочного металла может быть выполнена по аналогии с присоединением Бучвальда-Хартига (Buchwald-Hartig coupling). Бис(триалкилсилил)амид щелочного металла может быть получен in situ из соответствующего амина действием сильного основания, такого как алкоксид щелочного металла, например трет-бутилат калия или гидрид щелочного металла, например гидрид лития, гидрид натрия и подобные им. Для осуществления гидролиза просто затем добавляют воду.
Если R представляет собой необязательно фторированный С1-С3-алкилкарбонил, то карбонильную группу в этих соединениях можно восстановить в СН2-группу действием либо диборана, борандиметилсульфида, либо алюмогидрида лития с получением соединения общей формулы I, где R представляет собой СН2-(необязательно фторированный С1-С3-алкил) (например, см. J. Heterocycl. Chem. 1979, 16, p.1525). При взаимодействии карбонильной группы с фторирующим агентом можно получить соединение I, где R1 представляет собой 1,1-дифторалкил.
Если R - защитная группа, то ее можно снять стандартными методами, получая тем самым соединения формулы I, где R1 и R1a представляют собой водород. Это соединение можно затем проалкилировать известным способом, добавляя соединение R1-L. В нем R1 представляет собой С2-С4-алкил, С3-С4-циклоалкил, С3-С4-алкенил, фторированный С1-С4-алкил, фторированный С3-С4-циклоалкил, фторированный С3-С4-алкенил, a L - нуклеофильно замещаемая уходящая группа, например галоген, трифторацетат, алкилсульфонат, арилсульфонат, алкилсульфат и подобные им. Условия требуемой для алкилирования реакции были адекватно раскрыты, например, в статьях Bioorganic and Medicinal Chemistry Lett. 2002, 12(7), pp.2443-2446 и 2002, 12(5), pp.1917-1919.
Введение C2-С4-алкила или фторированного С2-С4-алкила в качестве радикала R1 в соединение формулы I, у которого R1 и R1a представляют собой водород, можно осуществить методами восстановительного аминирования путем взаимодействия I [R1=R1a=Н] с подходящим кетоном или альдегидом в присутствии восстановителя, например борогидрида, такого как борогидрид натрия, цианоборогидрид натрия или триацетоксиборогидрид натрия. Компетентный специалист в соответствующей области знаком с условиями реакции, необходимыми для проведения восстановительного аминирования, например, из статьи Bioorganic and Medicinal Chemistry Lett. 2002, 12(5), pp.795-798 и 12(7) pp.1269-1273.
Для компетентного специалиста понятно, что соединение I, где R1 представляет собой алкенил, можно преобразовать в соединение, у которого R1 представляет собой алкил или фторированный алкил, путем гидрогенизации, присоединения фтористого водорода или фторированием соответствующими агентами фторирования, такими как XeF2 или CoF3.
Для компетентного специалиста понятно также, что отличающийся от водорода радикал R3 можно ввести либо в соединение I, либо на ранней стадии синтеза путем обычного алкилирования.
Соединения общей формулы I, где Е представляет собой N-R3, можно получить синтетическим путем, описанным схемой 2.
Схема 2:
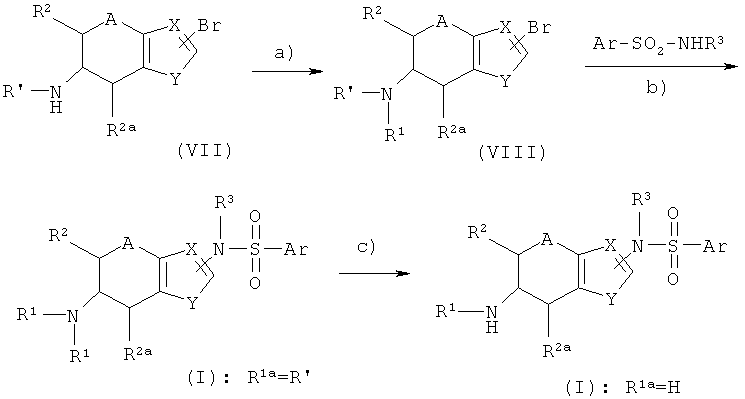
На схеме 2 R' представляет собой амино-защитную группу, или его значение совпадает с приведенным для радикала R1a, если R' не означает водород. R2, R2a, R3, А, X, Y и Ar были описаны выше.
На этапе а) схемы 2 радикал R1 вводят в соединение VII с помощью ацилирования или алкилирования, как показано на схеме 1.
На этапе b) схемы 2 соединение VIII реагирует либо с арилсульфониламидом Ar-SO2-NH2, либо с его литиевой солью в присутствии соединения палладия(0), такого как трис(дибенилиденацетон)дипалладий(0) в присутствии тризамещенного фосфина, например триарилфосфина, такого как трифенилфосфин или тритолилфосфин, три(цикло)алкилфосфина, такого как трис-N-бутилфосфин, трис(трет-бутил)фосфин или трис(циклогексилфосфин), предпочтительно, в присутствии основания, такого как гидрид натрия по методу, описанному в работе J. Org. Chem., 68 (2993) рр. 8274-8276, и кратко изложенному далее.
Если R' представляет собой амино-защитную группу, то ее можно удалить стандартными методами с получением соединения формулы I, где R1a представляет собой водород (этап с).
Для компетентного специалиста понятно, что показанный на схеме 2 радикал R1 соединения I можно модифицировать и дальше, как показано на схеме 1.
Соединения формулы I, где R1a и R2 вместе составляют (CH2)n, причем n равняется 2 или 3, могут быть приготовлены способом, похожим на тот, что был описан в способе, проиллюстрированном схемой 1, начиная от соединения формулы IX. Сам метод проиллюстрирован схемой 3:
Схема 3
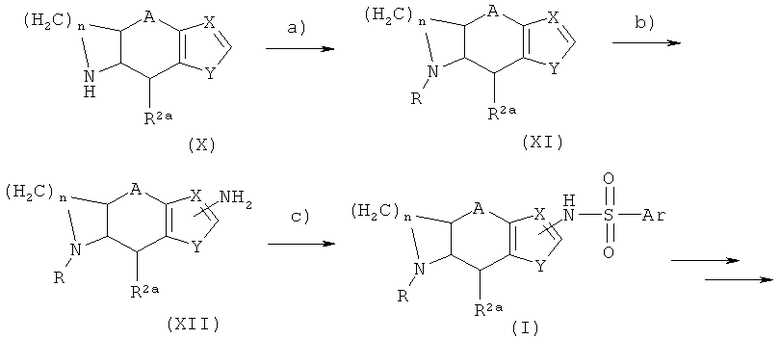
Радикалы R2, R2a, R3, А, X, Y и Ar на схеме 3 были описаны выше. R представляет собой радикал R1 или амино-защитную группу. В частности, R1 - это С1-С3-алкилкарбонил. На этапе а) радикал R1 вводят в соединение Х методом, соответствующим методу, описанному для этапа е) на схеме 1. Соединение XI преобразуется в аминосоединение XII с помощью последовательного нитрования и восстановления, описанных в этапах b) и с) схемы 1. Этап с) схемы 3 может быть выполнен по аналогии с этапом d) схемы 1.
Для компетентного специалиста понятно, что соединение I схемы 3 может и дальше реагировать, как показано на схеме 1. Также компетентному специалисту понятно, что соединения, в которых R1a и R2a вместе составляют (СН2)n, могут быть приготовлены аналогичным методом.
Соединения формулы I, в которых Х соответствует СН, Y - N=CH и Е - NR3, могут быть получены в соответствии с синтетическим способом, описанным на схеме 4:
Схема 4:
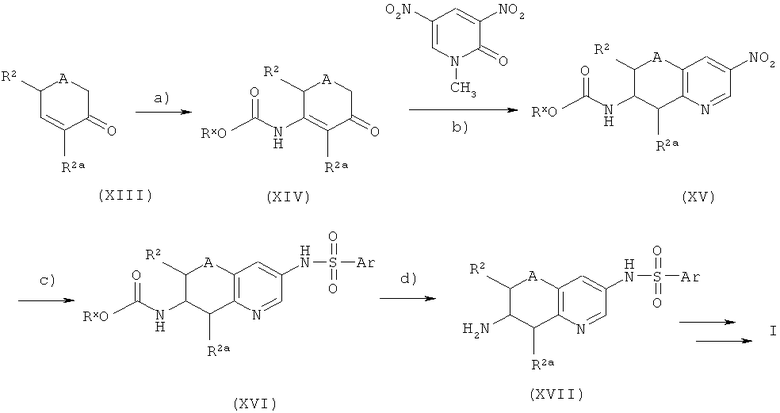
Начиная от циклогекс-2-енона XIII (или соответствующего пиранона (А=O) или тианона (A=S)), осуществляется селективное присоединение Михаэля (Michael addition) с участием карбамата RxO-С(O)-NH2 и в присутствии нитрата висмута. При этом генерируется требуемый β-амино кетон XIV (этап а), см, например, J. Org. Chem. 2003, 68, 2109-2114). На этапе b) соединение XIV вступает в реакцию Тохды (Tohda reaction) с участием динитропиридона и с получением азабициклического нитропроизводного XV (этап с), см., например, работы Bull. Chem, Soc. Jpn. 1990, 63, 2820-2827; J. Med. Chem. 1996, 39, 2844-2851; Synth. Commun. 2001, 31, 787-797; Bioorg. Med. Chem. Lett. 2003, 13, 529-532). При этом получается смесь 5- и 7-аминоизомеров, которые можно выделить в виде амино- или сульфонамидо-соединения. Эту смесь можно восстановить до аминов с помощью методов, описанных на этапе b) схемы 2, например, с помощью хлорида олова или каталитического гидрирования (например, на катализаторе Pd-C/H2), и затем конвертировать в требуемый сульфонамид по реакции с соответствующим сульфонилхлоридом, как описано на этапе b) схемы 1, получив в итоге соединение формулы XVI. Амин XVII можно получить расщеплением карбамата в присутствии такой кислоты, как трифторуксусная кислота, и преобразовать в целевое N-алкильное производное с помощью алкилирования, ацилирования/восстановления или восстановительного аминирования, как показано на схеме 1.
Соединения формул II, VII и Х известны в литературе, или в случае Х их можно получить последовательным введением защиты для аминогруппы соответствующих аминов и бромированием. Соединение Х можно получить, например, по методу, описанному в работе Organic Process Research and Development 7(6) (2003) 904-912.
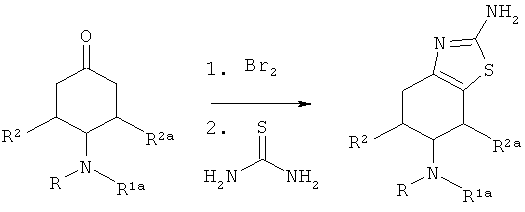
Соединения V, где R представляет собой алкилкарбонил, А=СН2, Х=N и Y=S, можно получить по следующей реакции:
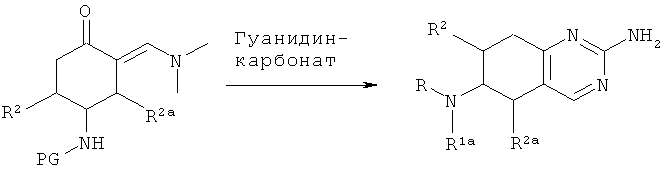
Соединения V, где R представляет собой аминозащитную группу PG, А - СН2, Х - N и Y - CH=N, можно получить по следующей реакции:
Соединения формулы I, где Е соответствует CR6R7, можно приготовить так, как описано на схеме 5:
Схема 5:
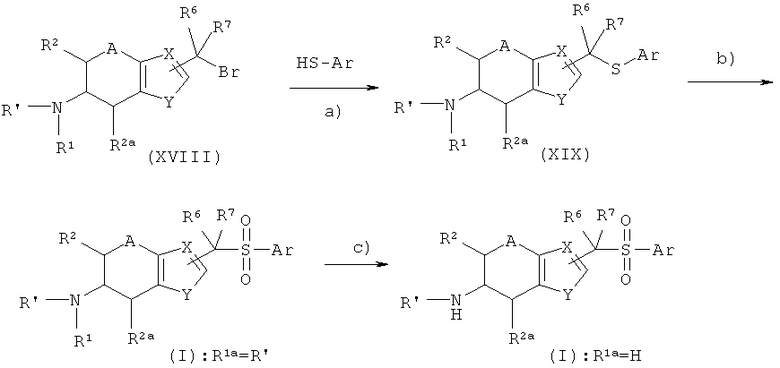
Радикалы R1, R2, R2a, R6, R7, Ar, A, X и Y на схеме 5 были описаны выше.
R' представляет собой радикал R1a или защитную группу. В соответствии со схемой 5 соединение XVIII реагирует на этапе b) с меркаптосоединением HS-Ar в присутствии основания, такого как гидрид натрия или алкоксид натрия, или с солью щелочного металла и этого основания, с получением тиоэфирного соединения XIX. Тиоэфирная группа этого соединения окисляется до сульфоновой группы, например, оксоном (этап b). Если R' представляет собой защитную группу, то ее можно отщепить, получив соединение I, где R1a представляет собой Н. Для компетентного специалиста ясно, что соединение I можно трансформировать и дальше, как показано на схеме 1.
Компетентному специалисту понятно, что соединения формулы I можно получить также из структурно похожих соединений интерконверсией функциональных групп. В частности, N-связанные радикалы Ra можно вводить в соединения формулы I путем взаимодействия галогенового производного, то есть соединения формулы I, у которого вместо Ra имеется атом галогена, в частности брома или иода, с первичным или вторичным амином в присутствии основания, предпочтительно, также и в присутствии палладиевого катализатора, подходящего для реакции Бучвальда-Хартвига (Buchwald-Hartwig).
Если не указано иначе, описанные выше реакции в общем случае осуществляются в растворителе при температуре от комнатной до температуры кипения используемого растворителя. Альтернативно, необходимую для протекания реакции энергию активации можно обеспечить, подвергая реакционную смесь действию микроволнового излучения; такой метод полезен, в особенности, для реакций, катализируемых переходными металлами (использование микроволнового излучения описано в работе Tetrahedron 2001, 57, p.9199 ff. p.9225 ff. и также аналогично "Microwaves in Organic Synthesis", Andre Loupy (Ed.), Wiley-VCH 2002).
Сульфонилхлориды Cl-SO2-Ar либо доступны коммерчески, либо могут быть получены стандартными синтетическими методами. Сульфонилхлориды, содержащие фторированный радикал Ra, могут быть получены разнообразными методами, например взаимодействием подходящего гидрокси- или оксо-предшественника (например, соединения Cl-SO2-Ar с гидрокси- или оксо-замещенным радикалом) с фторированными реагентами, такими как DAST(трифториддиэтиламиносеры), морфолин-DACТ, деоксофтор (трифторид бис(2-метоксиэтил)аминосеры), реагент Ишикавы (N,N-диэтил-(1,1,2,3,3,3-гексафторпропил)амин; Journal of Fluorine Chemistry, 1989, 43, 371-377). Чаще гидрокси-группу ароматического соединения, содержащего гидрокси-замещенный радикал, но не хлорсульфонильную группу, преобразуют в уходящую группу, которую затем вытесняют фторид-ионом (J. Org. Chem., 1994, 59, 2898-22901; Tetrahedron Letters, 1998, 7305-6; J. Org. Chem., 1998, 63, 9587-9589, Synthesis, 1987, 920-21)). Последующее непосредственное хлорсульфонирование хлорсульфоновой кислотой (Heterocycles, 2001, 55, 9, 1789-1803; J. Org. Chem., 2000, 65, 1399-1406) или двухстадийный процесс получения сначала производных сульфоновой кислоты и их последующего преобразования в сульфонилхлориды под действием, например, хлорсульфоновой кислоты, пентахлорида фосфора (Eur. J. Med. Chem., 2002, 36, 809-828) и подобных соединений приводит к получению требуемых сульфонилхлоридов (Tetrahedron Letters, 1991, 33, 50 7787-7788)). Сульфонилхлориды можно получить также диазотированием подходящего амино-предшественника Ar-NH2 нитритом натрия в кислой среде и взаимодействием с диоксидом серы в уксусной кислоте (схема (iii); J. Org. Chem., 1960, 25, 1824-26); окислением подходящих гетероарилтиолов HS-Ar или гетероарилбензилтиоэфиров C6H5-CH2-S-Ar хлором (Synthesis, 1998, 36-38; J. Am. Chem. Soc., 1950, 74, 4890-92;) с получением непосредственно сульфонилхлоридов. Остальные соединения известны в химии или могут быть приготовлены стандартными методами. Например, предшественники меркапто-пиримидинов или пиримидинил-бензилтиоэфиров могут быть получены так, как описано в литературе (Chemische Berichte, 1960, 1208-11; Chemische Berichte, 1960, 95, 230-235; Collection Czechoslow. Chem. Comm., 1959, 24, 1667-1671; Austr. J. Chem., 1966, 19, 2321-30; Chemiker-Zeitung, 101, 6, 1977, 305-7; Tetrahedron, 2002, 58, 887-890; Synthesis, 1983, 641-645).
В следующих далее схемах 6-8 представлены несколько путей получения бензолсульфонилхлоридов с фторированными пропильными радикалами.
Схема 6
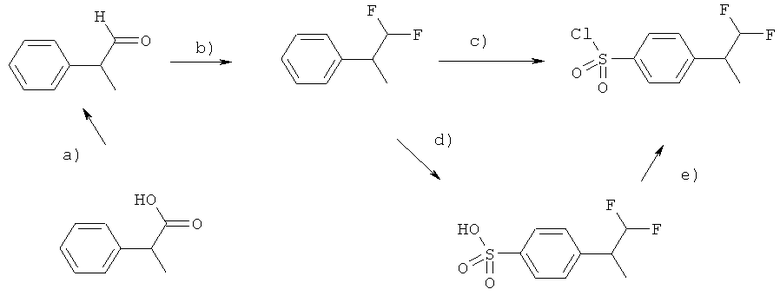
Интермедиат 4-(1,1-дифторпропан-2-ил)бензол-1-сульфонилхлорид может быть получен из коммерчески доступной 2-фенилпропановой кислоты. На первом этапе а) 2-фенилпропановая кислота преобразуется в алкильный сложный эфир этерификацией спиртом (например, метанолом или этанолом), катализируемой кислотой (например, HCl, SO2Cl2). Сложный эфир можно восстановить в соответствующий 2-фенилпропаналь действием такого восстановителя, как DIBAL (гидрид диизобутилалюминия). Альдегид конвертируется в производное 1,1-дифтор-2-пропила под действием подходящего фторирующего агента, такого как DAST (диэтиламиносератрифторид), морфолине-DAST, деоксофтор (бис(2-метоксиэтил)аминосера трифторид), реагент Ишикавы (N,N-диэтил-(1,1,2,3,3,3-гексафторпропил)амин; Journal of Fluorine Chemistry, 1989, 43, 371-377) (этап b). Полученный таким способом 1,1-дифтор-2-фенилпропан можно превратить в 4-(1,1-дифтор-2-пропил)бензолсульфонилхлорид либо непосредственным хлорсульфонированием хлорсульфоновой кислотой (Heterocycles, 2001, 55, 9, 1789-1803; J. Org. Chem., 2000, 65, 1399-1406), либо двухстадийным процессом сначала получением производных сульфоновой кислоты (этап d) и затем их преобразованием в сульфонилхлориды (этап е) под действием, например, хлорсульфоновой кислоты или пентахлорида фосфора (Eur. J. Med. Chem., 2002, 36, 809-828); а также диазотированием подходящего амино-предшественника Ar-NH2 нитритом натрия в кислой среде и взаимодействием с диоксидом серы в уксусной кислоте (схема (iii); J. Org. Chem., 1960, 25, 1824-26); окислением подходящих гетероарилтиолов HS-Ar или гетероарилбензилтиоэфиров хлором (Synthesis, 1998, 36-38; J. Am. Chem. Soc., 1950, 74, 4890-92;) с получением непосредственно сульфонилхлоридов.
Если представленный на схеме 6 синтез осуществить с использованием (R)-2-фенилпропановой кислоты или (S)-2-фенилпропановой кислоты, то можно получить соответствующие хиральные 4-(1,1-дифторпропан-2-ил)бензол-1-сульфонилхлориды.
Схема 7:
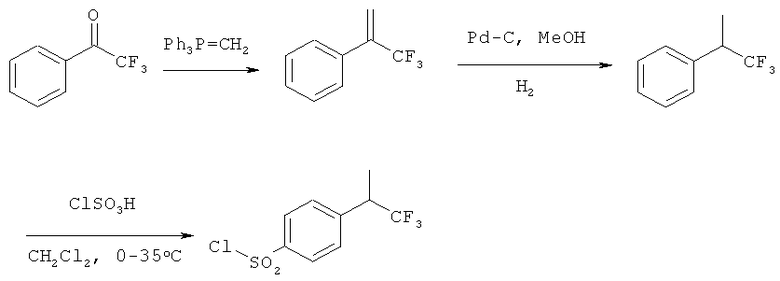
Интермедиат 4-(1,1,1-трифторпропан-2-ил)бензол-1-сульфонилхлорид можно получить из коммерчески доступного 2,2,2-трифтор-1-фенилэтанона по маршруту синтеза, показанному на схеме 7. Кетон можно преобразовать в 3,3,3-трифтор-2-фенилпропен реакцией Виттига с подходящим илидом, таким как метилентрифенилфосфаном (полученным в результате реакции галогенида метилентрифенилфосфония с подходящим основанием, например диизопропиламидом лития или трет-бутоксидом калия) или реакцией Хормера-Эммонса с подходящим фосфонатом, таким как диэтилметилфосфонат, и подходящим основанием, таким как диизопропил лития или трет-бутоксид калия. Полученный таким способом 3,3,3-трифтор-2-фенилпропен можно затем восстановить в насыщенный алкан каталитическим гидрогенированием (например, на Pd-C) с последующим превращением в сульфонилхлорид методами, описанными в схеме 6.
Синтез по схеме 7 можно осуществить с использованием хирального катализатора гидрогенирования алкена, что позволит получить соответствующие хиральные 4-(1,1,1-трифторпропан-2-ил)бензол-1-сульфонил хлориды.
Схема 8
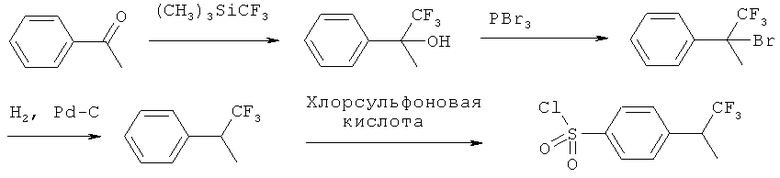
4-(1,1,1-Трифторпропан-2-ил)бензол-1-сульфонилхлорид можно также получить из коммерчески доступного 1-фенилэтанона четырехстадийным синтезом, описанным на схеме 8. Кетон превращается в трифторметил гидроксильный интермедиат по реакции с триметилтрифторметилсиланом (Journal of Organic Chemistry, 2000, 65, 8848-8856; Journal of Fluorine Chemistry, 2003, 122, 243-246). Этот интермедиат затем можно превратить в трифторметилбромид (Journal of the American Chemical Society, 1987, 109, 2435-4). Дегалогенирование продукта методами каталитического гидрирования (например, на Pd-C) позволит затем осуществить превращение в сульфонилхлорид так, как это было описано раньше.
Примерами возможных растворителей являются эфиры, такие как диэтиловый эфир, диизопропиловый эфир, метил трет-бутиловый эфир или тетрагидрофуран, апротонные полярные растворители, такие как диметилформамид, диметилсульфоксид, диметоксиэтан и ацетонитрил, ароматические углеводороды, такие как толуол и ксилен, кетоны, такие как ацетон или метилэтилкетон, галогенированные углеводороды, например дихлорметан, трихлорметан и дихлорэтан, сложные эфиры, такие как этилацетат и метилбутират, карбоновые кислоты, например уксусная и пропионовая кислоты, а также спирты, как, например, метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, 2-бутанол и трет-бутанол.
Если необходимо, в реакционную смесь можно ввести основание, чтобы нейтрализовать протоны, выделяющиеся входе реакций. К числу подходящих оснований относятся неорганические основания, такие как карбонат натрия или калия, гидрокарбонат натрия или калия, а также алкоксиды, такие как метоксид или этоксид натрия, гидриды щелочных металлов, такие как гидрид натрия, а также органометаллические соединения, например соединения бутиллития или алкилмагния, или органические азотные основания, такие как триэтиламин или пиридин. Последние соединения могут в то же время служить растворителями.
Неочищенный продукт выделяют обычными способами, например фильтрованием, упариванием растворителя, экстракцией из реакционной смеси и т.д. Полученные соединения также очищают обычными способами, такими как перекристаллизацией из растворителя, хроматографией или превращением в соль присоединения кислоты.
Соль присоединения кислоты готовят обычными способами, смешивая свободное основание с соответствующей кислотой, если необходимо, то в растворе органического растворителя, например низшего спирта, такого как метанол, этанол или пропанол, простого эфира, такого как метил трет-бутиловый эфир или диизопропиловый эфир, кетона, например ацетон или метилэтилкетон, или сложного эфира, такого как этилацетат.
Соответствующие формуле I соединения настоящего изобретения представляют собой неоожиданно высокоселективные лиганды дофаминовых рецепторов D3. Это связано с их малым сродством с другими рецепторами, такими как D1, D4, α1-адренергические и/или α2-адренергические, мускариновые, гистаминовые, опиатные и, в особенности, дофаминовые D2 рецепторы, что приводит к малому количеству побочных эффектов, по сравнению с классическими нейролептиками, представляющими собой антагонисты D2 рецепторов. Соединения настоящего изобретения могут представлять собой агонисты дофаминовых D3 рецепторов, включая частичные агонисты, а также антагонисты D3 рецепторов, включая частичные антагонисты.
Высокое сродство соединений настоящего изобретения к дофаминовым D3 рецепторам выражается очень низкой константой связывания с рецептором in vitro (малые значения Ki(D3)). Как правило, она меньше 50 нМ (нмоль/л), предпочтительно меньше 10 нМ, особенно предпочтительно, если меньше 5 нМ. В экспериментах по связыванию для определения сродства к D3 рецепторам можно, например, использовать метод вытеснения [125I]-иодсульпирида.
Селективность соединений настоящего изобретения, то есть отношение констант связывания с рецепторами Ki(D2)/Ki(D3), как правило, не бывает меньше 50, предпочтительно по меньше мере 100, еще более предпочтительно, если селективность составляет по меньшей мере 150. Для выполнения экспериментов по связыванию с D1, D2 и D4 рецепторами можно использовать, например, вытеснение of [3H]SCH23390, [125I]-иодсульпирида или [125I]-спиперона.
Из-за низкого профиля связывания соединения настоящего изобретения можно использовать для лечения заболеваний, чувствительных к действию лигандов дофаминовых D3 рецепторов (или таких, которые чувствительны к действию лигандов дофаминовых D3 рецепторов), то есть они эффективны для лечения таких медицинских состояний или заболеваний, в которых влияние на (модулирование) дофаминовые D3 рецепторы приводит к улучшению клинической картины заболевания. Примерами таких заболеваний являются заболевания или расстройства центральной нервной системы.
Расстройства или заболевания центральной нервной системы следует понимать как значимые расстройства, влияющие на спинной и, в особенности, на головной мозг. В контексте настоящего изобретения термин "расстройство" означает нарушения и/или отклонения, которые, как правило, считаются патологическим состоянием или функцией и которые могут выражаться в конкретных признаках, симптомах и/или нарушениях. Хотя лечение в контексте настоящего изобретения может быть направлено на конкретные заболевания, то есть аномалии или патологические состояния, оно применимо и в случае тяжелых аномалий, которые могут быть причинно связаны друг с другом, объединяться в паттерны или синдромы, которые можно лечить методами настоящего изобретения.
Заболевания, которые можно лечить методами настоящего изобретения, это, в особенности, психиатрические и неврологические нарушения. К числу таких нарушений относятся, в частности, органические нарушения, включая симптоматические нарушения, такие как психозы острого экзогенного типа реагирования или сопутствующие психозы органического или экзогенного происхождения, например, связанные с нарушениями метаболизма, инфекциями и патологиями эндокринной системы; эндогенные психозы, такие как шизофрения и связанные с ней расстройства личности и делюзии; аффективные нарушения, такие как депрессии, мании и/или маниакально-депрессивные состояния; смешанные формы упомянутых нарушений; невротические и соматические заболевания и нарушения, связанные со стрессом; диссоциативные нарушения, такие как потеря или омрачение сознания, раздвоение и нарушения личности; нарушения внимания и сна, такие как поведенческие или функциональные нарушения, чье происхождение лежит в детстве и юности, такие как гиперактивность у детей, нарушения интеллекта, в особенности, нарушения внимания (заболевания, связанные с дефицитом внимания), нарушения памяти и когнитивные нарушения, такие как нарушения обучения и памяти (мягкое когнитивное снижение), деменция, нарколепсия, нарушения сна (например, синдром беспокойных ног); нарушения в развитии; тревожность, бред; нарушения сексуальной жизни, такие как импотенция у мужчин; нарушения пищевого поведения, например анорексия или булемия; зависимость; а также другие не указанные психиатрические нарушения.
Заболевания, которые можно лечить в контексте настоящего изобретения, включают также болезнь Паркинсона, эпилепсию и, в особенности, связанные с ними аффективные нарушения.
Связанные с зависимостью заболевания включают психиатрические и поведенческие нарушения, вызванные пристрастием к психотропным веществам, таким как лекарства или наркотики, а также другие виды зависимости, например игромания (расстройства контроля над влечениями, не классифицированные иначе). Примерами вызывающих привыкание веществ являются: опиоиды (например, морфин, героин и кодеин), кокаин, никотин; алкоголь; вещества, взаимодействующие с комплексом канала хлорид-ионов GABA, седативные препараты, гипнотики и транквилизаторы, например бензодиазепины; LSD; каннабиноиды; психомоторные стимуляторы, такие как 3,4-метилендиокси-N-метиламфетамин (экстази); амфетамин и амфетамин-подобные вещества, такие как метилфенидат и другие стимуляторы, включая кофеин. Аддиктивными веществами, требующими особого рассмотрения, являются опиоиды, кокаин, амфетамин или амфетамин-подобные вещества, никотин или алкоголь.
В контексте лечения зависимости особое предпочтение уделяется таким веществам настоящего изобретения формулы I, которые сами не обладают психотропным эффектом. Это проверяется в экспериментах на крысах, которые, после введения им соединений настоящего изобретения, уменьшают самовведение психотропных препаратов, например кокаина.
В соответствии с другим аспектом настоящего изобретения соединения настоящего изобретения могут использоваться для лечения заболеваний, причина которых по меньшей мере частично связана с аномальной активностью дофаминовых D3 рецепторов.
В соответствии с еще одним аспектом настоящего изобретения лечение направлено, в особенности, на такие заболевания, на которые можно повлиять (применяя разумное медицинское лечение), связывая предпочтительно экзогенно вводимые лиганды с дофаминовыми D3 рецепторами.
Заболевания, которые можно лечить соединениями настоящего изобретения, часто характеризуются прогрессивным течением, то есть описанные выше состояния изменяются со временем; как правило, их интенсивность возрастает, и такие состояния могут переходить друг в друга, или могут возникать другие заболевания в дополнение к уже имеющимся.
Соединения настоящего изобретения можно использовать для лечения большого количества признаков, симптомов и/или нарушений, связанных с заболеваниями центральной нервной системы и, в особенности, с упомянутыми выше состояниями. Эти признаки, симптомы и/или нарушения включают, например, нарушение связи с реальностью, неадекватную самооценку и неспособность соблюдать обычные социальные нормы и требования жизни, изменения темперамента, побуждений, таких как голод, сон, жажда и т.д., изменения настроения, нарушения способности наблюдать и комбинировать, нарушения личности, в частности эмоциональную лабильность, галлюцинации, нарушения эго, легкая отвлекаемость, амбивалентность, аутизм, деперсонализацию и ложные восприятия, делюзии, недостаток синкинезии, короткий шаг при походке, неуверенное положение туловища и конечностей, тремор, бедность лицевой мимики, монотонную речь, депрессии, апатию, подавленную спонтанность и способность принимать решения, сниженную способность к ассоциативному восприятию, тревожность, нервное возбуждение, заикание, социальные фобии, панические расстройства, синдром отмены в связи с зависимостью, биполярные синдромы, состояния возбуждения и конфузии, дисфорию, дискинетические синдромы и тик, например хорею Хантингтона и синдром Жиль Де Ла Туретта, синдромы вертиго, например периферическое позиционное, вращательное и осцилляторное вертиго, меланхолию, истерию, гипохондрию и т.д.
В контексте настоящего изобретения лечение включает также превентивное лечение (профилактику), в особенности профилактику рецидивов и фазовую профилактику, а также лечение острых и хронических признаков, симптомов и/или нарушений. Лечение может быть ориентировано симптоматически, например на подавление симптомов. Оно может назначаться на короткий период или быть средне- или долгосрочным лечением, например, в контексте поддерживающей терапии.
Таким образом, соединения настоящего изобретения предпочтительно подходят для лечения заболеваний центральной нервной системы, в частности для лечения аффективных расстройств; невротических нарушений, стресса и соматических расстройств и психозов, и, в особенности, для лечения шизофрении и депрессии. Благодаря своей высокой селективности по отношению к D3 рецептору соединения I настоящего изобретения также подходят для лечения нарушения функции почек, в особенности, вызванных сахарным диабетом (см. WO 00/67847) и, особенно, диабетической нефропатии.
Применение описанных соединений настоящего изобретения в контексте лечения предполагает наличие метода. Согласно этому методу эффективное количество одного или нескольких соединений, как правило, формулируется в соответствии с фармацевтической или ветеринарной практикой и вводится индивидууму, предпочтительно млекопитающему, в особенности человеку, сельскохозяйственному или домашнему животному. Решение о том, показано ли такое лечение, и в какой форме его назначать, зависит от индивидуального случая и от медицинского определения (диагноза), учитывающего имеющиеся признаки, симптомы и/или нарушения, вероятность развития конкретных признаков, симптомов и/или нарушений, и других факторов.
Как правило, лечение осуществляется однократным или многократным ежедневным введением совместно или по очереди с другими активными соединениями и содержащими их препаратами, так что ежедневная доза предпочтительно составляет приблизительно от 0,1 до 1000 мг/кг веса тела, в случае перорального назначения или приблизительно от 0,1 до 100 мг/кг веса тела в случае парентерального введения.
Изобретение также относится к получению фармацевтических композиций для лечения индивидуума, предпочтительно млекопитающего, в особенности человека, сельскохозяйственного или домашнего животного. Таким образом, лиганды, обычно, вводят в форме фармацевтической композиции, включающей фармацевтически приемлемый наполнитель совместно с по меньшей мере одним соединением изобретения и, если это необходимо, с другими активными соединениями. Эти составы могут вводиться, например, перорально, ректально, трансдермально, подкожно, внутривенно, внутримышечно или интраназально.
Примерами подходящих фармацевтических композиций являются твердые медицинские формы, такие как порошки, гранулы, таблетки, в частности пленочные таблетки, таблетки в форме капсул, таблетки в оболочке из сахара, капсулы, такие как твердые и мягкие желатиновые капсулы, суппозитории или вагинальные медицинские формы, полутвердные медицинские формы, такие как мази, кремы, гидрогели, пасты или пластыри, а также жидкие медицинские формы, включая растворы, эмульсии, в особенности водно-масляные эмульсии, суспензии, например лосьоны, составы для инъекций и инфузий, а также глазные и ушные капли. Для введения ингибиторов настоящего изобретения можно использовать также имплантированные приспособления для постепенного высвобождения препарата. Можно применять также липосомы или микросферы.
При получении композиции соединения настоящего изобретения можно смешивать или разбавлять одним или несколькими наполнителями. Наполнители могут быть твердыми, полутвердыми или жидкими и использоваться в качестве носителей или среды для активных соединений.
Подходящие наполнители приводятся в специальных медицинских монографиях. Кроме того, составы могут включать фармацевтически приемлемые носители и дополнительные вспомогательные вещества, такие как смазывающие составы, увлажняющие агенты, эмульсификаторы и средства суспендирования, консерванты, антиоксиданты, средства, снимающие раздражение, хелаторы, вещества, входящие в состав оболочки, стабилизаторы эмульсий, агенты для образования пленок и гелей, средства для маскировки запаха и для улучшения вкуса, смолы, гидроколлоиды, растворители, стабилизаторы, вещества для нейтрализации, ускорители диффузии, пигменты, соединения четвертичного аммония, жиры, исходные материалы для создания мазей, кремов или масел, силиконовые производные, средства для облегчения рассеивания, стабилизаторы, средства для стерилизации, базовые составы для суппозиториев, используемые в таблетках вспомогательные средства, такие как связывающие составы, наполнители, смазывающие средства, дезинтеграторы или покрытия, осушители, красители, уплотнители, воски, пластификаторы и белые минеральные масла. Приготовление составов с учетом указанных факторов определяется специальными навыками и знаниями, описанными, например, в работе Fiedler, H.P., Lexikon der Hilfsstoffe fur Pharmazie, Kosmetik und angrenzende Gebiete [Encyclopedia of auxiliary substances for pharmacy, cosmetics и related fields], 4th Edition, Aulendorf: ECV-Editio-Kantor-Verlag, 1996].
Приводимые далее примеры используются для того, чтобы пояснить сущность изобретения, не ограничивая его.
Соединения были охарактеризованы либо протонным ЯМР (NMR) в d6-диметилсульфоксиде или d-хлороформе на 400 MHz или 500 MHz NMR спектрометре (Bruker AVANCE), либо методом масс-спетрометрии, обычно, HPLC-MS в быстром градиенте на веществе с С18 (режим электрораспыления (electrospray-ionisation (ESI)), либо по температуре плавления.
Свойства спектра ядерного магнитного резонанса ЯМР (NMR), обычно, выражают в химическом сдвиге (δ), который, в свою очередь, выражается в долях на миллион (parts per million (ppm)). Относительная площадь сдвига в спектре 1H NMR соответствует количеству атомов водорода для конкретного функционального типа в молекуле. Природа сдвига, так называемая множественность (multiplicity), обозначается ка ксинглет - singlet (s), широкий синглет - broad singlet (s. br.), дублет - doublet (d), широкий дублет - broad doublet (d br.), триплет - triplet (t), широкий триплет - broad triplet (t br.), квартет - quartet (q), квинтет - quintet (quint.) и мультиплет - multiplet (m).
Примеры получения:
I. Получение интермедиатов
а. Синтез сульфонилхлоридов
а.1 4-((S)-2-Фтор-1-метилэтил)-бензолсульфонилхлорид
а.1.1 Эфир толуол-4-сульфоновой кислоты и (S)-2-фенилпропила
К раствору 20 г (S)-(-)-2-фенил-1-пропанола в 240 мл дихлорметана порциями добавили 28 г пара-толуолсульфонилхлорида (146,8 ммоль). После перемешивания в течение 18 часов при комнатной температуре органическую фазу промыли 100 мл воды, высушили над сульфатом магния, профильтровали и растворитель упарили при пониженном давлении с получением 43 г заявленного соединения.
1H-NMR (CDCl3, 400 MHz): δ [ppm] 7,65 (d, 2H), 7,15-7,3 (m, 5H), 7,1 (d, 2H), 4,0-4,1 (m, 2H), 3,1 (m, 1H), 2,4 (s, 3H), 1,3 (d, 3H).
a. 1.2 ((S)-2-Фтор-1-метил-этил)-бензол
9,62 г эфира толуол-4-сульфоновой кислоты и (S)-2-фенилпропила (33,13 ммоль) растворили в 80 мл полиэтиленгликоля 400. В систему добавили 9,62 г фторида калия (165,6 ммоль) и 3 дня перемешивали реакционную смесь при 50°С, а затем еще 2 дня при 55-70°С. В смесь добавили 150 мл насыщенного водного раствора хлорида натрия, трижды проэкстрагировали диэтиловым эфиром, объединенные органические слои высушили над сульфатом магния, профильтровали и упарили растворитель при пониженном давлении. "Сырой" продукт очистили хроматографией на силикагеле, в качестве элюента использовали 15% циклогексан/этилацетат. В результате выделили 2,85 г требуемого продукта, содержащего ~25% побочного продукта реакции элиминирования.
1H-NMR (CDCl3, 400 MHz): δ [ppm] 7,2-7,4 (m, 5H), 4,3-4,6 (несколько m, 2H), 3,15 (m, 1H),1,3 (m, 3H).
a. 1.3 4-((S)-2-Фтор-1-метилэтил)-бензолсульфонилхлорид
3,5 г ((S)-2-фтор-1-метилэтил)-бензола (25,32 ммоль) растворили в 80 мл дихлорметана. В систему по каплям добавили 11,81 г хлорсульфоновой кислоты (101,31 ммоль), растворенной в 20 мл дихлорметана при температуре 0-5°С. Реакционную смесь перемешивали 30 минут при комнатной температуре и 2 часа при 30°С, после чего растворитель упарили. К остатку добавили 150 мл диэтилового эфира, однократно промыли 150 мл воды и органический слой высушили над сульфатом магния, профильтровали, растворитель упарили при пониженном давлении. "Сырой" продукт очистили хроматографией на силикагеле, в качестве элюента использовали н-гептандихлорметан (6:4), получив 1,5 г заявленного соединения.
1H-NMR (CDCl3, 400 MHz): δ [ppm] 8,0 (d, 2H), 7,5 (d, 2H), 4,5 (dd, 2H), 3,25 (m, 1H), 1,4 (d, 3Н).
а.2 4-((R)-2-Фтор-1-метилэтил)-бензолсульфонилхлорид
а.2.1 (R)-2-фенилпропиловый эфир толуол-4-сульфоновой кислоты
Заявленное соединение было получено при следовании процедурам, аналогичным тем, что использовались при синтезе эфира толуол-4-сульфоновой кислоты и (S)-2-фенилпропила, но с использованием (R)-2-фенил-1-пропанола.
а.2.2 ((В)-2-Фтор-1-метилэтил)-бензол
Заявленное соединение было получено при следовании процедурам, аналогичным тем, что использовались при синтезе ((S)-2-фтор-1-метилэтил)-бензола, но с использованием (R)-2-фенилпропилового эфира толуол-4-сульфоновой кислоты, а не (S)-2-фенилпропилового эфира толуол-4-сульфоновой кислоты.
1H-NMR (CDCl3, 400 MHz): δ [ppm] 7,2-7,4 (m, 5H), 4,3-4,6 (несколько m, 2H), 3,15 (m, 1H), 1,3 (m, 3Н).
a.2.3 4-((R)-2-Фтор-1-метилэтил)-бензолсульфонил хлорид
1,3 г ((R)-2-фтор-1-метилэтил)-бензола (9,4 ммоль) растворили в 50 мл дихлорметана, после чего по каплям добавили 1,1 гхлорсульфоновой кислоты (9,4 ммоль), растворенной в 10 мл дихлорметана при 0-5°С. Смесь 20 минут перемешивали при температуре 0-5°С, после чего добавили к раствору 2,15 г пентахлорида фосфора в 40 мл дихлорметана. Реакционную смесь перемешивали 30 минут при 0-5°С и 1 час при комнатной температуре. Растворитель упарили, в систему добавил и 100 мл диэтилового эфира, после чего ее промыли 150 мл воды, органический слой высушили над сульфатом магния, профильтровали и растворитель упарили при пониженном давлении. "Сырой" продукт очистили хроматографией на силикагеле (в качестве элюента использовали н-гептандихлорметан (1:1)), получив 0,261 г заявленного соединения.
1H-NMR (CDCl3, 400 MHz): δ [ppm] 8,0 (d, 2H), 7,5 (d, 2H), 4,5 (dd, 2H), 3,25 (m, 1H), 1,4 (d, 3H).
а.3 4-(2-Фтор-1-метилэтил)-бензолсульфонилхлорид
Заявленное соединение было получено при следовании процедурам, аналогичным тем, что использовались при синтезе 4-((S)-2-фтор-1-метилэтил)-бензолсульфонилхлорида, но с использованием 2-фенил-1-пропанола на этапе а.3.1.
1H-NMR (CDCl3, 400 MHz): δ [ppm] 8,0 (d, 2H), 7,5 (d, 2H), 4,5 (dd, 2H), 3,25 (m, 1H), 1,4 (d, 3H).
a.4 4-(2-Фтор-1-фторметилэтил)-бензолсульфонилхлорид
а.4.1 (2-Фтор-1-фторметилэтил)-бензол
4 г 3-фенилглутаровой кислоты (19,21 ммоль) суспендировали в 350 мл дихлорметана. При комнатной температуре в систему добавили 6,5 г дифторида ксенона (38,42 ммоль), после чего реакционную смесь 18 часов перемешивали при комнатной температуре. Органическую фазу промыли 975 мл 6% водного раствора гидрокарбоната натрия, высушили над сульфатом магния, профильтровали и упарили растворитель. Остаток дистиллировали на бане при температуре 123°С и при 21 мм, получив 0,78 г заявленного соединения, которое содержало ~50% 4-(2-Фтор-1-метилэтил)-бензола.
1H-NMR (CDCl3, 400 MHz): δ [ppm] 7,2-7,4 (m, 5H), 4,6-4,8 (dd, 4H), 3,3 (m, 1H).
a.4.2 4-(2-Фтор-1-фторметилэтил)-бензолсульфонилхлорид
Заявленное соединение было получено при следовании процедурам, аналогичным тем, что использовались при синтезе 4-((S)-2-фтор-1-метилэтил)-бензолсульфонилхлорида, но с использованием 5 эквив. хлорсульфоновой кислоты, удалось получить 0,12 г соединения.
1H-NMR (CDCl3, 400 MHz): δ [ppm] 8,05 (d, 2H), 7,55 (d, 2H), 4,75 (dd, 4H), 3,4 (m, 1H).
a.5 4-(3,3,3-Трифторпропил)-бензолсульфонилхлорид
2,9 г заявленного соединения получили из коммерчески доступного (3,3,3-трифторпропил)-бензола по описанной выше процедуре синтеза 4-((S)-2-фтор-1-метилэтил)-бензолсульфонилхлорида.
1H-NMR (CDCl3, 400 MHz): δ [ppm] 8,0 (d, 2H), 7,45 (d, 2H), 3,0 (t, 2H), 2,45 (m, 2H).
a.6 4-(2,2,2-Трифторэтил)-бензолсульфонилхлорид
Продукт получили из коммерчески доступного (2,2,2-трифторэтил)-бензола по методу, описанному в работе J. Org. Сhem., 1960, 25, 1824-26.
1H-NMR (CDCl3, 400 MHz): δ [ppm] 8,05 (d, 2H), 7,55 (d, 2H), 3,5 (q, 2H).
а.7 4-(3-Фторпропил)-бензолсульфонилхлорид
а.7.1 (3-Фторпропил)-бензол
15,6 г диэтиламинотрифторида серы (DAST, 96,91 ммоль) растворили в 18 мл дихлорметана, после чего по каплям добавили 12 г 3-фенил-1-пропанола (88,1 ммоль), растворенного в 30 мл дихлорметана при 0-5°С. Реакционную смесь перемешивали 18 часов, добавили 30 мл дихлорметана и вылили в 100 мл ледяной воды. Органический слой отделили, высушили над сульфатом магния, профильтровали и растворитель упарили. "Сырой" продукт очистил и дистилляцией на водяной бане при 106°С и 20 мм, получив 7,4 г заявленного соединения.
1H-NMR (CDCl3, 400 MHz): δ [ppm] 7,1-7,3 (m, 5H), 4,4 (dt, 2H), 2,7 (m, 2H), 2,0 (m, 2H).
a.7.2 4-(3-Фторпропил)-бензолсульфонилхлорид
4,1 г (3-фторпропил)-бензола (29,67 ммоль) растворили в 40 мл дихлорметана, после чего по каплям добавили 6,91 г хлорсульфоновой кислоты (59,34 ммоль), растворенной в 10 мл дихлорметана при 0-5°С. Реакционную смесь перемешивали 45 минут при 0-5°С и добавили к раствору 6,8 г пентахлорида фосфора (32,63 ммоль) растворенного в 50 мл дихлорметана. После этого смесь перемешивали в течение часа при 5-10°С. Растворитель упарили, добавили 150 мл диэтилового эфира, промыли 150 мл ледяной воды, а органический слой высушили над сульфатом магния, профильтровали и растворительупарили при пониженном давлении. "Сырой" продукт очистили хроматографией на силикагеле (в качестве элюента использовали н-гептандихлорметан (11:9)), получив 5,5 г заявленного соединения.
1H-NMR (CDCl3, 400 MHz): δ [ppm] 7,95 (d, 2H), 7,45 (d, 2H), 4,5 (dt, 2H), 2,9 (t, 2H), 2,05 (m, 2H).
a.8 4-(2,2-Дифторциклопропил)-бензолсульфонилхлорид
2,07 г продукта получили из коммерчески доступного (2,2-дифторциклопропил)-бензола по методу, использовавшемуся при синтезе (3-фторпропил)-бензолсульфонилхлорида, но при этом использовали только 1,1 эквивалента пентахлорида фосфора.
1H-NMR (CDCl3, 400 MHz): δ [ppm] 8,0 (d, 2H), 7,45 (d, 2H), 2,85 (m, 1H), 2,0 (m, 1H), 1,75 (m, 1H).
a.9 3-Бром-4-трифторметоксибензолсульфонилхлорид
2,0 г 1-бром-2-(трифторметокси)бензола (8,3 ммоль) растворили в 30 мл дихлорметана, после чего по каплям добавили 1,06 г хлорсульфоновой кислоты (9,13 ммоль), растворенной в 3 мл дихлорметана при 0-5°С. Реакционную смесь перемешивали 30 минут при комнатной температуре. Для завершения реакции добавили еще 5,5 эквивалентов хлорсульфоновой кислоты в дихлорметане. После стандартной очистки и хроматографии на силикагеле (в качестве элюента использовали н-гептандихлорметан (6:4)) удалось получить 2,19 г заявленного соединения.
1H-NMR (CDCl3, 400 MHz): δ [ppm] 8,3 (d, 1H), 8,05 (dd, 1H), 7,5 (dd, 1H).
a.10 4-(2-Фторэтил)-бензолсульфонилхлорид
а.10.1 (2-Фторэтил)-бензол
6,8 г заявленного соединения получили из коммерчески доступного 2-фенил-этанола по методу, использовавшемуся при синтезе (3-фторпропил)-бензола.
1H-NMR (CDCl3, 400 MHz): δ [ppm] 7,1-7,3 (m, 5H), 4,6 (m, 1H), 4,45 (m, 1H), 2,95 (m, 1H), 2,9 (m, 1H).
a. 10.2 4-(2-Фторэтил)-бензолсульфонилхлорид
3,55 г заявленного соединения получили по методу, использовавшемуся при синтезе 4-((R)-2-фтор-1-метилэтил)-бензолсульфонилхлорида.
1H-NMR (CDCl3, 400 MHz): δ [ppm] 8,0 (d, 2H), 7,5 (d, 2H), 4,7 (dt, 2H), 3,05-3,2 (dt, 2H).
a.11 5-Пропилтиофен-2-сульфонилхлорид
Заявленное соединение было получено по методу, аналагичному тому, что использовался при синтезе (3-фторпропил)-бензолсульфонилхлорида, но с использованием только одного эквивалента пентахлорида фосфора.
1H-NMR (CDCl3, 400 MHz): δ [ppm] 7,7 (d, 1H), 6,85 (d, 1H), 2,9 (t, 2H), 1,75 (m, 2H), 1,0 (t, 3Н).
а. 12 4-(1-Метил-1Н-пиразол-4-ил)-бензолсульфонилхлорид
а.12.1 1-Метил-4-фенил-1Н-пиразол
1 г 2-фенилмалональдегида (6,75 ммоль) растворили в 25 мл этанола. В систему добавили 0,36 мл н-метилгидразина (6,75 ммоль), реакционную смесь перемешивали при кипячении в течение 4 часов, после чего растворитель упарили при пониженном давлении. Удалось получить 1,09 г продукта.
ESI-MS: 159,1 [М+Н]+
1H-NMR (CDCl3, 400 MHz): δ [ppm] 7,75 (s, 1H), 7,6 (s, 1H), 7,45 (d, 2H), 7,35 (t, 2H), 7,2 (t, 1H), 3,9 (s, 3Н)
а.12.2 4-(1-Метил-1Н-пиразол-4-ил)-бензолсульфонилхлорид
0,5 г 1-метил-4-фенил-1Н-пиразола (3,16 ммоль) растворили в 20 мл дихлорметана. В систему добавили 0,232 мл хлорсульфоновой кислоты при 0°С и реакционную смесь перемешивали в течение часа при охлаждении на льду. После этого добавили еще 0,7 мл хлорсульфоновой кислоты, смесь перемешивали 30 минут при 0°С и затем 90 минут при 50°С. Две фазы разделили, нижний слой поместили на лед, дважды проэкстрагировали диэтиловым эфиром, высушили над сульфатом магния, профильтровали и упарили растворитель при пониженном давлении, получив 0,496 г продукта.
1H-NMR (CDCl3, 400 MHz): δ [ppm] 8,0 (d, 2H), 7,85 (s, 1H), 7,75 (s, 1H), 7,65 (d, 2H), 4,0 (s, 3Н).
a.13 4-(1,1,1-Трифторпропан-2-ил)бензолсульфонилхлорид и 2-(1,1,1-трифторпропан-2-ил)-бензолсульфонилхлорид
Вещества были получены в количестве 14 г по методу, описанному на схеме 7. 2. Побочным продуктом реакции является (1,1,1-трифторпропан-2-ил)бензолсульфонилхлорид.
4-(1,1,1 -Трифторпропан-2-ил)бензолсульфонилхлорид:
MS (ESI) m/z: 273,1 [M+H]+
1H-NMR (DMSO): δ [ppm] 7,62 (d, 2H), 7,33 (d, 2H), 3,81 (m, 1H), 1,42 (d, 3Н).
2-(1,1,1-Трифторпропан-2-ил)бензолсульфонилхлорид:
MS (ESI) m/z: 273,1 [M+H]+
a.14 4-(1,1-Дифторпропан-2-ил)бензолсульфонилхлорид и
2-(1,1-дифторпропан-2-ил)бензол-1-сульфонилхлорид
Вещества были получены в количестве 11 г по методу, описанному на схеме 6. Побочным продуктом реакции является 2-(1,1-дифторпропан-2-ил)бензол-1-сульфонилхлорид.
4-(1,1-Дифторпропан-2-ил)бензолсульфонилхлорид:
MS (ESI) m/z: 255,0 [M+H]+
1H-NMR (DMSO): δ [ppm] 8,03 (d, 2H), 7,55 (d, 2H), 5,88 (dt, 1H), 3,34 (m, 1H), 1,47 (d, 3H).
13C-NMR (DMSO): δ [ppm] 146,43, 143,54, 129,77, 127,28, 117,06 (t), 43,76, 13,78.
2-(1,1-Дифторпропан-2-ил)бензол-1-сульфонилхлорид:
Выделен хроматографически в количестве 110 мг.
MS (ESI) m/z: 255,0 [M+H]+
1H-NMR (DMSO-d6): δ [ppm] 8,15 (d, 1H), 7,77 (t, 1H), 7,70 (d, 1H), 7,54 (t, 1H), 5,99 (dt, 1H), 4,43 (m, 1H), 1,51 (d, 3H).
13C-NMR (DMSO-d6): ([ppm] 143,45, 138,63, 135,53, 130,93, 129,04, 128,17, 116,61 (t), 38,38, 13,68.
II. Получение соединений формулы I
Пример 1
(R)-N-[7-(4-Изопропилбензолсульфониламино)-1,2,3,4-тетрагидро-нафтален-2-ил]-пропионамид
1.1 (R)-N-(1,2,3,4-Тетрагидронафтален-2-ил)-пропионамид
Раствор (В)-2-аминотетралин гидрохлорида (2,50 г, 13,6 ммоль) и триэтиламина (3,42 г, 33,77 ммоль) в тетрагидрофуране (THF) (30 мл) перемешали при -5°С и добавили по каплям пропионовый ангидрид (1,78 г, 13,7 ммоль). После этого смесь перемешивали 18 часов при комнатной температуре, растворитель упарили и добавили в систему смесь этил ацетат/вода. Органический слой промыли раствором лимонной кислоты (5%) и высушили над MgSO4. Отфильтрованный раствор сконцентрировали, получив белый твердый осадок (2,69 г, 97%).
1H-NMR (COCl3): δ [ppm] 7,12 (m, 4H), 5,49 (br s, 1H), 4,30 (m, 1H), 3,12 (m, 1H), 2,87 (m, 1H), 2,63 (m, 1H), 2,18 (q, 2H), 2,03 (m, 1H), 1,76 (m, 1H), 1,13 (t, 3Н).
MS(ESI) m/z: 204,1 [M+H]+
1.2 (R)-N-(7-Нитро-1,2,3,4-тетрагидронафтален-2-ил)-пропионамид, 5-нитро изомер, 6-нитроизомер и 8-нитроизомер
N-(1,2,3,4-Тетрагидронафтален-2-ил)-пропионамид (3,00 г, 14,8 ммоль) растворили в нитрометане (45 мл) и охладили до 5°С. В систему по каплям в течение 30 минут добавили раствор концентрированной H2SO4 (14,5 мл), азотную кислоту (1,05 мл, 65%) и воду (2,40 мл). Раствор перемешивали еще 2 часа, вылили в воду и проэкстрагировали этил ацетатом. Органическую фазу высушили над MgSO4, профильтровали и фильтрат упарили в вакууме с получением продукта в виде желтого масла (3,56 г, 97%).
1H-NMR (CDCl3): δ [ppm] региоизомеры (1:1) 9,15 (br s, 1H), 7,92 (m, 3Н), 7,70 (d, 1H), 7,20 (m, 3Н), 6,15 (br m, 1H), 4,26 (m, 4H), 3,20 (m, 2H), 3,10 (m, 1H), 2,98 (m, 3Н), 2,72 (m, 2H), 2,25 (q, 4H), 2,15 (m, 2H), 1,60 (m, 2H), 1,15 (t, 6H). MS(ESI) m/z: 249,1 [M+H]+
1,3 (R)-N-(7-Амино-1,2,3,4-тетрагидронафтален-2-ил)-пропионамид, 5-амино изомер, 6-аминоизомер и 8-аминоизомер
Смесь нитроизомеров (3,50 г, 14,1 ммоль) растворили в метаноле (МеОН) (100 мл) и добавили Pd-C (0,40 г, 10%). Раствор 6 часов перемешивали в атмосфере газообразного водорода. Раствор профильтровали и фильтрат сконцентрировали, получив масло, которое удалось разделить методами препаративной HPLC (20-95% МеОН) на все 4 аминоизомера. Продукты были получены в виде масел желтого цвета: 8-аминоизомер (0,05 г, 2%), 7-аминоизомер (0,38 г, 12%), 6-аминоизомер (0,19 г, 6%) и 5-аминоизомер (0,34 г, 10%).
8-Аминоизомер;
MS(ESI) m/z: 219,1 [М+Н]+
7-Аминоизомер:
MS(ESI) m/z: 219,1 [М+H]+
1H-NMR (DMSO-d6): δ [ppm] 7,72 (d, NH), 6,71 (d, 2H), 6,35 (d, 1H), 6,25 (s, 1H), 4,72 (s, NH2), 3,84 (m, 1H), 2,75 (m, 1H), 2,62 (m, 2H), 2,48 (m, 1H), 2,05 (q, 2H), 1,85 (m, 1H), 1,51 (m, 1H), 0,98 (t, 3H).
6-Аминоизомер:
MS (ESI) m/z: 219,1 [M+H]+
1H-NMR (DMSO-d6): δ [ppm] 7,74 (d, 1H), 6,71 (d, 2H), 6,50 (br s, NH), 6,33 (d, 1H), 6,31 (s, 1H), 3,84 (m, 1H), 2,75 (m, 1H), 2,68 (m, 2H), 2,42 (m, 1H), 2,08 (q, 2H), 1,85 (m, 1H), 1,51 (m, 1H), 0,99 (t, 3H).
5-Аминоизомер:
MS (ESI) m/z: 219,1 [M+H]+
1H-NMR (DMSO): δ [ppm] 7,74 (d, NH), 6,79 (t, 1H), 6,44 (d, 1H), 6,26 (d, 1H), 4,71 (s, NH2), 3,84 (m, 1H), 2,81 (m, 1H), 2,52 (m, 2H), 2,36 (m, 1H), 2,07 (q, 2H), 1,94 (m, 1H), 1,59 (m, 1H), 1,00 (t, 3H).
1.4 (R)-N-[7-(4-Изопропилбензолсульфониламино)-1,2,3,4-тетрагидронафтален-2-ил]-пропионамид
(R)-N-(7-Амино-1,2,3,4-тетрагидронафтален-2-ил)-пропионамид (0,34 г, 1,56 ммоль) растворили в смеси пиридиндихлорметана (1:2, 30 mL) и охладили до 5°С. В систему добавили 4-изопропилбензолсульфонилхлорид (0,37 г, 1,69 ммоль) и перемешивали раствор 3 часа при 5°С. Раствор упарили, разделили между этил ацетатом и водой, органическую фазу отделили и высушили над MgSO4. Отфильтрованный раствор сконцентрировали с получением продукта в виде желтого масла (0,56 г, 90%).
7-Амино: MS (ESI) m/z: 401,1 [М+Н]+
Пример 2
(R)-4-Изопропил-N-((R)-7-пропиламино-5,6,7,8-тетрагидронафтален-2-ил)бензолсульфонамид
(R)-N-[7-(4-Изопропилбензолсульфониламино)-1,2,3,4-тетрагидронафтален-2-ил]-пропионамид (0,56 г, 1,40 ммоль) растворили в 15 мл тетрагидрофурана (THF). 7,5 мл (78,4 ммоль) комплекса боран-THF по каплям добавляли в течение 15 минут. Полученную смесь один час перемешивали при кипячении. Раствор охладили, медленно добавили 5 мл 2 N HCl и перемешивали смесь 2 часа при 40°С. В охлажденном растворе реакцию остановили водой и затем NaOH (2N), после чего проэкстрагировали этил ацетатом. Органическую фазу высушили над MgSO4, профильтровали и фильтрат упарили под вакуумом с получением продукта в виде белого твердого осадка, который затем очистили перекристаллизацией из МеОН-изопропанол с получением также белого осадка (100 мг, 18%).
MS (ESI) m/z: 387,2 [M+H]+
1H-NMR (DMSO-d6): δ [ppm] 14,3 (br s, 1H), 12,0 (br s, 1H), 7,68 (d, 2H), 7,43 (d, 2H), 6,88 (m, 2H), 6,76 (s, 1H), 2,82 (m, 2H), 2,65 (m, 1H), 2,52 (m, 3Н), 2,36 (m, 1H), 1,88 (m, 1H), 1,40 (m, 3Н), 1,15 (d, 6H), 0,84 (t, 3Н),
13C-NMR (DMSO): 6 [ppm] 153,4 (s), 137,4 (s), 136,0 (s), 135,3 (s), 131,8 (s), 129,0 (d), 127,1 (d), 126,7 (d), 120,4 (d), 117,5 (d), 52,7 (d), 48,2 (t), 35,7 (t), 33,2 (d), 28,5 (t), 26,5 (t), 23,3 (q), 22,6 (t), 11,8 (q).
Пример 3
4-Изопропил-N-((R)-6-пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-бензолсульфонамид
N-[6-(4-Изопропилбензолсульфониламино)-1,2,3,4-тетрагидронафтален-2-ил]-пропионамид (0,19 г, 0,47 ммоль) растворили в 10 мл тетра гидрофура на (THF) и по каплям в течение 20 минут ввели в систему 3 мл (31,3 ммоль) комплекса боран-THF. Полученную смесь три часа перемешивали при кипячении. Раствор охладили, медленно добавили 3 мл 2 N HCl и перемешивали смесь 1 час при 40°С. В охлажденном растворе реакцию остановили водой и затем NaOH (2N), после чего проэкстрагировали этил ацетатом. Органическую фазу высушили над MgSO4, профильтровали и фильтрат упарили под вакуумом с получением продукта в виде бесцветного масла (100 мг, 55%).
MS (ESI) m/z: 387,1 [M+H]+
1H-NMR (DMSO-d6): δ [ppm] 7,68 (d, J 8,4, 2H), 7,39 (d, J 8,4, 2H), 6,90-6,75 (m, 3H), 2,92 (m, 2H), 2,69 (m, 1H), 2,52 (m, 3H), 2,38 (m, 1H), 1,88 (m, 1H), 1,40 (m, 3H), 1,15 (d, 6H), 0,84(t, 3H).
Пример 4
(R)-N-[5-(4-Изопропилбензолсульфониламино)-1,2,3,4-тетрагидронафтален-2-ил]-пропионамид
5-амино-изомер (0,26 г, 1,19 ммоль) из примера 1,3 растворили в пиридин-дихлорметан (1:2, 30 мл) и охладили до 5°С. В систему добавили 4-изопропилбензолсульфонилхлорид (0,29 г, 1,31 ммоль) и перемешивали раствор 3 часа при 5°С. Раствор упарили, разделили между этилацетатом и водой, органическую фазу отделили и высушили над MgSO4. Отфильтрованный раствор сконцентрировали с получением продукта в виде желтого масла (0,61 г, 100%).
MS (ESI) m/z: 401,1 [M+H]+
Пример 5
(R)-4-Изопропил-N-(6-пропиламино-5,6,7,8-тетрагидронафтален-1-ил)-бензолсульфонамид
(R)-N-[5-(4-Изопропилбензолсульфониламино)-1,2,3,4-тетрагидронафтален-2-ил]-пропионамид (0,48 г, 1,20 ммоль) растворили в 10 мл THF и по каплям в течение 20 мин добавили 5 мл (8,36 ммоль) комплекса боран-THF. Полученную смесь три часа перемешивали при кипячении. Раствор охладили, медленно добавили 5 мл 2 N HCl и перемешивали смесь 1 час при 40°С. В охлажденном растворе реакцию остановили водой и затем NaOH (2N), после чего проэкстрагировали этилацетатом. Органическую фазу высушили над MgSO4, профильтровали и фильтрат упарили под вакуумом с получением продукта в виде бесцветного масла (130 мг, 28%).
MS (ESI) m/z: 387,4 [M+H]+
1H-NMR (DMSO-d6): δ [ppm] 7,56 (d, J 8,4, 2H), 7,39 (d, J 8,4, 2H), 6,98 (m, 1H), 6,83 (m, 2H), 2,83 (m, 1H), 2,70-2,52 (m, 3H), 2,37 (m, 1H), 2,15 (m, 1H), 1,75 (m, 1H), 1,40 (m, 2H), 1,15 (d, 6H), 0,82 (t, 3H).
13C-NMR (DMSO-d6): δ [ppm] 153,1 (s), 138,7 (s), 136,6 (s), 135,2 (s), 132,4 (s), 126,8 (d), 126,5 (d), 125,5 (d), 123,2 (d), 52,4 (d), 48,3 (t), 35,2 (t), 33,3 (d), 28,3 (t), 23,5 (q), 23,0 (t), 22,8 (t), 11,8(q).
Пример 6
N-((R)-6-Аллиламино-5,6,7,8-тетрагидронафтален-2-ил)-4-изопропилбензол сульфонамид, гидрохлорид
6.1 Трет-бутиловый эфир ((R)-6-бром-1,2,3,4-тетрагидронафтален-2-ил)-карбаминовой кислоты
(R)-6-Бром-1,2,3,4-тетрагидронафтален-2-иламингидрохлорид (5,25 г, 20 ммоль) растворили в дихлорметане (100 мл). После этого добавили триэтиламин (11,14 мл, 80 ммоль) и ди-трет-бутилдикарбонат (5,45 г, 25 ммоль) и перемешивали реакционную смесь при комнатной температуре одну ночь. После этого смесь проэкстрагировали водным раствором NaHCO3. Органический слой высушили над сульфатом магния, профильтровали и упарили досуха, получив требуемый кристаллический продукт (6,4 г, 98%).
6.2 Трет-бутиловый эфир аллил-((R)-6-Бром-1,2,3,4-тетрагидронафтален-2-ил)-карбаминовой кислоты
Трет-бутиловый эфир ((R)-6-бром-1,2,3,4-тетрагидронафтален-2-ил)-карбаминовой кислоты (3,26 г, 10 ммоль) растворили в диметилформамиде (30 мл). В систему добавили гидрид натрия (50% в масле) (528 мг, 11 ммоль) и перемешивали 15 минут при комнатной температуре. После этого добавили аллил бромид (0,95 мл, 11 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи, после чего добавили Н2О (400 мл) и дважды экстрагировали 150 мл диэтилового эфира. Органический слой высушили над сульфатом магния, профильтровали и упарили досуха, получив "сырой" продукт (3,25 г). "Сырой" продукт очистили хроматографией на силикагеле (с использованием смеси циклогексан/этил ацетат (9:1) в качестве элюента), получив очищенный продукт (2,7 г, 66%).
6.3 Трет-бутиловый эфир аллил-[(R)-6-(4-изопропилбензолсульфониламино)-1,2,3,4-тетрагидронафтален-2-ил]-карбаминовой кислоты
В атмосфере инертного газа (аргон) при комнатной температуре трет-бутиловый эфир аллил-((R)-6-бром-1,2,3,4-тетрагидронафтален-2-ил)-карбаминовой кислоты (2,04 г, 5,5 ммоль) растворили в трифтортолуоле (10 мл). К реакционной смеси добавили трис(дибензилиденацетон) дипалладий (230 мг, 0,25 ммоль) и три-трет-бутилфосфан (152 мг, 0,75 ммоль). В отдельной колбе 4-изопропилбензолсульфонамид (996 мг, 5 ммоль) растворили в трифтортолуоле (20 мл) при 65°С. В эту систему добавили гидрид натрия (50% в масле) (240 мг, 5 ммоль), 5 минут перемешивали и добавили ее к реакционной смеси. Реакционную смесь разделили на 5 сосудов и перемешивали в течение 1 часа при 160°С в микроволновой печи (СЕМ). После объединения смесь упарили досуха, добавили Н2О (50 мл) и трижды проэкстрагировали 50 мл диэтилового эфира. Органический слой высушили над сульфатом магния, профильтровали и упарили досуха, получив 2,8 г "сырого продукта". "Сырой" продукт очистили хроматографией на силикагеле (с использованием смеси циклогексан/этил ацетат (85:15) в качестве элюента), получив очищенный продукт (1,13 г, 45%).
6.4 N-((R)-6-Аллиламино-5,6,7,8-тетрагидронафтален-2-ил)-4-изопропилбензолсульфонамид, гидрохлорид
Трет-бутиловый эфир аллил-((R)-6-Бром-1,2,3,4-тетрагидронафтален-2-ил)-карбаминовой кислоты (2,04 г, 5,5 ммоль) растворили в дихлорметане (50 мл). Добавили трифторуксусную кислоту (2 мл) и реакционную смесь перемешивали при комнатной температуре 3 часа. Затем ее упарили досуха, добавили этилацетат (100 мл) и проэкстрагировали NaOH (2M). Органический слой высушили над сульфатом магния, профильтровали и упарили досуха, получив 790 мг неочищенного продукта. "Сырой" продукт очистили хроматографией на силикагеле (с использованием смеси этилацетат/метанол (90:10) в качестве элюента), получив очищенный продукт (300 мг, 30% выход).
50 мг этого продукта растворили в диэтиловом эфире и дихлорметане. Добавили раствор 1 N HCl в диэтиловом эфире и после образования осадка упарили суспензию в условиях пониженного давления, получив 36 мг белого осадка.
ESI-MS: 385,1 [М+Н]+
1H-NMR (DMSO-d6): δ [ppm] 10,2 (s, 1H), 9,2 (bs, 2H), 7,7 (d, 2H), 7,4 (d, 2H), 7,0 (d, 1H), 6,9 (d, 1H), 6,8 (s, 1H), 6,0 (m, 1H), 5,5 (d, 1H), 5,4 (d, 1H), 3,7 (d, 2H), 3,3 (bs, 1H), 3,1 (dd, 1H), 2,9 (m, 1H), 2,7 (m, 3H), 2,2 (m, 1H), 1,7 (m, 1H), 1,2 (d, 6H).
Пример 7
N-((S)-6-Аллиламино-5,6,7,8-тетрагидронафтален-2-ил)-4-изопропилбензолсульфонамид, гидрохлорид
7.1 Трет-бутиловый эфир ((S)-6-Бром-1,2,3,4-тетрагидронафтален-2-ил)-карбаминовой кислоты
(S)-6-Бром-1,2,3,4-тетрагидронафтален-2-иламингидрохлорид (3,94 г, 15 ммоль) растворили в дихлорметане (75 мл). После этого в реакционную смесь добавили триэтиламин (8,32 мл, 60 ммоль) и ди-трет-бутилдикарбонат (4,09 г, 18,75 ммоль) и перемешивали ее при комнатной температуре в течение ночи. Реакционную смесь проэкстрагировали водным раствором NaHCO3. Органический слой высушили над сульфатом магния, профильтровали и упарили досуха, получив требуемый кристаллический продукт (4,85 г, 99%).
7.2 Трет-бутиловый эфир аллил-((S)-6-Бром-1,2,3,4-тетрагидронафтален-2-ил)-карбаминовой кислоты
Трет-бутиловый эфир ((S)-6-бром-1,2,3,4-тетрагидронафтален-2-ил)-карбаминовой кислоты (4,85 г, 14,87 ммоль) растворили в диметилформамиде (40 мл). В систему добавили гидрид натрия (50% в масле) (785 мг, 16,35 ммоль) и перемешивали смесь 15 минут при комнатной температуре. После этого добавили аллил бромид (1,41 мл, 16,35 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Затем к ней добавили H2O (500 мл) и трижды проэкстрагировали 100 мл диэтилового эфира. Органический слой высушили над сульфатом магния, профильтровали и упарили досуха, получив 5,5 г неочищенного продукта. "Сырой" продукт очистили хроматографией на силикагеле (с использованием смеси циклогексан/этилацетат (95:5) в качестве элюента), получив очищенный продукт (3,9 г, 68%).
7.3 Трет-бутиловый эфир аллил-[(S)-6-(4-изопропилбензолсульфониламино)-1,2,3,4-тетрагидронафтален-2-ил]-карбаминовой кислоты
В атмосфере инертного газа (аргон) при комнатной температуре трет-бутиловый эфир ((S)-6-бром-1,2,3,4-тетрагидронафтален-2-ил)-карбаминовой кислоты (1,94 г, 5,3 ммоль) растворили в трифтортолуоле (10 мл). К реакционной смеси добавили трис(дибензилиденацетон)дипалладий (230 мг, 0,25 ммоль) и три-трет-бутилфосфан (152 мг, 0,75 ммоль). В отдельной колбе 4-изопропилбензолсульфонамид (996 мг, 5 ммоль) растворили в трифтортолуоле (20 мл) при 65°С. В эту систему добавили гидрид натрия (50% в масле) (240 мг, 5 ммоль), 5 минут перемешивали и добавили ее к реакционной смеси. Реакционную смесь разделили на 8 сосудов и перемешивали в течение 1 часа при 150°С в микроволновой печи (СЕМ). После объединения смесь упарили досуха, добавили Н2О (50 мл) и трижды проэкстрагировали 50 мл диэтилового эфира. Органический слой высушили над сульфатом магния, профильтровали и упарили досуха, получив 4,3 г "сырого продукта". "Сырой" продукт очистили хроматографией на силикагеле (с использованием смеси циклогексан/этилацетат (85:15) в качестве элюента), получив очищенный продукт (1,5 г, 50% чистоты, выход 31%).
7.4 N-((S)-6-Аллиламино-5,6,7,8-тетрагидронафтален-2-ил)-4-изопропилбензолсульфонамид, гидрохлорид
Трет-бутиловый эфир аллил-[(S)-6-(4-изопропилбензолсульфониламино)-1,2,3,4-тетрагидронафтален-2-ил]-карбаминовой кислоты (1,5 г, 1,5 ммоль) растворили в дихлорметане (50 мл). Добавили трифторуксусную кислоту (2 мл) и реакционную смесь перемешивали при комнатной температуре 3 часа. Затем ее упарили досуха, добавили этилацетат (100 мл) и проэкстрагировали NaOH (2M). Органический слой высушили над сульфатом магния, профильтровали и упарили досуха, получив 1,05 г неочищенного продукта. "Сырой" продукт очистили хроматографией на силикагеле (с использованием смеси этилацетат/метанол (90:10) в качестве элюента), получив очищенный продукт (290 мг, 30% выход).
50 мг этого продукта растворили в диэтиловом эфире и дихлорметане. Добавили раствор 1 N HCl в диэтиловом эфире и после образования осадка упарили суспензию в условиях пониженного давления, получив 36 мг белого осадка.
ESI-MS: 385,1 [М+Н]+
1H-NMR (DMSO-d6): δ [ppm] 10,2 (s, 1H), 9,2 (bs, 2H), 7,7 (d, 2H), 7,4 (d, 2H), 7,0 (d, 1H), 6,9 (d, 1H), 6,8 (s, 1H), 6,0 (m, 1H), 5,5 (d, 1H), 5,4 (d, 1H), 3,7 (d, 2H), 3,1 (dd, 1H), 2,9 (m, 1H), 2,7 (m, 3Н), 2,5 (m, 1H), 2,2 (m, 1H), 1,7 (m, 1H), 1,2 (d, 6H).
Пример 8
4-Изопропил-N-((S)-6-пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-бензолсульфонамид, гидрохлорид
Смесь N-((S)-6-аллиламино-5,6,7,8-тетрагидронафтален-2-ил)-4-изопропилбензолсульфонамида (240 мг, 0,48 ммоль) и 10% палладия на углероде (25 мг) в этилацетате (25 мл) гидрировали одну ночь. Катализатор отфильтровали и растворитель удалили под вакуумом с получением масла (190 мг). Остаток растворили в Н2О (20 мл) и HCl (1N, 1 мл) и дважды проэкстрагировали этиловым эфиром (20 мл). Водную фазу защелочили и проэкстрагировали этилацетатом. Органическую фазу отделили, высушили над сульфатом магния, профильтровали и упарили досуха, получив продукт в виде пены (120 мг, 58%). 50 мг этой пены растворили в дистиллированной Н2О (30 мл) и добавили несколько капель концентрированной HCl. После лиофилизации этого раствора был получен требуемый продукт.
ESI-MS: 387,4 [М+Н]+
1H-NMR (DMSO-d6): δ [ppm] 10,2 (s, 1H), 8,9 (m, 2H), 7,7 (d, 2H), 7,4 (d, 2H), 7,0 (d, 1H), 6,9 (d, 1H), 6,8 (s, 1H), 3,1 (dd, 1H), 3,0 (m 3Н), 2,8 (m, 3Н), 2,5 (m, 1H), 2,2 (m, 1H), 1,7 (m, 3Н), 1,2 (d, 6H), 0,9 (t, 3Н).
Пример 9
N-((S)-6-Аллиламино-5,6,7,8-тетрагидронафтален-2-ил)-4-изопропил-N-метилбензолсульфонамид
9.1 Трет-бутиловый эфир аллил-{(S)-6-[(4-изопропилбензолсульфонил)-метиламино]-1,2,3,4-тетрагидронафтален-2-ил}-карбаминовой кислоты
В атмосфере инертного газа (аргон) при комнатной температуре трет-бутиловый эфир аллил-((S)-6-бром-1,2,3,4-тетрагидронафтален-2-ил)-карбаминовой кислоты растворили в трифтортолуоле (10 мл). К реакционной смеси добавили трис(дибензилиденацетон)дипалладий (92 мг, 0,1 ммоль) и три-трет-бутилфосфан (61 мг, 0,3 ммоль). В отдельной колбе 4-изопропил-N-метилбензолсульфонамид (427 мг, 2 ммоль) растворили в трифтортолуоле (20 мл) при 65°С. В эту систему добавили гидрид натрия (50% в масле) (96 мг, 2 ммоль), 5 минут перемешивали и добавили ее к реакционной смеси. Реакционную смесь разделили на 3 сосуда и перемешивали в течение 1 часа при 150°С в микроволновой печи (СЕМ). После объединения смесь упарили досуха, добавили Н2О (50 мл) и трижды проэкстрагировали 50 мл диэтилового эфира. Органический слой высушили над сульфатом магния, профильтровали и упарили досуха, получив неочищенный продукт (1,12 г, 68%).
9.2 N-((S)-6-Аллиламино-5,6,7,8-тетрагидронафтален-2-ил)-4-изопропил-N-метилбензолсульфонамид
Трет-бутиловый эфир аллил-{(S)-6-[(4-изопропилбензолсульфонил)-метил амино]-1,2,3,4-тетрагидронафтален-2-ил}-карбаминовой кислоты (672 мг, 1,35 ммоль) растворили в дихлорметане (30 мл). В систему добавили трифторуксусную кислоту (1 мл) и реакционную смесь перемешивали при комнатной температуре в течение ночи. После этого реакционную смесь упарили досуха, добавили этилацетат (100 мл) и проэкстрагировали смесь NaOH (2M). Органический слой высушили над сульфатом магния, профильтровали и упарили досуха, получив 1,05 г неочищенного продукта. "Сырой" продукт растворили в этилацетате (20 мл), после чего собрали осадок, получив требуемое соединение (270 мг, 50%). Маточный раствор упарили под вакуумом, получив продукт в виде масла (840 мг, чистота 54%).
ESI-MS: 399,1 [М+Н]+
1H-NMR (CDC3): δ [ppm] 9,8 (bs, 2H), 7,5 (d, 2H), 7,3 (d, 2H), 7,0 (d, 1H), 6,9 (s, 1H), 6,8 (dd, 1H), 6,0 (m, 1H), 5,5 (m, 2H), 3,7 (m, 2H), 3,4 (m, 1H), 3,2 (dd, 1H), 3,1 (s, 3Н), 3,0-2,8 (m, 4H), 2,3 (m, 1H), 1,9 (m, 1H), 1,3 (d, 6H).
Пример 10
4-Изопропил-N-метил-N-((S)-6-пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-бензолсульфонамид
Смесь N-((S)-6-аллиламино-5,6,7,8-тетрагидронафтален-2-ил)-4-изопропил-N-метилбензолсульфонамида (840 мг, чистота 54%, 1,13 ммоль) и 10% палладия на углероде (50 мг) в этилацетате (25 мл) гидрировали в течение ночи. Катализатор отфильтровали и растворитель удалили под вакуумом, получив продукт в виде масла (720 мг). "Сырой" продукт растворили в этилацетате (20 мл) и собрали осадок, получив требуемое соединение (100 мг, 22%).
ESI-MS: 401,2 [М+Н]+
1H-NMR (COCl3): δ [ppm] 9,5 (bs, 2H), 7,5 (d, 2H), 7,3 (d, 2H), 7,0 (d, 1H), 6,9 (s, 1H), 6,8 (d, 1H), 3,4 (m, 1H), 3,2 (dd, 1H), 3,1 (s, 3Н), 3,0-2,8 (m, 6H), 2,3 (m, 1H), 1,9 (m, 1H), 1,8 (m, 2H), 1,3 (d, 6H), 1,0 (t, 3Н).
Пример 11 (ссылка)
N-[3-(4-трифторметоксибензолсульфониламино)-5,6,7,8-тетрагидрохинолин-7-ил]-пропионамид и его 5-региоизомер
11.1 Бензиловый эфир (3-оксоциклогексил)-карбаминовой кислоты
Пентагидрат нитрата висмута (1,02 г, 2,10 ммоль) добавили к смеси бензилкарбаминовой кислоты (3,2 г, 21,16 ммоль) и циклогекс-2-енона (2 мл, 20,59 ммоль) в CH2Cl2 (2 мл). Полученную густую смесь тщательно перемешивали при комнатной температуре в течение ночи. Затем к реакционной смеси добавили CH2Cl2 (20 мл) и профильтровали через слой целита. Фильтрат промыли насыщенным раствором NaHCO3. Органический слой высушили над Na2SO4 и упарили. Очистка "сырого" продукта методом флеш-хроматографии (гептан:этилацетат, 3:1) позволила получить заявленное соединение (4,81 г, 94%) в виде бледно-желтой клейкой смолы.
MS (ESI+) m/z=248,3 [М+Н]+
1H NMR (400 MHz, CDCl3: δ (ppm) 1,71 (m, 2H), 1,97 (m, 1H), 2,10 (m, 1H), 2,27 (m, 2H), 2,37 (m, 1H), 2,71 (dd, J=14,0, 4,4 Hz, 1H), 3,99 (bs, 1H), 4,77 (bs, 1H), 5,09 (s, 2H), 7,35 (m, 5H).
11.2 Бензиловый эфир (3-нитро-5,6,7,8-тетрагидрохинолин-5 и 7-ил)-карбаминовой кислоты
Смесь 1-метил-3,5-динитро-2-пиридона (3,66 г, 18,38 ммоль) и бензилового эфира (3-оксоциклогексил)-карбаминовой кислоты (4,55 г, 18,39 ммоль) в метанольном растворе аммония (1 M, 140 мл) нагревали при 65°С в течение 1,5 часов. Затем реакционную смесь сконцентрировали и добавили CH2Cl2. Органический слой промыли H2O (×2), высушили над Na2SO4 и упарили. Остаток очистили хроматографией на силикагеле (гептан:этилацетат, 3:1), получив смесь региоизомеров 5 и 7 в соотношении 1/2 (4,51 г, 75% по результатам двух этапов) в виде светло-желтой клейкой смолы.
MS (ESI+) m/z=328,1 [М+Н]+
1H NMR (400 MHz, CDCl3: δ (ppm) 1,83 (m, 1,5H), 2,01 (m, 1H), 2,20 (m, 1,5H), 2,90 (dd, J=18,1, 8,7 Hz, 1H), 3,00 (t, J=6,4 Hz, 2H), 3,05 (t, J=6,4 Hz, 1H), 3,43 (dd, J=18,1, 5,2 Hz, 1H), 4,16 (m, 1H), 4,81 (bs, 1H), 5,03 (bs, 1H), 5,12 (s, 2H), 5,19 (s, 1H), 7,36 (m, 7,5 H), 8,19 (bs, 1H), 8,46 (bs, 0,5H), 9,20 (d, J=1,9 Hz, 1H), 9,23 (d, J=2,1 Hz, 0,5H).
11.3 Бензиловый эфир [3-(4-трифторметоксибензолсульфониламино)-5,6,7,8-тетрагидрохинолин-5 и 7-ил]-карбаминовой кислоты
Бензиловый эфир (3-нитро-5,6,7,8-тетрагидрохинолин-5 и 7-ил)-карбаминовой кислоты (1 г, 3,05 ммоль) растворили в EtOH (25 мл) и добавили SnCl2·2H2O (3,44 г, 15,24 ммоль). Полученную смесь кипятили 14 часов, затем растворитель упарили в вакууме. Остаток растворили в этилацетате и последовательно промыли 2N водным раствором NaOH (×2) и водой. Органический слой высушили над Na2SO4, профильтровали через слой целита и упарили. Затем "сырой" продукт растворили в CH2Cl2 (60 мл) и пиридине (370 мкл, 4,53 ммоль), после чего прибавили по каплям 4-(трифторметокси)бензолсульфонилхлорид (620 мкл, 3,65 ммоль). Перемешивали реакционную смесь при комнатной температуре в течение ночи, после этого разбавили CH2Cl2 и последовательно промыли 1N водным раствором HCl, насыщенным раствором NaHCO3 и водой. Органический слой высушили над Na2SO4 и упарили. Остаток очистили хроматографией на силикагеле (гептан:этилацетат, 1:1), получив смесь региоизомеров 5 и 7 в соотношении 1/2 (1,32 г, 83% по результатам двух этапов) в виде бледно-желтой клейкой смолы.
MS (ESI+) m/z=522,2 [М+Н]+
1H NMR (400 MHz, CDCl3): δ (ppm) 1,74 (m, 1,5H), 1,89 (m, 1H), 2,08 (m, 1,5H), 2,72 (dd, J=17,2, 8,6 Hz, 1H), 2,82 (m, 3Н), 3,21 (dd, J=17,2, 5,0 Hz, 1H), 4,06 (m, 1H), 4,86 (d, J=7,2 Hz, 1,5H), 5,10 (m, 3,5H), 7,23 (d, J=8,5 Hz, 1H), 7,27 (d, J=8,5 Hz, 2H), 7,34 (m, 8,5H), 7,47 (s, 0,5H), 7,81 (d, J=8,6 Hz, 3H), 7,99 (s, 1H), 8,15 (s, 0,5H).
11.4 N-[3-(4-трифторметоксибензолсульфониламино)-5,6,7,8-тетрагидрохинолин-7-ил]-пропионамид и его 5-региоизомер
10% Pd/C (150 мг) суспендировали в растворе бензилового эфира [3-(4-трифторметоксибензолсульфониламино)-5,6,7,8-тетрагидрохинолин-5 и 7-ил]-карбаминовой кислоты (558 мг, 1,07 ммоль) в МеОН (25 мл). Полученную смесь перемешивали в атмосфере Н2 (1 атм) при комнатной температуре в течение 3 часов, затем профильтровали через слой целита и сконцентрировали в вакууме, получив свободное основание. Это основание растворили в THF (20 мл) и охладили раствор до 0°С. Затем добавили пропионил хлорид (94 мкл, 1,07 ммоль) и триэтиламин (150 мкл, 1,07 ммоль), смеси дали нагреться до 20°С и перемешивали в течение 2 часов. После этого смесь разбавили CH2Cl2 и последовательно промыли 1N водным раствором HCl, насыщенным раствором NaHCO3 и водой. Органический слой высушили над Na2SO4 и упарили. Остаток очистили хроматографией на силикагеле (гептан:этилацетат, 1:4) получив заявленное соединение (268 мг, 56% по результатам двух этапов) в виде белого твердого вещества и его 5-региоизомер (130 мг, 27% по результатам двух этапов) в виде клейкой смолы.
N-[3-(4-трифторметоксибензолсульфониламино)-5,6,7,8-тетрагидрохинолин-7-ил]-пропионамид:
MS (ESI+) m/z=444,0 [М+Н]+
1H NMR (400 MHz, COCl3): δ (ppm) 1,17 (t, J=7,6 Hz, 3H), 1,71 (m, 1H), 2,08 (m, 1Н), 2,23 (q, J=7,6 Hz, 2H), 2,68 (dd, J=17,1, 9,2 Hz, 1H), 2,82 (m, 2H), 3,18 (dd, J=17,2, 5,2 Hz, 1H), 4,28 (m, 1H), 5,51 (d, J=7,6 Hz, 1H), 7,29 (d, J=8,3 Hz, 2H), 7,34 (d, J=1,7 Hz, 1H), 7,82 (d, J=8,8 Hz, 2H), 8,02 (d, J=2,0 Hz, 1H).
N-[3-(4-трифторметоксибензолсульфониламино)-5,6,7,8-тетрагидрохинолин-5-ил]-пропионамид:
MS (ESI+) m/z=444,0 [M+H]+
1H NMR (400 MHz, COCl3): δ (ppm) 1,19 (t, J=7,6 Hz, 3H), 1,70 (m, 2H), 1,92 (m, 2H), 2,07 (m, 1H), 2,25 (m, 2H), 2,88 (m, 2H), 5,16 (dd, J=14,0, 8,2 Hz, 1H), 5,69 (d, J=8,7 Hz, 1H), 7,29 (d, J=8,4 Hz, 2H), 7,41 (bs, 1H), 7,85 (d, J=8,8 Hz, 2H), 8,18 (d, J=1,8 Hz, 1H).
Пример 12 (ссылка)
N-(7-Пропиламино-5,6,7,8-тетрагидрохинолин-3-ил)-4-трифторметоксибензолсульфонамид
К раствору N-[3-(4-трифторметоксибензолсульфониламино)-5,6,7,8-тетрагидрохинолин-7-ил]-пропионамида (260 мг, 0,58 ммоль) в THF (10 мл) добавили по каплям 1М ВН3·ТНF (5,8 мл), после чего перемешивали смесь при комнатной температуре в течение 6 часов. Реакцию остановили путем осторожного добавления 1N HCl (10 мл) и 4 часа кипятили полученный раствор с обратным холодильником. Затем раствор охладили до комнатной температуры, добавили раствор 2 N NaOH до рН ~8 и разбавили CH2Cl2. Органический слой отделили, высушили над Na2SO4 и упарили под вакуумом, получив "сырой" продукт, который затем очистили методом флеш-хроматографии (CH2Cl2:МеОН, 95:5), выделив заявленное соединение (160 мг, 64%) в виде белого твердого вещества.
MS (ESI+) m/z=430,1 [M+H]+
1H NMR (400 MHz, COCl3): δ (ppm) 0,93 (t, J=7,4 Hz, 3Н), 1,53 (m, 2H), 1,65 (m, 1H), 2,04 (m, 1H), 2,69 (m, 4H), 2,84 (m, 1H), 3,10 (m, 2H), 3,67 (bs, 2H), 7,27 (m, 3Н), 7,81 (d, J=8,6 Hz, 2H), 7,95 (bs, 1H).
Пример 13 (ссылка)
N-(5-Пропиламино-5,6,7,8-тетрагидрохинолин-3-ил)-4-трифторметоксибензолсульфонамид
Следуя описанной выше методике, N-[3-(4-трифторметоксибензол сульфониламино)-5,6,7,8-тетрагидрохинолин-5-ил]-пропионамид (120 мг, 0,27 ммоль) в THF (10 мл) обработали 1М ВН3·ТНF (2,7 мл). Очистка "сырого" продукта методом флеш-хроматографии (гептан: этилацетат, 1:2) позволила получить заявленное соединение (66 мг, 57%) в виде белого твердого вещества.
MS (ESI+) m/z=430,1 [М+Н]+
1H NMR (400 MHz, (CD3)2SO): δ (ppm) 0,85 (t, J=7,4 Hz, 3Н), 1,40 (m, 3Н), 1,67 (m, 2H), 2,86 (m, 2H), 2,43 (m, 2H), 2,68 (m, 2H), 3,68 (bs, 1H), 7,46 (d, J=2,0 Hz, 1H), 7,53 (d, J=8,4 Hz, 2H), 7,85 (d, J=8,8 Hz, 2H), 8,04 (d, J=2,3 Hz, 1H).
Пример 14
N-[3-(4-Изопропилбензолсульфониламино)-5,6,7,8-тетрагидрохинолин-7-ил]-пропионамид и N-[3-(4-Изопропилбензолсульфониламино)-5,6,7,8-тетрагидрохинолин-5-ил]-пропионамид (ссылка)
14.1 Бензиловый эфир [3-(4-изопропилбензолсульфониламино)-5,6,7,8-тетрагидрохинолин-5 и 7-ил]-карбаминовой кислоты и его 5-региоизомер
Следуя процедуре, описанной в примере 11,3, раствор бензилового эфира (3-нитро-5,6,7,8-тетрагидрохинолин-5 и 7-ил)-карбаминовой кислоты (1 г, 3,05 ммоль) в EtOH (25 мл) обработали SnCl2·2H2O (3,44 г, 15,24 ммоль). Полученный амин растворили в CH2Cl2 (50 мл) и обработали пиридином (500 мкл, 6,13 ммоль) и 4-изопропилбензолсульфонилхлоридом (655 мкл, 3,65 ммоль). Очистка "сырого" продукта методом флеш-хроматографии (гептан: этилацетат, 1:1) позволила получить смесь региоизомеров 5 и 7 в соотношении 1/2 (872 мг, 60% по результатам двух этапов) в виде бледно-желтой клейкой смолы.
MS (ESI+) m/z=480,1 [М+Н]+.
14.2 N-[3-(4-Изопропилбензолсульфониламино)-5,6,7,8-тетрагидрохинолин-7-ил]-пропионамид и N-[3-(4-Изопропилбензолсульфонил амино)-5,6,7,8-тетрагидрохинолин-5-ил]-пропионамид
Следуя описанной выше процедуре, бензиловый эфир [3-(4-изопропилбензолсульфониламино)-5,6,7,8-тетрагидрохинолин-5 и 7-ил]-карбаминовой кислоты 412 мг, 0,86 ммоль) в МеОН (18 мл) гидрировали в присутствии 10% Pd/C (100 мг) в атмосфере Н2 (1 атм). Полученный амин растворили в ТНF (15 мл) и обработали пропионил хлоридом (75 мкл, 0,86 ммоль) и триэтиламином (120 мкл, 0,86 ммоль). Очистка "сырого" продукта методом флеш-хроматографии (гептан: этилацетат, 1:9) позволила получить заявленное соединение (290 мг, 58% по результатам двух этапов) в виде белого твердого вещества и его 5-региоизомер (136 мг, 27% по результатам двух этапов) также в виде белого твердого вещества,
N-[3-(4-Изопропилбензолсульфониламино)-5,6,7,8-тетрагидрохинолин-7-ил]-пропионамид:
MS (ESI+) m/z=402,1 [М+Н]+
1H NMR (400 MHz, CDCl3): δ (ppm) 1,16 (t, J=7,6 Hz, 3H), 1,24 (d, J=6,9 Hz, 6Н), 1,72 (m, 1H), 2,07 (m, 1H), 2,21 (q, J=7,6 Hz, 2H), 2,68 (dd, J=17,1, 8,9 Hz, 1H), 2,81 (m, 2H), 2,95 (m, 1H), 3,17 (dd, J=17,1, 5,2 Hz, 1H), 4,30 (m, 1H), 5,53 (d, J=7,6 Hz, 1H), 7,31 (d, J=8,3 Hz, 2H), 7,35 (d, J=1,9 Hz, 1H), 7,68 (d, J=8,4 Hz, 2H), 7,99 (d, J=2,1 Hz, 1H).
N-[3-(4-Изопропилбензолсульфониламино)-5,6,7,8-тетрагидрохинолин-5-ил]-пропионамид:
MS (ESI+) m/z=402,1 [M+H]+
1H NMR (400 MHz, CDCl3: δ (ppm) 1,19 (t, J=7,6 Hz, 3H), 1,24 (d, J=7,0 Hz, 6H), 1,70 (m, 2H), 1,91 (m, 2H), 2,06 (m, 1H), 2,26 (q, J=7,6 Hz, 2H), 2,86 (m, 2H), 2,94 (m, 1H), 5,16 (dd, J=13,8, 8,2 Hz, 1H), 5,75 (d, J=8,7 Hz, 1H), 7,31 (d, J=8,3 Hz, 2H), 7,41 (d, J=2,1 Hz, 1H), 7,71 (d, J=8,4 Hz, 2H), 8,14 (d, J =2,3 Hz, 1H).
Пример 15
4-Изопропил-N-(7-пропиламино-5,6,7,8-тетрагидрохинолин-3-ил)-бензолсульфонамид
Следуя процедуре, описанной выше, N-[3-(4-изопропилбензолсульфониламино)-5,6,7,8-тетрагидрохинолин-7-ил]-пропионамид (90 мг, 0,22 ммоль) в THF (5 мл) обработали 1М BH3.THF (2,2 мл). Очистка "сырого" продукта методом флеш-хроматографии (CH2Cl2:МеОН, 95:5) позволила получить заявленное соединение (52 мг, 60%) в виде белого твердого вещества.
MS (ESI+) m/z=388,1 [М+Н]+
1H NMR (400 MHz, CDCl3): δ (ppm) 0,94 (t, J=7,4 Hz, 3H), 1,24 (d, J=6,9 Hz, 6H), 1,56 (m, 2H), 1,66 (m, 1H), 2,06 (m, 1H), 2,72 (m, 4H), 2,85 (dt, J=17,1, 5,3 Hz, 1H), 2,94 (m, 1H), 3,06 (m, 1H), 3,14 (dd, J=16,8, 4,6 Hz, 1H), 3,62 (bs, 2H), 7,30 (d, J=8,3 Hz, 2H), 7,32 (d, J=2,1 Hz, 1H), 7,68 (d, J=8,4 Hz, 2H), 7,94 (d, J=2,3 Hz, 1H).
Пример 16 (ссылка)
4-Изопропил-N-(5-пропиламино-5,6,7,8-тетрагидрохинолин-3-ил)-бензолсульфонамид
Следуя процедуре, описанной выше, N-[3-(4-изопропилбензолсульфониламино)-5,6,7,8-тетрагидрохинолин-5-ил]-пропионамид (136 мг, 0,33 ммоль) в THF (10 мл) смешали с 1М ВН3·ТНF (3,3 мл). Очистка "сырого" продукта методом флеш-хроматографии (гептан:этилацетат, 1:2) позволила получить заявленное соединение (74 мг, 56%) в виде белого твердого вещества.
MS (ESI+) m/z=388,1 [М+Н]+
1H NMR (400 MHz, CDCl3): δ (ppm) 0,94 (t, J=7,4 Hz, 3Н), 1,24 (d, J=6,9 Hz, 6H), 1,51 (m, 2H), 1,75 (m, 3Н), 1,96 (m, 3Н), 2,59 (m, 2H), 2,86 (m, 3Н), 3,73 (m, 1H), 7,30 (d, J=8,3 Hz, 2H), 7,68 (d, J=1,9 Hz, 1H), 7,68 (d, J=8,3 Hz, 2H), 8,02 (d, J=2,2 Hz, 1H).
Пример 17
N-[6-(4-Изопропилбензолсульфониламино)-хроман-3-ил]-пропионамид
17.1 N-Хроман-3-илпропионамид
Раствор хроман-3-иламина (5,00 г, 33,5 ммоль) и триэтиламина (5,09 г, 50,27 ммоль) в THF (70 мл) перемешали при -5°С и затем по каплям добавили пропионовый ангидрид (4,36 г, 33,5 ммоль). После этого смесь перемешивали в течение 2 часов при комнатной температуре, растворитель удалили и добавили смесь этилацетата/воды. Органический слой промыли раствором лимонной кислоты (5%) и высушили над MgSO4. Отфильтрованный раствор сконцентрировали, получив желто-коричневое твердое вещество (5,40 г, 78%).
MS(ESI) m/z: 206,1 [M+H]+
1H-NMR (CDCl3): δ [ppm] 7,15 (t, 1H), 7,06 (d, 1H), 6,88 (t, 1H), 6,82 (d, 1H), 5,76 (br s, 1H), 4,50 (m, 1H), 4,12 (m, 2H), 3,12 (dd, 1H), 2,72 (d, 1H), 2,16 (q, 2H), 1,25 (t, 3H).
17.2 N-(6-Нитрохроман-3-ил)-пропионамид
Нитрование проводили согласно вышеописанной процедуре. Продукт был получен в виде масла красного цвета (1,40 г).
MS(ESI) m/z: 251,1 [М+Н]+
1H-NMR (DMSO-d6): δ [ppm] 8,07 (s, 1H), 8,00 (m, 2H), 6,97 (d, 1H), 4,22 (m, 2H), 3,12 (dd, 1H), 2,80 (dd, 1H), 2,14 (q, 2H), 1,16 (t, 3H).
17.3 N-(6-Аминохроман-3-ил)-пропионамид
Восстановление с помощью SnCl2 проводили согласно вышеописанной процедуре. Продукт был получен в виде коричневого твердого вещества (3,63 г, 65%).
MS (ESI) m/z: 221,1 [M+H]+
17.4 - [6-(4-Изопропилбензолсульфониламино)-хроман-3-ил]-пропионамид
Связывание сульфонамида проводили согласно вышеописанной процедуре. Продукт был получен в виде желтого масла (0,46 г, 31%).
MS (ESI) m/z: 403,1 [M+H]+
1H-NMR (DMSO-d6): δ [ppm] 7,66 (d, J 8,2, 2H), 7,39 (d, J 8,2, 2H), 7,00 (s, 1H), 6,81 (m, 2H), 6,70 (m, 1H), 5,83 (d, 1H), 4,40 (m, 1H), 2,92 (m, 2H), 2,65 (m, 1H), 2,15 (m, 2H), 1,15 (m, 9H).
Пример 18
4-Изопропил-N-(3-пропиламинохроман-6-ил)-бензолсульфонамид
N-[6-(4-Изопропилбензолсульфониламино)-хроман-3-ил]-пропионамид (0,48 г, 1,20 ммоль) растворили в THF (5 мл), после чего к перемешиваемой суспензии по каплям добавили LiAlH4 (0,43 г, 11,3 ммоль) в THF (5 мл) при 0°С. Полученную смесь перемешивали при комнатной температуре в течение 18 часов. Раствор нагрели и кипятили 3 часа, охладили и остановили реакцию добавлением воды и 2 N HCl. Смесь проэкстрагировали этилацетатом, органическую фазу высушили над MgSO4 и профильтровали. Фильтрат упарили в вакууме, получив продукт, который затем был очищен с помощью препаративной HPLC (20-90% МеОН). В результате выделено 10 мг (6%) белого твердого вещества
MS (ESI) m/z: 389,1 [М+Н]+
ПРИМЕР 19
N-((4aS,10bS)-4-Аллил-1,2,3,4,4а,5,6,100b-октагидробензо[f]хинолин-8-ил)-4-изопропилбензолсульфонамид
19.1 4aS, 10bS)-8-Нитро-1,2,3,4,4а,5,6,10b-октагидробензо [f]хинолин
Транс-(4а,10b)-1,2,3,4,4а,5,6,10b-октагидробензо[f]хинолин (5,00 г, 26,7 ммоль) растворили в концентрированной H2SO4 (14,2 мл) и охладили смесь до 5°С. После перемешивания в течение 15 минут небольшими порциями добавляли сухой нитрат калия (2,90 г, 29,0 ммоль) таким образом, чтобы температура оставалась ниже 5°С. Реакционную смесь перемешивали при 5°С в течение часа, затем позволили нагреться до комнатной температуры и перемешивали еще 18 часов. Реакционную смесь вылили на лед (200 г) и собрали желтый осадок (3,92 г). Этот осадок идентифицировали как сернокислую соль требуемого продукта. рН раствора довели до 11-50% NaOH/H2O, проэкстрагировали этилацетатом (150 мл), органический слой отделили и высушили над MgSO4. Отфильтрованный раствор сконцентрировали, получив масло красного цвета (1,96 g). Общий выход составил 76%.
MS(ESI) m/z: 233,1 [М+Н]+
1H-NMR (DMSO-d6): δ [ppm] региоизомеры 8,08-7,95 (m, 1H), 7,73-7,58 (m, 1H), 7,41 (m, 1H), 3,05 (m, 3Н), 2,60 (m, 2H), 2,42 (m, 2H), 1,92 (m, 1H), 1,80 (m, 1H), 1,64 (m, 2H), 1,22 (m, 1H).
19.2 (4аS,10bS)-4-Аллил-8-нитро-1,2,3,4,4а,5,6,10b-октагидробензо[f]хинолин
(4aS,10bS)-8-Нитро-1,2,3,4,4а,5,6,10b-октагидробензо[f]хинолин (0,50 г, 1,51 ммоль) растворили в THF (30 мл) и добавили аллилбромид (0,40 г, 3,30 ммоль). Раствор перемешивали при 50°С в течение 8 часов, затем при комнатной температуре в течении 18 часов, а потом упарили. Остаток распределили между этилацетатом и NaOH (2M) и органический слой отделили и высушили над MgSO4. Отфильтрованный раствор сконцентрировали и очистили методом колоночной хроматографии (дихлорметан:0-3% МеОН), получив продукт в виде желтого масла (0,40 г, 97%).
MS (ESI) m/z: 273,2 [M+H]+
19.3 4aS, 10bS)-4-Аллил-1,2,3,4,4a,5,6,10b-октагидробензо [f]хинолин-8-иламин
(4aS,10bS)-4-Аллил-8-нитро-1,2,3,4,4a,5,6,10b-октагидробензо[f]хинолин (0,85 г, 3,12 ммоль) растворили в МеОН (50 мл) и добавили хлорид олова (3,50 г, 15,5 ммоль). Раствор нагрели и кипятили 3 часа, затем упарили. Остаток распределили между этилацетатом и NaOH (2M), органический слой отделили и высушили над MgSO4. Отфильтрованный раствор сконцентрировали и очистили методом препаративной HPLC (20-90% МеОН), получив 3 амино изомеры. Продукт был получен в виде желтого масла (0,35 г, 46%).
MS (ESI) m/z: 243,3 [M+H]+
1H-NMR (DMSO-d6): δ [ppm] 6,90 (d, 1H), 6,35 (d, 1H), 6,25 (s, 1H), 5,87 (m, 1H), 5,12 (m, 2H), 3,42 (m, 1H), 3,04 (m, 1H), 2,90 (m, 1H), 2,64 (m, 2H), 2,34 (m, 2H), 2,13 (m, 2H), 1,95 (m, 1H), 1,62 (m, 2H), 1,39 (m, 1H), 1,00 (m, 1H),
13C-NMR (DMSO-d6): δ [ppm] 146,1 (s), 135,7 (s), 135,3 (d), 126,4 (s), 125,6 (d), 117,1 (t), 113,2 (d), 112,2 (d), 63,9 (d), 55,4 (t), 52,8 (t), 41,3 (d), 29,4 (t), 28,6 (t), 26,3 (t), 24,9 (t).
19.4 N-((4aS,10bS)-4-Аллил-1,2,3,4,4а,5,6,10b-октагидробензо[f]хинолин-8-ил)-4-изопропилбензолсульфонамид
(4aS,10bS)-4-Аллил-1,2,3,4,4а,5,6,10b-октагидробензо[f]хинолин-8-иламин (60 мг, 0,23 ммоль) растворили в пиридиндихлорметане (1:2, 7,5 мл) и охладили до 5°С. Добавили 4-изопропилбензолсульфонилхлорид (50 мг, 0,24 ммоль) и 3 часа перемешивали раствор при 5°С. Раствор упарили, остаток распределили между этилацетатом и водой. Органический слой отделили и высушили над MgSO4. Отфильтрованный раствор сконцентрировали и очистили методом колоночной хроматографии (дихлорметан-3% МеОН), получив масло. Это масло растворили в этилацетате, добавили HCl (4M, диоксан) и получили продукт в виде белого твердого вещества (20 мг, 15%).
MS (ESI) m/z: 425,2 [M+H]+
Описанные в примере 19 методики использовались для получения соединений примеров 20 и 21. Эти соединения были охарактеризованы следующими спектрами.
Пример 20
N-((4aS,10bS)-4-Аллил-1,2,3,4,4а,5,6,10b-октагидробензо[f]хинолин-9-ил)-4 -изопропилбензолсульфонамид
20.1 4aS, 10bS)-9-Нитро-1,2,3,4,4а,5,6,10b-октагидробензо[f]хинолин
MS (ESI) m/z: 233,1 [M+H]+
1H-NMR (DMSO-d6): δ [ppm] 8,13 (s, 1H), 8,03 (d, 1H), 7,43 (d, 1H), 4,05 (br s, 1H), 3,38 (m, 1H), 2,97 (m, 3H), 2,64 (m, 1H), 2,15 (d, 1H), 1,99 (m, 1H), 1,88 (m, 2H), 1,46 (m, 2H).
13C-NMR (DMSO-d6): δ [ppm] 146,1 (s), 143,7 (s), 138,2 (d), 130,1 (d), 121,3 (d), 120,6 (d), 56,3 (d), 43,7 (t), 27,6 (t), 26,4 (t), 25,5 (t), 22,1 (t).
20.2 4aS,10bS)-4-Аллил-9-нитро-1,2,3,4,4а,5,6,10b-октагидробензо[f]хинолин
Масса полученного продукта 1,51 г. Выход: 97%
MS (ESI) m/z: 273,0 [M+H]+
20.3 (4aS,10bS)-4-Аллил-1,2,3,4,4a,5,6,10b-октагидробензо[f]хинолин-9-иламин
Масса полученного продукта 0,73 г. Выход 59%
MS (ESI) m/z: 243,3 [M+H]+
1H-NMR (DMSO-d6): δ [ppm] 6,47 (d, 1H), 6,28 (s, 1H), 6,13 (d, 1H), 5,67 (m, 1H), 5,40 (br s, 2H), 4,93 (m, 2H), 3,18 (m, 1H), 2,82 (m, 1H), 2,70 (d, 1H), 2,41 (m, 2H), 2,11 (m, 2H), 1,93 (m, 2H), 1,85 (m, 1H), 1,47 (m, 2H), 1,15 (m, 1H), 0,82 (m, 1H).
13C-NMR (DMSO-d6): δ [ppm] 146,2 (s), 139,1 (s), 135,1 (d), 128,4 (d), 122,8 (s), 117,2 (t), 112,2 (d), 110,9 (d), 63,7 (d), 55,4 (t), 52,7 (t), 41,9 (d), 29,3 (t), 27,6 (t), 26,5 (t), 24,9 (t).
20.4 N-((4aS, 10b8)-4-Аллил-1,2,3,4,4а, 5,6,10b-октагидробензо[f]хинолин-9-ил)-4-изопропилбензолсульфонамид.
Процедура была описана выше. Масса полученного продукта 0,73 г. Выход 45%.
MS (ESI) m/z: 425,2 [M+H]+
1H-NMR (DMSO-d6): δ [ppm] 7,68 (d, 2H), 7,42 (d, 2H), 6,92 (m, 3H), 6,00 (m, 1H), 5,52 (m, 2H), 3,90 (m, 1H), 3,78 (m, 1H), 3,41 (m, 1H), 3,05-2,85 (m, 4H), 2,75 (m, 2H), 2,40 (m, 1H), 2,22 (m, 1H), 2,00 (m, 2H), 1,78 (m, 1H), 1,30 (m, 1H), 1,19 (d, 6H).
Пример 21
N-((4aS,10bS)-4-Аллил-1,2,3,4,4а,5,6,10b-октагидробензо[f]хинолин-7-ил)-4-изопропилбензолсульфонамид
21.1 (4aS,10bS)-4-Аллил-7-нитро-1,2,3,4,4а,5,6,10b-октагидробензо[f]хинолин
Процедура была описана выше, за исключением того, что реакция при комнатной температуре продолжалась 18 часов. Выход 51%.
MS (ESI) m/z: 273,0 [M+H]+
21.2 (4aS,10bS)-4-Аллил-1,2,3,4,4a,5,6,10b-октагидробензо[f]хинолин-7-иламин
Масса полученного продукта 0,85 г. Выход: 46%
MS (ESI) m/z: 243,3 [M+H]+
21.3 N-((4aS,10bS)-4-Аллил-1,2,3,4,4а,5,6,10b-октагидробензо[f]хинолин-7-ил)-4-изопропилбензолсульфонамид
Методика была описана выше. Масса полученного продукта 0,26 г. Выход 53%. Преобразован в соль соляной кислоты.
MS (ESI) m/z: 425,1 [М+Н]+
1H-NMR (DMSO-d6): δ [ppm] 11,38 (br s, 1H), 9,56 (br s, 1H), 7,60 (d, 2H), 7,44 (d, 2H), 7,21 (d, 2H), 7,11 (t, 1H), 6,84 (d, 1H), 6,00 (m, 1H), 5,50 (m, 2H), 3,85 (m, 1H), 3,75 (m, 1H), 3,15 (m, 1H), 2,95 (m, 3H), 2,60 (m, 2H), 2,28 (m, 1H), 2,00 (m, 2H), 1,68 (m, 1H), 1,40 (m, 1H), 1,19 (d, 6H).
13C-NMR (DMSO-d6): δ [ppm] 153,5 (s), 138,0 (s), 134,1 (s), 132,0 (s), 127,0 (d), 126,5 (d), 126,3 (d), 124,6 (t), 124,4 (d), 123,9 (d), 62,8 (d), 53,8 (t), 51,2 (t), 35,2 (t), 33,3 (d), 26,8 (t), 23,3 (q), 22,6 (t), 22,1 (t).
Пример 22
Транс-4-изопропил-N-(1-пропионил-1,2,3,4,4а,5,10,10а-октагидробензо[f]хинолин-7-ил)-бензолсульфонамид
22.1 Транс-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин
Соединение было получено в соответствии с методикой получения (4aR,10aR)-9-метокси-1-метил-6-триметилсиланил-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолина, приведенной в работе Organic Process Research & Development, 2003, 904-12.
ESI-MS: [M+H]+
1H-NMR (CDCl3): δ [ppm] 7,1-8,0 (несколько значений m, 4Н), 3,15 (m, 1H), 3,0 (m, 1H), 2,9 (m, 1H), 2,6-2,8 (несколько значений m, 3H), 2,55 (m, 1H), 2,0 (m, 1H), 1,75 (m, 1H), 1,6 (m, 2H), 1,2 (m, 1H).
1H-NMR (DMSO-d6): δ [ppm] 7,0-7,1 (несколько значений m, 4Н), 2,95 (m, 1H), 2,8 (m, 1H), 2,7 (m, 1H), 2,3-2,6 (несколько значений m, 4H), 1,85 (m, 1H), 1,55 (m, 1H), 1,45 (m, 1H), 1,35 (m, 1H), 1,05 (m, 1H).
22.2 Транс-1-(3,4,4а,5,10,10а-гексагидро-2Н-бензо[g]хинолин-1-ил)-пропан-1-он
5,33 г Транс-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолина (28,46 ммоль) растворили в 70 мл тетрагидрофуран, после чего последовательно добавили 5,76 г триэтиламина (56,9 ммоль) и при -5°С 4,07 г ангидрид пропионовой кислоты (31,3 ммоль) в 10 мл тетрагидрофурана. После перемешивания в течение 2 часов при -5°С к смеси добавили 4 мл концентрированного водного раствора аммиака, реакционную смесь упарили досуха, затем добавили 100 мл этилацетата и промыли систему 60 мл воды. Органический слой высушили над сульфатом магния, профильтровали и упарили досуха, получив 7,79 г требуемого продукта.
ESI-MS: 244,2 [М+Н]+
1H-NMR (COCl3): δ[ppm]
22.3 Транс-1-(7-нитро-3,4,4а,5,10,10а-гексагидро-2Н-бензо[g]хинолин-1-ил)-пропан-1-он
2,5 г Транс-1-(3,4,4а,5,10,10а-гексагидро-2Н-бензо[g]хинолин-1-ил)-пропан-1-она (10,27 ммоль) растворили в 25 мл нитрометана. При температуре от -5°С до -10°С в течение 30 минут добавили смесь 0,71 мл азотной кислоты (10,27 ммоль), 1,5 мл воды и 9,5 мл серной кислоты (170 ммоль). Перемешивание продолжали 1,5 часа при охлаждении, после чего смесь вылили на толченый лед. Водную фазу дважды проэкстрагировали этилацетатом, объединенные органические слои высушили над сульфатом магния, профильтровали и растворитель упарили при пониженном давлении, получив 2,7 г нитрированного продукта в виде смеси нескольких нитро-изомеров, использовавшихся в последующей реакции без дополнительного разделения.
ESI-MS: 289,1 [М+Н]+
22.4 Транс-1-(7-амино-3,4,4а,5,10,10а-гексагидро-2Н-бензо[g]хинолин-1-ил)-пропан-1-он
2,7 г Транс-1-(7-нитро-3,4,4а,5,10,10а-гексагидро-2Н-бензо[g]хинолин-1-ил)-пропан-1-он со всеми региоизомерами (9,36 ммоль) растворили в 100 мл метанола, добавили 11 гдихлорида олова (48,75 ммоль) и реакционную смесь полтора часа перемешивали при кипячении. Метанол удалили и остаток обработали 1N водным раствором гидроксида натрия и этилацетатом, профильтровали через целит, фазы разделили и водную фазу дважды экстрагировали этилацетатом. Объединенные органические слои высушили над сульфатом магния, профильтровали и растворитель упарили при пониженном давлении. "Сырой" продукт очистили методом препаративной HPLC (DeltaPak, диаметр 40 мм, в качестве элюента использовали смесь метанол/вода/1%уксусная кислота), получив 0,04 г 6-амино-изомера, 0,1 г 7-амино-изомера, 0,14 г 8-амино-изомера и 0,19 г 9-амино-изомер.
6-амино-изомер:
ESI-MS: 259,1 [М+Н]+
1H-NMR (CDCl3): δ [ppm] 6,95 (m, 1Н), 6,5 (m, 2H), 3,8 (m, очень широкий, 2Н), 3,55 (m, очень широкий, 2H), 3,1 (m, очень широкий, 2H), 2,6-2,8 (m, 2H), 2,3-2,5 (m, 2H), 2,15 (m, 1Н), 1,7-2,0 (несколько значений m, 4Н), 1,3 (m, 1Н), 1,15 (m, 3H).
7-амино-изомер:
ESI-MS: 259,1 [M+H]+
1H-NMR (CDCl3): δ [ppm] 6,9 (m, 1H), 6,5 (m, 1H), 6,4 (m, 1H), 3,7 (m, очень широкий, 2Н), 3,55 (m, очень широкий, 2Н), 3,1 (m, очень широкий, 2Н), 2,3-2,8 (несколько значений m, 5H), 1,65-2,0 (несколько значений m, 4H), 1,3 (m, 1H), 1,15 (m, 3Н).
8-амино-изомер:
ESI-MS: 259,1 [М+Н]+
1H-NMR (COCl3): δ [ppm] 6,85 (m, 1H), 6,5 (m, 1H), 6,4 (m, 1H), 3,3-4,2 (m, очень широкий, 4H), 3,1 (m, очень широкий, 2Н), 2,55-2,8 (m, 2Н), 2,25-2,5 (m, 3Н), 1,9 (m, 2Н), 1,75 (m, 2Н), 1,25 (m, 1H), 1,15 (m, 3Н).
9-амино-изомер:
ESI-MS: 259,1 [M+H]+
1H-NMR (CDCl3): δ [ppm] 6,95 (m, 1H), 6,5 (m, 2Н), 3,4-4,0 (m, очень широкий, 4H), 3,0-3,3 (m, очень широкий, 2Н), 2,8 (m, 1H), 2,55 (m, 1H), 2,2-2,45 (m, 3Н), 1,95 (m, 2Н), 1,75 (m, 2Н), 1,25 (m, 1H), 1,15 (m, 3Н).
22.5 Транс-4-изопропил-М-(1-пропионил-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-7-ил)-бензолсульфонамид
1,21 г транс-1-(7-амино-3,4,4а,5,10,10а-гексагидро-2Н-бензо[g]хинолин-1-ил)-пропан-1-она (0,38 ммоль) растворили в 2 мл пиридина. При температуре 0-4°С к смеси добавили 0,08 г 4-изопропилбензолсульфонилхлорида (0,4 ммоль), после чего перемешивали ее 1 час при охлаждении. Затем добавили 40 мл водного раствора 1 N соляной кислоты и диэтиловый эфир, фазы разделили и водный слой дважды проэкстрагировали диэтиловым эфиром. Органические фазы объединили, трижды промыли водой, подкисленной 1 N водным раствором соляной кислоты, высушили над сульфатом магния, профильтровали и растворитель упарили при пониженном давлении, получив 0,118 г требуемого продукта.
ESI-MS: 441,1 [М+Н]+
Пример 23
Транс-4-изопропил-N-(1-пропил-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-7-ил)-бензолсульфонамид
0,18 мг транс-4-изопропил-N-(1-пропионил-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-7-ил)-бензолсульфонамида (0,268 ммоль) растворили в 7 мл тетрагидрофурана. В систему добавили 1,4 мл 1 М боран-тетрагидрофуранового комплекса в тетрагидрофуране и смесь полчаса перемешивали при кипячении с обратным холодильником. После этого добавили 2 мл 2 N водного раствора соляной кислоты, смесь еще три часа перемешивали при кипячении и растворитель удалили в условиях пониженного давления. рН воды довели до 9 раствором гидроксида натрия и водную фазу трижды проэкстрагировали диэтиловым эфиром. Объединенные органические слои высушили над сульфатом магния, профильтровали и удалили растворитель. Остаток очистили хроматографией на силикагеле на колонке chromabond с использованием смеси циклогексан/этилацетат 1:3 в качестве элюента, получив 0,0155 г требуемого продукта.
ESI-MS: 427,1 [М+Н]+
1H-NMR (CDCl3): δ [ppm] 7,6 (d, 2H), 7,2 (d, 2H), 6,9 (m, 1H), 6,7 (m, 3H), 3,05 (m, 1H), 2,95 (m, 1H), 2,85 (m, 1H), 2,5-2,75 (несколько значений m, 3H), 2,05-2,5 (несколько значений m, 4Н), 1,8 (m, 1H), 1,6 (m, 3H), 1,45 (m, 2H), 1,2 (m, 6H), 0,8 (m, 3H).
Пример 24
Транс-4-изопропил-N-(1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-7-ил)-бензолсульфонамид
В результате хроматографического разделения продукта, полученного в примере 20, можно получить 0,0227 г вторичного амина.
ESI-MS: 385,1 [М+Н]+
1H-NMR (CDCl3: δ [ppm] 7,7 (d, 2H), 7,25 (d, 2H), 6,9 (m, 1H), 6,75 (m, 2H), 3,1 (m, 1H), 2,9 (m, 1H), 2,8 (m, 1H), 2,7 (m, 2H), 2,6 (m, 2H), 2,35 (m, 1H), 1,9 (m, 1H), 1,7 (m, 1H), 1,6 (m, 1H), 1,45 (m, 1H), 1,2 (m, 6H), 1,1 (m, 1H).
Пример 25
Транс-4-трифторметил-N-(1-пропионил-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-7-ил)-бензолсульфонамид
0,792 г (3,065 ммоль) смеси транс-(7-амино-3,4,4а,5,10,10а-гексагидро-2Н-бензо[g]хинолин-1-ил)-пропан-1-она и транс-(8-амино-3,4,4а,5,10,10а-гексагидро-2Н-бензо[g]хинолин-1-ил)-пропан-1-она (1:1) растворили в 20 мл пиридина. При температуре от 0 до 4°С добавили 0,75 г 4-трифторметил-бензол сульфонилхлорида (3,066 ммоль) и смесь 2 часа перемешивали при охлаждении. Пиридин упарили и остаток распределили между 20% водным раствором лимонной кислоты и диэтиловым эфиром. Водный слой дважды проэкстрагировали диэтиловым эфиром, объединенные органические фазы промыли 20% водным раствором лимонной кислоты, высушили над сульфатом магния, профильтровали и растворитель упарили при пониженном давлении, получив 1,327 г требуемого продукта. MSD: 467,1 г/моль.
ESI-MS: 467,1 [М]+
Пример 26
Транс-4-трифторметил-N-(1-пропил-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-7-ил)-бензолсульфонамид
22,5 мг искомого соединения было получено в результате хроматографической очистки продукта примера 27, в котором описано восстановление смеси 1:1 7- и 8-изомеров соответствующих предшественников пропионала.
Пример 27
Транс-4-трифторметил-N-(1-пропил-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-8-ил)-бензолсульфонамид
К суспензии 0,035 г алюмогидрида лития (0,922 ммоль) в 2,5 мл тетрагидрофурана при 40°С добавили раствор 0,2 г смеси транс-4-трифторметил-N-(1-пропионил-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-7-ил)-бензолсульфонамида и
транс-4-трифторметил-N-(1-пропионил-1,2,3,4,4а,5,10,10а-октагидробензо[g]хинолин-8-ил)-бензолсульфонамида (0,429 ммоль, смесь 1:1) в 2,5 мл тетрагидрофурана. После перемешивания в течение 5 минут при 10°С осторожно добавили 1 мл воды, растворитель упарили и остаток обработали диэтиловым эфиром и водой. Водную фазу реэкстрагировали диэтиловым эфиром, объединенные органические слои высушили над сульфатом магния, профильтровали и упарили растворитель при пониженном давлении. "Сырой" продукт очистили препаративной HPLC (компрессионная колонка, Delta Pack диаметром 40 мм) с использованием в качестве элюента градиента метанол/ вода / 0,1% уксусная кислота; фракция 3, m=31,9 мг (8-изомер), фракция 4.4, m=22,4 мг, фракции 5-7, m=22,5 мг (7-изомер),
ESI-MS: 453,3 [M+H]+
Пример 28
N-((S)-6-Амино-5,6,7,8-тетрагидронафтален-2-ил)-4-изопропилбензолсульфонамид, гидрохлорид
Смесь N-((S)-6-аллиламино-5,6,7,8-тетрагидронафтален-2-ил)-4-изопропилбензолсульфонамида (108 мг, 0,26 ммоль) и 10% палладия на углероде (25 мг) в смеси этилацетата (12 мл) и метанола (3 мл) гидрировали в течение ночи. Катализатор отфильтровали и растворитель удалили в вакууме, получив масло. Масло растворили в дистилированной H2O (30 мл) и добавили несколько капель концентрированной HCI. Полученный раствор лиофилизировали, получив деаллилированный продукт (60 мг, 61%).
ESI-MS: 345,2 [М+Н]+
1H-NMR (DMSO-d6): δ [ppm] 10,2 (bs, 1H), 8,2 (bs, 1H), 7,7 (d, 2H), 7,4 (d, 2H), 7,0 (d, 1H), 6,9 (d, 1H), 6,8 (s, 1H), 3,7 (m, 1H), 3,0 (m, 2H), 2,7 (m, 3Н), 2,1 (m, 1H), 1,7 (m, 1H), 1,2 (d, 6H).
Пример 29
N-((R)-6-Дипропиламино-5,6,7,8-тетрагидронафтален-2-ил)-4-изопропилбензолсульфонамид, гидрохлорид
4-Изопропил-N-((R)-6-пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-бензолсульфонамид (150 мг, 0,39 ммоль) и пропиональдегид (42 мкл, 0,58 ммоль) растворили в THF (20 мл). Последовательно добавили уксусную кислоту (30 мкл, 0,58 ммоль) и трисацетоксиборогидрид натрия (165 мг, 0,78 ммоль) и перемешивали реакционную смесь в течение ночи. Затем реакционную смесь сконцентрировали и остаток растворили в смеси воды (10 мл) и этилацетата (50 мл). рН раствора довели до 9 с помощью NaOH (2М). Органический слой отделили, высушили над сульфатом магния, профильтровали и упарили досуха, получив масло (95 мг). Затем масло растворили в дистилированной Н2О (30 мл) и добавили несколько капель концентрированной HCl. Полученный раствор лиофилизировали, получив требуемый продукт (92 мг, 54%).
ESI-MS: 429,2 [М+Н]+
1H-NMR (DMSO-d6): δ [ppm] 10,2 (s, 1H), 9,9 (bs, 1H), 7,7 (d, 2H), 7,4 (d, 2H), 7,0 (d, 1H), 6,9 (d, 1H), 6,8 (s, 1H), 3,6 (m, 1H), 3,1-2,9 (m, 6H), 2,8 (m, 2H), 2,5 (m, 1H), 2,2 (m, 1H), 1,7 (m, 5H), 1,2 (d, 6H), 0,9 (t, 6H).
Пример 30
N-((S)-6-дипропиламино-5,6,7,8-тетрагидронафтален-2-ил)-4-изопропилбензолсульфонамид, гидрохлорид
4-Изопропил-N-((S)-6-пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-бензолсульфонамид (70 мг, 0,18 ммоль) и пропиональдегид (42 мкл, 0,58 ммоль) растворили в THF (20 мл). Последовательно добавили уксусную кислоту (19 мкл, 0,27 ммоль) и трисацетоксиборогидрид натрия (75 мг, 0,35 ммоль) и перемешивали реакционную смесь в течение ночи. Затем реакционную смесь сконцентрировали и остаток растворили в смеси воды (10 мл) и этилацетата (50 мл). рН раствора довели до 9 с помощью NaOH (2М). Органический слой отделили, высушили над сульфатом магния, профильтровали и упарили досуха, получив продукт в виде масла (95 мг). Масло растворили в дистилированной H2O (30 мл) и добавили несколько капель концентрированной HCl. Полученный раствор лиофилизировали, получив требуемый продукт (21 мг, 25%).
ESI-MS: 429,2 [М+Н]+
1H-NMR (DMSO-d6): δ [ppm] 10,2 (s, 1H), 9,9 (bs, 1H), 7,7 (d, 2H), 7,4 (d, 2H), 7,0 (d, 1H), 6,9 (d, 1H), 6,8 (s, 1H), 3,6 (m, 1H), 3,1-2,9 (m, 6H), 2,8 (m, 2H), 2,5 (m, 1H), 2,2 (m, 1H), 1,7 (m, 5H), 1,2 (d, 6H), 0,9 (t, 6H).
Пример 31
N-[7-(4-трифторметоксибензолсульфониламино)-3,4-дигидро-2Н-пирано[3,2-b]пиридин-3-ил]-пропионамид
31.1 Бензиловый эфир (5-оксотетрагидропиран-3-ил)-карбаминовой кислоты
Следуя процедуре, описанной в примере 11.1, 6Н-пиран-3-он (5 г, 50,96 ммоль) в CH2Cl2 (5 мл) обработали пентагидратом нитрата висмута (5 г, 10,30 ммоль) и бензилкарбаматом (8,5 г, 56,22 ммоль). Очистка "сырого" продукта методом флеш-хроматографии (гептан: этилацетат, 3:1) позволила получить заявленное соединение (8,11 г, 64%) в виде бесцветного масла.
MS (ESI+) m/z=250,1 [М+Н]+
1H NMR (400 MHz, COCl3) δ 2,67 (dd, J=16,6, 2,5 Hz, 1H), 2,75 (dd, J=16,6, 5,4 Hz, 1H), 3,84 (br d, J=11,5 Hz, 1H), 3,92 (dd, J=11,8, 2,7 Hz, 1H), 3,99 (d, J=16,1 Hz, 1H), 4,06 (d, J=16,2 Hz, 1H), 4,30 (br s, 1H), 5,10 (m, 2H), 5,19 (m, 1H), 7,35 (m, 5H);
13C NMR (100 MHz, CDCl3) δ 44,1, 47,9, 67,0, 69,3, 74,9, 128,1 (2С), 128,2, 128,5 (2С), 136,0, 155,4, 204,7.
31.2 Бензил-3,4-дигидро-7-нитро-2Н-пирано[3,2-b]пиридин-3-илкарбамат и бензил 6,8-дигидро-3-нитро-5Н-пирано [3,4-b]пиридин-5-илкарбамат
Раствор бензилового эфира (5-оксотетрагидропиран-3-ил)-карбаминовой кислоты (750 мг, 3 ммоль) и 1-метил-3,5-динитро-2-пиридона (660 г, 3,31 ммоль) в метанольном растворе аммиака (1М, 6 мл) облучали в запаянном сосуде при 120°С в течение 20 минут. Затем смесь сконцентрировали и полученный остаток растворили в CH2Cl2. Органический слой промыли раствором NaHCO3 и затем водой, высушили над Na2SO4 и упарили. Очистка полученного остатка хроматографией на силикагеле (гептан: этилацетат, 3:1) позволила получить смесь бензил 6,8-дигидро-3-нитро-5Н-пирано[3,4-b]пиридин-5-илкарбамата в качестве основного продукта и бензил
3,4-дигидро-7-нитро-2Н-пирано[3,2-b]пиридин-3-илкарбамата в качестве дополнительного продукта в соотношении 7,5/1 (632 мг, 64%). Чтобы охарактеризовать эти соединения, они были выделены в небольшом количестве.
Бензил-3,4-дигидро-7-нитро-2Н-пирано[3,2-b]пиридин-3-илкарбамат: белое твердое вещество
MS (ESI+) m/z=330,1 [М+Н]+.
1H NMR (400 MHz, CDCl3) δ 3,10 (dd, J=18,1, 3,5 Hz, 1H), 3,34 (dd, J=18,2, 5,3 Hz, 1H), 4,25 (s, 2H), 4,39 (br s, 1H), 5,02 (br s, 1H), 5,10 (s, 2H), 7,33 (m, 5H), 7,90 (d, J=2,0 Hz, 1H), 8,98 (d, J=2,0 Hz, 1H);
13C NMR (100 MHz, COCl3) δ 34,9, 43,7, 67,2, 68,7, 118,6, 128,2 (2C), 128,3, 128,5 (2C), 135,8, 137,2, 143,6, 148,0, 150,3, 155,4.
Расчетные данные для C16H15N3O5: С, 58,36; Н, 4,59; N, 12,76; О, 24,29,
Реальные: С, 58,76; Н, 5,00; N, 12,23; О, 24,12.
Бензил-6,8-дигидро-3-нитро-5Н-пирано[3,4-b]пиридин-5-илкарбамат: бледно-желтое твердое вещество
MS (ESI+) m/z=330,1 [М+Н]+.
1H NMR (400 MHz, CDCl3) δ 3,96 (dd, J=11,9, 3,2 Hz, 1H), 4,07 (dd, J=11,9, 2,9 Hz, 1H), 4,80 (d, J=17,4 Hz, 1H), 4,94 (d, J=17,4 Hz, 1H), 5,00 (m, 1H), 5,13 (d, J=12,3 Hz, 1H), 5,17 (d, J=12,3 Hz, 1H), 5,38 (d, J=9,0 Hz, 1H), 7,35 (m, 5H), 8,61 (d, J=1,6 Hz, 1H), 9,29 (d, J=1,9 Hz, 1H);
13C NMR (100 MHz, CDCl3) δ 46,7, 67,3, 68,8, 69,8, 128,1 (2C), 128,3, 128,5 (2C), 130,9, 131,8, 135,8, 143,2, 144,1, 155,8, 160,8;
Расчетные данные для C16H15N3O5: С, 58,36; Н, 4,59; N, 12,76; О, 24,29,
Реальные: С, 58,46; Н, 4,80; N, 12,59; О, 23,98.
31.3 N-(3,4-дигидро-7-нитро-2Н-пирано[3,2-b]пиридин-3-ил)пропионамид и N-(6,8-дигидро-3-нитро-5Н-пирано[3,4-b]пиридин-5-ил)пропионамид
Смесь бензил 3,4-дигидро-7-нитро-2Н-пирано[3,2-b]пиридин-3-илкарбамата и бензил-6,8-дигидро-3-нитро-5Н-пирано[3,4-b]пиридин-5-илкарбамата (6,54 г, 26,23 ммоль) в CH2Cl2 (55 мл) перемешали при 0°С, затем добавили 33% HBr в уксусной кислоте (45 мл). Раствор перемешивали при 0°С в течение часа, затем при комнатной температуре еще два часа. Растворитель удалили. "Сырую" смесь растворили в CH2Cl2/H2O 1/1 (80 мл) и добавили 2N NaOH так, чтобы рН водной фазы был равен 10. Органический слой отделили, промыли Н2О (×2), высушили над Na2SO4 и упарили. Остаток растворили в CH2Cl2 (400 мл) и охладили раствор до 0°С. Добавили пропионилхлорид (4,54 мл, 52 ммоль) и триэтиламин (7,22 мл, 52 ммоль), позволили смеси нагреться до 20°С и перемешивали в течение 4,5 часов. Полученный раствор последовательно промыли 1 N водным раствором HCl, насыщенным раствором NaHCO3 и водой. Органический слой высушили над Na2SO4 и выпарили. Выполненная сразу же перекристаллизация из ацетона позволила получить чистую фракцию N-(6,8-дигидро-3-нитро-5Н-пирано [3,4-b]пиридин-5-ил)пропионамида (2,2 г, 33% по результатам двух этапов) в виде белого твердого вещества. Оставшуюся смесь очистили хроматографией на силикагеле (гептан:этилацетат, 1,5:3,5, затем CH2Cl2:СН3ОН, 95:5), получив еще одну порцию N-(6,8-дигидро-3-нитро-5Н-пирано[3,4-b]пиридин-5-ил)пропионамида (1,15 мг, 17% по результатам двух этапов) и N-(3,4-дигидро-7-нитро-2Н-пирано[3,2-b]пиридин-3-ил) пропионамид (445 мг, 7% по результатам двух этапов) в виде белого твердого вещества. N-(3,4-дигидро-7-нитро-2Н-пирано[3,2-b]пиридин-3-ил) пропионамид:
MS (ESI+) m/z=252,1 [М+Н]+ 1H-NMR (400 MHz, CDCl3) δ 1,14 (t, J=7,6 Hz, 3H), 2,21 (q, J=7,6 Hz, 2H), 3,08 (dd, J=18,3, 4,0 Hz, 1H), 3,35 (dd, J=18,3, 5,5 Hz, 1H), 4,25 (m, 2H), 4,65 (m, 1H), 5,57 (br s, 1H), 7,93 (d, J=1,9 Hz, 1H), 9,01 (d, J=2,0 Hz, 1H).
31.4 N-(7-Амино-3,4-дигидро-2Н-пирано[3,2-b]пиридин-3-ил)-пропионамид
N-(3,4-дигидро-7-нитро-2Н-пирано[3,2-b]пиридин-3-ил)пропионамид (445 мг, 1,76 ммоль) растворили в этаноле (80 мл) и добавили SnCl2·2H2O (2 г, 8,82 ммоль). Полученную смесь кипятили 8 часов, после чего растворитель удалили в вакууме. Неочищенное вещество растворили в этилацетате и последовательно промыли 2 N водным раствором NaOH (2x) и водой. Органический слой высушили (Na2SO4), профильтровали через слой целита и упарили, получив "сырой" N-(7-амино-3,4-дигидро-2Н-пирано[3,2-b]пиридин-3-ил)-пропионамид (390 мг, 99%) в виде светло-желтого порошка.
31.5 N-[7-(4-трифторметокси-бензолсульфониламино)-3,4-дигидро-2Н-пирано[3,2-b]пиридин-3-ил]-пропионамид
Часть неочищенного N-(7-амино-3,4-дигидро-2Н-пирано[3,2-b] пиридин-3-ил)-пропионамида (100 мг, 0,45 ммоль) растворили в CH2Cl2/пиридине 9/1 (20 мл) и добавили по каплям 4-(трифторметокси)бензолсульфонилхлорид (100 мкл, 0,58 ммоль). Смесь одну ночь перемешивали при комнатной температуре, затем реакционную смесь сконцентрировали и очистили остаток хроматографией на силикагеле (CHaCl2:CH3OH, 97:3), получив заявленное соединение (94 мг, 47% по результатам двух этапов 31,4 и 31,5) в виде клейкой смолы.
MS (ESI+) m/z=446,1 [М+Н]+
Пример 32
N-[7-(4-Изопропилбензолсульфониламино)-3,4-дигидро-2Н-пирано[3,2-b]пиридин-3-ил]-пропионамид
Следуя процедуре, описанной в примере 31.5, часть "сырого" N-(7-амино-3,4-дигидро-2Н-пирано[3,2-b]пиридин-3-ил)-пропионамида (100 мг, 0,45 ммоль), растворенного в смеси CH2Cl2/пиридин 9/1 (20 мл), обработали 4-изопропилбензолсульфонилхлоридом (130 мкл, 0,72 ммоль). Очистка методом флеш-хроматографии (CH2Cl2:метанол, 97:3) позволила получить заявленное соединение (85 мг, 47% на этапе 31,4 и на данном этапе) в виде клейкой смолы.
MS (ESI+) m/z=404,1 [М+Н]+
Пример 33
N-{7-[4-((S)-2-Фтор-1-метилэтил)-бензолсульфониламино]-3,4-дигидро-2Н-пирано[3,2-b]пиридин-3-ил}-пропионамид
Следуя процедуре, описанной в примеру 31,5, часть "сырого" N-(7-амино-3,4-дигидро-2Н-пирано[3,2-b]пиридин-3-ил)-пропионамида (95 мг, 0,43 ммоль), растворенного в смеси CH2Cl2/пиридин 9/1 (10 мл), обработали 4-((S)-2-фтор-1-метилэтил)-бензолсульфонилхлоридом (132 мг, 0,55 ммоль). Очистка методом флеш-хроматографии (CH2Cl2:МеОН, 97:3) позволила получить заявленное соединение (100 мг, 55% на этапе 31,4 и на данном этапе) в виде клейкой смолы.
MS (ESI+) m/z=422,1 [М+Н]+
Пример 34
N-(3-Пропиламино-3,4-дигидро-2Н-пирано[3,2-b]пиридин-7-ил)-4-трифторметоксибензолсульфонамид
К раствору N-[7-(4-трифторметоксибензолсульфониламино)-3,4-дигидро-2Н-пирано[3,2-b]пиридин-3-ил]-пропионамида (93 мг, 0,20 ммоль) в THF (20 мл) добавляли по каплям 1М ВН3·THF (2,08 мл, 2,08 ммоль) и перемешивали смесь 12 часов при комнатной температуре. Реакцию остановили осторожным добавлением 1N водного раствора HCl (8 мл) и полученный раствор кипятили в течение 4 часов. Затем раствор охладили до комнатной температуры, рН водной смеси довели приблизительно до 8 добавлением 2 N раствора NaOH и разбавили CH2Cl2. Органическую фазу отделили, высушили над Na2SO4 и упарили в вакууме, получив "сырой продукт, который затем очистили методом флеш-хроматографии (CH2Cl2:метанол, 97:3). Это позволило получить заявленное соединение (70 мг, 78%) в виде белого аморфного твердого вещества.
MS (ESI+) m/z=432,1 [М+Н]+
1H NMR (400 MHz, COCl3): δ (ppm) 0,92 (t, J=7,3 Hz, 3H), 1,53 (m, 2H), 2,69 (t, 1Н, J=7,3 Hz, 2H), 2,78 (dd, J=16,9, 6,5 Hz, 1H), 3,10 (dd, J=16,9, 4,8 Hz, 1H), 3,24 (m, 1H), 3,96 (dd, J=10,8, 6,4 Hz, 1H), 4,16 (m, 3H), 6,97 (d, J=1,7 Hz, 1H), 7,27 (d, J=8,3 Hz, 2H), 7,77 (d, J=1,2 Hz, 1H), 7,84 (d, J=8,7 Hz, 2H).
Пример 35
4-Изопропил-N-(3-пропиламино-3,4-дигидро-2Н-пирано[3,2-b]пиридин-7-ил)-бензолсульфонамид
Следуя процедуре, описанной в примере 34, N-[7-(4-изопропилбензолсульфониламино)-3,4-дигидро-2Н-пирано[3,2-b]пиридин-3-ил]-пропионамид (85 мг, 0,21 ммоль) в ТНF (10 мл) обработали 1М ВН3·ТНF (2,1 мл, 2,1 ммоль). Очистка "сырого" продукта методом флеш-хроматографии (CH2Cl2:метанол, 97:3) позволила получить заявленное соединение (50 мг, 61%) в виде белого аморфного твердого вещества.
MS (ESI+) m/z=390,1 [М+Н]+
1H NMR (400 MHz, CDCl3): δ (ppm) 0,92 (t, J=7,4 Hz, 3H), 1,23 (d, J=6,9 Hz, 6H), 1,52 (m, 2H), 2,69 (t, 1H, J=7,3 Hz, 2H), 2,78 (dd, J=16,9, 6,9 Hz, 1H), 2,93 (m, 1H), 3,09 (dd, J=16,8, 4,8 Hz, 1H), 3,28 (m, 1H), 3,90 (m, 1H), 3,92 (dd, J=10,8, 6,8 Hz, 1H), 4,17 (d, J=10,1 Hz, 1H), 7,02 (d, J=2,1 Hz, 1H), 7,30 (d, J=8,3 Hz, 2H), 7,71 (d, J=8,3 Hz, 2H), 7,79 (d, J=2,0 Hz, 1H).
Пример 36
4-((S)-2-Фтор-1-метилэтил)-N-(3-пропиламино-3,4-дигидро-2Н-пирано[3,2-b]пиридин-7-ил)-бензолсульфонамид
Следуя процедуре, описанной в примере 34, N-{7-[4-((S)-2-фтор-1-метилэтил)-бензолсульфониламино]-3,4-дигидро-2Н-пирано[3,2-b]пиридин-3-ил}-пропионамид (100 мг, 0,27 ммоль) в THF (15 мл) смешали с 1М BH3·THF (2,3 мл, 2,3 ммоль). Очистка "сырого" продукта методом флеш-хроматографии (CH2Cl2:метанол, 97:3) позволила получить заявленное соединение (50 мг, 52%) в виде белого твердого вещества.
MS (ESI+) m/z=408,1 [М+Н]+
1H NMR (400 MHz, СН3ОН-d4): δ (ppm) 0,92 (t, J=7,4 Hz, 3Н), 1,18 (d, J=6,9 Hz, 3Н), 1,61 (m, 2H), 2,93 (m, 1H), 3,00 (m, 2H), 3,09 (m, 1H), 3,28 (dd, J=18,1, 5,9 Hz, 1H), 3,81 (m, 1H), 4,18 (m, 1H), 4,31 (d, J=6,2 Hz, 1H), 4,34 (m, 1H), 4,43 (d, J=6,2 Hz, 1H), 7,11 (d, J=1,9 Hz, 1H), 7,36 (d, J=8,3 Hz, 2H), 7,67 (d, J=8,3 Hz, 2 H), 7,83 (bs, 1m).
Пример 37
4-Оксазол-5-ил-N-((S)-6-пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-бензолсульфонамид
Этап 1. Присоединение сульфонамида. Методика была описана выше, например, в примере 6,3. Выход: 1,57 г (88%)
Этап 2. Удаление защитной ВОС (трет-бутоксикарбонил) группы выполнено по методике, описанной выше, например, в примере 6,4 (HCl/диоксан/CH2Cl2). Масса полученного продукта 0,59 г. Выход: 40%. Получено в виде гидрохлорида.
MS (ESI) m/z: 449,1 [М+Н]+
1H-NMR (DMSO-d6): δ [ppm] 10,24 (s, 1H), 8,80 (m, 2H), 8,53 (s, 1H), 7,84 (m, 4H), 6,98 (d, 1H), 6,88 (m, 2H), 3,39 (m, 1H), 3,07(m, 1H), 2,91 (m, 2H), 2,72 (m, 3Н), 2,16 (m, 1H), 1,63 (m, 3Н), 0,91 (t, J=7,3 Hz, 3Н).
Пример 38
((S)-6-Пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-амид 5-оксазол-5-илтиофен-2-сульфоновой кислоты
Этап 1. Связывание сульфонамида выполнено по методике, описанной выше, например, в примере 6.3
Этап 2. Удаление защитной ВОС (трет-бутоксикарбонил) группы выполнено по методике, описанной выше, например, в примере 6,4. Выход: 110 мг (74% по результатам двух этапов)
MS(ESI) m/z: 418,0 [М+Н]+
1H-NMR (DMSO-d6): δ [ppm] 10,50 (s, 1H), 8,62 (br s, 1H), 8,48 (s, 1H), 7,72 (s, 1H), 7,50 (m, 2H), 7,00 (m, 4H), 3,12 (m, 1H), 2,93 (m, 2H), 2,76 (t, 1H, J=7,3 Hz, 2H), 2,16 (m, 1H), 1,63 (m, 3H), 1,47 (m, 1H), 0,92 (t, J=7,3 Hz, 3H).
Пример 39
((S)-6-Пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-амид 5-изоксазол-5-илтиофен-2-сульфоновой кислоты
Этап 1. Связывание сульфонамида выполнено по методике, описаной выше, например, в примере 6,3.
Этап 2. Удаление защитной ВОС (трет-бутоксикарбонил) группы выполнено по методике, описанной выше, например, в примере 6,4. Количество 130 мг. Выход: 87% рассчитан по результатам двух этапов. Получено в виде гидрохлорида.
MS(ESI) m/z: 418,1 [М+Н]+
1H-NMR (DMSO-d6): δ [ppm] 10,55 (s, 1H), 8,70 (br s, 2H), 7,67 (d, 1H), 7,62 (d, 1H), 7,06 (m, 2H), 6,96 (m, 2H), 3,10 (m, 1H), 2,92 (m, 2H), 2,76 (m, 3H), 2,15 (m, 1H), 1,63 (m, 3H), 0,93 (t, J=7,3 Hz, 3H).
Пример 40
N-((S)-6-Пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-4-(2,2,2-трифтор-1-метилэтил)-бензолсульфонамид - рацемат.
Этап 1. Присоединение сульфонамида выполнено по методике, описанной выше, например, в примере 6,3. Количество 900 мг. Выход 100%
Этап 2. Удаление защитной ВОС (трет-бутоксикарбонил) группы выполнено по методике, описанной выше, например, в примере 6,4.
Количество 700 мг. Выход: 88%
Получено в виде гидрохлорида.
MS(ESI) m/z: 441,1 [М+Н]+
1H-NMR (DMSO-d6): δ [ppm] 10,23 (br s, 1H), 8,72 (br s, 1H), 7,78 (d, 2H), 7,59 (d, 2H), 6,88 (m, 3H), 3,92 (m, 1H), 3,32 (m, 1H), 3,08 (m, 1H), 2,90 (m, 2H), 2,70 (m, 3H), 2,16 (m, 1H), 1,63 (m, 3H), 1,41 (d, 3H), 0,91 (t, J=7,3 Hz, 3H).
Пример 41
N-((S)-6-Пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-4-((R)-2,2,2-трифтор-1-метилэтил)-бензолсульфонамид
Рацемическая смесь, полученная в примере 40, была разделена на хиральной колонке для HPLC. Количество 40 мг. 80% recovery.
MS (ESI) m/z: 441,1 [M+H]+
1H-NMR (DMSO-d6): δ [ppm] 10,23 (br s, 1H), 8,72 (br s, 1H), 7,78 (d, 2H), 7,59 (d, 2H), 6,88 (m, 3H), 3,92 (m, 1H), 3,32 (m, 1H), 3,08 (m, 1H), 2,90 (m, 2H), 2,70 (m, 3H), 2,16 (m, 1H), 1,63 (m, 3H), 1,41 (d, 3H), 0,91 (t, J=7,3 Hz, 3H).
Пример 42
N-((S)-6-Пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-4-((S)-2,2,2-трифтор-1-метилэтил)-бензолсульфонамид
Рацемическая смесь, полученная в примере 40, была разделена на хиральной колонке для HPLC. Количество 50 мг. 100% восстановление.
MS (ESI) m/z: 441,1 [M+H]+
1H-NMR (DMSO-d6): δ [ppm] 10,23 (br s, 1H), 8,72 (br s, 1H), 7,78 (d, 2H), 7,59 (d, 2H), 6,88 (m, 3H), 3,92 (m, 1H), 3,32 (m, 1H), 3,08 (m, 1H), 2,90 (m, 2H), 2,70 (m, 3H), 2,16 (m, 1H), 1,63 (m, 3H), 1,41 (d, 3H), 0,91 (t, J=7,3 Hz, 3H).
Пример 43
((S)-6-Пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-амид 5-изоксазол-3-илтиофен-2-сульфоновой кислоты
Этап 1. Присоединение сульфонамида выполнено по методике, описаной выше, например, в примере 6,3. Количество 100 мг. Выход: 59%
Этап 2. Удаление защитной ВОС (трет-бутоксикарбонил) группы выполнено по методике, описанной выше, например, в примере 6,4. Количество 50 мг. Выход: 57%
MS (ESI) m/z: 418,0 [M+H]+
1H-NMR (DMSO-d6): δ [ppm] 7,28 (d, 1H), 7,07 (br s, 1H), 6,90 (m, 4H), 6,60 (d, 2H), 4,10 (m, 1H), 3,94 (m, 1H), 3,03 (m, 1H), 2,75 (m, 5H), 2,06 (m, 2H), 1,53 (m, 3H), 0,92 (t, J=7,3 Hz, 3H).
Пример 44
4-((R)-3-Фторпирролидин-1-ил)-N-((S)-6-пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-бензолсульфонамид
Этап 1. Присоединение Бучвальда (Buchwald coupling) с использованием (R)-3-фторпирролидина.
Взаимодействие 0,200 г трет-бутилового эфира [(S)-6-(4-бромбензолсульфониламино)-1,2,3,4-тетрагидронафтален-2-ил]-пропилкарбаминовой кислоты (0,38 ммоль), 72 мг (R)-3-фторпирролидина (0,57 ммоль), 51 мг NaOtC4H9 (1,53 ммоль), 39 мг Pd2(dba)3 (трис(дибензилиденацетон) дипалладий(0) (0,04 ммоль)), 47 мг BINAP (2,2'-бис(дифенилфосфино)-1,1'-бинафтил) (0,08 ммоль) в 5 мл тетрагидрофурана при 80°С в течение 48 часов позволило получить 95 мг (47%) трет-бутилового эфира {(S)-6-[4-((R)-3-фторпирролидин-1-ил)-бензолсульфониламино]-1,2,3,4-тетрагидронафтален-2-ил}-пропилкарбаминовой кислоты в виде желтого твердого вещества.
Этап 2. Удаление защитной ВОС группы выполнено по методике, описанной ниже, см. пример 47,2. Количество: 39 мг. Выход: 49%
MS (ESI) m/z: 432,0 [M+H]+
Пример 45
4-Морфолин-4-ил-N-((S)-6-пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-бензолсульфонамид
Этап 1. Присоединение Бучвальда с использованием морфолина было выполнено по методике, описанной в примере 44, на этапе 1. Количество: 40 мг. Выход 20%
Этап 2. Удаление защитной ВОС группы выполнено по методике, описанной ниже, смотри пример 47,2. Количество: 11 мг. Выход 31%
MS (ESI) m/z: 430,0 [M+H]+
Пример 46
4-Дифторметокси-N-((S)-6-пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-бензолсульфонамид, гидрохлорид
46.1 Трет-бутиловый эфир ((S)-6-бром-1,2,3,4-тетрагидронафтален-2-ил)-пропилкарбаминовой кислоты
Трет-бутиловый эфир ((S)-6-бром-1,2,3,4-тетрагидронафтален-2-ил)-карбаминовой кислоты (12,2 г, 37,4 ммоль) растворили в N,N-диметилформамиде (1000 мл). Добавили гидрид натрия (50% в масле) (1,975 г, 41,14 ммоль) и перемешивали смесь в течение 15 минут при комнатной температуре. Затем добавили пропил бромид (3,74 мл, 41,14 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь вылили на смесь льда и H2O (400 мл) и дважды проэкстрагировали 200 мл диэтилового эфира. Органический слой высушили над сульфатом магния, профильтровали и упарили досуха, получив 14,4 г "сырого" продукта. "Сырой" продукт очистили хроматографией на силикагеле, используя в качестве элюента циклогексан/этилацетат (95:5), и получили заявленное соединение в количестве 10,5 г (76%).
46.2 Трет-бутиловый эфир ((S)-6-Амино-1,2,3,4-тетрагидронафтален-2-ил)-пропилкарбаминовой кислоты
В инертной атмосфере (аргон) трет-бутиловый эфир ((S)-6-бром-1,2,3,4-тетрагидронафтален-2-ил)-пропилкарбаминовой кислоты (5,0 г, 13,58 ммоль) растворили в толуоле (150 мл) при комнатной температуре. В реакционную смесь добавили трис(дибензилиденацетон)дипалладий (622 мг, 0,68 ммоль) и три-трет-бутилфосфан (412 мг, 2,04 ммоль). Через 15 минут медленно прибавили амид бис-(триметилсилил)лития (29,86 мл 1 М раствора в THF) и реакционную смесь перемешивали в течение 1 часа при 100°С. Затем реакционную смесь охладили и медленно прибавили H2O (150 мл). Смесь несколько раз проэкстрагировали диэтиловым эфиром. Органический слой высушили над сульфатом магния, профильтровали и упарили досуха, получив 6,9 г "сырого" продукта (95% выход, 57% чистота).
46.3 Трет-бутиловый эфир [(S)-6-(4-дифторметоксибензолсульфониламино)-1,2,3,4-тетрагидронафтален-2-ил]-пропилкарбаминовой кислоты
Трет-бутиловый эфир ((S)-6-амино-1,2,3,4-тетрагидронафтален-2-ил)-пропилкарбаминовой кислоты (1,5 г, 4,93 ммоль) растворили в тетрагидрофуране (50 мл). Затем добавили диметиламинопиридин (100 мг, 0,82 ммоль) и дифторметоксибензолсульфонилхлорид (1,195 г, 4,93 ммоль) и реакционную смесь перемешивали одну ночь при комнатной температуре. Растворитель упарили при пониженном давлении, остаток обработали водой и диэтиловым эфиром. Органический слой высушили над сульфатом магния, профильтровали и растворитель упарили при пониженном давлении, получив "сырой" продукт (2,5 г). "Сырой" продукт очистили хроматографией на силикагеле, используя в качестве элюента смесь дихлорметан/метанол (100:0 дo 96:4). В результате получили чистый продукт в количестве 2,08 г (83%).
46.4 4-Дифторметокси-N-((S)-6-пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-бензолсульфонамид, гидрохлорид
Трет-бутиловыйэфир[(S)-6-(4-дифторметоксибензолсульфониламино)-1,2,3,4-тетрагидронафтален-2-ил]-пропилкарбаминовой кислоты (2,08 г, 4,07 ммоль) растворили в дихлорметане (100 мл). Добавили трифторуксусную кислоту (10 мл) и перемешивали реакционную смесь при комнатной температуре в течение 1 часа. Реакционную смесь упарили досуха. Добавили диэтиловый эфир (100 мл) и проэкстрагировали смесь насыщенным раствором NaHCO3. К органическому слою добавили эфирный раствор гидрохлорида и растворитель упарили. К остатку добавили диэтиловый эфир (25 мл) и отфильтровали образовавшийся кристаллический продукт, получив очищенное заявленное соединение (1,41 г, 77% выход).
ESI-MS: 411,15 [М+Н]+
1H-NMR (DMSO-d6, 400 MHz): δ [ppm] 10,25 (s, 1H), 9,0 (m, 2H), 7,8 (d, 2H), 7,35 (t, J=70 Hz, 1H), 7,3 (d, 2H), 7,0 (d, 1H), 6,9 (d, 1H), 6,85 (s, 1H), 3,4 (m, 1Н), 3,1 (dd, 1H), 2,95 (m, 2H), 2,75 (m, 3Н), 2,2 (m, 1H), 1,7 (m, 3H), 0,9 (t, 3H).
Пример 47
N-((S)-6-Пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-4-(2,2,2-трифтор-этил)-бензолсульфонамид, гидрохлорид
47.1 Трет-бутиловый эфир пропил-{(S)-6-[4-(2,2,2-трифторэтил)-бензолсульфониламино]-1,2,3,4-тетрагидронафтален-2-ил}-карбаминовой кислоты
Трет-бутиловый эфир ((S)-6-амино-1,2,3,4-тетрагидронафтален-2-ил)-пропилкарбаминовой кислоты (720 мг, 2,37 ммоль) растворили в тетрагидрофуране (50 мл). Затем добавили диметиламино пиридин (100 мг, 0,82 ммоль) и 4-(2,2,2-трифторэтил)-бензолсульфонилхлорид (761 мг, 2,37 ммоль) и 30 минут перемешивали реакционную смесь при комнатной температуре. Растворитель упарили при пониженном давлении, остаток обработали водой и диэтиловым эфиром. Органический слой высушили над сульфатом магния, профильтровали и растворитель упарили при пониженном давлении, получив "сырой" продукт (1,22 г, 95% чистота, 93% выход).
47.2 N-((S)-6-Пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-4-(2,2,2-трифторэтил)-бензолсульфонамид, гидрохлорид
Трет-бутиловый эфир пропил-{(S)-6-[4-(2,2,2-трифторэтил)-бензолсульфониламино]-1,2,3,4-тетрагидронафтален-2-ил}-карбаминовой кислоты (1,22 г, 2,07 ммоль) растворили в дихлорметане (40 мл). Добавили трифторуксусную кислоту (2 мл) и один час перемешивали реакционную смесь при комнатной температуре, после чего ее упарили досуха. К смеси добавили диэтиловый эфир (100 мл) и проэкстрагировали ее насыщенным раствором NaHCO3. Органический слой высушили над сульфатом магния, профильтровали и растворитель упарили при пониженном давлении. Остаток растворили в этилацетате и добавили эфирный раствор гидрохлорида. Образовавшийся кристаллический осадок отфильтровали, получив чистый продукт (625 мг, 65% выход).
ESI-MS: 427,15 [М+Н]+
1H-NMR (DMSO-d6, 400 MHz): δ [ppm] 10,25 (s, 1H), 8,9 (m, 2H), 7,8 (d, 2H), 7,55 (d, 2H), 7,0 (d, 1H), 6,9 (d, 1H), 6,85 (s, 1H), 3,75 (q, 2H), 3,35 (m, 1H), 3,1 (dd, 1H), 2,95 (m, 2H), 2,75 (m, 3Н), 2,2 (m, 1H), 1,95 (m, 4H), 1,7 (m, 3H), 0,95 (t, 3Н).
Процедура, описанная в примере 46, была использована для синтеза соединений, описанных в примерах с 48 по 57. Полученные соединения были охарактеризованы следующим образом:
Пример 48
4-(2,2-Дифторциклопропил)-N-((S)-6-пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-бензолсульфонамид, гидрохлорид
ESI-MS: 421,35 [М+Н]+
Пример 49
N-((S)-6-Пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-4-пирролидин-1-илбензолсульфонамид, гидрохлорид
ESI-MS: 414,25 [М+Н]+
1H-NMR (DMSO-d6, 400 MHz): δ [ppm] 9,8 (s, 1H), 8,85 (m, 2H), 7,5 (d, 2H), 6,95 (d, 1H), 6,9 (d, 1H), 6,85 (s, 1H), 6,55 (d, 1H), 3,35 (m, 1H), 3,25 (m, 4H), 3,1 (dd, 1H), 2,95 (m, 2H), 2,75 (m, 3Н), 2,2 (m, 1H), 1,95 (m, 4H), 1,7 (m, 3Н), 0,95 (t, 3Н).
Пример 50
4-Диметиламино-N-((S)-6-пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-бензолсульфонамид, гидрохлорид
ESI-MS: 388,25 [М+Н]+
1H-NMR (DMSO-d6, 400 MHz): δ [ppm] 9,85 (s, 1H), 9,05 (m, 2H), 7,55 (d, 2H), 6,95 (d, 1H), 6,9 (d, 1H), 6,85 (s, 1H), 6,7 (d, 2H), 3,35 (m, 1H), 3,1 (dd, 1H), 2,95 (m, 7H), 2,75 (m, 4H), 2,2 (m, 1H), 1,65 (m, 3H), 0,95 (t, 3H).
Пример 51
4-(3-Фторпропил)-N-((S)-6-пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-бензолсульфонамид
ESI-MS: 405,2 [М+Н]+
1H-NMR (DMSO-d6, 400 MHz): δ [ppm] 10,1 (m, 1H), 8,9 (m, 1H), 7,7 (d, 2H), 7,4 (d, 2H), 7,0 (d, 1H), 6,9 (d, 1H), 6,85 (s, 1H), 4,5 (t, 1H), 4,4 (t, 1H), 3,35 (m, 1H), 3,05 (dd, 1H), 2,9 (m, 2H), 2,75 (m, 5H), 2,2 (m, 1H), 1,95 (m, 2H), 1,65 (m, 3H), 0,95 (t, 3H).
Пример 52
((S)-6-Пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-амид 5-пропилтиофенсульфоновой кислоты, гидрохлорид
"Сырой" продукт очистили хроматографией на силикагеле с использованием в качестве элюента смеси дихлорметан/метанол (9:1) и преобразовали в гидрохлорид.
ESI-MS: 393,15 [М+Н]+
1H-NMR (DMSO-d6, 400 MHz): δ [ppm] 10,25 (s, 1H), 8,95 (m, 2H), 7,35 (d, 1H), 7,05 (d, 1H), 6,95 (d, 1H), 6,85 (m, 2H), 3,4 (m, 1H), 3,1 (dd, 1H), 2,95 (m, 2H), 2,8 (m, 5H), 2,2 (m, 1H), 1,8-1,55 (m, 5H), 0,95 (t, 3H), 0,9 (t, 3H).
Пример 53 ссылка
4-Хлор-N-((S)-6-пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-бензолсульфонамид, гидрохлорид
ESI-MS: 379,15 [М+Н]+
1H-NMR (DMSO-d6, 400 MHz): δ [ppm] 10,3 (s, 1H), 8,9 (m, 2H), 7,75 (d, 2H), 7,65 (d, 2H), 7,0 (d, 1H), 6,9 (d, 1H), 6,85 (s, 1H), 3,4 (m, 1H), 3,1 (dd, 1H), 2,95 (m, 2H), 2,75 (m, 3H), 2,2 (m, 1H), 1,7 (m, 3H), 0,95 (t, 3H).
Пример 54 ссылка
N-((S)-6-Пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-4-трифторметилбензолсульфонамид, гидрохлорид
ESI-MS: 413,15 [М+Н]+
1H-NMR (DMSO-d6, 400 MHz): δ [ppm] 10,45 (s, 1H), 8,9 (m, 2H), 8,0 (s, 4H), 7,0 (d, 1H), 6,9 (d, 1H), 6,85 (s, 1H), 3,4 (m, 1H), 3,1 (dd, 1H), 2,95 (m, 2H), 2,75 (m, 3H), 2,2 (m, 1H), 1,65 (m, 3H), 0,95 (t, 3H).
Пример 55
4-((S)-2-Фтор-1-метилэтил)-N-((S)-6-пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-бензолсульфонамид, гидрохлорид
ESI-MS: 405,15 [M+H]+
1H-NMR (DMSO-d6, 400 MHz): δ [ppm] 10,2 (s, 1H), 8,9 (m, 2H), 7,75 (d, 2H), 7,5 (d, 2H), 7,0 (d, 1H), 6,9 (d, 1H), 6,85 (s, 1H), 4,6 (d, 1H), 4,45 (d, 1H), 3,4 (m, 1H), 3,2 (m, 1H), 3,1 (dd, 1H), 2,9 (m, 2H), 2,75 (m, 3H), 2,2 (m, 1H), 1,7 (m, 3H), 1,2 (d, 3H), 0,95 (t, 3H).
Пример 56
4-((R)-2-Фтор-1-метилэтил)-N-((S)-6-пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-бензолсульфонамид, гидрохлорид
ESI-MS: 405,15 [M+H]+
1H-NMR (DMSO-d6, 400 MHz): δ [ppm] 10,2 (s, 1H), 8,85 (m, 2H), 7,75 (d, 2H), 7,5 (d, 2H), 7,0 (d, 1H), 6,9 (d, 1H), 6,85 (s, 1H), 4,6 (d, 1H), 4,45 (d, 1H), 3,4 (m, 1H), 3,2 (m, 1H), 3,1 (dd, 1H), 2,95 (m, 2H), 2,75 (m, 3H), 2,2 (m, 1H), 1,7 (m, 3H), 1,2 (d, 3H), 0,95 (t, 3H).
Пример 57
4-(1-Метил-1Н-пиразол-4-ил)-N-((S)-6-пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-бензолсульфонамид, гидрохлорид
ESI-MS: 425,15 [M+H]+
1H-NMR (DMSO-d6, 400 MHz): δ [ppm] 10,15 (s, 1H), 9,0 (m, 2H), 8,35 (s, 1H), 7,7 (s, 4H), 7,0 (d, 1H), 6,9 (d, 1H), 6,85 (s, 1H), 3,9 (s, 3H), 3,35 (m, 1H), 3,1 (dd, 1H), 2,9 (m, 2H), 2,75 (m, 3H), 2,2 (m, 1H), 1,65 (m, 3H), 0,95 (t, 3H).
Пример 58
4-(3-Фторпропил)-N-((R)-6-пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-бензолсульфонамид, гидрохлорид
58.1 Трет-бутиловый эфир
((R)-6-бром-1,2,3,4-тетрагидронафтален-2-ил)-карбаминовой кислоты
К (R)-6-бром-1,2,3,4-тетрагидронафтален-2-иламину (5,252 г, 20,0 ммоль) и ди-трет-бутилдикарбонату (5,456 г, 25,0 ммоль) в дихлорметане (100 мл) добавили триэтиламин (21,12 мл, 152,34 ммоль). Реакционную смесь одну ночь перемешивали при комнатной температуре и затем дважды проэкстрагировали водным раствором NaHCO3. Органический слой высушили над сульфатом магния, профильтровали и упарили досуха, получив чистый продукт (6,4 г, 98% выход).
ESI-MS: 270,05/272,05 [М+Н-С(СН3)3]+
58.2 Трет-бутиловый эфир ((R)-6-бром-1,2,3,4-тетрагидронафтален-2-ил)-пропилкарбаминовой кислоты
Трет-бутиловый эфир ((R)-6-бром-1,2,3,4-тетрагидронафтален-2-ил)-карбаминовой кислоты (3,4 г, 10,42 ммоль) растворили в диметилформамиде (40 мл). К раствору добавили гидрид натрия (60% в масле) (625 мг, 15,63 ммоль) и один час перемешивали его при 0°С. Затем при 0°С добавили пропилбромид (1,04 мл, 11,46 ммоль), растворенный в N,N-диметилформамиде (DMF). 2 часа спустя добавили еще одну порцию пропилбромида (0,2 мл, 2,20 ммоль) и реакционную смесь одну ночь перемешивали при комнатной температуре. Затем к смеси добавили воду и трижды проэкстрагировали ее диэтиловым эфиром. Органический слой высушили над сульфатом магния, профильтровали и упарили досуха, получив "сырой" продукт."Сырой" продукт очистили хроматографией на силикагеле с использованием в качестве элюента смеси циклогексан/этилацетат (92:8), получив чистый продукт (3,54 г, 92%).
ESI-MS: 312,05/314,05 [М+Н-С(СН3)3]+
58.3 Трет-бутиловый эфир ((R)-6-амино-1,2,3,4-тетрагидронафтален-2-ил)-пропилкарбаминовой кислоты
В инертной атмосфере (аргон), трет-бутиловый эфир ((R)-6-бром-1,2,3,4-тетрагидронафтален-2-ил)-пропилкарбаминовой кислоты (3,54 г, 9,61 ммоль) растворили в толуоле (50 мл) при комнатной температуре. Затем добавили трис(дибензилиденацетон)дипалладий (440 мг, 0,48 ммоль) и три-трет-бутилфосфан (292 мг, 1,44 ммоль). Через 10 минут медленно добавили бис-(триметилсилил)литийамид (21,14 мл 1 М раствор в THF) и реакционную смесь перемешивали в течение 1 часа при 100°С. Реакционную смесь охладили и медленно добавили воду. Органическую фазу дважды проэкстрагировали водой. Органический слой высушили над сульфатом магния, профильтровали и упарили досуха, получив 6,06 г "сырого" продукта (93% выход, 45% чистота). ESI-MS: 249,15 [М+Н-С(СН3)3]+
58.4 Трет-бутиловый эфир {(R)-6-[4-(3-фторпропил)-бензолсульфониламино]-1,2,3,4-тетрагидронафтален-2-ил}-пропилкарбаминовой кислоты
Трет-бутиловый эфир ((R)-6-амино-1,2,3,4-тетрагидронафтален-2-ил)-пропилкарбаминовой кислоты (200 мг, 0,66 ммоль) растворили в тетрагидрофуране (10 мл). Затем добавили диметиламино пиридин (80 мг, 0,66 ммоль) и 4-(3-фторпропил)-бензолсульфонилхлорид (156 мг, 0,66 ммоль) и реакционную смесь перемешивали одну ночь при комнатной температуре. Растворитель упарили при пониженном давлении, остаток обработали водой и этилацетатом. Органический слой высушили над сульфатом магния, профильтровали и растворитель упарили при пониженном давлении получив "сырой" продукт."Сырой" продукт очистили хроматографией на силикагеле, используя в качестве элюэнта смесь дихлорметан/метанол (от 100:0 до 96:4), в результате получили очищенный продукт (150 мг, 45%).
ESI-MS: 455,15 [М+Н-С(СН3)3]+
58.5 4-(3-Фторпропил)-N-((R)-6-пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-бензолсульфонамид, гидрохлорид
Заявленное соединение получали, следуя процедуре, описанной в примере 46.4.
ESI-MS: 405,55 [М+Н]+
1H-NMR (СН3ОН-d4, 400 MHz): δ [ppm] 7,55 (d, 2H), 7,25 (d, 2H), 6,9 (d, 2H), 6,8 (s, 1H), 4,35 (t, 1H), 4,25 (t, 1H), 3,35 (m, 1H), 3,1 (dd, 1H), 3,0 (t, 2H), 2,75 (m, 3H), 2,65 (m, 3H), 2,2 (m, 1H), 1,85 (m, 2H), 1,65 (m, 3H), 0,95 (t, 3H).
Пример 59
4-(2-Фторэтил)-N-((R)-6-пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-бензолсульфонамид, гидрохлорид
Заявленное соединение получали, следуя процедуре, описанной в примере 46.
ESI-MS: 391,15 [М+Н]+
1H-NMR (СН3ОН-d4, 400 MHz): δ [ppm] 7,6 (d, 2H), 7,3 (d, 2H), 6,9 (d, 1H), 6,8 (m, 2H), 4,6 (t, 1H), 4,45 (t, 1H), 3,35 (m, 1H), 3,1 (dd, 1H), 2,95 (m, 3H), 2,9 (m, 1H), 2,75 (m, 3H), 2,2 (m, 1H), 1,65 (m, 3H), 0,95 (t, 3H).
Пример 60
4-Ацетил-N-((S)-6-пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-бензолсульфонамид
Заявленное соединение получали, следуя процедуре, описанной в примере 46.
ESI-MS: 387,15 [М+Н]+
1H-NMR (DMSO-d6, 400 MHz): δ [ppm] 8,05 (d, 2H), 7,85 (d, 2H), 6,9 (d, 1H), 6,8 (d, 1H), 6,75 (s, 1H), 3,4 (m, 1H), 2,9 (m, 2H), 2,65 (m, 6H), 2,45 (m, 1H), 1,95 (m, 1H), 1,45 (m, 3H), 0,85 (t, 3H).
Пример 61
4-(1-Гидрокси-1-метилэтил)-N-((S)-6-пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-бензолсульфонамид, ацетат
61.1 Трет-бутиловый эфир
{(S)-6-[4-(1-гидрокси-1-метилэтил)-бензолсульфониламино]-1,2,3,4-тетрагидронафтален-2-ил}-пропилкарбаминовой кислоты
Трет-бутиловый эфир [(S)-6-(4-ацетилбензолсульфониламино)-1,2,3,4-тетрагидронафтален-2-ил]-пропилкарбаминовой кислоты (400 мг, 0,71 ммоль) растворили в тетрагидрофуране (15 мл) при 0°С, Медленно добавили 3 М раствор метилмагнийбромида в диэтиловом эфире (2,82 мл, 7,12 ммоль) и реакционную смесь три часа перемешивали при комнатной температуре. Затем добавили еще одну порцию 3 М раствора метилмагнийбромида в диэтиловом эфире (0,5 мл, 1,26 ммоль). Поскольку продолжения конверсии не наблюдалось, реакционную смесь упарили досуха. К остатку добавил и воду (20 мл) и водную фазу дважды проэкстрагировали диэтиловым эфиром (50 мл). Органический слой высушили над сульфатом магния, профильтровали и упарили досуха, получив "сырой" продукт."Сырой" продукт очистили хроматографией MPLC, используя в качестве элюента смесь дихлорметан/метанол (100:0-70:30) и получив целевой продукт (300 мг, 47% чистота, 39%).
61.2 4-(1-Гидрокси-1-метилэтил)-N-((S)-6-пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-бензолсульфонамид, ацетат
Трет-бутиловый эфир {(S)-6-[4-(1-гидрокси-1-метилэтил)-бензолсульфониламино]-1,2,3,4-тетрагидронафтален-2-ил}-пропилкарбаминовой кислоты (115 мг, 47% чистота, 0,11 ммоль) растворили в дихлорметане (10 мл). К раствору добавили трифторуксусную кислоту (1 мл) и реакционную смесь один час перемешивали при комнатной температуре, после чего упарили досуха. К остатку добавили этилацетат (15 мл) и проэкстрагировали насыщенным раствором NaHCO3 (5 мл). Органический слой высушили над сульфатом магния, профильтровали и упарили досуха, получив "сырой" продукт (65 мг). "Сырой" продукт очистили хроматографией HPLC, получив чистый продукт (22 мг, 42%).
ESI-MS: 403,2 [М+Н]+
Пример 62
4-(1-Фтор-1-метилэтил)-N-((S)-6-пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-бензолсульфонамид, трифторацетат
62.1 Трет-бутиловый эфир {(S)-6-[4-(1-Фтор-1-метилэтил)-бензолсульфониламино]-1,2,3,4-тетрагидронафтален-2-ил}-пропилкарбаминовой кислоты
Трет-бутиловый эфир {(S)-6-[4-(1-гидрокси-1-метилэтил)-бензолсульфониламино]-1,2,3,4-тетрагидронафтален-2-ил}-пропилкарбаминовой кислоты (50 мг, 92% чистота, 0,09 ммоль) растворили в дихлорметане (10 мл) и охладили до -78°С. Добавили диэтиламинотрифторид серы (59 мг, 0,36 ммоль) и реакционной смеси позволили нагреться до 0°С, процесс продолжался 30 минут, после чего смесь упарили досуха. Остаток растворили в насыщенном растворе NaHCO3 (10 мл) и проэкстрагировали диэтиловым эфиром (20 мл). Органический слой высушили над сульфатом магния, профильтровали и упарили досуха, получив "сырой" продукт (49 мг, 83% чистота, 88%).
62.2 4-(1-Фтор-1-метилэтил)-N-((S)-6-пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-бензолсульфонамид, трифторацетат
Трет-бутиловый эфир {(S)-6-[4-(1-фтор-1-метилэтил)-бензолсульфониламино]-1,2,3,4-тетрагидронафтален-2-ил}-пропилкарбаминовой кислоты (49 мг, 83% чистота, 0,08 ммоль) растворили в дихлорметане (10 мл). К раствору добавили трифторуксусную кислоту (1 мл) и реакционную смесь один час перемешивали при комнатной температуре, после чего упарили досуха, добавили этилацетат (15 мл) и проэкстрагировали смесь насыщенным раствором NaHCO3 (5 мл). Органический слой высушили над сульфатом магния, профильтровали и упарили досуха, получив "сырой" продукт (33 мг). "Сырой" продукт очистили хроматографией HPLC, получив чистый продукт (19 мг, 46%).
ESI-MS: 405,25 [М+Н]+
1H-NMR (DMSO-d6, 400 MHz): δ [ppm] 10,25 (s, 1H), 8,45 (m, 2H), 7,8 (d, 2H), 7,6 (d, 2H), 7,0 (d, 1H), 6,9 (d, 1H), 6,85 (s, 1H), 3,4 (m, 1H), 3,05 (dd, 1H), 2,95 (m, 2H), 2,75 (m, 3Н), 2,15 (m, 1H), 1,65 (m, 9H), 0,95 (t, 3H).
Для получения соединений, описанных в примерах с 63 по 70, были использованы методы, описанные из примера 46. Полученные соединения имеют следующие физические характеристики:
Пример 63
N-((S)-6-Этиламино-5,6,7,8-тетрагидронафтален-2-ил)-4-трифторметоксибензолсульфонамид, гидрохлорид
ESI-MS: 415,15 [М+Н]+
1H-NMR (DMSO-d6, 400 MHz): δ [ppm] 10,35 (s, 1H), 8,95 (m, 2H), 7,9 (d, 2H), 7,55 (d, 2H), 7,0 (d, 1H), 6,9 (d, 1H), 6,85 (s, 1H), 3,35 (m, 1H), 3,05 (m, 3H), 2,75 (m, 3H), 2,2 (m, 1H), 1,7 (m, 1H), 1,25 (t, 3H).
Пример 64
N((S)-6-Этиламино-5,6,7,8-тетрагидронафтален-2-ил)-4-изопропил-бензолсульфонамид, гидрохлорид
ESI-MS: 373,15 [М+Н]+
1H-NMR (DMSO-d6, 400 MHz): δ [ppm] 10,15 (s, 1H), 8,95 (m, 2H), 7,7 (d, 2H), 7,45 (d, 2H), 7,0 (d, 1H), 6,9 (d, 1H), 6,85 (s, 1H), 3,4 (m, 1H), 3,05 (m, 3H), 2,95 (sept, 1H), 2,75 (m, 3H), 2,2 (m, 1H), 1,7 (m, 1H), 1,25 (t, 3H), 1,2 (d, 6H).
Пример 65
N-[(S)-6-(2-Фторэтиламино)-5,6,7,8-тетрагидронафтален-2-ил]-4-трифторметоксибензолсульфонамид, гидрохлорид
ESI-MS: 433,15 [М+Н]+
1H-NMR (DMSO-d6, 400 MHz): δ [ppm] 10,35 (s, 1H), 9,3 (m, 2H), 7,9 (d, 2H), 7,55 (d, 2H), 7,0 (d, 1H), 6,9 (d, 1H), 6,85 (s, 1H), 4,85 (t, 1H), 4,75 (t, 1H), 3,45 (m, 2H), 3,15 (dd, 1H), 2,75 (m, 4H), 2,25 (m, 1H), 1,75 (m, 1H).
Пример 66
N-[(S)-6-(2-Фторэтиламино)-5,6,7,8-тетрагидронафтален-2-ил]-4-изопропилбензолсульфонамид, гидрохлорид
ESI-MS: 391,15 [М+Н]+
1H-NMR (DMSO-d6, 400 MHz): δ [ppm] 10,15 (s, 1H), 9,3 (m, 2H), 7,7 (d, 2H), 7,45 (d, 2H), 7,0 (d, 1H), 6,9 (d, 1H), 6,85 (s, 1H), 4,85 (t, 1H), 4,75 (t, 1H), 3,4 (m, 2H), 3,1 (dd, 1H), 2,95 (m, 1H), 2,75 (m, 4H), 2,25 (m, 1H), 1,75 (m, 1H), 1,2 (d, 6H).
Пример 67
N-[(S)-6-(3-Фторпропиламино)-5,6,7,8-тетрагидронафтален-2-ил]-4-трифторметоксибензолсульфонамид, гидрохлорид
ESI-MS: 447,15 [М+Н]+
1H-NMR (DMSO-d6, 400 MHz): δ [ppm] 10,35 (s, 1H), 9,05 (m, 2H), 7,9 (d, 2H), 7,55 (d, 2H), 7,0 (d, 1H), 6,9 (d, 1H), 6,85 (s, 1H), 4,65 (t, 1H), 4,5 (t, 1H), 3,45 (m, 1H), 3,1 (m, 3H), 2,75 (m, 3H), 2,2 (m, 1H), 2,05 (m, 2H), 1,75 (m, 1H).
Пример 68
N-[(S)-6-(3-Фторпропиламино)-5,6,7,8-тетрагидронафтален-2-ил]-4-изопропилбензолсульфонамид, гидрохлорид
ESI-MS: 405,15 [М+Н]+
1H-NMR (DMSO-d6, 400 MHz): δ [ppm] 10,15 (s, 1H), 9,1 (m, 2H), 7,7 (d, 2H), 7,45 (d, 2H), 7,0 (d, 1H), 6,9 (d, 1H), 6,85 (s, 1H), 4,65 (t, 1H), 4,5 (t, 1H), 3,4 (m, 1H), 3,1 (m, 3H), 2,95 (sept, 1H), 2,75 (m, 3Н), 2,2 (m, 1H), 2,1 (m, 2H), 1,75 (m, 1H), 1,2 (d, 6H).
Пример 69
N-((S)-6-Этиламино-5,6,7,8-тетрагидронафтален-2-ил)-4-(2-оксо-пирролидин-1-ил)-бензолсульфонамид, гидрохлорид
ESI-MS: 414,2 [М+Н]+
Пример 70
N-((S)-6-Этиламино-5,6,7,8-тетрагидронафтален-2-ил)-4-пирролидин-1-илбензолсульфонамид, гидрохлорид
ESI-MS: 400,15 [М+Н]+
1H-NMR (DMSO-d6, 400 MHz): δ [ppm] 9,8 (s, 1H), 8,95 (m, 2H), 7,55 (d, 2H), 6,95 (d, 1H), 6,9 (d, 1H), 6,85 (s, 1H), 6,55 (d, 2H), 3,4 (m, 1H), 3,25 (m, 4H), 3,05 (m, 3H), 2,75 (m, 3H), 2,2 (m, 1H), 1,95 (m, 4H), 1,7 (m, 1H), 1,25 (t, 3H).
Пример 71
4-Изопропил-N-(3-пропиламинохроман-7-ил)-бензолсульфонамид, гидрохлорид
71.1 7-Метокси-2Н-хромен-3-карбонитрил
К 2-гидрокси-4-метоксибензальдегиду (10,0 г, 65,72 ммоль) и DABCO (1,4-диазабицикло[2,2,2]октану) (1,84 г, 16,43 ммоль) добавили акрилонитрил (17,44 г, 328,62 ммоль). Реакционную смесь кипятили в течение 20 часов, после чего разбавили этилацетатом и разделили образовавшуюся слизь. Органическую фазу промыли 1 М раствором NaOH и после этого 1 М раствором HCl. Органический слой высушили над сульфатом магния, профильтровали и растворитель упарили при пониженном давлении с получением "сырого" продукта (8,89 г, 72% выход).
71.2 7-Метокси-2Н-хромен-3-карбоновая кислота
К 7-метокси-2Н-хромен-3-карбонитрилу (8,89 г, 47,49 ммоль) добавили 10 М раствор NaOH (40 мл). Реакционную смесь кипятили 6 часов. Охладив ее до комнатной температуры, довели рН смеси до 2 с помощью концентрированной HCl. Осадок отделили фильтрованием и промыли водой с получением чистого продукта (6,07 г, 62% выход).
71.3 7-Метоксихроман-3-он
7-Метокси-2Н-хромен-3-карбоновую кислоту (6,07 г, 29,44 ммоль) и триэтиламин (4,8 мл, 34,48 ммоль) растворили в дихлорметане (60 мл). Дифенилфосфорил азид (6,54 мл, 29,44 ммоль) растворили в толуоле (24 мл) и по каплям добавили к полученной смеси, медленно повышая температуру до 60°С. После этого добавили 60 мл толуола и реакционную смесь 90 минут перемешивали при 70°С. К смеси добавили 10 М раствор HCl (28 мл), после чего ее 2 часа перемешивали при температуре кипения. Охладив смесь до комнатной температуры, фазы разделили. Органическую фазу проэкстрагировали водным раствором NaHCO3. Органический слой высушили над сульфатом магния, профильтровали и растворитель упарили при пониженном давлении. "Сырой" продукт очистили хроматографией на силикагеле с использованием смеси циклогексан/этилацетат (от 100:0 до 95:5) в качестве элюента, получив заявленный продукт (1,47 г, 24% выход).
ESI-MS: 179,05 [М+Н]+
71.4 (7-Метоксихроман-3-ил)-пропиламин
7-Метоксихроман-3-он (1,47 г, 8,25 ммоль) и пропиламин (748 мкл, 9,07 ммоль) растворили в дихлорметане (20 мл). Уксусную кислоту (710 мкл, 12,37 ммоль) и трисацетоксиборогидрид натрия (3,5 г, 16,51 ммоль) последовательно добавили к реакционной смеси, после чего ее перемешивали в течение 1 часа при комнатной температуре. Затем в систему добавили дихлорметан и воду. Водный слой защелочили 1 М раствором NaOH, отделили и три раза проэкстрагировали дихлорметаном. Объединенные органические фазы высушили над сульфатом магния, профильтровали и упарили досуха, получив "сырой" продукт (1,68 г, 92% выход).
ESI-MS: 222,15 [М+Н]+
71.5 3-Пропиламинохроман-7-ол, гидробромид
(7-Метоксихроман-3-ил)-пропиламин (1,3 г, 5,87 ммоль) растворили в дихлорметане (100 мл) и охладили до -78°С. К раствору добавили трибромид бора (11,7 мл, 122,52 ммоль) и реакционной смеси позволили нагреться до комнатной температуры, процесс продолжался одну ночь. После этого смесь охладили до -78°С и медленно добавили смесь метанола и дихлорметана (2:3). Реакционной смесь снова позволили нагреться до комнатной температуры и затем упарили досуха, получив "сырой" продукт (1,69 г, 5,86 ммоль)
ESI-MS: 208,15[М+Н]+
71.6 Трет-бутиловый эфир
(7-гидроксихроман-3-ил)-пропилкарбаминовой кислоты
3-Пропиламинохроман-7-ол, гидробромид, (1,69 г, 5,86 ммоль) растворили в дихлорметане (50 мл), после чего добавили триэтиламин (4,08 мл, 29,32 ммоль) и ди-трет-бутилдикарбонат (1,28 г, 5,86 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Затем смесь сконцентрировали в вакууме и растворили в диэтиловом эфире и воде. рН водного слоя довели до 4 добавлением 5% раствора лимонной кислоты. Органическую фазу отделили и промыли водой и соляным раствором. Органический слой высушили над сульфатом магния, профильтровали и упарили досуха, получив требуемый продукт (1,61 г, 89%).
ESI-MS: 252,15 [М+Н-С(СН3)3]+
71.7 3-(Трет-бутоксикарбонилпропиламино)-хроман-7-иловый эфир трифторметансульфоновой кислоты
Трет-бутиловый эфир (7-гидроксихроман-3-ил)-пропилкарбаминовой кислоты (1,58 г, 5,14 ммоль) и триэтиламин (2,15 мл, 15,42 ммоль) растворили в дихлорметане (40 мл) и охладили до -78°С. Трифторметансульфоновый ангидрид (1,45 г, 5,14 ммоль) также растворили в дихлорметане (10 мл) и медленно добавили к реакционной смеси. Перемешивание продолжали 2 часа. Реакционной смеси позволили нагреться до комнатной температуры, разбавили дихлорметаном и дважды промыли водным раствором лимонной кислоты (рН 4). Органическую фазу отделили и промыли соляным раствором. Органический слой высушили над сульфатом магния, профильтровали и упарили досуха, получив требуемый продукт (2,57 г, 88% чистота, 100% выход).
ESI-MS: 384,05 [М+Н-С(СН3)3]+
71.8 3-Пропиламинохроман-7-иловый эфир трифторметансульфоновой кислоты
3-(Трет-бутоксикарбонилпропиламино)-хроман-7-иловый эфир трифторметансульфоновой кислоты (2,1 г, 4,78 ммоль) растворили в дихлорметане (30 мл). К раствору добавили трифторуксусную кислоту (3 мл) и реакционную смесь перемешивали при комнатной температуре в течение 3 часов, после чего упарили досуха. В систему дважды добавили дихлорметан и упарили реакционную смесь досуха с получением заявленного продукта (2,6 г, 65% чистота).
ESI-MS: 340,05 [М+Н]+
71.9 3-(Бензилпропиламино)-хроман-7-иловый эфир трифторметансульфоновой кислоты
3-Пропиламинохроман-7-иловый эфир трифторметансульфоновой кислоты (1,62 г, 4,78 ммоль) и бензальдегид (975 мкл, 9,56 ммоль) растворили в дихлорметане (60 мл). К раствору добавили уксусную кислоту (710 мкл, 12,37 ммоль) и трисацетоксиборогидрид натрия (3,04 г, 14,34 ммоль), после чего смесь оставили на выходные перемешиваться при комнатной температуре. Затем добавили дихлорметан и воду. рН водного слоя довели до 6 добавлением 1 М раствора NaOH. Органический слой отделили, высушили над сульфатом магния, профильтровали и упарили досуха, получив "сырой" продукт. Его очистили хроматографией на силикагеле с использованием смеси циклогексан/этилацетат (от 100:0 до 95:5) в качестве элюента, получив очищенный продукт (1,24 г, 50% чистота, 30% выход).
ESI-MS: 430,15 [М+Н]+
71.10 N-3-Бензил-N-3-пропилхроман-3,7-илдиамин
В инертной атмосфере (аргон), 3-(бензилпропиламино)-хроман-7-иловый эфир трифторметансульфоновой кислоты (1,25 г, 2,91 ммоль), бензгидрилиденамин (528 мг, 2,91 ммоль) и трет-бутоксид натрия (420 мг, 4,37 ммоль) растворили в толуоле (15 мл) при комнатной температуре. Трис(дибензилиденацетон)дипалладий (320 мг, 0,35 ммоль) и BINAP (2,2'-бис(дифенилфосфино)-1,1'-бинафтил) (326 мг, 0,52 ммоль) также растворили в толуоле (5 мл) и добавили к реакционной смеси, после чего ее 4 часа кипятили при перемешивании. Затем смесь охладили, профильтровали и упарили досуха. Остаток обработали тетрагидрофураном и 1 М раствором HCl (40 мл). Тетрагидрофуран упарили и добавили диэтиловый эфир. Водный слой отделили и дважды проэкстрагировали диэтиловым эфиром. Затем его защелочили 1 М раствором NaOH и несколько раз снова проэкстрагировали диэтиловым эфиром. Объединенные органические фазы высушили над сульфатом магния, профильтровали и упарили досуха, получив "сырой" продукт."Сырой" продукт очистили хроматографией на силикагеле с использованием смеси дихлорметан/метанол (от 100:0 до 95:5) в качестве элюента, получив требуемый продукт (110 мг, 35% чистота, 5% выход).
ESI-MS: 297,15 [М+Н]+
71.11 N-[3-(Бензилпропиламино)-хроман-7-ил]-4-изопропил-бензолсульфонамид
N-3-Бензил-N-3-пропилхроман-3,7-илдиамин (110 мг, 0,13 ммоль) растворили в тетрагидрофуране (5 мл). К смеси добавили диметиламинопиридин (17 мг, 0,13 ммоль) и 4-изопропилбензол сульфонилхлорид (57 мг, 0,26 ммоль), после чего ее одну ночь перемешивали при комнатной температуре. Растворитель упарили при пониженном давлении, остаток обработали водой и диэтиловым эфиром. Органический слой высушили над сульфатом магния, профильтровали и растворитель упарили при пониженном давлении с получением "сырого" продукта (2,5 г). "Сырой" продукт очистили хроматографией на силикагеле с использованием смеси дихлорметан/метанол (от 100:0 до 0:100) в качестве элюента, получив очищенный продукт (25 мг, 40%).
ESI-MS: 479,25 [М+Н]+
71.12 4-Изопропил-N-(3-пропиламинохроман-7-ил)-бензолсульфонамид, гидрохлорид
Смесь N-[3-(бензилпропиламино)-хроман-7-ил]-4-изопропил-бензолсульфонамида (25 мг, 0,05 ммоль) и 10% палладия на углероде (3 мг) в метаноле (5 мл) гидрировали в течение ночи. Катализатор отфильтровали и растворитель удалили в вакууме, получив неочищенный продукт."Сырой" продукт очистили хроматогрфией в обращенной фазе. После этого очищенный продукт преобразовали в гидрохлорид (5,8 мг, 26% выход).
ESI-MS: 389,15 [М+Н]+
1H-NMR, измерен для свободного основания: 1H-NMR (СН3ОН-d4, 400 MHz): d [ppm] 7,75 (d, 2H), 7,4 (d, 2H), 7,05 (d, 1H), 6,75 (m, 2H), 4,35 (m, 1H), 4,25 (m, 1H), 3,8 (m, 1H), 3,35 (dd, 1H), 3,1 (m, 2H), 2,95 (m, 2H), 1,75 (m, 2H), 1,25 (d, 6H), 1,05 (t, 3Н).
Для получения соединений, описанных в примерах 72 и 73, были использованы методы из примера 46. Полученные соединения имеют следующие физические характеристики:
Пример 72
4-((S)-2-Фтор-1-метилэтил)-N-((R)-6-пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-бензолсульфонамид, гидрохлорид
ESI-MS: 405,15 [М+Н]+
1H-NMR (СН3ОН-d4, 400 MHz): δ [ppm] 7,6 (d, 2H), 7,3 (d, 2H), 6,9 (d, 1H), 6,85 (d, 1H), 6,8 (s, 1H), 4,45 (d, 1H), 4,3 (d, 1H), 3,35 (m, 1H), 3,1 (m, 2H), 3,0 (m, 2H), 2,75 (m, 3Н), 2,2 (m, 1H), 1,65 (m, 3Н), 1,2 (d, 3H), 0,95 (t, 3H).
Пример 73
N-((R)-6-Пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-4-(2,2,2-трифтор-1-метилэтил)-бензолсульфонамид
ESI-MS: 441,15 [M+H]+
1H-NMR (СН3ОН-d4, 400 MHz): δ [ppm] 7,75 (d, 2H), 7,5 (d, 2H), 6,95 (d, 1H), 6,85 (d, 1H), 6,8 (s, 1H), 3,7 (m, 1H), 2,95 (m, 2H), 2,7 (m, 4H), 2,5 (m, 1H), 2,1 (m, 1H), 1,55 (m, 3Н), 1,5 (d, 3Н), 1,0 (t, 3Н).
Пример 74
4-дифторметокси-N-((S)-6-пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-бензолсульфонамид, гидрохлорид
74.1 Трет-бутиловый эфир ((S)-6-бром-1,2,3,4-тетрагидронафтален-2-ил)-карбаминовой кислоты
К раствору (S)-6-бром-1,2,3,4-тетрагидронафтален-2-иламина (10,0 г, 38,08 ммоль) и ди-трет-бутилдикарбоната (10,39 г, 47,6 ммоль) в дихлорметане (200 мл) добавили триэтиламин (21,12 мл, 152,34 ммоль). Реакционную смесь перемешивали в течение 1 часа при комнатной температуре, затем дважды проэкстрагировали водой (50 мл). Органический слой высушили над сульфатом магния, профильтровали и упарили досуха, получив чистый продукт (12,2 г, 98% выход).
ESI-MS: 310,95/312,95 [М+Н-СН3]+
74.2 Трет-бутиловый эфир ((S)-6-бром-1,2,3,4-тетрагидронафтален-2-ил)-пропилкарбаминовой кислоты
Трет-бутиловый эфир ((S)-6-бром-1,2,3,4-тетрагидронафтален-2-ил)-карбаминовой кислоты (12,2 г, 37,4 ммоль) растворили в N.N-диметилформамиде (1000 мл). Добавили гидрид натрия (50% в масле) (1,975 г, 41,14 ммоль) и перемешивали в течение 15 минут при комнатной температуре. Затем добавили пропилбромид (3,74 мл, 41,14 ммоль) и перемешивали реакционную смесь при комнатной температуре еще одну ночь. Затем ее вылили на смесь льда и H2O (400 мл) и дважды проэкстрагировали 200 мл диэтилового эфира. Органический слой высушили над сульфатом магния, профильтровали и упарили досуха, получив 14,4 г "сырого" продукта. "Сырой" продукт очистили хроматографией на силикагеле, используя в качестве элюента смесь циклогексан/этилацетат (95:5), и получили чистый продукт (10,5 г, 76%).
74.3 Трет-бутиловый эфир ((S)-6-амино-1,2,3,4-тетрагидронафтален-2-ил)-пропилкарбаминовой кислоты
В инертной атмосфере (аргон), трет-бутиловый эфир ((S)-6-бром-1,2,3,4-тетрагидронафтален-2-ил)-пропилкарбаминовой кислоты (5,0 г, 13,58 ммоль) растворили в толуоле (150 мл) при комнатной температуре. В реакционную смесь добавили трис(дибензилиденацетон)дипалладий (622 мг, 0,68 ммоль) и три-трет-бутилфосфан (412 мг, 2,04 ммоль). Через 15 минут медленно добавили еще бис-(триметилсилил)лития амид (29,86 мл 1 М раствора в тетрагидрофуране) и перемешивали реакционную смесь в течение 1 часа при 100°С. Затем смесь охладили, медленно добавили H2O (150 мл) и несколько раз проэкстрагировали диэтиловым эфиром. Органический слой высушили над сульфатом магния, профильтровали и упарили досуха, получив 6,9 г "сырого" продукта (95% выход, 57% чистота).
ESI-MS: 249,15 [М+Н-С(СН3)3]+
74.4 Трет-бутиловый эфир [(S)-6-(4-дифторметоксибензолсульфониламино)-1,2,3,4-тетрагидронафтален-2-ил]-пропилкарбаминовой кислоты
Трет-бутиловый эфир ((S)-6-амино-1,2,3,4-тетрагидронафтален-2-ил)-пропилкарбаминовой кислоты (1,5 г, 4,93 ммоль) растворили в тетрагидрофуране (50 мл). Последовательно добавили диметиламинопиридин (100 мг, 0,82 ммоль) и дифторметоксибензолсульфонилхлорид (1,195 г, 4,93 ммоль) и перемешивали реакционную смесь при комнатной температуре одну ночь. Растворитель упарили при пониженном давлении, остаток смешали с водой и диэтиловым эфиром. Органический слой высушили над сульфатом магния, профильтровали и растворитель упарили при пониженном давлении, получив "сырой" продукт (2,5 г). Этот продукт затем очистили хроматографией на силикагеле, используя в качестве элюента смесь дихлорметан/метанол (от 100:0 до 96:4), и получили чистый продукт (2,08 г, 83%).
74.5 4-Дифторметокси-N-((S)-6-пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-бензолсульфонамид, гидрохлорид
Трет-бутиловый эфир [(S)-6-(4-дифторметоксибензолсульфониламино)-1,2,3,4-тетрагидронафтален-2-ил]-пропилкарбаминовой кислоты (2,08 г, 4,07 ммоль) растворили в дихлорметане (100 мл), добавили трифторуксусную кислоту (10 мл) и перемешивали реакционную смесь при комнатной температуре в течение 1 часа. Реакционную смесь упарили досуха, добавили диэтиловый эфир (100 мл) и проэкстрагировали насыщенным раствором NaHCO3. К органическому слою добавили раствор гидрохлорида в эфире и упарили растворитель. К остатку добавили диэтиловый эфир (25 мл) и отфильтровали кристаллический осадок, получив чистый продукт (1,41 г, 77% выход).
ESI-MS: 411,15 [М+Н]+
1H-NMR (DMSO-d6, 400 MHz): δ [ppm] 10,25 (s, 1H), 9,0 (m, 2H), 7,8 (d, 2H), 7,35 (t, J=70 Hz, 1H), 7,3 (d, 2H), 7,0 (d, 1H), 6,9 (d, 1H), 6,85 (s, 1H), 3,4 (m, 1H),3,1 (dd, 1H), 2,95 (m, 2H), 2,75 (m, 3Н), 2,2 (m, 1H), 1,7 (m, 3H), 0,9 (t, 3Н).
Пример 75
4-Дифторметокси-N-((R)-6-пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-бензолсульфонамид, гидрохлорид
Соединение примера 75 было синтезировано в соответствии с процедурой, описанной в примере 74, за исключением того, что на этапе 75.1 вместо (S)-6-бром-1,2,3,4-тетрагидронафтален-2-иламина был использован (R)-6-бром-1,2,3,4-тетрагидронафтален-2-иламин.
Для получения соединений, описанных в примерах с 76 по 81, были использованы методы из примера 47. Полученные соединения имеют следующие физические характеристики:
Пример 76
N-((S)-6-Пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-4-пиразол-1-илбензолсульфонамид, гидрохлорид
Присоединение сульфонамида: выход 14% (количество 24 мг); удаление защитной трет-бутоксикарбонильной группы: выход: 45% (количество 12 мг);
ESI-MS: 411,2 [М+Н]+;
1H-NMR (DMSO-d6, 400 MHz): δ [ppm] 10,22 (s, 1H), 8,70 (br m, 2H), 8,59 (s, 1H), 8,03 (d, 2H), 7,84 (d, 2H), 7,82 (s, 1H), 6,90 (m, 3H), 6,60 (s, 1H), 2,92 (m, 2H), 2,72 (m, 2H), 2,15 (m, 1H), 1,68 (m, 2H), 0,92 (t, 3H).
Пример 77
4-(2,2-дифтор-1-метилэтил)-N-((S)-6-пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-бензолсульфонамид, гидрохлорид
Присоединение сульфонамида: продукт синтезирован в количестве 300 мг; выход 97%; удаление защитной трет-бутоксикарбонильной группы: продукт синтезирован в количестве 190 мг; выход: 72%.
ESI-MS: 423,1 [М+Н]+
1H-NMR (DMSO-d6, 400 MHz): δ [ppm] 10,22 (s, 1H), 8,75 (br m, 2H), 7,74 (d, 2H), 7,50 (d, 2H), 6,92 (m, 3H), 6,19 (t, 1H), 3,36 (m, 1H), 3,09 (m, 1H), 2,93 (m, 2H), 2,72 (m, 2H), 2,18 (m, 1H), 1,68 (m, 3H), 1,30 (m, 3H), 0,92 (t, 3H).
Пример 78
4-Оксазол-5-ил-N-((R)-6-пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-бензолсульфонамид
78.1 Трет-бутиловый эфир [(R)-6-(4-оксазол-5-илбензолсульфониламино)-1,2,3,4-тетрагидронафтален-2-ил]-пропилкарбаминовой кислоты
Продукт синтезирован в количестве 165 мг, выход 75%.
1SI-MS: 512,1 [М+Н]+
78.2 4-Оксазол-5-ил-N-((R)-6-пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-бензолсульфонамид
Продукт синтезирован в количестве: 150 мг, выход 100%.
ESI-MS: 412,1 [М+Н]+
Пример 79
((R)-6-Пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-амид 5-оксазол-5-илтиофен-2-сульфоновой кислоты
79.1 Трет-бутиловый эфир [(R)-6-(5-оксазол-5-илтиофен-2-сульфониламино)-1,2,3,4-тетрагидронафтален-2-ил]-пропилкарбаминовой кислоты
Продукт синтезирован в количестве 201 мг, выход 91%.
ESI-MS: 518,1 [М+Н]+
79.2 ((R)-6-Пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-амид 5-оксазол-5-илтиофен-2-сульфоновой кислоты
Продукт синтезирован в количестве 172 мг; выход: 100%
ESI-MS: 418,1 [М+Н]+
Пример 80
4-(2,2-Дифтор-1-метилэтил)-N-((R)-6-пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-бензолсульфонамид
80.1 Трет-бутиловый эфир {(R)-6-[4-(2,2-дифтор-1-метилэтил)-бензолсульфониламино]-1,2,3,4-тетрагидронафтален-2-ил}-пропилкарбаминовой кислоты
Продукт синтезирован в количестве: 247 мг; выход: 100%.
ESI-MS: 523,1 [М+Н]+
80.2 4-(2,2-Дифтор-1-метилэтил)-N-((R)-6-пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-бензолсульфонамид
Продукт синтезирован в количестве: 235 мг; выход: 100%.
ESI-MS: 423,1 [М+Н]+
Пример 81
4-(Бром)-N-((R)-6-пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-бензолсульфонамид
81.1 Трет-бутиловый эфир [(R)-6-(4-бромбензолсульфониламино)-1,2,3,4-тетрагидронафтален-2-ил]-пропилкарбаминовой кислоты
Продукт синтезирован в количестве: 317 мг; выход: 62%.
ESI-MS: 523,1, 525,1 1 [М+Н]+
81.2 4-(Бром)-N-((R)-6-пропиламино-5,6,7,8-тетрагидронафтален-2-ил)-бензолсульфонамид
Примеры составления фармацевтических форм
A) Таблетки
Таблетки приводимого далее состава можно компрессировать на прессе для таблеток традиционным способом:
40 мг вещества из примера 8
120 мг кукурузного крахмала
13,5 мг желатина
45 мг лактозы
2,25 мг вещества Aerosil(r) (химически чистая кремниевая кислота в виде субмикроскопически измельченных частиц)
6,75 мг картофельного крахмала (в виде 6% клейкой массы)
B) Таблетки с сахарным покрытием
20 мг вещества из примера 8
60 мг состава основной части таблетки
70 мг сахарного состава для покрытия таблетки
Основная часть таблетки состоит из 9 частей кукурузного крахмала, 3 частей лактозы и 1 части сополимера винилпирролидон/винилацетат (60:40). Сахарный состав состоит из 5 частей тростникового сахара, 2 частей кукурузного крахмала, 2 частей карбоната кальция и 1 части талька. Приготовленные таким способом таблетки, покрытые сахаром, затем покрываются составом, устойчивым к действию желудочного сока.
Биологические исследования
Эксперименты по связыванию с рецепторами:
Исследуемое вещество сначала растворяли либо в смеси метанол/Chremophor(r) (BASF-AG), либо в диметилсульфоксиде и затем разбавляли водой до создания требуемой концентрации.
Дофаминовые D3 рецепторы:
Смесь для анализа (0,250 мл) состояла из мембран, выделенных приблизительно из 106 клеток НЕК-293, стабильно экспрессирующих человеческие D3 рецепторы, 0,1 нМ [125I]-иодсульприда и инкубационного буфера (общее связывание). При построении кривых ингибирования в среду добавляли тестируемые вещества, а для определения неспецифического связывания - 1 мкМ спиперона. Каждый анализ повторяли трижды.
Инкубационный буфер содержал 50 мМ трис, 120 мМ NaCl, 5 мМ KCl, 2 мМ CaCl2, 2 мМ MgCl2 и 0,1% бычьего сывороточного альбумина, 10 мкМ хинолона и 0,1% аскорбиновой кислоты (растворенной в день проведения эксперимента). рН буфера доводили до 7,4 соляной кислотой.
Дофаминовые D2L рецепторы:
Смесь для анализа (1 мл) состояла из мембран, выделенных приблизительно из 106 клеток НЕК-293, стабильно экспрессирующих человеческие D2L рецепторы (длинная изоформа), 0,01 нМ [125I]-иодспиперона и инкубационного буфера (общее связывание). При построении кривых ингибирования в среду добавляли тестируемые вещества, а для определения неспецифического связывания - 1 мкМ галоперидола. Каждый анализ повторяли трижды.
Инкубационный буфер содержал 50 мМ трис, 120 мМ NaCl, 5 мМ KCl, 2 мМ CaCl2, 2 мМ MgCl2 и 0,1% бычьего сывороточного альбумина. рН буфера доводили до 7,4 соляной кислотой.
Измерения и анализ
После часовой инкубации при температуре 25°С смесь для анализа профильтровали под вакуумом через фильтр из стекловолокна Whatman GF/B с использованием приспособления для сбора клеток. Фильтры перенесли в сцинтилляционные сосуды с помощью специальной системы для переноса фильтров. После добавления 4 мл состава Ultima Gold((Packard) образцы встряхивались в течение одного часа, после чего определили радиоактивность счетчиком Beta-Counter (Packard, Tricarb 2000 или 2200СА). Для преобразования значений радиоактивности (срm) в значения dpm использовали стандартные серии гашения и поставляемую совместно с измерительным прибором программу.
Кривые ингибирования проанализировали итеративным методом нелинейной регрессии с использованием системы статистического анализа (Statistical Analysis System (SAS)), похожей на программу "LIGAND", описанную в работе Munson и Rodbard.
Результаты экспериментов по связыванию с рецепторами выражены в виде описанных выше констант связывания с рецепторами Ki(D2) и Ki(D3) соответственно и представлены в таблице 2.
В этих экспериментах соединения настоящего изобретения демонстрируют очень хорошее сродство к D3 рецепторам (часто <20 нМ, в особенности <5 нМ) и селективное связывание с D3 рецепторами.
Результаты экспериментов по связыванию представлены в таблице 5.






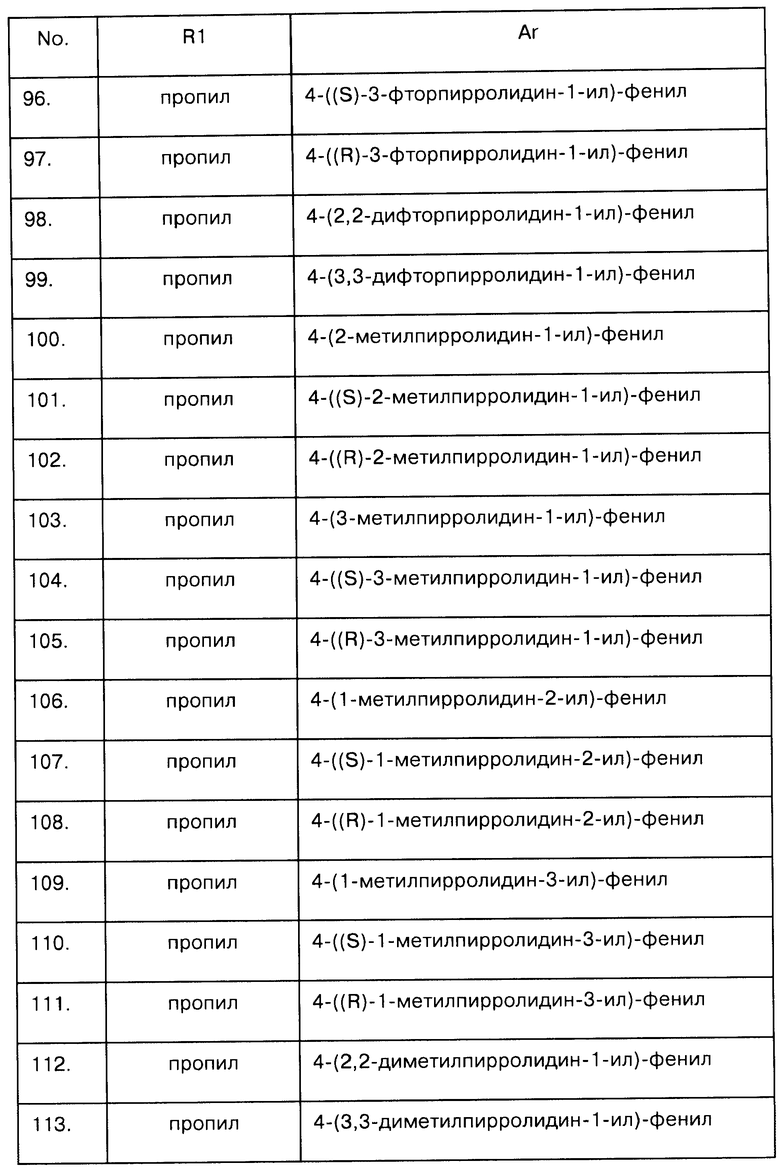
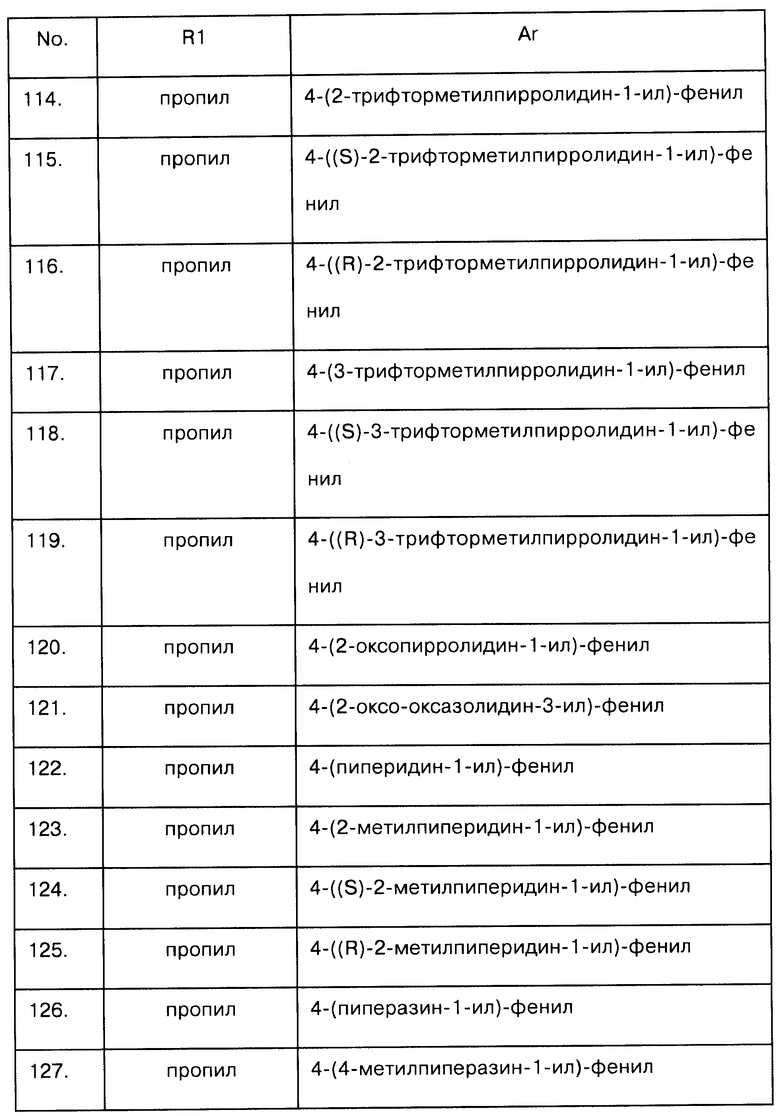
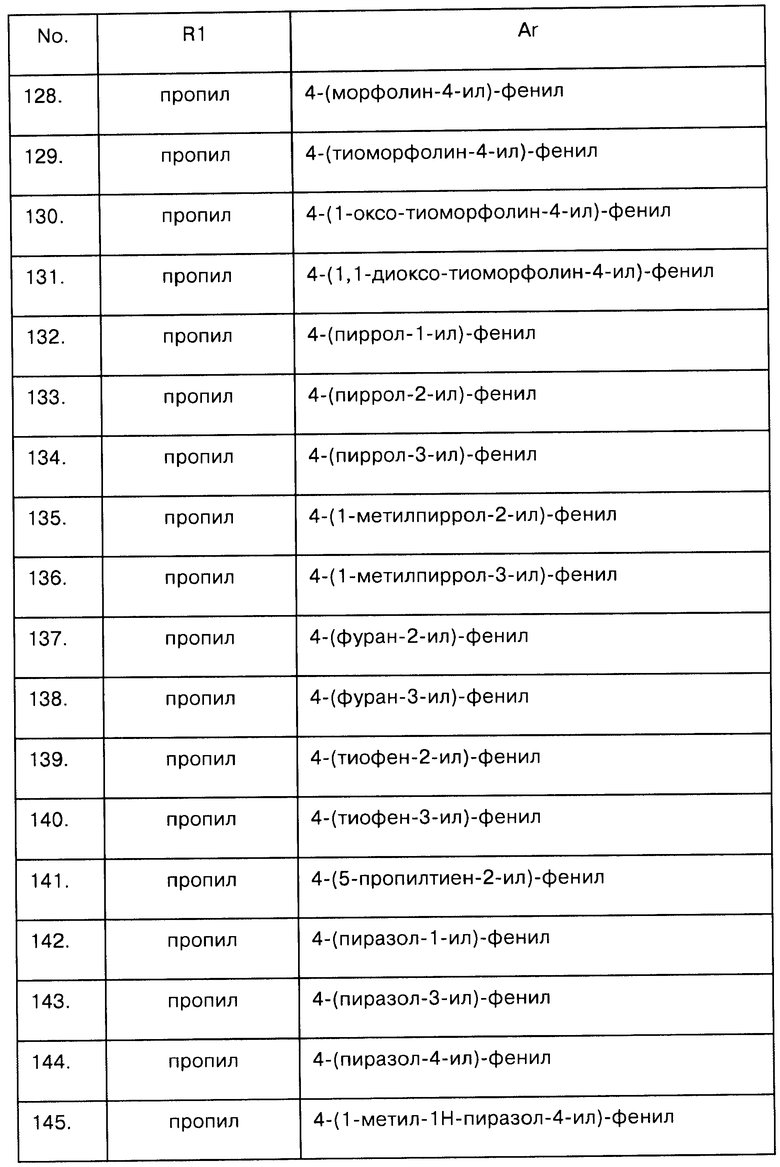
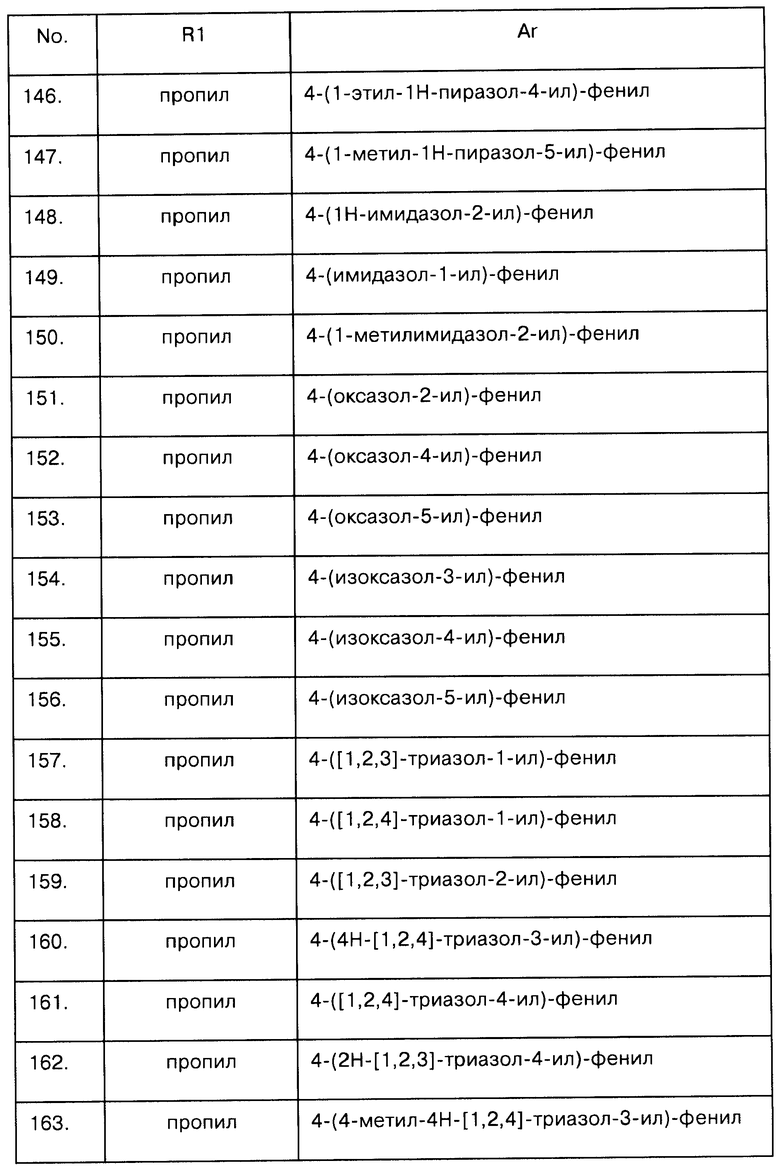

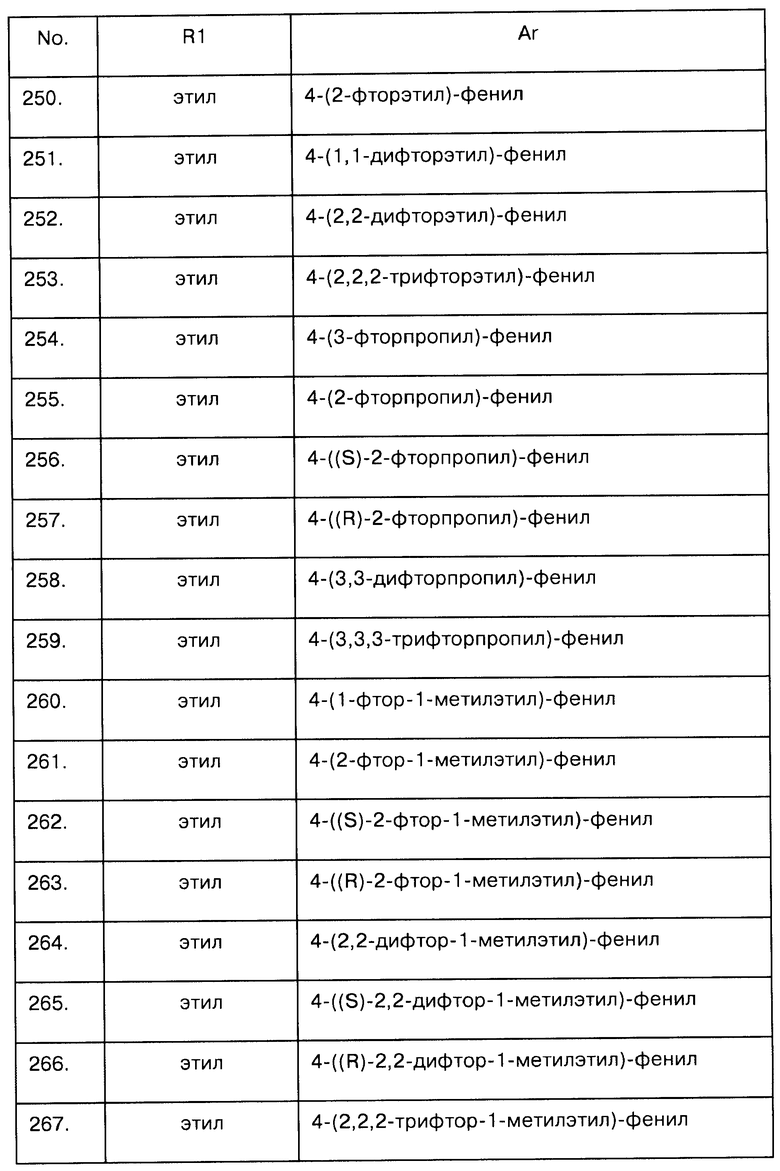
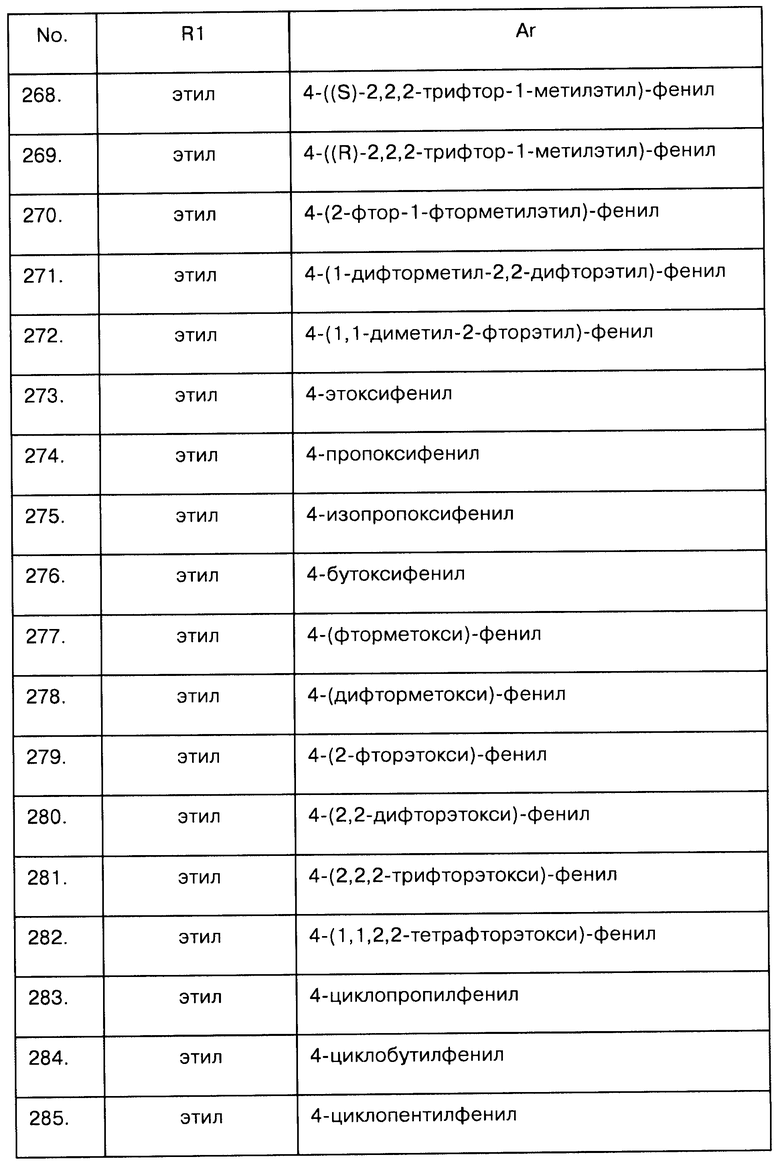
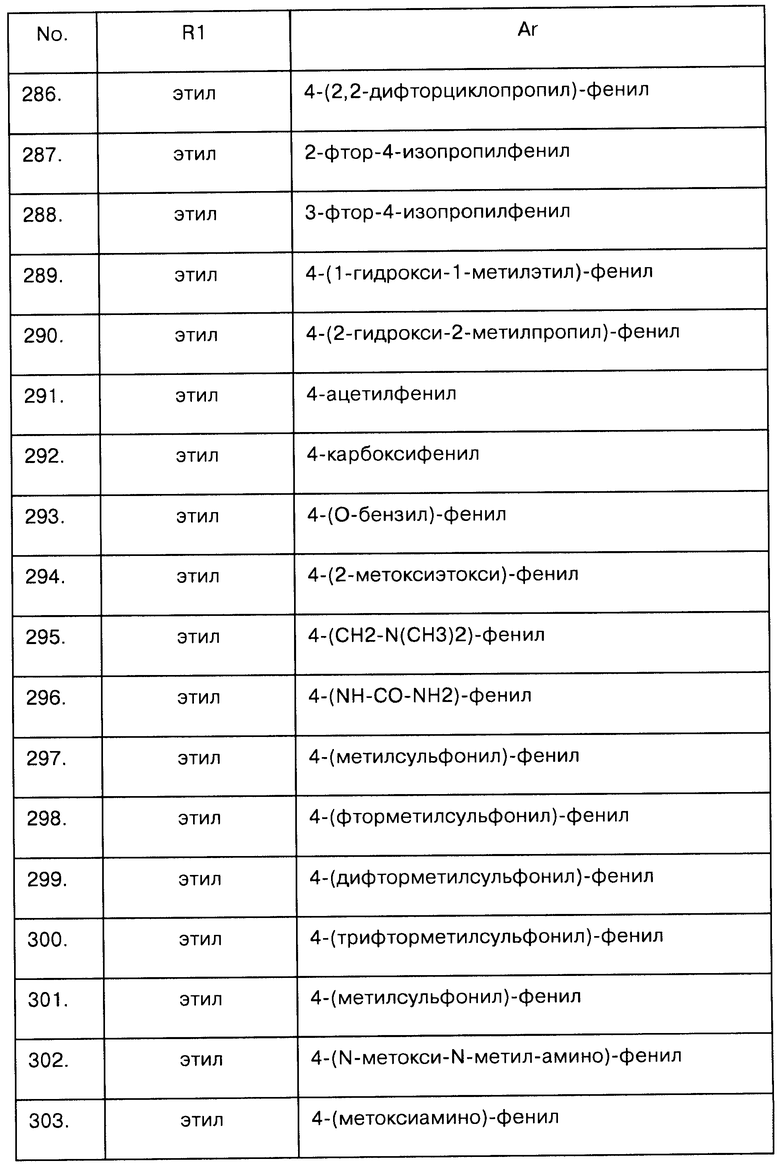
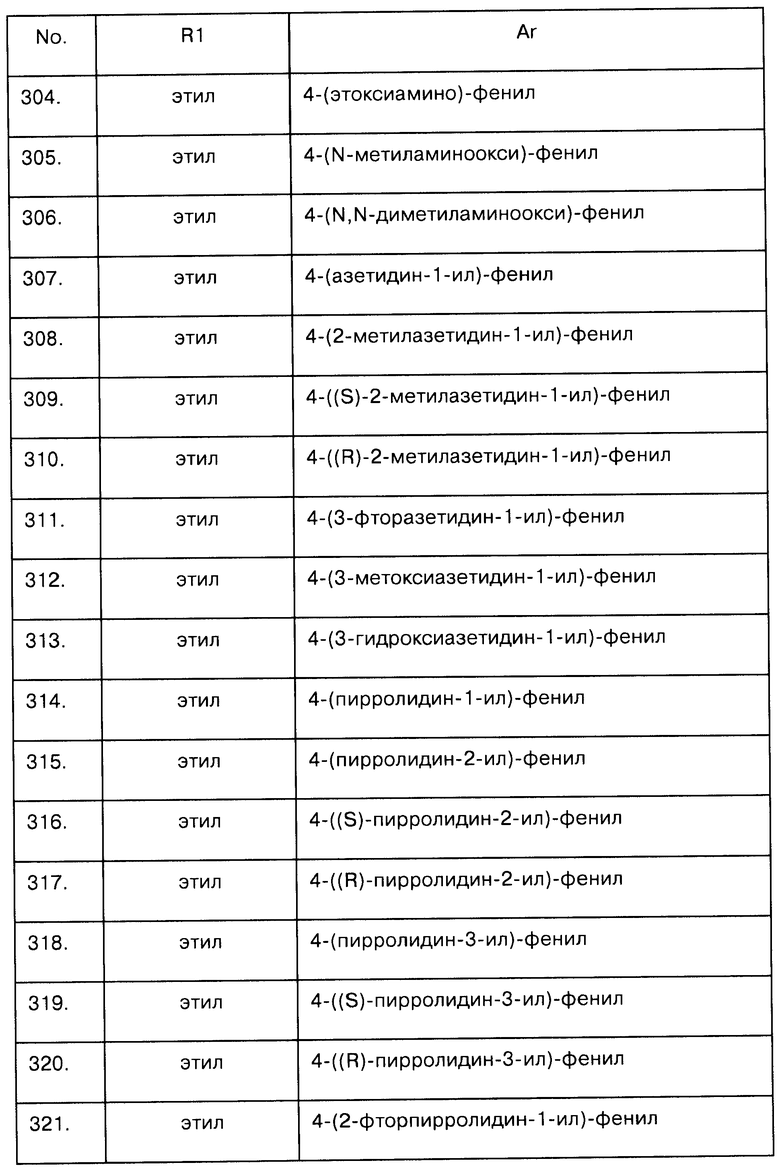
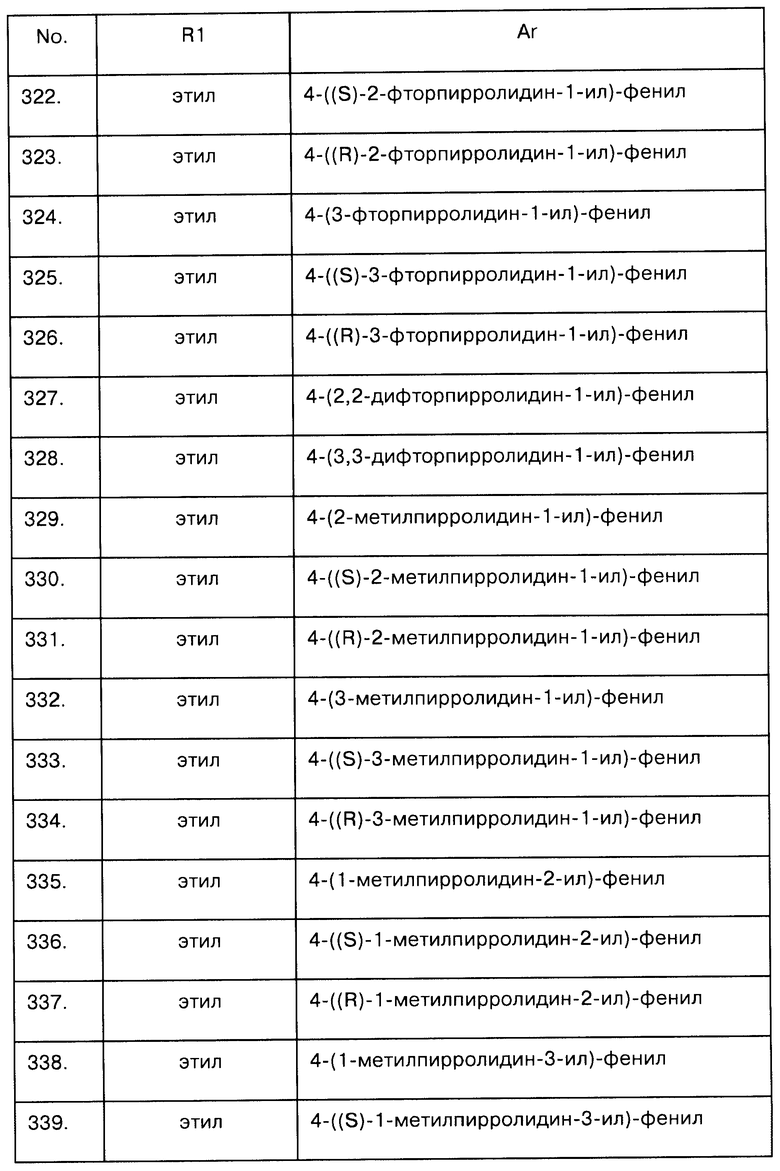
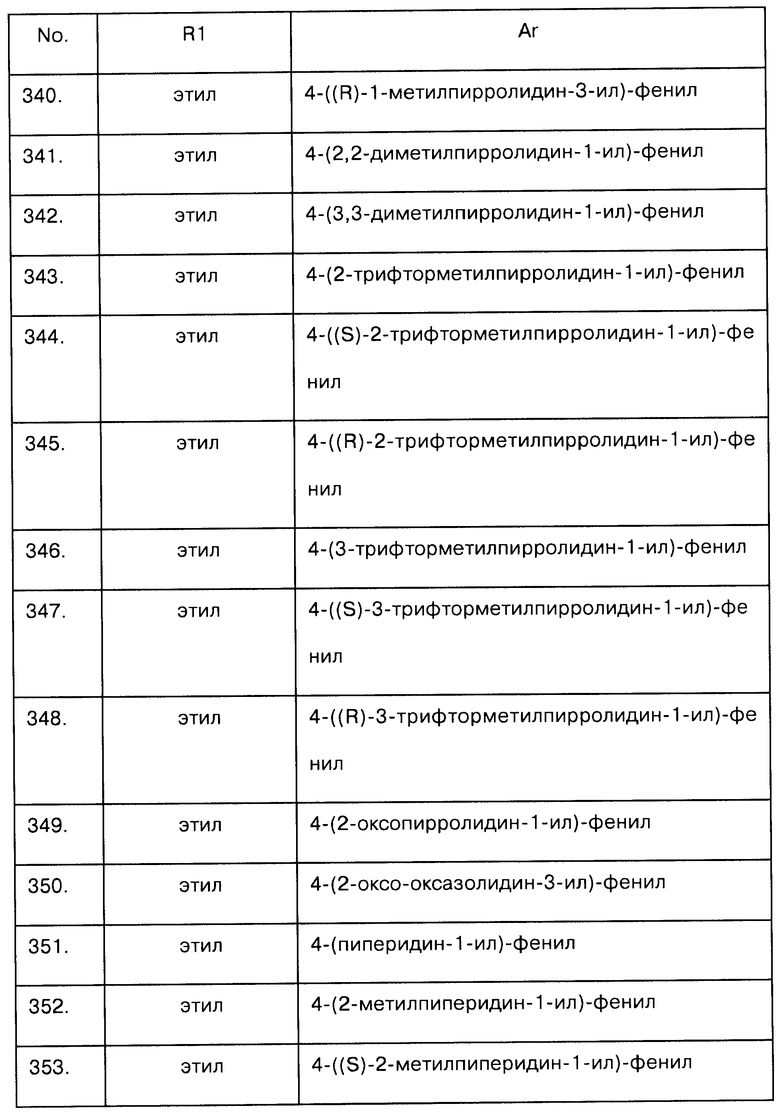
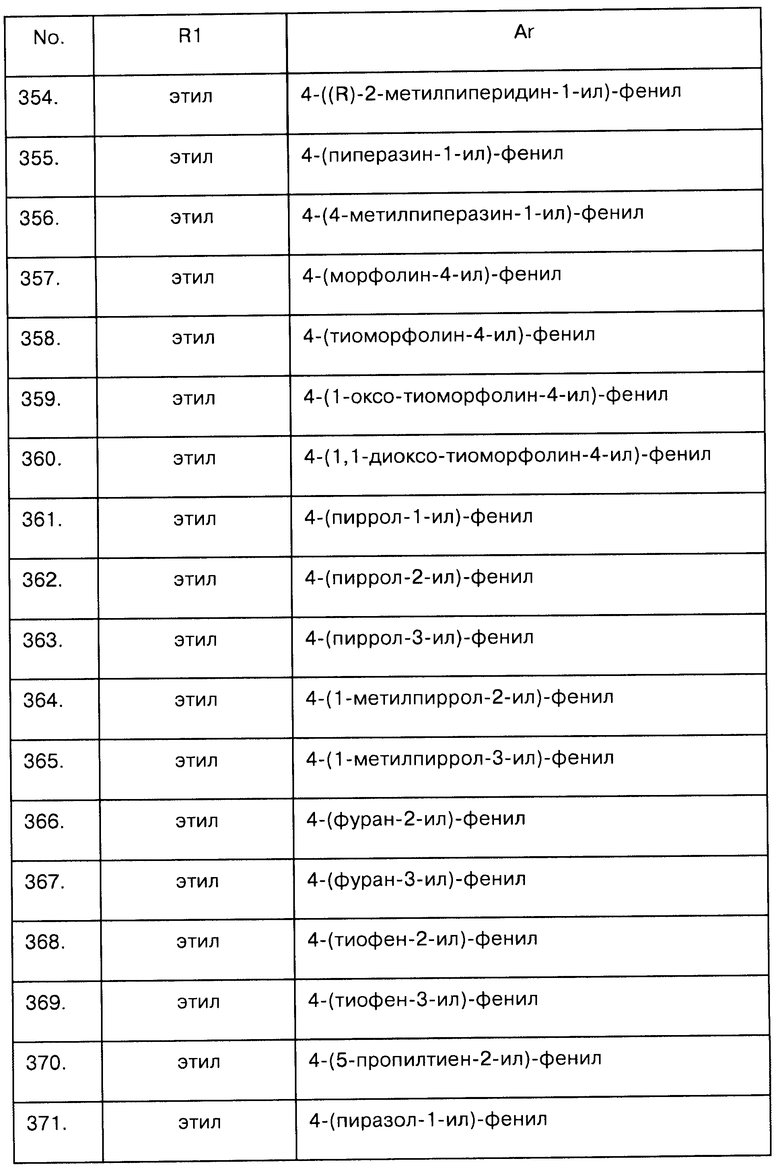
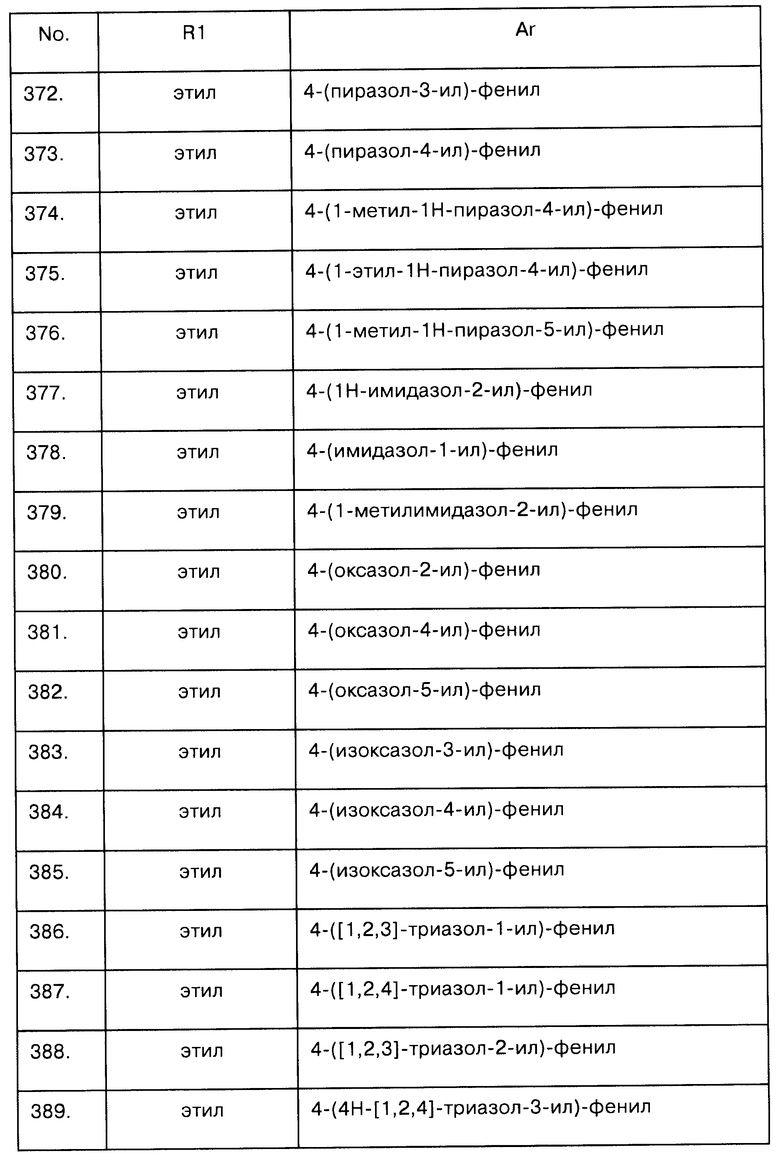
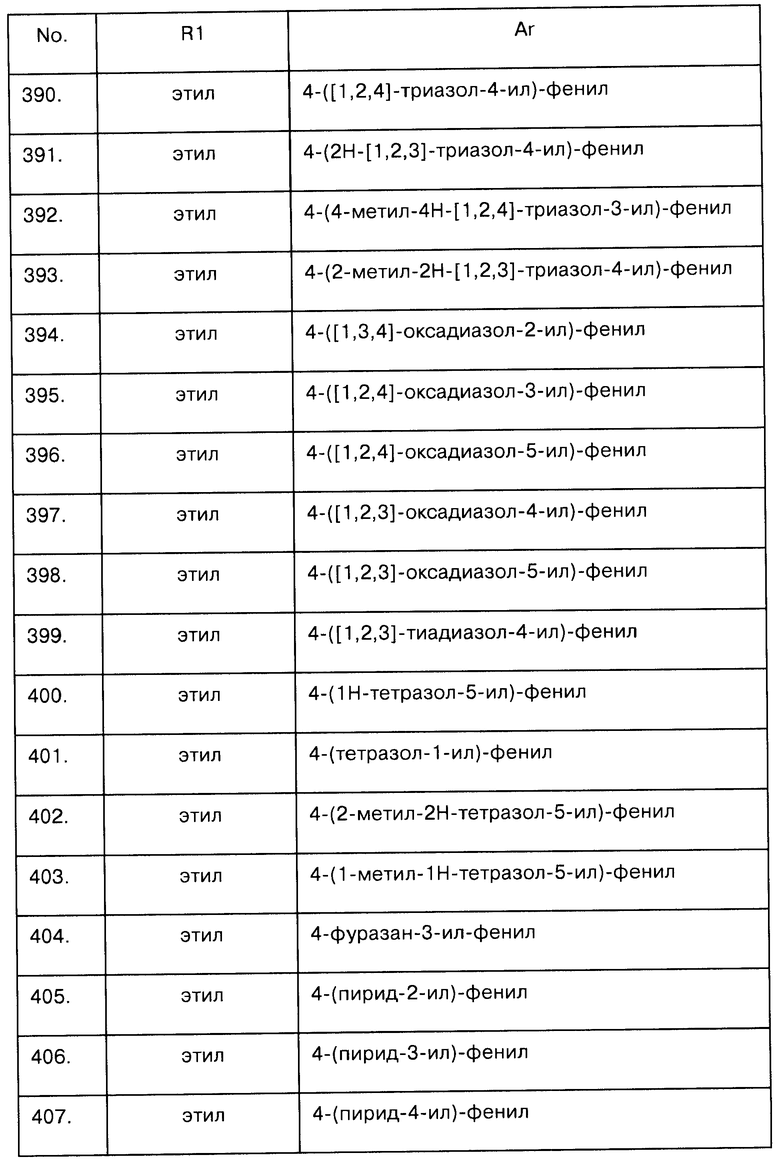

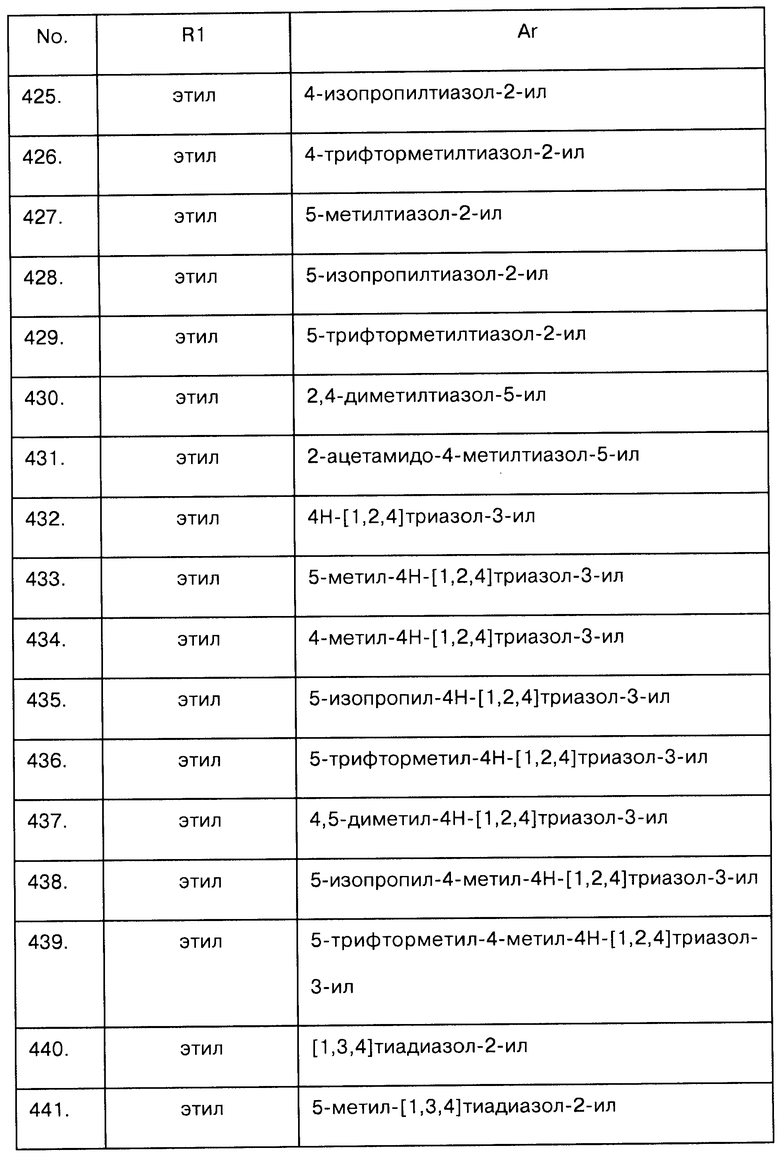

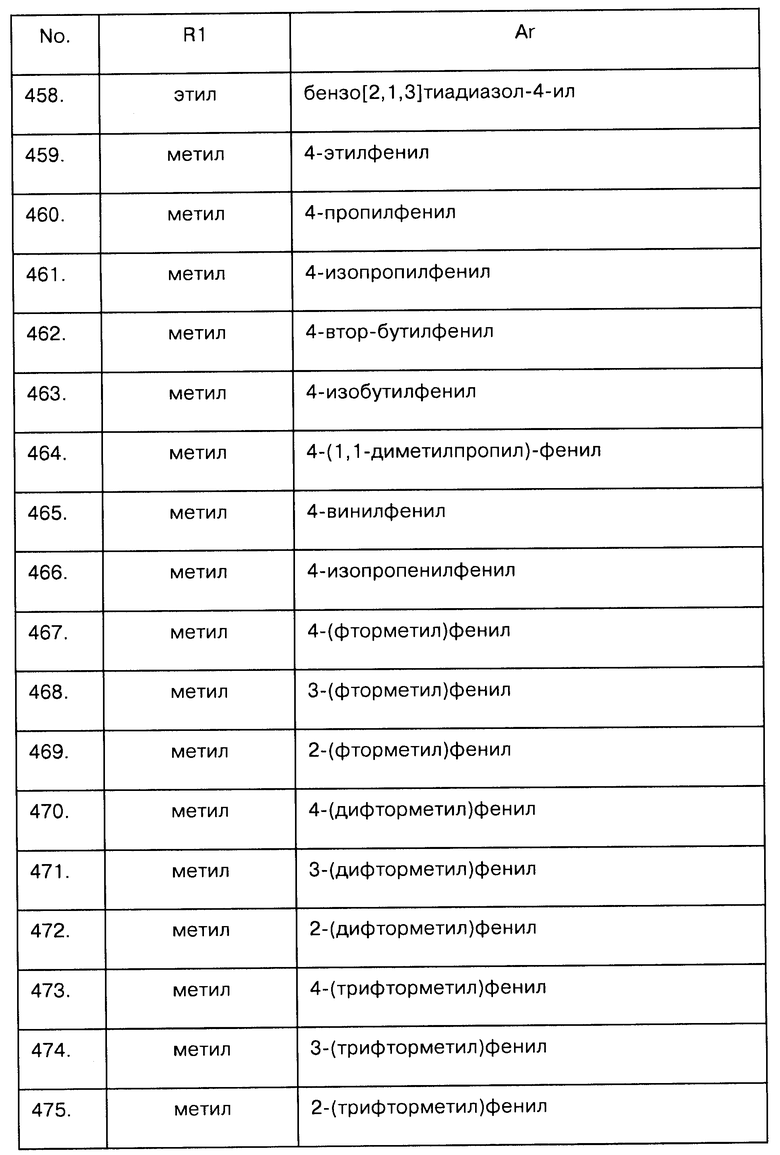
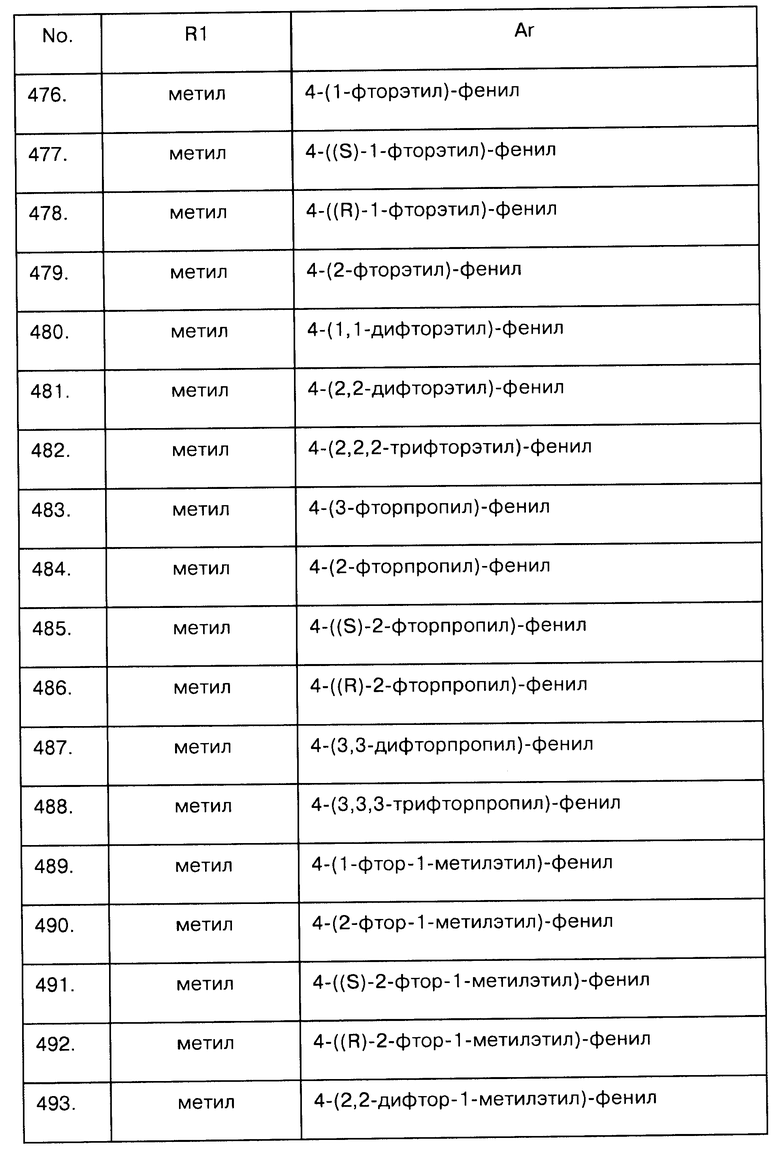
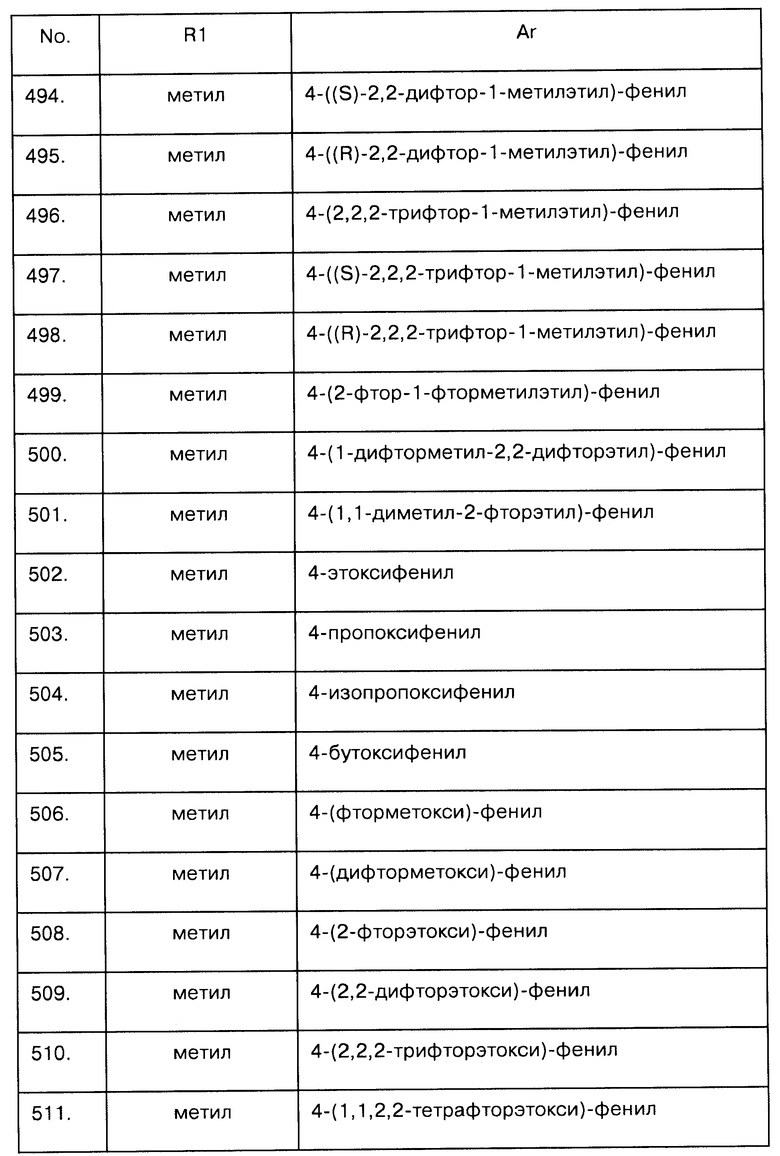
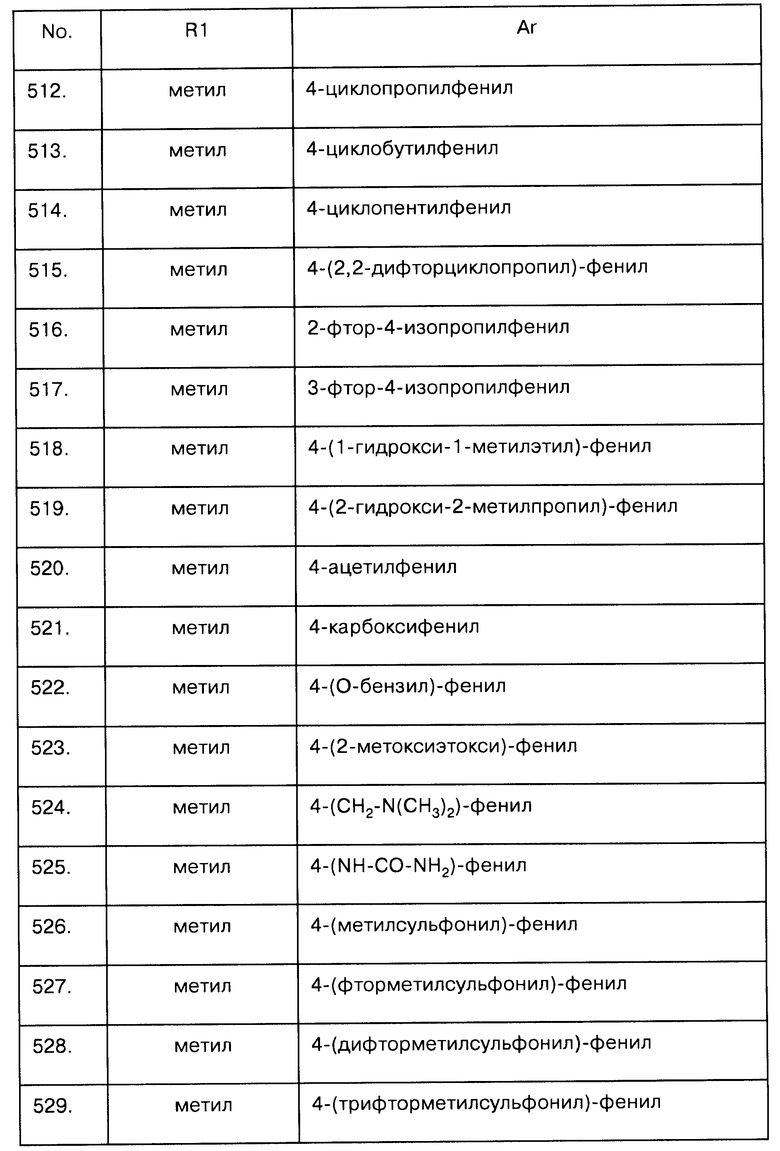
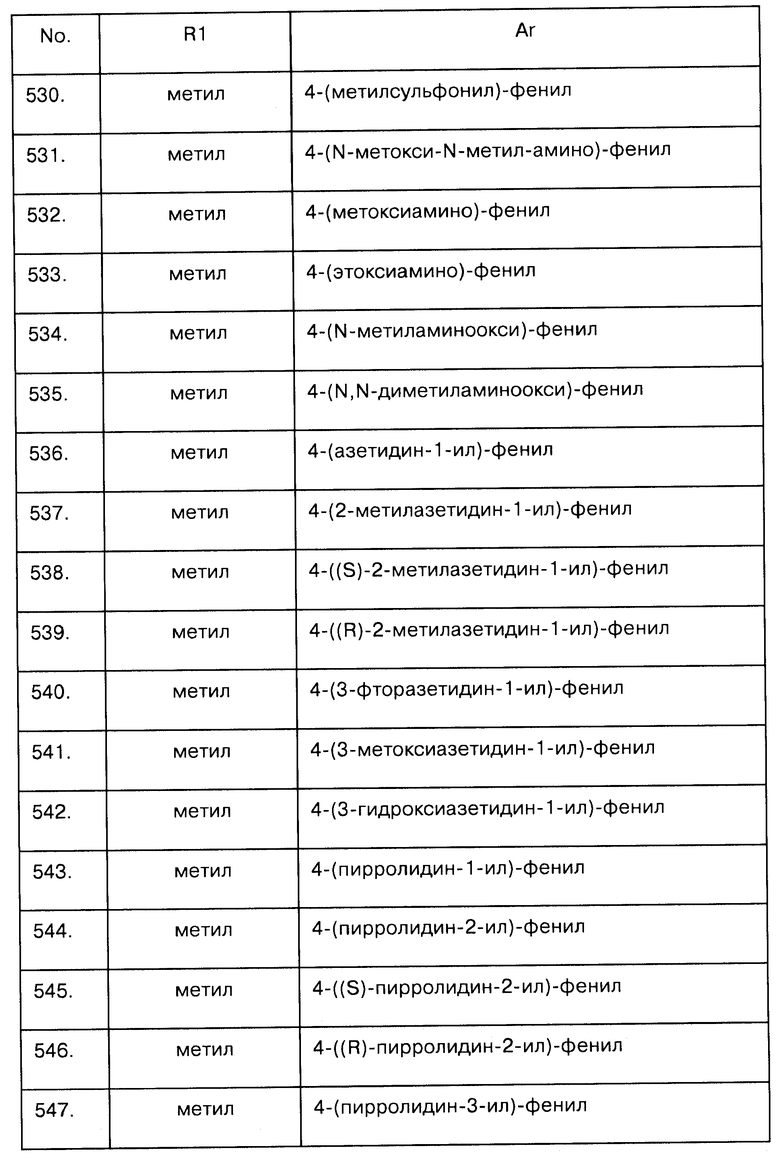
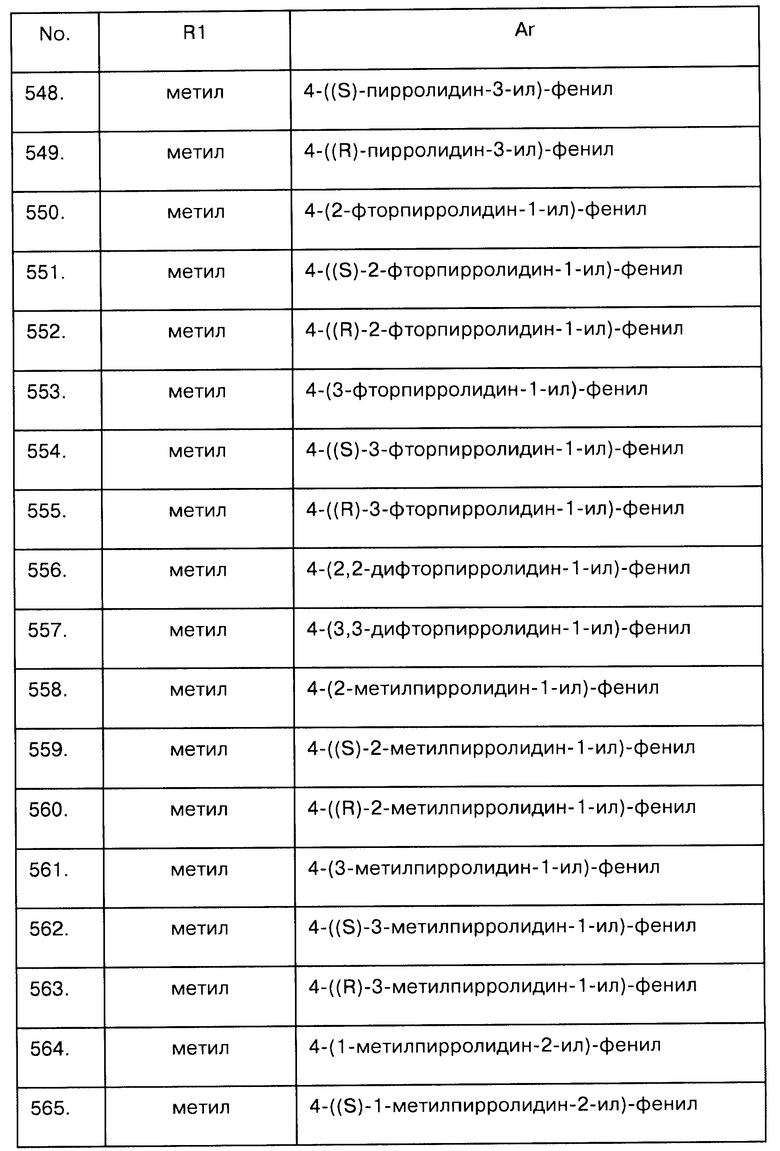
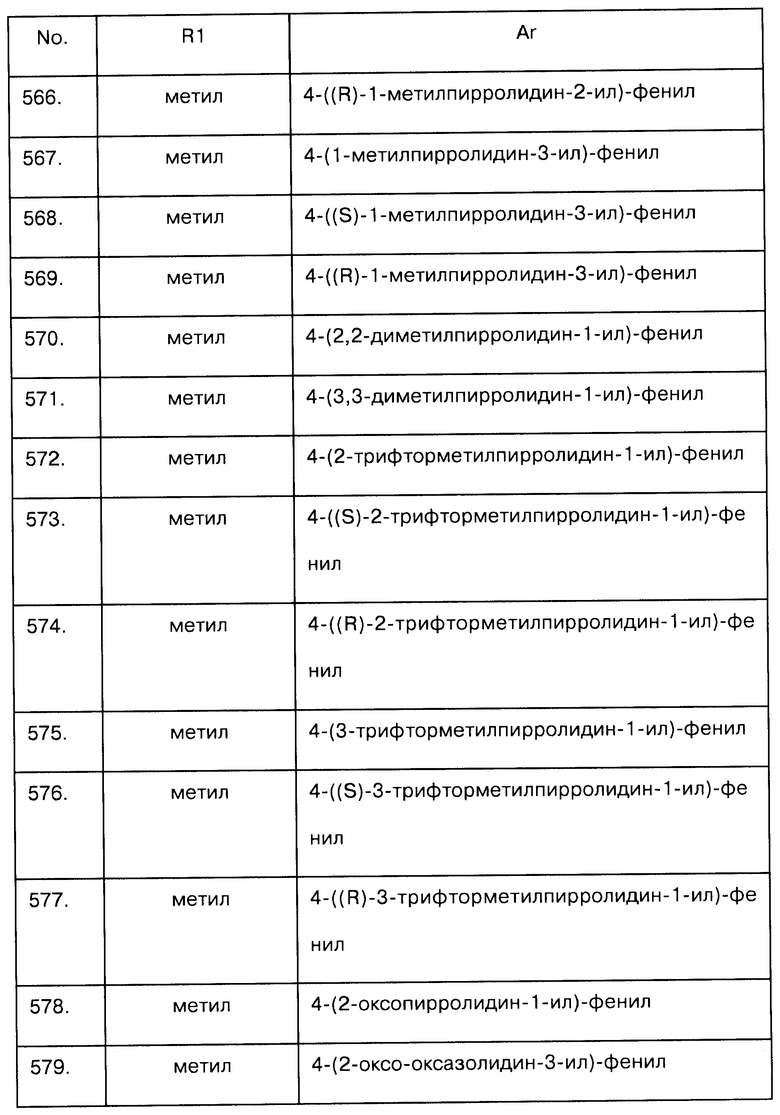
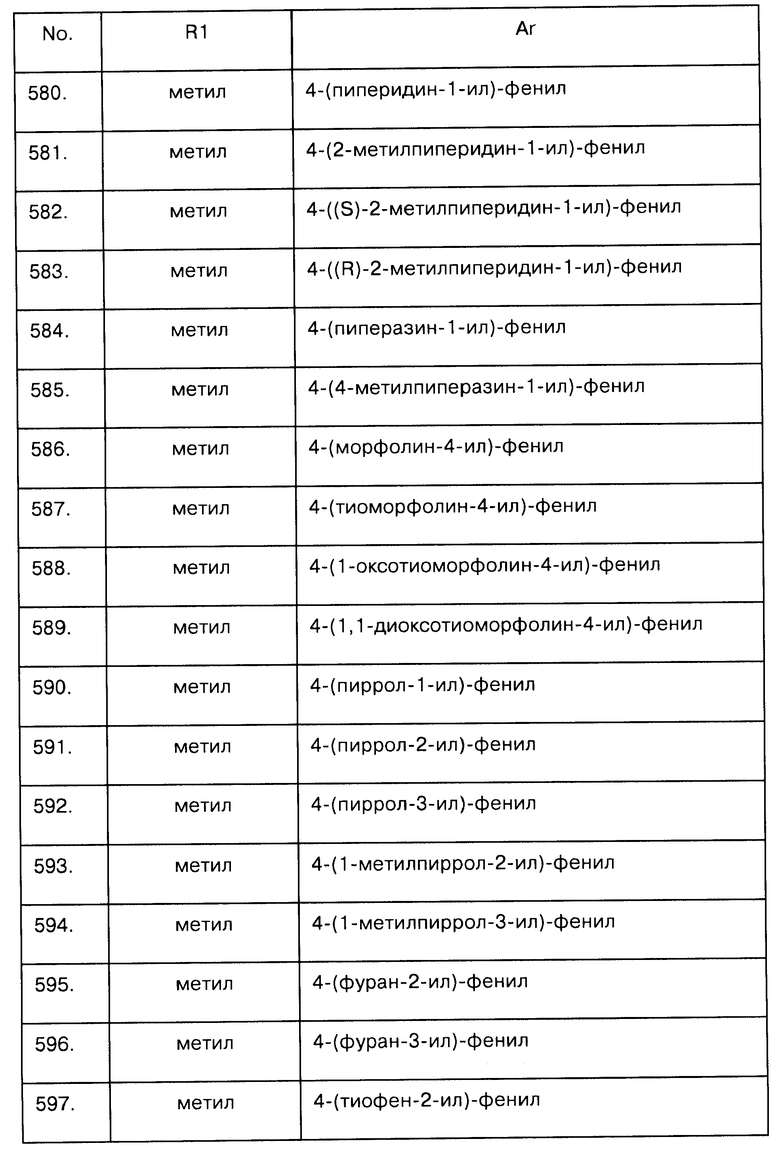
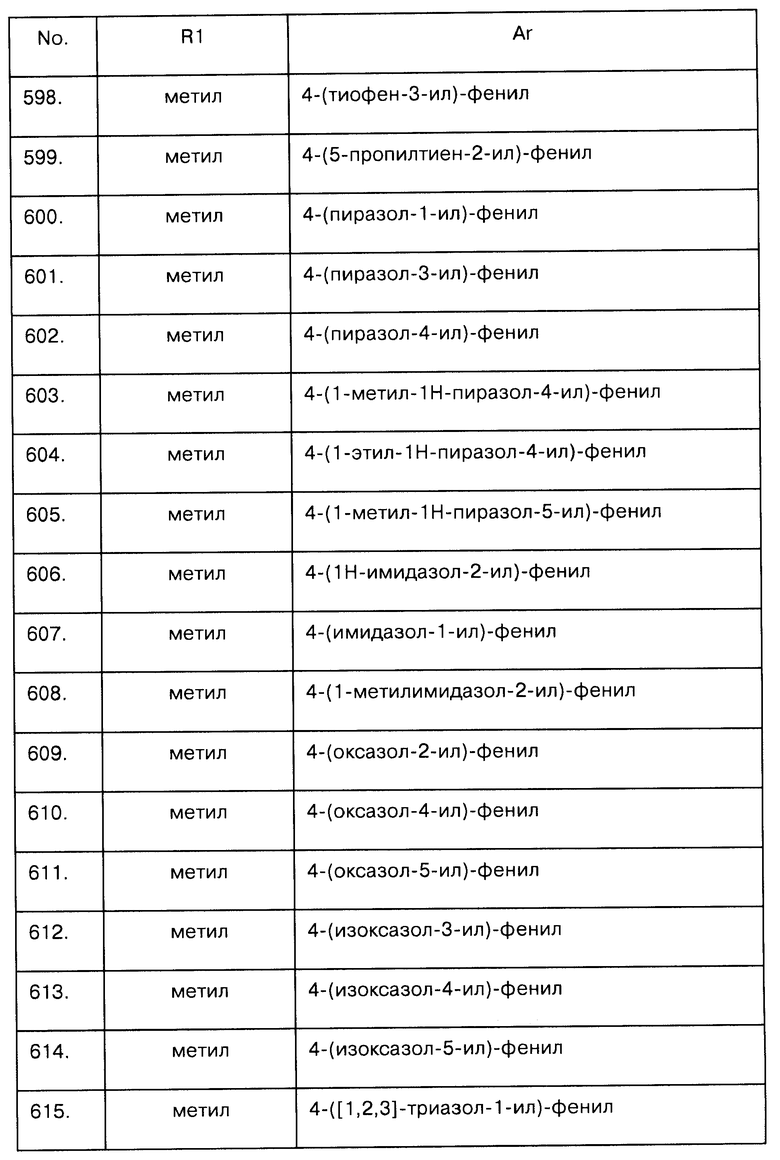
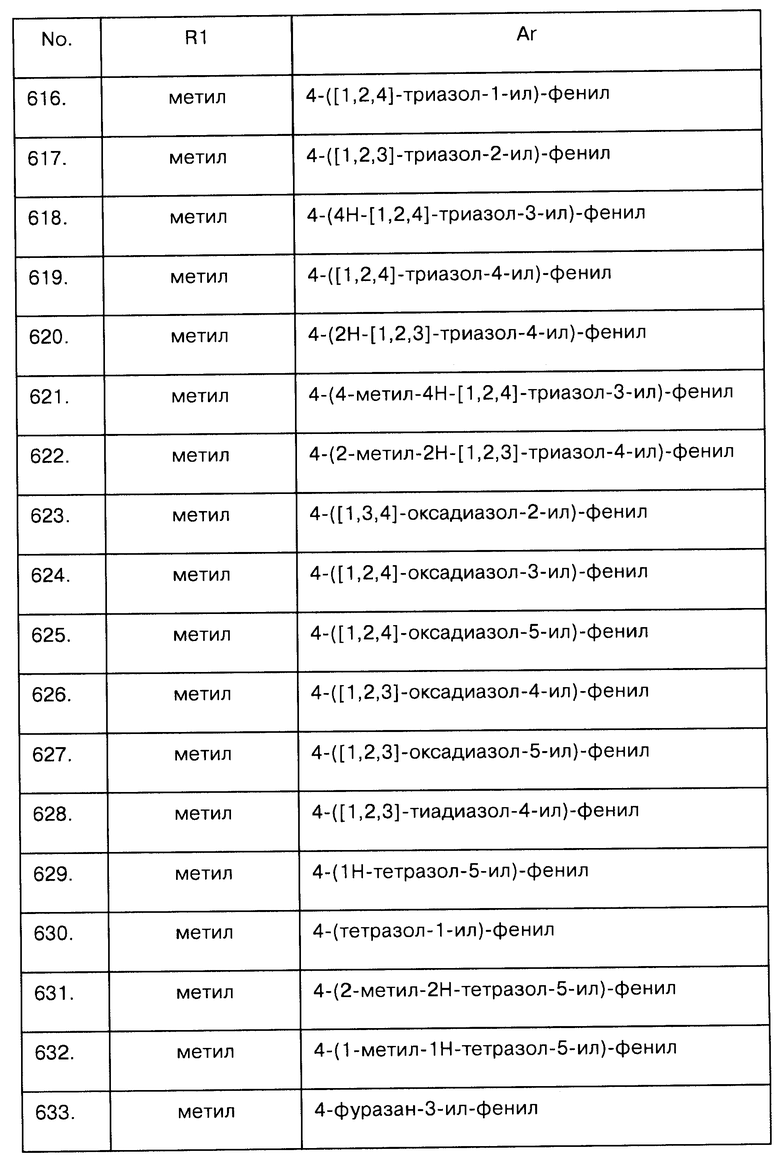

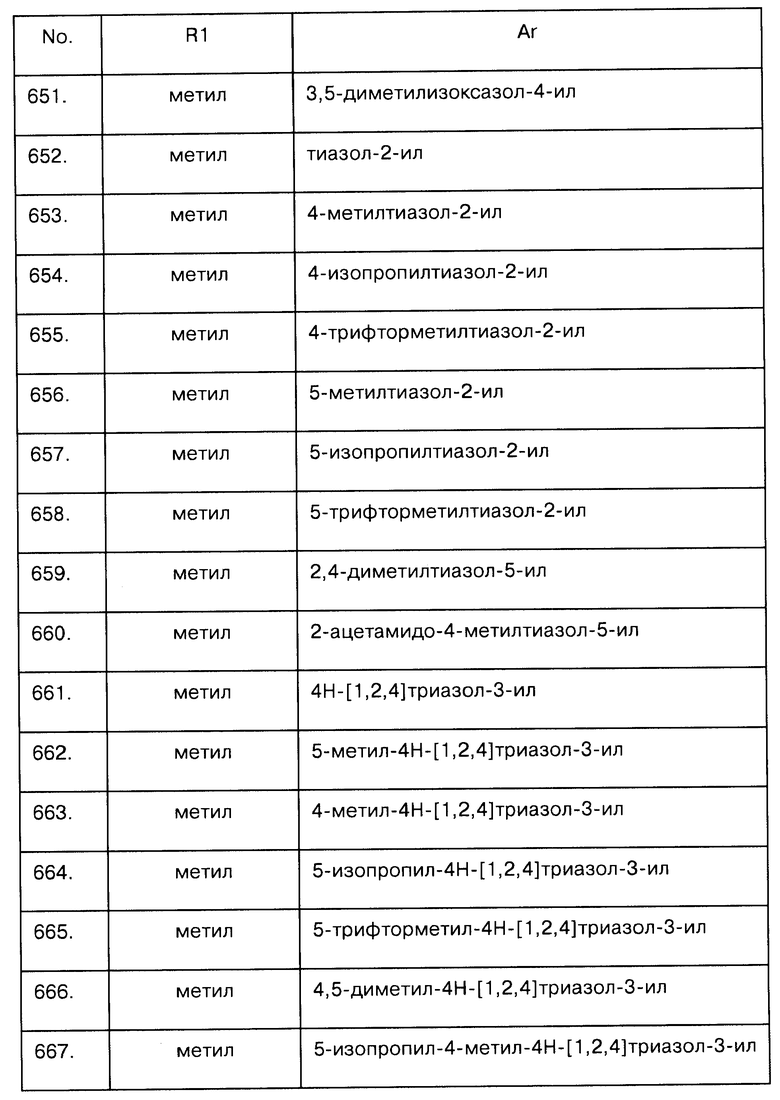
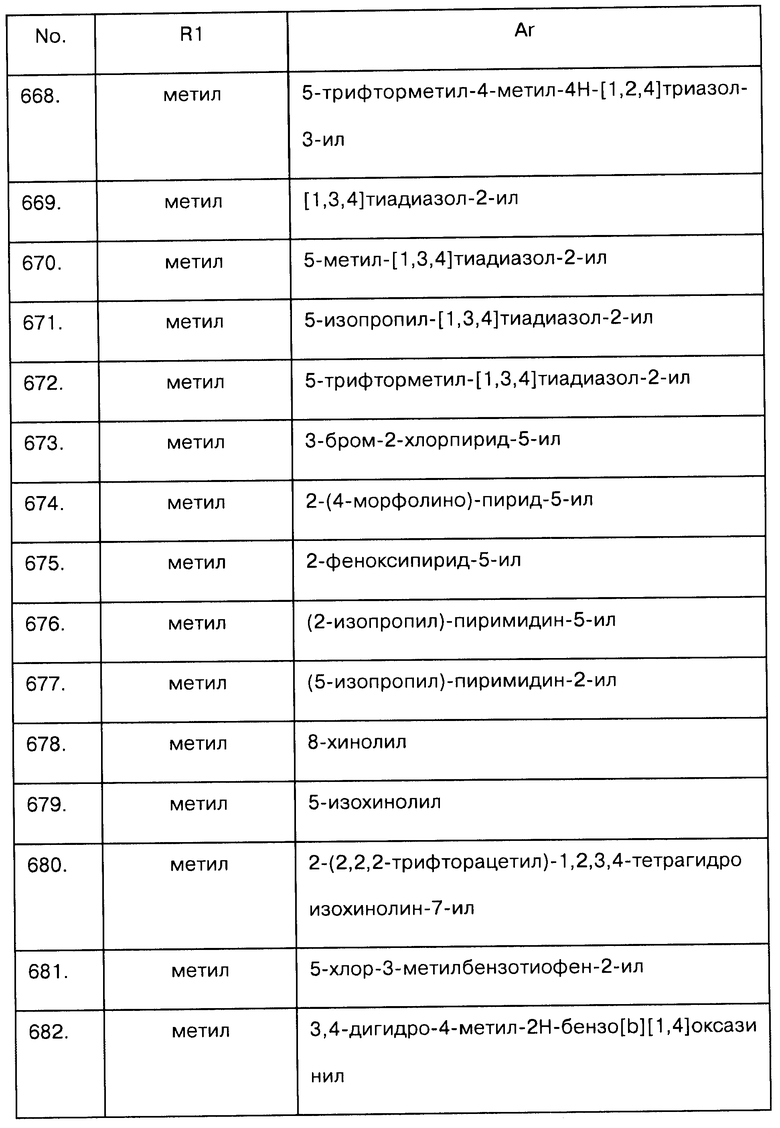
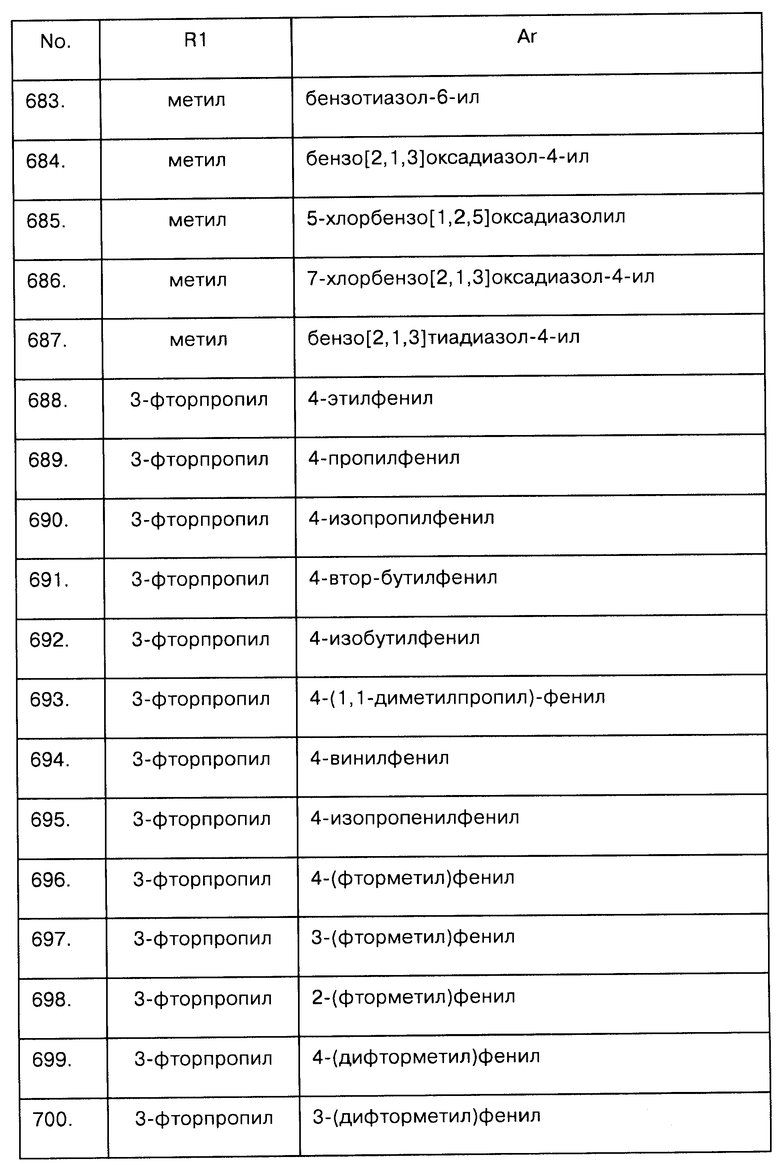

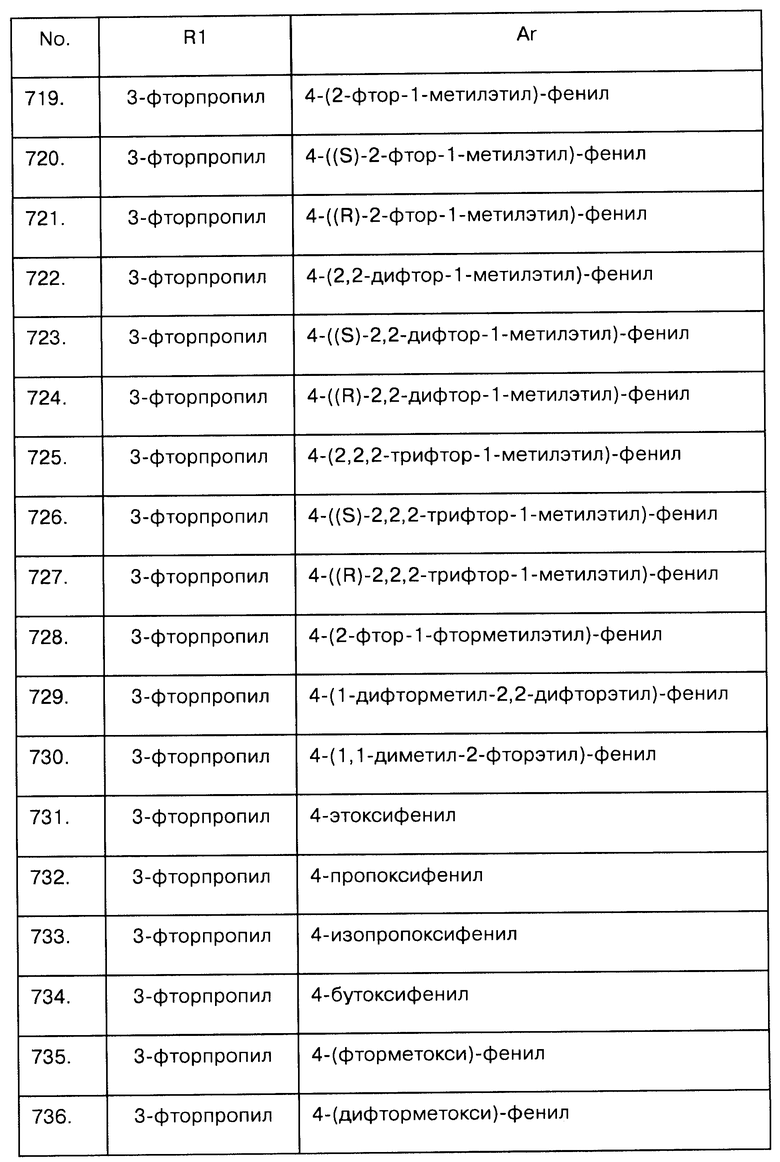










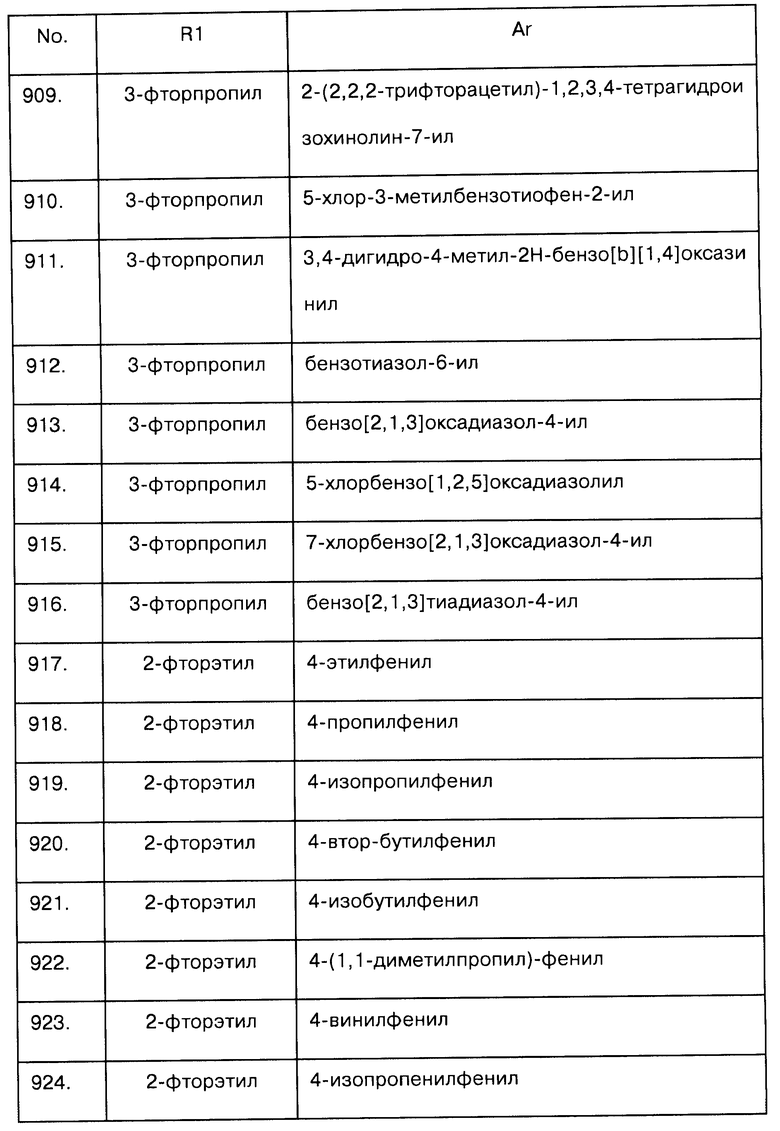
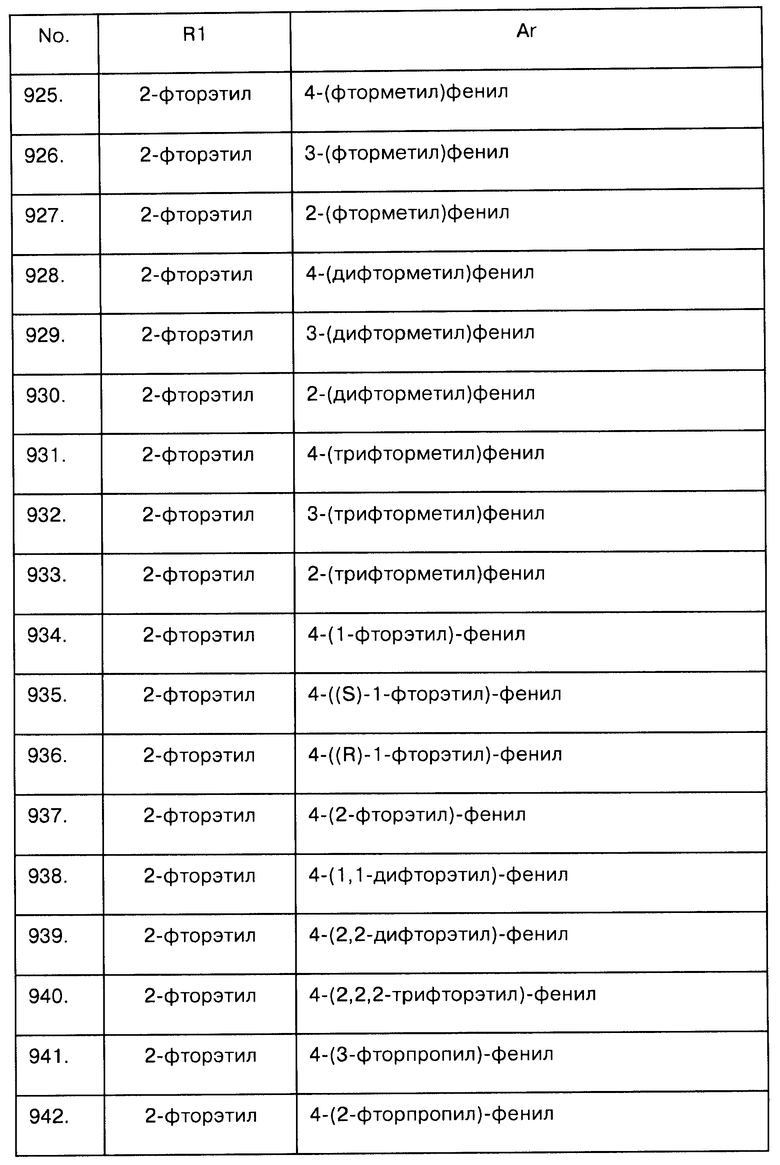
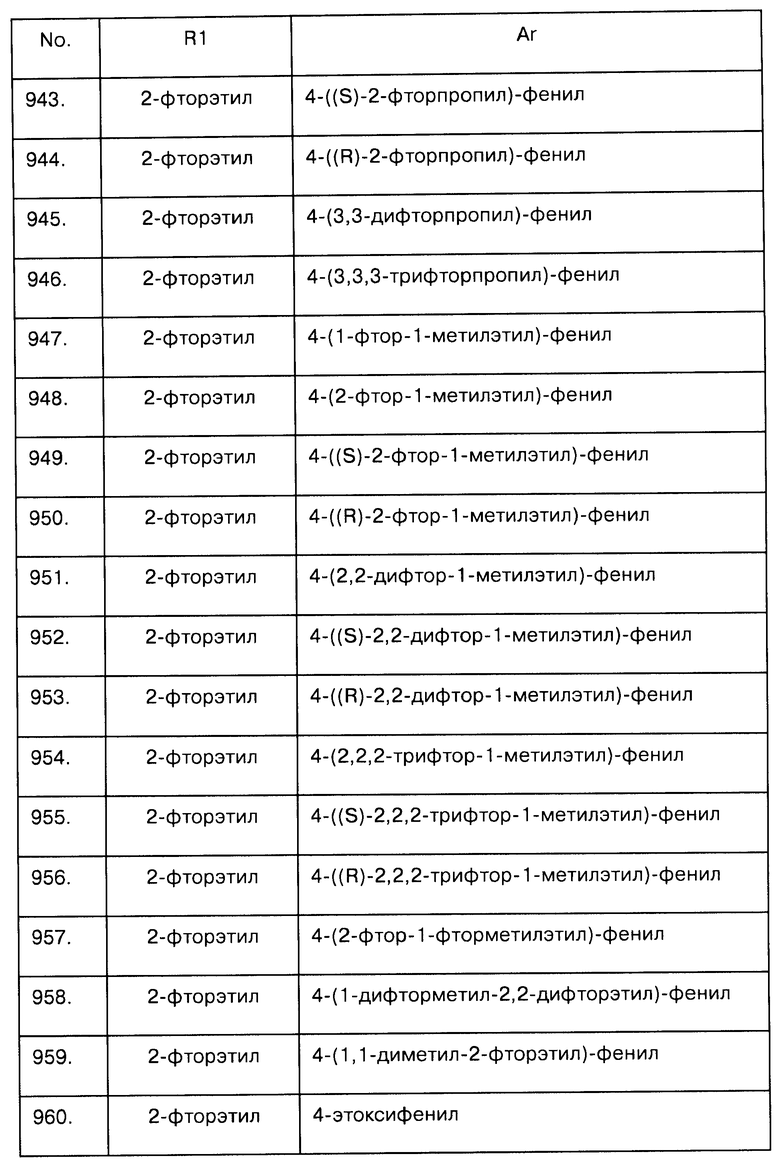
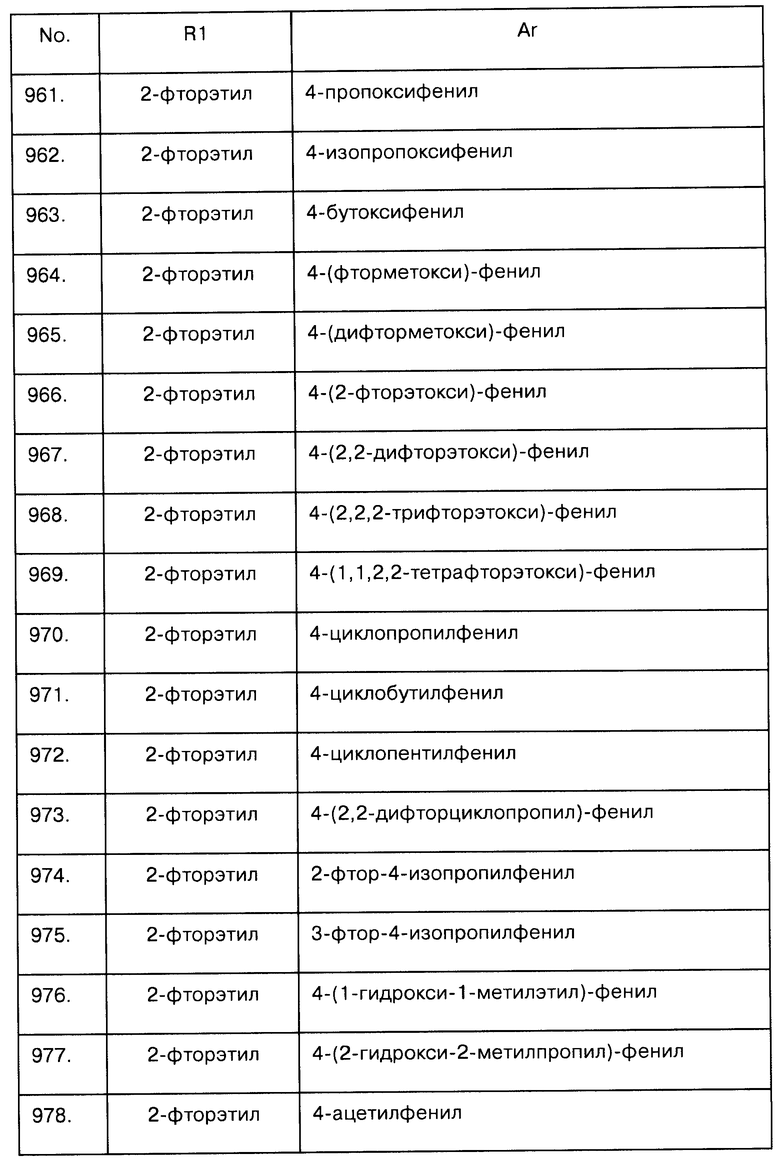
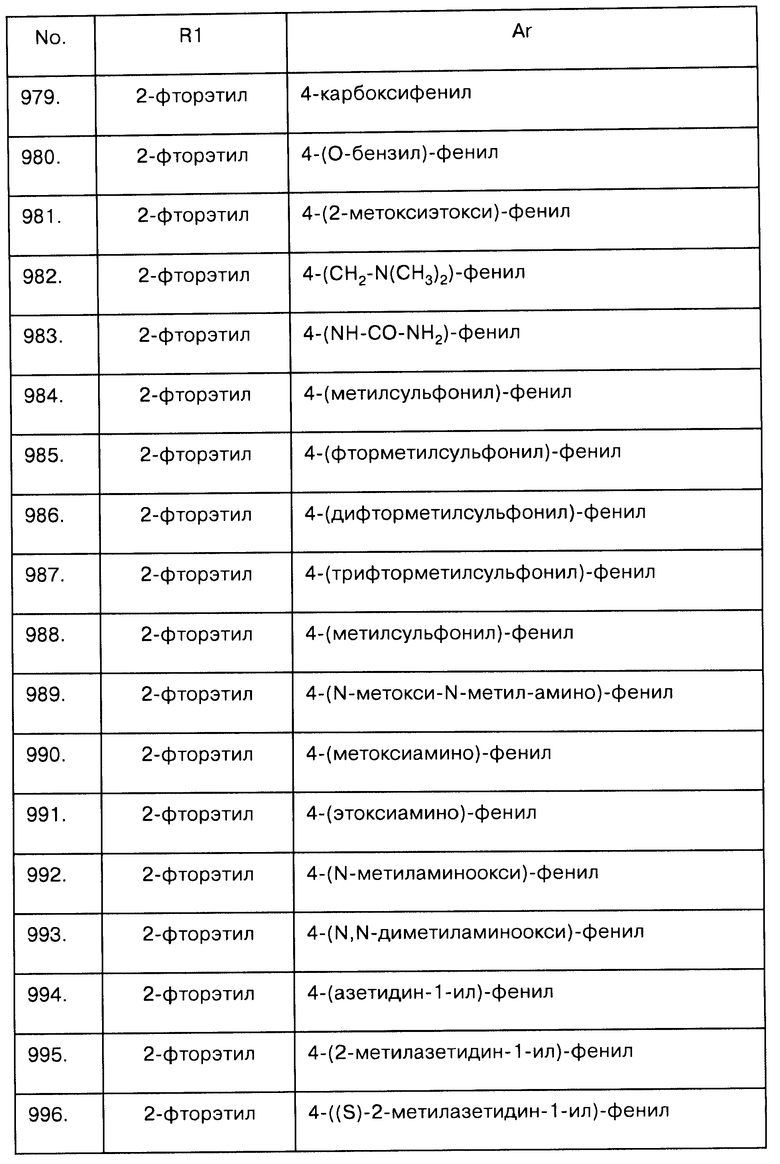

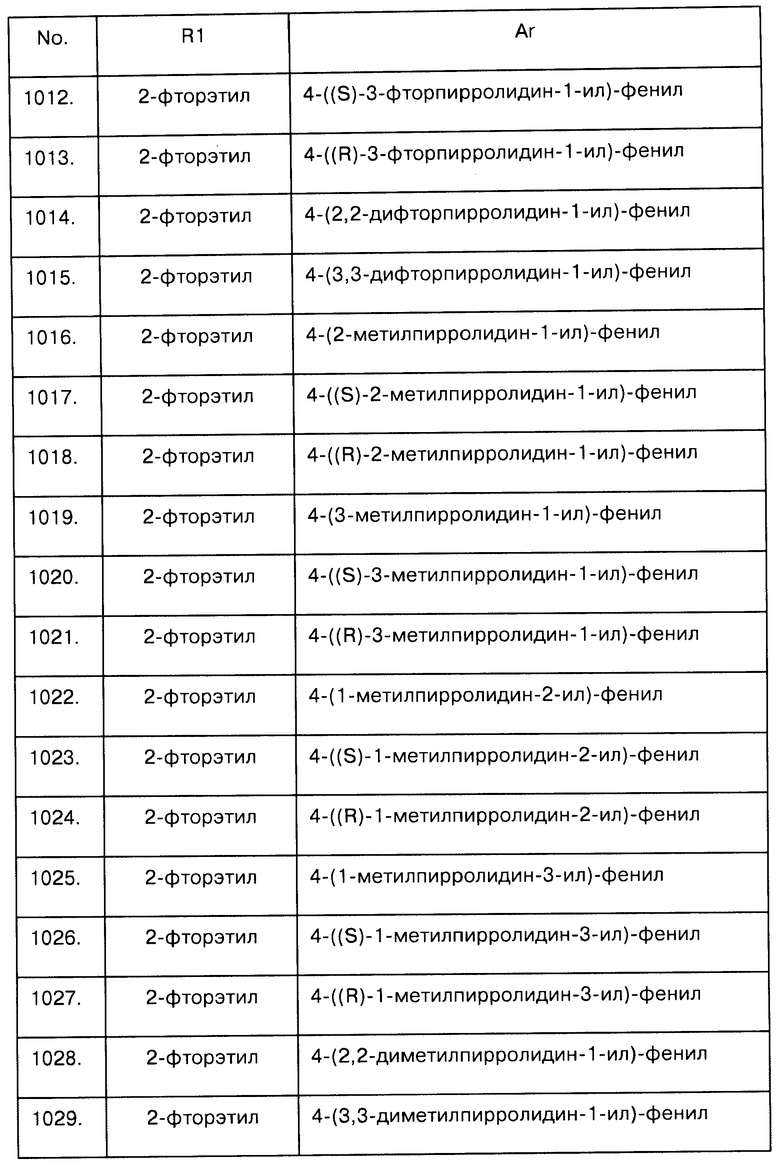
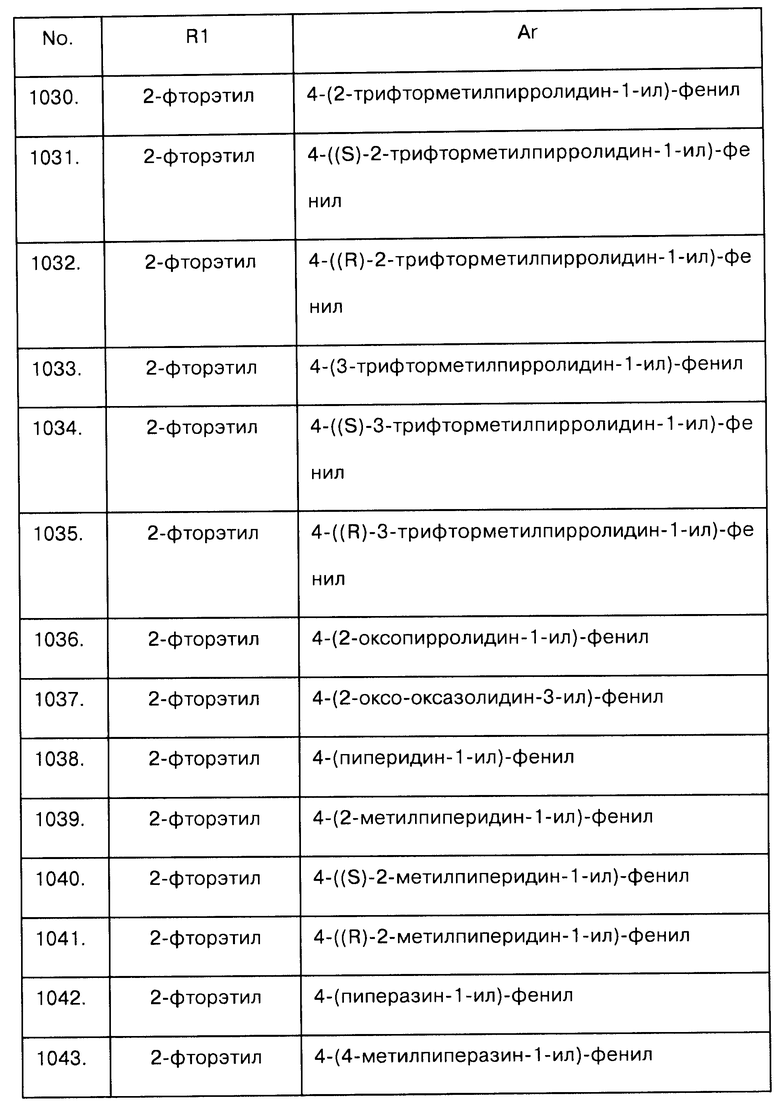
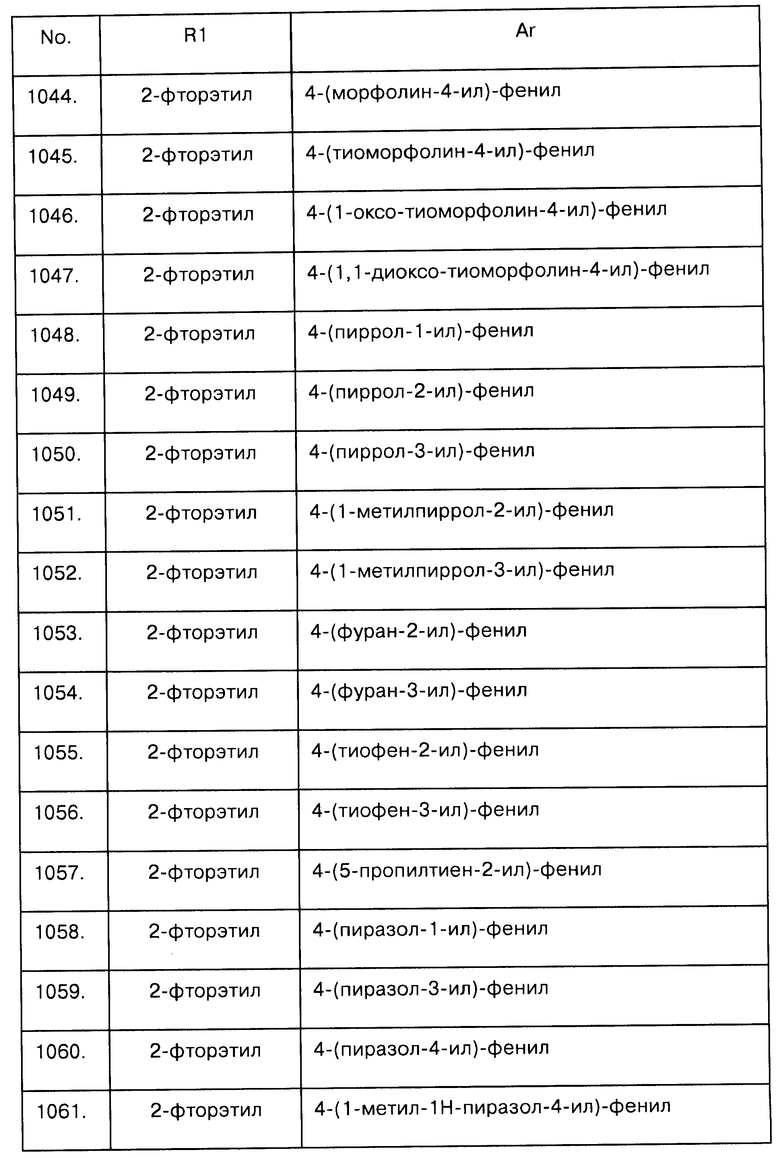


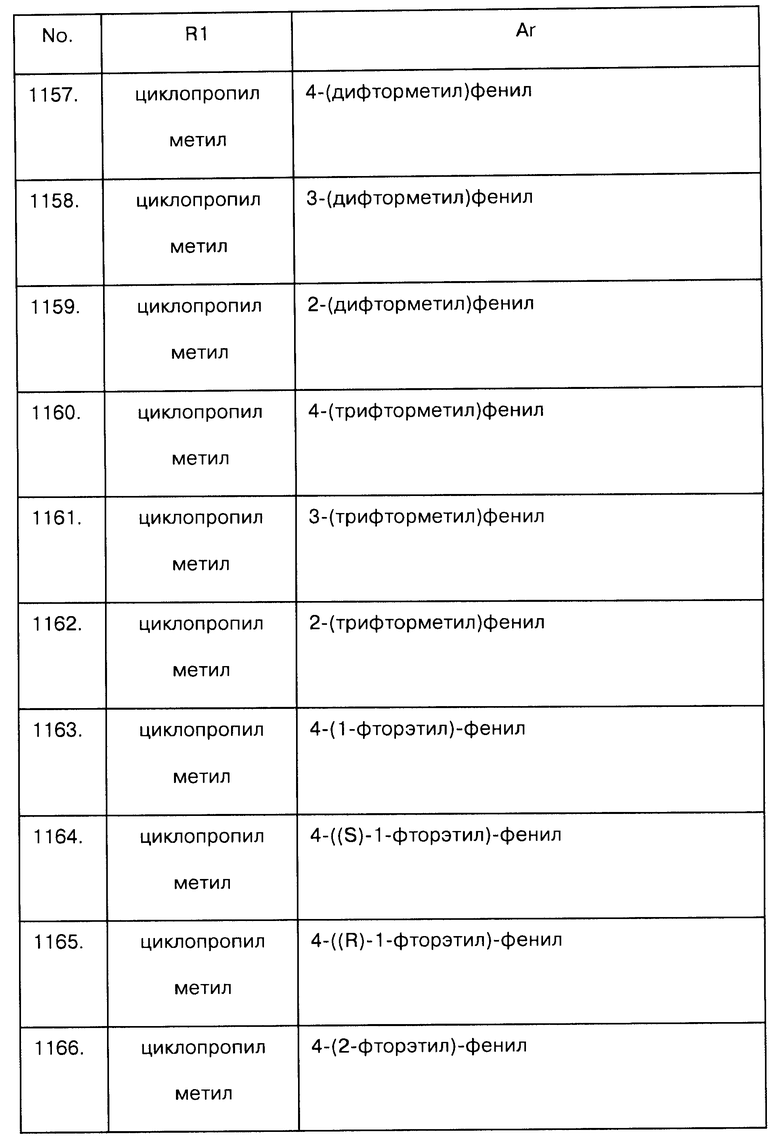
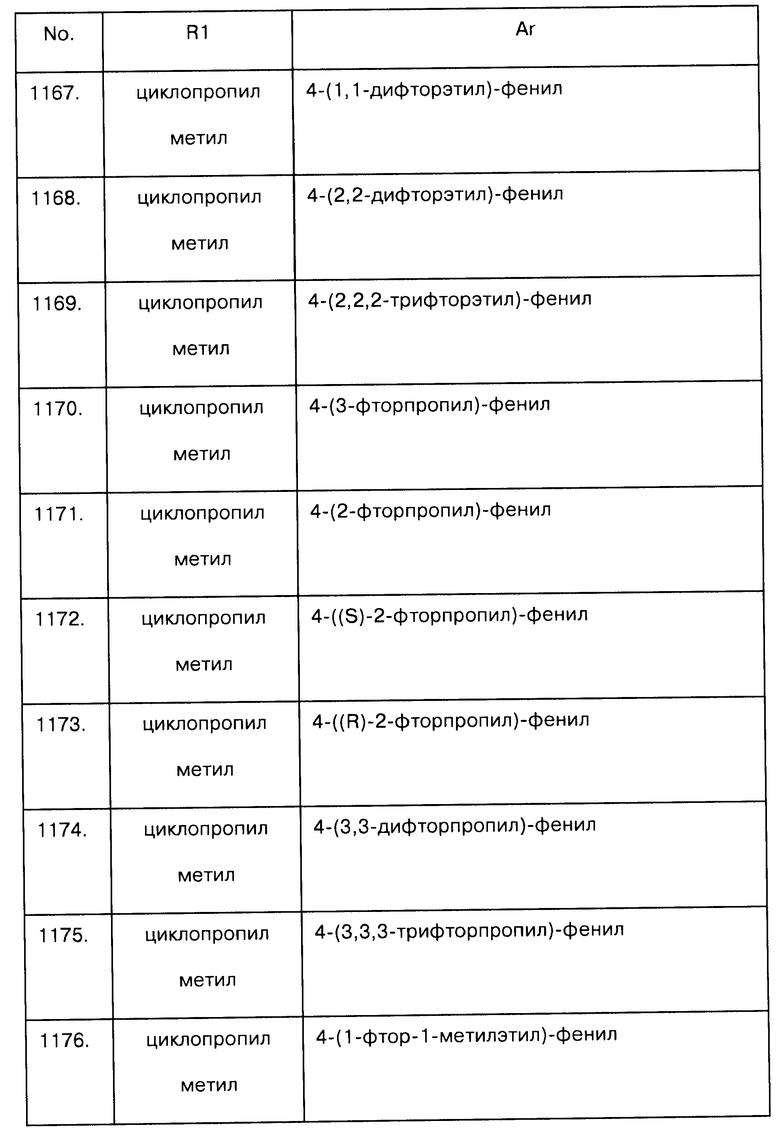
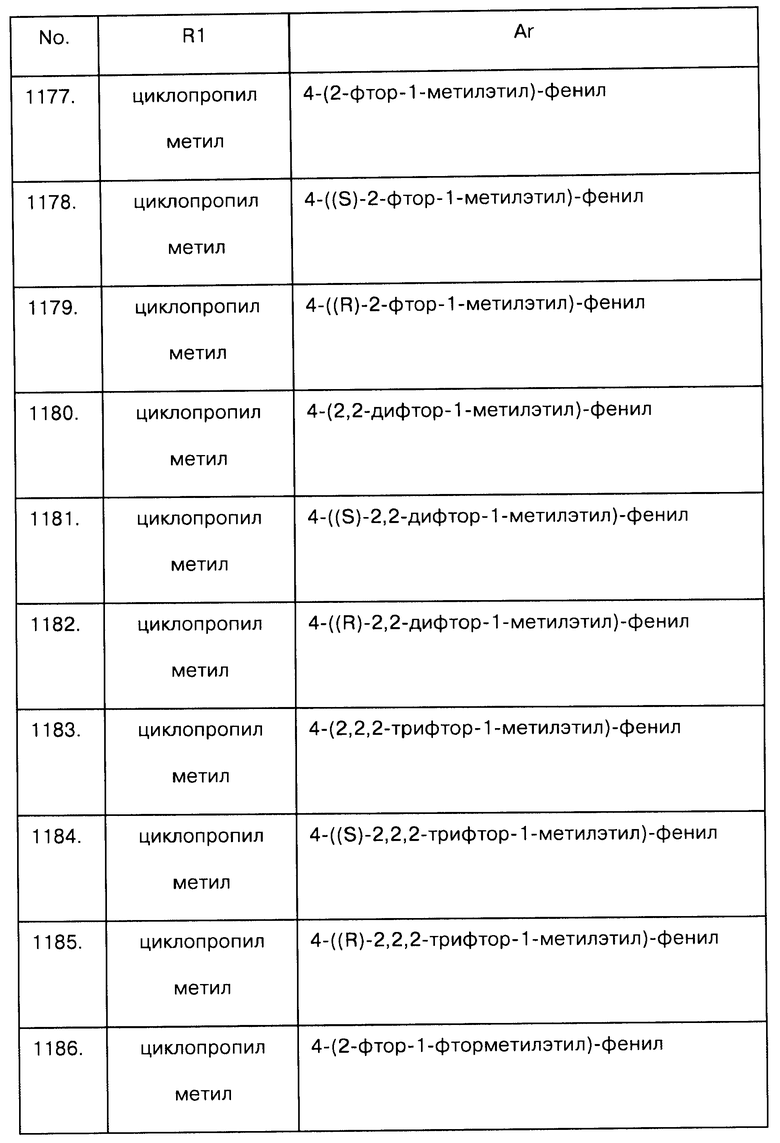
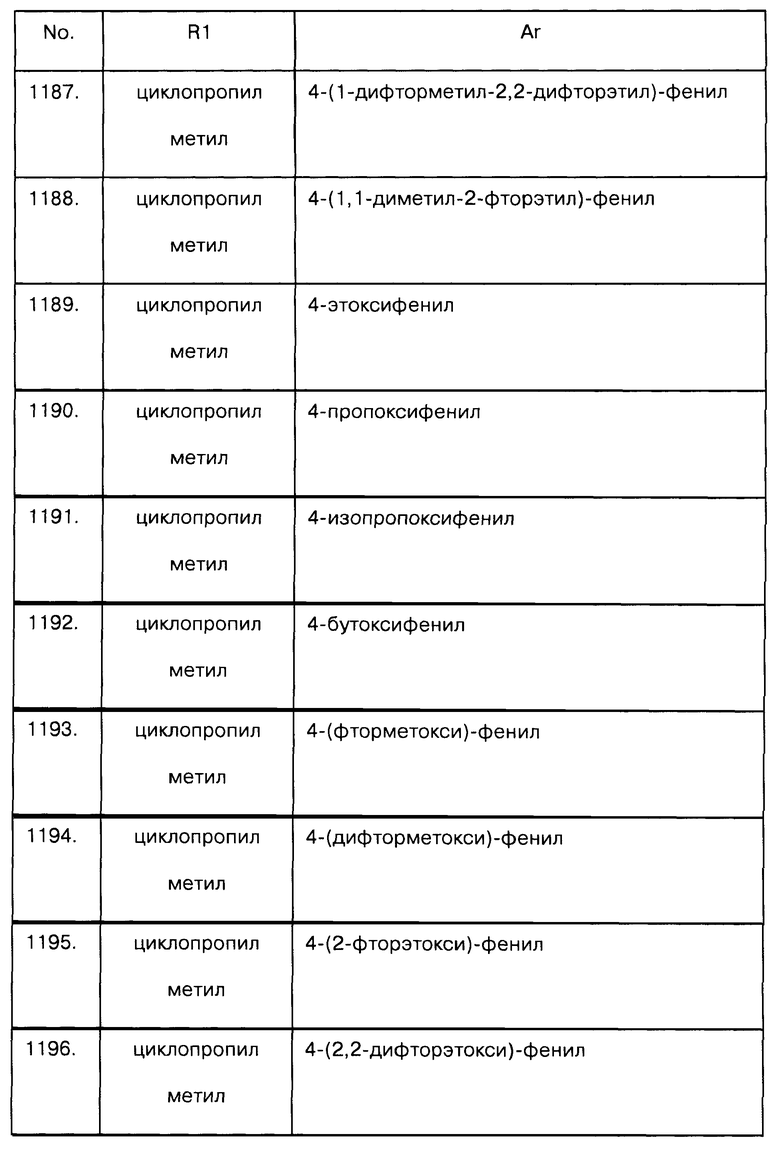

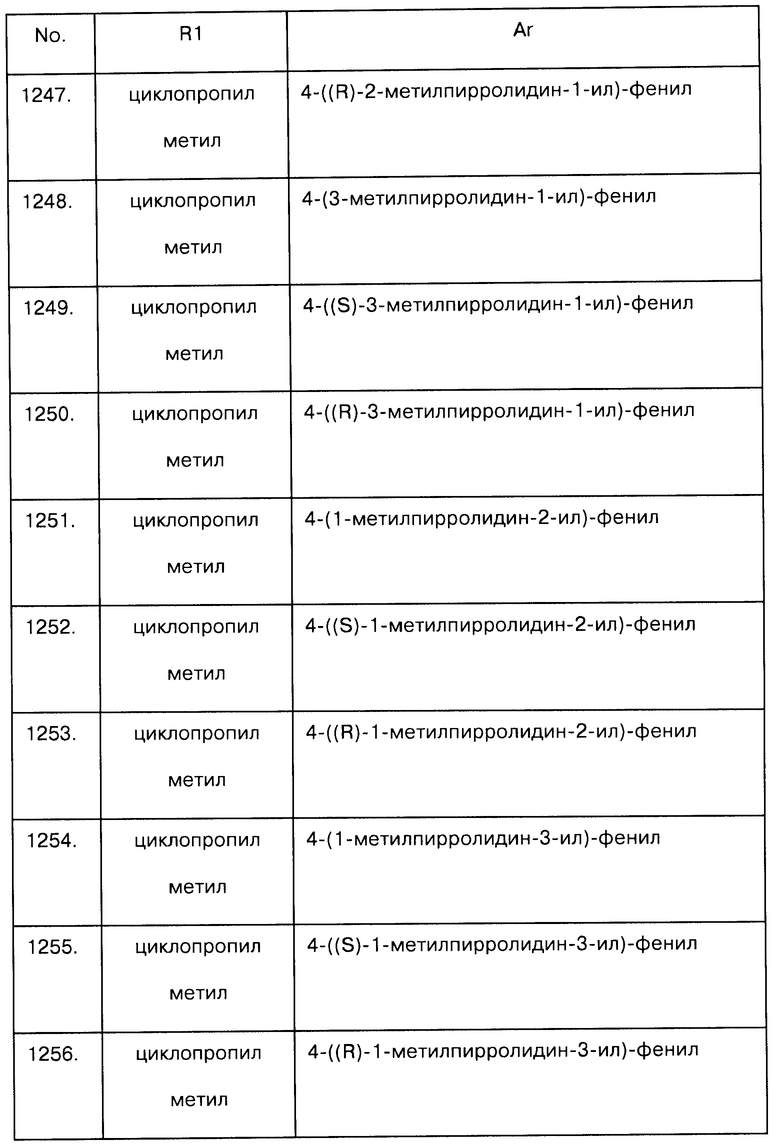
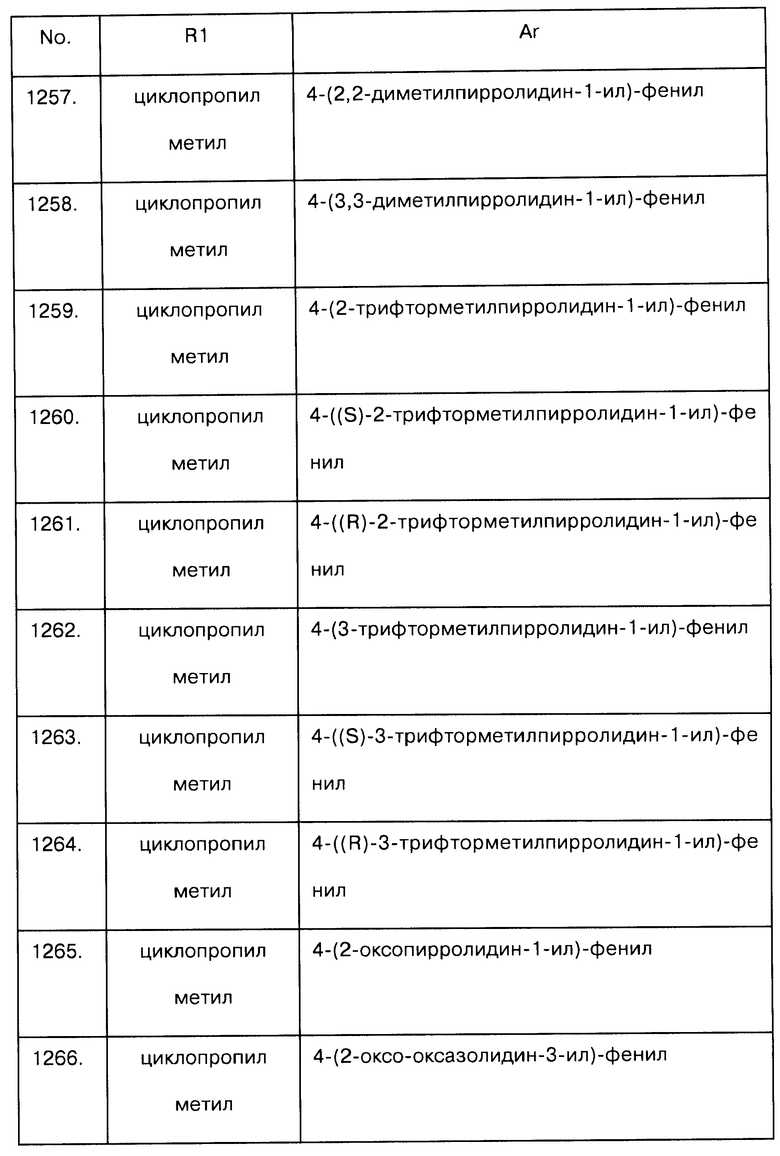
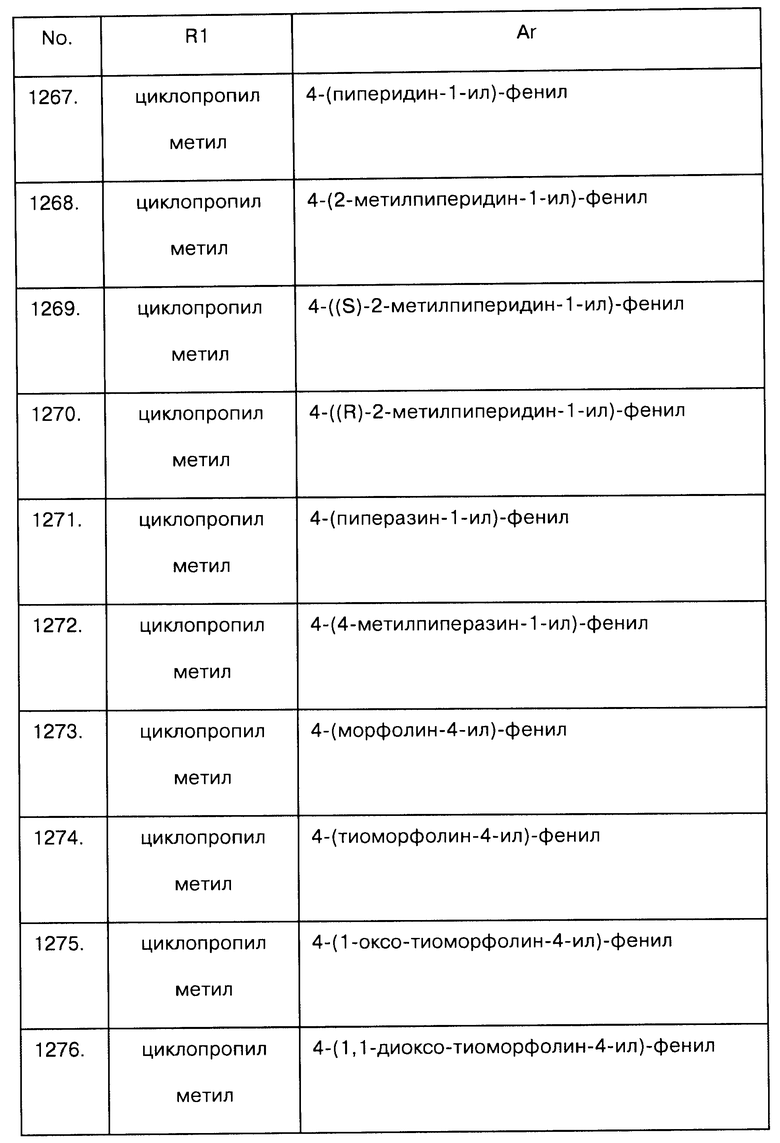
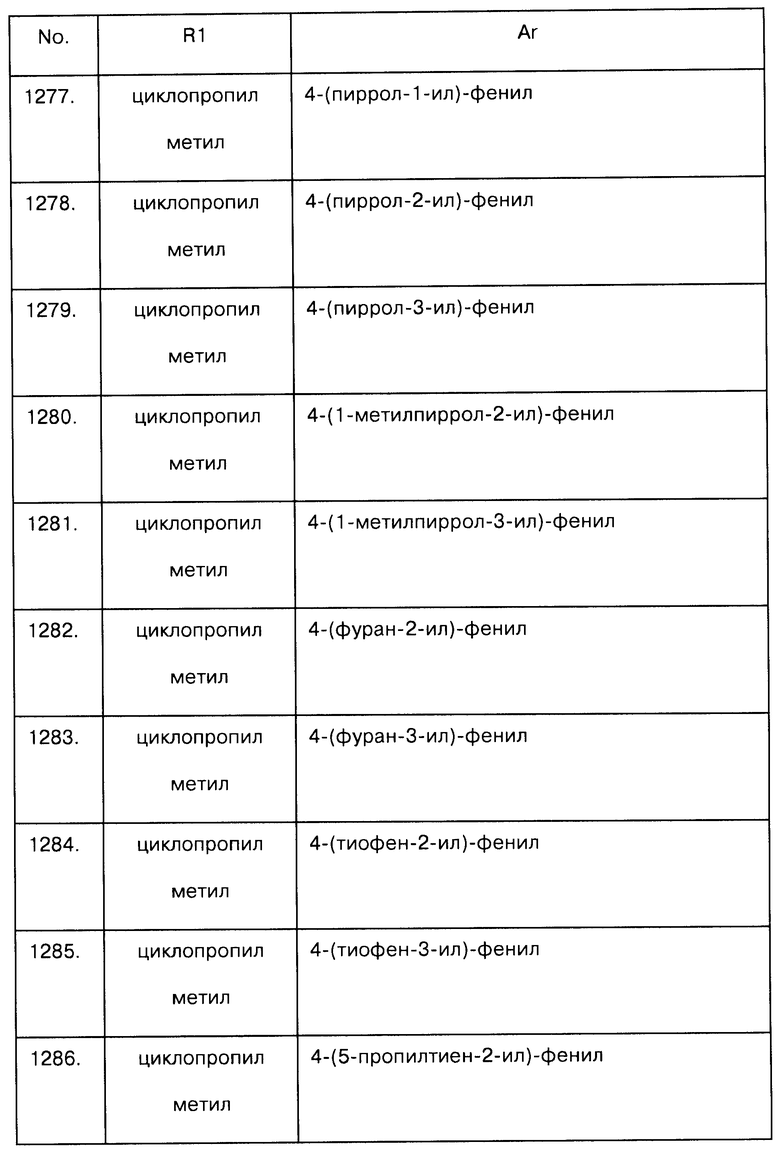
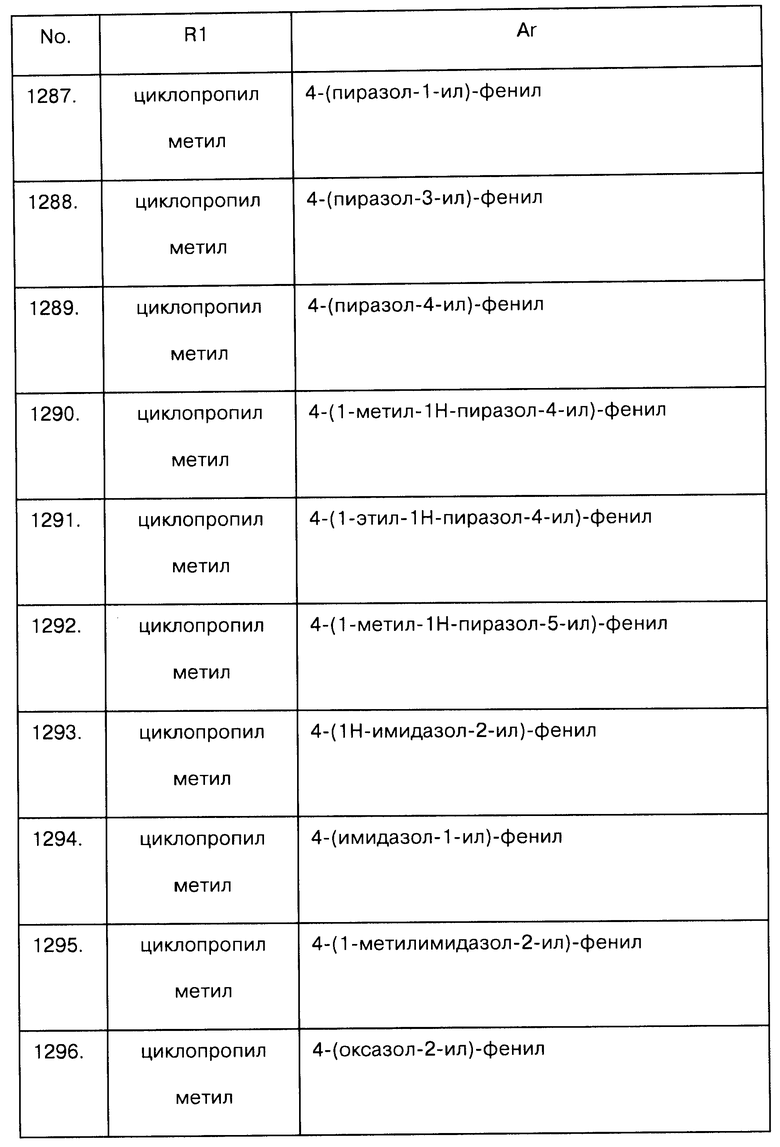
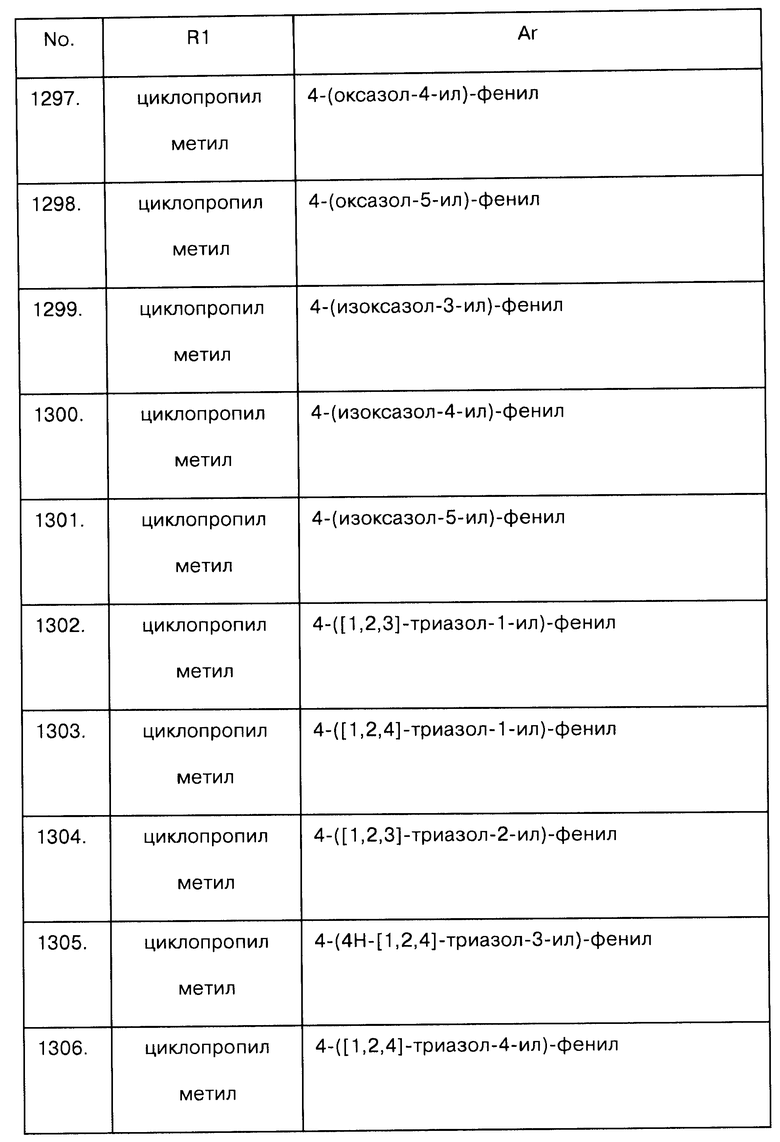
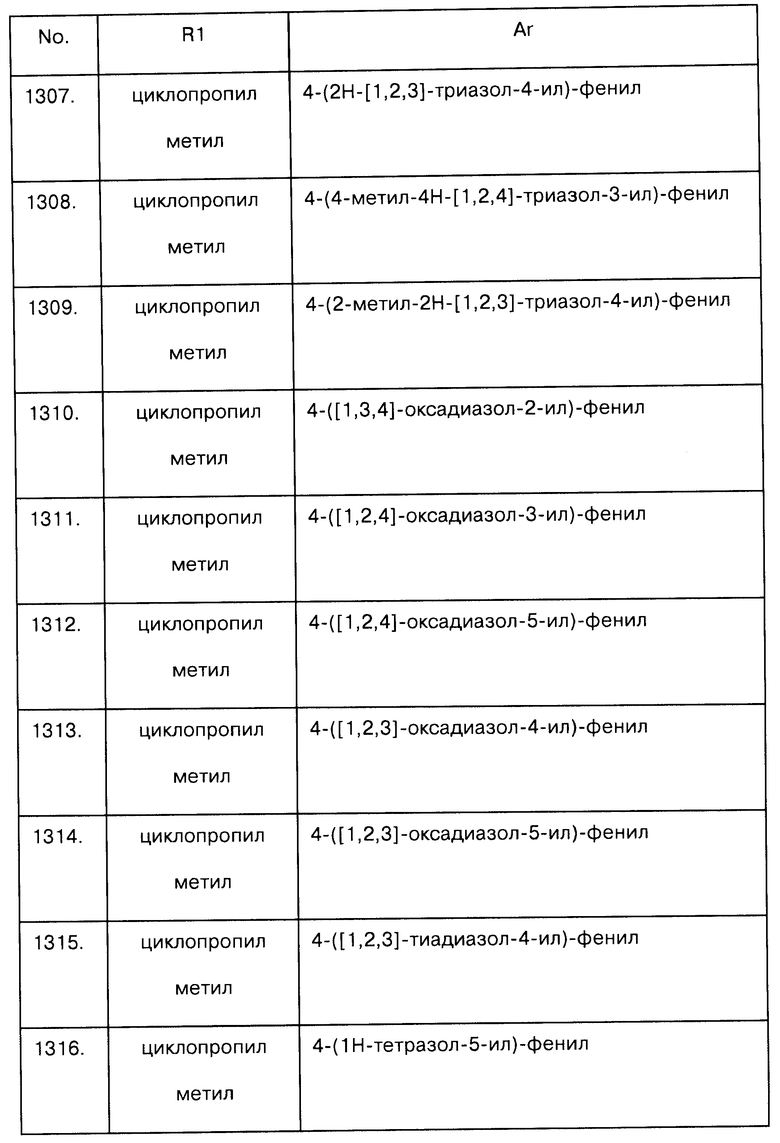
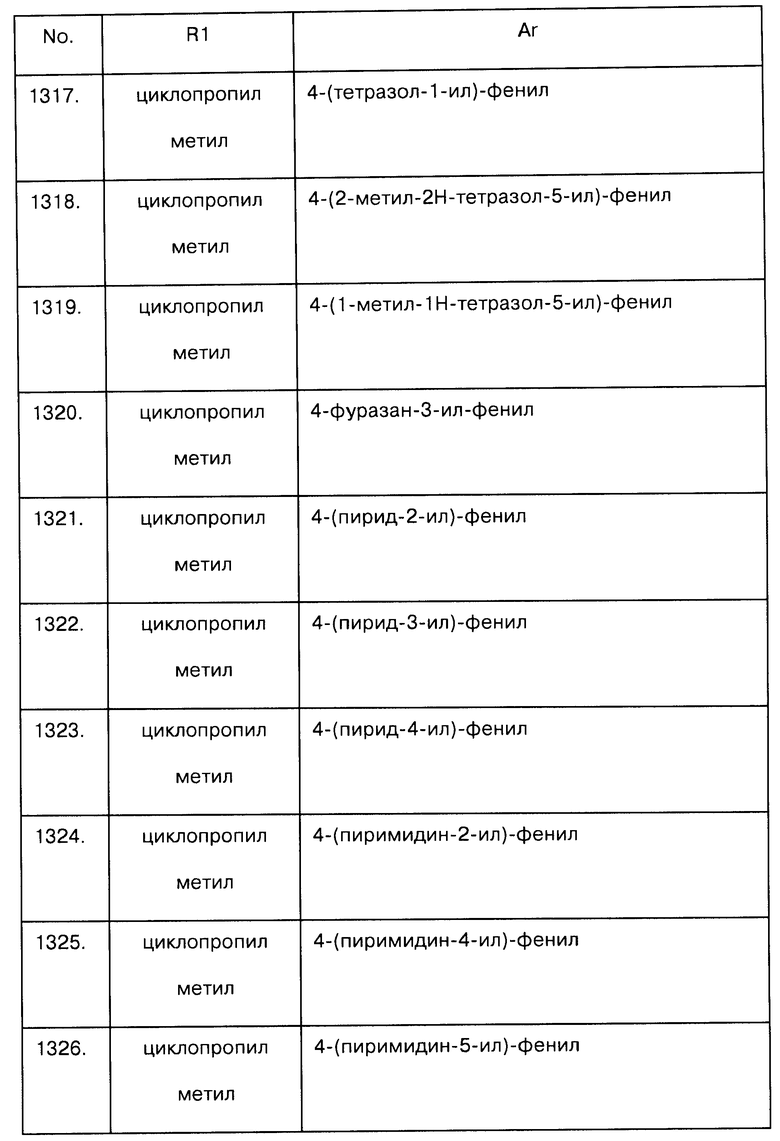
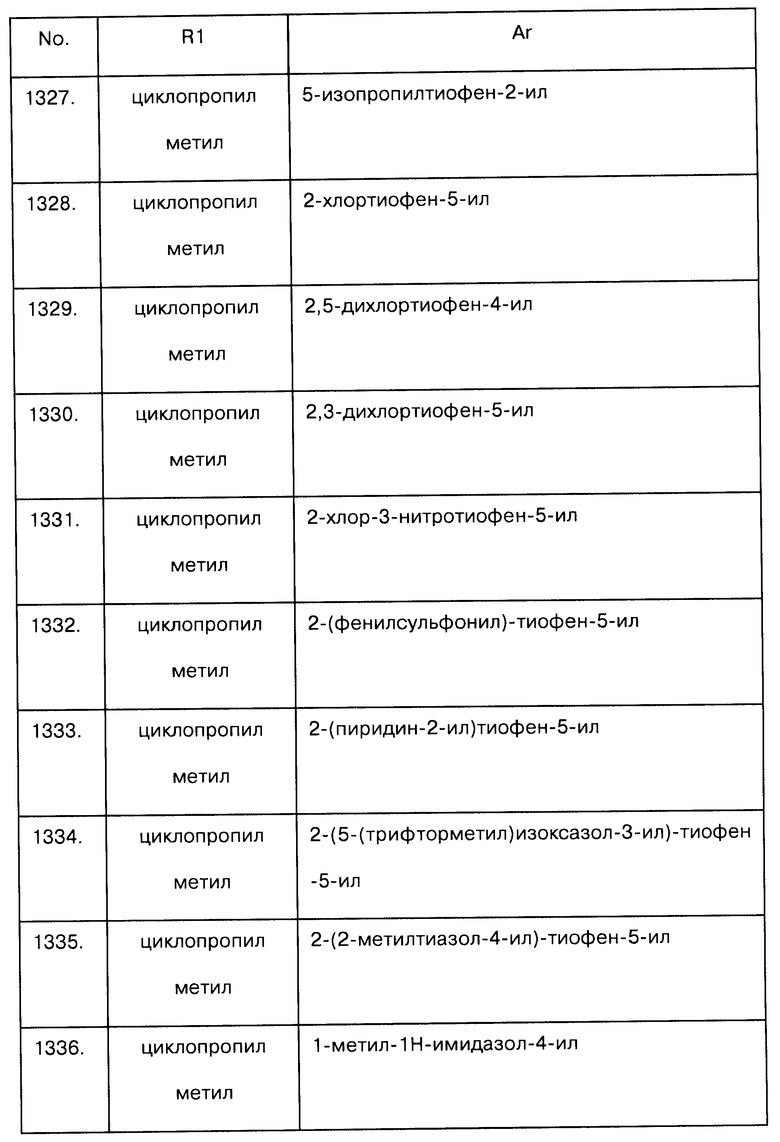
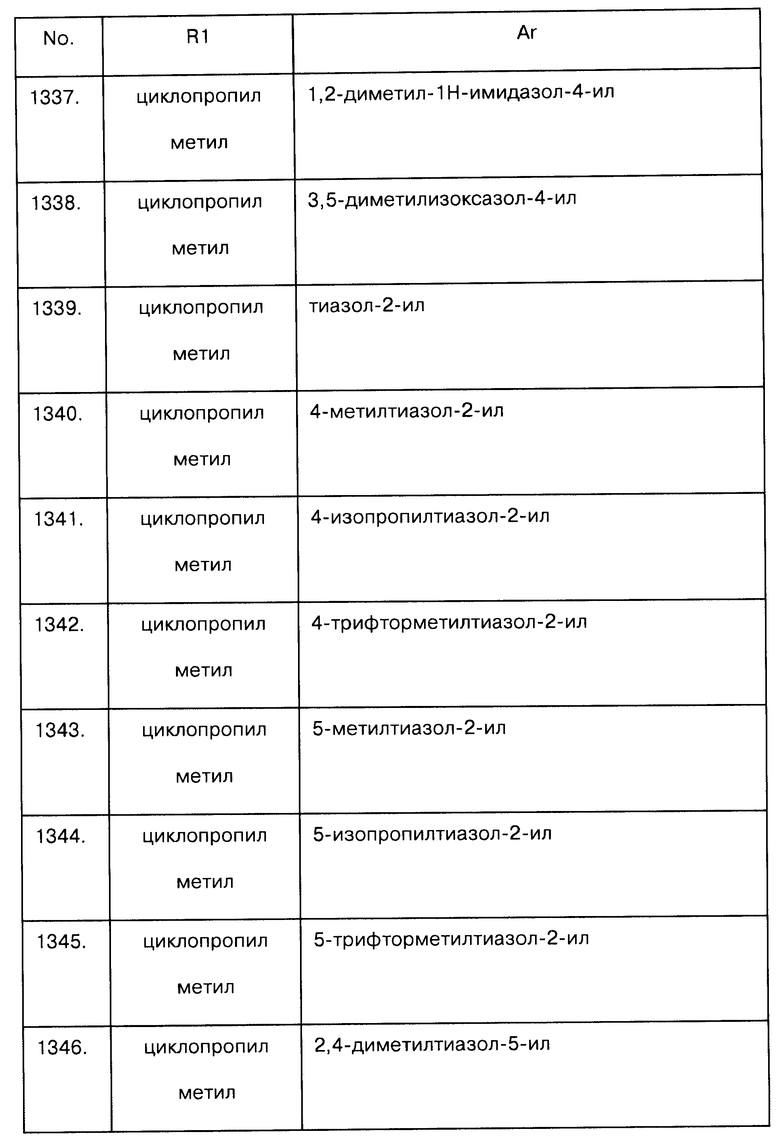

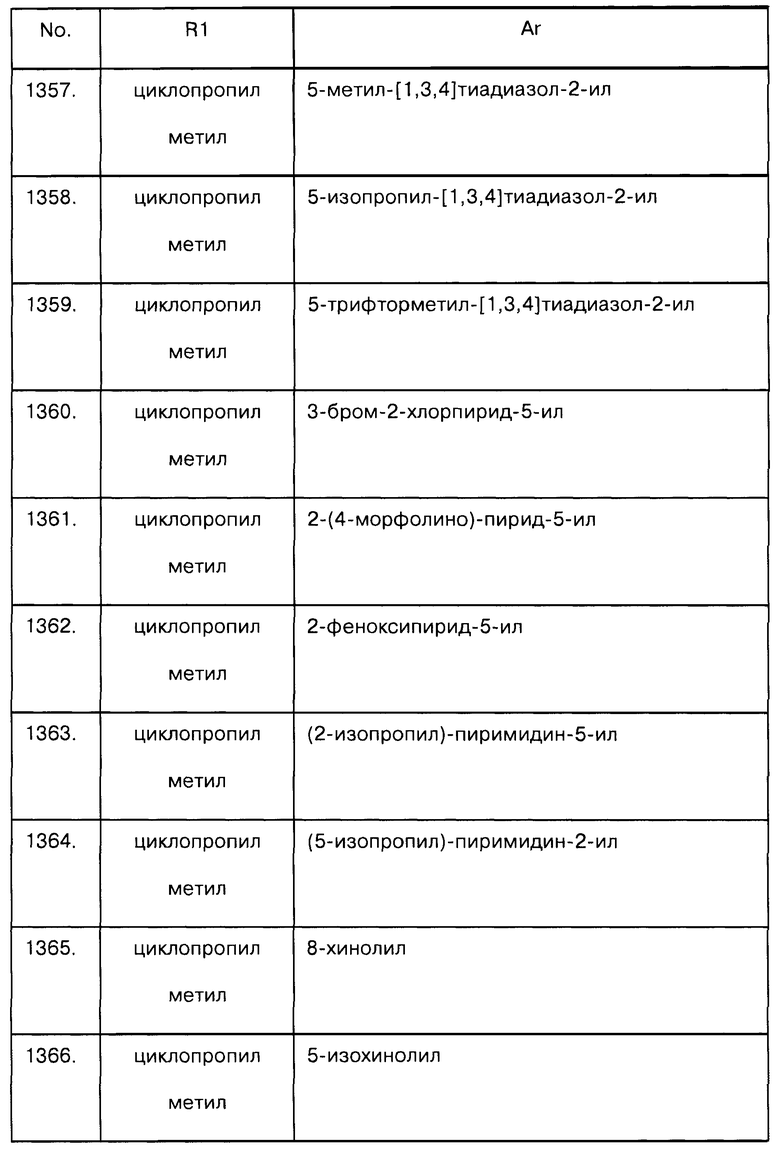
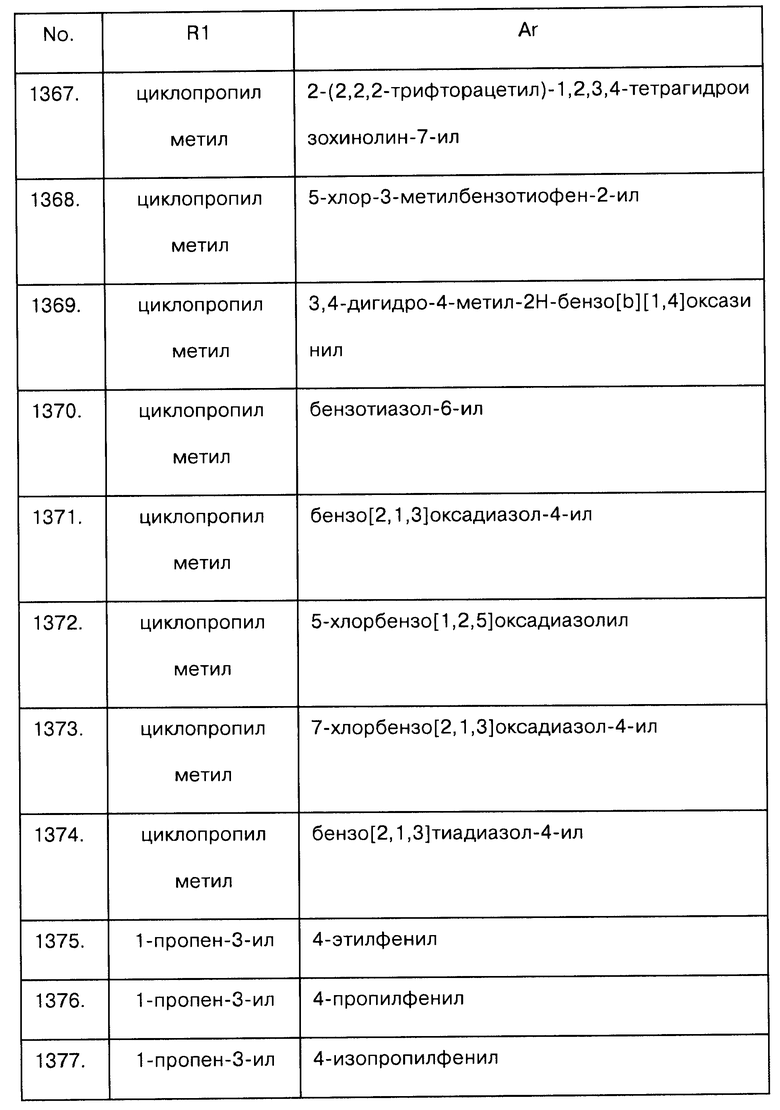






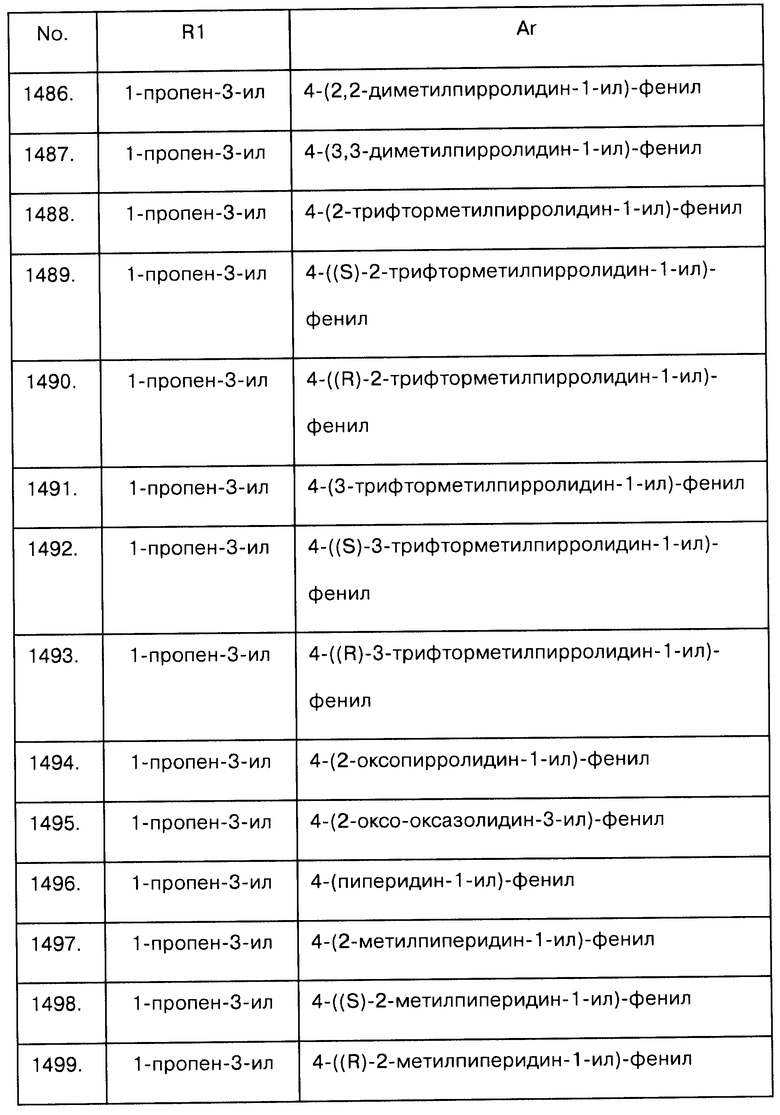






| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ИЗОХИНОЛИНОНА, ПОЛЕЗНЫЕ ДЛЯ ЛЕЧЕНИЯ РАКА | 2015 |
|
RU2690853C2 |
| СОЕДИНЕНИЯ ЗАМЕЩЕННЫХ ПИРАЗОЛОНОВ И СПОСОБЫ ИСПОЛЬЗОВАНИЯ | 2013 |
|
RU2650895C2 |
| НОВЫЕ ПИРИДАЗОНЫ И ТРИАЗИНОНЫ ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ЗАРАЖЕНИЯ ВИРУСОМ ГЕПАТИТА B | 2015 |
|
RU2664329C1 |
| Производное циннамида оленана, способ его получения и применение | 2020 |
|
RU2829816C1 |
| ПИРАЗОЛ-4-ИЛ-ГЕТЕРОЦИКЛИЛ-КАРБОКСАМИДНЫЕ СОЕДИНЕНИЯ И СПОСОБЫ ПРИМЕНЕНИЯ | 2012 |
|
RU2638552C2 |
| Производные пиримидина - ингибиторы репродукции вирусов, относящихся к роду Orthoflavivirus | 2023 |
|
RU2831118C1 |
| Соединение-антагонист PD-L1 | 2020 |
|
RU2823231C1 |
| 3'-ЗАМЕЩАЕМЫЕ ПРОИЗВОДНЫЕ АБСЦИЗОВОЙ КИСЛОТЫ | 2015 |
|
RU2688347C2 |
| Анелированные 9-гидрокси-1,8-диоксо-1,3,4,8-тетрагидро-2Н-пиридо[1,2-a]пиразин-7-карбоксамиды - ингибиторы интегразы ВИЧ, способы их получения и применения | 2019 |
|
RU2717101C1 |
| Гибридные производные (1Н-1,2,4) триазола и серосодержащих гетероциклов: производных тиазолидин-2,4-диона, тиоморфолин-3-она и 1,4-тиазепан-3-она, обладающих антимикробной активностью | 2020 |
|
RU2771027C1 |
Настоящее изобретение относится к соединениям формулы I и физиологически переносимым солям присоединения кислот указанных соединений. Соединения формулы I или их фармацевтически приемлемые соли могут быть использованы для приготовления фармацевтических композиций с целью лечения медицинских расстройств, восприимчивых к лечению лигандами дофаминовых рецепторов D3. 3 н. и 44 з.п. ф-лы, 2 табл., 81 пр.

1. Арилсульфонилметильные или арилсульфонамидные производные ароматических соединений, охватываемые общей структурной формулой I

где Ar представляет собой фенил или ароматический 5- или 6-членный связанный через атом углерода гетероароматический радикал, содержащий 1-3 гетероатома, выбранных из группы, включающей О, S и N, в составе цикла и где Ar может содержать в качестве заместителя 1 радикал Ra, a также 1 или 2 радикала Rb;
Ra выбран из группы, включающей С1-С6-алкил, С3-С6-циклоалкил, C1-С6-алкокси, фторированный С1-С6-алкил, фторированный С3-С6-циклоалкил, фторированный С1-С6-алкокси, NR4R5, C(O)NR4R5, С1-С6-алкилкарбонил, фторированный С1-С6-алкилкарбонил, С1-С6-алкилкарбониламино, C1-С6-алкоксикарбонил, фенилсульфонил, фенокси и 4-6 членный гетероциклический радикал, содержащий 1-3 гетероатома, выбранных из группы, включающей О, S и N, в составе цикла, причем последние 3 упомянутых радикалов могут содержать заместители -1 или 2 радикала, выбранные из группы, включающей галоген, циано, оксо, С1-С6алкил, фторированный C1-С6алкил и C1-С6алкилсульфонил,
Rb независимо друг от друга выбраны из группы, включающей галоген и метил, или
радикал Ra и один радикал Rb, если они присутствуют в молекуле и связаны с двумя соседними атомами углерода фенила, могут образовывать 5- или 6- членный гетеро- или карбоцикл, конденсированный с фенилом и который необязательно содержит 1 заместитель, выбранный из группы, включающей С1-С6-алкил, С1-С6-алкилкарбонил фторированный C1-C6-алкилкарбонил, который содержит 1-3 гетероатома, выбранных из группы, включающей О, S и N, в составе цикла,
причем, если Ar представляет собой фенил, R2a - водород и R2 - водород и А-СН2, то Ar содержит в качестве заместителя один радикал Ra, отличающийся от следующих: метил, метокси, трифторметил и трифторметокси и необязательно содержит 1 или 2 радикала Rb;
X представляет собой N или СН;
Y представляет собой -СН=СН- или -N=CH-;
А представляет собой СН2 или О;
Е представляет собой NR3;
R1 представляет собой С1-С4алкил, С3-С4-алкенил, фторированный С1-С4-алкил или С1-С3-алкилкарбонил;
Rla представляет собой Н, С2-С4-алкил или фторированный С1-С4-алкил, или Rla и R2a вместе составляют (СН2)n причем n принимает значение 3, или
Rla и R2a вместе составляют (СН2)n где n принимает значение 3;
R2 и R2a представляют собой Н;
R3 представляет собой Н или С1-С4-алкил;
R4, R5 независимо друг от друга выбраны из группы, включающей Н, С1-С2-алкил и С1-С2-алкокси;
а также физиологически переносимые соли присоединения кислот указанных соединений.
2. Соединения по п.1, где
Ar представляет собой фенил или ароматический 5- или 6-членный гетероароматический радикал, связанный через атом углерода, содержащий 1 атом азота в составе цикла, и 0 или 1 других гетероатома, независимо друг от друга выбранных из группы, включающей О, S и N в составе цикла, где Ar содержит в качестве заместителя 1 радикал Ra, выбранный из группы, включающей С2-С6-алкил, С3-С6-циклоалкил, С2-С6-алкокси, фторированный С2-С6-алкил, фторированный С3-С6-циклоалкил, фторированный С2-С6-алкокси, NR4R5, азетидин-1-ил или пирролидин-1-ил, причем последние два радикала могут быть фторированными и ароматический 5- или 6-членный гетероароматический радикал, связанный через атом углерода, содержащий 1 атом азота в составе цикла, и 0 или 1, других гетероатома, независимо друг от друга выбранных из группы, включающей О, S и N, где последний радикал может содержать в качестве заместителя 1 или 2 радикала, выбранных из группы, включающей галоген, циано, окси, C1-С6-алкил, фторированный С1-С6-алкил и C1-С6алкилсульфонил, и где Ar может содержать 1 или 2 других радикала Rb, которые независимо друг от друга выбраны из группы, включающей галоген и метил, и где
Е представляет собой NR3, a R3 -Н или С1-С4алкил, и
R1 представляет собой С2-С4алкил, С3-С4-алкенил, фторированный С1-С4-алкил или С1-С3-алкилкарбонил;
R4 и R5 независимо друг от друга выбраны из группы, включающей Н и С1-С2-алкил.
3. Соединения по п.1, где Ar содержит один радикал Ra формулы Ra′

где Y представляет собой N, СН или CF,
если Y соответствует СН или CF, то Ral и Ra2 независимо друг от друга выбраны из группы, включающей С1-С2-алкил и фторированный С1-С2-алкил, причем один из радикалов Ral или Ra2 может также представлять собой водород или фтор, или
Ral и Ra2 вместе образуют радикал (СН2)m, где 1 или 2 атома водорода могут быть замещены фтором, или Ral и Ra2 вместе образуют радикал (СН2)m, где одна группа СН2 может быть замещена на О, S или N-Rc, причем Rc представляет собой водород или С1-С2-алкил, где 1 или 2 атома водорода могут быть замещены радикалами, выбранными из группы, включающей фтор, оксо или С1-С2-алкил, и где m принимает значения 2, 3, 4 или 5, и
если Y представляет собой N, то Ral и Ra2 независимо могут быть замещены радикалами, выбранными из группы, включающей С1-С2-алкил или С1-С2-алкокси, или
Ral и Ra2 вместе образуют радикал (СН2)m, где 1 или 2 атома водорода независимо могут быть замещены радикалами, выбранными из группы, включающей фтор, оксо или С1-С2-алкил, где одна группа СН2 может быть замещена на О, S или N-Rc, причем Rc представляет собой водород или С1-С2-алкил, и где m принимает значения 2, 3, 4 или 5.
4. Соединения по п.3, где радикал R3 выбран из группы, включающей изопропил, (R)-1-фторэтил, (S)-1-фторэтил, 2-фторэтил, 1,1-дифторэтил, 2,2-дифторэтил, 2,2,2-трифторэтил, (R)-1-фторпропил, (S)-1-фторпропил, 2-фторпропил, 3-фторпропил, 1,1-дифторпропил, 2,2-дифторпропил, 3,3-дифторпропил, 3,3,3-трифторпропил, (R)-2-фтор-1-метилэтил, (S)-2-фтор-1-метилэтил, (R)-2,2-дифтор-1-метилэтил, (S)-2,2-дифтор-1-метилэтил, (R)-1,2-дифтор-1-метилэтил, (S)-1,2-дифтор-1-метилэтил, (R)-2,2,2-трифтор-1-метилэтил, (S)-2,2,2-трифтор-1-метилэтил, 2-фтор-1-(фторметил)этил, 1-(дифторметил)-2,2-дифторэтил, циклобутил, 1-фторциклопропил, (R)-2,2-дифторциклопропил, (S)-2,2-дифторциклопропил (R)- и (S)-2-фторциклопропил.
5. Соединения по п.3, где радикал Ra′ выбран из группы, включающей 4-морфолинил, 4-тиоморфолинил, 4-(1,1-диоксо)тиоморфолинил, пиперазин-1-ил, 4-метилпиперазин-1-ил, азетидин-1-ил, 2-метилазетидин-1-ил, (S)-2-метилазетидин-1-ил, (R)-2-метилазетидин-1-ил, 3-фторазетидин-1-ил, пирролидин-1-ил, пирролидин-2-ил, (S)-пирролидин-2-ил, (R)-пирролидин-2-ил, пирролидин-3-ил, (S)-пирролидин-3-ил, (R)-пирролидин-3-ил, 2-фторпирролидин-1-ил, (S)-2-фторпирролидин-1-ил, (R)-2-фторпирролидин-1-ил, 3-фторпирролидин-1-ил, (S)-3-фторпирролидин-1-ил, (R)-3-фторпирролидин-1-ил, 2,2-дифторпирролидин-1-ил, 3,3-дифторпирролидин-1-ил, 2-метилпирролидин-1-ил, (S)-2-метилпирролидин-1-ил, (R)-2-метилпирролидин-1-ил, 3-метилпирролидин-1-ил, (S)-3-метилпирролидин-1-ил, (R)-3-метилпирролидин-1-ил, 1-метилпирролидин-2-ил, (S)-1-метилпирролидин-2-ил, (R)-1-метилпирролидин-2-ил, 1-метилпирролидин-3-ил, (S)-1-метилпирролидин-3-ил, (R)-1-метилпирролидин-3-ил, 2,2-диметилпирролидин-1-ил, 3,3-диметилпирролидин-1-ил, 2-трифторметилпирролидин-1-ил, (S)-2-трифторметилпирролидин-1-ил, (R)-2-трифторметилпирролидин-1-ил, 3-трифторметилпирролидин-1-ил, (S)-3-трифторметилпирролидин-1-ил, (R)-3-трифторметилпирролидин-1-ил, 2-оксопирролидин-1-ил, 2-оксооксазолидин-3-ил, пиперидин-1-ил, 2-метилпиперидин-1-ил, (S)-2-метилпиперидин-1-ил и (R)-2-метилпиперидин-1-ил.
6. Соединения по п.3, где радикал Ra′ содержит 1, 2, 3 или 4 атома фтора.
7. Соединения по п.1, где Ar содержит в качестве заместителя один радикал Ra, выбранный из группы, включающей CHF2, CH2F, OCHF2 и OCH2F.
8. Соединения по п.1, где Ar содержит в качестве заместителя один радикал Ra, выбранный из числа 5- или 6-членных гетероароматических радикалов, которые содержат в цикле один гетероатом из числа О, S и N и могут содержать дополнительно 1 или 2 атома азота, и где 5- или 6-членный гетероароматический радикал необязательно содержит 1 или 2 заместителя, выбранных из группы, включающей галоген, CN, С1-С6-алкил, фторированный С1-С6-алкил и С1-С6-алкилсульфонил.
9. Соединения по п.8, где Ar содержит в качестве заместителя один гетероароматический радикал Ra, выбранный из группы, включающей фуранил, тиенил, пирролил, пиразолил, имидазолил, оксазолил, изоксазолил, 1,3,4-тиадиазолил, 1,2,4-триазолил и 1,2,3-триазолил, где гетероароматический радикал необязательно содержит один или два заместителя, выбранных из группы, включающей галоген, С1-С4алкил и фторированный С1-С4-алкил.
10. Соединения по п.1, где Ar представляет собой фенил.
11. Соединения по п.1, где Ar представляет собой фенил, содержащий в качестве заместителя радикал Ra в четвертом положении фенильного цикла.
12. Соединения по п.1, где R1 представляет собой н-пропил, фторированный неразветвленный С2-С3-алкил или 1-пропен-3-ил.
13. Соединения по п.1, где Rla представляет собой водород.
14. Соединения по п.1, где Rla представляет собой н-пропил.
15. Соединения по п.1, где либо группы Rla и R2, либо группы Rla и R2a образуют группу (СН2)n, где n принимает значение 3.
16. Соединения по п.1, где X представляет собой СН и Y соответствует -СН=СН- или -N=CH- или X представляет собой N a Y означает -СН=СН-.
17. Соединения по п.16, где Y представляет собой -СН=СН- и X соответствует СН.
18. Соединения по п.17, охватываемые общей структурной формулой Ia
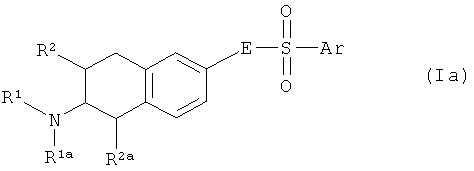
и их физиологически переносимые соли присоединения кислот.
19. Соединения по п.17, охватываемые общей структурной формулой Ib
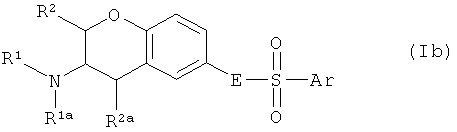
и их физиологически переносимые соли присоединения кислот.
20. Соединения по п.17, охватываемые общей структурной формулой Ic
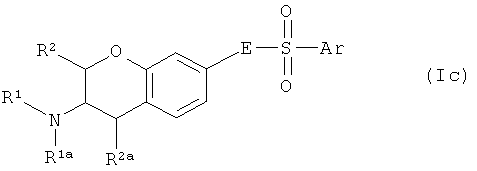
и их физиологически переносимые соли присоединения кислот.
21. Соединения по п.1, где Y представляет собой -СН=СН- и X представляет собой N.
22. Соединения по пп.18, 19 или 20, где Ar содержит один радикал Ra формулы Ra′

где
Y представляет собой N, СН или CF,
если Y соответствует СН или CF, то Ra1 и Ra2 независимо друг от друга выбраны из группы, включающей С1-С2-алкил, и фторированный С1-С2-алкил, причем, один из радикалов Ra1 или Ra2 может также представлять собой водород или фтор, или
Ral и Ra2 вместе образуют радикал (СН2)m, где 1 или 2 атома водорода могут быть замещены фтором или Ral и Ra2 вместе образуют радикал (СН2)m, где одна группа СН2 может быть замещена на О, S или N-Rc, причем Rc представляет собой водород или С1-С2-алкил, где 1 или 2 атома водорода могут быть замещены радикалами, выбранными из группы, включающей фтор, оксо или С1-С2-алкил, и где m принимает значения 2, 3, 4 или 5, и
если Y представляет собой N, то Ral и Ra2 независимо могут быть замещены радикалами, выбранными из группы, включающей С1-С2-алкил или С1-С2-алкокси, или
Ral и Ra2 вместе образуют радикал (СН2)m, где 1 или 2 атома водорода независимо могут быть замещены радикалами, выбранными из группы, включающей фтор, оксо или С1-С2-алкил, где одна группа СН2 может быть замещена на О, S или N-Rc, причем Rc представляет собой водород или С1-С2-алкил, и где m принимает значения 2, 3, 4 или 5.
23. Соединения по п.22, где радикал Ra′ выбран из группы, включающей изопропил, (R)-1-фторэтил, (S)-1-фторэтил, 2-фторэтил, 1,1-дифторэтил, 2,2-дифторэтил, 2,2,2-трифторэтил, (R)-1-фторпропил, (S)-1-фторпропил, 2-фторпропил, 3-фторпропил, 1,1-дифторпропил, 2,2-дифторпропил, 3,3- дифторпропил, 3,3,3-трифторпропил, (R)-2-фтор-1-метилэтил, (S)-2-фтор-1-метилэтил, (R)-2,2-дифтор-1-метилэтил, (S)-2,2-дифтор-1-метилэтил, (R)-1,2-дифтор-1-метилэтил, (S)-1,2-дифтор-1-метилэтил, (R)-2,2,2-трифтор-1-метилэтил, (S)-2,2,2-трифтор-1-метилэтил, 2-фтор-1-(фторметил)этил, 1-(дифторметил)-2,2-дифторэтил, циклобутил, 1-фторциклопропил, (R)-2,2- дифторциклопропил, (3)-2,2-дифторциклопропил (R)- и (S)-2-фторциклопропил.
24. Соединения по п.22, где радикал Ra′ выбран из группы, включающей 4-морфолинил, 4-тиоморфолинил, 4-(1,1-диоксо)тиоморфолинил, пиперазин-1-ил, 4-метилпиперазин-1-ил, азетидин-1-ил, 2-метилазетидин-1-ил, (S)-2-метилазетидин-1-ил, (R)-2-метилазетидин-1-ил, 3-фторазетидин-1-ил, пирролидин-1-ил, пирролидин-2-ил, (S)-пирролидин-2-ил, (R)-пирролидин-2-ил, пирролидин-3-ил, (S)-пирролидин-3-ил, (R)-пирролидин-3-ил, 2-фторпирролидин-1-ил, (S)-2-фторпирролидин-1-ил, (R)-2-фторпирролидин-1-ил, 3-фторпирролидин-1-ил, (S)-3-фторпирролидин-1-ил, (R)-3-фторпирролидин-1-ил, 2,2-дифторпирролидин-1-ил, 3,3-дифторпирролидин-1-ил, 2-метилпирролидин-1-ил, (S)-2-метилпирролидин-1-ил, (R)-2-метилпирролидин-1-ил, 3-метилпирролидин-1-ил, (S)-3-метилпирролидин-1-ил, (R)-3-метилпирролидин-1-ил, 1-метилпирролидин-2-ил, (S)-1-метилпирролидин-2-ил, (R)-1-метилпирролидин-2-ил, 1-метилпирролидин-3-ил, (S)-1-метилпирролидин-3-ил, (R)-1-метилпирролидин-3-ил, 2,2-диметилпирролидин-1-ил, 3,3-диметилпирролидин-1-ил, 2-трифторметилпирролидин-1-ил, (S)-2-трифторметилпирролидин-1-ил, (R)-2-трифторметилпирролидин-1-ил, 3-трифторметилпирролидин-1-ил, (S)-3-трифторметилпирролидин-1-ил, (R)-3-трифторметилпирролидин-1-ил, 2-оксопирролидин-1-ил, 2-оксооксазолидин-3-ил, пиперидин-1-ил, 2-метилпиперидин-1-ил, (S)-2-метилпиперидин-1-ил и (R)-2-метилпиперидин-1-ил.
25. Соединения по п.22, где радикал Ra′ содержит 1, 2, 3 или 4 атома фтора.
26. Соединения по пп.18, 19 или 20, где Ar представляет собой фенил, содержащий в качестве заместителя один радикал Ra, выбранный из группы, включающей CHF2, CH2F, OCHF2 и OCH2F.
27. Соединения по пп.18, 19 или 20, где Ar содержит один радикал Ra, выбранный из числа 5- или 6-членных гетероароматических радикалов, которые содержат в составе цикла один гетероатом из числа О, S и N и могут содержать дополнительно 1 или 2 атома азота в составе цикла, и где 5- или 6-членный гетероароматический радикал необязательно содержит 1 или 2 заместителя, выбранные из группы, включающей галоген, CN, С1-С6-алкил, фторированный С1-С6-алкил, и С1-С6-алкилсульфонил.
28. Соединения по п.27, где Ar содержит один гетероароматический радикал Ra, выбранный из группы, включающей фуранил, тиенил, пирролил, пиразолил, имидазолил, оксазолил, изоксазолил, 1,3,4-тиадиазолил, 1,2,4-триазолил и 1,2,3-триазолил, где гетероароматический радикал необязательно содержит от 1 до 3 заместителей, выбранных из группы, вкллючающей галоген, С1-С4алкил, С1-С4алкокси, фторированный С1-С4алкил и фторированный С1-С4алкокси.
29. Соединения по пп.18, 19 или 20, где Ar представляет собой фенил, который содержит радикал Ra в четвертом положении фенильного цикла.
30. Соединения по пп.18, 19 или 20, где Е представляет собой NR3.
31. Соединения по п.30, где R3 представляет собой Н.
32. Соединения по пп.18, 19 или 20, где R1 представляет собой н-пропил, фторированный неразветвленный С2-С3-алкил или 1-пропен-3-ил.
33. Соединения по пп.18, 19 или 20, где Rla представляет собой водород.
34. Соединения по пп.18, 19 или 20, где Rla представляет собой н-пропил.
35. Соединения по пп.18, 19 или 20, где либо Rla и R2, либо Rla и R2a образуют группу (СН2)n, где n может принимать значение 3.
36. Соединения по пп.18, 19 или 20, где R2 и R2a представляют собой водород.
37. Соединения по пп.18, 19 или 20, где Ar представляет собой 4-дифторметоксифенил.
38. Соединения по пп.18, 19 или 20, где R1 представляет собой н-пропил или 1-пропен-3-ил.
39. Соединения по пп.18, 19 или 20, где Rla представляет собой водород.
40. Соединения по п.18, где R2 и R2a представляют собой водород, Ar-4-дифторметоксифенил, R1-н-пропил или 1-пропен-3-ил.
41. Соединения по п.40, где Rla представляет собой водород.
42. Соединения по п.40 или п.41, где R1 представляет собой пропил.
43. Фармацевтическая композиция для лечения медицинских расстройств, восприимчивых к лечению лигандами дофаминовых D3 рецепторов, содержащая по меньшей мере одно соединение формулы I или его фармацевтически приемлемую соль по пп.1-42 по меньшей мере с одним физиологически приемлемым носителем или вспомогательным веществом.
44. Применение соединений формулы I или их фармацевтически приемлемых солей по пп.1-42 в качестве ингредиента фармацевтических композиций для лечения медицинских расстройств, восприимчивых к лечению лигандами дофаминовых D3 рецепторов.
45. Применение по п.44, где медицинское расстройство представляет собой заболевание центральной нервной системы.
46. Применение по п.45, где медицинское расстройство выбрано из группы, включающей болезнь Паркинсона, шизофрению, когнитивные нарушения, депрессию, тревожность, синдром зависимости, нарушения функции почек и пищевого поведения.
47. Применение по п.46, где медицинское расстройство представляет собой синдром зависимости.
| ПРОИЗВОДНЫЕ 2-АМИНОПИРИДИНОВ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ И ПРОМЕЖУТОЧНЫЕ ВЕЩЕСТВА | 1999 |
|
RU2226527C2 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| D.CUSSAC ET AL: "The novel antagonist, S33084, and GR218,231 interact selectively with cloned and native, rat dopamine D3 receptors as compared with native, rat dopamine D2 receptors" EUROPEAN JOURNAL OF PHARMACOLOGY, 2000, vol.394, pages 47-50. | |||
Авторы
Даты
2012-02-20—Публикация
2005-10-14—Подача