ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
По настоящей заявке испрашивается приоритет предварительной заявки США No. 61/020,960, поданной 14 января 2008, описание которой в полном объеме включено в настоящее описание в качестве ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение в целом относится к композициям и способам, которые могут использоваться для лечения состояний и заболеваний, связанных с ангиогенезом. В частности, настоящее изобретение относится к антагонистам EGF-подобного домена 8 (EGFL8).
ПРЕДПОСЫЛКИ ДЛЯ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
В настоящем время хорошо известно, что ангиогенез является важным звеном патогенеза различных расстройств. В их число входят солидные опухоли и метастазы, атеросклероз, ретролентальная фиброплазия, гемангиомы, хроническое воспаление, заболевания, связанные с внутриглазной неоваскуляризацией, такие как пролиферативные ретинопатии, например, диабетическая ретинопатия, окклюзия ретинальных вен (RVO), возрастная дегенерация желтого пятна (AMD), неоваскулярная глаукома, иммунологическое отторжение трансплантированной ткани роговицы и других тканей, ревматоидный артрит и псориаз. Duda et al. J. Clin. Oncology 25(26): 4033-42 (2007); Kesisis et al. Curr. Pharm. Des. 13: 2795-809 (2007); Zhang & Ma Prog. Ret. & Eye Res. 26: 1-37 (2007).
В случае опухолевого роста ангиогенез обеспечивает клеткам опухоли преимущества в росте и автономной пролиферации по сравнению с нормальными клетками. Обычно опухоль начинается с одиночной патологической клетки, которая способна расти только лишь до размера в несколько кубических миллиметров, обусловленного расстоянием до ближайшего доступного капиллярного русла, и она в течение долгого периода может оставаться в “спящем” состоянии, без дальнейшего роста или диссеминации. Затем некоторые опухолевые клетки переключаются на ангиогенный фенотип для активации эндотелиальных клеток (ЭК), которые пролиферируют и созревают во вновь образованные капиллярные кровеносные сосуды. Указанные вновь образованные кровеносные сосуды обеспечивают возможность не только непрерывного роста первичной опухоли, но также диссеминации и реколонизации метастатических опухолевых клеток. Механизмы, которые контролируют ангиогенное переключение, не совсем понятны, но считается, что неоваскуляризация опухолевой массы приводит к чистому балансу совокупности стимуляторов и ингибиторов ангиогенеза.
На сегодняшний день показано, что значительное количество молекул, в основном секретируемых факторов, продуцируемых окружающими клетками, регулирует дифференцировку, пролиферацию, миграцию ЭК и их коалесценцию в шнуроподобные структуры. Например, фактор роста сосудистого эндотелия (VEGF) идентифицирован как ключевой фактор, участвующий в стимулирующем ангиогенезе и индуцирующий сосудистую проницаемость. Ferrara et al., Endocr. Rev.18: 4-25 (1997). Кроме того, было показано, что ECM-связанный белок, называемый белком, подобным эпидермальному фактору роста 7 (EGFL7), экспрессируется эндотелиальными клетками и играет роль в ангиогенезе. Parker et al., Nature 428: 754-58 (2004); Fitch et al., Dev. Dynamics 230: 316-24 (2004); Campagnolo et al., Am. J. Path. 167(1): 275-284 (2005); Schmidt et al., Development, 134(16): 2913-23. (2007), патентная заявка США US2007/0031437. В публикации Fitch et al. описан также паралог Egfl7, обозначаемый Egfl8, и указано, что его экспрессия подобна экспрессии Egfl7, но что при этом EGFL7 и EGFL8 могут функционально и не перекрываться.
Несмотря на многочисленные успехи в области ангиогенеза, все еще остается потребность в идентификации мишеней и разработке средств, которые могут дополнить или повысить эффективность существующей антиангиогенной терапии.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение, по крайней мере отчасти, основано на открытии того факта, что EGF-подобный домен 8 (EGFL8) участвует в процессе ангиогенеза. Соответственно, настоящее изобретение относится к новым композициям и к их применению для ингибирования патологических процессов с участием ангиогенного компонента.
В одном из аспектов настоящее изобретение относится к способу уменьшения или ингибирования ангиогенеза у индивида с патологическим состоянием, связанным с ангиогенезом, предусматривающим введение указанному индивиду антагониста EGFL8. В некоторых вариантах осуществления антагонист EGFL8 представляет собой антитело против EGFL8. В некоторых вариантах осуществления указанным патологическим состоянием является новообразование, например, карцинома. В определенных вариантах осуществления указанный способ дополнительно включает введение химиотерапевтического средства. В некоторых вариантах осуществления указанное патологическое состояние связано с болезнями глаза. В некоторых вариантах осуществления указанным патологическим состоянием является заболевание, связанное с внутриглазной неоваскуляризацией.
В некоторых вариантах осуществления указанный способ дополнительно включает введение указанному индивиду второго антиангиогенного средства. В определенных вариантах осуществления указанное второе антиангиогенное средство вводят до или после введения антагониста EGFL8. В других вариантах осуществления указанное второе антиангиогенное средство вводят одновременно с антагонистом EGFL8. В некоторых вариантах осуществления указанным вторым антиангиогенным средством является антагонист EGFL7 или антагонист фактора роста клеток сосудистого эндотелия (VEGF), например, антитело против EGFL7 или антитело против VEGF (например, бевацизумаб).
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На ФИГУРЕ 1A и ФИГУРЕ 1B показан характер экспрессии Egfl7 и Egfl8 в краниальной сосудистой сети эмбриона мыши E10.5.
На ФИГУРЕ 2 показана стратегия, используемая для получения нокаутных по Egfl8 мышей.
На ФИГУРЕ 3 показан сосудистый фенотип в сетчатке глаза мышей Egfl7+/-, Egfl8-/- и Egfl7-/-, Egfl8-/-.
На ФИГУРЕ 4 показан фенотип ангиогенеза «микрокармана» в роговице глаза у нокаутных по Egfl8 мышей.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Определения
Если не указано иначе, используемые в данном описании технические и научные термины обозначают то же, что обычно известно специалисту в той области, к которой относится настоящее изобретение. См., например, Singleton et al., Dictionary of Microbiology and Molecular Biology 2nd ed., J. Wiley & Sons (New York, NY 1994); Sambrook et al., Molecular Cloning, A Laboratory Manual Cold Spring Harbor Press (Cold Spring Harbor, NY 1989). Для целей, преследуемых в настоящем изобретении, некоторые термины определены ниже.
Используемые в данном описании термины "EGFL8" и "полипептид EGFL8" относятся к полипептиду с аминокислотной последовательностью природным образом полученного полипептида EGFL8, независимо от способа его получения или от того, из какого биологического вида он получен. Таким образом, EGFL8 может иметь аминокислотную последовательность полученного природным образом EGFL8 человека, EGFL8 мыши или EGFL8, полученного из любого другого биологического вида. Полноразмерная аминокислотная последовательность EGFL8 человека является следующей:
MGSRAELCTLLGGFSFLLLLIPGEGAKGGSLRESQGVCSKQTLVVPLHYNESYSQPVYKPY LTLCAGRRICSTYRTMYRVMWREVRREVQQTHAVCCQGWKKRHPGALTCEAICAKPCLNGG VCVRPDQCECAPGWGGKHCHVDVDECRTSITLCSHHCFNTAGSFTCGCPHDLVLGVDGRTC MEGSPEPPTSASILSVAVREAEKDERALKQEIHELRGRLERLEQWAGQAGAWVRAVLPVPP EELQPEQVAELWGRGDRIESLSDQVLLLEERLGACSCEDNSLGLGVNHR (SEQ ID NO:1).
Полноразмерная аминокислотная последовательность EGFL8 мыши является следующей:
MGLWAELCISLRGLSFFLVLMTGEGTRGGSFKESLGVCSKQTLLVPLRYNESYSQPVYKPY LTLCAGRRICSTYRTTYRVAWREVRREVPQTHVVCCQGWKKPHPGALTCDAICSKPCLNGG VCTGPDRCECAPGWGGKHCHVDVDECRASLTLCSHGCLNTLGSFLCSCPHPLVLGLDGRTC AGGPPESPTSASILSVAVREADSEEERALRWEVAELRGRLEKLEQWATQAGAWVRAVLPMP PEELRPEQVAELWGRGDRIESLSDQVLLLEERLGACACEDNSLGPSLRG (SEQ ID NO:2).
Такие полипептиды EGFL8 могут быть выделены из природных источников или могут быть получены рекомбинантным и/или синтетическим путями.
"Выделенный, EGFL8" означает EGFL8, который очищен из источника EGFL8 или который получен рекомбинантным или синтетическим путем и очищен. Очищенный EGFL8 является по существу свободным от других полипептидов или пептидов. В данном описании "по существу свободный" означает имеющий менее приблизительно 5%, предпочтительно, менее приблизительно 2%, более предпочтительно, менее приблизительно 1%, еще более предпочтительно, менее приблизительно 0,5%, и наиболее предпочтительно, менее приблизительно 0,1% примесей других белков.
Термин "антагонист" используется в данном описании в наиболее широком смысле и включает любую молекулу, которая частично или полностью блокирует, ингибирует или нейтрализует биологическую активность EGFL8. Подходящие антагонистические молекулы включают, в частности, антагонистические антитела или фрагменты антител, варианты фрагментов или аминокислотных последовательностей нативного полипептида EGFL8, пептидов, растворимых фрагментов рецептора (рецепторов) EGFL8, антисмысловые РНК, рибозимы, iРНК, низкомолекулярные органические молекулы и т.д. Способы идентификации антагонистов полипептида EGFL8 могут включать приведение полипептида EGFL8 в контакт с антагонистической молекулой-кандидатом и измерение детектируемого изменения на уровне одной или более биологических активностей, в норме связанных с полипептидом EGFL8.
"Активный" или "активность" в связи с преследуемыми в данном описании целями относится к форме(формам) EGFL8, которая сохраняет биологическую и/или иммунологическую активность EGFL8, причем "биологическая" активность относится к биологической функции (либо ингибирующей, либо стимулирующей), вызываемой EGFL8 и отличной от способности индуцировать выработку антитела против антигенного эпитопа, содержащегося в EGFL8, а "иммунологическая" активность относится к способности индуцировать выработку антитела против антигенного эпитопа, содержащегося в EGFL8. Основными биологическими активностями EGFL8 являются его способность стимулировать сосудообразование и поддерживать адгезивные и миграционные свойства эндотелиальных клеток.
"Рецептором EGFL8" является молекула, с которой соединяется EGFL8 и которая опосредует биологическую активность EGFL8.
Термин "антитело" используется в данном описании в наиболее широком смысле и охватывает, в частности, антитело человека, не являющиеся человеческими (например, мышиные) и гуманизированные моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела), а также любые фрагменты антител, которые проявляют требуемую биологическую активность.
"Нативные антитела" обычно являются гетеротетрамерными гликопротеинами размером приблизительно в 150000 Дальтон, состоящими из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей. Каждая легкая цепь связана с тяжелой цепью одной ковалентной дисульфидной связью, в то время как число дисульфидных связей среди тяжелых цепей иммуноглобулинов различных изотипов варьирует. Каждая тяжелая и легкая цепь имеет также регулярно расположенные дисульфидные мостики внутри цепи. Каждая тяжелая и легкая цепь на одном конце имеет вариабельный домен (VH) с последующим рядом константных доменов. Каждая легкая цепь на одном конце имеет вариабельный домен (VL), а на другом конце имеет константный домен; константный домен легкой цепи совпадает с первым константным доменом тяжелой цепи, а вариабельный домен легкой цепи совпадает с вариабельным доменом тяжелой цепи. Считается, что конкретные аминокислотные остатки образуют сопряжение между вариабельными доменами легкой и тяжелой цепи.
При расщеплении антител папаином образуется два идентичных антиген-связывающих фрагмента, которые называются "Fab"-фрагментами, каждый из которых содержит единственный антиген-связывающий участок, и остальной "Fc"-фрагмент, название которого отражает его повышенную способность к кристаллизации. Обработка пепсином приводит к образованию F(ab')2-фрагмента, который имеет два антиген-связывающих участка и который сохраняет способность к поперечному связыванию с антигеном.
"Fv" представляет собой минимальный фрагмент антитела, который полностью содержит участок распознавания и связывания антигена. Указанный участок состоит из димера вариабельных доменов одной легкой цепи и одной тяжелой цепи, находящихся в тесной нековалентной ассоциации друг с другом.
Fab-фрагмент содержит также константный домен легкой цепи и первый константный домен (CH1) тяжелой цепи. Fab'-фрагменты отличаются от Fab-фрагментов добавлением нескольких остатков к карбокси-концу их CH1-домена тяжелой цепи, включая один или более цистеинов из шарнирной области антитела. Обозначение Fab'-SH используется в данном описании в отношении Fab'-фрагмента, в котором цистеиновый остаток(остатки) константных доменов несет свободную тиоловую группу. F(ab')2-фрагменты антитела первоначально продуцируются в виде пары Fab'-фрагментов, между которыми содержатся шарнирные цистеины. Остальные варианты химического связывания фрагментов антитела хорошо известны.
"Легкие цепи" антител (иммуноглобулинов) из любых видов позвоночных могут быть отнесены к одному из двух совершенно различных типов цепей, называемых каппа (κ) и лямбда (λ) на основе аминокислотных последовательностей их константных доменов.
В зависимости от аминокислотной последовательности константных доменов их тяжелых цепей, иммуноглобулины могут быть отнесены к разным классам. Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть дополнительно подразделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, называются, соответственно, α, δ, ε, γ и μ. Субъединичные структуры и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны.
"Фрагменты антитела" содержат часть полноразмерного антитела, обычно его антиген-связывающий или вариабельный домен. Примеры фрагментов антитела включают Fab-, Fab'-, F(ab')2- и Fv- фрагменты.
Используемый в данном описании термин "моноклональное антитело" относится к антителу, полученному из популяции по существу гомогенных антител, то есть индивидуальные антитела, составляющие указанную популяцию, идентичны, за исключением возможных природных мутаций, которые могут присутствовать в минорных количествах. Моноклональные антитела являются высокоспецифическими, направленными на единственный антигенный участок. Кроме того, в отличие от препаратов обычных (поликлональных) антител, которые, как правило, включают различные антитела, направленные на различные детерминанты (эпитопы), каждое моноклональное антитело направлено на единственную детерминанту конкретного антигена. Уточнение "моноклональное" указывает на характер антитела как антитела, полученного из по существу гомогенной популяции антител и не должно быть истолковано как указание на то, что такое антитело получено тем или иным конкретным методом. Например, моноклональные антитела, используемые в соответствии с настоящим изобретением, могут быть получены гибридомным методом, впервые описанным Kohler et al., Nature 256: 495 (1975), или могут быть получены с помощью методов рекомбинантной ДНК (см., например, патент США No. 4816567). "Моноклональные антитела" могут быть также выделены из библиотек фаговых антител с использованием технологий, описанных Clackson et al., Nature 352: 624-628 (1991), и, например, Marks et al., J. Mol. Biol. 222: 581-597 (1991).
В данном описании моноклональные антитела включают, в частности, "химерные" антитела, в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных из конкретных видов или принадлежащих конкретному классу или подклассу антител, тогда как остальная цепь(цепи) идентична или гомологична соответствующим последовательностям в антителах, полученных из других видов или принадлежащих другому классу или подклассу антител, а также во фрагментах таких антител, которые обладают требуемой биологической активностью (патент США No. 4816567; и Morrison et al., Proc. Natl. Acad. Sci. USA 81: 6851-6855 (1984)).
"Гуманизированные" формы антител, не являющихся антителами человека (например, антител мыши), являются химерными антителами, которые содержат минимальную последовательность, полученную из иммуноглобулина, не являющегося иммуноглобулином человека. По большей частью гуманизированные антитела являются иммуноглобулинами человека (реципиентское антитело), в которых остатки гипервариабельной области реципиента заменены остатками гипервариабельной области отличных от человека видов (донорское антитело), таких как мышь, крыса, кролик или отличный от человека примат, имеющих требуемую специфичность, аффинность и эффективность. В некоторых случаях остатки области рамки считывания (FR) иммуноглобулина человека заменены соответствующими остатками иммуноглобулина не-человеческой природы. Кроме того, гуманизированные антитела могут включать остатки, которые не обнаруживаются в реципиентском антителе или в донорском антителе. Такие модификации производят для дальнейшего повышения эффективности антитела. Обычно гуманизированное антитело содержит все из по меньшей мере одного, обычно двух вариабельных доменов, в которых все или по существу все гипервариабельные области соответствуют таковым иммуноглобулина не-человеческой природы, а все или по существу все области FR имеют последовательность иммуноглобулина человека. Гуманизированное антитело необязательно содержит также по меньшей мере часть константной области иммуноглобулина (Fc), как правило, таковую иммуноглобулина человека. Для ознакомления с дальнейшими подробностями см. Jones et al. Nature 321: 522-525 (1986); Reichmann et al. Nature 332: 323-329 (1988); и Presta Curr. Op. Struct. Biol. 2: 593-596 (1992).
В данном описании под "лечением" подразумевается подход, обеспечивающий улучшение или требуемые клинические результаты. Для целей, преследуемых данным изобретением, улучшение или требуемые клинические результаты включают, не ограничиваясь перечисленным, детектируемое или недетектируемое облегчение симптомов, ослабление выраженности заболевания, стабилизацию (то есть отсутствие ухудшения) состояния болезни, задержку или замедление прогрессирования заболевания, улучшение или временное облегчение состояния болезни и ремиссию (будь то частичная или полная ремиссия). "Лечение" может означать также увеличение выживаемости по сравнению с выживаемостью в отсутствие лечения. "Лечение" представляет собой вмешательство, предпринимаемое с целью предотвращения развития или внесения изменений в патологический процесс, связанный с заболеванием. Соответственно, "лечение" относится как к терпевтическому воздействию, так и к профилактическим или превентивным мерам. Таковые в случае необходимости лечения включают меры, предпринимаемые уже при наличии расстройства, а также такие меры, которые призваны предотвратить расстройство. В частности, лечение может непосредственно предотвратить, замедлить или иным способом снизить патологические явления дегенерации или повреждения клеток, такие как патологические явления, связанные с опухолевыми клетками при лечении злокачественной опухоли, или может придать клеткам большую чувствительность к лечению под действием других терапевтических средств.
"Хроническое" введение относится к введению средства(средств) в непрерывном режиме, в отличие от кратковременного режима, с целью поддержания первоначального терапевтического эффекта (активности) в течение длительного периода. "Периодическое" введение представляет собой лечение, которое не является лечением, проводимым последовательно и без перерыва, а скорее является лечением, циклическим по природе.
В данном описании термин "опухоль" относится к любому неопластическому росту и пролиферации клеток, будь то злокачественные или доброкачественные опухоли, а также ко всем предраковым и злокачественным клеткам и тканям.
Термины "рак" и "злокачественный" описывают или относятся к физиологическому состоянию у млекопитающих, которое обычно характеризуется нерегулируемым ростом клеток. Примеры рака включают, не ограничиваясь перечисленным, карциному, лимфому, бластому, саркому и лейкемию. Более конкретные примеры таких злокачественных состояний включают плоскоклеточный рак, рак легкого (включая мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого и плоскоклеточную карциному легкого), рак брюшины, гепатоцеллюлярный рак, гастральный рак или рак желудка (включая желудочно-кишечный рак), рак поджелудочной железы, глиобластому, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишки, колоректальный рак, карциному эндометрия или матки, карциному слюнной железы, почечный или ренальный рак, рак печени, рак предстательной железы, рак наружных женских половых органов, рак щитовидной железы, карциному печени и разные типы рака головы и шеи, а также B-клеточную лимфому (включая низкодифференцированную/ /фолликулярную неходжкинскую лимфому (NHL); мелкоклеточную лимфоцитарную (SL) NHL; среднедифференцированную/фолликулярную NHL; среднедифференцированную диффузную NHL; высокодифференцированную иммунобластную NHL; высокодифференцированную лимфобластную NHL; высокодифференцированную мелкоклеточную NHL с нерассеченными ядрами; массивное поражение при лимфогранулематозе; лимфому клеток мантийной ткани; СПИД-связанную лимфому; и макроглобулинемию Вальденстрема); хроническую лимфоцитарную лейкемию (CLL); острый лимфобластный лейкоз (ALL); волосатоклеточную лейкемию; хронический миелобластный лейкоз; и посттрансплантационный лимфопролиферативный синдром (PTLD), а также аномальную васкулярную пролиферацию, связанную с факоматозом, отек (например, связанный с опухолями мозга) и синдром Мейгса.
"Химиотерапевтическим средством" является химическое соединение, используемое при лечении злокачественной опухоли. В это определение включаются также противогормональные средства, которые действуют в качестве регуляторов или ингибиторов действия гормонов на опухоли, таких как антиэстрогены и селективные модуляторы эстрогенных рецепторов (SERM).
"Заболеванием внутриглазной неоваскуляризации" является заболевание, характеризующееся неоваскуляризацией глаза. Примеры заболеваний внутриглазной неоваскуляризации включают, не ограничиваясь перечисленным, пролиферативные ретинопатии, включая пролиферативную диабетическую ретинопатию, хороидальную неоваскуляризацию (CNV), возрастную дегенерацию желтого пятна (AMD), диабетическую и другие связанные с ишемией ретинопатии, диабетический отек зоны желтого пятна (DME), патологическую миопию, болезнь Гиппеля-Линдау, гистоплазмоз глаза, окклюзию центральных вен сетчатки (CRVO), разветвленную окклюзию центральных вен сетчатки (BRVO), неоваскуляризацию роговицы, неоваскуляризацию сетчатки, ретинопатию недоношенных (ROP), субконъюнктивальное кровоизлияние, гипертензивную ретинопатию и т.д.
"Патология" заболевания включает все явления, которые нарушают хорошее самочувствие пациента. В случае злокачественных опухолей это включает, не ограничиваясь перечисленным, аномальный или неконтролируемый рост клеток, метастазы, помехи нормальному функционированию близлежащих клеток, аномальные уровни высвобождения цитокинов или других продуктов секреции, супрессию или обострение воспалительного или иммунологического ответа и т.д.
Введение "в сочетании с" одним или более дополнительными терапевтическими средствами включает одновременное (совместное) и последовательное введение в любом порядке.
Используемые в данном описании "носители" включают фармацевтически приемлемые носители, наполнители или стабилизаторы, которые являются нетоксичными для клетки или млекопитающего, подвергающегося их действию в используемых дозах и концентрациях. Часто физиологически приемлемый носитель является забуференным водным раствором. Примеры физиологически приемлемых носителей включают буферы, такие как фосфатный, цитратный и буферы других органических кислот; антиоксиданты, включая аскорбиновую кислоту; низкомолекулярные (имеющие приблизительно менее чем 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатобразующие агенты, такие как ЭДТА; сахарные спирты, такие как маннит или сорбит; солеобразующие противоионы, такие как натрий; и/или неионные поверхностно-активные соединения, такие как TWEENTM, полиэтиленгликоль (ПЭГ) и PLURONICSTM.
В данном описании "низкомолекулярная молекула" определяется как молекула, имеющая молекулярную массу приблизительно менее чем в 500 Дальтон.
Способы реализации настоящего изобретения
EGFL8
Ген Egfl8 человека кодирует секретируемый белок ~32 кДа, который является эволюционно консервативным. Аминокислотная последовательность человека (Homo sapiens) (SEQ ID NO:1) имеет приблизительно 80% гомологию с последовательностью мыши (Mus musculus; SEQ ID NO:2). Номерами доступа для полипептидов EGFL8 являются следующие: NM_030652 (Homo sapiens), NM_152922 (Mus musculus).
Получение и идентификация антагонистов активности EGFL8
Были разработаны скрининг-анализы антагонистических средств-кандидатов для идентификации соединений, которые связываются с полипептидами EGFL8 или образуют с ними комплекс или иным способом мешают взаимодействию EGFL8 с другими клеточными белками.
Низкомолекулярные молекулы способны действовать в качестве антагонистов EGFL8 и, таким образом, быть терапевтически эффективными. Такие низкомолекулярные молекулы могут включать низкомолекулярные молекулы, образующиеся природным путем, искусственные органические или неорганические соединения и пептиды. Однако в настоящем изобретении низкомолекулярные молекулы не ограничены указанными формами. Обширные библиотеки низкомолекулярных молекул являются коммерчески доступными, и в данной области хорошо известно множество анализов, предназначенных для скрининга указанных молекул на предмет обнаружения требуемой активности.
В некоторых вариантах осуществления низкомолекулярные молекулы-антагонисты EGFL8 идентифицируют по их способности ингибировать одну или более биологических активностей EGFL8. Таким образом, соединение-кандидат приводят в контакт с EGFL8. Затем определяют биологическую активность EGFL8. В одном из вариантов осуществления определяют способность EGFL8 поддерживать адгезию и миграцию эндотелиальных клеток. Соединение идентифицируют в качестве антагониста, если происходит ингибирование биологической активности EGFL8.
Соединения, идентифицируемые в качестве антагонистов EGFL8, могут быть использованы в способах по изобретению. Например, антагонисты EGFL8 могут быть использованы для лечения злокачественных опухолей.
В случае злокачественных опухолей могут быть использованы различные хорошо известные животные модели для более полного понимания роли EGFL8 в развитии и патогенезе опухолей, а также для проверки эффективности терапевтических средств-кандидатов, включая антитела и другие антагонисты нативных полипептидов EGFL8, такие как низкомолекулярные молекулы-антагонисты. Природа in vivo таких моделей делает их особенно предсказательными в отношении ответов у пациента-человека. Животные модели опухолей и злокачественных опухолей (например, рака молочной железы, рака толстой кишки, рака предстательной железы, рака легкого и т.д.) включают как нерекомбинантных, так и рекомбинантных (трансгенных) животных. Нерекомбинантные животные модели включают, например, грызунов, например, модели мыши. Такие модели могут быть разработаны путем введения опухолевых клеток в организм сингенной мыши с использованием стандартных технологий, например, путем подкожной инъекции, инъекции в хвостовую вену, имплантации селезенки, внутрибрюшинной имплантации, имплантации под почечную капсулу или ортотопической имплантации, например, когда клетки злокачественной опухоли толстой кишки имплантируют в ткань толстого кишечника. См., например, публикацию PCT No. WO 97/33551, опубликованную 18 сентября 1997. Вероятно, наиболее часто используемым видом животных в онкологических исследованиях являются иммунодефицитные мыши и, в частности, “голые” мыши. То наблюдение, что “голые” мыши с гипо/аплазией тимуса могут успешно выступать в качестве хозяина для ксенотрансплантатов опухоли человека, привело к их широкомасштабному использованию для этих целей. Аутосомно-рецессивный ген nu вводили в очень большое количество различных конгенных штаммов “голых” мышей, включая, например, ASW, A/He, AKR, BALB/c, B10.LP, C17, C3H, C57BL, C57, CBA, DBA, DDD, I/st, NC, NFR, NFS, NFS/N, NZB, NZC, NZW, P, RIII и SJL. Кроме того, было разработано множество других разнообразных животных, отличных от “голых” мышей, с наследственными иммунологическими дефектами, и эти животные были использованы в качестве реципиентов опухолевых трансплантатов. Для ознакомления с дальнейшими подробностями см., например, The Nude Mouse in Oncology Research, E. Boven and B. Winograd, eds. (CRC Press, Inc., 1991).
Клетки, вводимые в организм таких животных, могут быть клеточными линиями, полученными из известных опухолей/злокачественных опухолей, таких как любая из перечисленных выше линий опухолевых клеток, и, например, клеточная линия B104-1-1 (стабильная линия клеток NIH-3T3, трансфицированных протоонкогеном neu); ras-трансфицированные клетки NIH-3T3; Caco-2 (ATCC® HTB-37); или умеренно дифференцированная линия клеток II аденокарциномы толстого кишечника человека, HT-29 (ATCC® HTB-38); или клеточные линии из опухолей и злокачественных опухолей. Образцы опухолей или злокачественных опухолей могут быть получены из организма пациентов, подвергаемых хирургическому вмешательству, с использованием стандартных условий, включая замораживание и хранение в жидком азоте. Karmali et al., Br. J. Cancer 48: 689-696 (1983).
Опухолевые клетки могут быть введены в организм животных, таких как “голые” мыши или EGFL8-нокаутные мыши, различными способами. Подкожное (п/к) пространство у мышей является весьма подходящим для опухолевой трансплантации. Опухоли могут быть трансплантированы п/к в виде солидных блоков, в виде пункционной биопсии с использованием троакара или в виде клеточных суспензий. В случае солидных блоков или имплантации троакара фрагменты опухолевой ткани подходящего размера вводят в подкожное пространство. Клеточные суспензии, являющиеся свежеприготовленными из первичных опухолей или являющиеся стабильными линиями опухолевых клеток, инъецируют подкожно. Опухолевые клетки могут быть также инъецированы в виде подкожных имплантатов. При такой локализации инокулят откладывается между нижней частью кожной соединительной ткани и подкожной тканью.
Животные модели рака молочной железы могут быть разработаны, например, путем имплантации клеток нейробластомы крысы (из которых первоначально был выделен онкоген neu) или neu-трансфицированных клеток NIH-3T3 в организм “голых” мышей, в основном так, как описано Drebin et al. Proc. Nat. Acad. Sci. USA 83: 9129-9133 (1986).
Аналогично, животные модели рака толстой кишки могут быть разработаны путем перепрививания клеток злокачественной опухоли толстой кишки животным, например, “голым” мышам, что приводит к возникновению опухолей у этих животных. Модель ортотопического трансплантата рака толстой кишки человека у “голых” мышей была описана, например, Wang et al., Cancer Research 54: 4726-4728 (1994) и Too et al., Cancer Research 55: 681-684 (1995). Указанная модель основана на так называемой "METAMOUSE®", продаваемой компанией Anticancer, Inc., (San Diego, California).
Опухоли, которые растут у животных, могут быть извлечены и культивированы in vitro. Затем клетки из указанных культур in vitro можно переносить животным. Такие опухоли могут служить в качестве мишеней для дальнейшего тестирования или скрининга лекарственных средств. Альтернативно, опухоли, образующиеся в результате пассажей (перепрививания), можно изолировать, и затем РНК, полученную из клеток, взятых до пассажей, и из клеток, выделенных после одного или более циклов пассирования, подвергнуть анализу на предмет определения уровней экспрессии представляющих интерес генов. Технологии такого пассирования (перепрививания) могут быть использованы в отношении любых известных опухолей или линий злокачественных клеток.
Например, Meth A, CMS4, CMS5, CMS21 и WEHI-164 представляют собой индуцированные саркомы самок мышей BALB/c (DeLeo et al., J. Exp. Med. 146:720 (1977)), обеспечивающие высококонтролируемую модельную систему для изучения противоопухолевой активности различных агентов. Palladino et al., J. Immunol. 138:4023-4032 (1987). Вкратце, опухолевые клетки размножали in vitro в клеточной культуре. Перед инъецированием в организм животных указанные линии клеток отмывали и суспендировали в буфере, при плотности клеток, приблизительно составляющей от 10×106 до 10×107 клеток/мл. Затем животных подкожно инфицировали 10-100 мкл указанной клеточной суспензии, и в течение одной-трех недель наблюдали за ними в ожидании появления опухоли.
Кроме того, карцинома легких Льюиса у мышей, которая является одной из наиболее полно изученных опухолей, может быть использована в качестве исследовательской опухолевой модели. Эффективность, достигаемая на указанной опухолевой модели, коррелировала с положительными эффектами при лечении пациентов-людей, у которых диагностирован мелкоклеточный рак легких (SCCL). Указанную опухоль можно ввести в организм нормальных мышей путем инъецирования фрагментов опухоли от пораженных мышей или клеток, стабилизированных в культуре. Zupi et al., Br. J. Cancer 41: suppl. 4, 30 (1980). Имеются указания на то, что опухоли могут развиться даже в результате инъецирования одной клетки и что очень большой процент инфицированных опухолевых клеток выживает. Для получения дополнительной информации в связи с указанной опухолевой моделью см. Zacharski, Haemostasis 16:300-320 (1986).
Одним из путей оценки эффективности тестируемого соединения на животной модели с имплантированной опухолью является измерение размера опухоли до и после лечения. Обычно размер имплантированных опухолей измеряют штангенциркулем в двух или трех измерениях (направлениях). Измерение, ограниченное измерениями в двух направлениях, недостаточно точно отражает размер опухоли; поэтому его обычно преобразуют в соответствующий объем, используя математическую формулу. Однако измерение объема опухоли является весьма приблизительным. Терапевтические эффекты лекарственного средства-кандидата могут быть лучше описаны в терминах задержки роста, вызванной лечением, и специфической задержки роста. Другим важным параметром при описании роста опухоли является время удвоения объема опухоли. Компьютерные программы для расчета и описания роста опухолей также доступны, например, программа, опубликованная Rygaard and Spang-Thomsen, Proc. 6th Int. Workshop on Immune-Deficient Animals, Wu and Sheng eds. (Basel, 1989), p. 301. Указано, однако, что реакции некроза и воспаления, сопровождающие лечение, могут на самом деле привести к увеличению размера опухоли, во всяком случае, на начальных этапах. Следовательно, необходимо производить тщательный мониторинг указанных изменений, используя сочетание морфометрического метода и метода анализа проточной цитометрии.
Эффективность идентифицированных в данном описании антител, связывающихся с EGFL8, и других лекарственных средств-кандидатов может быть тестирована также и при лечении спонтанных опухолей у животных. Подходящей мишенью для таких исследований является кошачья оральная плоскоклеточная карцинома (SCC). Кошачья оральная SCC является высокоинвазивной злокачественной опухолью, которая представляет собой наиболее частое оральное злокачественное поражение у кошек, насчитывающее, согласно публикациям, свыше 60% оральных опухолей у данного вида. Оно редко метастазирует в отдаленные области, хотя указанная низкая встречаемость может быть скорее результатом коротких сроков выживаемости кошек с такой опухолью. Такие опухоли обычно не поддаются хирургическому лечению, прежде всего в силу анатомических особенностей ротовой полости у кошек. В настоящее время для этих опухолей не существует эффективного лечения. Перед включением в программу исследования каждую кошку подвергают полному клиническому обследованию и биопсии, и сканированию с использованием метода компьютерной томографии (КТ). Кошек, у которых диагностировали сублингвальные оральные плоскоклеточные опухоли, исключали из программы исследований. В результате такой опухоли язык может парализовать, и тогда, даже если лечение приведет к уничтожению опухоли, животные утрачивают способность самостоятельно питаться. Каждую кошку обрабатывали многократно в течение длительного периода. Опухоли ежедневно фотографировали в течение всего периода лечения и при каждой последующей контрольной проверке. После лечения каждую кошку подвергали еще одному сканированию методом КТ. В дальнейшем КТ-срезы и торакальные радиограммы оценивали каждые 8 недель. Полученные данные оценивали в плане различий на уровне выживаемости, ответа и токсичности по сравнению с контрольными группами. Положительный ответ может служить признаком опухолевой регрессии, предпочтительно с улучшением качества жизни и/или с увеличением продолжительности жизни.
Кроме того, можно тестировать также и другие спонтанные опухоли животных, такие как фибросаркома, аденокарцинома, лимфома, хондрома или лейомиосаркома собак, кошек и бабуинов. Из указанных опухолей аденокарцинома молочной железы у собак и кошек является предпочтительной моделью, поскольку признаки и поведение указанной опухоли весьма схожи с таковыми у человека. Однако применение указанной модели ограничено низкой частотой возникновения такого типа опухоли у животных.
В данном описании применимы также и другие сердечно-сосудистые, эндотелиальные и ангиогенные тесты in vitro и in vivo, известные в данной области.
Изучение связывания антитела
Тестировали способность антител против EGFL8 ингибировать эффект EGFL8 в отношении эндотелиальных клеток или других клеток, используемых в сердечно-сосудистых, эндотелиальных и ангиогенных анализах. Примеры антител включают моноклональные, гуманизированные, биспецифические и «гетероконъюгатные» антитела, получение которых описано в настоящей заявке.
Изучение связывания антител может быть выполнено с помощью любого из известных способов анализа, таких как анализы конкурентного связывания, прямой и непрямой сэндвич-анализы и анализы иммунопреципитации. Zola, Monoclonal Antibodies: A Manual of Techniques (CRC Press, Inc., 1987), pp.147-158.
Анализы конкурентного связывания основаны на способности меченого стандарта конкурировать с тестируемым образцом анализируемого материала за связывание с ограниченным количеством антитела. Количество белка-мишени в тестируемом образце обратно пропорционально количеству стандарта, который оказывается связанным с антителами. Чтобы облегчить определение количества стандарта, который оказывается связанным, предпочтительно, чтобы антитела до или после анализа конкурентного связывания были переведены в нерастворимую форму, с тем, чтобы стандарт и анализируемый материал, которые связались с антителами, легко было отделить от стандарта и анализируемого материала, оставшихся не связанными.
Сэндвич-анализы включают использование двух антител, каждое из которых способно связываться только с одним из разных иммуногенных участков, или эпитопов, детектируемого белка. В сэндвич-анализе тестируемый образец анализируемого материала связывается с первым антителом, которое иммобилизовано на твердой подложке, а затем второе антитело связывается с анализируемым материалом, образуя, таким образом, нерастворимый трехкомпонентный комплекс. См., например, патент США No. 4376110. Второе антитело как таковое можно пометить детектируемой меткой (прямой сэндвич-анализ), или же оно может быть количественно определено с помощью анти-иммуноглобулинового антитела, которое метят детектируемой меткой (непрямой сэндвич-анализ). Например, одним из типов сэндвич-анализа является метод ELISA, при котором детектируемой меткой является фермент.
В случае иммуногистохимического анализа образец ткани может быть свежим или замороженным, или же он может быть погружен в парафин и зафиксирован консервантом, таким, например, как формалин.
Композиции, используемые для лечения сердечно-сосудистых, эндотелиальных и ангиогенных заболеваний, включают, не ограничиваясь перечисленным, антитела, низкомолекулярные органические и неорганические молекулы, пептиды, фосфопептиды, антисмысловые siРНК и молекулы рибозимов, трехспиральные молекулы и т.д., которые ингибируют экспрессию и/или активность продукта гена-мишени.
Более специфические примеры вероятных антагонистов включают олигонуклеотид, который связывается с EGFL8, и, в частности, антитела, включающие, не ограничиваясь перечисленным, поли- и моноклональные антитела и фрагменты антител, одноцепочечные антитела, антиидиотипические антитела и химерные или гуманизированные версии таких антител или их фрагментов, а также антитела человека и фрагменты антител человека. Альтернативно, вероятным антагонистом может быть близкородственный белок, например, мутантная форма EGFL8, которая распознает рецептор, но не вызывает никакого эффекта, конкурентно ингибируя, таким образом, действие EGFL8.
Другим вероятным антагонистом EGFL8 является антисмысловая РНК- или ДНК-конструкция, полученная с помощью антисмысловой технологии, где, например, молекула антисмысловой РНК или ДНК действует, напрямую блокируя трансляцию мРНК путем гибридизации с мРНК-мишенью и предотвращая трансляцию белка. Антисмысловая технология может быть использована для контроля экспрессии гена посредством образования тройной спирали или с помощью антисмысловой ДНК или РНК, причем оба этих способа основаны на связывании полинуклеотида с ДНК или РНК. Например, 5'-кодирующая часть полинуклеотидной последовательности, которая, по настоящему описанию, кодирует зрелые полипептиды EGFL8, используется для создания антисмыслового олигонуклеотида РНК, насчитывающего в длину приблизительно от 10 до 40 пар оснований. Олигонуклеотид ДНК создается таким образом, чтобы быть комплементарным области гена, участвующего в транскрипции (тройная спираль - см., Lee et al., Nucl. Acids Res. 6:3073 (1979); Cooney et al., Science 241:456 (1988); Dervan et al., Science 251:1360 (1991)), и чтобы таким образом предотвратить транскрипцию и продуцирование EGFL8. В данном описании последовательность, "комплементарная" части РНК, означает последовательность, способную к гибридизации с указанной РНК, с образованием стабильного дуплекса; таким образом, в случае двухцепочечных антисмысловых нуклеиновых кислот можно тестировать одну цепь дуплекса ДНК или можно провести анализ образования тройной спирали. Способность к гибридизации будет зависеть как от степени комплементарности, так и от длины антисмысловой нуклеиновой кислоты. Обычно чем длиннее гибридизующаяся нуклеиновая кислота, тем больше она может содержать ошибочно спариваемых с РНК оснований, все еще образуя стабильный дуплекс (или, соответственно, триплекс, в зависимости от конкретного случая). Специалист в данной области может установить степень толерантности ошибочного спаривания с использованием стандартных процедур для определения точки плавления гибридизованного комплекса. Антисмысловой олигонуклеотид РНК гибридизуется с мРНК in vivo и блокирует трансляцию молекулы мРНК в EGFL8 (см. Okano, Neurochem. 56:560 (1991); Oligodeoxynucleotides as Antisense Inhibitors of Gene Expression (CRC Press: Boca Raton, FL, 1988).
Антисмысловыми олигонуклеотидами могут быть ДНК или РНК, или химерные смеси, или производные, или их модифицированные версии, одноцепочечные или двухцепочечные. Указанные олигонуклеотиды могут быть модифицированы в области основания, в области сахара или по фосфатному остову, например, для улучшения стабильности молекулы, ее гибридизации и т.д. Указанный олигонуклеотид может включать другие присоединенные группы, такие как пептиды (например, для нацеливания на рецепторы хозяйских клеток in vivo), или агенты, облегчающие транспорт через клеточную мембрану (см., например, Letsinger, et al., Proc. Natl. Acad. Sci. U.S.A. 86: 6553-6556 (1989); Lemaitre, et al., Proc. Natl. Acad. Sci. U.S.A. 84:648-652 (1987); публикацию PCT No. WO 88/09810, опубликованную 15 декабря 1988), или гематоэнцефалический барьер (см., например, публикацию PCT No. WO 89/10134, опубликованную 25 апреля 1988), активируемые гибридизацией расщепляющие агенты (см., например, Krol et al., BioTechniques 6: 958-976 (1988)) или интеркалирующие агенты (см., например, Zon, Pharm. Res. 5: 539-549 (1988)). С этой целью олигонуклеотид может быть конъюгирован с другой молекулой, например, с пептидом, с активируемым гибридизацией поперечно-сшивающим агентом, с агентом-переносчиком, с активируемым гибридизацией расщепляющим агентом и т.д.
Антисмысловой олигонуклеотид может содержать по меньшей мере один фрагмент модифицированного основания, который выбран из группы, включающей, но не ограниченной, 5-фторурацилом, 5- бромурацилом, 5-хлорурацилом, 5-йодоурацилом, гипоксантином, ксантином, 4-ацетилцитозином, 5-(карбоксигидроксиметил)урацилом, 5-карбоксиметиламинометил-2-тиоуридином, 5-карбоксиметиламинометилурацилом, дигидроурацилом, бета-D-галактозилквеозином, инозином, N6-изопентениладенином, 1-метилгуанином, 1-метилинозином, 2,2-диметилгуанином, 2-метиладенином, 2-метилгуанином, 3-метилцитозином, 5- метилцитозином, N6-аденином, 7-метилгуанином, 5-метиламинометилурацилом, 5-метоксиаминометил-2-тиоурацилом, бета-D-маннозилквеозином, 5'-метоксикарбоксиметилурацилом, 5-метоксиурацилом, 2-метилтио-N6-изопентениладенином, урацил-5- оксиуксусной кислотой (v), вибутоксозином, псевдоурацилом, квеозином, 2-тиоцитозином, 5-метил-2-тиоурацилом, 2-тиоурацилом, 4-тиоурацилом, 5-метилурацилом, метиловым эфиром урацил-5-оксиуксусной кислоты, урацил-5-оксиуксусной кислотой (v), 5-метил-2-тиоурацилом, 3-(3-амино-3-N-2-карбоксипропил)-урацилом, (acp3)w и 2,6-диаминопурином.
Антисмысловой олигонуклеотид может также включать по меньшей мере один модифицированный фрагмент сахара, выбранный из группы, включающей, но не ограниченной арабинозой, 2-фторарабинозой, ксилозой и гексозой.
В еще одном из вариантов осуществления антисмысловой олигонуклеотид содержит по меньшей мере один модифицированный фосфатный остов, выбранный из группы, состоящей из фосфоротиоата, фосфородитиоата, фосфорамидотиоата, фосфорамидата, фосфордиамидата, метилфосфоната, сложного алкил-фосфотриэфира и формацеталя или их аналога.
В еще одном из вариантов осуществления антисмысловой олигонуклеотид является аномерным олигонуклеотидом. Аномерный олигонуклеотид образует специфические двухцепочечные гибриды с комплементарной РНК, в которой, в отличие от обычной, цепи идут параллельно друг другу (Gautier, et al., Nucl. Acids Res. 15: 6625-6641 (1987)). Указанный олигонуклеотид является 2'-O-метилрибонуклеотидом (Inoue, et al., Nucl. Acids Res. 15: 6131-6148 (1987)) или химерным РНК-ДНК-аналогом (Inoue, et al., FEBS Lett. 215: 327-330 (1987)).
В некоторых вариантах осуществления антагонисты являются ингибирующими дуплексами РНК, например, siРНК, shРНК и т.д.
Олигонуклеотиды по изобретению могут быть синтезированы стандартными методами, известными в данной области, например, с помощью автоматизированного ДНК-синтезатора (такого, какие являются коммерчески доступными в компании Biosearch, Applied Biosystems, etc.). В качестве примеров, фосфоротиоатные олигонуклеотиды могут быть синтезированы согласно методу Stein, et al. (Nucl. Acids Res. 16: 3209 (1988)), метилфосфонатные олигонуклеотиды могут быть получены с использованием контролируемых полимерных носителей из пористого стекла (Sarin, et al., Proc. Natl. Acad. Sci. U.S.A. 85: 7448-7451 (1988)), и т.д.
Олигонуклеотиды, описанные выше, могут быть также доставлены к клеткам, с тем, чтобы антисмысловую РНК или ДНК можно было экспрессировать in vivo для ингибирования продукции EGFL8. Когда используют антисмысловую ДНК, предпочтительны олигодезоксирибонуклеотиды, полученные из сайта инициации трансляции, например, приблизительно между -10 и +10 положениями нуклеотидной последовательности гена-мишени.
Вероятные антагонисты дополнительно включают низкомолекулярные молекулы, которые связываются с EGFL8, таким образом блокируя их активность. Примеры низкомолекулярных молекул включают, но ими не ограничиваются, низкомолекулярные пептиды или пептидоподобные молекулы, предпочтительно, растворимые пептиды и синтетические непептидильные или неорганические соединения.
Дополнительными вероятными антагонистами являются рибозимы, которые являются ферментативными молекулами РНК, способными катализировать специфическое расщепление РНК. Рибозимы действуют путем последовательность-специфической гибридизации с комплементарной РНК-мишенью, с последующим эндонуклеолитическим расщеплением. Специфические сайты расщепления рибозимами внутри вероятной РНК-мишени могут быть идентифицированы с помощью известных технологий. Подробнее см., например, Rossi, Current Biology 4: 469-471 (1994), и публикацию PCT No. WO 97/33551 (опубликованную 18 сентября 1997).
Когда для разрушения молекул мРНК могут быть использованы рибозимы, которые расщепляют мРНК на участке специфического распознавания последовательности, предпочтительно использование «рибозимов-молотков». Рибозимы-молотки расщепляют мРНК в местах локализации, которые диктуются фланкирующими областями, образующими комплементарную пару оснований с мРНК-мишенью. Единственным требованием является то, чтобы мРНК-мишень имела следующую последовательность двух оснований: 5'-UG-3'. Конструирование и продуцирование рибозимов-молотков хорошо известно в данной области и более полно описано в публикациях Myers, Molecular Biology and Biotechnology: A Comprehensive Desk Reference, VCH Publishers, New York (1995), (см., в частности, фигуру 4 на странице 833) и Haseloff and Gerlach, Nature, 334: 585-591 (1988), которые в полном объеме включены в настоящее описание в виде ссылок.
Рибозимы предпочтительно создаются генно-инженерным путем, таким образом, что участок распознавания для расщепления расположен рядом с 5'-концом мРНК гена-мишени, т.е. для повышения эффективности и для минимизации внутриклеточного накопления нефункциональных мРНК-транскриптов.
Рибозимы по изобретению включают также РНК-эндорибонуклеазы (в данном описании и далее рибозимы типа рибозимов Чека, "Cech-type ribozymes"), такие как рибозим, который встречается в природе у Tetrahymena thermophila (известный как IVS, или РНК L-19 IVS) и который был подробно описан Thomas Cech и сотрудниками (Zaug, et al., Science, 224: 574-578 (1984); Zaug and Cech, Science, 231: 470-475 (1986); Zaug, et al., Nature, 324: 429-433 (1986); опубликованная международная патентная заявка No. WO 88/04300 в University Patents Inc.; Been and Cech, Cell, 47:207-216 (1986)). Рибозимы типа рибозимов Чека имеют активный участок из восьми пар оснований, который гибридизуется с последовательностью РНК-мишени, после чего происходит расщепление РНК-мишени. Настоящее изобретение охватывает те рибозимы типа рибозимов Чека, которые нацелены на последовательности активных участков из восьми пар оснований, присутствующие в гене-мишени.
Как и в способе, связанном с антисмысловым подходом, рибозимы могут быть составлены из модифицированных олигонуклеотидов (например, для улучшения устойчивости, нацеленности и т.д.), и их следует доставлять в клетки, в которых ген-мишень экспрессируется in vivo. Предпочтительный способ доставки включает использование ДНК-конструкции, "кодирующей" рибозим под контролем сильного конститутивного промотора pol III или pol II, таким образом, чтобы трансфицируемые клетки продуцировали достаточные количества рибозима для разрушения транскриптов эндогенного гена-мишени и ингибирования трансляции. Поскольку рибозимы, в отличие от антисмысловых молекул, являются каталитическими молекулами, для эффективности их действия требуется более низкая внутриклеточная концентрация.
Молекулы нуклеиновой кислоты с трехспиральной структурой, используемые для ингибирования транскрипции, должны быть одноцепочечными и должны состоять из дезоксинуклеотидов. Состав нуклеотидов в таких олигонуклеотидах разрабатывают таким образом, чтобы он способствовал образованию трехспиральной структуры в соответствии с правилами спаривания оснований Хугстэна, согласно которым в основном требуется наличие пуриновых или пиримидиновых отрезков значительного размера на одной из цепей дуплекса. Дополнительные подробности см., например, в публикации PCT No. WO 97/33551, выше.
Другим вариантом применения антагонистов EGFL8 является профилактика опухолевого ангиогенеза, который включает васкуляризацию опухоли, обеспечивающую ее рост и/или метастазирование. Этот процесс зависит от роста новых кровеносных сосудов. Примеры новообразований и связанных с ними состояний, в которые вовлечен опухолевый ангиогенез, включают плоскоклеточный рак, рак легких (в том числе мелкоклеточный рак легких, немелкоклеточный рак легких, аденокарциному легких и плоскоклеточную карциному легких), рак брюшной полости, гепатоцеллюлярный рак, гастральный рак или рак желудка (в том числе рак желудочно-кишечного тракта), рак поджелудочной железы, глиобластому, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишки, рак прямой и ободочной кишки, карциному эндометрия или матки, карциному слюнных желез, рак почек или ренальный рак, рак печени, рак предстательной железы, рак вульвы, рак щитовидной железы, гепатокарциному и различные типы рака головы и шеи, а также B-клеточную лимфому (в том числе низкой степени злокачественности/фолликулярную неходжкинскую лимфому (NHL); NHL малых лимфоцитов (SL); промежуточной степени злокачественности/фолликулярную NHL; диффузную NHL промежуточной степени злокачественности; иммунобластную NHL высокой степени злокачественности; лимфобластную NHL высокой степени злокачественности; NHL мелких клеток с нерасщепленными ядрами высокой степени злокачественности; NHL с массивным поражением; лимфому из клеток мантийной зоны; связанную со СПИДом лимфому; а также макроглобулинемию Вальденстрема); хронический лимфолейкоз (CLL); острый лимфобластный лейкоз (ALL); волосатоклеточный лейкоз; хронический миелобластный лейкоз и посттрансплантационное лимфопролиферативное расстройство (PTLD), а также связанную с факоматозами патологическую пролиферацию сосудов, отек (такой как связанный с опухолями головного мозга) и синдром Мейгса.
Антагонисты EGFL8 могут быть эффективны также при лечении внутриглазных неоваскулярных заболеваний, включающих, но ими не ограничивающихся, пролиферативные ретинопатии, включая диабетическую пролиферативную ретинопатию, хориоидальную неоваскуляризацию (CNV), связанную с возрастом дегенерацию желтого пятна (AMD), диабетическую и другие связанные с ишемией ретинопатии, диабетический отек желтого пятна, патологическую миопию, болезнь Гиппеля-Линдау, гистоплазмоз глаза, окклюзию центральной вены сетчатки (CRVO), разветвленную окклюзию центральной вены сетчатки (BRVO), неоваскуляризацию роговицы, неоваскуляризацию сетчатки, ретинопатию недоношенных (ROP), субконъюнктивальное кровоизлияние, гипертензивную ретинопатию и т.д.
Другим показанием является ревматоидный артрит. Процесс роста кровеносных сосудов и нацеливания провоспалительных клеток через сосудистую систему является важным компонентом в патогенезе ревматоидной и серонегативной форм артрита.
В свете указанного выше, описанные в данном описании антагонисты EGFL8, для которых показано, что они либо влияют на функцию и миграцию эндотелиальных клеток, либо изменяют их, вероятно, играют важную роль в этиологии и патогенезе многих или всех указанных выше нарушений и как таковые могут служить в качестве терапевтических мишеней для ингибирования этих процессов или для связанного с сосудами нацеливания лекарственного средства при указанных нарушениях.
Протоколы, схемы, дозы и композиции для введения
Антагонисты EGFL8 фармацевтически эффективны в качестве профилактического и терапевтического средства для различных нарушений и заболеваний, как указано выше.
Терапевтические композиции антагонистов EGFL8 получают для хранения в виде лиофилизированных препаратов или водных растворов путем смешивания желаемой молекулы, имеющей соответствующую степень чистоты, с необязательными фармацевтически приемлемыми носителями, наполнителями или стабилизаторами (Remington's Pharmaceutical Sciences, 16th edition, Osol, A. ed. (1980)). Приемлемые носители, наполнители или стабилизаторы в используемых дозах и концентрациях не токсичны для реципиентов и содержат буферы, такие как фосфатный, цитратный и относящиеся к другим органическим кислотам; антиоксиданты, в том числе аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония; хлорид бензетония; феноловый, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцин; циклогексанол; 3-пентанол и м-крезол); полипептиды с низкой молекулярной массой (приблизительно менее чем 10 остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, в том числе глюкозу, маннозу или декстрины; хелатобразующие средства, такие как ЭДТА; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, комплексы Zn-белок); и/или неионные поверхностно-активные вещества, такие как TWEENTM, PLURONICSTM или полиэтиленгликоль (ПЭГ).
Дополнительные примеры таких носителей включают ионообменники, оксид алюминия, стеарат алюминия, лецитин, белки сыворотки, такие как сывороточный альбумин человека, буферные вещества, такие как фосфаты, глицин, сорбиновая кислота, сорбат калия, неполные глицеридные смеси насыщенных растительных жирных кислот, воду, соли или электролиты, такие как протаминсульфат, двузамещенный фосфорнокислый натрий, однозамещенный фосфорнокислый калий, хлорид натрия, соли цинка, коллоидный оксид кремния, трисиликат магния, поливинилпирролидон, вещества на основе целлюлозы и полиэтиленгликоль. Носители для форм агониста или антагониста для местного применения или на основе геля включают полисахариды, такие как карбоксиметилцеллюлоза натрия или метилцеллюлоза, поливинилпирролидон, полиакрилаты, блок-полимеры полиоксиэтилен-полиоксипропилен, полиэтиленгликоль и древесные парафиновые спирты. Для всех способов введения используют обычные формы замедленного высвобождения. Такие формы включают, например, микрокапсулы, нанокапсулы, липосомы, пластыри, формы для ингаляции, спреи для носа, таблетки для подъязычного применения и препараты с замедленным высвобождением. Как правило, антагонисты EGFL8 смешивают с такими носителями в концентрации, приблизительно составляющей от 0,1 мг/мл до 100 мг/мл.
Другая композиция содержит антагонист EGFL8, включенный в состав формованных веществ. Такие вещества можно использовать в модуляции роста эндотелиальных клеток и ангиогенеза. Кроме того, с использованием этих веществ можно осуществлять регуляцию метастазирования и инвазии опухоли.
Антагонисты EGFL8, которые предназначены для введения in vivo, должны быть стерильны. Это легко осуществимо путем фильтрации через стерильные мембранные фильтры перед лиофилизацией и восстановлением или после них. Обычно в случае лиофилизированной формы антагонист EGFL8 составляют в композицию в сочетании с другими ингредиентами для восстановления соответствующим разбавителем в момент использования. Примером жидкой композиции антагониста EGFL8 является стерильный, прозрачный бесцветный неконсервированный раствор, которым заполняют ампулу для однократной дозы для подкожной инъекции. Приемлемые для многократного применения консервированные фармацевтические композиции могут содержать, например, в основном в зависимости от показания и типа полипептида,
антагонист EGFL8;
буфер, способный поддерживать pH в диапазоне максимальной стабильности полипептида или другой молекулы в растворе, предпочтительно, приблизительно от 4 до 8;
детергент/поверхностно-активное вещество прежде всего для придания полипептиду или молекуле устойчивости против вызываемой перемешиванием агрегации;
придающее изотоничность средство;
консервант, выбранный из группы фенола, бензилового спирта и галогенида бензетония, например, хлорида; и
воду.
В случае использования неионного детергента он может представлять собой, например, полисорбаты (например, POLYSORBATETM (TWEENTM) 20, 80 и т.д.) или полоксамеры (например, POLOXAMERTM 188). Использование неионных поверхностно-активных веществ позволяет подвергать препарат воздействию напряжений сдвига поверхности, не вызывая денатурацию полипептида. Кроме того, такие композиции, содержащие поверхностно-активное вещество, можно использовать в аэрозольных устройствах, таких как устройства-дозаторы, используемые для легочного введения и в безыгольных реактивных пистолетах для инъекции (см., например, EP 257956).
Придающее изотоничность средство может присутствовать для обеспечения изотоничности жидкой композиции антагониста EGFL8 и включает многоатомные сахарные спирты, предпочтительно, трехатомные сахарные спирты или сахарные спирты высшей атомности, такие как глицерин, эритрит, арабит, ксилит, сорбит и маннит. Эти сахарные спирты можно использовать по отдельности или в сочетании. Альтернативно, для придания растворам изотоничности можно использовать хлорид натрия или другие соответствующие неорганические соли.
Буфер может быть, например, ацетатным, цитратным, сукцинатным или фосфатным буфером, в зависимости от желаемого pH. Величина pH одного из типов жидких композиций по изобретению поддерживается буфером в диапазоне приблизительно от 4 до 8, предпочтительно, приблизительно на уровне физиологического значения pH.
Известными противомикробными средствами, которые могут быть использованы, являются консерванты фенол, бензиловый спирт и галогениды бензетония, например, хлорид.
Обычно описанные в данном описании терапевтические композиции полипептида помещают в контейнер со стерильным входным отверстием, например, в пакет или сосуд для внутривенного раствора, имеющий пробку, которая поддается прокалыванию иглой для подкожной инъекции. Предпочтительно композиции вводят в виде многократных внутривенных (в/в), подкожных (п/к) или внутримышечных (в/м) инъекций или в виде аэрозольных композиций, приемлемых для интраназальной или внутрилегочной доставки (для внутрилегочной доставки см., например, EP 257956).
Терапевтические полипептиды можно вводить также в виде лекарственных средств с замедленным высвобождением. Подходящие примеры лекарственных средств с замедленным высвобождением включают полупроницаемые матрицы из содержащих белок твердых гидрофобных полимеров, где указанные матрицы представлены в виде веществ с заданной формой, например, пленок или микрокапсул. Примеры матриц с замедленным высвобождением включают сложные полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат), как описано Langer et al., J. Biomed. Mater. Res. 15: 167-277 (1981) и Langer, Chem. Tech. 12: 98-105 (1982), или поли(виниловый спирт)), полилактиды (патент США 3773919, EP 58481), сополимеры L-глутаминовой кислоты и гамма-этил-L-глутамата (Sidman et al., Biopolymers 22: 547-556 (1983)), неразлагаемый ацетат этиленвинила (Langer et al., выше), разлагаемые сополимеры молочная кислота-гликолевая кислота, такие как Lupron DepotTM (инъецируемые микросферы, состоящие из сополимера молочная кислота-гликолевая кислота и ацетата лейпролида), а также поли-D-(-)-3-гидроксимасляную кислоту (EP 133988).
Тогда как такие полимеры как ацетат этиленвинила и молочная кислота-гликолевая кислота способны высвобождать молекулы в течение более 100 суток, некоторые гидрогели высвобождают белки в течение более коротких периодов. Если заключенные в капсулу белки остаются в организме в течение длительного времени, они могут денатурировать или агрегировать в результате воздействия влаги при 37°C, что приводит к утрате биологической активности и возможным изменениям в иммуногенности. В зависимости от имеющего место механизма, можно разрабатывать целесообразные способы для стабилизации белка. Например, если выявленный механизм агрегации связан с образованием внутримолекулярных S-S-связей в результате тиодисульфидного обмена, можно достичь стабилизации путем модификации сульфгидрильных остатков, лиофилизации из кислых растворов, контролирования содержания влаги, использования соответствующих добавок и разработки специфических композиций полимерных матриц.
Композиции антагониста EGFL8 с замедленным высвобождением включают также заключенные в липосомы антагонисты. Такие липосомы получают способами, которые сами по себе известны: DE 3218121; Epstein et al., Proc. Natl. Acad. Sci. USA 82: 3688-3692 (1985); Hwang et al, Proc. Natl. Acad. Sci. USA 77: 4030-4034 (1980); EP 52322; EP 36676; EP 88046; EP 143949; EP 142641; патентная заявка Японии 83-118008; патенты США 4485045 и 4544545; а также EP 102324. Обычно липосомы представляют собой мелкие частицы (приблизительно в 200-800 ангстрем) однослойного типа, в которых содержание липидов приблизительно составляет более 30 молярных % холестерина, где выбираемое соотношение приводят в соответствие для оптимальной терапии.
Безусловно, терапевтически эффективная доза антагониста EGFL8 будет изменяться, в зависимости от таких факторов как подлежащее лечению (включая профилактику) патологическое состояние, способ введения, тип используемого для лечения соединения, любая используемая сочетанная терапия, возраст пациента, его вес, общее состояние здоровья, история болезни и т.д., и определение этой дозы полностью входит в рамки компетенции практикующего врача. Соответственно, лечащему врачу необходимо будет титровать дозу и подбирать способ введения, в зависимости от потребностей, чтобы достичь максимального терапевтического эффекта.
Согласно указанным выше рекомендациям, обычно эффективная доза заключена в диапазоне приблизительно от 0,001 примерно до 1,0 мг/кг, более предпочтительно, примерно от 0,01 до 1,0 мг/кг, наиболее предпочтительно, приблизительно от 0,01 до 0,1 мг/кг.
Путь введения антагониста EGFL8 соответствует известным в данной области способам, например, введение путем инъекции или инфузии посредством внутривенного, внутримышечного, внутримозгового, внутрибрюшинного, внутриспинномозгового, подкожного, внутриглазного, внутрисуставного, внутрисиновиального, интратекального, перорального, местного способов введения или введения путем ингаляции, или введения с помощью систем с замедленным высвобождением, как указано ниже. Приемлемыми способами введения антагонистов EGFL8 являются также внутриопухолевое введение, введение вокруг опухоли, введение внутрь поврежденной области или вокруг поврежденной области с целью оказания местных, а также системных терапевтических эффектов. Внутрибрюшинный путь введения считается особенно эффективным, например, при лечении опухолей яичника.
Если в качестве антагониста используют пептид или низкомолекулярную молекулу, то их предпочтительно вводить млекопитающим пероральным или непероральным путем в виде жидкости или твердого вещества.
Примеры фармакологически приемлемых солей молекул, которые образуют соли и могут быть использованы в настоящем изобретении, включают соли щелочных металлов (например, соль натрия, соль калия), соли щелочноземельных металлов (например, соль кальция, соль магния), соли аммония, соли органических оснований (например, соль пиридина, соль триэтиламина), соли неорганических кислот (например, гидрохлорид, сульфат, нитрат) и соли органических кислот (например, ацетат, оксалат, пара-толуолсульфонат).
Комбинированная терапия
Эффективность антагониста EGFL8 в профилактике или лечении рассматриваемого нарушения может быть повышена путем периодического введения активного средства или его введения в сочетании с другим эффективным для указанных целей средством либо в составе одной и той же композиции, либо в виде отдельных композиций.
Например, антагонисты EGFL8, используемые для лечения связанных с ангиогенезом состояний, таких как злокачественная опухоль или глазные заболевания, можно комбинировать с цитотоксическими, химиотерапевтическими или противоангиогенными средствами, как указано выше. Антагонисты EGFL8 желательно использовать в сочетании с другим противоангиогенным средством. В некоторых вариантах осуществления антагонист EGFL8 используют в сочетании с антагонистом VEGF, например, с антителом, например, бевацизумабом. В некоторых вариантах осуществления антагонист EGFL8 используют в сочетании с антагонистом EGFL7.
Эффективные количества терапевтических средств, вводимых в сочетании с антагонистом EGFL8, остаются на усмотрение лечащего врача или ветеринара. Подбор и корректировку вводимых дозировок осуществляют для обеспечения максимально эффективного контролирования подлежащих лечению состояний. Например, при лечении гипертонии в идеале при подборе этих количеств следует учитывать использование диуретиков или препаратов наперстянки, а также такие состояния как гипер- или гипотонию, почечную недостаточность и т.д. Кроме того, указанная доза дополнительно зависит от таких факторов как тип подлежащего использованию терапевтического средства и конкретный пациент, подлежащий лечению. Обычно используемое количество составляет такую же дозу, которую используют при введении указанного терапевтического средства без EGFL8.
Антитела против EGFL8
Некоторые наиболее перспективные лекарственные средства-кандидаты по изобретению представляют собой антитела и фрагменты антител, которые способны ингибировать продукцию EGFL8 и/или понижать активность EGFL8.
Поликлональные антитела
Способы получения поликлональных антител известны специалистам в данной области. Поликлональные антитела могут быть получены у млекопитающего, например, путем однократной или многократных инъекций иммунизирующего средства и, если это желательно, адъюванта. Обычно иммунизирующее средство и/или адъювант вводят млекопитающему путем многократных подкожных или внутрибрюшинных инъекций. Иммунизирующее средство может включать полипептид EGFL8 или его слитый белок. Может быть эффективна конъюгация иммунизирующего средства с белком, иммуногенность которого у подлежащего иммунизации животного подтверждена. Примеры таких иммуногенных белков включают, но ими не ограничиваются, гемоцианин лимфы улитки, сывороточный альбумин, бычий тиреоглобулин и соевый ингибитор трипсина. Примеры адъювантов, которые могут быть использованы, включают полный адъювант Фрейнда и адъювант MPL-TDM (монофосфориллипид A или синтетический дикориномиколат трегалозы). Схема иммунизации без излишнего экспериментирования может быть выбрана специалистом в данной области.
Моноклональные антитела
Альтернативно, антитела против EGFL8 могут быть моноклональными антителами. Моноклональные антитела могут быть получены с использованием гибридомных методов, таких как методы, описанные Kohler and Milstein, Nature 256: 495 (1975). Обычно в гибридомном методе мышь, хомяка или другое подходящее животное-хозяина иммунизируют иммунизирующим средством для получения лимфоцитов, которые продуцируют или способны продуцировать антитела, которые будут специфически связываться с иммунизирующим средством. Альтернативно, лимфоциты можно иммунизировать in vitro.
Обычно иммунизирующее средство содержит полипептид EGFL8 или его слитый белок. В целом, если желательны клетки человеческого происхождения, то используют лимфоциты периферической крови (“PBL”), а если в качестве источников желательны млекопитающие, не являющиеся человеком, используют клетки селезенки или клетки лимфатических узлов. Затем лимфоциты сливают с иммортализованной линией клеток, используя приемлемое средство для слияния, такое как полиэтиленгликоль, с образованием клеточной гибридомы. Goding, Monoclonal Antibodies: Principles and Practice (New York: Academic Press, 1986), pp. 59-103. Обычно иммортализованные линии клеток представляют собой трансформированные клетки млекопитающих, в частности, миеломные клетки, происходящие от грызунов, быка или человека. Обычно используют линии клеток миеломы крысы или мыши. Клеточные гибридомы можно культивировать в подходящей культуральной среде, которая предпочтительно содержит одно или несколько веществ, ингибирующих рост или выживание неслитых иммортализованных клеток. Например, если у родительских клеток отсутствует фермент гипоксантин-гуанинфосфорибозилтрансфераза (HGPRT или HPRT), в культуральную среду для гибридом обычно включают вещества гипоксантин, аминоптерин и тимидин (“среда HAT”), которые предотвращают рост HGPRT-дефицитных клеток.
Предпочтительными иммортализованными линиями клеток являются линии, которые эффективно сливаются, на высоком уровне поддерживают стабильную экспрессию антитела выбранными клетками-антителопродуцентами, и которые чувствительны к среде, такой как среда HAT. Более предпочтительными иммортализованными линиями клеток являются линии миеломы мыши, которые могут быть получены, например, в Salk Institute Cell Distribution Center, San Diego, California и в Американской коллекции типовых культур, Manassas, Virginia. Для получения моноклональных антител человека были описаны также линии клеток миеломы человека и гетеромиеломы человека-мыши. Kozbor, J. Immunol. 133: 3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications (Marcel Dekker, Inc.: New York, 1987) pp. 51-63.
Затем культуральную среду, в которой культивируют клеточные гибридомы, можно анализировать на предмет наличия моноклональных антител против полипептида EGFL8. Предпочтительно, чтобы специфичность связывания моноклональных антител, продуцируемых клеточными гибридомами, определялась методом иммунопреципитации или путем анализа связывания in vitro, таким как радиоиммуноанализ (RIA) или твердофазный иммуноферментный анализ (ELISA). Такие технологии и анализы известны в данной области. Аффинность связывания моноклонального антитела может быть определена, например, путем анализа Скэтчарда, согласно Munson and Pollard, Anal. Biochem. 107: 220 (1980).
После идентификации требуемых клеточных гибридом клоны можно субклонировать, используя технологию серийных разведений, и выращивать известными способами. Goding, выше. Приемлемые для этой цели культуральные среды включают, например, модифицированную согласно Дульбекко среду Игла и среду RPMI-1640. Альтернативно, клеточные гибридомы можно выращивать in vivo в виде асцита у млекопитающего.
Секретируемые субклонами моноклональные антитела могут быть выделены или очищены из культуральной среды или асцитной жидкости согласно известным процедурам очистки иммуноглобулинов, таким, например, как белок A-сефароза, хроматография на основе гидроксиапатита, гель-электрофорез, диализ или аффинная хроматография.
Моноклональные антитела можно также получить, используя способы рекомбинантной ДНК, такие как способы, описанные в патенте США No.4816567. ДНК, кодирующую моноклональные антитела по изобретению, можно легко выделить и секвенировать с использованием общепринятых процедур (например, с помощью олигонуклеотидных зондов, способных специфически связываться с генами, кодирущими тяжелую и легкую цепи антител мыши). Клеточные гибридомы по изобретению служат в качестве предпочтительного источника такой ДНК. После выделения ДНК можно встроить в экспрессирующие векторы, которые затем трансфицируют в клетки-хозяева, такие как обезьяньи клетки COS, клетки яичника китайского хомячка (CHO) или клетки миеломы, которые иным способом иммуноглобулиновый белок не продуцируют, чтобы достичь синтеза моноклональных антител в рекомбинантных хозяйских клетках. ДНК может быть также модифицирована, например, путем замены последовательностью, кодирующей константные домены тяжелой и легкой цепей человека, гомологичных последовательностей мыши (патент США No.4816567; Morrison et al., выше) или путем ковалентного присоединения к последовательности, кодирующей иммуноглобулин, полной или частичной последовательности, кодирующей неиммуноглобулиновый полипептид. Таким неиммуноглобулиновым полипептидом можно заменить константные домены антитела по изобретению или можно заменить вариабельные домены одного из антигенсвязывающих участков антитела по изобретению с получением химерного двухвалентного антитела.
Антитела могут быть моновалентными антителами. Способы получения моновалентных антител хорошо известны в данной области. Например, одним из способов предусмотрена рекомбинантная экспрессия легкой цепи и модифицированной тяжелой цепи иммуноглобулина. Обычно тяжелую цепь усекают в каком-либо положении участка Fc, с тем, чтобы предотвратить перекрестное связывание тяжелых цепей. Альтернативно, соответствующие цистеиновые остатки заменяют другим аминокислотным остатком или удаляют таким образом, чтобы предотвратить перекрестное связывание.
Для получения моновалентных антител приемлемы также способы in vitro. Расщепление антител с получением их фрагментов, в частности, Fab-фрагментов, можно осуществить с использованием общепринятых технологий, известных в данной области.
Антитела человека и гуманизированные антитела
Антитела против EGFL8 могут дополнительно включать гуманизированные антитела или антитела человека. Гуманизированные формы не являющихся человеческими антител (например, мышиных) представляют собой химерные иммуноглобулины, цепи иммуноглобулинов или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие субпоследовательности антител), которые содержат минимальную последовательность, полученную из не являющегося человеческим иммуноглобулина. Гуманизированные антитела включают иммуноглобулины человека (реципиентное антитело), в которых остатки из области CDR реципиента заменены остатками из области CDR отличных от человека видов (донорное антитело), таких как мышь, крыса или кролик, обладающие требуемой специфичностью, аффинностью и емкостью. В некоторых случаях остатки из области рамки считывания Fv иммуноглобулина человека заменены соответствующими остатками, не совпадающими с человеческими. Гуманизированные антитела могут также содержать остатки, которые не встречаются ни в реципиентском антителе, ни в вводимых последовательностях CDR или области рамки считывания. Обычно гуманизированное антитело содержит практически все из по меньшей мере одного, чаще двух вариабельных доменов, в которых все или практически все участки CDR соответствуют таковым в не являющемся человеческим иммуноглобулине, а все или практически все области FR представляют собой участки консенсусной последовательности иммуноглобулина человека. Предпочтительно, чтобы гуманизированное антитело содержало также по меньшей мере участок константной области иммуноглобулина (Fc), обычно константной области иммуноглобулина человека. Jones et al., Nature 321: 522-525 (1986); Riechmann et al., Nature 332: 323-329 (1988); Presta, Curr. Op. Struct. Biol. 2: 593-596 (1992).
Способы гуманизирования не являющихся человеческими антител хорошо известны в данной области. Обычно гуманизированное антитело имеет один или несколько аминокислотных остатков, вводимых в него из не относящегося к человеку источника. Эти не совпадающие с человеческими аминокислотные остатки часто называют ”импортируемыми” остатками, которые обычно получают из ”импортируемого” вариабельного домена. В целом гуманизацию можно осуществлять, согласно способу Winter и сотрудников (Jones et al., Nature 321: 522-525 (1986); Riechmann et al., Nature 332: 323-327 (1988); Verhoeyen et al., Science 239: 1534-1536 (1988)), путем замены последовательностей CDR грызунов или CDR-последовательностей соответствующими последовательностями антитела человека. Соответственно, такие ”гуманизированные” антитела являются химерными антителами (патент США No. 4816567), где значительно меньший, чем интактный, вариабельный домен человека заменен соответствующей последовательностью из отличных от человека видов. На практике гуманизированные антитела обычно представляют собой антитела человека, в которых некоторые остатки CDR и, возможно, некоторые остатки FR заменены остатками из аналогичных участков антител грызунов.
Антитела человека могут быть получены также с использованием различных известных в данной области технологий, включая библиотеки фагового дисплея. Hoogenboom and Winter, J. Mol. Biol. 227: 381 (1991); Marks et al., J. Mol. Biol. 222: 581 (1991). Для получения моноклональных антител человека также доступны технологии Cole et al. и Boerner et al. Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p. 77 (1985) и Boerner et al., J. Immunol. 147(1):86-95 (1991). Аналогично антитела человека могут быть получены путем введения локусов иммуноглобулина человека трансгенным животным, например, мышам, у которых частично или полностью инактивированы гены эндогенных иммуноглобулинов. При контрольном заражении антигеном наблюдали продукцию антител человека, во всех отношениях очень сходную с таковой, наблюдаемой у человека, включая реаранжировку генов, их сборку и спектр антител. Этот способ описан, например, в патентах США No. 5545807; 5545806; 5569825; 5625126; 5633425; и 5661016, а также в следующих научных публикациях: Marks et al., Bio/Technology 10: 779-783 (1992); Lonberg et al., Nature 368: 856-859 (1994); Morrison, Nature, 368: 812-813 (1994); Fishwild et al., Nature Biotechnology 14: 845-851 (1996); Neuberger, Nature Biotechnology 14: 826 (1996); Lonberg and Huszar, Intern. Rev. Immunol. 13: 65-93 (1995).
Биспецифические антитела
Биспецифические антитела являются моноклональными, предпочтительно, антителами человека или гуманизированными антителами, обладающими специфичностями связывания по меньшей мере в отношении двух различных антигенов. В данном случае одной из специфичностей связывания является специфичность в отношении полипептида EGFL8; другой специфичностью является специфичность в отношении любого другого антигена, предпочтительно, белка клеточной поверхности или рецептора, или субъединицы рецептора.
Способы получения биспецифических антител известны в данной области. Обычно рекомбинантная продукция биспецифических антител основана на совместной экспрессии двух пар тяжелая цепь/легкая цепь иммуноглобулина, где указанные две тяжелые цепи имеют различные специфичности связывания. Milstein and Cuello, Nature 305: 537-539 (1983). Вследствие случайного набора тяжелых и легких цепей иммуноглобулина данные гибридомы (квадромы) продуцируют потенциальную смесь из зачастую разных молекул антител, из которых только одна имеет правильную биспецифическую структуру. Как правило, очистку правильной молекулы осуществляют путем проведения стадий аффинной хроматографии. Сходные процедуры описаны в заявке WO 93/08829, опубликованной 13 мая 1993, и в публикации Traunecker et al., EMBO J. 10: 3655-3659 (1991).
Вариабельные домены антитела с требуемыми специфичностями связывания (участками связывания антиген-антитело) могут быть слиты с последовательностями константного домена иммуноглобулина. Слияние предпочтительно осуществляют с константным доменом тяжелой цепи иммуноглобулина, содержащим по меньшей мере часть шарнирной области, областей CH2 и CH3. Предпочтительно иметь первый участок константной области тяжелой цепи (CH1), содержащий участок, который необходим для связывания легкой цепи, присутствующей по меньшей мере в одном из продуктов слияния. ДНК, кодирующие слитые тяжелые цепи иммуноглобулина и, если необходимо, легкую цепь иммуноглобулина, встраивают в отдельные экспрессирующие векторы и совместно трансфицируют в организм приемлемого хозяина. Дополнительные подробности получения биспецифических антител см., например, у Suresh et al., Methods in Enzymology 121: 210 (1986).
Гетероконъюгированные антитела
Гетероконъюгированные антитела состоят из двух ковалентно связанных антител. Такие антитела были предложены, например, для нацеливания клеток иммунной системы на нежелательные клетки (патент США No. 4676980) и для лечения инфекции ВИЧ. WO 91/00360; WO 92/200373; EP 03089. Пристально рассматривается возможность получения антител in vitro с использованием известных технологий в химии синтетических белков, включая способы с использованием поперечно сшивающих средств. Например, иммунотоксины могут быть сконструированы с помощью реакции дисульфидного обмена или путем формирования простой тиоэфирной связи. Примеры приемлемых для этой цели реагентов включают иминотиолат и метил-4-меркаптобутиримидат, а также реагенты, описанные, например, в патенте США No. 4676980.
Иммуноконъюгаты
Настоящее изобретение относится также к иммуноконъюгатам, содержащим антитело, конъюгированное с цитотоксическим средством, таким как химиотерапевтическое средство, токсин (например, ферментативно-активный токсин бактериального, грибного, растительного или животного происхождения или его фрагменты) или радиоактивный изотоп (то есть радиоконъюгат).
Химиотерапевтические средства, используемые при получении таких иммуноконъюгатов, были описаны выше. Ферментативно активные токсины и их фрагменты, которые могут быть использованы, включают A-цепь дифтерийного токсина, не связывающиеся активные фрагменты дифтерийного токсина, A-цепь экзотоксина (из Pseudomonas aeruginosa), A-цепь рицина, A-цепь абрина, A-цепь модекцина, альфа-сарцин, белки Aleurites fordii, белки диантина, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор из Momordica charantia, курцин, кротин, ингибитор из Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трихотецены. Для получения антител, конъюгированных с радиоактивным веществом, доступно множество радионуклидов. Примеры таковых включают 212Bi, 131I, 131In, 90Y и 186Re.
Конъюгаты антитела и цитотоксического средства получают с использованием множества бифункциональных связывающих белки средств, таких как N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), иминотиолан (IT), бифункциональные производные сложных имидоэфиров (таких как диметиладипимидат HC1), активные сложные эфиры (такие как суберат дисукцинимидила), альдегиды (такие как глутаральдегид), бис-азидо-соединения (такие как бис(пара-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(пара-диазонийбензоил)этилендиамин), диизоцианаты (такие как 2,6-диизоцианат толуола) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин рицина может быть получен, как описано Vitetta et al., Science 238: 1098 (1987). Примером хелатобразующего соединения для конъюгации радионуклеотида с антителом является меченная углеродом-14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA). См. WO 94/11026.
В другом варианте осуществления изобретения антитело может быть конъюгировано с "рецептором" (таким как стрептавидин) для применения в предварительном нацеливании на опухоль, где пациенту вводят конъюгат рецептор-антитело с последующим удалением не связавшегося конъюгата из кровотока с помощью очищающего средства, а затем вводят "лиганд" (например, авидин), который конъюгирован с цитотоксическим средством (например, радионуклеотидом).
Иммунолипосомы
Описанные в данном описании антитела могут быть также составлены в виде иммунолипосом. Содержащие антитело липосомы получают известными в данной области способами, такими как способы, описанные Epstein et al., Proc. Natl. Acad. Sci. USA 82:3688 (1985); Hwang et al., Proc. Natl. Acad. Sci. USA 77:4030 (1980); и в патентах США No. 4485045 и 4544545. Липосомы с повышенным временем нахождения в циркуляции описаны в патенте США No. 5013556.
Особенно эффективные липосомы могут быть получены способом обращенно-фазового выпаривания с использованием липидной композиции, содержащей фосфатидилхолин, холестерин и ПЭГ-дериватизированный фосфатидилэтаноламин (PEG-PE). Для получения липосом с требуемым диаметром проводят экструзию липосом через фильтры с определенным размером пор. Fab'-фрагменты антитела по изобретению могут быть конъюгированы с липосомами, как описано у Martin et al., J. Biol. Chein. 257: 286-288 (1982), посредством реакции дисульфидного обмена. Липосома необязательно содержит химиотерапевтическое средство (такое как доксорубицин). См. Gabizon et al., J. National Cancer Inst. 81 (19): 1484 (1989).
Фармацевтические композиции антител
Антитела, специфически связывающиеся с идентифицируемым в данном описании полипептидом EGFL8, а также с другими молекулами, идентифицируемыми с помощью указанных выше скрининг-анализов, можно вводить для лечения различных расстройств, как указано выше и ниже, в виде фармацевтических композиций.
Указанная в данном описании композиция может также содержать более чем одно активное соединение, если это необходимо по конкретным показаниям для лечения, предпочтительно, соединения с взаимодополняющей активностью, не оказывающие неблагоприятных воздействий друг на друга. Альтернативно или в дополнение, указанная композиция может содержать усиливающее ее функцию средство, такое, например, как цитотоксическое средство, цитокин, химиотерапевтическое средство или ингибирующее рост средство. Соответственно, такие молекулы присутствуют в сочетании в таких количествах, которые эффективны для заданной цели.
Активные ингредиенты могут быть также заключены в микрокапсулы, полученные, например, способами коацервации или путем полимеризации на границе раздела фаз, например гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли(метилметакрилатные)микрокапсулы, соответственно, в коллоидные системы для доставки лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие способы описаны в руководстве Remington's Pharmaceutical Sciences, выше.
Композиции, подлежащие использованию для введения in vivo, должны быть стерильны. Это легко осуществить путем фильтрации через стерильные мембранные фильтры.
Могут быть получены препараты с замедленным высвобождением. Подходящие примеры препаратов с замедленным высвобождением включают содержащие антитело полупроницаемые матрицы из твердых гидрофобных полимеров, при этом указанные матрицы представлены в виде веществ с заданной формой, например, пленок или микрокапсул. Примеры матриц с замедленным высвобождением включают сложные полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поли(виниловый спирт)), полилактиды (патент США No. 3773919), сополимеры L-глутаминовой кислоты и γ-этил-L-глутамата, недеградируемый ацетат этиленвинила, деградируемые сополимеры молочной кислоты-гликолевой кислоты, такие как LUPRON DEPOT(R) (инъецируемые микросферы, состоящие из сополимера молочной кислоты-гликолевой кислоты и ацетата лейпролида), а также поли-D-(-)-3-гидроксимасляную кислоту. Тогда как полимеры, такие как ацетат этиленвинила и молочной кислоты-гликолевой кислоты, способны высвобождать молекулы в течение периода более чем в 100 суток, некоторые гидрогели высвобождают белки в течение более коротких периодов. Если заключенные в капсулу антитела остаются в организме в течение длительного времени, они могут денатурировать или агрегировать в результате воздействия влаги при 37°C, что приводит к утрате биологической активности и возможным изменениям в иммуногенности. В зависимости от участия того или иного механизма, можно разрабатывать целесообразные способы стабилизации. Например, если выявленный механизм агрегации связан с образованием внутримолекулярных S-S-связей посредством тиодисульфидного обмена, стабилизацию можно осуществлять путем модификации сульфгидрильных остатков, лиофилизации из кислых растворов, контролирования содержания влаги, использования соответствующих добавок и разработки специфических композиций полимерных матриц.
Способы лечения с использованием антитела
Предполагается, что антитела против полипептида EGFL8 могут быть использованы для лечения различных связанных с ангиогенезом состояний, как указано выше.
Антитела вводят млекопитающему, предпочтительно, человеку, в соответствии с известными способами, такими как внутривенное введение в виде ударной дозы или посредством непрерывной инфузии в течение некоторого периода, используя внутримышечный, внутрибрюшинный, внутриспинномозговой, подкожный, внутрисуставной, внутрисиновиальный, интратекальный, пероральный, местный способы введения или введение путем ингаляции. Внутривенное введение антитела вляется предпочтительным.
Другие схемы лечения можно сочетать с введением антител по настоящему изобретению, как указано выше. Например, если антитела предназначены для лечения злокачественной опухоли, пациенту, которого предстоит лечить с применением таких антител, можно проводить также лучевую терапию. Альтернативно или в дополнение, пациенту можно вводить химиотерапевтическое средство. Схемы введения препаратов и дозы таких химиотерапевтических средств можно определять в соответствии с инструкциями производителя или в соответствии с тем, как, исходя из опыта, назначает практикующий специалист в данной области. Схемы введения препаратов и дозы при такой химиотерапии описаны в Chemotherapy Service, Ed., M. C. Perry (Williams & Wilkins: Baltimore, MD, 1992). Химиотерапевтическое средство можно вводить до или после введения антитела, или же одновременно с ним.
Если антитела используются для лечения злокачественной опухоли, то может быть желательно вводить также антитела против других связанных с опухолью антигенов, такие как антитела, которые связываются с одним или несколькими из рецепторов ErbB2, EGFR, ErbB3, ErbB4 или VEGF. Они включают также указанные выше средства. Антитело можно вводить также периодически или в сочетании с радиологическими процедурами, включая облучение или введение радиоактивных веществ. Альтернативно или в дополнение пациенту можно совместно вводить два или более из указанных в данном описании антител, связывающих одинаковые или два или более различных антигена. Иногда может оказаться благотворным также введение пациенту одного или нескольких цитокинов. В предпочтительном варианте осуществления указанные в данном описании антитела вводят совместно с ингибирующим рост средством. Например, можно сначала вводить ингибирующее рост средство, а затем антитело по изобретению. Однако предусмотрено также одновременное введение или введение сначала антитела по изобретению. Подходящими дозами ингибирующего рост средства являются дозы, используемые в настоящее время, и их можно уменьшать в силу комбинированного действия (синергичность) ингибирующего рост средства и указанного в данном описании антитела.
В одном из вариантов осуществления комбинированной терапией воздействуют на васкуляризацию опухолей. Пациентам-опухоленосителям вводят антитело против EGFL8 и другое антитело (например, антитело против VEGF) в терапевтически эффективных дозах, что определяется, например, путем наблюдения за некрозом опухоли или за очагами ее метастазирования, если таковые имеются. Кроме того, можно вводить дополнительные противоопухолевые средства, такие как альфа-, бета- или гамма-интерферон, антитело против HER2, херегулин, антитело против херегулина, D-фактор, интерлейкин-1 (IL-1), интерлейкин-2 (IL-2), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) или средства, способствующие микрососудистому свертыванию в опухолях, такие как антитело против белка C, антитело против белка S или C4b-связывающий белок (см. международную заявку WO 91/01753, опубликованную 21 февраля 1991), или тепловое воздействие или облучение.
В других вариантах осуществления антагонист FGF или PDGF, такой как нейтрализующее антитело против FGF или против PDGF, вводят пациенту в сочетании с антителом против EGFL8. Предпочтительно, чтобы лечение с использованием антител против EGFL8 было временно прекращено в течение периодов заживления ран или желательной неоваскуляризации.
В случае профилактики или лечения сердечно-сосудистого, эндотелиального и ангиогенного расстройства соответствующая доза указанного в данном описании антитела зависит, как указано выше, от типа подлежащего лечению нарушения, от тяжести и течения заболевания, от того, вводят ли антитело в профилактических или лечебных целях, от предшествующего лечения, истории болезни пациента и реакции на антитело, а также от решения, принимаемого лечащим врачом. Указанное антитело предназначено для однократного или серийного введения пациенту.
Например, в зависимости от типа и тяжести заболевания, исходная предполагаемая доза для введения пациенту составляет приблизительно от 1 мкг/кг до 50 мг/кг (например, 0,1-20 мг/кг) антитела путем, например, одного или нескольких отдельных введений или посредством непрерывной инфузии. Как правило, суточная или недельная доза может колебаться приблизительно от 1 мкг/кг до 100 мг/кг или более, в зависимости от указанных выше факторов. В случае многократных введений в течение нескольких суток или более, в зависимости от состояния, лечение повторяют или поддерживают до тех пор, пока не произойдет требуемое подавление симптомов заболевания. Однако могут быть эффективны и другие схемы введения доз. Эффективность такого лечения легко наблюдать с применением общепринятых технологий и анализов, включая, например, радиографическую визуализацию опухоли.
Следующие примеры приведены только лишь в иллюстративных целях и не предназначены для какого бы то ни было ограничения объема настоящего изобретения.
Описания всех ссылок на патенты и всех литературных ссылок, цитируемых в настоящем описании, в полном объеме включены в настоящее описание в виде ссылок.
ПРИМЕРЫ
Коммерчески доступные реагенты, указанные в примерах, были использованы, если не указано иначе, в соответствии с инструкциями производителя. Источником тех клеток, которые идентифицированы в настоящем описании под номерами доступа ATCC(R), является Американская коллекция типовых культур, Manassas, VA 20108.
Все публикации, цитируемые в настоящем описании, в полном объеме включены в описание в виде ссылки.
ПРИМЕР 1. Esfl8 экспрессируется в сосудистой сети
Были предприняты эксперименты для определения характера экспрессии Egfl8 и, в частности, для сравнения результатов с характером экспрессии Egfl7. Антисмысловыми рибозондами для проведения гибридизации in situ служили следующие:
Для Egfl7:
GTAGGGCTCTGCCGGGACCTGGGTCTTCCCTCTCCTGGAGCTGCAGAGGCCAGAAGTTCAG TGGTGAGGGGTCCAAGGAGAGTCCGGGGAGACCAGGGAGGCTCTGTCCATCCCCTGTCCCT GTCCCTGTGGGAAGCCCCCGGCAGCAGCAAGACGCTGGCTGTTCCACCTGCCCACAAGAAC AGCCACCACCAGTACCCAGGGGATGACAAGCGGCCGGACCACAGGCCACAAAAAGAAGAAG GCTACCCCACTTACAGATGCAGACCATGTGGGGCTCCGGAGAACTGCTTGTAGCATGGTTT CTAGTGTTGGCAGCAGATGGTACTACTGAGCATGTCTACAGACCCAGCCGTAGAGTGTGTA CTGTGGGGATTTCCGGAGGTTCCATCTCGGAGACCTTTGTGCAGCGTGTATACCAGCCTTA CCTCACCACTTGCGACGGACACAGAGCCTGCAGCACCTACCGAACCATCTACCGGACTGCC TATCGCCGTAGCCCTGGGGTGACTCCCGCAAGGCCTCGCTATGCTTGCTGCCCTGGTTGGA AGAGGACCAGTGGGCTCCCTGGGGCTTGTGGAGCAGCAATATGCCAGCCTCCATGTGGGAA TGGAGGGAGTTGCATCCGCCCAGGACACTGCCGCTGCCCTGTGGGATGGCAGGGAGATACT TGCCAGACAGATGTTGATGAATGCAGTACAGGAGAGGCCAGTTGTCCCCAGCGCTGTGTCA ATACTGTGGGAAGTTACTGGTGCCAGGGATGGGAGGGACAAAGCCCATCTGCAGATGGGAC GCGCTGCCTGTCTAAGGAGGGGCCCTCCCCGGTGGCCCCAAACCCCACAGCAGGAGTGGAC AGCATGGCGAGAGAGGAGGTGTACAGGCTGCAGGCTCGGGTTGATGTGCTAGAACAGAAAC TGCAGTTGGTGCTGGCCCCACTGCACAGCCTGGCCTCTCGGTCCACAGAGCATGGGCTACA AGATCCTGGCAGCCTGCTGGCCCATTCCTTCCAGCAGCTGGACCGAATTGATTCACTGAGT GAGCAGGTGTCCTTCTTGGAGGAACATCTGGGGTCCTGCTCCTGCAAAAAAGATCTGTGAT AACCTCTCACCACCCAGGCTGGATAGAGCAGTCATCCCTAGATCCCTTGTAGCCAGAGTTC AGGCGCTGTCTGGTGGTGCCTATGAGCAGAAGGCCCTGCCTCATTGTCCCTCTTTCTTAGG AGGTTCCTAGGACTTGGGCATGGGGAGTGGGGTCTTGTGTGACTCTTCAGTGGGGCTCCCT GTCTAAGTGGTAAGGTGGGGATTGTCTCCATCTTTGTCATAATAAAGCTGAGACTT (SEQ ID NO: 3)
Для Egfl8:
GGAGGATCTTTCAAAGAGAGTTTGGGAGTGTGCTCCAAGCAGACGCTGCTGGTTCCTCTCC GTTACAACGAGTCCTATAGTCAACCGGTGTACAAACCCTACCTGACCTTGTGTGCGGGGAG GCGCATATGTAGCACCTACAGGACCACATACCGTGTGGCCTGGCGGGAGGTGAGGCGGGAG GTACCACAGACACACGTGGTGTGCTGTCAGGGCTGGAAGAAGCCACACCCAGGAGCTCTCA CCTGTGATGCCATCTGCTCCAAGCCTTGTCTTAATGGAGGTGTCTGCACTGGACCAGACCG GTGCGAGTGTGCCCCAGGCTGGGGAGGAAAGCATTGCCACGTGGATGTCGATGAATGCAGG GCCAGCCTTACCCTCTGCTCTCATGGCTGCCTCAACACACTGGGCAGCTTCTTGTGCAGCT GTCCACACCCCCTGGTGCTGGGTCTCGATGGACGCACCTGTGCAGGAGGCCCACCGGAGAG TCCAACCAGCGCG (SEQ ID NO:4).
Эмбрионов мыши извлекали из маток и промывали в PBS (без РНКазы). Эмбрионов мышей E10.5 CD1 фиксировали в свежеприготовленном 4% параформальдегиде в PBS в течение 4 часов при комнатной температуре (RT), промывали 2×5 минут в PBT (PBS + 0,1% Tween(TM) 20) и подвергали дегидратации, на льду, с использованием 25%, 50%, 75%, 2×100% метанола в PBT, проводя каждую из указанных стадий в течение 5-10 минут. Эмбрионов обесцвечивали при комнатной температуре в смеси метанол/H2O2 (4:1) в течение 1 часа, промывали 2×10 минут в 100% метаноле, на льду, и до проведения гибридизации хранили в 100% метаноле при -20ºC.
Эмбрионов последовательно инкубировали в следующих буферах: 75%, 50%, 25% метанола в PBT, проводя каждую из указанных стадий на льду в течение 5-10 минут. Эмбрионов промывали 3×5 минут на льду в PBT, затем в течение 30 минут в 20 мкг/мл протеиназы K в PBT при RT и при осторожном перемешивании, дважды тщательно промывали холодным PBT, в течение 20 минут фиксировали в 0,2% глутаральдегиде + 4% PFA в PBS, при RT, при осторожном перемешивании, промывали 3×5 минут в PBT при RT. Затем их в течение 5 минут инкубировали в 50% PBT + 50% предгибидизационной смеси (25 мл сверхчистого деионизированного формамида; 12,5 мл 20×SSC (5× конечн.); 40 мкл гепарина в концентрации 50 мг/мл; 500 мкл раствора 10 мг/мл ДНК спермы лосося; 125 мкл раствора 20 мг/мл дрожжевой тРНК; 500 мкл 10% Tween(TM) 20; ~2-4 мл 1 M безводной лимонной кислоты, до pH=4,5-5; не содержащей РНКазу воды - до 50 мл), затем 5 минут в предгибидизационной смеси. Раствор удаляли, а затем в течение 3-6 часов проводили предгибридизацию в предгибидизационной смеси при 68-70ºC, при осторожном перемешивании, после чего в течение ночи на шейкере проводили гибридизацию при 70°C в смеси 2 мл предгибидизационной смеси с 50 мкл формамида и 1 мкг/мл Dig-рибозонда (денатурация рибозонда в течение 5-10 минут при 80°C перед добавлением к гибидизационной смеси).
После гибридизации эмбрионы промывали многократно: дважды промывали предварительно нагретым раствором I (125 мл формамида; 62,5 мл 20×SSC (конечн. 5×); 2,5 мл 10% Tween(TM) 20; воды - до 250 мл) при 68-70°C; затем 2× 30 минут предварительно нагретым раствором I при 68-70°C, при встряхивании; затем 3×60 мин раствором II (125 мл формамида; 25 мл 20×SSC (конечн. 2×); 2,5 мл 10% Tween(TM) 20; воды - до 250 мл) при 68-70°C, при встряхивании; 3×5 минут отмывали TBST (8 г NaCl; 0,2 г KCl; 2,5 мл 1 M Tris, pH 7,4 или 7,5; 10 мл 10% Tween(TM) 20; с добавлением воды до 1 литра) при RT, при встряхивании; и затем 60 минут в TBST/10% в прогретой инактивированной бараньей (или овечьей) сыворотке при RT, при встряхивании. Затем добавляли разбавленное 1/2000 баранье антитело против Dig (производства Roche Molecular Diagnostics) в TBST/1% прогретой инактивированной бараньей сыворотке и инкубировали в течение ночи при 4°C, при встряхивании.
Затем эмбрионы 3×5 минут промывали в TBST при RT, при встряхивании, промывали в течение всего дня при RT, при встряхивании, сменяя TBST каждый час, а затем в течение ночи промывали в TBST при 4°C, при встряхивании. Затем их промывали 2× 20 минут в свежеприготовленном буфере AP (2 мл 5M NaCl, 0,2 г KCl, 2,5 мл 1 M Tris, pH 7,4 или 7,5, 10 мл 10% Tween(TM) 20, воды - до 100 мл) при RT, при встряхивании. Затем проводили цветную реакцию путем добавления 10 мл буфера AP + 200 мкл раствора NBT/BCIP, пробирки заворачивали в фольгу и встряхивали. Реакцию останавливали, 3 раза промывая PBT/1 мМ ЭДТА, осуществляли постфиксацию эмбрионов посредством 4% PFA в PBS в течение 20 минут при RT, несколько раз промывали в PBT и хранили эмбрионов в смеси 80% глицерина в PBS + 0,1% NaN3 при 4°C.
Согласно наблюдениям авторов изобретения, Egfl7 экспрессировался в большинстве краниальных сосудов, включая артерии и вены, тогда как Egfl8 экспрессировался только лишь в некоторой субпопуляции краниальных артерий (Фиг. 1A и Фиг. 1B). По-видимому, в определенных сегментах разветвленной артериальной иерархии имеется запрет, в частности, для экспрессии Egfl8. Кроме того, сходные эксперименты были предприняты с использованием моделей опухолей мыши in vivo, и было показано, что в опухолях Egfl8 экспрессируется только в определенных сосудах.
ПРИМЕР 2. У нокаутных мышей с выключенным геном Egfl8 обнаруживаются дефекты в ангиогенезе
Была создана конструкция, в которой экзоны 2-7 домена Egfl8 были заменены на LacZ и ген резистентности к неомицину, и такая конструкция, с помощью стандартных способов гомологической рекомбинации, была использована для получения нокаутных мышей с выключенным геном Egfl8 (см. Фиг. 2). Образованный в результате нокаутный аллель кодировал только первые 35 аминокислот домена EGFL8, из которых 28 кодировали сигнальную последовательность. Гетерозиготных и нокаутных в отношении Egfl8 мышей (Egfl8+/-) скрещивали с мышами Egfl7+/- (описанными Schmidt et al., Development, 134(16): 2913-23. (2007)) с целью получения дважды гомозиготных мышей (Egfl7-/- Egfl8-/-).
Сначала производили окрашивание тотальных препаратов, чтобы определить влияние мутаций в Egfl7 и/или Egfl8 на уровне сосудистой сети сетчатки. Для этого постнатально забивали 8-дневных мышей (разного фенотипа), вырезали глазное яблоко и фиксировали его в течение ночи в 4% PFA в PBS (забуференный фосатом физиологический раствор, pH 7,4) при 4°C. Затем промывали 3× в PBS, вырезали сетчатку и извлекали сосуды гиалоидной мембраны и помещали их в 48- или 96-луночные планшеты для окрашивания. После пермеабилизации с помощью PBST (PBS + 0,5% Triton(R) X100) в течение 1 часа сетчатки инкубировали в блокирующем буфере (5% нормальной козьей сыворотки + 0,5% Triton(R) X100 + 0,01% NaN3 в PBS) в течение 2-16 часов при 4°C. Блокирующий буфер удаляли, и затем в течение ночи проводили инкубацию на ротаторе при 4°C с первичным красителем (первичным красителем служил биотинилированный изолектин B4: производства Sigma, Cat.# = L2140. Изолектин B4 специфически связывается с сосудистым эндотелием). Маточный раствор биотинилированного изолектина B4 готовили следующим образом: растворяли в 0,9% (0,15 M NaCl) до концентрации 1 мг/мл, малые аликвоты хранили при -20ºC. При применении маточных растворов их разбавляли в 50 раз (рабочая концентрация = 20 мкг/мл). Производили по меньшей мере 6-кратную промывку в PBST, каждый раз в течение 1 часа при 4ºC, а затем инкубировали со вторичным красителем (стрептавидин Alexa 488 (1:150) производства Molecular Probes) в PBST + 10% козьей сыворотки, в течение ночи во вращаюшемся планшете при 4°C. Затем производили по меньшей мере 6-кратную промывку в PBST, каждый раз в течение 1 часа при 4°C на ротаторе, а затем 1 раз в PBS, содержащем DAPI. Ткани однократно фиксировали 4% параформальдегидом (PFA) в PBS в течение не более 5 минут, а затем по меньшей мере 4 раза промывали PBS, пока ткань полностью не отмывалась от PFA (приблизительно в течение 30 минут - 1 часа).
Каждую сетчатку переносили в малую чашку Петри, содержащую PBS, делали 4-5 надрезов вдоль радиальных осей от кромки приблизительно до 2/3 радиуса. Сетчатки помещали на стеклянные пластинки с прозрачными приподнятыми боками, по возможности удаляли всю жидкость, а затем с помощью пинцета расправляли сетчатку на стеклянной пластинке. Затем быстро добавляли 1-2 капли реактива Fluoromount-G, и образцы накрывали покровным стеклом. Если в ткани сетчатки локально образовывались мелкие складки, их аккуратно расправляли осторожными движениями покровного стекла, пока не добивались абсолютно ровного расположения сетчатки. Кроме того, необходимо было удостовериться, что в ткани не образовалось пузырьков. Фотографии были сделаны в конфокальном микроскопе Zeiss, с получением серийных оптических изображений по всей толщине каждой сетчатки, а затем на основе отдельных серийных изображений, используя программное обеспечение Zeiss, восстанавливали 3D-изображения.
В сетчатках дикого типа и в сетчатках Egfl7-/- (данные не приведены), также как и в сетчатках Egfl7+/-, Egfl8-/- (Фиг. 3, левые панели), наблюдали нормальное распределение и морфологию индивидуальных вертикальных отростков, которые образованы отростками при сосудообразовании из сосудов NFL. Однако в сетчатках Egfl7-/-, Egfl8-/- (Фиг. 3, правые панели) вертикальные отростки образовывали друг с другом кластеры, образуя аберрантные отростки больших размеров. Таким образом, эти результаты показывают, что Egfl7 и Egfl8 вместе осуществляют контроль прорастания сосудов при ангиогенезе в более глубоком слое сетчатки. Утраты одного какого-нибудь из этих генов недостаточно для того, чтобы вызвать дефективное (патологическое) сосудообразование.
Затем анализировали фенотип мутантов Egfl8 на модели ангиогенеза в роговице мышей (см., например, Kenyon et al., Invest. Ophthalmol. Vis. Sci. 37: 1625-32 (1996)). На протяжении всего эксперимента была использована асептическая технология. Взрослые мыши в возрасте 7-10 недель были анестезированы путем внутрибрюшинной инъекции 2,5% авертина®. Вдобавок к общей анестезии производили местную анестезию глаза 0,5% пропаракаином (Allergan, Irvine, CA). В рамках хирургических возможностей осуществляли центральную внутристромальную линейную кератотомию, при этом скальпель хирурга был направлен параллельно прикреплению латерального прямого мускула. С помощью модифицированного “Грефевского” ножа вскрывали ламеллярный «микрокарман» по направлению к височному лимбу. Гидроновый пеллет, содержащий bFGF (от 40 до 50 нг/пеллет) помещали на поверхность роговицы у основания «кармана» с помощью мелких форцепсов для ювелирных работ и, орудуя одной лапкой форцепса, продвигали пеллет вперед к височному концу «кармана», на расстояние в 1 мм от лимбического сосуда. Антибиотическую мазь (0,5% эритромицин; E.Fougera & Co) накладывали на глаз, не только для того, чтобы предотвратить развитие инфекции, но также и в целях уменьшения раздражения в ответ на неровность глазной поверхности. В этих исследованиях использовали оба глаза мышей.
Через шесть дней после имплантации пеллета были сделаны снимки с помощью препаровальной лупы (Stemi 2000-C, Zeiss), соединенной с цифровым фотоаппаратом (AxioCam MRc5, Zeiss). Во время эвтаназии мышей перфузировали 10 мл HBSS-гепарина, а затем 10 мл раствора ФИТЦ-декстран/5,5 мг/мл поли-L-лизина. Из вылущенных глаз были приготовлены тотальные препараты роговицы. Визуализацию новых сосудов, которые поглотили флуоресцеин, производили под микроскопом. Площадь неоваскуляризации, меченную ФИТЦ, а также размер роговиц измеряли путем автоматизированного с помощью компьютера анализа изображения (Image-Pro Plus 6.0, MediaCybernetics). Процент площади васкуляризации вычисляли согласно формуле: (площадь неоваскуляризации/размер роговицы) × 100.
Согласно наблюдениям авторов изобретения, плотность сосудов роговицы у мышей Egfl8-/- составляла немного меньше половины этого показателя у мышей дикого типа (фиг. 4). Полученные результаты подтвердили то, что Egfl8 сам по себе играет роль в процессе васкуляризации.
Подразумевается, что приведенное выше письменное описание является достаточным для предоставления возможности специалисту в данной области осуществлять изобретение на практике. При этом различные модификации изобретения, в дополнение к представленным и описанным в рамках настоящей заявки вариантам, считаются, в свете указанного выше описания, очевидными для специалистов в данной области и входящими в объем прилагаемой формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ РЕГУЛЯЦИИ РАЗВИТИЯ СОСУДОВ | 2005 |
|
RU2365382C2 |
| АНТИТЕЛА К EGFL7 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2007 |
|
RU2415870C2 |
| ИНГИБИТОРЫ АНГИОПОЭТИНПОДОБНОГО БЕЛКА 4, ИХ КОМБИНАЦИИ И ПРИМЕНЕНИЕ | 2005 |
|
RU2392966C2 |
| ИНГИБИРОВАНИЕ АНГИОГЕНЕЗА | 2008 |
|
RU2471498C2 |
| СПОСОБЫ ИНГИБИРОВАНИЯ ГЛАЗНОГО АНГИОГЕНЕЗА | 2009 |
|
RU2530583C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ МОДУЛЯЦИИ ГЕПСИНОМ СТИМУЛИРУЮЩЕГО МАКРОФАГИ БЕЛКА | 2010 |
|
RU2539772C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ МОДУЛЯЦИИ АКТИВАЦИИ ФАКТОРА РОСТА ГЕПАТОЦИТОВ | 2005 |
|
RU2405041C2 |
| СПОСОБ ЛЕЧЕНИЯ ОПУХОЛИ У СУБЪЕКТА | 2006 |
|
RU2404193C2 |
| НОВЫЕ АНТИТЕЛА | 2008 |
|
RU2490277C2 |
| СПОСОБЫ ДИАГНОСТИКИ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ РАКА | 2013 |
|
RU2666627C2 |




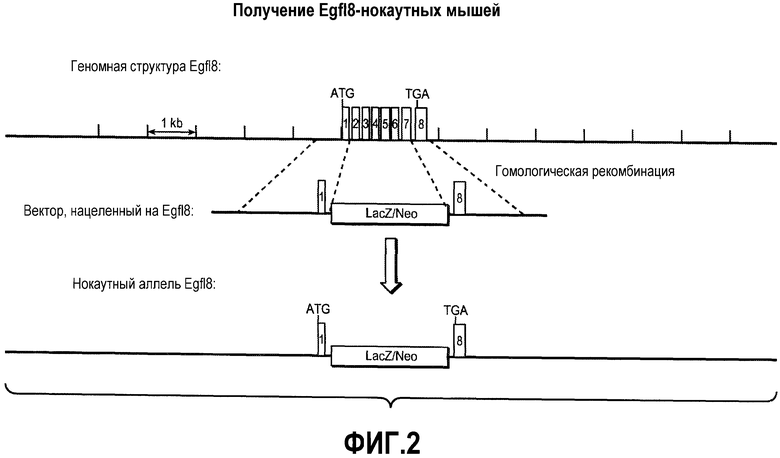
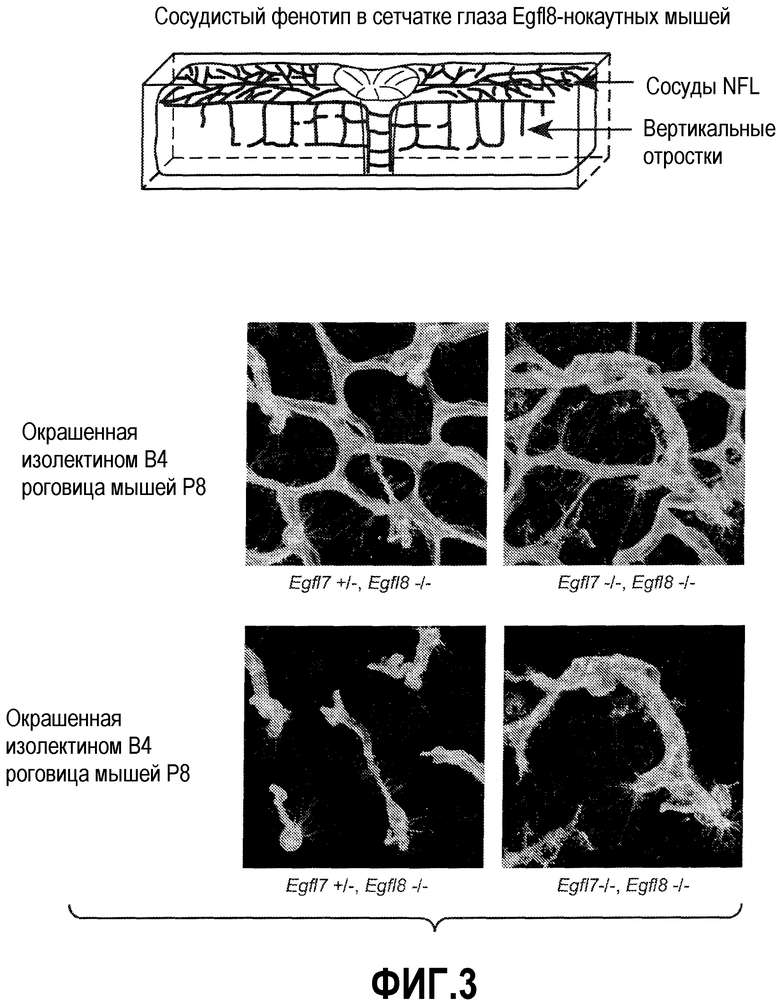
Изобретение относится к области биотехнологии, конкретно к средствам, ингибирующим ангиогенез, и может быть использовано в медицине. Способ предусматривает введение антагониста EGFL8 индивидууму с патологическим состоянием, связанным с ангиогенезом. Изобретение позволяет ингибировать рост сосудов в патологических, например, опухолевых тканях. 13 з.п. ф-лы, 4 ил., 2 пр.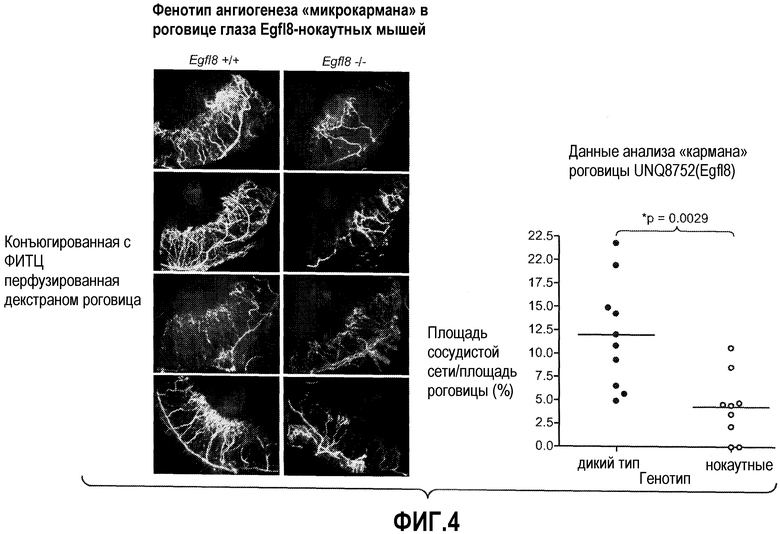
1. Способ уменьшения или ингибирования ангиогенеза у индивида с патологическим состоянием, связанным с ангиогенезом, предусматривающий введение указанному индивиду антагониста EGFL8.
2. Способ по п.1, согласно которому указанный антагонист EGFL8 представляет собой антитело против EGFL8.
3. Способ по п.1, согласно которому указанным патологическим состоянием является новообразование.
4. Способ по п.3, согласно которому указанной неоплазмой является карцинома.
5. Способ по п.4, дополнительно предусматривающий введение химиотерапевтического средства.
6. Способ по п.1, согласно которому указанное патологическое состояние связано с глазом.
7. Способ по п.6, согласно которому указанным патологическим состоянием является внутриглазное неоваскулярное заболевание.
8. Способ по п.1, дополнительно предусматривающий введение индивиду второго антиангиогенного средства.
9. Способ по п.8, согласно которому указанное второе антиангиогенное средство вводят перед или после введения антагониста EGFL8.
10. Способ по п.8, согласно которому указанное второе антиангиогенное средство вводят одновременно с указанным антагонистом EGFL8.
11. Способ по п.8, согласно которому указанное второе антиангиогенное средство является антагонистом EGFL7 или антагонистом фактора роста клеток сосудистого эндотелия (VEGF).
12. Способ по п.11, согласно которому указанный антагонист EGFL7 представляет собой антитело против EGFL7.
13. Способ по п.11, согласно которому указанный антагонист VEGF представляет собой антитело против VEGF.
14. Способ по п.13, согласно которому указанное антитело против VEGF является бевацизумабом.
| WO 2005117968 A2, 15.12.2005 | |||
| PARKER L.H | |||
| ET AL., The endothelial-cell-derived secreted factor Egfl7 regulates vascular tube formation, NATURE, 2004, v.428, n.6984, p.754-758 | |||
| СПОСОБЫ И КОМПОЗИЦИИ, ПРИМЕНИМЫЕ ДЛЯ МОДУЛЯЦИИ АНГИОГЕНЕЗА С ИСПОЛЬЗОВАНИЕМ ПРОТЕИНКИНАЗЫ RAF И RAS | 2000 |
|
RU2257911C2 |
Авторы
Даты
2013-06-27—Публикация
2009-01-14—Подача