Уровень техники
В нормально функционирующих биологических системах численность клеток регулируется балансом между пролиферацией клеток и апоптозом. Нарушенный баланс между пролиферацией и апоптозом клеток ранее считался причиной множества заболеваний. Например, считается, что активизация апоптозных механизмов способствует развитию нейродегенеративных заболеваний, например болезни Альцгеймера, аутоиммунных заболеваний, примером которых является рассеянный склероз, а также поражений, связанных с ишемией, таких как инсульт. Напротив, снижение активности соответствующих каналов апоптоза рассматривается как основной механизм таких заболеваний, как рак.
Апоптоз характеризуется несколькими отличительными чертами, в том числе сокращением размера клетки и набуханием цитоплазматической мембраны, конденсацией хроматина, фрагментацией ядерной ДНК и распадом белка. Существует по крайней мере два различных канала апоптоза - внутренний и внешний (см. обзоры в Oncogene 23:2861-2874, 2004; Photochem. Photobiol.Sci. 3:721-729, 2004). Внешний, или опосредованный рецепторами канал индуцируется лигандами рецепторов смерти, например фактором некроза опухоли. Лиганды рецепторов смерти передают сигнал через каскад каспазы, что в конечном счете приводит к расщеплению ДНК нуклеазами, активированными каспазой. Внутренний канал, передающий сигнал через митохондриальные механизмы, чувствителен к внешним факторам стресса, например, ультрафиолету или лекарствам. Подобные факторы стресса делают проницаемой митохондриальную мембрану, что приводит к выбросу цитохрома с, эндонуклеазы G, апоптоз-индуцирующего фактора (АИФ), а также многих других неидентифицированных молекул. Относительный вклад внешнего или внутреннего каналов в апоптоз определяется балансом между проапоптотическими факторами и факторами выживания клетки (см. обзор в J. Intern. Med. 258:479-517, 2005).
Апоптоз может быть вызван связыванием лигандов рецепторов смерти, активацией индукторов апоптоза, активацией каспаз, супрессией молекул выживания клетки или другими известными или неизвестными новыми механизмами. Все это приводит к фрагментации ДНК, поэтому фенотипический анализ фрагментации ДНК позволит определить все вызывающие апоптоз вещества независимо от характера действия и, возможно, определить соединения с новыми механизмами. Ступенчатый анализ ДНК на основе гель-электрофореза является золотым стандартом анализа фрагментации ДНК. Вместе с тем трудоемкий и многостадийный ступенчатый анализ ДНК на основе гель-электрофореза не подходит для высокопроизводительного скрининга. Поэтому существует потребность в скрининговом анализе, который позволит определить агенты, действующие через классические каналы апоптоза, а также новые механизмы действия. В принципе, можно использовать цитотоксический анализ, но такого рода анализы неселективны в том отношении, что они определяют соединения, задействованные в гибели клеток, как опосредованной апоптозом, так и не связанной с ним, и могут приводить к завышенным ложным результатам. Предпочтительно будет использовать нерадиоактивные и стабильные методы анализа, которые подходят для высокопроизводительного скрининга.
В настоящее время используется три различных формата для скрининга соединений, задействованных в апоптозе. Первый основан на методе радиометрической фильтрации, где клетки выращивают в присутствии 3H-тимидина, а затем неповрежденную ДНК отделяют от фрагментированной на пластинке стекловолокнистого фильтра (Anal. Biochem. 242:187-196, 1996). Производительность радиометрического анализа лимитируется опасностью, связанной с большими количествами радиоактивного вещества и трудоемкой процедурой анализа. Вторым подходом к анализу является метод TUNEL, который основан на введении метки флуоресцентного dUTP в 3'-двуцепочечную ДНК (дцДНК) с помощью фермента трансферазы с последующим обнаружением проточной цитометрией или методами визуализации. Существует множество наборов для анализа TUNEL, но все они предполагают трудоемкую процедуру, и в ходе одного анализа можно протестировать лишь несколько образцов. Третьим методом анализа является сэндвичевый иммуноферментный анализ ELISA с использованием анти-ДНК и антигистонных антител. Такой метод анализа также трудоемкий, и потребность в двух антителах делает его сравнительно дорогостоящим для высокопроизводительного скрининга соединений.
Эффективный и нерадиоактивный метод анализа мог бы опираться на использование интеркалятора ДНК, например, PicoGreen или пропидия иодида для обнаружения фрагментированной ДНК. Например, PicoGreen представляет собой небольшую органическую молекулу, которая интеркалирует в большую бороздку дцДНК. PicoGreen был полезным инструментом для изучения уровня ДНК в образцах крови Scan. J. Immunol. 57:525 - 533, 2003; Clin. Immunol. 106:139 -147, 2003; Blood 102(6):2243 - 2250, 2003. На основе применения интеркаляторов ДНК в настоящем изобретении приводятся способы обнаружения агентов, которые влияют на образование фрагментов ДНК в клетках, подходящие для использования в высокопроизводительных скрининговых приложениях.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
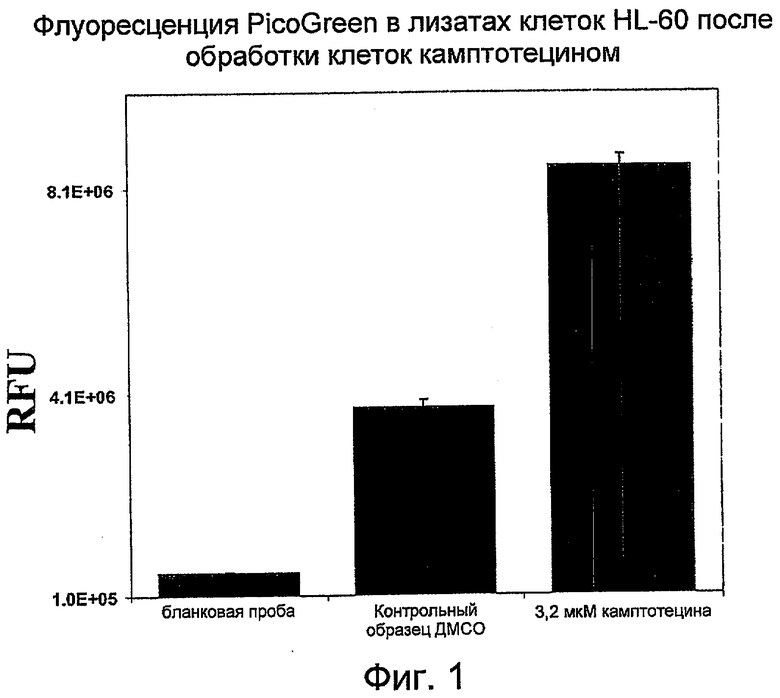
На Фиг.1 показано изменение интенсивности флуоресценции PicoGreen в относительных единицах флуоресценции (RFU) в лизатах HL-60 после обработки клеток камптотецином (кампто) или ДМСО (контроль). (RFU- относительные единицы флуоресценции; ДМСО - диметилсульфоксид).
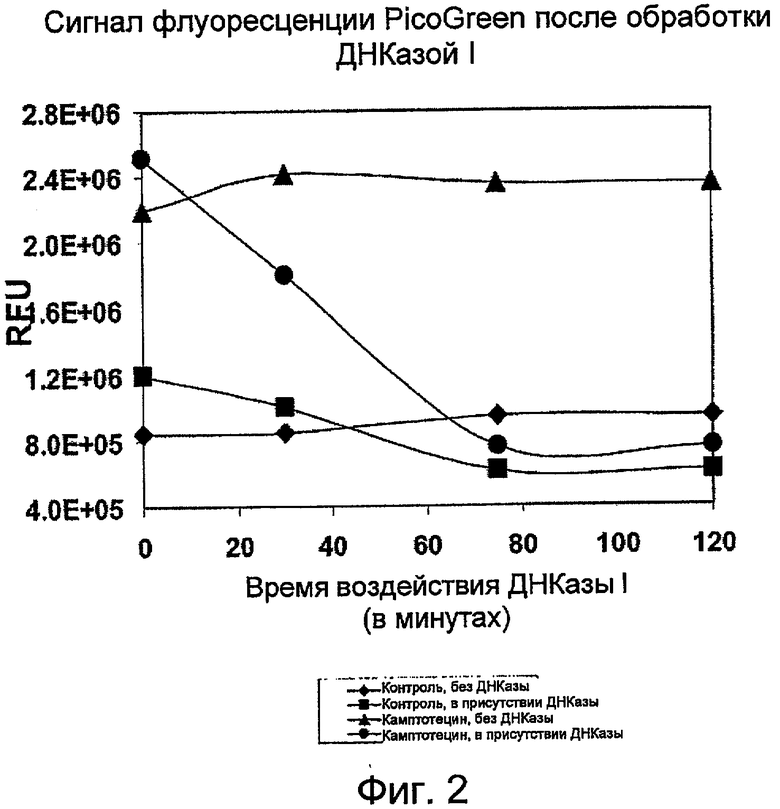
На Фиг.2 показана зависимость интенсивности сигнала флуоресценции PicoGreen (RFU - относительные единицы флуоресценции) от уровня ДНК в лизатах клеток после обработки клеток HL-60 камптотецином (кампто). (RFU - относительные единицы флуоресценции).
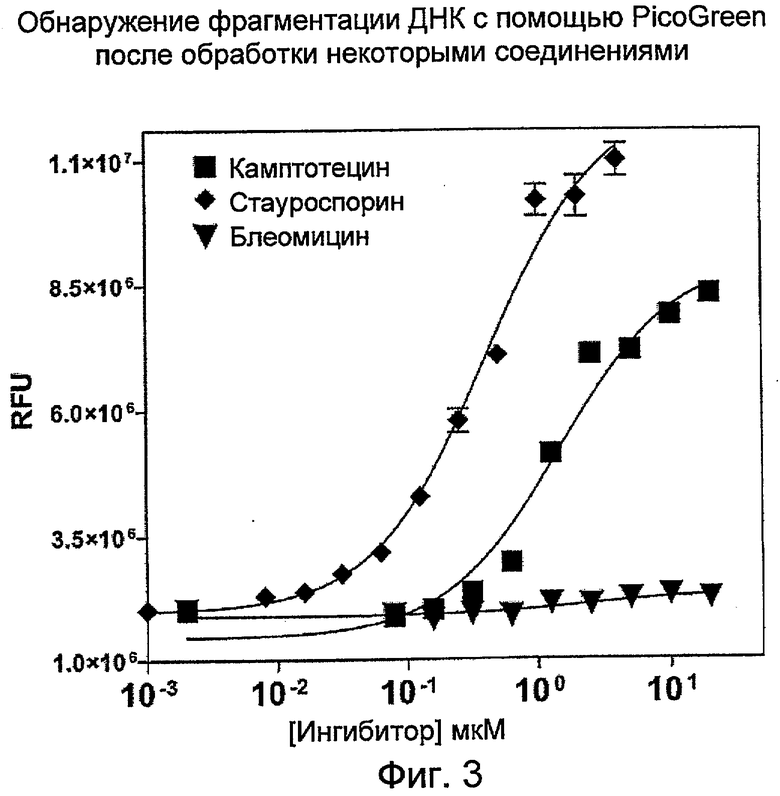
На Фиг.3 показаны эффекты воздействия некоторых соединений, например, камптотецина (кампто), стауроспорина и блеомицина на фрагментацию ДНК в клетках HL-60, регистрируемую с помощью PicoGreen. (RFU - относительные единицы флуоресценции).
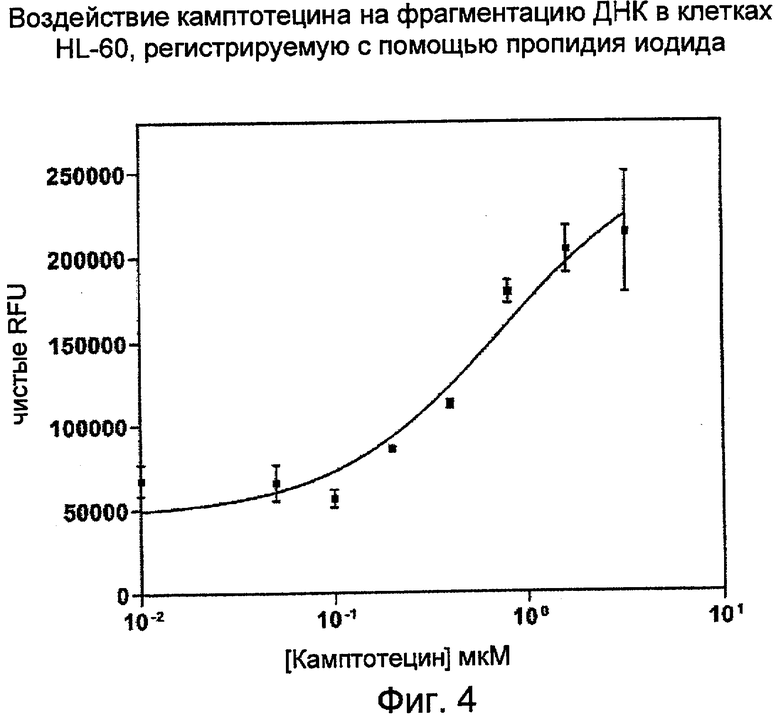
На Фиг.4 показаны эффекты воздействия камптотецина (кампто), на фрагментацию ДНК в клетках HL-60, регистрируемую с помощью пропидия иодида. (RFU - относительные единицы флуоресценции).
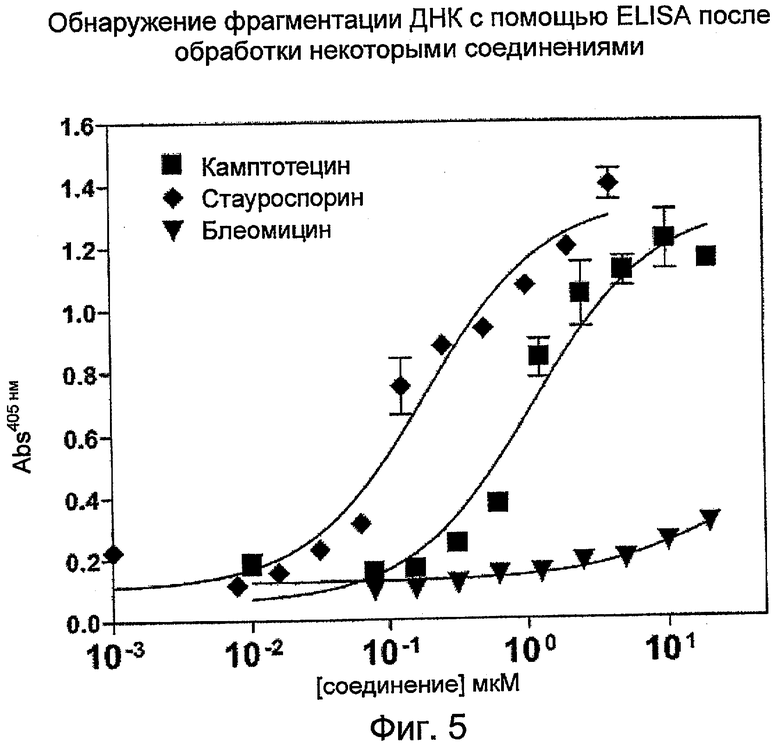
На Фиг.5 показаны эффекты воздействия камптотецина (кампто), стауроспорина и блеомицина на фрагментацию ДНК в клетках HL-60, регистрируемую с помощью ELISA. (Abs - поглощение)
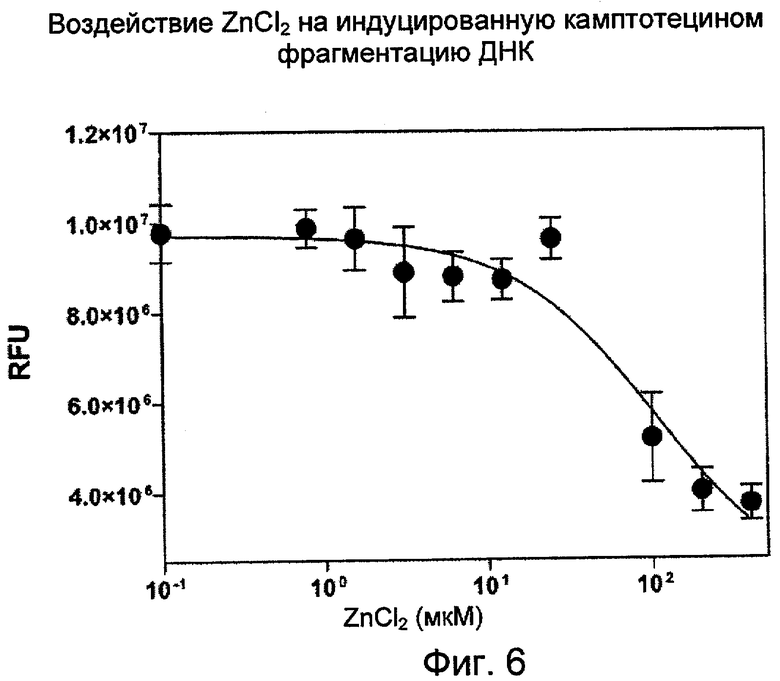
На Фиг.6 показан эффект воздействия ингибитора апоптоза, ZnCl2, на вызванную камптотецином фрагментацию ДНК, регистрируемую с помощью PicoGreen. (RFU - относительные единицы флуоресценции).
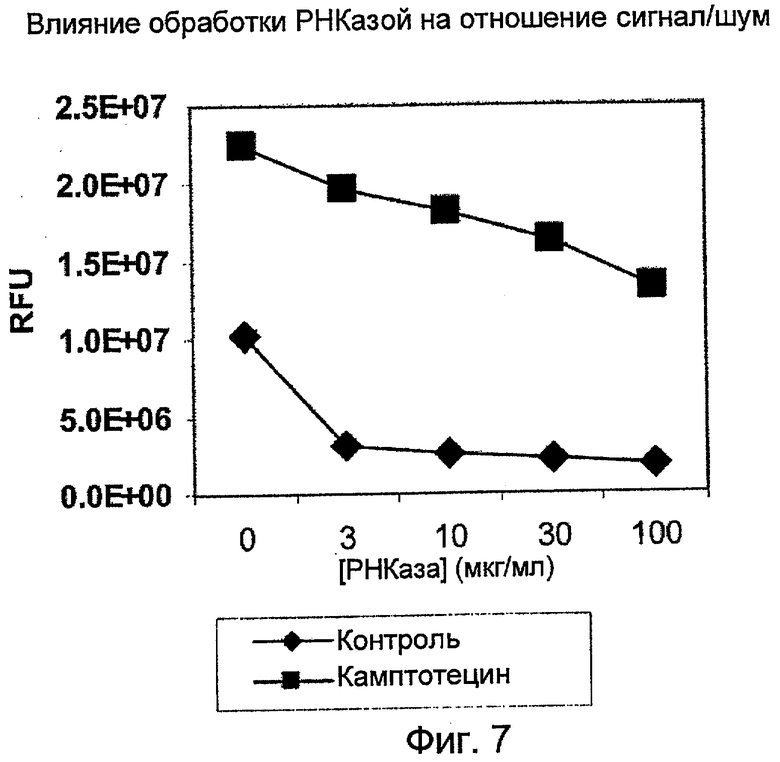
На Фиг.7 показано, что обработка РНКазой улучшает отношение сигнал/шум для фрагментации ДНК в лизатах клеток HL-60, регистрируемой с помощью PicoGreen. (RFU - относительные единицы флуоресценции).
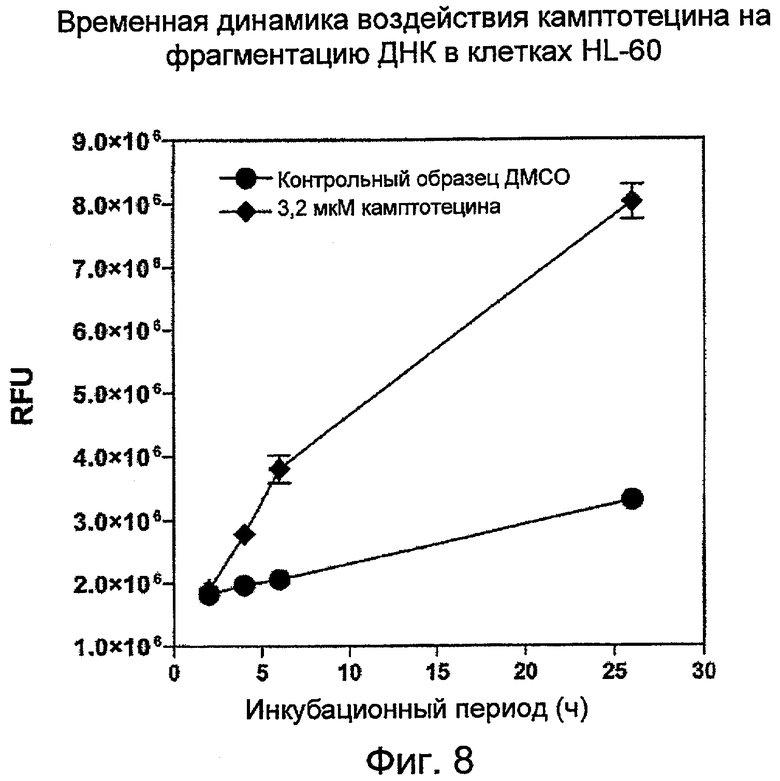
На Фиг.8 показана временная динамика воздействия камптотецина (кампто) на фрагментацию ДНК, регистрируемую с помощью PicoGreen в лизатах HL-60. (RFU - относительные единицы флуоресценции; ч. - час; ДМСО - диметилсульфоксид).
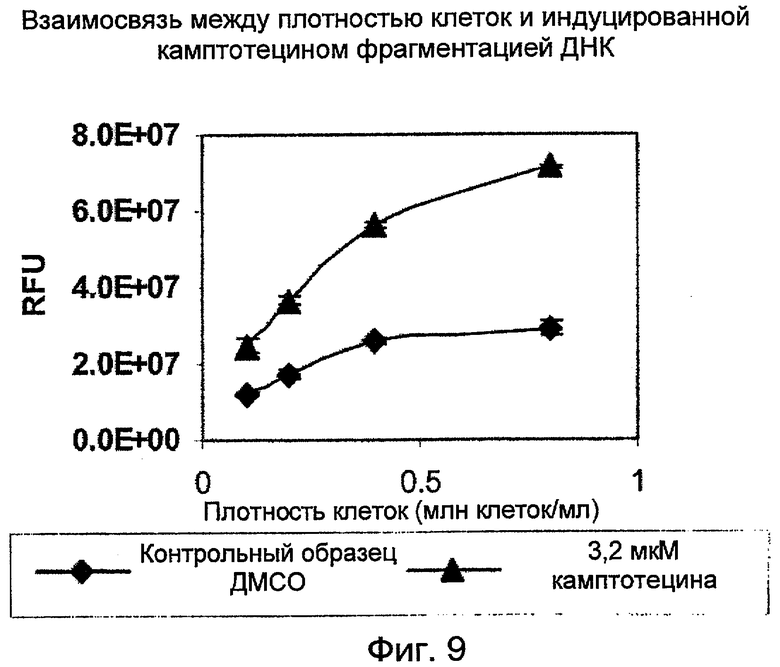
На Фиг.9 показан эффект влияния плотности клеток HL-60 на фрагментацию ДНК, регистрируемую с помощью PicoGreen в лизатах HL-60. (RFU, относительные единицы флуоресценции; ДМСО, диметилсульфоксид).
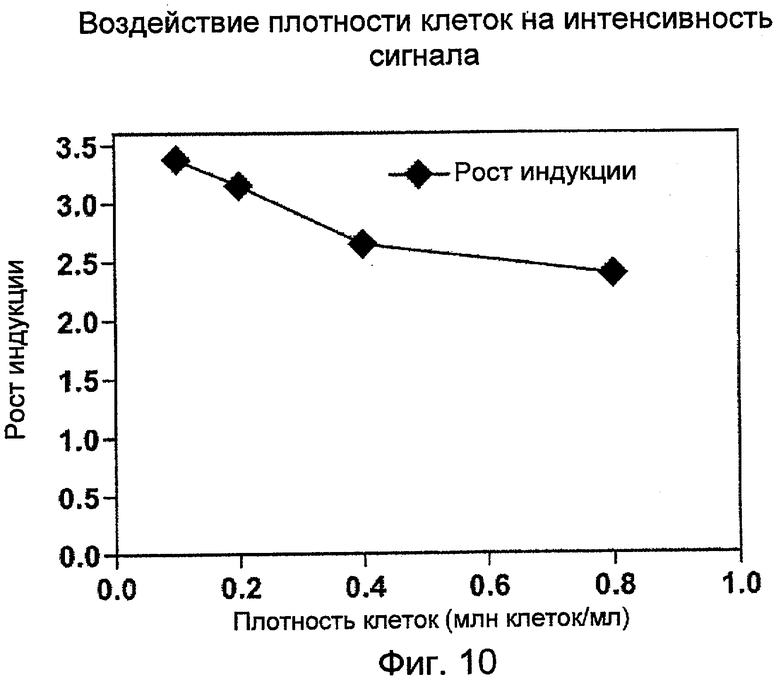
На Фиг.10 показан рост индукции сигнала фрагментации ДНК в присутствии PicoGreen в зависимости от плотности клеток HL-60.
На Фиг.11 показан эффект воздействия концентраций ДМСО на клетки HL-60. (RFU - относительные единицы флуоресценции; ДМСО - диметилсульфоксид)
На Фиг.12 показана индукция фрагментации ДНК, обнаруживаемая по PicoGreen, после инкубации клеток HL-60 с валиномицином, винбластином или винкристином.
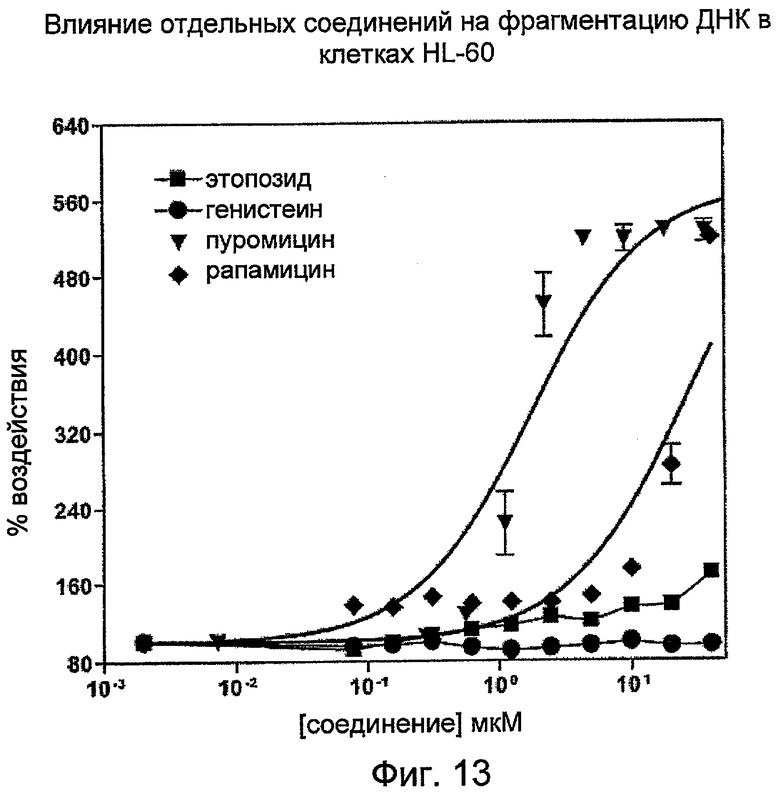
На Фиг.13 показана индукция фрагментации ДНК, обнаруживаемая по PicoGreen, после инкубации клеток HL-60 с этопозидом, генистеином, пуромицином или рапамицином.
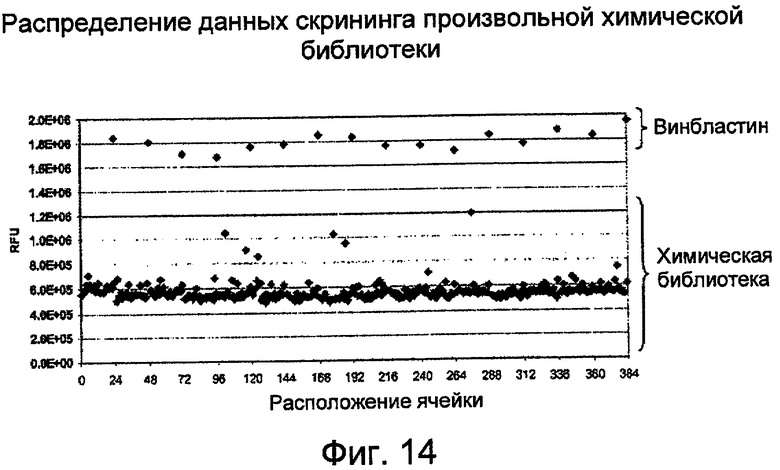
На Фиг.14 показано распределение данных скрининга произвольной химической библиотеки при обнаружении фрагментации ДНК в лизатах HL-60 с помощью PicoGreen. (RFU - относительные единицы флуоресценции).
Подробное описание изобретения
Все публикации, цитируемые в настоящем документе, в силу ссылки на них включаются в настоящий документ. Если не указано иначе, все технические и научные термины, используемые в настоящем документе, имеют такое же значение, которое общеизвестно рядовым специалистам в области, к которой относится настоящее изобретение.
Терминология, используемая в настоящем описании и прилагаемой формуле изобретения, предназначена исключительно для характеристики конкретных приложений, и ее использование в описании не подразумевает какого-либо ограничения изобретения. Формы единственного числа того или иного слова подразумевают охват форм множественного числа, если только в контексте не указано иное. Например, формы единственного числа для конкретных и общих терминологических определений также включают и формы множественного числа. Кроме того, ссылки на тот или иной агент могут относиться к смеси двух или более агентов. Поэтому термин «агент» включает множество агентов, в том числе смеси и/или их энантиомеры. Следует также отметить, что термин «или» обычно имеет свой основной смысл, в том числе «и/или», если только содержание однозначно не указывает на обратное. Кроме того, следует понимать, что термины «включает» и/или «включающий» при использовании в настоящем описании определяют наличие указанных особенностей, стадий, элементов и/или компонентов, но не отрицают наличия или добавления одной или нескольких иных особенностей, стадий, элементов, компонентов и/или их групп.
Кроме того, в соответствии с настоящим изобретением в рамках ноу-хау могут использоваться стандартные методики молекулярной биологии, микробиологии и технологии рекомбинантной ДНК. Содержание таких методик подробно изложено в литературе. См., например, Sambrook, Fritsch & Maniatis, Molecular Cloning: A Laboratory Manual, Second Edition (1989) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (далее "Sambrook et al., 1989"); DNA Cloning: A Practical Approach, Volumes I and II (D.N.Glover ed. 1985); Oligonucleotide Synthesis (M.J.Gait ed. 1984); Nucleic Acid Hybridization [B.D.Hames & S.J.Higgins eds. (1985)]; Transcription And Translation [B.D.Hames & S.J.Higgins, eds. (1984)]; Animal Cell Culture [R.I.Freshney, ed. (1986)]; Immobilized Cells And Enzymes [IRL Press, (1986)]; B.Perbal, A Practical Guide To Molecular Cloning (1984); F.M.Ausubel et al. (eds.), Current Protocols in Molecular Biology, John Wiley & Sons, Inc. (1994).
Поэтому осуществлением настоящего изобретения является способ идентификации агента, который влияет на образование фрагментов ДНК, и такой способ включает: (a) подготовку клеток в наборе приемников; (b) добавление агента, по крайней мере, к одному приемнику; (c) инкубирование агента с клетками в течение заранее определенного периода времени; (d) лизирование клеток; (e) добавление обнаруживаемого соединения, способного к интеркаляции во фрагменты ДНК, по крайней мере, к одному указанному приемнику; (f) измерение количества интеркалированного обнаруживаемого соединения; и (g) сравнение количества интеркалированного обнаруживаемого соединения с контролем с целью определить разницу, что позволяет идентифицировать указанный агент как модифицирующий агент, если разница превышает заранее установленный предел.
Анализ позволяет обнаруживать фрагменты ДНК. Фрагменты ДНК могут представлять собой небольшие фрагменты двуцепочечной ДНК (дцДНК) в цитоплазматической фракции лизатов клеток и фрагменты дцДНК, выделенные апоптотическими клетками в среду. Кроме того, фрагменты ДНК могут представлять собой фрагменты одноцепочечной ДНК (оцДНК) в цитоплазматической фракции лизатов клеток и фрагменты оцДНК, выделенные апоптотическими клетками в среду. В одном из осуществлений изобретения анализ используется для измерения спонтанного апоптоза, например, среди прочего, апоптоза во время совместного культивирования в присутствии или в отсутствие различных типов клеток или в различных условиях культивирования. Поэтому образование фрагмента ДНК может индуцироваться удалением ингредиента из культуральной среды, например, фетальной бычьей сыворотки. В другом осуществлении изобретения анализ используется для оценки отсутствия апоптоза. В еще одном осуществлении в ходе обработки клеток агентом может оцениваться наличие или рост уровня апоптоза, или отсутствие или снижение уровня апоптоза. В еще одном осуществлении изобретения анализ используется для измерения выживания или пролиферации клеток.
Еще одним осуществлением настоящего изобретения является способ идентификации агента, который влияет на образование фрагментов ДНК, и такой способ включает: (a) подготовку клеток в наборе приемников; (b) добавление соединения, выбираемого из группы, состоящей из индуктора, ингибитора, модулятора, модулятора индуктора и модулятора ингибитора, по крайней мере, к одному приемнику; (c) инкубирование компонента с клетками в течение заранее определенного периода времени; (d) добавление агента к указанному, по крайней мере, одному приемнику; (е) инкубирование агента с клетками в течение заранее определенного периода времени; (f) лизирование клеток; (g) добавление обнаруживаемого соединения, способного к интеркаляции во фрагменты ДНК, к указанному, по крайней мере, одному приемнику; (h) измерение количества интеркалированного обнаруживаемого соединения; и (i) сопоставление количества интеркалированного обнаруживаемого соединения с контролем с целью определить разницу, что позволяет идентифицировать указанный агент как модифицирующий агент, если разница превышает заранее установленный предел.
Такие усовершенствования, как добавление индуктора, ингибитора или модулятора вместе с агентом на одной стадии, вполне соответствуют уровню знаний и способностям квалифицированного специалиста и рассматриваются как различные осуществления настоящего изобретения.
Одним из осуществлений изобретения является компонент, который влияет на образование фрагментов ДНК за счет воздействия на апоптоз, выживание или пролиферацию клеток. Компонент выбирается из группы, включающей индуктор, ингибитор, модулятор, модулятор индуктора и модулятор ингибитора.
Выживание клеток представляет собой способность клеток сохранять жизненные функции в благоприятных или неблагоприятных условиях. Неблагоприятные условия включают, среди прочего, присутствие одного или нескольких токсичных компонентов, удаление питательных веществ или недостаток кислорода. В качестве одного из множества примеров - некоторые раковые клетки увеличивали экспрессию белков выживания, например, Bcl2, что делало такие клетки устойчивыми к апоптозу. Другие раковые клетки вырабатывали механизмы, которые обеспечивали более высокую выживаемость клеток или их меньшую склонность к апоптозу в условиях пониженного уровня кислорода.
Пролиферацией клеток называется увеличение их количества. Ко множеству примеров пролиферации клеток относятся увеличение количества клеток в результате их нормального деления, индукция деления клеток или ингибирование их гибели.
Одним из осуществлений настоящего изобретения является способ идентификации агента, который влияет на образование фрагментов ДНК в клетках, проходящих апоптоз. Вместе с тем настоящее изобретение не ограничивается какой-либо конкретной формой гибели клеток. Изобретение может применяться к любому механизму гибели клеток, где терминальным процессом является фрагментация ДНК.
Термин «ингибитор» включает любое лекарство, химическое вещество, белок или белковый фрагмент, способный блокировать, прерывать или предупреждать клеточный ответ, активность или канал, связанные с апоптозом, выживанием или пролиферацией клеток. Кроме того, ингибитором может быть, например, молекулярный шаперон, антитело или ингибирующая РНК (РНКи), которые блокируют экспрессию клеточных белков, тем самым прямо или косвенно ингибируя каналы воздействия. «Ингибитором» может быть регулирование условий культивирования, например увеличение или уменьшение уровня кислорода или изменение компонентов среды, так чтобы блокировать, прервать или предотвратить клеточный ответ.
Термин «индуктор» включает любое лекарство, химическое вещество, белок или белковый фрагмент, способный инициировать или стимулировать клеточный ответ, активность или канал, связанные с апоптозом, выживанием или пролиферацией клеток. Кроме того, индуктором может быть, например, молекулярный шаперон, антитело или ингибирующая РНК (РНКи), которые блокируют экспрессию клеточных белков, тем самым устраняя ингибирование или напрямую инициируя или стимулируя клеточный ответ, активность или канал воздействия. «Индуктором» может быть регулирование условий культивирования, например увеличение или уменьшение уровня кислорода, или изменение компонентов среды, так чтобы блокировать, прервать или предотвратить клеточный ответ.
Термин «модулятор» включает любое лекарство, химическое вещество, белок или белковый фрагмент, способный корректировать интенсивность, долю или характеристики клеточного ответа, активности или канала, связанного с апоптозом, выживанием или пролиферацией клеток. Кроме того, модулятором может быть, например, молекулярный шаперон, антитело или ингибирующая РНК (РНКи), которые блокируют экспрессию клеточных белков, тем самым устраняя ингибирование или индуцируя клеточный ответ, активность или канал воздействия. «Модулятором» может быть регулирование условий культивирования, например, увеличение или уменьшение уровня кислорода, или изменение компонентов среды, так чтобы блокировать, прервать или предотвратить клеточный ответ.
В еще одном осуществлении изобретения модулятор может использоваться в сочетании с индуктором, так что модулятор индуктора делает индуктор более эффективным (например, приводя к более активному клеточному ответу) или менее эффективным (например, приводя к пониженному клеточному ответу). Модулятор ингибитора делает ингибитор менее эффективным (например, более активный клеточный ответ) или более эффективным (например пониженный клеточный ответ).
Ингибиторы, индукторы или модуляторы могут использоваться для имитации каналов воздействия или характеристик болезненных состояний. В качестве одного из множества показательных примеров - одним из осуществлений настоящего изобретения будет возможность индуцировать апоптоз с помощью β-амилоидных фрагментов для имитации характеристик болезни Альцгеймера в присутствии или в отсутствие потенциальных модуляторов, например воспалительных цитокинов. Еще один из множества наглядных примеров - применение настоящего изобретения для идентификации агентов, которые стимулируют апоптоз в одном или нескольких аспектах рака. В рамках такой парадигмы предположительное применение настоящего изобретения подразумевает количественное определение способности испытываемого агента индуцировать или усиливать апоптоз в раковых клетках, тканях или органах. Индуктор апоптоза может обладать широким спектром действия, охватывая множество каналов, ведущих к гибели клетки. В альтернативном варианте, индуктор апоптоза может обладать высокой специфичностью к единичному каналу апоптоза или ограничиваться воздействием на конкретное заболевание или патологическое состояние. Поэтому осуществление настоящего изобретения включает способ скрининга для идентификации испытываемого агента, который может корректировать болезненное состояние, при котором предположительно происходит ингибирование апоптоза, например рак. К таким формам рака, среди прочего, относятся острая миелоидная лейкемия, множественная миелома, не-Ходжкинская лимфома, хроническая лимфоцитарная лейкемия и солидные опухоли.
Другим осуществлением настоящего изобретения является использование более одного индуктора, ингибитора или модулятора. Применение более одного индуктора, ингибитора или модулятора может, среди прочего, приводить к аддитивным эффектам, обратному действию, синергическим эффектам или воздействовать на различные каналы.
В одном из осуществлений изобретения используется интеркалирующее поддающееся обнаружению соединение. Одним из множества примеров является интеркалирующий флуоресцентный краситель. Интеркаляторы обычно представляют собой гетероароматические полициклические молекулы, которые встраиваются между двумя парами оснований в дуплексе ДНК. Вместе с тем изобретение не ограничивается гетероароматическими полициклическими молекулами. Любая интеркалирующая молекула, которая демонстрирует заметное усиление флуоресценции или сдвиг эмиссии или параметра (параметров) возбуждения в присутствии фрагментов ДНК в условиях незначительного или полного отсутствия неселективного связывания с РНК или белками, входит в сферу охвата настоящего изобретения. Такие интеркалирующие красители хорошо известны специалистам в области и, среди прочего, включают бис-бензимидный краситель Hoechst 33258. Другим удобным интеркалирующим обнаруживаемым соединением является пропидия иодид. В одном из осуществлений настоящего изобретения используется PicoGreen. PicoGreen относится к семейству несимметричных монометинцианиновых красителей. Он обладает высокими константами связывания с ДНК и демонстрирует высокую интенсивность флуоресценции при связывании с ней, при этом практически не проявляя флуоресцентных свойств в свободном состоянии в растворе. В еще одном осуществлении изобретения используется пропидия иодид. Кроме того, некоторые интеркалирующие соединения в состоянии связываться с оцДНК, например TOTO (Nucleic Acids Res. 23:1215-1222, 1995) и OliGreen (Molecular Probes, кат. №07582, кат. №011492). В еще одном осуществлении изобретения используются проникающие через мембрану зонды ДНК, например, BENA435 (Nucleic Acids Res. 34:), и за счет этого можно избавиться от необходимости лизирования клеток, чтобы ввести метку в ДНК. В другом применении настоящего изобретения используются YOPRO, Hoechst 33342, DAPI и DRAQ5.
Круг интеркалирующих обнаруживаемых молекул не ограничивается флуоресцентными красителями. Количество фрагментов ДНК может определяться с использованием любой методологии, известной специалистам в области. Количество интеркалирующих молекул, включенных в ДНК, может определяться с помощью меток, в том числе, среди прочих, радиоизотопных или активирующих сцинтиллятор соединений. К методам обнаружения, среди прочих, относятся пептидные метки, ферментативная активность, поглощение, флуоресценция, время-разрешенная флуоресценция, поляризованная флуоресценция, резонансный перенос энергии флуоресценции, люминесценция, резонансный перенос энергии биолюминесценции, радиоактивная метка и сцинтилляционное сближение или другие методы, широко используемые в данной области. В еще одном применении могут использоваться методы косвенной метки, в том числе, среди прочих, применение меченых антител, использование взаимодействия стрептавидин-биотин, аффинные реагенты, образующие хелаты с металлами, или аффинные реагенты GST-глутатиона. Любой прямой или косвенный метод метки, известный специалистам в области, рассматривается как входящий в сферу охвата настоящего изобретения. В еще одном осуществлении количество ДНК может определяться по поглощению на 260 нм (А260).
Еще одно осуществление изобретения включает отделение хромосомной ДНК от фрагментов ДНК до измерения количества интеркалировавшего обнаруживаемого соединения. Отделение хромосомальной ДНК от фрагментов ДНК может проводиться с использованием методов, известных специалистам в области. Среди множества примеров - центрифугирование, фильтрация, седиментация, электрофорез, гель-фильтрация, аффинная очистка и осаждение. Для отделения или удаления хромосомальной ДНК от фрагментов ДНК специалист в данной области может использовать любой метод разделения.
Одно из осуществлений настоящего изобретения предусматривает лизирование клеток. Лизирование клеток может осуществляться добавлением детергента, содержащего лизирующий буфер. При этом изобретение не ограничивается использованием детергента в лизирующем буфере, но может включать любой метод, который подходит для лизирования клеток. Например, лизирование клеток может проходить под действием гипотонического буфера, ультразвуковой обработкой или в цикле замораживание/оттаивание. Другие методы лизирования также хорошо известны специалистам в данной области.
В еще одном осуществлении настоящего изобретения используется свободная от ДНКаз РНКаза для удаления РНК из лизатов клеток с целью увеличить отношение сигнал/шум за счет уменьшения фонового сигнала флуоресценции, связанного с эндогенной клеточной РНК.
Осуществление настоящего изобретения предусматривает использование набора приемников, в которые могут помещаться клетки и другие материалы, например культуральные среды. Набор приемников может представлять собой любое количество приемников от по крайней мере одного до нескольких приемников, пригодных для помещения клеток в соответствии с охватом настоящего изобретения. К примерам, среди прочего, относятся колбы, чашки для культивирования, пробирки, например пробирки на 1,5 мл, 12-ячеечные планшеты, 96-ячеечные планшеты, 384-ячеечные планшеты и миниатюрные планшеты для микротитрования с около 4000 приемных ячеек (заявка U.S. Patent Application 20050255580). Набор приемников можно усовершенствовать, дополнив его защитной крышкой, тем самым исключив попадание загрязнений или испарение содержимого.
Дополнительной особенностью приемников является то, что в них можно проводить анализ, к примерам такого анализа относятся спектрофотометрический анализ, сцинтилляционный счет и измерения флуоресценции. Тем не менее это не является ограничением для приемников, которые могут использоваться в рамках охвата настоящего изобретения, с учетом того что образцы можно перенести в подходящую емкость, пригодную для дальнейшего анализа. Один из множества примеров предполагает такую модификацию способа, которая предусматривает подготовку второго набора приемников, причем стадия лизирования клеток дополнительно включает отделение супернатанта от клеточных остатков, а следующая стадия далее включает добавление обнаруживаемого соединения, способного к интеркаляции во фрагменты ДНК, по крайней мере к одному приемнику указанного второго набора, содержащего образец указанного отделенного супернатанта.
В одном из применений настоящего изобретения используется контроль. Контроль представляет собой термин, хорошо понятный квалифицированным специалистам в данной области. Надлежащий контроль может зависеть от используемых параметров анализа или исследуемой экспериментальной проблемы. Контролем может быть конкретный набор условий анализа или добавление в культуральную среду или удаление из нее конкретного соединения. Контроль может рассматриваться как положительный контроль, в том случае если условия анализа или добавленное контрольное соединение обеспечивают ожидаемый ответ. Например, если ожидается, что исследуемый агент вызывает апоптоз, положительным контролем будет соединение, которое является известным индуктором апоптоза. Одним из примеров положительного контроля является добавление винбластина сульфата. Контроль также может быть отрицательным. Отрицательным контролем может быть конкретный набор условий анализа, а также добавление в культуральную среду или удаление из нее конкретного соединения, которое будет вызывать ожидаемый отклик. Например, если ожидается, что исследуемый агент вызывает апоптоз, отрицательным контролем будет соединение, которое, предположительно, не приводит к апоптозу. Контролем может быть «носитель». Например, если испытываемый агент растворяется в ДМСО, тогда контролем с использованием носителя может быть ДМСО без испытываемого агента. Контролем может быть и просто использование полученных в прошлом данных.
В одном из осуществлений изобретения используются имеющиеся в продаже клеточные линии. Например, клетки, которые пригодны для использования, можно приобрести у American Tissue Culture Company. В одном из применений используются клетки HL-60. Клетки могут быть прокариотическими или эукариотическими. Настоящее изобретение не ограничивается видом используемых клеток. Могут также применяться первичные культуры. Недифференцированные клетки можно подвергать воздействию различных агентов, которые вызывают их дифференциацию в конкретный фенотип. Например, в одном из применений изобретения используются клетки-предшественники, которые после индуцирования дифференцируются в олигодендроциты. Конкретный тип используемых клеток можно выбрать с помощью маркеров, специально экспрессированных в соответствии с желаемым типом клеток, или, в альтернативном варианте, за счет потери конкретного маркера (маркеров). Клетки можно отделять или сортировать с помощью таких методов, как проточная цитометрия, которые широко используются квалифицированными специалистами в области.
В одном из применений настоящего изобретения используется однородная популяция клеток. В альтернативном применении настоящего изобретения используется неоднородная популяция клеток. Для проведения анализа в рамках настоящего изобретения можно использовать клетки любого типа и в любой пропорции.
Клетки могут быть получены из биологического образца. К биологическим образцам, среди прочего, могут относиться ткани или жидкости, срезы тканей, например образцы биопсии или вскрытия, а также замороженные срезы, взятые для гистологического анализа. Такие образцы включают кровь, слюну, ткани, культивированные клетки, например первичные культуры, эксплантаты и трансформированные клетки, кал, мочу и пр. Биологический образец может быть взята у эукариотического организма, в том числе у млекопитающего, например примата, такого как шимпанзе, макака или человек; коровы, собаки, кошки, грызуна, в том числе морской свинки, крысы, мыши, кролика, или птицы, рептилии или рыбы.
В другом осуществлении настоящего изобретения используются клетки, которые были временно или стабильно трансформированы, так чтобы обеспечить сверхэкспрессию или исключить экспрессию по крайней мере одного белка и определить, влияет ли такая экспрессия или ее отсутствие на фрагментацию ДНК. Экспрессия может быть индуцированной или конститутивной. Агенты могут проверяться на способность влиять на фрагментацию ДНК в трансформированных клетках. Кроме того, испытываемые агенты могут проверяться на способность влиять на фрагментацию ДНК в трансфектированных клетках в присутствии или в отсутствие индукторов или ингибиторов апоптоза. Такое применение может рассматриваться как контроль.
Рекомбинантный вектор экспрессии, представленный в изобретении, включают молекулу нуклеиновой кислоты в форме, подходящей для экспрессии нуклеиновой кислоты в клетке-хозяине. Таким образом, рекомбинантные векторы экспрессии настоящего изобретения могут содержать одну или несколько регуляторных последовательностей, выбранных на основе клетки-реципиента, используемой для экспрессии, причем эта последовательность функционально связана с нуклеиновой кислотой, которая должна быть экспрессирована. По отношению к рекомбинантному вектору экспрессии выражение «функционально связанный» призвано означать, что представляющая интерес последовательность нуклеотидов связана с регуляторной последовательностью (последовательностями) таким способом, который обеспечивает экспрессию последовательности нуклеотидов (например в системе транскрипции/трансляции «in vitro» или в клетке-хозяине, если вектор введен в клетку-хозяина). Термин «регуляторная последовательность» включает промоторы, энхансеры и другие элементы, контролирующие экспрессию (например сигналы полиаденилирования). Такие регуляторные последовательности описаны, например, в Goeddel, Gene Expression Technology: Methods in Enzymology Vol. 185, Academic Press, San Diego, Calif. (1990). Регуляторные последовательности включают направляющие конститутивную экспрессию последовательности нуклеотидов во многих типах клеток-хозяев (например специфичные к тканям регуляторные последовательности). Специалистам известно, что структура вектора экспрессии может зависеть от таких факторов, как выбор клетки-хозяина для трансформации, желаемый уровень экспрессии белка и т.д. Векторы экспрессии настоящего изобретения могут вводиться в клетки-хозяева для выработки белков или пептидов, кодированных нуклеиновыми кислотами, как это описано в настоящем документе.
Используемый в настоящем документе термин «сверхэкспрессия» относится к экспрессии полипептида (например молекулы, которая может быть задействована в апоптозе или механизмах выживания клеток) в той или иной клетке на уровне, превышающем нормальный уровень экспрессии полипептида в клетке, которая обычно экспрессирует полипептид, или в клетке, которая обычно не обеспечивает экспрессии полипептида. Например, уровень экспрессии полипептида может составлять 10%, 20%, 30%, 40%, 50%, 60%, 70, 80%, 90%, 100% или более по сравнению с экспрессией полипептида в немутантной клетке, которая обычно экспрессирует полипептид. Возможна сверхэкспрессия мутантов, вариантов или аналогов представляющего интерес полипептида.
Используемый в настоящем документе термин «транзиторная» экспрессия относится к экспрессии экзогенной молекулы (молекул) нуклеиновых кислот, которые отделены от хромосом клетки. Транзиторная экспрессия обычно достигает своего максимума через 2-3 дня после введения экзогенной нуклеиновой кислоты, а затем постепенно снижается.
Используемый в настоящем документе термин «стабильная» экспрессия относится к экспрессии экзогенной молекулы (молекул) нуклеиновых кислот, которые являются частью хромосом клетки. В общем случае векторы стабильной экспрессии генов включают один или несколько маркеров селекции.
Методы культивирования клеток для трансформированных, нетрансформированных образцов, первичных культур и биологических образцов хорошо известны специалистам в области. Биологические образцы или культивированные клетки могут храниться, пока не потребуется их использование. Среды, используемые для культивирования, могут готовиться специально или приобретаться из коммерческих источников.
В настоящем изобретении приводятся способы идентификации (например скрининга, обнаружения, характеризации, анализа и количественного определения) агентов, которые оказывают влияние на образование фрагментов дцДНК и оцДНК. Термин «агент», «испытываемый агент», «испытываемое соединение», «потенциальное лекарство» или «модулятор» или их грамматические эквиваленты, используемые в настоящем документе, описывает любую молекулу, как существующую в природе, так и синтетическую, например белок, олигопептид (например длиной примерно от 5 до 25 аминокислот, предпочтительно длиной примерно от 10 до 20 или от 12 до 18 аминокислот, предпочтительно длиной 12, 15 или 18 аминокислот), малую органическую молекулу, полисахарид, липид (например сфинголипид), жирную кислоту, полинуклеотид, олигонуклеотид и пр., которая используется в анализах, описанных в настоящем изобретении, и анализируется для установления способности влиять на фрагментацию ДНК или апоптоз. Не существует конкретных ограничений в отношении соединения, которое может использоваться для анализа. К примерам относятся отдельные агенты или библиотеки малых, средних или высокомолекулярных химических соединений, очищенные белки, продукты экспрессии генных библиотек, библиотеки синтетических пептидов, клеточные экстракты и супернатанты культур. Термин агент включает любую комбинацию различных агентов.
Агент может включать по крайней мере один или несколько растворимых и нерастворимых факторов, компоненты клеточной матрицы, кондиционированные среды, клеточные экстракты, экстракты тканей, эксплантаты, модификаторы рН, газы, модификаторы осмотического давления, модификаторы ионной силы, вирусы, ДНК, РНК или фрагменты генов. Агент может быть в форме библиотеки испытываемых агентов, например комбинаторной или рандомизированной библиотеки, которая обеспечивает достаточный диапазон разнообразия или, напротив, ограничена сходными структурами или характеристиками. Агенты могут быть дополнительно связаны с партнером слияния, например соединениями направленной доставки, спасающими соединениями, соединениями димеризации, стабилизирующими соединениями, адресуемыми соединениями и другими функциональными компонентами. Обычно для создания новых химических объектов с полезными свойствами выбирают испытываемый агент (называемый «ведущим соединением» или «ведущим») с рядом желательных свойств или активностью, например ингибирующей активностью или модулирующей активностью. Затем ведущее соединение используется как основа для создания вариантов ведущего соединения и дальнейшей оценки свойств и активности таких вариантов.
Тот или иной агент может включать условия обработки и регулирование внешних или внутренних условий или среды. Одним из множества примеров такого агента является ультрафиолетовый свет.
Одно из осуществлений изобретения предусматривает его использование в методах высокопроизводительного скрининга (ВПС). ВПС является автоматизированным одновременным методом тестирования тысяч различных химических соединений в анализах, призванных моделировать биологические механизмы или аспекты патологий заболеваний. Несколько соединений, например набор соединений, могут тестироваться одновременно, например в одной партии. В одном из осуществлений термин метода скрининга ВПС относится к анализам, в ходе которых тестируется способность одного соединения или набора соединений влиять на выбранные показатели.
Системы для работы с жидкостями, аналитическое оборудование, например планшеты-ридеры флуоресценции или сцинтилляционные счетчики и роботы для клеточных культур и манипуляций с образцами хорошо известны специалистам в области. Механические системы, например роботизированные манипуляторы или устройства точного выбора, доступны любому квалифицированному специалисту. Существуют серийно выпускаемые планшет-ридеры для анализа обычных 96-ячеечных или 384-ячеечных планшет. В наличии имеются ридеры единичных образцов, множества образцов или планшет, которые анализируют заранее определенные ячейки и готовят предварительные отчеты данных. Исходные данные могут преобразовываться и представляться самыми различными способами.
Одним из осуществлений настоящего изобретения является система анализа для идентификации агента, который влияет на образование фрагментов двуцепочечной ДНК, и такая система анализа включает: (a) набор приемников; (b) буфер лизирования; (c) обнаруживаемое соединение, способное к интеркаляции в двуцепочечную ДНК; и (d) по крайней мере, один компонент, где компонент выбирается из группы, состоящей из агента (агентов), индуктора (индукторов) апоптоза, ингибитора (ингибиторов) апоптоза, контроля и клеток.
Еще одним осуществлением изобретения является набор, включающий, по крайней мере, один элемент системы анализа и инструкции для применения. Таким образом, компоненты системы анализа могут предоставляться отдельно или вместе в виде набора. Компоненты системы анализа могут готовиться и включаться в набор в соответствии с методами, которые максимально увеличивают стабильность отдельных компонентов. Такие методы известны специалистам в области. Например, клетки системы анализа могут поставляться в форме суспензии или в лиофилизованном виде. Могут также присутствовать дополнительные компоненты системы, например буферы, контейнеры для смешения компонентов анализа, например планшеты для микротитрования или пробирки для тестирования. Система для анализа может поставляться в форме набора, который включает инструкции для проведения анализа и инструкции по обработке и интерпретации данных.
Одним из осуществлений изобретения является лекарственный препарат для модулирования образования фрагментов ДНК, включающий терапевтически эффективное количество агента, идентифицируемого с помощью способов настоящего изобретения, и фармацевтически приемлемый носитель.
Термин «терапевтически эффективное количество» относится к количеству агента, эффективному при лечении заболевания или расстройства у субъекта или млекопитающего. В случае рака терапевтически эффективное количество лекарства может уменьшать численность раковых клеток; сокращать размер опухоли; ингибировать (то есть в некоторой степени замедлять и, предпочтительно, останавливать) проникновение раковых клеток в периферические органы; ингибировать (то есть в некоторой степени замедлять и предпочтительно останавливать) метастазирование опухоли; в некоторой степени ингибировать рост опухоли; и/или в некоторой степени ослаблять один или несколько связанных с раком симптомов. В зависимости от того, насколько лекарство в состоянии предупреждать рост и/или уничтожать существующие раковые клетки, оно может быть цитостатическим и/или цитотоксическим. Пример рака не является единственным, поскольку агент, который влияет на образование фрагментов дцДНК или оцДНК, может применяться для множества различных заболеваний.
Лекарственный препарат для модуляции образования фрагментов ДНК может включать терапевтически эффективное количество агента, при котором агент модулирует образование фрагмента ДНК через рецепторный белок. Поэтому лекарственный препарат может включать испытываемый агент, который является агонистом, частичным агонистом, антагонистом или обратным агонистом. Кроме того, фармацевтический состав может включать испытываемый агент, который является пептидом, его пептидными фрагментами, когнатами, конгенерами, мимиками, аналогами или секретирующими клетками и их растворимыми молекулами. Еще одним из осуществлений изобретения является лекарственный препарат для модулирования образования фрагментов ДНК, включающий терапевтически эффективное количество идентифицируемого агента и фармацевтически приемлемый носитель, причем такой лекарственный препарат эффективно влияет на канал или механизм апоптоза.
Используемый в настоящем документе термин «агонист» относится к веществам (например, среди прочих, к лигандам и агентам), которые при связывании с рецептором вызывают внутриклеточный ответ или усиливают связывание ГТФ с мембранами.
Используемый в настоящем документе термин «частичный агонист» относится к веществам (например, среди прочих, к лигандам и агентам), которые при связывании с рецептором вызывают меньший по уровню/масштабам внутриклеточный ответ, чем агонисты, или по сравнению с ними в меньшей степени/масштабе усиливают связывание ГТФ с мембранами.
Используемый в настоящем документе термин «антагонист» относится к веществам (например, среди прочих, к лигандам и агентам), которые конкурентно связываются с рецептором в том же сайте, что и агонист. Вместе с тем антагонист не активирует внутриклеточный ответ, инициированный активной формой рецептора, и, тем самым, в состоянии ингибировать внутриклеточные отклики, вызванные агонистами или частичными агонистами. Соответственно, в отсутствие агониста или частичного агониста антагонисты не снижают исходный внутриклеточный ответ.
Используемый в настоящем документе термин «обратный агонист» относится к веществам (например, среди прочих, к лиганду и агенту), которые связываются с конститутивно активным рецептором и ингибируют исходный внутриклеточный ответ. Исходный отклик инициируется активной формой рецептора с уровнем активности ниже нормы, который наблюдается при отсутствии агонистов или частичных агонистов, или при уменьшении связывания ГТФ с мембранами.
Используемый в настоящем документе термин «лиганд» относится к веществу, которое связывается с другой молекулой, где таким веществом, среди прочих, может быть гормон или нейромедиатор, и где такое вещество относится к лигандам, стереоселективно связывающимся с рецептором.
Лекарственные препараты настоящего изобретения могут использоваться в сочетании с другими терапевтическими агентами. Например, при лечении рака лекарственный препарат может вводиться в сочетании с цитокинами или различными соединениями, используемыми для химиотерапии.
Еще одним осуществлением настоящего изобретения является способ диагностики или мониторинга лечения заболевания, при котором биомаркер заболевания предполагает образование фрагментов ДНК, и такой способ включает: (a) внесение биологического образца в набор приемников; (b) добавление обнаруживаемого соединения, способного к интеркаляции во фрагменты ДНК, по крайней мере, к одному приемнику; (c) измерение количества интеркалированного обнаруживаемого соединения; и (d) сравнение количества интеркалированного обнаруживаемого соединения со стандартом для определения различия, что позволяет осуществить диагностику или мониторинг лечения заболевания, в случае если различие превышает заранее установленное предельное значение.
Понятие биомаркера хорошо известно специалистам в области. Одним из множества примеров является использование термина биомаркер, с тем чтобы охватить любой физиологический отклик, фенотип или характеристику, которые могут использоваться для количественного или качественного описания определенного состояния клетки, организма и млекопитающего.
Биомаркер считается полезным для диагностики, мониторинга и прогнозирования заболевания или при мониторинге лечения заболевания, если его протекание значительно различается в разных подгруппах тестируемых биологических образцов. Уровни биомаркера считаются «значительно различающимися», если вероятность случайной идентификации конкретного биомаркера оказывается меньше заранее установленного значения. Метод расчета такой вероятности будет зависеть от конкретного метода, используемого для сопоставления уровней между подгруппами, например, t-критерий или подобные ему методы статистического анализа. Для специалистов в данной области будет очевидно, что заранее установленное предельное значение будет меняться в зависимости от числа использованных образцов.
Биологическим образцом могут быть образцы органов, взятые из органов животных или человека, образцы тканей, полученные из тканей животных или человека, а также образцы клеток, полученные из клеток животных или человека, или из клеточных культур. В случае экспериментов с животными биологические образцы включают ткани изучаемого органа, полученные после вскрытия или биопсии, а также жидкости организма, например кровь. Для клинического применения биомаркеров особенно предпочтительными образцами являются жидкости организма, например кровь, сыворотка, плазма, моча, синовиальная жидкость, ликвор, спинномозговая жидкость, сперма или лимфа, а также ткани тела, полученные с помощью биопсии.
Специалистам в области хорошо известно понятие стандарта. К стандартам может относиться, среди прочего, биологический образец здорового субъекта, причем таким субъектом может быть животное или человек. Кроме того, стандартом может быть биологический образец субъекта, не проходившего лечение. В альтернативном варианте стандарт может быть взят от того же субъекта до, во время и после лечения. Стандарт может быть от того же субъекта, но это может быть другая клетка, образец ткани или органа, отличающиеся от исходной клетки, ткани или органа, используемых для определения уровня биомаркера. Стандартом необязательно должен быть биологический образец, но может быть образец с известным количеством фрагментов ДНК.
Настоящее изобретение более подробно описывается в приведенных ниже примерах, которые не ограничивают сферы его охвата, изложенной в формуле изобретения. Несмотря на достаточно подробное описание и иллюстрации настоящего изобретения, позволяющие квалифицированным специалистам в данной области реализовать и использовать его, очевидны различные альтернативы, модификации и усовершенствования, не затрагивающие основной идеи и охвата настоящего изобретения. Квалифицированный специалист в данной области без труда оценит тот факт, что настоящее изобретение хорошо приспособлено для достижения цели и получения указанных и характерных для него результатов и преимуществ. Приведенные ниже примеры содержат описания осуществлений и не призваны ограничивать сферу охвата настоящего изобретения. Для специалистов в данной области будут очевидны приведенные в настоящем документе модификации и иные применения. Такие модификации не отходят от сути настоящего изобретения и определяются сферой охвата формулы изобретения. В приведенное в настоящем документе изобретение могут быть внесены различные изменения и модификации, не затрагивающие сущности и охвата изобретения.
Изобретение, наглядно описанное в настоящем документе, может применяться в отсутствие любого элемента или элементов, ограничения или ограничений, которые специально не раскрываются в настоящем документе. Применяемые термины и выражения используются в целях описания, а не для ограничения, и в использовании таких терминов и выражений нет никакого намерения исключить любые эквиваленты приведенных и описанных свойств или их части; напротив, признается возможность различных модификаций в рамках сферы охвата заявленного изобретения. Поэтому следует понимать, что несмотря на полное раскрытие настоящего изобретения в его основных осуществлениях и дополнительных характеристиках, специалисты в данной области могут вносить модификации и изменения в концепции, раскрываемые в настоящем документе, и что такие модификации и изменения считаются входящими в сферу охвата изобретения, которая определяется в прилагаемой формуле.
Пример 1
Обнаружение фрагментов ДНК с помощью PicoGreen:
Описываются общие условия и соображения по проведению анализа. Вместе с тем в приведенных ниже последующих примерах условия анализа меняли с целью проверить переменные и обеспечить соответствие целям эксперимента, и не для того чтобы обязательно ограничивать изобретение конкретными применениями.
HL-60 представляет собой линию клеток ОМЛ человека, выпускаемую ATCC (ATCC кат. № CCL-240™). Среду для клеточной культуры готовили следующим образом: 100 мл термоинактивированной фетальной бычьей сыворотки, 20 мл 1M HEPES (pH 7,5), 10 мл исходного раствора пенициллина/стрептомицина (см. таблицу 1) добавляли к 1 литру среды RPMI-1640. После тщательного перемешивания полученную среду фильтровали через стерилизованное устройство для фильтрования с диаметром пор 0,22 мкм (Nalgene). Среда для инкубирования готовилась следующим образом: 5 мл исходного раствора пенициллина/стрептомицина и 25 мл термоинактивированной бычьей сыворотки смешивались с 500 мл RPMI-1640 (без фенолового красного и L-глутамина).
В общем, эксперимент проводили в соответствии со следующим протоколом: клетки культивировали от четырех до пяти дней перед обработкой соединением. Жизнеспособность клеток должна была быть больше примерно 92%. Подсчитывали плотность клеток, и их жизнеспособность подтверждали с использованием GUAVA PCA с помощью программы Viacount 2.12. Клетки отбирали и центрифугировали при 300×g в течение 6 минут. Супернатант сливали, и осадок клеток вновь размешивали до концентрации 0,15 млн клеток/мл с RPMI (без фенолового красного) с 5% фетальной бычьей сыворотки и 1% пенициллина/стрептомицина. Аликвоту 40 мкл суспензии клеток помещали в каждую ячейку 384-ячеечной планшеты. Клетки инкубировали в течение надлежащего периода времени в определенных экспериментальных условиях. Затем 45 мкл буфера клеточного лизирования добавляли к образцам клеток.
Лизирующий буфер готовили следующим образом: для приготовления 1 литра лизирующего буфера 20 мл 1M раствора Tris-HCl (pH 8,0), 40 мл 0,5M EDTA (pH 8,0), 10 мл 20% раствора Tween-20, 10 мл 20% раствора Triton X-100 смешивали с 920 мл деионизованной воды. Непосредственно перед использованием 5 мл исходного раствора РНКазы А (10 мг/мл) добавляли к буферу лизирования до конечной концентрации 0,05 мг/мл. После добавления буфера лизирования планшеты выдерживали при комнатной температуре в течение 60 минут. Планшеты с клеточными культурами центрифугировали при 2000×g в течение 20 мин, и 10 мкл супернатанта клеточных лизатов, содержащего фрагменты ДНК, переносили в CyBio-well 384 на планшеты для обнаружения (Corning Costar 384-ячеечная полистирольная аналитическая планшета, черная, несвязывающая поверхность). К каждой ячейке образца в планшетах для обнаружения добавляли аликвоту 10 мкл обнаруживающего раствора PicoGreen. Раствор PicoGreen для обнаружения готовили непосредственно перед использованием путем разбавления исходного раствора в ДМСО буфером для обнаружения в соотношении 1:200. Буфер для обнаружения готовили смешением 50 мл исходных 10×Tris-HCL буферного физиологического раствора (TBS, pH 8,0) и 2 мл 0,5M раствора EDTA (pH 8,0) в деионизованной воде до конечного объема 500 мл. Интенсивность флуоресценции анализировали с помощью PerkinElmer Envision.
В таблице 1 перечислены некоторые примеры реагентов и материалов, концентрации, функции и сведения по поставщиках.
BP3223-1
В таблице 2 приводятся некоторые примеры оборудования, методы использования такого оборудования и поставщики.
Ниже приводятся параметры измерений на PerkinElmer Envision: для возбуждения зеркало FITC; фильтр возбуждения FITC 485; фильтр испускания FITC 535; число импульсов 25; возбуждающий свет 1%; усиление детекции равно 1 и высота измерения равна 8 мм.
Каждый анализ включает положительный, отрицательный и бланковый контроль. Использование надлежащих методов контроля определяли поставленными экспериментальными целями. Как правило, в качестве положительного контроля использовали клетки HL-60, обработанные 5 мкM винбластина сульфатом в 1% ДМСО. Отрицательным контролем были клетки HL-60, обработанные 1% ДМСО. Бланковой пробой была инкубационная среда с 1% ДМСО (без клеток HL-60).
Анализ данных может быть скорректирован с учетом экспериментальных параметров или исследуемой парадигмы. Как правило, относительное количество образующейся фрагментированной ДНК определяли по интенсивности флуоресценции (ИФ) образца. Эффект влияния агента на фрагментацию ДНК в клетках HL-60 рассчитывали по изменению интенсивности флуоресценции относительно контрольных образцов ДМСО. Процент эффекта определяли как:
% эффекта = 100*[(ИФагента - среднее(ИФотрицательный контроль))/ среднее(ИФотрицательный контроль)]
Пример 2
PicoGreen обеспечивает специфическое обнаружение фрагментов ДНК, выделяемых клетками HL-60:
На Фиг.1 отображено повышение интенсивности флуоресценции PicoGreen в клетках HL-60, обработанных камптотецином. Клетки HL-60 в фазе середины логарифмического роста (0,4 млн клеток/мл) были обработаны либо 0,1% растворителя-носителя ДМСО, либо 3,2 мкМ камптотецина в течение 5,5 часов. Ко всей клеточной культуре добавляли равный объем лизирующего буфера (20 мМ Tris-HCl (pH 8,0), 20 мМ EDTA, 0,2 % Tween-20). После выдерживания при комнатной температуре в течение 45 минут лизат клеток центрифугировали при 2000×g в течение 20 минут, отбирали верхнюю порцию супернатанта и определяли содержание ДНК по величине интенсивности флуоресценции при смешении с красителем PicoGreen. Бланковой пробой среды была смесь в равных отношениях клеточной культуральной среды и лизирующего буфера.
Пример 3
Сигнал флуоресценции PicoGreen зависит от уровня ДНК в клеточных лизатах:
После обработки 0,1% растворителем-носителем ДМСО или 3,2 мкМ камптотецина в течение 5,5 часов равный объем лизирующего буфера без EDTA (20 мМ Tris-HCl (pH 8,0) 0,2% Tween-20 и 3 мкг/мл РНКазы) добавляли ко всей клеточной культуре HL-60. После выдерживания при комнатной температуре в течение 45 минут клеточные лизаты центрифугировали, отбирали верхнюю порцию супернатанта и инкубировали со свободной от РНКаз ДНКазой при 37°C в течение заданного времени (Фиг.2). После 2 часов обработки ДНКаза I оказалась в состоянии уменьшить интенсивность флуоресценции контрольного образца ДМСО примерно на 50%. Сигнал клеток, обработанных камптотецином, обладал более высокой интенсивностью флуоресценции до обработки ДНКазой I и эффективно уменьшался до уровня, сопоставимого с контролем ДМСО при обработке ДНКазой I. Эти результаты показывают, что сигнал флуоресценции PicoGreen связан с присутствием фрагментированной ДНК в клеточных лизатах.
Пример 4
Сравнение PicoGreen с пропидия иодидом или ELISA для обнаружения дцДНК:
Клетки HL-60 в фазе середины логарифмического роста (0,3 млн клеток/мл) обрабатывали различными дозами камптотецина, стауроспорина или блеомицина в течение 20 часов. Ко всей клеточной культуре добавляли равный объем лизирующего буфера (20 мМ Tris-HCl (pH 8,0), 20 мМ EDTA, 0,2% Tween-20 и 5 мкг/мл РНКазы). Лизат клеток центрифугировали при 2000xg в течение 20 минут, отбирали верхнюю порцию супернатанта и определяли количественное содержание ДНК с помощью набора ELISA (Roche Applied Sciences) или по величине интенсивности флуоресценции в присутствии PicoGreen или пропидия иодида. Кривая ответной реакции на дозу для камптотецина при обнаружении с помощью PicoGreen (Фиг.3) сопоставляли с обнаружением в присутствии пропидия иодида (Фиг.4). Пропидия иодид разбавляли из исходного раствора 0,5 мг/мл до рабочего раствора 0,00125 мг/мл в 10 мМ Tris-HCL (pH 7,5) с 1 мМ EDTA. 20 мкл рабочего раствора пропидия иодида смешивали с 20 мкл анализируемого раствора перед измерением интенсивности флуоресценции на PerkinElmer Envision с длиной волны возбуждения 531 нм; длина волны испускания 635 нм.
Кривые ответной реакции на дозу для камптотецина, стауроспорина или блеомицина, зарегистрированные с помощью PicoGreen, приведены на Фиг.3. Значение EC50 для камптотецина составляло 1,48 мкМ, стауроспорина 0,41 мкМ, а для блеомицина было более 100 мкМ. Значения EC50, определяемые по PicoGreen, хорошо согласовывались с результатами, полученными с помощью набора обнаружения ELISA (Фиг.5). Значения EC50, определяемые по ELISA, были равны 1,11 мкМ для камптотецина, 0,19 мкМ для стауроспорина и более 100 мкМ для блеомицина.
Пример 5
Воздействие ZnCl2, ингибитора апоптоза, на индуцированную камптотецином фрагментацию ДНК в клетках HL-60:
Известно, что цинк является ингибитором апоптоза, вызванного химическими веществами и агонистами рецепторов гибели клетки. Чтобы продемонстрировать возможности применения анализа с PicoGreen для обнаружения и количественного определения дцДНК как показателя фрагментации ДНК в апоптозе, клетки HL-60 в фазе середины логарифмического роста (0,3 млн клеток/мл) обрабатывали 3,2 мкМ камптотецина в присутствии различных доз хлористого цинка в течение 20 часов (Фиг.6). Фрагменты ДНК, выделенные из клеток, количественно определяли с помощью реагента PicoGreen, как это описано выше. Для образцов с камптотецином в отсутствие хлорида цинка или при его низких концентрациях сигнал флуоресценции более чем в 3 раза превышал сигнал в образцах, обработанных ДМСО. Если концентрации хлористого цинка увеличивали до 100 мкМ или выше, масштабы фрагментации ДНК, которые определяли по уровню сигнала флуоресценции, уменьшались до тех же величин, что и в образцах, обработанных только ДМСО.
Пример 6
Влияние обработки РНКазой на отношение сигнал/шум фрагментации ДНК в лизатах HL-60:
Клетки HL-60 в фазе середины логарифмического роста (0,4 млн клеток/мл) были обработаны либо 0,1% растворителя-носителя ДМСО, либо 3,2 мкМ камптотецина в течение 5,5 часов. Ко всей клеточной культуре добавляли равный объем лизирующего буфера (20 мМ Tris-HCl (pH 8,0), 20 мМ EDTA, 0,2% Tween-20) с различными концентрациями свободной от ДНКазы РНКазы (Roche Applied Sciences 1579681). После выдерживания при комнатной температуре в течение 45 минут лизат клеток центрифугировали при 2000xg в течение 20 минут. Отбирали верхнюю порцию супернатанта и определяли содержание ДНК при смешении с красителем PicoGreen. Обработка лизата клеток высокими концентрациями РНКазы снижала фоновую флуоресценцию, связанную с клеточной РНК, и улучшала величину сигнала (Фиг.7).
Пример 7
Временная зависимость эффектов воздействия камптотецина на фрагментацию ДНК в клетках HL-60:
Клетки HL-60 в фазе середины логарифмического роста (0,4 млн клеток/мл) обрабатывали либо 0,1% растворителя-носителя ДМСО, либо 3,2 мкМ камптотецина (Фиг.8). В каждый заданный момент времени отбирали 100 мкл суспензии клеток, чтобы смешать их с равным объемом буфера лизирования (20 мМ Tris-HCl (pH 8,0), 20 мМ EDTA, 0,2% Tween-20). Камптотецин является быстродействующим агентом, вызывающим апоптоз. После 4 часов обработки камптотецин уже вызвал значительное увеличение фрагментации ДНК.
Пример 8
Влияние плотности клеток на фрагментацию ДНК в клетках HL-60:
Клетки HL-60 в клеточной культуральной среде центрифугировали при 300×g в течение 6 мин. После отделения среды клетки ресуспендировали в среде инкубации соединения до указанной концентрации. Суспензии клеток затем инкубировали с 1/10 объема либо 0,1% растворителя-носителя ДМСО, либо 3,2 мкМ камптотецина в течение 20 часов до лизиса и процедуры обнаружения. Бланковой пробой среды была смесь в равных отношениях клеточной культуральной среды и лизирующего буфера. На Фиг.9 приводится воздействие плотности клеток на интенсивность сигнала, а на Фиг.10 графически отображен рост индукции сигнала относительно плотности клеток.
Пример 9
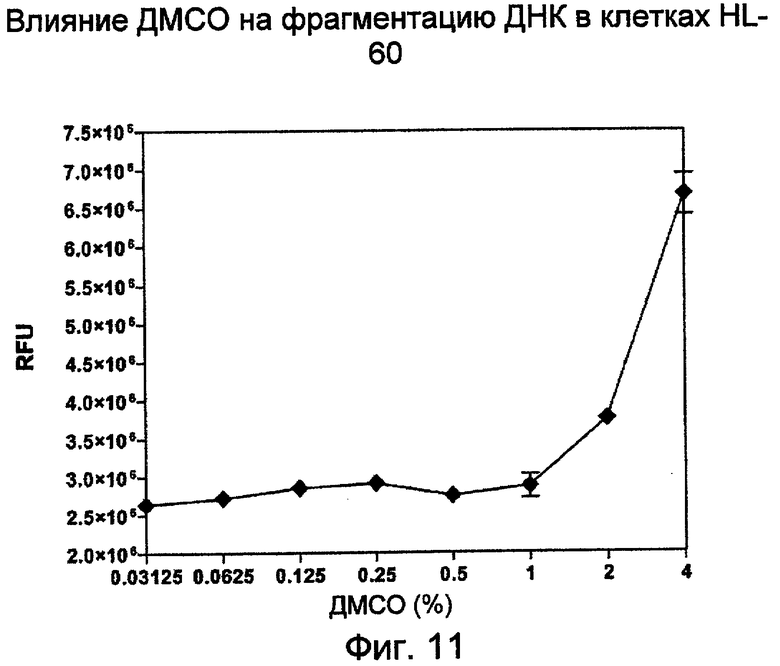
Чувствительность к ДМСО клеток HL-60:
Клетки HL-60 в фазе середины логарифмического роста (0,3 млн клеток/мл) обрабатывали различными дозами ДМСО в течение 20 часов. Ко всей клеточной культуре добавляли равный объем лизирующего буфера (20 мМ Tris-HCl (pH 8,0), 20 мМ EDTA, 0,2% Tween-20 и 5 мкг/мл РНКазы). Лизат клеток центрифугировали при 2000×g в течение 20 минут. Отбирали верхнюю порцию супернатанта и определяли содержание ДНК с помощью флуоресцентного анализа с PicoGreen. На Фиг.11 показано, что в течение 20 часов инкубирования клетки HL-60 могут выдерживать воздействие до 1% ДМСО.
Пример 10
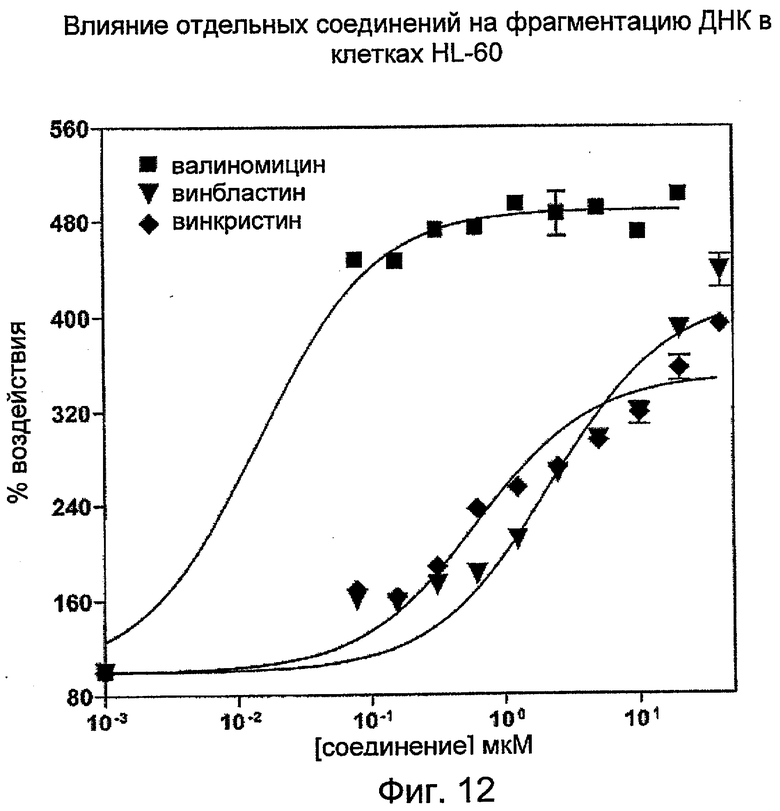
Кривые ответной реакции на дозу для набора цитотоксических агентов с различными механизмами действия:
Клетки HL-60 в фазе середины логарифмического роста (0,3 млн клеток/мл) обрабатывали различными дозами известных соединений, вызывающих апоптоз, в течение 20 часов. На Фиг.12 отображена цитотоксическая активность валиномицина, винбластина и винкристина. На Фиг.13 отображена цитотоксическая активность этопозида, генистеина, пуромицина и рапамицина.
Пример 11
Распределение данных скрининга случайной химической библиотеки:
Библиотеку соединений распределяли по 384-ячеечной планшете в ячейки от колонки 1 до колонки 22. Положительный контроль, винбластин (5 мкМ), добавляли в ячейки колонки 24. Ячейки в колонке 23 использовали для отрицательного контроля (без соединения). Аликвоты клеток HL-60 помещали в каждую ячейку и инкубировали в течение 40 часов (Фиг.14). Фрагментацию ДНК измеряли с помощью процедуры, описанной в примере 1.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ ОПУХОЛЕЙ | 2007 |
|
RU2500815C2 |
| СИНТЕТИЧЕСКАЯ ЛЕТАЛЬНОСТЬ И ЛЕЧЕНИЕ РАКА | 2013 |
|
RU2676697C2 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИАПОПТОТИЧЕСКОЙ АКТИВНОСТЬЮ | 2018 |
|
RU2685428C1 |
| ГУМАНИЗИРОВАННОЕ МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, СПЕЦИФИЧНОЕ К ЛЕГУМАИНУ | 2013 |
|
RU2574203C2 |
| АНТАГОНИСТ-ЛИГАНД RAR-γ ИЛИ АГОНИСТ-ЛИГАНД RAR-α В КАЧЕСТВЕ ИНГИБИТОРА АПОПТОЗА | 1996 |
|
RU2191008C2 |
| СПОСОБ ВЫДЕЛЕНИЯ БЕЛКОВОГО ВЫСОКОМОЛЕКУЛЯРНОГО КОМПЛЕКСА АКТИВАЦИИ КАСПАЗЫ-2 ЧЕЛОВЕКА | 2016 |
|
RU2671510C1 |
| КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ БОЛЕЗНИ ГЛАЗ, СВЯЗАННОЙ С НУКЛЕИНОВЫМИ КИСЛОТАМИ | 2012 |
|
RU2642609C2 |
| ГИБРИДОМА, ОБОЗНАЧЕННАЯ 199М, И МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, СЕКРЕТИРОВАННОЕ ЭТОЙ ГИБРИДОМОЙ | 1997 |
|
RU2183671C2 |
| СРЕДСТВО, СТИМУЛИРУЮЩЕЕ АПОПТОЗ КЛЕТОК ЛЕЙКЕМИИ ЧЕЛОВЕКА | 2007 |
|
RU2360692C1 |
| КОМБИНАЦИИ АНТИТЕЛ, ОБЛАДАЮЩИХ СЕЛЕКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К РЕЦЕПТОРУ ЛИГАНДА, ИНДУЦИРУЮЩЕМУ АПОПТОЗ, АССОЦИИРОВАННЫЙ С ФАКТОРОМ НЕКРОЗА ОПУХОЛИ, И ДРУГИХ ТЕРАПЕВТИЧЕСКИХ СРЕДСТВ | 2002 |
|
RU2313368C2 |
Изобретение относится к области биотехнологии и касается способа идентификации агента на основе высокопроизводительного скрининга. Представленный способ включает следующие стадии: подготовку клеток в первом наборе, включающем, по меньшей мере, 96 приемников; добавление агента, по крайней мере, к одному приемнику; инкубирование агента с клетками; лизирование клеток путем добавления буфера, который является гипотоническим или содержит детергент, и содержит ингибитор ДНКазы; удаление РНК из клеточного лизата с помощью РНКазы; центрифугирование первого набора приемников при низкой скорости; перенос супернатанта, содержащего фрагменты ДНК, на второй набор приемников; добавление обнаруживаемого соединения, способного к интеркаляции с фрагментами ДНК, в буфере для детекции, содержащем ингибитор ДНКазы, к, по крайней мере, одному приемнику; измерение количества интеркалированного обнаруживаемого соединения; и сравнение количества интеркалированного обнаруживаемого соединения с контролем для определения разницы, что позволяет идентифицировать указанный агент как модифицирующий агент, если разница превышает заранее установленный предел. Представленное изобретение позволяет обнаружить агенты, которые влияют на образование фрагментов ДНК в клетках, используя высокопроизводительные скрининговые приложения. 9 з.п. ф-лы, 14 ил., 2 табл., 11 пр.
1. Способ идентификации агента на основе высокопроизводительного скрининга, который влияет на апоптоз, причем способ включает:
a) подготовку клеток в первом наборе, включающем, по меньшей мере, 96 приемников;
b) добавление агента, по крайней мере, к одному приемнику;
c) инкубирование агента с клетками в течение заранее определенного периода времени;
d) лизирование клеток путем добавления буфера, который является гипотоническим или содержит детергент, где буфер дополнительно содержит ингибитор ДНКазы;
e) удаление РНК из клеточного лизата с помощью РНКазы;
f) центрифугирование указанного первого набора приемников при низкой скорости;
g) перенос супернатанта, содержащего фрагменты ДНК, на второй набор приемников;
h) добавление обнаруживаемого соединения, способного к интеркаляции с фрагментами ДНК, в буфере для детекции, содержащем ингибитор ДНКазы, к указанному, по крайней мере, одному приемнику;
i) измерение количества интеркалированного обнаруживаемого соединения; и
j) сравнение количества интеркалированного обнаруживаемого соединения с контролем с целью определить разницу, что позволяет идентифицировать указанный агент как модифицирующий агент, если разница превышает заранее установленный предел.
2. Способ по п.1, где обнаруживаемое соединение включает вещество, выбираемое из группы, состоящей из радиоактивного изотопа, флуоресцирующего или люминесцирующего химического соединения, пептидной метки, активирующего сцинтиллятор соединения, фермента и эпитопа, распознаваемого обнаруживаемым антителом.
3. Способ по п.2, где обнаруживаемое соединение включает вещество, выбираемое из группы, состоящей из PicoGreen, SYBR Green, ТОТО, YOPRO, BENA435, Hoechst 33258, Hoechst 33342, DAPI, DRAQ5, OliGreen и йодида пропидия.
4. Способ по п.1, где клетка включает прокариотическую клетку.
5. Способ по п.1, в котором клетка включает эукариотическую клетку.
6. Способ по п.1, где клетка временно или стабильно трансформирована для сверхэкспрессии, по крайней мере, одного белка.
7. Способ по п.1, где клетку получают в результате выделения из биологического образца.
8. Способ по п.7, где биологический образец взят у человека.
9. Способ по п.1 или 2, где клетка является клеткой HL60.
10. Способ по п.1, где набор приемников центрифугируют при менее чем 7000g.
| YIANIS A | |||
| IOANNOU et al | |||
| Quantitation of DNA fragmentation in apoptosis, Nucleic Acids Research, 1996, Vol.24, No.5, p.p.992-993 | |||
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| СТАНОК ДЛЯ ШЛИФОВАНИЯ (ОКРУГЛОВКИ) ПУГОВИЦ | 1932 |
|
SU32716A1 |
| ГОРДЕЕВА А.В | |||
| и др | |||
| Апоптоз | |||
Авторы
Даты
2013-06-27—Публикация
2007-06-20—Подача