Настоящее изобретение относится к электроду, способу получения такого электрода и его применению. Настоящее изобретение также включает в себя способ получения хлората щелочного металла и электролитическую ячейку для такого получения.
Предпосылки изобретения
Хорошо известны электроды, включающие электродную подложку, несущую слой или покрытие из одного или нескольких оксидов металлов, для использования в электролитических процессах. Обычные подложки включают, среди прочих, титан, тантал, никель и сталь. В настоящее время в качестве электродов часто используют титан, однако при отрицательной поляризации титана образуется гидрид титана, который, в конце концов, серьезно нарушает стабильность электрода. Сталь может корродировать во время или после остановок электролитической ячейки. Стальные катоды также способны проводить атомарный водород, в результате чего соединение между стальными катодами и анодами на основе титана в биполярных ячейках может потребовать подкладочной плиты для предотвращения образования гидрида титана. В US 7001494 раскрыт еще один электродный материал для использования в хлор-щелочной ячейке.
Электролитическое получение хлората щелочного металла, а особенно хлората натрия, хорошо известно. Хлорат щелочного металла представляет собой важный химический реагент, в частности, в целлюлозно-бумажной промышленности, в качестве сырья для получения диоксида хлора, широко применяемого для отбеливания. Традиционно его получают электролизом хлоридов щелочных металлов в бездиафрагменных электролитических ячейках. В таких ячейках протекает следующая общая химическая реакция:
MCl+3H2O→MClO3+3H2,
где М представляет собой щелочной металл. Примеры хлоратных процессов описаны, среди прочих, в US 5419818 и ЕР 1242654.
Одной задачей настоящего изобретения является разработка электрода, имеющего улучшенные рабочие характеристики в электролитической ячейке. Еще одной задачей является разработка электрода, стойкого в условиях выделения водорода и восстановительных условиях в щелочной среде и по меньшей мере более кратковременных воздействий в окислительной среде. Следующей задачей настоящего изобретения является разработка электролитической ячейки и способа получения хлората щелочного металла. Особенно желательной является разработка такой ячейки, в которой снижены образование кислорода и, следовательно, опасность взрывов, а условия работы облегчены. Очередной задачей настоящего изобретения является разработка ячейки, в которой установлены биполярный электрод или гибриды биполярного и монополярного электродов.
Следующей задачей настоящего изобретения является разработка ячейки, в которой полярность электродов может быть изменена на противоположную, так что электроды могут последовательно работать как анод и катод в течение некоего данного периода времени.
Следующей задачей изобретения является разработка электрода, улучшающего катодный выход по току при работе в электролитической ячейке, особенно при снижении напряжения на ячейке. Следующей задачей изобретения является разработка электрода с уменьшенной толщиной, приводящей в результате к экономии материала и оптимизации, позволяющей разместить большее число электродов в одном и том же пространстве ячейки, за счет чего производство может быть повышено без укрупнения существующей установки. Следующей задачей изобретения является разработка электродов, способных снизить удельное металлосодержание драгоценных металлов на электродной подложке при по существу сохранении рабочих характеристик коммерческих электродов. Следующей задачей изобретения является разработка электрода, который не корродирует, в результате чего не образуется шлам, который может осаждаться на анодах.
Изобретение
Настоящее изобретение относится к электроду, содержащему:
а) электродную подложку, содержащую М(n+1)AXn, где М представляет собой металл группы IIIB, IVB, VB, VIB или VIII Периодической таблицы элементов или их комбинацию, А представляет собой элемент группы IIIA, IVA, VA или VIA Периодической таблицы элементов или их комбинацию, Х представляет собой углерод, азот или их комбинацию, где n составляет 1, 2 или 3; и
b) электрокаталитическое покрытие, осажденное на упомянутой электродной подложке, выбранное из по меньшей мере одного из
b.1) оксида металла и/или сульфида металла, содержащего ByC(1-y)Oz1Sz2, где В представляет собой по меньшей мере один из рутения, платины, родия, палладия, иридия и кобальта, С представляет собой по меньшей мере один вентильный металл; y составляет 0,4-0,9; 0<=z1, z2<=2 и z1+z2=2;
b.2) оксида металла, содержащего BfCgDhEi, где В представляет собой по меньшей мере один из рутения, платины, родия, палладия и кобальта, С представляет собой по меньшей мере один вентильный металл, D представляет собой иридий, Е представляет собой Мо и/или W, где f составляет 0-0,25 или 0,35-1, g составляет 0-1, h составляет 0-1, i составляет 0-1, при этом f+g+h+i=1;
b.3) по меньшей мере одного благородного металла;
b.4) любого сплава или смеси, содержащего(ей) железо-молибден, железо-вольфрам, железо-никель, рутений-молибден, рутений-вольфрам, или их смесей;
b.5) по меньшей мере одного нанокристаллического материала.
Согласно одному варианту воплощения М представляет собой скандий, титан, ванадий, хром, цирконий, ниобий, молибден, гафний, тантал или их комбинации, например, титан или тантал.
Согласно одному варианту воплощения А представляет собой алюминий, галлий, индий, таллий, кремний, германий, олово, свинец, серу или их комбинации, например, кремний.
Согласно одному варианту воплощения электродная подложка выбрана из любого из Ti2AlC, Nb2AlC, Ti2GeC, Zr2SnC, Hf2SnC, Ti2SnC, Nb2SnC, Zr2PbC, Ti2AlN, (Nb,Ti)2AlC, Cr2AlC, Ta2AlC, V2AlC, V2PC, Nb2PC, Nb2PC, Ti2PbC, Hf2PbC, Ti2AlN0,5C0,5, Zr2SC, Ti2SC, Nb2SC, Hf2Sc, Ti2GaC, V2GaC, Cr2GaC, Nb2GaC, Mo2GaC, Ta2GaC, Ti2GaN, Gr2GaN, V2GaN, V2GeC, V2AsC, Nb2AsC, Ti2CdC, Sc2InC, Ti2InC, Zr2InC, Nb2InC, Hf2InC, Ti2InN, Zr2InN, Hf2InN, Hf2SnN, Ti2TlC, Zr2TlC, Hf2TlC, Zr2TlN, Ti3AlC2, Ti3GeC2, Ti3SiC2, Ti4AlN3 или их комбинаций. Согласно одному варианту воплощения электродная подложка представляет собой любой из Ti3SiC2, Ti2AlC, Ti2AlN, Cr2AlC, Ti3AlC2, или их комбинации. Способы получения перечисленных материалов, которые могут быть использованы в качестве электродных подложек в настоящем изобретении, известны из The MaxPhases: Unique New Carbide and Nitride Materials, American Scientist, Volume 89, p.334-343, 2001.
Согласно одному варианту воплощения конфигурация электродной подложки может, например, принимать вид плоского листа или пластины, изогнутой поверхности, криволинейной поверхности, перфорированной пластины, плетеной проволочной сетки, листа растянутой сетки, стрежня или трубки. Однако согласно одному варианту воплощения электродная подложка имеет плоскую форму, например, листа, сетки или пластины.
Согласно одному варианту воплощения вентильный металл по b.1) и b.2) может быть выбран из титана, тантала, ниобия, циркония, гафния, ванадия, молибдена, вольфрама или их комбинаций, например, титана. Однако могут быть также использованы и другие вентильные металлы.
Вентильные металлы известны как пленкообразующие металлы, обладающие свойством, при подключении в качестве электрода в том электролите, в котором предназначен работать этот электрод с покрытием, быстро образовывать пассивирующую оксидную пленку при работе в местных анодных условиях, что защищает нижележащий металл от коррозии электролитом.
Молярное соотношение в электрокаталитических покрытиях может варьироваться согласно указанным здесь диапазонам. Согласно одному варианту воплощения y составляет 0,5-0,9, например, 0,6-0,9 или 0,7-0,9.
Согласно одному варианту воплощения f составляет 0-0,15 или 0,45-1, например, 0-0,1 или 0,55-1. Согласно одному варианту воплощения g составляет 0-0,8, например, 0-0,5. Согласно одному варианту воплощения h составляет 0,1-1 или 0-0,65, например, 0,1-0,65. Согласно одному варианту воплощения i составляет 0-0,5 или 0-0,3, например 0-0,2.
Согласно одному варианту воплощения благородный металл представляет собой платину, рутений, иридий, рений, палладий, золото, серебро, родий или их комбинации. Согласно одному варианту воплощения благородный металл представляет собой платину, рутений, иридий, рений, палладий или их комбинации.
Согласно одному варианту воплощения нанокристаллический материал имеет удельную площадь поверхности, равную или большую 2 м2/г. Согласно одному варианту воплощения нанокристаллический материал имеет размер зерен менее 100 нм. Согласно одному варианту воплощения нанокристаллический материал находится в виде композита или сплава, выполненного из K-L-N: где К представляет собой Pt, Ru или соединение Pt или Ru; L представляет собой по меньшей мере один элемент, выбранный из группы, состоящей из Ru, Ge, Si, W, Sn, Ga, As, Sb, Mo, Ti, Ta, Cr, Mn, Fe, Co, Ni, Cu, Rh, V, Pd, Ag, In, Os, Ir, Au, Pb, C, Cd, N, P, Bi, Nb и Zr; a N представляет собой по меньшей мере один элемент, выбранный из группы, состоящей из Al, Mg, Zn, Li, Na, K, Ca, Ti, Zr, Mo и U; либо N представляет собой по меньшей мере один элемент, выбранный из группы, состоящей из Н, С, N, O, F, Cl, P и S; либо N представляет собой комбинацию множества элементов N, как указано выше.
Согласно одному варианту воплощения нанокристаллический материал находится в виде композита или сплава, выполненного из K'-L'-N': где К' представляет собой Mg, Be или соединение Mg или Be; L' представляет собой по меньшей мере один элемент, выбранный из группы, состоящей из Li, Ca, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn, Y, Zr, Nb, Mo, In, Sn, O, Si, B и F; a N' представляет собой по меньшей мере один элемент, выбранный из группы, состоящей из Al, Mg, Zn, Li, Na, K, Ca, Ti, Zr и Mo; либо N' представляет собой по меньшей мере один элемент, выбранный из группы, состоящей из Н, С, N, O, F, Cl, P и S; либо N' представляет собой металлоорганическое соединение, в котором металлический элемент представляет собой один из металлов, перечисленных в определении L', или металл, выбранный из группы, состоящей из Ru, Rh, Pd, Ir и Pt; либо N' представляет собой комбинацию множества элементов N', как указано выше. Нанокристаллический материал может иметь дополнительные характеристики, описанные в US 5872074, WO 2006/072169, CA 2492128, US 5662834 и WO 97/04146. Способы нанесения нанокристаллического материала на электродную подложку также хорошо известны из упомянутых документов.
Согласно одному варианту воплощения нанокристаллический материал выбран из MoS2, WS2, RhS2, PdS2, RuS2, PtS2 и их комбинаций, например, MoS2, WS2 и их комбинаций. Нанокристаллический материал может иметь дополнительные характеристики, описанные в US 4237204.
Согласно одному варианту воплощения нанокристаллический материал выбран из MxRu1-xS2, MxMo1-xS2, MxW1-xS2, MxPd1-xS2, MxRh1-xS2, MxPt1-xS2 и их комбинаций, где М выбран из Ni, Co, Fe, Al, а х составляет 0-0,7.
Согласно одному варианту воплощения электрод представляет собой катод. Согласно одному варианту воплощения электрод представляет собой биполярный электрод.
Согласно одному варианту воплощения электрод прикреплен к изолирующему или неизолирующему материалу, служащему опорой.
Согласно одному варианту воплощения плотность электродной подложки составляет в диапазоне от примерно 3 до примерно 6, например, от примерно 4 до примерно 4,7 или от примерно 4,2 до примерно 4,5 г/см3.
Согласно одному варианту воплощения шероховатость поверхности электродной подложки, измеренная как (Ra, Rz) в соответствии с SS-EN ISO 4287:1998, составляет в диапазоне от (0,05, 1) до (20, 40), например, от (1, 3) до (5, 20) в мкм.
Согласно одному варианту воплощения толщина электрода составляет от примерно 0,05 до примерно 5, например, от примерно 0,5 до примерно 2,5 или от примерно 1 до примерно 2 мм.
Согласно одному варианту воплощения по меньшей мере примерно 10, например, по меньшей мере примерно 30 или по меньшей мере примерно 50, например, по меньшей мере примерно 70 или по меньшей мере примерно 95% геометрической площади поверхности электродной подложки покрыто раскрытым здесь электрокаталитическим покрытием.
Изобретение также относится к способу получения электрода, в котором на электродной подложке, охарактеризованной здесь в разделе а) выше, формируют электрокаталитическое покрытие, охарактеризованное в любом из подпунктов b.1)-b.5).
Согласно одному варианту воплощения электродной подложке может быть придана шероховатость посредством механической обработки, пескоструйной обработки, дробеструйной обработки, химического травления и т.п. либо их комбинаций, подобных струйной обработке травящими частицами с последующим травлением. Использование химических травителей хорошо известно, и такие травители включают наиболее сильные неорганические кислоты, такие как хлористоводородная кислота, серная кислота, азотная кислота и фосфорная кислота, а также органические кислоты, такие как щавелевая кислота. Согласно одному варианту воплощения шероховатую, подвергнутую струйной обработке и протравленную электродную подложку покрывают электрокаталитическим покрытием, например, посредством окунания, окраски, нанесения валиком или напыления.
Согласно одному варианту воплощения, для того чтобы подготовить подложку к травлению, наиболее целесообразной может оказаться кондиционирование металла, например, отжигом, для диффузии примесей в границы зерен.
Согласно одному варианту воплощения предшественник для покрытия в виде растворенной соли или кислоты растворяют в кислотном водном или органическом растворе или их смеси. Согласно одному варианту воплощения органическая дисперсия содержит спирты, такие как 1-пропанол, 2-пропанол, бутанол, 1-бутанол, 1-пентанол, 2-пентанол, 3-метил-2-бутанол, или их смеси. Согласно одному варианту воплощения предшественник содержит по меньшей мере одну органическую соль и/или кислоту, растворенную в органическом растворителе, например, алкоголяте титана, тетрабутилтитанате и/или тетрапентилтитанате. Согласно одному варианту воплощения предшественник содержит по меньшей мере одну неорганическую соль или кислоту, растворенную в по существу водной дисперсии. Согласно одному варианту воплощения предшественники В и С, например, TiCl4 и RuCl3, растворяют в органическом растворителе, таком как спирт.
Согласно одному варианту воплощения органические и/или водные растворы предшественников имеют кажущийся рН в диапазоне от примерно 0 до примерно 5, например, от примерно 1 до примерно 4. Согласно одному варианту воплощения предшественники, например, соли или кислоты растворенных вентильных металлов, включают хлориды, нитраты, иодиды, бромиды, сульфаты, бораты, карбонаты, ацетаты и цитраты, например, TiCl3 или TiCl4 в кислых растворах.
Согласно одному варианту воплощения раствор предшественника осаждают на подложке, нанося раствор на электродную подложку, например, до тех пор, пока общее удельное содержание не составит от примерно 0,1 до примерно 10, например, от примерно 1 до примерно 6 или от примерно 1,5 до примерно 3 г металла/м2, например, благородного металла.
Согласно одному варианту воплощения, для того чтобы получить более толстое оксидное покрытие, процедура осаждения может быть повторена, например, по меньшей мере 2 или по меньшей мере 4, или по меньшей мере 8 раз. Согласно одному варианту воплощения толщина электрокаталитического покрытия, осажденного на электродной подложке, например, металлооксидного покрытия, составляет в диапазоне от примерно 0,1 до примерно 20, например, от примерно 0,1 до примерно 4 мкм.
Согласно одному варианту воплощения раствор предшественника пропитывается в поры электродной подложки, покрывая открытую поверхность. Глубина проникновения раствора покрытия может составлять, например, от 0,1 до примерно 500 мкм.
Согласно одному варианту воплощения первый слой покрытия имеет высокое содержание вентильного металла, например, содержание титана, например, 80 вес.% или более в расчете на общее количество металла в упомянутом слое, который хорошо сцепляется на электродной подложке. Согласно одному варианту воплощения второй или последующие слои имеют более высокое содержание компонента В, чем первый слой покрытия, например, от примерно 30 или от примерно 50 вес.% в расчете на общее содержание металла, осажденного на электродной подложке. Таким образом, в электрокаталитическом покрытии может быть сформирован градиент с повышающимися/понижающимися содержаниями оксидов металлов компонентов В и С соответственно. Хорошая адгезионная способность покрытия может быть обеспечена при использовании меньшего количества активного компонента В во внутренних слоях, более близких к электродной подложке, и больших количеств в верхнем(их) слое(ях). Таким же образом, большее количество компонента С может быть использовано в слое(ях), обращенных к электродной подложке, в то время как внешние слои или верхний(ие) слой(и) могут содержать меньшее количество компонента С.
Согласно одному варианту воплощения водный или органический раствор, содержащий предшественник оксида металла, приводится в контакт с электродной подложкой, а затем сцепляется с ней в результате термического разложения предшественника.
Согласно одному варианту воплощения предшественник подвергается термическому разложению, например, при температуре от примерно 200 до примерно 700°С, например, от примерно 350 до примерно 550°С, при этом образующийся оксид металла сцепляется с подложкой.
Согласно одному варианту воплощения раствор для электроосаждения содержит молибденовый компонент (молибден в виде, способном электроосаждаться на катод, например, Na2MoO4) и/или железный компонент (железо в виде, способном электроосаждаться на катод, например, FeCl3 или FeSO4), которые могут быть осаждены in-situ. Раствор для электроосаждения может дополнительно содержать хелатирующую железо добавку, например, Na4P2O7. Раствор для электроосаждения может дополнительно содержать буферный агент, такой как бикарбонат, например, NaHCO3. Согласно одному варианту воплощения железо-молибденовые покрытия включают покрытия, содержащие 5-95% по весу молибдена. В некоторых вариантах воплощения железо-молибденовое покрытие содержит 5-50% по весу молибдена. В других вариантах воплощения железо-молибденовое покрытие содержит 10-50% по весу молибдена. В еще одном варианте воплощения железо-молибденовое покрытие содержит 10-40% по весу молибдена. В еще одном варианте воплощения железо-молибденовое покрытие содержит 25-35% по весу молибдена. В некоторых вариантах воплощения железо-молибденовое покрытие содержит 10-20% по весу молибдена. Концентрации растворов для электроосаждения могут также быть такими, как указанные в WO 2006/039804 A1.
Согласно одному варианту воплощения электрокаталитическое покрытие, например, электрокаталитическое оксидное покрытие, например, содержащее молибденовый компонент, формируют на электродной подложке посредством электроосаждения in-situ, т.е. внутри ячейки.
Изобретение также относится к электроду, получаемому охарактеризованным здесь способом. Изобретение также относится к применению охарактеризованного здесь электрода в электролитической ячейке, например, для электролитического получения монохлоруксусной кислоты, например, восстановлением дихлоруксусной кислоты или хлорированием уксусной кислоты. Однако такой электрод может быть также использован для любого альфа-хлорирования карбоновых кислот. Изобретение также относится к охарактеризованному здесь электроду, предназначенному для использования в процессе электрофлотации. Такой электрод может быть также использован в некоторых других областях применения, включая получение хлората щелочного металла, применения с HVDC (постоянным током высокого напряжения), особенно применения, в которых полярность меняют на противоположную через по меньшей мере один час или по меньшей мере один день, например, по меньшей мере одну неделю или по меньшей мере один месяц. Согласно одному варианту воплощения полярность меняют на противоположную через 6 месяцев или через 12 месяцев. Такой электрод может быть также использован при применениях для дезинфекции, например, небольших бассейнов, где изменение полярности на противоположную может быть использовано для предотвращения накапливания примесей на электродах. Другой вид применения такого электрода включает использование в ячейках электродиализа (ED), где предложенный электрод может действовать и как катод, и как анод.
Согласно одному варианту воплощения электрод используют для электродиалитического расщепления воды, например, для эффективного извлечения сульфатов. В этом процессе водный раствор, содержащий сульфат различного происхождения, помещают в ячейку электродиализа, оборудованную по меньшей мере одним сепаратором. Пропуская постоянный электрический ток, сульфат и воду расщепляют на ионы, которые реагируют с серной кислотой в анолите и с гидроксидом в католите. Подобным же образом, электрод может быть также использован в ячейках электродиализа для расщепления хлората натрия, а также расщепления соли на кислоту и каустик. Такие процессы подробно описаны, например, в US 5423959 и US 5407547.
Изобретение также относится к электролитической ячейке для получения хлората щелочного металла, содержащей по меньшей мере один анод и по меньшей мере один катод, причем по меньшей мере один из упомянутых анода и катода содержит электродную подложку, содержащую М(n+1)AXn, где М представляет собой металл группы IIIB, IVB, VB, VIB или VIII Периодической таблицы элементов или их комбинацию, А представляет собой элемент группы IIIA, IVA, VA или VIA Периодической таблицы элементов или их комбинацию, Х представляет собой углерод, азот или их комбинацию, где n составляет 1, 2 или 3.
Согласно одному варианту воплощения такая ячейка имеет надежную конструкцию, выдерживающую потоки электролита с линейной скоростью в зазоре ячейки, составляющей в диапазоне от примерно 0,1 до примерно 4, например, от примерно 0,2 до примерно 1,3 м/с.
Согласно одному варианту воплощения входы и выходы из ячейки также спроектированы так, чтобы выдерживать жесткие условия процесса в коммерческой хлоратной ячейке.
Согласно одному варианту воплощения ячейка представляет собой бездиафрагменную, например, монополярную ячейку. Это допускает множество различных конфигураций ячейки. По меньшей мере одна пара электродов из анода и катода может образовывать блок, содержащий электролит между анодом и катодом, причем этот блок может иметь форму пластин или трубок. В ячеечный ящик может быть также погружено множество пар электродов. Согласно одному варианту воплощения ячейка представляет собой биполярную ячейку. Согласно одному варианту воплощения по меньшей мере один катод и анод содержит раскрытую здесь электродную подложку. Упомянутые катод и анод могут дополнительно содержать электрокаталитическое покрытие, охарактеризованное здесь выше в подпунктах b.1)-b.5).
Согласно одному варианту воплощения ячейка представляет собой гибридную ячейку, т.е. комбинированную монополярную и биполярную ячейку. Такой тип ячеек позволяет модернизировать монополярную технологию, комбинируя монополярные и биполярные секции в ячеечном ящике. Такая комбинация может быть организована путем размещения, например, двух или трех раскрытых здесь электродов в виде биполярной секции среди множества монополярных электродов. Монополярные электроды гибридной ячейки могут быть любого типа, включая, например, традиционные электроды, известные сами по себе.
Согласно одному варианту воплощения отдельные монополярные аноды и катоды установлены в электролитической ячейке по краям, в то время как биполярные электроды установлены между ними, образуя тем самым гибридную электролитическую ячейку.
Согласно одному варианту воплощения в ячейке размещен по меньшей мере один описанный здесь электрод. Согласно одному варианту воплощения полярность по меньшей мере одной пары электродов в ячейке последовательно изменяют на противоположную.
Изобретение также относится к способу получения хлората щелочного металла, включающему введение раствора электролита, содержащего галогенид щелочного металла и хлорат щелочного металла, в охарактеризованную здесь электролитическую ячейку, электролиз раствора электролита с получением подвергнутого электролизу раствора хлората, перенос подвергнутого электролизу раствора хлората в хлоратный реактор для дальнейшего реагирования подвергнутого электролизу раствора хлората с получением более концентрированного электролита с хлоратом щелочного металла. По мере протекания электролиза на аноде образуется хлор, который сразу же образует гипохлорит, в то время как на катоде образуется газообразный водород.
Согласно одному варианту воплощения плотность тока в этом процессе составляет в диапазоне от примерно 0,6 до примерно 4,5, например, от примерно 1 до примерно 3,5, или от примерно 1,3 до примерно 2,9 кА/м2.
Согласно одному варианту воплощения образовавшийся хлорат отделяют кристаллизацией, в то время как маточный раствор рециркулируют для приготовления хлоридного электролита с целью дальнейшего электролиза с образованием гипохлорита.
Согласно одному варианту воплощения рН регулируют в нескольких местах в пределах диапазона 5,5-12 с целью оптимизации условий процесса для работы соответствующего блока. Таким образом, в электролизере и в реакционных сосудах используют слабокислый или нейтральный рН для способствования реакции из гипохлорита до хлората, в то время как рН в кристаллизаторе является щелочным для предотвращения образования и выхода газообразных гипохлорита и хлора и для снижения опасности коррозии. Согласно одному варианту воплощения рН раствора, подаваемого в ячейку, составляет от примерно 5 до примерно 7, например, от примерно 5,5 до примерно 6,5, такой как от примерно 5,8 до примерно 6,5.
Согласно одному варианту воплощения раствор электролита содержит галогенид щелочного металла, например, хлорид натрия, в концентрации от примерно 80 до примерно 180, например, от примерно 100 до примерно 140 или от примерно 106 до примерно 125 г/л. Согласно одному варианту воплощения раствор электролита содержит хлорат щелочного металла в концентрации от примерно 0 до примерно 700, например, от примерно 450 до примерно 700, например, от примерно 500 до примерно 650 или от примерно 550 до примерно 610 г хлората натрия/л. Согласно одному варианту воплощения введенный раствор галогенида щелочного металла содержит хромат в пересчете на Na2Cr2O7 в концентрации от примерно 0 до примерно 10, например, от примерно 1 до примерно 7 или от примерно 2 до примерно 6 г/л.
Согласно одному варианту воплощения данный процесс используют для получения хлората натрия или хлората калия, но могут быть также получены и хлораты других щелочных металлов. Получение хлората калия может быть осуществлено посредством добавления очищенного раствора хлорида калия к подщелоченному частичному потоку полученного электролитически хлората натрия, с последующим осаждением кристаллов охлаждением и/или упариванием. Хлорат подходящим образом получают непрерывным способом, однако также может быть использован периодический процесс.
Согласно одному варианту воплощения хлорид щелочного металла в виде соли технического сорта и сырую воду подают для приготовления солевой суспензии. Такое приготовление раскрыто, например, в ЕР-А-0498484. Согласно одному варианту воплощения поток в хлоратные ячейки обычно составляет от 75 до 200 м3 электролита на метрическую тонну полученного хлората щелочного металла. Согласно одному варианту воплощения каждая хлоратная ячейка работает при температуре, составляющей от примерно 50 до примерно 100, например, от примерно 60 до примерно 80°С. Согласно одному варианту воплощения часть хлоратного электролита рециркулируют из реакционных сосудов в солевую суспензию, а некоторое количество - для подщелачивания и фильтрации электролита, а также окончательного регулирования рН до кристаллизатора хлората. Подщелоченный таким образом электролит упаривают в кристаллизаторе, хлорат калия кристаллизуют и удаляют на фильтре или посредством центрифуги, а отогнанную воду конденсируют. Согласно одному варианту воплощения маточный раствор, который является насыщенным по хлорату и содержит большие количества хлорида натрия, рециркулируют непосредственно на приготовление суспензии через скрубберы для электролизного газа и скрубберы для реакторного газа. Согласно одному варианту воплощения давление в ячейке на примерно 20-30 мбар выше атмосферного давления.
Согласно одному варианту воплощения (электрическая) проводимость в электролите ячейки составляет в диапазоне от примерно 200 до примерно 700, например, от примерно 300 до примерно 600 мСм/см.
Согласно одному варианту воплощения температура в ячейке составляет в диапазоне от примерно 50 до примерно 110, например, от примерно 70 до примерно 100, или от примерно 75 до примерно 95°С.
Согласно одному варианту воплощения анод и/или катод представляет собой охарактеризованный здесь выше электрод, который может дополнительно содержать электрокаталитическое покрытие b.1)-b.5).
Краткое описание чертежей
На фигуре 1 показаны результаты настоящего изобретения. Четко видно, что при положительных потенциалах, при которых получают кислород и хлор, активность Maxthal® 312 (2) является низкой. Однако тонкий слой RuO2/TiO2, нанесенный на Maxthal® 312 (3), давал почти такую же высокую активность, как и PSC120 (1). Фиг.1 также показывает, что возможно менять потенциал активированного электрода Maxthal® 312 на противоположный и получать хорошие катодные характеристики для выделения водорода.
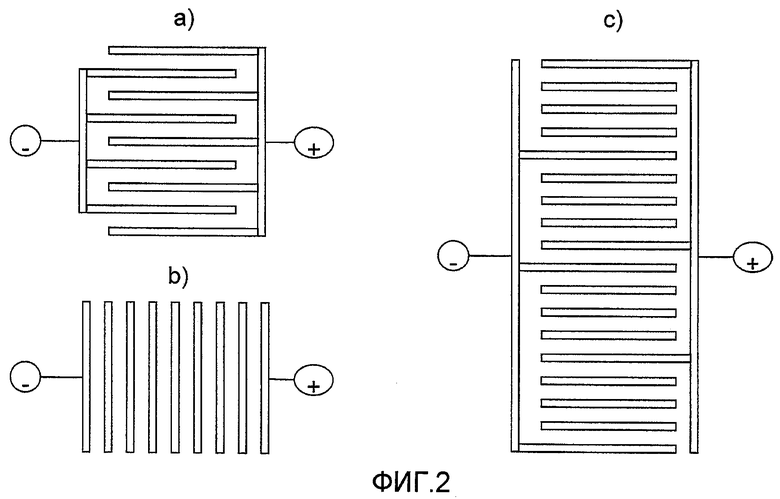
Фигура 2 представляет собой схематические иллюстрации а) монополярной, b) биполярной и с) гибридов монополярной и биполярной конструкций ячеек.
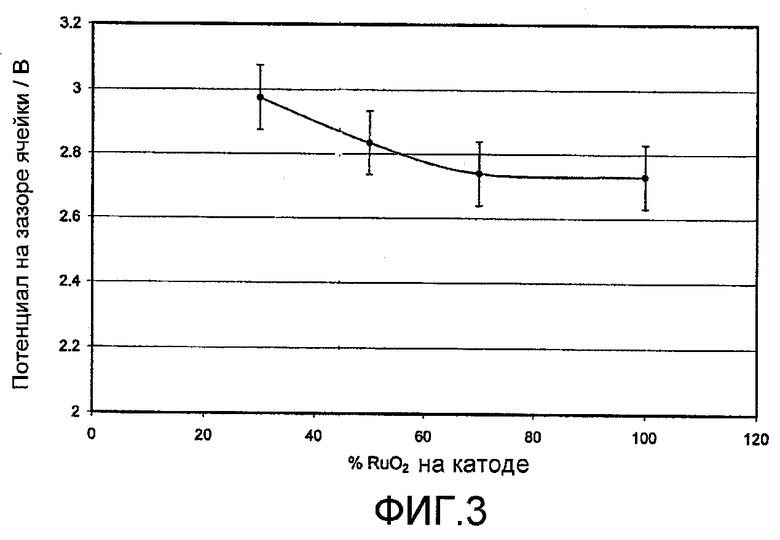
Фигура 3 показывает потенциал на зазоре ячейки (потенциал между анодом и катодом) в зависимости от количества Ru, присутствующего в молярном соотношении оксида Ru/Ti, используемого в качестве катализатора на катоде.
Описав таким образом изобретение, будет очевидным, что оно может варьироваться множеством путей. Такие вариации не должны рассматриваться как отклонение от сути и объема настоящего изобретения, и все такие модификации, как было бы очевидно специалисту в данной области техники, предполагаются находящими в рамках объема формулы изобретения. Следующие далее примеры дополнительно проиллюстрируют то, как описанное изобретение может быть осуществлено, без ограничения его объема.
Если не указано иное, то все части и процентные величины приведены в расчете по весу.
Пример 1
Использовали небольшую пилотную установку для получения хлората, включавшую в себя электролизную ячейку и реакционный сосуд (также действовавший как сепаратор газа). Электролит вынуждали циркулировать посредством насоса. Газ отводили в верхней части реакторного сосуда, где небольшое количество частиц хлора абсорбировали в 5-молярном гидроксиде натрия, а воду полностью удаляли адсорбцией в осушителе. Затем непрерывно измеряли содержание кислорода в оставшемся газе в % по объему. Также измеряли поток (литры/с) того же газа с целью вычисления катодного выхода по току (КВТ) на катоде. Расход водорода определяли, вычитая кислородную часть из общего расхода газа. Затем по расходу водорода вычисляли КВТ, используя следующее выражение: КВТ=(нормальный литр Н2 в секунду/22,4)·(2F/I), где F - постоянная Фарадея, а I - сила проходящего через ячейку тока в амперах.
Использованный исходный электролит представлял собой водный раствор, содержавший 120 г/л NaCl и 580 г/л NaClO3. Анодом в электролизной ячейке был PSC120 (DSA®, TiO2/RuO2), выпускаемый Permascand. Использовали три различных типа катодов: стальная пластина, титановая пластина (марки 1) и MAXTHAL® 312 (Ti3SiC2) (4,1 г/см3), выпускаемый Kanthal, с обработанной механически поверхностью. Расстояние между анодом и катодом составляло примерно 4 мм. Геометрическая площадь открытой для электролиза поверхности для анода и катода соответственно составляла 30 см2. В каждом эксперименте использовали плотность тока 3 кА/м2. Полученные результаты представлены ниже в таблице 1.
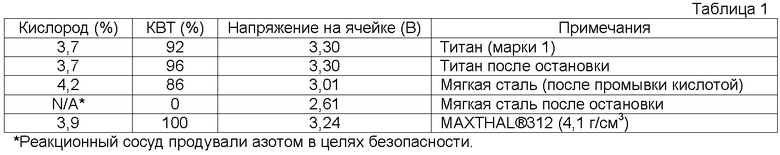
Каждый эксперимент (катод) осуществляли в течение периода времени в примерно четыре часа. В течение такого кроткого периода времени на титановых пластинах коррозии не наблюдалось. Стальной катод явно корродировал, цвет электролита явно изменился во время остановки, когда циркуляционный насос был включен. Непосредственно после остановки на катоде не образовывался газообразный водород. Никаких следов коррозии на материале MAXTHAL® 312 не наблюдалось и не было обнаружено поддающегося измерению изменения веса.
Пример 2
Использовали такую же пилотную установку, как и в примере 1. Использованный исходный электролит представлял собой водный раствор, содержавший 120 г/л NaCl, 580 г/л NaClO3 и 4,4 г/л Na2Cr2O7.
Анодом в электролизной ячейке был PSC120 (DSA®, TiO2/RuO2), выпускаемый Permascand. Катодным материалом был MAXTHAL® 312 (4,1 г/см3) с обработанной механически поверхностью. Расстояние между анодом и катодом составляло примерно 4 мм. Площадь открытой поверхности составляла 30 см2. Во всех экспериментах использовали плотность тока 3 кА/м2. Полученные результаты представлены в таблице 2.
Пример 3
Использовали такую же пилотную установку и экспериментальные исходные параметры, как и в примере 2. Полученные результаты представлены в таблице 3.
Эти эксперименты ясно указывают на то, как шероховатость поверхности влияет на напряжение на ячейке и образование кислорода. Согласно этим экспериментам значения шероховатости поверхности Ra и Rz между 1 и 3 мкм и от 5 до 15 мкм соответственно обеспечивали самое низкое напряжение на ячейке.
Пример 4
Для того чтобы подтвердить, что оксид молибдена и оксид вольфрама могут быть использованы в комбинации с оксидом рутения в катодном покрытии по сравнению со стандартным покрытием Ti0,7Ru0,3O2, осуществили следующие стадии эксперимента:
1. В качестве растворителя использовали водный раствор лимонной кислоты (рН2).
2. В растворителе растворяли 0,5% по весу хлорида рутения.
3. В другом растворе растворяли эквивалентное молярное количество (исходя из количества растворенного хлорида рутения) хлорида молибдена или хлорида вольфрама.
4. Оба раствора распределяли на двух титановых пластинах небольшой кистью.
5. Пластины выдерживали на воздухе при 70°С в течение 10 минут.
6. Пластины выдерживали на воздухе при 470°С в течение 10 минут.
7. На каждый электрод распределяли другой слой раствора хлорида молибдена или хлорида вольфрама.
8. Пластины выдерживали на воздухе при 70°С в течение 10 минут.
9. Пластины выдерживали на воздухе при 470°С в течение 60 минут.
Затем эти пластины использовали в качестве катодов в двух экспериментах и сравнивали с результатами испытания, в котором в качестве катода использовали PSC120. Использовали такую же пилотную установку и экспериментальные параметры, как и в примере 2.
В этом эксперименте выход по току у титановых катодов, покрытых оксидом молибдена и оксидом вольфрама (близкий к 100%), был выше выхода по току у PSC 120. В случае катода, покрытого оксидом молибдена, также наблюдалось снижение образования кислорода.
Пример 5
Для осуществления испытаний небольших электродов использовали установку с вращающимся диском. Вращающийся диск использовали в качестве рабочего электрода (катода), а большую платиновую сетку использовали в качестве противоэлектрода (анода). Рабочий электрод вращали со скоростью 1000 об/мин.
Использованный исходный электролит представлял собой водный раствор, содержавший 110 г/л NaCl, 550 г/л NaClO3 и 5 г/л Na2Cr2O7. Плотность тока на рабочем электроде составляла 1 кА/м2. Для того чтобы продемонстрировать, что материал Maxthal® может быть покрыт электропроводящим оксидом, таким как Ti0,7Ru0,3O2, были осуществлены следующие стадии эксперимента:
Небольшой диск из Maxthal® 312 (4,41 г/см3) с необработанной поверхностью (Ra=1,7, а Rz=10) использовали в качестве подложки для такого покрытия.
1. Раствор, использованный в процедуре нанесения покрытия, представлял собой TiCl4 и RuCl3·3H2O (молярное отношение Ru:Ti=3:7), растворенные в н-бутаноле.
2. Небольшой диск обезжиривали и промывали ацетоном.
3. Кисть погружали в раствор, описанный в п.1, и смазывали кистью одну сторону небольшого диска, покрывая ее раствором.
4. Диск выдерживали на воздухе при 70°С в течение 10 минут.
5. Диск выдерживали на воздухе при 470°С в течение 60 минут.
6. Диск помещали в держатель и использовали в качестве катода (отрицательно поляризованного).
При нанесении Ti0,7Ru0,3O2 на подложку из Maxthal® 312 можно было заметить активацию в примерно 160 мВ по сравнению с Maxthal® 312 без покрытия.
При визуальном осмотре электрода после поляризации покрытие на Maxthal® 312 выглядело неповрежденным и в электролите не наблюдалось следов материала покрытия.
Пример 6
Для того чтобы проверить, может ли активированный (с нанесенным покрытием) Maxthal® 312, полученный в примере 5, также быть использован в качестве анода и может ли полярность быть легко изменена на противоположную, осуществили эксперимент по циклической вольтамперометрии со скоростью сканирования 100 мВ/с. В этом примере использовали такую же установку, как и в примере 5, и использовали сравнительный электрод, имеющий скорость вращения 2000 об/мин.
В эксперименте сравнивали три электрода:
1. PSC 120
2. Maxthal® 312
3. Maxthal® 312, активированный Ti0,7Ru0,3O2
После эксперимента электрод номер 3 вытирали белой тканью. На ткани не наблюдалось никаких следов покрытия. Это указывает на высокую стойкость покрытия независимо от его положительной или отрицательной поляризации.
Пример 7
Использовали небольшую пилотную установку для получения хлората, включавшую в себя электролизную ячейку и реакционный сосуд (также действовавший как сепаратор газа). Электролит вынуждали циркулировать посредством насоса. Газ отводили в верхней части реакторного сосуда, где небольшое количество частиц хлора абсорбировали в 5-молярном гидроксиде натрия, а воду полностью удаляли адсорбцией в осушителе. Затем непрерывно измеряли содержание кислорода в оставшемся газе в % по объему. Также измеряли поток (литры/с) того же газа с целью вычисления катодного выхода по току (КВТ) на катоде. Расход водорода определяли, вычитая кислородную часть из общего расхода газа. Затем по расходу водорода вычисляли КВТ, используя следующее выражение: КВТ=(нормальный литр Н2 в секунду/22,4)·(2F/I), где F - постоянная Фарадея, а I - сила проходящего через ячейку тока в амперах.
Использованный исходный электролит представлял собой водный раствор, содержавший 120 г/л NaCl, 580 г/л NaClO3 и 4,4 г/л дихромата натрия. Анодом в электролизной ячейке был PSC120 (DSA®, TiO2/RuO2), выпускаемый Permascand.
В качестве материала основы катода по отдельности использовали три пластины из MAXTHAL® 312 (Ti3SiC2) (4,1 г/см3), выпускаемого Kanthal, с нанесенными на них тремя различными покрытиями, как показано в приведенной ниже таблице 6. Расстояние между анодом и катодом составляло примерно 4 мм. Геометрическая площадь открытой для электролиза поверхности для анода и катода соответственно составляла 30 см2. В каждом эксперименте использовали плотность тока 3 кА/м2.
**После остановки (питание выключали на пять минут, а затем вновь включали)
Ясно, что молибденсодержащие покрытия оказывают благоприятное влияние на уровни КВТ и кислорода. Также ясно показано, что чистый RuO2 обеспечивает самый низкий потенциал ячейки.
Пример 8
В этом эксперименте использовали 600-миллилитровую закаленную колбу, содержавшую водный раствор 550 г/л NaClO3, 120 г/л NaCl и 5 г/л дихромата натрия. Раствор в колбе имел температуру 70°С, который использовали в качестве электролита для двух обращенных друг к другу небольших электродных пластинок. Используемые электроды были покрыты катализатором только с одной стороны. Анодом всегда был титан (марки 1), покрытый PSC120 (DSA®, TiO2/RuO2), а используемые катоды представляли собой MAXTHAL® 312 (Ti3SiC2) (4,1 г/см3), покрытый сверху TiO2/RuO2 с различными соотношениями, как показано в приведенной ниже таблице 7. Расстояние между анодом и катодом составляло примерно 3,0±0,1 мм.
**Означает потенциал между анодом и катодом после одной минуты электролиза.
***Среднее из двух циклов.
Таблица 7 также может быть представлена в виде показанного на фигуре 3 графика, который четко показывает преимущества присутствия более 30 мол.% рутения на катоде.
| название | год | авторы | номер документа |
|---|---|---|---|
| АКТИВАЦИЯ КАТОДА | 2010 |
|
RU2518899C2 |
| ВЫСОКОЭФФЕКТИВНОЕ АНОДНОЕ ПОКРЫТИЕ ДЛЯ ПОЛУЧЕНИЯ ГИПОХЛОРИТА | 2005 |
|
RU2379380C2 |
| ЭЛЕКТРОДНЫЙ УЗЕЛ И ЭЛЕКТРОЛИЗЕР | 2021 |
|
RU2830159C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭЛЕКТРОДА, ЭЛЕКТРОД (ВАРИАНТЫ) И ЭЛЕКТРОЛИТИЧЕСКАЯ ЯЧЕЙКА (ВАРИАНТЫ) | 2004 |
|
RU2425176C2 |
| СПОСОБ ЭЛЕКТРОЛИЗА ВОДНЫХ ХЛОРНО-ЩЕЛОЧНЫХ РАСТВОРОВ, ЭЛЕКТРОД ДЛЯ ЭЛЕКТРОЛИЗА ХЛОРНО-ЩЕЛОЧНОГО РАСТВОРА И СПОСОБ ИЗГОТОВЛЕНИЯ ЭЛЕКТРОЛИТНОГО ЭЛЕКТРОДА | 2003 |
|
RU2330124C2 |
| КАТАЛИТИЧЕСКОЕ ИЛИ ЭЛЕКТРОКАТАЛИТИЧЕСКОЕ ПОЛУЧЕНИЕ ДИОКСИДА ХЛОРА | 2015 |
|
RU2674688C2 |
| УЛУЧШЕННЫЙ РОДИЕВЫЙ ЭЛЕКТРОКАТАЛИЗАТОР И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2002 |
|
RU2311496C2 |
| АНОД ДЛЯ ЭЛЕКТРОЛИЗА | 2007 |
|
RU2419686C2 |
| ЭЛЕКТРОХИМИЧЕСКАЯ ЯЧЕЙКА И СПОСОБ ЕЕ ЭКСПЛУАТАЦИИ | 2008 |
|
RU2469959C2 |
| БИПОЛЯРНАЯ ПЛАСТИНА ДЛЯ ТОПЛИВНЫХ ЭЛЕМЕНТОВ | 1999 |
|
RU2237317C2 |
Изобретение относится к электроду, имеющему улучшенные рабочие характеристики, содержащему а) электродную подложку, содержащую М(n+1)АХn, где М представляет собой металл группы IIIB-VIB или VIII Периодической таблицы элементов или их комбинацию, А представляет собой элемент группы III-VIA или их комбинацию, Х представляет собой углерод, азот или их комбинацию, где n составляет 1, 2 или 3; и b) электрокаталитическое покрытие, осажденное на упомянутой электродной подложке, которое выбрано из b.1) оксида металла и/или сульфида металла, содержащего ByC(1-y)Oz1Sz2, где В по меньшей мере один из рутения, платины, родия, палладия, иридия и кобальта, С представляет собой по меньшей мере один вентильный металл, у составляет 0,4-0,9; 0<=z1, z2<=2 и z1+z2=2; b.2) оксида металла, содержащего BfCgDhEi, где В представляет собой по меньшей мере один из рутения, платины, родия, палладия и кобальта, С представляет собой по меньшей мере один вентильный металл, D представляет собой иридий, Е представляет собой Мо и/или W, причем f составляет 0-0,25 или 0,35-1, g составляет 0-1, h составляет 0-1, i составляет 0-1, при этом f+g+h+i=1; b.3) no меньшей мере одного благородного металла; b.4) любого сплава или смеси, содержащего(ей) железо-молибден, железо-вольфрам, железо-никель, рутений-молибден, рутений-вольфрам или их смеси; b.5) по меньшей мере одного нанокристаллического материала. Изобретение также относится к способу получения электрода, его применению, а также к способу получения хлората щелочного металла и электролитической ячейке для его получения. 8 н. и 12 з.п. ф-лы, 3 ил., 7 табл., 8 пр.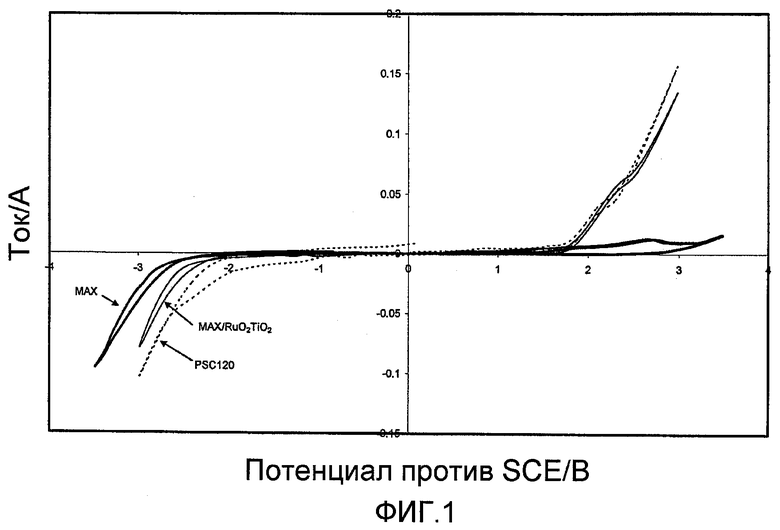
1. Электрод, содержащий:
a) электродную подложку, содержащую M(n+1)AXn, где М представляет собой металл группы IIIB, IVB, VB, VIB или VIII Периодической таблицы элементов или их комбинацию, А представляет собой элемент группы IIIA, IVA, VA или VIA Периодической таблицы элементов или их комбинацию, Х представляет собой углерод, азот или их комбинацию, где n составляет 1, 2 или 3; и
b) электрокаталитическое покрытие, осажденное на упомянутой электродной подложке, выбранное из по меньшей мере одного из
b.1) оксида металла и/или сульфида металла, содержащего ByC(1-y)Oz1Sz2, где В представляет собой по меньшей мере один из рутения, платины, родия, палладия, иридия и кобальта, С представляет собой по меньшей мере один вентильный металл, у составляет 0,4-0,9, 0<=z1, z2<=2 и z1+z2=2;
b.2) оксида металла, содержащего BfCgDhEi, где В представляет собой по меньшей мере один из рутения, платины, родия, палладия и кобальта, С представляет собой по меньшей мере один вентильный металл, D представляет собой иридий, Е представляет собой Мо и/или W, причем f составляет 0,35-1, g составляет 0-1, h составляет 0-1, i составляет 0-0,5, при этом f+g+h+i=1;
b.3) no меньшей мере одного благородного металла;
b.4) любого сплава железа-молибдена, железа-вольфрама, железа-никеля, рутения-молибдена, рутения-вольфрама или их смесей;
b.5) по меньшей мере одного нанокристаллического материала.
2. Электрод по п.1, в котором нанокристаллический материал выбран из MoS2, WS2 и их комбинаций.
3. Электрод по п.1 или 2, в котором благородный металл представляет собой платину, рутений, иридий, рений, палладий или их комбинации.
4. Электрод по п.1, в котором М представляет собой скандий, титан, ванадий, хром, цирконий, ниобий, молибден, гафний, тантал или их комбинации.
5. Электрод по п.1, в котором А представляет собой алюминий, галлий, индий, таллий, кремний, германий, олово, свинец, серу или их комбинации.
6. Электрод по п.1, причем электрод представляет собой катод.
7. Электрод по п.1, причем электрод представляет собой биполярный электрод.
8. Способ получения электрода, охарактеризованного по любому из пп.1-7, в котором на электродной подложке, охарактеризованной в подпункте а) п.1, формируют электрокаталитическое покрытие, охарактеризованное по любому из подпунктов b.1)-b.5) п.1.
9. Способ по п.8, в котором водный или органический раствор, содержащий предшественник оксида металла, приводят в контакт с электродной подложкой, а затем осуществляют сцепление с ней термическим разложением упомянутого предшественника.
10. Электрод, получаемый способом, заявленным по п.8 или 9.
11. Применение электрода по любому из пп.1-7 и 10 в электролитической ячейке.
12. Применение электрода, охарактеризованного по любому из пп.1-7 и 10, в процессе электрофлотации.
13. Применение электрода по п.11 для электролитического получения монохлоруксусной кислоты.
14. Применение электрода по любому из пп.1-7 и 10 в ячейке электродиализа.
15. Бездиафрагменная электролитическая ячейка для получения хлората щелочного металла, содержащая по меньшей мере один анод и по меньшей мере один катод, причем по меньшей мере один из упомянутых анода и катода содержит электродную подложку, содержащую M(n+1)AXn, где М представляет собой металл группы IIIB, IVB, VB, VIB или VIII Периодической таблицы элементов или их комбинацию, А представляет собой элемент группы IIIA, IVA, VA или VIA Периодической таблицы элементов или их комбинацию, Х представляет собой углерод, азот или их комбинацию, где n составляет 1, 2 или 3, при этом предусмотрено средство переноса подвергнутого электролизу раствора хлората для переноса этого раствора в хлоратный реактор.
16. Электролитическая ячейка по п.15, причем эта ячейка содержит электрод, охарактеризованный по любому из пп.1-7 или 10.
17. Электролитическая ячейка по п.15 или 16, причем в упомянутой ячейке размещен по меньшей мере один анод и катод, охарактеризованные по любому из пп.1-7 и 10.
18. Способ получения хлората щелочного металла, включающий в себя введение раствора электролита, содержащего галогенид щелочного металла и хлорат щелочного металла, в электролитическую ячейку, охарактеризованную по любому из пп.15-17, электролиз раствора электролита с получением подвергнутого электролизу раствора хлората, перенос подвергнутого электролизу раствора хлората в хлоратный реактор для дальнейшего реагирования подвергнутого электролизу раствора хлората с получением более концентрированного хлората щелочного металла.
19. Способ по п.18, в котором введенный раствор электролита содержит хромат в пересчете на Na2Cr2O7 в концентрации от примерно 1 до примерно 7 г/л.
20. Способ по п.18 или 19, в котором полярность по меньшей мере одной пары электродов последовательно изменяют на противоположную.
| US 20050011755 A1, 20.01.2005 | |||
| РОДИЕВЫЙ ЭЛЕКТРОКАТАЛИЗАТОР И СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ | 2000 |
|
RU2230136C2 |
| ЭЛЕКТРОД И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1992 |
|
RU2083724C1 |
| DE 19506857 A1, 22.08.1996 | |||
| Датчик диагностики износа узлов трения | 1983 |
|
SU1104387A1 |
| СПОСОБ ПОЛУЧЕНИЯ ХЛОРАТА НАТРИЯ | 1972 |
|
SU431099A1 |
| 0 |
|
SU369923A1 | |
Авторы
Даты
2013-07-10—Публикация
2008-11-14—Подача