Изобретение относится к органической химии и химии природных соединений, конкретно, способу получения нового соединения, производного 20-гидроксиэкдизона, конъюгированного с короткоцепочечным аналогом витамина Е, перспективного для медицины и фармакологии.
Экдистероиды - гормоны линьки и метаморфоза насекомых - составляют распространенный и разнообразный класс стероидных соединений в природе. Обнаружение гормонов насекомых во многих растениях, а в некоторых видах до 2-3% от сухой массы, позволило выделять эти соединения для изучения их свойств и проведения химических трансформаций [Ахрем А.А., Ковганко Н.В. Экдистероиды: химия и биологическая активность II Минск: Наука и техника, 1989, 327 с.].
Установлено, что экдистероиды обладают широким спектром биологических свойств, представляющим практический интерес для медицины, и относятся к малотоксичным соединениям [Сыров В.Н., Хушбактова З.А. Фармакотерапевтический эффект фитоэкдистероидов и неробола при токсическом поражении почек в эксперименте // Эксперим. и клин. фармакол., 2001, №4, с.56-58; Сыров В.Н., Шахмурова Г.А., Хушбактова З.А. Влияние фитоэкдистероидов и бемитила на функциональные, метаболические и иммунобиологические показатели работоспособности в эксперименте. // Эксперим. и клин. фармакол., 2008, №5, с.40-43; Шахмурова Г.А., Сыров В.Н., Хушбактова З.А. Иммуномодулирующая и стресс-протективная активность фитоэкдистероидов экдистерона и туркестерона при иммобилизационном стрессе у мышей. // Химико-фармацевтический журнал, 2010, т.44, №1, с.9-11]. В ряде модельных экспериментов показано, что 20-гидроксиэкдизон (наиболее распространенный и доступный экдистероид) и его производные проявляет выраженные антиоксидантные свойства, сопоставимые с гидрохиноном и бутилгидрокситолуолом [Кузьменко А.И., Морозова Р.П., Николаенко И.А., Донченко Г.В. // Военно-медиц. журнал., 1999, №3, с.35; Володин В.В., Ширшова Т.И., Бурцева С.А., Мельник М.В. // Раст. Ресурсы., 1999, т. 35, №2, с.76; Кузьменко А.И., Морозова Р.П., Николаенко И.А., Донченко Г.В. // Укр. биохим. журнал., 1999, т.71, №2, с.69; Коновалова Н.П., Митрохин Ю.И., Волкова Л.М., Сидоренко Л.И., Тодоров И.Н. // Изв. АН. Сер. биол., 2002, №6, с.650; Кузьменко А.И., Морозова Р.П., Николаенко И.А., Корнилец Г.В., Холодова Ю.Д. // Биохимия, 1997, т.62, №6, с.712]. Описано использование в практической медицине лекарственного средства, разработанного на основе 20-гидроксиэкдизона («экдистен») в качестве препарата коррекции нарушенных метаболических процессов в организме человека при лечении различных заболеваний [Сыров В.Н., Хушбактова ЗА., Комарин А.С. и др. Экспериментально-клиническая оценка эффективности применения экдистена при лечении гепатита // Эксперим. и клин. фармакол., 2004, №5, с.56-59; Сыров В.Н. Фитоэкдистероиды: биологические эффекты в организме высших животных и перспективы использования в медицине. // Эксперим. и клин. фармакол., 2008, №5, с.40-43].
В последнее время в медицинской химии передовым направлением в создании лекарственных средств является синтез конъюгатов путем химических комбинаций разных молекул с определенными свойствами. Полученные конъюгаты (гибридные молекулы) проявляют либо синергетический эффект, либо обладают эффектом пролонгированного действия в организме, либо строго воздействуют на орган-мишень.
Наиболее близким к предлагаемому изобретению является метод молекулярной конъюгации витаминов C и аналога витамина E, признанных природных антиоксидантов, взаимодействием вицинальной диольной группы аскорбиновой кислоты с альдегидной функцией хроманильного компонента (аналога витамина E) при катализе n-TsOH. Реакция проводилась в бензоле при нагревании в течение 8 часов, при этом выход образующегося коньюгата составил 55%. Полученный таким образом синтетический конъюгат показал интересные свойства. Обладая антиоксидантной активностью, соизмеримой с природными а-токоферолом или L-аскорбиновой кислотой, он способен улавливать свободные радикалы как в гидрофильной, так и в липофильной тканях организма, повышая иммунный статус [Manfredini S., Vertuani S., Manfredi B., Rossoni G., Calviello G., Palozza P Novel antioxidant agents deriving from molecular combinations of vitamins C and E analogues.// Biorganic and Medicinal Chem., 2000, 8, p.2791-2801].
Конъюгаты экдистероидов с аналогами витамина E или другими фармакофорами неизвестны. Задачей изобретения явился способ получения нового гибридного антиоксиданта на основе синтетической комбинации природного экдистероида - 20-гидроксиэкдизона и C2-аналога α-токоферола.
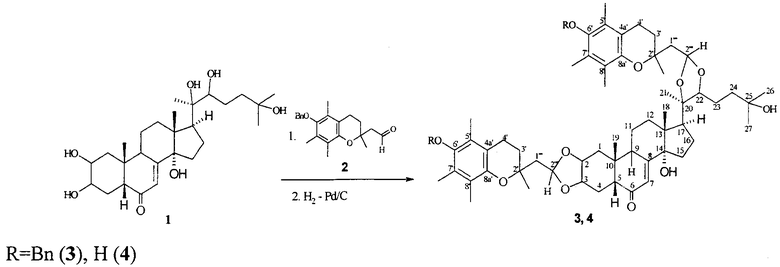
Решение поставленной задачи было достигнуто взаимодействием 20-гидроксиэкдизона (1) со стехиометрическим количеством (6-гидрокси-2,5,7,8-тетраметилхроман-2-ил)ацетальдегида (2) в этилацетате в присутствии каталитического количества пара-толулсульфокислоты TsOH (10% от веса экдистероида) при комнатной температуре (~20°C) течение 24 часов. При этом с выходом 62% образуется бис-конъюгированный аддукт (3). Если n-TsOH заменить на другой катализатор, например, фосфорномолибденовую кислоту (ФМК), то время реакции увеличивается.
6-Дебензилирование конъюгата (3) гладко протекает при гидрировании в растворе этанола в присутствии катализатора Pd-C и приводит к соответствующему соединению (4) со свободными фенольными группами.
Соединения 3, 4 являются новыми. Их структура доказана методами ЯМР 1H и 13C. Для соединения 4 был снят масс-спектр MALDI TOF и зарегистрирован ион [M+H]+. В спектрах ЯМР 1H и 13C полученных гибридных соединений 3, 4 зарегистрированы сигналы всех атомов углерода и водорода экдистероидного и хроманильного фрагментов молекул.
Полученный экдистероидсодержащий конъюгат с C2-аналогом витамина E 4 перспективен для использования в качестве адаптогенного и геропротекторного препарата при заболеваниях, связанных с активацией процессов перекисного окисления в организме.
Сущность метода продемонстрирована на следующих примерах.
Пример 1. 2,3:20,22-Бис-O-[2-(6-бензилокси-2,5,7,8-тетраметилхроман-2-ил)этилиден]-20-гидроксиэкдизон (3). К раствору 0.20 г (0.42 ммоль) соединения 1 в 3 мл EtOAc прилили раствор 0.28 г (0.83 ммоль) альдегида 2 в 3 мл EtOAc и добавили 0.02 г TsOH, реакционную смесь перемешивали 24 ч при комнатной температуре и упарили. Остаток хроматографировали на колонке (20 г SiO2, элюент - CHCl3). Получили 0.29 г (62%) соединения 3, Rf 0.56 (CHCl3-MeOH, 20:1), т.пл. 128-130°C, [α]D 20+20.7° (с 2.03, CHCl3). Спектр ЯМР 1Н (CDCl3), δ, м.д., J, Гц: 0.90 с (3Н, H3C18), 1.00 с (3Н, Н3С19), 1.17 с (3Н, Н3С21), 1.27 с (3Н, H3C26), 1.28 с (3Н, H3C27), 1.37 с (6Н, СН3-С2' и CH3-C2''), 2.11 с, 2.18 с и 2.24 с (18Н, 6 СН3-Ar), 2.63 м (4Н, H2C4' и H2C4''), 3.62 м (1Н, HC22), 4.10 м (1Н, HC2), 4.14 м (1Н, НС3), 4.71 с (4Н, OCH2Ph), 5.18 уш.с. (1Н, НС2'''', w1/2=13.0 Гц), 5.24 уш.с. (1Н, НС2''', w1/2=13.0 Гц), 5.85 с (1Н, НС7), 7.35-7.50 м (10Н, Н-Ar). Спектр ЯМР 13С (CDCl3), δ, м.д.: 11.92, 12.01 и 12.89 (6 Ме-Ar), 17.00 (С18), 20.56 (С19), 20.56 (С4' и С4''), 21.50 (C11), 23.04 (C16), 23.61 (C21), 24.80 (MeC2'), 24.97 (MeC2''), 26.68 (С23), 29.47 (С26 и С27), 30.86 (С15), 30.94 (C4), 31.74 (С3'), 31.85 (С3'') 34.00 (С12), 34.71 (С9), 37.82 (С1), 38.40 (С10), 41.41 (С24), 45.53 (С13), 47.36 (С5), 49.74 (С1''', С17), 50.83 (С1''''), 70.48 (С25), 73.36 (С2' и С2''), 74.75 (OCH2Ph), 76.75 (С3), 77.07 (C2), 83.55 (С20), 83.85 (С22), 84.86 (С14), 101.41 и 101.63 (С2''''), 102.00 (С2'''), 117.41 (C8a'), 117.49 (C8a''), 121.43 (С7), 123.04 (С8' и С8''), 126.06 (С7', С7''), 127.74, 127.76 и 128.47 (Ph), 128.055 (С5', С5''), 137.97 (ОСН2-С), 147.48 (C4a'), 147.60 (C4a''), 148.39 (С6' и С6''), 163,23 (С8), 202.62 (С6).
Пример 2. К раствору 0.20 г (0.42 ммоль) соединения 1 в 3 мл EtOAc прилили раствор 0.28 г (0.83 ммоль) альдегида 2 в 3 мл EtOAc и добавили 0.02 г ФМК, реакционную смесь перемешивали 54 ч при комнатной температуре и упарили. Далее обрабатывали как описано в примере 1. Получили 0.29 г (61%) соединения 3, идентичного полученному в примере 1.
2,3:20,22-Бис-O-[2-(6-гидрокси-2,5,7,8-тетраметилхроман-2-ил)этилиден]-20-гидроксиэкдизон (4). Через суспензию 0.28 г (0.25 ммоль) соединения 3 и 0.07 г катализатора (10% Pd-C) в 5 мл абс. метанола пропускали водород (контроль ТСХ, ~3 ч). Катализатор отфильтровали, фильтрат упарили. Остаток хроматографировали на колонке (15 г SiO2, элюент - CHCl3). Получили 0.23 г (96%) соединения 4, т.пл. 130-134°С, [α]D 20+24.5° (с 1.82, CH2Cl2). Спектр ЯМР 1Н (CDCl3), δ, м.д., J, Гц: 0.81 с (3Н, H3C18), 0.97 с (3Н, H3C19), 1.15 с (3Н, Н3С21), 1.26 с (6Н, Н3С26, Н3С27), 1.33 с (3Н, СН3С2'), 1.34 с (3Н, СН3С2''), 2.11 с, 2.16 с и 2.18 с (18Н, 6 СН3-Ar), 2.62 с (4Н, CH2 4' и CH2 4''), 3.59 м (1Н, С22), 4.12 м (1Н, HC2), 4.46 м (1Н, HC3), 5.14 уш.с. (1Н, HC2''''), 5.21 уш.с. (1Н, HC2'''), 5.82 с (1Н, HC7). Спектр ЯМР 13С (CDCl3), δ, м.д.: 11.32, 11.85 и 12.26 (Me-Ar), 16.97 (С18), 20.63 (С19), 20.63 (С4' и С4''), 21.46 (С11), 23.00 (С16), 23.53 (С21), 24.37 (МеС2'), 24.64 (МеС2''), 26.65 (С23), 29.43 (С26 и С27), 30.82 (С15), 30.92 (С4), 31.65 (С3'), 31.95 (С3'') 33.16 (С12), 34.69 (С9), 37.80 (С1), 38.37 (С10.), 41.38 (С24), 45.42 (С13), 47.33 (С5), 49.71 (С17), 50.90 (С1''' и С1''''), 70.51 (С25), 73.05 (С2'), 73.32 (С2''), 76.73 (С3), 77.05 (С2), 83.59 (С20), 83.83 (С22), 84.80 (С14), 101.44 и 101.66 (1Н, С2'''') 102.01 (1Н, С2'''), 117.10 (C8a' и C8a''), 118.71(C5' и C5''), 121.38 (С8', С8'', С7), 122.64 (С7'и С7''), 144.81 (C4a' и C4a''), 145.11 (С6'), 163.21 (С8), 203.01 (С6). MALDI-TOF MS: m/z 942.360 [М+Н]+. Вычислено для (C57H80O11+H) 942.248.
Для бисаддукта (4) было изучено влияние на процессы перекисного окисления липидов (ПОЛ) в экспериментах in vitro на гомогенате печени. В опытах т vivo на интактных животных определяли степень накопления малонового диальдегида (МДА) в печени и активность ферментов антиоксидантной системы - каталазы и супероксиддисмутазы. У животных с острым экспериментальным гепатитом в гомогенате печени определяли содержание диеновых коньюгатов (ДН), малонового диальдегида и восстановленного глютатиона.
Биологическая активность препарата (4) продемонстрирована следующими примерами.
Пример 1. Опыты проводили в системе in vitro на гомогенатах печени нормальных животных (крысы-самцы - 160-180 г). Процессы перекисного окисления липидов (ПОЛ) активировали путем добавления сульфата железа (II) (1·10-4 М) и аскорбиновой кислоты (2·10-4 М). Один из конечных продуктов ПОЛ - малоновый диальдегид (МДА) определяли в реакции с тиобарбитуровой кислотой.
Проведенные эксперименты показали выраженное ингибирующее влияние соединения 4 на процессы ПОЛ, что проявляется подавлением реакции образования МДА на 94.2%. Соответствующий эффект витамина Е (использовали аптечный препарат токоферола в конечной концентрации 1·10-4 г/мл) и экдистерона составлял 83.3 и 27.8% соответственно (табл.1).
Пример 2. Крысам самцам (160-180 г) орально в течение 7 дней вводили соединение 4 (5 мг/кг), экдистерон (5 мг/кг) и витамин Е (50 мг/кг). (Дозы предварительно определили как наиболее оптимальные). После окончания эксперимента животных забивали декапитацией (под легким эфирным наркозом). В печени животных определяли содержания МДА [Стальная И.Д., Гариашвили Т.Г. Методы определения малонового диальдегида с помощью тиобарбитуровой кислоты // Современные методы в биохимии, под ред. В.Н. Ореховича, М., 1977, с.66-68] и активность ферментов антиоксидантной системы: каталазы и супероксиддисмутазы (СОД) по методам [Королюк М.А., Иванова Л.И., Майорова И.Т. и др. Метод определения активности каталазы // Лаб. дело, 1988, №1, с.16-19] и [Дубинина Е.Е., Сальникова Л.А., Ефимова Л.Ф. Активность и изоферментный спектр супероксиддисмутазы эритроцитов и плазмы крови человека // Лаб. дело, 1983, №10, с.30-33].
Проведенные исследования показали, что как и в опытах in vitro, введение соединения 4 в организм животных приводит к угнетению процессов ПОЛ, о чем свидетельствовало понижение содержания в печени МДА на 42% по сравнению с показателями интактной группы. При введении экдистерона и витамина Е содержание МДА в печени понижалось только на 17.9 и 30% (табл.2). При этом в случае введения соединения 4 отмечено также более выраженное повышение активности ферментов, определяющих состояние антиоксидантной защиты организма (табл.2).
Пример 3. Опыты проводили на крысах-самцах массой 180-200 г. Поражение печени у них вызывали путем введения ССЦ (по 0.4 мл 50% масляного раствора на 100 г массы ежедневно в течение 4-х дней) [Левшин Б.И, Экспериментальная фармакотерапия препаратами селена и тиазолидина токсического повреждения печени: Автореф. дис. д-ра мед. наук., Харьков, 1973]. Известно, что CCl4 является сильным прооксидантом. Начиная со 2-го дня введения CCl4, крысам орально при помощи специального зонда вводили внутрь экдистерон (5 мг/кг), соединение 4 (5 мг/кг) и витамин Е (50 мг/кг) (дозы подобрали как наиболее эффективные в предварительных экспериментах).
По истечении 3-х дней после повторного введения препаратов животным (через 2 часа после последнего введения) крыс забивали декапитацией (под легким эфирным наркозом). О выраженности процессов перекисного окисления липидов (ПОЛ) судили по содержанию диеновых коньюгатов (ДК), малонового диальдегида (МДА) и восстановленного глютатиона в гомогенате печени. Содержание диеновых коньюгатов и восстановленного глютатиона определяли по методу [Стальная И.Д. Метод определения диеновой конъюгации ненасыщенных высших жирных кислот // Современные методы в биохимии, под ред. В.Н. Ореховича, М., 1977, с.63-64] и [Смирнов В.В. Глютатион - зависимая антиоксидантная система головного мозга при черепно-мозговой травме // Дис. канд. мед. наук., СПб, 1995, 153 с.]. Проведенные эксперименты показали, что введение крысам CCl4 приводило к резкой активации ПОЛ, о чем свидетельствовало увеличение количества ДК, МДА (на 164.8-69.7%) и снижение восстановленного глютатиона (на 51.4%) в гомогенатах печени. Соединение 4 и в этих опытах проявило выраженное антиоксидантное действие, заметно более превосходящее действие экдистерона и витамина Е. Под действием соединения 4 содержание ДК и МДА в печени крыс с CCl4 - гепатитом было ниже на 53.5 и 36.9% и всего на 23.1 и 7.1% (p>0.05) выше, чем у интактных животных. Экдистерон понижал содержание ДК и МДА только на 29.5 и 20.9%. Витамин Е оказывал тоже выраженный эффект, но и в этом случае содержание ДК и МДА снизилось только на 41.5 и 26.8%. Соединение 4 проявило также выраженный глютатионстабилизирующий эффект. И в этом случае соединение 4 действовало более выражено, чем собственно экдистерон и витамин Е (табл.3).
Таким образом, соединение 4 обладает выраженным антиоксидантным действием, что открывает перспективу его использования при целом ряде заболеваний, в основе которых лежит активация процессов перекисного окисления липидов.
В результате проведенного тестирования соединение 4 показало более высокую антиоксидантную активность в сравнении с витамином Е и 20-гидроксиэкдизоном (экдистерон).
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОТИВОЛУЧЕВОЕ СРЕДСТВО | 2006 |
|
RU2326672C2 |
| АНТИОКСИДАНТ | 1991 |
|
RU2056846C1 |
| СРЕДСТВО "ЭКДИСТЕРОН-80", ОБЛАДАЮЩЕЕ КАРДИОПРОТЕКТОРНОЙ, АДАПТОГЕННОЙ, АНТИГИПОКСИЧЕСКОЙ, ГАСТРОПРОТЕКТОРНОЙ, ТЕРМОПРОТЕКТОРНОЙ, АНАБОЛИЧЕСКОЙ И АКТОПРОТЕКТОРНОЙ АКТИВНОСТЬЮ, И СПОСОБ ЕГО ПРОИЗВОДСТВА | 2006 |
|
RU2321420C1 |
| ГИПОЛИПИДЕМИЧЕСКОЕ И ПРОТИВОИШЕМИЧЕСКОЕ СРЕДСТВО "СЕРПИСТЕН" | 2007 |
|
RU2337701C1 |
| СРЕДСТВО НА ОСНОВЕ ПРИРОДНЫХ ФОСФОЛИПИДОВ | 2008 |
|
RU2367443C1 |
| ЭКСТРАКТ ИЗ ЛИСТЬЕВ ШПИНАТА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2015 |
|
RU2627450C1 |
| ФОСФОЛИПИДНАЯ КОМПОЗИЦИЯ ЭКДИСТЕНА, ОБЛАДАЮЩАЯ АДАПТОГЕННОЙ И ГЕПАТОПРОТЕКТОРНОЙ АКТИВНОСТЬЮ | 2013 |
|
RU2575561C2 |
| СПОСОБ ПОЛУЧЕНИЯ МЕТИЛПЕРЕГРУППИРОВАННОГО ЭКДИСТЕРОИДА - 2,3:20,22-ДИАЦЕТОНИДА 9α,13α-ЭПОКСИ-14β-МЕТИЛ-13-ДЕМЕТИЛ-14-ДЕЗОКСИ-7,8-ДИГИДРО-20-ГИДРОКСИЭКДИЗОНА | 2010 |
|
RU2443709C1 |
| (Z)-МЕТИЛ-16-(5-ОКСО-2-ФЕНИЛ-ОКСАЗОЛ-4-ИЛИДЕНМЕТИЛ)-15,16-ЭПОКСИ-8(17),13(16),14-ЛАБДАТРИЕН-18-ОАТ, ОБЛАДАЮЩИЙ АНТИОКСИДАНТНОЙ, ГЕПАТОПРОТЕКТОРНОЙ И ГЕМОСТИМУЛИРУЮЩЕЙ АКТИВНОСТЬЮ | 2007 |
|
RU2353620C1 |
| ЭКСТРАКТ ИЗ РАСТЕНИЯ Аlhagi pseudalhagi, ФАРМАЦЕВТИЧЕСКАЯ И КОСМЕТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ, СПОСОБЫ СНИЖЕНИЯ СОДЕРЖАНИЯ ХОЛЕСТЕРИНА И ТРИГЛИЦЕРИДОВ В КРОВИ, СНИЖЕНИЯ УРОВНЯ ПРОДУКТОВ ОКИСЛЕНИЯ ЛИПИДОВ, УЛУЧШЕНИЯ МИКРОЦИРКУЛЯЦИИ, АНТИОКСИДАНТНЫХ СВОЙСТВ, УЛУЧШЕНИЯ СОСТОЯНИЯ КОЖНЫХ ПОКРОВОВ, СТИМУЛИРОВАНИЯ ОБРАЗОВАНИЯ КОЛЛАГЕНА, РАНОЗАЖИВЛЕНИЯ И СНИЖЕНИЯ ВОСПАЛЕНИЯ | 2008 |
|
RU2402345C2 |
Изобретение относится к органической химии и химии природных соединений, конкретно к способу получения нового соединения, производного 20-гидроксиэкдизона, конъюгированного с короткоцепочечным аналогом витамина E, перспективного для медицины и фармакологии, а именно к способу получения конъюгата 20-гидроксиэкдизона путем его взаимодействия с (6-гидрокси-2,5,7,8-тетраметилхроман-2-ил)ацетальдегидом в этилацетате при комнатной температуре в присутствии кислотного катализатора (TsOH или ФМК) в течение 24 ч, с последующим дебензилированием полученного промежуточного конъюгата в растворе этанола в присутствии катализатора Pd-C. Изобретение также относится к применению этого соединения в качестве антиоксидантного средства, ингибирующего процесс перекисного окисления липидов. Полученные гибридные соединения перспективны в медицине и фармакологии как новые геропротекторные антиоксиданты. 2 н. и 1 з.п. ф-лы, 3 табл., 3 пр.
1. Способ получения конъюгата (6-гидрокси-2,5,7,8-тетраметилхроман-2-ил)ацетальдегида с 20-гидроксиэкдизоном, отличающийся тем, что 20-гидроксиэкдизон взаимодействует со стехиометрическим количеством 6-гидрокси-2,5,7,8-тетраметилхроман-2-ил)ацетальдегидом в этилацетате в присутствии кислотного катализатора при температуре ~20°C в течение 24 ч, с последующим дебензилированием полученного промежуточного конъюгата в растворе этанола в присутствии катализатора Pd-C.
2. Способ по п.1, отличающийся тем, что в качестве кислотного катализатора использовали пара-толуолсульфокислоту (TsOH) или фосфорномолибденовую кислоту (ФМК) в количестве 10% от веса экдистероида.
3. Применение конъюгата (6-гидрокси-2,5,7,8-тетраметилхроман-2-ил)ацетальдегида с 20-гидроксиэкдизоном в качестве антиоксидантного средства, ингибирующего процесс перекисного окисления липидов.
| Manfredini S | |||
| Et al, Bioorganic & Medical Chemistry, 2000, v.8, №12, p.2791-2801 | |||
| Odinokov V.N | |||
| et al | |||
| Chemistry of Heterocyclic Compouds, 2008, v.44, №9, p.1077-1091 | |||
| Odinokov V.N | |||
| et al | |||
| Akivoc, 2003, (13), p.l01-118 | |||
| WO 0230462 A2, 18.04.2002. |
Авторы
Даты
2013-08-20—Публикация
2010-05-28—Подача