Изобретение относится к синтезу природных соединений, конкретно к синтезу экдистероидов-гормонов линьки насекомых.
Экдистероиды - относительно новый класс природных соединений, полигидроксилированных стеринов, выполняющих функцию гормонов линьки, метаморфоза и диапаузы насекомых и ракообразных. Открытые в середине 1950-х годов в организме насекомых они спустя 10 лет были выделены из растений. Фитоэкдистероиды рассматриваются как аллелохимические токсины и антифиданты для насекомых, не адаптированных к определенным экдистероидам. Наряду с одним основным экдистероидом (2-2.5% от сухой массы), растения, как правило, содержат набор минорных экдистероидов модифицированной структуры, синтезируемых в ответ на приобретаемую адаптацию насекомых-фитофагов к поступающим с пищей фитоэкдистероидам.
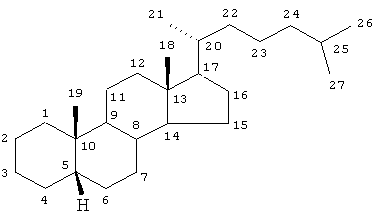
Стероидный остов экдистероидов имеет структуру 5β-холестана:
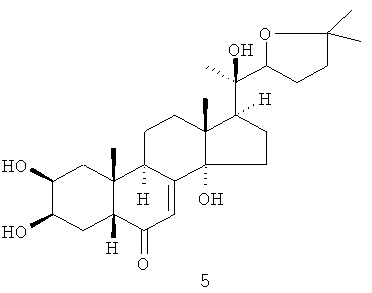
Из коры растения Stachyurus praecox были выделены 4 фитоэкдистероида 2-5 (выход каждого 0,002-0,004%) [стахистерон А (2), стахистерон В (3), стахистерон С (4) и стахистерон D (5)], имеющих одинаковую молекулярную формулу (С27Н12О6), соответствующую потере молекулы воды от 20-гидроксиэкдизона (1) [S. Imai, E. Murata, S. Fujioka, T. Masuoka, M. Koreeda, К. Nakanishi J. Amer. Chem. Soc., 1970, 92, 7510].
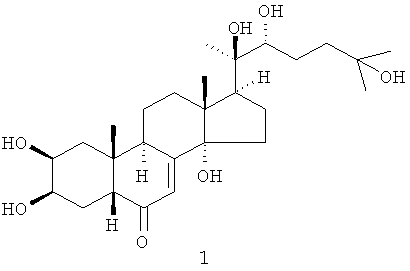
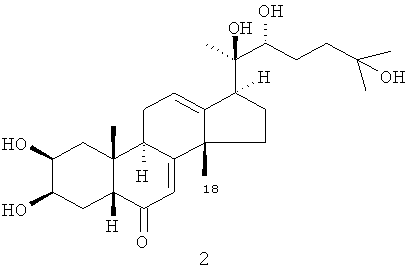
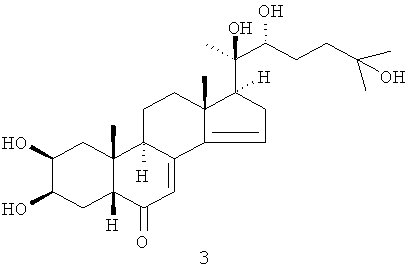
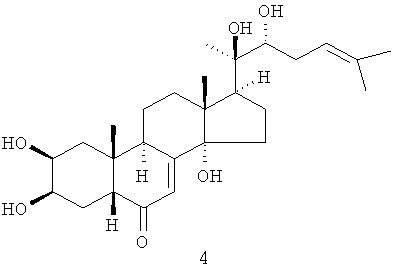
Один из выделенных фитоэкдистероидов - стахистерон А 2 оказался первым (и пока единственным) природным 27-углеродным стероидом с перегруппированной (из 13-го положения в положение 14) метильной группой.
Задачей изобретения является разработка способа получения С27-стероида 9 с перегруппированной метильной группой путем каталитического гидрирования над палладиевым катализатором (10% Pd/C) в спиртовом растворе в присутствии алкоголята щелочного металла следующих соединений: диацетонида 9α,14α-эпокси-14-дезокси-20-гидроксиэкдизона 6, диацетонида 14α-гидроперокси-20-гидроксиэкдизона 7 или диацетонида 8(14)-ен-20-гидроксиэкдизона 8.
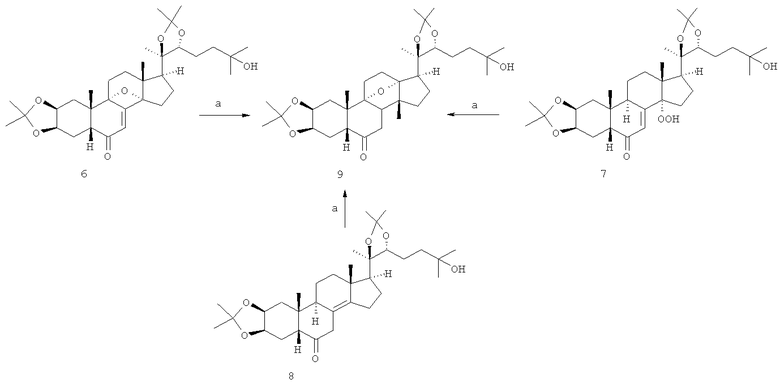
Реагенты и условия: а. (1) H2/Pd-C, MeOH-MeONa, (2) NH4Cl, (3) KX (SiO2).
Исходные соединения 6-8 являются продуктами трансформации диацетонида 20-гидроксиэкдизона в литий-аммиачном растворе [V.N. Odinokov, I.V. Galyautdinov, A.Sh. Ibragimova, N.A. Veskina, L.M. Khalilov, P.M. Dolgushin and Z.A. Starikova, Mendeleev Commun., 2008,18, 291].
Реакция завершается обработкой реакционной смеси насыщенным раствором NH4Cl, хроматографированием продукта на колонке с SiO2 и упариванием элюата с получением 2,3:20,22-диацетонида 9α,13α-эпокси-14β-метил-13-деметил-20-гидроксиэкдизона 9.
Способ получения 2,3:20,22-диацетонида 9α,13α-эпокси-14β-метил-13-деметил-14-дезокси-7,8-дигидро-20-гидроксиэкдизона 9 - С27-стероида с перегруппированной метильной группой заключается в гидрировании над палладиевым катализатором (10% Pd-C) в растворе спирта (лучше метанола) в присутствии алкоголята щелочного металла (лучше метилата натрия) диацетонида 9α,14α-эпокси-14-дезокси-20-гидроксиэкдизона 6 или диацетонида 14α-гидроперокси-20-гидроксиэкдизона 7 или Δ8(14) - 14-дезокси-20-гидроксиэкдизона 8 с последующей обработкой реакционной смеси раствором хлористого аммония и выделением известными приемами целевого 2,3:20,22-диацетонида 9α,13α-эпокси-14β-метил-13-деметил-14-дезокси-7,8-дигидро-20-гидроксиэкдизона 9.
Соединение 9 может быть использовано для получения других стероидов (экдистероидов) с перегруппированной метильной группой.
Структура полученного экдистероида 9 была подтверждена данными одномерных и двумерных спектров ЯМР 1Н и 13С.
Способ поясняется следующими примерами.
Пример 1
К раствору диацетонида 9α,14α-эпокси-14-дезокси-20-гидроксиэкдизона 6 (0.2 г, 0.358 ммоль) в 5 мл абсолютированного этанола при перемешивании добавили мелко измельченный натрий (0.044 г, 19 ммоль), перемешивали 30 минут при комнатной температуре. Затем реакционную смесь продули аргоном и внесли 10% Pd/C (0.2 г), барботировали водород при перемешивании в течение 1 ч. Катализатор отфильтровали, раствор выпарили, остаток растворили в безводном EtOAc (20 мл), раствор промыли насыщенным раствором NH4Cl (10 мл) и концентрировали. Сухой остаток хроматографировали на колонке (5 г SiO2, элюент-хлороформ), получили 0.12 г (60%) соединения 9 (Rf 0.45, CHCl3-МеОН, 7:1), т.пл. 112-114°С, [α]D 20 46.5 (с 1.49, CHCl3). ЯМР 1Н (400 МГц, CDCl3): δ: 0.97 с (3Н, Н3С18), 1.14 с (3Н, Н3С21), 1.21 с (6Н, Н3С26, Н3С27), 1.26 с (3Н, Н3С19), 1.30, 1.31, 1.40 и 1.50 все с (12Н, 2Ме2С), 1.60-2.25 м (18Н, СН, СН2), 2.48 к (1Н, НС8), 2.46 м (1Н, Н5), 2.63 д (1Н, Н7), 3.67 м (1Н, НС22), 4.43 уш с (2Н, НС2, НС3). Спектр ЯМР 13С (100, МГц, CDCl3), δ: 17.0 к (С18), 21.3 т (С11), 22.4 к (С21), 23.4 к (С19), 23.7 т (С23), 25.6 т (С16), 25.9 т (С15), 26.0, 26.6, 26.7, 28.4 все к (2Me2CO2), 29.0 к (С26 и С27), 29.8 т (С12), 31.0 т (С4), 37.6 т (С1), 39.8 с (С10), 41.5 т (С24), 46.0 д (С8), 47.1 т (С7), 47.5 д (С17), 52.9 д (С5), 52.9 с (С14), 70.3 с (С25), 71.7 д (С2), 72.1 д (С3), 81.8 д (С22), 83.9 с (С20), 87.1 с (С9), 98.3 с (С13), 106.8 и 107.0 оба с (2Me2CO2), 212.5 с (С6).
Пример 2
К раствору диацетонида 14α-гидропероксида 20-гидроксиэкдизона 7 (0.227 г, 0.347 ммоль) в 5 мл абсолютированного метанола при перемешивании добавили мелко измельченный натрий (0.06 г, 26 ммоль), перемешивали 30 минут при комнатной температуре. Затем продули реакционную смесь аргоном и внесли 10% Pd/C (0.46 г), барботировали водород при перемешивании в течение 3 ч. Катализатор отфильтровали, добавили 3 мл воды, нейтрализовали насыщенным раствором NH4Cl, экстрагировали EtOAc (3×20 мл), органические слои выпарили. Сухой остаток хроматографировали на колонке (5 г SiO2, элюент-хлороформ), получили 0.140 г (62%) соединения 9 (Rf 0.45, CHCl3-МеОН, 7:1), идентичного полученному в примере 1.
Пример 3
К раствору диацетонида 8(14)-ен-14-дезокси-20-гидроксиэкдизона 8 (0.2 г, 0.368 ммоль) в 10 мл сухого метанола при перемешивании добавили мелко измельченный натрий (0.045 г, 20 ммоль), перемешивали 30 минут при комнатной температуре. Затем продули реакционную смесь аргоном и внесли Pd/C (0.54 г), барботировали водород при перемешивании в течение 2 ч. Катализатор отфильтровали, выпарили, растворили в безводном ЕtOАс (20 мл), промыли насыщенным раствором NH4Cl (10 мл), органические слои концентрировали. Сухой остаток хроматографировали на колонке (5 г SiO2, элюент-хлороформ), получили 0.13 г (65%) соединения 9 (Rf 0.45, CHCl3-МеОН, 7:1), идентичного полученному в примере 1.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 2,3-ДЕЗОКСИ-ΔЭКДИСТЕРОИДОВ | 2020 |
|
RU2760001C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2,3-МОНОАЦЕТОНИДА 20-ГИДРОКСИЭКДИЗОНА | 2007 |
|
RU2351604C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОНЪЮГАТА (6-ГИДРОКСИ-2,5,7,8-ТЕТРАМЕТИЛХРОМАН-2-ИЛ)АЦЕТАЛЬДЕГИДА С 20-ГИДРОКСИЭКДИЗОНОМ И ЕГО ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТИОКСИДАНТНОГО СРЕДСТВА, ИНГИБИРУЮЩЕГО ПРОЦЕСС ПЕРЕКИСНОГО ОКИСЛЕНИЯ ЛИПИДОВ | 2010 |
|
RU2490267C2 |
| СПОСОБ ПОЛУЧЕНИЯ 2-ДЕГИДРО-3-ЭПИ-20-ГИДРОКСИЭКДИЗОНА, МИНОРНОГО ЭКДИСТЕРОИДА СЕМЯН РАСТЕНИЙ Froelichia floridana | 2008 |
|
RU2397177C2 |
| СПОСОБ ПОЛУЧЕНИЯ 7,8-ДИГИДРОАНАЛОГОВ ЭКДИСТЕРОИДОВ | 2010 |
|
RU2434877C1 |
| СПОСОБ ПОЛУЧЕНИЯ α-ЭКДИЗОНА | 2003 |
|
RU2246966C1 |
| СПОСОБ ПОЛУЧЕНИЯ ШИДАСТЕРОНА | 2001 |
|
RU2183641C1 |
| СРЕДСТВО "ЭКДИСТЕРОН-80", ОБЛАДАЮЩЕЕ КАРДИОПРОТЕКТОРНОЙ, АДАПТОГЕННОЙ, АНТИГИПОКСИЧЕСКОЙ, ГАСТРОПРОТЕКТОРНОЙ, ТЕРМОПРОТЕКТОРНОЙ, АНАБОЛИЧЕСКОЙ И АКТОПРОТЕКТОРНОЙ АКТИВНОСТЬЮ, И СПОСОБ ЕГО ПРОИЗВОДСТВА | 2006 |
|
RU2321420C1 |
| 14-ЗАМЕЩЕННЫЕ МАРКФОРТИНЫ | 1994 |
|
RU2131877C1 |
| ПРОТИВОПАРАЗИТАРНЫЕ МАРКФОРТИНЫ И ПАРАГЕРКВАМИДЫ | 1996 |
|
RU2162090C2 |
Изобретение относится к органической химии и химии природных соединений, конкретно к способу получения нового соединения, производного диацетонида 20-гидроксиэкдизона с перегруппированной 18-метальной группой, ранее неизвестного.
Описан способ получения С27-стероида с перегруппированной метальной группой путем гидрирования над палладиевым катализатором (10% Pd/C) в растворе спирта (преимущественно метанола) в присутствии алкоголята щелочного металла (преимущественно метилата натрия) диацетонида 9α,14α-эпокси-14-дезокси-20-гидроксиэкдизона или диацетонида 14α-гидроперокси-20-гидроксиэкдизона, или Δ8(14) - 14-дезокси-20-гидроксиэкдизон с последующей обработкой реакционной смеси раствором хлористого аммония и выделением известными приемами целевого 2,3:20,22-диацетонида 9α,13α-эпокси-14β-метил-13-деметил-14-дезокси-7,8-дигидро-20-гидроксиэкдизона с выходами 60-65%. 3 пр.
Способ получения метилперегруппированного экдистероида - 2,3:20,22-диацетонида 9α,13α-эпокси-14β-метил-13-деметил-14-дезокси-7,8-дигидро-20-гидроксиэкдизона, отличающийся тем, что исходные соединения диацетонид 9α,14α-эпокси-14-дезокси-20-гидроксиэкдизона, диацетонид 14α-гидропероксида 20-гидроксиэкдизона или диацетонид 8(14)-ен-14-дезокси-20-гидроксиэкдизона гидрируют над палладиевым катализатором в растворе спирта (преимущественно метанола) в присутствии алкоголята щелочного металла (преимущественно метилата натрия) с последующим выделением известными приемами.
| S.IMAI et al // J | |||
| Amer | |||
| Chem | |||
| Soc | |||
| Кинематографический аппарат | 1923 |
|
SU1970A1 |
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| V.N.ODINOKOV et al // Mendeleev Commun | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Способ использования делительного аппарата ровничных (чесальных) машин, предназначенных для мериносовой шерсти, с целью переработки на них грубых шерстей | 1921 |
|
SU18A1 |
| Способ получения @ -экдизона из растения рода @ | 1983 |
|
SU1146050A1 |
| СПОСОБ ПОЛУЧЕНИЯ α-ЭКДИЗОНА | 2003 |
|
RU2246966C1 |
Авторы
Даты
2012-02-27—Публикация
2010-07-06—Подача