Изобретение относится к медицине, конкретно к новому химическому соединению Z-метил-16-(5-оксо-2-фенил-оксазол-4-илиденметил)-15,16-эпокси-8(17),13(16),14-лабдатриен-18-оату формулы (I),
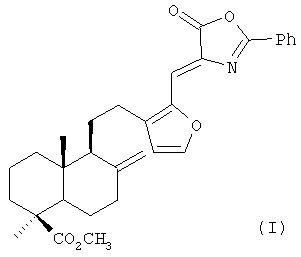
обладающему антиоксидантной, гепатопротективной и гемостимулирующей активностью.
Указанное свойство позволяет предполагать возможность использования соединения в медицине в качестве фармацевтического препарата.
В современной медицинской практике используются антиоксиданты синтетического и природного (растительного) происхождения. Среди антиоксидантов растительного происхождения применение нашли преимущественно флавоноиды, например рутин, кверцетин [1, 2], дигидрокверцетин [3]. Аналогом по фармакологическим свойствам заявляемого соединения является дигидрокверцетин [(2R,3R)-3,5,7,3',4'-пентагидроксифлаванон] формулы (II).
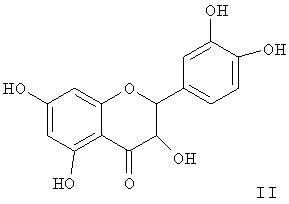
Дигидрокверцетин является основным биофлавоноидом (90% и выше) препарата диквертин, производство которого из древесины лиственницы налажено в последние годы. Дигидрокверцетин обладает антирадикальной и антиоксидантной активностью, противовоспалительными, капилляропротективными, гастро- и гепатопротекторными свойствами [3]. Основным недостатком препаратов на основе флавоноидов является возможное побочное действие на желудочно-кишечный тракт, проявляющееся в основном в виде тошноты, изжоги [1, 2].
Задачей, на решение которой направлено предлагаемое изобретение, является создание на основе отечественного растительного сырья антиоксиданта нового структурного типа с высокой гепатопротекторной активностью. Важным элементом поставленной задачи служит получение агента с улучшенными фармакологическими свойствами, направленными на коррекцию системных побочных эффектов, возникающих при применении высокотоксичных лекарственных препаратов, таких как цитостатики. Препараты данной группы, широко используемые при противоопухолевой терапии, вызывают тяжелые расстройства в виде миело- и гемодепрессии, иммунологических нарушений, функциональных и морфологических повреждений различных органов и т.д. [4, 5]. Анализ литературных данных показывает, что синтез новых соединений из растительного сырья с целью расширения ассортимента нетоксичных антиоксидантов с дополнительными (помимо антиоксидантной активности) протекторными свойствами, является актуальной задачей.
Поставленная задача решается новым химическим соединением - Z-метил-16-(5-оксо-2-фенил-оксазол-4-илиденметил)-15,16-эпокси-8(17), 13(16),14-лабдатриен-18-оатом формулы (I), обладающим выраженной антиоксидантной, гепатопротекторной и гемостимулирующей активностью, в том числе на фоне введения в организм цитостатических препаратов.
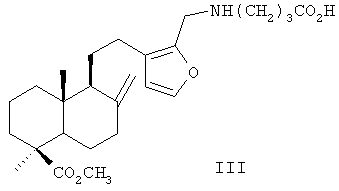
Структурным аналогом указанного соединения является 16-аминометилпроизводное ламбертиановой кислоты, формулы (III), обладающее ноотропной активностью [6].
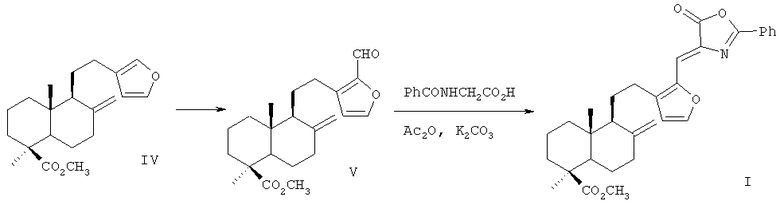
Способ получения соединения (I), имеющего строение азлактона лабданового типа, реализуется по приведенной схеме 1. Формилирование метилового эфира ламбертиановой кислоты (IV) приводит к 16-формилпроизводному (V) [7], выделяемому кристаллизацией. Взаимодействие альдегида (V) с бензоилглицином (гиппуровой кислотой) приводит к образованию лабданоидного 5(4Н)-оксазолона (I). Соединение (I) образуется с выходом до 76% в виде индивидуального изомера с (Z)-конфигурацией двойной связи. К достоинствам изобретения следует отнести способ получения соединения (I) путем химической модификации доступного растительного метаболита кедра сибирского Pinus sibirica R.Mayr. - метилового эфира ламбертиановой кислоты (IV). Последний легко выделяется из лесопромышленного продукта - кедровой живицы или из хвои кедра, являющейся многотоннажным отходом лесосеки [8]. Физико-химические константы нового, впервые полученного соединения (I) приведены в примере 1.
Схема 1
Биологическая активность соединения (I) изучалась путем определения антиоксидантной и гепатопротекторной активности на модели токсического CCl4 гепатита у мышей, а также при поражении крыс, вызванном введением циклофосфана. В качестве препарата сравнения использовали антиоксидант дигидрокверцетин (II).
Предварительно в эксперименте на беспородных мышах массой 18-23 г определяли острую токсичность при однократном внутрижелудочном способе введения. Установлено, что LD50 соединения (I) превышает максимально возможную для разового введения дозу 1000 мг/кг.
Для исследования антиоксидантного и гепатопротекторного эффектов была использована стандартная экспериментальная модель токсического CCl4 гепатита у мышей. Модель воспроизводилась согласно методическим рекомендациям [9]. Раствор CCl4 в растительном масле (25%) вводился внутрижелудочно мышам самцам. Соединение (I) вводили в желудок в дозе 100 мг/кг в виде водно-твиновой взвеси за 1 час до гепатотоксина. Референсное соединение - дигидрокверцетин (ДКВ) - вводили аналогичным образом. Через сутки в сыворотке крови мышей определяли активность аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (ACT), щелочной фосфатазы (ЩФ) и концентрацию малонового диальдегида (МДА) общепринятыми методами [10]. Установлено, что соединение (I) достоверно снижает активность трансаминаз в крови на фоне токсического гепатита, не уступая дигидрокверцетину по антицитолитическому и превосходя его по антихолестатическому эффекту (табл.1).
Изучение протекторного действия соединения (I) в условиях поражения циклофосфаном (ЦФ) изучали на крысах самках Вистар. ЦФ вводился однократно внутрибрюшинно в дозе 125 мг/кг в растворе 0.9% NaCl всем животным. Соединение (I) в виде водно-твиновой взвеси вводилось группе крыс (12 шт.) в желудок в дозе 50 мг/кг в течение трех дней после введения ЦФ. Референсное соединение - дигидрокверцетин (ДКВ) - вводили в той же дозе аналогичным образом отдельной группе крыс (10 шт.). Контрольной группе вводили только циклофосфан (10 шт.). В конце опыта определяли состав периферической крови и лейкоцитарную формулу. В сыворотке крови с помощью стандартных наборов реактивов исследовали активность аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (ACT), щелочной фосфатазы (ЩФ), концентрацию общего белка, глюкозы. Концентрацию малонового диальдегида (МДА) исследовали общепринятым методом [10].
Результаты изучения биологической активности приведены в табл.2-4. Установлено, что соединение (I) на фоне циклофосфана значительно уменьшает активность ЩФ. Отмеченный антихолестазный эффект в 1,7 раз превышает соответствующий эффект ДКВ. Соединение (I) также в 1,3 раза снижает концентрацию МДА по сравнению с ДКВ, что указывает на его антиоксидантную активность. Установлено, что при поражении циклофосфаном соединение (I) проявляет гемостимулирующий эффект, достоверно повышая количество лейкоцитов в периферической крови (в 1,7 раз относительно контроля), а также в 1,2-1,3 раза увеличивает количество эритроцитов, тромбоцитов и гемоглобина по сравнению с ДКВ.
Таким образом, новое соединение - Z-метил-16-(5-оксо-2-фенил-оксазол-4-илиденметил)-15,16-эпокси-8(17),13(16),14-лабдатриен-18-оату формулы (I) - обладает следующими преимуществами, а именно:
- Оно обладает высокой антиоксидантной и гепатопротекторной активностью, а также гемостимулирующим действием на фоне введения цитостатика циклофосфана.
- Использование для синтеза соединения (I) исходного, получаемого из доступного растительного сырья - хвои или живицы кедра сибирского Pinus sibirica R.Mayr.
Изобретение иллюстрируется следующими примерами.
Пример 1. Z-метил-16-(5 -оксо-2-фенил-оксазол-4-илиденметил)-15,16-эпокси-8(17),13(16),14-лабдатриен-18-оат (I).
К раствору 1.00 г (2.79 ммоль) 16-формилметилламбертианата (V) [7] в 15 мл уксусного ангидрида при перемешивании добавили 0.50 г (2.79 ммоль) гиппуровой кислоты и 0.38 г (2.79 ммоль) карбоната калия. Реакционную смесь перемешивали в течение 5 ч и оставили на ночь. Выпавший осадок отфильтровали, промыли водой, сушили под вакуумом и перекристаллизовывали из смеси петролейный эфир:серный эфир = 2:1. Получили 1.06 г (выход 76%) соединения (I). Тпл 112-115°С. [α]20 D 1.16 (с 7.68, CHCl3). ИК спектр, см-1: 702, 780, 883 (Ph); 883 (C=C); 983, 1551 (фуран); 1173, 1380, 1720 (CO2Ме); 1645, 1759, 1789 (азлактон). УФ спектр, λмакс., нм (lg ε) 232 (3.41), 266 (3.75), 392 (4.18), 409 (4.17). Спектр ЯМР 1Н (δ, м.д., J, Гц): 0.43 с (3Н, С20'H3), 0.82 т.д. (1Н, Н1', J 12, 3), 0.90 т.д. (1Н, H3', J 12, 3), 1.06 с (3Н, С19'H3), 1.13 д.д. (1Н, Н5', J 11, 2.4), 1.38 д.м. (1Н, H2', J 12), 1.48 д (1Н, H9', J 9), 1.60-1.80 м (6Н, H 7',2',6',11',11',1'), 1.89 д.м. (1Н, H6' J 12), 2.05 д.м. (1Н, H3', J 11), 2.36 т.д. (1Н, H7', J 11, 3), 2.51 м (1Н, H12'), 2.66 м (1Н, H12'), 3.51 с (3Н, ОСН3), 4.53 с, 4.92 с (2Н, H17',17'), 6.40 д (1Н, Н14', J 1.8), 6.92 с (1Н, Н6), 7.41 т (2Н, H3'',5'', J 7), 7.48 т.т. (1Н, H4'', J 7, 1), 7.68 д (1Н, H15, J 1.8), 8.07 д.д. (2Н, H2'',6'', J 7, 1). Спектр ЯМР С13 (CDCl3, δС м.д.): 12.36 к (С20'), 19.54 т (С21), 23.49 т (С12'), 23.89 т (С11'), 25.90 т (С6'), 28.39 к (С19'), 37.74 т (С3'), 38.19 т (С7'), 38.65 т (С1'), 39.78 с
(С4'), 43.87 с (С10'), 50.81 к (ОСН3), 54.17 д (С9'), 55.77 д (С5'), 106.58 т (С17'), 113.67 д (С14'), 115.00 д (С6), 125.32 с (С1''), 127.86 д (С2'',6''), 128.18 с (С4), 128.49 д (С3'',5''), 132.64 д (С4''), 137.80 с (С13'), 146.80 с (С16'), 147.14 с (С8'), 147.71 д (С15'), 162.14 с (С2), 167.53 с (С5), 177.27 с (С18'). Найдено: С 74.03, Н 7.11, N 2.7. C31O5NH35. Вычислено: С 74.25, Н 6.99, N 2.79.
Пример 2. Исследование гепатопротекторных свойств на модели острого токсического гепатита
Острый токсический гепатит вызывали у беспородных мышей самцов путем однократного внутрижелудочного введения 25% раствора CCl4 в подсолнечном масле из расчета по 0,1 мл на 10 г массы тела. Соединение (I) вводили внутрижелудочно в дозе 100 мг/кг в виде водно-твиновой взвеси за 1 час до воспроизведения гепатита. Контрольным животным аналогично вводили водно-твиновую взвесь в эквивалентном объеме, группе сравнения - дигидрокверцетин в дозе 100 мг/кг. Через сутки в сыворотке крови мышей определяли с помощью стандартных наборов реактивов («Biocon», «Ольвекс Диагностикум») активность аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (ACT) и щелочной фосфатазы (ЩФ). Уровень малонового диальдегида (МДА) определяли общепринятым методом [10]. Результаты обрабатывали статистически с помощью пакета программ «STATISTIKA 6».
Установлено, что соединение (I) в условиях токсического гепатита оказывает антицитолитический эффект, достоверно снижая активность трансаминаз в крови (в 1,3-1,5 раз по сравнению с контролем). По антицитолитическому действию агент (I) не уступает дигидрокверцетину, о чем свидетельствует отсутствие статистически значимых различий в показателях между соответствующими группами. Обнаружено, что под действием соединения (I) заметно понижается уровень ЩФ (в 1,9 раза по сравнению с контролем), что свидетельствует о антихолестазном действии агента. По выраженности антихолестазного эффекта соединение (I) превосходит ДКВ в 1,4 раза. Оба агента в условиях данного опыта не проявили влияния на интенсивность процессов перекисного окисления: концентрация МДА в соответствующих группах не имела достоверных различий с контролем (табл.1).
# Р<0,05 различия с ДКВ достоверны
Таким образом, показано, что соединение (I) при внутрижелудочном введении в дозе 100 мг/кг обладает гепатопротекторным действием, снижая выраженность цитолитических и холестатических процессов на фоне токсического гепатита.
Пример 3. Исследование гепатопротекторных и антиоксидантных свойств на фоне токсического поражения крыс циклофосфаном
Эксперимент проводили на крысах самках Вистар, которым вводился однократно внутрибрюшинно циклофосфан в дозе 125 мг/кг (в растворе 0.9% NaCl). Соединение (I) вводилось в желудок 12 крысам в дозе 50 мг/кг в течение трех дней после введения ЦФ (в виде водно-твиновой взвеси). Референсное соединение - дигидрокверцетин (ДКВ) - вводили в той же дозе аналогичным образом отдельной группе крыс (10 шт.). Контролем являлись животные с введением только ЦФ (10 шт.). В конце опыта в сыворотке крови исследовали с помощью стандартных наборов реактивов («Biocon», «Ольвекс Диагностикум») активность аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (ACT), щелочной фосфатазы (ЩФ), концентрацию общего белка и глюкозы.
Результаты представлены в табл.2. Установлено, что соединение (I) достоверно уменьшает активность ЩФ относительно контроля и референс соединения. Отмеченный антихолестазный эффект в 1,7 раз выше, чем у ДКВ. Соединение (I) также достоверно снизило (в 1,3 раза) концентрацию МДА относительно ДКВ, который в условиях данного опыта усилил интенсивность перекисного окисления. На фоне ЦФ соединение (I) не оказало влияние на активность трансаминаз, тогда как ДКВ достоверно снизило активность одной из них - ACT. Действия обоих соединений на показатели общего обмена (белок, глюкозу) не наблюдалось.
Из данных таблицы 2 видно, что соединение (I) при внутрижелудочном введении в дозе 100 мг/кг на фоне циклофосфанового поражения превосходит ДКВ по антихолестатическому и антиоксидантному эффекту.
# Р<0,05 различия с ДКВ достоверны.
Пример 4. Исследование гемостимулирующего действия на фоне токсического поражения крыс циклофосфаном
Эксперимент проводили на крысах самках Вистар, которым вводился однократно внутрибрюшинно циклофосфан в дозе 125 мг/кг (в растворе 0.9% NaCl). Соединение (I) вводилось в желудок 12 крысам в дозе 50 мг/кг в течение трех дней после введения ЦФ (в виде водно-твиновой взвеси). Референсное соединение - дигидрокверцетин (ДКВ) - вводили в той же дозе аналогичным образом отдельной группе крыс (10 шт.). Контролем являлись животные с введением только ЦФ (10 шт.). В конце опыта с помощью гемоанализатора MEDONIC определяли морфологический состав периферической крови. Лейкоцитарную формулу подсчитывали под микроскопом в мазках крови, окрашенных гематоксилин-эозином.
Результаты представлены в табл.3. Установлено, что соединение (I) проявляет гемостимулирующий эффект, достоверно повышая количество лейкоцитов в периферической крови (в 1,7 раз относительно контроля). Соответствующий эффект ДКВ был менее значимым (1,5 раз относительно контроля). В отношении остальных показателей крови отмечена тенденция к их нормализации под действием соединения (I), положительный эффект которого превышал эффект ДКВ. Так под действием агента (I) количество эритроцитов и тромбоцитов увеличилось соответственно в 1,3 и 1,2 раза; гематокрит и гемоглобин повысился в 1,3-1,2 раза по сравнению с ДКВ (хотя среднее содержание и концентрация гемоглобина в эритроците были достоверно выше, чем в контроле).
RBC - количество эритроцитов, НСТ - гематокрит, WBC - количество лейкоцитов, HGB - гемоглобин, PLT - тромбоциты, MCV - средний объем эритроцитов, RDW% - процент распределения по абсолютному весу красной крови, MPV - объем тромбоцитов.
На фоне вызванной циклофосфаном нейтропении в группах наблюдался умеренный лимфоцитоз. Под действием соединения (I) и ДКВ у животных развился относительный (статистически недостоверный) моноцитоз, который был более выражен в референс-группе.
Таким образом, показано, что соединение (I) при внутрижелудочном введении в дозе 100 мг/кг на фоне гемодепрессии, вызванной введением циклофосфана, превосходит ДКВ по гемостимулирующему действию.
Источники информации
1. М.Д. Машковский. Лекарственные средства, в двух томах, изд. «Торсинг», Харьков, 1998, т.2, 55.
2. Лекарственные препараты, разрешенные к применению в СССР. Под ред. М.А. Клюева, Э.А. Бабаяна. М.: Медицина, 1979, с.61-65.
3. М.Б. Плотников, Н.А. Тюкавкина, Т.М. Плотникова. Лекарственные препараты на основе диквертина. Томск. Изд-во Томского университета. 2005, 228 с.
4. М.Л. Гершанович, В.А. Филов, М.А. Акимов, А.А. Акимов. Введение в фармакотерапию злокачественных опухолей. СПб. Изд-во Сатис, 1999, 152 с.
5. В.А. Тутельян, М.М. Гаппаров, Л.Ю. Телегин, В.М. Девиченский, Л.А. Певницкий, Бюллетень экспериментальной биологии и медицины. 2003. Т.136. №12. С.604-607.
6. Т.Г. Толстикова, И.В. Сорокина, Т.В. Воевода, С.В. Чернов, Э.Э. Шульц, Г.А.Толстиков. Доклады академии наук. 2001. Т.376. №1. С.271-273.
7. Клок Д.А., Шакиров М.М., Гришко В.В., Ралдугин В.А. Известия АН. Серия химическая. 1995. №11. С.2514-2517.
8. Т.Г. Толстикова, И.В. Сорокина, М.П. Долгих, Ю.В. Харитонов, С.В. Чернов, Э.Э. Шульц, Г.А. Толстиков. Химико-фармацевтический журнал. 2004. Т.38. №10. С.13-15.
9. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. М.: Медицина, 2005, 832 с.
10. Камышников B.C. Справочник по клинико-химической лабораторной диагностике. Минск: Беларусь, 2000. Т.2, с.207.
| название | год | авторы | номер документа |
|---|---|---|---|
| 16-{2-БЕНЗОИЛАМИНО-2-[(3,5-ДИ-ТРЕТ-БУТИЛ-4-ГИДРОКСИФЕНИЛ)-АЛКИЛКАРБАМОИЛ]ВИНИЛ}-ЛАБДАТРИЕНЫ С АНТИОКСИДАНТНЫМИ, ГЕПАТОПРОТЕКТОРНЫМИ И ГЕМОСТИМУЛИРУЮЩИМИ СВОЙСТВАМИ | 2007 |
|
RU2346940C1 |
| АНТИОКСИДАНТ, ОБЛАДАЮЩИЙ ГЕПАТОПРОТЕКТОРНОЙ И ГЕМОСТИМУЛИРУЮЩЕЙ АКТИВНОСТЬЮ | 2007 |
|
RU2364599C2 |
| БЕНЗИЛУРСОНАТ - ПРОТИВОВОСПАЛИТЕЛЬНОЕ И ГЕПАТОПРОТЕКТОРНОЕ СРЕДСТВО | 2010 |
|
RU2430106C1 |
| КАЛИЕВАЯ СОЛЬ КАРБОКСИМЕТИЛОВОГО ЭФИРА 3-ОКСИ-УРСАН-12-ЕН-28-ОВОЙ КИСЛОТЫ, ОБЛАДАЮЩАЯ ГЕПАТОПРОТЕКТОРНОЙ, АНТИОКСИДАНТНОЙ И ПРОТИВОВОСПАЛИТЕЛЬНОЙ АКТИВНОСТЬЮ | 2010 |
|
RU2430105C1 |
| НОВЫЙ КОМПЛЕКС БИОЛОГИЧЕСКИ АКТИВНЫХ СОЕДИНЕНИЙ ИЗ КОРЫ ЛИСТВЕННИЦЫ-ПИКНОЛАР | 2003 |
|
RU2252028C2 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИОКСИДАНТНЫМИ, ГЕПАТОПРОТЕКТОРНЫМИ И ПРОТИВОВОСПАЛИТЕЛЬНЫМИ СВОЙСТВАМИ | 2010 |
|
RU2436793C1 |
| КОРРЕКТОР ЦИТОСТАТИЧЕСКОЙ ПОЛИХИМИОТЕРАПИИ | 2007 |
|
RU2353623C1 |
| СРЕДСТВО ДЛЯ КОРРЕКЦИИ ЦИТОСТАТИЧЕСКОЙ ПОЛИХИМИОТЕРАПИИ С ПРОТИВОВОСПАЛИТЕЛЬНОЙ АКТИВНОСТЬЮ | 2010 |
|
RU2425680C1 |
| СПОСОБ ЛЕЧЕНИЯ ОНКОЗАБОЛЕВАНИЙ В ЭКСПЕРИМЕНТЕ | 2007 |
|
RU2396967C2 |
| N-[3-ОКСО-ЛУПАНО-28-ИЛ]-МОРФОЛИН - СРЕДСТВО КОРРЕКЦИИ ЦИТОТОКСИЧЕСКИХ ПОВРЕЖДЕНИЙ ПЕЧЕНИ С ПРОТИВООПУХОЛЕВОЙ И АНТИМЕТАСТАТИЧЕСКОЙ АКТИВНОСТЬЮ | 2011 |
|
RU2461563C1 |
Изобретение относится к (Z)-метил-16-(Z-оксо-2-фенил-оксазол-4-илиденметил)-15,16-эпокси-8(17),13(16),14-лабдатриен-18-оату формулы (I),
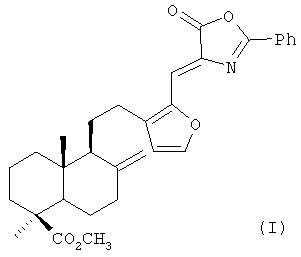
Соединение (I) обладает высокой антиоксидантной, гепатопротекторной и гемостимулирующей активностью и может быть использовано для коррекции системных побочных эффектов, возникающих при применении высокотоксичных лекарственных препаратов, используемых в противоопухолевой терапии. 4 табл.
(Z)-Метил-16-(5-оксо-2-фенил-оксазол-4-илиденметил)-15,16-эпокси-8(17),13(16),14-лабдатриен-18-оат формулы (I),
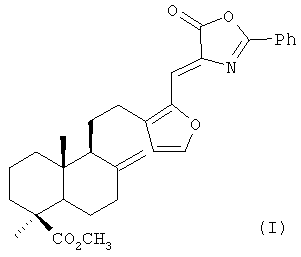
обладающий антиоксидантной, гепатопротекторной и гемостимулирующей активностью.
| Приспособление для разматывания лент с семенами при укладке их в почву | 1922 |
|
SU56A1 |
| Синтетические трансформации высших терпеноидов XV | |||
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
| - Журнал органической химии, 2007, т.43(6), с.843-854 | |||
| СРЕДСТВО ДЛЯ АКТИВАЦИИ ПРОРАСТАНИЯ СЕМЯН ПШЕНИЦЫ | 2002 |
|
RU2223647C1 |
Авторы
Даты
2009-04-27—Публикация
2007-08-23—Подача