Изобретение относится к медицине и может быть использовано, как в пищевой промышленности в виде биологически активной добавки к пище, так и в фармакологической промышленности для решения задач лечения печеночных энцефалопатий: обеспечения обратного развития поведенческих, неврологических и психических нарушений, предупреждения развития коматозного состояния пациентов и летального исхода. Для лечения острых и хронических печеночных энцефалопатий предлагаются комплексные составы, компоненты которых обладают синергичным действием на различные метаболические и сигнальные системы, включая активацию: осмопротекторных и энергетических систем, систем реакций детоксикации иона аммония и др. токсинов, а также антиоксидантных систем клеток мозга, печени и др. тканей и органов.
ПЭ - обратимые метаболические нарушения функций мозга (спектр нейропсихических нарушений), вызванные недостаточностью функций печени. В основе острых ПЭ лежит острая недостаточность функций печени - неспособность печени обеспечивать детоксикацию иона аммония (NH4 +) и других токсинов, поступающих в мозг, минуя печень. Обязательным признаком острых ПЭ является гипераммонемия (1, 2).
Хронические ПЭ чаще всего возникают при циррозе печени, вызванном алкогольным или неалкогольным стеатогепатитом, вирусным гепатитом и др. факторами. Признаком хронических форм ПЭ также является гипераммонемия, зачастую наблюдающаяся в комбинации с повышением концентраций провоспалительных цитокинов в крови (1-4).
Тяжелые формы хронических ПЭ (III и IV) и острые ПЭ зачастую могут приводить к развитию комы и гибели организма (1-6).
Принято различать три типа ПЭ (1-5), обусловленных:
А - острой (acute) недостаточностью печени;
В - наличием порто-системного шунта (by pass) без заболеваний печени;
С - циррозом (chirrhosis).
В соответствии с критериями Вест Хэвена, классифицируют (1-4) следующие стадии ПЭ:
МНЕ - минимальная (латентная) ПЭ, без видимых признаков ПЭ;
1 (I) - с инверсией сна, астериксом и др.;
2 (II) - с летаргией (апатией), дезориентацией во времени, сбивчивой речью и др.;
3 (III) - с сонливостью (ступором), полной дезориентацией, эксцентричным поведением, гиперрефлексией;
4 (IV) - кома.
Предклинические стадии МНЕ, I и II диагностируют, используя специальные психологические и нейропсихологические тесты, а стадии III и IV - клинически (2). 60-80% пациентов с циррозом имеют ПЭ, половина из них имеет выраженные ПЭ (I-IV), а ежегодный риск развития ПЭ у пациентов с циррозом достигает 20% (3, 4).
Коматозное состояние, возникающее при острых ПЭ, обычно связывают с развитием токсической или вазогенной эдемы в мозге, с дисфункцией и набуханием астроцитов и (или) с дисфункцией эндотелия и нарушением проницаемости гематоэнцефалического барьера (4, 7, 8).
В предыдущем десятилетии преобладала точка зрения (7, 9-12, 130), что избыточная активность ионотропного глутаматного рецептора (NMDA), возникающая в присутствии избытка NH4 + вызывает: - накопление Ca2 + и активацию нейрональной NOS (nNOS), с последующим накоплением NO, cGMP и активацией PKG; - активацию Na-K АТФазы и истощение АТФ; снижению концентрации глутамата и накоплению глутамина, набухание астроцитов и, тем самым, развитие токсической эдемы (отека).
В качестве основного токсического осмолита рассматривается глутамин (13, 14), который образуется в астроцитах в глутаминсинтазной реакции:
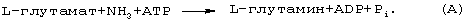
Выход из астроцитов основных буферных органических осмолитов - миоинозитола, таурина и бетаина в таких условиях не компенсирует накопление глутамина («Троянского коня»), что приводит к увеличению объема клеток за счет входа воды, к окислительному и нитрозативному стрессу и образованию митохондриальной проницаемой поры за счет гидролиза глутамина и накопления NH4 + в митохондриях (14).
В проследнее время наиболее популярным является представление о том, что набухание астроцитов и отек мозга связаны также с развитием окислительного и нитрозативного стресса, с активацией NADPH-оксидазы (15), NFкβ (16), активацией метаболизма арахидоновой кислоты (17) и истощением восстановленного глутатиона - GSH (18, 19). Считается, что нитрозативный стресс приводит к снижению активности глутаминсинтазы в мозге (А), одного из ключевых ферментов уборки NH4 + в организме (20, 21). Известно также, что при ПЭ, при наличие воспалительных процессов, имеет место также активация индуцибельной iNOS (2, 4, 7, 8, 12, 23, 116).
Окисление NAD-зависимых субстратов в митохондриях клеток мозга при ПЭ подавлено (12, 28). Имеет место существенное снижение АТФ (12, 29, 30, 124) и накопление лактата и глутамина в мозге (12, 29, 30, 48). Старая гипотеза о том, что NH4 + может замещать K+ в ряде транспортных процессов (24, 25) и вызывать деполяризацию клеток мозга, получила экспериментальное подтверждение только в последнее время (26, 27). Метаболические и сигнальные пути, вовлекаемые в механизм токсического действия NH4 + изучены недостаточно.
При острой недостаточности печени, например, когда имеет место портальная гипертензия и шунтирование печеночного кровотока, избыток NH4 + и других токсинов, продуцируемых микрофлорой желудочно-кишечного тракта (при желудочно-кишечных кровотечениях),- приводят к нарушению функций мозга и развитию острой ПЭ. К числу таких вторичных токсинов могут относиться жирные кислоты, меркаптаны, марганец, ложные трансмиттеры типа тирамина и октапамина (1, 33), лиганды периферических бензодиазепиновых (BDZ) рецепторов - нейростероиды и др. (2-4, 7, 8, 33).
В случае развития тяжелых форм хронических ПЭ (III и IV), набухание и дисфункция астроцитов не всегда наблюдаются, или наоборот, имеет место гипертрофия и гиперфункция астроцитов. Однако в любом случае окислительный и нитрозативный стресс рассматривают, как основную причину дисфункции мозга при ПЭ (1-4, 7, 8, 15).
При этом могут иметь место нарушения различных нейронных сетей в мозге, связанные: с гиперактивацией (при острых ПЭ) и с последующим подавлением (при хронических ПЭ) сигнализации в цепочке глутамат ⇒NMDA⇒Ca2+⇒cGMP⇒PKG (9-11); с нарушением в системе обмена моноаминов (34); с нарушениями в системе передачи сигналов с участием ацетилхолина (Ach) (35, 36); с доминированием сигнализации с участием тормозного трансмиттера гамма-аминомасляной кислоты (ГАМК) за счет избыточной активации периферических BDZ рецепторов (4, 7, 33) и избыточного производства митохондриями нейростероидов (7) и др.
При острой печеночной недостаточности, вызванной лекарственными отравлениями, первичными токсинами становятся активированные производные этих соединений (в частности в форме производных кофермента А), которые вызывают быстрое ожирение, снижение GSH, окислительный стресс и некроз клеток печени, а также ингибирование энергетики клеток разных типов в результате ингибирования Цикла Кребса, β-окисления жирных кислот (ЖК) и Цикла Мочевины (в печени). Рост ЖК в этих условиях приводит к развитию микровезикулярного стеатоза в печени (37, 38). Накапливающиеся КоА производные длинноцепочечных ЖК в этих условиях сами становятся токсинами, вызывающими дальнейший коллапс различных систем энергетики и гибель организма (39, 130). Такой сценарий имеет место при отравлении ацетилсалициловой кислотой (синдром Рейе и Рейеподобные заболевания (37-39)). Блокирование реакций Цикла Мочевины в печени в этих условиях приводит к развитию острой вторичной гипераммонемии.
Сходные механизмы могут реализовываться при ряде врожденных заболеваний, связанных с нарушением в системах окисления разветвленных аминокислот и с накоплением токсических КоА производных разветвленных кетокислот (пропионовая, метилмалоновая и изовалериановая ацидемии и др.) (40,41, 130). Следует отметить, что короткоцепочечные ЖК с нечетным числом атомов углерода (пропионовая и валериановая), образуемые кишечными бактериями, также могут быть важными вторичными токсинами, усиливающими токсичное действие избытка NH4 + (2,33). Роль таких вторичных токсинов не принимается во внимание.
К числу недооцениваемых вторичных токсинов, при классических формах ПЭ, относятся также длинноцепочечные ЖК (миристиновая, пальмитиновая, олеиновая, линоленовая и арахидоновая), которые могут образовываться в условиях избытка NH4 + из триглицеридов или при гидролизе фосфолипидов мембран, как это имеет место при инфаркте или инсульте (ишемия/реперфузия), когда локальное увеличение концентраций таких токсичных ЖК может достигать десятков микромолей (42, 43). Показано (44, 45), что пальмитоилкарнитин в концентрации 10-20 µМ, может вызывать гибель клеток разных типов, за счет нарушения Са2+ гомеостаза, активации липо-ксигеназных путей окисления арахидоной кислоты и гибели клеток, вследствие возникновения неспецифической катионной проводимости плазмалеммы. В присутствии NH4 + токсическое действие длинноцепочечных ЖК усиливается (46).
Следует учитывать, что значительная часть больных с ПЭ в анамнезе имеет стеатогепатит, вызванный алкогольным или неалкогольным жировым перерождением печени.
При таких условиях становится понятным, что отсутствие строгой корреляции уровня NH4 + в крови и степени тяжести развития ПЭ, может быть связано, как с неоднородной выборкой пациентов, так и с наличием вторичных токсинов в печени и мозге (жирные кислоты, нейростероиды и др.). Так, только в одном уникальном исследовании, проведенном в Индии, при однородной выборке пациентов с острыми ПЭ (при отсутствии их медикаментозного сопровождения в первые три дня после госпитализации!), показано наличие корреляции уровня NH4 + в крови, степени тяжести ПЭ и риска гибели пациентов, вследствие развития острых ПЭ (47).
Таким образом, в настоящее время признается, что ион аммония, воспаление и инфекция лежат в основе патогенеза ПЭ при циррозе печени, и их действие синергично (4, 7, 8).
Существующие подходы в лечении пациентов с ПЭ хорошо известны (1-6). Эффективных средств лечения острых ПЭ и тяжелых форм хронических ПЭ нет. Последним способом лечения острых и тяжелых форм ПЭ считается трансплантация печени (1-4).
При острых ПЭ, вызванных острым отравлением печени ацетаминофеном (часто используется самоубийцами), наиболее эффективным средством считается введение N-ацетилцистеина (NAC), способствующего снятию окислительного стресса, восстановлению пула GSH и подавлению синтеза некоторых воспалительных цитокинов (49).
В практике лечения острых и хронических ПЭ, связанных с избытком иона аммония, в течение последних 60 лет используют два сочетающихся подхода (1-6, 33, 50-55):
1) уменьшение продукции NH4 + кишечными бактериями с использованием лактулозы и пробиотиков;
2) активация систем уборки NH4 + в организме, в первую очередь за счет активации Цикла Мочевины в печени и глутаминсинтазы в различных тканях и органах.
Реже используются: применение антагонистов ГАМК рецепторов, трансфузионная терапия или радикальный метод - трансплантация печени (1-4).
Существует два патентованных препарата, имеющих в первую очередь целью активацию уборки NH4 + в организме и заявленных как: гепатопротекторы, средства борьбы с гипераммонемией и протекторы печеночных энцефалопатии:
1. Препарат компании «Мерц» (Германия) - «ГепаМерц» (52).
«ГепаМерц», более 15 лет используемый в мировой клинической практике. В составе «ГепаМерц» - L-орнитин и L-аспартат, вследствие чего его название в исследовательских кругах LOLA. Суточный прием при острых ПЭ: до 20-40 г иногда - до 80 г.
2. «Глутаргин» (53) - украинский препарат, разработанный ГНЦ лекарственных средств Украины в 2001 г. «Глутаргин» с 2005 используется, как лекарственное средство. В составе «Глутаргина»: L-глутамат и L-аргинин. Рекомендуемый суточный прием до 6-10 г.
Действие обоих препаратов сходно и в первую очередь направлено на активацию основной системы уборки NH4 + в печени - Цикла Мочевины, а также глутаминсинтазы.
Обе композиции, LOLA и «Глутаргин», содержат взаимопревращающиеся соединения.
L-аргинин и L-орнитин непосредственно являются субстратами (интермедиатами) Цикла Мочевины, а L-аспартат, АТФ и карбомоилфосфат - косубстратами. Общее уравнение баланса в Цикле Мочевины имеет вид:
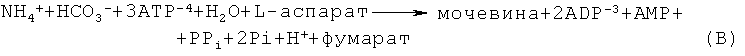
L-глутамат в квазиравновесной трансаминазной реакции быстро переаминируется в L-аспартат:
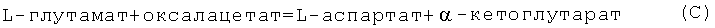
и является источником L-орнитина в другой трансаминазной реакции:
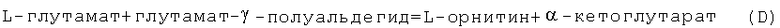
L-глутамат в глутаминсинтазной реакции в мозге, мышцах, почках и в перивенозных гепатоцитах участвует в уборке NH4 + с образованием глута-мина (реакция А). L-аргинин, кроме того является субстратом NO-синтазы (NOS) и источником NO в организме.
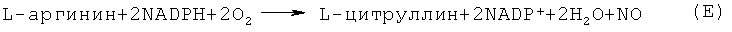
Комбинированное использование пробиотиков, L-глутамата и L-аргинина при лечении ПЭ, исследовалось еще в 50-60-х годах (55). В 60-х годах в ряде патентов, для ускорения уборки NH4, вместо пары L-глутамат и L-аргинин, предлагалось использовать L-орнитин и L-аспартат (51).
Препарат «Глутаргин» не получил широкого применения в мировой медицинской практике, хотя активно рекламируется в Украине как гепатопротектор, антиоксидант и противоалкогольный препарат (53).
Препарат «ГепаМерц» (LOLA) активно исследуется в разных медицинских центрах, включая РФ(1-6, 56-62), однако, данные о его эффективности весьма противоречивы. Иногда наблюдается снижение уровня NH4 + и улучшение состояния пациентов (5, 56-58), иногда реверсия только легких форм ПЭ (5, 59). В других исследованиях эффективность LOLA не подтверждается (60-62). В России зарегистрирован патент на метод лечения больных с ПЭ с применением лактулозы, пробиотиков и LOLA (63). В отечественной практике синоним LOLA - орницетин.
В последнее время делаются попытки использовать в качестве протектора ПЭ комбинацию L-орнитина и фенилацетата и др (64). В ряде клинических исследований используются L-карнитин или ацетил-L-карнитин (в дозах 2-4 г), которые также обладают протекторными свойствами при легких формах ПЭ (минимальные ПЭ; I, II). Иногда отмечается снижение уровня NH4 + в крови и улучшение состояния пациентов (65-67).
Отдельной группой идут препараты с гепатопротекторными свойствами, противоэнцефалопатическое действие которых чаще всего не заявляется. Действие этих препаратов направлено на восстановление функций печени при циррозе и гепатитах разной этиологии.
Представленный в последнее время на отечественном рынке «Фосфоглив», включает фосфолипид фосфатидилхолин и глицерризиновую кислоту (флаволигнан из расторопши пятнистой) (6, 68). В мировой медицинской практике и в физиологии спорта давно используются препараты (БАД) сходного состава (например «Liver-Pro» компании «Santegra», USA). Считается что, эссенцинальные фосфолипиды и флавоглинаны существенно усиливают антиоксидантные и репаративные защитные механизмы клеток печени.
В последнее время запатентованы средства, в которые кроме указанных соединений входят желчные кислоты и другие соединения (69). Однако вопрос о методах реверсии фиброза и цирроза печени все еще остается открытым (Нобелевская премия). В настоящее время перспективным в лечении таких заболеваний считается подход, направленный на активацию метаболизма стеллатных и купферовских клеток печени с участием каннабиноидных рецепторов.
Таким образом, в мировой медицинской практике наиболее популярным протектором ПЭ является препарат LOLA, который взят нами за прототип.
Основным недостатком существующих подходов в поиске методов коррекции ПЭ, являются попытки найти минимальный набор средств, способный обеспечить эффективную защиту организма от избытка NH4, как при острых, так и при хронических ПЭ.
Это относится к попыткам применения LOLA (1-6, 51-63), «Глутаргина» (53), L-карнитина (65-67, 70, 71), ингибиторов NMDA (10) или ГАМК рецепторов (33, 50), сочетания ингибиторов NMDA рецептора и L-карнитина (128), ингибиторов NOS (129), ингибиторов глутаминсинтазы (13, 14), введения инкапсулированной глутаминазы (125, 126), креатина (127) и др.
Не существует одного-двух соединений, способных быть панацеей в условиях ПЭ.
По определению ПЭ являются метаболическими ПЭ. ПЭ - это обратимые метаболические нарушения функций мозга, вызванные первичными нарушениями функций печени (1-4).
Острые и хронические ПЭ представляют собой «метаболический» Синдром, включающий комплекс химических (метаболических) и психических (сигнальных) нарушений, коррекция которых требует комплексной защиты.
Оставляя в стороне существующие эффективные способы уменьшения продукции NH4 + бактериями желудочно-кишечного тракта (по п.1), по-нашему мнению эффективные протекторы метаболических нарушений при острых и хронических ПЭ должны быть комплексными и обладать следующими свойствами:
1) активировать осмопротекторные системы клеток мозга и печени, участвующие в регуляции объема клеток и способствующие выведению «токсических» осмолитов: глутамина, лактата и станина, т.е. препятствующие развитию отека мозга;
2) активировать энергетику митохондрий разных клеток, поскольку активное функционирование: глутаминсинтазы (А), Цикла Мочевины (В), а также ряда транспортных АТФаз (участвующих в регуляции Ca2+ и Na+/K+/Cl- гомеостаза в мозге, почках, печени и мышцах) - является энергозатратными процессами;
3) активировать уборку NH4 + в мозге, почках, мышцах и печени (перивенозные гепатоциты) с участием глутаминсинтазы, а также, в печени с участием Цикла Мочевины (перипортальные гепатоциты);
4) снижать активность функционирования различных нейронных сетей в мозге с участием сигнализации возбуждающего нейротрансмиттера глутамата (NMDA, AMP А) и активировать сигнализацию с участием тормозного трансмиттера ГАМК и глицина (в случаях острых ПЭ). Восстанавливать активность сигнализации аргинин ⇒NO⇒cGMP⇒PKG и сигнализации с участием ацетилхолина (в условиях хронических ПЭ);
5) активировать антиоксидантные и противовоспалительные системы клеток мозга и печени;
6) уменьшать накопление токсических КоА производных и др. веществ;
7) индуцировать метаболические и сигнальные системы, направленные на активацию транскрипции и синтеза ферментов de novo ряда метаболических путей, включая: реакции окислительного фосфорилирования митохондрий, Цикла Кребса, Цикла Мочевины, обмена глутамата, обмена GSH, пентозного шунта и др. (при хронических ПЭ).
Многолетний поиск протекторов ПЭ с использованием тысяч животных позволил нам обнаружить неожиданный результат, заключающийся в том, что комбинации некоторых метаболитов обладают синергичными эффектами при их действии на различные метаболические и сигнальные системы. Сочетание сравнительно небольших концентраций этих соединений усиливает эффект действия каждого из них.
Это касается сочетанного действия:
- сукцината, глутамата и ацетил-Е-карнитина на энергетику клеток;
- бигуанидинов (L-аргинина и креатинфосфата) и триметиламинов (L-карнитина, ацетил-L-карнитина и бетаина) на разные сигнальные и транспортные системы с участием центральных α2 и m2 рецепторов;
- сукцината, кофермента Q10 и липоамида, а также L-аргинина и L-глутамата на активацию факторов транскрипции различных метаболических и сигнальных путей.
- L-глутамата, N-ацетилцистеина (или S-аденозил-метионина) и бетаина на активацию антиоксидантных систем клеток;
- L-глутамата и ацетил-L-карнитина на активацию синтеза N-ацетилглутамата (ключевого активатора Цикла Мочевины) и на активацию синтеза N-ацетиласпартилглутамата (NAAG) - тормозного дипептида, лиганда mGluRII (2) - метаботропных глутаматных рецепторов и др.
Характеристика компонентов предлагаемых составов протекторов ПЭ
Все составляющие компоненты, являются природными соединениями, хорошо изучены и являются стандартными компонентами пищевой и фармацевтической продукции.
L-карнитин, ацетил-L-карнитин и бетаин
L-карнитин - обязательный кофермент переноса ацильных групп в клетках животных и растений с длиной углеродной цепи от C2 (ацетат) и C3 (пропионат) до C24-26. L-карнитин является важнейшим буфером ацильных групп. Вследствие этого экзогенный L-карнитин способен снижать концентрации токсических АцилКоА или КоА - производных лекарственных средств и желчных кислот и увеличивать концентрацию свободного кофермента А.
L-карнитину посвящено огромное количество публикаций. Он показан к применению при сердечно-сосудистых заболеваниях, при ожирении и диабете, при ПЭ и болевых синдромах, при лечении нейрологических заболеваний у детей, при инфаркте/инсульте. Широко применяется в спорте и рекламируется, как сжигатель веса.
Механизмы и сигнальные пути, участвующие в регуляции объема клеток, слабо изучены. L-карнитин был одним из первых соединений, действие которого увеличивало выживание животных при модельной острой интоксикации NH4 + (70), хотя не всегда это подтверждалось (71). Показано, что все четвертичные амины, включая L-карнитин, ацетил-L-карнитин и бетаин являются осмопротекторами (71, 72) и холиномиметиками (71-75).
Однако сам по себе L-карнитин даже при больших концентрациях (15-30 г) не является эффективным протектором ПЭ.
По нашему мнению, важны 3 ключевых свойства L-карнитина:
- холиномиметика (центральные m2-холинорецепторы) и осмопротектора (совместно с действием α2-адреномиметиков - L-аргинина и креатинфосфата);
- буфера ацильных групп субстратов, окисляемых в Цикле Кребса в виде ацетил или сукцинилКоА, т.е. участника энергетического обмена;
- акцептора ацильных и др. групп, токсических производных длинноцепочечных ЖК и др. соединений, метаболизируемых в виде КоА-производных (включая желчные кислоты).
В заявленных композициях по настоящему изобретению количество L-карнитина на 1 дозу составляет 4-6 г или 2,5-3 г (острые ПЭ) или 1,5-2 г (хронические ПЭ).
Ацетил-L-карнитин
Также, как и L-карнитин, широко используется в медицине и спорте. Известно, что в условиях острых ПЭ (модельных ПЭ) имеет место сильное снижение скоростей окисления NAD-зависимых субстратов в Цикле Кребса, включая пируват, малат, пальмитоилкарнитин и др. в митохондриях, в сравнении с окислением сукцината и глутамата (12, 28).
В условиях снижения скоростей окисления пирувата кетоновых тел и ЖК при ПЭ, образование ацетилКоА из ацетил-L-карнитина,- имеет большое значение для обеспечения высокой скорости работы Цикла Кребса и наработки АТФ в митохондриях (при наличии сукцината и глутамата).
Использование в составе композиции ацетил-L-карнитина преследует несколько целей:
- действие как холиномиметика (центральные m2-холинорецепторы) и осмопротектора (совместно с действием α2-адреномиметиков - L-аргинина и креатинфосфата);
- донора ацетильных групп при синтезе Ach в пресинаптических терми-налях;
- донора ацетильных групп в Цикле Кребса (образование ацетилКоА и активация Цикла Кребса, совместно с сукцинатом и глутаматом);
- донора ацетильных групп при синтезе N-ацетиласпартата {совместно с глутаматом), предшественника тормозного дипептида NAAG;
- донора ацетильных групп при синтезе N-ацетилглутамата (совместно с глутаматом) - ключевого активатора Цикла Мочевины.
В заявляемых композициях по настоящему изобретению количество ацетил-L-карнитина на 1 дозу составляет 4-5 г или 1-2 г (при острых ПЭ) и 0,5-1,5 г (при хронических ПЭ).
Бетаин (Триметилглицин) широко используется: в пищевой индустрии в количестве 0,3-3 г. (как гейнер); как гепатопротектор; при травмах; заболеваниях кишечника и др. Бетаин является продуктом распада холина, предшественником глицина и серина. Биполярная молекула, способная удерживать воду. Наряду с мио-инозитолом и таурином является эндогенным осмолитом, поскольку в условиях накопления токсических осмолитов глутамина, лактата и аланина - выход бетаина и других осмолитов препятствует увеличению объема клетки.
Бетаин,- хороший донор метальных групп, что имеет большое значение в различных реакциях метилирования, в том числе при индукции синтеза ферментов различных метаболических путей de novo. Наряду с L-карнитином и ацетил-L-карнитином является холиномиметиком (75, 78).
Таким образом бетаин введен в состав как:
- осмопротектор и холиномиметик;
- донор метальных групп.
В заявленных композициях по настоящему изобретению количество бетаина (триметилглицина) на 1 дозу составляет 0,5-2 г (при острых и хронических ПЭ).
L-аргинин, L-глутамат
L-аргинин - один из интермедиатов Цикла Мочевины, субстрат в реакциях синтеза NO и полиаминов. Предшественник креатина. Аргинин - «многоликий Янус», о котором написано не меньше чем о карнитине. Широко используется в медицине и в спорте (как гейнер).
Известен «аргининовый парадокс» (89), который вызван тем, что увеличение концентрации аргинина больше 1 мМ вызывает активацию NOS и рост NO, несмотря на высокое сродство (n, e и i) NOS к аргинину (1-5 мкМ). Объясняют такое свойство наличием конкурентного ингибитора NOS - асимметричного диметиларгинина (АДМА) в клетках (89). Установлено, что концентрация АДМА в условиях разных типов патологий может достигать 100-300 мкМ (90, 91). Однако возможны и другие механизмы действия аргинина. Известно, что аргинин обладает сродством к α2-адренорецептору, поскольку введение аргинина в кровь вызывает гипотензивный эффект (92). Показано также (31, 32), что L-аргинин, действуя через α2 адренорецепторы, вызывает активацию eNOS в миокардиоцитах, усиливая сигнализацию: Gβγ⇒PIP3K⇒АКТ⇒eNOS. Аналогичным образом добавка L-аргинина проявляется и в его антагонизме с норэпинефрином (NE) на адипоцитах (78).
Таким образом, введение L-аргинина в состав обеспечивает:
- активацию (субстрат и активатор N-ацетилглутамин-синтазы) Цикла
Мочевины в печени;
- активацию центральных α2 адренорецепторов, которые (совместно с m2 холинорецепторами) могут иметь важное значение:
- в осморегуляции астроцитов и нейронов;
- в пресинаптическом торможении в разных нейронных сетях;
- в подавлении сигнализации с участием сАМР и Ca2+;
- активацию и восстановление сигнализации в цепочке NO⇒cGMP⇒PKG в условиях хронических ПЭ;
- восстановление пула креатина;
- активацию сигнализации с участием PIP3K, АКТ, mTOR, при синтезе различных белков, при репаративных процессах и ангиогенезе.
В заявленных композициях по настоящему изобретению количество L-аргинина на 1 дозу составляет 1,5-2,5 г (для острых и хронических ПЭ).
L-глутамат - ключевая аминокислота, учавствующая в переаминировании различных аминокислот (т.е. источник аспартата и орнитина в Цикле Мочевины), возбуждающий нейротрансмиттер в мозге, предшественник тормозного трансмиттера ГАМК и тормозного пептида NAAG. Хорошо окисляется в Цикле Кребса в паре с сукцинатом (в состоянии 3 по Чансу - имеет место максимальная скорость дыхания). Источник α-кетоглутарата для Цикла Кребса в глутаматдегидрогеназной и трансаминазных реакциях (В, С) и субстрат при синтезе глутамина в глутаминсинтазной реакции (А). В условиях острых и хронических ПЭ имеет место уменьшение концентрации глутамата, накопление глутамина и развитие эдемы (4, 7, 12, 93-95).
Таким образом, наличие L-глутамата в составе обеспечивает:
- активацию глутаминсинтазы (реакция А);
- активацию Цикла Мочевины за счет образования важного регулятора Цикла - N-ацетил-глутамата (совместно с ацетил-L-карнитином);
- активацию Цикла Мочевины за счет образования косубстрата Цикла L-аспартата (реакция В);
- активацию Цикла Кребса за счет реутилизации оксалацетата (реакция В) - субстрата Цикла Кребса и ингибитора сукцинатдегидрогеназы, чем достигается максимальная скорость окисления сукцината в Цикле Кребса (совместно с сукцинатом и ацетил-L-карнитином);
- активацию Цикла Кребса за счет предотвращения истощения α-кетоглутарата (реакции В, С);
- синтез тормозного трансмиттера ГАМК и тормозного дипептида NAAG (совместно с ацетил-L-карнитином), участвующего в пресинаптическом торможении через метаботропные глутаматные рецепторы II типа - mGluR II (2) (87, 88);
- активацию сигнализации с участием mTOR и синтеза белков;
- участие в синтезе GSH (совместно с N-ацетилцистеином и бетаином).
В заявленных композициях (для острых и хронических ПЭ) по настоящему изобретению количество L-глутамата (глутаминовой кислоты) на 1 дозу составляет 0,75-1,5 г.
Янтарная кислота (сукцинат) - один из интермедиатов Цикла Кребса, субстрат сукцинатдегидрогеназной реакции (СДГ). СДГ является одной из самых быстрых реакций Цикла Кребса и, в отличие от ключевых регуляторных реакций Цикла - α-кетоглутаратдегидрогеназной и цитратсинтазной реакций, - скорость СДГ слабо зависит от отношений NAD/NADH и ATP/ADP в митохондриях. Ингибирование СДГ различными АцилКоА также выражено слабо. Поэтому, в условиях гипоксии и при др. патологических условиях, окисление сукцината приобретает особое значение. В паре с глутаматом (обеспечивающим уборку ингибитора СДГ - оксалацетата и образование α-кетоглутарата) достигается максимальная скорость дыхания митохондрий в состоянии 3 (по Чансу) (12). В условиях острых ПЭ, угнетение дыхания митохондрий для этой пары субстратов выражено намного слабее, чем для всех NAD-зависимых субстратов (пируват, малат, кетоновые тела, пальмитоилкарнитин) (12, 28).
Исследованию роли янтарной кислоты в различных условиях, благо-даря в первую очередь усилиям проф. М.Н. Кондрашовой, посвящено большое количество работ, симпозиумов и конференций (96,97).
Янтарная кислота широко используется в медицине и в спорте. Даже низкие фармакологические количества янтарной кислоты и ее производных (например Мексидол или сукцинат аммония) оказывают важное регуляторное действие на метаболизм человека и животных (97). Это может быть связано с ее действием через клеточные рецепторы GPR91 с участием Gi/Go и Gq белков (98). Акивация экспрессии GPR91 сукцинатом имеет место при ишемии. Важную роль янтарная кислота имеет также в стабилизации образования гипоксического белкового фактора HIF-1 (гипоксия-индуцируемый фактор), т.е. в регуляции de novo активности метаболических путей, обеспечивающих эффективное производство энергии митохондриями в условиях гипоксии и при различных стрессовых условиях, включая окислительный стресс (99, 100).
Таким образом, в составе протекторов ПЭ, янтарная кислота обеспечивает:
- высокую скорость работы Цикла Кребса и наработку АТФ в мито-хондриях (в комбинации с глутаматом и ацетил-L-карнитином);
- энергопродукцию в условиях окислительного и нитрозативного стресса;
- индукцию метаболических путей de novo (через HIF и рецептор GPR91), обеспечивающих наработку FADH и NADH.
Однако, сама по себе янтарная кислота, даже при больших концентрациях (до 5-10 мг/кг), не является эффективным протектором острой аммонийной интоксикации (101).
В заявленных композициях по настоящему изобретению количество сукцината (янтарной кислоты) на 1 дозу составляет 0,75-1,5 г.
Креатинфосфат - важный кофактор переноса макроэргических фосфатных групп, буфер АТФ в клетке:
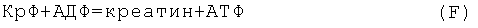
КрФ имеет важное значение при выполнении предельных анаэробных нагрузок спортсменами, поскольку пул креатина в клетках мышц и мозга в 4-5 раз превышает суммарное содержание аденилатов. Широко используется в спортивной биохимии. В условиях ПЭ имеет место распад креатина до креатинина, уровень креатинина в крови увеличивается (4, 93).
В составе протектора ПЭ креаинфосфат используется для:
- восстановления пула креатин+креатинфосфат в клетках;
- как бигуанидин, который через α2 адренорецепторы может участвовать в осморегуляции клеток и в пресинаптическом торможении (совместно с L-аргинином и m2 холиномиметиками).
При введении больших доз, креатинфосфат может, как осмопротектор, в сочетании с L-карнитином и этанолом, заменять L-аргинин (см. ниже).
В заявленных композициях по настоящему изобретению количество креатинфосфата на 1 дозу составляет 4-6 г (острые ПЭ) или 0,5-1,5 г (хронические ПЭ)
Этанол, одно из самых популярных соединений, которое при хроническом приеме вызывает привыкание и ожирение печени (алкогольный стеатогепатит), за счет восстановления NADH и устойчивого подавления окисления NAD-зависимых субстратов, в том числе и с участием транскрипционных факторов. При остром введении больших доз этанола возникает отравление ацетальдегидом. Однако, в ряде случаев при острых ПЭ, вызванных ацетаминофеном, показан положительный эффект введения этанола наряду с N-ацетилцистеином (102).
В составе протектора острых ПЭ, этанол может быть использован, как регулятор рецепторов NMDA, ГАМК и глицина, благодаря тому, что даже малые дозы этанола активируют тормозные ГАМКА-рецепторы, а большие дозы (50 мМ и выше) приводят к ингибированию активности NMDA-рецепторов (80, 123) и активации глициновых рецепторов (123).
В заявленных композициях по настоящему изобретению количество этанола на 1 дозу составляет 20-50 мл.
N-ацетилцистеин (NAC) - ацетилированная аминокислота цистеин. Играет важную роль в реакциях синтеза глутатиона GSH de novo наряду с глутаматом и глицином, а также в различных реакциях трансацетилирования.
В условиях острых ПЭ, вызванных избытком иона аммония, при наличии окислительного и нитрозативного стресса (2, 4, 8, 12, 15), активность антиоксидантных систем клеток печени и мозга падает. При этом уменьшается активность глутатионпероксидазы и глутатионредуктазы (12). На экспериментальных моделях ПЭ с введением ацетаминофена и других токсинов, показано, что имеет место падение восстановленного GSH, вследствие развития окислительного стресса (103, 104). В экспериментах, выполненных на культурах нейронов и астроцитов также показано, что гибель клеток вследствие окислительного стресса, связана с истощением GSH (18, 19).
Уровень GSH может снижаться, как за счет его превращения в GSSG в антиоксидантных реакциях, так и за счет образования коньюгатов с различными токсинами или в реакциях синтеза лейкотриенов, при активации липоксигеназных путей с участием арахидоновой кислоты.
NAC используется в качестве антидота при отравлениях ацетаминофеном, обеспечивая активное восстановление пула глутатиона и уровня восстановленности GSH (103, 104). Комбинации NAC, глутамата и глицина также способны обеспечивать эффективный ресинтез GSH de novo. Использование трипептида GSH нецелесообразно, т.к. сначала он распадается в почках, а затем исходные соединения используются организмом для ресинтеза GSH (105).
Поэтому в составе гепатопротекторов ПЭ NAC:
- обеспечивает, в сочетании с L-глутаматом, ресинтез GSH;
- участвует в реакциях трансацетилирования;
- регулирует противовоспалительные процессы.
Однако сам по себе NAC, даже в больших концентрациях (15-20 г) не является эффективным протектором острых ПЭ, вызванных первичной гипераммонемией.
В заявленных композициях по настоящему изобретению количество Q10 на 1 дозу составляет 20-30 мг (хронические ПЭ).
ДГК - флаваноид, экстрагируемый из лиственницы; - хорошо извест-ный и широко используемый антиоксидант (108) - применяется в составе протекторов по своему непосредственному назначению,- как антиоксидант. ДГК может быть заменен флаваноидами, полученными из винограда (Ресвератрол (109)) или из зеленого чая.
В заявленных композициях по настоящему изобретению количество ДГК на 1 дозу составляет 15-20 мг (хронические ПЭ).
Составы и дозы заявленных композиций протекторов ПЭ
Приводимые ниже примеры служат для иллюстрации заявленного изобретения, а не для ограничения объема притязаний. Все составляющие компоненты хорошо изучены, являются природными соединениями и широко применяются в пищевой и фармацевтической продукции.
Предлагаемые составы протекторов ПЭ могут использоваться в качестве БАД и выполняются в виде порошков или гранул, пригодных для перорального применения. Составы протекторов ПЭ получают прямым смешиванием, делят на порции или гранулируют и делят на порции и упаковывают в фольгированные пакетики с использованием традиционных вспомогательных компонентов и методик по стандартной для этой области технологии.
Составы используются в виде напитков с добавлением требуемых количеств бикарбоната натрия (эквимолярных содержанию кислот). 1 дозу предлагаемых составов растворяют в 150-250 мл воды для приготовления шипучего напитка.
Составы протекторов ПЭ вводят перорально по 1-2 дозы до 2-3 раз в день, в зависимости от степени развития ПЭ и состояния пациента.
Коэнзим Q10 и дигидрокверцитин (ДГК) предварительно растворяют в растительном масле (предпочтительно в оливковом масле) и упаковывают в мягкие желатиновые капсулы по стандартной для этой области технологии и используют в сочетании с основным составом протектора хронических ПЭ, по той же схеме.
Дигидрокверцитин и Q10, упакованные в β-циклодекстрине или в других водорастворимых формах, могут быть введены в основной состав в соответствующих количествах, без растворения в масле.
Примеры составов протекторов ПЭ
Выполнены в виде порошков или гранул в саше-пакетиках
Состав пакетика растворяется в 150-200 мл воды. Прием per os 1-6 доз в день.
Пример 3
Саше-пакетики (гранулы или порошок).
Состав пакетика растворяется в 150-200 мл воды. Используется 1-6 доз в день per os, а также 2-6 капсул в день.
5. Испытание протекторов ПЭ in vivo
Модели ПЭ на животных
В экспериментах использовали белых беспородных самцов мышей весом 20-35 г после 12 часового голодания.
1. Классическая модель гиперамонемии
Использовали классическую модель гиперамонемии (9-12, 71) с введением ip летальных доз NH4Cl (NH4Ac), при одновременном введении NaCl. Для NH4Cl определяемая LD100 составляет 16,5 ммоль/кг. После возникновения клонических и затем тонических судорог и комы животные погибали в течение 10-15 минут.
Раствор NH4Cl с рН 7.4 (NaOH) и растворы протекторов ПЭ готовили исходя из расчета введения 25-30 мл/кг растворов i.p. Учитывая крутую зависимость процента выживания животных от введенной дозы NH4Cl при величинах близких к LD 100, в острых экспериментах введенная доза NH4C1 равнялась 110-115% от LD100, и составляла 18,0-18,5 ммоль/кг (LD100+). Гибель животных наступает через 6-7 мин. Это позволяет избежать влияния неспецифических факторов на выживание животных при введении протекторов ПЭ. Протекторы в большинстве острых ПЭ вводили i.p. через 20-30 сек после NH4Cl. Последовательность введения протекторов и токсинов указана в таблицах 1-3.
На основании динамики изменений концентраций иона аммония NH4 +, глюкозы и мочевины в крови у мышей при введении токсина NH4C1 и протекторов LoLa и Σ1 хорошо видно, что протектор Σ1 вызывает снижение концентрации токсина иона аммония NH4 +более эффективно, чем существующий на фармацевтическом рынке препарат LoLa («Гепамерц»). При этом наблюдается меньшее увеличение концентрации глюкозы и мочевины в крови, связанное с обоими препаратами Цикла Мочевины и Глюконеогенеза в печени.
1. Модели с недостаточностью печени
Ввиду того, что печень здорового животного не отражает состояния с печеночной недостаточностью, возникающие при различных типах ПЭ использовали: несколько известных моделей (114, 115) острой или хронической недостаточности печени, приводящих к развитию ПЭ, а также, рекомендуемую классификацию стадий ПЭ для лабораторных животных (116).
2.1 Острую недостаточность печени, приводящую к некрозу и жировому перерождению клеток печени, окислительному стрессу - вызывали введением ССl4 (2-4 мл/кг подкожно или i.p.), ацетаминофена - AAF (300-500 мг/кг i.p.) или тиоацетамида (ТАА, 300-500 мг/кг i.p.), в соответствии с известными данными (103, 104, 116-118). Использовали также модель острой полиорганной недостаточности, с i.p. введением пропионовой кислоты (119, 120).
2.2 Хроническую недостаточность печени, вызвали введением CCl4 (или ТАА), с последующим введением через 24 часа NH4C1, или использовали модель диабета 2 типа (115),с последующим введением CCL» (или ТАА).
2.2.1 В моделях с ожирением, животных в течение 1-2 месяца наряду со стандартным кормом, кормили свиным салом (с контролем липидного состава) из расчета до 300-500 мг на 1 животное в день. Контролировали уровень глюкозы, инсулина, АЛТ, билирубина, глицерола, триглицеридов и ЖК в крови и в печени, проводили гистологические исследования печени.
2.2.2 В модели Диабета 2 типа, в соответствии с данными работы (115), через 1 - 2 месяца скармливания жиров, животным вводили i.p. 50мг/кг стрептозотоцина (для подавления активности β-клеток) и, затем, через 15 дней, после контроля основных показателей крови, использовали в экспериментах.
LOLA2: L-орнитин = 750, L-аспартат = 500.
Острые ПЭ
Сводные данные испытаний протекторов острых ПЭ приведены в Таблице 1. Видно, что одновременное введение токсина NH4Cl и разных протекторов вызывает выживание части животных. Эффект сильно варьирует, не зависит от пола животных. Введение LOLA, действие которого направлено на уменьшение концентрации NH4Cl (в организме), обеспечивает выживание 60-80% животных. Наилучшими показателями обладает состав Σ3 (70,100%). Введение половинных доз обоих протекторов за 15 минут до введения NH4Cl обеспечивает более высокие показатели эффективности Σ2 и LOLA (Таб.1, строки 6, 7). Однако, чистая модель острой аммонийной интоксикации с использованием животных с интактной печенью не отражает состояние защитных механизмов у животных с недостаточностью печени.
Предварительное введение животным пропионовой кислоты обеспечивает подавление энергетики клеток разных органов и тканей, а также реакций детоксикации NH4 в организме за счет накопления токсических производных пропионилКоА и метилмалонилКоА (119, 121) и является моделью пропионовой и метилмалоновой ацидемии и полиорганной недостаточности. При введении животным 20-25 ммоль/кг пропионатаNа, имеет место падение АТФ в клетках и накопление NN4 в крови за счет ингибирования Цикла Мочевины (92). Из таблицы 1 (строка 8) видно, что введение нелетальных доз NH4Cl в таких условиях приводит к быстрой гибели животных. Даже при введении больших доз NH4Cl, введение протекторов обеспечивает выживание части животных (Таб 2, строки 10, 11). Лучшими показателями защиты обладает протектор Σ2
В Таблице 1 (строки 12-14) приведены также сводные данные, полученные на моделях ПЭ, в которых нелетальные дозы гепатотоксина CCl4, вызывают стеатогепатит и некроз клеток печени, что моделирует наличие печеночной недостаточности. Введение различных доз NH4 (12-14 ммоль/кг) через 24 часа после введения этих токсинов может вызвать развитие острых ПЭ и гибель животных. Однако этот эффект зависит от дозы используемых токсинов CCl4. Видно, что при использовании малых доз CCl4 (2 мл/кг) при введении летальной для интактных животных дозы NH4, почти все животные выживают (80%), т.е. имеет место своеобразный эффект прекондиционирования.
Известно, что при введении CCl4, AAF или ТАА, репаративные процессы начинаются уже через несколько часов. Поэтому выбор таких моделей и условий для демонстрации эффективности действия протекторов должен тщательно контролироваться, поскольку при малых дозах токсинов самые разнообразные протекторы будут оказывать позитивное влияние, что хорошо видно из ряда опубликованных экспериментов (56, 117, 118).
Видно, что в наших условиях введение протекторов в разной степени обеспечивает выживание животных. Наиболее эффективным оказывается Σ2.
Хронические ПЭ
Исследования на животных
При введении больших доз ССl4 (или ТАА), последующее введение нелетальных доз NH4Cl через 24 часа (Таб.2, строка 1) приводило к гибели всех животных в течении 3-4 суток, с развитием признаков хронических ПЭ для животных (потеря активности, летаргия, отсутствие реакций на болевые стимулы и кома).
Введение протекторов Σ3 и LOLA через 24 часа после CCl4 (1 раз в сутки) приводило к уменьшению гибели животных и предотвращало развитие симптомов хронических ПЭ. Показатели для Σ3 оказались выше, чем для протектора LOLA (Таб 2 строки 2, 3).
И, наконец, в модели Диабета 2 типа, нелетальные дозы CCl4 (для здоровых животных) приводят к гибели животных в течение 3-4 суток, вследствие развития гипераммонемии и комы, со всеми регистрируемыми признаками хронических ПЭ. Ежедневное введение протекторов также вызывает выживание части животных. Состав Уз снова оказывается более эффективным, чем LOLA (Таб.2, строки 5, 6).
В Таблице 3 приведены данные о параметрах крови животных с Диабетом 2 типа, полученные у контрольных животных (до введения ССl4), а также через 72 часа после введения ССl4 и последующего введения протекторов. Сравнение показывает, что состав уз обладает высокой эффективностью гепатопротектора и протектора хронических ПЭ.
Хроническая токсичность составов Σ2 и Σ3 определялась в экспериментах с введением этих протекторов в течение 1 месяца per os. Параметры крови остаются в норме, гистологических изменений в печени (рис.1) и мозге не обнаружено. Эти данные показывают, что исследуемые составы не токсичны.
Хроническая токсичность составов Σ2 и Σ3 определялась в экспериментах с введением этих протекторов в течение 1 месяца per os. Параметры крови остаются в норме, гистологических изменений в печени (рис.1) и мозге не обнаружено. Эти данные показывают, что исследуемые составы не токсичны.
Клинические исследования на пациентах
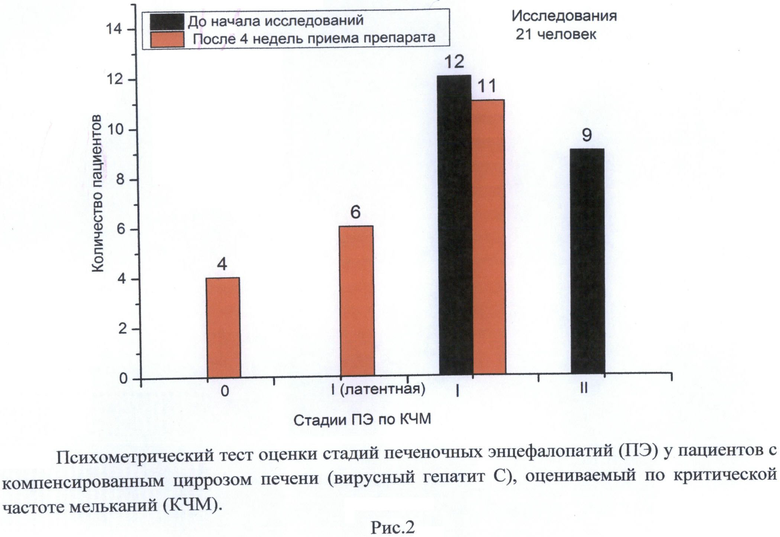
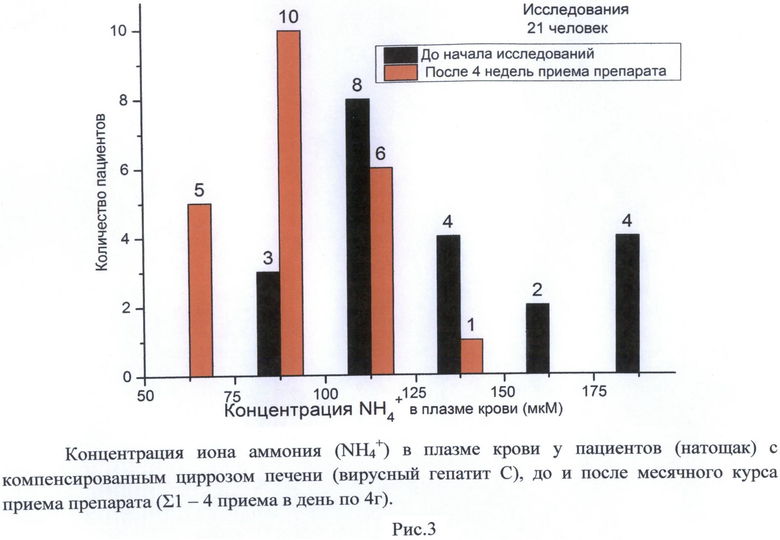
Исследования указанных составов также проводились на пациентах с хроническими формами печеночных энцефалопатий, обусловленных циррозом печени (вызванного гепатитом С). Проверялась способность гепатопротекторов уменьшать гипераммонемию и снижать степень развития печеночных энцефалопатий, оцениваемую по регистрации частоты критического мелькания в сек (КЧМ тест). На Рис. 2, 3 представлены данные месячного приема препарата, выполненного по Примеру 1 из расчета 8 г на 1 прием 2 раза в день за 30 мин. до еды. Видно, что прием препарата приводит к уменьшению концентрации токсина NH4 + в плазме артериальной крови. У 11 пациентов имело место 2-3-кратное снижение концентрации NH4 +, у 10 пациентов снижение происходило на 30-60%. Активность трансаминаз в крови оставалась в пределах нормы у 18 пациентов, у 3 пациентов - снижалась. По оценке стадий ПЭ, регистрируемых с использованием теста КЧМ, у 16 пациентов имело место увеличение показателя КЧМ и улучшение стадий ПЭ (переход из стадии ПЭ II в стадии ПЭ I, 0), а у 5 пациентов стадия ПЭ I сохранялась. Общее состояние и оценка самочувствия больных существенно улучшались.
Таким образом, исследуемые препараты являются эффективными гепатопротекторами и протекторами ПЭ, обеспечивая эффективное снижение концентрации эндотоксина NH4 + как в условиях острых, так и хронических форм ПЭ; выживание животных в модельных острых экспериментах; улучшение состояния больных и реверсию стадий хронических ПЭ у пациентов с недостаточностью печени, вызванной циррозом.
Предлагаемые составы композиций
Были выявлены следующие совокупности признаков, обеспечивающие достижение результата:
1. Композиция протекторов острых и хронических форм печеночных энцефалопатий, содержащая в расчете на одну дозу L-карнитин - 1,5-3 г, ацетил-L-карнитин - 1-3 г, сукцинат (янтарная кислота) - 0,75-1,5 г, L-глутамат (глутаминовая кислота) - 0,75-1,5 г, L-аргинин - 1,5-2,5 г, бетаин - 0,25-2 г.
2. Композиция протекторов острых и хронических форм печеночных энцефалопатий, содержащая в расчете на одну дозу L-карнитин - 1,5-3 г, ацетил-L-карнитин - 1-3 г, сукцинат (янтарная кислота) - 0,75-1,5 г, L-глутамат (глутаминовая кислота) - 0,75-1,5 г, L-аргинин - 1,5-2,5 г, бетаин - 0,25-2 г, креатинфосфат - 2-3 г, N-ацетилцистеин - 0,25-1,5 г.
3. Композиция протекторов острых и хронических форм печеночных энцефалопатий, содержащая в расчете на одну дозу L-карнитин - 1,5-3 г, ацетил-L-карнитин - 1-3 г, сукцинат - 0,75-1,5 г, L-глутамат - 0,75-1,5 г, L-аргинин - 1,5-2,5 г, бетаин - 0,25-2 г, кофермент Q10 - 20-30 мг и дигидрокверцитин - 15-20 мг.
4. Композиция по п.1, отличающаяся тем, что она выполнена в виде порошков или гранул с добавлением NaНСО3 в эквимолярных кислотам дозах, а также других воспомогательных компонентов, уменьшающих слипание компонентов порошков или гранул, при этом порошки или гранулы выполнены с возможностью растворения в воде для использования в качестве шипучего напитка и пакетирована в саше-пакеты.
5. Композиция по п.2, отличающаяся тем, что она выполнена в виде порошков или гранул с добавлением NaHCO3 в эквимолярных кислотам дозах, а также других всопомогательных компонентов, уменьшающих слипание компонентов порошков или гранул, при этом порошки или гранулы выполнены с возможностью растворения в воде для использования в качестве шипучего напитка и пакетирована в саше-пакеты.
6. Композиция по п.3, отличающаяся тем, что она выполнена в виде порошков или гранул с добавлением NаНСО3 в эквимолярных кислотам дозах, а также других воспомогательных компонентов, уменьшающих слипание компонентов порошков или гранул, при этом порошки или гранулы выполнены с возможностью растворения в воде для использования в качестве шипучего напитка и пакетирована в саше-пакеты.
7. Способ лечения острых и хронических форм печеночных энцефалопатии, а также заболеваний печени, выбранных из острого и хронического гепатита и стеатогепатита и цирроза печени разной этиологии, включающий пероральное введение пациентам от 1 до 6 доз в сутки в любом сочетании по пп.1-6, в зависимости от веса больного и индивидуальной переносимости компонентов композиций.










| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕПАТОПРОТЕКТОРНАЯ И АНТИГЕПАТОТОКСИЧЕСКАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ПЕЧЕНИ, ВКЛЮЧАЮЩИЙ ВВЕДЕНИЕ УКАЗАННОЙ КОМПОЗИЦИИ | 2008 |
|
RU2381800C1 |
| Способ лечения острой печеночной недостаточности | 2018 |
|
RU2701792C1 |
| Способ лечения головного мозга при острой гипоксии с гиперкапнией | 2022 |
|
RU2803387C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ ГЕПАТОПРОТЕКТОРНЫМИ И АНТИЭНЦЕФАЛОПАТИЧЕСКИМИ СВОЙСТВАМИ, ДЛЯ СНИЖЕНИЯ АЛКОГОЛЬНОГО ОПЬЯНЕНИЯ, ПРЕДУПРЕЖДЕНИЯ И СНЯТИЯ АЛКОГОЛЬНОЙ ИНТОКСИКАЦИИ И ПОХМЕЛЬНОГО СИНДРОМА | 2004 |
|
RU2254858C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ АСТЕНИИ И/ИЛИ СИНДРОМА ХРОНИЧЕСКОЙ УСТАЛОСТИ | 2014 |
|
RU2578412C1 |
| СПОСОБ ЛЕЧЕНИЯ ПЕЧЕНОЧНОЙ НЕДОСТАТОЧНОСТИ | 2015 |
|
RU2586952C1 |
| СПОСОБ ЛЕЧЕНИЯ ОТЕКА МОЗГА У БОЛЬНЫХ ХРОНИЧЕСКИМИ ЗАБОЛЕВАНИЯМИ ПЕЧЕНИ | 2014 |
|
RU2539139C1 |
| СРЕДСТВО НА ОСНОВЕ ПРИРОДНЫХ ФОСФОЛИПИДОВ | 2008 |
|
RU2367443C1 |
| Комбинации пальмитоилэтаноламида для лечения хронической боли | 2018 |
|
RU2701720C1 |
| СТЕРОИДНОЕ СОЕДИНЕНИЕ ДЛЯ ПРИМЕНЕНИЯ В ЛЕЧЕНИИ ПЕЧЕНОЧНОЙ ЭНЦЕФАЛОПАТИИ | 2015 |
|
RU2684616C2 |

Группа изобретений относится к медицине и предназначена для лечения и профилактики печеночных энцефалопатий. Предлагаются комплексные составы, содержащие в разных комбинациях L-карнитин, ацетил- L-карнитин, сукцинат, L-глутамат, L-аргинин, бетаин и креатинфосфат, N-ацетилцистеин, кофермент Q10 и дигидрокверцитин; S-аденозилметионин; кофермент Q10 и дигидрокверцитин, дигидрокверцитин и липоамид. Группа изобретений позволяет уменьшить поведенческие, неврологические и психические нарушения путем активации осмопротекторных и энергетических систем, систем реакций детоксикации иона аммония и др. токсинов, а также антиоксидантных систем клеток мозга и печени. 4 н. и 1 з.п. ф-лы, 3 пр., 3 табл., 3 ил.
1. Композиция протекторов острых и хронических форм печеночных энцефалопатий, содержащая в расчете на одну дозу: L-карнитин - 1,5-3 г, ацетил-L-карнитин - 1-3 г, сукцинат (янтарная кислота) - 0,75-1,5 г, L-глутамат (глутаминовая кислота) - 0,75-1,5 г, L-аргинин -1,5-2,5 г, бетаин -0,25-2 г.
2. Композиция протекторов острых и хронических форм печеночных энцефалопатий, содержащая в расчете на одну дозу: L-карнитин - 1,5-3 г, ацетил-L-карнитин - 1-3 г, сукцинат (янтарная кислота) - 0,75-1,5 г, L-глутамат (глутаминовая кислота) - 0,75-1,5 г, L-аргинин -1,5-2,5 г, бетаин - 0,25-2 г, креатинфосфат - 2-3 г, N-ацетилцистеин - 0,25-1,5 г.
3. Композиция протекторов острых и хронических форм печеночных энцефалопатий, содержащая в расчете на одну дозу: L-карнитин - 1,5-3 г, ацетил-L-карнитин - 1-3 г, сукцинат - 0,75-1,5 г, L-глутамат - 0,75-1,5 г, L-аргинин - 1,5-2,5 г, бетаин - 0,25-2 г, кофермент Q10 - 20-30 мг и дигидрокверцитин - 15-20 мг.
4. Композиция по п.1-3, отличающаяся тем, что она выполнена в виде порошков или гранул с добавлением NaHCO3 в эквимолярных кислотам дозах, а также других воспомогательных компонентов, уменьшающих слипание компонентов порошков или гранул, при этом порошки или гранулы выполнены с возможностью растворения в воде для использования в качестве шипучего напитка и пакетирована в саше-пакеты.
5. Способ лечения острых и хронических форм печеночных энцефалопатий, включающий введение пациентам композиции, выбранной из композиций по пп.1-4.
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ЗАБОЛЕВАНИЙ ПЕЧЕНИ РАЗЛИЧНОЙ ЭТИОЛОГИИ, СОПРОВОЖДАЮЩИХСЯ ВНУТРИПЕЧЕНОЧНЫМ ХОЛЕСТАЗОМ | 2008 |
|
RU2386969C2 |
| KR 20000036088, 26.06.2000 | |||
| ГРИГОРЬЕВ П.Я | |||
| и др | |||
| Справочное руководство по гастроэнтерологии, МИА-2003, с.194-227 | |||
| NAGY J | |||
| Alcohol related changes in regulation of NMDA receptor functions. | |||
| Curr | |||
| NeuropharmacoL, 2008, №6, с.39-54, онлайн [найдено 12.03.2013] [найдено из интернета] http://www.ncbi.nlm.nih.gov/pubmed. | |||
Авторы
Даты
2013-08-27—Публикация
2011-03-16—Подача