Изобретение относится к области медицины, фармакологии, а именно к комбинации пальмитоилэтаноламида и, по меньшей мере, одного вещества, выбранного из группы, включающей уридинмонофосфат, таурин и витамин Е, или их фармацевтически приемлемых солей. Такая комбинация применяется для патогенетического и симптоматического лечения в виде монотерапии и в составе комплексной терапии хронической боли, заболеваний и синдромов нервной системы различного происхождения, особенно предпочтительно:
- нейропатической боли после химиотерапии;
- диабетической хронической нейропатической боли;
- нейропатической боли при синдроме сдавления нерва (карпальный туннельный синдром, ишиаз; люмбаго, другие дорсопатии, невриты, невралгии, пудендальная невралгия, постгерпетическая невралгия, сопровождающиеся хронической периферической нейропатической болью);
- постинсультной хронической нейропатической боли (эндометриоза, дисменореи, интерстициального цистита, вульводинии, простатита, сопровождающихся хронической тазовой болью);
- синдрома хронической тазовой боли;
- фантомной боли;
- болей в постинсультный период, диабетической мигрени, сопровождающейся хронической центральной нейропатической болью;
- боли при ревматических заболеваниях (ревматоидный артрит, остеоартрит и другие дегенеративно-дистрофические заболевания суставов);
- заболеваний, синдромов, сопровождающихся острой и хронической висцеральной болью (например, при болезни Крона, СРК);
- фибромиалгии, рассеянного склероза, сопровождающихся болевым синдромом, связанным с нарушениями в периферическом и центральном звене ноцицептивной и антиноцицептивной системы;
- болевого синдрома при гриппе и др. ОРВИ.
Боль относится к наиболее частым жалобам, с которыми имеют дело врачи самых разных специальностей в повседневной практике. Распространенность болевых синдромов в системе первичной медицинской помощи колеблется от 11 до 40% [Gureje О., Simon G.Е., Van Korff М. A cross-national study of the course of persistent pain in primary care // Pain. - 2001. - Vol. 92. - P. 195-200]. По данным ВОЗ в развитых странах мира боль по масштабам своего распространения вполне сопоставима с пандемией.
Для достижения успеха в лечении важно разделение боли на острую и хроническую. Острая боль неразрывно связана с вызвавшим ее повреждением и обычно является симптомом какого-либо заболевания. Она, как правило, исчезает при устранении повреждения и/или истечении периода заживления. Хроническая боль продолжается в течение длительного времени даже после устранения причины, вызвавшей острую боль, и часто приобретает статус самостоятельной болезни. Международная ассоциация по изучению боли определяет ее как «боль, которая продолжается сверх нормального периода заживления». Главным отличием хронической боли от острой является не временной фактор, а качественно иные нейрофизиологические, биохимические, психологические и клинические соотношения [Коржавина В.Б., Данилов А.Б. Новые возможности и перспективы терапии болевых синдромов // РМЖ. 2010. С. 31].
Все болевые синдромы в зависимости от причины и механизма их развития можно условно разделить на три основные группы: ноцицептивные, нейропатические и психогенные. Ноцицептивная боль возникает из-за активации ноцицепторов, свободных нервных окончаний, вследствие повреждения тканей (примерами таких болей является послеоперационная боль, боль при травме, стенокардия у больных с ишемической болезнью сердца, боли в эпигастрии при язвенной болезни желудка, боли у больных с артритами и миозитами). Психогенные болевые синдромы характеризуются наличием у пациентов боли, не объяснимой никакими известными соматическими заболеваниями или поражением структур нервной системы. Локализация этой боли обычно не соответствует анатомическим особенностям тканей или зонам иннервации, поражение которых можно было бы подозревать в качестве причины боли.
Окончательное восприятие боли является результатом
взаимодействия ноцицептивной и антиноцицептивной систем. Формирование болевого ощущения у человека опосредуется структурами ноцицептивной системы, которая осуществляет восприятие, проведение и обработку информации о различных раздражителях. Нисходящий ингибиторный цереброспинальный контроль над проведением болевой импульсации является функцией антиноцицептивной системы. В физиологических условиях антиноцицептивная система обеспечивает оптимальную модуляцию перцепции болевых стимулов, защищая от боли и поддерживая болевые пороги на определенном уровне. Однако длительно повторяющиеся повреждающие воздействия часто приводят к сенситизации болевой системы (устойчивой длительной деполяризации нейронов), что дает начало ее патофизиологическим изменениям [Болевые синдромы в неврологической практике / Под ред. чл. - корр. РАМН A.M. Вейна. М.: МЕДпресс-информ, 2001].
В механизмах развития сенситизации ноцицептивных нейронов выделяют несколько этапов: активация АМРА-рецепторов (α-амино-3-гидрокси-5-метил-4-изоксазол-пропионовая кислота) в ответ на кратковременную стимуляцию болевых афферентов, затем возбуждение NMDA-рецепторов (N-метил-D-аспартат) глутаматом при нанесении повторного или длительного повреждающего воздействия. Это приводит к удалению ионов магния, блокирующих NMDA-рецепторные каналы, в результате чего происходит внутриклеточное вхождение ионов кальция. В условиях усиленного поступления в нейроны кальция происходит экспрессия генов раннего реагирования c-fos, c-jun, jun В, которые, активируя эффекторные гены, изменяют клеточный фенотип и формируют длительную гипервозбудимость нейронов. Посредством таких механизмов центральная сенситизация может существовать даже после того, как будут устранены начальные инициирующие факторы [Кукушкин М.Л., Хитров Н.К. Общая патология боли. - М.: Медицина, 2004. - 144 с].
Поэтому принципиально важным является своевременное и адекватное лечение острого болевого синдрома с целью предупреждения хронизации патологического состояния [Баринов А.Н. Комплексное лечение боли. РМЖ, 2007, том 15, №4, с. 215-220].
Среди взрослых наиболее частой причиной хронической боли являются дорсопатии: остеоартроз поясничного и шейного отдела позвоночника - 65% от общей популяции, из них у 16-55% наблюдается нейропатический компонент боли; карпальный туннельный синдром - 1-3,8% от общей популяции. В мире у пациентов с сахарным диабетом (СД) периферическая нейропатическая регистрируется в 35% от всех пациентов с СД [Marcucci М, Germini F, et al. Efficacy of ultra-micronized palmitoylethanolamide (um-PEA) in geriatric patients with chronic pain: study protocol for a series of N-of-1 randomized trials. Trials. 2016, 17: 369].
В России ежегодно регистрируется около 500 тысяч инсультов, и одним из осложнений инсульта является постинсультный болевой синдром, который развивается у 2,7% пациентов, перенесших инсульт [Mulla SM, Wang L, et all. Management of Central Poststroke Pain: Systematic Review of Randomized Controlled Trials. Stroke. 2015, 46 (10): 2853-60].
Таким образом, хроническая боль - явление сложное, часто представляет собой взаимосвязанную комбинацию различных болевых феноменов. Как известно, мышечные боли могут сочетаться с болями неврогенного характера, а в процессе развития синдрома к нему присоединяется и психологическая составляющая, которая оказывает влияние на восприятие человеком болевых ощущений.
Один из видов хронической боли - хроническая нейропатическая боль (НБ) - является следствием прямого повреждения или дисфункции соматосенсорной нервной системы (центральной и/или периферической) при интактном состоянии периферических (болевых, ноцицептивных) рецепторов (в отечественной литературе нейропатические боли, возникающие вследствие поражения центральных структур
соматосенсорной нервной системы, называют также «центральными болями»).
Центральную нейропатическую боль связывают с нарушением баланса ноцицептивных (болевых) и антиноцицептивных (противоболевых) систем вследствие дезорганизации и поражения антиноцицептивных структур, что приводит к усилению и хронизации болевых ощущений.
Таким образом, при ноцицептивной боли имеет место поражение периферических болевых рецепторов при интактности всех отделов нервной системы, а при НБ, наоборот, имеет место поражение каких-либо структур соматосенсорной нервной системы при интактности болевых рецепторов. В отличие от ноцицептивной боли, являющейся адекватной физиологической реакцией на болевой раздражитель или повреждение тканей, НБ, как правило, не адекватна характеру, интенсивности или продолжительности воздействия раздражителя [А.Б. Данилов "Фармакотерапия нейропатической боли в спине" Неврология/Ревматология. Приложение consilium meducum, 2011, №1, с. 51-55].
Причинами повреждения периферической соматосенсорной нервной системы могут быть метаболические нарушения, травма, интоксикации, инфекционный процесс, механическое сдавление, авитаминозы. Наиболее распространены периферические НБ у пациентов с болевой диабетической полиневропатией, постгерпетической невралгией и хроническими болями в спине. Причинами возникновения НБ при повреждении структур центральной нервной системы, приводящему к дефициту соматосенсорной чувствительности, считают травмы спинного и головного мозга, ишемические и геморрагические инсульты, боли при болезни Паркинсона, сирингомиелию и демиелинизирующие заболевания (рассеянный склероз) и другие заболевания.
В развитии и поддержании хронической боли принимают участие патологические процессы, приводящие к реорганизации ноцицептивной системы, из которых наиболее изучены процессы, связанные с формированием периферической нейропатической боли:
формирование эктопических (спонтанных) разрядов нервными волокнами вследствие дисфункции ионных каналов, локализованных в их мембране;
образование новых патологических синаптических связей афферентных аксональных терминалей в заднем роге спинного мозга - так называемый «спрутинг-феномен», что приводит к ошибочному восприятию неболевой информации как болевой (клинический феномен аллодинии);
образование связей симпатическими постганглионарными волокнами с афферентными проводниками соматосенсорной системы, в результате этого происходит обмен сигналами между ними, то есть активация симпатических («не болевых») постганглионарных волокон приводит к возбуждению ноцицепторов (болевых рецепторов) [Болевые синдромы в неврологической практике / Под ред. чл. - корр. РАМН A.M. Вейна. М.: МЕДпресс-информ, 2001].
Клинические проявления хронической боли характеризуются комбинацией негативных и позитивных симптомов, отражающих повреждение соматосенсорного анализатора. Хроническая боль может быть постоянной или пароксизмальной в виде стреляющей, сдавливающей или жгучей боли, которая чаще всего локализуется в области измененной тактильной, температурной и болевой чувствительности. При неполном, частичном повреждении периферических нервов, сплетений или дорсальных спинномозговых корешков в большинстве случаев возникает острая периодическая пароксизмальная боль, подобная электрическому разряду, длящаяся несколько секунд. В условиях обширного или полного повреждения нервных проводников боли в денервированной области чаще имеют постоянный характер в виде онемения, жжения, ломоты. Неврологическое обследование обычно позволяет в зоне болезненности у пациентов с хронической болью обнаружить изменения тактильной, температурной и болевой чувствительности в виде дизестезии, гиперпатии, аллодинии. Усиленное восприятие обычных стимулов, характеризующееся долго длящимися неприятными болезненными ощущениями после прекращения раздражения, относят к гиперпатии, а болевые ощущения, возникающие в ответ на легкое механическое или температурное (то есть в ответ на не болевое) раздражение кожных участков, определяют как аллодинию. Частым симптомом у пациентов с нейропатическими болевыми синдромами являются парестезии в виде спонтанно возникающих ощущений покалывания, онемения или ползания мурашек в зоне повреждения. В клинической картине у больных с хронической болью могут быть трофические нарушения кожи, подкожной клетчатки, волос, ногтей, изменение мышечного тонуса или локальные вегетативные нарушения в виде припухлости тканей, изменения дермографизма, цвета и температуры кожи [Baron R., Binder A. How neuropathic is sciatica? The mixed pain concept. Orthopade 2004; 33 (5): 568 - 75].
В случае хронической боли, когда включаются центральные патофизиологические механизмы боли, необходимо применение лекарственных средств, воздействующих на формирование центральной сенситизации:
- применение противосудорожных препаратов (карбамазепин, ламотриджин, вальпроаты), тормозящих проведение возбуждающих нервных импульсов посредством блокирования потенциалзависимых натриевых и кальциевых каналов периферических нервов;
- использование блокаторов обратного захвата норадреналина и серотонина, повышающих концентрацию этих нейротрансмиттеров в ядрах ретикулярной формации мозгового ствола, из которых исходят нисходящие тормозящие пути, воздействующие на интернейроны заднего рога (флуоксетин, амитриптилин, сертралин, дулоксетин и др.);
- использование антагонистов NMDA-рецепторов, «стирающих» болевую память (кетамин, декстраметорфан);
- электростимуляцию и другие методы физической стимуляции (физиопроцедуры, акупунктура, чрескожная электронейростимуляция, массаж и др.), вызывающие торможение ноцицептивных нейронов заднего рога путем активации энкефалинергических нейронов [Баринов А.Н. Комплексное лечение боли. РМЖ, 2007, том 15, №4, с. 215-220].
Поскольку при хронической боли обычные обезболивающие препараты из группы НПВС неэффективны, применять их для лечения таких пациентов не только бессмысленно, но и небезопасно, так как НПВС обладают целым рядом неблагоприятных побочных эффектов. Лечение хронической боли представляет существенную трудность и должно быть комплексным, включающим в себя медикаментозные средства, методы психотерапии и рефлексотерапии. Лечебный алгоритм должен учитывать клиническую характеристику хронической боли, быть простым, безопасным и эффективным. Обычно лекарственные средства назначают на длительный срок, причем их следует принимать строго по расписанию в индивидуально подобранной (оттитрованной) дозировке.
В настоящее время фармакологические исследования в области поиска эффективной терапии хронической боли сфокусированы в основном на лекарственных препаратах нейротропного действия, таких как трициклические антидепрессанты амитриптилин (триптизол), доксепин (синэкван), кломипрамин (анафранил); селективные ингибиторы обратного захвата серотонина (СИОЗС) СИОЗС - флуоксетин, сертралин (золофт), пароксетин (паксил), флувоксамин (феварин); мышечные релаксанты, которые демонстрируют более высокую эффективность, чем анальгетики [Табеева Г.Р. Современные принципы лечения фибромиалгии. РМЖ, 2011, Том 19, №15, с. 1-9]. Для лечения хронической боли применяют средства, которые снижают возбудимость нервных клеток и таким образом частично блокируют, уменьшают проведение болевых импульсов по нервным волокнам к головному мозгу. Это антиконвульсанты, антидепрессанты и другие средства.
Это связано с тем, что результаты многочисленных исследований показали, что хроническая боль (независимо от наличия в анамнезе травматического повреждения головного мозга и других неврологических заболеваний) отрицательно влияет на когнитивные функции. Кроме того, она часто сопровождается тревогой, депрессией, ограничением повседневной активности, что значительно снижает качество жизни пациентов, страдающих хроническими болями [Severeijns R., Vlaeyen J.W., van den Hout M.A. et al. Pain catastrophizing predicts pain intensity, disability, and psychological distress independent of the level of physical impairment // Clin J. Pain. 2001. Vol. 17. P. 165-172].
Первое место в терапии хронической боли, связанной с депрессией, занимают антидепрессанты, которые оказывают не только антидепрессивное, но и собственно анальгетическое действие (Мосолов С.Н. Клиническое применение современных антидепрессантов. СПб, 1995; 565).
Эффективность антидепрессантов в лечении хронических болевых синдромов достигает 75% [Fuller RW. Serotonin uptake inhibitor // Prog Drug Res 1995; 45: 167-204]. Эффективность антидепрессантов тем выше, чем большую роль в хронической боли играет депрессия.
Механизмы противоболевого действия антидепрессантов следующие. - противоболевой эффект в связи с редукцией депрессии (этот механизм особенно значим, если болевой синдром являлся маской депрессии, т.е. при первичных депрессиях, однако и при вторичных по отношению к боли депрессиях редукция депрессии всегда приводит к ослаблению болевого синдрома);
- противоболевой эффект в связи с потенцированием действия как экзогенных, так и эндогенных анальгезирующих веществ, в основном опиоидных пептидов;
- противоболевой эффект в связи со стимуляцией антиноцицептивных нисходящих в основном серотонинергических систем мозга.
Для получения достаточного противоболевого и антидепрессивного эффекта антидепрессанты надо назначать в достаточной клинической дозе и на длительное время.
Для лечения болей с учетом нейрохимических механизмов ее развития, разработчиками предлагались различные комбинации препаратов.
Например, известен патент US 7534806 (опубл. 19.05.2009), описывающий лечение нейропатической боли и связанных с ней симптомов комбинацией ибудиласта (3-изобутирил-2-изопропилпиразоло[1,5-а]пиридина) и второго компонента, такого как габапентин, мемантин, морфин, каннабиоиды, трамадол, дулоксетин, трициклические антидепрессанты.
Известен также патент US 6251863 (опубл. 26.06.2001), описывающий лечение нейродегенеративных заболеваний,
сопровождающихся болью, с помощью комбинации релаксина с эстрогеном или глюкозамином.
Известен патент US 6245802 (опубл. 12.06.2001), описывающий способ лечения боли, включающий введение млекопитающим обезболивающей комбинации, содержащей дулоксетин и нестероидное противовоспалительное средство (НПВС) или парацетамол. Боль может представлять боль из группы, состоящей из невропатической боли, диабетической невропатии, фибромиалгии, боли, связанной с соматоформными расстройствами, боли в суставах, боли при раке, боли в шее, плече, в спине, головные боли, мигрень, герпес невралгию, фантомные боли конечностей, центральное боли, зубной боли, НПВП-устойчивой боли, висцеральной боли, хирургической боли, послеоперационной боли, боли в костях травмы, боли во время родов, боли в результате ожогов, послеродовые боли, стенокардии боли, боли, связанной с мочеполовой системой, и ноцицептивной боли.
С другой стороны, например, антиконвульсанты весьма эффективны при лечении нейропатической боли. Их антиболевая активность связана с механизмом блокирования избыточного выброса в пресинаптическую щель глутамата - передатчика болевого импульса с одного нейрона на другой. Среди антиконвульсантов наиболее признанными препаратами для лечения нейропатической боли являются габапентин и прегабалин [Dworkin R.H., O 'Connor А.В., Backonja Metal. Pharmacologic management of neuropathic pain: evidence-based recommendations. Pain 2007; 132:23 7-51]. Например, габапентин при хронической нейропатической боли назначается в качестве монотерапии, начиная с минимальной дозы, с последующим ее увеличением до достижения желаемого результата. Подходящая для пациента доза зависит от многих факторов: наследственно обусловленный порог болевой чувствительности, условия жизни и работы, общее физическое состояние и эмоциональный статус пациента. Продолжительность лечения зависит от клинической реакции пациента на терапию [Данилов А.В., Давыдов О.С. Принципы и алгоритмы лечения нейропатической боли. РМЖ, 2008, Т. 16, с. 11-16].
Указанные препараты зачастую имеют серьезные побочные эффекты, в ряде случаев могут вызывать привыкание, утрачивать эффективность при хроническом применении, поэтому в настоящее время сохраняется потребность в новых высокоэффективных и безопасных средствах для лечения хронической боли, подходящих для длительного применения.
Пальмитоилэтаноламид (ПЭА, PEA) - эндоканнабиноид, который напрямую не связывается с каннабиноидными рецепторами (имеет низкий аффинитет к СВ1 и СВ2 рецепторам), является эндогенным лигандом для альфа рецепторов, активируемых пероксисомными пролифераторами (PPAR альфа). PPAR альфа рецептор является регулятором генов, которые контролируют боль и воспаление, возможно, через выключение ядерного сигнального каскада каппаВ-фактора [Hesselink JM., Hekker ТА. Therapeutic utility of palmitoylethanolamide in the treatment of neuropathic pain associated with various pathological conditions: a case series. J. Pain Res. 2012, 5: 437-42].
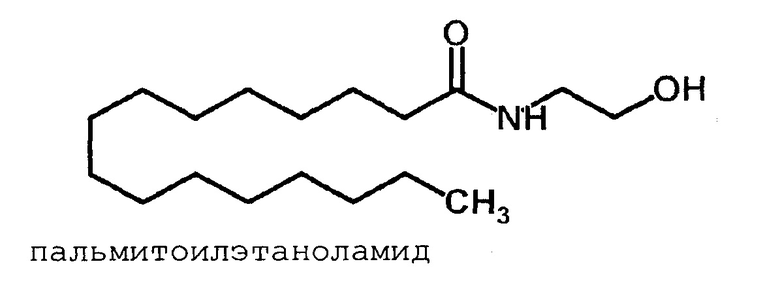
Пальмитоилэтаноламид не обладает выраженным аффинитетом к СВ1-и СВ2-рецепторам, но вызывает антиноцицептивный эффект, который может ослабляться избирательными СВ2-антагонистами, но не селективными блокаторами СВ1-рецепторов [D.M. Lambert, F.G. Di Paolo, P. Sonveaux, et al., Analogues and homologues of N-palmitoyletanolamides, a putative endogenous CB(2) cannabinoid, as potential ligands for the cannabinoid receptors. Biochim. Biophys. Acta, 1440, 266-274, 1999]. Анализируя данный феномен на разных моделях ноцицепции с использованием различных способов введения вещества, а также взаимодействие ПЭА с анандамидом, исследователи пришли к выводу о наличии в организме СВ рецепторов, не принадлежащих к типу ваниллоидных рецепторов [G. Griffin, S.R. Fernando, R.A. Ross, et al., Evidence for the presence of CB2-like cannabinoid receptors on peripheral nerve terminals. Eur. J. Pharmacol., 339, 53-61, 1997].
В настоящее время доказано, что в патогенезе развития хронической боли лежит активация не только ноцицептивных путей, но и ненейрональных клеток, таких как тучные клетки, глиальные и микроглиальные клетки. Тучные клетки (их дегрануляция) играют ключевую роль в развитии гиперальгезии при повреждении нервов, дорсопатии, мигрени, хронической тазовой боли. PEA относится к эндогенным субстратам организма, синтезируется "по требованию", местно аккумулируется в тканях пропорционально стрессу, степени повреждения и боли [Ghafouri N et al. Palmitoylethanolamide and stearoylethanolamide levels in the interstitium of the trapezius muscle of women with chronic widespread pain and chronic neck-shoulder pain correlate with pain intensity and sensitivity. Pain. 2013, 154(9): 1649-58]. На моделях с животными доказано, что PEA ингибирует активность тучных клеток и продукцию провоспалительных медиаторов, уменьшая эндоневральный отек, тем самым реализуя противовоспалительный и обезболивающий эффекты [Marcucci М, Germini F, et al. Efficacy of ultra-micronized palmitoylethanolamide (um-PEA) in geriatric patients with chronic pain: study protocol for a series of N-of-1 randomized trials. Trials. 2016, 17: 369]. Ha моделях с животными применение PEA вызывало утолщение миелиновой оболочки, увеличение аксонального диаметра, а также количества нервного волокна, что возможно расценивать как нейропротективный эффект.
PEA липофилен, плохо растворим в воде; биодоступность у человека недостаточно изучена (т.к. это естественный компонент организма), у животных, вероятно, биодоступность низкая; T1/2 у крыс составляет 12 мин; быстро гидролизуется ферментами NAAA (N-acylethanolamine-hydrolyzing acid amidase) и FAAH (fatty acid amide hydrolase). Распределение в головном мозге гетерогенное, с максимальным накоплением в гипоталамусе. Сравнение эффективности двух доступных форм PEA, микронизированного и ультрамикронизированного, на человеке не проводилось; в открытых источниках отсутствуют данные по превосходству одной формы над другой [Gabrielsson et al. Palmitoylethanolamide for the treatment of pain: pharmacokinetics, safety and efficacy. Br. J. Clin. Parmacol. 2016, 82(4): 932-42].
Для повышения растворимости пальмитоилэтаноламида применяют технологию уменьшения размера частиц (микронизация и/или ультамикронизация) для увеличения площади взаимодействия с растворителем [Nokhodchi A. The effect of type and concentration of vehicles on the dissolution rate of a poorly soluble drug from liquisolid compacts // J. Pharm. Pharmauceut. Sci. 2005, 8(1): 18-25].
Микронизированный пальмитоилэтаноламид может иметь размер частиц, например, 0,5-10 мкм (Nestmann ER. Safety of micronized palmitoylethanolamide (microPEA): lack of toxicity and genotoxic potential. Food Sci Nutr, 2016, 5(2): 292-309), a ультрамикронизированный пальмитоилэтаноламид может иметь размер частиц, например, 0,8-6 мкм (US 20150328173).
Уридинмонофосфат (УМФ, UMP) представляет собой нуклеотид, который используется в качестве мономера в РНК. Это сложный эфир фосфорной кислоты с нуклеозидом уридином. UMP состоит из фосфатной группы, пентозного сахара рибозы и нуклеотида урацила; следовательно, представляет собой рибонуклеотид монофосфат. В исследовании было обнаружено, что у песчанок, получавших комбинацию монофосфата уридина, холина и докозагексаеновой кислоты (DHA), были значительно улучшены характеристики обучения и памяти в тестах с использованием лабиринтов по сравнению с животными, которые не получали указанные добавки, что подразумевало увеличение когнитивной функции [Holguin, S. et al. Dietary uridine enhances the improvement in learning and memory produced by administering DHA to gerbils. The FASEB Journal. 22 (11): 3938-3946, 2008]. Было установлено, что повреждение нервной ткани сопровождается увеличением потребности в уридине и цитидине, а прием уридина монофосфата и цитидина монофосфата ускоряет регенерацию нервной ткани и увеличивает скорость нервной проводимости.
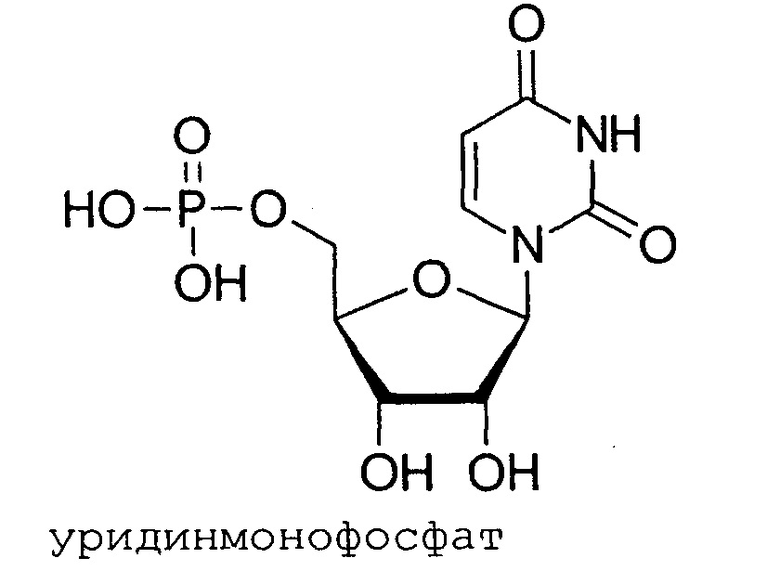
В настоящее время цитидинмонофосфат (ЦМФ) и уридинмонофосфат (УМФ) назначают пациентам для лечения нейромышечных нарушений. У пациентов, получаюших ЦМФ/УМФ, происходит восстановление нарушенных неврологических функций и ослабление боли.
Известно применении уридина для лечения диабетической периферической нейропатии (Gallai V, Mazzotta G, Montesi S, Sarchielli P, Del Gatto F. Effects of uridine in the treatment of diabetic neuropathy: an electrophysiological study. Acta Neurol Scand. 1992 Jul; 86(1): 3-7) и применение трифосфата уридина в комплексной терапии компрессионной невропатии (Henrique Goldberg, Marco Antonio Mibielli, Carlos Pereira Nunes, Stephanie Wrobel Goldberg, Luiz Buchman, Spyros GE Mezitis, Helio Rzetelna, Lisa Oliveira, Mauro Geller, and Fernanda Wajnsztajn. A double-blind, randomized, comparative study of the use of a combination of uridine triphosphate trisodium, cytidine monophosphate disodium, and hydroxocobalamin, versus isolated treatment with hydroxocobalamin, in patients presenting with compressive neuralgias. J Pain Res. 2017; 10: 397-404). При этом известно, что монофосфат, дифосфат и трифосфат уридина могут в организме взаимопревращаться под действием ферментов киназ и фосфатаз. Полагают, что уридин не оказывает прямого анальгетического эффекта, и механизм действия его при нейропатической боли может быть связан с регенерацией нервной ткани.
Таурин (2-аминоэтансульфоновая кислота) - сульфокислота, образующаяся в организме из аминокислоты цистеина. Таурин часто называют серосодержащей аминокислотой, при этом в молекуле отсутствует карбоксильная группа. В небольших количествах присутствует в тканях и желчи животных и человека. Используется как пищевая добавка или в качестве лекарственного средства.
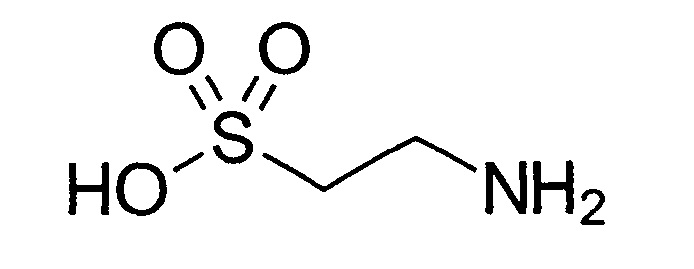
таурин
Таурин оказывает при субконъюнктивальном введении ретинопротекторное, противокатарактное, а также метаболическое действие. При системном воздействии таурин оказывает не только метаболическое действие, но и обладает гепатопротекторным действием, кардиотоническими и гипотензивными свойствами [Sagara, М., Murakami, S.(Mizushima, S. et al. Taurine in 24-h Urine Samples Is Inversely Related to Cardiovascular Risks of Middle Aged Subjects in 50 Populations of the World. // Taurine. 2015. Vol. 9. P. 623-636].
Есть данные, что таурин способствует образованию новых клеток в гиппокампе - области мозга, связанной с памятью [Gebara, Е., Udry, F., Sultan, S. et al. Taurine increases hippocampal neurogenesis in aging mice. // Stem cell research. 2015. Vol. 14(3). P. 369-379]. Он способствует также регенерации мозга при закрытых травмах головы. Обладает радиопротекторными свойствами.
Таурин играет важную роль в липидном обмене, способствует нормализации функции клеточных мембран, оптимизации энергетических и обменных процессов, сохранению электролитного состава цитоплазмы за счет накопления ионов калия и кальция. В головном мозге выполняет функцию нейромедиатора, тормозящего синаптическую передачу, обладает противосудорожной активностью. Вызывает нормализацию метаболизма глазных тканей при заболеваниях дистрофического характера.
Известна антиноцицептивная активность таурина при нейропатической боли, выражающаяся в снижении аллодинии в моделях диабетической нейропатии и сдавления нерва у крыс.Полагают, что эффект таурина может быть обусловлен активацией глициновых рецепторов нейронов [Terada Т, Нага K, Haranishi Y, Sata Т. Antinociceptive effect of intrathecal administration of taurine in rat models of neuropathic pain. Can J Anaesth. 2011, 58(7): 630-637], либо его защитным действием в отношении ингибиторных нейронов в ЦНС от их эксайтотоксического повреждения [Belfer I, Davidson Е, Ratner A, Beery Е, Shir Y, Seltzer Z. Dietary supplementation with the inhibitory amino acid taurine suppresses autotomy in HA rats. Neuroreport. 1998, 9(13): 3103-3107]. Анальгетический эффект таурина проявляется в том числе при его пероральном введении.
Витамин Е (vitamin Е) - группа природных соединений производных токола. Важнейшими соединениями являются токоферолы и токотриенолы. Жирорастворимый витамин. Впервые был выделен в 1922 году, а в 1938 был синтезирован химическим путем.
Витамин Е является универсальным протектором клеточных мембран от окислительного повреждения. Он занимает такое положение в мембране, которое препятствует контакту кислорода с ненасыщенными липидами мембран (образование гидрофобных комплексов). Это защищает биомембраны от их перекисной деструкции. Антиоксидантные свойства токоферола обусловлены также способностью подвижного гидроксила хроманового ядра его молекулы непосредственно взаимодействовать со свободными радикалами кислорода (O2⋅, НО⋅, HO2⋅), свободными радикалами ненасыщенных жирных кислот (RO⋅, RO2⋅) и перекисями жирных кислот. Мембраностабилизирующее действие витамина проявляется и в его свойстве предохранять от окисления SH-группы мембранных белков. Его антиоксидантное действие заключается также в способности защищать от окисления двойные связи в молекулах каротина и витамина А. Витамин Е (совместно с аскорбатом) способствует включению селена в состав активного центра глутатионпероксидазы, тем самым он активизирует ферментативную антиоксидантную защиту (глутатионпероксидаза обезвреживает гидропероксиды липидов).
Токоферол является не только антиоксидантом, но и антигипоксантом, что объясняется его способностью стабилизировать митохондриальную мембрану и экономить потребление кислорода клетками.
Известно, что витамин Е оказывает анальтезирующий эффект при хронической боли и аллодинии, причем его действие, вероятно, обусловлено антиоксидантными свойствами, так как активные формы кислорода играют критическую роль в патогенезе нейропатической боли (Kim НК, Kim JH, Gao X, et al. Analgesic effect of vitamin E is mediated by reducing central sensitization in neuropathic pain. Pain. 2006 May; 122 (1-2): 53-62; Jun-Mo Park, Chae Kyung Kim, Hyung Chul Lee, et al. Antiallodynic effects of vitamin С and vitamin E in chronic post-ischemia pain rat model. Korean J Anesthesiol. 2013 Nov; 65 (5): 442-448).
Авторы настоящего изобретения обнаружили, что ранее не известно использование комбинации пальмитоилэтаноламида и, по меньшей мере, одного вещества, выбранного из группы, включающей уридинмонофосфат, таурин и витамин Е, для лечения хронической боли, и при этом указанная комбинация позволяет добиться неожиданного
синергетического эффекта в лечении хронической боли.
Ниже приведены определения терминов, которые используются в описании настоящего изобретения.
«Лекарственное средство (препарат)» - вещество (или смесь веществ в виде фармацевтической композиции) в виде таблеток, капсул, инъекций, мазей и др. готовых форм, предназначенное для восстановления, исправления или изменения физиологических функций у человека и животных, а также для лечения и профилактики болезней, диагностики, анестезии, контрацепции, косметологии и прочего.
«Фармацевтическая композиция» обозначает композицию, включающую в себя новую комбинацию по настоящем изобретению, и, по крайней мере, один из компонентов, выбранных из группы, состоящей из фармацевтически приемлемых и фармакологически совместимых наполнителей, растворителей, разбавителей, носителей,
вспомогательных, распределяющих средств, средств доставки, таких как консерванты, стабилизаторы, наполнители, увлажнители, эмульгаторы, суспендирующие агенты, загустители, подсластители, отдушки, ароматизаторы, антибактериальные агенты, фунгициды, лубриканты, регуляторы пролонгированной доставки, выбор и соотношение которых зависит от природы и способа назначения и дозировки. Примерами суспендирующих агентов являются этоксилированный изостеариловый спирт, полиоксиэтилен, сорбитол и сорбитовый эфир, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, а также смеси этих веществ. Защита от действия микроорганизмов может быть обеспечена с помощью разнообразных антибактериальных и противогрибковых агентов, например, таких как, парабены, хлорбутанол, сорбиновая кислота и подобные им соединения. Композиция может включать также изотонические агенты, например, сахара, хлористый натрий и им подобные. Пролонгированное действие композиции может быть обеспечено с помощью агентов, замедляющих абсорбцию активного начала, например, моностеарат алюминия и желатин, производными целлюлозы, например, гидроксипропилметилцеллюлоза (ГПМЦ). Примерами подходящих носителей, растворителей, разбавителей и средств доставки являются вода, этанол, полиспирты, а также их смеси, растительные масла (такие, как оливковое масло) и инъекционные органические сложные эфиры (такие, как этилолеат). Примерами наполнителей являются лактоза, молочный сахар, цитрат натрия, карбонат кальция, фосфат кальция и им подобные. Примерами и распределяющих средств являются крахмал, альгиновая кислота и ее соли, силикаты. Примерами лубрикантов являются стеарат магния, лаурилсульфат натрия, тальк, диоксид кремния, а также полиэтиленгликоль с высоким молекулярным весом. Фармацевтическая композиция для перорального, сублингвального, трансдермального, внутримышечного, внутривенного, подкожного, местного или ректального введения активного начала, одного или в комбинации с другим активным началом, может быть введена животным и людям в стандартной форме введения, в виде смеси с традиционными фармацевтическими носителями. Пригодные стандартные формы введения включают пероральные формы, такие как таблетки, желатиновые капсулы, пилюли, порошки, гранулы, жевательные резинки и пероральные растворы или суспензии, сублингвальные и трансбуккальные формы введения, аэрозоли, имплантаты, местные, трансдермальные, подкожные, внутримышечные, внутривенные, интраназальные или внутриглазные формы введения и ректальные формы введения.
Фармацевтические композиции могут включать фармацевтически приемлемые эксципиенты. Под фармацевтически приемлемыми эксципиентами подразумеваются применяемые в сфере фармацевтики разбавители, вспомогательные агенты и/или носители. Фармацевтическая композиция наряду с действующими веществами по настоящему изобретению, или их фармацевтически приемлемыми солями и производными, может включать и другие активные субстанции, в том числе обладающие активностью, при условии, что они не вызывают нежелательных эффектов.
При необходимости использования фармацевтической композиции по настоящему изобретению в клинической практике она может смешиваться с традиционными фармацевтическими носителями.
Носители, используемые в фармацевтических композициях по настоящему изобретению, представляют собой носители, которые применяются в сфере фармацевтики для получения распространенных форм, в том числе: в пероральных формах используются связующие вещества, смазывающие агенты, дезинтеграторы, растворители, разбавители, стабилизаторы, суспендирующие агенты, корригенты вкуса; в формах для инъекций используются антисептические агенты, солюбилизаторы, стабилизаторы; в местных формах используются основы, разбавители, смазывающие агенты, антисептические агенты.
«Биологически активная добавка» означает композицию натуральных или идентичных натуральным биологически активных веществ, предназначенных для непосредственного приема или введения в состав пищевых продуктов с целью обогащения рациона химическими или биологически активными веществами и их комплексами.
«Фармацевтически приемлемая соль» означает относительно нетоксичные органические и неорганические соли кислот и оснований, заявленных в настоящем изобретении. Эти соли могут быть получены in situ в процессе синтеза, выделения или очистки соединений или получены специально. В частности, соли оснований могут быть получены специально, исходя из очищенного свободного основания заявленного соединения и подходящей органической или неорганической кислоты. Примерами полученных таким образом солей являются гидрохлориды, гидробромиды, сульфаты, бисульфаты, фосфаты, нитраты, ацетаты, оксалаты, валериаты, олеаты, пальмитаты, стеараты, лаураты, бораты, бензоаты, лактаты, тозилаты, цитраты, фумараты, сукцинаты, тартраты, мезилаты, малонаты, салицилаты, пропионаты, этансульфонаты, бензолсульфонаты, сульфаматы и им подобные (Подробное описание свойств таких солей дано в Berge S.M., et al., "Pharmaceutical Salts" J. Pharm. Sci. 1977, 66: 1-19). Соли заявленных кислот также могут быть специально получены реакцией очищенной кислоты с подходящим основанием, при этом могут быть синтезированы соли металлов и аминов. К металлическим относятся соли натрия, калия, кальция, бария, цинка, магния, лития и алюминия, наиболее желательными из которых являются соли натрия и калия. Подходящими неорганическими основаниями, из которых могут быть получены соли металлов, являются гидроксид, карбонат, бикарбонат и гидрид натрия, гидроксид и бикарбонат калия, поташ, гидроксид лития, гидроксид кальция, гидроксид магния, гидроксид цинка. В качестве органических оснований, из которых могут быть получены соли заявленных кислот, выбраны амины и аминокислоты, обладающие достаточной основностью, чтобы образовать устойчивую соль, и пригодные для использования в медицинских целях (в частности, они должны обладать низкой токсичностью). К таким аминам относятся аммиак, метиламин, диметиламин, триметиламин, этиламин, диэтиламин, триэтиламин, бензиламин, дибензиламин, дициклогексиламин, пиперазин, этилпиперидин, трис(гидроксиметил)аминометан и подобные им. Кроме того, для солеобразования могут быть использованы гидроокиси тетраалкиламмония, например, такие как холин, тетраметиламмоний, тетраэтиламмоний и им подобные. В качестве аминокислот могут быть использованы основные аминокислоты - лизин, орнитин и аргинин.
Более предпочтительные фармацевтически приемлемые соли и производные таурина по настоящему изобретению представляют собой таураты Li, К, Мд и Са, аддукты таурина с L-карнитином и О-ацетил-L-карнитином, а также соли N-ацетилтаурина.
Более предпочтительные фармацевтически приемлемые соли уридинмонофосфата по настоящему изобретению представляют собой натриевую соль уридинмонофосфата, предпочтительно, динатриевую соль уридинмонофосфата, ее дигидрат.
Витамин Е по настоящему изобретению включает все его фармацевтически приемлемые формы, изомеры и производные, обладающие активностью витамина Е, включая токоферолы и токотриенолы, такие как альфа-токоферол, бета-токоферол, гамма-токоферол, дельта-токоферол, альфа-токотриенол, бета-токотриенол, гамма-токотриенол, дельта-токотриенол, а также их эфиры, такие, как альфа-токоферил ацетат, сукцинат, никотинат и линолат, а также их смеси.
Термин «лечение» обозначает любое лечение заболевания или состояния у субъекта, включающее подавление развития заболевания или состояния, что означает приостановку или подавление развития клинических симптомов, и/или снижение интенсивности симптомов заболевания или состояния, что означает регрессию клинических симптомов.
Термин «терапевтически эффективное количество» означает количество комбинации соединений по настоящему изобретению или любых их производных, которое (1) лечит или предупреждает конкретное заболевание, состояние или расстройство, (2) ослабляет, улучшает или устраняет один или более симптомов конкретного заболевания, состояния или расстройства, или (3) предупреждает или задерживает наступление одного или более симптомов конкретного заболевания, состояния или расстройства, изложенного в данном описании.
Термин «фармацевтически приемлемый» означает, что данное вещество или композиция, в отношении которых применяется этот термин, должны быть совместимы с точки зрения химии и/или токсикологии с другими ингредиентами, входящими в состав препарата, и безопасны для того, кого лечат этим веществом или композицией.
Термины «содержащий», «содержит» означает, что указанные комбинации, композиции и наборы включают перечисленные компоненты, но не исключают включение других компонентов.
Термин «нутрицевтически приемлемый» для целей настоящей заявки означает, что данный компонент может в принципе использоваться при изготовлении нутрицевтических композиций, что он является безопасным для потребителя композиции биологически активной добавки и что он совместим с другими компонентами композиции биологически активной добавки.
Задачей настоящего изобретения является создание нового средства для лечения хронической боли, содержащая в эффективных количествах пальмитоилэтаноламид и по меньшей мере одно вещество, выбранное из группы, включающей уридинмонофосфат, таурин, витамин Е, или их фармацевтически приемлемую соль или производное.
Техническими результатами настоящего изобретения являются:
- повышение эффективности лечения хронической боли за счет синергетического эффекта действующих веществ, и, как следствие снижение требующихся доз активных веществ, уменьшение побочных эффектов и повышение безопасности лечения;
- расширение арсенала средств для лечения хронической боли. Поставленная задача осуществляется, а технический результат
достигается созданием комбинации для лечения хронической боли, содержащей в эффективных количествах пальмитоилэтаноламид, которая включает также по меньшей мере одно вещество, выбранное из группы, включающей уридинмонофосфат, таурин, витамин Е, или их фармацевтически приемлемые соли или их производные.
Согласно предпочтительным вариантам реализации технический результат также достигается тем, что:
- действующие вещества в составе упомянутой комбинации вводят в суточных дозировках:
- введение упомянутой комбинации осуществляется перорально;
- упомянутая комбинация представляет собой таблетки для приема внутрь или сублингвальное саше;
- пальмитоилэтаноламид в упомянутой комбинации находится в микронизированном или ультрамикронизированном виде;
- упомянутая комбинация дополнительно включает вещество, выбранное из группы, включающей карнитин, витамины группы В, ресвератрол, куркумин, бенфотиамин, линолевая, линоленовая кислоты, липоевая кислота.
Поставленная задача также осуществляется, а технический результат достигается получением фармацевтической композиции для лечения хронической боли, которая содержит в эффективных количествах вышеупомянутую комбинацию, и поменьше мере одно вспомогательное вещество и/или поменьше мере один фармацевтически приемлемый носитель.
Согласно предпочтительным вариантам реализации технический результат также достигается тем, что:
- действующие вещества в составе упомянутой композиции вводят в суточных дозировках:
- действующие вещества в составе упомянутой композиции входят в массовых соотношениях:
пальмитоилэтаноламид : уридинмонофосфат от 1:4 до 2500:1;
пальмитоилэтаноламид : таурин от 1:200 до 500:1;
пальмитоилэтаноламид : витамин Е от 1:37 до 192:1
- введение упомянутой композиции осуществляется перорально;
- упомянутая композиции представляет собой таблетки для приема внутрь или сублингвальное саше;
- пальмитоилэтаноламид в упомянутой композиции находится в микронизированном или ультрамикронизированном виде;
- упомянутая композиция дополнительно включает вещество, выбранное из группы, включающей карнитин, витамины группы В, ресвератрол, куркумин, бенфотиамин, линолевая, линоленовая кислоты, липоевая кислота.
Поставленная задача также осуществляется, а технический результат достигается созданием набора для лечения хронической боли, отличающийся тем, что упомянутый набор включает фармацевтическую композицию, которая содержит в эффективных количествах пальмитоилэтаноламид и поменьше мере одно вспомогательное вещество и/или поменьше мере один фармацевтически приемлемый носитель. Также в состав набора входит по меньшей мере одна дополнительная фармацевтическая композиция, содержащая в эффективном количестве, по меньшей мере одно вещество, выбранное из группы, включающей уридинмонофосфат, таурин, витамин Е, или их фармацевтически приемлемые соли или производные, и, опционально, вспомогательные вещества и фармацевтически приемлемый носитель. Кроме того, в состав набора входит инструкция по применению.
Поставленная задача также осуществляется, а технический результат достигается применением упомянутой комбинации или упомянутой фармацевтической композиции, или упомянутого набора согласно настоящему изобретению для лечения хронической боли.
Согласно предпочтительным вариантам реализации технический результат также достигается тем, что:
- хроническая боль выбрана из группы, включающей нейропатическую боль после химиотерапии, диабетическую хроническую нейропатическую боль, нейропатическую боль при синдроме сдавления нерва, постинсультную хроническую нейропатическую боль, синдром хронической тазовой боли, боль при ревматических заболеваниях, воспалительных заболеваниях, фибромиалгию, фантомную боль;
- нейропатическая боль при синдроме сдавления нерва представляет собой карпальный туннельный синдром, дорсопатию или ишиаз;
- синдром хронической тазовой боли представляет собой боль при вульводинии, интерстициальном цистите, эндометриозе, менструальные боли;
- боль при ревматических заболеваниях представляет собой боль при ревматоидном артрите, остеоартрите;
- боль при воспалительных заболеваниях представляет собой боль при болезни Крона, синдроме раздраженного кишечника, гриппе;
- действующие вещества вводят в предпочтительных суточных дозировках:
Поставленная задача также осуществляется, а технический результат достигается созданием биологически активной добавки к пище, включающей пальмитоилэтаноламид, которая включает также по меньшей мере, одно вещество, выбранное из группы, включающей уридинмонофосфат, таурин, витамин Е, или их нутрицевтически приемлемую соль или производное.
Согласно предпочтительным вариантам реализации технический результат также достигается тем, что:
- упомянутая добавка представляет собой таблетки для приема внутрь или сублингвальное саше;
- пальмитоилэтаноламид в добавке находится в микронизированном или ультрамикронизированном состоянии;
- упомянутая добавка дополнительно включает вещество, выбранное из группы, включающей карнитин, витамины группы В, ресвератрол, куркумин, бенфотиамин, линолевая, линоленовая кислоты, липоевая кислота.
Лекарственные средства и фармацевтические композиции могут вводиться перорально или парентерально (например, внутривенно, подкожно, внутрибрюшинно или местно). Клиническая дозировка средства, содержащего новую комбинацию пальмитоилэтаноламида и, по меньшей мере, одного вещества, выбранного из группы, включающей уридинмонофосфат, таурин и витамин Е, по настоящему изобретению, у пациентов может корректироваться в зависимости от терапевтической эффективности и биодоступности активных ингредиентов в организме, скорости их обмена и выведения из организма, а также в зависимости от возраста, пола и стадии заболевания пациента, при этом суточная доза пальмитоилэтаноламида у взрослых обычно составляет 50-2500 мг в сутки, предпочтительно, 300-1200 мг в сутки, например, примерно 600-1200 мг в сутки. Суточная доза таурина у взрослых может составлять 50-10000 мг в сутки, предпочтительно, 500-6000 мг в сутки, предпочтительно, 1500-3000 мг в сутки, например, примерно 2000 мг в сутки. Суточная доза уридинмонофосфата у взрослых может составлять 1-1000 мг в сутки, предпочтительно, 1-500 мг в сутки, предпочтительно, 1-200 мг в сутки, например, примерно 150 мг в сутки. Суточная доза витамина Е у взрослых может составлять 15-2000 ME в сутки, предпочтительно, 100-1000 ME в сутки, предпочтительно, 60-75 ME в сутки, например, примерно 30 ME в сутки. Поэтому во время приготовления из фармацевтической композиции лекарственного средства по настоящему изобретению в виде единиц дозировки необходимо учитывать вышеназванную эффективную дозировку, при этом каждая единица дозировки препарата может содержать одно или несколько из следующих веществ: 25-2500 мг пальмитоилэтаноламида, 25-5000 мг таурина,. 0,5-200 мг уридинмонофосфата, 5-2000 ME витамина Е. В соответствии с указаниями врача или фармацевта данные препараты могут приниматься несколько раз в течение определенных промежутков времени (предпочтительно - от одного до шести раз).
Представленные ниже примеры иллюстрируют, но не ограничивают изобретение.
Пример 1. Модель болевого синдрома, вызванного перерезкой седалищного нерва (постинсультная хроническая боль).
Хроническая боль, связанная с повреждением периферического нерва, характеризуется неприятным аномальным ощущением (дизестезия), повышенной реакцией на болевые стимулы (гипералгезия) и болью в ответ на стимул, который обычно не вызывает боли (аллодиния). Аксотомия, полная перерезка периферического нерва, широко используется в качестве экспериментальной модели для индуцирования периферической нейропатии у крыс [A. Muthuraman et al. Ameliorative effects of Ocimum sanctum in sciatic nerve transection-induced neuropathy in rats. J Ethnopharmacol.,120 (1): 56-62, 2008]. Экотомическая невропатия у экспериментальных животных может быть соотнесена с комплексным региональным болевым синдром (CRPS) у людей, который является общим после перелома, артропластики коленного сустава и инсульта [Daviet, J. С, et al. 2002. Clinical factors in the prognosis of complex regional pain syndrome type 1 after stroke: a prospective study. American Journal of Physical Medicine and Rehabilitation 81, 34-3 9].
В экспериментах использовались взрослые крысы линии Wistar, имеющие массу тела 180-250 граммов. Крысы содержались в терморегулируемых боксах (с температурой 21°С) с 12-часовым циклом дня и ночи и достаточным количеством воды и пищи.
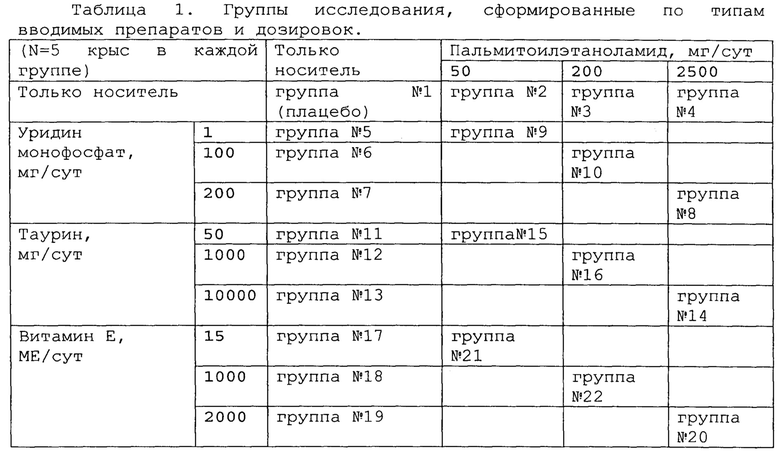
Сто десять (110) крыс линии Wistar случайным образом распределяли на двадцать две (22) равных по составу группы (N=5), отличающихся типом вводимого препарата и дозировкой. Сформированные группы крыс кратко описаны в таблице 1 ниже.
Исследование проводилось для 4 препаратов (пальмитоилэтаноламид, уридинмонофосфат, таурин, витамин Е), каждый из которых вводился в 3 разных дозах, и для 3 комбинаций (пальмитоилэтаноламид и уридинмонофосфат, пальмитоилэтаноламид и таурин, пальмитоилэтаноламид и витамин Е), каждая из которых также вводилась в трех дозах. Контролем служила группа крыс, получающих только носитель (группа плацебо). Информация по дозировкам приведена в таблице 1. Все препараты вводили перорально через 3 дня после операции и далее один раз в день в течение всего времени исследования. Все дозы приведены в пересчете на человека.
Периферическую невропатию индуцировали у крыс путем полной трансакции седалищного нерва (аксотомии). Крыс анестезировали тиопенталом натрия (35 мг/кг внутрибрюшинно). Кожа боковой поверхности левого бедра была разрезана, и разрез был сделан непосредственно через мышцу бедра, чтобы выявить седалищный нерв. Он был плотно лигирован шелком в двух местах перед трифуркацией концевых ветвей (икроножный, общий малоберцовый и большеберцовый нервы). Седалищный нерв был перерезан между лигатурами длиной около 5 мм в левой лапе. На правом бедре операции не проводилось, а неповрежденная правая лапа служила контролем. Ноцицептивные пороги оценивали на 14-й день после операции (аллодиния и гипералгезия).
Механико-тактильная аллодиния. Животных помещали в приподнятую над землей акриловую камеру (15×15×15 см) с проволочной сеткой на дне. Перед началом тестирования животных оставляли в камере на 5-10 минут для адаптации. Далее подошвенную поверхность лапы животного стимулировали калиброванными филаментами (или нитями) фон Фрея (BIOSEB, США). Филаменты представляли собой набор из 10 стандартных пластиковых нитей, увеличивающихся в диаметре. Жесткость нитей, выражаемая как минимальное усилие необходимое для сгибания волоска, возрастала при такой калибровке логарифмически с абсолютными значениями от 0,6 граммов до 26 граммов. У каждой крысы порог чувствительности поочередно определяли на каждой лапе в трех повторах (всего 6 прикладываний с интервалом в 10 секунд для каждого филамента; интервал между последовательным прикладыванием разных филаментов составлял 2 минуты). Кончиком нити прикасались к середине подошвенной поверхности лапы с усилием, необходимым для сгибания волоска, и удерживали волосок в таком положении 6-8 секунд. Положительный ответ регистрировали, если животное резко отдергивало лапу во время касания. Порог чувствительности определяли по минимальному давлению, вызывающему рефлекторную реакцию отдергивания лапы (4 раза из 6 прикладываний).
Холодовая гипералгезия. Для оценки холодовой гипералгезии в данном исследовании использовали специальную тест-камеру с горячей/холодной пластиной (Ugo Basile, Италия). Тест проводили в камере с акриловыми стенками высотой 30 см на охлажденной до 0°С металлической пластине размером 30×30 см. Здоровые животные способны в течение длительного времени выдерживать данную температуру, опираясь всеми конечностями на охлажденный пол, тогда как при повреждении нерва время контакта конечности с холодной пластиной значительно сокращается. Для количественной оценки данного параметра регистрировали время удержания конечности на весу в течение 1 минуты пребывания животного в тест-камере. Каждое животное тестировалось трижды с интервалом в 5 минут между измерениями; полученные значения усредняли.
Для каждой группы исследования (n=5) рассчитывали среднюю оценку, полученную в соответствующем тесте, и стандартную ошибку среднего для каждого значения. Достоверность различий между группами оценивали с помощью парного t-критерия Стьюдента (при уровне значимости р<0,05).
Полученные результаты приведены в таблицах 2-4 ниже.
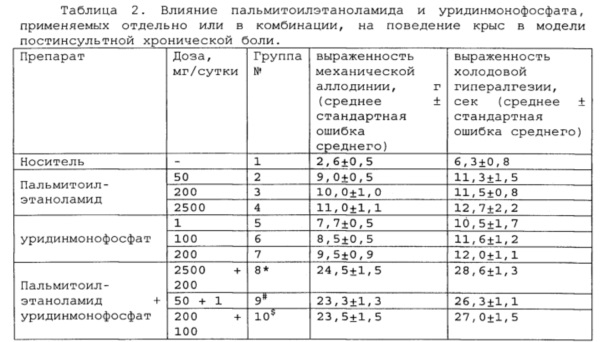
*, # s - достоверное отличие от ожидаемого (расчетного) аддитивного эффекта комбинации пальмитоилэтаноламид и
уридинмонофосфат (уровень значимости р<0,05) для каждого уровня доз.

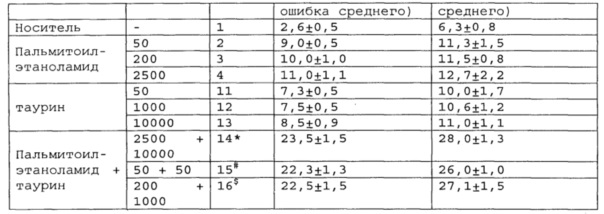
*, #, s - достоверное отличие от ожидаемого (расчетного) аддитивного эффекта комбинации пальмитоилэтаноламид и таурин (уровень значимости р<0,05) для каждого уровня доз.
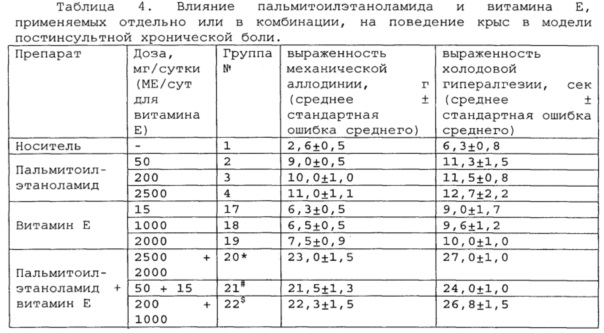
*, #, s - достоверное отличие от ожидаемого (расчетного) аддитивного эффекта комбинации пальмитоилэтаноламид и витамин Е (уровень значимости р<0,05) для каждого уровня доз.
В группах, получающих комбинацию пальмитоилэтаноламид и уридинмонофосфат, пальмитоилэтаноламид и таурин,
пальмитоилэтаноламид и витамин Е, показатели механической аллодинии и холодовой гипералгезии значительно снижены, что свидетельствует об эффективности их использования для постинсультной хронической боли. Но помимо этого также обнаружен синергический эффект действия данных комбинаций на всех тестируемых уровнях доз.
Пример 2. Модель болевого синдрома, вызванного перевязкой спинномозговых нервов.
Модель нейропатической боли спинного нерва (SNL) широко использовалась для различных исследовательских работ по механизмам нейропатической боли, а также для скрининговых тестов для разработки новых анальгетических препаратов. Эта модель была разработана путем плотного лигирования одного (L5) или двух (L5 и L6) сегментных спинальных нервов у крысы. Операция приводит к длительным поведенческим признакам механической аллодинии, тепловой гипералгезии, холодной аллодинии и постоянной боли [Jin Mo Chung et al. Segmental Spinal Nerve Ligation Model of Neuropathic Pain. Methods in Molecular Medicine, 99: 35-45, 2004].
В экспериментах использовались взрослые крысы линии Спрег-Доули, имеющие массу тела 250-300 граммов. Крысы содержались в терморегулируемых боксах (с температурой 21°С) с 12-часовым циклом дня и ночи и достаточным количеством воды и пищи.
Сто десять (110) крыс линии Спрег-Доули случайным образом распределяли на двадцать две (22) равных по составу группы (N=5), отличающихся типом вводимого препарата и дозировкой. Сформированные группы крыс кратко описаны в таблице 1.
Исследование проводилось для 4 препаратов
(пальмитоилэтаноламид, уридинмонофосфат, таурин, витамин Е), каждый из которых вводился в 3 разных дозах, и для 3 комбинаций (пальмитоилэтаноламид и уридинмонофосфат, пальмитоилэтаноламид и таурин, пальмитоилэтаноламид и витамин Е), каждая из которых также вводилась в трех дозах. Контролем служила группа крыс, получающих только носитель (группа плацебо). Информация по дозировкам приведена в таблице 1. Все препараты вводили перорально через 3 дня после операции и далее раз день в течение всего времени исследования. Все дозы приведены в пересчете на человека.
Животных анестезируют внутрибрюшинной инъекцией пентобарбитала натрия и обстригают волосы на спине. Каждое животное затем помещают на хирургическую платформу в положении лежа, а конечности фиксируются липкой лентой. В стерильных условиях длительный разрез (около 3 см в длину и 5 мм по бокам от средней линии) производится на нижнем поясничном и крестцовом уровнях (от хвостовой части позвонка L5 до первого крестцового позвонка). Локализация разреза определяется положением позвонка L5, который расположен на уровне рострального конца подвздошного гребня. Используя маленькие ножницы с тупыми кончиками, параспинальные мышцы выделяются и удаляются от уровня позвонка L5 до крестца.
Для оценки болевого поведения использовали тест с филаментами фон Фрея (возникновение механической аллодинии) на 15-й день после операции. Тестирование проводили, как описано в примере 1 выше за исключением того, что филаменты прикладывали только к ноге.
Для каждой группы исследования (n=5) рассчитывали среднюю оценку, полученную в соответствующем тесте, и стандартную ошибку среднего для каждого значения. Достоверность различий между группами оценивали с помощью парного t-критерия Стьюдента (при уровне значимости р<0,05).
Полученные результаты приведены в таблицах 5-7 ниже.

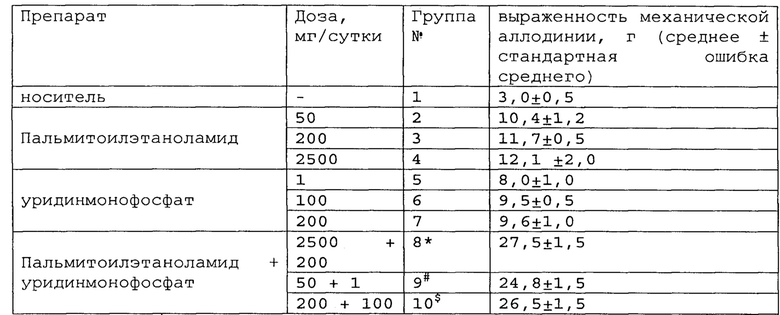
*, #, s - достоверное отличие от ожидаемого (расчетного) аддитивного эффекта комбинации пальмитоилэтаноламид и уридинмонофосфат (уровень значимости р<0,05) для каждого уровня доз.
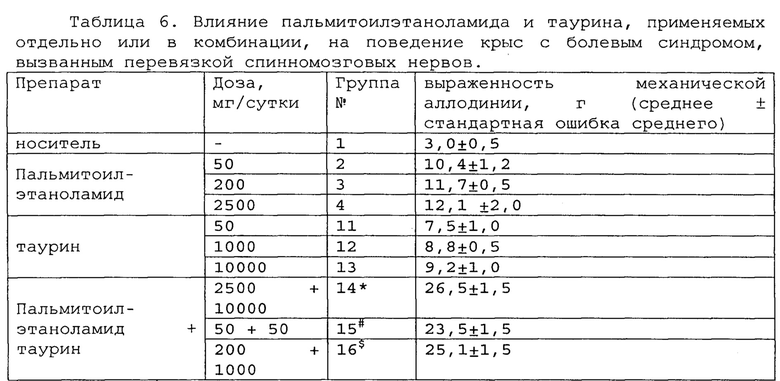
*, #, s - достоверное отличие от ожидаемого (расчетного) аддитивного эффекта комбинации пальмитоилэтаноламид и таурин (уровень значимости р<0,05) для каждого уровня доз.
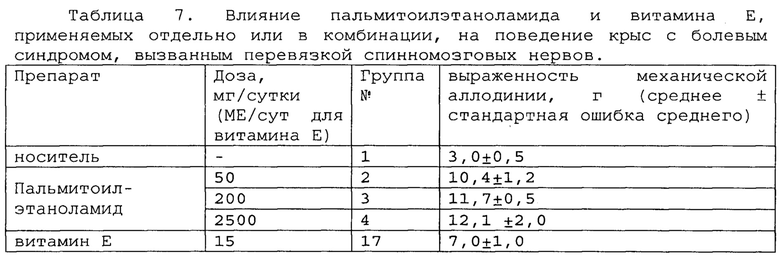
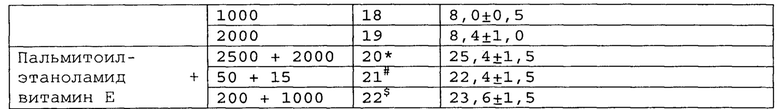
*, #, s - достоверное отличие от ожидаемого (расчетного) аддитивного эффекта комбинации пальмитоилэтаноламид и витамин Е (уровень значимости р<0,05) для каждого уровня доз.
В группах, получающих комбинацию пальмитоилэтаноламид и уридинмонофосфат, пальмитоилэтаноламид и таурин,
пальмитоилэтаноламид и витамин Е, показатели механической аллодинии значительно снижены, что свидетельствует об эффективности их применения для лечения болевого синдрома, вызванного перевязкой спинномозговых нервов. Кроме этого также обнаружен синергический эффект действия данных комбинаций на всех тестируемых уровнях доз.
Пример 3. Модель диабетического нейропатического болевого синдрома.
Диабетическая невропатия является распространенным осложнением диабета. Это происходит примерно у 10-20% пациентов с диабетом или примерно у 40-50% пациентов с диабетической невропатией [F. Gao, Z. М. Zheng. Animal Models of Diabetic Neuropathic Pain. Exp Clin Endocrinol Diabetes, 122: 100-106, 2014].
Стрептозоцин-индуцированная диабетическая крыса была выдвинута как модель хронической боли с признаками гипералгезии и аллодинии, которые могут отражать признаки, наблюдаемые у людей с диабетом [С. Courteix et al. Study of the sensitivity of the diabetes-induced pain model in rats to a range of analgesics, Pain, 57: 153-160, 1994].
В экспериментах использовались взрослые крысы линии Спрег-Доули, имеющие массу тела 250-300 граммов. Крысы содержались в терморегулируемых боксах (с температурой 21°С) с 12-часовым циклом дня и ночи и достаточным количеством воды и пищи.
Сто десять (110) крыс линии Спрег-Доули случайным образом распределяли на двадцать две (22) равных по составу группы (N=5), отличающихся типом вводимого препарата и дозировкой. Сформированные группы крыс кратко описаны в таблице 1.
Исследование проводилось для 4 препаратов
(пальмитоилэтаноламид, уридинмонофосфат, таурин, витамин Е), каждый из которых вводился в 3 разных дозах, и для 3 комбинаций (пальмитоилэтаноламид и уридинмонофосфат, пальмитоилэтаноламид и таурин, пальмитоилэтаноламид и витамин Е), каждая из которых также вводилась в трех дозах. Контролем служила группа крыс, получающих только носитель (группа плацебо). Информация по дозировкам приведена в таблице 1. Все дозы приведены в пересчете на человека.
Крысам была сделана диабетическая интраперитональная инъекция 75 мг/кг стрептозоцина (STZ) (Zanosar®, Upjohn), растворенного в дистиллированной воде. Через четыре недели диабет был подтвержден измерением уровней глюкозы в крови венозной вены с помощью Ames Dextrostix и колориметра отражательной способности (Ames Division, Miles Laboratories). Образцы крови были получены из хвоста, и в исследование были включены только крысы с окончательным уровнем глюкозы в крови более 14 мМ. Тесты проводились через 4 недели после индукции диабета.
Для оценки болевого поведения использовали тест с филаментами фон Фрея (возникновение механической аллодинии). Тестирование проводили, как описано в примере 1 выше за исключением того, что ноцицептивные пороги, выраженные в граммах, измеряли, применяя все большее давление к левой задней лапе до тех пор, пока не будет вызвана вокализация. Когда были получены два стабильных порога вокализации, вводили лекарство или плацебо. Пороги вокализации затем определялись в течение 2 ч. Отсечка составляла 7 50 г.
Для каждой группы исследования (n=5) рассчитывали среднюю оценку, полученную в соответствующем тесте, и стандартную ошибку среднего для каждого значения. Достоверность различий между группами оценивали с помощью парного t-критерия Стьюдента (при уровне значимости р<0,05).
Полученные результаты приведены в таблицах 8-10 ниже.
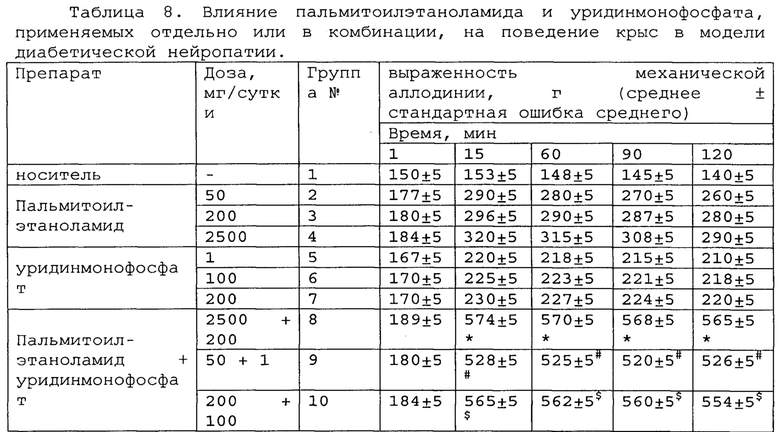
*, #, s - достоверное отличие от ожидаемого (расчетного) аддитивного эффекта комбинации пальмитоилэтаноламид и уридинмонофосфат (уровень значимости р<0,05) для каждого уровня доз в соответствующей временной точке.
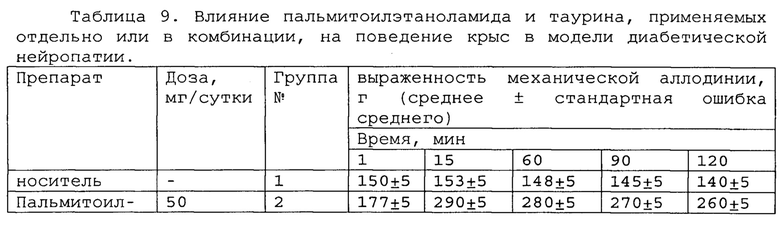
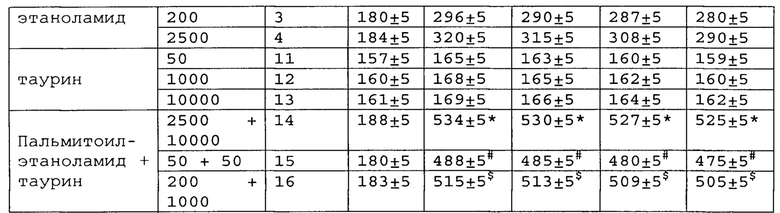
*, #, s - достоверное отличие от ожидаемого (расчетного) аддитивного эффекта комбинации пальмитоилэтаноламид и таурин (уровень значимости р<0,05) для каждого уровня доз в соответствующей временной точке.
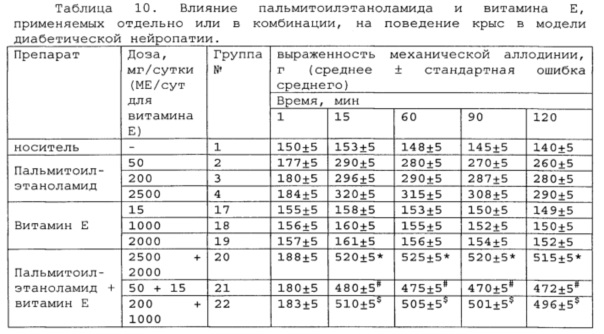
* # s - достоверное отличие от ожидаемого (расчетного) аддитивного эффекта комбинации пальмитоилэтаноламид и витамин Е (уровень значимости р<0,05) для каждого уровня доз в соответствующей временной точке.
В группах, получающих комбинацию пальмитоилэтаноламид и уридинмонофосфат, пальмитоилэтаноламид и таурин,
пальмитоилэтаноламид и витамин Е, показатели механической аллодинии значительно снижены, что свидетельствует об эффективности их применения для лечения диабетической нейропатии. Кроме этого также обнаружен статистический значимый синергический обезболивающий эффект действия данных комбинаций в период максимального действия на всех тестируемых уровнях доз.
Пример 4. Модель хронической висцеральной гиперчувствительности (хроническая боль в брюшной полости).
Во всех экспериментах используют 13-недельных самцов мышей линии С57 BL/6. Сто десять (110) мышей случайным образом распределяли на двадцать две (22) равных по составу группы (N=5), отличающихся типом вводимого препарата и дозировкой. Сформированные группы мышей аналогичны описанным в таблице 1. Колит индуцируют введением 0,1 мл TNBS (тринитробензолсульфонат) (130 мкг/мл в 30% EtOH) в толстую кишку через полиэтиленовый катетер, вставленный на 3 см в анус анестезированных изофлураном мышей. Затем мышей размещают индивидуально и ежедневно наблюдают за изменениями в массе тела, внешнем виде и поведении. Гистологическое исследование структуры слизистой оболочки, клеточного инфильтрата, абсцессов крипт кишечника и бокаловидных клеток подтвердило значительные повреждения, вызванные введением TNBS на 3-й день, в значительной степени на 7-й день. Высокопороговые ноцицепторы мышей на 28-день проявляли значительную механическую гиперчувствительность, более низкие пороги механической активации, гипералгезию и аллодинию [de Araujo AD et al. Selenoether oxytocin analogues have analgesic properties in a mouse model of chronic abdominal pain. Nature Communications, 2014, 5: 3165].
Для оценки болевого поведения использовали тест с филаментами фон Фрея (возникновение механической аллодинии) на 28-й день после введения TNBS. Тестирование проводили, как описано в примере 1 выше, за исключением того, что филаменты прикладывали к брюшной полости.
Для каждой группы исследования (n=5) рассчитывали среднюю оценку, полученную в соответствующем тесте, и стандартную ошибку среднего для каждого значения. Достоверность различий между группами оценивали с помощью парного t-критерия Стьюдента (при уровне значимости р<0,05).
Полученные результаты приведены в таблицах 11-13 ниже.
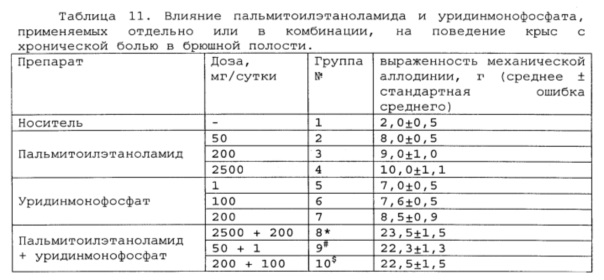
* # s - достоверное отличие от ожидаемого (расчетного) аддитивного эффекта комбинации пальмитоилэтаноламид и уридинмонофосфат (уровень значимости р<0,05) для каждого уровня доз.
Таблица 12. Влияние пальмитоилэтаноламида и таурина, применяемых отдельно или в комбинации, на поведение крыс с хронической болью в брюшной полости.
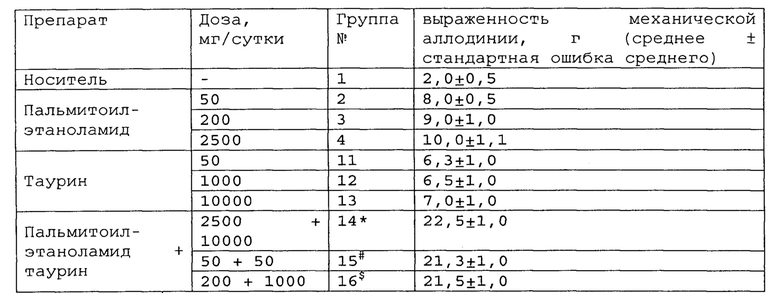
*, #, s - достоверное отличие от ожидаемого (расчетного) аддитивного эффекта комбинации пальмитоилэтаноламид и таурин (уровень значимости р<0,05) для каждого уровня доз.
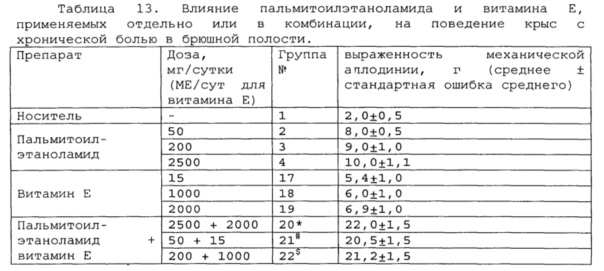
*, #, s - достоверное отличие от ожидаемого (расчетного) аддитивного эффекта комбинации пальмитоилэтаноламид и витамин Е (уровень значимости р<0,05) для каждого уровня доз.
В группах, получающих комбинацию пальмитоилэтаноламид и уридинмонофосфат, пальмитоилэтаноламид и таурин,
пальмитоилэтаноламид и витамин Е, показатели механической аллодинии значительно снижены, что свидетельствует об эффективности их применения для лечения хронической боли в брюшной полости. Кроме этого также обнаружен синергический эффект действия данных комбинаций на всех тестируемых уровнях доз.
Пример 5. Модель адъювантного артрита, вызванного введением адъюванта Фрейнда.
Сходство адъювантного артрита крыс с ревматоидным артритом человека заключается в наличии отека конечностей, деградации хрящей, лимфоцитарной инфильтрации воспаленной ткани суставов, утрате их функции, кроме того, отмечается резорбция кости и надкостницы. У животных также страдают позвоночник, желудочно-кишечный тракт, мочеполовые пути, кожа и глаза, что похоже на спондилоартропатии человека. Модель адъювантного артрита Т-клеточнозависима и комплементнезависима. Индукцию адъювантного артрита осуществляют внутрикожным или подкожным введением полного адъюванта Фрейнда (ПАФ). Адъювант Фрейнда (Freund adjuvant) [лат. adjuvans (adjuvantis) - помогающий, способствующий] - один из наиболее распространенных адъювантов, который содержит убитые туберкулезные микобактерии, суспензированные в масляной фазе водной эмульсии. Адъювант Фрейнда является мощным стимулятором неспецифических иммунных реакций.
Адъювант может быть введен в основание хвоста или в одну из подушечек лап, что позволяет изучить острую воспалительную реакцию в месте введения, а также иммунологическую реакцию, которая развивается примерно через 5-9 дней в контралатеральной лапе и различных органах.
Отек задней лапы контролируется с самого первого дня до 15 или более в зависимости от продолжительности эксперимента. На более поздних стадиях заболевания (12 день и далее) крысы с адъювантным артритом часто неподвижны из-за тяжести отека лапы и им требуется специальный уход, включая гарантированный доступ к воде и пище. При использовании модели с целью разработки профилактических мероприятий терапевтические препараты применяют с нулевого дня, а в случае необходимости отработки лечебной стратегии препараты назначают с восьмого дня создания модели [Громыко М.В., Грицук А.И. Экспериментальные модели ревматоидного артрита. Проблемы здоровья и экологии. №2 (32), 2012, с. 115-118].
Эксперимент проводят на 3-х месячных крысах-самцах линии Wistar массой 180-200 г, содержащихся в стандартных условиях вивария. Сто десять (110) крыс линии Wistar случайным образом распределяли на двадцать две (22) равных по составу группы (N=5), отличающихся типом вводимого препарата и дозировкой. Сформированные группы крыс кратко описаны в таблице 1.
Адъювантный артрит у крыс индуцируют субплантарным введением в заднюю лапу полного адъюванта Фрейнда (ПАФ). Отек сустава, по которому определяют тяжесть развития заболевания, после введения ПАФ измеряют при помощи штангенциркуля через сагиттальный диаметр в области заплюсневого сустава. Индекс отека сустава вычисляют по формуле: х = а/b, где х = индекс отека сустава, а = среднее значение диаметра сустава крыс с адъювантным артритом для группы, b = среднее значение диаметра сустава для группы до введения адъюванта. Для интактных животных индекс отека сустава был принят за 1.
Лечение начинают с 5-го дня после инъекции. Начиная с 2-х суток после индукции адъювантного артрита у животных наблюдали развитие прогрессирующего отека сустава, который достигал максимума на 15-20-е сутки (индекс 2.50±0.10). Для оценки болевого поведения использовали тест с филаментами фон Фрея (возникновение механической аллодинии) на протяжении 30 дней после введения ПАФ и развития адъювантного артрита. Тестирование проводили, как описано в примере 1 выше за исключением того, что филаменты прикладывали к поврежденному суставу задней лапы, в которую вводился ПАФ.
Для каждой группы исследования (n=5) рассчитывали среднюю оценку, полученную в соответствующем тесте, и стандартную ошибку среднего для каждого значения. Достоверность различий между группами оценивали с помощью парного t-критерия Стьюдента (при уровне значимости р<0,05).
Полученные результаты приведены в таблицах 14-16 ниже.
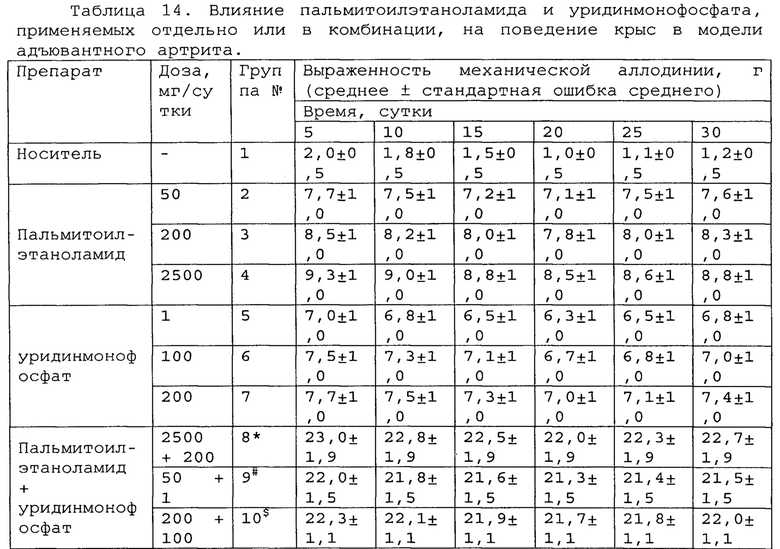
*, #, s - достоверное отличие от ожидаемого (расчетного) аддитивного эффекта комбинации пальмитоилэтаноламид и уридинмонофосфат (уровень значимости р<0,05) для каждого уровня доз в соответствующей временной точке.
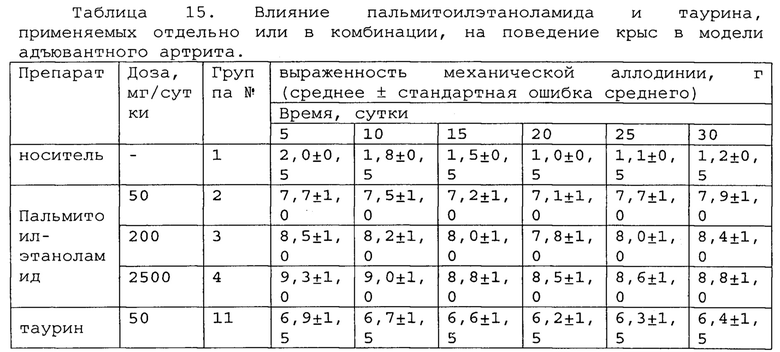
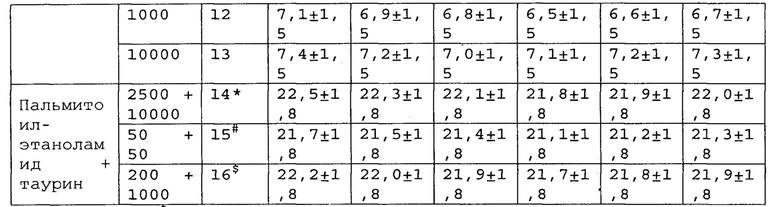
*, #, s - достоверное отличие от ожидаемого (расчетного) аддитивного эффекта комбинации пальмитоилэтаноламид и таурин (уровень значимости р<0,05) для каждого уровня доз в соответствующей временной точке.
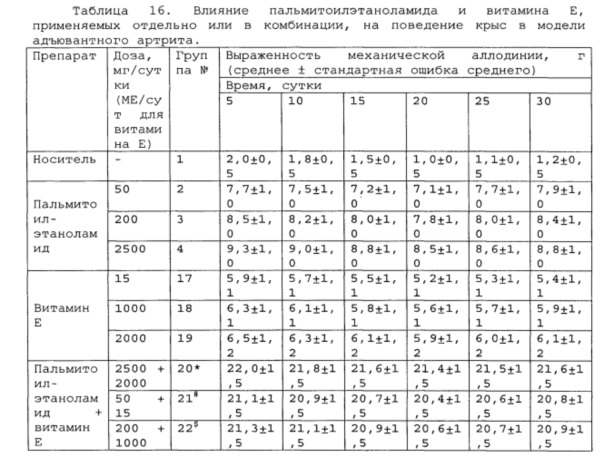
*, #, s - достоверное отличие от ожидаемого (расчетного) аддитивного эффекта комбинации пальмитоилэтаноламид и витамин Е (уровень значимости р<0,05) для каждого уровня доз в соответствующей временной точке.
В группах, получающих комбинацию пальмитоилэтаноламид и уридинмонофосфат, пальмитоилэтаноламид и таурин, пальмитоилэтаноламид и витамин Е, показатели механической аллодинии значительно снижены, что свидетельствует об эффективности их применения для лечения болевых синдромов при адъювантном или ревматоидном артрите. Кроме этого также обнаружен статистический значимый синергический обезболивающий эффект действия данных комбинаций в период максимального действия на всех тестируемых уровнях доз.
Пример 6. Получение композиции в форме таблеток.
Для получения микронизированной формы пальмитоилэтаноламида используют стандартные методики механического или ультразвукового диспергирования [Ультразвук. Маленькая энциклопедия. Главн. редак. И.П. Голямина. Изд. «Советская энциклопедия», Москва, 1989, 399 стр.]
Смешивают 1600 мг крахмала, 1600 мг измельченной лактозы, 400 мг талька, 1000 мг пальмитоилэтаноламида и 1000 мг уридинмонофосфата и спрессовывают в брусок.
Смешивают 1600 мг крахмала, 1600 мг измельченной лактозы, 400 мг талька, 1000 мг пальмитоилэтаноламида и 4000 мг таурина и спрессовывают в брусок.
Смешивают 1600 мг крахмала, 1600 мг измельченной лактозы, 400 мг талька, 1000 мг пальмитоилэтаноламида и 500 мг витамина Е и спрессовывают в брусок.
Полученные бруски измельчают в гранулы и просеивают через сита, собирая гранулы размером 14-16 меш. Полученные гранулы таблетируют в подходящую форму таблетки весом 500 мг каждая.
Пример 7. Получение композиции в форме капсул.
Тщательно смешивают пальмитоилэтаноламид и уридинмонофосфат в соотношении 1:1.
Тщательно смешивают пальмитоилэтаноламид и таурин в соотношении 1:4.
Тщательно смешивают пальмитоилэтаноламид и витамин Е в соотношении 2:1.
Полученные комбинации смешивают с порошком лактозы в соотношении 2:1. Полученную порошкообразную смесь упаковывают по 300 мг в желатиновые капсулы подходящего размера.
Пример 8. Получение композиции в форме инъекционных композиций для внутримышечных, внутрибрюшинных или подкожных инъекций.
Смешивают 1000 мг пальмитоилэтаноламида и 1000 мг уридинмонофосфата с 600 мг хлорбутанола, 4 мл пропиленгликоля и 200 мл инъекционной воды. Полученный раствор фильтруют и помещают по 1 мл в ампулы, которые запаивают.
Смешивают 1000 мг пальмитоилэтаноламида и 4000 мг таурина с 600 мг хлорбутанола, 4 мл пропиленгликоля и 200 мл инъекционной воды. Полученный раствор фильтруют и помещают по 1 мл в ампулы, которые запаивают.
Смешивают 1000 мг пальмитоилэтаноламида и 500 мг витамина Е с 600 мг хлорбутанола, 4 мл пропиленгликоля и 200 мл инъекционной воды. Полученный раствор фильтруют и помещают по 1 мл в ампулы, которые запаивают.
Изобретение может быть использовано в медицине, фармакологии, а также для получения функционально-активных биологически активных добавок к пище.
| название | год | авторы | номер документа |
|---|---|---|---|
| Комбинации флупиртина и циклобензаприна для лечения болевых синдромов | 2017 |
|
RU2680244C1 |
| КОМБИНАЦИЯ ДЛЯ ПРОФИЛАКТИКИ, КОРРЕКЦИИ И ТЕРАПИИ БОЛИ, СВЯЗАННОЙ С НЕЙРОДЕГЕНЕРАЦИЕЙ ИЛИ АССОЦИИРОВАННОЙ С СОМАТОФОРМНЫМИ РАССТРОЙСТВАМИ | 2013 |
|
RU2506077C1 |
| СОКРИСТАЛЛЫ ТРАМАДОЛА И КОКСИБОВ | 2010 |
|
RU2547830C2 |
| АНАЛЬГЕЗИРУЮЩИЕ КОМПОЗИЦИИ | 2019 |
|
RU2820449C2 |
| КОМПОЗИЦИИ, ВКЛЮЧАЮЩИЕ ТРАМАДОЛ И ЦЕЛЕКОКСИБ, ДЛЯ ЛЕЧЕНИЯ БОЛИ | 2010 |
|
RU2707752C2 |
| НОВЫЕ ТЕРАПЕВТИЧЕСКИЕ КОМБИНАЦИИ МИРТАЗАПИНА ДЛЯ ПРИМЕНЕНИЯ ПРИ БОЛЕВЫХ РАССТРОЙСТВАХ | 2013 |
|
RU2509560C1 |
| КОМБИНАЦИЯ МИРТАЗАПИНА И ТИЗАНИДИНА ДЛЯ ПРИМЕНЕНИЯ ПРИ БОЛЕВЫХ РАССТРОЙСТВАХ | 2019 |
|
RU2736713C1 |
| ПРИМЕНЕНИЕ ПРЕГНАНДИОНОВ ИЛИ ПРЕГНАНДИОЛОВ В КАЧЕСТВЕ НЕВРОПАТИЧЕСКИХ АНАЛЬГЕТИЧЕСКИХ АГЕНТОВ | 2002 |
|
RU2346690C2 |
| ПРИМЕНЕНИЕ РЕТИГАБИНА ДЛЯ НЕВРОПАТИЧЕСКИХ БОЛЕЙ | 2000 |
|
RU2264813C2 |
| Способ лечения нейропатической боли | 2021 |
|
RU2780139C1 |
Изобретение относится к области медицины, фармакологии, а именно к комбинации для лечения хронической боли. Для этого комбинация содержит в эффективных количествах пальмитоилэтаноламид, отличающаяся тем, что упомянутая комбинация включает также по меньшей мере одно вещество, выбранное из группы, включающей уридинмонофосфат, таурин, витамин Е, или их фармацевтически приемлемые соли, где действующие вещества в составе упомянутой комбинации содержатся в следующих количествах: пальмитоилэтаноламид 50-2500 мг; уридинмонофосфат 1-200 мг; таурин 50-10000 мг; витамин Е 15-2000 МЕ. Изобретение также относится к фармацевтической композиции для лечения хронической боли, которая содержит в эффективных количествах комбинацию по любому из пп. 1-4 и по меньшей мере одно вспомогательное вещество и/или по меньшей мере один фармацевтически приемлемый носитель, где действующие вещества в составе упомянутой композиции входят в массовых соотношениях: пальмитоилэтаноламид:уридинмонофосфат от 1:4 до 2500:1; пальмитоилэтаноламид:таурин от 1:200 до 50:1; пальмитоилэтаноламид:витамин Е от 1:36,4 до 248,7:1. Изобретение относится к набору для лечения хронической боли, содержащему фармацевтическую композицию по п.5 и инструкцию по применению, где действующие вещества в составе фармацевтической композиции содержатся в следующих количествах: пальмитоилэтаноламид 50-2500 мг; уридинмонофосфат 1-200 мг; таурин 50-10000 мг; витамин Е 15-2000 МЕ. Изобретение обеспечивает повышение эффективности лечения хронической боли за счет синергетического эффекта действующих веществ и, как следствие снижение требующихся доз активных веществ, уменьшение побочных эффектов и повышение безопасности лечения, а также расширение арсенала средств для лечения хронической боли. 3 н. и 6 з.п. ф-лы, 16 табл., 8 пр.
1. Комбинация для лечения хронической боли, содержащая в эффективных количествах пальмитоилэтаноламид, отличающаяся тем, что упомянутая комбинация включает также по меньшей мере одно вещество, выбранное из группы, включающей уридинмонофосфат, таурин, витамин Е, или их фармацевтически приемлемые соли, где действующие вещества в составе упомянутой комбинации содержатся в следующих количествах:
2. Комбинация по п. 1, отличающаяся тем, что упомянутая комбинация представляет собой таблетки для приема внутрь или сублингвальное саше.
3. Комбинация по п. 1, отличающаяся тем, что пальмитоилэтаноламид в упомянутой комбинации находится в микронизированном или ультрамикронизированном виде.
4. Комбинация по п. 1, отличающаяся тем, что упомянутая комбинация дополнительно включает вещество, выбранное из группы, включающей карнитин, витамины группы В, ресвератрол, куркумин, бенфотиамин, линолевая, линоленовая кислоты, липоевая кислота.
5. Фармацевтическая композиция для лечения хронической боли, отличающаяся тем, что упомянутая композиция содержит в эффективных количествах комбинацию по любому из пп. 1-4 и по меньшей мере одно вспомогательное вещество и/или по меньшей мере один фармацевтически приемлемый носитель, где действующие вещества в составе упомянутой композиции входят в массовых соотношениях:
6. Композиция по п.5, отличающаяся тем, что упомянутая композиция представляет собой таблетки для приема внутрь или сублингвальное саше.
7. Композиция по п.5, отличающаяся тем, что пальмитоилэтаноламид в упомянутой композиции находится в микронизированном или ультрамикронизированном виде.
8. Композиция по п.5, отличающаяся тем, что упомянутая композиция дополнительно включает вещество, выбранное из группы, включающей карнитин, витамины группы В, ресвератрол, куркумин, бенфотиамин, линолевая, линоленовая кислоты, липоевая кислота.
9. Набор для лечения хронической боли, содержащий фармацевтическую композицию по п.5 и инструкцию по применению, где действующие вещества в составе фармацевтической композиции содержатся в следующих количествах:
| GATTI A | |||
| et al | |||
| Palmitoylethanolamide in the treatment of chronic pain caused by different etiopathogenesis //Pain medicine | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| - Т | |||
| Насос | 1917 |
|
SU13A1 |
| - No | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| - С | |||
| ЗАТВОР ДЛЯ КИНЕМАТОГРАФИЧЕСКОГО АППАРАТА | 1923 |
|
SU1121A1 |
| NEGRAO L | |||
| et al | |||
| Uridine monophosphate, folic acid and vitamin B12 in patients with symptomatic peripheral entrapment neuropathies //Pain management | |||
| Токарный резец | 1924 |
|
SU2016A1 |
| - Т | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| - No | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| - С | |||
| Видоизменение пишущей машины для тюркско-арабского шрифта | 1923 |
|
SU25A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| CREMON C | |||
| et al | |||
| Randomised clinical trial: the analgesic properties of dietary supplementation with palmitoylethanolamide and polydatin in irritable bowel syndrome //Alimentary pharmacology & therapeutics | |||
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
| - Т | |||
| Железобетонный фасонный камень для кладки стен | 1920 |
|
SU45A1 |
| - No | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| - С | |||
| Многоцилиндровый объемный водомер двойного действия с вращающимися цилиндрами | 1923 |
|
SU909A1 |
Авторы
Даты
2019-10-01—Публикация
2018-04-12—Подача