Вирусы гриппа типа В (Influenza В virus family Orthomyxoviridae) впервые были выделены в 1940 году. До недавнего времени они значительно уступали вирусам гриппа типа А по уровню вирулентности, контагиозности и эпидемической значимости. Такое поведение вирусов гриппа В отмечалось до 1983 года, пока в результате не вполне раскрытых событий не наметился дивергентный характер эволюции возбудителя. С этого времени в циркуляции регистрировались две резко отличающееся в антигеном отношении разновидности вирусов гриппа типа В: В/Виктория/2/87 и В/Ямагата/16/88 (Rota, 1989). При этом активность вирусов гриппа В резко усилилась, эпидемии среди населения России стали отмечаться значительно чаще (через 1-2 года), а с 1993 года - практически ежегодно (Слепушкин, 1998). Кроме того, в пределах линий, родоначальниками которых являются вышеуказанные эталоны вирусов гриппа В, происходит постоянный антигенный дрейф гемагглютинина. В настоящее время в мире имеют эпидемическую значимость два варианта вируса гриппа типа В: В/Брисбен/60/08 Викторианской линии и В/Флорида/04/О6 Ямагатской разновидности (Waicharoen S., 2008., Jian J-W., 2008). Это определяет необходимость четкой и быстрой идентификации вирусов гриппа В с определением их принадлежности к той или оной эволюционным линиям, что необходимо для своевременного изменения штаммового состава вакцин и диагностических препаратов.
В настоящее время для диагностики вируса гриппа В используются вирусологические, серологические, электронно-микроскопические методы и ПЦР-анализ.
Приоритетными направлениями в области создания диагностических препаратов для выявления возбудителей инфекционных заболеваний являются:
- Создание современных высокоспецифичных тест-систем, базирующихся на использовании моноклональных антител и достижениях иммунохимии
- Создание молекулярно-биологических тест-систем (real-time PCR, биочипы и др.)
Одним из наиболее перспективных путей совершенствования иммуно-ферментного анализа (ИФА) и иммунофлуоресцентного анализа (ИФЛ) является включение в их состав препаратов моноклональных антител (МКА) заданной направленности, синтезируемых гибридомами, которые получают путем соматической гибридизации клеток миеломных опухолей и В-лимфоцитов, продуцирующих антитела после иммунизации животных соответствующими антигенами. МКА позволяют существенно повысить специфичность и достигнуть высокой стандартизации анализов, а также существенно упростить технологию производства тест-систем.
Аналогичный предлагаемому набор штаммов гибридом в патентной и доступной литературе не описан. За рубежом опубликованы работы по созданию гибридом, в том числе и в патентной литературе, продуцирующих антитела к нуклеопротеину вируса гриппа типа В, однако они не позволяют проводить дифференциацию изолятов, принадлежащих к разным эволюционным ветвям, поскольку синтезируют антитела, направленные к консервативным детерминантам, присутствующим в составе вирусов обеих разновидностей (Glikmann et al, 1995). Известные зарубежные и отечественные МКА к гемагглютинину вирусов гриппа В направлены к антигенным детерминантам реликтовых штаммов (B/Singapore/222/79) и, следовательно, они не пригодны для идентификации современных одновременно циркулирующих штаммов вирусов гриппа В (Буссе и др, 1987). Описанные МКА не позволяют проводить дифференциацию вирусов Ямагатской и Викторианской ветвей, что имеет высокую значимость не только для диагностики, но и для понимания закономерностей естественной эволюции и распространения возбудителя в популяции людей.
Известны используемые в диагностике и изучении эволюции вирусов гриппа В поликлональные сыворотки к вновь выделяемым вирусам гриппа В, полученные в результате иммунизации кроликов, баранов, крыс или хорьков соответствующими штаммами вирусов В. Недостатками прототипа являются:
- необходимость получения гипериммунных сывороток, что требует определенного времени и не позволяет осуществлять незамедлительную идентификацию выделенных вирусов, что чрезвычайно важно для оперативного анализа эпидемиологической ситуации и надзора за гриппом (табл.1);
- поликлональные иммуноглобулины отличаются гетерогенность состава сывороточных антител, что таит в себе опасность перекрестной неспецифической реактивности с хозяйскими и гетерологическими вирусными антигенами при их использовании в составе иммунологических тестов (Малоголовкин, 1998);
- специфичность и репертуар иммунного ответа при получении поликлональных сывороток зависит от вида животного, схем иммунизации и варьирует в зависимости от серии препарата;
- получаемые в результате иммунизации животных препараты антител трудно поддаются стандартизации в силу отличий составляющих популяцию антител по аффинитету и эпитопной направленности (Игнатьева, 1989);
- характерной особенностью современных вирусов гриппа является их чрезвычайно высокая чувствительность к неспецифическим ингибиторам сывороток нормальных животных, что создает определенные трудности при первичной идентификации изолятов и искажает результаты анализа (Грипп и другие респираторные вирусные инфекции, 2003).
Кроме того, поликлональные иммуноглобулины не способны дифференцировать вирусы, принадлежащие к одной из эволюционных ветвей от другой (Lupulescu Е., 1996). Использование высокотитражных диагностических сывороток из наборов ВОЗ также не позволяет проводить дифференциацию вирусов Викторианской и Ямагатской линий друг от друга, что чрезвычайно важно для правильного выбора вирусов в состав гриппозной вакцины на предстоящий эпидсезон (табл.2, 3).
Все вышеперечисленные недостатки отсутствуют в предполагаемом изобретении. Отличительными характеристиками и преимуществами МКА по сравнению с поликлональными являются:
1. МКА обеспечивают высокую стандартизацию анализов, в которых они используются, так как имеют фиксированные молекулярные, биохимические и биологические свойства:
- высокая степень гомогенности по изотипам антител: характеризуются только одним классом (субклассом) и одним аллотипом тяжелых цепей, одним типом и аллотипом легких цепей, определенным идиотипом (Фукс, 1982).
- МКА обладают иммунологической однородностью по эпитопной направленности.
2. МКА позволяют обеспечить высокую специфичность, чувствительность и воспроизводимость приемов иммунологического анализа.
3. Гибридомы с установившимися характеристиками позволяют получать неограниченные количества антител с заданной желательной аффинностью - высокой для иммуносорбентных методов и низкой для аффинной хроматографии и иммунохимии (Spira 1985).
4. МКА направлены только к одному эпитопу (детерминанте) антигенной молекулы и способны распознавать одиночные аминокислотные замены в составе отдельных вирусных детерминант, тем самым могут служить эффективным инструментом раскрытия и изучения механизмов эволюции и дифференциации белковых молекул в составе вирусов (Манько 1990, Дробышевская 1980).
5. Возможность замораживания гибридомной культуры и реклонирования ее с получением МКА в определенные сроки (при необходимости заранее), доступность в относительно больших количествах при сравнительно низкой себестоимости (Englenberg 1984, Spira 1985).
6. Возможность создания иммунотерапевтических препаратов направленного действия с использованием МКА.
7. Методический прием получения escape-мутантов в присутствии МКА, обладающих вируснейтрализующей активностью, с последующим анализом первичной структуры генома и идентификацией аминокислотных замен позволяет распознавать сайты, ответственные за индукцию вируснейтрализующих антител, что существенно важно для направленного дизайна современных генно-инженерных вакцин, а также понимания структурной композиции вируса, путей и направленности его естественной эволюции и ее моделирования в условиях in vitro (Nakagava 2005, 2006).
Краткое описание изобретения
Описан набор гибридом, включающий:
1. гибридому В/4Н1, продуцирующую МКА к антигенной детерминанте в составе гемагглютинина вирусов гриппа В Викторианской ветви, не реагирующие с вирусами Ямагатской ветви, но активно выявляющие в РТГА и ИФА все изученные штаммы Викторианской линии (схема 1).
2. гибридому 4Н7, продуцирующую МКА к антигенной детерминанте в составе гемагглютинина вирусов гриппа В Ямагатской ветви, не реагирующие с вирусами Викторианской ветви, но активно выявляющие в РТГА и ИФА все изученные штаммы Ямагатской линии (схема 2).
Способ настоящего изобретения позволяет повышать чувствительность и специфичность иммунологических тест-сисем для диагностики и дифференцировки по эволюционной принадлежности вирусов гриппа В за счет включения в их состав предлагаемых МКА. Кроме того, выраженная вируснейтрализующая активность МКА к гемагглютинину вирусов гриппа В Ямагатской и Викторианской разновидностей открывает перспективы их использования для изучения антигенной структуры и эволюционной изменчивости данного гликопротеина.
Настоящее изобретение относится к способу проведения в биологических материалах от больных детекции антигенов вирусов гриппа B в зависимости от их принадлежности к различным современным эволюционным линиям (Ямагатской или Викторианской), а также сайтов, специфичных для каждой из ветвей.
Описан способ получения панели разнонаправленных МКА к вирусам гриппа В при помощи гибридомной технологии, предусматривающей выбор и накопление актуальных для поставленных задач вирусных антигенов, проведение иммунизации мышей-доноров селезеночных клеток, постановки гибридизации иммуноцитов с мышиной миеломой, отбором положительных культур в методе ИФА с последующим их клонированием, накоплением клеточной массы специфичных гибридом для получения асцитических препаратов МКА на чувствительной линии мышей.
Краткое описание графического материала
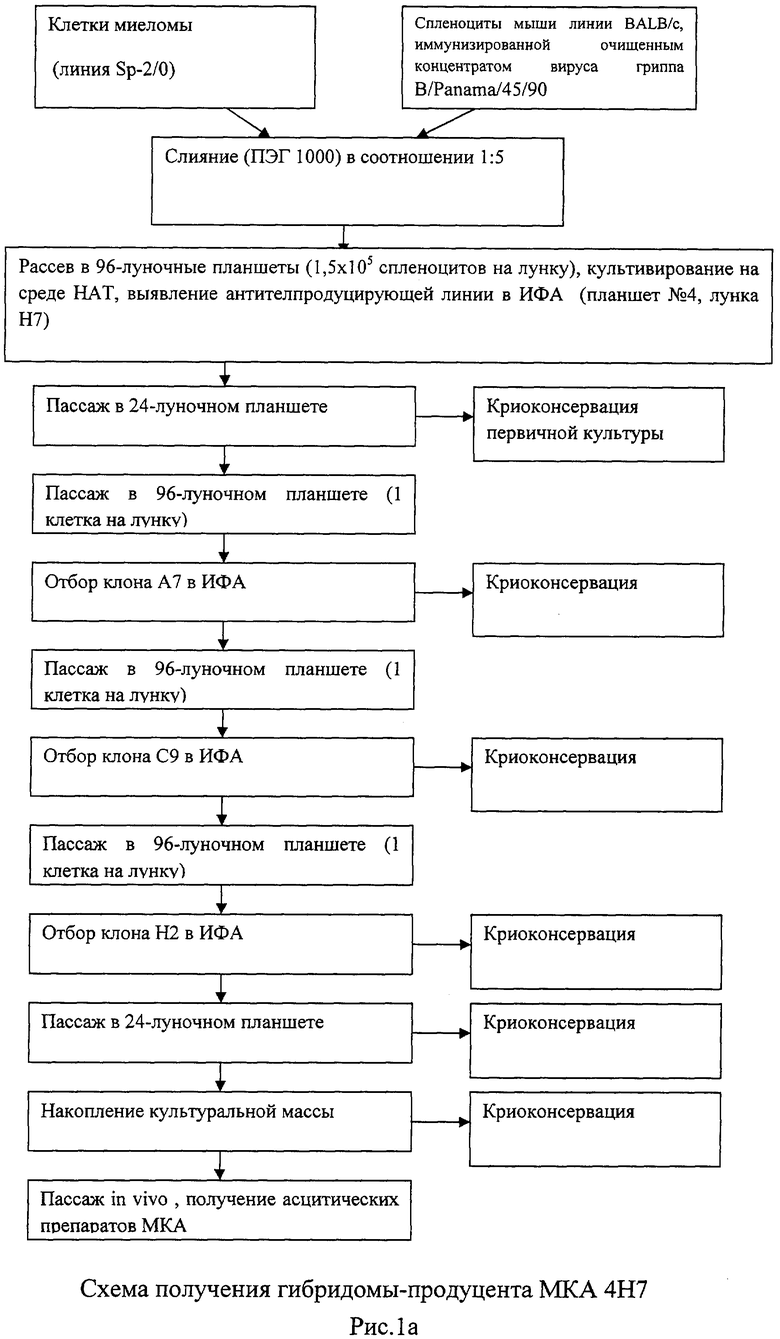
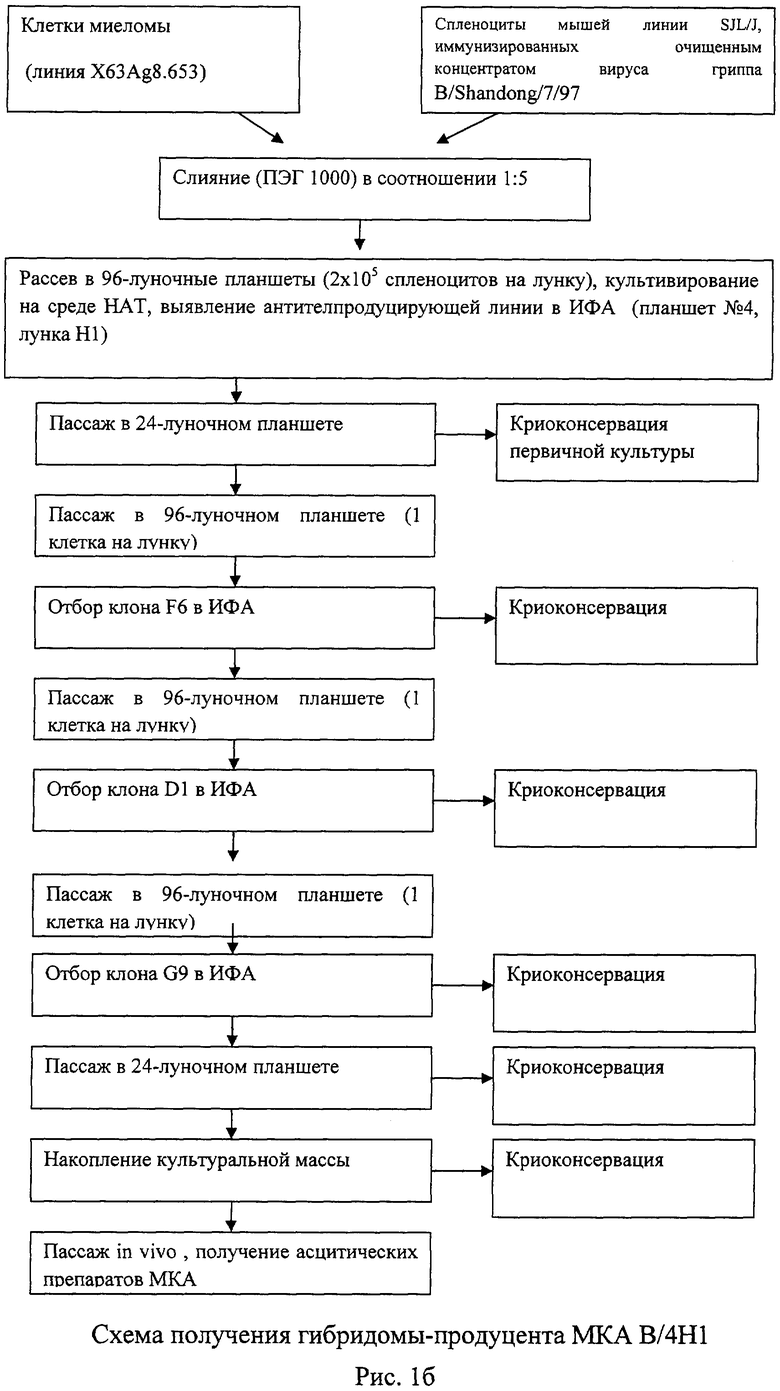
Рисунок 1. Схемы получения гибридом и продуцированных ими МКА.
Культуру мышиной миеломы сливали со спленоцитами иммунных мышей в суспензии с помощью 50% ПЭГ. Затем клетки переносили в селективную HAT-среду и распределяли по ячейкам 96-луночных планшетов. Основным приемом тестирования был твердофазный ИФА. Позитивные культуры клонировали 2-4 раза методом лимитирующих разведении. Гомогенные гибридомные штаммы наращивали в культуре, собирали надосадочную жидкость для изучения свойств МКА, часть клеточной популяции замораживали, а часть прививали сингенным мышам для получения МКА-содержащей асцитической жидкости.
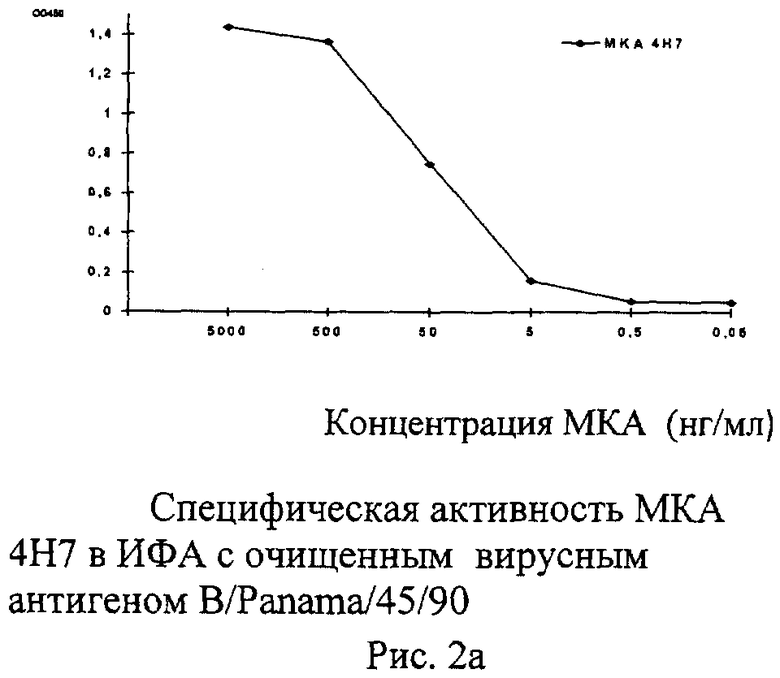
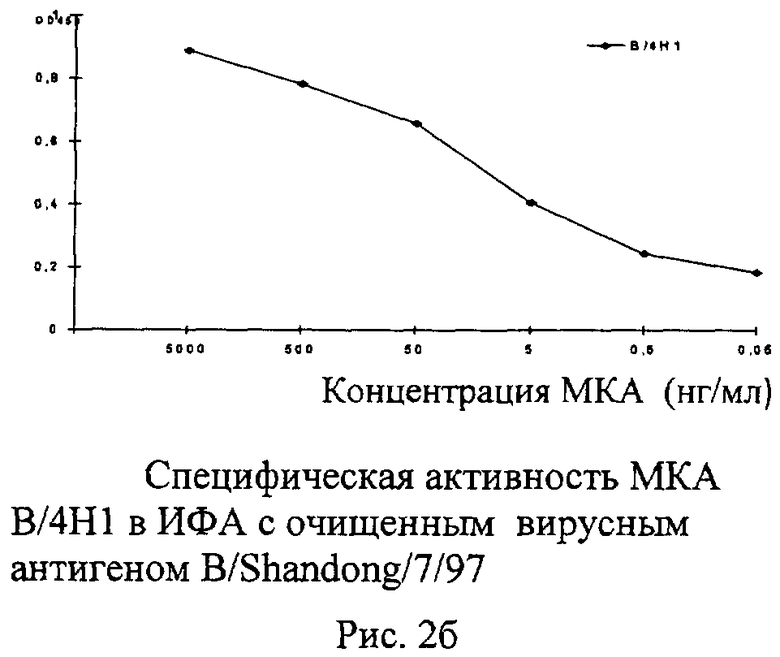
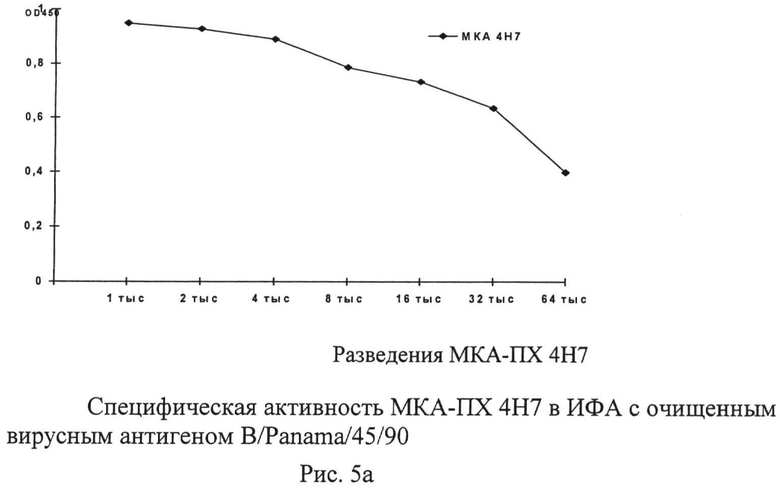
Рисунок 2. Представляет собой серию графиков, иллюстрирующих концентрации исследуемых МКА, до которых они специфично взаимодействуют в ИФА с очищенным концентратом гомологичного вируса. Вирусные концентраты наносились на подложку в концентрации 2 мкг/мл. Результат учитывали по изменению оптической плотности при длине волны 450 нм.
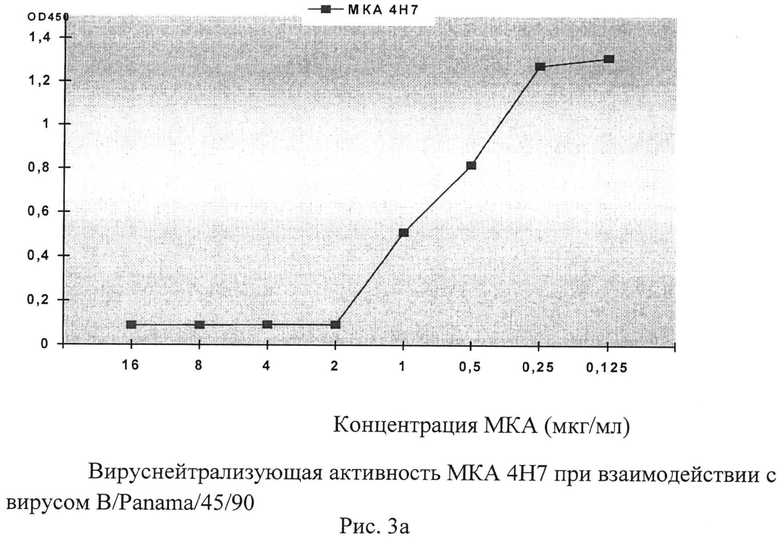
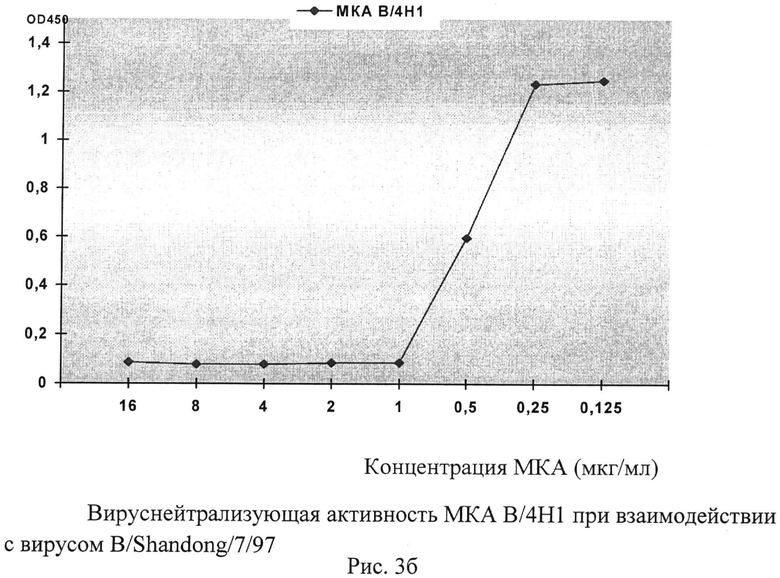
Рисунок 3. Исследование вируснейтрализующей активности МКА применительно к гомологичным вирусам гриппа В было проведено в условиях микропланшетного культивирования. Учет результатов нейтрализации МКА репродукции вируса (доза заражения - 100 ТЦД50) был выполнен с использованием микропланшетного ИФА с окраской клеточного монослоя пероксидазным конъюгатом МКА 1/22, направленного к высококонсервативному эпитопу в составе нуклеопротеина вируса гриппа В.
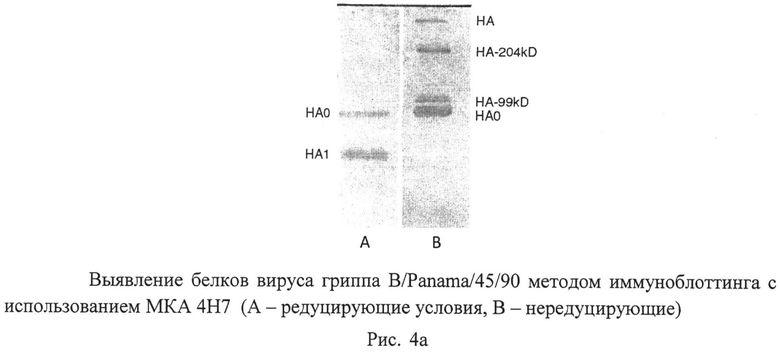
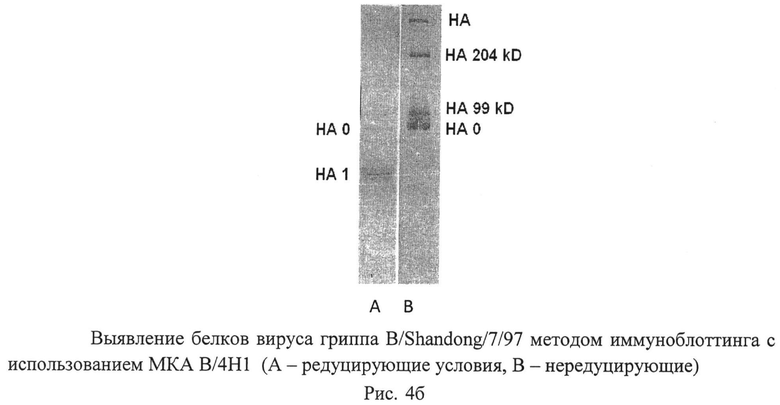
Рисунок 4. Специфическое связывание МКА с вирусными протеинами в Вестерн-блот-анализе. Дорожка А иллюстрирует связывание МКА с белком гомологичного антигена в редуцирующих условиях, дорожка В - в нередуцирующих условиях.
Рисунок 5. Графики показывают предельные разведения пероксидазных конъюгатов МКА, которые выявляют в ИФА гомологичный антиген, сорбированный на твердой фазе в концентрации 2 мкг/мл.
Подробное описание изобретения
В современном мире, включая Россию, социркулируют две эволюционно различные линии вируса гриппа В - Викторианская и Ямагатская. Настоящее изобретение относится к способу, позволяющему осуществлять идентификацию гетерогенных по антигенным свойствам вирусов гриппа В с последующим определением их принадлежности к одной из эволюционных ветвей.
Настоящее изобретение относится к новому набору гибридом, продуцирующих МКА, направленные к консервативной и изменчивым антигенным детерминантам в составе вирусов гриппа В. Данные МКА пригодны для приготовления иммунодиагностических препаратов.
Гибридома В/4Н1 продуцирует МКА к антигенной детерминанте в составе гемагглютинина вирусов гриппа В Викторианской ветви, которые позволяют идентифицировать исключительно штаммы данной эволюционной линии. Гибридома 4Н7 продуцирует МКА к антигенной детерминанте в составе гемагглютинина вирусов гриппа В Ямагатской ветви, пригодные для выявления изолятов только данной разновидности.
До настоящего времени в отечественной и зарубежной литературе не описана аналогичная панель гибридом, продуцирующих МКА с вышеуказанными диагностическими возможностями. МКА настоящего изобретения прекрасно зарекомендовали себя в диагностической практике. МКА, специфичные для каждой из эволюционных ветвей вируса гриппа В, продуцируемые гибридомами 4Н7 и В/4Н1, позволяют конструировать иммуноферментные и иммунофлюоресцентные тесты для выявления возбудителей, относящихся к различным эволюционным линиям.
Гибридомы, продуцирующие МКА к различным антигенным детерминантам вируса гриппа В, могут быть получены путем иммунизации мыши очищенными концентратами различных штаммов вируса, с последующим слиянием клеток селезенки, взятых у иммунной мыши, с клетками мышиной миеломы.
Получение гибридомы и продуцируемого ею МКА включает, например, следующие стадии:
1. очистка и концентрация вируса для использования в качестве иммунизирующего антигена;
2. получение антитело-продуцирующих клеток в результате инфицирования мыши соответствующим антигеном под контролем в ИФА титра специфических сывороточных антител;
3. накопление клеток мышиной миеломы;
4. слияние антитело-продуцирующих клеток с миеломными в присутствии ПЭГ;
5. селекция в ИФА гибридом заданной специфичности, обладающих хорошим ростом, с использованием широкой панели антигенов;
6. клонирование отобранных гибридом методом предельных разведении в микропланшетах на среде HAT;
7. отбор в ИФА хорошо растущих клонов из лунок, где содержатся специфические антитела в высоких титрах;
8. реклонирование гибридомы с последующим накоплением клеточной массы;
9. культивирование гибридных клеток на мышах с целью получения асцитических препаратов МКА;
10. тестирование полученного МКА на биологическую активность и специфичность, изучение его параметров в различных иммунологических и биохимических реакциях;
11. криоконсервация гибридомы
Общая процедура получения гибридом 4Н7 и В/4Н1 более подробно описана ниже в соответствии с каждой из вышеуказанных стадий. Этот метод получения гибридом настоящего изобретения приводится лишь для иллюстрации способов получения гибридомы и не является ограничивающим. При этом могут быть использованы и другие известные процедуры или нижеследующий модифицированный метод.
1. Получение антигена
Очищенные концентраты вирусов гриппа В (B/Shandong/7/97 Викторианской линии, B/Panama/45/90 Ямагатской линии), использованные в качестве антигенов при иммунизации мышей-доноров селезеночных клеток получали в несколько стадий по методу дифференциального ультрацентрифугирования вируссодержащей аллантоисной жидкости. Специфичность полученных вирусных концентратов до начала этапа иммунизации была подтверждена в реакции торможения гемагглютинации с референс-сыворотками.
2. Получение антитело-продуцирующих клеток
Мышь иммунизировали иммуногеном, продуцированном в стадии 1 и смешанным с адъювантом, таким как полный или неполный адъювант Фрейнда или квасцы. Другими подходящими экспериментальными животными являются, например, крысы, морские свинки, кролики, собаки, куры, лошади, свиньи, коровы и овцы.
Подходящими способами введения иммуногена для иммунизации экспериментального животного являются подкожная, внутрибрюшинная, внутривенная и внутримышечная инъекции, при этом предпочтительной являются подкожная и внутрибрюшинная иммунизации. Иммунизация может быть проведена путем введения разовой дозы или нескольких многократных доз через соответствующие интервалы времени (предпочтительно 1-3 недели).
Затем проводится мониторинг иммунизированных животных на титр специфических антител в сыворотках и животное с достаточно высоким титром антител отбирают в качестве источника антитело-продуцирующих клеток. Отбор животного с высоким титром антител делает последующий процесс более эффективным. Клетки для последующего слияния собирают от животного через 3-4 дня после последней иммунизации.
Методы анализа на титр специфических антител представляют собой хорошо известную технику, такую как радиоиммуноанализ, твердофазный иммуноферментный анализ (далее обозначаемый ELISA), флуоресцентный анализ, реакцию торможения гемагглютинации, при этом предпочтительным является ELISA, благодаря его чувствительности, быстроте, точности и возможности автоматизации.
Определение титра антител может быть осуществлено, например, с помощью ELISA следующим образом. Сначала очищенный концентрат гомологичного вируса гриппа В адсорбируют на твердой поверхности, такой как 96-луночный планшет для ELISA, а затем остальную поверхность с которой вирус не связывается, блокируют белком, не являющимся родственным антигену, таким как 0,5% желатин. После промывки для осуществления связывания антивирусного МКА с антигеном поверхность лунок подвергают контакту с серийно разведенными образцами мышиной сыворотки. Для связывания с мышиным антителом добавляют меченое ферментом антитело против мышиного иммуноглобулина в качестве «второго» антитела. После промывки добавляют субстрат для фермента и титр антитела оценивают путем определения изменения оптической плотности вследствие развития окраски, вызываемой изменением субстрата.
3. Накопление миеломных клеток
В качестве источника миеломных клеток служат 8- азагуанин- резистентные миеломные штаммы, такие как P3/NS1/1-Ag4-1, P3X63Ag8U.1, SP/20-Ag14, P3X63Ag8.653 и P3X63Ag8. Выбранную клеточную линию культивируют на среде RPMI-1640 с добавлением глутамина, 2- меркаптоэтанола, гентамицина и сыворотки животных для обеспечения в день слияния плотности, по крайней мере 2×107 клеток/мл.
В качестве партнера для слияния при получении гибридом настоящего изобретения использовали культуру клеток мышиной миеломы линии X63Ag8.653, адаптированную к росту на средах с добавлением СКРС, полученную из коллекции ЦНИИРРИ (Климович 1986). Данный штамм является устойчивым к 8-азагуанину, то есть дефектным по гену гипоксантин-гуанин-фосфорибозилтрансферазы.
Культивирование миеломы осуществляли в пластиковых культуральных планшетах или во флаконах производства Sarstedt или Nunc. Клетки содержали при +37°С и 100% влажности в атмосфере с 6-7% СО2. Базовая культуральная среда содержала 90% RPMI-1640 и 10% сыворотки крови крупного рогатого скота (СКРС) производства фирмы «Биолот» (Санкт-Петербург).
4. Слияние клеток
Для получения гибридом, продуцирующих МКА, в качестве клеток предшественников используют лимфоциты или клетки плазмы, полученные из любой подходящей части организма животного. Такими источниками лимфоцитов или клеток плазмы являются, например, селезенка, лимфатические узлы, периферическая кровь или любая их подходящая комбинация, при этом чаще всего используют клетки селезенки.
После последней бустер-иммунизации для получения антител-продуцирующих клеток у мыши, имеющей предварительно высокий титр специфических антител, удаляют ткань, в которой присутствуют антитело-продуцирующие клетки. В современной предпочтительной технике слияния клеток селезенки с клетками миеломы, полученными как описано в стадии 3, используют полиэтиленгликоль.
Указанная техника слияния предусматривает промывку клеток селезенки и миеломы бессывороточной средой (такой как RPMI-1640) или забуференным физиологическим раствором и их смешивание, так чтобы отношение клеток селезенки к клеткам миеломы составляло приблизительно 5:1-10:1, после чего клетки центрифугируют.Затем супернатант отбрасывают и осажденные клетки в достаточной степени разрыхляют, после чего перемешивая по каплям добавляют 1 мл бессывороточной среды, содержащей 50% (масс./об.) полиэтиленгликоля (Mw 1000-4000). Затем медленно добавляют 10 мл бессывороточной среды, после чего смесь центрифугируют. Супернатант снова отбрасывают, а осажденные клетки суспендируют в соответствующем количестве селективной HAT среды, содержащей раствор гипоксантина, аминоптерина и тимидина. Затем суспензию распределяют по лункам планшета для культивирования и инкубируют в присутствии 5-8% СО2 при 37°С, примерно в течение 2-3 недель с добавлением селективной среды.
5. Отбор гибридом
Если используемый штамм миеломы является резистентным к 8-азагуанину, то есть если он является дефицитным по ферменту гипоксантин-гуанин-фосфорибозилтрансферазе, то любые не слитые миеломные клетки и любые гибриды миелома-миелома не способны выживать в среде HAT. С другой стороны, гибриды антитело-образующих клеток, образуемых друг с другом, а также гибридомы, образованные антиетело-подуцирующими и миеломными клетками, могут выживать в этой среде, причем первые имеют лишь ограниченное время жизни. В соответствии с этим продолжительное инкубирование в среде HAT приводит к отбору лишь нужных гибридом. Затем берут аликвоты супернатанта для определения титра специфических антител в ELISA (процедура подробно описана в пункте 2).
6. Клонирование, тестирование и реклонирование гибридомных культур.
Подходящими методами клонирования являются: метод предельных разведении, в котором гибридомы разводят так, чтобы на одну лунку планшета приходилась одна клетка, а затем культивируют; метод, в котором колонии выделяют при культивировании в среде с мягким агаром; метод с использованием микроманипулятора для выделения одиночной клетки; и «сортировка клона», в котором одиночные клетки разделяют на клеточном сортере.
Процедуру клонирования, осуществляемую, например, методом лимитирующих разведении, повторяют 2-4 раза для каждого клона, продуцирующего специфические антитела. Клоны, стабильные продуценты антител, отбирают для получения МКА.
Гибридому, полученную путем клонированя, затем культивируют в ростовой среде с целью накопления достаточного количества клеток для пассажа на сингенных мышах. Крупномасштабное культивирование осуществляют в культуральных роллер-флаконах или культуральных флаконах больших размеров.
Гибридомы «мышь-мышь» настоящего изобретения, на основе которых получают МКА В/4Н1, 4Н7, были депонированы в Специализированной коллекции культур клеток позвоночных Российской коллекции клеточных культур 13.01.2009 г.под регистрационными номерами РККК (П) 719Д, РККК (П) 720Д, соответственно. В соответствии с этим получение МКА с использованием гибридом В/4Н1 и 4Н7 может быть достигнуто в соответствии с процедурой, описанной ниже в стадии 9 без осуществления стадий 1-6.
9. Культивирование гибридомы в мышах с целью получения МКА
Асцитические жидкости, содержащие МКА, секретируемые представленными гибридомами получали по методам, описанным Новохатским А.С.с коллегами (Новохатский 1985), а также рядом других авторов (Новиков, 1988, Hoogenraad N., 1983). Для пассирования гибридом мышам-реципиентам за 7-14 дней до прививки внутрибрюшинно вводили 0,5 мл пристана (Sigma). Клетки в количестве 5-10 млн инокулировали в брюшную полость. После образования асцита делали прокол брюшной стенки и собирали оттекающую жидкость.
Для очистки собранных асцитических препаратов МКА используется насыщенный раствор сульфата аммония. Первое высаливание осуществляли с использованием насыщенного раствора (NH4)2SO4 в соотношении с асцитической жидкостью 1:1 (50% раствор). Насыщенный раствор (NH4)2SO приготавливали из расчета 70,7 г на 100 мл дистиллированной воды. Для второго и третьего (при необходимости) высаливания использовали 40% раствор сульфата аммония.
10. Анализ МКА
МКА, продуцируемые гибридомами настоящего изобретения, имеют различные функциональные свойства, описанные ниже.
10.1 МКА 4Н7 к вирусу гриппа В, штамм B/Panama/45/90, были охарактеризованы с помощью иммуноферментного анализа и реакции торможения гемагглютинации. Установлено, что титр МКА с очищенными вирусами гриппа В Ямагатской эволюционной линии, сорбированными на твердой фазе, составлял 10-5-10-6, а уровень неспецифического реагирования с различными субтипами вируса гриппа А, штаммами гриппа В ранних лет выделения и штаммами вируса гриппа В Викторианской линии не превышал фоновых значений.
В РТГА МКА 4Н7 обладали выраженной ингибирующей активностью. Исследование спектра реагирования МКА 4Н7 с большим набором штаммов вирусов гриппа типа В 1940-2006 г.г.выделения, существенно отличающихся по антигенной характеристике НА, показало, что гемагглютинирующая активность штаммов 1988-2006 г., ведущих свое происхождение от эталонного штамма B/Yamagata/16/88, как правило, подавлялась в высоких разведениях МКА, вплоть до титра 1/5120. Штаммы, берущие свое начало от вируса B/Victoria/2/87, и штаммы, выделенные ранее 1988 г., не взаимодействовали с МКА 4Н7 ни в ИФА, ни в РТГА.
Способность антител нейтрализовать вирус, ингибируя тем самым инфекционный процесс, является важнейшей характеристикой их функциональной активности. Использование МКА позволяет определить, является ли антигенная детерминанта вирусного белка, с которой они взаимодействуют, индуктором синтеза вируснейтрализующих AT. Для оценки вируснейтрализующих свойств AT был использован микрокультуральный метод, основанный на учете остаточной репродукции вируса в монослойных культурах после инкубации его с МКА с помощью ИФА. Т.о. было установлено, что МКА 4Н7 подавляли репродукцию гомологичного вируса B/Panama/45/90 до концентрации 2 мкг/мл.
Оценка эпитопной направленности МКА была проведена с использованием иммуноблотинга. После электрофоретического разделения вирусных белков в нередуцирующих условиях, НА выявлялся МКА 4Н7 в виде нескольких олигомерных полипептидов с молекулярными массами (ММ) 82 кД, 99 кД и 205 кД. Чтобы удостовериться, что эти полипептиды действительно являются олигомерными формами НА, эти белки были проанализированы в двумерном электрофорезе. Полипептиды НА 82 и НА 205 в редуцирующих условиях разделялись на две субъединицы, соответствующие по относительной молекулярной массе НА1 (52 кД) и НА2 (29кД). НА 99 в тех же условиях переходил в форму НА 82, но не разделялся на НА1 и НА2, т.е., вероятно, этот полипептид является частью молекул НА не претерпевших посттрансляционного протеолиза хозяйскими протеазами на тяжелую и легкую цепи. Эти данные еще раз подтверждают, что МКА 4Н7 направлены к молекуле НА. В редуцирующих условиях МКА 4Н7 взаимодействовали с двумя белками с ММ 52кД и 82 кД, которые можно уверенно идентифицировать как НА1 и НА0. Таким образом, иммуноблотинг показал, что МКА 4Н7 взаимодействуют с эпитопами молекулы НА, локализованными в НА1-домене.
Получение и характеристика escape-мутантов (ЕМ), резистентных к действию вируснейтрализующих МКА является ценным инструментом при изучении антигенной структуры вирусных белков. Стандартная методика получения ЕМ основана на однократном клонировании штамма ДТ в присутствии вируснейтрализующих МКА (Berton M, Webster R., 1985). Полученные таким образом ЕМ имеют как правило 1 или 2 нуклеотидные и соответствующие им аминокислотные замены, при этом, как правило, наблюдается 8-32 кратное снижение титров антител в РТГА (с МКА, использованными для селекции). Секвенирование гена НА ЕМ, клонированного в присутствии МКА 4Н7, показало, что эти МКА взаимодействуют с эпитопом включающим в себя аминокислотные остатки в положениях 75 и 150 (рис 6).
10.2 Анализ МКА В/4Н1, полученных к вирусу гриппа B/Shandong/7/97, в ИФА и РТГА, показал, что данные антитела реагировали в ИФА только со штаммами вируса гриппа В Викторианской эволюционной линии и не взаимодействовали с различными субтипами вируса гриппа А, штаммами гриппа В ранних лет выделения и штаммами вируса гриппа В Ямагатской ветви. В РТГА МКА В/4Н1 обладали выраженной гемагглютинирующей активностью с B/Victoria/2/87 - подобными штаммами 1987-2007 г.г. выделения до титра 1/20480 при отсутствии связывания со штаммами гриппа В ранних лет выделения и вирусами гриппа В Ямагатской ветви.
Изучение вируснейтрализующей активности МКА В/4Н1 с гомологичным штаммом B/Shandong/7/97, показало, что эти МКА ингибируют репродукцию вируса на 100% в концентрации 1 мкг/мл и более.
Методом иммуноблоттинга установлено, что МКА В/4Н1 в нередуцирующих условиях выявляли белки с молекулярными массами 82 кД, 99 кД и 205 кД, что соответствует олигомерным формам гемагглютинина. В редуцирующих условиях МКА В/4Н1 взаимодействовали с двумя белками с ММ 52кД и 82 кД, которые являются полипептидами НА1 и НА0. Таким образом, иммуноблотинг показал, что МКА В/4Н1 взаимодействуют с эпитопами молекулы НА, локализованными в тяжелой субъединице HAL
Секвенирование гена НА ЕМ, клонированного в присутствии МКА В/4Н1, позволило установить, что эти МКА направлены к эпитопу со значимым аминокислотным остатком в положении 218 (рис.7).
10.3 Изучение МКА 4Н7 к вирусу В/Панама/45/90 в иммунологических реакциях выявило, что данные МКА работают в ИФА, РТГА и реакции нейтрализации. Тестирование МКА 4Н7 в ИФА с большим набором штаммов гриппа типа В разных лет выделения (1954-2007 г.г.) позволило установить, что МКА 4Н7 взаимодействуют до высоких титров (10-5-10-6) со всеми вирусами Ямагатской линии, что позволяет предположить, что исследуемые МКА направлены к изменчивому эпитопу, входящему в состав гемагглютинина вирусов Ямагатской линии.
Действительно, по данным иммуноблоттинга в редуцирующих условиях МКА 4Н7 взаимодействовали с молекулой нерасщепленного гемагглютинина (НА0) и субъединицей HAL В нередуцирующих условиях эти МКА взаимодействовали только с нерасщепленной молекулой НА0 (в мономерной и димерной форме).
Для идентификации изотипа и подкласса МКА предпочтительно использовать коммерческие наборы. Для определения изотипа МКА, секретируемых гибридомами настоящего изобретения, использовались коммерческие наборы: "Mouse Monoclonal Antibody Isotyping Reagents" (SIGMA, USA, Lot 18H4870) и "Mouse Monoclonal Antibody Isotyping Kit" (SIGMA ImmunoType, USA, Lot 108H4869) согласно рекомендациям изготовителя. Определено, что МКА 4Н7 относится к изотипу IgG1, a второе МКА (В/4Н1) относится к изотипу IgG2a.
11. Для криоконсервирования клеток использовали среду, состоящую из 90% СКРС и 10% ДМСО (Sigma). Предварительно охлажденные до -70°С в парах азота криопробирки с клетками помещали в жидкий азот (для многолетнего хранения). Криоконсервированию подвергали культуры гибрид омных клеток, находящиеся в логарифмической фазе роста, образующие сплошной монослой, или клетки, выращенные в перитонеальной полости мышей сингенной линии при получении асцитных жидкостей. Перед замораживанием клетки подвергали микроскопическому исследованию на отсутствие контаминации микрофлорой. Количество живых клеток оценивали по эксклюзии трипанового синего. Восстановление клеточных культур после их хранения в условиях низких температур (-70°С, -196°С) осуществляли по методу, описанному Oi V.T. & Herzenberg L.A. (25) с учетом рекомендаций Малаховой И.В. с соавторами (6).
Нижеследующие примеры иллюстрируют способы и результаты настоящего изобретения.
Пример 1. Получение антигенов вирусов гриппа В
1.1 Культивирование вирусов в развивающихся куриных эмбрионах (РКЭ).
Вирусы гриппа В культивировали в 10-11- дневных РКЭ. При пассировании лабораторных штаммов вирусов гриппа В в качестве вирусного инокулята использовали аллантоисную жидкость инфицированных КЭ и заражали вирусом в дозе 102-103 ЭИД50, вводя в аллантоисную полость по 0,2 мл вируссодержащего материала в физиологическом растворе с добавлением 50 мкг/мл гентомицина. Вирусы пассировали от трех до пяти раз для получения инокулята с инфекционным титром 7-9 lg ЭИД50 / 0,2 мл. Вирусы гриппа В культивировали 72 часа при +32°С. Концентрацию гемагглютининов в вируссодержащей аллантоисной жидкости определяли титрованием по стандартной методике с использованием 1% суспензии эритроцитов кур (Вирусология 1988).
1.2 Определение инфекционной активности вирусов гриппа методом титрования на куриных эмбрионах.
Инфекционную активность определяли методом титрования на КЭ, заражая по 4 КЭ каждым из последовательных 10-кратных разведении вирусного материала на ФСБ. Показатель ИА, рассчитанный по методу (Thompson 1947), выражали в виде обратной величины десятичного логарифма ЭИД50.
1.3 Получение препарата концентрированного очищенного вируса осуществляли в несколько стадий по методу дифференциального ультрацентрифугирования (Вирусология 1988). На первом этапе вируссодержащую аллантоисную жидкость (ВАЖ) осветляли низкоскоростным центрифугированием при 4000 об./мин. в течение часа. Каждую следующую стадию очистки и концентрирования вирусов гриппа осуществляли при 100000g (центрифуга "Beckman") в течение 2,5 часов. Сначала ВАЖ осаждали на дно скоростным центрифугированием с холодовым обеспечением. Осадок ресуспендировали в 10 мМ STE буфере (100 мМ NaCl, 10 мМ трис-HCl и 1 мМ ЭДТА), pH 7.2-7,4. Очистку полученного вирусного концентрата осуществляли центрифугированием в ступенчатом градиенте плотности сахарозы (20%-60% растворы сахарозы в STE) при +4°С. Вирусную зону собирали в районе 40%-42% сахарозы, разводили STE в 4 раза и повторно осаждали на дно пробирки. Осадок ресуспендировали в 10 мМ STE буфере, pH 7.2-7,4, хранили до использования при -20°С.Белок измеряли по методу Lowry (Lowry 1951). Концентрация вирусного белка в препарате обычно составляла 1-5 мг/мл. Контроль за качеством препарата осуществляли с помощью электронно-микроскопического анализа морфологии вирионов методом негативного контрастирования 1,5% раствором Na-соли фосфорно-вольфрамовой кислоты на угольных подложках.
Пример 2. Разработка МКА В/4Н1 к вирусу гриппа B/Shandong/7/97.
2.1 Получение антителопродуцирующих клеток.
С целью получения гибрид омы В/4Н1 в качестве иммуногена использовали очищенный концентрат вируса гриппа B/Shandong/7/97. Иммунизация самок мышей межлинейных гибридов F1(SGL/J × Balb/c) 7-8-ми недельного возраста очищенными концентратами вирусов гриппа, растворенными в ФСБ, осуществлялась внутрибрюшинно в дозе 50-100 мкг/ мышь. Инъекции антигенов делали 3 раза с интервалом 3-8 недель. За три дня до слияния мышам, имевшим наивысшие титры специфических антител, внутрибрюшинно проводилась бустер-иммунизация антигеном в дозе 70 мкг/мышь.
2.2 Для контроля качества иммунизации мышей-доноров селезеночных клеток, а также характера иммунного ответа на антиген, сыворотки крови животных, полученные из ретробульбарного синуса, исследовали в реакции непрямого варианта ИФА. Предварительно планшеты для иммуноферментных реакций ("Медполимер") сенсибилизировали очищенным концентратом вируса гриппа B/Shandong/7/97 в концентрации 2-3 кг/мл в 0,05М КББ, инкубация 18 часов, +4°С. Затем лунки планшеты 3 раза промывали от несвязанного антигена с помощью ФСБ, содержащего 0,05% твина-20 (ФСБ-Т). Мышиные сыворотки вносили в соответствующих разведениях на ФСБ-Т, содержащем 0,5% желатины (ФСБ-Ж-Т), инкубация 1 час при +37°С или 18 часов при +4°С. Далее лунки планшеты были отмыты 3 раза ФСБ-Т и был внесен пероксидазный конъюгат против IgG мыши (Sigma) на ФСБ-Ж-Т, инкубация 1 час при +37°С. После четырехкратной промывки ФСБ-Т в лунки планшета вносили субстрат-хромогенную смесь, состоящую из 3,3'5,5' тетраметилбензидина (0,1 мг/мл) и 0,003% перекиси водорода на 0,1М ацетат-цитратном буфере, pH 5,0. Реакцию останавливали 2N серной кислотой. Результат учитывали на иммуноферментном анализаторе Anthos при длине волны 450 нм.
2.3 Проведение процедуры гибридизации при получении гибридомы В/4Н1.
Гибридому В/4Н1 настоящего изобретения получали по методике, описанной Гальфре и Мильстейном (Galfre, Milstem, 1981). На третий день после бустер-иммунизации у мыши удаляли селезенку и помещали в 10 мл бессывороточной среды RPMI-1640, содержащей 50 мг/л гентамицина, а затем выделяли спленоциты путем механического выдавливания в гомогенизаторе. Полученную суспензию центрифугировали для осаждения клеток, которые затем дважды промывали бессывороточной средой RPMI-1640, после чего клетки ресуспендировали в бессывороточной среде и подсчитывали.
Культуру мышиной миеломы X63Ag8.653, дефектной по гену ГГФРТ, поддерживали в логарифмической фазе роста путем ежедневных рассевов в среде RPMI-1640 с 10% СКРС при +37°С и 100% влажности в атмосфере с 6-7% CO2. К моменту слияния клетки миеломы культивировали до клеточной плотности, не превышающей 1×106 клеток/мл. Гибридизацию спленоцитов гипериммунизированных мышей с клетками мышиной миеломы осуществляли в суспензии в соотношении 10:1 в присутствии 50% ПЭГ-1000. (Sigma). Затем клетки переносили в селективную НАТ-среду, приготовленную на основе RPMI-1640 и 20% СКРС с добавлением гипоксантина (10-4М), аминоптерина (4×10-7М) и тимидина (1,6×10-5M) производства Sigma, а также 2 мМ глютамина, 1 мМ пирувата натрия (Sigma), 1 мг/л амфотерицина В и 50 мг/л гентамицина. Суспензию распределяли по ячейкам 96-луночных планшетов, содержащих трехсуточную культуру мышиных макрофагов.
2.4 Культивирование и тестирование гибридом.
После 10 суток культивирования НАТ-среду заменяли на более щадящую НТ, а после 20 суток культуры поддерживали на среде RPMI-1640 с СКРС. Для удаления Ig, секретированных не слившимися спленоцитами мышей, культуральную жидкость из ячеек с растущими гибридами отбирали на 5-6, затем 10-12 и на 16-17 дни после слияния.
Скрининг гибридом проводили методом описанного выше твердофзаного ИФА. Для контроля неспецифической реактивности культуральных жидкостей использовали препараты очищенных концентратов гетерологичных вирусов гриппа А и В и хозяйский компонент (аллантоисная жидкость). При этом культуральные жидкости, содержащие иммуноглобулины, разводили в 5-10 раз.
2.5 Клонирование.
Всего в результате гибридизации получено 7 первичных гибридом, активно реагирующих в ИФА с очищенным концентратом вируса гриппа B/Shandong/7/97 и не взаимодействующих с препаратами гетерологичных вирусных и хозяйским антигенами. Положительно специфически реагирующие гибриды трижды клонировали методом лимитирующих разведении по McKearn T.J. под контролем их активности и специфичности в ИФА. В результате получены 2 гибридных клона заданной специфичности, один из которых (В/4Н1) представляет гибридому В/4Н1 настоящего изобретения. Эта гибридома была депонирована в Специализированной коллекции культур клеток позвоночных Российской коллекции клеточных культур 13.01.2009 г.под номером РККК (П) 719Д. Клонированные гибридомы криоконсервировали в жидком азоте (-196°С).
2.6 Получение асцитических препаратов МКА В/4Н1.
Гибридому В/4Н1 выращивали in vitro до концентрации 1,5×106 кл/мл клетки осаждали низкоскоростным центрифугированием, ресуспендировали в 0,01 М ФСБ и вводили внутрибрюшинно мышам - межлинейным гибридам F1(SGL/J × Balb/c), предварительно праймированным пристанем, по 5×106 кл/мышь в объеме 1 мл. Асцитные опухоли формировались на 10-16 сутки после введения гибридомы. После центрифугирования асцитов супернатант, содержащий специфические МКА в высоких титрах, использовали в качестве полуфабриката для выделения иммуноглобулина, который использовали для получения иммунопрепаратов. Клетки гбридом, прошедшие пассирование на мышах, криоконсервировали и в дальнейшем использовли для массового получения асцитических препаратов МКА В/4Н1.
Пример 3. Использования набора МКА, продуцированных предлагаемыми гибридомами, для идентификации в ИФА различных штаммов вируса гриппа В.
Проведен анализ взаимодействия асцитических препаратов, содержащих МКА, с эталонными штаммами вируса гриппа типа В разных лет выделения различных эволюционных линий. ИФА проводили по методике, описанной в примере 2. Очищенные концентраты исследованных штаммов вируса гриппа В сорбировались на подложку в концентрации 2 мкг/мл. МКА вносили в разведениях 10-2-10-6. Результаты ИФА показали, что МКА В/4Н1 позволяют идентифицировать исключительно штаммы Викторианской эволюционной линии, а МКА 4Н7 пригодны для выявления изолятов только Ямагатской данной разновидности.
Пример 4. Постановка реакции торможения гемагглютинации (РТГА).
РТГА использовали для определения спектра реактивности МКА, продуцируемых гибридомами 4Н7 и В/4Н1 с различными штаммами вируса гриппа В, принадлежащими к двум эволюционным линиям. РТГА ставили по методу, рекомендованному ВОЗ. МКА титровали с шагом 2 в объеме 50 мкл на 0,1М ФСБ, после чего вносили 25 мкл вирусной суспензии, содержащей 8 гемагглютинирующих единиц. После инкубации указанной смеси при комнатной температуре в течение часа вносили равное количество (75 мкл) 1% суспензии куриных эритроцитов. За титр МКА принимали их наибольшее разведение, полностью подавляющее гемагглютинацию.
Взаимодействие МКА 4Н7 и В/4Н1 в РТГА со штаммами различных эволюционных линий вируса В.
Пример 5. Изучение вируснейтрализующей активности МКА 4Н7 и В/4Н1 к НА вирусов гриппа В.
Реакцию нейтрализации проводили методом микрокультурального ИФА. Клеточную культуру МДСК выращивали в 96-лупочных планшетах фирмы Sarstadt (Германия) при +37°С в СО2-термостате в среде Игла МЭМ с добавлением 10% сыворотки крупного рогатого скота (СКРС), 0,3 мг/мл глютамина и 100 мкг/мл гентамицина. МКА осаждали из взвеси полунасыщенного сульфата аммония центрифугированием при 6000 об/мин в течение 20 мнут.Осадок растворяли в минимальном оъеме дистиллированной воды. Далее МКА диализовали против ФСБ в течение 12-18 часов на магнитной мешалке при +4°С. 2-кратные разведения препаратов МКА соединяли с равными объемами 100 ТЦД50 вирусов гриппа В, разведенных в среде Игла МЭМ без СКРС с добавлением 0,126 мг/мл аргинина и 2 мгк/мл ТРСК-трипсина (Sigma), и инкубировали 1 час при +37°С. 100 мкл смеси вирус - МКА наносили на отмытые ФСБ лунки с монослоем клеток МДСК. Дозу вируса контролировали заражением клеток его 10-кратными разведениями. Планшеты выдерживали 3 суток в CO2-термостате до развития ЦПД в контрольных лунках. После удаления среды клетки фиксировали 20 мин 80% холодным ацетоном. В лунки вносили по 100 мкл конъюгата МКА А/4Н1,специфичных к HP вируса гриппа типа А, с пероксидазой хрена и инкубировали 1 час при +37°С. Рабочее разведение конъюгата на 0,01М ФСБ с 5% обезжиренным молоком составляло 1:5000. После отмывания ФСБ в лунки добавляли 100 мкл субстрат-хромогенной смеси, содержащей 0,05% Н2О2 и 0,1 мг/мл 3,3', 5,5' - тетраметилбензидина (ТМБ) на 0,1 М ацетат-цитратном буфере. pH 5,0. Реакцию останавливали 2N H2SO4. Оптическую плотность при длине волны 450 нм (ОП450) определяли на фотометре Anthos (Австрия). Титром нейтрализации в РН считали последнее разведение сыворотки, при котором наблюдалось 2-кратное снижение ОП450 по сравнению с контролем вируса.
Пример 6. Определение эпитопной направленности МКА.
6.1. Проведение электрофореза.
Электрофорез проводили по методу Laemmli U.K. (Laemmli, 1970), используя аппарат ЕС 135 (USA). В качестве разделяющего использовали полиакриламидный гель (ПААГ) с линейной концентрацией 5-20%. Разделяющий гель готовили на буфере, содержащем 1,5М трис (pH 8,8), концентрирующий гель готовили с использованием 0,5М трис (pH 6,8). В их состав входил также додецил- сульфат натрия (ДСН) в концентрации 1%. В редуцирующих условиях электрофорез проводили с 2-меркаптоэтанолом). Очищенный в градиенте плотности сахарозы вирусный концентрат разводили в лизирующем буфере (0,062М трис, 2% ДСН, 5% - меркаптоэтанол, 10% глицерин, 2% бромфеноловый синий pH 6,8) до концентрации 5 мкг/мл и прогревали 2-3 минуты на водяной бане. Полученную смесь вирусных полипептидов вносили с помощью шприца в карманы геля под электродный буфер (0,025М трис, 0,192М глицерин, 0,1% ДСН pH 8,4). Электрофорез проводили при постоянном напряжении 100 mV, после чего разделяющий гель вынимали и использовали для постановки иммуноблотинга. Вирусные белки окрашивали красителем Кумасси R-250 (Sigma).
6.2 Иммуноблоттинг.
Разделенные в редуцирующих и нередуцирующих условиях в ПААГ вирусные белки электрофоретически переносили на нитроцеллюлозные мембраны (НЦ) (Millipore Co.) как описано (Towbin H., 1979) в буфере для переноса (20 тМ трис, pH 8,3, 192 mM глицин, 20% этанол) в течение 1 часа при постоянном напряжении 26 mV. Свободные центры связывания НЦ блокировали 5% обезжиренным молоком на ФСБ (ФСБ-М) (инкубация 18 часов, +4°С). Затем НЦ стрипы инкубировали в растворе МКА (разведение 1/1000) на ФСБ-М, инкубация 1 час при +37°С. Далее НЦ промывали в ФСБ и инкубировали в растворе пероксидазного конъюгата против IgG мыши (Sigma), инкубация 1 час при +37°С. После промывки НЦ ФСБ стрипы обрабатывали 1% декстран сульфатом на 10 мМ ЭДТА-цитратном буфере, pH 5,0. Субстрат-хромогенная смесь состояла из 3,3'5,5' тетраметилбензидина (0,25 мг/мл) и 0,125% перекиси водорода на 10 мМ ЭДТА-цитратном буфере. Реакцию останавливали, промывая НЦ дистиллированной водой.
Пример 7. Определение активности МКА 4Н7 в прямом и непрямом методе флуоресцирующих антител (МФА).
7.1 Получение тест-препаратов различных штаммов вирусов гриппа В МФА.
Культуру перевиваемых клеток почки собаки (МДСК) выращивали в пробирках с покровными стеклами размером 6×18 в ростовой среде Игла с 10% фетальной сыворотки в течение суток. После формирования монослоя не менее чем на 75% среду сливали и монослой дважды промывали ФСБ или средой Игла. Клетки заражали вируссодержащей жидкостью в дозе 4.0-5.0 lg ЭИД50/0.1 мл, разведения инокулята готовили на среде Игла (pH 7,2-7,3). Адсорбцию вирусов гриппа В на монослое проводили в течение 60 минут при 32°С, после чего инокулят у даляли, а культуру трижды отмывали средой Игла. После этого в культуру клеток вносили поддерживающую среду Игла с добавлением аргинина и глутамина, 50 мг/л гентамицина. Инфицированные вирусом клетки инкубировали в течение 48-120 ч. при 32°С. Затем среду сливали, зараженный монослой дважды отмывали ФСБ, высушивали и затем фиксировали в ацетоне в течение 10 минут при +4°С.
7.2 Определение активности МКА 4Н7 в непрямом МФА.
При непрямом МФА фиксированные тест-препараты инкубировали с МКА 4Н7 в различных концентрациях в течение 30 минут при комнатной температуре. После этого препараты отмывали ФСБ в течение 20 минут (двукратная смена буфера), высушивали и инкубировали с ФИТЦ-конъюгатом антимышиных IgG в рабочем разведении в течение 20 минут с последующим двукратным отмыванием.
Яркость флуоресценции пораженных клеток оценивали по условной четырехкрестовой шкале. Для контроля проводили ее сравнение с флуоресценцией незараженных клеток. Наличие в препарате клеток с типичной цитоплазматической или ядерной флуоресценцией, при яркости не менее ++ (два креста), было достаточным, чтобы расценивать результат как позитивный (при условии отсутствия фоновой флуоресценции в контрольных препаратах). Было установлено, что МКА 4Н7 давали специфическое цитоплазматическое свечение клеток, инфицированных вирусами гриппа В, принадлежащими только к Ямагатской эволюционной линии, с яркостью +++/++++ в рабочем разведении 5-10 мкг/мл.
7.3 Приготовление МКА 4Н7, меченых ФИТЦ.
МКА осаждали из взвеси полунасыщенного сульфата аммония центрифугированием при 6000 в течение 20 минут.Осадок растворяли в минимальном объеме дистиллированной воды. Далее МКА диализовали против 0,01М карбонат-бикарбонатного буфера, pH 9,5 в течение 10-18 часов на магнитной мешалке при +4°С. Для наиболее полного удаления сульфата аммония проводили несколько (в зависимости от соотношения объемов препарата и буфера) замен буфера.
Далее растворяли 1 мкг ФИТЦ в 1 мл 0,2 М карбоната натрия (Na2CO3), pH 9,5 в соотношении 12,5 мкг ФИТЦ на 1 мг белка МКА 4Н7. Необходимый объем ФИТЦ по каплям, постоянно перемешивая, добавляли в раствор белка, процедуру проводили в темной стеклянной посуде на льду. В течение первых 30 минут периодически контролировали pH и при необходимости доводили его до 9,0 с помощью 0,15 М раствора двузамещенного фосфата калия.
Инкубацию продолжали на ледяной бане в холодильнике на магнитной мешалке в течение 18 часов.
Освобождение конъюгата от несвязавшегося ФИТЦ проводили на колонке с сефадексом G-25, уравновешенной фосфатно-солевым буфером (без хлористого натрия). Для определения концентрации белка и молярного соотношения ФИТЦ/белок пробу разводили в 50 раз с помощью 0,1 М едкого натрия и измеряли поглощение при длине волны 280 и 495.

7.4 Определение активности ФИТЦ-конъюгатов МКА 4Н7. При окраске по прямому методу ФИТЦ-конъюгаты МКА 4Н7 наносили на исследуемые препараты и инкубировали 30 минут при комнатной температуре, после чего отмывали по 10 минут в двух сменах 0,01М ФСБ и высушивали. Учет результатов проводили по аналогии с непрямым МФА. ФИТЦ-конъюгаты МКА 4Н7 давали преимущественно гомогенное свечение в околоядерной зоне цитоплазмы клеток, инфицированных исключительно штаммами вирусов гриппа В Ямагатской разновидности. Красящие титры полученных конъюгатов варьировали от 1:10 до 1:80 и коррелировали с концентрацией МКА, взятых в конъюгацию.
Для дифференциальной диагностики вирусных инфекций, вызванных штаммами гриппа В Ямагатской ветви, с использованием ФИТЦ-конъюгатов МКА 4Н7 при окраске клинических материалов (клетки эпителия нижних носовых ходов) рекомендуется использовать рабочие разведения в 2-4 раза ниже красящих титров.
Пример 8. Получение escape-мутантов вируса гриппа /Shandong/7/97 в РКЭ, их биологические и генетические характеристики.
8.1 Escape-мутанты (ЕМ) получали по стандартной методике (Nakagawa et al., 2005, 2006). Для этого аллантоисную жидкость, содержащую штамм дикого типа B/Shandong/7/97, смешивали с равным объемом предварительно диализованных против 0,1 М фосфатно-солевого буфера (pH 7,2-7,4) МКА В/4Н1. Смесь вируса и МКА инкубировали при комнатной температуре в течение 1 часа. Затем смесь вносили в шесть 10-дневных развивающихся куриных эмбрионов (РКЭ) в объеме 0,4 мл/эмбрион и инкубировали 72 часа при температуре +32°С. После этого РКЭ вскрывали и собранную аллантоисную жидкость анализировали в РГА и РТГА. По данным РГА в результате первого клонирования гемагглютинирующей активностью до титров 1/128-1/256 обладали клоны (4) и (6). В РТГА клоны (4) и (6) показали 256-кратное снижение уровня взаимодействия с МКА В/4Н1 по сравнению со штаммом дикого типа B/Shandong/7/97 (титры в РТГА 1/80, 1/80 и 1/20480 соответственно). Далее клоны (4) и (6) были 4х - кратно клонированы предельными разведениями (10-6-10-8) в РКЭ уже в отсутствии МКА.
Полученные клоны были обозначены как ЕМ-В/4Н1(4) и ЕМ-В/4Н1(6). 8.2 Результаты тестирования ЕМ приведены в таблице. Анализ ЕМ В/4Н1 с МКА в РТГА
Для более полной характеристики ЕМ, кроме МКА В/4Н1 к которому они были получены, были использованы МКА 5 В7, также полученные к штамму B/Shandong/7/97. Как видно из таблицы, ЕМ-В/4Н1(4) и ЕМ-В/4Н1(6) полностью утратили способность взаимодействовать в РТГА с МКА В/4Н1, которые были использованы для селекции. В тоже время, оба ЕМ показали такой же уровень активности в РТГА с МКА 5В7, как и штамм дикого типа B/Shandong/7/97.
9.3 Секвенирование гена НА ЕМ-В/4Н1(4), показало, что этот ЕМ имел одну аминокислотную замену в положении 218 - лизин на треонин - по сравнению с диким типом. ЕМ-В/4Н1(6) также имел единичную аминокислотную замену в том же положении 218, но это была замена лизина на изолейцин.
Т.о., секвенирование гена НА escape-мутантов, клонированных в присутствии МКА В/4Н1, позволило установить, что эти МКА направлены к эпитопу со значимым аминокислотным остатком в положении 218.
Настоящее изобретение не ограничено вышеуказанным депозитом или вариантами его осуществления, описанными в примерах, которые иллюстрируют лишь несколько аспектов настоящего изобретения. В объем настоящего изобретения входят любые варианты, которые являются функциональными эквивалентами настоящего изобретения. Помимо описанных и упомянутых здесь вариантов, в настоящее изобретение могут быть внесены различные модификации, очевидные для каждого специалиста и не выходящие за рамки прилагаемой формулы изобретения
Источники информации
1. Буссе Т.Л., Христова М.Л., Соколова М.В. и др. Получение и характеристика моноклональных антител к вирусам гриппа типов А и В // Вопросы вирусологии. - 1987. - №. - С.543-547.
2. Вирусология. Методы / Под ред. Б.Ммейхи.; Пер. с англ. - М.: Мир, 1988. - 344 с.
3. Грипп и другие респираторные вирусные инфекции: эпидемиология, практика, диагностика и терапия. Под ред. Киселева О.И., Маринича И.Г., Сомининой А.А., С.-Петербург 2003., 245 стр.
4. Дробышевская Э.И., Манилова Г.М., Семенов Б.Ф. Гибридомы как продуценты специфических антител // Иммунология. - 1980. - №1. - С.15-21.
5. Игнатьева Г.А., Сидорович И.Г., Болтовская М.Н. Гибридомы и моноклональные антитела в биотехнологии и медицине // Итоги науки и техники. - 1989. - Т.20. - С.3-96.
6. Малахова И.В., Зорин Е.В., Новохатский А.С.Хранение и восстановление гибридом, продуцирующих моноклональные антитела к вирусным антигенам // Молекулярная генетика микробиология и вирусология, 1985, №3, С.41-44.
7. Малоголвкин С.А., Власов Н.А., Вишняков И.Ф. // Роль моноклональных антител в развитии отечественной ветеринарной медицины и вирусологии // Ветеринария. - 1998. - №11.-С.6-10.
8. Манько В.М. Моноклональные антитела: иммунобиотехнологические принципы получения и перспективы их применения // Гематология и трансфузиология. - 1990. - №4. - С.4-10.
9. Новиков В.В., Трофимова М.Н., Дубинкин И.В., Барышников Ю.А. Биотехнологические аспекты получения диагностических препаратов на основе моноклональных антител // Физиология и молекулярная биология болезнетворных микроорганизмов. Межвузовский сборник. Горький, 1988, С.77-82.
10. Новохатский А.С., Малахова И.В., Гайдамович С.Я. и др. Получение асцитических препаратов моноклональных антител // Вопросы вирусологии, 1985, №6, С.749-753.
11. Слепушкин А.Н., Львов Д.К., Маринич И.Г. и др. Эпидемиологические особенности гриппа последних лет // Вопросы вирусологии. - 1998. - №2. -С.59-62.
12. Фукс Б.Ф., Сидорович И.Г., Игнатьева Г.А., Гибридомы и моноклональные антитела // Журнал ВХО им. Менделеева. - 1982. - №4. - С.409-416.
13. Berton M., Webster R. The antigenic structure of the influenza В virus hemagglutinin: operational and topological mapping with monoclonal antibodies. // Virology, 1985, vol. 143, p.583-594.
14. Englenberg N.C., Eisenstein B.I. The impact of new cloning techniques on the diagnosis and treatment of infectious diseases // N Engi J Med. - 1984. - Vol.311, №14. - P.892-901.
15. Galfre G. & Milstein C. (1981) Preparation of monoclonal antibodies: Strategies and procedures. In: J.J. Langone and H. Van Vunakis (Eds.), Methods in Enzymology, Vol.73, Immunochemical Techniques, Part В (Academic Press, New York) p.3.
16. Glikmann G., Chen S., Mordhorst C.H., Koch C. (1995). Monoclonal antibodies for the rapid diagnosis of influenza-B virus infections by ELISA: productions and characterization. Clin. Diag. ViroL, Vol.4, №1, 27-42.
17. Hoogenraad N., Helman Т., Hoogenraad J. (1983) The effect of pre-injection of mice with pristane on ascites tumor formacion and monoclonal antibody production // J. Immunol. Mem., vol.61, p.317.
18. Jian J-W., Lai C-T., Kuo C-Y. at all. (2008). Genetic analysis and evaluation of the reassortment of influenza В viruses isolated in Taiwan during the 2004-2005 and 2006-2007 epidemics. Virus Research., 131., 243-249.
19. Laemmli U.K. (1970) Cleavage of structural proteins during the assembly of the head ofbacteriophage T4//Nature, vol. 227, pp.680-685.
20. Lowry O.H., Roserbrough N.J., Far A.L., Randall R.J. Protein measurement with the folin phenol reagent//J. Biol. Chem. - 1951 / - Vol.193, №1. - P.265-275.
21. Lupulescu E., lonita E., Constantinescu C. at all. (1996). ELYSA in the rapid
diagnosis of influenza using as the detecting antibodies polyclonal
antinucleoprotein sera. Bacteriol. Virusol. Parazitol. Epidemiol., 41 (1-2)., 63-67.
22. McKeam T.J. (1980) Cloning ofhybridoma cells by limiting dilution in fluid phase. In: Kennett R.H., McKeam T.J. & Bechtol K.B. (Eds.), Monoclonal Antibodies. Hybridomas: A new dimension in biological analises, Plenum Press, p.374.
23. Nakagava N., Kubota R., and Okuno Y. (2005). Variation of the conserved neutralizing epitope in influenza В virus victoria group isolates in Japan. J. Clin. Vicrobiol, 43, №8, 4212-4214.
24. Nakagava N., Suzuoki J., Kubota R. at all. (2006). Discovery of the neutralizing epitope common to influenza В virus victoria group isolates in Japan. J. Clin. VicrobioL, 44, №4, 1564-1566.
25. Oi V.T. & Herzenberg L.A. (1980) Immunoglobulin-producing hybrid cell lines. In: Mishell B.B. & Shiigi S.M. (Eds.), Selected Methods in Cellular Immunology, Freeman, pp.351-372.
26. Rota P.A., Wallis T.R., Harmon M.W. at all. (1990). Cocirculation of two distinct evolutionary lineages of influenza type В virus since 1983. Virology 175, 59-68.
27. Spira G., Pollock R.R., Bargellesi A., Scharff M.D. Monoclonal antibodies: a potentially powerful tool in the diagnosis and treatment of infectious diseases // Eur J Clin Microbiol. - 1985. - Vol.4, №3. - P. 251-6.
28. Towbin H., Staehelin Т., J. Gordon (1979) Electrophorectic transfer of proteins from polycrylamide gels to nitrocellulose sheets: procedure and some applications// Proc. Natl. Acad. Sci. USA vol. 76, pp.4350-4355.
29. Waicharoen S., Thawatsupha P., Chittaganpitch M. at all. (2008). Influenza viruses circulating in Thailaland in 2004 and 2005. Jpn. J. Infect. Dis., 61, 321-323.
30. Walls H.H., Harmon M.W., Slagle J.J. at all. (1986). Characterization and evaluation of monoclonal antibodies developed for typing influenza A and В viruses. J.Clin. Microbiol, Vol.23, №2, 240-245.
| название | год | авторы | номер документа |
|---|---|---|---|
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА, СПЕЦИФИЧНЫЕ К РАЗЛИЧНЫМ ШТАММАМ ВИРУСА ГРИППА В | 2018 |
|
RU2714246C1 |
| ТЕСТ-СИСТЕМА ДЛЯ ДИАГНОСТИКИ ВОЗБУДИТЕЛЕЙ ОСТРЫХ РЕСПИРАТОРНЫХ ВИРУСНЫХ ИНФЕКЦИЙ | 2019 |
|
RU2733379C1 |
| СПОСОБ ДИАГНОСТИКИ ВОЗБУДИТЕЛЕЙ ОСТРЫХ РЕСПИРАТОРНЫХ ВИРУСНЫХ ИНФЕКЦИЙ | 2019 |
|
RU2726797C1 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА, СПЕЦИФИЧНЫЕ К РАЗЛИЧНЫМ ШТАММАМ РЕСПИРАТОРНО-СИНЦИТИАЛЬНОГО ВИРУСА | 2018 |
|
RU2713340C1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК МЫШИ Mus. Musculus - 1E7, ПРОДУЦИРУЮЩИЙ МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, ИММУНОРЕАКТИВНОЕ С БЕЛКОМ ГЕМАГГЛЮТИНИНА ПАНДЕМИЧЕСКОГО ВИРУСА ГРИППА А/IIV-Moscow/01/09(H1N1)sw1 | 2011 |
|
RU2457243C1 |
| Способ получения гибридомы, продуцирующей моноклональные антитела к реассортанту вируса гриппа | 1987 |
|
SU1482943A1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК МЫШИ Mus. musculus - 4F11, ПРОДУЦИРУЮЩИЙ МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, ИММУНОРЕАКТИВНОЕ С БЕЛКОМ ГЕМАГГЛЮТИНИНА ВЫСОКОПАТОГЕННОГО ШТАММА virus A/duck/Novosibirsk/56/05 Н5N1 | 2008 |
|
RU2384617C1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК МЫШИ Mus. Musculus - 6F3, ПРОДУЦИРУЮЩИЙ МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, ИММУНОРЕАКТИВНОЕ С БЕЛКОМ ГЕМАГГЛЮТИНИНА ВЫСОКОПАТОГЕННОГО ШТАММА virus A/duck/Novosibirsk/56/05 H5N1 | 2008 |
|
RU2385929C1 |
| ШТАММ АС25 ПОСТОЯННОЙ ГИБРИДОМНОЙ ЛИНИИ КЛЕТОК МЫШИ Mus. musculus-ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К АНТИГЕНУ Н3 ВИРУСА ГРИППА ЛОШАДЕЙ | 2013 |
|
RU2549713C1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК ЖИВОТНОГО RATTUS NORVEGICUS, ИСПОЛЬЗУЕМЫЙ ДЛЯ ПОЛУЧЕНИЯ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К ВИРУСУ ГЕПАТИТА А ЧЕЛОВЕКА | 1997 |
|
RU2142507C1 |



Изобретение раскрывает применение моноклональных антител (МКА), продуцируемых гибридомами В/4Н1 и 4Н7, направленных к изменчивым детерминантам в составе белков вируса гриппа В. Штаммы гибридом В/4Н1 и 4Н7 депонированы в РККК(П) под номерами 719 Д и 720 Д соответственно. Две современные эволюционные линии вируса гриппа типа В определяют с помощью МКА В/4Н1 и МКА 4Н7, направленных к изменчивым детерминантам гемагглютинина вирусов гриппа В Викторианской и Ямагатской разновидности соответственно. Использование набора полученных МКА позволяет идентифицировать вновь выделенные вирусы гриппа В. Кроме того, МКА по изобретению могут быть использованы для изучения антигенной структуры и изменчивости данного возбудителя, определения их принадлежности к определенной эволюционной линии, а также могут быть применены для конструирования диагностических тест-систем. 3 н.п. ф-лы, 12 ил., 8 пр.
1. Применение моноклональных антител В/4Н1 изотипа IgG2a, продуцируемых гибридомой В/4Н1, и моноклональных антител 4Н7 изотипа IgG1, продуцируемых гибридомой 4Н7, для идентификации Ямагатской и Викторианской эволюционных линий вируса гриппа типа В.
2. Штамм гибридомы В/4Н1, продуцирующий моноклональные антитела В/4Н1, относящиеся к изотипу IgG2a, предназначенные для идентификации вирусов гриппа типа В Викторианской эволюционной линии, депонированный в Специализированной коллекции культур клеток позвоночных Российской коллекции клеточных культур клеток от 13.01.2009 под инвентарным номером РККК (П) 719Д.
3. Штамм гибридомы 4Н7, продуцирующий моноклональные антитела 4Н7, относящиеся к изотипу IgG1, предназначенные для идентификации вирусов гриппа типа В Ямагатской эволюционной ветви, депонированный в Специализированной коллекции культур клеток позвоночных Российской коллекции клеточных культур от 13.01.2009 г.под инвентарным номером РККК (П) 720Д.
| RU 2006103302 А, 10.09.2007 | |||
| WO 2010028614 A1, 18.03.2010 | |||
| RU 2010127156 A, 20.01.2012 | |||
| БУКРИНСКАЯ А.Г | |||
| Вирусология, М., Медицина, 1986 г., с.287. |
Авторы
Даты
2013-08-27—Публикация
2011-06-30—Подача