Область техники
Настоящее изобретение относится к области биохимии, иммунологии и медицины, в частности, к средствам диагностики вирусных инфекций. Предлагаемое изобретение может найти применение в аналитической биохимии, иммунологии и медицине, в частности, при диагностике вирусных инфекций в условиях стационара или амбулаторно.
Предшествующий уровень техники
В настоящее время проблема выявления и лечения острых респираторных вирусных инфекций (ОРВИ) стоит крайне остро. По данным ВОЗ, в 2018–2019 гг., например, заболеваемость гриппом типа А и В достигла 1 миллиарда, из которых от 3 до 5 миллионов представляют собой тяжёлые случаи, в результате которых от связанных с гриппом респираторных осложнений умерли от 290 000 до 650 000 человек. Вирусы гриппа (типа А и В) относятся к семейству Orthomyxoviridae. Указанные вирусы циркулируют в природных резервуарах, вызывая инфекцию у человека, птиц, некоторых видов млекопитающих; и являются причиной сезонных эпидемий и периодических пандемий, которые уносят миллионы жизней. Наибольшую эпидемиологическую опасность представляют вирусы гриппа А и В (далее по тексту - ВГА и ВГВ); вирусы гриппа В подразделяются на две линии - Викторианскую и Ямагатскую.
При этом, существуют и другие опасные для человека вирусы, например, аденовирус (АдВ), респираторно-синцитиальный вирус (РСВ), вирусы парагриппа 2 и 3 типа (ВПГ). Следует отметить, что указанные вирусы имеют сходную симптоматику. Например, вирус гриппа вызывает жар, головную боль, насморк (ринит), кашель, боль в теле или суставах. Подобные симптомы свойственны и в случае заболевания аденовирусом, и вирусами парагриппа. Это состояние может продолжаться 3-5 дней, при этом иммунитет может быть ослаблен, что приводит к осложнению в виде дополнительных инфекций бактериального или вирусного типа.
Клиническая картина при инфицировании вирусами, вызывающими ОРВИ, весьма похожа, однако для лечения, диагностики и прогноза течения заболевания существенное значение имеет определение патогена. Несмотря на то, что лечение ОРВИ в большинстве случаев ограничено применением средств симптоматической терапии, а также препаратами неспецифической профилактики, подтверждение диагноза у пациентов с тяжёлым течением позволяет проводить высокоэффективное специфическое противовирусное лечение (например, препаратами амантадинового ряда или озельтамивиром в случае подтверждения диагноза грипп). Наиболее распространённые вирусы, вызывающие ОРВИ: вирус гриппа А и В, аденовирус, респираторно-синцитиальный вирус (РСВ), вирусы парагриппа 2 и 3 типа - имеют разное строение, состав и жизненный цикл, что обуславливает выбор специфической терапии.
Таким образом, при сезонном вирусном заболевании для последующего успешного лечения желательно точно и быстро определить патоген, при этом, в случае ОРВИ принципиально важно, чтобы диагностика была проведена в кратчайшие сроки и включала в себя определение нескольких вирусов одновременно.
В настоящее время в качестве тест-систем распространены диагностические системы на основе биологических чипов (микрочипов, биочипов). Биочип представляет собой инертную подложку, на которую нанесён каким-либо образом диагностический реагент. В случае биохимических и иммунологических тест-систем реагентом, как правило, служат антитела. В этих случаях применяют методы диагностики, основанные на использовании поликлональных или моноклональных антител, иммуноферментный (ИФА) и иммунофлуоресцентный анализ (ИФ). ИФА представляет собой метод, в основе которого лежит реакция «антиген-антитело». В ИФА при связывании антитела с антигеном образуется комплекс, который выявляют с использованием фермента в качестве метки для регистрации сигнала. В случае ИФ для визуализации связывания антиген-антитело используют флуоресцентную метку, конъюгированную с антителами, так что интенсивность флуоресценции прямо пропорционально коррелирует с количеством антигена в исследуемом образце.
В зависимости от того, какие антигены используются, иммуноферментные тест-системы подразделяют на:
- Лизатные - в которых используется смесь нативных антигенов (лизированный или обработанный ультразвуком возбудитель инфекции, полученный в культуре);
- Рекомбинантные - в которых используются полученные генно-инженерным способом белки-аналоги определённых белковых антигенов возбудителя;
- Пептидные - использующие химически синтезированные фрагменты белков.
В современной литературе описаны многочисленные тест-системы, основанные на применении ИФА. Например, патент RU 2599890 описывает многопараметрическую диагностическую тест-систему, предназначенную для выявления рака молочной железы и рака яичников. Такая система содержит набор реагентов, биологический биочип для определения концентраций нескольких опухолеассоциированных антигенов: АФП, ХГЧ, РЭА, СА125, СА15-3 и СА19-9 в образце сыворотки крови человека, набор калибровочных проб в лиофилизованной форме, изготовленных на основе стабилизированной пулированной донорской сыворотки крови человека, состоящий из нескольких калибровочных проб, содержащих одновременно все анализируемые онкомаркеры, и нулевой калибровочной пробы, не содержащей указанных онкомаркеров и представляющей собой стабилизированную пулированную сыворотку здоровых доноров, абсорбированную на аффинных сорбентах, проявляющую систему, набор буферных растворов и инструкцию по проведению анализа.
Система включает набор для диагностики нескольких антигенов, при этом в качестве образца используется образец сыворотки крови человека. Биочип представляет собой микроматрицу, расположенную на поверхности подложки, состоящую из полусферических гелевых ячеек с ковалентно иммобилизованными антителами, каждое из которых специфично к одному из анализируемых онкомаркеров, причём в каждой отдельной ячейке иммобилизовано только одно индивидуальное вещество. Однако, данная система предназначена для выявления только онкоассоциированных маркеров и не предназначена для выявления вирусных заболеваний.
В патенте RU 2298796 описывается другая диагностическая система на основе биологического биочипа для параллельного определения множества показателей (шести опухолевых маркеров, в частности, AFP, CEA, PSA, свободного PSA, CA125, CA153). Система содержит смешанный раствор двух или более белков, приготовленный в определённых соотношениях концентраций и содержащий люминесцентные метки, т.е. реакционный раствор, серии смешанных растворов белков, которые должны быть определены, в известных и возрастающих концентрациях, т.е. стандартные образцы растворов и раствор для промывки белковых чипов. Состав указанных стандартных образцов растворов включает 40-60% фетальной бычьей сыворотки, различные очищенные антигены в высоких концентрациях и 0,02-0,1‰ NaN3 или фосфатно-солевой буферный раствор (KH2PO4-Na2HPO4) 0,05M при рН 7,0-7,8, 2-30% БСА, 1,5-2,5% сахарозы, 0,02-0,1‰ NaN3 и различные очищенные антигены в высоких концентрациях. Согласно примерам, данную систему также использовали для выявления онкомаркеров.
Патент US6881835 описывает тест-систему для определения ОРВИ на основе ПЦР с использованием специфичных нуклеиновых последовательностей.
Среди тест-систем для образцов смывов с носовой полости известны системы BINAX Now (производитель Alere Inc., Waltham, MA, USA), Directigen EZ Flu A and B (производитель - Becton Dickinson, Franklin Lakes, NJ, USA) и другие. Однако, данные тест-системы представляют собой диагностикумы только для определения вирусов гриппа А и В и не позволяют определять другие вирусы.
Таким образом, существует потребность в быстром и точном определении типа вирусов среди распространённых возбудителей острых респираторных вирусных инфекций, с минимальной обработкой получаемого образца, например, мазков из носовой полости.
Краткое описание изобретения
Настоящее изобретение представляет собой многопараметрическую диагностическую тест-систему, предназначенную для обнаружения путём иммунофлуоресцентного анализа следующих патогенов, вызывающих ОРВИ: вируса гриппа А, вируса гриппа В двух линий - Викторианской и Ямагатской, аденовируса, респираторно-синцитиального вируса (РСВ), вирусов парагриппа 2 и 3 типа (ВПГ),
включающую белковый чип для одновременного определения указанных вирусов в образце, содержащий моноклональные антитела к вирусам гриппа А и В, аденовирусу, респираторно-синцитиальному вирусу (РСВ), вирусам парагриппа 2 и 3 типа (ВПГ),
буферный раствор для пробоподготовки образца для исследования,
при этом белковый чип представляет собой твёрдый субстрат, содержащий подложку с активированными альдегидными группами.
Тест-система предназначена для определения вирусов в клиническом материале, который представляет собой мазок из носовой полости (назофарингеальный смыв). В качестве буферного раствора для транспортировки и хранения назофарингеальных смывов используется ТТ-буферный раствор (1% Тритон X-100 на 100 мМ Трис-HCl pH 8,5). При необходимости исследование образца может быть отложено. В этом случае образец следует заморозить, температура хранения –80°С.
Буферный раствор (лизирующий буферный раствор) для обработки назофарингеального смыва в транспортировочном буферном растворе с целью дальнейшего проведения анализа на биочипе (пробоподготовка) представляет собой 100 мМ Трис-HCl, 1% Тритон X-100, 400 мМ ДТТ, pH 8,5. Буферный раствор для пробоподготовки следует добавлять в равном объёме по отношению к назофарингеальному смыву в транспортировочном буферном растворе для обеспечения следующих конечных концентраций компонентов в образце перед проведением анализа: 100 мМ Трис-HCl, 1% Тритон X-100, 200 мМ ДТТ.
В одном из вариантов тест-система содержит моноклональные антитела для определения вирусов гриппа А, вирусов гриппа В двух линий - Викторианской и Ямагатской, аденовируса, респираторно-синцитиального вируса (РСВ), вирусов парагриппа 2 и 3 типа (ВПГ), в концентрации 250 мкг/мл, в количестве 320 пиколитров.
В одном из вариантов тест-система включает в себя белковый чип, который может представлять собой подложку с активированными альдегидными группами, способными нековалентно связывать антитела (белковые молекулы) в буферном растворе, содержащем 20 мМ Na2HPO4, 0,005% бромфеноловый голубой, 0,5% глицерин.
Описание фигур
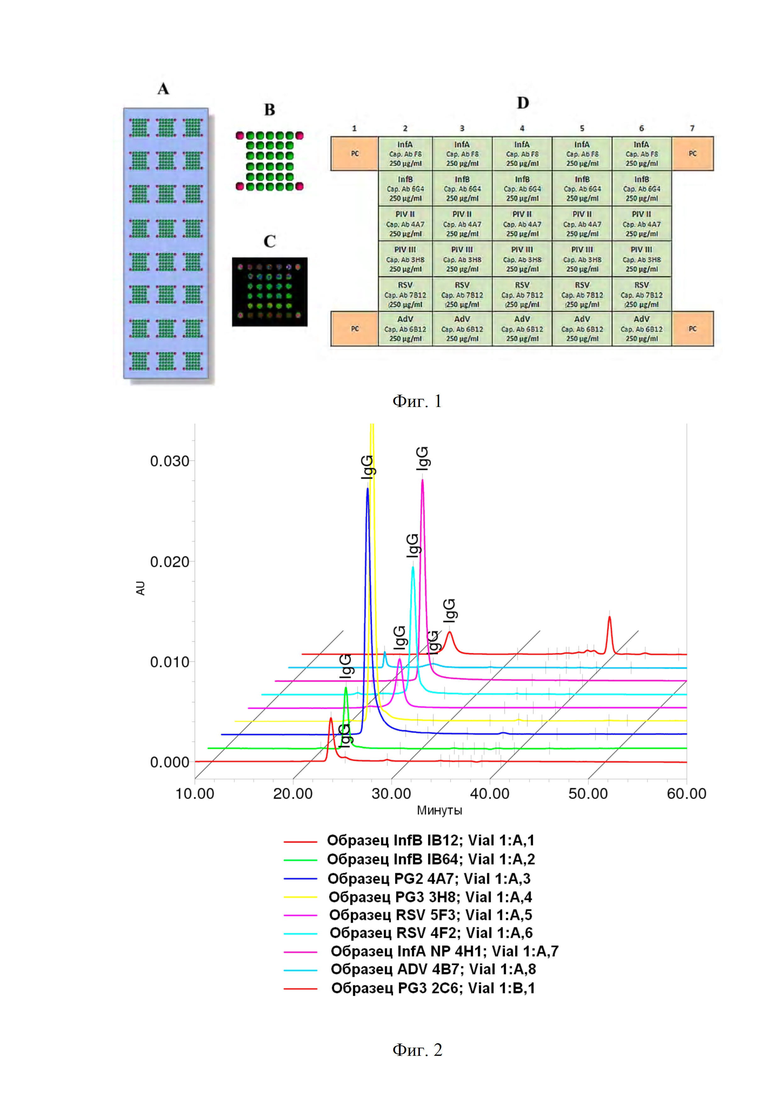
Фиг. 1. Показана схема биочипа, содержащего 14 субэрреев.
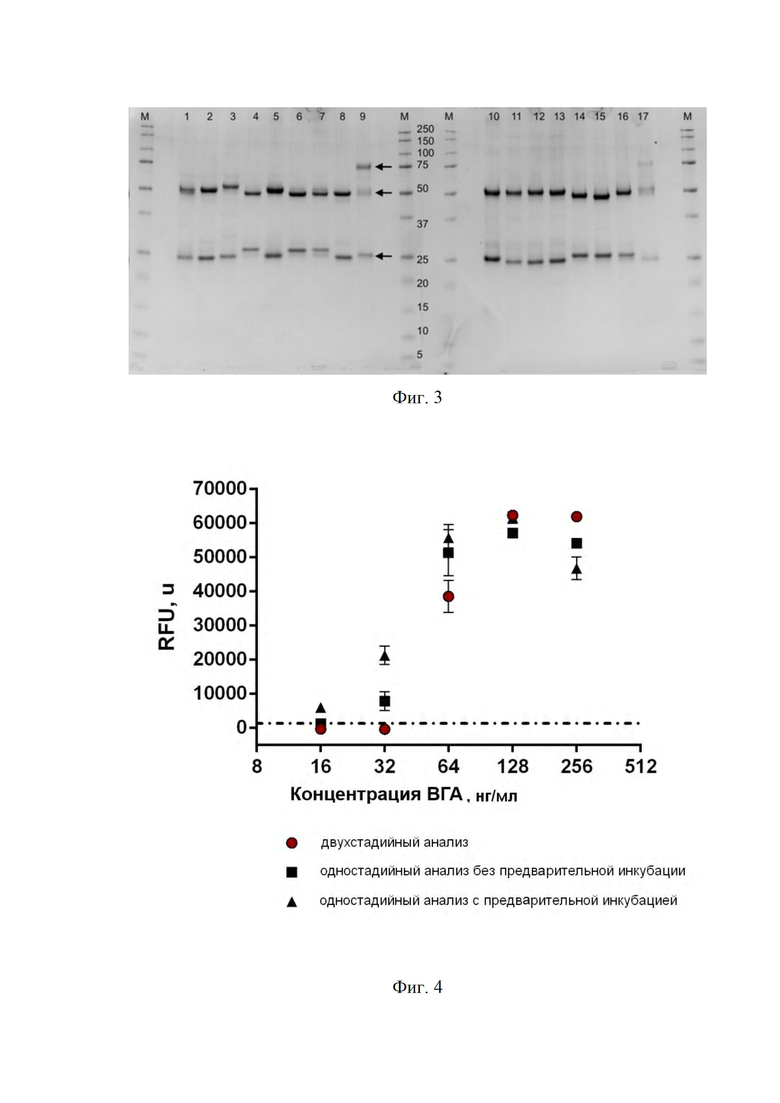
Фиг. 2. Хроматограмма полученных антител.
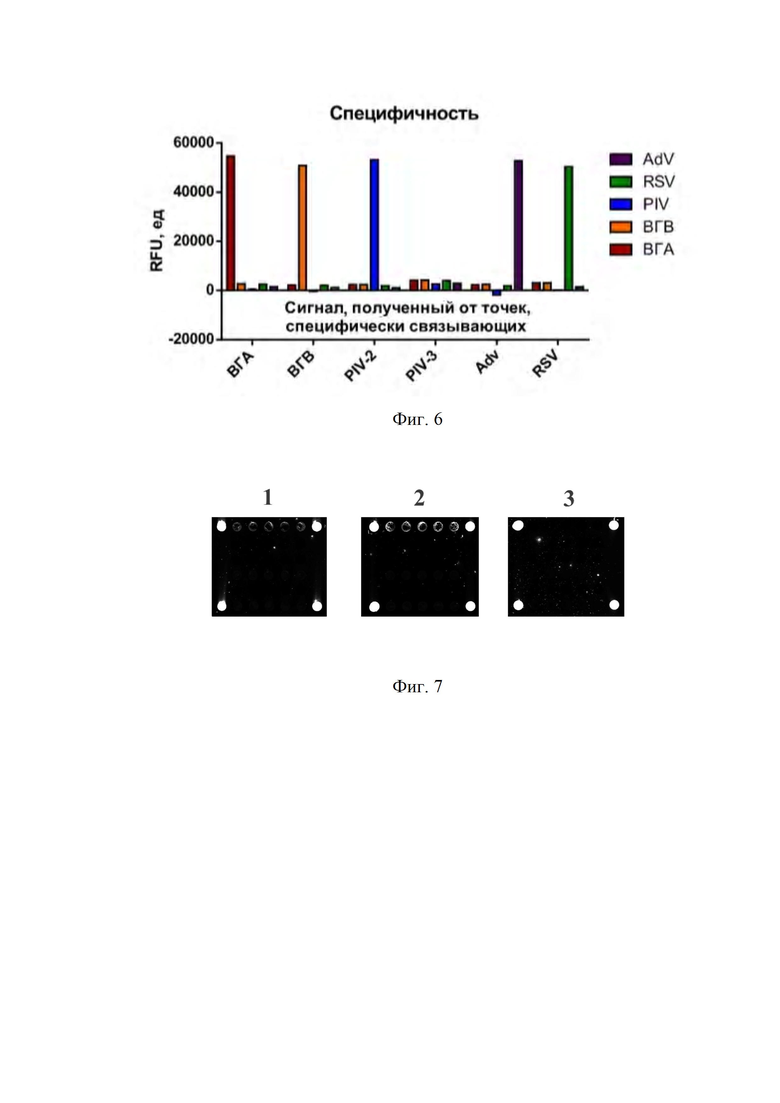
Фиг. 3. Гель-электрофореграмма полученных антител.
Фиг. 4. Сравнение чувствительности биочипа при проведении одностадийного и двухстадийного анализа.
Фиг. 5. Результаты гибридизации клинических образцов, содержащих ВГА в различных концентрациях, с использованием и без использования буферного раствора для пробоподготовки назофарингеальных смывов.
Фиг. 5А. Сравнение различных лизирующих буферных растворов для пробоподготовки образцов.
Фиг. 6. Оценка специфичности биочипа для детекции ОРВИ.
Фиг. 7. Изображение биочипа после гибридизации с полученными от пациентов образцами.
Подробное описание изобретения
Настоящее изобретение предлагает многопараметрическую диагностическую тест-систему, предназначенную для обнаружения путём иммунофлуоресцентного анализа следующих патогенов, вызывающих ОРВИ: вируса гриппа А, вируса гриппа В двух линий - Викторианской и Ямагатской, аденовируса, респираторно-синцитиального вируса (РСВ), вирусов парагриппа 2 и 3 типа (ВПГ),
включающую белковый чип для одновременного определения указанных вирусов в образце, содержащий моноклональные антитела к вирусам гриппа А и В, аденовирусу, респираторно-синцитиальному вирусу (РСВ), вирусам парагриппа 2 и 3 типа (ВПГ),
растворы для блокировки чипа, представляющие собой 0,4% NaHB4, 20% этанол в ФСБ и 1% БСА, 0,05% Твин 20 на ФСБ, pH 8,5,
буферный раствор для пробоподготовки образца для исследования,
при этом белковый чип представляет собой твёрдый субстрат, содержащий подложку с активированными альдегидными группами.
При этом система может быть предназначена для определения любых патогенов, антитела к которым могут быть иммобилизованы на активированную подложку биочипа посредством буферного раствора для печати антитела, например, при использовании коммерческих буферных растворов или буферного раствора, содержащего20 мМ Na2HPO4, 0,005% бромфеноловый голубой, 0,5% глицерин.
Биочип, согласно настоящему изобретению, содержит моноклональные антитела к вирусам, в частности, к вирусу гриппа А, вирусу гриппа В двух линий - Викторианской и Ямагатской, циркулирующим преимущественно в человеческой популяции, аденовирусу, респираторно-синцитиальному вирусу (РСВ), вирусам парагриппа 2 и 3 типа (ВПГ). В качестве примеров вирусов гриппа А и В могут рассматриваться следующие штаммы: A/California/07/09 (H1N1pdm09); A/Texas/50/12 (H3N2), B/Massachusetts/2/12 (В/Yam) и B/Brisbane/46/15 (В/Vic).
Также антитела могут представлять собой антитела к вирусу гриппа А всех субтипов (циркулирующих преимущественно в человеческой популяции), а также к вирусу гриппа В вне зависимости от эволюционной линии. Идеальной мишенью для получения моноклональных антител (МКА) является белок NP. Белок NP - это высококонсервативный структурный РНК-связанный белок вирусной частицы, который индуцирует образование кросс-протективного иммунитета к ВГА различных субтипов.
ВПГ - оболочечные вирусы, геном которых представлен одноцепочечной отрицательной РНК, кодирующей шесть ключевых структурных белков. Два гликопротеина - рецепторный белок гемагглютинин-нейраминидаза (HN) и белок слияния (F) - обнаружены на поверхности вирусной частицы. Моноклональные антитела к двум этим вирусным белкам были использованы для конструирования диагностических систем для дифференциальной типоспецифической диагностики парагриппозной инфекции.
РСВ человека существует в виде одного серотипа, но состоит из двух антигенных групп (А и В). Оболочку вириона РСВ формируют два основных трансмембранных гликопротеина: белок G, ответственный за специфическое прикрепление вирусной частицы к поверхности клетки, и белок слияния F, обуславливающих синтез вируснейтрализующих антител. F-белок является наиболее консервативным, процент гомологии его аминокислотной последовательности между A и B группами составляет 91%. G-белок, напротив, является, наиболее вариабельным из всех белков РСВ, степень гомологии его составляет 53–58%. С учётом представленных данных наиболее рациональным для выявления РСВ представляется использование МКА к консервативному F-белку.
У людей встречаются 57 серотипов аденовирусов (АдВ от 1 до 57), входящих в семь серогрупп (от A до G). В формировании наружной оболочки аденовирусов участвует семь белков, однако основным структурным компонентом является гексоновый белок. Гексон составляет около 60% массы вириона. Вариабельность аминокислотного состава гексона составляет менее 15%. Гексон содержит консервативные участки, формирующее родо-, группо- и типоспецифические антигенные детерминанты. Кроме того, в инфицированных клетках гексон синтезируется в избытке: только 20–30% белка используется для сборки вирусных частиц. Это даёт возможность сравнительно легко получать гексон в нативной форме и использовать полученные к нему МКА для детекции аденовируса различных серотипов в клинических материалах.
Используемые антитела могут быть получены различными способами, например, рекомбинантными методами (генно-инженерными методами), культивированием гибридомы, методами иммунизации животных и получением асцитов.
Используемая для биочипа подложка может быть из стекла (керамики), металла или полимерного материала. Подложка может иметь поверхности с карбоксильными, амино-, меркапто-, альдегидными, изоцианатными, метакрилатными и др. группами. Чаще всего подложка представляет собой подложку с альдегидными группами или аминосилановую подложку. Материалы для таких подложек широко известны из уровня техники и могут включать как коммерческие подложки, так и специально разработанные для нанесения на них антител. Основным отличием в данном случае служит то, что подложка имеет активные альдегидные группы, способные связывать белковые молекулы (в представленном изобретении - МКА).
При этом тест-система предназначена для определения вирусов в образце для анализа, который представляет собой смыв из носовой полости, мазок из носовой полости, носоглоточную жидкость или выделенный образец антигена. В ещё одном варианте указанный образец обрабатывают буферным раствором для проведения анализа перед внесением в тест-систему.
Буферный раствор (лизирующий буферный раствор) для обработки образца может содержать различные компоненты, например, дезоксихолат натрия в Трис-HCl, дезоксихолат натрия в ФСБТ, додецилсульфат натрия (ДСН) в ФСБТ, Тритон X-100 в 100 мМ Трис-HCl, Nonidet Р-40 в Трис-HCl, ДТТ в ФСБТ и ДТТ в ФСБТ, или коммерческие буферные растворы.
В материалах носоглоточного мазка, вследствие наличия в них муцинов и гликопротеидов, формирующих гелеобразные субстанции, может быть существенно затруднена детекция антигенов, находящихся в образце. В связи с этим, для повышения точности предлагаемой тест-системы было предложено обрабатывать буферным раствором образцы при внесении в тест-систему. Предпочтительно, лизирующий буферный раствор для пробоподготовки включает ДСН на ФСБТ, Тритон X-100 на 100 мМ Трис-HCl и дезоксихолат натрия на ФСБ.
В одном из вариантов тест-система содержит антитела для определения вирусов гриппа А и В, аденовируса, респираторно-синцитиального вируса (РСВ), вирусов парагриппа 2 и 3 типа (ВПГ), в концентрации 250 мкг/мл, в количестве 320 пиколитров.
В одном из вариантов тест-система содержит белковый чип, который может представлять собой подложку с альдегидными группами или аминосилановую подложку, включающий антитела в буферном растворе, содержащем 20 мМ Na2HPO4, 0,005% бромфеноловый голубой, 0,5% глицерин.
Более подробно изобретение раскрыто ниже в примерах.
Примеры
Пример 1
Получение моноклональных антител
Антитела, используемые для диагностической тест-системы, получали с помощью асцитов.
Описанные антитела получали способом, включающим следующие стадии:
- получение антитело-продуцирующих спленоцитов;
- накопление клеток мышиной миеломы;
- слияние антитело-продуцирующих спленоцитов с миеломными клетками;
- отбор гибридом;
- введение гибридомы в брюшную полость праймированных пристаном мышей;
- накопление моноклональных антител в асцитах;
- очистка полученных моноклональных антител.
Более подробно процесс получения антитела с помощью асцитов описан ниже на примере антитела к РСВ.
Получение МКА к белкам респираторно-синцитиального вируса
Процесс получения гибридом-продуцентов МКА к консервативным эпитопам в составе респираторно-синцитиального вируса состоял из нескольких стадий.
Стадия 1. Очистка вирусов, предназначенных для использования в качестве иммуногена.
Эталонный штамм РСВ, принадлежащий к антигенной группе Long (группа А), полученный из National Institute for Medical Research (London), культивировали в перевиваемой клеточной культуре МА-104 (эпителиальные клетки почки обезьяны) в течение 5-7 суток. В качестве поддерживающей бессывороточной среды использовали среду alpha-МЕМ («Биолот», Россия). Вируссодержащую культуральную жидкость использовали для очистки и концентрации вируса путём ультрацентрифугирования в градиенте плотности сахарозы по методу Orvell [Orvell et al., 1978]. Для этого вирусы из культуральной среды осаждали ультрацентрифугированием при 50 000 g в течение 2 ч, суспендировали в малом количестве 10 мМ Трис-ЭДТА буферного раствора, рН 7,2 (STE) и производили очистку через градиент 20-60% сахарозы ультрацентрифугированием при 100 000 g в течение 2,5 ч с последующим осаждением вируса из зоны 36–40% сахарозы на дно при 120 000 g в течение 1 ч. Осадок ресуспендировали в STE. Содержание белка в очищенном вирусном материале определяли с использованием набора “Pierce BCA Protein assay kit” (“Thermo Fisher Scientific”, США). Наличие вирусной контаминации и целостность полученных вирионов контролировали с помощью электронной микроскопии. Полученные цельновирионные вирусные суспензии хранили при –80°С.
Стадия 2. Получение антитело-продуцирующих спленоцитов в результате иммунизации мышей соответствующим антигеном под контролем образования специфических сывороточных антител в ИФА.
Мышей линии BALB/c иммунизировали очищенным антигеном, полученным на стадии 1, смешанным с неполным адъювантом Фрейнда путём внутрибрюшинного введения (иммунизации) очищенного ультрацентрифугированием в градиенте плотности сахарозы антигена РСВ в концентрации 50–100 мкг/мл (по 1 мл на мышь). Затем проводили мониторинг иммунизированных животных на образование специфических антител. Животных с достаточно высоким титром антител отбирали в качестве источника антитело-продуцирующих клеток.
Инъекции антигенов проводили двукратно с интервалом в 5 недель. Спустя 7 дней после каждой иммунизации из ретробульбарного синуса мышей брали пробы крови для определения титра сывороточных антител против гомологичного РСВ или рекомбинантного белка в ИФА. Через две недели после последней иммунизации мышей, имевших по данным ИФА антитела в титре 1:10000, бустировали антигеном, полученным на стадии 1, или рекомбинантным белком.
Стадия 3. Определение титра сывороточных антител в ИФА.
Очищенный концентрат РСВ сорбировали на твёрдой поверхности (96-луночный планшет для ИФА) в концентрации 1-5 мкг/мл. После промывания планшета в лунки с сорбированным антигеном вносили серийные двукратные разведения сыворотки от иммунизированной мыши (от 1:10 до 1:20480) и инкубировали в течение часа при температуре 37°C. Для выявления сформированного комплекса антигена с антителом добавляли антитела против IgG мыши, меченные пероксидазой хрена (HRP). После промывания в планшет добавляли субстратную смесь для фермента. В качестве субстрата на стадии детекции использовали раствор ТМБ (3,3’,5,5’-тетраметилбензидин) в концентрации 100 мкг/мл с 0,03% Н2О2. Титр антител оценивали по изменению оптической плотности раствора, регистрируемой спектрофотометрически на фотометре Multiscan FC при длине волны 450 нм.
Стадия 4. Накопление клеток мышиной миеломы.
Через 3 дня после бустер-иммунизации мышь использовали в качестве донора лимфоцитов селезёнки для слияния с клетками мышиной миеломы в целях получения гибридом [Новохатский и др., 1985; Новиков и др., 1988]. Для этого проводили гибридизацию спленоцитов иммунизированных мышей с клетками мышиной миеломы в присутствии 50% ПЭГ-2000. В качестве партнёра для слияния при получении гибридом использовали культуру клеток мышиной миеломы линии Х63Аg8.653, адаптированную к росту в среде с добавлением сыворотки крови крупного рогатого скота (КРС), полученную из коллекции ФГБУ «РНЦРХТ». Данный штамм является устойчивым к 8-азагуанину, то есть дефектным по гену гипоксантин-гуанин-фосфорибозил трансферазы.
Выбранную клеточную линию культивировали на среде RPMI-1640 c добавлением глутамина, 2-меркаптоэтанола (МЭ), гентамицина и сыворотки КРС для обеспечения в день слияния со спленоцитами плотности популяции не менее 2×107 клеток/мл. Культивирование миеломы осуществляли в пластиковых культуральных планшетах или во флаконах производства “Sarstedt” или “Nunc” (Германия, США). Клетки размножали при температуре 36-37°С и 100% влажности в атмосфере воздуха с 5-7% СО2. Базовая культуральная среда содержала 90% RPMI-1640 и 10% сыворотки КРС («Биолот», Санкт-Петербург).
Стадия 5. Слияние антитело-продуцирующих спленоцитов с миеломными клетками.
Для получения антитело-продуцирующих клеток у мышей с высокими титрами специфических антител через 3–4 дня после последней бустер-иммунизации удаляли селезёнку и вымывали из неё спленоциты бессывороточной средой (такой как RPMI-1640) или забуференным физиологическим раствором, после чего их смешивали с миеломными клетками в соотношении от 5:1 до 10:1. Затем клетки центрифугировали (10 мин, 1000 об/мин), осадок разрыхляли, после чего, перемешивая, по каплям добавляли 1 мл бессывороточной среды, содержащей 50% (масс/об) ПЭГ (молекулярный вес 1000-4000 Да). Затем медленно добавляли 10 мл бессывороточной среды, после чего смесь центрифугировали.
Осаждённые клетки суспендировали в соответствующем количестве селективной НАТ-среды. Затем клетки переносили в селективную НАТ-среду, приготовленную на основе RPMI-1640 и 20% СКРС с добавлением гипоксантина (10–4 М), аминоптерина (4×10–7 М) и тимидина (1,6×10–5 М) производства “Sigma-Aldrich” (США), а также 2 мМ глютамина, 1 мМ пирувата натрия (“Sigma-Aldrich”, США), 1 мг/л амфотерицина В и 50 мг/л гентамицина. Суспензию распределяли по ячейкам 96-луночных планшетов для культивирования, содержащих трёхсуточную культуру мышиных макрофагов, и инкубировали в атмосфере 5-7% СО2 при температуре 37°С в течение 3 недель. После 10 суток культивирования НАТ-среду заменяли на более щадящую НТ-среду, а после 20 суток культуры поддерживали на среде RPMI-1640 с СКРС. Для удаления Ig, секретированных неслившимися спленоцитами мышей, культуральную жидкость из ячеек с растущими гибридами отбирали на 5-6, затем 10-12 и на 16-17 дни после слияния.
Стадия 6. Отбор гибридом.
Поскольку используемый штамм миеломы резистентен к 8-азагуанину, он является дефектным по ферменту гипоксантин-гуанин-фосфорибозил трансферазе, и любые не слитые с лимфоцитами миеломные клетки и любые гибриды миелома-миелома не способны выживать в среде НАТ. С другой стороны, гибриды антитело-образующих клеток друг с другом, а также гибридомы, образованные антитело-продуцирующими и миеломными клетками, могут выживать в этой среде, причём гибриды спленоцитов друг с другом имеют ограниченное время жизни (на протяжении 3-4 пассажей) и отмирают в ходе культивирования, тогда как гибридомы спленоцитов с миеломными клетками (СМ) способны к неограниченному размножению.
Стадия 7. Реклонирование и криоконсервирование гибридом.
Скрининг гибридом проводили методом твердофазного ИФА. Из большого числа активно размножающихся гибридом отбирали гибридомы, активно продуцирующие противовирусные антитела. Для этого в супернатантах гибридом определяли титры специфических антител к вирусу-иммуногену в ИФА. Вирусным материалом (очищенные концентраты), разведённым карбонатно-бикарбонатным буферным раствором (КББ) до концентрации 2-5 мкг/мл, сенсибилизировали планшеты в течение 18 часов при температуре 4°С. После отмывания несвязавшегося антигенного материала 0,01 М фосфатно-солевым буферным раствором (ФСБ) с добавлением 0,05% Tween 20 (ФСБТ), рН 7,2 вносили культуральную жидкость в ФСБТ в разведении 1:10 (при тестировании субклонов в 2-х повторах) и инкубировали 1 час при 37°С. Связавшиеся с антигеном антитела детектировали с помощью пероксидазных конъюгатов АТ к IgG мыши (“Sigma-Aldrich”, США) в ФСБТ в течение 1 часа при температуре 37°С. Пероксидазную реакцию проявляли добавлением субстратной смеси, содержащей 0,1 мг/мл 3,3’,5,5’-тетраметилбензидина (ТМБ) и 0,02% Н2О2 в ацетат-цитратном буферном растворе, рН 5,0. После остановки реакции 2N H2SO4 оптическую плотность измеряли на фотометре Multiscan FC при длине волны 450 нм.
Для последующего клонирования отобранных гибридом СМ использовали метод предельных разведений. Клетки гибридомы разводили из расчёта, чтобы на одну лунку планшета приходилось 1-2 клетки, и затем культивировали их, как выше описано, в ростовой среде в инкубаторе с подачей 5-7% СО2 при температуре 36-37°С. Процедуру клонирования повторяли 3-4 раза для каждого избранного клона, продуцирующего специфические антитела. Клоны - стабильные продуценты антител - отбирали для последующего накопления культивированием в ростовой среде с целью накопления клеток в количестве, достаточном для последующего пассажа на сингенных мышах и криоконсервирования.
Стадия 8. Криоконсервирование гибридом.
Криоконсервированию подвергали культуры гибридомных клеток, находящиеся в логарифмической фазе роста, или клетки, выращенные в перитонеальной полости мышей сингенной линии (при получении асцитных жидкостей). Перед замораживанием клетки подвергали микроскопическому анализу на жизнеспособность и бактериологическому исследованию на отсутствие контаминации микрофлорой. Количество живых клеток оценивали по эксклюзии трипанового синего. После центрифугирования при 1000 об/мин концентрацию клеток доводили до 1-2 млн в мл. Для криоконсервирования клеток использовали среду, состоящую из 90% сыворотки крупного рогатого скота и 10% ДМСО (“Sigma-Aldrich”, США). Предварительно охлаждённые до температуры –80°С в парах азота криопробирки с клетками помещали в жидкий азот (для многолетнего хранения при температуре –196°С) и хранили в Криобанке гибридом ФГБУ «НИИ гриппа им. А.А. Смородинцева» Минздрава России.
Полученные гибридомы были депонированы в специализированную коллекцию культур клеток ЦКП «Коллекция культур клеток позвоночных» 08.11.18 под номером РККК(П) 784Д (гибридома 10G6/RS) и 786Д (гибридома 11G4/RS), соответственно.
Стадия 9. Накопление МКА в асцитах.
Асцитные жидкости мышей линии BALB/c, содержащие МКА, секретируемые гибридомой, получали следующим образом. Для этого мышам-реципиентам за 12–14 дней до инокуляции гибридомы вводили внутрибрюшинно 0,5 мл пристана (“Sigma-Aldrich”, США) [Hoogenraad et al., 1983]. Восстановленные гибридомы в количестве 5–10 млн инокулировали в брюшную полость праймированных пристаном мышей. Спустя 2–3 недели после образования асцита, контролируемого визуально, делали прокол брюшной стенки и собирали оттекающую жидкость. После центрифугирования асцитов надосадочная жидкость служила источником МКА, а клетки гибридом, прошедшие пассирование на мышах, криоконсервировали. Исследования выполнялись согласно «Правилам проведения работ с использованием экспериментальных животных» (приказ № 266 МЗ РФ от 19.06.2003).
Аналогичным образом получали антитела к аденовирусу, вирусу гриппа А и В, вирусам парагриппа 2 и 3 типа.
Для их получения использовали штаммы вирусов из коллекции клеточных культур, полученные из ФГБУ «НИИ гриппа им. А.А. Смородинцева» Минздрава России (Санкт-Петербург, Россия). Для гибридизации использовали следующие штаммы вирусов гриппа А и В: A/California/07/09 (H1N1pdm09); A/Texas/50/12 (H3N2); A/Vietnam/1194/04 (H5N1) вакцинный штамм NIBRG-14; A/duck/Potsdam/1402-6/86 (H5N2); B/Brisbane/46/15; B/Massachusetts/2/12; B/Beijing/184/93; B/Phuket/3073/13. Для получения антител к вирусу парагриппа использовали штамм II ALTB cc 2056 (вирус парагриппа типа 2); штамм III V2932 (вирус парагриппа типа 3). Для получения антител к аденовирусу использовали аденовирус тип 5 (штаммы Adenoid 75 и Tonsil 99).
Пример 2
Характеристика антител
Для создания белкового биочипа были охарактеризованы 47 моноклональных антител (МКА), полученных в ФГБУ «НИИ гриппа им. А.А. Смородинцева» Минздрава России. Антитела характеризовали по специфичности (отсутствию перекрёстной реактивности) и чувствительности к искомому вирусу, а также по физико-химическим параметрам, таким как чистота полученного препарата антител и молекулярная масса тяжёлой и лёгкой цепей иммуноглобулинов. Специфичность и чувствительность антител оценивали методом ИФА, физико-химические параметры - методами хроматографии и электрофоретического разделения в полиакриламидном геле (ПААГ).
Полученные антитела характеризовали посредством хроматографии и гель-электрофореза. Результаты представлены на Фиг. 2 и 3.
Обозначения на Фиг. 3: 1-17 - исследуемые образцы МКА. Стрелками отмечены фрагменты, соответствующие компонентам IgG: ~25 кДа - лёгкая цепь, ~50 кДа - тяжёлая цепь, ~75 кДа - лёгкая + тяжёлая цепи. 1 - 6D11; 2 - 4H1; 3 - 3F8; 4 - 1E7; 5 - 4E2; 6 - 4D12; 7 - 5G4; 8 - 6B12; 9 - 4B7; 10 - 4A7; 11 - 2C6; 12 - 5D4; 13 - 3H8; 14 - 1H3; 15 - 4F2; 16 - 5F3; 17 - 5H8. М - маркеры молекулярного веса, Dual Xtra (cat. no. 1610377, “Bio-Rad”, США).
Основными критериями выбора антител были их специфичность и чувствительность к искомому антигену, а также возможность создания на их базе надёжной мультиплексной системы.
В результате клонирования и отбора культур гибридом было выделено 9 клонов МКА к ВГА. По данным иммуноблотинга все МКА взаимодействовали с белком, соответствующим по молекулярной массе NP ВГА. Для оценки способности полученных МКА взаимодействовать со штаммами различных субтипов ВГА был проведён мк-ИФА с использованием монослойных культур клеток MDCK, инфицированных вирусом. Большинство МКА взаимодействовали в мк-ИФА (микрокультуральный ИФА) с широким спектром ВГА как сезонных, так и потенциально пандемических субтипов. В качестве оптимальной пары для определения ВГА была выбрана пара F8-4H1b.
Все полученные МКА к ВГВ специфически взаимодействовали в непрямом варианте ИФА с очищенными концентратами современных ВГВ Ямагатской (B/Massachusetts/2/12 (В/М/2/12)) и Викторианской (B/Brisbane/46/15 (В/Brisbane/46/15)) эволюционных линий при отсутствии перекрёстного реагирования с гетерологичными ВГА. Полученные антитела давали более высокий сигнал, чем коммерческие антитела IB12 («Биалекса», Россия) и IB64 («Биалекса», Россия) (в тех же концентрациях). В силу того, что антитела 6G4 обладали наилучшими характеристиками и проявляли высокую аффинность к более широкому диапазону штаммов вируса гриппа B, было принято решение использовать на биочипе именно эту пару антител (6G4-6G4b).
Для антител к РСВ было получено одно МКА к ВПГ2 4А7. Определение чувствительности и специфичности очищенных МКА 4А7 проводилось в одностадийном ИФА, где сорбировался ВПГ2. После очистки МКА 4А7 сохранили свою специфичность и активность в отношении ВПГ2. К ВПГ3 было получено 3 МКА: 2C6, 5D4, 3H8. Определение чувствительности и специфичности очищенных МКА проводилось в ИФА с сорбцией ВПГ3. Очищенные МКА остались чувствительны и специфичны в отношении ВПГ3.
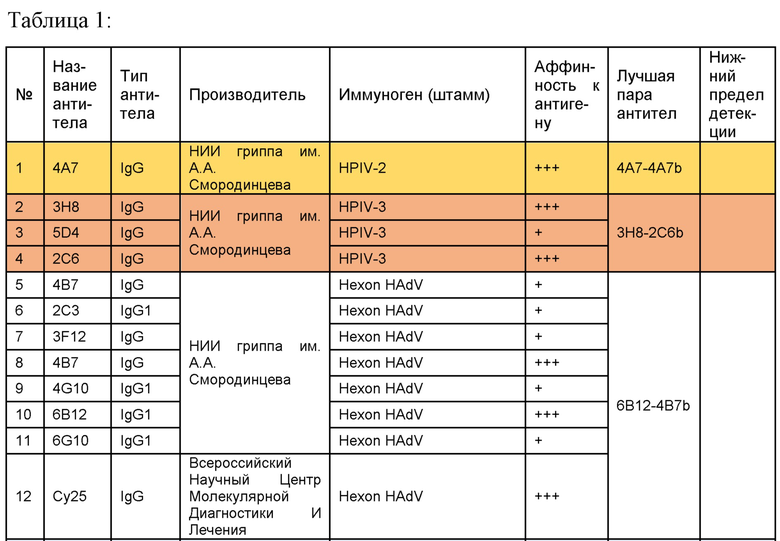
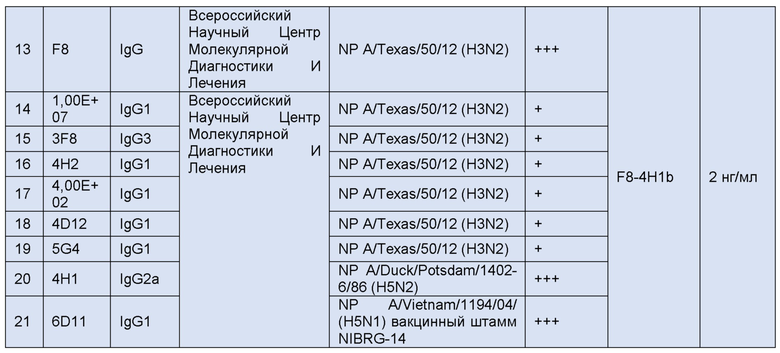
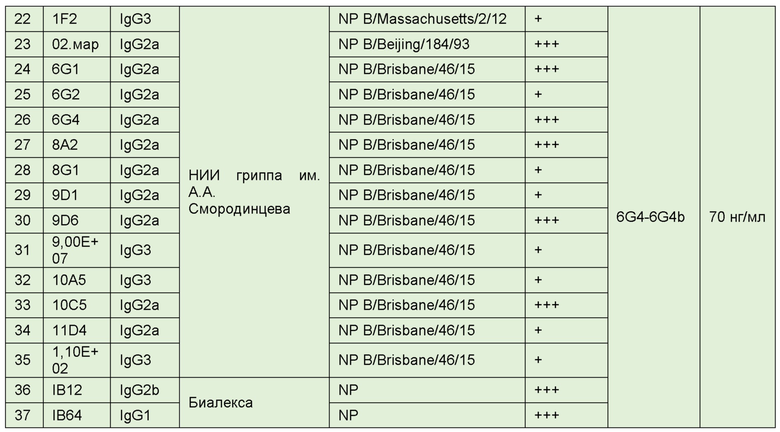
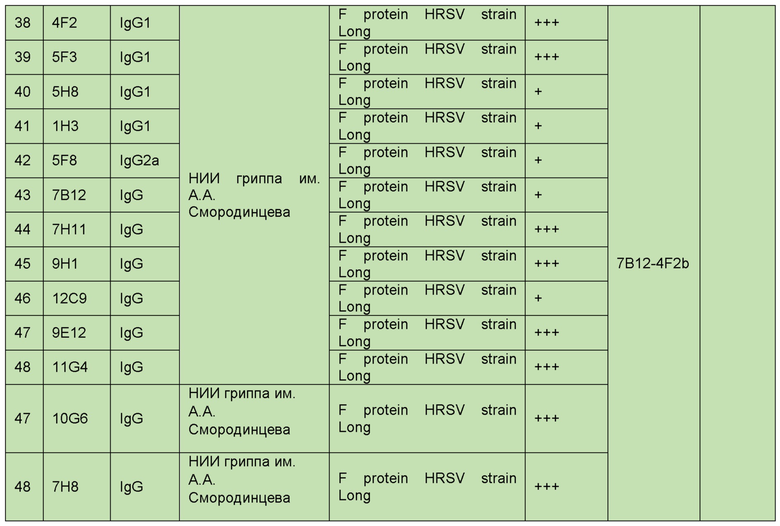
В целом, были получены и охарактеризованы следующие антитела (таблица 1).
Полученные антитела сравнивались с уже известными.
Пример 3
Нанесение выбранных антител на подложку биочипа
Моноклональные антитела (МКА) наносили на подложку биочипа, содержащую альдегидные группы, или на аминосилановую подложку, следующим образом. Использовали нанесение бесконтактным способом при помощи роботизированной системы sciFLEXARRAYER S3 robotic system (“SCIENION”, Германия). Антитела разбавляли в буферном растворе для печати, содержащем 20 мM Na2HPO4, 0,005% бромфеноловый голубой, 0,5% глицерин, до конечной концентрации 250 мкг/мл.
Для нанесения МКА на поверхность биочипа в виде круглой области (спота) диаметром 250 мкм использовали капиллярный диспенсер PDC 70 Piezo (10 капель в споте). Полученный объём антител в споте составлял 325 пиколитров.
После нанесения антител на биочип и последующего этапа их конъюгации (связывания) с активными группами подложки, заключающегося в инкубации биочипа в течение 16–20 часов во влажной камере при относительной влажности не менее 80%, проводили процесс деактивации свободных альдегидных групп биочипа. Для этого биочип обрабатывали боргидридом натрия, что приводило к восстановлению альдегидных групп и потери их способности связывать белки. Благодаря этому биочип можно было хранить без потери активности в течение 6 месяцев (при +4°C).
Все стадии гибридизации биочипов были выполнены с применением гибридизационных камер AHC4×24 и силиконовых прокладок 3×8 (“Arrayit”, США). Данные камеры позволяют при полной загрузке проводить гибридизацию до 96 образцов одновременно (по 24 образца на биочип и по 4 биочипа на гибридизационную камеру).
Изначально поверхность биочипа блокировали 1% БСА в ФСБ (блокировку проводили непосредственно перед анализом образца). Для этого добавляли 100 мкл блокирующего раствора в лунку гибридизационной камеры и инкубировали 2 часа.
При использовании двухстадийного протокола анализа гибридизацию проводили аналогично ИФА. Образцы в известных концентрациях, полученных серией двукратных разведений в ФСБ, добавляли к лункам биочипа и инкубировали при 37°C. После промывки биочипа ФСБТ к лункам добавляли 100 мкл смеси биотинилированных антител (каждое в конечной концентрации 1 мкг/мл) и инкубировали при 37°C. Затем лунки промывали ФСБТ, инкубировали со стрептавидином-Cy5 и регистрировали связывание по определению уровня флуоресцентного сигнала.
При использовании одностадийного протокола анализа 100 мкл (общий объём) смеси образца и биотинилированных антител одновременно добавляли к лункам биочипа. Конечные концентрации биотинилированных антител составляли 1 мкг/мл, конечная концентрация образца соответствовала двухстадийному протоколу. Смесь инкубировали на биочипе.
Биочипы сканировали с использованием двухцветного сканера InnoScan 710 (“Innopsys”, Франция) при следующих параметрах:
флуорофор Cy5; мощность лазера 30%; коэффициент усиления PMT 70%; сканирующее разрешение 10 мкм.
Полученные изображения обсчитывали с помощью программы Mapix Software. Дополнительную обработку данных проводили в программе Microsoft Excel. Программу GraphPad Prism использовали для статистической оценки достоверности различий полученных сигналов.
Сравнение чувствительности биочипа при проведении одностадийного и двухстадийного анализа представлены на Фиг. 4. Точками указаны средние значения (Mean) ± стандартное отклонение (SD), пунктирной линией отмечено пороговое значение флуоресценции. В качестве аналита использовали назофарингеальные смывы, полученные от здоровых волонтёров (отрицательный диагноз подтверждён методом ОТ-ПЦР), в которые был добавлен очищенный препарат ВГА.
Конечная концентрация каждого из антител в лунке была 250 мкг/мл. Общее количество антитела в каждой лунке было около 320 пиколитров.
На Фиг. 1 представлены схемы полученной тест-системы:
A - Общий вид полученного белкового биочипа;
B - Схема субэррея;
С - Отсканированное изображение субэррея после печати на канале 635 нм (флуорофор Cy5) при следующих параметрах: мощность лазера - низкая, PMT = 10%, сканирующее разрешение - 15 мкм, скорость сканирования 35;
D - Порядок расположения антител в субэррее.
Пример 4
Оценка специфичности антител на биочипе
Для исследования специфичности разрабатываемого метода в лунки биочипа вносили вирусы, по одному в каждую лунку, в высоких концентрациях, позволяющих оценить степень неспецифического связывания используемых в тест-системе антител. Результаты представлены на Фиг. 6. По оси абсцисс отмечены вирусы, которые вносили в лунки биочипа (представлено 6 независимых лунок), цветом показаны сигналы RFU, соответствующие регистрируемому вирусу (расшифровка представлена справа от диаграммы). Пунктирной линией отмечено пороговое значение RFU, ниже которого все значения считаются отрицательными.
Как видно из полученных результатов, разработанный биочип обладает достаточно высокой специфичностью. Несмотря на наличие слабых сигналов, полученных от антител, неспецифически связывающихся с внесёнными вирусными мишенями, их уровень достаточно низкий и не преодолевает порогового значения RFU.
Пример 5
Использование лизирующего буферного раствора для пробоподготовки
Для повышения эффективности тест-системы были проведены исследования по предварительной обработке клинических образцов лизирующим буферным раствором. В качестве опытных буферных растворов были использованы: ДСН на ФСБТ, Тритон X-100 на 100 мМ Трис-HCl и дезоксихолат натрия на ФСБ, содержащие от 0,025% до 1% ПАВ.
Результаты анализа на примере ВГА в концентрациях 4, 8 и 16 нг/мл (по тотальному белку), с использованием и без использования лизирующего буферного раствора, представлены на Фиг. 5.
Результаты анализа на примере ВГА в концентрациях 10, 20 и 50 нг/мл (по тотальному белку), с использованием различных лизирующих буферных растворов, представлены на Фиг. 5А.
Пример 6
Применение тест-системы для анализа клинических образцов
Для апробации биочипа на клинических образцах было проведено исследование назофарингеальных смывов у 30 пациентов с диагнозом ОРЗ в эпидемический сезон 2018-2019 гг. Для подтверждения клинического диагноза проводили первичную диагностику биологических проб методом ПЦР на 12 патогенов, в частности: грипп А (в том числе проводили субтипирование), грипп B, парагрипп 2 и 3 типа, аденовирус, РС-вирус, бокавирус, метапневмовирус, коронавирус, риновирус, а также бактериальные инфекции S. pneumoniae, N. meningitis и H. influenzae. Далее полученные образцы анализировали на биочипе. Результат анализа на биочипах не выявил ложноположительных результатов.
Изображение биочипа согласно изобретению после гибридизации с образцами от пациентов представлено на Фиг. 7. Обозначения: 1 - образец, содержащий ВГА (подтверждено методом ПЦР), 2 - образец, содержащий ВГА (подтверждено методом ПЦР), 3 - образец, не содержащий ВГА, ВГБ, РСВ, АдВ и ВПГ-2 или ВПГ-3 (согласно методу ПЦР).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ДИАГНОСТИКИ ВОЗБУДИТЕЛЕЙ ОСТРЫХ РЕСПИРАТОРНЫХ ВИРУСНЫХ ИНФЕКЦИЙ | 2019 |
|
RU2726797C1 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА, СПЕЦИФИЧНЫЕ К РАЗЛИЧНЫМ ШТАММАМ РЕСПИРАТОРНО-СИНЦИТИАЛЬНОГО ВИРУСА | 2018 |
|
RU2713340C1 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА, СПЕЦИФИЧНЫЕ К РАЗЛИЧНЫМ ШТАММАМ ВИРУСА ГРИППА В | 2018 |
|
RU2714246C1 |
| Штамм гибридных клеток животных Mus musculus 1F1 - продуцент моноклонального антитела к нуклеокапсидному белку N вируса SARS-CoV-2 | 2021 |
|
RU2769817C1 |
| ПРИМЕНЕНИЕ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ ДЛЯ ИДЕНТИФИКАЦИИ ЯМАГАТСКОЙ ИЛИ ВИКТОРИАНСКОЙ ЭВОЛЮЦИОННЫХ ЛИНИЙ ВИРУСА ГРИППА ТИПА В, ШТАММ ГИБРИДОМЫ 4Н7 ДЛЯ ПОЛУЧЕНИЯ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ, ПРЕДНАЗНАЧЕННЫХ ДЛЯ ОПРЕДЕЛЕНИЯ ВИРУСОВ ГРИППА В ЯМАГАТСКОЙ ВЕТВИ, ШТАММ ГИБРИДОМЫ В/4Н1 ДЛЯ ПОЛУЧЕНИЯ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ, ПРЕДНАЗНАЧЕННЫХ ДЛЯ ОПРЕДЕЛЕНИЯ ВИРУСОВ ГРИППА В ВИКТОРИАНСКОЙ ВЕТВИ | 2011 |
|
RU2491338C2 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ РЕСПИРАТОРНЫХ ВИРУСНЫХ ИНФЕКЦИЙ МЕТОДОМ МУЛЬТИПЛЕКСНОЙ ПЦР С ДЕТЕКЦИЕЙ В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ И ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2010 |
|
RU2460803C2 |
| Штамм гибридных клеток животных Mus musculus 2E1B5 - продуцент моноклонального антитела к рецептор-связывающему домену белка S вируса SARS-CoV-2 | 2021 |
|
RU2771288C1 |
| Моноклональные антитела с ориентировкой на антиген Р респираторно-синцитиального вируса человека, получаемые и секретируемые из клеточных гибридом, используемые для обнаружения и диагностики инфекции, вызываемой респираторно-синцитиальным вирусом | 2016 |
|
RU2716990C2 |
| Моноклональное антитело, специфичное к вирусу Эбола | 2018 |
|
RU2705763C1 |
| СПОСОБ ВЫЯВЛЕНИЯ АНТИТЕЛ - ИММУНОГЛОБУЛИНОВ КЛАССА G В СЫВОРОТКЕ КРОВИ К ВОЗБУДИТЕЛЯМ ТЯЖЕЛЫХ ОСТРЫХ РЕСПИРАТОРНЫХ ВИРУСНЫХ ИНФЕКЦИЙ, ВКЛЮЧАЯ SARS-COV-2, С ОДНОВРЕМЕННЫМ ПРОГНОЗОМ ТЯЖЕСТИ ПРОТЕКАНИЯ КОРОНАВИРУСНОЙ ИНФЕКЦИИ COVID-19, НА ГИДРОГЕЛЕВОМ БИОЧИПЕ | 2020 |
|
RU2746815C1 |

Настоящее изобретение относится к средствам диагностики вирусных инфекций. Многопараметрическая диагностическая тест-система, предназначенная для одновременного дифференциального обнаружения путём иммунофлуоресцентного анализа вирусов следующих типов: вирусов гриппа А и В, циркулирующих преимущественно в человеческой популяции, аденовируса, респираторно-синцитиального вируса, вирусов парагриппа 2 и 3 типа, включает белковый чип для одновременного определения указанных вирусов в образце, содержащая антитела к вирусам гриппа А и В, аденовирусу, респираторно-синцитиальному вирусу, вирусам парагриппа 2 и 3 типа, в концентрации 250 мкг/мл каждого из указанных типов антител, лизирующий буферный раствор для пробоподготовки образцов, растворы для двухэтапной блокировки чипа, включающие раствор для первого этапа, представляющий собой 0,4% NaHB4, 20% этанол в ФСБ, и раствор для второго этапа, включающий 1% БСА в 20 мМ Na2HPO4, pH 8,5, используемый непосредственно перед анализом образца, при этом белковый чип представляет собой подложку с альдегидными группами или аминосилановую подложку, а антитела к вирусам гриппа А и В, аденовирусу, респираторно-синцитиальному вирусу, вирусам парагриппа 2 и 3 типа получали следующим образом: получение антитело-продуцирующих спленоцитов; накопление клеток мышиной миеломы; слияние антитело-продуцирующих спленоцитов с миеломными клетками; отбор гибридом; инокуляцию клеток гибридомы в брюшную полость праймированных пристаном мышей; накопление моноклональных антител в асцитах; очистку полученных моноклональных антител. Изобретение обеспечивает быстрое и точное определение типа вирусов. 3 з.п. ф-лы, 8 ил., 1 табл., 6 пр.
1. Многопараметрическая диагностическая тест-система, предназначенная для одновременного дифференциального обнаружения путём иммунофлуоресцентного анализа вирусов следующих типов:
вирусов гриппа А и В, циркулирующих преимущественно в человеческой популяции, аденовируса, респираторно-синцитиального вируса, вирусов парагриппа 2 и 3 типа,
включающая белковый чип для одновременного определения указанных вирусов в образце, содержащая антитела к вирусам гриппа А и В, аденовирусу, респираторно-синцитиальному вирусу, вирусам парагриппа 2 и 3 типа, в концентрации 250 мкг/мл каждого из указанных типов антител,
лизирующий буферный раствор для пробоподготовки образцов,
растворы для двухэтапной блокировки чипа, включающие раствор для первого этапа, представляющий собой 0,4% NaHB4, 20% этанол в ФСБ, и раствор для второго этапа, включающий 1% БСА в 20 мМ Na2HPO4, pH 8,5, используемый непосредственно перед анализом образца,
при этом белковый чип представляет собой подложку с альдегидными группами или аминосилановую подложку, а антитела к вирусам гриппа А и В, аденовирусу, респираторно-синцитиальному вирусу, вирусам парагриппа 2 и 3 типа получали следующим образом:
- получение антитело-продуцирующих спленоцитов;
- накопление клеток мышиной миеломы;
- слияние антитело-продуцирующих спленоцитов с миеломными клетками;
- отбор гибридом;
- инокуляцию клеток гибридомы в брюшную полость праймированных пристаном мышей;
- накопление моноклональных антител в асцитах;
- очистку полученных моноклональных антител.
2. Тест-система по п. 1, отличающаяся тем, что образец для анализа представляет собой назофарингеальный смыв, мазок из носовой полости, носоглоточную жидкость или выделенный образец антигена, при этом образец обрабатывают лизирующим буферным раствором перед внесением в тест-систему.
3. Тест-система по п. 1, отличающаяся тем, что содержит антитела для определения вирусов гриппа А, вирусов гриппа В двух линий - Викторианской и Ямагатской, аденовируса, респираторно-синцитиального вируса, вирусов парагриппа 2 и 3 типа, в концентрации 250 мкг/мл.
4. Тест-система по пп. 1, 2, отличающаяся тем, что лизирующий буферный раствор представляет собой ДСН на ФСБТ, Тритон X-100 на 100 мМ Трис-HCl и дезоксихолат натрия на ФСБ, с концентрацией от 0,025 до 1% ПАВ.
| US 2003130497 A1, 10.07.2003 | |||
| МНОГОПАРАМЕТРИЧЕСКАЯ ДИАГНОСТИЧЕСКАЯ ТЕСТ-СИСТЕМА, ПРЕДНАЗНАЧЕННАЯ ДЛЯ ОБНАРУЖЕНИЯ И МОНИТОРИНГА ТЕРАПИИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ И РАКА ЯИЧНИКОВ, И СПОСОБ ПРОВЕДЕНИЯ АНАЛИЗА С ЕЕ ИСПОЛЬЗОВАНИЕМ | 2014 |
|
RU2599890C2 |
| ДИАГНОСТИЧЕСКИЕ И ТЕРАПЕВТИЧЕСКИЕ СПОСОБЫ | 2010 |
|
RU2559584C2 |
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| Прибор для промывания газов | 1922 |
|
SU20A1 |
Авторы
Даты
2020-10-01—Публикация
2019-12-23—Подача