Описание
Настоящее изобретение относится к химиотерапевтическому средству против рака (называемому далее в данном описании «химиотерапевтическое средство против рака») и конкретнее, к химиотерапевтическому средству против рака, в котором используются производное холестанола и противораковое средство в комбинации.
Уровень техники
До настоящего времени разработано и классифицированно на основании структуры, механизма действия и т.д. множество противораковых средств, используемых в химиотерапии против рака, которая является одним из способов лечения рака. Однако эффективность таких противораковых средств, используемых в виде отдельного средства, является неудовлетворительной. Действительно, в последние годы преимущественно осуществляют полилекарственную терапию с использованием нескольких противораковых средств с точки зрения подавления вредного побочного действия, и была признана эффективность полилекарственной терапии.
В таких условиях желательны как разработка новой противораковой комбинированной терапии, которая имеет меньшее побочное действие, чем обычная химиотерапия, так и разработка новых химиотерапевтических средств для применения в химиотерапии.
Между тем, ранее обнаружено, что производное холестанола, в котором с холестанолом (соединение, в котором двойная связь в цикле В холестерина является насыщенной) связывается сахарная цепь, такая как GlcNAc-Gal-, GlcNAc-Gal-Glc-, Fuc-Gal-, Gal-Glc-, Gal- или GlcNAc-, обладает исключительной противоопухолевой активностью (патентные документы 1-4).
Однако, не сообщается о случаях, когда вышеуказанные производные холестанола и другое противораковое средство использовались бы в комбинации.
Патентный документ 1 - JP-A-2000-191685
Патентный документ 2 - JP-A-1999-60592
Патентный документ 3 - WO 2005/007172 (публикация)
Патентный документ 4 - WO 2007/026869 (публикация)
Раскрытие изобретения
Проблемы, решаемые изобретением
Таким образом, настоящее изобретение относится к химиотерапевтическому средству против рака, которое обладает меньшим побочным действием и превосходной активностью.
Способы решения проблемы
С учетом вышеописанного, авторы настоящего изобретения осуществили широкие исследования и обнаружили, что существенно потенцированного противоракового действия можно добиться посредством использования в комбинации производного холестанола, представленного формулой (1), или его соединения включения с циклодекстрином, и известного химиотерапевтического средства (противоракового средства), и, в соответствии с этим, комбинированное использование указанных фармацевтических средств в химиотерапии против рака является весьма применимым.
Соответственно, настоящее изобретение относится к указанному далее в разделах (1)-(10).
(1) Химиотерапевтическое средство против рака, включающее в комбинации производное холестанола, представленное формулой (1)
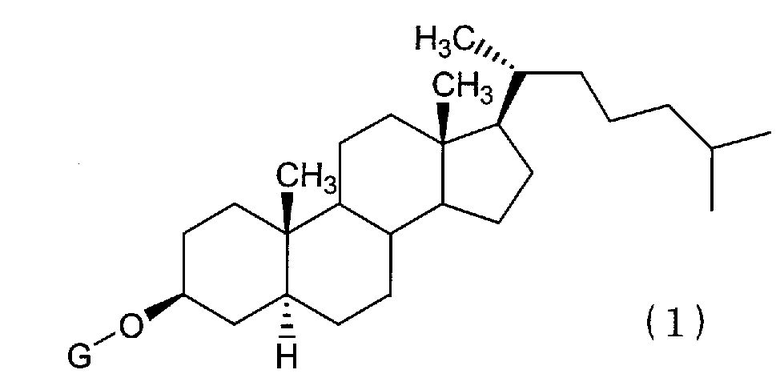
(где G представляет собой GlcNAc-Gal-, GlcNAc-Gal-Glc-, Fuc-Gal-, Gal-Glc-, Gal- или GlcNAc-), или его соединение включения с циклодекстрином и противораковое средство.
(2) Химиотерапевтическое средство против рака согласно разделу (1), изложенному выше, где в формуле (1) G представляет собой GlcNAc-Gal- или GlcNAc-.
(3) Химиотерапевтическое средство против рака согласно разделу (1) или (2), изложенным выше, где противораковое средство представляет собой один или несколько видов средств, выбранных из группы, состоящей из противоракового средства, представляющего собой таксан, противоракового средства, представляющего собой комплекс платины, соединения пеметрекседа и фторурацила.
(4) Химиотерапевтическое средство против рака согласно разделу (3), изложенному выше, где противораковое средство представляет собой один или несколько видов средств, выбранных из группы, состоящей из паклитаксела, доцетаксела, алимты, 5-FU, цисплатина и оксалиплатина.
(5) Химиотерапевтическое средство против рака согласно любому из разделов (1)-(4), изложенным выше, которое представляет собой смешанное средство.
(6) Химиотерапевтическое средство против рака согласно любому из разделов (1)-(4), изложенным выше, которое находится в форме набора, включающего лекарственное средство, содержащее производное холестанола, и лекарственное средство, содержащее противораковое средство.
(7) Химиотерапевтическое средство против рака согласно разделу (6), изложенному выше, где лекарственное средство, содержащее производное холестанола, представляет собой липосомальную композицию.
(8) Применение в комбинации производного холестанола, представленного формулой (1)

(где G представляет собой GlcNAc-Gal-, GlcNAc-Gal-Glc-, Fuc-Gal-, Gal-Glc-, Gal- или GlcNAc-), или его соединения включения с циклодекстрином и противоракового средства для получения химиотерапевтического средства против рака.
(9) Противораковая химиотерапия, характеризующаяся введением пациенту, нуждающемуся в этом, производного холестанола, представленного формулой (1)

(где G представляет собой GlcNAc-Gal-, GlcNAc-Gal-Glc-, Fuc-Gal-, Gal-Glc-, Gal- или GlcNAc-), или его соединения включения с циклодекстрином и противоракового средства в комбинации.
(10) Противораковая химиотерапия согласно разделу (9), изложенному выше, где производное холестанола или его соединение включения с циклодекстрином и противораковое средство вводят пациенту, нуждающемуся в этом, одновременно или раздельно с интервалами.
Эффекты изобретения
При использовании химиотерапевтического средства против рака и противораковой химиотерапии согласно настоящему изобретению можно осуществлять профилактику или лечение рака безопасно и с высокой эффективностью.
Краткое описание чертежей
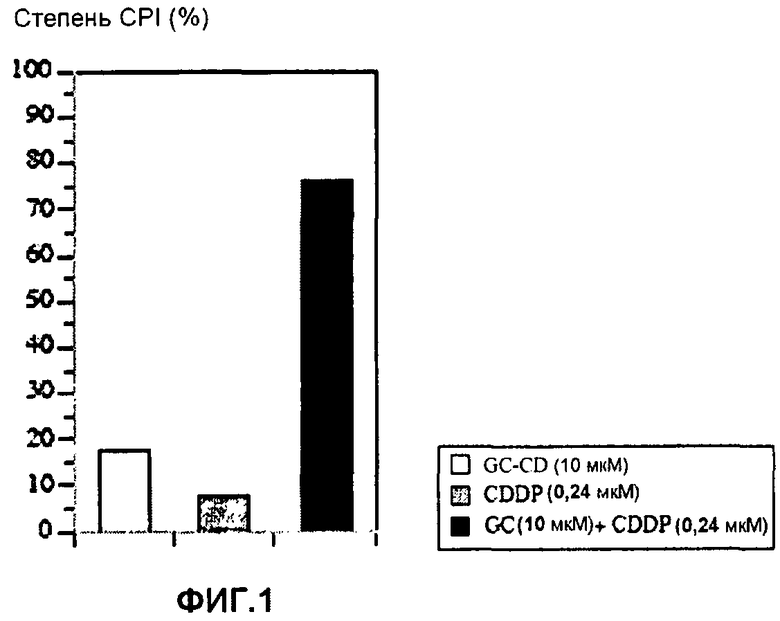
Фиг.1 представляет собой диаграмму, показывающую ингибирующее пролиферацию клеток действие CDDP, GC-CD и CDDP + GC-CD на клетки colon26;
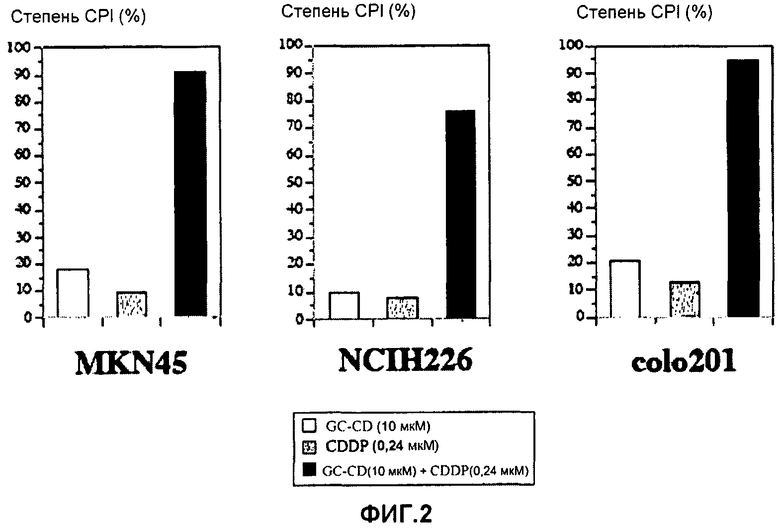
фиг.2 представляет собой диаграмму, показывающую ингибирующее пролиферацию клеток действие CDDP, GC-CD и CDDP + GC-CD на клетки MKN45, клетки NCIH226 или клетки colo201;
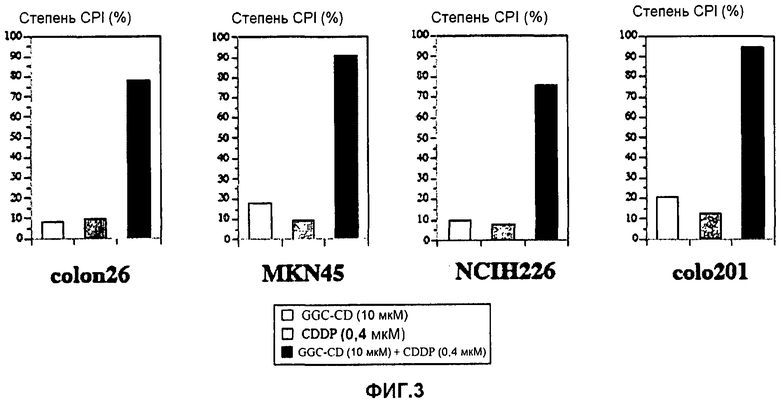
фиг.3 представляет собой диаграмму, показывающую ингибирующее пролиферацию клеток действие CDDP, GGC-CD и CDDP + GGC-CD на клетки colon26, клетки MKN45, клетки NCIH226 или клетки colo201;
фиг.4 представляет собой диаграмму, показывающую противоопухолевое действие однократного введения CDDP, GC-CD и CDDP + GC-CD против перитонеальной диссеминации, вызванной клетками colon26, инокулированными мышам интраперитонеально;
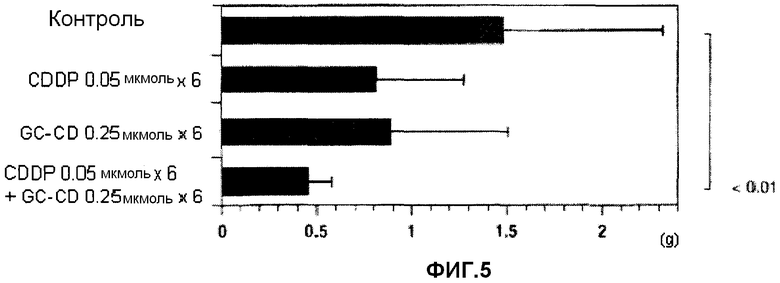
фиг.5 представляет собой диаграмму, показывающую противоопухолевое действие нескольких введений CDDP, GC-CD и CDDP + GC-CD против перитонеальной диссеминации, вызванной клетками colon26, инокулированными мышам интраперитонеально;
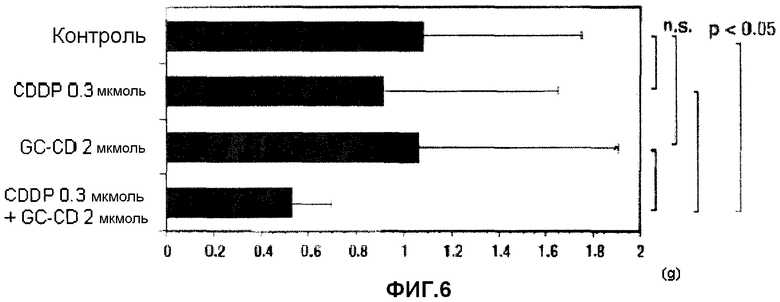
фиг.6 представляет собой диаграмму, показывающую противоопухолевое действие однократного отсроченного введения CDDP, GC-CD и CDDP + GC-CD против перитонеальной диссеминации, вызванной клетками colon26, инокулированными мышам интраперитонеально, после подтверждения перитонеальной диссеминации на мезотелии мышей;
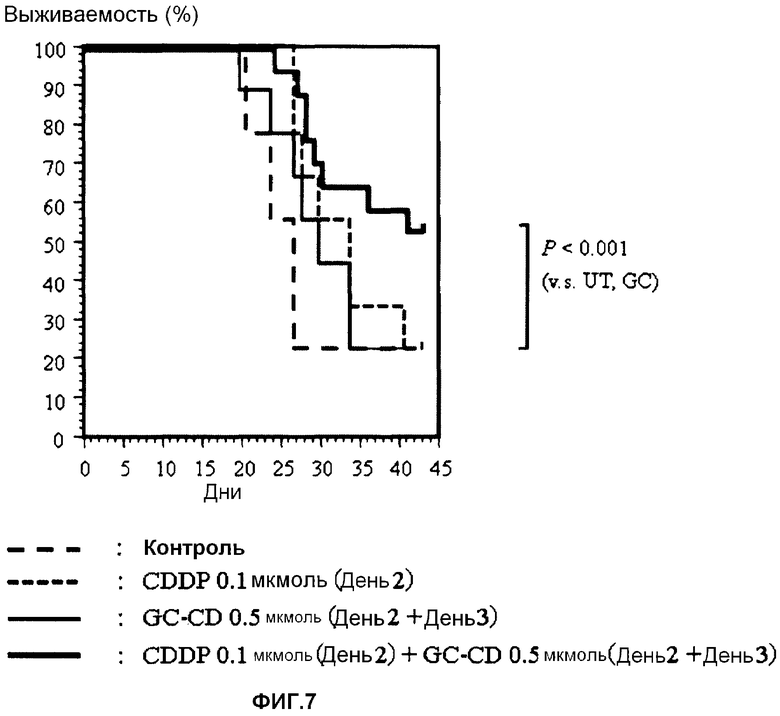
фиг.7 представляет собой график, показывающий коэффициент выживаемости мышей, которым инокулированы интраперитонеально клетки colon26, после однократного введения CDDP, GC-CD или CDDP + GC-CD (однократного введения CDDP и двойного введения GC-CD, соответственно);
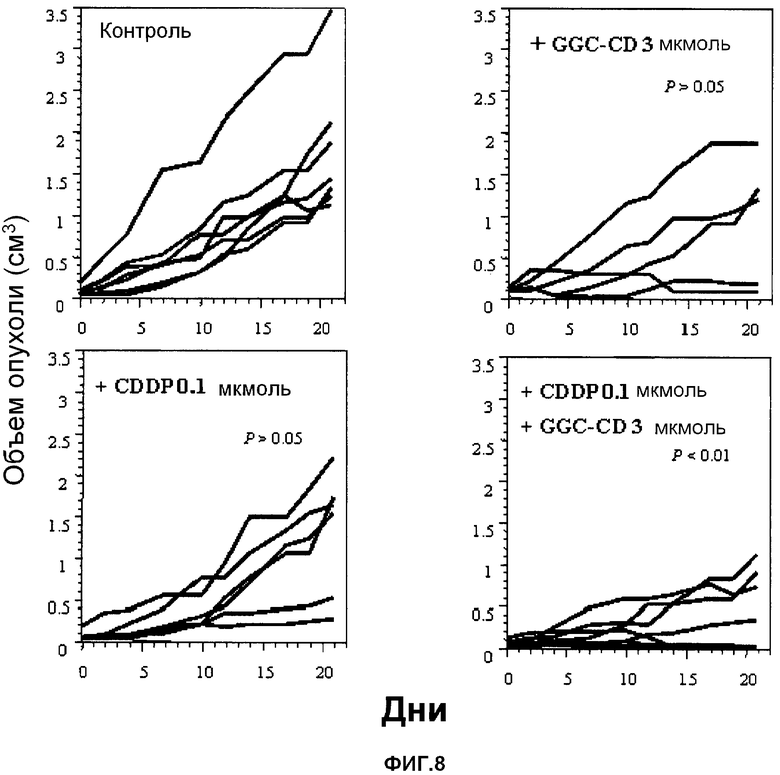
фиг.8 представляет собой графики, показывающие эффект подавления или снижения роста опухоли у мышей, которым подкожно инокулированы клетки colon26, после однократного введения CDDP, GGC-CD или CDDP + GGC-CD; и
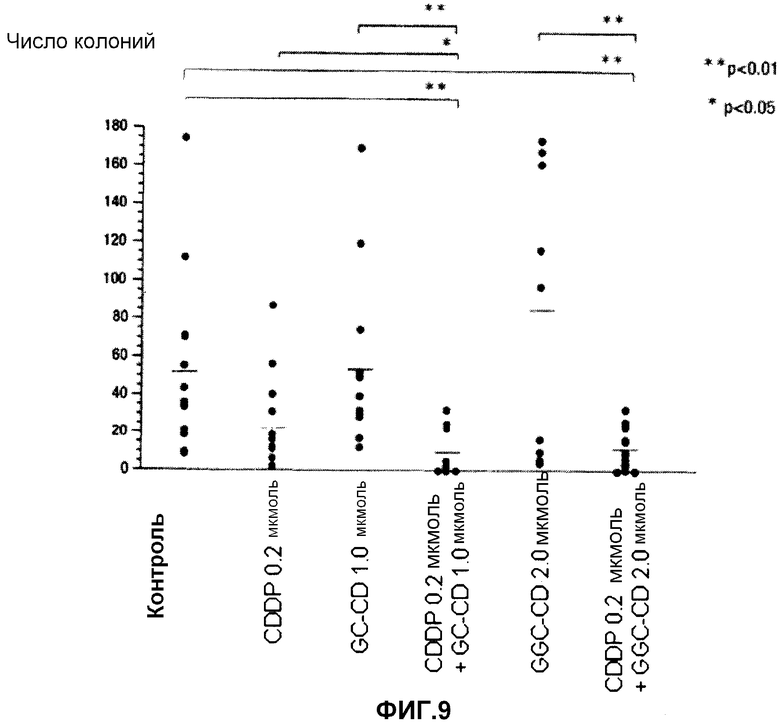
фиг.9 представляет собой диаграмму, показывающую действие ингибирования метастазирования клеток colon26 в легкое после однократного введения CDDP, GC-CD, GGC-CD, CDDP + GC-CD и CDDP + GGC-CD.
Подробное описание предпочтительных воплощений
Конретными производными холестанола, представленными формулой (1) и используемыми в настоящем изобретении, являются все известные соединения.
В производных холестанола, которые представлены формулой (1), и в которых G представляет собой GlcNAc-Gal-, G предпочтительно представляет собой GlcNAcβ1,3-Galβ- или GlcNAcβ1,4-Galβ-. В производных холестанола (1), в которых G представляет собой GlcNAc-Gal-Glc-, G предпочтительно представляет собой GlcNAcβ1,3-Galβ1,4-Glc-. В производных холестанола (1), в которых G представляет собой Fuc-Gal-, G предпочтительно представляет собой Fucβ1,3Gal-. В производных холестанола (1), в которых G представляет собой Gal-Glc-, G предпочтительно представляет собой Galβ1,4Glcβ-. В производных холестанола (1), в которых G представляет собой Gal-, G предпочтительно представляет собой Galβ-. В производных холестанола (1), в которых G представляет собой GlcNAc-, G предпочтительно представляет собой GlcNAcβ-.
Из указанных соединений более предпочтительны виды, в которых G представляет собой GlcNAc-Gal- и GlcNAc-, причем еще более предпочтительными являются соединения, в которых G представляет собой GlcNAcβ1,4-Galβ- и GlcNAcβ-.
Вышеуказанные производные холестанола можно получить, например, способом, раскрытом в вышеупомянутых патентных документах 1-4, или подобным способом.
Производное холестанола, представленное формулой (1), легко образует комплекс включения с циклодекстрином или его производным. Таким образом, производное холестанола, используемое в настоящем изобретении, может представлять собой его соединение включения с циклодекстрином. При образовании таких соединений включения необходимо принимать во внимание размер молекулы-гостя, ван-дер-ваальсово взаимодействие между молекулой-гостем и циклодекстрином и водородные связи между гидроксильными группами циклодекстрина и молекулы-гостя. Поэтому не всегда нерастворимые соединения-гости образуют соответствующие соединения включения. Однако производное холестанола по настоящему изобретению может образовывать с циклодекстрином подходящие комплексы включения.
Примеры циклодекстрина, образующего соединение включения с циклодекстрином по настоящему изобретению, включают такие циклодекстрины, как α-циклодекстрин, β-циклодекстрин и γ-циклодекстрин; и производные циклодекстрина, такие как метил-β-циклодекстрин, 2-гидроксипропил-β-циклодекстрин, моноацетил-β-циклодекстрин и 2-гидроксипропил-γ-циклодекстрин. Из них предпочтителен 2-гидроксипропил-β-циклодекстрин для получения улучшенной растворимости.
Соединение включения с циклодекстрином можно получить, например, следующей процедурой: получают водный раствор циклодекстрина или его производного соответствующей концентрации (например, 20-40%), и к водному раствору добавляют производное холестанола по настоящему изобретению с последующим перемешиванием полученной смеси.
Определенное ограничение по концентрации раствора производного холестанола (1) не ставится до тех пор, пока производное холестанола может образовывать соединение включения с циклодекстрином. Как правило, концентрация составляет от примерно 1 до примерно 50 мас.%, предпочтительно, от примерно 10 до примерно 30 мас.%.
Полученное таким образом соединение включения с циклодекстрином является высоко водорастворимым и поэтому эффективно проявляет действие гостя in vivo. Другим преимуществом соединения включения с циклодекстрином является обеспечение совместимости результатов испытаний in vitro.
С другой стороны, производное холестанола (1) можно получить в липосомальной композиции, посредством чего производное холестанола может быть эффективнее доставлено в место воздействия. Другим преимуществом соединения включения с циклодекстрином является обеспечение совместимости результатов испытаний in vitro.
Предпочтительно, липосомальная композиция включает производное холестанола по настоящему изобретению, мембранный компонент и алифатический или ароматический амин.
Содержание производного холестанола в липосомальной композиции составляет предпочтительно 0,3-2,0 моль, предпочтительнее, 0,8-1,5 моль на 1 моль мембранного компонента.
Мембранный компонент может представлять собой фосфолипид. Конкретные примеры предпочтительно используемых фосфолипидов включают природные и синтетические фосфолипиды, такие как фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин, фосфатидилинозит и фосфатидная кислота; их смеси и модифицированные природные фосфолипиды, такие как водный лецитин. Примеры более предпочтительных видов включают фосфатидилхолин (1α-дипальмитоилфосфатидилхолин (DPPC)).
Алифатический или ароматический амин используют, главным образом, для создания положительного заряда на поверхности липидной мембраны. Примеры таких аминов включают алифатические амины, такие как стеариламин и олеиламин, и ароматические амины, такие как флуорениламин. Из них особенно предпочтительным для использования является стеариламин.
Предпочтительно амин содержится в количестве 0,04-0,15 моль, предпочтительнее, 0,1-0,15 моль на 1 моль мембранного компонента (фосфолипида).
Кроме вышеуказанных компонентов, при необходимости, липосома также может содержать стбилизатор структуры мембраны, такой как холестерин, жирная кислота, диацетилфосфат и т.д.
Водный раствор, предпочтительно используемый для диспергирования мембранного компонента, представляет собой, предпочтительно, воду, физиологический раствор, буферный раствор, водный раствор сахара или их смесь. Можно использовать или органический или неорганический буфер, до тех пор, пока буфер оказывает буферирующее действие вблизи концентрации ионов водорода в жидкости организма. Примеры таких буферов включают фосфатный буфер.
Не ставится особого ограничения в отношении способа получения липосомальной композиции, и как правило, можно выбрать известные способы. Примеры способа, который можно использовать, включают способы, раскрытые в JP-A-1982-82310, JP-A-1985-12127, JP-A-1985-58915, JP-A-1989-117824, JP-A-1989-167218, JP-A-1992-29925 и JP-A-1997-87168; способ, раскрытый в Methods of Biochemical Analysis (1988), 33, p.337; или способ, раскрытый в «Liposome» (опубликовано Nankodo).
Не ставится особого ограничения в отношении противоракового средства, которое используют в комбинации с производным холестанола, представленным формулой (1), или его соединением включения с циклодекстрином, и могут быть использованы известные химиотерапевтические средства против рака. Предпочтительно использовать стандартные терапевтические средства, которые установлены в отношении таргеттной терапии рака.
Конкретные примеры включают алкилирующие средства, такие как циклофосфамид, ифосфамид, мелфалан (L-PAM), бусульфан и карбохион; антагонисты метаболизма, такие как 6-меркаптопурин (6-МР), метотрексат (МТХ), 5-фторурацил (5-FU), тегафур, эноцитабин (ВНАС) и антагонисты метаболизма фолиевой кислоты (соединения пеметрекседа (алимта, МТА), и т.д.); канцеростатические антибиотки, такие как актиномицин D, даунорубицин, блеомицин, пепломицин, митомицин С, акларубицин и неокарциностатин (NCS); растительные алкалоиды, такие как винкристин, виндезин, винбластин, и таксановые противораковые средства (таксотер (доцетаксел) и таксол (паклитаксел, TXL), и т.д.); и соединения платины, такие как цисплатин (CDDP) и карбоплатин, оксалиплатин (L-OHP). Указанные противораковые средства можно использовать одни или в комбинации двух или более средств.
Как показано в примерах, описанных в данном описании ниже, когда производное холестанола, представленное формулой (1), или его соединение включения с циклодекстрином используют в комбинации с противораковым средством, пролиферация раковых клеток различных типов существенно подавляется по сравнению со случаем введения только одного средства. Следовательно, такая комбинированная химиотерапия может радикально усилить терапевтическую эффективность и ослабление побочного действия, и фармацевтический продукт, содержащий указанные ингредиенты, является применимым химиотерапевтическим средством против рака.
Не ставится особого ограничения в отношении рака, который можно эффективно лечить посредством введения химиотерапевтического средства против рака по настоящему изобретению. Примеры рака как мишени включают злокачественные опухоли, такие как рак желудка, рак толстой кишки, рак поджелудочной железы, рак матки, рак яичников, рак легких, рак желчного пузыря, рак пищевода, рак печени, рак молочной железы, мезотелиома и рак предстательной железы.
Форма химиотерапевтического средства против рака по настоящему изобретению может представлять собой смешанное средство, в котором вышеуказанные ингредиенты смешаны в соответствующем отношении, каждое в эффективном количестве, с образованием единой лекарственной формы (однокомпозиционный тип), или может представлять собой набор, который состоит из соответствующих лекарственных форм вышеуказанных ингредиентов, каждая из которых сформирована независимо, причем каждая включает эффективное количество, и который дает возможность вводить лекарственные формы одновременно или раздельно с интервалами (двухкомпозиционный тип).
Подобно обычным фармацевтическим композициям, не ставится особого ограничения в отношении лекарственной формы вышеуказанной композиции, и форма может представлять сообой любую твердую форму, такую как таблетка, жидкую форму, такую как инъекция, сухой порошок, который растворяют перед применением, и т.д.
Композицию можно получить способом, известным в технике. Также можно использовать все фармацевтически приемлемые носители (эксципиенты или разбавители, такие как наполнитель, вещество, придающее объем, и связующее вещество), обычно используемые в технике.
Например, пероральную твердую форму можно получить, смешивая лекарственные ингредиенты по настоящему изобретению с эксципиентом и необязательными связующим веществом, веществом, способствующим рассыпанию, смазывающим веществом, красителем, корригентом, отдушкой и т.д., и формируя смесь в таблетки, таблетки с покрытием, гранулы, порошок, капсулы и т.д. способом, известным в технике. Такие добавки могут представлять собой добавки, обычно используемые в технике. Примеры эксципиента включают лактозу, сахарозу, хлорид натрия, глюкозу, крахмал, карбонат кальция, каолин, микрокристаллическую целлюлозу и кремниевую кислоту. Примеры связующего вещества включают воду, этанол, пропанол, обычный сироп, раствор глюкозы, раствор крахмала, раствор желатина, карбоксиметилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилкрахмал, метилцеллюлозу, этилцеллюлозу, шеллак, фосфат кальция и поливинлпирролидон. Примеры вещества, способствующего рассыпанию, включают сухой крахмал, альгинат натрия, порошок агара, гидрокарбонат натрия, карбонат кальция, лаурилсульфат натрия, моноглицерилстеарат и лактозу. Примеры смазывающего вещества включают очищенный тальк, стеараты, боракс и полиэтиленгликоль. Примеры корригента включают сахарозу, цедру апельсина, лимонную кислоту и винную кислоту.
Пероральную жидкую композицию можно получить, смешивая лекарственные ингредиенты по настоящему изобретению с корригентом, буфером, стабилизатором, отдушкой и т.д., и формируя смесь в жидкость для внутреннего применения, сироп, эликсир и т.д., способом, известным в технике. Корригент, используемый в препарате, может представлять собой любой из вышеперечисленных корригентов. Примеры буфера включают цитрат натрия. Примеры стабилизатора включают трагакант, аравийскую камедь и желатин.
Растворы для инъекции можно получить, смешивая лекарственные ингредиенты по настоящему изобретению с такими добавками, как регулятор рН, буфер, стабилизатор, средство для регулирования тоничности и местное анестезирующее средство, и т.д., и формируя смесь способом, известным в технике, и получая посредством этого жидкости для подкожной, внутримышечной и внутривенной инъекции. Примеры регулятора рН и буфера включают цитрат натрия, ЭДТК, тиогликолевую кислоту и тиолуксусную кислоту. Примеры местного анестезирующего средства включают гидрохлорид прокаина и гидрохлорид лидокаина. Примеры средства для регулирования тоничности включают хлорид натрия и глюкозу.
Суппозитории можно получить, смешивая лекарственные ингредиенты по настоящему изобретению с носителем для препарата, известным в технике, таким как полиэтиленгликоль, ланолин, масло какао и триглицерид жирной кислоты, и с необязательным поверхностно-активным веществом, таким как твин (зарегистрированный торговый знак), и формируя смесь в суппозитории способом, известным в технике.
Мази можно получить, смешивая лекарственные ингредиенты по настоящему изобретению с необязательными добавками, обычно используемыми в технике, такими как основа, стабилизатор, увлажняющее вещество и консерванты, и формируя смесь в мази способом, известным в технике. Примеры основы включают жидкий парафин, белый вазелин, белый пчелиный воск, октилдодециловый спирт и парафин. Примеры консерванта включают метил-п-гидроксибензоат, этил-п-гидроксибензоат и пропил-п-гидроксибензоат.
Припарки можно получить, нанося вышеуказанную мазь, гель, крем, пасту и т.д. на обычно используемую основу обычным способом. Примеры соответствующих основ включают тканые и нетканые ткани, изготовленные из хлопка, штапельного волокна или химического волокна, и листовой пенопласт, изготовленный из мягкого поливинилхлорида, полиэтилена, полиуретана и т.д.
Как правило, композицию предпочтительно получают таким образом, чтобы иметь содержание производного холестанола и содержание противоракового средства от 0,0001 до 80 мас.% (как эффективного ингредиента).
Когда химиотерапевтическое средство против рака по настоящему изобретению предоставляется в виде набора, набор может быть сконструирован для независимой упаковки соответствующей лекарственной формы, в том числе, по отдельности, производного холестанола, представленного формулой (1), или его соединения включения с циклодекстрином и противоракового средства, каждая из которых получена указанным выше способом, и использования каждой фармацевтической композиции, взятой по отдельности из соответствующей упаковки перед применением. С другой стороны, каждая фармацевтическая композиция может храниться в упаковке, подходящей для каждого момента комбинированного введения.
Доза химиотерапевтического средства против рака по настоящему изобретению изменяется в зависимости от массы тела, возраста, пола, симптомов у пациента, нуждающегося в нем, способа и частоты введения пациенту, нуждающемуся в нем, и т.д. Как правило, ежесуточная доза для взрослого составляет примерно 0,1-30 мг/кг производного холестанола (1), предпочтительно, 3-10 мг/кг. Доза противоракового средства может находиться в интервале, установленном в отношении данного средства, или может быть ниже такого интервала.
Не ставится особое ограничение в отношении частоты введения, и средство можно вводить один или несколько раз в сутки. Однократное введение предпочтительно. Когда используют набор, каждую из композиций, включающих отдельные ингредиенты лекарственного средства, можно вводить одновременно или с перерывом.
Далее настоящее изобретение будет описываться подробнее с помощью примеров, которые не следует рассматривать как ограничивающие изобретение.
Примеры
Пример 1
Влияние добавления лекарственного средства на ингибирование пролиферации раковых клеток
Клетки colon26 (мышиного рака толстой кишки) инокулируют в 96-луночный планшет (1 × 104 клеток/50 мкл среды 10% FCS-RPMI/лунку) и инкубируют при 37°С в течение 16 часов. В каждую лунку добавляют цисплатин (сокращенно «CDDP») и/или соединение включения с циклодекстрином (сокращенно «GC-CD») производного холестанола, в котором G в формуле (1) представляет собой ClcNAcβ- (сокращенно «GC») (многократное разбавление средой FCS(-), конечная концентрация ≤500 мкМ, 50 мкл), и затем инкубируют при 37°С в течение двух суток. GC-CD получают согласно способу, раскрытому в примере 1(2) в патентном документе 4. Конкретно, получают 40% водный раствор гидроксипропил-β-циклодекстрина, к раствору добавляют GC, затем смешивают посредством перемешивания (80°С в течение 30 минут) и посредством этого получают GC-CD.
В качестве контроля используют лунки, в которые добавляют только среду FCS(-). Подсчет жизнеспособных клеток осуществляют с помощью набора для подсчета клеток (продукт Dojin).
Степень ингибирования пролиферации клеток (CPI) (%) вычисляют с помощью приведенного далее уравнения. Результаты показывает фиг.1.
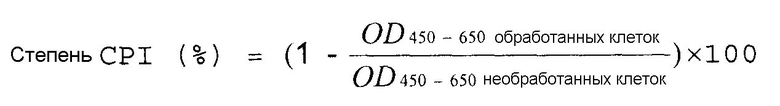
Пример 2
Действие ингибирования пролиферации различных раковых клеток
Повторяют процедуру примера 1 за исключением того, что клетки colon26 заменяют на MKN45 (рак желудка человека), NCIH226 (рак легких человека) и Colo201 (рак толстой кишки человека). Степень CPI (%) определяют схожим способом. Результаты показывает фиг.2.
В примере 2 также используют соединение включения с циклодекстрином (сокращенно «GGC-CD») производного холестанола, в котором G в формуле (1) представляет собой ClcNAcβ1,4-Galβ- (сокращенно «GGC»). GGC-CD получают способом, схожим с вышеуказанным способом получения GC-CD, за исключением того, что производное холестанола заменяют на GGC. Определяют степень CPI в отношении раковых клеток. Результаты показывает фиг.3.
Пример 3
Влияние добавления лекарственного средства на ингибирование пролиферации раковых клеток in vivo
В приведенных далее примерах в качестве подопытных животных используют мышей Balb/c (6-недельные самки).
(1) Мышам инокулируют интраперитонеально клетки colon26 (1 × 104 клеток/мышь) (день 0). На следующий день после инокуляции (день 1) CDDP и/или GC-CD доводят физиологическим раствором (нормальный физиологический раствор Otsuka) до нужной концентрации, и CDDP, GC-CD или CDDP + GC-CD (500 мкл) вводят мышам интраперитонеально с последующим отбором. В день 19 мышей вскрывают, и определяют массу брыжейки и большого сальника. Контрольной группе вводят только физиологический раствор (500 мкл) (n = 10; 10 мышей на группу).
Результаты показывает фиг.4.
(2) Мышам инокулируют интраперитонеально клетки colon26 (1 × 104 клеток/мышь) (день 0). В день 1, день 2, день 3, день 6, день 7 и день 8 CDDP и/или GC-CD доводят физиологическим раствором (нормальный физиологический раствор Otsuka) до нужной концентрации, и CDDP, GC-CD или CDDP + GC-CD (500 мкл) вводят мышам интраперитонеально с последующим отбором. В день 21 мышей вскрывают, и определяют массу брыжейки и большого сальника. Контрольной группе вводят только физиологический раствор (500 мкл) (n=10; 10 мышей на группу).
Результаты показывает фиг.5.
(3) Мышам инокулируют интраперитонеально клетки colon26 (1 × 104 клеток/мышь) (день 0). В день 7 CDDP и/или GC-CD доводят физиологическим раствором (нормальный физиологический раствор Otsuka) до нужной концентрации, и CDDP, GC-CD или CDDP + GC-CD (500 мкл) вводят мышам интраперитонеально с последующим отбором. В день 18 мышей вскрывают, и определяют массу брыжейки и большого сальника. Контрольной группе вводят только физиологический раствор (500 мкл) (n=10; 10 мышей на группу).
Результаты показывает фиг.6.
Пример 4
Противоопухолевое действие при введении лекарственного средства
В качестве подопытных животных используют мышей Balb/c (6-недельные самки). Мышам инокулируют интраперитонеально клетки colon26 (1 × 104 клеток/мышь) (день 0). В день 2 и/или день 3 CDDP и/или GC-CD доводят физиологическим раствором (нормальный физиологический раствор Otsuka) до нужной концентрации, и вводят мышам интраперитонеально CDDP (один раз в день 2), GC-CD (дважды, в день 2 и день 3) или CDDP (один раз в день 2) + GC-CD (дважды, в день 2 и день 3) (500 мкл) с последующим отбором. Длительность выживания (дни) подсчитывают до дня 43. Контрольной группе вводят только физиологический раствор (500 мкл) (n=10; 10 мышей на группу).
Результаты показывает фиг.7.
Пример 5
Противоопухолевое действие при введении лекарственного средства
В качестве подопытных животных используют мышей Balb/c (6-недельные самки). Мышам инокулируют интраперитонеально клетки colon26 (5 × 104 клеток/мышь) (день 0). После подтверждения того, что опухоль достигла размера примерно 4 мм (день 7-день 10 после инокуляции), CDDP и/или GGC-CD доводят физиологическим раствором (нормальный физиологический раствор Otsuka) до нужной концентрации, и CDDP, GGC-CD или CDDP + GGC-CD (200 мкл) вводят мышам в хвостовую вену с последующим отбором. Изменение размера опухоли в зависимости от времени проверяют до дня 21, и определяют соответствующий размер опухоли. Контрольной группе вводят только физиологический раствор (200 мкл) (n=7; 7 мышей на группу).
Результаты показывает фиг.8.
Пример 6
Ингибирующее действие добавления лекарственного средства на метастазирование рака
В качестве подопытных животных используют мышей Balb/c (6-недельные самки). Мышам инокулируют интраперитонеально клетки colon26 (5 × 104 клеток/мышь) (день 0). Сразу же после инокуляции CDDP и/или GC-CD или GGC-CD доводят физиологическим раствором (нормальный физиологический раствор Otsuka) до нужной концентрации, и CDDP, GC-CD (или GGC-CD) или CDDP + GC-CD (или GGC-CD) (200 мкл) вводят мышам в каудальную вену с последующим отбором. В день 14 мышей вскрывают, и подсчитывают опухолевые утолщения в легких. Контрольной группе вещество не вводят (n=10; 10 мышей на группу).
Результаты показывает фиг.9.
Как описано в данном описании выше, за счет использования в комбинации производного холестанола по настоящему изобретению или его соединения включения с циклодекстрином и противоракового средства существенно ингибируется пролиферация различных раковых клеток, и можно получить синергичный эффект и/или эффект потенцирования противоопухолевого действия известного противоракового средства.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНОЕ СОЕДИНЕНИЕ ХОЛЕСТАНОЛА ДЛЯ КОМБИНИРОВАННОГО ПРИМЕНЕНИЯ | 2009 |
|
RU2519186C2 |
| ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ АГОНИСТА TLR И КОМБИНИРОВАННАЯ ТЕРАПИЯ | 2011 |
|
RU2603467C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОЕДИНЕНИЯ, СПОСОБЫ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ | 1995 |
|
RU2168995C2 |
| МОДУЛЬНЫЕ ЧАСТИЦЫ ДЛЯ ИММУНОТЕРАПИИ | 2014 |
|
RU2672055C2 |
| КОМБИНАЦИИ ДЛЯ ЛЕЧЕНИЯ РАКА, ВКЛЮЧАЮЩИЕ ABX196 | 2017 |
|
RU2770432C2 |
| НОВЫЕ СИНЕРГИЧЕСКИЕ ЭФФЕКТЫ | 2009 |
|
RU2471499C2 |
| ПРОИЗВОДНОЕ БЕНЗОХИНОНА Е3330 В КОМБИНАЦИИ С ХИМИОТЕРАПЕВТИЧЕСКИМИ АГЕНТАМИ ДЛЯ ЛЕЧЕНИЯ РАКА И АНГИОГЕНЕЗА | 2008 |
|
RU2510270C2 |
| ABX196 ДЛЯ ПРИМЕНЕНИЯ ПРИ ЛЕЧЕНИИ РАКА МОЧЕВОГО ПУЗЫРЯ | 2018 |
|
RU2778812C2 |
| СПОСОБЫ ЛЕЧЕНИЯ РАКА | 2013 |
|
RU2657749C2 |
| ПРИМЕНЕНИЕ АНАЛОГОВ АЦИЛФУЛЬВЕНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1994 |
|
RU2145849C1 |

Настоящее изобретение относится к медицине и описывает химиотерапевтическое средство против рака, содержащее, в комбинации, производное холестанола, представленное формулой (1)
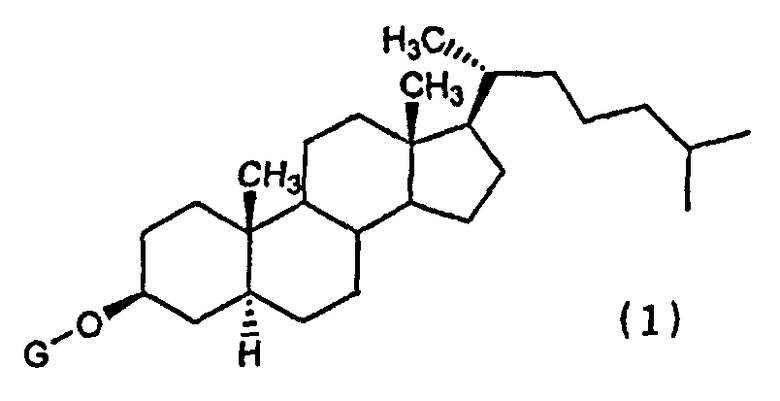
где G представляет собой GlcNAc-Gal- или GlcNAc-, или его соединение включения с циклодекстрином, и противораковое средство, представляющее собой один или несколько видов средств, выбранных из группы, состоящей из паклитаксела, доцетаксела, циклофосфамида, пеметрекседа, 5-FU, цисплатина и оксалиплатина. Химиотерапевтическое средство против рака имеет более слабое побочное действие и превосходную эффективность. 3 н. и 4 з.п. ф-лы, 9 ил., 6 пр.,
1. Химиотерапевтическое средство против рака, содержащее, в комбинации, производное холестанола, представленное формулой (1)
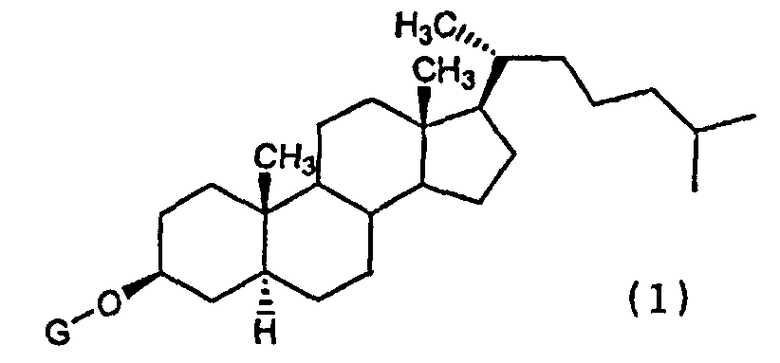
где G представляет собой GlcNAc-Gal- или GlcNAc-, или его соединение включения с циклодекстрином, и противораковое средство, представляющее собой один или несколько видов средств, выбранных из группы, состоящей из паклитаксела, доцетаксела, циклофосфамида, пеметрекседа, 5-FU, цисплатина и оксалиплатина.
2. Химиотерапевтическое средство против рака по п.1, которое представляет собой смешанное средство.
3. Химиотерапевтическое средство против рака по п.1, которое находится в форме набора, включающего лекарственное средство, содержащее производное холестанола, и лекарственное средство, содержащее противораковое средство.
4. Химиотерапевтическое средство против рака по п.3, где лекарственное средство, содержащее производное холестанола, представляет собой липосомальную композицию.
5. Применение, в комбинации, производного холестанола, представленного формулой (1)
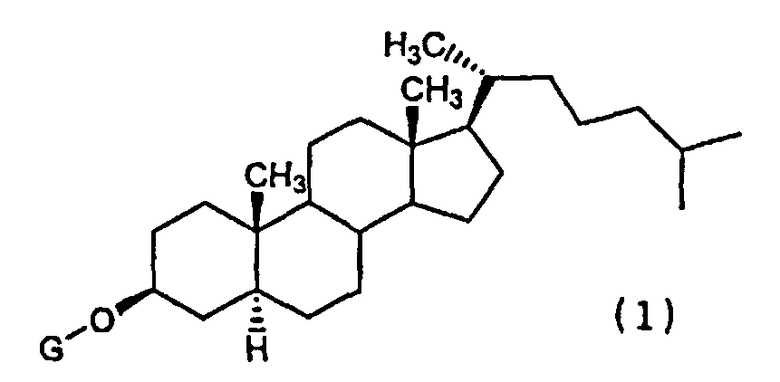
где G представляет собой GlcNAc-Gal- или GlcNAc-, или его соединение включения с циклодекстрином, и противораковое средство, представляющее собой один или несколько видов средств, выбранных из группы, состоящей из паклитаксела, доцетаксела, циклофосфамида, пеметрекседа, 5-FU, цисплатина и оксалиплатина, для получения химиотерапевтического средства против рака.
6. Способ лечения рака, включающий введение пациенту, нуждающемуся в этом, производного холестанола, представленного формулой (1)
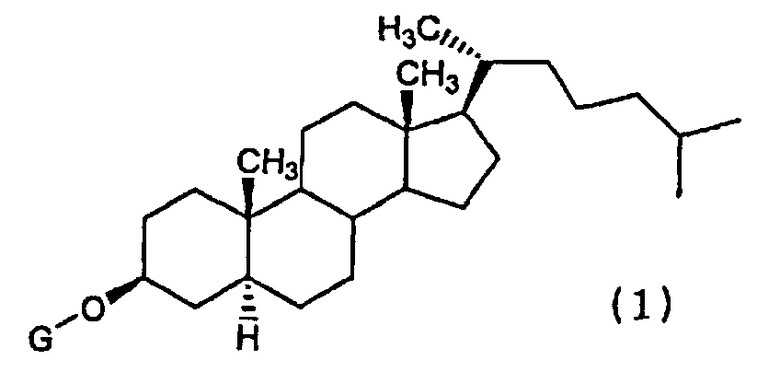
где G представляет собой GlcNAc-Gal- или GlcNAc-, или его соединение включения с циклодекстрином и противораковое средство, представляющее собой один или несколько видов средств, выбранных из группы, состоящей из паклитаксела, доцетаксела, циклофосфамида, пеметрекседа, 5-FU, цисплатина и оксалиплатина, в комбинации.
7. Способ по п.6, где производное холестанола, или его соединение включения с циклодекстрином, и противораковое средство вводят пациенту, нуждающемуся в этом, одновременно или раздельно с интервалами.
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Vladimir N Ivanov et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Oncogene | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| JP 11060592 A, 02.03.1999. | |||
Авторы
Даты
2013-09-20—Публикация
2009-03-04—Подача