Описание изобретения
Изобретение относится к медицинской биотехнологии, а именно, к экспериментальной гастроэнтерологии и может применяться как в исследовательской работе, так и для проведения диагностических наблюдений в практической медицине.
Уровень техники
Введение в гладкомышечные клетки низкомолекулярных соединений широко используют при изучении функционального состояния этих клеток в развитии патологии тканей, состоящих из гладкомышечных клеток, а также для оценки действия лекарственных препаратов, используемых в лечении соответствующих заболеваний.
Гладкомышечные клетки являются основным типом клеток, составляющим ткани гладкомышечной мускулатуры организма, выполняющими роль сократительного аппарата в стенках кровеносных и лимфатических сосудов, а также в различных отделах пищеварительной, репродуктивной и выделительной систем человека и животных. Эффективность транспорта низкомолекулярных соединений внутрь гладкомышечных клеток достигается путем повышения проницаемости внешних клеточных мембран гладкомышечных клеток при действии на них различных пороформирующих агентов в результате образования в цитоплазматическом мембранном слое различных по строению поровых каналов.
Из известных в настоящее время способов повышения проницаемости клеточных мембран (пермеабилизации мембран) наиболее широко применяется обработка внешних мембран гладкомышечных клеток человека и животных пороформирующим гемолизином альфа-токсином из Staphylococcus aureus [26, 49], который образует в мембранном слое клеток поровые каналы для транспорта внутрь клеток низкомолекулярных веществ с молекулярным весом менее 4 килодальтон и диаметром молекул менее 2 нанометров.
В гастроэнтерологии пермеабилизация гладкомышечных клеток альфа-токсином используется в исследовании патологии сократительных свойств и кровоснабжения различных отделов пищеварительной и выделительной систем, в частности сократимости мышечных клеток желудка [3], дисфункции кишечника при колитах [18, 24]. На пермеабилизованных фрагментах тканей желудка и кишечника изучали механизмы регуляции их тонуса и сокращения препаратами омепразола, карбахола, селеретрина и другими фармпрепаратами. [12, 14, 31, 37, 38, 44, 51, 52,]. С применением обработки альфа-токсином исследовали чувствительность к ионам кальция пермеабилизованных брыжеечных лимфатических мышц и артерий [10]. С использованием пермеабилизации гладкомышечных клеток изучали патологию органов выделительной системы, в частности уточняли механизмы релаксации соответствующих интактных и пермеабилизованных мышц под действием монензина, фосфоколина и NaCN [20]. Было установлено, что терапевтический эффект широко используемого при цистите ДМСО вызывается уменьшением чувствительности к кальцию соответствующих гладкомышечных миофибрилл [39], кроме того, показано ослабление сократительных свойств обработанных альфа-токсином соответствующих гладкомышечных фрагментов выделительной системы при развитии сахарного диабета [43].
Известны многочисленные работы по использованию обработки альфа-токсином гладкомышечных клеток сосудов, являющихся основным сократительным компонентом артерий, артериол, вен и венул организма животных и человека. На обработанных альфа-токсином гладкомышечных клетках артерий мозга показаны различия в расслаблении гладкомышечных клеток базиларной и средней мозговых артерий при применении доноров оксида азота и вазодилататорного действия на них цикломонофосфатов [33, 63], а также исследованы некоторые условия и последствия гемаррогического инсульта мозга и миогенной реактивности артерий мозга. На пермеабилизованных фрагментах коронарных сосудов показано, что одной из причин развития сердечной недостаточности является падение сердечно-сосудистого тонуса, вызываемое изменением фосфорилирования миозиновой фосфатазы, что предполагает лечение этой патологии препаратами Y27632 или ML7 [58,59]. Обработку альфа-токсином гладкомышечных клеток сосудов, обеспечивающих кровоснабжение различных отделов дыхательных путей, использовали при изучении причин возникновения таких патологий легких, как легочная гипертония, гипоксия, бронхиальная астма, а также воспалительные процессы, возникающие при курении. В частности, были уточнены механизмы регуляции гипертензии пермеабилизованных легочных артерий и вен [9, 35, 42, 61]. На пермеабилизованных фрагментах гладкомышечных тканей сосудов изучали причины развития других широко распространенных типов гипертензии, таких, как почечная и портальная [25, 62], а также гипертензивные состояния, развивающиеся в периферийных частях кровеносной системы [6, 26, 27, 50].
Пермеабилизация гладкомышечных клеток представляет особый интерес в изучении регуляции женской сосудистой и репродуктивной систем во время беременности, что важно для понимания основ адаптации репродуктивных органов матери при развитии плода. При обработке альфа-токсином показано, что сокращение сосудов плаценты беременных женщин происходит из-за повышения их чувствительности к кальцию во время беременности и может ослабевать под действием оксида азота [16, 17]. Также установлены различия в действии препаратов каликулина, киназных ингибиторов и тромбоксан-миметиков на пермеабилизованные и интактные гладкомышечные клетки сосудов беременных женщин [60]. Показано действие препаратов нейропептида нейрокинина, дилтиозема на сократимость интактных и пермеализованных гладкомышечных клеток миометриума беременных и небеременных женщин и экспериментальных животных [34, 40]. В данном направлении на пермеабилизованных образцах мышц из беременных и небеременных женщин выяснены различия в действии препаратов активатора протеинкиназы, ингибиторов типа Go 6850, LY333531 и изменения соотношений активности изоформ регуляторной протеин киназы С [34]. Пермеабилизованные альфа-токсином и нативные гладкомышечные клетки исследовали при патологиях мужской репродуктивной системы, в частности при функционировании мышечных тканей простаты и нарушении сокращений соответствующих мышц при гиперплазии простаты человека [47, 48]. На пермеабилизованных фрагментах соответствующих мышц экспериментальных животных изучали причины эректильной дисфункции и пути ее устранения фармпрепаратами фенилефрина, нейрокинина, нифедипина, фосфорамидона, нифедрина [45, 46, 56, 57], а также другие аспекты поддержания тонуса гладкомышечной мускулатуры [55].
Пермеабилизация гладкомышечных клеток позволяет оценивать эффективность действия на эти клетки различных лекарственных препаратов и оптимизировать лечение патологий в функционировании гладкомышечных тканей организма человека. В связи с широким применением методов пермеабилизации клеток гладкомышечной мускулатуры в молекулярной медицине дальнейшая разработка способов их пермеабилизации является актуальной.
Известный способ пермеабилизации гладкомышечных клеток препаратом альфа-токсина применяется наряду с другими способами пермеабилизации клеток препаратами сапонина, эсцина и тритона Х-100 [6].
Основной недостаток при применении этих детергентных препаратов заключается в неконтролируемом размере образуемых при пермеабилизации поровых каналов, поэтому данные способы считаются недостаточно воспроизводимыми и точными.
Принятый за прототип способ пермеабилизации клеточных мембран пороформирующим альфа-токсином не имеет этого недостатка, так как образует в мембране строго фиксированные по размеру 2 нм поровые каналы. Данный способ состоит в обработке проб различными концентрациями альфа-токсина, и последующем введении в обработанные токсином и отмытые от него пробы изучаемых низкомолекулярных веществ. Примером способа пермеабилизации, принятого за прототип, является обработка клеток различными концентрациями альфа-токсина для последующего транспорта через клеточные мембраны красителя пропидиум иодида и различных ионов, как описано [19].
При данном способе пермеабилизации каждая проба клеток обрабатывается одной концентрацией альфа-токсина. Приготовление проб для пермеабилизации часто является трудоемким и дорогостоящим процессом, связанными с малым количеством выделяемого в клинических условиях биопсийного материала. Примерами являются эксперименты по лечению глаукомы и устранению непроизвольного сокращения глазных мышц, приводящих к нежелательным рефлекторным сокращениям зрачка при контакте с хирургическим инструментом во время глазных операций, а также к ослаблению развития послеоперационных воспалительных процессов. В данной работе эксперименты проводились на изолированной и пермеабилизованной альфа-токсином мышце радужной оболочки глаза в комбинации с ингибиторами Y27632, GF109203X и вазодилататором карбахолом [15]. Также на ограниченном количестве биопсийно изолированных фрагментов мышц из опухолеобразований легочных путей человека и в опытах на лабораторных животных, при пермеабилизации образцов альфа-токсином исследовали особенности сокращения трахей [32], бронхов и действия бронходилататоров [7, 8, 11, 36] при курении. Типичным примером обработки биопсийных проб альфа-токсином является пермеабилизация гладкомышечных клеток сосудов мозга, проводимая при исследовании механизмов регуляции кровяного давления в сосудах мозга и выяснения причин спазма церебральных артерий, вызывающих кровоизлияние в мозг, в частности для оценки амплитуды мозговых вазоспазмов при изменении чувствительности к кальцию пермеабилизованной мозговой артерии [13, 22, 23, 28, 29]. В данном аспекте изучали механизмы возникновения вазоспазмов с целью расширения просветов пораженных сосудов мозга, обработанных альфа-токсином, препаратами эндотелина, фенилэфрина, никардипина, папаверина, цитохалазина, и кальциевыми ионофорами [22, 23, 28, 29].
Для получения эффективной пермеабилизации образцов клеток в описанных примерах предварительно подбираются необходимые для этого оптимальные концентрации препарата альфа-токсина. Причем при выборе оптимальной концентрации используемого альфа-токсина каждая концентрация препарата этого токсина тестируется на отдельно приготовленном образце клеток.
Основным недостатком, присущим для данного способа прототипа, является трудность предварительного подбора условий по пермеабилизации образцов, возникающая из-за малого числа получаемых биопсийных образцов и сложности их подготовки для пермеабилизации, поскольку подбираемые условия пермеабилизации варьируют в зависимости от источника биопсии клеток, их жизнеспособности, выбранного способа приготовления образцов, включающего состав буферов, ферментативную обработку мембран клеток и качество используемых реактивов.
Заявляемый способ пермеабилизации не имеет этого недостатка, присущего для способа, принятого за прототип. Заявляемый способ состоит в том, что предварительный подбор условий эффективной пермеабилизации с использованием различных концентраций пороформирующего токсина проводится только на одном образце клеток с использованием бактериального пороформирующего гемолизина II (HlyII) Bacillus cereus в присутствии красителя пропидиум иодида. Данный гемолизин HlyII имеет высокую пороформирующую активность, образуя стабильные поровые каналы диаметром 1,4-1,6 нанометров в мембранах различных типов клеток [4, 5, 21, 41, 53, 54].
Несмотря на высокую гомологию с альфа-токсином (31% идентичности), гемолизин II отличается от него значительно меньшей стабильностью белка в растворе. Вместе с тем, как описано ранее, препарат HlyII после быстрого, в течение нескольких минут, связывания с клеточными мембранами, стабилизируется и сохраняет высокую пороформирующую активность на мембранах [1,2]. При этом активность HlyII не уступает, а на некоторых типах клеток, например, эритроцитах человека, превышает пороформирующую активность альфа-токсина [4, 30]. Оба описанных свойства HlyII, отличающих его от альфа-токсина, позволяют использовать заявляемый способ последовательного добавления в одну пробу увеличивающихся аликвот HlyII для предварительного подбора оптимальных концентраций этого токсина. Данная модификация, значительно ускоряющая подбор условий пермеабилизации клеток препаратом HlyII по сравнению с альфа-токсином, является основой заявляемого способа обработки образцов гладкомышечных клеток.
В настоящее время нет сообщений, описывающих действие HlyII на мембраны гладкомышечных клеток кишечника. Также отсутствует описание методики для тестирования пермеабилизации гладкомышечных клеток с использованием этого токсина в различных концентрациях, при последовательной обработке клеток в одном образце.
Сущность изобретения
Заявляемый способ применяется с целью более эффективного предварительного определения оптимальных условий пермеабилизации образцов гладкомышечных клеток.
Сущность изобретения состоит в использовании для тестирования уровня пермеабилизации вместо нескольких проб только одной пробы гладкомышечных клеток. Осуществление заявляемого способа основано на свойствах используемого токсина HlyII, отличных от свойств альфа-токсина, применяемого в способе пермеабилизации, принятым за прототип. Способ осуществляется при добавлении в пробу возрастающих концентраций HlyII в присутствии в этой пробе флуоресцентного красителя пропидиум иодида.
Технической задачей предлагаемого изобретения является повышение проницаемости внешних мембран гладкомышечных клеток для низкомолекулярных соединений при обработке их препаратом HlyII, получаемым из условно патогенных почвенных бактерий Bacillus cereus, обладающим высокой мембранной пороформирующей активностью и сохраняющим стабильность после связывания с мембранами обрабатываемых клеток.
Поставленная цель достигается тем, что высокоочищенный препарат гемолизина II имеет следующие свойства, обеспечивающие реализацию заявляемого способа: во-первых, HlyII инактивируется в течение короткого времени инкубации в растворе и во-вторых, HlyII стабилизируется и сохраняет высокую активность после связывания с мембранами гладкомышечных клеток как в отсутствие, так и в присутствии красителя пропидиум иодида.
Препарат HlyII в минимальной концентрации инкубируется с образцом гладкомышечных клеток из тонкого кишечника мыши, содержащем краситель пропидиум иодид, после чего этот же образец частично пермеабилизованных и окрашенных гладкомышечных клеток инкубируется с последовательно возрастающими концентрациями HlyII в присутствии пропидиум иодида, после чего на основе полученных результатов определяются оптимальные условия повышения проницаемости мембран обработанных гемолизином гладкомышечных клеток, составляющих данный образец.
Заявляемый способ пермеабилизации мембран гладкомышечных клеток при обработке их HlyII осуществляется следующим образом: 1) из стенок тонкого кишечника лабораторных животных выделяются гладкомышечные клетки, которые инкубируются в течение 10 минут с пропидиум иодидом в концентрации 3 мкг/мл при 20°С в растворе фосфатно-солевого буфера состава: 015 М хлорида натрия, 0,01 М фосфата калия, рН. 7.2; 2) после определения фонового уровня флуоресценции образца гладкомышечных клеток к тестируемой пробе добавляется препарат HlyII в минимальной концентрации 1 мкг/мл и инкубируется еще в течение 10 минут с пропидиум иодидом в концентрации 3 мкг/мл при 20°С в растворе фосфатно-солевого буфера; 3) проводится повышение уровня пермеабилизации образца гладкомышечных клеток с последовательным увеличением концентрации HlyII от 1 до 10 мкг/мл при обработке образца с каждой новой концентрацией HlyII также в течение 10 минут с пропидиум иодидом в концентрации 3 мкг/мл при 20°С в том же буфере. Относительно максимального уровня пермеабилизации, получаемого при концентрации HlyII в 10 мкг/мл, расчитываются условия, необходимые для достижения желательного уровня проницаемости мембран данного образца гладкомышечных клеток.
Сведения, подтверждающие возможность осуществления изобретения.
Пример 1. Определение активности препарата HlyII при обработке проб в присутствии пропидиум иодида.
Для пермеабилизации мембран гладкомышечных клеток используется препарат HlyII, выделенный из рекомбинантного штамма Escherihia coli Z85 (PUJ2) как описано ранее [4]. Препарат HlyII используется в концентрации 20 мкг/мл в буфере, содержащем 20 мМ К-Р04 рН 7,2, 40 мМ NaCI, 10% глицерина и имеет удельную активность около 400 ГЕ на мкг белка.
Основной особенностью используемого в заявляемом способе препарата HlyII является сохранение его высокой пороформирующей активности в присутствии флуоресцентного красителя пропидиум иодида.
Целью данной стадии заявляемого способа пермеабилизации является оценка пороформирующей активности HlyII в присутствии различных концентраций красителя пропидиум иодида.
Для достижения этого определяется значение фонового уровня флуоресценции мембран гладкомышечных клеток при окрашивании их пропидиум иодидом в отсутствии препарата HlyII.
Далее определяется величина флуоресценции гладкомышечных клеток в пробах, обрабатываемых препаратом HlyII, отмываемых от несвязавшегося HlyII и после этого окрашиваемых пропидиум иодидом.
Затем определяется величина флуоресценции гладкомышечных клеток в пробах, обрабатываемых препаратом HlyII в присутствии пропидиум иодида.
Тестирование пороформирующей активности и окрашивание пропидиум иодидом проводится на гладкомышечных клетках, изолированных из стенок тонкого кишечника 3-х месячных мышей самцов. Для определения пороформирующей HlyII активности используются пробы гладкомышечных клеток с плотностью посева 2×104 клеток/см2 в 96 луночных плашках Nunc. Перед использованием клетки инкубируются в среде DMEM модификации Дульбекко без сыворотки, с добавлением до 10 мМ Hepes (Sigma, США) рН 6,9, а также 100 мкг/мл стрептомицина и 100 мкг/мл пенициллина и промываются избытком среды DMEM в модификации Дульбекко без ЭДТА с добавлением 2 мМ CaCl2. Оценку проб проводят под микроскопом, подсчитывая число прикрепившихся клеток при увеличении ×200, с учетом прикрепления к плашке не менее 50 клеток, наблюдаемых в поле объектива микроскопа. Часть лунок используется для определения целостности мембран гладкомышечных клеток по стандартному методу определения количества жизнеспособных клеток их окрашиванием 1% раствором трипанового синего.
Окрашивание проб гладкомышечных клеток пропидиум иодидом проводится в растворе фосфатно-солевого буфера при добавлении к клеткам раствора 100 мкг/мл красителя пропидиум иодида до конечной концентрации 5 мкг/мл и инкубированием проб в течение 1 часа при 20°С. Интенсивность флуоресценции окрашенных проб с максимальным уровнем фонового окрашивания пропидиум иодидом для клеток с ненарушенными мембранами исследуется с помощью флуоресцентного микроскопа (Leica, Германия) при 200 и 800-кратном увеличении. Обработка изображений проб гладкомышечных клеток с флуоресценцией при 610 нм проводится с использованием программ Photoshop Adobe CS и Image J. Часть лунок после окрашивания пропидиум иодидом используется для повторного определения целостности мембран прикрепившихся к плашкам гладкомышечных клеток при помощи их окраски стандартным красителем трипановым синим.
После определения фонового уровня флуоресценции измеряется величина флуоресценции гладкомышечных клеток в пробах, обрабатываемых препаратом HlyII по способу прототипа. К тестируемой пробе добавляется препарат HlyII в фосфатно-солевом буфере в концентрации 5 мкг/мл и инкубируется в течение 30 минут при 20°С, пробы отмываются избытком раствора фосфатно-солевого буфера и инкубируются в течение 30 минут с пропидиум иодидом в концентрации 1, 3 и 5 мкг/мл при 20°С в 200 мкл того же буфера.
Затем измеряется величина флуоресценции гладкомышечных клеток в опытных пробах, обрабатываемых препаратом HlyII без его отмытия от пробы, в присутствии красителя пропидиум иодида. К тестируемой пробе добавляется препарат HlyII в концентрации 5 мкг/мл, а также пропидиум иодид до концентрации 1, 3 и 5 мкг/мл и опытная проба инкубируется в 200 мкл фосфатно-солевого буфера в течение 30 минут при 20°С.
При обработке HlyII, величина интенсивности флуоресценции пропидиум иодида, включенного в гладкомышечные клетки в опытных пробах, приготовленных в присутствии пропидиум иодида, не отличается от интенсивности флуоресценции в пробах, полученных способом прототипа, при используемых концентрациях красителя в 1, 3 и 5 мкг/мл пропидиум иодида.
Пример 2. Определение оптимального времени обработки гладкомышечных клеток препаратом HlyII в присутствии пропидиум иодида.
Целью данной стадии заявляемого способа пермеабилизации является установление интервала времени, достаточного для эффективной пермеабилизации проб гладкомышечных клеток при их обработке препаратами HlyII при наличии в пробах красителя пропидиум иодида.
Пробы гладкомышечных клеток, приготовленные как описано в примере 1, обрабатываются препаратами HlyII с концентрациями 1, 3, 5 и 10 мкг/мл соответственно в течение 5, 10 и 30 минут в присутствии 5 мкг/мл пропидиум иодида.
При обработке проб препаратами HlyII в различных концентрациях в течение 5 минут в присутствии 5 мкг/мл пропидиум иодида, последующей отмывке проб от несвязавшегося HlyII и инкубации проб в течение еще 25 минут в фосфатно-солевом буфере, содержащем 5 мкг/мл пропидиум иодида, величина флуоресценции включенного в клетки пропидиум иодида составляет 80% максимально возможной, получаемой при инкубации проб с HlyII в течение 30 минут. При обработке проб препаратами HlyII в тех же условиях в течение 10 минут, последующей отмывке проб от HlyII и инкубации проб в течение еще 20 минут в тех же условиях, величина флуоресценции включенного в клетки пропидиум иодида, составляет более 90% максимально возможной, получаемой при инкубации проб с HlyII в течение 30 минут.
Определение времени HlyII обработки проб в присутствии пропидиум иодида показывает, что интервал в 10 минут достаточен для получения высокого уровня пермеабилизации гладкомышечных клеток препаратом HlyII.
Пример 3. Определение предварительных условий для оптимальной HlyII пермеабилизации в присутствии пропидиум иодида, проводимых в одной пробе гладкомышечных клеток.
Целью данной стадии заявляемого способа является определение эффективности пермеабилизации в одной пробе гладкомышечных клеток при ее обработке HlyII в присутствии пропидиум иодида, проводимой по заявляемому способу пермеабилизации в сравнении с пробами, обработанными по способу принятому за прототип заявляемого способа.
Величина фоновой флуоресценции пробы гладкомышечных клеток определяется окрашиванием проб пропидиум иодидом в концентрации 5 мкг/мл в отсутствие препарата HlyII, как описано в примере 1.
Флуоресценция пяти проб, приготовленных по способу, принятому за прототип, определяется следующим образом. Каждая проба, приготовленная, как описано в примере 1, отдельно обрабатывается концентрациями HlyII в 1, 2, 3, 5 и 10 мкг/мл соответственно в течение 10 минут при 20°С. Далее каждая пермеабилизованная проба отмывается от несвязавшегося с мембранами препарата HlyII. Затем каждая отмытая проба окрашивается пропидиум иодидом в концентрации 5 мкг/мл в течение 10 минут инкубации.
В сравнении с этим, флуоресценция в одной пробе, приготовленной по заявляемому способу пермеабилизации определяется следующим образом. Для определения уровня фоновой флуоресценции проба окрашивается пропидиум иодидом в концентрации 5 мкг/мл в отсутствии препарата HlyII в течение 10 минут. Далее в пробу через каждые 10 минут инкубации добавляются аликвоты препарата HlyII из исходного препарата 20 мкг/мл HlyII до конечных концентраций HlyII в 1, 2, 3, 5 и 10 мкг/мл соответственно. Фоторегистрация интенсивности флуоресценции всех тестируемых проб при 610 нм осуществляется через 2-3 минутные интервалы времени в течение 10-30 минут инкубации. Обработка изображений проб гладкомышечных клеток проводится с использованием программ Photoshop Adobe CS и Image J.
Оценка эффективности пермеабилизации гладкомышечных клеток (Пгмк) препаратами HlyII в опытной пробе, тестируемой по заявляемому способу, определяется по формуле:
Пгмк=(Фк-Ф0)/(Фм-Ф0)×100
где Ф0 - фоновое значение флуоресценции,
Фк-интенсивность флуоресценции одной пробы гладкомышечных клеток, которая обработана возрастающими концентрациями гемолизина II в 1, 2, 3 и 5 мкг/мл, Фм-интенсивность флуоресценции пробы, принятой за максимально пермеабилизованную, полученную обработкой 2×104 гладкомышечных клеток препаратом HlyII в концентрации 10 мкг/мл в объеме 1 мл ростовой среды при температуре 20°С в течение 10 минут инкубации. Статистическая обработка данных проводится с помощью пакета программ Microsoft Excel.
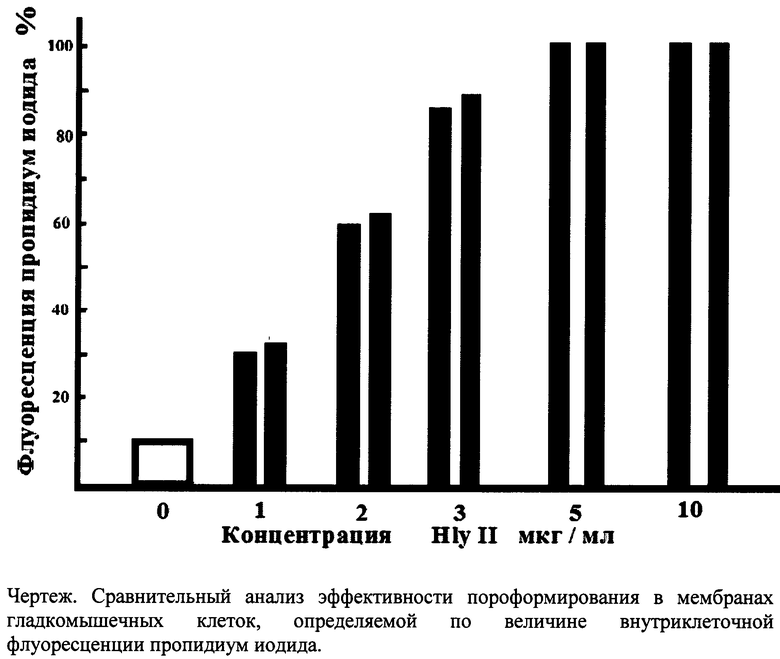
При обработке проб гладкомышечных клеток препаратом HlyII в концентрации 1 мкг/мл в течение 10 минут величина флуоресценции включенного в клетки пропидиум иодида в пробе, обработанной по способу прототипа и пробе, обработанной по заявляемому способу не отличается и составляет 30% максимально возможного. При обработке этих же проб в аналогичных условиях с применением препаратов HlyII в концентрации 2, 3, 5 и 10 мкг/мл величина флуоресценции в 4-х пробах, обработанных по способу прототипа и одной пробы, приготовленной по заявляемому способу, также не отличается и составляет соответственно 60, 90 и около 100% максимально возможного. При используемых в данном примере условиях оптимальный уровень пермеабилизации достигается обработкой гладкомышечных клеток препаратом HlyII в концентрации 3-5 мкг/мл.
Таким образом, уровень пермеабилизации в одной пробе гладкомышечных клеток, определенный при использовании заявляемого способа, соответствует по эффективности принятому за прототип способу пермеабилизации в 5 отдельных пробах гладкомышечных клеток. Следовательно, применение заявляемого способа в несколько раз уменьшает расходование выделяемого из организма клеточного материала и сокращает время обработки исследуемых клеток препаратами токсина и красителя пропидиум иодида.
Пример 4. Определение условий пороформирования HlyII в присутствии этидиум бромида, проводимое в одной пробе гладкомышечных клеток.
Заявляемый способ пермеабилизации клеток препаратом HlyII в одной пробе для подбора оптимальных условий их пермеабилизации повторяется при помощи окраски проб красителем этидиум бромидом, как описано в примерах 2-3.
Определяется флуоресценция 5 проб, приготовленных по способу прототипа, состоящему в их обработке концентрациями HlyII в 1, 2, 3, 5 и 10 мкг/мл, отмытии от HlyII и окрашивании этидиум бромидом в концентрации 5 мкг/мл. Определяется флуоресценция одной пробы, приготовленной по заявляемому способу, состоящему в обработке пробы увеличивающимися концентрациями HlyII в 1, 2, 3, 5 и 10 мкг/мл соответственно в присутствии 5 мкг/мл этидиум бромида. Величина флуоресценции в пробе, обработанной заявляемым способом, также соответствует величине флуоресценции проб, тестируемых способом, принятым за прототип. Таким образом, данные по тестированию проб в присутствии этидиум бромида подтверждают эффективность пермеабилизации проб гладкомышечных клеток препаратом HlyII с применением заявляемого способа.
В связи с тем, что использование существенных признаков заявляемого способа, включающих пермеабилизацию гладкомышечных клеток в одной пробе возрастающими концентрациями HlyII Bacillus cereus в присутствии флуоресцентных красителей в научно-технических источниках не обнаружено, можно сделать вывод, что данный способ отвечает критериям изобретения "новизна" и "существенные отличия".
Пояснение чертежа.
На чертеже представлены данные по повышению проницаемости мембран гладкомышечных клеток тонкого кишечника после обработки их препаратами с возрастающими концентрациями HlyII Bacillus cereus, при наличии в обрабатываемых пробах красителя пропидиум иодида, как описано в примерах 1-3.
Проба (0) - контрольная величина фоновой флуоресценции пробы гладкомышечных клеток в отсутствии препарата HlyII. Пробы 1, 2, 3, 5, 10 (черные столбцы) - флуоресценция 5 проб, приготовленных по способу пермеабилизации, принятому за прототип. Каждая проба обработана отдельно концентрациями HlyII в 1, 2, 3, 5 и 10 мкг/мл соответственно, каждая проба отмыта от несвязавшегося препарата HlyII и окрашена пропидиум иодидом в концентрации 5 мкг/мл. Проба 1, 2, 3, 5, 10 (светлые столбцы) - флуоресценция одной пробы, приготовленной по заявляемому способу пермеабилизации. Проба обработана увеличивающимися концентрациями HlyII в 1, 2, 3, 5 и 10 мкг/мл соответственно в присутствии 5 мкг/мл пропидиум иодида.




| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОРОФОРМИРОВАНИЯ В МЕМБРАНАХ КЛЕТОК ПЕЧЕНИ С ПОМОЩЬЮ ОБРАБОТКИ ИХ ГЕМОЛИЗИНОМ II Bacillus cereus | 2012 |
|
RU2504389C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АНТИГЕНОВ БАКТЕРИЙ | 2010 |
|
RU2451083C1 |
| СПОСОБ ТРАНСФЕКЦИИ И ТРАНСДУКЦИИ РАСТИТЕЛЬНЫХ КЛЕТОК | 2008 |
|
RU2485180C2 |
| СПЕЦИАЛЬНО РАЗРАБОТАННЫЕ ЛИПОСОМЫ ДЛЯ ЛЕЧЕНИЯ БАКТЕРИАЛЬНЫХ ИНФЕКЦИЙ | 2013 |
|
RU2780026C2 |
| СПЕЦИАЛЬНО РАЗРАБОТАННЫЕ ЛИПОСОМЫ ДЛЯ ЛЕЧЕНИЯ БАКТЕРИАЛЬНЫХ ИНФЕКЦИЙ | 2013 |
|
RU2672106C2 |
| ТРАНСГЕННЫЕ КОПЫТНЫЕ ЖИВОТНЫЕ, ИМЕЮЩИЕ ПОНИЖЕННУЮ АКТИВНОСТЬ ПРИОННОГО БЕЛКА, И ИХ ПРИМЕНЕНИЯ | 2003 |
|
RU2384059C2 |
| СПОСОБ КАЧЕСТВЕННОЙ И КОЛИЧЕСТВЕННОЙ ОЦЕНКИ СВЯЗЫВАНИЯ МЕМБРАННОГО БЕЛКА С ЛИГАНДОМ | 2007 |
|
RU2380421C2 |
| СПОСОБЫ ЛЕЧЕНИЯ И ПРЕДУПРЕЖДЕНИЯ ИНФЕКЦИЙ СТАФИЛОКОККА ЗОЛОТИСТОГО И СВЯЗАННЫХ С НИМИ НАРУШЕНИЙ | 2012 |
|
RU2635462C2 |
| СПОСОБ ОЦЕНКИ ЦИТОПРОТЕКТИВНОГО ЭФФЕКТА ПРЕПАРАТОВ ИММУНОГЛОБУЛИНОВ ДЛЯ ВНУТРИВЕННОГО ВВЕДЕНИЯ В ОТНОШЕНИИ КЛЕТОК ТРОФОБЛАСТА В УСЛОВИЯХ ИХ ВЗАИМОДЕЙСТВИЯ С ЕСТЕСТВЕННЫМИ КИЛЛЕРАМИ | 2021 |
|
RU2768461C1 |
| СРЕДСТВО, ИНГИБИРУЮЩЕЕ ЖИЗНЕДЕЯТЕЛЬНОСТЬ БАКТЕРИЙ Escherichia coli O75 №5557 (ВАРИАНТЫ) | 2012 |
|
RU2524138C2 |
Изобретение относится к медицине и предназначено для повышения проницаемости мембран гладкомышечных клеток тонкого кишечника. Проводят обработку клеток в одной пробе пороформирующим гемолизином HlyII из Bacillus cereus в концентрации 3-5 мкг/мл. Способ позволяет уменьшить расход клеточного материала и сократить время обработки без снижения эффективности. 3 пр., 1 ил.
Способ пермеабилизации мембран гладкомышечных клеток тонкого кишечника, включающий обработку этих клеток пороформирующим гемолизином, отличающийся тем, что используют обработку гладкомышечных клеток HlyII из Bacillus cereus, при котором воздействуют на гладкомышечные клетки HlyII из Bacillus cereus в концентрации 3-5 мкг/мл.
| ШТАММ БАКТЕРИЙ BACILLUS SUBTILIS, НЕСУЩИЙ СВОЙСТВО АНТИБИОТИКОРЕЗИСТЕНТНОСТИ, ИСПОЛЬЗУЕМЫЙ ДЛЯ ПОЛУЧЕНИЯ ПРЕПАРАТА "БАКТИСПОРИН" | 1995 |
|
RU2067616C1 |
| RU 2000102364, 27.03.2002 | |||
| CLELLAND LJ et al., Rho-kinase inhibition attenuates calcium-induced contraction in β-escin but not Triton X-100 permeabilized rabbit femoral artery | |||
| J Muscle Res Cell Motil | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
Авторы
Даты
2013-10-27—Публикация
2012-03-06—Подача