[0001] Настоящая заявка испрашивает приоритет по предварительной заявке на патент США сер. № 61/498596, поданной 19 июня 2011 года, содержание которой полностью включено в настоящую заявку путем ссылки.
ОБЛАСТЬ ТЕХНИКИ
[0002] Настоящее изобретение относится к способам скрининга, лечения и предупреждения инфекций Стафилококка золотистого и связанных с ними нарушений.
УРОВЕНЬ ТЕХНИКИ
[0003] Стафилококк золотистый («S. aureus») представляет собой бактерию, которая комменсально заселяет более 25% населения. Важно заметить, что этот организм способен разрушать свой начальный участок колонизации, вызывая распространение бактерий и болезнь. S. aureus является главной причиной внутрибольничных инфекций, наиболее распространенных этиологическим агентом инфекционного эндокардита, а также инфекций кожи и мягких тканей, и одной из четырех главных причин пищевых отравлений. В целом, S. aureus заражает более 1,2 миллиона пациентов в год в больницах США. Угроза S. aureus здоровью человека еще раз подчеркивается появлением резистентных к антибиотикам штаммов (например, резистентные к метициллину штаммы Staphylococcus aureus (MRSA)), включая штаммы, резистентные к ванкомицину, антибиотику, который считается последней линией защиты против инфекции S. aureus. Данные факты подчеркивают важность разработки новых терапевтических препаратов против этого сильного возбудителя.
[0004] S. aureus выпускает широкий спектр факторов вирулентности и токсинов, которые позволяют этой бактерии нейтрализовать и противостоять атакам различных видов клеток иммунной системы, в частности субпопуляции белых кровяных клеток, из которых состоят тела первичной системы защиты. Создание этих факторов вирулентности и токсинов позволяют S. aureus сохранять инфекционное состояние, см. Низет, «Понимание того, как главные бактериальные патогены разрушают врожденный иммунитет для выявления новых терапевтических целей», - J. Allergy Clin. Immunol. 120(1):13-22 (2007). Среди этих факторов вирулентности, S. aureus производит несколько би-компонентных лейкотоксинов, разрушающих мембраны клеток, которые отвечают за иммунную защиту организма, и эритроцитов синергетического действия двух не связанных белков или субъединиц (см. Менестрина и др., «Механизм действия бета бочкообразных порообразующих токсинов семейства альфа-гемолизиновых стафилококков», Токсикол. 39(11):1661 1672 (2001)). Среди этих би-компонентных лейкотоксинов лучше всего описан гамма-гемолизин (HlgAB и HlgCB) и лейкоцидин Пантон-Валентина (PVL).
[0005] Токсичность лейкоцидинов в клетках млекопитающих включает в себя действия двух компонентов или субъединиц. Первая субъединица называется субъединицей класса S (т.е. «медленно элюирующая»), а вторая субъединица называется субъединицей класса F (т.е. «быстро элюирующая»). S- и F-субъединицы действуют синергически для формирования пор в белых клетках крови, в том числе моноцитах, макрофагах, дендритных клетках и нейтрофилах (в целом известных, как фагоциты) (см. Менестрина и др., «Механизм действия бета бочкообразных порообразующих токсинов семейства альфа-гемолизиновых стафилококков», Токсикол. 39(11):1661 1672 (2001)). Механизм, с помощью которого би-компонентные токсины образуют поры в клетках-мишенях мембран, не совсем понятен. Предполагаемый механизм действия этих токсинов включает в себя связывание S-субъединицы к мембране клетки-мишени, вероятно, за счет рецепторов с последующим связыванием F-субъединицы и S-субъединицы, тем самым формируя олигомер, который, в свою очередь, формирует предпору, которая вводится в мембрану клетки-мишени, Jayasinghe и др., «Пора лейкосодина: Данные для октамера с четырьмя субъединицами LukF, а также четырьмя субъединицами LukS переменной вокруг центральной оси», Protein. Sci. 14(10):2550 2561 (2005). Поры, образованные би-компонентными лекотоксинами, обычно катионоизбирательные. Порообразование приводит к гибели клеток через медленное ослабление, которое приводит целевые белые кровяные клетки, как сообщают, к осмотическому дисбалансу из-за притока катионов (Майлз и др., «Лейкоцидин стафилококка би-компонентного токсина формирует большие ионные каналы», Биохимия 40(29):8514 8522 (2001)).
[0006] В дополнение к PVL (также известного как лейкоцидин S/F-PV или LukSF-PV) и гамма-гемолизин (HlgAB и HlgCB), набор би-компонентных лейкотоксинов вызванных S. aureus, как известно, включает лейкоцидин E/D («LukE/D»), лейкоцидин A/B («LukAB») и лейкоцидин М/F («LukMF»). Таким образом, субъединицы класса S этих би-компонентных лейкоцидинов включают HlgA, HlgC, LukE, LukS-PV, LukA и LukM, и субъединицы класса F включают HlgB, LukD, LukF-PV, LukB, и LukF'-PV. S- и F-субъединицы S. aureus не являются характерными лейкоцидинами. То есть, они являются взаимозаменяемыми таким образом, что другие би-компонентные комбинации могли бы образовать функциональную пору в белых кровяных клетках, что значительно увеличивает набор лейкотоксинов, Мэйер и др., «Анализ специфики связи лейкоцидина Пантон-Валентина и компонента F гамма-гемолизина,» Infect. Immun. 77(1):266 273 (2009)).
[0007] Создание эффективной терапии для лечения инфекции MRSA было особенно сложным. В дополнение к резистентности к метициллину и соответствующим антибиотикам, в MRSA также были обнаружены существенные уровни резистентности к макролидам (например, эритромицину), бета-лактамазным ингибиторным комбинациям (например, уназину, аугментину), фторхинолонам (например, ципрофлоксацину), а также клиндамицину, триметоприму/сульфаметоксизолу (бактрим), и рифампину. В случае тяжелой инфекции S. aureus, врачи прибегают к введению ванкомицина внутривенной инъекцией. Тем не менее, есть доклады о резистентности S. aureus к ванкомицину. Таким образом, существует необходимость разработать новые способы лечения, эффективного противодействия инфекции S. aureus.
[0008] Настоящее изобретение направлено на преодоление этих и других ограничений в данной области.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0009] Первый аспект данного изобретения относится к композиции, содержащей терапевтически фактическое количество изолированного белка или полипептида лейкоцидина E (LukE), изолированного белка или полипептида лейкоцидина D (LukD) или их комбинацию, и фармацевтически допустимого носителя.
[0010] Другой аспект настоящего изобретения относится к способу иммунизации против инфекции золотистого стафилококка у пациента. Этот способ включает в себя введение композиции настоящего изобретения в эффективной дозе для создания устойчивости иммунитета против инфекции S. aureus у пациента.
[0011] Следующий аспект данного изобретения относится к композиции, содержащей терапевтически эффективное количество антител, выбранных из группы, которая содержит антитело к LukE, антитело к LukD, или их комбинации, и фармацевтически допустимый носитель.
[0012] Следующий аспект настоящего изобретения направлен на способ профилактики инфекции S. aureus и/или состояний здоровья человека, связанных с S. aureus. Этот способ включает в себя применение композиции, содержащей антитело, которое выбрано из группы, которая содержит антитело к LukE, антитело к LukD, или их комбинации, в эффективной дозе для профилактики инфекции S. aureus и/или состояния здоровья человека, связанного с S. Aureus.
[0013] Следующий аспект изобретения направлен на способ лечения инфекции S. aureus и/или состояний здоровья человека, связанных с S. aureus. Этот способ включает в себя применение композиции, содержащей один или несколько ингибиторов LukE/D, которые служат связующим звеном цитотоксичности в эффективной дозе при лечении инфекции S. aureus и/или S. aureus, связанного с состоянием здоровья человека.
[0014] Следующий аспект настоящего изобретения относится к способу прогнозирования тяжести инфекции S. aureus. Этот способ включает культивирование бактерий S. aureus, полученных от зараженного человека посредством образца жидкости или ткани у пациента, и количественное выражение LukE и/или LukD культивированных бактерий S. aureus. Количество LukE и/или LukD в образце человека, по сравнению с количеством LukE и/или LukD в контрольном образце, который вырабатывает малое или неопределенное количество LukE и/или LukD, и тяжесть инфекции S. aureus прогнозируется на основе вышеуказанного сравнения.
[0015] Следующий аспект данного изобретения связан со способом лечения пациента с инфекцией S. aureus. Этот способ включает культивирование бактерий S. aureus, полученных от зараженного пациента посредством жидкости или ткани пациента и количественного выражения LukE и/или LukD культивированных бактерий S. aureus. Количество LukE и/или LukD в образце пациента по сравнению с количеством LukE и/или LukD в контрольном образце, который вырабатывает малое или неопределенное количество LukE и/или LukD, и соответствующее лечение пациента определяется на основе этого сравнения. Способ предполагает дальнейшее применение определенного соответствующего курса лечения для пациента с инфекцией S. aureus.
[0016] Следующий аспект настоящего изобретения связан со способом определения ингибиторов LukE/D цитотоксичности. Этот способ предусматривает популяцию клетки, препарат, содержащий LukE/D, и применяемый ингибитор LukE/D. Популяция клетки подвергается воздействию препарата, содержащего LukE/D в присутствии и в отсутствие применяемого ингибитора, и опосредованная цитотоксичность LukE/D измеряется в присутствии и в отсутствие применяемого ингибитора. Измеряемое количество цитотоксичности сравнивается в присутствии и в отсутствие применяемого ингибитора и ингибитор цитотоксичности LukE/D определяется на основе этого сравнения.
[0017] Следующий аспект настоящего изобретения связан со способом определения ингибиторов опосредованного порообразования LukE/D. Этот способ предусматривает популяцию лейкоцитов, препарат, содержащий LukE и LukD, и применяемый ингибитор. Популяция лейкоцитов подвергается воздействию препарата, содержащего LukE и LukD в присутствии и в отсутствие применяемого ингибитора, и порообразование популяции лейкоцитов измеряется в присутствии и в отсутствие кандидата ингибитора. Сравнивается измеряемое количество порообразования в присутствии и в отсутствие применяемого ингибитора, и ингибитор LukE/D опосредованного порообразования определяется на основе сравнения.
[0018] Следующий аспект настоящего изобретения направлен на способ идентификации ингибиторов LukE и/или LukD, связывающихся с лейкоцитами. Этот способ предусматривает популяцию лейкоцитов, препарат, содержащий выявленные меченые LukE и LukD, и применяемый ингибитор. Популяция клетки подвергается воздействию препарата, содержащего выявленные меченые LukE и LukD в присутствии и в отсутствие применяемого ингибитора, и меченые LukE и/или LukD, связывающиеся с популяцией лейкоцитов, измеряются в присутствии и в отсутствие применяемого ингибитора. Сравнивается измеряемое количество LukE и/или LukD, связывающихся с лейкоцитами в присутствии и в отсутствие применяемого ингибитора и ингибитор LukE и/или LukD, связывающийся с лейкоцитами, определяется на основе сравнения.
[0019] Большой успех S. aureus в качестве возбудителя достигает отчасти из-за своей способности отображать большое количество факторов, которые наносят вред человеку. Среди этих факторов можно выделить ряд бактериальных белковых токсинов, которые скрываются во внеклеточной среде, где они действуют, убивая клетки человека. Лейкоцидин E/D (LukE/D) представляет собой плохо характеризующийся токсин, вырабатываемый S. aureus. Как показано в настоящем изобретении, этот токсин поражает и убивает лейкоциты человека, которые являются ключевыми иммунными клетками, участвующими в защите организма человека от инфекции S. aureus. Данные исследования иллюстрируют, что LukE/D является критическим фактором патогенеза в организме человека, подчеркивают важность этого токсина в процессе болезни. Как описано здесь, иммунизация LukE и/или LukD производит нейтрализующие антитела против S. aureus. Таким образом, активные и/или пассивные стратегии вакцинации предлагают новую терапевтическую стратегию для профилактики инфекции S. aureus. Кроме прямого торможения LukE/D опосредованная цитотоксичность предлагает новое средство лечения пациентов с инфекцией S. Aureus.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0020] Фигуры 1А-1B иллюстрируют делецию поврежденного гена при отсутствии локуса S. aureus agr (ΔagrΔrot), который восстанавливает вирулентность у мышей на уровне дикого типа («ДТ») и приводит к переработке LukE/D. На фигуре 1А кривая выживания показывает, что удвоенный мутант Δagr Δrot показывает характеристики вирулентности у мышей ДТ. Наблюдалась выживаемость мышей после введения внутривенной инъекцией ~1×107 CFU S. aureus ДТ, Δagr, или удвоенных мутантов ΔagrΔrot. Общее количество мышей в каждой группе составляло N=6. Статистическая значимость между кривыми была определена с помощью логрангового критерия (критерия Кокса-Мантеля) ***, p≤0,0005. На фигуре 1B выработка лейкотоксинов восстанавливается у удвоенных мутантов ΔagrΔrot. Проиллюстрированы образцы белка иммуноблотов из трихлоруксусной кислоты (ТХК), которые образуют осадок бактериальных супернатантов активированных клеток (выращенных в течение 5 часов в RPMI+CAS) следующих штаммов: ДТ, Δagr, и ΔagrΔrot. Отрицательные контрольные полосы содержат ТХК, которые образуют осадок из супернатанта лейкотоксина соответствующих разрушенных мутантов (ΔlukE/D, ΔlukA/B, Δhla, ΔhlgC). Δ lukE/D ΔhlgACB двойных мутантных эксопротеинов были также опробованы во всех иммуноболитах LukE в качестве контроля для перекрестной реактивности антитела LukE.
[0021] Фигуры 2А-2В показывают, что делеция повреждения вызывает гипервирулентность только у животных, фенотипа, вызванного дерепрессией и получающейся в результате переработки LukE/D. Кривая выживания на фигуре 2А показывает гипервирулентность мутанта Δrot по сравнению с родительским штаммом ДТ. Наблюдалась выживаемость мышей после введения внутривенной инъекцией ~1×107 CFU S. aureus ДТ и штаммов Δrot. Общее количество мышей в каждой группе: ДТ, N=17; Δrot, N=12. Выработка LukE/D увеличивается в отсутствии транскрипционного репрессора Rot, в то время как выработка других лейкотоксинов в значительной степени остается неизменной. В иммуноблотах на фигуре 2B показаны образцы белка ТХУ осажденных бактериальных супернатантных активированных клеток (выращиваемых в течение 5 часов в RPMI+CAS) следующих штаммов: ДТ, и Δrot. Отрицательные контрольные полосы содержат осажденный супернатант ТХК из соответствующих токсинраспадающихся двойных мутантов (Δrot ΔlukE/D, Δrot ΔlukA/B, Δrot Δhla, и Δrot ΔhlgACB). Также были испытаны тройные мутирующие эксопротеины Δrot ΔlukE/D ΔhlgACB во всех иммуноблотах LukE в качестве контроля для перекрестной реактивности антитела LukE.
Как показано на кривой выживания, на фигуре 2C гипервирулентность мутанта Δrot увеличивается за счет выработки LukE/D. Наблюдалась выживаемость мышей после введения внутривенной инъекцией ~1×107 CFU S. aureus ДТ, Δrot, и Δrot ΔlukE/D. Статистическая значимость между кривыми выживаемости была определена с помощью логрангового критерия (критерия Кокса-Мантеля) **, p≤0,005; ***, p≤0,0005.
[0022] Фигуры 3А-3В иллюстрируют, что ген распада связывает промотор lukE/D и подавляет выражение генов. Как показано на фигуре 3А, оптимальное выражение генов зависит от дерепрессии распада. Были использованы транскрипционные сплавы зоны промотора lukE/D к GFP для измерения активации промотора в бульонной культуре в следующих фонах штамма (ДТ, Δagr, Δrot, и Δagr Δrot). Флуоресценция GFP была измерена с течением времени и значения выражены в виде относительных флуоресцентных единиц (RFU) после нормализации бактериальной оптической плотности в 600 нм. Показанные значения являются результатом трех экспериментов, представленных в трех экземплярах. На фигуре 3B ген распада связывает промотор lukE/D. На фигуре 3B иммуноблот промотора или снижает биотинилированный внутригенный ДНК (неспецифический), или промотор lukE/D ДНК привязывается к стрептавидиновым магнитным шарикам M280 и инкубируется со всеми клеточными лизатами S. aureus. Ген распада был обнаружен с помощью иммуноблота с использованием антител анти-распада.
[0023] Фигуры 4A-4F свидетельствуют о том, что единственный мутант ΔlukE/D значительно ослабляется по степени вирулентности в модели мыши системной инфекции. Фигуры 4A и 4B иллюстрируют верификацию делеции lukE/D в S. aureus по Ньюмену. На фигуре 4А показана ПЦР геномной ДНК S. aureus со специфическими праймерами lukE. На фигуре 4B проиллюстрированы образцы белка иммуноблотов из ТХК осажденных бактериальных супернатантов активированных клеток (выращиваемых в течение 5 часов в RPMI+CAS) следующих штаммов: ДТ, ΔlukE/D, ΔlukE/D::plukE/D, ΔhlgACB, и ΔhlgACB. Эксопротеины мутанта ΔlukE/D исследовались также в качестве контроля для перекрестной реакции антитела LukE. Фигуры 4C-4F иллюстрируют, что мутант ΔlukE/D подвергается серьезному риску при вирулентности у мышей. На фигурах 4C и 4D наблюдается выживаемость мышей после введения внутривенной инъекцией ~1×107 CFU (Фиг. 4C) или ~1×108 CFU (фигура 4D) S. aureus ДТ, ΔlukE/D, и ΔlukE/D::plukE/D штаммов. Общее количество мышей в каждой группе составляло N=6. Статистическая значимость между кривыми выживаемости была определена с помощью логрангового критерия (критерия Кокса-Мантеля) **, p≤0,005; ***, p≤0,0005. Фигуры 4E и 4F изображают подсчет бактериальной КОЕ (фигура 4Е) и явной патологии (фигура 4F) почек на протяжении 96 часов после заражения ~1×107 CFU тех же штаммов, описанных на фигурах 4C и 4D. Стрелки обозначают расположение нарывов на почках. Статистическая значимость была определена по способу 1-Way ANOVA с помощью итогового тестирования множественного сравнения Тьюки **, p≤0,005; ***, p≤0,0005.
[0024] Фигуры 5A-5E иллюстрируют, что LukE/D токсичен и образует поры в иммунных клетках. Фигура 5A - представляет собой кривую жизнеспособности клеток, показывающую, что очищенный рекомбинантный LukE/D является токсичным для моноцитарно-подобной клеточной линии THP-1 человека. Клеточная линия THP-1 была заражена рекомбинантным LukE, LukD, или смесью LukE+LukD (LukE/D). За жизнеспособностью клеток следили в течение 1 часа после интоксикации с помощью CellTiter, где клетки, обработанные средством, были определены как 100% жизнеспособные. Результаты представляют собой среднее из тройных образцов ± С.О. (стандартное отклонение). Очищенный рекомбинантный ген LukE/D не является токсичным для клеток человека линии HL60, как показано на кривой жизнеспособности клеток на фигуре 5В. Линия клеток HL60 была заражена (см. выше) и за жизнеспособностью клеток следили в течение 1 часа после интоксикации с помощью CellTiter, где клетки, обработанные средством, были определены как 100% жизнеспособные. В отличие от этого, кривые жизнеспособности клеток на фигуре 5C иллюстрируют очищенный рекомбинантный LukE/D, который токсичен для нейтрофилов как человека (левый график), так и мышей (правый график) (также известные как полиморфноядерные нейтрофилы, или PMNs). PMNs были заражены, как указывалось выше, и за жизнеспособностью клеток следили в течение 1 часа после интоксикации с помощью CellTiter, где клетки, обработанные средством, были определены как 100% жизнеспособные. Ген LukE/D является посредником цитотоксичности по отношению к принимающей клетке THP-1 клетки, формируя поры в мембране клетки, как показано на фигуре 5D. Клетки THP-1 и HL60 были культивированы очищенным геном LukE/D, и порообразование определялось смешанным анализом с бромидом эдития. Была показана низкая флуоресценция тройных экспериментов как для THP-1, так и для HL60. Фигура 5E показывает флуоресцентное микроскопическое изображение поглощения очищенного гена LukE/D бромидом эдития (30 мг/мл) и контроль (без токсинов) THP-1 клетки.
[0025] Фигуры 6А-6В иллюстрируют, что цитотоксичность LukE/D нейтрализуется сходством с поликлональным очищенным антителом α-LukE. Клетки THP-1, находившиеся в отравленном состоянии с 1,5 мг рекомбинантными LukE/D после инкубации с 0,1 мг α-LukE поликлональным антителом или предиммунной сывороткой. Жизнеспособность клеток (фигура 6A) и порообразование (фигура 6B) контролировались с помощью CellTiter и БЭ соответственно. Для анализов CellTiter, клетки, обработанные средством, были определены как 100% жизнеспособные. Результаты представляют собой среднее значение дубликатов проб ± стандартное отклонение (С.О.).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0026] Первый аспект настоящего изобретения относится к композиции, которая содержит терапевтически эффективное количество изолированного белка LukE или его полипептида, изолированного белка LukD или его полипептида, или их комбинацию, и фармацевтически приемлемый носитель.
[0027] В одном примере изобретения композиция содержит изолированный белок LukE или полипептид. В другом примере изобретения композиция содержит изолированный белок LukD или его полипептид. В другом примере изобретения содержатся белки, как LukE, так и LukD и их полипептиды.
[0028] В соответствии с этим аспектом изобретения соответствующие изолированные белки LukE включают производные от любого штамма S. aureus. Последовательность аминокислот белков LukE различных штаммов S. aureus, которые подходят для композиции данного изобретения, приведена в Таблице 1 ниже (т.е. SEQ ID NOS:1-10). SEQ ID NO:11 Таблица 1 представляет собой консенсусную последовательность LukE, которая показывает высокий уровень идентичной последовательности у белков LukE различных штаммов S. aureus. Соответственно, в одном из примеров изобретения, изолированный белок LukE содержит аминокислотную последовательность SEQ ID NO:11. В другом примере настоящего изобретения изолированный белок LukE содержит аминокислотную последовательность, которая имеет около 70-80% идентичной последовательности SEQ ID NO:11, преимущественно около 80-90% идентичной последовательности SEQ ID NO:11, и преимущественно 90-95% идентичной последовательности SEQ ID NO:11, и преимущественно 95-99% идентичной последовательности SEQ ID NO:11.
[0029] В другом примере настоящего изобретения композиция содержит изолированный иммуногенный полипептид LukE. Соответствующие полипептиды LukE содержат от 50 до 100 аминокислот в длину. Более предпочтительные полипептиды LukE содержат около 100-200 аминокислот в длину, преимущественно 200-250 аминокислот в длину, и наиболее предпочтительно 250-300 аминокислот в длину. N-терминальные аминокислотные остатки полной длины LukE представляют врожденную секрецию/последовательность сигналов. Таким образом, «зрелая» секретная форма LukE представлена аминокислотными остатками 29-311 в каждом SEQ ID NO:1-10 и SEQ ID NO:11. Соответственно, аминокислотные остатки 1-311 в каждом SEQ ID NO:1-10 и SEQ ID NO:11 называются «незрелые» в форме LukE. Соответственно, в одном из примеров изобретения, полипептид LukE содержит аминокислотные остатки 29-311 SEQ ID NO:11. Кроме того, полипептид LukE изобретения содержит аминокислотные остатки 48-291, аминокислоты 29-301, или аминокислоты 48-301 SEQ ID NO:11. Этих полипептидов LukE недостаточно для деятельности LukE, но они поддерживают антигенность. В любом случае, к соответствующим полипептидам LukE также относятся те полипептиды, которые включают последовательность аминокислот и имеют 70-80% идентичной последовательности, преимущественно 80-90% идентичной последовательности, более предпочтительно 90-95% идентичной последовательности, и наиболее предпочтительно 95-99% идентичной последовательности аминокислотных остатков 29-311 SEQ ID NO:11, аминокислотных остатков 48-291 SEQ ID NO:11, аминокислотных остатков 29-301 SEQ ID NO:11, или аминокислотных остатков 48-301 SEQ ID NO:11.
[0030] В соответствии с этим аспектом изобретения соответствующие изолированные белки LukD включают те протеины, которые получены из любого штамма S. aureus. Последовательность аминокислот белков LukD из различных штаммов S. aureus, которые подходят для композиции данного изобретения, приведена в Таблице 2 ниже (т.е. SEQ ID NO: 12-21). SEQ ID NO:22 Таблица 2 представляет собой консенсусную последовательность LukD и показывает высокий уровень идентичной последовательности белков LukD различных штаммов S. aureus. Соответственно, в одном из примеров изобретения изолированный белок LukD состоит из аминокислотной последовательности SEQ ID NO:22. В другом примере настоящего изобретения изолированный белок LukD содержит аминокислотную последовательность, которая имеет 70-80% идентичной последовательности для SEQ ID NO:22, преимущественно 80-90% идентичной последовательности для SEQ ID NO:22, и более предпочтительно 90-95% идентичной последовательности для SEQ ID NO:22, и наиболее предпочтительно 95-99% идентичной последовательности для SEQ ID NO:22.
[0031] В другом примере настоящего изобретения композиция состоит из изолированного иммуногенного полипептида LukD. Соответствующие полипептиды LukD имеют от 50 до 100 аминокислот в длину. Более предпочтительны полипептиды LukD с 100-200 аминокислотами в длину, более предпочтительны с 200-250 аминокислотами в длину, и наиболее предпочтительно с 250-300 аминокислотами в длину. N-терминальные аминокислотные остатки LukD в полную длину представляют врожденную секрецию/последовательность сигналов. Таким образом, зрелые секретированные формы LukD представлены аминокислотными остатками 27-327 в каждом SEQ ID NO:12-21 и SEQ ID NO:22. Соответственно, аминокислотные остатки 1-327 SEQ ID NO:12-21 и SEQ ID NO:22 называются «незрелой» формой LukD. Соответственно, в одном из примеров изобретения полипептид LukE состоит из аминокислотных остатков 27-327 SEQ ID NO:22. Кроме того, полипептид LukE изобретения содержит аминокислотные остатки 46-307, 27-312, и 46-312 SEQ ID NO:22. Этих полипептидов LukD недостаточно для деятельности LukD, но они поддерживают антигенность. В любом случае соответствующие полипептиды также включают те полипептиды, которые содержат последовательность аминокислот с 70-80% идентичной последовательностью, преимущественно с 80-90% идентичной последовательностью, более предпочтительно с 90-95% идентичной последовательностью, и наиболее предпочтительно с 95-99% идентичной последовательностью аминокислотных остатков 27-327 SEQ ID NO:22, аминокислотных остатков 46-307 SEQ ID NO:22, аминокислотных остатков 27-312 SEQ ID NO:22 или аминокислотных остатков 46-312 SEQ ID NO:22.
Выстраивание последовательности S. aureus LukE
 Изображает начало выделяемого белка LukE
Изображает начало выделяемого белка LukE
Выстраивание последовательности LukD аминокислоты
[0032] Таким образом, если только не указано иное, как незрелые, так и зрелые формы врожденных LukE и LukD, и последовательности, имеющие менее 100% идентичности с врожденными LukE и LukD (т.е. врожденные последовательности и их аналоги, далее вместе именуемые как «LukE» и «LukD»), могут использоваться в способах данного изобретения.
[0033] Белки и полипептиды LukE и LukD изобретения могут отличаться от врожденных полипептидов, таких как SEQ ID NOS:1-11 и 12-22 соответственно, в пересчете на одну или несколько дополнительных аминокислотных вставок, замен или удалений. Например, один или несколько аминокислотных остатков в пределах SEQ ID NOS:1-22 может быть заменен на другую аминокислоту аналогичной полярности, которая выступает в качестве функционального эквивалента и вызывает бесшумное изменение. То есть, изменение относительно врожденной последовательности не будет заметно уменьшать основные свойства врожденных LukE или LukD. Любой такой аналог LukE или LukD может быть проверен в соответствии с протоколами, описанными в настоящем изобретении (например, анализа клеточной токсичности и повреждения мембран), чтобы определить, поддерживает ли он деятельность врожденных LukE или LukD. Замены могут выбираться в пределах этих лейкоцидинов из других представителей класса, которому аминокислота принадлежит. Например, неполярные (гидрофобные) аминокислоты включают аланин, лейцин, изолейцин, валин, пролин, фенилаланин, триптофан, метионин. Полярные нейтральные аминокислоты включают глицин, серин, треонин, цистеин, тирозин, аспарагин и глютамин. Положительно заряженные (основные) аминокислоты включают аргинин, лизин и гистидин. Отрицательно заряженные (кислотные) аминокислоты содержат аспарагиновую кислоту и глютаминовую кислоту.
[0034] В других примерах неконсервативные изменения (например, аминокислотные замены, делеции и/или дополнения) могут быть сделаны для целей детоксикации LukE и/или LukD. В обезвреженных генах LukE и LukD может использоваться вакцин в активном составе. Молекулярные изменения могут быть достигнуты способами, хорошо известными в данной области, в том числе праймер расширением шаблона плазмиды с помощью шаблонов одной молекулярной цепочки, Kunkel et al., Proc. Acad. Sci., USA 82:488-492 (1985 г.), посредством ссылки в целом, двуцепочных шаблонов ДНК, Papworth, et al., Strategies 9(3):3-4 (1996), посредством ссылки в целом, и способом клонирования PCR, Braman, J. (ed.), ПРОТОКОЛЫ МУТАГЕНЕЗА В ИСКУССТВЕННЫХ УСЛОВИЯХ, 2nd ed. Humana Press, Totowa, N.J. (2002), посредством ссылки в целом). Здесь описаны способы, которые определяют, снижает ли данное молекулярное изменение в LukE и LukD цитотоксичность LukE/D.
[0035] В соответствующем примере изобретения используется высокоочищенный препарат LukE/LukD. Примеры включают белки и полипептиды LukE и LukD, которые очищены от различных штаммов и проиллюстрированы в Таблицах 1 и 2. Способы очистки токсинов LukE и LukD известны в данной области (Гравет и др., «Характеристика нового структурного элемента, LukE-LukD, семейства би-компонентных стафилококковых лейкотоксинов», FEBS 436: 202-208 (1998 г.), посредством ссылки в целом). Как используется здесь, «изолированный» белок или полипептид относится к белку или полипептиду, который был отделен от других белков, липидов, нуклеиновых кислот, с которыми он, естественно, был связан. Чистота может быть измерена с помощью любых соответствующих стандартам способов, например, способом колоночной хроматографии, электрофореза в полиакриламидном геле, анализа HPLC. Изолированные белок или полипептид данного изобретения могут быть очищены из естественного источника, полученного способом рекомбинантной ДНК-технологии или химическими способами.
[0036] В одном из примеров этого аспекта настоящего изобретения изолированные белок или полипептид LukE или LukD состава связаны с иммуногенным носителем молекулы. В некоторых случаях аллергенный носитель молекулы может быть ковалентно или не-ковалентно связан с аллергенным белком или пептидом. Образцовый иммуногенный носитель молекул содержит, но не ограничивается, бычий сывороточный альбумин, яичный овальбумин цыпленка, гемоцианин, столбнячный токсин, дифтерийный токсин, тиреглобулин, капсульный полисахарид пневмококка, CRM 197, белок наружной мембраны менингококка.
[0037] В определенных примерах изобретения композиция дополнительно может содержать один или несколько дополнительных антигенов S. aureus. Соответствующие антигены S. aureus содержат, но не ограничиваются, антиген альфа гемолизин, белок А, полисахаридный антиген серотипа 336, коагулазу, фактор слипания B, связывающийся с белком фибронектина, связывающийся с белком фибриногена, связывающийся с белком коллагена, связывающийся с белком эластина, аналог белка главного комплекса гистосовместимости, полисахарид внутриклеточной адгезии, бета гемолизин, дельта гемолизин, гамма гемолизин, лейкоцидин Пантон-Валентина, лейкоцидин B, лейкоцидин М, эксфолиативный токсин А, эксфолиативный токсин В, протеазу V8, гиалуронат лиазы, липазы, стафилокиназы, энтеротоксин, токсин-1 синдрома токсического шока, поли-N-сукцинал бета-1→6 глюкозамина, каталазу, бета-лактамазу, тейхоевую кислоту, пептидогликан, связывающийся белок с пенициллином, ингибирующий хемотаксис белка, ингибитор комплемента, Sbi, антиген типа 5, антиген типа 8, липотейхоевую кислоту и микроорганизмы поверхностных белков, которые распознают белки хозяина (например, распознающие поверхности определителя железа, серин-аспартат повторяющихся белков).
[0038] В соответствии с этим аспектом изобретения композиция дополнительно может содержать один или несколько адъювантов. Соответствующие адъюванты, как известно в данной области, содержат, но не ограничиваются, флагеллин, полные или неполные адъюванты Фрейнда, гидроксид алюминия, лизолецитин, поверхностно-активные плурониковые полиолы, полианионы, пептиды, масляную эмульсию, динитрофенол, искоматрикс, и липосомные поликатионные частицы ДНК.
[0039] В примерах, где терапевтическая композиция предназначена для использования в качестве активной вакцины, белки и полипептиды LukE и/или LukD могут быть изменены для проявления пониженной токсичности. Изменения в целях уменьшения токсичности LukE и/или LukD содержат химическую обработку (например, изменение определенных аминокислотных остатков, как описано выше) или конъюгацию в другой части (например, на другом бактериальном антигене, таком как бактериальный полисахарид или бактериальный гликопротеин). Химические изменения известны в других токсинах S. aureus в целях дезинтоксикации (или снижения токсичности). Способы определения того, снижает ли данное изменение токсичность LukE и/или LukD, известны в данной области и/или описаны в настоящем изобретении.
[0040] Лечебные композиции изобретения изготовлены по разработке LukE и/или LukD фармацевтически допустимым носителем и, при необходимости, фармацевтически допустимым наполнителем. Используемые здесь термины «фармацевтически допустимый носитель» и «фармацевтически допустимые вещества» (например, добавки, такие как разбавители, иммуностимуляторы, активирующие добавки, антиоксиданты, консерванты и агенты растворения) не токсичны для клетки млекопитающих при дозировках и концентрациях. Примеры фармацевтически допустимых носителей содержат воду, например, буферизованный фосфат, цитрат и другие органические кислоты. К типичным примерам фармацевтически допустимых вспомогательных веществ, которые могут быть полезны в настоящем изобретении, относятся антиоксиданты, такие как аскорбиновая кислота; полипептиды с низкой молекулярной массой (менее 10 остатков); белки, такие как сывороточные альбумины, желатин, или иммуноглобулины; адъюванты, которые отбираются таким образом, чтобы избежать адъювантной-индуцированной токсичности, такие как бета-глюкан, как полностью описано в U.S. Patent 6355625 по ссылке, или гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМКФ); гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, аргинин или лизин; моносахариды, дисахариды, и другие углеводы, в том числе глюкоза, манноза, или декстринов; хелатирующие агенты, такие как ЭДТА, сахарные спирты, такие как маннитол или сорбит, соль, образующая противоионы, такие, как натрий; и/или неионогенные поверхностно-активные вещества, такие как TWEEN®, полиэтиленгликоль (PEG), и плуроники SuperDrive.
[0041] Лечебные композиции изобретения могут быть изготовлены для хранения путем смешивания активного ингредиента(ов), обладающего требуемой степени чистоты фармацевтически допустимого носителя и дополнительных вспомогательных веществ и/или дополнительного активного агента, в форме лиофилизированных препаратов или водных растворов.
[0042] Другой аспект настоящего изобретения относится к способу иммунизации против инфекции золотистого стафилококка у пациента. Этот способ включает в себя введение композиции настоящего изобретения в размере эффективной иммунизации против инфекции S. aureus у пациента. Соответствующий пациент для лечения в соответствии с этим аспектом настоящего изобретения является субъектом с риском развития инфекции S. aureus.
[0043] В соответствии с этим аспектом изобретения терапевтически эффективное количество композиции, применяемое для иммунизации против инфекции S. aureus, представляет собой количество, необходимое для формирования гуморального (т.е. опосредованного антитела) иммунного ответа. Преимущественно, введение терапевтически эффективного количества композиции данного изобретения способствует нейтрализации иммунного ответа против S. aureus у пациента. Для осуществления эффективного иммунного ответа у пациента композиция дополнительно может содержать один или несколько дополнительных антигенов или вспомогательное средство S. aureus, как описано выше. В альтернативном примере этого аспекта изобретения вспомогательное средство вводится отдельно от композиции человеком, либо до, после или одновременно с введением композиции данного изобретения.
[0044] Режимы введения и терапевтически эффективная дозировка, связанные с этим аспектом изобретения, описаны ниже.
[0045] Другой аспект настоящего изобретения относится к композиции, которая содержит терапевтически эффективное количество антител, выбранных из группы, которая состоит из антитела к лейкоцидину E (LukE), антитела к лейкоцидину D (LukD), или их комбинаций, и фармацевтически допустимого носителя.
[0046] В одном из примеров этого аспекта настоящего изобретения композиция содержит антитело к LukE или фрагмент связывающего антигена. Подходящие антитела к LukE включают такие антитела, которые признают один или несколько эпитопов в аминокислотной последовательности SEQ ID NO:11. Аналогично, в другом примере, композиция содержит антитело к LukD или его фрагмент, связанный с антигеном. Подходящие антитела к LukD распознают один или несколько эпитопов в аминокислотной последовательности SEQ ID NO:22. В другом примере изобретения композиция содержит антитела как к LukE, так и к LukD или его фрагменты, связанные с антигеном. Предпочтительно, чтобы композиция содержала один или несколько нейтрализующих антител к LukE и/или к LukD. В другом примере композиция анти-LukE и/или анти-LukD антитела многовалентная, потому, что она также содержит антитело, специально связанное с другим бактериальным антигеном (и при необходимости нейтрализует другие бактериальные антигены). Например, композиция может содержать одно или несколько антител, которые распознают один или несколько дополнительных антигенов S. aureus, в том числе, без ограничений, один или несколько антигенов S. aureus, описанных выше.
[0047] Для целей настоящего изобретения термин «антитело» содержит моноклональные антитела, поликлональные антитела, фрагменты антитела, генетически модифицированные формы антител, а также их комбинации. В частности, термин «антитело», который используется в качестве синонима термина «иммуноглобулин», включает полную длину, т.е. залегающий от рождения или образованный нормальным геном иммуноглобулин, который отвечает за рекомбинаторные процессы, молекулы иммуноглобулина (например, антитело IgG) и иммунологически активные фрагменты (т.е. те, которые содержат конкретную привязку части полной молекулы иммуноглобулина человека), что опять же может иметь естественный или синтетический характер. Соответственно, термин «фрагмент антитела» содержит в себе часть антител, таких как F(ab')2, F(ab)2, Fab', Fab, Fv, scFv и тому подобное. Независимо от структуры фрагмент антитела связывается с тем же антигеном, который распознается антителом в полную длину, а также в контексте настоящего изобретения специфически привязывается к LukE, LukD, или комплексу LukE/D. Способы приготовления и скрининга фрагментов антитела хорошо известны в данной области.
[0048] В настоящем изобретении анти-LukE антитела могут иметь некоторую степень перекрестной реактивности с другими S-субъединицами лейкоцидина стафилококка, такими как HlgC, LukS-PVL, HlgA, LukS-PV, LukA, и LukM. Аналогичным образом в некоторых вариантах анти-LukD антитела настоящего изобретения могут иметь некоторую степень перекрестной реактивности с другими F-субъединицами лейкоцидина стафилококка, такими как LukF'-PV, LukF-PV, LukB, LukF-I, и HlgB. Анти-LukE и/или анти-LukD антитела могут ингибировать или ослабить активность LukE и активность LukD соответственно. В некоторых примерах анти-LukE и/или анти-LukD антитела нейтрализуют (например, существенно элиминируют) активность LukE и LukD соответственно.
[0049] Врожденно прилегающие антитела обычно имеют две одинаковые тяжелые цепочки и две одинаковые легкие цепочки, каждая легкая цепочка ковалентно связана с тяжелой цепочкой дисульфидной связью промежуточной цепочки и несколькими дисульфидными связями в дальнейшем для связи двух тяжелых цепочек друг с другом. Отдельные цепочки могут сворачиваться в доменах, имеющих сходные размеры (110-125 аминокислот) и структурах, но с различными функциями. Легкая цепочка может состоять из одного переменного домена (VL) и/или одного постоянного домена (CL). Тяжелая цепочка может также включать в себя один переменный домен (VH) и/или, в зависимости от класса или изотипа антитела, три или четыре постоянных доменов (CHI, CH2, CH3 и CH4). У людей изотипы IgA, IgD, IgE, IgG, IgM, IgA и IgG подразделяются на подклассы или подтипы (IgA1-2 IgG1-4).
[0050] Как правило, переменные домены указывают на значительную изменчивость аминокислотной последовательности от одного антитела к следующему, особенно при расположении связывания участка антигена. Три участка, называемые гиперпеременными или гипервариабельными участками (CDR), можно найти в каждой VL и VH, которые поддерживаются менее вариабельными участками, называемыми структурными вариабельными участками. Антитела данного изобретения включают моноклональные антитела IgG, а также фрагменты антител или генно-инженерные формы. Таковы, например, фрагменты Fv или белки, в которых CDR и/или переменные домены показанных антител разработаны в единую цепочку антигена связывающего белка.
[0051] Часть антитела, состоящая из VL и VH доменов, определяется как Fv (Фрагмент переменной), и представляет собой антиген связывающего участка. Единая цепочка Fv (scFv или SCA) представляет собой фрагмент антитела, который содержит VL домен и VH домен на одной полипептидной цепочке, где N, конечная точка одного домена, и C, конечная точка другого домена, соединены эластичным линкером. Пептидные линкеры, используемые для производства одной цепи антител, обычно являются эластичными пептидами, которые гарантируют надлежащее трехмерное сворачивание VL и VH доменов. Линкер, как правило, от 10 до 50 аминокислотных остатков, а в некоторых случаях короче, например, около 10-30 аминокислотных остатков, либо от 12 до 30 аминокислотных остатков, или даже 15 до 25 аминокислотных остатков. Пример таких пептидных линкеров содержит многократные отражения четырех остатков глицина, сопровождающиеся остатком серина.
[0052] Отсутствуют антитела одной цепочки нескольких или всех постоянных доменов всех антител, из которых они получены. Таким образом, они могут преодолеть некоторые проблемы, связанные с использованием всех антител. Например, антитела одной цепочки, как правило, свободны от определенных нежелательных взаимодействий между тяжелой цепочкой постоянных участков и других биологических молекул. Кроме того, антитела одной цепочки значительно меньше, чем все антитела и могут иметь большую проницаемость, чем все антитела, позволяя антителам одной цепочки локализоваться и привязываться к целевым антигенам связывающего участка более эффективно. Кроме того, относительно небольшой размер антител одной цепочки делает их менее способными для того, чтобы спровоцировать нежелательный иммунный ответ получателя, чем все антитела.
[0053] Fab (Фрагмент связывания антигена) относится к фрагментам антитела, состоящего из VL, CL,VH, и CH1 доменов. Те, которые получены в результате переработки папаина, просто называются Fab и не сохраняют шарнирный участок тяжелой цепочки. В результате переработки пепсина образуются различные Fab, удерживаемые в шарнире тяжелой цепочки. Те фрагменты, которые соединены интактными дисульфидными связями, называются F(ab')2, в то время как результатом несохраненных дисульфидных связей является один Fab'. Фрагменты F(ab')2 имеют более высокий авидитет для моновалентного антигена фрагментов Fab.
[0054] Fc (Фрагмент кристаллизации) представляет собой обозначение части или фрагмента антитела, которое содержит постоянные домены спаренных тяжелых цепочек. Антитело IgG, например, Fc содержит домены CH2 и CH3. Fc антитела IgA или IgM дополнительно содержит домен CH4. Fc ассоциируется с лиганд-рецепторным взаимодействием, активацией комплемента опосредованной цитотоксичности и антитела зависимой клеточной цитотоксичности (ADCC). Для антител, таких как IgA и IgM, которые являются комплексом нескольких IgG-подобных белков, смешанная структура необходима для постоянных доменов Fc.
[0055] Наконец, шарнирная область разделяет части антитела Fab и Fc, которые обеспечивают мобильность Fabs относительно друг от друга и относительно Fc, а также включают несколько дисульфидных связей для ковалентного связывания двух тяжелых цепочек.
[0056] Антитело «специфичность» подразумевает выборочное узнавание антитела для определенного эпитопа антигена. Термин «эпитоп» содержит в себе любой протеиновый детерминант, который способен на конкретную привязку к иммуноглобулину или Т-клеточному рецептору или, другими словами, взаимодействие с молекулой. Эпитопические детерминанты, как правило, содержат химически активные поверхностные группирования молекул, такие как аминокислоты или углеводы или боковые цепочки сахара и, как правило, имеют конкретные трехмерные структурные характеристики, а также конкретные характеристики заряда. Эпитоп может быть «линейный» или «конформационный». В линейном эпитопе все точки взаимодействия между белками и взаимодействующими молекулами (например, антитела) происходят линейно вдоль первичной аминокислотной последовательности белка. В конформационном эпитопе точки взаимодействия, которые возникают между остатками аминокислот белка, отделены друг от друга, т.е. являются несвязанными аминокислотами, пограничными с третичной сворачиваемостью белка. Эпитопы, образованные из прилегающих аминокислот, как правило, воздействуют на денатурирующие растворители, в то время как эпитопы, образованные с помощью третичного свертывания, обычно утрачиваются денатурирующими растворителями при обработке. Эпитоп, как правило, содержит как минимум 3, а чаще, 5 или 8-10 аминокислот в уникальной пространственной структуре. Антитела, которые распознают один и тот же эпитоп, могут быть проверены в простом иммуноферментном анализе, который показывает способность одного антитела блокировать связывание другого антитела к антигену-мишени.
[0057] Моноклональные антитела данного изобретения могут быть мышиными, человеческими, гуманизированными и гибридными. Гуманизированное антитело является рекомбинантным белком, в котором антитело CDR от одного вида: например, антитело грызуна, кролика, собаки, козы, лошади, или курицы (или антитело любого другого подходящего животного), передается в легкие и тяжелые переменные домены человека. Постоянные домены молекулы антитела являются производными от антитела человека. Способы создания гуманизированных антител известны в данной области. Гибридные антитела преимущественно имеют постоянные участки производного в основном или исключительно антитела человека постоянных участков и вариабельных участков, полученных в основном или исключительно из последовательности переменного участка других млекопитающих, а не человека. Процесс гибридизации может быть более эффективным, если поменять переменные участки на другие, гиперпеременные участки или определяющие комплементарность участки (CDR), мышиные (или других млекопитающих, а не человека) антитела с соответствующими последовательностями у пациента. Переменные участки, кроме CDRs, также известны как переменные структурные участки (FRs). Впрочем, и другие моноклональные антитела данного изобретения би-специфические, в том, что они имеют специфику как LukE, так и LukD. Би-специфические антитела предпочтительны для человека, или могут быть гуманизированными.
[0058] Описанные выше антитела могут быть получены в соответствии со стандартными способами. Например, LukE, LukD, или иммунологически активный фрагмент LukE или LukD может быть введен испытуемому (например, млекопитающему, человеку или мыши). Лейкоцидины могут быть использованы сами по себе, как иммуногены или они могут быть присоединены к белку-носителю, или другим объектам, таким как гранулы сефарозы. После того, как млекопитающее выработало антитела, смесь клеток, которые производят антитела, такие как спленоциты, изолируются, из которых могут быть получены поликлональные антитела. Моноклональные антитела могут быть выработаны путем изоляции отдельных клеток, которые производят антитела из смеси и иммортализованы, например, их слиянием с опухолевыми клетками, такими как клетки миеломы. Полученные гибридомы сохраняются в среде и моноклональные антитела собирают из питательной среды.
[0059] Другой аспект настоящего изобретения направлен на способ профилактики инфекции S. aureus и/или состояний, связанных с S. aureus у пациента. Этот способ включает в себя введение композиции изобретения, содержащей антитела, которые выбраны из группы, состоящей из антитела к лейкоцидину E (LukE), антитела к лейкоцидину D (LukD), или их комбинации, в количестве эффективном для профилактики инфекции S. aureus и/или состояний, связанных с S. aureus у пациента.
[0060] В соответствии с этим аспектом изобретения условия, связанные с S. aureus, включают, но не ограничиваются, инфицирования кожных ран, абсцессы тканей, фолликулиты, остеомиелиты, пневмонию, синдром ожога кожи, септицемию, септический артрит, миокардит, эндокардит, синдром токсического шока.
[0061] Режимы введения и терапевтически эффективная дозировка, связанные с этим аспектом изобретения, описаны ниже.
[0062] Другой аспект изобретения направлен на способ лечения инфекции S. aureus и/или состояний, связанных с S. aureus у пациента. Этот способ включает в себя применение композиции, содержащей один или несколько ингибиторов LukE/D опосредованной цитотоксичности в количестве эффективном для лечения инфекции S. aureus и/или состояний, связанных с S. aureus у пациента.
[0063] В соответствии с этим аспектом изобретения ингибиторы LukE/D опосредованной цитотоксичности содержат белковые или пептидные ингибиторы, нуклеиновые кислоты, ингибиторы, или малые молекулярные ингибиторы.
[0064] В одном из примеров изобретения ингибитор LukE/D опосредованной цитотоксичности является ингибитором LukE. Соответствующие ингибиторы LukE содержат антитела или фрагменты антител, которые распознают эпитоп в аминокислотной последовательности SEQ ID NO:11. В другом примере изобретения ингибитор LukE/D опосредованной цитотоксичности представляет собой ингибитор LukD. Соответствующие ингибиторы LukD содержат антитела или фрагменты антител, которые распознают эпитоп в аминокислотной последовательности SEQ ID NO:22.
[0065] В другом примере этого аспекта настоящего изобретения ингибитор LukE/D опосредованной цитотоксичности ингибирует взаимодействие LukE и LukD. Соответствующие ингибиторы в соответствии с настоящим примером содержат анти-LukE и/или LukD антитела, предназначенные для взаимодействующих участков LukE или LukD. Кроме того, соответствующие ингибиторы включают малые молекулы, которые привязаны к взаимодействующим участкам LukE и/или LukD. Эти взаимодействующие участки могут содержать аминокислоты 3-13 SEQ ID NO:11, аминокислоты 32-47 SEQ ID NO:11, аминокислоты 126-139 SEQ ID NO:11, аминокислоты 151-156 SEQ ID NO:11, и аминокислоты 272-283 SEQ ID NO:11. Взаимодействующие участки могут также содержать аминокислоты: 3-17 SEQ ID NO:22, аминокислоты 33-51 SEQ ID NO: 22, аминокислоты 94-113 SEQ ID NO:22, аминокислоты, 115-131 SEQ ID NO:22, и аминокислоты 229-2741 SEQ ID NO:22.
[0066] В другом примере этого аспекта настоящего изобретения ингибитор LukE/D опосредованной цитотоксичности сдерживает LukE/D от привязки к плазматической мембране лейкоцитов. Соответствующие ингибиторы содержат антитела или малые молекулы, которые распознают эпитопы LukE и/или LukD, которые взаимодействуют с плазматической мембраной лейкоцитов. Участки LukE и LukD, которые взаимодействуют с плазматической мембраной, содержат аминокислоты, охватывающие внешний домен LukE. Эти участки аминокислот содержат аминокислоты LukE 57-75, SEQ ID NO:11, аминокислоты 162-198 SEQ ID NO:11, и аминокислоты 230-273 SEQ ID NO:11 и LukD аминокислот 59-75 SEQ ID NO:22, аминокислоты 170-220 SEQ ID NO:22, и аминокислоты 253-268 SEQ ID NO:22. Соответственно, антитела распознают эти эпитопы LukE и/или LukD и соответствуют этому примеру изобретения.
[0067] В другом примере этого аспекта настоящего изобретения ингибитор LukE/D опосредованной цитотоксичности представляет собой агент, который предотвращает комплексное образование олигомера LukE/D, агент, который блокирует LukE/LukD опосредованного порообразования, или агент, который блокирует поры LukE/LukD. В соответствии с этим примером соответствующие ингибиторы LukE/LukD опосредованной поры содержат циклодекстрин и родственные соединения, и любой другой ингибитор пор, в том числе белковые или пептидные ингибиторы, нуклеиновые кислоты, ингибиторы, или малые молекулярные ингибиторы.
[0068] В другом примере этого аспекта изобретения ингибитор LukE/D опосредованной цитотоксичности представляет собой агент, который модулирует выражения и/или выражение активности эндогенного репрессора или активатора LukE/D. Соответственно, применение агента, который побуждает, или имитирует выражение и/или деятельности Угнетателя Токсинов («Rot»), который является угнетателем выражения lukE и lukD, тормозит LukE/D опосредованной цитотоксичности в силу блокирования выработки токсина. Соответствующие агенты, которые имитируют выражение Rot и деятельность и предназначены для использования в способах изобретения, раскрыты в U.S. Patent Application Publication No. 2003/0171563 to McNamara, которые представлены полностью посредством ссылки. Аналогичным образом, применение агента, который подавляет экспрессию или деятельность SaeRS, которая является возбудителем выражения lukE и lukD, тормозит LukE/D опосредованной цитотоксичности в силу блокирования выработки токсина.
[0069] Для целей этого и другого аспектов изобретения, целевой «субъект» охватывает любое животное, желательно млекопитающее, более предпочтительно человека. В контексте введения композиции изобретения для целей профилактики инфекции S. aureus у пациента, включаются любые субъекты, которые подвергаются риску заражения S. aureus. Особенно таким инфекциям подвержены грудные младенцы и несовершеннолетние, а также подростки с ослабленным иммунитетом, а также взрослые и пожилые люди. Однако, любой младенец, подросток, взрослый или пожилой человек с ослабленным иммунитетом или индивидуальным риском инфекции S. aureus могут быть обработаны в соответствии со способами изобретения. В контексте введения композиции изобретения в целях лечения инфекции S. aureus у пациента, включены любые субъекты населения, инфицированные S. aureus. Особенно подходят те субъекты, которые подвергаются риску заражения или субъекты, инфицированные метициллин-резистентным Staphylococcus aureus (MRSA) или метициллин-чувствительным S. aureus (MSSA).
[0070] В контексте использования лечебных композиций изобретения для профилактики инфекции S. aureus, или путем активной или пассивной вакцинации, концентрация белков и полипептидов LukE и LukD или анти-LukE и анти-LukD антител в композиции достаточны для достижения профилактики инфекции S. aureus, в частности, предотвращения S. aureus в восприимчивых группах населения. В контексте использования лечебных композиций для лечения инфекции S. aureus, количества анти-LukE и анти-LukD антител или агентов, что подавляют LukE/D опосредованной цитотоксичности способны добиться снижения ряда симптомов, снижение тяжести, по крайней мере, одного симптома, или задержать дальнейшее развитие, по крайней мере, одного симптома, или даже полной отмены инфекции.
[0071] Терапевтически эффективное количество LukE, LukD, анти- LukE и анти-LukD антител, и агентов, которые подавляют LukE/D опосредованной цитотоксичности, может определяться в соответствии со стандартными процедурами, которые принимают во внимание множество факторов, и включают, например, концентрацию этих активных агентов в составе, способ и кратность введения, тяжесть инфекции S. aureus к ним (или предотвращение), и данные испытуемых, такие как возраст, вес и общее состояние здоровья и иммунной системы. Общие рекомендации можно найти, например, в публикациях Международной Конференции по Гармонизации и в ФАРМАЦЕВТИЧЕСКИХ НАУКАХ РЕМИНГТОНА (Издательство Mack 1990 г.), которые представлены посредством ссылки в полном объеме. Клиницист может вводить антитела к LukE и к LukD или анти-LukE и анти-LukD до тех пор, пока дозировка не даст желаемый или требуемый профилактический или лечебный эффект. Прогресс этой терапии может быть легко проверен с помощью обычных способов.
[0072] Терапевтически эффективное количество LukE и LukD для иммунизации будет зависеть от того, совместим ли адъювант с высокими дозировками, которые требуются в отсутствие адъюванта. Количество LukE и LukD для введения иногда варьируется от 1 мг -500 мг на одного пациента и более, как правило, от 5-500 мг для введения пациенту одной инъекции. Иногда, при более высокой дозе с 1-2 мг в упаковке используется система впрыска. Как правило, используется около 10, 20, 50 или 100 мг для введения инъекции одному пациенту. Предпочтительно, чтобы количество LukE и LukD в значительной степени оставалось одинаковым. Время введения инъекций может значительно варьироваться от одного раза в день до одного раза в год или до одного раза в десятилетие. Как правило, эффективная дозировка может контролироваться путем получения проб жидкости у пациента, как правило, сыворотки крови, определения титра развитых антител против белков или полипептидов LukE и LukD, с использованием способов, хорошо известных в данной области, и легко адаптируемых к дозировке специфического антигена. Теоретически, проба берется до начальной дозировки, и последующие пробы берутся и титруются после каждой иммунизации. Как правило, доза или дозировка, которая обеспечивает ощутимое изменение титра, по крайней мере, в четыре раза больше, чем контрольные или «фоновые» уровни при разбавлении сыворотки 1:100, являются предпочтительными, где фон определяется по отношению к контрольной сыворотке или относительно защитного покрытия фона в анализах ELISA.
[0073] Терапевтически эффективное количество композиций антител к LukE и к LukD, как правило, составляет 50 мг состава на килограмм веса тела (мг/кг), в том числе не менее 100 мг/кг, не менее 150 мг/кг, не менее 200 мг/кг, не менее 250 мг/кг, не менее 500 мг/кг, не менее 750 мг/кг и не менее 1000 мг/кг, на ежедневную дозу. Дозы для моноклональных композиций антител могли, как правило, быть ниже, например, около одной десятой немоноклональных композиций антител, таких как, по 5 мг/кг, не более 10 мг/кг, около 15 мг/кг, около 20 мг/кг или около 25 мг/кг. В некоторых способах два или несколько моноклональных антитела с различными связующими особенностями принимаются одновременно, в этом случае разрабатывается дозировка каждого вводимого антитела в указанных пределах. Антитела обычно принимаются по несколько раз. Интервалы между разовыми дозами могут проводиться еженедельно, ежемесячно или ежегодно. Интервалы могут также быть нерегулярными, как указано, согласно с измерением уровня антител в крови у пациента. Кроме того, антитела могут применяться в качестве устойчивого высвобождения формулировки, в таком случае реже, чем требуется при введении. Дозировка и частота введения варьируются в зависимости от периода полураспада антител у пациента. В общем, антитела пациента иллюстрируют самый длинный период полураспада, который сопровождается гуманизированными антителами, химерными антителами, и антителами, не принадлежащими человеку. Доза и кратность введения могут различаться в зависимости от того, является ли лечение профилактическим или лечебным. Для профилактических применений назначают относительно низкие дозы с относительно редкими интервалами в течение длительного периода времени. Для терапевтических применений назначают относительно высокие дозы в относительно короткие промежутки времени, иногда такая дозировка требуется для снижения или прекращения прогрессирования заболевания, и, преимущественно, до тех пор, пока пациент показывает полное или частичное улучшение симптомов заболевания.
[0074] Лечебные композиции изобретения можно вводить в состав комбинированной терапии в сочетании с другим активным агентом, в зависимости от характера инфекции S. aureus, что подвергается лечению. Такие дополнительные активные агенты включают противомикробные вещества, антибиотики агентов, и антимикробные препараты. Показательные противомикробные вещества, которые могут быть полезны в настоящем изобретении, содержат ванкомицин и лизостафин. Показательные антибактериальные агенты и противомикробные средства, которые могут быть полезны в настоящем изобретении, содержат стойкую пенициллиназу пенициллинов, цефалоспорины и карбапенемы, включая ванкомицин, лизостафин, пенициллин G, ампициллин, оксациллин, нафцилин, клоксациллин, диклоксациллин, цефалотин, цефазолин, цефалексин, цефрадин, цефамандолу, цефокситин, имипенем, меропенем, гентамицин, тейкопланин, линкомицин и клиндамицин. Дозировки антибиотиков известны в данной области. См., например, МЕРК СПРАВОЧНИК ПО ДИАГНОСТИКЕ И ТЕРАПИИ, Раздел 13, Гл. 157, 100-е изд. (Beers & Berkow, eds., 2004), которые представлены посредством ссылки в полном объеме. Противовоспалительный, антибактериальный антибиотик и/или антимикробные препараты могут быть объединены перед применением, или введены одновременно (как в рамках одной и той же композиции, так и в разных составах) или последовательно с лечебной композицией изобретения. В некоторых примерах введение повторяется. Пациентом может быть грудной ребенок, подросток, взрослый или пожилой человек. Пациентом также может быть человек с ослабленным иммунитетом, подросток, взрослый или пожилой человек.
[0075] Лечебные композиции изобретения могут назначаться в разовой дозе, или в соответствии с протоколом мульти-дозирования. Например, относительно нескольких дозировок лечебную композицию вводят, например, в одной или двух дозах. В примерах, включающих обычную антибактериальную терапию, которая, как правило, включает в себя несколько доз в течение нескольких дней или недель, антибиотики могут вводиться один, два или три, или более раз в день в течение определенного периода времени, например, в течение 5 дней, 10 дней или даже 14 дней или более, в то время как антитела композиции, как правило, принимаются один или два раза. Однако, разные дозы, сроки и количество лечебной композиции, и антибиотики могут быть выбраны и установлены специалистом данной области.
[0076] Композиции изобретения можно принимать как парентеральное, локальное, внутривенное, пероральное, подкожное, внутрибрюшное, интраназальное или внутримышечное средства для профилактики и/или лечения. Наиболее типичный способ применения это введение подкожно, в то время как другие способы могут быть также эффективными. Следующий наиболее распространенный способ применения это внутримышечная инъекция. Этот тип введения, как правило, выполняется в мышцу руки или ноги. Внутривенные инъекции, также как и внутрибрюшинные инъекции, внутриартериальные, внутричерепные или подкожные инъекции эффективны в формировании иммунного ответа.
[0077] Фармацевтические средства изобретения могут быть разработаны для парентерального применения. Растворы или суспензии агента могут быть изготовлены в воде соответственно в сочетании с ПАВ, таким как гидроксипропилцеллюлоза. Дисперсии могут быть изготовлены в глицерине, жидком полиэтиленгликоле, и их смесях в маслах. Иллюстративные масла изготавливаются из нефти, могут иметь животное, растительное или синтетическое происхождение, например, арахисовое масло, масло сои, или минеральное масло. В целом используются вода, соли, водные растворы декстрозы, связанный сахарный раствор и гликоли, например, пропиленгликоль или полиэтиленгликоль, где предпочтение отдается жидким энергоносителям, в частности для инъецируемых растворов. При обычных условиях хранения и использовании, эти препараты содержат консервант для предотвращения роста микроорганизмов.
[0078] Фармацевтические препараты, пригодные для инъекций, содержат стерильные водные растворы или дисперсии и стерильные порошки для разового изготовления стерильного раствора для инъекций или дисперсий. Во всех случаях форма должна быть стерильной и жидкой для легкого введения. Она должна быть стабильной в условиях изготовления и хранения, а также должна быть сохранена в отношении загрязняющих процедуру микроорганизмов, таких как бактерий и грибков. Носитель может быть растворителем или дисперсной средой, содержащей, например, воду, этанол, полиол (например, глицерол, пропиленгликоль, и жидкий полиэтиленгликоль), подходящие смеси и растительные масла.
[0079] При предпочтительной системной доставке фармацевтических агентов изобретения они могут быть составлены для парентерального введения путем инъекции, например, путем болюсной инъекции или непрерывной инфузии. Композиции для инъекций могут быть представлены в единицах лекарственной формы, например, в ампулах или в мультидозовых контейнерах с добавлением консерванта. Композиции могут принимать такие формы, как суспензии, растворы или эмульсии в маслянистых или водных наполнителях, а также содержать фармакологические агенты, такие, как агенты приостановления, стабилизации и/или диспергаторы.
[0080] Внутрибрюшинное или интратекальное введение агентов изобретения может также быть достигнуто с помощью устройств инфузионного насоса таких, которые описаны Medtronic, Northridge, CA. Такие устройства позволяют непрерывной инфузии требуемой смеси избежать многократных инъекций и нескольких манипуляций.
[0081] В дополнение к формулировкам, описанных ранее, агенты также могут быть составлены в виде депо препарата. Такие долгосрочные формулировки могут быть составлены с учетом полимерных или гидрофобных материалов (например, в виде эмульсии в соответствующем масле) или ионообменной смолы, или таких умеренно растворимых производных как, например, труднорастворимые соли.
[0082] Следующий аспект настоящего изобретения относится к способу прогнозирования тяжести инфекции S. aureus. Этот способ включает культивирование S. aureus, полученных от зараженного пациента посредством образца жидкости или ткани у испытуемого и количественного выражения LukE и/или LukD культивированного S. aureus. Количества LukE и/или LukD в образце от испытуемого сравнивается с количеством LukE и/или LukD в контрольном образце, который производит малое или неопределенное количество LukE и/или LukD и тяжестью инфекции S. aureus, по прогнозам, на основе вышесказанного сравнения.
[0083] Другой аспект настоящего изобретения относится к способу лечения пациента с инфекцией S. aureus. Этот способ включает культивирование S. aureus, полученного от зараженного пациента посредством образца жидкости или ткани у пациента и количественного выражения LukE и/или LukD культивированного S. aureus. Количества LukE и/или LukD в образце от пациента сравниваются с количеством LukE и/или LukD в контрольном образце, который производит малое или неопределенное количество LukE и/или LukD, и подходящее лечение пациента определяется на основе этого сравнения. Способ предполагает дальнейшее применение определенного подходящего лечения испытуемого с учетом инфекции S. aureus.
[0084] В соответствии с этими аспектами изобретения количественное выражение LukE и LukD в образце от пациента включает в себя измерение уровня выражения LukE и/или LukD mRNA или выработки белка. Способы количественного определения уровней выражения mRNA и белка в образце известны в данной области. Повышенный уровень выражения LukE и/или LukD мРНК или белка в образце от пациента, по сравнению с контрольной пробой указывает, или прогнозирует, что пациент имеет, или будет иметь более тяжелые инфекции S. aureus. Аналогичным образом, повышенный уровень выражения LukE и/или LukD мРНК или белка в образце от пакциента указывает на то, что подходящее лечение для пациента, имеющего инфекции, содержит один или несколько агентов, которые ингибируют LukE/D опосредованной цитотоксичности. Подходящие средства для подавления LukE/D цитотоксичности описаны выше.
[0085] Другой аспект настоящего изобретения относится к способу определения ингибиторов цитотоксичности LukE/D. Этот способ предполагает предоставление популяции клеток препарата, содержащего LukE и LukD и кандидата ингибитора LukE/D. Клеточная популяция подвергается воздействию препарата, содержащего LukE и LukD в присутствии и в отсутствие кандидата ингибитора, и опосредованная цитотоксичность LukE/D измеряется в присутствии и в отсутствие кандидата ингибитора. Измеренное количество цитотоксичности сравнивается в присутствии и в отсутствие кандидата ингибитора, и ингибитор цитотоксичности LukE/D определяется на основе этого сравнения.
[0086] В соответствии с этим аспектом изобретения антитела и их фрагменты анти-LukE и анти-LukD, а также другие потенциальные терапевтические метаболиты (например, небольшие органические молекулы могут быть экранированы для оценки их способности подавлять LukE/D опосредованной цитотоксичности). Как описано ниже, были разработаны различные способы для идентификации агентов, которые препятствуют некоторым аспектам потока событий, что приводит к LukE/D опосредованной цитотоксичности и лизису лейкоцитов человека. Способы предназначены также для определения измененных форм LukE и LukD, которые обладают пониженной токсичностью по отношению к родным аналогам. Целевые мероприятия, которые являются частью потока, включают, например, связывание LukE и/или LukD к лейкоцитам мембран плазмы, взаимодействие между LukE и LukD (олигомеризация LukE/D), и засорение поры мембраны, образованное олигомерами LukE/D. Анализ форматов, как правило, требует для лейкоцитов человека (часть связывающей мембраны или LukE, или LukD), подходящую питательную среду, очищенную LukE и LukD.
[0087] Специалисту необходимо принять во внимание, что следующие протоколы носят лишь иллюстративный характер и различные рабочие параметры, такие, как условия реакции, выбор обнаруживаемых бирок и приборов (например, оборудование для обнаружения и количественной оценки) могут быть изменены по мере необходимости.
[0088] Следующие способы, как правило, направлены на выявление агентов, которые ингибируют цитотоксичность LukE/D, без обязательного уведомления точного события в потоке, который затрагивается.
[0089] Для определения ингибиторов цитотоксичности LukE/D, лейкоциты человека (например, THP-1), могут быть покрыты 384-здоровыми клетками, с прозрачной основой черной ткани культурной очищенной пластиной (Corning) на 5×103 здоровых клеток в окончательном объеме 50 мкл RPMI (Gibco) с добавлением 10% теплой инактивированной эмбриональной сыворотки крупного рогатого скота (FBS). Клетки могут быть затем связанными/смешанными/протестированными/обработанными тестовым соединением/молекулой (около 5 мкл/различных концентраций), а затем заражены LukE и LukD, которые в предпочтительных примерах главным образом очищены (5 мкл около 0,01-5 мкм раствора), желательно соединены вместе, при условиях выращивания, позволяющим интоксикацию лейкоцитов LukE и LukD, например, в течение 1 ч при 37°C, 5% СО2. В качестве контрольных клеток, они могут быть обработаны питательной средой (100% жизнеспособных) и 0,1% v/v Triton ×100 (100% нежизнеспособных).
[0090] В этих примерах обработанные клетки, как описано выше, могут быть инкубированы красителем, чтобы контролировать жизнеспособность клеток, таких как CellTiter (Promega) (включает определенную жизнеспособность клеток через поглощение путем измерения количества жизнеспособных клеток в культуре путем количественной оценки метаболической активности клеток), в течение дополнительного периода времени (например, около 2 часов при 37°C, 5% СО2). Жизнеспособность клеток может определяться, например, путем измерения колориметрической реакции на 492нм с использованием планшет-ридера, например, Envision 2103 Multi-label Ридер (Perkin-Elmer). Процент жизнеспособных клеток может рассчитываться, например, с помощью следующего уравнения: % Жизнеспособности = 100×(Ab492Sample-Ab492TritonX)/(Ab492Tissue culture media). Увеличение на 100% жизнеспособности предполагает торможение LukE/D опосредованной цитотоксичности.
[0091] Пример этого анализа называется анализ повреждения мембраны. В этих примерах обработанные клетки, как описано выше (например, вплоть до лечения клеток с тест соединением/молекулы и затем заражением клеток очищенным LukE и LukD), могут быть инкубированы клетко-непроницаемым флуоресцентным красителем, таким как SYTOX зеленым (0,1 мкм; инвитрогеном) (в соответствии с инструкциями производителя) и инкубированы, например, дополнительно на 15 минут при комнатной температуре в темноте.
Флуоресценция, как индикатор повреждения мембран, может быть измерена с помощью спектрофотометра, например, Envision 2103 Multilabel Reader (Perkin-Elmer) при активации 485 нм, выделении 535 нм. Снижение флуоресценции предполагает торможение LukE/D цитотоксичности.
[0092] В другом примере этого анализа рассматриваются клетки, как описано выше, (например, вплоть до лечения клеток с тест соединением и затем зараженные клетки очищенным LukE и LukD), могут быть инкубированы маркером лизиса в течение дополнительного периода времени при комнатной температуре в темноте. Маркером лизиса измеряется и снижение уровня лизиса клеток в присутствии соединения, которое указывает на угнетение LukE/D цитотоксичности.
[0093] Вместе эти анализы будут способствовать идентификации соединений, которые ингибируют, или уменьшают цитотоксические эффекты LukE/D в сторону клеток лейкоцитов.
[0094] Дополнительные способы могут использоваться самостоятельно или в сочетании со способами, описанными выше, особенно если вышеупомянутые способы выявляют ингибирующую активность, что позволит специалисту в данной области более точно определить, какое событие в биохимическом потоке страдает или исполняется агентом. Эти мероприятия включают в себя привязку LukE и/или LukD к лейкоцитам мембран, связывание LukE LukD (LukE/D олигомеризации), и засорение поры мембраны, образованное олигомерами LukE/D.
[0095] Другой аспект настоящего изобретения направлен на способ идентификации ингибиторов LukE, LukD, и/или LukE/D связывания с клетками-мишенями. Этот способ обеспечивает популяцию лейкоцитов или других целевых клеток, препарата с маркированными LukE, LukD, или LukE/D, и представителя ингибитора. Клетка популяции подвергается воздействию препарата, содержащего маркированные LukE, LukD, или LukE/D в присутствии и в отсутствие представителя ингибитора, и маркированные LukE, LukD, или LukE/D, связующиеся с популяцией лейкоцитов измеряются в присутствии и в отсутствие кандидата ингибитора. Измеренное количество LukE, LukD, или LukE/D привязок в присутствии и в отсутствие кандидата ингибитора сравнивается и ингибитор LukE, LukD, или LukE/D, связующийся с лейкоцитами, определяется на основе этого сравнения.
[0096] Для защиты ингибиторов, которые блокируют или уменьшают связывание LukE, LukD или LukE/D с клетками-мишенями, а это является первым шагом в процессе интоксикации, лейкоциты человека (например, клетки THP-1) могут покрываться 384 здоровыми клетками с прозрачной основой черной ткани культурной очищенной пластиной (Corning) на 2,5×103 здоровых клеток в окончательном объеме 50 мл RPMI (Gibco) с добавлением 10% теплой инактивированной эмбриональной сыворотки крупного рогатого скота (FBS). Клетки могут рассматриваться тестовым соединением/молекулой (около 5 мкл/различных концентраций) и инкубироваться очищенными, флуоресцентными маркированными LukE, LukD и/или LukE/D (например, FITC, Cy3, СУ5, APC, PE) 5 мкл из 0,01-5 мкм раствора в течение 1 ч при 4°C, 5% СО2. Для оценки эффективности исследуемого вещества/молекул, флуоресценция связывающей клетки может определять показатель LukE, LukD, или LukE/D привязки к клеткам, например, с использованием автоматизированной флуоресценции системы микроскопии, предназначенной для высокого содержания скрининга и высокого содержания анализа (например, Cellomics ArrayScan HCS Reader (Thermo Scientific) (Активизация 485нм, Выделение 535 нм)). В соответствии с этим аспектом изобретения снижение LukE, LukD, или LukE/D-лейкоцитарной формулы привязки в присутствии представителя ингибитора, сравнивая в ее отсутствие, определяет привязку ингибитора.
[0097] Для защиты ингибиторов, которые блокируют или уменьшают взаимодействие LukE /LukD, а это является вторым шагом в процесс интоксикации, лейкоциты человека (например, клетки THP-1) могут покрываться 384 здоровыми клетками, с прозрачной основой черной ткани культурной очищенной пластиной (Corning) на 2,5×103 здоровых клеток в окончательном объеме 50 мл RPMI (Gibco) с добавлением 10% теплой инактивированной эмбриональной сыворотки крупного рогатого скота (FBS). Клетки могут быть обработаны тестовым соединением/молекулы и потом зараженными смесью очищенного LukE и очищенного LukD, где флуоресцентной маркированной молекулой LukD, такой как FITC, Cy3, Cy5, APC и PE, и отстоянной для завершения процесса интоксикации (например, в течение 1 ч при 37°C, 5% СО2). Для оценки эффективности исследуемых веществ/молекул, флуоресценция связанной клетки LukD-FITC может определяться как показатель LukE/LukD-FITC взаимодействия, с использованием, например, автоматизированной флуоресценции микроскопической системы, предназначенной для высокого содержания скрининга и высокого содержания анализа, например, в Cellomics ArrayScan HCS Reader (Thermo Scientific) (Активация 485 нм, Выбросы 535 нм). Подобные эксперименты могут быть выполнены с помощью флуоресцентного маркированного LukE вместо LukD.
[0098] Другой аспект настоящего изобретения относится к способу определения ингибиторов опосредованного порообразования LukE/D. Этот способ обеспечивает популяцию лейкоцитов препаратом, содержащим LukE и LukD, и представителя ингибитора. Популяция лейкоцитов подвергается воздействию препарата, содержащего LukE и LukD в присутствии и в отсутствие представителя ингибитора, и порообразование лейкоцитов населения измеряется в присутствии и в отсутствие представителя ингибитора. Сравнивается измеренное количество порообразования в присутствии и в отсутствие представителя ингибитора, и ингибитор опосредованного порообразования LukE/D определяется на основе сравнения.
[0099] Для защиты ингибиторов, которые преграждают или блокируют формирование пор LukE/D эффекторных молекул, которые приводят к лизису клетки, лейкоциты человека (например, THP-1 клетку) могут покрываться 384 здоровыми клетками, с прозрачной основой черной ткани культурной очищенной пластиной (Corning) на 2,5×103 здоровых клеток в окончательном объеме 50 мл RPMI (Gibco) с добавлением 10% теплой инактивированной эмбриональной сыворотки крупного рогатого скота (FBS). Клетки могут обрабатываться тестовым соединением/молекулой (около 5 мкл, содержащих различные концентрации) и потом, зараженные очищенным LukE и LukD или LukE/D (около 0,01-5 мкм) в течение 15 минут при 37°C, 5% СО2. В качестве контроля клетки могут быть обработаны питательной средой (отрицательный контроль) и 0,1% v/v TritonX100 (положительный контроль).
[0100] Чтобы непосредственно оценить поры LukE/D на поверхности клеток-хозяев, может быть использован анализ притока бромистого этидия. БЭ представляет собой небольшой катионный краситель, непроницаемый для здоровых клеток хозяина. При формировании катионных пор LukE/D БЭ поступает в клетки и связывается с ДНК, что приводит к флуоресценции. Клетки, обработанные таким способом, могут быть инкубированы БЭ (5 мкм) дополнительно в течение 5 минут при комнатной температуре в темноте. Для оценки эффективности исследуемого вещества/молекул в подавлении LukE/D порообразования флуоресценция может быть определена как показатель порообразования с помощью пластины-ридером, такого как Envision 2103 Multilabel Reader (Perkin-Elmer) при активации 530 нм, выбросах 590 нм. Этот анализ будет способствовать идентификации молекул, которые могут блокировать, или препятствовать порам LukE/D, которые уменьшают опосредованную токсичность LukE/D.
[0101] Чтобы непосредственно оценить поры LukE/D на поверхности клеток-хозяев, могут быть использованы анализы притока бромистого этидия. БЭ небольшой катионный краситель, непроницаемый в здоровые клетки хозяина. При формировании катионных пор LukE/D БЭ поступает в клетки и связывается с ДНК, что приводит к флуоресценции (см., например, Фиг. 5E). Клетки, обработанные с помощью агента, могут инкубироваться БЭ (5 мкм) дополнительно в течение 5 минут при комнатной температуре в темноте. Для оценки эффективности исследуемого вещества/молекул в подавлении порообразования LukE/D флуоресценция может быть определена как показатель порообразования с помощью пластины-ридера, такого как Envision 2103 Multilabel Reader (Perkin-Elmer) при активации 530 нм, выбросах 590 нм. Этот анализ будет способствовать идентификации молекул, которые могут блокировать, или препятствовать поры LukE/D, которые уменьшают опосредованную токсичность LukE/D.
[0102] Кандидатом соединений, который используется в этих способах, описанных в данном изобретении, может быть, по существу, любое вещество или композиция, предположительно способное повлиять на биологические функции или взаимодействие. Смеси или комбинации могут быть частью библиотеки соединений или составов. Кроме того, соединения или композиции могут быть разработаны специально для взаимодействия или препятствовать биологической активности LukE, LukD, или LukE/D изобретения.
ПРИМЕРЫ
[0103] Следующие примеры иллюстрируют примеры изобретения, но ни в коем случае не направлены на ограничение сферы ее применения.
Пример 1 - Инактивация rot повышает вирулентность штамма S. aureus при нехватке agr
[0104] В недавних исследованиях было установлено, что мутантные штаммы S. Aureus при нехватке основного регулятора, известного как вспомогательный ген-регулятор («Agr») и транскрипционный факторный регрессор токсинов («Rot») (т.е. Δagr Δrot), обладают повышенной вирулентностью в модели мыши системной инфекции по сравнению с сильно ослабленным мутантом Δagr. В то время как один мутант делеции Δagr сильно ослаблен по степени вирулентности, как измеряется степень выживания в течение времени после заражения, двойной мутант Δagr Δrot отображает вирулентные характеристики, близкие к родительским штаммам (ДТ Newman) (Фиг. 1А). Считалось, что повышенная вирулентность, наблюдаемая у двойного мутанта Δagr Δrot, может быть связана с повышенной экспрессией лейкотоксинов S. aureus как можно больше этих токсинов считаются выверенными способом, зависимым от Agr-Rot. Действительно, анализ иммуноблота на токсины, вырабатываемые S. aureus мутантных штаммов Дикого Типа, Δagr, и Δagr Δrot, подтвердил гипотезу о том, что количество токсинов было восстановлено на уровне двойных мутантов ДТ Δagr Δrot (Фиг. 1B). Поразительно, было отмечено, что LukE/D сильно превысил выработку штаммов Δagr Δrot по сравнению с другими токсинами (Фиг. 1B). Эти данные иллюстрируют, что репрессия в отношении ключевых факторов вирулентности Rot является критически важной для оптимальной вирулентности потенциала S. aureus и лейкотоксин LukE/D сильно репрессирован при Rot–зависимой связи, в большей степени, чем другие лейкотоксины.
Пример 2 - LukE/D способствует усиленной вирулентности, показанной штаммом S. aureus при нехватке rot
[0105] Результаты, представленные на фигурах 1А-1В, показали, что инактивация rot в штамме agr+ может также привести к повышенной вирулентности, возможно, при LukE/D-зависимой связи. Как и в случае с двойным мутантом Δagr Δrot (Фиг. 1А), было отмечено, что один мутант делеции Δrot также привел к повышению вирулентности у модели мыши системной инфекции, о чем свидетельствует снижение в процентах выживаемости животных, инфицированных Δrot по сравнению с теми, кто заражен ДТ (Фиг. 2А). Ранние наблюдения показали, что Rot вероятно, один из основных репрессоров лейкотоксина LukE/D. Чтобы подтвердить эти результаты в контексте одного мутанта делеции Δrot, иммуноблот был подвержен испытаниям. Эти эксперименты показали, что, действительно LukE/D сильно вырабатываются в отсутствие rot, вопреки γ-гемолизина (HlgC)LukAB, или α-токсин (Hla; Фиг. 2B). Эти выводы еще больше укрепили предположения о том, что LukE/D является основным Rot-репрессированных фактором, ответственным за рост вирулентности мутанта Δrot и то, что LukE/D может играть существенную роль в патогенезе S. aureus в организме. Чтобы определить, была ли переработка LukE/D ответствена за усиленный патогенный фенотип Δrot, был построен двойной мутант Δrot ΔlukE/D и оценивалась его вирулентность инфекции в модели мыши. Двойной мутант Δrot ΔlukE/D многозначительно подвергался риску для вирулентности, о чем свидетельствует резкое сокращение смертности по сравнению, как с ДТ, так и мутантом Δrot (Фиг. 2В). Эти результаты иллюстрируют, что LukE/D является основным Rot-репрессированным фактором, который является критическим для гипервирулентности, связанной с мутантом Δrot и то, что LukE/D может быть одной из основных причин болезни в целом. Эти данные также свидетельствуют о том, что препараты, усиливающие Rot опосредованную репрессию целевых генов, позволит снизить патогенез S. aureus.
Пример 3 - Rot подавляет выражение LukE/D прямой связки с промотором LukE/D
[0106] Для дальнейшего изучения влияния Rot на экспрессию генов lukE/D, были построены регуляции синтеза участка промотора lukE/D к гену, который кодирует зеленый флуоресцентный белок (GFP) и флуоресценция была измерена с течением времени в бульонной культуре с использованием штаммов ДТ, Δagr, Δrot, и Δagr Δrot. Как предполагалось, выражение генов lukE/D было преувеличено, а в штаммах ДТ не хватает Rot, в то время как штаммы, представленные в больших количествах Rot (мутанты Δagr иллюстрируют повышенные уровни Rot) были уменьшены в выражении. Чтобы оценить, насколько репрессия lukE/D против Rot является прямой, была изучена способность Rot привязывать его к промотору lukE/D с помощью стратегии промотора pull-down. Бактериальные клеточные лизаты инкубировали с промотором ДНК lukE/D, или неспецифические межгенные ДНК связывались с магнитными шариками. Иммуноблот связанных белков показал, что Rot действительно связывает промотор lukE/D особым образом (Фиг. 3В). Эти результаты предполагают Rot прямым репрессором экспрессии генов lukE/D. Изменения на Rot уровнях, таким образом, могут существенно уменьшить, или увеличить выработку lukE/D и, в результате регулировать потенциал вирулентности S. aureus.
Пример 4 – Значительные содействующие факторы lukE/D в патогенезе S. aureus
[0107] Не только двойной мутант делеции Δrot ΔlukE/D элиминирует гипервирулентность, связанную с rot делецией, а также значительно снижает вирулентность в целом (ср. ДТ выживания с Δrot ΔlukE/D выживания Фиг. 3B). Чтобы проверить, играет ли lukE/D важную роль в патогенезе септической формы инфекции S. aureus, был создан мутант Δ lukE/D в штамме Ньюман (Фиг. 4A и 4B) и было рассмотрено влияние делеции lukE/D только на вирулентность. Выживание в течение времени значительно увеличилось для мышей, инфицированных или 107 или 108 CFU мутантом ΔlukE/D по сравнению с диким типом. Все мыши дикого типа поддавались инфекции в течение 250 часов при дозе 107 (Фиг. 4C) и в течение 100 часов при дозе 108 (Фиг. 4D). В обоих случаях, однако, почти 100% мышей, инфицированных мутантом ΔlukE/D, выжили, по крайней мере, до 300 часов после заражения, фенотип полностью дополняется штаммом Δ LukE/D::plukE/D (Фиг. 4B и 4C). Кроме того, бактериальная нагрузка на почки уменьшается в 10 раз по сравнению с диким типом или дополнительными штаммами (Фиг. 4Е) и формирование абсцесса значительно сократилось (Фиг. 4F). Эти результаты иллюстрируют, что LukE/D - представляет собой на самом деле критический фактор вирулентности системной инфекции S. aureus. Таким образом, LukE/D является заманчивой новой целью для разработки новых терапевтических средств для противодействия инфекции S. aureus.
Пример 5 - LukE/D поражает и убивает лейкоциты
[0108] Чтобы определить потенциальный механизм действия LukE/D, рекомбинантные белки LukE и LukD из E. coli были представлены и очищены. Чтобы проверить потенциал токсичности этих белков человека, инкубировали моноцитарные клетки (THP-1s) и промиелоцитарные клетки лейкоза человека (HL60s) с различной концентрацией, или отдельные субъединицы (т.е. LukE или LukD) или смеси LukE+LukD (LukE/D). Клетки были заражены ответной дозой, либо один LukE, либо один LukD, либо LukE/D и после 1 часа заражения был добавлен CellTiter для измерения процента жизнеспособных клеток после интоксикации. Моноцитарноподобная клеточная линия КД-1 человека была однозначно чувствительна к интоксикации в обеих субъединицах токсина вместе, а не в отдельных субъединицах. Активность токсина в сторону клеток зависит от дозы и присутствия обеих субъединиц (Фиг. 5А). В отличие от этого, HL60s не были затронуты либо одиночными субъединицами, либо инкубированными вместе (Фиг. 5В). В дополнение к клеточным линиям, была также рассмотрена активность LukE/D в сторону первичных человеческих и мышиных клеток PMNs. Клетки были заражены ответной дозой, либо одним LukE, либо одним LukD, либо LukE/D и после 1 часа заражения был добавлен CellTiter для измерения процента жизнеспособных клеток после интоксикации. LukE/D, а не LukE или LukD был заметно цитотоксичен к PMNs у пациента и мыши (Фиг. 5C).
[0109] Проанализировать механизм, с помощью которого LukE/D токсичен для клеток THP-1s, находившихся в состоянии заражения, в присутствии бромистого этидия, небольшой катионный краситель, который, как правило, является непроницаемый для размещения клеточных мембран, но может получить доступ к клетке с помощью поры токсина. Вдобавок к субъединицам токсина, БЭ был быстро взят у клеток, как это отражено увеличением относительной флуоресценции по сравнению с унитоксикационным контролем и в состоянии заражения PMN-HL60s (Фигуры 5D и 5E). Эти эксперименты иллюстрируют, что, когда вместе, LukE и LukD выражают цитотоксичность по отношению к специфическому типу иммунных клеток человека, а не других, подчеркивая специфику этого токсина.
Пример 6 - Антитела к LukE против антител к LukE/D с сильно нейтрализованной цитотоксичностью
[0110] Чтобы определить, способны ли поликлональные антитела, повышенные на фоне LukE, нейтрализовать LukE/D цитотоксичность, была выполнена нейтрализация анализа. Инкубация LukE/D с очищенными антителами анти-LukE сильно подавляла анти-LukE/D опосредованной цитотоксичности к клеткам THP-1, как измеряется CellTiter (Фиг. 6A). Как показано на фиг. 5A-5E, появляется LukE/D для оказания своего токсичного воздействия путем формирования проницаемых пор в плазматической мембране клеток-мишеней. Для того чтобы понять механизм, с помощью которого анти-LukE нейтрализует LukE/D цитотоксичность, формирование поры клеток LukE/D в состоянии заражения, с LukE/D в присутствии очищенных анти-LukE антител, был проведен мониторинг. Было отмечено, что порообразование LukE/D сильно тормозится анти-LukE антителами (Фиг. 6B). Эти данные свидетельствуют о том, что иммунизация LukE создает нейтрализующие анти-LukE антитела, предполагая, что специфические антитела к LukE могут быть новыми терапевтическими антителами в целях борьбы с инфекцией S. aureus.
[0111] Хотя изобретение было описано в деталях, для наглядности, понятно, изменения могут быть сделаны в нем только специалистом в данной области, не отходя от основного направления и границ изобретения, которое определяется следующими требованиями.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИНГИБИРОВАНИЯ ТОКСИЧНОСТИ ЛЕЙКОЦИДИНА ED STAPHYLOCOCCUS AUREUS У СУБЪЕКТА | 2012 |
|
RU2609650C2 |
| ЛЕЙКОЦИДИНЫ STAPHYLOCOCCUS AUREUS, ТЕРАПЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ | 2011 |
|
RU2677140C1 |
| ЛЕЙКОЦИДИНЫ STAPHYLOCOCCUS AUREUS, ТЕРАПЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2795545C2 |
| ЛЕЙКОЦИДИНЫ STAPHYLOCOCCUS AUREUS, ТЕРАПЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ | 2011 |
|
RU2644237C2 |
| АНТИТЕЛА, КОТОРЫЕ СПЕЦИФИЧНО СВЯЗЫВАЮТ АЛЬФА-ТОКСИН STAPHYLOCOCCUS AUREUS, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2620065C2 |
| КОМПОЗИЦИИ, ОТНОСЯЩИЕСЯ К МУТАНТНОМУ ТОКСИНУ CLOSTRIDIUM DIFFICILE, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2592686C2 |
| ИММУНОГЕННАЯ КОМПОЗИЦИЯ ДЛЯ ПРИМЕНЕНИЯ В ВАКЦИНАЦИИ ПРОТИВ СТАФИЛОКОККОВ | 2009 |
|
RU2521501C2 |
| Композиции и способы, имеющие отношение к мутантному токсину из Clostridium Difficile | 2013 |
|
RU2630671C2 |
| АНТИТЕЛА, НАПРАВЛЕННЫЕ ПРОТИВ ЛЕЙКОТОКСИНОВ STAPHYLOCOCCUS AUREUS | 2019 |
|
RU2805969C2 |
| КОМБИНАЦИИ АНТИТЕЛ К STAPHYLOCOCCUS AUREUS | 2019 |
|
RU2804815C2 |































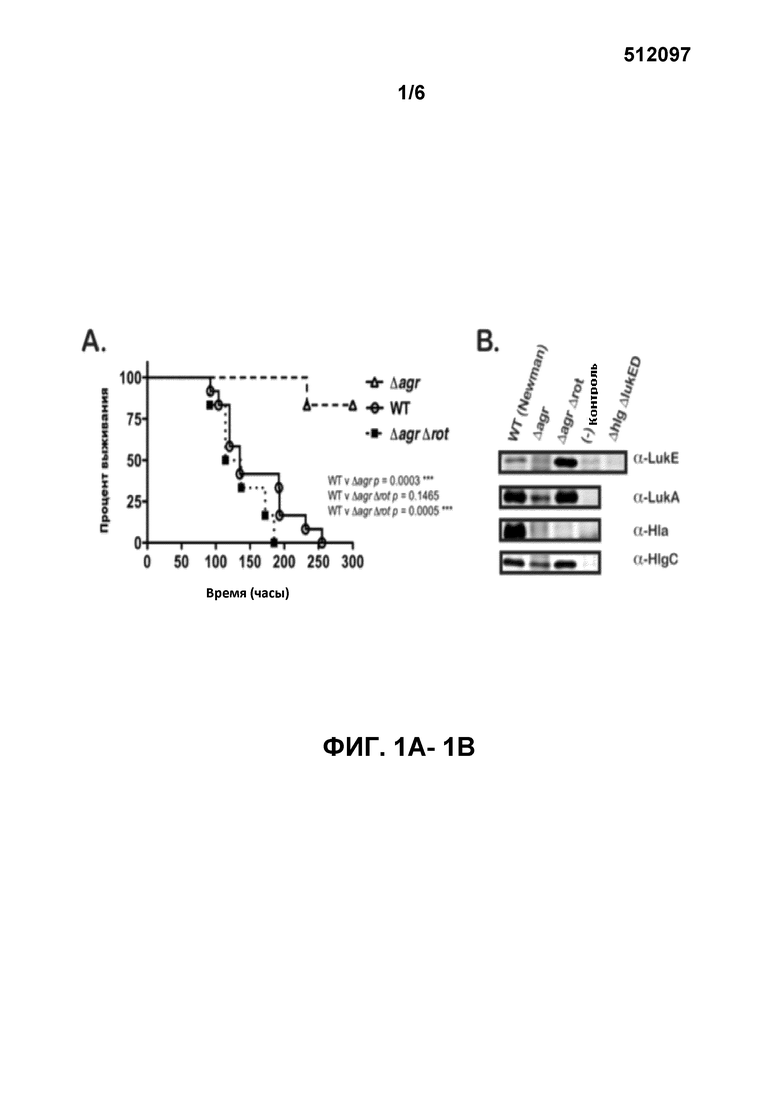
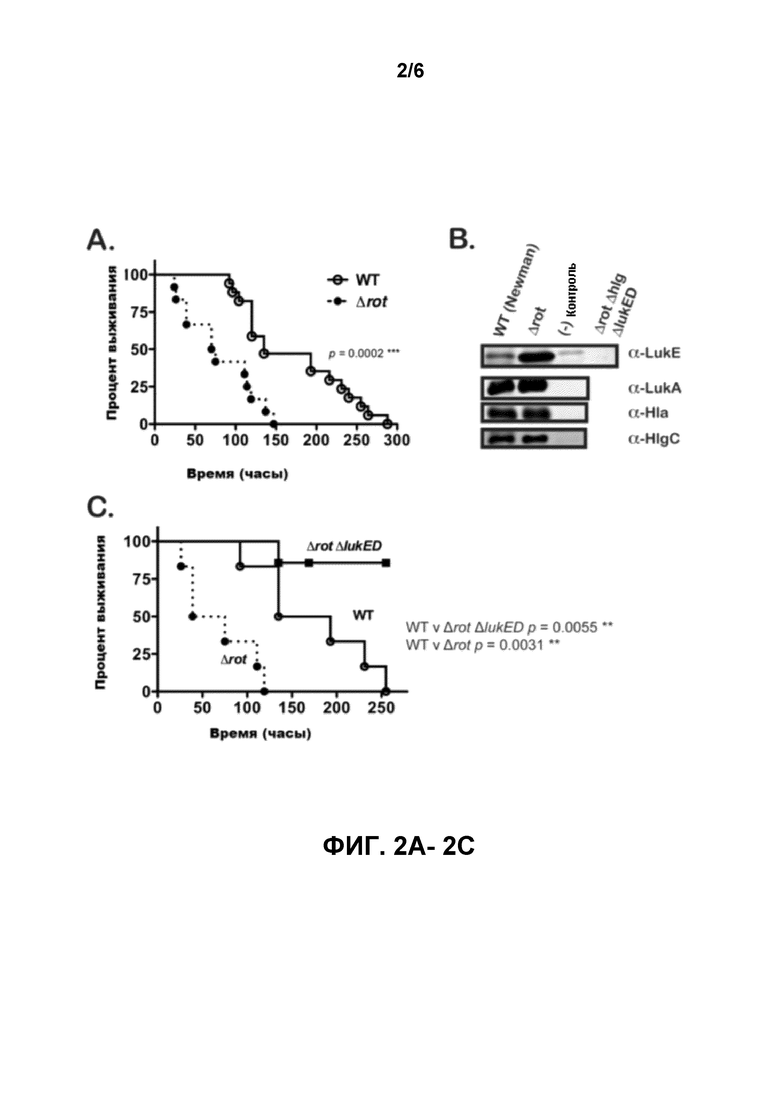
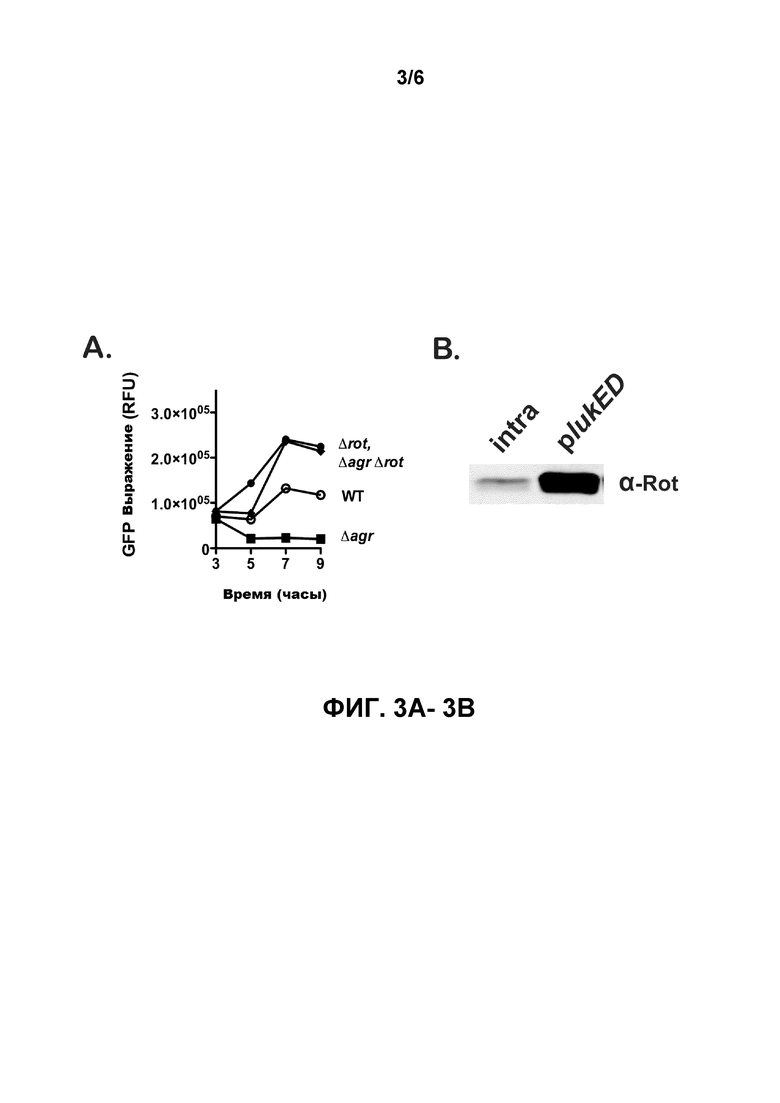
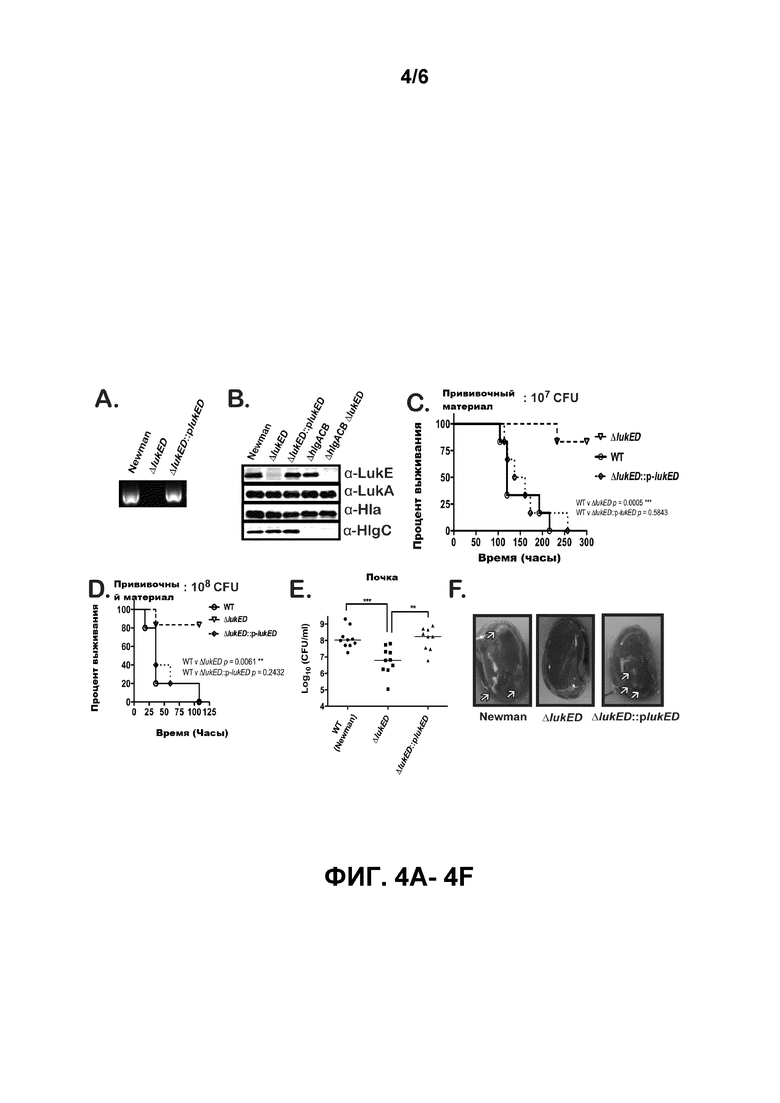
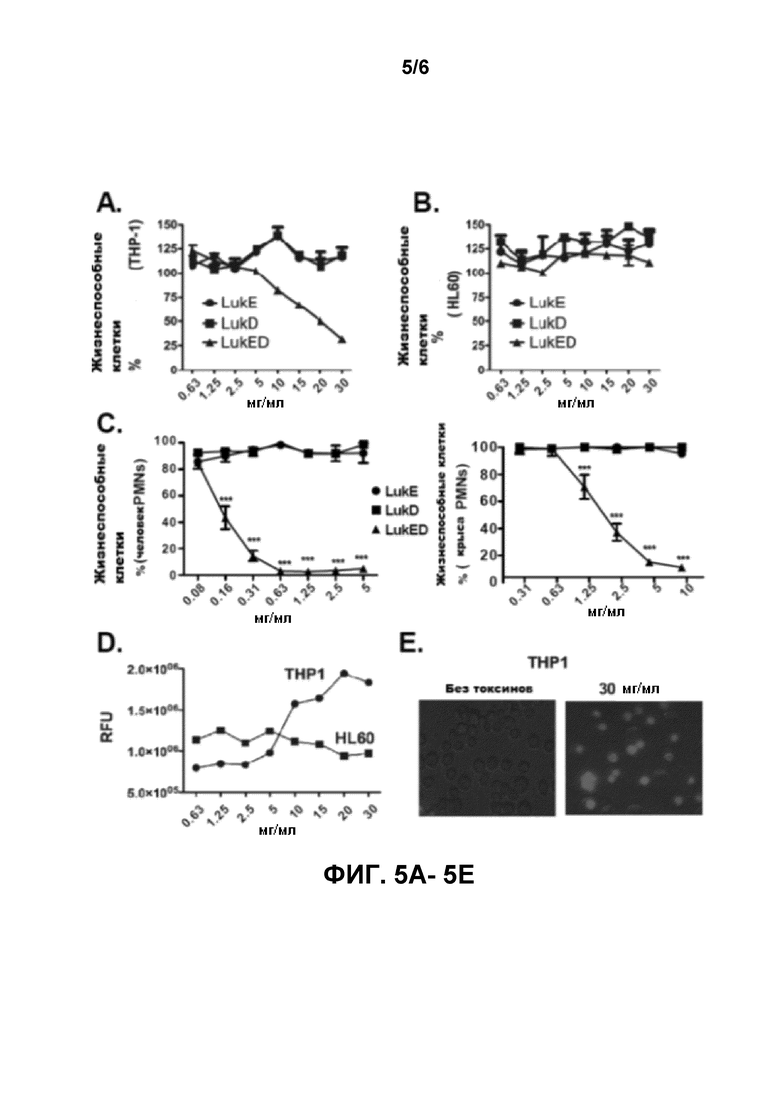
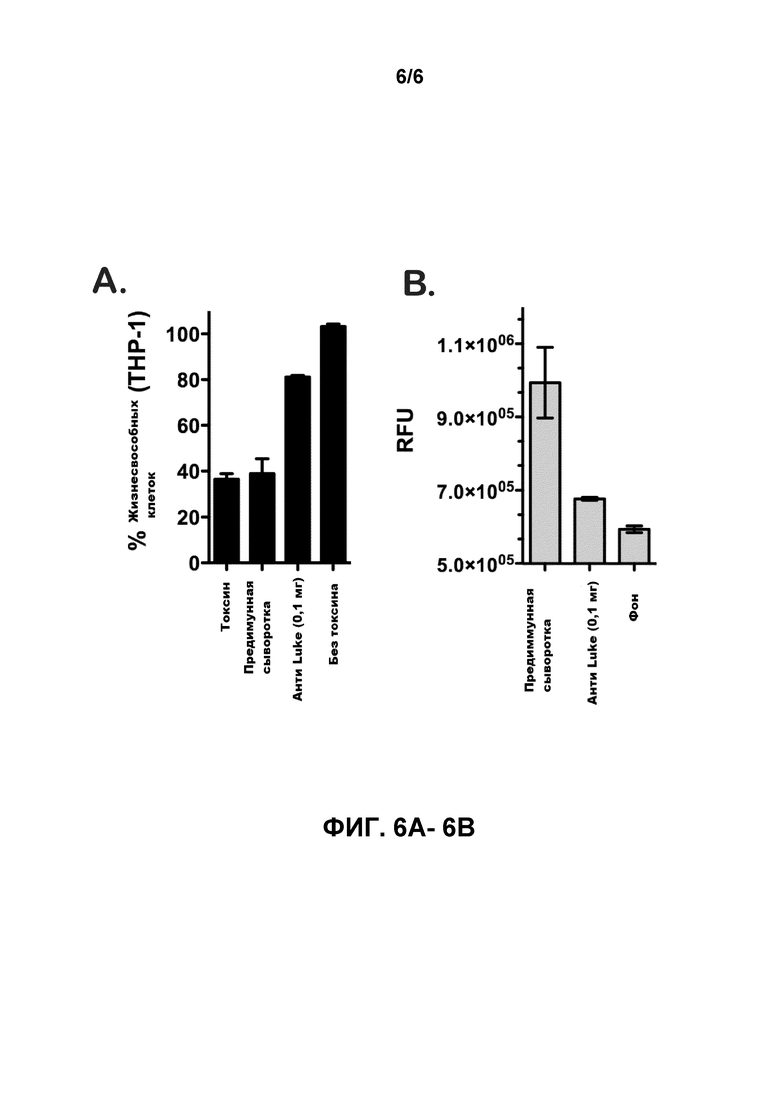
Группа изобретений относится к области медицины, а именно к способам и композициям для профилактики и лечения стафилококка у пациента. Лечебные композиции изобретения составляют лейкоцидин белка и его полипептида E и/или D и фармацевтически приемлемый носитель. Способ иммунизации пациента против инфекции стафилококка золотистого включает введение композиции для профилактики и лечения стафилококка в количестве, эффективном для иммунизации пациента против стафилококка золотистого. Группа изобретений может быть использована для эффективного скрининга, лечения и предупреждения инфекций стафилококка золотистого и связанных с ними нарушений. 3 н. и 18 з.п. ф-лы, 6 ил., 6 пр., 2 табл.
1. Композиция, пригодная для формирования ответа антитела против Staphylococcus aureus Лейкоцидина Е (LukE) и/или Лейкоцидина D (LukD) у пациента, причем указанная композиция содержит:
терапевтически эффективное количество (i) выделенного полипептида LukE, который в длину 300 аминокислотных остатков или менее и содержит аминокислотную последовательность из аминокислотных остатков 29-301 в SEQ ID NO: 11 аминокислотных остатков 29-311 в SEQ ID NO: 11, аминокислотных остатков 48-291 в SEQ ID NO: 11, или аминокислотных остатков 48-301 в SEQ ID NO: 11, (ii) выделенного полипептида LukD, который в длину 300 аминокислотных остатков или менее и содержит аминокислотную последовательность из аминокислотных остатков 27-312 в SEQ ID NO: 22, аминокислотных остатков 27-327 в SEQ ID NO: 22, аминокислотных остатков 46-307 в SEQ ID NO: 22, или аминокислотных остатков 46-312 в SEQ ID NO: 22, или (iii) их комбинацию, и
фармацевтически приемлемый носитель.
2. Композиция по п. 1, отличающаяся тем, что выделенный полипептид LukE содержит аминокислотные остатки 48-291 SEQ ID NO: 11.
3. Композиция по п. 1, отличающаяся тем, что выделенный полипептид LukD содержит аминокислотные остатки 46-307 SEQ ID NO: 22.
4. Композиция по п. 1, отличающаяся тем, что выделенный полипептид в композиции связаны с молекулой иммуногенного носителя.
5. Композиция по п. 4, отличающаяся тем, что молекула иммуногенного носителя ковалентно или не-ковалентно связана с выделенным полипептидом.
6. Композиция по п. 4, отличающаяся тем, что молекула иммуногенного носителя выбрана из группы, состоящей из бычьего сывороточного альбумина, яичного овальбумина цыпленка, гемоцианина лимфы улитки, столбнячного анатоксина, дифтерийного анатоксина, тиреоглобулина, капсульного полисахарида пневмококка, CRM 197, белка наружной мембраны менингококка.
7. Композиция по п. 1, отличающаяся тем, что дополнительно содержит один или несколько дополнительных антигенов S. aureus, выбранных из группы, которая состоит из антигена альфа гемолизина, белка А, полисахаридного антигена серотипа 336, коагулазы, фактора слипания А, фактора слипания В, связывающегося с фибронектином белка, связывающегося с фибриногеном белка, связывающегося с коллагеном белка, связывающегося с эластином белка, аналога белка главного комплекса гистосовместимости, полисахарида внутриклеточной адгезии, бета гемолизина, дельта гемолизина, гамма гемолизина, лейкоцидина Пантон-Валентина, лейкоцидина А, лейкоцидина В, лейкоцидина М, эксфолиативного токсина А, эксофолиативного токсина В, протеазы V8, гиулуронат лиазы, липазы, стафилокиназы, энтеротоксина, токсина-1 синдрома токсического шока, поли-N-сукцинил бета-1→6 глюкозамина, каталазы, бета-лактамазы, тейхоевой кислоты, пептидогликана, связующегося с пенициллином белка, ингибирующего хемотаксис белка, ингибитора комплемента, Sbi, антигена типа 5, антигена типа 8, липотейхоевой кислоты, и молекул хозяина, распознающих компоненты поверхности микроорганизма.
8. Композиция по п. 1, отличающаяся тем, что дополнительно содержит адъювант.
9. Композиция по п. 8, отличающаяся тем, что адъюванты выбраны из группы, состоящей из флагеллина, полного или неполного адъюванта Фрейнда, гидроксида алюминия, лизолецитина, плюроновых полиолов, полианионов, пептидов, эмульсии масла, динитрофенола, искоматрикса и липосомальных поликатионных частиц ДНК.
10. Способ иммунизации пациента против инфекции Staphylococcus aureus, который включает: введение композиции по п. 1 в количестве, эффективном для иммунизации пациента против инфекции S. aureus.
11. Способ по п. 10, отличающийся тем, что композиция дополнительно содержит один или несколько дополнительных антигенов S. aureus, выбранных из группы, состоящей из антигена альфа гемолизина, белка, полисахаридного антигена серотипа 336, коагулазы, фактора слипания А, фактора слипания В, связывающегося с фибронектином белка, связывающегося с фибриногеном белка, связывающегося с коллагеном белка, связывающегося с эластином белка, аналога белка главного комплекса гистосовместимости, полисахарида внутриклеточной адгезии, бета гемолизина, дельта гемолизина, гамма гемолизина, лейкоцидина Пантон-Валентина (PVL), лейкоцидина А, лейкоцидина В, лейкоцидина М, эксфолиативного токсина А, эксфолиативного токсина В, протеазы V8, гиалуроната лиазы, липазы, стафилокиназы, энтеротоксина, токсина-1 синдрома токсического шока, поли-N-суцинил бета-1→6 глюкозамина, каталазы, бета-лактамазы, тейхоевой кислоты, пептидогликана, связывающегося с пенициллином белка, ингибирующего хемотаксис белка, ингибитора комплемента, Sbi, антигена типа 5, антигена типа 8, липотейхоевой кислоты и молекул хозяина, распознающих компоненты поверхности микроорганизма.
12. Способ по п. 10, отличающийся тем, что композиция дополнительно содержит адъювант.
13. Способ по п. 10, дополнительно включающий:
введение пациенту адъюванта до, после или одновременно с введением композиции, содержащей выделенный полипептид LukE, выделенный полипептид LukD или их комбинацию.
14. Способ по п. 10, отличающийся тем, что указанное введение вызывает у пациента нейтрализацию иммунного ответа к S. aureus.
15. Способ по п. 10, отличающийся тем, что инфекция S. aureus является резистентной к метициллину инфекцией S. aureus (MRSA) или чувствительной к метициллину инфекцией S. aureus (MSSA).
16. Способ по п. 10, отличающийся тем, что указанное введение осуществляется перорально, ингаляционно, путем интраназальной инстилляции, местно, внутрикожно, парентерально, подкожно, внутривенной инъекцией, внутриартериальной инъекцией, внутримышечной инъекцией, внутриплеврально, внутрибрюшинно или путем нанесения на слизистую оболочку.
17. Способ по п. 10, дополнительно включающий повторение указанного введения.
18. Способ по п. 10, отличающийся тем, что пациентом является грудной ребенок, подросток, взрослый или пожилой человек.
19. Способ по п. 10, отличающийся тем, что пациентом является подросток, взрослый или пожилой человек с ослабленным иммунитетом.
20. Композиция, пригодная для формирования ответа антитела против Staphylococcus aureus Лейкоцидина Е (LukE) и/или Лейкоцидина D (LukD) у пациента, причем указанная композиция содержит:
терапевтически эффективное количество (i) выделенного полипептида LukE, который в длину менее чем 100 аминокислотных остатков и содержит аминокислотную последовательность из аминокислотных остатков 32-47 в SEQ ID NO: 11 аминокислотных остатков 57-75 в SEQ ID NO: 11, аминокислотных остатков 126-139 в SEQ ID NO: 11, аминокислотных остатков 151-156 в SEQ ID NO: 11, аминокислотных остатков 162-198 в SEQ ID NO: 11, аминокислотных остатков 230-273 в SEQ ID NO: 11 или аминокислотных остатков 272-283 в SEQ ID NO: 11, (ii) выделенного полипептида LukD, в длину менее чем 100 аминокислотных остатков и содержит аминокислотную последовательность из аминокислотных остатков 33-51 в SEQ ID NO: 22, аминокислотных остатков 59-75 в SEQ ID NO: 22, аминокислотных остатков 94-113 в SEQ ID NO: 22, аминокислотных остатков 115-131 в SEQ ID NO: 22, аминокислотных остатков 170-220 в SEQ ID NO: 22, аминокислотных остатков 253-268 в SEQ ID NO: 22 или аминокислотных остатков 229-274 в SEQ ID NO: 22, или (iii) их комбинацию, и
фармацевтически приемлемый носитель.
21. Композиция по п. 20, в которой выделенный полипептид LukE в длину от 50 до 100 аминокислот, а выделенный полипептид LukD в длину от 50 до 100 аминокислот.
| WO 2010119343, 21.10.2010 | |||
| GRAVET A ET AL | |||
| "Characterization of a novel structural member, LukE-LukD, of the bi-component staphylococcal leucotoxins family", FEBS LETTERS, ELSEVIER, AMSTERDAM, NL (19981002), vol | |||
| СПОСОБ ПОЛУЧЕНИЯ АЗОПИГМЕНТОВ | 1925 |
|
SU436A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| US 2009053235, 26.02.2009 | |||
| E | |||
| L | |||
| BROWN ET AL | |||
| ТКАЦКИЙ СТАНОК | 1920 |
|
SU300A1 |
| Прибор для нагревания перетягиваемых бандажей подвижного состава | 1917 |
|
SU15A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2017-11-13—Публикация
2012-06-19—Подача