Область техники
Настоящее изобретение относится к применению пустых липосом или смесей липосом и к применению других липидных бислоев или монослоев определенного липидного состава для лечения и предотвращения бактериальных инфекций. Настоящее изобретение также относится к лечению таких бактериальных инфекций, включающему введение пустых липосом или смесей липосом отдельно или в комбинации со стандартным лечением антибиотиками. Кроме того, настоящее изобретение относится к самим новым смесям липосом.
Уровень техники
Бактериальные инфекции остаются одной из главных угроз жизни человека. Поскольку резистентность бактерий даже к самым сильным антибиотикам растет, должны расти и усилия по нахождению новых стратегий борьбы с бактериями. Наряду с другими факторами вирулентности многие патогенные бактерии секретируют токсины, которые убивают эукариотические клетки путем повреждения их клеточной мембраны. Бактериальные порообразующие токсины активны на поверхности клеток, что вызывает образование пор и повреждение клеточной мембраны с последующим лизисом или апоптозом целевых клеток-хозяев, тогда как бактериальные фосфолипазы индуцируют гибель клеток-хозяев путем ферментативного расщепления фосфолипидов плазмалеммы.
Бактериальные токсины, дестабилизирующие мембраны, такие как холестерин-зависимые цитолизины (ХЗЦ: пневмолизин О, стрептолизин О, тетанолизин), α-гемолизин или бактериальные фосфолипазы (фосфолипаза С, сфингомиелиназа), играют решающую роль в развитии и прогрессировании инфекционных заболеваний. Такими заболеваниями является пневмония - основная причина смерти среди всех возрастных групп и главная причина смерти у детей в странах с низким уровнем доходов; бактериемия - тяжелое осложнение после инфекций или оперативного вмешательства, которая характеризуется высокой смертностью в результате сепсиса и септического шока; и менингит - опасное для жизни заболевание, которое также приводит к серьезным длительным последствиям, таким как глухота, эпилепсия, гидроцефалия и когнитивные расстройства.
Для нацеленного воздействия на клетки-хозяева бактериальные токсины, дестабилизирующие мембраны, либо связываются с отдельными мембранными липидами (головными группами липидов), либо используют неоднородный характер липидного бислоя клеточной мембраны эукариотических клеток, взаимодействуя с микродоменами, обогащенными определенными видами липидов (Gonzales M.R. et al., Cell. Mol. Life Sci. 2008, 65:493-507). Условия in vivo не способствуют неоднородному распределению липидов в бислое, поскольку трансмембранные белки и присутствие большого числа отдельных видов липидов с различной длиной и степенью насыщения ацильной цепи препятствуют расслаиванию липидов и, таким образом, образованию стабильных липидных микродоменов (Simons K. and Gerl M.J., Nat. Rev. Mol. Cell Biol. 2010, 11:688-99). Однако расслаивание липидов может быть доведено до крайних значений в искусственных не содержащих белок липосомах, полученных из ограниченного числа тщательно выбранных видов липидов, в которых могут быть получены более длинные стабильные липидные микродомены (Klose С. et al., J. Biol. Chem. 2010, 285:30224-32). Более того, искусственные липосомы обеспечивают гораздо более высокие относительные концентрации конкретного липида, чем те, которые могут встретиться in vivo. Следовательно, могут быть получены липосомы со стабильными липидными микродоменами, обладающие определенными биохимическими свойствами и содержащие высокие относительные концентрации конкретных липидов. В настоящее время липосомы используют в косметической и фармацевтической промышленности в качестве носителей для местной и системной доставки лекарственных средств, и они считаются нетоксичными.
Краткое описание изобретения
Настоящее изобретение относится к применению пустых липосом определенного липидного состава или смесей пустых липосом определенного липидного состава для лечения и предотвращения бактериальных инфекций, в частности поражений кожи, бактериемии, менингита, инфекций дыхательных путей, таких как пневмония, и абдоминальных инфекций, таких как перитонит.
Более того, настоящее изобретение относится к липидным бислоям или липидным монослоям определенного липидного состава, покрывающим нелипидные поверхности, для применения для лечения и предотвращения бактериальных инфекций.
Аналогичным образом, настоящее изобретение также относится к лечению таких бактериальных инфекций, включающему введение нуждающемуся в этом пациенту терапевтически эффективного количества пустых липосом определенного липидного состава или смесей пустых липосом определенного липидного состава, и к способу предотвращения таких бактериальных инфекций у подверженного риску субъекта. Более того, настоящее изобретение относится к лечению бактериальных инфекций, включающему введение нуждающемуся в этом пациенту терапевтически эффективного количества пустых липосом определенного липидного состава или смесей пустых липосом определенного липидного состава до, после, совместно или параллельно со стандартным лечением антибиотиками против бактериальной инфекции.
Более того, настоящее изобретение относится к новым смесям пустых липосом определенного липидного состава.
Краткое описание графических материалов
Фиг. 1. Липосомы, состоящие из холестерина и сфингомиелина, защищают моноциты от холестерин-зависимых цитолизинов, α-гемолизина и фосфолипазы С.
A-D) Липосомы (смеси 1:1 масс./масс.), содержащие холестерин в комбинации с фосфатидилхолином (PC) (3), сфингомиелином (Sm) (4) или фосфатидилсерином (PS) (5), но не с фосфатидилэтаноламином (РЕ) (6), защищали клетки ТНР-1 от холестерин-зависимых цитолизинов: пневмолизина О (А), стрептолизина О (В), тетанолизина (С), а также от фосфолипазы С (D).
E) Липосомы (1:1 масс./масс.), содержащие холестерин в комбинации со Sm (4), но не с PC (3), PS (5) или РЕ (6), защищали клетки ТНР-1 от α-гемолизина.
F) Липосомы без холестерина (7-9) были неэффективными.
с (о.е.) = количество клеток, выдержанных в присутствии токсина (1, 3-9), относительно количества клеток, выдержанных в отсутствии токсина (2), приведено в относительных единицах (о.е.). PLY = пневмолизин О; SLO = стрептолизин О; TL = тетанолизин; PLC = фосфолипаза С; HML = α-гемолизин. 1 = Контроль (отсутствие липосом); 2 = Контроль (отсутствие токсина), 3 = липосомы холестерин (Ch):PC (1:1 масс./масс.); 4 = липосомы Ch:Sm (1:1 масс./масс.); 5 = липосомы Ch:PS (1:1 масс./масс.); 6 = липосомы Ch:PE (1:1 масс./масс.); 7 = липосомы PC:Sm (1:1 масс./масс.); 8 = липосомы Sm; 9 = липосомы PC. Ch = холестерин; PC = фосфатидилхолин; PS = фосфатидилсерин; Sm = сфингомиелин; РЕ = фосфатидилэтаноламин.
Фиг. 2. Липосомы, состоящие из холестерина и сфингомиелина (1:1 масс./масс.), защищают моноциты от холестерин-зависимых цитолизинов в микрограммовых количествах, в то время как для защиты от α-гемолизина Staphylococcus aureus и фосфолипазы С Clostridium perfringens требуется 25-100 микрограмм липосом.
А) Защита от 0,2 микрограмма PLY. В) Защита от 0,4 микрограмма SLO. С) Защита от 0,2 микрограмма TL. D) Защита от 1,2 микрограмма HML. Е) Защита от 4,5 микрограмма PLC.
с (о.е.) = количество клеток, выдержанных в присутствии токсина, относительно количества клеток, выдержанных в отсутствии токсина, приведенное в относительных единицах. Ось X: LP (мкг) = количество липосом в микрограммах. PLY = пневмолизин О; SLO = стрептолизин О; TL = тетанолизин; HML = α-гемолизин; PLC = фосфолипаза С.
Фиг. 3. Для защиты моноцитов от пневмолизина, тетанолизина или α-гемолизина липосомами, состоящими из холестерина и сфингомиелина, требуется холестерин в концентрациях более 30% (масс./масс.)
А) Защита от 0,2 микрограмма PLY. В) Защита от 0,2 микрограмма TL. С) Защита от 1,2 микрограмма HML. с (о.е.) = количество клеток, выдержанных в присутствии токсина, относительно количества клеток, выдержанных в отсутствии токсина, приведенное в относительных единицах. Ch (%) = процент холестерина (масс./масс.) в липосомах, состоящих из холестерина и сфингомиелина. PLY = пневмолизин; TL = тетанолизин; HML = α-гемолизин.
Фиг. 4. Липосомы, состоящие из холестерина и сфингомиелина, защищают моноциты от комбинации холестерин-зависимых цитолизинов и α-гемолизина S. aureus.
A) Липосомы Ch:Sm (1:1 масс./масс.) (6) оказывали полное защитное действие от комбинированного действия α-гемолизина (HML; 1,2 микрограмма), стрептолизина О (SLO; 0,4 микрограмма) и тетанолизина (TL; 0,2 микрограмма), в то время как липосомы Ch:PC (1:1 масс./масс.) были неэффективными (7).
с (о.е.) = количество клеток, выдержанных в присутствии токсинов (2-7), относительно количества контрольных клеток, выдержанных в отсутствии токсинов (1), в относительных единицах. 1 = Контроль (отсутствие токсинов); 2 = SLO, отсутствие липосом; 3 = TL, отсутствие липосом; 4 = HML, отсутствие липосом; 5 = SLO+TL+HML, отсутствие липосом; 6 = SLO+TL+HML, липосомы Ch:Sm; 7 = SLO+TL+HML, липосомы Ch:PC. Ch = холестерин; PC = фосфатидилхолин; Sm = сфингомиелин.
B) Полное защитное действие от комбинированного действия HML (1,2 микрограмма), SLO (0,4 микрограмма) и TL (0,2 микрограмма) наблюдали при 25 микрограммах липосом, состоящих из Ch:Sm (1:1 масс./масс.). LP (мкг) = количество липосом в микрограммах.
C) Эксперименты с центрифугированием подтвердили, что все три токсина напрямую связываются с липосомами Ch:Sm (1:1 масс./масс.). Токсины предварительно инкубировали совместно с липосомами Ch:Sm (6) или без них (2-5). После центрифугирования надосадочные жидкости добавляли к клеткам. 1 = Контроль (отсутствие токсинов); 2 = SLO, отсутствие липосом; 3 = TL, отсутствие липосом; 4 = HML, отсутствие липосом; 5 = SLO+TL+HML, отсутствие липосом; 6 = SLO+TL+HML, липосомы Ch:Sm.
Фиг. 5. Липосомы, состоящие из холестерина и сфингомиелина (1:1 масс./масс.), защищают моноциты от токсинов Streptococcus pyogenes.
А, В) Клетки ТНР-1 пролиферируют в присутствии бульона с сердечно-мозговым экстрактом (BHI) (квадраты; пунктирная линия на (А)). Культуральные надосадочные жидкости 5 штаммов Streptococcus pyogenes (GAS 1-5 = клинические изоляты; все выращенные в бульоне BHI) эффективно уничтожали клетки ТНР-1 (треугольники), однако указанные клетки были защищены от воздействия стрептококковых токсинов липосомами, состоящими из холестерина и сфингомиелина (кружки). 105c = количество клеток × 105. t (д) = время после лечения (дни).
С) Липосомы, состоящие из холестерина и сфингомиелина, защищают моноциты от культуральных надосадочных жидкостей Streptococcus pyogenes в микрограммовых количествах. с(%) = процент клеток, выдержанных в присутствии бактериальных надосадочных жидкостей, относительно клеток, выдержанных в отсутствии бактериальных надосадочных жидкостей (100%). LP (мкг) = количество липосом в микрограммах.
Фиг. 6. Липосомы, состоящие из холестерина и сфингомиелина (1:1 масс./масс.), в комбинации с липосомами, содержащими только сфингомиелин, полностью защищают моноциты от токсинов Streptococcus pneumoniae.
А, В) Клетки ТНР-1 пролиферируют в присутствии бульона BHI (квадраты). Культуральные надосадочные жидкости 2 штаммов Streptococcus pneumoniae (Pneumo 1 = клинический изолят и Pneumo 2 = штамм D39; оба выращены в бульоне BHI) эффективно уничтожали клетки ТНР-1 (треугольники), однако указанные клетки были частично защищены от воздействия токсинов Streptococcus pneumoniae липосомами, состоящими из холестерина и сфингомиелина (1:1 масс./масс.) (кружки). 105с = количество клеток × 105. t (д) = время после лечения (дни).
С) Смесь содержащих холестерин и не содержащих холестерин липосом, содержащих только сфингомиелин, полностью защищала от токсинов Streptococcus pneumoniae. График показывает защитное действие липосомальных смесей, состоящих из постоянного (400 мкг) количества липосом холестерин : сфингомиелин (1:1 масс./масс.) и различных количеств (0-400 мкг) липосом, содержащих только сфингомиелин.
с (о.е.) = количество клеток, выдержанных в присутствии бактериальной надосадочной жидкости, относительно количества клеток, выдержанных в отсутствии надосадочной жидкости, приведено в относительных единицах (о.е.). Sm LP (мкг) = количества липосом, содержащих только сфингомиелин, в микрограммах.
Фиг. 7. Липосомы холестерин : фосфатидилхолин (1:1 масс./масс.) и смесь липосом холестерин : фосфатидилхолин (1:1 масс./масс.) и сфингомиелиновых липосом защищают моноциты от токсинов, секретируемых штаммом MRSA 2040 Staphylococcus aureus.
Клетки ТНР-1 пролиферируют в присутствии бульона BHI (квадраты). Культуральные надосадочные жидкости Staphylococcus aureus (выращенного в бульоне BHI) эффективно уничтожают клетки ТНР-1 в отсутствии липосом (треугольники). (А) 900 микрограмм (ромбы) липосом холестерин : фосфатидилхолин (1:1 масс./масс.) обеспечивают значительную защиту от бактериальных токсинов, тогда как только ограниченную защиту наблюдали при 600 микрограммах (кружки). (В) Полную защиту наблюдали для смеси 600 микрограмм липосом холестерин : фосфатидилхолин (1:1 масс./масс.) с 75 микрограммами липосом Sm (ромбы). 900 микрограмм липосом Sm, используемых отдельно, были неэффективными (кружки). 105c = количество клеток × 105. t (д) = время после лечения (дни).
Фиг. 8. Не содержащие холестерин липосомы, содержащие сфингомиелин, и смесь липосом холестерин : фосфатидилхолин (1:1 масс./масс.) и липосом, содержащих только сфингомиелин, защищают моноциты от токсинов, секретируемых штаммом Doppelhof Staphylococcus aureus.
А, В) Клетки ТНР-1 пролиферируют в присутствии бульона BHI (квадраты). Культуральные надосадочные жидкости Staphylococcus aureus (выращенного в бульоне BHI) эффективно уничтожают клетки ТНР-1 в отсутствии липосом (треугольники). (А) 1200 микрограмм (ромбы) сфингомиелиновых липосом обеспечивали значительную защиту от бактериальных токсинов. (В) При использовании в количестве 600 микрограмм наиболее мощную защиту наблюдали для смеси сфингомиелина и сфингомиелина : фосфатидилхолина (1:1 масс./масс.) (ромбы), тогда как сфингомиелиновые липосомы отдельно (кружки) и липосомы сфингомиелин : фосфатидилхолин (1:1 масс./масс.) отдельно (звездочки) были менее эффективными. С) Смесь содержащих холестерин и не содержащих холестерин липосом, содержащих только сфингомиелин, полностью защищала от токсинов, секретируемых штаммом Doppelhof Staphylococcus aureus. График показывает защитное действие липосомальных смесей, состоящих из постоянного (600 мкг) количества липосом холестерин : фосфатидилхолин (1:1 масс./масс.) и различных количеств (0-1200 мкг) липосом, содержащих только сфингомиелин.
105c = количество клеток × 105. t(д) = время после лечения (дни), с (о.е.) = количество клеток, выдержанных в присутствии бактериальной надосадочной жидкости, относительно количества клеток, выдержанных в отсутствии надосадочной жидкости, приведено в относительных единицах (о.е.). Sm LP (мкг)=количества липосом, содержащих только сфингомиелин, в микрограммах.
Фиг. 9. 4-компонентная смесь липосом холестерин : сфингомиелин (1:1 масс./масс.), липосом, содержащих только сфингомиелин, липосом сфингомиелин : фосфатидилхолин (1:1 масс./масс.) и липосом холестерин : фосфатидилхолин (1:1 масс./масс.) защищает моноциты от токсинов, секретируемых штаммами Staphylococcus aureus как Doppelhof, так и MRSA 2040.
Клетки ТНР-1 пролиферируют в присутствии бульона BHI (квадраты). Культуральные надосадочные жидкости штаммов MRSA 2040 (А) или Doppelhof (В) Staphylococcus aureus (выращенных в бульоне BHI) эффективно уничтожают клетки ТНР-1 в отсутствии липосом (треугольники), однако 1200 микрограммов 4-компонентной липосомальной смеси (1:1:1:1) полностью защищают указанные клетки от токсинов либо MRSA 2040 (А), либо Doppelhof (В).
105c = количество клеток × 105. t (д) = время после лечения (дни).
Фиг. 10. Липосомы защищают мышей от бактериемии, вызываемой Staphylococcus aureus, от пневмонии, вызываемой Streptococcus pneumonia, и от бактериемии, вызываемой Streptococcus pneumoniae.
A) Лабораторным мышам внутривенно вводили смертельную дозу штамма Doppelhof Staphylococcus aureus путем инъекции. Через 1, 5 и 24 часа после инъекции бактерий мышам вводили путем инъекции либо 25-50 микролитров изотонического раствора (ромбы), либо 25 микролитров (1 мг) липосом холестерин : сфингомиелин (1:1 масс./масс.) (квадраты), либо 50 микролитров (2 мг) смеси липосомы холестерин : сфингомиелин (1:1 масс./масс.) + липосомы, содержащие только сфингомиелин + липосомы сфингомиелин : фосфатидилхолин (3:1 масс./масс.) в соотношении 1:2:2 (треугольники).
B) Мышей интраназально инфицировали штаммом D39 Streptococcus pneumoniae. Через 30 минут после инъекции бактерий мыши получали либо инъекцию 50 микролитров изотонического раствора (ромбы), либо однократную интраназальную инъекцию 50 микролитров (2 мг) смеси липосомы холестерин : сфингомиелин (1:1 масс./масс.) + липосомы холестерин : фосфатидилхолин (1:1 масс./масс.) + липосомы, содержащие только сфингомиелин + липосомы сфингомиелин : фосфатидилхолин (3:1 масс./масс.) в соотношении 1:1:1:1 (треугольники).
C) Мышам внутривенно вводили смертельную дозу штамма D39 S. pneumoniae путем инъекции. Через 8 и 12 часов после инъекции бактерий мыши получали внутривенно 75 микролитров/инъекция (3 мг) следующих липосом: 1) смесь липосомы холестерин : сфингомиелин (1:1 масс./масс.) + липосомы, содержащие только сфингомиелин, в соотношении 1:1 (треугольники); 2) липосомы холестерин : сфингомиелин (1:1 масс./масс.) (квадраты); 3) липосомы, содержащие только сфингомиелин (кружки), или 4) изотонический раствор (ромбы).
S (%) = процент выживших мышей, t (д) = время после инфицирования (дни)
Подробное описание изобретения
Предложены пустые липосомы и смеси липосом для ингаляционного, внутривенного или инфузионного введения, разработанные с обеспечением повышенной афинности к токсинам, воздействующим на мембраны, по сравнению с указанной афинностью в организме. Указанные пустые липосомы и смеси липосом выступают в качестве ловушек для бактериальных токсинов, находящихся в крови или дыхательных путях инфицированных пациентов, что обеспечивает возможность новой антибактериальной терапии, позволяющей изолировать токсины.
Настоящее изобретение относится к применению пустых липосом определенного липидного состава или смесей пустых липосом определенного липидного состава для лечения и предотвращения бактериальных инфекций, в частности, бактериемии, менингита, бактериальных инфекций кожи, инфекций дыхательных путей, таких как пневмония, и абдоминальных инфекций, таких как перитонит.
Липосомы согласно настоящему изобретению представляют собой пустые липосомы, т.е. липосомы, в которых не инкапсулирован какой-либо антибиотик или другое лекарственное средство. При необходимости их можно применять в комбинации с известными или новыми липосомами, содержащими лекарственные средства.
Исследование, лежащее в основе настоящего изобретения, показывает, что искусственные липосомы, имеющие точно определенный липидный состав, или смеси липосом, имеющих точно определенный липидный состав, эффективно изолируют очищенные порообразующие токсины и фосфолипазу С, и тем самым предотвращают их связывание с целевыми клетками. Следовательно, применение липосом или их смесей предотвращает лизис культивированных эпителиальных клеток и моноцитов, индуцируемый применением очищенных токсинов или культуральных надосадочных жидкостей Streptococcus pneumonia, Streptococcus pyogenes и Staphylococcus aureus, и защищает лабораторных мышей от смерти, вызываемой экспериментально индуцированной бактериемией или пневмонией.
Настоящее изобретение относится к применению пустых липосом определенного липидного состава или смесей пустых липосом определенного липидного состава для лечения и предотвращения бактериальных инфекций.
Кроме того, настоящее изобретение относится к липидным бислоям или липидным монослоям определенного липидного состава, покрывающим нелипидные поверхности, для применения для лечения и предотвращения бактериальных инфекций. Рассматриваемые нелипидные поверхности представляют собой, например, устройства медицинского назначения, биоразлагаемые гранулы и наночастицы.
Рассматриваемые липосомы представляют собой искусственные липосомы от 20 нм до 10 мкм, предпочтительно от 20 до 500 нм, содержащие липиды или фосфолипиды, выбранные из группы стеролов, сфинголипидов и глицеролипидов, в частности, выбранные из группы, состоящей из холестерина, сфингомиелинов, церамидов, фосфатидилхолинов, фосфатидилэтаноламинов, фосфатидилсеринов, диацилглицеринов и фосфатидных кислот, содержащих одну (лизо-) или две (диацил-) насыщенные или ненасыщенные жирные кислоты длиной более 4 атомов углерода и до 28 атомов углерода.
Состав рассматриваемых липидных бислоев или липидных монослоев является такой же, как указано для липосом.
Жирные кислоты, содержащие от 4 до 28 атомов углерода, представляют собой, например, насыщенные линейные алканкарбоновые кислоты предпочтительно с четным числом атомов углерода, например, 12-26 атомами углерода, например, лауриновую, миристиновую, пальмитиновую, стеариновую, арахидиновую или бегеновую кислоту, или ненасыщенные линейные алкенкарбоновые кислоты предпочтительно с четным числом атомов углерода от 12 до 26 и одной, двумя или более предпочтительно до шести двойными связями в транс- или предпочтительно цис-конфигурации, например, олеиновую кислоту, линолевую кислоту, альфа-линолевую кислоту, арахидоновую кислоту или эруковую кислоту.
Термин «пустые липосомы» означает, что в липосомы, рассматриваемые в настоящем изобретении, не заключены антибиотики или другие лекарственные средства. В настоящем описании термин «заключенный» означает инкапсулированный в полость липосомы, внутри потенциального двойного слоя липосомы или в виде части слоя мембраны липосомы. В настоящем описании термин «липосомы» также исключает липосомы, модифицированные связывающими агентами, такими как антитела и моно- или олигосахариды, например, как в гликолипидах. Однако липосомы, модифицированные полиэтиленгликолем (ПЭГ), рассматриваются как часть настоящего изобретения. Известно, что ПЭГ изменяет время циркуляции липосомы.
В частности, настоящее изобретение относится к применению пустых липосом, содержащих холестерин и сфингомиелин, и смесей пустых липосом, содержащих холестерин и сфингомиелин, или фосфатидилхолин и сфингомиелин, с другими пустыми липосомами определенного липидного состава, такими как липосомы, содержащие липиды или фосфолипиды, выбранные из группы, состоящей из стеролов, сфинголипидов и глицеролипидов, в частности, выбранные из группы, состоящей из холестерина, сфингомиелинов, церамидов, фосфатидилхолинов, фосфатидилэтаноламинов, фосфатидилсеринов, диацилглицеринов и фосфатидных кислот, содержащих одну или две насыщенные или ненасыщенные жирные кислоты длиной более 4 атомов углерода и до 28 атомов углерода, для лечения и предотвращения бактериальных инфекций.
В одном из вариантов реализации настоящее изобретение относится к применению пустых липосом, содержащих сфингомиелин и 30% (масс./масс.) или более холестерина, и смесей пустых липосом, содержащих сфингомиелин и 30% (масс./масс.) или более холестерина, с другими пустыми липосомами, определенными в настоящем описании, для лечения и предотвращения бактериальных инфекций. В частности, настоящее изобретение относится к применению пустых липосом, состоящих из сфингомиелина и 30% (масс./масс.) или более холестерина, и смесей пустых липосом, состоящих из сфингомиелина и 30% (масс./масс.) или более холестерина, с другими пустыми липосомами, определенными в настоящем описании, для лечения и предотвращения бактериальных инфекций. В частности, настоящее изобретение относится к применению пустых липосом, состоящих из сфингомиелина и из 35%-65% (масс./масс.) холестерина, предпочтительно от 40% до 55% (масс./масс.) холестерина, в частности, от 45% до 55% (масс./масс.) холестерина, например, примерно 50% (масс./масс.) холестерина, и смесей пустых липосом, состоящих из сфингомиелина и из 35%-65% или от 40% до 55%, или от 45% до 55%, например, примерно 50% (масс./масс.) холестерина, с другими пустыми липосомами, определенными в настоящем описании, для лечения и предотвращения бактериальных инфекций.
В конкретном варианте реализации настоящее изобретение относится к применению липосомальной смеси пустых липосом, содержащих или состоящих из холестерина и сфингомиелина, с другими пустыми липосомами, содержащими или состоящими из сфингомиелина, для лечения и предотвращения бактериальных инфекций.
В другом варианте реализации настоящее изобретение относится к применению липосомальной смеси пустых липосом, содержащих или состоящих из фосфатидилхолина и сфингомиелина, с другими пустыми липосомами, определенными в настоящем описании, для лечения и предотвращения бактериальных инфекций. В частности, настоящее изобретение относится к применению липосомальной смеси пустых липосом, содержащих или состоящих из фосфатидилхолина и сфингомиелина, с другими пустыми липосомами, содержащими или состоящими из сфингомиелина, для лечения и предотвращения бактериальных инфекций.
В конкретном варианте реализации настоящее изобретение относится к применению трехкомпонентной липосомальной смеси пустых липосом, содержащих или состоящих из холестерина и сфингомиелина, с другими пустыми липосомами, содержащими или состоящими из фосфатидилхолина и сфингомиелина, и с пустыми липосомами, состоящими из сфингомиелина, для лечения и предотвращения бактериальных инфекций.
В другом конкретном варианте реализации настоящее изобретение относится к применению четырехкомпонентной липосомальной смеси пустых липосом, содержащих или состоящих из холестерина и сфингомиелина, с другими пустыми липосомами, содержащими или состоящими из фосфатидилхолина и сфингомиелина, с пустыми липосомами, состоящими из сфингомиелина, и с пустыми липосомами, содержащими или состоящими из холестерина и фосфатидилхолина, для лечения и предотвращения бактериальных инфекций.
Конкретный состав рассматриваемых липидных бислоев или липидных монослоев является таким же, как указано для липосом, и они предпочтительно содержат холестерин и сфингомиелин, а также, возможно, фосфатидилхолин.
Очевидно, что пустые липосомы, определенные выше, смеси пустых липосом, определенных выше, и липидные бислои или липидные монослои можно применять совместно с другими соединениями. Например, можно добавлять компоненты для получения стандартных фармацевтических композиций. Также рассматривается возможность добавления лекарственных средств или подобных лекарственным средствам соединений, или добавления дополнительных липосом, в которые заключены лекарственные средства или подобные лекарственным средствам соединения во внутреннем пространстве липосом.
Рассматриваемые лекарственные средства, в частности, представляют собой антибиотики. Такие антибиотики представляют собой, например, карбапенемы, такие как имипенем/циластатин, меропенем, эртапенем и дорипенем; цефалоспорины 1-го поколения, такие как цефадроксил и цефалексин; цефалоспорины 2-го поколения, такие как цефуроксим, цефаклор и цефпрозил; цефалоспорины 3-го поколения, такие как цефтазидим, цефтриаксон, цефиксим, цефдинир, цефдиторен, цефотаксим, цефподоксим и цефтибутен, цефалоспорины 4-го поколения, такие как цефепим; цефалоспорины 5-го поколения, такие как цефтаролина фосамил и цефтобипрол; гликопептиды, такие как ванкомицин, тейкопланин и телаванцин; макролиды, такие как кларитромицин, азитромицин, диритромицин, эритромицин, рокситромицин, тролеандомицин, телитромицин, спектиномицин и спирамицин; пенициллины, такие как амоксициллин, флуклоксациллин, оксациллин, карбенициллин и пиперациллин; комбинации пенициллинов, такие как амоксициллин/клавуланат, пиперациллин/тазобактам, ампициллин/сульбактам и тикарциллин/клавуланат; хинолоны, такие как ципрофлоксацин (например, липосомальный ципрофлоксацин Aradigm) и моксифлоксацин; лекарственные средства от микобактерий, такие как рифампицин (рифампин в США), клофазимин, дапсон, капреомицин, циклосерин, этамбутол, этионамид, изониазид, пиразинамид, рифабутин, рифапентин и стрептомицин; другие антибиотики, такие как метронидазол, арсфенамин, хлорамфеникол, фосфомицин, фусидовая кислота, линезолид, мупироцин, платенсимицин, хинупристин/дальфопристин, рифаксимин, тиамфеникол, тигециклин и тинидазол; аминогликозиды, такие как амикацин, гентамицин, канамицин, неомицин, нетилмицин, тобрамицин (например, тобрамицин fluidosomes™ Axentis) и паромомицин; сульфаниламиды, такие как мафенид, сульфонамидохризоидин, сульфацетамид, сульфадиазин, сульфадиазин серебра, сульфаметизол, сульфаметоксазол, сульфаниламид, сульфасалазин, сульфизоксазол, триметоприм и триметоприм-сульфаметоксазол (котримоксазол, TMP-SMX); тетрациклины, такие как демеклоциклин, доксициклин; миноциклин, окситетрациклин и тетрациклин; линкозамиды, такие как клиндамицин и линкомицин; и липопептиды, такие как даптомицин.
Другие рассматриваемые лекарственные средства представляют собой противораковые агенты, например, винкристина сульфат, винкристин, цитарабин, даунорубицин и доксорубицин.
Другие рассматриваемые лекарственные средства представляют собой противовоспалительные лекарственные средства, например, кортикостероиды (глюкокортикоиды), такие как гидрокортизон (кортизол), кортизон, преднизон, преднизолон, метилпреднизолон, дексаметазон, бетаметазон, триамцинолон, беклометазон, флудрокортизона ацетат, дезоксикортикостерона ацетат (DOCA), альдостерон, будесонид, дезонид и флуоцинонид; нестероидные противовоспалительные лекарственные средства, например, салицилаты, такие как аспирин (ацетилсалициловая кислота), дифлунизал и салсалат; производные пропионовой кислоты, такие как ибупрофен, дексибупрофен, напроксен, фенопрофен, кетопрофен, декскетопрофен, флурбипрофен, оксапрозин и локсопрофен; производные уксусной кислоты, такие как индометацин, толметин, сулиндак, этодолак, кеторолак, диклофенак и набуметон; производные эноловой кислоты (оксикам), такие как пироксикам, мелоксикам, теноксикам, дроксикам, лорноксикам и изоксикам; производные фенаминовой кислоты (фенаматы), такие как мефенамовая кислота, меклофенамовая кислота, флуфенамовая кислота и толфенамовая кислота; селективные ингибиторы СОХ-2 (коксибы), такие как Целекоксиб; и другие, такие как ликофелон.
Другие рассматриваемые лекарственные средства представляют собой сосудосуживающие средства и вазоконстрикторы, например, вазопрессин, оксиметазолин, фенилэфрин, пропилгекседрин, псевдоэфедрин, эпинефрин, норэпинефрин, дофамин и антигистаминные средства.
Также рассмотрены другие типы лекарственных средств, например, парацетамол (болеутоляющее средство), амфотерицин В (от грибковых инфекций), бупивакаин (устранение послеоперационной боли), вакцины против гепатита А, гриппа, столбняка, уклончивого MRSA, коклюша, дифтерии, менингококка, холеры, брюшного тифа, сибирской язвы, пневмококка (например, Превнар 13®) и другие антибактериальные вакцины, морфин (болеутоляющее средство), вертепорфин (офтальмологическйе заболевания), эстрадиол (расстройства в менопаузе), соединения аганоцида®, например, ауриклозен (auriclosene) (NVC-422, N,N-дихлор-2,2-диметилтаурин (антибактериальные средства), липосомные частицы М Bio Technology, содержащие специфические липидные бактериальные антигены, например, имитирующие бактерии частицы в качестве вакцин (микоплазматические инфекции, включая пневмонию) и бактериофаги.
Другие рассматриваемые лекарственные средства представляют собой антитоксины, например, столбнячный антитоксин, такой как противостолбнячный иммуноглобулин, наногубки, полимерные наночастицы, ядро биомиметическйх полимерных наночастиц, окруженное мембранами клеток-хозяев (такими как мембраны красных кровяных телец), прицельно воздействующие на токсины моноклональные антитела и фрагменты антител, природные соединения, ингибирующие выработку конкретных токсинов, ингибиторы системы секреции бактериальных токсинов, такие как ингибиторы T3SS, токсинсвязывающие гибридные белки муцинового типа, растворимые Т-клеточные рецепторы, выступающие в качестве приманки для нейтрализации токсинов; и пептиды, ингибирующие процессинг токсинов.
Более того, настоящее изобретение относится к новым смесям пустых липосом определенного липидного состава. В частности, настоящее изобретение относится к смесям пустых липосом, содержащих холестерин и сфингомиелин, или фосфатидилхолин и сфингомиелин, с другими пустыми липосомами определенного липидного состава, такими как липосомы, содержащие липиды или фосфолипиды, выбранные из группы стеролов, сфинголипидов и глицеролипидов, в частности, выбранные из группы, состоящей из холестерина, сфингомиелинов, церамидов, фосфатидилхолинов, фосфатидилэтаноламинов, фосфатидилсеринов, диацилглицеринов и фосфатидных кислот, содержащих одну или две насыщенные или ненасыщенные жирные кислоты длиной более 4 атомов углерода и до 28 атомов углерода, для лечения и предотвращения бактериальных инфекций.
Конкретные рассматриваемые смеси представляют собой смеси пустых липосом, содержащих или состоящих из сфингомиелина и холестерина, с другими пустыми липосомами, определенными в настоящем описании, такие как смеси пустых липосом, содержащих или состоящих из холестерина и сфингомиелина, с другими пустыми липосомами, содержащими или состоящими из сфингомиелина.
Другие конкретные рассматриваемые смеси представляют собой смеси пустых липосом, содержащих или состоящих из фосфатидилхолина и сфингомиелина, с другими пустыми липосомами, определенными в настоящем описании, такие как смеси пустых липосом, содержащих или состоящих из фосфатидилхолина и сфингомиелина, с другими пустыми липосомами, содержащими или состоящими из сфингомиелина.
Другие конкретные рассматриваемые смеси представляют собой трехкомпонентные липосомальные смеси пустых липосом, содержащих или состоящих из холестерина и сфингомиелина, с другими пустыми липосомами, содержащими или состоящими из фосфатидилхолина и сфингомиелина, и с пустыми липосомами, содержащими или состоящими из сфингомиелина.
Другие конкретные рассматриваемые смеси представляют собой четырехкомпонентные липосомальные смеси пустых липосом, содержащих или состоящих из холестерина и сфингомиелина, с другими пустыми липосомами, содержащими или состоящими из фосфатидилхолина и сфингомиелина, с пустыми липосомами, состоящими из сфингомиелина, и с пустыми липосомами, содержащими или состоящими из холестерина и фосфатидилхолина.
В липосомах компоненты могут присутствовать в разных количествах в зависимости от склонности к образованию липосом, стабильности липосом, имеющих различный состав, и предполагаемого применения. Примерами являются липосомы, состоящие из двух компонентов в композиции приблизительно 1:1, 2:1, 3:1, 4:1 или 5:1 (масс./масс.). Дополнительные компоненты могут быть примешаны в количествах, составляющих приблизительно 10, 20 или 25% (масс./масс.).
В предпочтительных липосомах согласно настоящему изобретению холестерин присутствует в количестве 30-70%, предпочтительно 40-60%, например, 45-55%, в частности, примерно 50% (масс./масс.), фосфатидилхолин присутствует в количестве 10-60%, предпочтительно 20-60%, предпочтительно 40-60%, например, 45-55%, более предпочтительно примерно 50% (масс./масс.); и сфингомиелин присутствует в количестве 10-100%, предпочтительно 20-60% или 100%, предпочтительно 40-60%, например, 45-55%, более предпочтительно примерно 50% (масс./масс.) или 100%, соотношение холестерин : сфингомиелин составляет от 5:1 до 1:2, предпочтительно от 2:1 до 1:2, в частности, примерно 1:1 (масс./масс.), и соотношение холестерин : фосфатидилхолин или фосфатидилхолин : сфингомиелин составляет от 5:1 до 1:5, предпочтительно от 2:1 до 1:2, в частности, примерно 1:1 (масс./масс.).
В липосомальных смесях отдельные компоненты липосом, имеющих разный состав, смешивают в пропорциях, определяемых потребностями лечения. Примерами являются приблизительно 1:1, 2:1 или 3:1 (масс./масс.) для 2-компонентных смесей; приблизительно 1:1:1, 2:1:1 или 2:2:1 (масс./масс.) для 3-компонентных смесей; и приблизительно 1:1:1:1, 2:1:1:1, 2:2:1:1 или 2:2:2:1 (масс./масс.) для 4-компонентных смесей.
Рассматриваемые липосомы состоят из одного или более фосфолипидных бислоев. Предпочтительными являются крупные моноламеллярные везикулы (LUV) и мультиламеллярные везикулы (MLV). Наиболее предпочтительными являются мелкие моноламеллярные везикулы (SUV).
Липосомы изготавливают в соответствии с методами экструзии или ультразвука, или микрофлюидизации (например, гомогенизации под высоким давлением), известными в данной области техники. Например, липиды смешивают в органическом растворителе, таком как хлороформ. Хлороформ выпаривают и сухую липидную пленку гидратируют в водном растворе, таком как изотонический раствор (0,9% NaCl), раствор Кребса или раствор Тироде, и дополнительно обрабатывают ультразвуком с получением липосом. При необходимости размер липосом можно контролировать путем их экструзии через мембранные фильтры с фиксированным диаметром пор. Индивидуально полученные липосомы, имеющие разный липидный состав, смешивают в необходимых пропорциях непосредственно перед применением.
Эпителиальные клетки составляют физический барьер для патогенов. Искусственные липосомы способны защищать эпителиальные клетки мезонефроса человека (НЕК 293) от индуцируемого стрептолизином О (SLO) лизиса. Образуемые поры SLO в клеточной мембране являются достаточно большими, чтобы вызывать отток цитоплазматических белков с Мr до 100 кДа. Прямое связывание SLO с содержащими холестерин липосомами подтверждали путем предварительной инкубации липосом совместно с токсином с последующим центрифугированием. После центрифугирования липосомы, выделенные в осадке, отбрасывали, а надосадочные жидкости, не содержащие липосомы, добавляли к клеткам. Надосадочные жидкости никак не повреждали незащищенные клетки, что позволяет предположить, что токсин был эффективно удален из раствора за счет его связывания с липосомами.
Липосомы защищали не только эпителиальные клетки, но также клетки врожденной иммунной системы от различных порообразующих токсинов (PFT). Влияние PFT на пролиферацию линии моноцитов человека ТНР-1 оценивали в присутствии или отсутствии липосом, имеющих различный липидный состав. Пролиферацию клеток ТНР-1 полностью ингибировали в присутствии 200 нг пневмолизина (PLY), 400 нг стрептолизина О (SLO), 200 нг тетанолизина (TL), 1,2 мкг α-гемолизина S. aureus (HML) или 4,5 мкг фосфолипазы С Clostridium perfringens. Как показано на фиг. 1A-D, липосомы, содержащие холестерин в комбинации (1:1 масс./масс.) либо с фосфатидилхолином (PC), сфингомиелином (Sm), либо с фосфатидилсерином (PS), но не с фосфатидилэтаноламином (РЕ), защищали клетки ТНР-1 от холестерин-зависимых цитолизинов (PLY, SLO, TL) или фосфолипазы С (PLC), в то время как липосомы, которые не содержали холестерин, были неэффективны (фиг. 1F).
Липосомы Ch:PC (1:1 масс./масс.) и липосомы Ch:PS (1:1 масс./масс.), напротив, не демонстрировали защитное действие от α-гемолизина S. aureus, который относится к группе малых порообразующих токсинов (фиг. 1E). Липосомы, которые не содержали холестерин, также были неэффективны (фиг. 1F). Однако липосомы, содержащие Ch:Sm (1:1 масс./масс.), могли оказывать полное защитное действие от α-гемолизина (фиг. 1Е.). Таким образом, только липосомы, состоящие из холестерина и сфингомиелина, могли защищать клетки ТНР-1 от любого из тестируемых токсинов.
На фиг. 2 показано, что полное защитное действие липосом Ch:Sm (1:1 масс./масс.) от 200 нг PLY наблюдали при 3 мкг; от 400 нг SLO при 1,5 мкг; от 200 нг TL при 3 мкг; от 1,2 мкг HML при 25-50 мкг и от 4,5 мкг PLC при 100 мкг.
На фиг. 3 показано, что для защиты моноцитов от PLY, TL или HML липосомам Ch:Sm требовался холестерин в концентрациях, равных или превышающих 30% (масс./масс.). Максимальную защиту наблюдали при 50% (масс./масс.) холестерина, что соответствует 66 моль % холестерина.
Поскольку липосомы, состоящие из холестерина и сфингомиелина, могли защищать клетки либо от холестерин-зависимых цитолизинов, либо от α-гемолизина исследовали, являются ли данные липосомы эффективными в отношении комбинации обоих классов токсинов. Действительно, 25 мкг липосом Ch:Sm (1:1 масс./масс.) демонстрировали полное защитное действие от комбинированного действия α-гемолизина (1,2 мкг), SLO (400 нг) и TL (200 нг), в то время как липосомы, состоящие из Ch:PC (1:1 масс./масс.), не оказывали действия (фиг. 4А, В). Эксперименты с центрифугированием подтверждают, что все три токсина напрямую связываются с липосомами Ch:Sm (фиг. 4С).
Липосомы Ch:Sm могут защищать культивированные клетки от всей палитры токсинов, секретируемых клинически значимыми штаммами бактериальных патогенов. Пролиферацию клеток ТНР-1 оценивали в присутствии литических концентраций надосадочных жидкостей бактериальных культур и в присутствии или отсутствии липосом.
Как показано на фиг. 5А, В, липосомы Ch:Sm (1:1 масс./масс.) защищали клетки от действия токсинов, секретируемых Streptococcus pyogenes. Полное защитное действие от токсина (токсинов) Streptococcus pyogenes наблюдали при микрограммовых количествах липосом (фиг. 5С). Данные количества схожи с количествами, необходимыми для нейтрализации литических концентраций очищенных холестерин-зависимых цитолизинов, но гораздо меньше количеств, необходимых для нейтрализации либо очищенного α-гемолизина, либо очищенной фосфолипазы С (фиг. 2), что позволяет предположить, что только холестерин-зависимые цитолизины ответственны за цитолитическое действие Streptococcus pyogenes.
Липосомы Ch:Sm также защищали клетки от воздействия токсинов, секретируемых Streptococcus pneumonia (фиг. 6А-С). Тогда как с помощью содержащих холестерин липосом (1:1 масс./масс.) (фиг. 6А-С) достигали только ограниченной защиты, смесь содержащих холестерин (400 мкг) и не содержащих холестерин липосом, содержащих только Sm (400 мкг), полностью защищала от данного патогена (фиг. 6С).
Staphylococcus aureus известен своей резистентностью к наиболее сильным антибиотикам. Изоляция токсинов липосомами обеспечивает защиту даже от данного патогена. Липосомы Ch:Sm (1:1 масс./масс.) демонстрировали только ограниченную защиту от токсинов, секретируемых метициллин-резистентным штаммом Staphylococcus aureus (MRSA 2040). Схожие результаты получали для липосом Ch:PC (1:1 масс./масс.): для достижения значительной защиты требовалось до 900 мкг липосом Ch:PC, в то время как 600 мкг данных липосом демонстрировали лишь слабый эффект (фиг. 7А). Однако подробный анализ различных липосомальных смесей показал, что добавление до 75 мкг липосом, содержащих только сфингомиелин, к 600 мкг липосом Ch:PC (1:1 масс./масс.) позволяло достичь полной защиты от данного патогена (фиг. 7В). Липосомы Sm отдельно или липосомы PC отдельно не обладали защитным действием в количествах до 900 мкг (фиг. 7В).
Лечение липосомами также было эффективно в отношении клинически значимого штамма «Doppelhof» Staphylococcus aureus, выделенного у пациента с сепсисом. Ни липосомы Ch:Sm (1:1 масс./масс.), ни липосомы Ch:PC (1:1 масс./масс.), ни их комбинация с липосомами, содержащими только Sm, не были эффективны при использовании в концентрациях, которые обладали защитным действием от штамма MRSA 2040. Однако подробный анализ защитного действия различных липосомальных композиций и их комбинаций показал, что в отличие от штамма MRSA 2040, цитолитические токсины, секретируемые штаммом Doppelhof, эффективно изолировались липосомами, содержащими только Sm (фиг. 8А). В то время как 1200 мкг липосом Sm отдельно демонстрировали значительную защиту от штамма Doppelhof, в более низких концентрациях смесь, содержащая липосомы Sm и липосомы Sm:PC, была более эффективна, чем такие же количества либо липосом Sm, либо липосом Sm:PC (Фиг. 8В), Смесь содержащих холестерин (1:1 масс./масс.; 600 мкг) и не содержащих холестерин липосом, содержащих только сфингомиелин (1'200 мкг), полностью защищала от токсинов, секретируемых штаммом Doppelhof Staphylococcus aureus (фиг. 8С).
Таким образом, не только Staphylococcus aureus или Streptococcus pneumonia секретируют многочисленные цитолитические токсины, но также относительные количества секретируемых токсинов значительно варьируются среди разных штаммов, что требует использования сложных липосомальных смесей для достижения высокоаффинного связывания токсинов для их полной нейтрализации. Однако из-за неидеальной селективности взаимодействий токсины-липосомы значительная частичная защита может быть уже достигнута с помощью отдельных липосом в том случае, если их концентрация достаточно высока, чтобы способствовать низкоаффинному связыванию токсинов.
Подробный анализ различных липосомальных смесей показал, что 1'200 мкг (общее количество липидов) смеси липосомы Ch:Sm (1:1 масс./масс.) + липосомы Ch:PC (1:1 масс./масс.) + липосомы, содержащие только Sm + липосомы Sm:PC (1:1 масс./масс.), в соотношении 1:1:1:1 требовались для защиты от штаммов 'Staphylococcus aureus как MRSA 2040, так и Doppelhof (фиг. 9). Важное значение имеет то, что благодаря присутствию содержащих холестерин липосом, указанная 4-компонентная смесь также защищает от стрептококковых токсинов (см. фиг. 1-5). Таким образом, четырехкомпонентная липосомальная смесь (общее количество липидов 1200 мкг) может защищать культивированные клетки от комбинированного действия стрептококковых и стафилококковых токсинов. Двухкомпонентная смесь, состоящая из содержащих холестерин липосом (50% масс./масс., холестерина) и липосом, содержащих только сфингомиелин, также защищала от всех тестируемых бактериальных надосадочных жидкостей (фиг. 6-8), однако несколько большее количество (общее количество липидов 1'800 мкг) данной смеси требовалось для полной защиты от токсинов, секретируемых штаммом Doppelhof Staphylococcus aureus (фиг. 8С).
Известно, что тестируемые виды бактерий (Streptococcus pneumoniae, Staphylococcus aureus и Streptococcus pyogenes) индуцируют или вносят вклад в развитие опасных для жизни состояний, таких как бактериемия. Предпочтительная трех- или четырехкомпонентная смесь липосом может защищать лабораторных мышей от экспериментально индуцируемой бактериемии или пневмонии.
Мышам внутривенно путем инъекции вводили смертельную дозу штамма Doppelhof Staphylococcus aureus, клинический изолят от пациента с сепсисом. Через 1, 5 и 24 часа после инъекции бактерий мышам внутривенно вводили путем инъекции либо изотонический раствор (контроль), 1 мг/инъекция липосом Ch:Sm (1:1 масс./масс.), либо 2 мг/инъекция смеси липосом Ch:Sm (1:1 масс./масс.); липосом, содержащих только Sm, и липосом Sm:PC (1:1 масс./масс.) в соотношении 1:2:2. Контрольные мыши не выживали после 7 дней, при этом 90% гибели происходило в течение 36 часов (фиг. 10А). Мыши, которых лечили липосомами холестерин-сфингомиелин, жили на 2-3 дня дольше, чем контрольные, но не восстанавливались после бактериемии. Однако лечение 3-компонентной липосомальной смесью приводило к полному восстановлению 6 из 8 мышей.
В модели пневмококковой пневмонии мышей интраназально инфицировали штаммом D39 S. pneumoniae. Через 30 минут после инъекции бактерий мыши получали однократную интраназальную инъекцию 2 мг смеси липосомы Ch:Sm (1:1 масс./масс.) + липосомы Ch:PC (1:1 масс./масс.) + липосомы, содержащие только Sm, + липосомы Sm:PC (3:1 масс./масс.) в соотношении 1:1:1:1. На фиг. 10В показано, что указанная липосомальная смесь обеспечивала защиту от пневмонии.
В модели пневмококковой бактериемии мышам внутривенно путем инъекции вводили смертельную дозу штамма D39 S. pneumoniae. Через 8 и 12 часов после инъекции бактерий мыши получали внутривенно 3 мкг/инъекция следующих липосом: 1) смесь липосомы Ch:Sm (1:1 масс./масс.) + липосомы, содержащие только Sm, в соотношении 1:1; 2) липосомы Ch:Sm (1:1 масс./масс.); 3) липосомы, содержащие только Sm, или 4) изотонический раствор. На фиг. 10С показано, что контрольные мыши и мыши, получавшие только Sm, не выживали после 32 часов. Однако 6 из 8 мышей, получавших липосомальную смесь Ch:Sm + липосомы, содержащие только Sm, и 3 из 8 мышей, получавших липосомы Ch:Sm, были по-прежнему живы после 56 часов бактериемии.
Известно, что дозы липосом (50-150 мг/кг), необходимые для защиты мышей от стафилококковой бактериемии, нетоксичны при использовании в качестве носителей для внутривенной доставки антибиотиков у крыс (400 мг/кг; Bakker-Woudenberg I.A.J.M. et al., Antimicrobial Agents and Chemotherapy, 2001, 45:1487-1492). Кроме того, рекомендуемые дозы липидных эмульсий (например, «Интралипид», «Lipovenös»), которые вводят внутривенно путем инфузии пациентам, страдающим дисфункциями метаболизма жирных кислот, содержат, в дополнение к 2,7 г/кг жирных кислот, приблизительно 300 мг/кг фосфолипидов яйца; т.е. фосфолипидов, используемых в липосомальных препаратах согласно настоящему изобретению. Таким образом, можно безопасно вводить липосомы для лечения бактериальных инфекций у пациентов, представляющих собой людей, и липосомы не будут вызывать нежелательных явлений.
Эффективность изоляции токсинов липосомами можно дополнительно повысить. Поскольку липосомы, используемые в данном исследовании, представляли собой главным образом мультиламеллярные липосомы и, следовательно, по меньшей мере половина содержания липидов в них была недоступна для связывания токсинов, можно прогнозировать, что способность моноламеллярных липосом изолировать токсины будет по меньшей мере вдвое больше. Липосомы, состоящие из выбранных синтетических липидов, содержащих однородные ацильные цепи, и дополнительных видов липидов (например, церамид), которые, как известно, значительно усиливают расслаивание двухслойных липидов, являются лучшей мишенью для бактериальных токсинов, чем липосомы, изготовленные из природных липидов, которые использовали в данном исследовании. С использованием ПЭГ-производных фосфатидилэтаноламина время циркуляции липосом и, таким образом, их эффективность также может быть значительно увеличено.
Липидная поверхность (бислой) липосом спонтанно образуется в растворителях на водной основе и, следовательно, «захватывает» воду и другие водорастворимые неорганические и органические молекулы, которые могут присутствовать во время получения липосом, внутрь липосомы. Пустые липосомы, используемые в настоящем исследовании, представляют собой липосомы, полученные в буферах, содержащих воду и простые органические или неорганические молекулы (например, NaCl, KCl, MgCl2, глюкоза, HEPES и/или CaCl2). Однако сложные органические молекулы (антибиотики, витамины, адъюванты и другие) также могут быть включены при получении липосом (загруженные липосомы). Предполагается, что данные сложные органические молекулы не нарушают свойства липосом изолировать токсины; однако они будут оказывать дополнительные терапевтические эффекты.
Настоящее изобретение также относится к лечению бактериальных инфекций, включающему введение нуждающемуся в этом пациенту терапевтически эффективного количества пустых липосом определенного липидного состава или смесей пустых липосом определенного липидного состава, описанных выше.
Настоящее изобретение также относится к предотвращению бактериальных инфекций, включающему введение субъекту, подверженному риску инфекции, профилактического количества пустых липосом определенного липидного состава или смесей пустых липосом определенного липидного состава, эффективного для защиты.
Рассматриваемые бактериальные инфекции представляют собой инфекции дыхательных путей, желудочно-кишечного тракта, мочеполового тракта; сердечнососудистой системы или кожи, а также системные инфекции, вызываемые бактериями, продуцирующими порообразующие токсины и фосфолипазы, например, вызываемые Aeromonas hydrophila, Arcanobacterium pyogene, Bacillus thurgiensis, Bacillus anthracis, Bacillus cereus, Clostridium botulinum, Clostridium perfringens, Clostridium septicum, Clostridium sordellii, Clostridium tetani, Corynebacterium diphtheriae, Escherichia coli, Listeria monocytogenes, Pseudomonas aeruginosa, Staphylococcus aureus (включая метициллин-резистентный Staphylococcus aureus (MRSA)), Streptococcus pneumonia, Streptococcus pyogenes (также известным как стрептококк группы A (GAS)), Streptococcus equisimilis, Streptococcus agalactiae, Streptococcus suis, Streptococcus intermedius или Vibrio cholera.
Другие рассматриваемые бактериальные инфекции представляют собой инфекции носоглоточной системы, системы ЦНС, менингеальных оболочек, влагалища, костей (например, остеомиелит) и суставов, почек, скелетных мышц, наружного уха (например, наружный отит) и глаз, например, инфекционный конъюнктивит, бактериальный кератит и инфекции внутренней части глаз.
Конкретные бактериальные инфекции, рассматриваемые в качестве мишени для лечения липосомами, описанными выше, представляют собой бактериемию, бактериальные инфекционные поражения кожи, менингит, инфекции дыхательных путей, например, пневмонию и абдоминальные инфекции, такие как перитонит.
Рассматриваемые дозы для лечения или предотвращения инфекций составляют от 1 мг до 300 г липосом (общее количество липидов) на ингаляцию/инъекцию/инфузию один раз или несколько раз в сутки, предпочтительно от 100 мг до 10 г от одного до трех раз в сутки. Эквивалентная доза для человека (HED) составляет от 100 до 1000 мг/м2, предпочтительно примерно 300 мг/м2 или примерно 8 мг/кг у людей.
Липосомы можно вводить в виде аэрозоля для лечения инфекций дыхательных путей. Получение аэрозолей из липосом, таких как пустые липосомы согласно настоящему изобретению, известно в данной области техники. Например, жидкую суспензию липосом можно доставлять с помощью дозирующего ингалятора (MDI), т.е. устройства, которое доставляет конкретное количество лекарственного средства в дыхательные пути или легкие, в форме короткого выброса аэрозолированного лекарственного средства, вдыхаемого пациентом.
Для лечения бактериальных инфекций кожи применение липосом согласно настоящему изобретению рассматривается в форме топических фармацевтических композиций, таких как жидкие суспензии и т.п. Получение суспензии из липосом, таких как пустые липосомы согласно настоящему изобретению, известно в данной области техники. Например, липосомальную суспензию, полученную в изотоническом растворе или любом другом водном растворе, можно наносить непосредственно на кожу.
Для лечения системных бактериальных инфекций пустые липосомы согласно настоящему изобретению применяют в форме внутривенных, внутримышечных или подкожных инъекций. Инъекционные растворы готовят стандартными способами, известными в данной области техники, например, в виде суспензий липосом в стерильном изотоническом растворе. Такие суспензии можно непосредственно вводить путем инъекции. Также рассмотрена возможность применения липосом согласно настоящему изобретению в составе, подходящем для сублингвального или трансбуккального применения. Для лечения перитонита рассмотрена возможность интраперитонеального применения. Глазные капли можно применять при бактериальной инфекции глаз.
Пустые липосомы согласно настоящему изобретению будут изолировать бактериальные токсины и, таким образом, предотвращать проникновение бактерий в эпителий хозяина или их системное распространение. Таким образом, можно предотвращать или замедлять развитие системного заболевания; и патогены могут быть эффективно устранены клетками врожденной иммунной системы хозяина, которые также защищены от токсинов липосомами.
Сами по себе липосомы не являются цитотоксическими, также они не являются бактерицидными. Следовательно, маловероятно, что они будут оказывать селективное антибактериальное давление, которое способствовало бы появлению бактерий, резистентных к лекарственным средствам. Пустые липосомы согласно настоящему изобретению имитируют структуры, которые уже существуют в клетках хозяина, для приманки бактериальных токсинов. Поэтому, исключено, что бактерии будут адаптироваться к введению липосом: каждая попытка избежать приманки путем уменьшения аффинности токсинов к липосомам неизбежно приводит к появлению токсинов, которые также неэффективны в отношении клеток хозяина.
Химиотерапия на основе липосом является привлекательной альтернативой как терапии антибиотиками, так и лечения антителами, изолирующими токсины.
Настоящее изобретение также относится к лечению бактериальных инфекций, включающему введение нуждающемуся в этом пациенту терапевтически эффективного количества пустых липосом до, после, совместно или параллельно со стандартным лечением бактериальной инфекции антибиотиками. В комбинации с лечением антибиотиками, помимо нейтрализации активно секретируемых бактериальных токсинов во время активной фазы инфекции, лечение липосомами будет обеспечивать дополнительные полезные эффекты для пациента за счет изоляции токсинов, высвобождаемых во время лечения антибиотиками лизированными бактериями, состояния, которое, как известно, является неблагоприятным, например, во время менингита, при инфекции Streptococcus pneumonia (резкое высвобождение пневмолизина) и инфекции Streptococcus pyogenes (резкое высвобождение стрептолизина О).
При данном комбинированном лечении пустые липосомы и смеси липосом можно рассматривать в качестве адъювантов, а соответствующий способ лечения - в качестве вспомогательного лечения.
Ограничением терапии липосомами является ее ограниченная эффективность у индивидуумов с ослабленным иммунитетом, поскольку устранение бактерий зависит не от химиотерапевтического агента, а от собственной иммунной системы хозяина. Однако даже у пациентов с иммунодефицитом лечение липосомами в комбинации с бактерицидной химиотерапией будет оказывать полезный эффект: замедление развития системного заболевания, и, таким образом, будет предоставлять организму столь необходимое время для того, чтобы позволить антибиотикам «развернуть» полное бактерицидное действие.
Рассматриваемое лечение антибиотиками совместно с лечением с использованием пустых липосом согласно настоящему изобретению представляет собой, например, лечение цефалоспоринами и другими β-лактамными антибиотиками, гликопептидами, линкозамидами, липопептидами, макролидами, пенициллинами и комбинациями пенициллинов, хинолонами, сульфаниламидами, хлорамфениколом и аналогами хлорамфеникола, тетрациклинами, клиндамицином и ингибиторами фолатов, перечисленными выше. Конкретные антибиотики, рассматриваемые при лечении совместно с пустыми липосомами согласно настоящему изобретению, представляют собой карбапенемы, такие как имипенем, циластатин и меропенем, цефалоспорины 2-го поколения, такие как цефуроксим, цефалоспорины 3-го поколения, такие как цефтазидим и цефтриаксон, цефалоспорины 4-го поколения, такие как цефепим, гликопептиды, такие как ванкомицин, макролиды, такие как кларитромицин, пенициллины, такие как амоксициллин и флуклоксациллин, комбинации пенициллинов, такие как комбинации амоксициллин/клавуланат и пиперациллин/тазобактам, хинолоны, такие как ципрофлоксацин и моксифлоксацин, и фторхинолоны, такие как левофлоксацин и гемифлоксацин.
Все компоненты пустых липосом согласно настоящему изобретению представляют собой вещества, которые встречаются в природе в организме людей. Поэтому, данные липосомы хорошо переносятся и выводятся из организма физиологическими путями. Липосомальные аэрозоли следует применять людям для предотвращения пневмонии и других заболеваний дыхательных путей во время сезонных эпидемий гриппа. Самое важное значение имеет то, что профилактические меры на основе липосомальных аэрозолей или другого применения липосом будут полезны при профилактике пневмоний MRSA или бактериемии в больницах, инфекций Pseudomonas aeruginosa, S. aureus или S. pneumonia и в других учреждениях, которые способствуют распространению инфекционных заболеваний.
Примеры
Токсины
Стрептолизин О (SLO) из Streptococcus pyogenes, а-гемолизин из Staphylococcus aureus, тетанолизин (TL) из Clostridium tetani и фосфолипазу С из Clostridium perfringens приобретали у Sigma. Пневмолизин получали от профессора Kadioglu (Cruse G. et al., J. Immunol. 2012; 184:7108-7115). Другие токсины включают лейкоцидин Пантон-Валентина (PVL) из S. aureus, листериолизин О (LLO) из Listeria monocytogenes, перфринголизин О (PFO) из Clostridium perfringens, суилизин (SLY) из S. suis, интермедилизин (ILY) из S. intermedius, цереолизин О (CLO) из В. cereus, турингиолизин О (TLO) из В. thuringiensis, ботулинолизин (BLY) из С.botulinum, сорделлилизин (SDL) из С.sordelli, пиолизин (PLO) из Arcanobacterium pyogenes. Культуральные надосадочные жидкости Streptococcus pneumoniae, Streptococcus pyogenes и Staphylococcus aureus получали от профессоров К. Mühlemann (Берн) и Е. Gulbins (Эссен).
Культура клеток
Линию клеток мезонефроса человека (НЕК 293) выдерживали, как описано Monastyrskaya K et al., Cell Calcium. 2007, 41:207-219. Линию клеток острого моноцитарного лейкоза человека (ТНР-1) выдерживали в среде RPMI 1640, содержащей 10% FBS, 2 мМ L-глутамин и 100 ед/мл пенициллина, 100 мкг/мл стрептомицина.
Трансфекции
Голубой флуоресцентный белок (CFP) временно экспрессировали в клетках НЕК 293 (Monastyrskaya et al., в приведенном выше источнике). Клетки НЕК 293, экспрессирующие CFP, использовали для экспериментов с получением изображений с помощью лазерного сканирующего модуля (LSM) через 2 дня после трансфекции.
Липосомы
Холестерин (Ch) (С-8667), сфингомиелин (Sm) из желтка куриного яйца (S0756), фосфатидилхолин (PC) из соевых бобов (Р7443), фосфатидилэтаноламин (РЕ) из головного мозга крупного рогатого скота (Р9137) и натриевую соль фосфатидилсерина (PS) из головного мозга крупного рогатого скота (Р5660) приобретали у Sigma. Липиды по отдельности растворяли в хлороформе в концентрациях 1 мг/мл и хранили при -20°С. Для получения липосом растворы индивидуальных липидов в хлороформе смешивали в композиции и пропорциях, приведенных в тексте, с получением обычно 50-500 мкл конечного раствора. Хлороформ полностью выпаривали в течение 20-50 минут при 60°С. В пробирки, содержащие пленки высушенных липидов, добавляли 50 мкл или 100 мкл буфера Тироде (140 мМ NaCl, 5 мМ KCl, 1 мМ MgCl2, 10 мМ глюкоза, 10 мМ HEPES; рН=7,4), содержащего 2,5 мМ CaCl2, и энергично перемешивали вихревым способом. Липидные суспензии инкубировали в течение 20-30 минут при 45°С в термомиксере Eppendorf при энергичном встряхивании. Для получения липосом конечные липидные суспензии обрабатывали ультразвуком 3×5 секунд при 6°С в ультразвуковом устройстве Bandelin Sonopuls на мощности 70%. Липосомальные препараты оставляли по меньшей мере на 1 час при 6°С перед их использованием в экспериментах. Концентрация отдельных липидов в липосомах всегда приведена в виде массового соотношения (масс./масс.). В липосомах, содержащих холестерин и сфингомиелин, соотношение 1:1 (масс./масс.) соответствует 50% (масс./масс.) или 66 моль % холестерина. Количества липосом приведены в виде общего количества липидов, используемых для их получения.
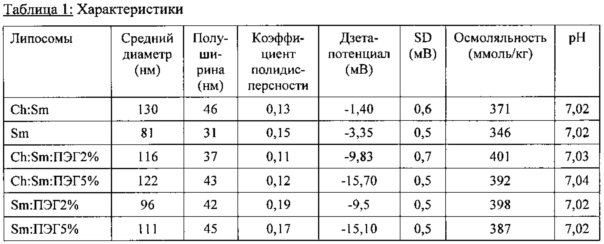
В альтернативном способе примерно 25 мл каждого состава получали методом гидратации этанола и экструзии. Конечные составы стерилизовали путем фильтрации и помещали в стеклянные флаконы с сывороткой для автоклавирования (конечная концентрация: 40 мг/мл). Размеры частиц липосом находятся в диапазоне 80-150 нм с хорошим коэффициентом полидисперсности (PDI). Также включены результаты измерения осмоляльности. Все они находятся в диапазоне примерно 400 ммоль/кг, который довольно близок к желаемому физиологическому уровню.
Индуцируемый токсинами лизис клеток и защитное действие липосом
В эпителиальных клетках мезонефроса человека (НЕК 293) индуцируемый токсинами лизис наблюдали в виде уменьшения цитоплазматической флуоресценции из-за индуцируемого порами оттока внутриклеточного CFP. Конфлюэнтные клетки НЕК 293, высеянные на 15 мм стеклянные покровные стекла (2,5×105 клеток на покровное стекло), помещали в перфузионную камеру при 25°С в буфере Тироде, содержащем 2,5 мМ CaCl2, и их флуоресценцию регистрировали под микроскопом Axiovert 200 М с лазерным сканирующим модулем LSM 510 МЕТА (Zeiss, Германия) с использованием ×63 иммерсионного объектива (Monastyrskaya et al., в приведенном выше источнике). В момент времени = 0 буфер заменяли 100 мкл или 200 мкл такого же буфера, дополнительно содержащего цитолитическое количество конкретного токсина (например, 120 нг SLO из Streptococcus pyogenes) и 20 мМ/л дитиотреитола (DTT). Для исследования защитного действия липосом в отношении индуцируемого токсинами лизиса клеток в момент времени = 0 клетки обычным путем заражали 100 мкл смеси, содержащей токсин/DTT и липосомы в различных концентрациях, имеющие различный липидный состав. Смесь токсинов и липосом готовили непосредственно перед добавлением к клеткам (с задержкой на манипуляции от 20 до 30 секунд). В некоторых случаях к клеткам сначала добавляли 100 мкл раствора, содержащего только липосомы, с последующим (с задержкой на манипуляции от 20 до 30 секунд) добавлением 100 мкл раствора, содержащего токсин. Защитное действие липосом было схожим в любых экспериментальных условиях. Изображения анализировали с использованием пакета программного обеспечения «Physiology evaluation» (Zeiss, Германия).
Влияние очищенных PFT или надосадочных жидкостей бактериальных культур на пролиферацию линии моноцитарных клеток человека (ТНР-1) оценивали в присутствии или отсутствии липосом, имеющих различный липидный состав. 100-600 мкл раствора, содержащего токсин (буфер Са2+-Тироде или бульон BHI), обычным путем добавляли к 100 мкл (5×104 клеток) клеток, выдержанных в культуральной среде и предварительно смешанных с 50-150 мкл липосом, имеющих различный липидный состав. После инкубации в течение 3 часов в пробирки добавляли 1-2 мл свежей культуральной среды. Клетки подсчитывали каждый день или через день в течение 8-12 дней. Токсины и липосомы присутствовали на протяжении всего эксперимента. Данные, представленные на графиках, соответствуют 5 дню или 6 дню, когда рост клеток находился еще в линейной фазе.
Сравнение «пустых» и «заполненных» липосом
Защиту от культуральных надосадочных жидкостей S. aureus или S. pneumoniae смесью «пустых» липосом Ch:Sm + содержащих только Sm сравнивали с защитой смесью липосом Ch:Sm + содержащих только Sm, заполненных флуоресцентным красителем, таким как флуоресцеин, Oregon Green 488, родамин или техасский красный.
Защиту от культуральных надосадочных жидкостей S. aureus или S. pneumoniae смесью «пустых» липосом Ch:PC сравнивали с защитой смесью липосом Ch:PC, заполненных флуоресцентным красителем, таким как флуоресцеин, Oregon Green 488, родамин или техасский красный.
Защита поверхностями, покрытыми липидами
Гранулы, покрытые холестерином и сфингомиелином, тестировали на предмет их активности по изоляции токсинов в отношении культуральных надосадочных жидкостей S. aureus или S. pneumoniae.
Действие in vivo в комбинации с лечением антибиотиками на бактериемию, индуцируемую S. aureus или S. pneumoniae
2-компонентную смесь липосом Ch:Sm и липосом, содержащих только Sm; 3-компонентную смесь липосом Ch:Sm; липосом, содержащих только Sm, и липосом Sm:PC (1:2:2) и 4-компонентную смесь липосом Ch:Sm, липосом, содержащих только Sm, липосом Sm:PC и липосом Ch:PC (1:1:1:1) тестировали в моделях бактериемии у мышей, индуцированной либо пенициллин-чувствительным штаммом Streptococcus pneumonia, либо метициллин-резистентным Staphylococcus aureus (MSSA). Рассмотрены два типа штаммов MSSA, характеризующиеся способностью секретировать или не секретировать токсин - лейкоцидин Пантон-Валентина (PVL). Кроме того, также тестировали 2-компонентную смесь пегилированных липосом Ch:Sm и содержащих только Sm (2% ПЭГ или 5% ПЭГ).
Лабораторных мышей заражали путем интраперитонеальной (и/п), внутривенной (в/в) или интраназальной (и/н) инъекции приблизительно 107 или 108 КОЕ/мл бактерий.
Для каждого штамма бактерий, каждого пути инфицирования и для каждой липосомальной смеси (смеси LP) внутривенные инъекции двух разных доз (2 мг/кг или 6 мг/кг) смеси LP начинали либо через шесть часов (t=6), двенадцать часов (t=12), восемнадцать часов (t=18) или двадцать четыре часа (t=24) после бактериального заражения (в каждом случае после инъекции смеси LP следовала либо одна дополнительная инъекция через 12 часов, либо две дополнительные инъекции через 4 часа и 24 часа после первой инъекции) с лечением пенициллином или без него (30 мг/кг). Лечение антибиотиками начинали в то же время, что и лечение липосомами. Осуществляли два типа контроля: инфекция без лечения и инфекция, которую лечили только антибиотиками (при t=6, t=12, t=18 или t=24).
Для каждого штамма бактерий и для каждой смеси липосом, и для каждой дозы липосомы и каждого пути инфицирования было 10 групп животных.


В 1 группе выживаемость, составляющую 50% из группы, наблюдали в течение по меньшей мере 8 дней, 25% из группы подвергали эвтаназии через один час после бактериального заражения, а оставшиеся 25% - через 6 часов после бактериального заражения.
Количество бактерий определяли в крови и некоторых органах, таких как легкие, селезенка и почки.
Полученные данные: выживаемость, признаки инфекций, метаболизм (последовательные измерения потери и восстановления массы тела, скорости потребления О2 и выработки СО2, измеренные путем непрямой калориметрии, расход энергии в состоянии покоя (REE), рассчитанный с помощью модифицированной формулы Вейра (Weir)); характеристики воспалительных цитокинов (твердофазный иммуноферментный анализ (ELISA) проводили в сыворотке на предмет фактора некроза опухолей (TNF)-альфа, макрофагального белка воспаления (MIP)-2 и IL-1b).
Минимальная бактерицидная концентрация (МБК)
Отсутствие активности липосом сфингомиелин/холестерин в отношении обычных штаммов:

Тестирование минимальной бактерицидной концентрации (МБК) осуществляли в соответствии с руководством, предложенным Институтом клинических и лабораторных стандартов (CLSI).
Для тестов с микролитровым разведением бульона 96-луночные планшеты с добавлением 50 мкл 0,5-16 мг/мл липосом инокулировали 50 мкл бульона Мюллера-Хинтона, содержащего суспензию бактериальных клеток из 1-5×105 колониеобразующих единиц (КОЕ) на мл S. aureus. Планшеты инкубировали в течение 24 часов при 36°С. МБК определяли путем переноса 10 мкл аликвот из лунок микротитрационных планшетов для разведения бульона на колумбийский кровяной агар (Oxoid, Везель, Германия). Инокулированные планшеты дополнительно инкубировали в течение 24 часов при 36°С, а затем подсчитывали колонии.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПЕЦИАЛЬНО РАЗРАБОТАННЫЕ ЛИПОСОМЫ ДЛЯ ЛЕЧЕНИЯ БАКТЕРИАЛЬНЫХ ИНФЕКЦИЙ | 2013 |
|
RU2780026C2 |
| ЗАМЕДЛЕННОЕ ВЫСВОБОЖДЕНИЕ ПРОТИВОИНФЕКЦИОННЫХ АГЕНТОВ | 2006 |
|
RU2438655C2 |
| АНТИБАКТЕРИАЛЬНОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ И ПТИЦ, СПОСОБ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ЦЫПЛЯТ ПРИ ЗАБОЛЕВАНИЯХ БАКТЕРИАЛЬНОЙ ЭТИОЛОГИИ, СПОСОБ ЛЕЧЕНИЯ РЕСПИРАТОРНОЙ БОЛЕЗНИ ТЕЛЯТ БАКТЕРИАЛЬНОЙ ЭТИОЛОГИИ, СПОСОБ ПРОФИЛАКТИКИ ТУБЕРКУЛЕЗА У КРУПНОГО РОГАТОГО СКОТА | 1999 |
|
RU2158587C1 |
| СТАБИЛИЗИРОВАННЫЕ СОСТАВЫ ВАНКОМИЦИНА | 2013 |
|
RU2675859C2 |
| ПРЕПАРАТ НА ОСНОВЕ ЛИТИЧЕСКОГО МИКОБАКТЕРИОФАГА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2018 |
|
RU2691439C1 |
| МАЛЕНЬКИЕ ЛИПОСОМЫ ДЛЯ ДОСТАВКИ КОДИРУЮЩЕЙ ИММУНОГЕН РНК | 2011 |
|
RU2671482C2 |
| ЦЕЛЕВЫЕ ВЕЗИКУЛЯРНЫЕ КОНСТРУКЦИИ ДЛЯ ЗАЩИТЫ КЛЕТКИ И ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИЙ H. PYLORI | 2000 |
|
RU2207113C2 |
| СПОСОБ ЛЕЧЕНИЯ БРУЦЕЛЛЕЗА | 2002 |
|
RU2239416C2 |
| СПОСОБ ЛЕЧЕНИЯ БРУЦЕЛЛЕЗА | 2002 |
|
RU2234311C1 |
| Способ доставки гранзима Б в клетки млекопитающих | 2021 |
|
RU2796685C2 |
Группа изобретений относится к химико-фармацевтической промышленности и представляет собой смесь пустых липосом для лечения или предотвращения бактериальной инфекции, содержащих холестерин (≥30 мас.%) и сфингомиелин в соотношении 5:1-1:2 (масс./масс.), с другими пустыми липосомами, содержащими липиды или фосфолипиды, выбранные из группы, состоящей из холестерина, сфингомиелинов, фосфатидилхолинов, фосфатидилэтаноламинов и фосфатидилсеринов, а также к способам лечения и профилактики бактериальных инфекций с использованием таких смесей, в том числе при совместном, параллельном и опосредованном их использовании со стандартными антибиотиками против бактериальной инфекции. Изобретения позволяют предотвращать гибель лабораторных мышей, инфицированных смертельными дозами Staphylococcus aureus или Streptococcus pneumoniae. 5 н. и 9 з.п. ф-лы, 1 табл., 10 ил., 1 пр.
1. Смесь пустых липосом для применения при лечении или предотвращении бактериальной инфекции, содержащих холестерин в количестве 30% (масс./масс.) или более и сфингомиелин, при этом соотношение холестерин:сфингомиелин составляет от 5:1 до 1:2 (масс./масс.), с другими пустыми липосомами, содержащими липиды или фосфолипиды, выбранные из группы, состоящей из холестерина, сфингомиелинов, фосфатидилхолинов, фосфатидилэтаноламинов и фосфатидилсеринов.
2. Смесь по п. 1 пустых липосом, содержащих холестерин в количестве 30% (масс./масс.) или более и сфингомиелин, при этом соотношение холестерин:сфингомиелин составляет от 5:1 до 1:2 (масс./масс.), с пустыми липосомами, состоящими из сфингомиелина.
3. Смесь по п. 1 пустых липосом, состоящих из холестерина в количестве 30% (масс./масс.) или более и сфингомиелина, при этом соотношение холестерин:сфингомиелин составляет от 5:1 до 1:2 (масс./масс.), с пустыми липосомами, содержащими сфингомиелин или состоящими из сфингомиелина.
4. Смесь пустых липосом по п. 1, при этом указанная смесь состоит из пустых липосом, состоящих из холестерина в количестве 30% (масс./масс.) или более и сфингомиелина, при этом соотношение холестерин:сфингомиелин составляет от 2:1 до 1:2 (масс./масс.), и пустых липосом, состоящих из сфингомиелина.
5. Смесь пустых липосом по п. 1, при этом указанная смесь состоит из пустых липосом, состоящих из холестерина в количестве 30% (масс./масс.) или более и сфингомиелина, при этом соотношение холестерин:сфингомиелин составляет приблизительно 1:1 (масс./масс.), и пустых липосом, состоящих из сфингомиелина.
6. Смесь по п. 1 пустых липосом, содержащих холестерин в количестве 30% (масс./масс.) или более и сфингомиелин, при этом соотношение холестерин:сфингомиелин составляет от 5:1 до 1:2 (масс./масс.), с пустыми липосомами, содержащими фосфатидилхолин и сфингомиелин, и пустыми липосомами, состоящими из сфингомиелина.
7. Смесь по п. 1 пустых липосом, содержащих холестерин в количестве 30% (масс./масс.) или более и сфингомиелин, при этом соотношение холестерин:сфингомиелин составляет от 5:1 до 1:2 (масс./масс.), с пустыми липосомами, содержащими фосфатидилхолин и сфингомиелин, с пустыми липосомами, состоящими из сфингомиелина, и с пустыми липосомами, содержащими холестерин и фосфатидилхолин.
8. Смесь по п. 1, отличающаяся тем, что некоторые или все липосомы модифицированы полиэтиленгликолем.
9. Смесь пустых липосом по любому из пп. 1-8 для лечения или предотвращения бактериемии, бактериальных инфекционных поражений кожи, менингита и инфекций дыхательных путей.
10. Применение смеси пустых липосом по любому из пп. 1-9 для лечения или предотвращения бактериальных инфекций.
11. Применение смеси пустых липосом по п. 10 для лечения или предотвращения бактериемии, бактериальных инфекционных поражений кожи, менингита и инфекций дыхательных путей.
12. Способ лечения бактериальных инфекций, включающий введение нуждающемуся в этом пациенту терапевтически эффективного количества смеси пустых липосом по любому из пп. 1-9.
13. Способ предотвращения бактериальной инфекции, включающий введение субъекту, подверженному риску инфекции, профилактического количества смеси пустых липосом по любому из пп. 1-9.
14. Способ лечения бактериальных инфекций, включающий введение нуждающемуся в этом пациенту терапевтически эффективного количества смеси пустых липосом по любому из пп. 1-9 до, после, совместно или параллельно со стандартным лечением антибиотиками против бактериальной инфекции.
| US 5741516 A, 21.04.1998 | |||
| WO 2006052767 A2, 18.05.2006 | |||
| WO 9104019 A1, 04.04.1991 | |||
| Мельянцева Л.П | |||
| Антибактериальное действие липосом и возможность их применения для профилактики раневой инфекции | |||
| Автореф | |||
| дисс | |||
| на соискание уч.ст.к.б.н, Москва, 1992 | |||
| Таран Т.В | |||
| Биотехнология получения лекарственных и иммуногенных липосомальных композиций, используемых в лечении экспериментальных особо опасных инфекций и получении сырья для производства медицинских иммунобиологических препаратов | |||
| Дисс | |||
| на соискание уч.ст.д.м.н | |||
| Ставрополь, 2004 | |||
| Campanha M.T.N | |||
| et al | |||
| Interactions between cationic liposomes and bacteria: the physical-chemistry of the bactericidal action // Journal of Lipid Research, 40, pp | |||
| Способ передачи радиотелеграфных сигналов | 1924 |
|
SU1495A1 |
| US 20030236265 A1, 25.12.2003 | |||
| Харкевич Д.А | |||
| Фармакология: Учебник, 9-е издание, М.: ГЭОТАР-Медиа, 2006. | |||
Авторы
Даты
2018-11-12—Публикация
2013-06-13—Подача